|
|
|
|
 Far Far |
 WinNavigator WinNavigator |
 Frigate Frigate |
 Norton
Commander Norton
Commander |
 WinNC WinNC |
 Dos
Navigator Dos
Navigator |
 Servant
Salamander Servant
Salamander |
 Turbo
Browser Turbo
Browser |
|
|
 Winamp,
Skins, Plugins Winamp,
Skins, Plugins |
 Необходимые
Утилиты Необходимые
Утилиты |
 Текстовые
редакторы Текстовые
редакторы |
 Юмор Юмор |
|
|
|
File managers and best utilites |
Гликозил-гидролазы. Гидролазы реферат
Реферат - ГИДРОЛАЗЫ - Биология
К классу гидролаз относятся многие ферменты, входящие в состав ферментных препаратов, выпускаемых отечественной промышленностью. Гидролазы катализируют реакции присоединения или отщепления воды (гидротазы и дегидротазы).
Наибольший интерес для специалистов в области пищевой биотехнологии представляют три подкласса ферментов класса гидролаз: эстеразы, гликозидазы и протеазы.
Эстеразы. В эту группу включен ряд ферментов, обладающих сравнительно широкой специфичностью. Эти ферменты, катализируя разрыв эфирных связей, гидролизуют очень большое число различных эфиров, хотя и не с одинаковой скоростью.
Наиболее широко применяется в производстве соков, используемых для безалкогольных напитков, фермент пектинэстераза (ПЭ), который, действуя на пектин, гидролизует его сложноэфирные связи, в результате чего от него отщепляется метиловый спирт по схеме, приведенной на рисунке 4.1.
Данный фермент в больших количествах содержится в таких препаратах, выпускаемых отечественной ферментной промышленностью, как Пектаваморин, Пектофоетидин и Ксилоглюкано-фоетидин.
Фосфатазы. Фосфомоноэстеразы и фосфодиэстеразы относятся к ферментам со сравнительно широкой специфичностью. Но в этой группе находятся также ферменты с узкой специфичностью. Фермент фитаза катализирует гидролиз фитина по уравнению
С6Н6(ОН2РО3)6 + 6Н2О → С6Н12О6 + 6Н3РО4 Фитин Инозит
Фитаза содержится в относительно большом количестве в ячменном солоде. Фитаза отщепляет от фитина фосфорную кислоту, и при этом образуется инозит. Фосфорная кислота проявляет свое действие при брожении, а инозит способствует росту дрожжевых клеток.
Гликозидазы. К этой группе относятся ферменты, гидролизующие не только истинные гликозиды, но и N-гликозильные, а также S-гликозильные соединения. В подгруппу истинных гликозидаз включены ферменты, действующие, на простые гликозиды (например, β-глюкозидаза — фермент, содержащийся в таких отечественных препаратах, как Ксилоглюканофоетидин, Пектаваморин, Пектофоетидин). В эту же группу включены также амилазы, гидролизующие гликозидные связи в крахмале.
Гидролиз крахмала катализируют ферменты из группы гликозидаз при участии ферментов из группы трансгликозидаз. К ферментам первой группы относятся а- и β-амилазы, а также глюкоамилаза, которые разрывают молекулу крахмала гидролизом а-гли-козидных связей. Равновесие этих реакций в основном сдвинуто в сторону гидролиза, поэтому они практически необратимы.
α-Амилаза — эндоамилаза, вызывающая гидролитическое расщепление α-1,4-гликозидных связей внутри высокополимери-зованного субстрата. Схему гидролиза под действием а-амилазы можно записать следующим образом:
Крахмал α — Амилаза α-Декстрины +Мальтоза + Глюкоза (гликоген) (много) (мало) (мало)
α-Амилаза содержится в больших количествах в таких отечественных ферментных препаратах, как Амилосубтилин и Амилоризин. При этом Амилосубтилин содержит главным образом α-амилазу разжижающего действия, а Амилоризин — осахаривающего.
β-Амилаза катализирует гидролиз крахмала до мальтозы. Это экзофермент концевого действия, проявляющий сродство к предпоследней α-1,4-связи с нередуцирующего конца амилозы линейного участка амилопектина. Действие β-амилазы на крахмал можно изобразить в виде следующей схемы:
Крахмал α — Амилаза β-Декстрин + Мальтоза
(гликоген) (42-46%) (54-58%)
Глюкоамилаза отщепляет одиночные остатки глюкозы от нередуцирующего конца цепей крахмала, гликогена и некоторых продуктов их гидролиза. Данный фермент содержится в таком ферментном препарате, как Глюкаваморин, и в небольших количествах в ферментном препарате Амилоризин.
β-Глюканаза гидролизует β-1,4-глюкановые связи в целлюлозе и β-глюкане. Этот фермент содержится в значительных количествах в ферментных препаратах Амилосубтилин, Ксилоглюка-нофоетидин, Цитороземин, Пектофоетидин, Пектаваморин, Целловиридин.
Ксиланаза гидролизует β-1,4- и β-1,3-ксилановые связи.Этот фермент содержится в препаратах Ксилоглюканофоетидин, Ксилонигрин, Пектаваморин, Пектофоетидин.
Целлобиогидролазы гидролизуют целлюлозу, отщепляя с нередуцирующих концов ангидроглюкозных цепей β-1,4-глюканов целлобиозу. Данные ферменты содержатся в таких препаратах как Целлокандин и Целловиридин.
β-Глюкозидаза гидролизует β-глюкозидную связь в дисахаридах и глюкозидах. Тождествен ферменту мальтазе. В результате действия этого фермента на мальтозу образуются две молекулы глюкозы. Фермент содержится в солоде и в препарате Глюкаваморин.
β-Галактозидаза (лактаза) гидролизует лактозу с образованием глюкозы и галактозы, содержится в так называемых лактозных дрожжах и препарате Лактоканесцин.
β-Фруктофуранозидаза (сахараза, инвертаза) гидролизует сахарозу с образованием глюкозы и фруктозы, содержится в дрожжах, в том числе в пивных.
Протеазы. До недавнего времени считалось, что протеазы включают протеиназы и пептидазы, причем протеиназы расщепляют только крупные молекулы, тогда как пептидазы — в основном мелкие молекулы азотистых веществ. В настоящее время протеазы разделяют на две группы. Для одной группы ферментов присутствие примыкающих концевых карбоксильных или аминных групп необязательно, для другой группы — необходимо.
Ферменты первой группы — эндопептидазы — могут действовать на центральные участки пептидной цепи и расщеплять молекулы белка на более мелкие фрагменты, небольшие пептиды они гидролизуют только тогда, когда их концевые группы искусственно блокированы химическим путем. Экзопептидазы не гидролизуют пептидные связи, находящиеся в середине цепи, а действуют либо с карбоксильного, либо с аминного конца цепи, отщепляя последовательно одну за другой концевые аминокислоты.
Расщепляя белок, эндо- и экзопептидазы действуют согласованно: первые образуют большое число свободных концов, а вторые воздействуют на образовавшиеся фрагменты. Эндопептидазы содержатся в ряде отечественных препаратов, таких, как Протосубтилин (щелочная протеаза), Амилосубтилин, Протомезентерин; экзопептидазы — в таких, как Амилоризин, Пектаваморин, Пектофоетидин, Ксилоглюканофоетидин.
ЛИАЗЫ
К данному классу относятся ферменты, разрывающие связи С—С, С—О, С—N и др. в результате реакции элиминирования, что приводит к образованию двойных связей, или, наоборот, присоединяющие определенные группы по двойным связям.
Карбоксилазы. Эти ферменты катализируют отщепление СО2 от молекул амино- и оксикислот или его фиксацию:
R-Ch3-COOH → R-Ch4 + СО2
Пируватдекарбоксилаза, или карбоксилаза (карбоксилаза-2-оксикислота), катализирует важную реакцию при спиртовом брожении — расщепление пировиноградной кислоты на ацетальдегид и СО2. Равновесие реакции сильно сдвинуто в сторону декарбоксилирования:
СН3 — СО — СООН → СО2 + СН3 — СОН
Этот фермент содержится в дрожжах.
Гидролиазы. Эти ферменты катализируют отщепление или присоединение воды (прежнее название — дегидратазы и гидратазы). В данном случае не происходит гидролиз, поскольку субстрат не расщепляется на два компонента, как при реакциях, катализируемых гидролазами.
Карбонатгидролиаза. Этот фермент катализирует расщепление угольной кислоты на воду и диоксид углерода, содержится в дрожжах.
Ферменты группы лиаз, в частности пектаттрансэлиминаза, содержатся в таких отечественных препаратах, как Пектоклостридин и Мацеробациллин.
www.ronl.ru
Гидролазы.
Количество просмотров публикации Гидролазы. - 472
Трансферазы.
Классификация ферментов.
Номенклатура ферментов
Ферменты имеют несколько типов названий.
1) Тривиальные названия (трипсин, пепсин)
2) Рабочая номенклатура. В этом названии фермента присутствует окончание – аза, ĸᴏᴛᴏᴩᴏᴇ прибавляется:
· к названию субстрата (сахараза, амилаза),
· к виду связи, на которую действует фермент (пептидаза, гликозидаза),
· к типу реакции, процесса (синтетаза, гидролаза).
3) У каждого фермента есть классификационное название, в котором отражается тип реакции, вид субстрата и кофермента. К примеру: ЛДГ – L лактат-НАД+ - оксидоредуктаза.
Классификация ферментов разработана в 1961 году. Согласно классификации каждый фермент расположен в определённом классе, подклассе, подподклассе и имеет порядковый номер. Размещено на реф.рфВ связи с этим каждый фермент имеет цифровой шифр, в котором первая цифра обозначает класс, вторая – подкласс, третья – подподкласс, четвертая – порядковый номер (ЛДГ: 1,1,1,27). Все ферменты классифицируются на 6 классов.
- Оксидоредуктазы
- Трансферазы
- Гидролазы
- Лиазы
- Изомеразы
- Синтетазы (лигазы)
Оксидоредуктазы.
Ферменты, катализирующие окислительно - востановительные процессы. Общий вид реакции: Аок + Ввос = Авост+Вок. Этот класс ферментов включает несколько подклассов:
1.Дегидрогиназы, катализируют реакции путём отщепления водорода от окисляемого вещества. Οʜᴎ бывают аэробными (переносят водород на кислород) и анаэробными (переносят водород не на кислород, а на какое-то другое вещество).
2. Оксигеназы - ферменты катализирующие окисление путём присоединение кислорода к окисляемому веществу. В случае если присоединяется один атом кислорода, участвуют монооксигеназы, в случае если два атома кислорода – диоксигеназы.
3. Пероксидазы – ферменты, катализирующие окисление веществ с участием пероксидов.
Ферменты, осуществляющие внутримолекулярный и межмолекулярный перенос функциональных групп с одного вещества на другое по схеме: АВ + С = А + ВС. Подклассы трансфераз выделяют исходя из вида переносимых групп: аминотрансферазы, метилтрансферазы, сульфотрансферазы, ацилтрансферазы (переносят остатки жирных кислот), фосфотрансферазы (переносят остатки фосфорной кислоты).
Ферменты этого класса катализируют разрыв химической связи с присоединением воды по месту разрыва, то есть реакции гидролиза по схеме: АВ + НОН = АН + ВОН. Подклассы гидролаз выделяют исходя из вида разрываемых связей: пептидазы расщепляют пептидные связи (пепсин), гликозидазы - гликозидные связи (амилаза), эстеразы – сложноэфирные связи (липаза).
Читайте также
Трансферазы. Классификация ферментов. Номенклатура ферментов Ферменты имеют несколько типов названий. 1) Тривиальные названия (трипсин, пепсин) 2) Рабочая номенклатура. В этом названии фермента присутствует окончание – аза, которое... [читать подробнее].
АЦИЛТРАНСФЕРАЗЫ (кислотные остатки). ФОСФОТРАНСФЕРАЗЫ (ФОСФАТНЫЕ группировки). МЕТИЛТРАНСФЕРАЗЫ (СНЗ группы). АСАТ - АСПАРАГИНОВАЯ АМИНОТРАНСФЕРАЗА. АМИНОТРАНСФЕРАЗЫ. Они участвуют в реакциях... [читать подробнее].
Гидролазы - участвуют в расщеплении сложных веществ (углеводов, жиров, белков) до простых с участием воды. Играют огромную роль при мобилизации запасных питательных веществ в процессе прорастания семян. Могут действовать и в обратном направлении, синтезируя сложные... [читать подробнее].
Белок и пептиды расщепляют ферменты, объединяемые в подкласс пептидгидролаз (К.Ф.3.4.). Их называют также протеазами, протеолитическими ферментами. Основной реакцией, катализируемой протеолитическими ферментами, является гидролиз пептидной связи в молекулах белков и... [читать подробнее].
Гидролитические ферменты – важнейший класс ферментов, используемых при переработке пищевого сырья. Основной продукцией ферментной промышленности являются препараты гидролаз, таких как амилазы, протеазы, пектиназы, целлюлазы. Гидролитические ферменты используются... [читать подробнее].
Характеристика фермента Пример 4 Характеристика фермента Пример 3 Характеристика фермента Пример 2 Систематическое название АТФ:фруктозо-6-фосфат-фосфотрансфераза Рабочее название Фосфофруктокиназа ... [читать подробнее].
referatwork.ru
Гидролазы
Количество просмотров публикации Гидролазы - 466
Характеристика фермента
Пример 4
Характеристика фермента
Пример 3
Характеристика фермента
Пример 2
| Систематическое название | АТФ:фруктозо-6-фосфат-фосфотрансфераза |
| Рабочее название | Фосфофруктокиназа |
| Класс | 2. Трансферазы |
| Подкласс | 2.7. Переносящие фосфорсодержащие группы |
| Подподкласс | 2.7.1. Со спиртовой группой в качестве акцептора |
| Классификационный номер | КФ 2.7.1.11. |
| Систематическое название | L-Аспартат:2-оксоглутарат-аминотрансфераза |
| Рабочее название | Аспартатаминотрансфераза |
| Класс | 2. Трансферазы |
| Подкласс | 2.6. Переносящие азотсодержащие группы |
| Подподкласс | 2.6.1. Аминотрансферазы |
| Классификационный номер | КФ 2.6.1.1. |
| Кофактор | Пиридоксальфосфат |
| Систематическое название | 5-метилтетрагидрофолат:L-гомоцистеин S-метилтрансфераза |
| Рабочее название | Метионинсинтаза |
| Класс | 2. Трансферазы |
| Подкласс | 2.1. Переносящие одноуглеродные фрагменты |
| Подподкласс | 2.1.1. Метилтрансферазы |
| Классификационный номер | 2.1.1.13. |
| Кофактор | Кобаламин. Цинк. |
Гидролазы – ферменты, осуществляющие разрыв внутримолекулярных связей в субстрате (за исключением С-С связей) путем присоединения элементов Н2О, подразделяются на 13 подклассов. Ввиду сложности многих субстратов у ряда ферментов сохранены тривиальные названия, к примеру, пепсин, трипсин. Коферменты отсутствуют.
Гидролазы широко представлены ферментами желудочно-кишечного тракта (пепсин, трипсин, липаза, амилаза и другие) и лизосомальными ферментами. Осуществляют распад макромолекул, образуя легко адсорбируемые мономеры. Примером подклассов служат группы ферментов, действующие на сложные эфиры, на простые эфиры, на пептиды, на углерод-углеродные связи.
В случае если рассматриватиь класс полностью, то в подклассы выделяются группы ферментов, катализирующие гидролиз: 3.1. сложных эфиров; 3.2. О-гликозидов; 3.3. простых эфиров; 3.4. пептидов; 3.5. не пептидных азот-углеродных связей; 3.6. ангидридов кислот; 3.7. углерод-углеродных связей; 3.8. связей с участием галогена; 3.9. связей фосфор-азот; 3.10. связей сера-азот; 3.11. связей углерод-фосфор; 3.12. связей сера-сера; 3.13. связей углерод-сера. Среди подподклассов выделяют гидролазы карбоновых кислот (3.1.1.), гидролазы фосфомоноэфиров (3.1.3.).
Исторически названия гидролаз складывались из названия субстрата с окончанием "‑аза" – коллагеназа,амилаза, липаза, ДНК-аза. Наиболее часто встречаются следующие рабочие названия гидролаз:
1. Эстеразы– гидролиз сложноэфирных связей.
2. Липазы– гидролиз нейтральных жиров (триацилглицеролов).
3. Фосфатазы– гидролиз моноэфиров фосфорной кислоты.
4. Гликозидазы– гидролизуют О- и S-гликозидные связи.
5. Протеазы, пептидазы– гидролиз белков и пептидов.
6. Нуклеазы– гидролиз нуклеиновых кислот.
Систематическое название образуется:
Гидролизуемый субстрат : отделяемая группа гидролаза.
Читайте также
Трансферазы. Классификация ферментов. Номенклатура ферментов Ферменты имеют несколько типов названий. 1) Тривиальные названия (трипсин, пепсин) 2) Рабочая номенклатура. В этом названии фермента присутствует окончание – аза, которое... [читать подробнее].
Трансферазы. Классификация ферментов. Номенклатура ферментов Ферменты имеют несколько типов названий. 1) Тривиальные названия (трипсин, пепсин) 2) Рабочая номенклатура. В этом названии фермента присутствует окончание – аза, которое... [читать подробнее].
АЦИЛТРАНСФЕРАЗЫ (кислотные остатки). ФОСФОТРАНСФЕРАЗЫ (ФОСФАТНЫЕ группировки). МЕТИЛТРАНСФЕРАЗЫ (СНЗ группы). АСАТ - АСПАРАГИНОВАЯ АМИНОТРАНСФЕРАЗА. АМИНОТРАНСФЕРАЗЫ. Они участвуют в реакциях... [читать подробнее].
Гидролазы - участвуют в расщеплении сложных веществ (углеводов, жиров, белков) до простых с участием воды. Играют огромную роль при мобилизации запасных питательных веществ в процессе прорастания семян. Могут действовать и в обратном направлении, синтезируя сложные... [читать подробнее].
Белок и пептиды расщепляют ферменты, объединяемые в подкласс пептидгидролаз (К.Ф.3.4.). Их называют также протеазами, протеолитическими ферментами. Основной реакцией, катализируемой протеолитическими ферментами, является гидролиз пептидной связи в молекулах белков и... [читать подробнее].
Гидролитические ферменты – важнейший класс ферментов, используемых при переработке пищевого сырья. Основной продукцией ферментной промышленности являются препараты гидролаз, таких как амилазы, протеазы, пектиназы, целлюлазы. Гидролитические ферменты используются... [читать подробнее].
referatwork.ru
Шпаргалка - ГИДРОЛАЗЫ - Биология
К классу гидролаз относятся многие ферменты, входящие в состав ферментных препаратов, выпускаемых отечественной промышленностью. Гидролазы катализируют реакции присоединения или отщепления воды (гидротазы и дегидротазы).
Наибольший интерес для специалистов в области пищевой биотехнологии представляют три подкласса ферментов класса гидролаз: эстеразы, гликозидазы и протеазы.
Эстеразы. В эту группу включен ряд ферментов, обладающих сравнительно широкой специфичностью. Эти ферменты, катализируя разрыв эфирных связей, гидролизуют очень большое число различных эфиров, хотя и не с одинаковой скоростью.
Наиболее широко применяется в производстве соков, используемых для безалкогольных напитков, фермент пектинэстераза (ПЭ), который, действуя на пектин, гидролизует его сложноэфирные связи, в результате чего от него отщепляется метиловый спирт по схеме, приведенной на рисунке 4.1.
Данный фермент в больших количествах содержится в таких препаратах, выпускаемых отечественной ферментной промышленностью, как Пектаваморин, Пектофоетидин и Ксилоглюкано-фоетидин.
Фосфатазы. Фосфомоноэстеразы и фосфодиэстеразы относятся к ферментам со сравнительно широкой специфичностью. Но в этой группе находятся также ферменты с узкой специфичностью. Фермент фитаза катализирует гидролиз фитина по уравнению
С6Н6(ОН2РО3)6 + 6Н2О → С6Н12О6 + 6Н3РО4 Фитин Инозит
Фитаза содержится в относительно большом количестве в ячменном солоде. Фитаза отщепляет от фитина фосфорную кислоту, и при этом образуется инозит. Фосфорная кислота проявляет свое действие при брожении, а инозит способствует росту дрожжевых клеток.
Гликозидазы. К этой группе относятся ферменты, гидролизующие не только истинные гликозиды, но и N-гликозильные, а также S-гликозильные соединения. В подгруппу истинных гликозидаз включены ферменты, действующие, на простые гликозиды (например, β-глюкозидаза — фермент, содержащийся в таких отечественных препаратах, как Ксилоглюканофоетидин, Пектаваморин, Пектофоетидин). В эту же группу включены также амилазы, гидролизующие гликозидные связи в крахмале.
Гидролиз крахмала катализируют ферменты из группы гликозидаз при участии ферментов из группы трансгликозидаз. К ферментам первой группы относятся а- и β-амилазы, а также глюкоамилаза, которые разрывают молекулу крахмала гидролизом а-гли-козидных связей. Равновесие этих реакций в основном сдвинуто в сторону гидролиза, поэтому они практически необратимы.
α-Амилаза — эндоамилаза, вызывающая гидролитическое расщепление α-1,4-гликозидных связей внутри высокополимери-зованного субстрата. Схему гидролиза под действием а-амилазы можно записать следующим образом:
Крахмал α — Амилаза α-Декстрины +Мальтоза + Глюкоза (гликоген) (много) (мало) (мало)
α-Амилаза содержится в больших количествах в таких отечественных ферментных препаратах, как Амилосубтилин и Амилоризин. При этом Амилосубтилин содержит главным образом α-амилазу разжижающего действия, а Амилоризин — осахаривающего.
β-Амилаза катализирует гидролиз крахмала до мальтозы. Это экзофермент концевого действия, проявляющий сродство к предпоследней α-1,4-связи с нередуцирующего конца амилозы линейного участка амилопектина. Действие β-амилазы на крахмал можно изобразить в виде следующей схемы:
Крахмал α — Амилаза β-Декстрин + Мальтоза
(гликоген) (42-46%) (54-58%)
Глюкоамилаза отщепляет одиночные остатки глюкозы от нередуцирующего конца цепей крахмала, гликогена и некоторых продуктов их гидролиза. Данный фермент содержится в таком ферментном препарате, как Глюкаваморин, и в небольших количествах в ферментном препарате Амилоризин.
β-Глюканаза гидролизует β-1,4-глюкановые связи в целлюлозе и β-глюкане. Этот фермент содержится в значительных количествах в ферментных препаратах Амилосубтилин, Ксилоглюка-нофоетидин, Цитороземин, Пектофоетидин, Пектаваморин, Целловиридин.
Ксиланаза гидролизует β-1,4- и β-1,3-ксилановые связи.Этот фермент содержится в препаратах Ксилоглюканофоетидин, Ксилонигрин, Пектаваморин, Пектофоетидин.
Целлобиогидролазы гидролизуют целлюлозу, отщепляя с нередуцирующих концов ангидроглюкозных цепей β-1,4-глюканов целлобиозу. Данные ферменты содержатся в таких препаратах как Целлокандин и Целловиридин.
β-Глюкозидаза гидролизует β-глюкозидную связь в дисахаридах и глюкозидах. Тождествен ферменту мальтазе. В результате действия этого фермента на мальтозу образуются две молекулы глюкозы. Фермент содержится в солоде и в препарате Глюкаваморин.
β-Галактозидаза (лактаза) гидролизует лактозу с образованием глюкозы и галактозы, содержится в так называемых лактозных дрожжах и препарате Лактоканесцин.
β-Фруктофуранозидаза (сахараза, инвертаза) гидролизует сахарозу с образованием глюкозы и фруктозы, содержится в дрожжах, в том числе в пивных.
Протеазы. До недавнего времени считалось, что протеазы включают протеиназы и пептидазы, причем протеиназы расщепляют только крупные молекулы, тогда как пептидазы — в основном мелкие молекулы азотистых веществ. В настоящее время протеазы разделяют на две группы. Для одной группы ферментов присутствие примыкающих концевых карбоксильных или аминных групп необязательно, для другой группы — необходимо.
Ферменты первой группы — эндопептидазы — могут действовать на центральные участки пептидной цепи и расщеплять молекулы белка на более мелкие фрагменты, небольшие пептиды они гидролизуют только тогда, когда их концевые группы искусственно блокированы химическим путем. Экзопептидазы не гидролизуют пептидные связи, находящиеся в середине цепи, а действуют либо с карбоксильного, либо с аминного конца цепи, отщепляя последовательно одну за другой концевые аминокислоты.
Расщепляя белок, эндо- и экзопептидазы действуют согласованно: первые образуют большое число свободных концов, а вторые воздействуют на образовавшиеся фрагменты. Эндопептидазы содержатся в ряде отечественных препаратов, таких, как Протосубтилин (щелочная протеаза), Амилосубтилин, Протомезентерин; экзопептидазы — в таких, как Амилоризин, Пектаваморин, Пектофоетидин, Ксилоглюканофоетидин.
ЛИАЗЫ
К данному классу относятся ферменты, разрывающие связи С—С, С—О, С—N и др. в результате реакции элиминирования, что приводит к образованию двойных связей, или, наоборот, присоединяющие определенные группы по двойным связям.
Карбоксилазы. Эти ферменты катализируют отщепление СО2 от молекул амино- и оксикислот или его фиксацию:
R-Ch3-COOH → R-Ch4 + СО2
Пируватдекарбоксилаза, или карбоксилаза (карбоксилаза-2-оксикислота), катализирует важную реакцию при спиртовом брожении — расщепление пировиноградной кислоты на ацетальдегид и СО2. Равновесие реакции сильно сдвинуто в сторону декарбоксилирования:
СН3 — СО — СООН → СО2 + СН3 — СОН
Этот фермент содержится в дрожжах.
Гидролиазы. Эти ферменты катализируют отщепление или присоединение воды (прежнее название — дегидратазы и гидратазы). В данном случае не происходит гидролиз, поскольку субстрат не расщепляется на два компонента, как при реакциях, катализируемых гидролазами.
Карбонатгидролиаза. Этот фермент катализирует расщепление угольной кислоты на воду и диоксид углерода, содержится в дрожжах.
Ферменты группы лиаз, в частности пектаттрансэлиминаза, содержатся в таких отечественных препаратах, как Пектоклостридин и Мацеробациллин.
www.ronl.ru
Реферат: Ферменты
Реферат по биологии на тему: “Ферменты”
Москва 1996
Оглавление
1. Общие положения..........................................................................................................
2. Свойства ферментов......................................................................................................
3. Строение ферментов.....................................................................................................
4. Номенклатура ферментов..........................................................................................
5. Классификация ферментов и характеристика некоторых групп......................
6. Локализация ферментов в клетке.............................................................................
7. Методы выделения и очистки ферментов..............................................................
Литература........................................................................................................................
1. Общие положения
Ферменты (от лат. fermentum - брожение, закваска), специфические белки, присутствующие во всех живых клетках и играющие роль биологических катализаторов. Через их посредство реализуется генетическая информация и осуществляются все процессы обмена веществ и энергии в живых организмах. Ферменты бывают простыми или сложными белками, в состав которых наряду с белковым компонентом (апоферментом) входит небелковая часть - кофермент. Эффективность действия ферментов определяется значительным снижением энергии активации катализируемой реакции в результате образования промежуточных фермент-субстратных комплексов. Присоединение субстратов происходит в активных центрах, которые обладают сходством только с определенными субстратами, чем достигается высокая специфичность (избирательность) действия ферментов. Одна из особенностей ферментов - способность к направленному и регулируемому действию. За счёт этого контролируется согласованность всех звеньев обмена веществ. Эта способность определяется пространственность структурной молекулы ферментов. Она реализуется через изменение скорости действия ферментов и зависит от концентрации соответствующих субстратов и кофакторов, рH среды, температуры, а также от присутствия специфических активаторов и ингибиторов (например, адениловых нуклеотидов, карбонильных, сульфгидрильных соединений и др.). Некоторые ферменты помимо активных центров имеют дополнительные, т.н. аллостерические регуляторные центры. Биосинтез ферментов находится под контролем генов. Различают конститутивные ферменты, постоянно присутствующие в клетках, и индуцируемые ферменты, биосинтез которых активируется под влиянием соответствующих субстратов. Некоторые функционально взаимосвязанные ферменты образуют в клетке структурно организованные полиферментные комплексы. Многие ферменты и ферментные комплексы прочно связаны с мембранами клетки или её органоидов (митохондрий, лизосом, микросом и т.д.) и участвуют в активном транспорте веществ через мембраны.
Известно более 20000 различных ферментов, из которых многие выделены из живых клеток и получены в индивидуальном состоянии. Первый кристаллический фермент (уреаза) выделен американским биохимиком Д.Самнером в 1926 г. Для ряда ферментов изучена последовательность аминокислот и выяснено расположение полипептидных цепей в трёхмерном пространстве. В лабораторных условиях осуществлен искусственный химический синтез фермента рибонуклеазы. Ферменты используют для количественного определения и получения различных веществ, для модификации молекул нуклеиновых кислот методами генной инженерии, диагностики и лечения ряда заболеваний, а также в ряде технологических процессов, применяемых в лёгкой, пищевой и фармацевтической промышленностях.
2. Свойства ферментов
Будучи белками, ферменты обладают всеми их свойствами. Вместе с тем биокатализаторы характеризуются рядом специфических качеств, тоже вытекающих из их белковой природы. Эти качества отличают ферменты от катализаторов обычного типа. Сюда относятся термолабильность ферментов, зависимость их действия от значения рН среды, специфичность и, наконец, подверженность влиянию активаторов и ингибиторов.
Термолабильность ферментов объясняется тем, что температура, с одной стороны, воздействует на белковую часть фермента, приводя при слишком высоких значениях к денатурации белка и снижению каталитической функции, а с другой стороны, оказывает влияние на скорость реакции образования фермент-субстратного комплекса и на все последующие этапы преобразования субстрата, что ведет к усилению катализа.
Зависимость каталитической активности фермента от температуры выражается типичной кривой. До некоторого значения температуры (в среднем до 5О°С) каталитическая активность растет, причем на каждые 10°С примерно в 2 раза повышается скорость преобразования субстрата. В то же время постепенно возрастает количество инактивированного фермента за счет денатурации его белковой части. При температуре выше 50°С денатурация ферментного белка резко усиливается и, хотя скорость реакций преобразования субстрата продолжает расти, активность фермента, выражающаяся количеством превращенного субстрата, падает.
Детальные исследования роста активности ферментов с повышением температуры, проведенные в последнее время, показали более сложный характер этой зависимости, чем указано выше: во многих случаях она не отвечает правилу удвоения активности на каждые 10°С в основном из-за постепенно нарастающих конформационных изменений в молекуле фермента.
Температура, при которой каталитическая активность фермента максимальна, называется его температурным оптимумом.
Температурный оптимум для различных ферментов неодинаков. В общем для ферментов животного происхождения он лежит между 40 и 50°С, а растительного - между 50 и 60°С. Однако есть ферменты с более высоким температурным оптимумом, например, у папаина (фермент растительного происхождения, ускоряющий гидролиз белка) оптимум находится при 8О°С. В то же время у каталазы (фермент, ускоряющий распад Н2О2 до Н2О и О2) оптимальная температура действия находится между 0 и -10°С, а при более высоких температурах происходит энергичное окисление фермента и его инактивация.
Зависимость активности фермента от значения рН среды была установлена свыше 50 лет назад. Для каждого фермента существует оптимальное значение рН среды, при котором он проявляет максимальную активность. Большинство ферментов имеет максимальную активность в зоне рН поблизости от нейтральной точки. В резко кислой или резко щелочной среде хорошо работают лишь некоторые ферменты.
Переход к большей или меньшей (по сравнению с оптимальной) концентрации водородных ионов сопровождается более или менее равномерным падением активности фермента.
Влияние концентрации водородных ионов на каталитическую активность ферментов состоит в воздействии ее на активный центр. При разных значениях рН в реакционной среде активный центр может быть слабее или сильнее ионизирован, больше или меньше экранирован соседними с ним фрагментами полипептидной цепи белковой части фермента и т.п. Кроме того, рН среды влияет на степень ионизации субстрата, фермент-субстратного комплекса и продуктов реакции, оказывает большое влияние на состояние фермента, определяя соотношение в нем катионных и анионных центров, что сказывается на третичной структуре белковой молекулы. Последнее обстоятельство заслуживает особого внимания, так как определенная третичная структура белка-фермента необходима для образования фермент-субстратного комплекса.
Специфичность - одно из наиболее выдающихся качеств ферментов. Эго свойство их было открыто еще в прошлом столетии, когда было сделано наблюдение, что очень близкие по структуре вещества - пространственные изомеры (a- и b-метилглюкозиды) расщепляются по эфирной связи двумя совершенно разными ферментами.
Таким образом, ферменты могут различать химические соединения, отличающиеся друг от друга очень незначительными деталями строения, такими, например, как пространственное расположение метоксильного радикала и атома водорода при 1-м углеродном атоме молекулы метилглюкозида.
По образному выражению, нередко употребляемому в биохимической литературе, фермент подходит к субстрату, как ключ к замку. Это знаменитое правило было сформулировано Э. Фишером в 1894 г. исходя из того, что специфичность действия фермента предопределяется строгим соответствием геометрической структуры субстрата и активного центра фермента.
В 50-е годы нашего столетия это статическое представление было заменено гипотезой Д. Кошланда об индуцированном соответствии субстрата и фермента. Сущность ее сводится к тому, что пространственное соответствие структуры субстрата и активного центра фермента создается в момент их взаимодействия друг с другом, что может быть выряжено формулой “перчатка - рука”. При этом в субстрате уже деформируются некоторые валентные связи и он, таким образом, подготавливается к дальнейшему каталитическому видоизменению, а в молекуле фермента происходят конформационные перестройки. Гипотеза Кошланда, основанная на допущении гибкости активного центра фермента, удовлетворительно объясняла активирование и ингибирование действия ферментов и регуляцию их активности при воздействии различных факторов. В частности, конформационные перестройки в ферменте в процессе изменения его активности Кошланд сравнивал с колебаниями паутины, когда в нее попала добыча (субстрат), подчеркивая этим крайнюю лабильность структуры фермента в процессе каталитического акта.
В настоящее время гипотеза Кошланда постепенно вытесняется гипотезой топохимического соответствия. Сохраняя основные положения гипотезы взаимоиндуцированной настройки субстрата и фермента, она фиксирует внимание на том, что специфичность действия ферментов объясняется в первую очередь узнаванием той части субстрата, которая не изменяется при катализе. Между этой частью субстрата и субстратным центром фермента возникают многочисленные точечные гидрофобные взаимодействия и водородные связи.
3. Строение ферментов
По строению ферменты могут быть однокомпонентными, простыми белками, и двухкомпонентными, сложными белками. Во втором случае в составе фермента обнаруживается добавочная группа небелковой природы.
В разное время возникли различные наименования белковой части и добавочной группы в двухкомпонентных ферментах. Все они до сих пор употребляются в литературе, например:
Фермент в целом Белковая часть Добавочная группа
Симплекс Ферон (носитель) Агон (активная группа)
Холофермент Апофермент Кофермент
Добавочную группу, прочно связанную, не отделяемую от белковой части, называют простетической группой; в отличие от этого добавочную группу, легко отделяющуюся от апофермента и способную к самостоятельному существованию, обычно именуют коферментом.
Химическая природа важнейших коферментов была выяснена в 30-е годы нашего столетия благодаря трудам О. Варбурга, Р. Куна, П. Каррера и др. Оказалось, что роль коферментов в двухкомпонентных ферментах играют большинство витаминов (Е, К, Q, В1, В2, В6 В12, С, Н и др.) или соединений, построенных с участием витаминов (коэнзим А, НАД+ и т. п.). Кроме того, функцию коферментов выполняют такие соединения, как НS-глутатион, многочисленная группа нуклеотидов и их производных, фосфорные эфиры некоторых моносахаридов и ряд других веществ.
Характерной особенностью двухкомпонентных ферментов является то, что ни белковая часть, ни добавочная группа в отдельности не обладают заметной каталитической активностью. Только их комплекс проявляет ферментативные свойства. При этом белок резко повышает каталитическую активность добавочной группы, присущую ей в свободном состоянии в очень малой степени; добавочная же группа стабилизирует белковую часть и делает ее менее уязвимой к денатурирующим агентам. Таким образом, хотя непосредственным исполнителем каталитической функции является простетическая группа, образующая каталитический центр, ее действие немыслимо без участия полипептидных фрагментов белковой части фермента. Более того, в апоферменте есть участок, характеризующийся специфической структурой, избирательно связывающий кофермент. Это так называемый кофермент связывающий домен; его структура у различных апоферментов, соединяющихся с одним и тем же коферментом, очень сходна. Таковы, например, пространственные структуры нуклеотидсвязывающих доменов ряда дегидрогеназ.
Иначе обстоит дело у однокомпонентных ферментов, не имеющих добавочной группы, которая могла бы входить в непосредственный контакт с преобразуемым соединением. Эту функцию выполняет часть белковой молекулы, называемая каталитическим центром. Предполагают, что каталитический центр однокомпонентного фермента представляет собой уникальное сочетание нескольких аминокислотных остатков, располагающихся в определенной части белковой молекулы.
Чаще всего в каталитических центрах однокомпонентных ферментов встречаются остатки сер, гис, три, арг, цис, асп, глу и тир. Радикалы перечисленных аминокислот выполняют здесь ту же функцию, что и кофермент в составе двухкомпонентного фермента.
Аминокислотные остатки, образующие каталитический центр однокомпонентного фермента, расположены в различных точках единой полипептидной цепи. Поэтому каталитический центр возникает в тот момент, когда белковая молекула приобретает присущую ей третичную структуру. Следовательно, изменение третичной структуры фермента под влиянием тех или иных факторов может привести к деформации каталитического центра и изменению ферментативной активности.
Кроме каталитического центра, образованного сочетанием аминокислотных радикалов или присоединением кофермента, у ферментов различают еще два центра: субстратный и аллостерический.
Под субстратным центром понимают участок молекулы фермента, ответственный за присоединение вещества (субстрата), подвергающегося ферментативному превращению. Часто этот участок называют “якорной площадкой” фермента, где, как судно на якорь, становится субстрат. Во многих случаях прикрепление субстрата к ферменту идет за счет взаимодействия с e-аминогрулпой радикала лиз, расположенного в субстратном центре. Эту же роль может выполнять СООН-группа глу, а также НS-группа цис. Однако работы последних лет показали, что гораздо большее значение здесь имеют силы гидрофобных взаимодействий и водородные связи, возникающие между радикалами аминокислотных остатков субстратного центра фермента и соответствующими группировками в молекуле субстрата.
Понятие о каталитическом и субстратном центре не следует абсолютизировать. В реальных ферментах субстратный центр может совпадать (или перекрываться) с каталитическим центром. Более того, каталитический центр может окончательно формироваться в момент присоединения субстрата. Поэтому часто говорят об активном центре фермента, представляющем сочетание первого и второго. Активный центр у ферментов располагается на две щели при двухъядерной структуре, например у лизоцима и рибонуклеазы, или на дне глубокой впадины, как у химотрипсиногена.
Аллостерический центр представляет собой участок молекулы фермента, в результате присоединения к которому определенного низкомолекулярного (а иногда - и высокомолекулярного) вещества изменяется третичная структура белковой молекулы. Вследствие этого изменяется конфигурация активного центра, сопровождающаяся либо увеличением, либо снижением каталитической активности фермента. Это явление лежит в основе так называемой аллостерической регуляции каталитической активности ферментов.
Значения молекулярных масс ферментов колеблются в широких пределах: от нескольких тысяч до нескольких миллионов. В природе насчитывается несколько десятков ферментов, обладающих сравнительно небольшими молекулами (до 50 тыс.). Однако большинство ферментов представлено белками более высокой молекулярной массы, построенными из субъединиц. Так, каталаза (М=25200) содержит в молекуле шесть протомеров с М=42000 каждый. Молекула фермента, ускоряющего реакцию синтеза рибонуклеиновых кислот (РНК-полимераза, М = 400000), состоит из 6 неравных субъединиц. Полная молекула глутаматдегидрогеназы, ускоряющей процесс окисления глутаминовой кислоты (М=336000), построена из 6 субъединиц с М=56000.
Способы компоновки протомеров в мультимеры разнообразны. Крайне важно, что достроенный из субъединиц фермент проявляет максимальную каталитическую активность именно в виде мультимера: диссоциация на протомеры резко снижает активность фермента. Не все ферменты-мультимеры построены исключительно из каталитически активных протомеров. Наряду с каталитическими в их составе отмечены регуляторные субъединицы, как, например, у аспартат-карбамилтрансферазы.
Среди ферментов-мультимеров безусловно преобладают димеры и тетрамеры (их несколько сотен), в меньшей мере распространены гексамеры и октамеры (несколько десятков) и необыкновенно редко встречаются тримеры и пентамеры.
Молекулы ферментов-мультимеров в ряде случаев составлены из субъединиц двух типов, обозначаемых условно как субъединицы типа А и В. Они сходны друг с другом, но отличаются по некоторым деталям первичной и третичной структур. В зависимости от соотношения протомеров типа А и В в мультимере последний может существовать в виде нескольких изомеров, которые называют изозимами. Так, при четырех субъединицах возможны 5 изозимов:
I II III IV V
AAAA AAAB AABB ABBB BBBB
В настоящее время интерес к изозимам резко повысился. Оказалось, что кроме генетически детерминированных изозимов существует большая группа ферментов, обладающая множественными формами, возникающими в результате их посттрансляционной модификации. Множественные формы ферментов и изозимы в частности используются сейчас для диагностики болезней в медицине, прогнозирования продуктивности животных подбора родительских пар при скрещивании для обеспечения максимального гетерозиса в потомстве и т. п.
Значение пространственной организации ферментов особенно ярко выявляется при изучении строения так называемых мультиэнзимов, т.е. ферментов, обладающих способностью ускорять одновременно несколько химических реакций и осуществлять сложные превращения субстрата. Примером может служить мультиэнзим, ускоряющий реакцию окислительного декарбоксилирования пировиноградной кислоты. Этот многоферментный комплекс с М=4500000 состоит из трех видов ферментов. Первый из них (E1) ускоряет реакцию декарбоксилирования пировиноградной кислоты. В состав комплекса входит 12 димерных молекул этого фермента (К=19200). Второй и третий ферменты, катализирующие окислительно-восстановительные процессы при окислении пировиноградной кислоты, сосредоточены внутри мультиэнзимного комплекса. Один из них (Е3) представлен шестью димерными молекулами (М=112 000), другой (Е2) - 24 протомерами (М=70000).
В тех случаях, когда мультиэнзимный комплекс обслуживает единый, многоступенчатый процесс биохимических превращений, его называют метаболоном (от слова метаболизм - обмен веществ). Таковы метаболоны гликолиза, биосинтеза ряда аминокислот, цикла дикарбоновых и трикарбоновых кислот и др.
В результате слаженного во времени и пространстве действия всех трех видов входящих в его состав ферментов мультиэнзим с огромной скоростью осуществляет превращение пировиноградной кислоты. Именно в кооперативном характере каталитического процесса и кроется главное отличие биокатализаторов от катализаторов неорганической природы, именно поэтому интенсивность биокатализа в десятки, сотни и тысячи раз превосходит мощность действия неорганических катализаторов.
Сравнительно недавно выявлена еще одна своеобразная черта в строении ферментов: некоторые из них являются полифункциональными, т.е. обладают несколькими энзиматическими активностями, но всего лишь одной полипептидной цепью. Дело в том, что эта единая цепь при формировании третичной структуры образует несколько функционально и стерически обособленных глобулярных участков - доменов, каждый из которых характеризуется своей каталитической активностью.
При изучении мультиэнзимных комплексов и полифункциональных ферментов удалось понять наиболее важную особенность ферментативного катализа, а именно - эстафетную передачу промежуточных продуктов реакции от одного компонента каталитической системы к другому без их высвобождения.
4. Номенклатура ферментов
Ферментология очень долго не располагала строго научной номенклатурой ферментов. Наименования ферментам давали по случайным признакам (тривиальная номенклатура), по названию субстрата (рациональная), по химическому составу фермента, наконец, по типу катализируемой реакции и характеру субстрата.
Примерами тривиальной номенклатуры могут служить названия таких ферментов, как пепсин (от греч. пепсис - пищеварение), трипсин (от греч. трипсис - разжижаю) и папаин (от названия дынного дерева Carica papaja, из сока которого он выделен). По действию все эти ферменты являются протеолитическими, т. е. ускоряют гидролиз протеинов (белков). Характерное название была дано группе окрашенных внутриклеточных ферментов, ускоряющих окислительно-восстановительные реакции в клетке, - цитохромы (от лат. citos - клетка и chroma - цвет).
Наибольшее распространение получила рациональная номенклатура, согласно которой название фермента составляется из названия субстрата характерного окончания -аза. Она была предложена более столетия тому назад, в 1883 г. Э. Дюкло - учеником Л. Пастера. Так, фермент, ускоряющий реакцию гидролиза крахмала, получил название амилаза (от греч. амилон - крахмал), гидролиза жиров - липаза (от греч. липос - жир), белков (протеинов) - протеаза, мочевины - уреаза (от греч. уреа - мочевина) и т. п.
Когда методами аналитической химии были достигнуты известные успехи в расшифровке химической природы простетических групп, возникла новая номенклатура ферментов. Их стали именовать по названию простетической группы, например, геминфермент (простетическая группа - гем), пиридоксаль-фермент (простетическая группа - пиридоксаль) и т.п.
Затем в названии фермента стали указывать как на характер субстрата, так и на тип катализируемой реакции. К примеру, фермент, отнимающий водород от молекулы янтарной кислоты, называют сукцинатдегидрогеназой, подчеркивая этим одновременно и химическую природу субстрата, и отнятие атомов водорода в процессе ферментативного действия:
- 2Н
НООС ¾ Сh3 ¾ СН2 ¾ CООН ¾¾¾¾¾® НООС ¾ СН = СН ¾ СООН
Янтарная кислота Дегидрирование
В 1961 г. Международная комиссия по номенклатуре ферментов представила V Международному биологическому конгрессу проект номенклатуры, построенный на строго научных принципах. Проект был утвержден конгрессом, и новая номенклатура прочно вошла в ферментологию. Согласно этой (Московской) номенклатуре название ферментов составляют из химического названия субстрата и названия той реакции, которая осуществляется ферментом. Если химическая реакция, ускоряемая ферментом, сопровождается переносом группировки атомов от субстрата к акцептору, название фермента включает также химическое наименование акцептора.
Например, пиридоксальфермент, катализируюший реакцию переаминирования между L-аланином и a-кетоглутаровой кислотой, называется L-аланин: 2-оксоглутарат аминотрансфераза. В этом названии отмечены сразу три особенности: 1) субстратом является L-аланин; 2) акцептором служит 2-окcоглутаровая кислота; З) от субстрата к акцептору передается аминогруппа.
Названия ферментов по научной номенклатуре неизмеримо выигрывают в точности, но становятся в ряде случаев гораздо сложнее старых, тривиальных. Так, уреаза (тривиальное название), ускоряющая реакцию гидролиза - мочевины на оксид углерода (IV) и аммиак, по научной номенклатуре именуется карбамид - амидогидролазой:
Н2N ¾ СО ¾ NН2 + Н2О ¾¾¾¾¾® 2NН3 + СО2
В этом названии дано точное химическое наименование субстрата и указано, что фермент катализирует реакцию гидролиза амидогруппы. Трегалаза, ускоряющая реакцию гидролиза трегалозы, называется трегалоза-1-глюко-гидролазой.
В связи со значительным усложнением научных названий в новой номенклатуре допускается сохранение наряду с новыми старых тривиальных, рабочих названий ферментов. Международной комиссией был составлен детальный список всех известных в то время ферментов, существенно дополненный в 1972 г. при пересмотре как классификации, так и номенклатуры некоторых ферментов, где рядом с новым научным названием каждого фермента приведено старое, а также указан химизм катализируемой ферментом реакции и в некоторых случаях природа фермента. Таким образом, исключается возможность путаницы в наименовании ферментов. В 1964 г. список включал 874 фермента; в последующее время он был существенно дополнен и возрос до 1770 ферментов в 1972 г. и до 2003 ферментов в 1979 г.
Каждому ферменту в указанном списке присвоен индивидуальный номер (шифр). Например, шифр уреазы выражается цифрами 3.5.1.5. Это означает, что уреаза относится к 3-му классу (первая цифра) ферментов, все представители которого катализируют реакции гидролиза. Вторая цифра (5) говорит о том, что уреаза принадлежит к 5-му подклассу этого класса, куда зачислены все ферменты, ускоряющие гидролиз С - N-связей, не являющихся пептидными. Третья цифра шифра (1) указывает на принадлежность уреазы к подподклассу 5-го подкласса, члены которого ускоряют гидролиз линейных амидов, а последняя цифра (5) - порядковый номер уреазы в этом подподклассе.
Упоминавшаяся ранее лактатдегидрогенеза имеет шифр 1.1.1.27, т. е. относится к 1-му классу ферментов (оксидоредуктазы), к 1-му подклассу (оксидоредуктазы, действующие на СН - ОН-группировки в качестве доноров атомов водорода), к 1-му подподклассу (акцептором атомов водорода служит никотинамидадениндинуклеотид) и занимает 27-е место в перечне ферментов упомянутого подподкласса. Таким образом, шифр абсолютно точно указывает место фермента в общем списке. В настоящее время принято в научных публикациях при первом упоминании фермента указывать в скобках его шифр.
5. Классификация ферментов и характеристика некоторых групп
По первой в истории изучения ферментов классификации их делили на две группы: гидролазы, ускоряющие гидролитические реакции, и десмолазы, ускоряющие реакции негидролитического распада. Затем была сделана попытка разбить ферменты на классы по числу субстратов, участвующих в реакции. В соответствии с этим ферменты классифицировали на три группы. 1. Катализирующие превращения двух субстратов одновременно в обоих направлениях: А+В)С+D. 2. Ускоряющие превращения двух субстратов в прямой реакции и одного в обратной: А+В)С. 3. Обеспечивающие каталитическое видоизменение одного субстрата как в прямой, так и в обратной реакции: А)В.
Одновременно развивалось направление, где в основу классификации ферментов был положен тип реакции, подвергающейся каталитическому воздействию. Наряду с ферментами, ускоряющими реакции гидролиза (гидролазы), были изучены ферменты, участвующие в реакциях переноса атомов и атомных групп (феразы), в изомеризации (изомеразы), расщеплении (лиазы), различных синтезах (синтетазы) и т. д. Это направление в классификации ферментов оказалось наиболее плодотворным, так как объединяло ферменты в группы не по надуманным, формальным признакам, а по типу важнейших биохимических процессов, лежащих в основе жизнедеятельности любого организма. По этому принципу все ферменты делят на 6 классов.
1. Оксидоредуктазы - ускоряют реакции окисления - восстановления. 2. Трансферазы - ускоряют реакции переноса функциональных групп и молекулярных остатков. 3. Гидролазы - ускоряют реакции гидролитического распада. 4. Лиазы - ускоряют негидролитическое отщепление от субстратов определенных групп атомов с образованием двойной связи (или присоединяют группы атомов по двойной связи). 5. Изомеразы - ускоряют пространственные или структурные перестройки в пределах одной молекулы. 6. Лигазы - ускоряют реакции синтеза, сопряженные с распадом богатых энергией связей. Эти классы и положены в основу новой научной классификации ферментов.
К классу оксидоредуктаз относят ферменты, катализирующие реакции окисления - восстановления. Окисление протекает как процесс отнятия атомов Н (электронов) от субстрата, а восстановление - как присоединение атомов Н (электронов) к акцептору.
В класс трансфераз входят ферменты, ускоряющие реакции переноса функциональных групп и молекулярных остатков от одного соединения к другому. Это один из наиболее обширных классов: он насчитывает около 500 индивидуальных ферментов. В зависимости от характера переносимых группировок различают фосфотрансферазы, аминотрансферазы, гликозилтрансферазы, ацилтрансферазы, трансферазы, переносящие одноуглеродные остатки (метилтрансферазы, формилтрансферазы), и др. Например, амидазы ускоряют гидролиз амидов кислот. Из них важную роль в биохимических процессах в организме играют уреаза, аспарагиназа и глутаминаза.
Уреаза была одним из первых белков-ферментов, полученным в кристаллическом состоянии. Это однокомпонентный фермент (М=480000), молекула его глобулярна и состоит из 8 равных субъединиц. Уреаза ускоряет гидролиз мочевины до NН3 и СО2.
Характерные черты действия ферментов класса лигаз (синтетаз) выявлены совсем недавно в связи со значительными успехами в изучении механизма синтеза жиров, белков и углеводов: Оказалось, что старые представления об образовании этих соединений, согласно которым они возникают при обращении реакций гидролиза, не соответствуют действительности. Пути их синтеза принципиально иные.
Главная их особенность - сопряженность синтеза с распадом веществ, способных поставлять энергию для осуществления биосинтетического процесса. Одним из таких природных соединений является АТФ. При отрыве от ее молекулы в присутствии лигаз одного или двух концевых остатков фосфорной кислоты выделяется большое количество энергии, используемой для активирования реагирующих веществ. Лигазы же каталитически ускоряют синтез органических соединений из активированных за счет распада АТФ исходных продуктов. Таким образом, к лигазам относятся ферменты, катализирующие соединение друг с другом двух молекул, сопряженное с гидролизом пирофосфатной связи в молекуле АТФ или иного нуклеозидтрифосфата.
Механизм действия лигаз изучен еще недостаточно, но, несомненно, он весьма сложен. В ряде случаев доказано, что одно из участвующих в основной реакции веществ сначала дает промежуточное соединение с фрагментом распадающейся молекулы АТФ, а вслед за этим указанный промежуточный продукт взаимодействует со вторым партнером основной химической реакции с образованием конечного продукта.
6. Локализация ферментов в клетке
Одним из принципиальных отличий ферментов от катализаторов небиологического происхождения является кооперативный характер их действия. На уровне одиночной молекулы фермента кооперативный принцип реализуется в тонком взаимодействии субстратного, активного и аллостерического центров. Однако гораздо большее значение имеет кооперативное осуществление реакций на уровне ансамблей ферментов. Именно благодаря наличию систем ферментов - в виде мультиэнзимных комплексов или еще более сложных образований - метаболонов, обеспечивающих каталитические превращения всех участников единого метаболического цикла - в клетках с большой скоростью осуществляются многостадийные процессы как распада, так и синтеза органических молекул. Ферментативный катализ в многостадийных реакциях идет без выделения промежуточных продуктов: только возникнув, они тут же подвергаются дальнейшим преобразованиям.
Это возможно лишь потому, что в клеточном содержимом ферменты распределены не хаотически, а строго упорядоченно. С современной точки зрения клетка представляется высокоорганизованной системой, в отдельных частях которой осуществляются строго определенные биохимические процессы. В соответствии с приуроченностью их к определенным субклеточным частицам или отсекам (компартментам) клетки в них локализованы те или иные индивидуальные ферменты, мультиэнзимные комплексы, полифункциональные ферменты или сложнейшие метаболоны.
Разнообразные гидролазы и лиазы сосредоточены преимущественно в лизосомах. Внутри этих сравнительно небольших (несколько нанометров в диаметре) пузырьков, ограниченных мембраной от гиалоплазмы клетки, протекают процессы деструкции различных органических соединений до тех простейших структурных единиц, из которых они построены. Сложные ансамбли окислительно-восстановительных ферментов, такие, например, как цитохромная система, находятся в митохондриях. В этих же субклеточных частицах локализован набор ферментов цикла дикарбоновых и трикарбоновых кислот. Ферменты активирования аминокислот распределены в гиалоплазме, но они же есть и в ядре. В гиалоплазме присутствуют многочисленные метаболоны гликолиза, структурно объединенные с таковыми пентозофосфатного цикла, что обеспечивает взаимопереключение дихотомического и апотомического путей распада углеводов. В то же время ферменты, ускоряющие перенос аминокислотных остатков на растущий конец полипептидной цепи и катализирующие некоторые другие реакции в процессе биосинтеза белка, сосредоточены в рибосомальном аппарате клетки. Нуклеотидилтрансферазы, ускоряющие реакцию переноса нуклеотидных остатков при новообразовании нуклеиновых кислот, локализованы в основном в ядерном аппарате клетки. Таким образом, системы ферментов, сосредоточенные в тех или иных структурах, участвуют в осуществлении отдельных циклов реакций. Будучи тонко координированы друг с другом, эти отдельные циклы реакций обеспечивают жизнедеятельность клеток, органов, тканей и организма в целом.
7. Методы выделения и очистки ферментов
Долгое время вполне обоснованно считали, что все ферменты - тела белковой природы. Однако в начале 80-х годов была неожиданно открыта способность низкомолекулярных рибонуклеиновых кислот ускорять реакцию превращения предшественников РНК в функционально значимый продукт, т. е. возникло представление о полирибонуклеотидной природе некоторых ферментов, названных рибозимами.
Хотя уже осуществлен лабораторный синтез ряда ферментов - рибонуклеазы, лизоцима, ферредоксина и цитохрома с, трудно ожидать, что синтетическое получение ферментов получит широкое распространение в ближайшие десятилетия ввиду его сложности и дороговизны, поэтому единственный реальный в настоящее время способ получения ферментов - это выделение их из биологических объектов.
Выделяют ферменты так же, как и другие белки, хотя есть приемы, применяемые преимущественно для ферментов. Из них можно отметить экстракцию глицерином, в котором сохраняются нативные свойства ферментов, а также метод ацетоновых порошков, состоящий в осаждении и быстром обезвоживании при температуре не выше -10°С тканей или вытяжек из них, содержащих ферменты. К их числу относится также получение ферментов путем адсорбции с последующей элюцией (снятием) с адсорбента. Этот метод был введен в химию ферментов А. Я. Данилевским и дал мощный толчок развитию ферментологии. Сейчас адсорбционный метод выделения и очистки ферментов разработан детально. Наряду с ним широко применяют метод ионообменной хроматографии, метод молекулярных сит, электрофорез и особенно изоэлектрофокусирование. Одна из модификаций адсорбционного метода - афинная хроматография, где адсорбентом служит вещество, с которым фермент взаимодействует избирательно. В результате лишь один этот фермент задерживается на колонке, а все сопутствующие ему выходят с током проявителя. Изменяя характер проявителя, исследуемый фермент элюирует с колонки. Этим методом достигают очистки фермента в несколько тысяч раз, применяя всего лишь одноэтажную (аффинная сорбция - элюция) схему выделения.
Для успешного выделения ферментов из клеточного содержимого необходимо очень тонкое измельчение исходного материала, вплоть до разрушения субклеточных структур: лизосом, митохондрий, ядер и др., которые несут в своем составе многие индивидуальные ферменты. Особое внимание при выделении ферментов уделяют проведению всех операций в условиях, исключающих денатурацию белка, так как она всегда связана с потерей ферментативной активности. Этому способствует проведение операций в присутствии защитных добавок, в частности HS-содержащих соединений (цистеина, глутатиона, меркаптоэтанола, цистеамина, дитиотреитола и др.):
HS ¾ Ch3 ¾ СН2 ¾ NН HS¾Ch3¾CH(ОН) ¾ СН (ОН) ¾ Сh3 ¾ SH
Цистеамин Дитиотреитол
Очень важно поддерживать на всех этапах выделения ферментов низкую температуру, так как некоторые из них даже при -80°С теряют активность.
Для оценки гомогенности ферментного препарата прибегают к обычным методам белковой химии. Переломным моментом в усовершенствовании методов получения высокоочищенных, гомогенных препаратов ферментов было открытие способности их кристаллизоваться, осуществленное впервые в 1906 г. А. Д. Розенфельдом (им была получена в виде кристаллов оксидаза из корней редьки) и приобретшее с 1926 г. широкую известность после работы Д. Самнера по получению кристаллической уреазы из бобов канавалии. Нередко о степени чистоты ферментного препарата судят по его биологической активности; если активность при дальнейшей очистке не возрастает, препарат можно считать гомогенным. Из 2003 включенных в список ферментов более 1500 выделено и в той или иной мере очищено, третья часть их закристаллизована, у нескольких сотен выяснена первичная, а у нескольких десятков - третичная структура.
Литература
1. Власова З.А. Биология. Справочник школьника. М., Всероссийское слово, 1995 г.
2. Хомченко Г.Л. Химия для поступающих в ВУЗы. Учебное пособие. М., Высшая школа, 1993 г.
3. Биологический энциклопедический словарь. Под ред. Гилярова М.С. М., Советская энциклопедия, 1987 г.
www.referatmix.ru
Реферат Гликозил-гидролазы
Реферат на тему:
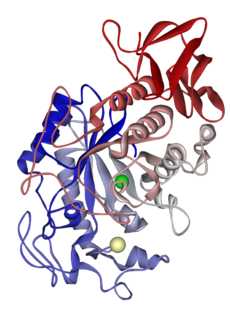
Модель молекулы гликозидазы с пространственной структурой в виде (β/α)8-бочонка
Модель молекулы гликозидазы с пространственной структурой в виде шести-лопастного β-пропеллера
Гликозил-гидролазы (или гликозидазы) катализируют гидролиз гликозидных связей в молекулах углеводов, приводя к появлению двух более мелких молекул углеводов. Эти ферменты встречаются в клетках почти всех живых организмов. Гликозидазы выполняют множество разнообразных функций: деградация биомассы (например, целлюлозы и гемицеллюлозы), участие в антибактериальной защите организма (например, лизоцим), развитие патогенеза (например, вирусные нейраминидазы), клеточный биосинтез (например, маннозидазы, вовлечённые в созревание N-гликозилированных гликопротеинов). Гликозидазы вместе с гликозилтрансферазами образуют основу биологического аппарата синтеза и разрушения гликозидных связей.
Классификация
Гликозил-гидролазы объединены в КФ 3.2.1 как ферменты, катализирующие гидролиз O- или S-гликозидов. Все гликозидазы имеют номера КФ 3.2.1.x, при этом x может быть от 1 до 165 в зависимости от субстратной специфичности фермента. На основе молекулярного механизма катализируемой ими реакции гликозидазы могут быть разбиты на две группы. Представители одной из них обращают (inverting), а другой — сохраняют (retaining) путём двойного обращения аномерную конфигурацию субстрата у продукта реакции гидролиза[1]. Гликозил-гидролазы также могут быть классифицированы как экзо- или эндо-действующие, в зависимости от того, действуют ли они соответственно на концевой или внутренний моносахаридный остаток в углеводной цепи. Более современные классификации гликозил-гидролаз основаны на сравнении их аминокислотных последовательностей. Такие классификации обладают большой предсказательной силой в отношении возможных биохимических активностей неисследованных ферментов с недавно определёнными последовательностями. Впервые классификация всех известных на тот момент последовательностей гликозидаз была предложена в 1991 году[2]. Близкородственные белки было предложено группировать в семейства. Впоследствии эволюционно родственные семейства стали объединять на более высоком иерархическом уровне в кланы[3]. Такая двухуровневая классификация в настоящее время доступна на сайте CAZy:
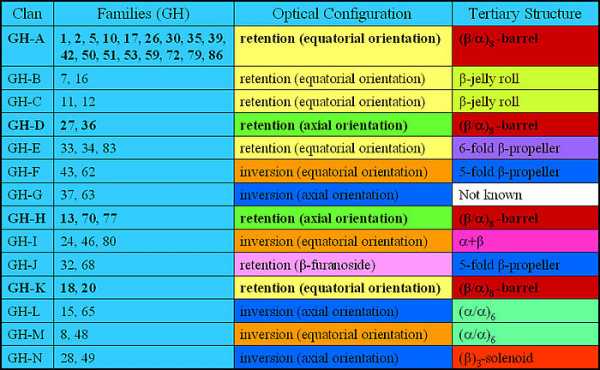
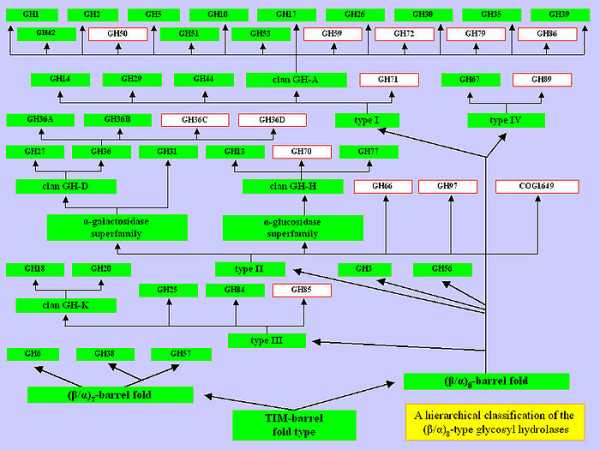
Недавние исследования позволили на основе двухуровневой классификации создать многоуровневую (иерархическую) классификацию гликозил-гидролаз и их гомологов[4][5]:
Номенклатура
Большинство гликозил-гидролаз получили свои названия по основному субстрату. Наряду с этими названиями часто также используются и названия, данные по отщепляемому углеводному остатку. Для ряда гликозил-гидролаз применяются тривиальные названия. Ниже для примера приведены названия некоторых гликозидаз и соответствующие К. Ф. номера:
- 4-α-глюканотрансфераза (К. Ф.2.4.1.25)
- α-амилаза (К. Ф.3.2.1.1)
- β-амилаза (К. Ф.3.2.1.2)
- глюкоамилаза (К. Ф.3.2.1.3)
- целлюлаза (К. Ф.3.2.1.4)
- β-ксиланаза (К. Ф.3.2.1.8)
- изомальтаза (К. Ф.3.2.1.10)
- хитиназа (К. Ф.3.2.1.14)
- лизоцим или мурамидаза (К. Ф.3.2.1.17)
- нейраминидаза (К. Ф.3.2.1.18)
- кислая α-глюкозидаза или мальтаза (К. Ф.3.2.1.20)
- β-глюкозидаза (К. Ф.3.2.1.21)
- α-галактозидаза или мелибиаза (К. Ф.3.2.1.22)
- β-галактозидаза или лактаза (К. Ф.3.2.1.23)
- α-маннозидаза (К. Ф.3.2.1.24)
- β-фруктозидаза или сахараза или инвертаза (К. Ф.3.2.1.26)
- трегалаза (К. Ф.3.2.1.28)
- β-глюкуронидаза (К. Ф.3.2.1.31)
- амило-α-1,6-глюкозидаза (К. Ф.3.2.1.33)
- гиалуронидаза (К. Ф.3.2.1.35)
- гиалуронидаза (К. Ф.3.2.1.36)
- пуллуназа (К. Ф.3.2.1.41)
- глюкоцереброзидаза (К. Ф.3.2.1.45)
- галактозилцерамидаза (К. Ф.3.2.1.46)
- сахараза (К. Ф.3.2.1.48)
- α-N-ацетилгалактозаминидаза (К. Ф.3.2.1.49)
- α-N-ацетилглюкозаминидаза (К. Ф.3.2.1.50)
- α-L-фукозидаза (К. Ф.3.2.1.51)
- гексоаминидаза (К. Ф.3.2.1.52)
- 1,2-α-L-фукозидаза (К. Ф.3.2.1.63)
- α-L-идуронидаза (К. Ф.3.2.1.76)
- 6-фосфо-β-галактозидаза (К. Ф.3.2.1.85)
- 6-фосфо-β-глюкозидаза (К. Ф.3.2.1.86)
- эндо-альфа-N-ацетилгалактозаминидаза (К. Ф.3.2.1.97)
- стриктозидин-β-глюкозидаза (К. Ф.3.2.1.105)
- лактаза (К. Ф.3.2.1.108)
- 1,3-α-L-фукозидаза (К. Ф.3.2.1.111)
- 2-дезоксиглюкозидаза (К. Ф.3.2.1.112)
- 1,6-α-L-фукозидаза (К. Ф.3.2.1.127)
- α-глюкуронидаза (К. Ф.3.2.1.139)
- тиоглюкозидаза или мирозиназа (К. Ф.3.2.1.147)
- β-примеверозидаза (К. Ф.3.2.1.149)
- 1,6-α-D-маннозидаза (К. Ф.3.2.1.163)
Примечания
- Sinnott, M. L. Chem. Rev. 1990, 90, 1171—1202.
- Henrissat, B. Biochem. J. 1991, 280, 309—316.
- Henrissat, B., Bairoch, A. Biochem. J. 1996, 316, 695—696.
- Naumoff, D.G. Proceedings of the Fifth International Conference on Bioinformatics of Genome Regulation and Structure. 2006, 1, 294—298. - www.bionet.nsc.ru/meeting/bgrs2006/BGRS_2006_V1.pdf
- Наумов Д.Г. Биохимия. 2011, 76, 764–780. - molbiol.ru/forums/index.php?s=06fe3964d28ba4f8b0fd924dbb570bc5&act=Attach&type=post&id=112105
Категории: Углеводы, Семейства гликозил-гидролаз.
Текст доступен по лицензии Creative Commons Attribution-ShareAlike.wreferat.baza-referat.ru
Реферат: Ферменты
Министерство образования РФ
Муниципальная средняя школа № 33
Экзаменационный реферат
по биологии на тему
«Ферменты»
Выполнил:
ученик 10 Г класса
Елизаров Александр
Научный руководитель
Захаров С. П.
Смоленск 2000
Содержание:
1.Введение.
2. Ферменты.
·История открытия.
·Природа ферментов.
а) Структуры.
б) Специфичность.
3. Состав.
4. Классификация.
5. Номенклатура.
6. Активность ферментов.
7.Механизм действия.
8.Значение.
·В организме.
·В науке.
9. Заключение.
ВВЕДЕНИЕ.
«Ферменты ( от латинского слова fermentum – закваска) – белки, которые обладают каталитической активностью и характеризуются очень высокой специфичностью и эффективностью действия. Все процессы в живом организме- дыхание, пищеварение, мышечное сокращение, фотосинтез и другие – осуществляются с помощью ферментов. Ферменты находятся во всех живых клетках и составляют большую часть всех их белков. Они во много миллионов раз ускоряют самые разнообразные химические превращения, из которых складывается обмен веществ. Под действием различных ферментов составные компоненты пищи: белки, жиры и углеводы – расщепляются до более простых соединений, из которых затем в организме синтезируются новые макромолекулы, свойственные данному типу. » Вот, всё что я знал о ферментах. Я решил пополнить свои знания и поэтому взял реферат по ферментам.
ИСТОРИЯ ОТКРЫТИЯ.
Науку составляет не только достигнутый результат, но и путь ведущий к результату путь от незнания к знанию, медленный, извилистый, скачкообразный, в каждой области зависящий от достижений смежных наук и общего развития мировоззрения. Ещё в незапамятные времена, на заре возникновения цивилизации, люди в своей практической деятельности сталкивались с различными ферментативными процессами и использовали их для своих целей. Это
спиртовое и молочнокислое брожение, применение сычуга для приготовления сыров, солода и плесневых грибов- для осахаривания продуктов. Вероятно, первым, кто попытался
создать общее представление о химических процессах в живом организме, был врач и ученый Парацельс, родившийся в Швейцарии в конце XV века. Несмотря на наивность
(с совершенной точки зрения), взгляды Парацельса во многом были прогрессивными, так как для понимания жизненных явлений он пытался привлечь реальные силы природы. Именно с этих позиций Парацельс и его последователи подошли к рассмотрению сущности ферментации, давно известного понятия обозначавшего разного рода брожения, главным
образом спиртовое и молочнокислое. В XVI и начале XVII века уже делались попытки рассматривать ферментации как химические процессы. И Василий Валентин ( первая
половина XVI века), и Андрей Либавий (1550-1616 годы) считали ферменты ( или дрожжи) особым веществом, хотя и подчиняли его действия неким не материальным силам. Другим последователем Парацельса был знаменитый голландский химик Иоганн Баптиста Ван Гельмонт (577-1644 годы). Именно он охарактеризовал фермент как агент, вызывающий химические процессы в организме и управляющий ими. Качественный скачёк в развитии учения о ферментациях произошёл в связи с исследованиями великого французского химика Антуана Лавуазье, совершившего переворот в химии и впервые внедрившего в химические исследования строгие количественные методы. К концу XVIII века уже было известно, что встречаются химические процессы, протекающие с участием какого-то агента, без которого процесс практически не идёт.
Первые успехи были достигнуты при изучении превращения крахмала в сахар. Решающая роль в этих исследованиях принадлежит работам петербургского академика К. С Кирхгофа, которые открыли новую страницу в истории и химия ферментов. В начале XIX века было открыто немало химических реакций, среди них были и некоторые ферментативные реакции. Юстус Либих был одним из наиболее крупных авторитетов среди химиков XIX века. В это время было открыто ещё несколько ферментов. В 1836 году Т.Шванн впервые обнаружил в желудочном соке фермент животного происхождения, названный им пепсином. Несколько позже, в 1857 году, А.Корвизар описал другой фермент, переваривающий белки - трипсин. В XIX веке (1897 год) Эдуард Бухнер убедительно доказал химическую природу ферментов. В 1907 году - Эдуард Бухнер был удостоен Нобелевской премии по химии. (В.И.Розенгарт Ферменты- двигатели жизни).
ПРИРОДАФЕРМЕНТОВ.
а)После того как стало возможным исследование ферментов в бес клеточной среде, была окончательно установлена их химическая природа. Было выявлено, что все они представляют собой вещества белковой природы и, как все белки могут быть простыми и сложными в зависимости от сопутствующего компонента небелкового характера ( простетической группы).
Так мы подчёркивали, что свойство каждого белка определяется последовательностью расположения остатков аминокислот в их молекуле. Эта последовательность называется первичнойструктурой белка. В последние годы разработаны очень надёжные, и даже автоматизированные методы изучения первичной структуры, что дало возможность определить
полную аминокислотную последовательность для многих белков, в том числе и для ферментов. Помимо первичной структуры, определяемой последовательностью расположения аминокислот, для проявления специфических свойств белка (в ном числе ферментативной активности) важную роль играют более высокие уровни - вторичная и третичная структуры, сущность которых заключается в определённом расположение полипептидных цепей в пространстве.
Вторичная и третичная структуры белков поддерживаются сравнительно слабыми внутримолекулярными связями, и поэтому легко могут быть разрушены разными физическими и химическими воздействиями. Такое нарушение высших структур белка без повреждения его первичной структуры составляет сущность денатурации. При денатурации белок нередко утрачивает свои биологические свойства, в случае ферментов исчезает ферментативная активность. Современные методы исследования позволяют получить представление не только о первичной структуре белков. Есть ферменты, для которых полностью выяснено пространственное расположение атомов, составляющее их молекулу, то- есть расшифрованы вторичная и третичная структуры. Это достигнуто благодаря применению исключительно тонкого и сложного метода, так называемого рентгеноструктурного анализа. Некоторым белкам свойственен ещё более высокий уровень структуры - четвертичная структура. Это уже надмолекулярный уровень: функционирование такого белка нуждается не в одной, а в нескольких молекулах ( чаще всего в двух или четырёх), которые вместе образуют комплекс, обладающий всеми специфическими свойствами. Каждая отдельная молекула такого белка, составляющая четвертичный комплекс, называется субъединицей. Многие ферменты построены из субъединиц. В одних случаях субъединиц сами обладают активностью, в других их субъединиц по отдельности неактивны. Субъединицы, сопоставляющие молекулу фермента, могут быть одинаковыми, но могут и отличатся друг от друга. Представление о молекуле фермента как структуре, состоящей из субъединиц , позволяет нам объяснить одно очень интересное и практически важное явление. Существуют ферменты, различающиеся по строению, но катализирующие одну и ту же реакцию, они называются изоферментами. Такие ферменты довольно широко распространены в организме, и их выявление имеет большое значение в медицине.
б)Одно из наиболее поразительных свойств ферментов их специфичность. Специфичность ферментов проявляется по- разному и может быть выражена в разной степени. Прежде всего следует различать специфичность по отношению к субстрату и к типу химической реакции, катализируемой ферментом.
Специфичность по отношению к реакции.
Каждый фермент катализирует одну химическую реакцию или группу реакций одного типа. Наиболее ярким проявлением этого вида специфичности могут служить довольно частые случаи, когда одно и то же химическое соединение выступает как субстрат действия нескольких ферментов, причём каждый из них, катализирует специфическую для него реакцию, приводит к образованию совершенно различных продуктов (смотри приложение № 1).
· В первой реакции под действием фермента оксидазы происходит окисление аминокислот. При этом аминогруппа (Nh3) отделяется в форме аммиака (Nh4) и образуется соединение, содержащие кретонную группу (С=О) и называемое кетокислотой.
· Вторую реакцию катализирует декарбоксилаза. Под влиянием этого фермента из карбоксильной группы (- СООН) отщепляется углекислота (СО2) и остаётся амин.
· Третья реакция более сложна. Она катализируется ферментом трансиминазой и состоит в переносе аминогруппы с аминокислоты на кетонокислоту. Мы видим. что исходная аминокислота имеет радикал R, а образовавшаяся в результате реакции новая аминокислота- радикал R'.
Итак, один и тот же субстрат подвергается разным превращениям под влиянием различных ферментов.
Специфичность по отношению к субстрату.
Наряду с только, что описанной формой специфичности фермента по отношению к катализируемой им реакции существует и другая, тесно связанная с первой форма специфичности, выражающаяся в способности фермента атаковать субстрат только определённого химического строения. Иногда фермент способен действовать только на один единственный субстрат, тогда говорят, что он обладает абсолютной специфичностью. Значительно чаще фермент влияет на группу субстратов, имеющих сходное строение. Такую специфичность называют групповой. Особый интерес представляет так называемая стереохимическая специфичность, состоящая в том, что фермент действует на субстрат или группу субстратов, отличающихся особым расположением атомов в пространстве.
Абсолютная специфичностьвстречается редко.
Хорошим примером фермента , обладающего очень высокой, практически абсолютной специфичностью может служить уреаза, катализирующая гидролиз мочевины.
h3N\
C=O + h3O = CO2 + 2Nh4
h3N/ вода углекислота аммиак
мочевина
Долгое время считалось, что мочевина является единственным субстратом уреазы. Но не так давно было показано, что кристаллическая уреаза может действовать и на близкого родственника мочевины - оксимочевину, отличающуюся наличием в молекуле одного атома кислорода.
HOHN\
C=O
h3N/
оксимочевина
«Правда, реакция гидролиза мочевины под влиянием уреазы протекает в 120 раз медленнее, чем гидролиз мочевины» (В. И. Розенгарт Ферменты- двигатели жизни)
Таким образом, понятие "абсолютная специфичность" является в известной мере относительным.
Групповая специфичность. Она характеризует подавляющее большинство ферментов и состоит в том, что фермент, проявляя свойственную ему специфичность по отношению к реакции, способен действовать не на один, а на несколько, иногда на большое число субстратов со сходным химическим строением. Например (смотри приложение № 1), три разных фермента, действующие на аминокислоты. все они обладают групповой специфичностью, так как действуют не на какую-нибудь одну аминокислоту, а на многие, иногда на все аминокислоты.
· Относительно групповая специфичность проявляется тогда, когда фермент безразличен к структуре соединения и имеет значение лишь тип связи. Примером служит химотрипсин, расщепляющий только пептидную связь.
Стереохимическая и оптическая специфичностьимеет особое значение. Проявляется только в случае оптически активных веществ, и фермент активен только по отношению к одной стереоизомерной форме соединения. Например, L- аргиназа разлагает L-аргинин на L- орнитини мочевину, но не действует на А- аргинин. Известным примером служит d и L- специфичность оксидаз аминокислот. Стереохимическая и оптическая активность так- же может быть абсолютной и относительной; например, карбоксипептидаза, расщепляющая карбобензокси -глицил-L- фенилаланин совсем не действует на субстрат с А- фенилаланином: с другой стороны, эстеразасвиной печени разлагает метиловый эфир L- миндальной кислоты лишь вдвое быстрее, чем его А- изомер.
СОСТАВ.
После того как стало возможным исследование ферментов в бес клеточной среде, была окончательно установлена их химическая природа. Было выявлено, что все они представляют собой вещества белковой природы и как все белки, могут быть простыми и сложными в зависимости от сопутствующего компонента небелкового характера (простетической группы).
Ферменты- простые белки- построены только из аминокислот, и их каталитические свойства обусловлены свойством самой белковой молекулы. К этой группе ферментов относится большинство гидролитических ферментов. Ферменты- сложные белки- содержат в своём составе, помимо белкового компонента, ещё и небелковый- например, нуклеотиды, геминовую группу, витамины, атомы ( катионы ) металла. К таким ферментам обычно относятся ферменты окислительно-восстановительного действия. Прочность связи между белковым компонентом и простетической группой в сложных ферментах может быть различной. В некоторых случаях связь прочная, в других - простетическая группа довольно легко отделяется, например при диализе. Легко диссоциирующие простетические группы ферментов получили название коферментов. При отделении простетической группы от белковой части фермента - последний теряет свою активность. В простых ферментах активный центр образуется непосредственно группировкой аминокислотных остатков в спиральной цепи белковой молекулы. В сложных ферментах он образуется простетической группой и некоторыми прилегающими к ней остатками. Размер активных центров значительно меньше самой молекулы фермента. На один активный центр приходится масса молекулы с молекулярным весом 30000. В простых ферментах пространственная группировка этих аминокислотных остатков сама по себе определяет структуру активного центра и каталитическую активность фермента. В сложных ферментах структура активного центра определяется простетической группой и боковыми группами некоторых аминокислотных остатков, пространственная структура которых оказывает существенное влияние на специфичность и каталитическую активность небелкового компонента. Среди таких аминокислотных остатков наибольшее значение имеют SH- группы цистеина, OH- группы серина, несколько меньшее значение имеет индольная группа триптофана, карбонильные группы дикарбоновых аминокислот. Компоненты активного центра нельзя представлять последовательно расположенными на, каком - либо участке цепи. По- видимому , активный центр формируется из компонентов, удалённых в первичной структуре полипептидной цепи, но пространственно сближенных благодаря специфической укладке полипептидной цепи.
КЛАССИФИКАЦИЯ.
Сейчас известно около 2 тысяч ферментов, но список этот не закончен. В зависимости от типа катализируемой реакции все ферменты подразделяются на 6 классов:
· Ферменты, катализирующие окислительно-восстановительные реакции оксидоредуктазы;
· Ферменты переноса различных группировок ( метильных, амино- и фосфогрупп и другие)- трансферазы.
· Ферменты, осущевствляющие гидролиз химических связей - гидролазы
· Ферменты не гидролитического отщепления от субстрата различных группировок (Nh4, CO2,h3O и другие)- лиазы.
· Ферменты, ускоряющие синтез связей в биологических молекулах при участии доноторов энергии, например АТФ,- лигазы.
· Ферменты, катализирующие превращение изомеров друг в друга,- изомеразы.
ОКСИДОРЕДУКТАЗЫ– ферменты, катализирующие окислительно-восстановительные процессы в организме. Они осущевствляют перенос водорода и электронов и по своим привиальным названием известны как дегидрогеназы, оксидазы и пероксидазы. Эти ферменты отличаются тем, что имеют специфические коферменты и простетические группы. Их подразделяют на функциональные группы доноров, от которых они принимают водород или электроны, и акцепторов, на которые они их передают (на СН-ОН группу, СН- NH группу, C-NH группу и другие).
ТРАНСФЕРАЗЫ– ферменты, переносящие атомные группы ( в зависимости от того, перенос какой группы они осуществляют, их соответственно называют). Среди них известны ферменты осуществляющие транспорт больших остатков, например гликозилтрансферазы и другие. Трансферазы благодаря разнообразию переносимых ими остатков принимают участие в промежуточном обмене веществ.
ГИДРОЛАЗЫ– ферменты, катализирующие гидролитическое расщепление различных субстратов (при участии молекул воды). В зависимости от этого среди них различают эстеразы, расщипляющие сложноэфирную связь между карбоновыми кислотами (липаза) тиоловых эфиров, фосфоэфирную связь и так далее; гликозидазы, расщепляющие гликозидные связи, пептид - гидролазы, действует на пептидную связь и другие.
ЛИАЗЫ. К этой группе относятся ферменты, способные отщеплять различные группы от субстрата не гидролитическим путём с образованием двойных связей или, напротив, присоединять группы к двойной связи. При расщеплении образуется Н2О или СО2 или большие остатки- например ацетил- СоА. Лиазы играют весьма важную роль в процессе обмена веществ.
ИЗОМЕРАЗЫ– ферменты, катализирующие превращение изомерных форм друг в друга, то - есть осуществляющие внутримолекулярное превращение различных групп. К ним относятся не только ферменты, стимулирующие реакции взаимных переходов оптических и геометрических изомеров, но и такие, которые могут способствовать превращению альдоз в кетозы или перемещению эфирной связи и другие.
ЛИГАЗЫ. Раньше эти ферменты не отделяли от лиаз, так как реакция последних часто идёт в двух направлениях, однако недавно было выяснено, что синтез и распад в большинстве случаев происходит под влиянием различных ферментов, и на этом основании выделен отдельный класс лигаз (синтетаз). Ферменты, обладающие двойным действием, получили название бифункциональных. Лигазы принимают участие в реакции соединения двух молекул, то есть синтетических процессах, сопровождающихся расщеплением макроэнергитических связей АТФ или других макроэргов.
«Первое подразделение ферментов на самые крупные группы (6 классов) основано не на названии субстрата, а на природе химической реакции, которую фермент катализирует. Далее, внутри классов ферменты делят на подклассы, руководствуясь строением субстрата. В подклассы объединяют ферменты данного класса, действующие на сходно построенные субстраты. На этом деление не заканчивается. Ферменты каждого подкласса разбивают на подклассы, в которых ещё строже уточняют структуру химических групп, отличающих субстраты друг от друга. Подкласс это последняя низшая ступень классификации. Внутри подклассов перечисляют уже отдельные, индивидуальные ферменты. Таким образом, вся система проста и достаточно стройна:
КЛАСС- ПОДКЛАСС- ПОДПОДКЛАСС- ИНДИВИДУАЛЬНЫЙ ФЕРМЕНТ.
В соответствии с этим принципом классификации предложена очень удобная система нумерации (индексации) ферментов. Каждый индекс состоит из четырёх цифр, разделённых точками:
1. Номер класса.
2. Номер подкласса в данном классе
3. Номер подподкласса
4. Номер, присвоенный данному индивидуальному ферменту этого подподкласса» (В. И. Розенгарт Ферменты- двигатели жизни)
Например, амилаза-фермент, гидролизующий крахмал с которой мы уже встречались неоднократно, имеет индекс 3.2.1.1. Классификация ферментов построена так, что в ней оставлены свободные места для ещё не открытых ферментов.
НОМЕНКЛАТУРА.
Ферментология очень долго не располагала, строг научной номенклатурой ферментов. Наименования ферментам давали по случайным признакам (тривиальная номенклатура), по названию субстрата (рациональная), по химическому составу фермента, наконец, по типу катализируемой реакции и характеру субстрата. Примерами тривиальной номенклатуры могут служить названия таких ферментов, как пепсин (от греч.пепсин- пищеварение), трипсин (от греч.трипсис- разжижаю) и папаин (от названия дынного дереваCarica papaja, из сока которого он выделен). По действию все эти ферменты являются протеолитическими, т. е. ускоряют гидролиз протеинов (белков). Характерное название была дано группе окрашенных внутриклеточных ферментов, ускоряющих окислительно-восстановительные реакции в клетке, - цитохромы (от лат.citos- клетка иchroma- цвет).
Наибольшее распространение получиларациональная номенклатура, согласно которой название фермента составляется из названия субстрата характерного окончания-аза. Она была предложена более столетия тому назад, в 1883 г. Э. Дюкло - учеником Л. Пастера. Так, фермент, ускоряющий реакцию гидролиза крахмала, получил название амилаза (от греч.амилон- крахмал), гидролиза жиров - липаза (от греч.липос- жир), белков (протеинов) - протеаза, мочевины - уреаза (от греч.уреа- мочевина) и т. п. Когда методами аналитической химии были достигнуты известные успехи в расшифровке химической природы простетических групп, возникла новая номенклатура ферментов. Их стали именоватьпо названию простетической группы, например, геминфермент (простетическая группа - гем), пиридоксаль- фермент (простетическая группа - пиридоксаль) и т.п. Затем в названии фермента стали указывать как нахарактер субстрата, так и натип катализируемой реакции. К примеру, фермент, отнимающий водород от молекулы янтарной кислоты, называют сукцинатдегидрогеназой, подчеркивая этим одновременно и химическую природу субстрата, и отнятие атомов водорода в процессе ферментативного действия:
- 2Н
НООС -Сh3 - СН2 – CООН НООС - СН = СН – СООН
Янтарная кислота Дегидрирование Малеиновая кислота
В 1961 г. Международная комиссия по номенклатуре ферментов представила V Международному биологическому конгрессу проект номенклатуры, построенный на строго научных принципах. Проект был утвержден конгрессом, и новая номенклатура прочно вошла в ферментологию. Согласно этой (Московской) номенклатуре название ферментов составляют из химического названия субстрата и названия той реакции, которая осуществляется ферментом. Если химическая реакция, ускоряемая ферментом, сопровождается переносом группировки атомов от субстрата к акцептору, название фермента включает такжехимическое наименование акцептора. Например, пиридоксальфермент, катализирующий реакцию переаминирования между L-аланином и -кетоглутаровой кислотой, называется L-аланин: 2-оксоглутарат аминотрансфераза. В этом названии отмечены сразу три особенности: 1) субстратом является L-аланин; 2) акцептором служит 2-окcоглутаровая кислота; З) от субстрата к акцептору передается аминогруппа.Названия ферментов по научной номенклатуре неизмеримо выигрывают в точности, но становятся в ряде случаев гораздо сложнее старых, тривиальных. Так, уреаза (тривиальное название), ускоряющая реакцию гидролиза - мочевины на оксид углерода (IV) и аммиак, по научной номенклатуре именуется карбамид - амидогидролазой:
Н2N - СО - NН2 + Н2О 2NН3 + СО2
В этом названии дано точное химическое наименование субстрата и указано, что фермент катализирует реакцию гидролиза аминогруппы. Трегалаза, ускоряющая реакцию гидролиза трегалозы, называется трегалоза-1-глюко-гидролазой.. В связи со значительным усложнением научных названий в новой номенклатуре допускается сохранение наряду с новыми старых тривиальных, рабочих названий ферментов. Международной комиссией был составлен детальный список всех известных в то время ферментов, существенно дополненный в 1972 г. при пересмотре, как классификации, так и номенклатуры некоторых ферментов, где рядом с новым научным названием каждого фермента приведено старое, а также указан химизм катализируемой ферментом реакции и в некоторых случаях природа фермента. Таким образом, исключается возможность путаницы в наименовании ферментов. В 1964 г. список включал 874 фермента; в последующее время он был существенно дополнен и возрос до 1770 ферментов в 1972 г. и до 2003 ферментов в 1979 г.
АКТИВНОСТЬ ФЕРМЕНТОВ.
Для исследования или практического работника, занимающегося ферментами, определение активности ферментов - это постоянная, повседневная работа, потому что любое изучение свойств ферментов, любое применение их в практической деятельности- в медицине и в народном хозяйстве- всегда связано с необходимостью знать, с какой скоростью протекает ферментативная реакция. Что бы понять и правильно оценить результаты определения ферментативной активности, нужно совершенно отчётливо представить себе, от каких факторов зависит скорость реакции, какие условия оказывают на неё влияние. Таких условий много. Прежде всего это соотношение концентрации самих реагирующих веществ: фермента и субстрата. Далее, это всевозможные особенности той среды, в которой протекает реакция: температура, кислотность, наличие солей или других примесей, способных как ускорять, так и замедлять ферментативный процесс, и так далее. Попытаемся рассмотреть поближе эти условия.
ВЛИЯНИЕ РЕАКЦИЙ СРЕДЫ.
Для большинства известных в настоящее время ферментов определён оптимум РН, при котором они обладают максимальной активностью. Эта величина- важный критерий, служащий для характеристик фермента. Иногда это свойство ферментов используют для их препаративного разделения. Наличие оптимума РН можно объяснить тем. Что ферменты представляют собой полиэлектролиты и их заряд зависит от значения РН (Смотри приложение 2). Иногда сопутствующие вещества могут изменить оптимум РН, например буферные растворы. В некоторых случаях в зависимости от субстратов ферменты с неярко выраженной специфичностью имеют несколько оптимумов. Например, пепсин расщепляет белки яйца при РН 1,5- 2,0, синтетические субстраты- при РН 4,0. Отсюда следует, что величина (РН оптимум)- весьма чувствительный признак для данного фермента. Она зависит от природы субстрата, состава буферного раствора и поэтому не является истинной константой. Нужно иметь в виду также свойства ферментов как белковых тел, способных к кислотно-щелочной денатурации. Поэтому при определении оптимума РН, в котором сохраняется физико-химическая стабильность фермента. Кислотно-щелочная денатурация может привести к необратимым изменениям структуры фермента с утратой его каталитических свойств.
ВЛИЯНИЕ ДРУГИХ ХИМИЧЕСКИХ ФАКТОРОВ.
Присутствие в реакционной среде некоторых ионов может активировать образование активного субстрат ферментного комплекса, и в этом случае скорость ферментативной реакции будет увеличивается. Такие вещества получили названиеактиваторов. При этом вещества, катализирующие ферментативные реакции, непосредственного участия в них не принимают. На активность одних ферментов существенно влияет концентрация солей в системе, другие ферменты не чувствительны к присутствию ионов. Однако некоторые ионы абсолютно необходимы для нормального функционирования некоторых ферментов. Известны ионы, которые тормозят активность одних ферментов и являются активаторами для других. К числу специфических активаторов относятся катионы металлов: Na+, K+,Rb+,Cs+,Mg2+, Ca2+,Zn2+,Cd2+,Cr2+,Cu2+,
Mn2+,Co2+,Ni2+,Al3+. Известно также, что катионы
Fe2+,Rb+,Cs+ только в присутствии Mg действуют как активаторы, в других случаях эти катионы не являются активаторами. В большинстве случаев один или два иона могут активировать тот или иной фермент. « Например, Mg2+- обычный активатор для многих ферментов, действующий на фосфоримированные субстраты, почти во всех случаях может быть заменён Mn2+, хотя другие металлы его заменить не могут. Следует заметить, что щелочноземельные металлы вообще конкурируют друг с другом, в частности, Са2+ подавляет активность многих ферментов, активируемых Mg2+ и Zn2+. Причина этого до настоящего времени не ясна» (Г. А. Смирнова Основы биологии).Механизм влияния ионовметаллов- активаторов может быть различным. Прежде всего, металл может быть компонентом активного центра фермента. Но может действовать как связующий мостик между ферментом и субстратом удерживая субстрат у активного центра фермента. Имеются данные о том, что ионы металлов способны связывать органическое соединение с белками и, наконец, один из возможных механизмов действия металлов как активаторов- это изменение константы равновесия ферментативной реакции. Доказано, что анионы также влияют на активность ряда ферментов. Например, очень велико влияние СI- на активность А - амилазы животного происхождения. Наряду с
существованием активаторов ферментов известен ряд веществ, присутствие которых тормозит каталитическое действие ферментов или полностью инактивирует его. Такие вещества принято называть ингибиторами.Ингибиторы– это вещества, действующие определённым химическим путём на ферменты и по характеру своего действия, могут быть подразделены на обратимые и необратимые ингибиторы. ДляобратимоготорможенияХарактерно равновесие между ферментом и ингибитором с определённой константой равновесия. Система такого типа характеризуется определённой степенью торможения, зависящей от концентрации ингибитора, при этом торможение достигается быстро и после этого не зависит от времени. При удалении ингибитора с помощью диализа активность фермента восстанавливается.Необратимоеторможение,прежде всего, выражается в том, что диализ не способствует восстановлению активности фермента. И в отличии от обратимого торможения усиливается со временем, так что может наступить полное торможение каталитической активности фермента при очень низкой концентрации ингибитора. В этом случае эффективность действия ингибитора зависит не от константы равновесия, а от константы скорости, определяющей долю фермента, подвергшегося торможению в данном случае.
ВЛИЯНИЕ ТЕМПЕРАТУРЫ.Температура – один из важнейших факторов внешней среды, который независимо от состояния равновесия реакции меняет её скорость. Поэтому при ферментативных реакциях при повышении температуры на 10 С процесс ускоряется в 1,5 – 2 раза. При дальнейшем повышении температуры присоединяются денатурационные процессы, характерные для всех белков и в то м числе для ферментов, поэтому наблюдается затухание скорости реакции (Смотри приложение 3).Температурным оптимумомреакции называют температуру, при которой одно её действие вызывает ускорение реакции, катализируемой данным ферментом. Для большинства ферментов животного происхождения он равен 40 – 50 С, для растительного происхождения он равен 50 – 60 С. Почти все ферменты разрушаются при температуре 80 С. Но для некоторых ферментов в настоящее время доказана возможность восстановления их каталитической активности в случае обратимого процесса денатурации белка. Известны и такие ферменты, максимальная активность которых проявляется при более низких температурах. «Например, каталаза, температурный оптимум которой лежит в пределах между 0-10С» (Г. А. Смирнова Основы биохимии). Понижение температуры снижает скорость ферментативных реакций. Большинство ферментов при 0 С ещё не утрачивают своих каталитических свойств, но при замораживании химические реакции прекращаются. При последующем оттаивании, если соблюдается определённые условия, ферментативная активность клеток может быть восстановлена.
ВЛИЯНИЕ ДАВЛЕНИЯ.При изучении действия давления на скорость ферментативных реакций необходимо, прежде всего, учитывать, как и при изучении других факторов, возможность денатурации ферментов при высоком давлении. Если константа скорости ферментативной реакции растёт с повышением давления, то образование активного комплекса происходит с уменьшением объёма и наоборот, если при увеличении давления образование активного комплекса сопровождается увеличением объёма, то константа скорости реакции снижается.
ВЛИЯНИЕ КОНЦЕНТРАЦИИ ФЕРМЕНТА И ЕГО СУБСТРАТА.
Скорость любого ферментативного процесса в значительной степени зависит от концентрации, как субстрата, так и фермента. Обычно скорость реакции прямо пропорциональна количеству фермента, при условии если содержание субстрата в в пределах оптимума или немного выше. При постоянном количестве фермента скорость возрастает с увеличением концентрации субстрата. Эта реакция подчинена закону действующих масс и рассматривается в свете теории Михаэлиса – Ментона, то есть
V=K(F)V-скорость реакции
K-константа скорости
(Смотри приложение 4).
На графике показано соотношение скорости реакции и концентрации субстрата. В восходящей части гиперболы при низких концентрациях субстрата скорость реакции пропорциональна концентрации субстрата. В верхней части, когда концентрация субстрата высока, скорость реакции приближается к максимальному значению и почти не зависит от концентрации. Первое объяснение этой кривой было дано Генри (1901 год). Он высказал предположение, что а основе этой реакции лежит образование субстрат - ферментного комплекса. В дальнейшем эта теория была экспериментально обоснована Михаэлисом – Ментеном и не утратила своего значения до настоящего времени.
МЕХАНИЗМ ДЕЙСТВИЯ.
Предполагалось, что ферменты адсорбируют на своей поверхности реагирующие молекулы, в результате чего на участках сорбции концентрация молекул субстрата увеличивается, и это повышает вероятность протекания реакции между ними. Постепенно сложилось мнение, что фермент не сорбирует субстрат на своей поверхности, а вступает с ним во взаимодействие, причём это взаимодействие на первом этапе состоит в образовании непрочного соединения- комплекса между ферментом и субстратом. С каждой молекулой фермента ( а точнее, с каждым его каталитическим центром) реагирует одна молекула субстрата, причём реакция носит необратимый характер. Если фермент обозначить буквойЕ, а субстрат буквойS, то реакцию можно написать в виде уравнения:
Совершенно очевидно, что ферментативный процесс в целом не может закончиться образованием фермент- субстратного комплекса. Этот комплекс представляет собой лишь промежуточное соединение, которое подвергается дальнейшим преобразованиям. В простейшем случае- это химическое превращение комплекса, в результате которого субстрат (S) распадается на продукты ( обозначим их буквойР), а фермент выходит из реакции в неизменном виде. В целом уравнение будет выглядеть так::
Именно таким образом представляли себе протекание ферментативной реакции немецкие учёные Л. Михаэлис и его сотрудница М. Ментен, которые ещё в 1913 году развили общую теорию ферментативного действия, основанную на идее образования промежуточного фермент- субстратного комплекса как первой стадии реакций. Чаще всего распаду комплекса предшествует его химическое преобразование( активирование), которое составляет ещё одну промежуточную стадию и снова усложняет уравнение реакции:
E+S ES ES* E+P
Здесь активный комплекс обозначенES*(Смотри приложение 5)
Скорости протекания отдельных стадий ферментативного процесса неодинаковы. Одни идут быстрее, другие медленнее. Скорость всей реакции будет определяться скоростью самой медленной реакции. В ферментативном процессе скорости разных стадий тоже неодинаковы. Первый этап этого процесса - образование фермент- субстратного комплексаESпредставляет собой, как мы уже говорили, обратимую реакцию и в обычных условиях протекает чрезвычайно быстро, по- видимому, значительно быстрее, чем последующие стадии. Поэтому общая суммарная скорость всего процесса определяется не этой реакцией. Но эта стадия наиболее ответственна, так как сама важность каталитического действия фермента зависит от того, образуется фермент- субстратный комплекс или нет. Все последующие этапы - это только преобразование возникшего комплекса. Как же представить себе образование такого комплекса? Какие условия должны быть соблюдены для того, чтобы он возник? Если снова обратиться к схеме (Смотри приложение 5) и присмотреться к причудливой форме молекулы фермента и субстрата, то заметили, что участок молекулы фермента, на который «садится» субстрат,. Своими очертаниями как бы повторяют форму субстрата. Это символизирует строгое пространственное и химическое соответствие, существующее между активным центром фермента и субстратом. Такое соответствие совершенно необходимо для того, чтобы комплекс мог образоваться. Ещё в конце прошлого века известный немецкий химик Эмиль Фишер высказал предположение, что фермент должен подходить к субстрату как ключ к замку. Это выражение стало крылатым и дожило до наших дней. Однако образ «ключ-замок» перестал удовлетворять учёных. Этот образ предполагает жёсткость, неизменность структуры, железную прочность фермента и субстрата. Такие свойства не типичны для гибких, подвижных молекул биологических веществ. Поэтому, главным образом благодаря работам американского биохимика Д. Кашленда, возникла другая теория, дополняющая и расширяющая представления Фишера. Согласно этой гипотезе, полное соответствие между молекулой субстрата и каталитическим центром фермента возникает лишь тогда, когда они встречаются с друг другом. Субстрат вызывает в молекуле фермента такое изменение расположения химических групп в пространстве, что ранее отсутствовавшее соответствие появляется и вместе с этим появляется возможность образовать фермент- субстратный комплекс. Его возникновение связано с гибкостью белковой молекулы, с подвижностью её структуры, но оно возможно, разумеется, только в том случае когда молекула субстрата имеет пригодные для этого свойства и форму. В приложении 5 изображена схема, поясняющая возникновение наведённого соответствия между ферментом и субстратом.
Только после контакта фермента с субстратом химические группировки активного центра (А, В, С) в результате изменения их пространственного расположения приходят в состояние строгого соответствия молекуле субстрата.
Нужно иметь также в виду, что молекула субстрата, хотя она, как правило, и значительно меньше молекулы фермента, тоже обладает некоторой подвижностью и при взаимодействии с ферментом эта подвижность может способствовать более полному соответствию.
Особенность ферментов состоит в том, что об их наличии мы можем судить только по их действию. Мы умеем измерять скорость ферментативных реакций, то есть количество субстрата, подвергшегося превращению в единицу времени, например в одну минуту или в один час. Разным ферментам свойственна далеко не одинаковая молекулярная активность. Некоторое представление о реальных величинах этой активности даёт таблица (Смотри приложение 7). Из таблицы видно, насколько различна молекулярная активность различных ферментов и каких огромных величин она может достигать в отдельных случаях. «Карбоангидраза, занимающая первое место в таблице и обладающая чудовищной молекулярной активностью (36 миллионов), является самым активным из всех известных ферментов. «(В. И. Розенгарт Ферменты – двигатели
жизни).
ЗНАЧЕНИЕ.
Постоянный обмен нуклеиновыми кислотами, составляет основную часть генетического материала клетки. В ходе обмена нуклеиновых кислот наряду с синтезом происходит и распад. Этот процесс катализирует большая группа ферментов, объединенных названиемнуклеаз. Цепочка нуклеиновых кислот образованна фосфорной кислотой и углеводородом; азотистые основания служат боковыми группами. Поэтому разрушение нуклеиновых кислот – это разрыв связей между остатками фосфорной кислоты и углевода. Все нуклеазы могут быть разделены на две группы:экзонуклеазыиэндонуклеазы. Экзонуклеазы действуют с одного из концов полинуклеотидной цепи и на каждом этапе отсекает по одному нуклеотиду, постепенно укорачивая цепочку. В отличие от этого эндонуклеазы сразу во многих местах разрывают связи внутри молекулы нуклеиновых кислот и поэтому приводят к быстрой деградации молекулы. Весь комплекс ферментов обмена нуклеиновых кислот выполняет важную биологическую задачу: сохранение в целостности генетического материала клетки и репарации (исправления) тех повреждений структуры ДНК, которые могут возникнуть а результате радиоактивного или ультрафиолетового облучения и других вредных воздействий.
Известно, что все проявления жизнедеятельности связаны с затратой энергии. Эта энергия освобождается при химических превращениях в клетке тех веществ, которые в виде пищи поступают в наш организм.Задача пищеварениясводится к тому, чтобы превратить главные пищевые вещества: белки, углеводы и жиры, - в такие продукты, которые непосредственно смогут быть использованы во внутриклеточном обмене. Свой путь в организме пища начинает, попадая в рот, и уже на этом этапе она сталкивается с ферментами. В слюне содержится ферментамилазы, катализирующий разложения крахмала и превращение его в сахар. Разжёванная и смоченная слюной пища проглатывается и через пищевод попадает в желудок. Слизистая оболочка желудка вырабатывает желудочный сок. В желудочном соке есть соляная кислота , придающая желудочному содержимому кислую среду. Так же в желудочном соке имеется протеолитический (расщепляющий белки) фермент –пепсин. Он как раз лучше всего действует в кислой среде. Пепсин не расщепляет белки до конца, он только ''раскладывает'' крупную белковую молекулу на части, доступные для действия пищеварительных ферментов кишечника. Из желудка пищевая кашица поступает в двенадцатиперстную кишку, где на неё изливаются соки дву самых крупных желёз человеческого организма: печени и поджелудочной железы. Сок поджелудочной железы содержит большой набор ферментов, действующих на все важнейшие пищевые вещества. Ферменты:трипсинихимотрипсин(расщепляющие белки) расщепляют пептидные цепи в разных местах. Комбинированная атака протеолитических ферментов желудочного и поджелудочного соков приводят к распаду белков на мелкие пептиды, содержащие небольшое количество аминокислотных остатков. В поджелудочном соке содержится чрезвычайно активнаяамилаза, она практически полностью завершает расщепление крахмала, начатое слюной. В результате крахмал превращается в солодовый сахар – мальтозу – дисахарид, состоящий из двух остатков глюкозы. Третий главный компонент пищи – жиры тоже расщепляются под влиянием поджелудочного сока. Для этой цели там содержится специальный фермент –липаза. Простейшая и наиболее распространённая форма жиров – триглицериды. Под действием липазы молекула триглицерида присоединяет три молекулы воды и распадается на составляющие его глицерин и жирные кислоты. Но заключительную работу в области пищеварения совершает кишечный сок, вырабатываемый клетками слизистых оболочек тонких кишок. Он содержит много ферментов, заканчивающих процесс окончательного разложения пищевых веществ. Осколки белковых молекул распадаются на отдельные аминокислоты; мальтоза, образовавшаяся из крахмала, и другие сложные углеводы превращаются в простые углеводы – моносахариды – вроде глюкозы. На этом заканчивается процесс пищеварения.
Одна из защитных реакций – свёртывание крови, происходит сучастием ферментов. Как же происходит свертывание крови? Кровь, как известно состоит из жидкой части –плазмыи так называемых ферменных элементов, которые в ней плавают. Это кровяные клетки:эритроциты(красные кровяные тельца) итромбоциты(кровяные пластинки).Плазмапредставляет собой сложный раствор многих веществ, в том числе самых разнообразных белков. Из белков плазмы для нас сейчас особый интерес представляет один –фибриноген. Пока кровь течёт по кровеносным сосудам, с фибриногеном ничего не происходит. Но стоит поранить сосуд настолько, чтобы кровь вытекала из него, как фибриноген очень быстро превращается в другой белок –фибрин. Фибрин, в отличии от фибриногена, не растворяется в плазме. В виде тонких нитей, переплетённых в густую сетку, он выпадает в осадок. В этой сетке застревают кровяные клетки и образуется плотный сгусток –тромб, препятствующий дальнейшему кровотечению. Превращение фибриногена в фибрин – процесс ферментативный, катализируемый ферментомтромбином. Тромбин – протеолитический фермент, подобный трипсину и химотрипсину. Но это фермент очень специфичный. Он действует только на фибриноген, отщепляя от его молекулы два сравнительно небольших полипептида. Оставшаяся часть молекулы фибриногена перестраивается и превращается в нерастворимый фибрин.
(тромбин)
Фибриноген 2 Полипептида + фибрин
Также ферменты играют важную роль во всех проявлениях жизни. Успехи учения о ферментах внесли весомый вклад в развитие всех направлений человеческой практики.
Ферменты нашли широкое применение в медицине. Это, прежде всего, изучение таких болезней причина, которых лежит в недостаточности тех или иных ферментов. Далее это использование определения активности ферментов в биологических жидкостях и тканях для диагностики различных заболеваний. И, наконец, это применение ферментов в качестве лекарственных средств. Генетически обусловленные нарушения. Время от времени в бесконечно длинных цепях ДНК, где записаны все инструкции по синтезу белков, вдруг появляются случайные замены: вместо одного нуклеотида становится другой. Такие замены называются мутациями. Чаще всего конкретные причины мутации неизвестны. А последствия их нередко бывают роковыми. Приведем такой пример. Люди отличаются друг от друга цветом кожи, волос и глаз. Причина этого – разные пигменты, меланины, синтезируемые из некоторых аминокислот под влиянием определённых ферментов. Если образование этих пигментов не происходит из - за отсутствия одного из участвующих в реакции ферментов, возникает альбинизм – отсутствие окраски. Люди альбиносы имеют очень белые волосы и светлые глаза. Альбиносы по здоровью не уступают людям с нормальной окраской. Гораздо более тяжёлым заболеванием, нередко приводящим к гибели новорождённых, является непереносимость простых углеводов – моносахаридов (галактозы и фруктозы ). Здесь речь идёт о невозможности нормального обмена веществ в клетках из- за отсутствия необходимых ферментов. Достаточно подробно изучены врождённые болезни, связанные с недостатком ферментов, катализирующих разложениегликогена. В результате нарушения этого процесса гликоген начинает накапливаться в тканях в избыточном количестве и препятствует нормальному течению обмена веществ. Такие болезни получили названиегликогенозов. Болезни, связанные с отсутствием витаминов, называютавитаминозом. Но по существу они являютсяферментозами. Давно известна и когда – то была широко распространена болезнь ''бери – бери ''(сейчас её называют полиневритом – множественное воспаление нервов, в некоторых слаборазвитых странах она и теперь встречается нередко). Причина её отсутствие в пище витаминаВ1. Этот витамин – тиамин – в соединении с фосфорной кислотой представляет собой небелковую часть ферментадекарбоксилазы. Декарбоксилаза разрушает карбоксильную группу (- СООН) некоторых органических кислот, отщепляя от неё углекислоту (СО2). В отсутствии витамина В1 декарбоксилаза образоваться не может, реакция прекращается и в нервной ткани наступают нарушения, типичные для полиневрита: параличи конечностей, боли в мышцах, слабость, контрактуры. Тяжёлое заболевание – пеллагра – связано с отсутствием в пище витамина РР – никотиновой кислоты. Упомянем ещё об одном витамине. Он называется витаминомВ2, а по химической природе представляет собой довольно сложную циклическую структуру –рибофлавин. Авитаминоз В2 связан с тяжёлым поражением кожи лица и глаз. Причина недостаток фермента.
Ферменты также используются в диагностике.Определение активности ферментов в биологических жидкостях и тканях стало неотъемлемым средством лабораторной диагностики различных заболеваний. Для диагностических целей ферментативную активность определяют почти исключительно в крови, значительно реже в моче и лишь в отдельных случаях в тканях. Не все ткани в одинаковой мере синтезируют разные ферменты. Для печени, например, типична высокая активность одних ферментов, для почек или скелетных мышц – других. Это явление называют органоспецифичностью ферментов. Иногда органоспецифичность выражена очень чётко: фермент содержится только в каком – нибудь одном органе и отсутствует, а других. Таким образом, врач получает возможность по повышению активности некоторых ферментов в плазме выявить заболевание, связанные с нарушением функций совершенно определенных органов. В последнее время предпринимаются всё болееуспешные попытки использовать ферменты и для лечения некоторых болезней.Уже давно некоторые ферменты применяют для так называемой заместительной терапии – для возмещения дефицита ферментов, возникающего при некоторых заболеваниях. Особенно успешна такая терапия при нарушениях функций желудочно-кишечного тракта, связанных с недостаточной выработкой пищеварительных ферментов. С успехом применяют ферменты в тех случаях, когда лечение требует разрушить накопившиеся в большом количестве белковые образования, мешающие нормальному функционированию тканей. Это бывает при ожогах, гнойных ранах, гнойно-воспалительных заболеваниях лёгких, когда в бронхах скапливается густая масса, препятствующая прохождению воздуха. Наметился очень перспективный путь применения ферментов для рассасывания сгустков крови, образовавшихся внутри кровеносных сосудов. Такие сгустки называются тромбами, они закупоривают сосуд и нарушают кровообращение. Велико значение ферментов в пищевой промышленности и сельском хозяйстве.Сыроварение, виноделие, производство кисломолочных продуктов, пивоварение, производство колбасных продуктов, хлебопечение, производство животных жиров, чая, уксуса, лимонной кислоты – всё это и многое другое , здесь не перечисленное – технологические процессы пищевой промышленности, в которых главным действующим лицом являются ферменты. Одна из важнейших проблем пищевой промышленности – это развитие комплексной переработки сырья и отходов пищевой промышленности и повышение эффективности этой переработки. Ферментные препараты могут сказать здесь решающее слово. Серьёзной проблемой в консервной промышленности, переработки плодов и овощей является использование семян и косточек, главная трудность которого состоит в необходимости разрушать прочную оболочку косточек. И здесь реальную пользу могут принести препараты ферментов. С помощью ферментных препаратов удаётся уменьшить расход сырья растительного и животного происхождения, идущего на приготовления пищевых продуктов. Использование ферментов в сельском хозяйстве необычайно широко и разнообразно. В растениеводстве селекция многих сельскохозяйственных культур направлена на создание сортов, обогащённых определёнными ферментами. Это имеет значение и для скорости созревания культур, и для получения более высококачественной продукции, и для повышения устойчивости растений к изменению погодных условий, к болезням, к действию вредных насекомых. Специальный интерес представляет использования ферментов в кормопроизводстве. Агрономы заботятся о том, чтобы получить полноценный растительный корм, содержащий все существенные составные части, необходимые для обеспеченья потребностей животного организма. Вот здесь роль ферментов оказалась особенно значительной, как в пищевой промышленности. Ферментативные препараты для производства кормов получают из плесневых грибов и бактерий, но задачи здесь ставят иные. Для повышения усвояемости грубых кормов необходим фермент целлюлоза, гидролизирующий клетчатку и повышающий возможность её переваривания и усвоения, особенно у таких животных, как свиньи, которые переваривают клетчатку хуже, чем крупный рогатый скот.
Мы познакомились с некоторыми аспектами практического использования ферментов в медицине, пищевой промышленности и сельском хозяйстве.
ЗАКЛЮЧЕНИЕ.
В результате проделанной работы я узнал, что ферменты это белки, катализирующие определённые химические реакции, входящие в процессы обмена веществ, отличаются чрезвычайно высокой эффективностью и специфичностью своего действия. По своему составу ферменты разделяют на простые ферменты, состоящие только из молекул белка, и сложные ферменты, состоящие из белка и небелкового компонента (простетические группы, коферменты). Каталитическое действие ферментов определяется главным образом, частью молекулы - активным центром. Действие всех ферментов происходит через стадию образования промежуточного соединения с молекулой субстрата. Ферменты играют важную роль в организме, в науке, в хозяйственной деятельности человека. Открытие разнообразных наук позволяет шире использовать ферменты.
Литература:
''Энциклопедический словарь юного биолога''
(М. С. Гиляров)
''Биофизическая химия'' (А. Г. Пасынский)
''Ферменты-двигатели жизни'' (В. И. Розенгарт)
''Основы биохимии'' (Г. А. Смирнова)
superbotanik.net
|
|
..:::Счетчики:::.. |
|
|
|
|
|
|
|
|