
Реферат
на тему: «Классификация дисперсных систем по агрегатному состоянию. Особенности каждой системы»
Выполнил: студент гр. Э – 2
Федотов А.Ю.
Проверила: Бубнова О.А.
Пенза 2008
Содержание
1. Понятие о дисперсных системах
2. Классификация дисперсных систем
2.1 Грубодисперсные системы
2.2 Коллоидные системы
2.2.1 Золи
2.2.2 Гели
2.2.3 Мицеллы
Список используемой литературы
1. Понятие о дисперсных системах
Далеко не все вещества растворимы друг в друге, т. е. образуют истинные растворы. Конечно, можно искусственно измельчить одно вещество и распределить его в объеме другого, но в любом случае такая система будет гетерогенной. Например, можно разбить жидкость на мельчайшие капельки и распылить их в газовую среду (допустим, с помощью аэрозольного баллончика). Раствором полученную систему назвать нельзя, даже мельчайшая капелька жидкости будет отделена от газа поверхностью раздела двух фаз: жидкой и газообразной.
Аналогичную систему представляет собой зубная паста: мелкие частицы твердого вещества распределены в жидкости. Подобные системы веществ получили название дисперсных систем.
Дисперсными называют гетерогенные системы, в которых одно вещество в виде очень мелких частиц равномерно распределено в объеме другого.
То вещество, которое распределено в объеме другого, называют дисперсной фазой. Второе вещество носит название дисперсионной среды.
В зависимости от агрегатного состояния дисперсной фазы и дисперсионной среды различают восемь типов дисперсных систем.
2. Классификация дисперсных систем
По размеру частиц дисперсной фазы различают грубодисперсные системы (взвеси) с размером частиц более 500 нм и тонкодисперсные (коллоидные растворы или коллоиды) с размерами частиц от 1 до 500 нм.
Дисперсные системы классифицируют также по степени взаимодействия между дисперсионной средой и дисперсной фазой. Если такое взаимодействие выражено очень слабо, систему называют лиофобной (в случае воды — гидрофобной). Примером гидрофобной системы может служить «баритовая каша» — осадок сульфата бария, получаемый смешиванием растворов, содержащих катион бария и сульфат-анион. Если же дисперсная фаза и дисперсионная среда «тяготеют» друг к другу (например, образуют водородные связи), образуется лиофилъная (гидрофильная) дисперсионная система. Такие системы образуются самопроизвольно и очень устойчивы. К ним относятся растворы высокомолекулярных соединений, например белков. Многие глобулярные белки диспергированы в водных растворах до отдельных молекул, но, поскольку их размеры составляют десятки нанометров, раствор нельзя считать истинным — это дисперсная система.
Разновидность дисперсных систем.
| Дисперсионная среда | Дисперсная фаза | Название дисперсной системы | Примеры дисперсных систем |
| Газ | Жидкость | Аэрозоль | Туман, облака, карбюраторная смесь бензина с воздухом в двигателе автомобиля. |
| Твердое вещество | Аэрозоль | Дым, смог, пыль в воздухе | |
| Жидкость | Газ | Пена | Газированные напитки, взбитые сливки |
| Жидкость | Эмульсии | Молоко, майонез, жидкие среды организма (плазма крови, лимфа), жидкое содержимое клеток (цитоплазма, кариоплазма) | |
| Твердое вещество | Золь, суспензия | Речной и морской ил, строительные растворы, пасты. | |
| Твердое вещество | Газ | Твердая пена | Керамика, пенопласты, полиуретан, поролон, пористый шоколад. |
| Жидкость | Гель | Желе, желатин, косметические и медицинские средства (мази, тушь, помада) | |
| Твердое вещество | Твердый золь | Горные породы, цветные стекла, некоторые сплавы. |
2.1 Грубодисперсные системы
Коэффициент растворимости карбоната кальция (мел) очень мал (6,2-10"4 г/100 г Н2 О).
Попробуем приготовить из этого вещества и воды дисперсную систему. Как можно более тщательно разотрем мел в Ступке, перенесем в стакан с водой и перемешаем. Получим мутную жидкость — дисперсную систему, называемую суспензией. Однако пройдет немного времени, и мел осядет на дно стакана, жидкость станет прозрачной. Под действием силы тяжести частицы твердого вещества седиментируют. Это aw кое доказательство того, что наша система получилась Грубодисперсной. Получить дисперсную систему карбонат кальция-вода можно химическим способом: пропусканием углекислого газа через известковую воду (раствор гидроксид кальция). При этом раствор мутнеет. Полученная система также грубодисперсна, через непродолжительное время в результате осаждения карбоната кальция она расслоится.
Грубодисперсные системы с твердой дисперсной фазой и жидкой дисперсионной средой называют суспензиями. Суспензиями являются многие краски, побелка, строительные растворы (цементный раствор, бетон). Особую группу составляют грубодисперсные системы, в которых концентрация дисперсной фазы относительно велика. Примерами таких систем могут служить пасты (в том числе зубная), кремы, мази.
Суспензии, в которых седиментация идет очень медленно из-за малой разности в плотностях дисперсионной среды и дисперсной фазы, называют взвесями. Вода из грязной лужи, сколько ее не отстаивай, всегда остается мутноватой, в ней во взвешенном состоянии находятся мельчайшие частицы пыли.
Грубодисперсную систему можно получить из двух несмешивающихся друг с другом жидкостей. Если несколько капель растительного масла энергично взболтать в пробирке с несколькими миллилитрами воды, образуется мутная дисперсная система — эмульсия. Со временем она расслоится, поскольку представляет собой грубодисперсную систему.
Примерами эмульсий могут служить некоторые смазоно-охлаждающие жидкости, пестицидные препараты, лекарственные и косметические средства. Например, в медицинской практике применяются жировые эмульсии для энергетического обеспечения голодающего или ослабленного организма путем внутривенного вливания. Типичные биологические эмульсии — это капельки жира в лимфе, кровь. Млечный сок каучуконосных деревьев (латекс) — тоже эмульсия. В химической технологии широко применяют эмульсионную полимеризацию, как основной метод получения каучуков, полистирола, поливинилацетата.
2.2 Коллоидные системы
Коллоиды занимают промежуточное положение между грубодисперсными системами и истинными растворами.
На основании таблицы вы можете убедиться, что дисперсные системы чрезвычайно многообразны. Можно сказать, что они составляют основу всего живого мира. Распространенность их в быту, в технике, в промышленности также очень велика.
Большое значение имеют коллоидные системы для биологии и медицины. В состав любого живого организма входят твердые, жидкие и газообразные вещества, находящиеся в сложнейших взаимоотношениях друг с другом и окружающей средой. Цитоплазма клеток обладает свойствами, характерными как для жидких, так и студнеобразных веществ. С химической точки зрения организм в целом — это сложная совокупность многих коллоидных систем, включающих в себя и жидкие коллоиды, и гели.
Если частицы дисперсной фазы достаточно малы, коллоидная система напоминает истинный раствор, отсюда и происходит название — коллоидный раствор. Такая систем образуется, например, при растворении небольшого количества яичного белка в воде.
Коллоидные растворы, как правило, опалесцируют, т.е. рассеивают падающий свет за счет частиц дисперсной фазы, размеры которых сравнимы с длиной волны излучения. При этом коллоидный раствор при освещении как бы светится сам. Характерным проявлением опалесценции является эффект Тиндаля. Он заключается в появлении в коллоидном растворе светящейся дорожки при пропускании через него луча света. Такой эффект можно наблюдать, выпустив на луч лазерной указки немного аэрозоля.
Существует несколько основных способов получения коллоидных растворов. Первый из них — дисперсионный, а проще говоря, дробление вещества на мелкие частицы в дисперсионной среде или вне ее. Такое дробление можно осуществлять механически с помощью специальных машин — коллоидных мельниц. Так получают, например, тушь, жидкие акварельные, водоэмульсионные и вододисперсионные краски. Дробление можно производить при помощи электрического тока (коллоидные растворы серебра, золота, платины) или ультразвука (коллоидные растворы гипса, графита, смол).
Второй способ получения коллоидов — химический, он основан на проведении различных реакций, приводящих к образованию нерастворимых в жидкости веществ.
При сливании очень разбавленных растворов нитрата серебра и хлорида натрия удается получить коллоидный раствор хлорида серебра:
AgNO3 + NaCl =AgCl+ NaNO3 .
С помощью реакции взаимодействия растворов тиосульфата натрия и кислоты можно получить коллоидный раствор серы:
Na2 S2 O3 + 2НС1 = 2NaCl + Н2 О + SO2 + S
Восстановлением соли золота формальдегидом можно получить коллоидный раствор этого металла:
2NaAuO2 + ЗНСНО + Na2 CO3 = = 2Au| + 3HCOONa + NaHCO3 + h3 O.
Важнейшими типами коллоидных систем являются золи и гели.
2.2.1 Золи
Золи — это коллоидные системы, в которых дисперсионной средой является жидкость, а дисперсной фазой — твердое вещество. Отдельные частицы золя изолированы друг от друга дисперсионной средой. С течением времени они могут укрупняться, сталкиваясь друг с другом. Такое явление получило название коагуляция. В результате действия силы тяжести такие частицы выпадают в осадок, происходит их седиментация.
2.2.2 Гели
Кроме коагуляции, при длительном хранении гидрофильные золи могут превращаться в гели — особое студнеобразное коллоидное состояние. При этом отдельные частицы золя связываются друг с другом, образуя сплошную пространствен ную сетку. Внутрь ячеек сетки попадают частицы растворителя. Получается, что дисперсная фаза и дисперсионная среда меняются ролями! Твердая фаза становится непрерывной, а частички жидкости — изолированными. Дисперсная система теряет свою текучесть, приобретая новые механические свойства. При нагревании гель может вновь превратиться в золь.
Гели широко распространены в нашей повседневной жизни. Любому известны пищевые гели (зефир, мармелад, холодец), косметические (гель для душа, кремы), медицин ские (мази, пасты). Однако немногие знают, что хрящи, сухожилия, волосы представляют собой органические гели, а опал, жемчуг, сердолик, хальцедон — минеральные.
Для некоторых гелей характерно явление синерезиса (или расслоения) — самопроизвольного выделения жидкости. При этом пространственная сетка геля уплотняется, ее объем уменьшается, образуется так называемый твердый коллош). Схематично описанные процессы представлены на рисунке.
Чаще всего с явлением синерезиса приходится бороться, поскольку именно оно определяет сроки годности пищевых, косметических, медицинских гелей. Например, при дли тельном хранении мармелад или торт «Птичье молоко» выделят жидкость, становятся непригодными к употреблению. Однако в некоторых случаях синерезис — великое благо.
Благодаря биологическому синерезису мы наблюдаем такое явлении, как свертывание крови, суть которого состоит в превращении растворимого белка фибриногена в нерастворимый — фибрин.
Процессы, изображенные на рисунке, являются обратимыми. Из твердого коллоида желатина (продукта белкового происхождения) при набухании в теплой воде образуется студнеобразный гель — желе. Но в кулинарных рецептах всегда предупреждают: нельзя доводить желе до кипения, иначе гель превратится в золь, и дисперсная система вновь приобретет текучесть.
Частицы дисперсной фазы коллоидных растворов нередко не оседают даже при длительном хранении. Почему так происходит? Первая причина заключается в том, что мельчайшие коллоидные частицы за счет теплового движения постоянно сталкиваются с молекулами дисперсионной среды, изменяя направление движения, т. е. оседания не наблюдается. Но почему при столкновении частиц дисперсной фазы не происходит их коагуляция, укрупнение, что неизбежно привело бы к расслоению коллоида? Слипанию препятствует электрический заряд на поверхности коллоидных частиц, все они оказываются одноименно заряженными, что приводит к их взаимному отталкиванию. Остается выяснить, как же образуется этот заряд? Для этого рассмотрим строение коллоидной частицы.
2.2.3 Мицеллы
Частицы дисперсной фазы золей называют мицеллами. Если исключить влияние растворителя, в котором образуется коллоидная система, то упрощенную схему строения мицеллы золя хлорида серебра (при избытке хлорид-анионов) можно представить следующим образом. Предположим, что золь хлорида серебра получен сливанием сильно разбавленных растворов хлорида калия и нитрата серебра, причем хлорид калия взят в избытке.
При взаимодействии катионов серебра с хлорид-анионами образуются частицы нерастворимого в воде хлорида серебра. Поскольку растворы сильно разбавлены, микрокристаллы получаются коллоидных размеров, очень мелкие. Такой микрокристалл образует ядро мицеллы.
Рост кристалла прекращается, когда в растворе практически до нуля падает концентрация ионов серебра. Но хлорид-анионы присутствуют в избытке. Часть из них адсорбируется на поверхности ядра, достраивая его кристаллическую решетку. Хлорид-анионы в данном случае называют потенциалопределяющими ионами. Именно они обусловливают наличие отрицательного заряда агрегата ядра с избытком ионов С1-. Если бы в растворе присутствовал избыток нитрата серебра, потенциалопределяющими ионами были бы катионы Ag+ .
Естественно, после возникновения заряда образовавшаяся частица начинает притягивать из раствора ионы с противоположным знаком — катионы калия (противоионы), образуется так называемый двойной электрический слой. Некоторая часть противоионов очень прочно притягивается к агрегату, образуя адсорбционный слой. Часть мицеллы, включающую ядро, потенциал определяющие ионы и адсорбционный слой, называют гранулой. Ионы К+, которые не входят в адсорбционный слой, слабее связаны с гранулой и могут диссоциировать в раствор. Они составляют диффузный слой противоионов.
В целом мицелла представляет собой электронейтральную частицу, но за счет перехода части ионов диффузного слоя в раствор гранулы имеют на поверхности избыточный отрицательный заряд, который и препятствует их коагуляции в более крупные частицы.
Строение мицеллы можно изобразить с помощью формулы. Последовательные шаги в составлении формулы мицеллы таковы.
1)Ядро мицеллы состоит из т частиц AgCl, образующих микрокристалл: m[AgCl].
2)Потенциалопределяющие ионы адсорбируются на поверхности ядра; предположим, что для нашего примера их число равно п: m[AgCl] • nСl-.
3)Затем следует слой противоионов. Их общее число так же равно п, однако часть (допустим, х) из них образуют диффузный слой, остальные (п — х) вместе с ядром и потенциалопределяющими ионами составляют гранулу. Часть формулы, относящуюся к грануле мицеллы, заключают в фигурные скобки. Заряд гранулы в данной мицелле равен х~. Таким образом, формула мицеллы золя хлорида серебра в избытке хлорид-анионов такова:
{m[AgCl] • TiCl" • (п — х)К+ }х — хК+
Зная строение мицеллы, можно управлять процессом коагуляции. Каким образом можно «заставить» коллоидные частицы коагулировать? Очевидно, необходимо лишить их поверхностного заряда. Этого можно добиться с помощью растворов электролитов. Действительно, если к золю хлорида серебра добавить, например, раствор сульфата алюминия, катионы А13+ нейтрализуют отрицательный заряд гранулы, мицеллы укрупняются и оседают под действием силы тяжести. Очевидно, что при равных концентрациях трехзарядный ион алюминия обладает большей коагулирующей способностью, чем, например, однозарядный ион лития Li+ .
В некоторых случаях, напротив, необходимо поддерживать устойчивость коллоидной системы или преобразовать коагулят в золь. Вспомните, например, принцип действия поверхностно-активного вещества, например мыла, при удавлении жира с загрязненной поверхности. Гидрофобный углердородный радикал растворяется в частицах жира, а гидрофильный карбоксилат-анион оказывается на поверхности. Мельчайшие (коллоидные) капельки жира с «одуванчиком» анионов -СОО- на поверхности переходят в раствор и не слипаются вновь из-за наличия отрицательного заряда.
Список используемой литературы
1. Калоус В. Биофизическая химия. /Калоус В., Павличек З. – М., 1985 г.
2. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для вузов/Ю.А. Ершов, В.А. Попков, А.С. Берлянд и др.; Под. Ред. Ю.А. Ершова. – 2-е изд., испр. и доп.- М.: Высш. шк., 2000м – 560 с.: ил.
3. Маршелл Э. Биофизическая химия. – М.: Мир, 1981.
www.ronl.ru
Министерство общего и профессионального образованияРоссийской Федерации.
/>ОмГТУКафедра Химии.
/>/>/>Реферат по курсу «Химия».Выполнил:
Студент МСФ С-110
Проверил:
Бродовская Г.Ф.
г. Омск, 2000
Оглавление:
1. Дисперсные системы.Истинные растворы: 3
2. Растворимость твёрдых веществ ижидкостей в жидкостях. Влияние природы веществ и температуры на растворимость. 5
3. Способы выражения концентрациирастворов: массовая – С%, молярная – См и нормальная (эквивалентная)– Сн. 7
4. Растворы электролитов.Электролитическая диссоциация кислот, оснований, солей. Ступенчатаядиссоциация. 7
5. Классификация электролитов. Степеньдиссоциации. Сильные и слабые электролиты. 8
6. Реакции обмена в растворахэлектролитов и условия их протекания. Ионные уравнения. 9
7. Ионное произведение воды.Водородный показатель рН растворов. Индикаторы. 10
Литература: 12
1. Дисперсные системы. Истинные растворы:Кристаллы любого вещества, например сахара или хлорида натрия,можно получить разного размера – крупные и мелкие. Каков бы ни был размеркристаллов, все они имеют одинаковую для данного вещества внутреннюю структуру– молекулярную или ионную кристаллическую решетку.
При растворении в воде кристаллов сахара ихлорида натрия образуются соответственно молекулярные и ионные растворы. Такимобразом, одно и то же вещество может находиться в различной степенираздробленности: макроскопически видимые частицы (>0,2 мм, разрешающаяспособность глаза), микроскопически видимые частицы (от 0,2-0,1мм до 400-300нм,разрешающая способность микроскопа при освещении белым светом) и в молекулярном(или ионном) состоянии.
Если толщина плёнок, поперечник волокон иличастиц (корпускул) меньше разрешающей способности оптического микроскопа то онине могут быть обнаружены с его помощью. Такие невидимые в оптический микроскопчастицы называют коллоидными, а раздробленное (диспергированное) состояниевеществ с размером частиц от 400-300нм до 1нм – коллоидным состояниемвещества.
Дисперсные (раздробленные) системы являютсягетерогенными. Они состоят из сплошной непрерывной фазы – дисперсионнойсреды и находящихся в этой среде раздробленных частиц того или иногоразмера и формы – дисперсной фазы.
Поскольку дисперсная (прерывная) фазанаходится в виде отдельных небольших частиц, то дисперсные системы, в отличиеот гетерогенных со сплошными фазами, называют микрогетерогенными, аколлоиднодисперсные системы называют также ультрамикрогетерогенными, чтобыподчеркнуть, что в этих системах граница раздела фаз не может быть обнаружена всветовом микроскопе.
Когда вещество находится в окружающей среде ввиде молекул или ионов, то такие растворы называют истинными, т.е. гомогеннымиоднофазными растворами.
Обязательным условием получения дисперсныхсистем является взаимная нерастворимость диспергируемого вещества идисперсионной среды. Например, нельзя получить коллоидные растворы сахара илихлорида натрия в воде, но они могут быть получены в керосине или в бензоле, вкоторых эти вещества практически нерастворимы.
Дисперсные системы классифицируют подисперсности, агрегатному состоянию дисперсной фазы и дисперсионной среды,интенсивности взаимодействия между ними, отсутствию или образованию структур вдисперсных системах.
/> /> Количественнойхарактеристикой дисперсности вещества является степень дисперсности (D) – величина, обратная размеру (а)дисперсных частиц:Здесь а равно либо диаметрусферических или волокнистых частиц, либо длине ребра кубических частиц, либотолщине плёнок.
Степень дисперсности численно равна числучастиц, которые можно плотно уложить в ряд (или стопку плёнок) на протяженииодного сантиметра.
Если все частицы дисперсной фазы имеютодинаковые размеры, то такие системы называют монодисперсными. Частицыдисперсной фазы неодинакового размера образуют полидисперсные системы.
/> /> С повышениемдисперсности всё большее число атомов вещества находится в поверхностном слое,на границе раздела фаз, по сравнению с их числом внутри объёма частицдисперсной фазы. Соотношение между поверхностью и объёмом характеризуетудельная поверхность: Sуд=S/V,которая для частиц сферической формы равна/> /> а для частиц кубическойформыгде r — радиус шара; d– его диаметр;l– длина ребра куба.
Следовательно, с повышением дисперсностивещества всё большее значение имеют его свойства, определяемые поверхностнымиявлениями, т.е. совокупностью процессов, происходящих в межфазовой поверхности.Таким образом, своеобразие дисперсных систем определяется большой удельнойповерхностью дисперсной фазы и физико-химическим воздействием дисперсной средына границе раздела фаз.
Многообразие дисперсных систем обусловленотем, что образующие их фазы могут находиться в любом из трёх агрегатныхсостояний (Ж, Г, Т).
Дисперсные системы с газообразной дисперснойсредой называют аэрозолями. Туманы представляют собой аэрозоли сжидкой дисперсной фазой, а пыль и дым – аэрозоли с твёрдойдисперсной фазой; пыль образуется при диспергировании веществ, а дым – приконденсации летучих веществ.
Пены – это дисперсия газа в жидкости,причем в пенах жидкость вырождается до тонких плёнок, разделяющих, разделяющихотдельные пузырьки газа. Эмульсиями называют дисперсные системы, вкоторых одна жидкость раздроблена в другой, не растворяющей её жидкость.Низкодисперсные системы твёрдых частиц в жидкостях, называют суспензиями, иливзвесями, а предельно-высокодисперсные – коллоидными растворами,или золями, часто лизолями, чтобы подчеркнуть, что дисперснойсредой является жидкость. Если дисперсной средой является вода, то такие золиназывают гидрозолями, а если органическая жидкость – органозолями.
Дисперсные системы могут быть свободнодисперснымии связнодисперсными в зависимости от отсутствия или наличиявзаимодействия между частицами дисперсной фазы. К свободнодисперсным системамотносятся аэрозоли, лиозоли, разбавленные суспензии и эмульсии. Они текучи. Вэтих системах частицы дисперсной фазы не имеют контактов, участвуют вбеспорядочном тепловом движении, свободно перемещаются под действием силытяжести. Связнодисперсные системы – твердообразны, они возникают при контактечастиц дисперсной фазы, приводящим к образованию структуры в виде каркаса илисетки. Такая структура ограничивает текучесть дисперсной системы и придаёт ейспособность сохранять форму. Подобные структурированные коллоидные системыназывают гелями. Переход золя в гель, происходящий в результатепонижения устойчивости золя, называют гелеобразованием (или желатинированием).Сильно вытянутая и плёночно-листочковая форма дисперсных частиц повышаетвероятность контакта между ними и благоприятствует образованию гелей при малойконцентрации дисперсной фазы. Порошки, концентрированные эмульсии и суспензии(пасты), пены – примеры связнодисперсных систем. Почва, образовавшаяся врезультате контакта и уплотнения дисперсных частиц почвенных минералов игумусовых (органических) веществ, также представляет собой связнодисперснуюсистему.
Сплошную массу вещества могутпронизывать поры и капилляры, образующие капиллярнодисперсные системы. К нимотносятся, например, дерево, разнообразные мембраны идиафрагмы, кожа, бумага,картон, ткани.
/>2. Растворимостьтвёрдых веществ и жидкостей в жидкостях. Влияние природы веществ и температурына растворимость.Раствором называется твёрдая или жидкаягомогенная система, состоящая из двух или более компонентов, относительныеколичества которых могут изменяться в широких пределах.
Всякий раствор состоит из растворённых веществи растворителя, т.е. среды, в которой эти вещества равномерно распределеныв виде молекул или ионов. Обычно растворителем считают тот компонент, который вчистом виде существует в таком же агрегатном состоянии, что и полученныйраствор. Если же оба компонента до растворения находились в одинаковомагрегатном состоянии, то растворителем считается компонент, находящийся вбольшем количестве.
Однородность растворов делает их оченьсходными с химическими соединениями. Выделение теплоты при растворениинекоторых веществ тоже указывает на химическое взаимодействие междурастворителем и растворяемым веществом. Отличие растворов от химическихсоединений состоит в том что, состав раствора может изменяться в широкихпределах. Кроме того, в свойствах раствора можно обнаружить многие свойства егоотдельных компонентов, чего не наблюдается в случае химического соединения.Непостоянство состава растворов приближает их к механическим смесям, но отпоследних они резко отличаются своею однородностью. Таким образом, растворызанимают промежуточное положение между механическими смесями и химическимисоединениями.
Растворимостью называется способность веществарастворяться в том или ином растворителе. Мерой растворимости вещества приданных условиях служит содержание его в насыщенном растворе. Поэтомучисленно растворимость может быть выражена теми же способами, что и состав,например, процентным отношением массы растворённого вещества к массенасыщенного раствора или количеством растворённого вещества, содержащимся в 1 лнасыщенного раствора. Часто растворимость выражают также числом единиц массы безводноговещества, насыщающего при данных условиях 100 единиц массы растворителя; иногдавыраженную этим способом растворимость называют коэффициентом растворимости.
Растворимость различных веществ в водеизменяется в широких пределах. Если в 100 г воды растворяется более 10 гвещества, то такое вещество принято называть хорошо растворимым; еслирастворяется менее 1 г вещества – малорастворимым и, наконец, практическинерастворимыми, если в раствор переходит менее 0,01 г вещества.
Принципы, позволяющие предсказатьрастворимость вещества, пока не известны. Однако обычно вещества, состоящие изполярных молекул, и вещества с ионным типом связи лучше растворяются в полярныхрастворителях (вода, спирты, жидкий аммиак), а неполярные вещества – неполярныхрастворителях (бензол, сероуглерод).
Растворение большинства твёрдых телсопровождается поглощением теплоты. Это объясняется затратой значительногоколичества энергии на разрушение кристаллической решётки твёрдого тела, чтообычно не полностью компенсируется энергией, выделяющейся при образованиигидратов (сольватов). Прилагая принцип Ле Шателье к равновесию между веществомв кристаллическом состоянии и его насыщенным раствором
/>Кристалл + Растворитель Насыщенный раствор ± Q
приходим к выводу, что в тех случаях, когда веществорастворяется с поглощением энергии, повышение температуры должно приводить кувеличению его растворимости. Если же, однако, энергия гидратации достаточновелика, чтобы образование раствора сопровождалось выделением энергии,растворимость с ростом температуры понижается. Это происходит, например, прирастворении в воде многих солей лития, магния, алюминия.
При растворении твёрдых тел в воде объём системыобычно изменяется незначительно. Поэтому растворимость веществ, находящихся втвёрдом состоянии, практически не зависит от давления.
Жидкости также могут растворяться в жидкостях.Некоторые из них неограниченно растворимы одна в другой, т.е. смешиваются другс другом в любых пропорциях, как, например, спирт и вода, другие – взаимнорастворяются лишь до известного предела. Так если взболтать диэтиловый эфир сводой, то образуется два слоя: верхний представляет собой насыщенный растворводы в эфире, а нижний – насыщенный раствор эфира в воде. В большинствеподобных случаев с повышением температуры взаимная растворимость жидкостейувеличивается до тех пор, пока не будет достигнута температура, при которой обежидкости смешиваются любых пропорциях.
Температура, при которой ограниченная взаимнаярастворимость жидкостей переходит в неограниченную, называется критическойтемпературой растворения.
Как и в случае растворения твёрдых тел, взаимноерастворение жидкостей обычно не сопровождается значительным изменением объёма.Поэтому взаимная растворимость жидкостей мало зависит от давления и заметновозрастает лишь при очень высоких давлениях (порядка тысяч атмосфер).
/> /> Если в систему, состоящую из двух несмешивающихся жидкостей, ввеститретье вещество, способное растворяться в каждой из этих жидкостей, торастворённое вещество будет распределяться между обеими жидкостямипропорционально своей растворимости в каждой из них. Отсюда вытекает законраспределения, согласно которому вещество, способное растворяться вдвух несмешивающихся растворителях, распределяется между ними так, чтоотношение его концентраций в этих растворителях при постоянной температуреостаётся постоянным, независимо от общего количества растворённого вещества:Здесь С1 и С2 –концентрации растворённого вещества в первом и втором растворителях; К – такназываемый коэффициент распределения.
/>3. Способы выраженияконцентрации растворов: массовая – С%, молярная – См и нормальная(эквивалентная) – Сн.· Массовая доля – отношение (обычно – процентное) массырастворённого вещества к массе раствора. Например, 15% (масс.) водный растворхлорида натрия – это такой раствор в 100 единицах массы которого содержится 15единиц массы NaCl и 85 единиц массы воды.
· Молярная концентрация, или молярность – отношениеколичества растворённого вещества к объёму раствора. Обычно молярностьобозначается СМ<sub/>или (после численного значениямолярности) М. Так, 2М h3SO4 означает раствор, в каждом литре которого содержится2 моля серной кислоты, т.е. СМ=2моль/л.
· Эквивалентная, или нормальная концентрация –отношение числа эквивалентов растворённого вещества к объёму раствора.Концентрация, выраженная этим способом, обозначается СНили(после численного значения нормальности) буквой н. Так 2н h3SO4 означаетраствор, в каждом литре которого содержится 2 эквивалента серной кислоты, т.е. СН(1/2h3SO4)=2моль/л.
/>4. Растворыэлектролитов. Электролитическая диссоциация кислот, оснований, солей.Ступенчатая диссоциация.Водные растворы солей, кислот и основанийобладают особенностью – они проводят электрический ток. При этом большинствотвёрдых солей и оснований в безводном состоянии, а также безводные кислотыобладают очень слабой электрической проводимостью: плохо проводит электрическийток и вода. Очевидно что при образовании растворов подобные веществапретерпевают какие-то изменения, обуславливающие возникновение высокойэлектрической проводимости. Эти изменения заключаются в диссоциациисоответствующих веществ на ионы, которые и служат переносчиками электрическоготока.
Вещества проводящие электрический ток своимиионами, называются электролитами. При растворении в воде и в ряденеводных растворителей свойства электролитов проявляют соли, кислоты иоснования. Электролитами являются также многие расплавленные соли, оксиды игидроксиды, некоторые соли и оксиды в твёрдом состоянии.
Кислоты.При диссоциации любой кислоты образуются ионы водорода.Поэтому все свойства, которые являются общими для водных растворов кислот, объясняютсяприсутствием гидратированных ионов водорода. Это они вызывают красный цветлакмуса, сообщают кислотам кислый вкус и т.д. С устранением ионов водорода,например при нейтрализации, исчезают и кислотные свойства. Поэтому теорияэлектролитической диссоциации определяет кислоты как электролиты,диссоциирующие в растворах с образованием ионов водорода. У сильных кислот,диссоциирующих нацело, свойства кислот проявляются в большей степени, у слабыхв меньшей. Чем лучше кислота диссоциирует, тем она сильнее.
Основания.Поскольку общим для всех растворов оснований являетсяприсутствие в них гидроксид-ионов, то ясно, что носителем основных свойствявляется гидроксид-ион. Поэтому с точки зрения теории электролитическойдиссоциации основания – это электролиты, диссоциирующие в растворах сотщеплением гидроксид-ионов.
Сила оснований, как и сила кислот, зависит отвеличины константы диссоциации.Чем больше константа диссоциации данногооснования, тем оно сильнее.
Соли.Соли можно определить как электролиты, которые прирастворении в воде диссоциируют, отщепляя положительные ионы, отличные от ионовводорода, и отрицательные ионы, отличные от гидроксид-ионов. Таких ионов,которые были бы общими для водных растворов всех солей, нет; поэтому соли и необладают общими свойствами. Как правило, соли хорошо диссоциируют, и тем лучше,чем меньше заряды ионов, образующих соль.
При растворении кислых солей в раствореобразуются катионы металла, сложные анионы кислотного остатка, а также ионы,являющиеся продуктами диссоциации этого сложного кислотного остатка, в томчисле ионы Н+.
При диссоциации основных солейобразуются анионы кислоты и сложные катионы, состоящие из металла игидроксогрупп. Эти сложные катионы также способны к диссоциации. Поэтому врастворе основной соли присутствуют ионы ОН-.
К равновесию, которое устанавливается врастворе слабого электролита между молекулами и ионами, можно применить законыхимического равновесия. Константа равновесия, отвечающая диссоциации слабогоэлектролита, называется константой диссоциации. Величина Кзависит от природы электролита и растворителя, а также от температуры, но независит от С раствора. Она характеризует способность даннойкислоты или данного основания распадаться на ионы: чем выше К,тем легче электролит диссоциирует.
Многоосновные кислоты, а также основания двух- иболее валентных металлов диссоциируют ступенчато. В растворах этих веществустанавливаются сложные равновесия, в которых участвуют ионы различного заряда.
Первое равновесие – диссоциация по первойступени – характеризуется константой диссоциации, обозначаемой К1,а второе — диссоциация по второй ступени – константой диссоциации К2.ВеличиныК, К1иК2 связаныдруг с другом соотношением
К= К1К2
При ступенчатой диссоциации веществ распад попоследующей ступени всегда происходит в меньшей степени, чем по предыдущей.Соблюдается неравенство:
К1>К2>К3…
Это объясняется тем, что энергия, которую нужнозатратить для отрыва иона, минимальна при отрыве его от нейтральной молекулы истановится больше при диссоциации по каждой следующей ступени.
/>5. Классификацияэлектролитов. Степень диссоциации. Сильные и слабые электролиты.Если бы электролиты полностью диссоциировали наионы, то осмотическое давление (и другие пропорциональные ему величины) всегдабыло бы в целое число раз больше значений, наблюдаемых в растворахнеэлектролитов. Но ещё Вант-Гофф установил, что коэффициент i выражается дробнымичислами, которые с разбавлением раствора возрастают, приближаясь к целым числам.
Аррениус объяснил этот факт тем, что лишь частьэлектролита диссоциирует в растворе на ионы, и ввёл понятие степенидиссоциации. Степенью диссоциации электролита называется отношениечисла его молекул, распавшихся в данном растворе на ионы, к общему числу егомолекул в растворе.
Позже было установлено что электролиты можноразделить на две группы: сильные и слабые электролиты. Сильные электролиты вводных растворах диссоциированны практически нацело. Понятие степенидиссоциации к ним по существу неприменимо, а отклонение изотоническогокоэффициента i от целочисленных значенийобъясняется другими причинами. Слабые электролиты в водных растворахдиссоциируют только частично. Поэтому число ионов в растворах сильныхэлектролитов больше, чем в растворах слабых той же концентрации. И если врастворах слабых электролитов С ионов мала, расстояние между ними великии взаимодействие ионов друг с другом незначительно, то в не очень разбавленныхрастворах сильных электролитов среднее расстояние между ионами вследствиезначительной концентрации сравнительно мало. В таких растворах ионы не вполнесвободны, движение их стеснено взаимным притяжением друг к другу. Благодаряэтому притяжению каждый ион как бы окружен шарообразным роем противоположнозаряженных ионов, получившим название «ионной атмосферы».
К сильным электролитам принадлежат все соли; изважнейших кислот и оснований к ним относятся HNO3,h3SO4, HClO4,HCl, HBr, HI,KOH, NaOH, Ba(OH)2, и Ca(OH)2.
К слабым электролитам относятся большинствоорганических кислот, а из важнейших неорганических соединений к ним принадлежатh3CO3, h3S, HCN,h3SiO3 и Nh5OH.
Степень диссоциации принято обозначать греческойбуквой a и выражать либо в доляхединицы, либо в процентах.
/>6. Реакции обмена врастворах электролитов и условия их протекания. Ионные уравнения./> /> При нейтрализации любой сильной кислоты любым сильнымоснованием на каждый моль образующейся воды выделяется около 57,6 кДж теплоты.Это говорит о том, что подобные реакции сводятся к одному процессу. Еслиперепишем уравнение, записывая сильные электролиты в ионной форме, посколькуони существуют в растворе в виде ионов, а слабые – в молекулярной, посколькуони находятся в растворе преимущественно в виде молекул.
/> /> Рассматривая получившееся уравнение, видим, что в ходе реакции ионы Na+ и Cl- непретерпели изменений. Поэтому перепишем уравнение ещё раз, исключив эти ионы изобеих частей уравнения. Получим:Таким образом, реакции нейтрализации любойсильной кислоты любым сильным основанием сводится к одному и тому же процессу –к образованию молекул воды из ионов водорода и гидроксид-ионов. Ясно, чтотепловые эффекты этих реакций тоже должны быть одинаковы.
Строго говоря, реакция образования воды из ионовобратима, что можно выразить уравнением:
/> /> Вода — очень слабый электролит и диссоциирует лишь в ничтожно малойстепени. Равновесие между молекулами воды и ионами сильно смещено в сторонуобразования молекул. Поэтому практически реакция нейтрализации сильной кислотысильным основанием протекает до конца/> При смешивании раствора какой-либо соли серебра с соляной кислотойили с раствором любой её соли всегда образуется характерный белый творожистыйосадок хлорида серебра:
/> Подобные реакции также сводятся к одному процессу. Для того чтобыполучить его ионно-молекулярное уравнение, перепишем уравнение первой реакции,записывая сильные электролиты в ионной форме а вещество, находящееся в осадке,в молекулярной:
/> Как видно, ионы Н+ и NО3-не претерпевают изменений в ходе реакции. Поэтому исключим их и перепишемуравнение ещё раз:
Это и есть ионно-молекулярное уравнениерассматриваемого процесса.
/> /> Здесь также надо иметь в виду, что осадок хлорида серебра находится вравновесии с ионами Ag+ и Cl-в растворе, так что процесс, выраженный последним уравнением обратим:Однако, вследствие малой растворимости хлоридасеребра, это равновесие очень сильно смещено вправо. Поэтому можно считать, чтореакция образования AgCl из ионов практически доходитдо конца.
Для составления ионно-молекулярных уравненийнеобходимо знать, какие соли растворимы в воде и какие практическинерастворимы.
Ионно-молекулярные уравнения помогают понятьособенности протекания реакций между электролитами.
/>7. Ионное произведениеводы. Водородный показатель рН растворов. Индикаторы.Чистая вода очень плохо проводит электрическийток, но всё же обладает измеримой электрической проводимостью, котораяобъясняется небольшой диссоциацией воды на ионы водорода и гидроксид-ионы. Дляводы и разбавленных водных растворов при неизменной температуре произведениеконцентраций ионов водорода и гидросид-ионов есть величина постоянная. Этапостоянная величина называется ионным произведением воды. Растворы,в которых концентрация ионов водорода и гидроксид-ионов одинаковы, называютсянейтральными растворами.
Если концентрация ионов водорода в водномрастворе известна, то тем самым определена и концентрация гидроксид-ионов.Поэтому как степень кислотности, так и степень щёлочности раствора можноколичественно охарактеризовать концентрацией ионов водорода. Кислотность ищелочность раствора можно выразить другим, более удобным способом: вместоконцентрации ионов водорода указывают её десятичный логарифм, взятый с обратнымзнаком. Эта величина называется водородным показателем и обозначаетсячерез рН:
рН=-lg[H+]
Для измерения рН существуют различныеметоды. Приближённо реакцию раствора можно определить с помощью специальныхреактивов, называемых индикаторами, окраска которых меняется взависимости от концентрации ионов водорода. Наиболее распространённый индикатор– метиловый оранжевый, метиловый красный, фенолфтолеин.
/>Литература:1. Глинка Н.Л.
Общая химия: — Л.: Химия 1985.-704с.
Под ред. В.А. Рабиновича.
2. Фролов В.В.
Химия: — М.: Высш. Шк., 1986.- 543с.
www.ronl.ru
Министерство общего и профессионального образования Российской Федерации.
ОмГТУ
Кафедра Химии.
Реферат по курсу «Химия».
Выполнил:
Студент МСФ С-110
Проверил:
Бродовская Г.Ф.
г. Омск, 2000
Оглавление:
1 . Дисперсные системы. Истинные растворы: 3
2. Растворимость твёрдых веществ и жидкостей в жидкостях. Влияние природы веществ и температуры на растворимость. 5
3. Способы выражения концентрации растворов: массовая – С%, молярная – См и нормальная (эквивалентная) – Сн. 7
4. Растворы электролитов. Электролитическая диссоциация кислот, оснований, солей. Ступенчатая диссоциация. 7
5. Классификация электролитов. Степень диссоциации. Сильные и слабые электролиты. 8
6. Реакции обмена в растворах электролитов и условия их протекания. Ионные уравнения. 9
7. Ионное произведение воды. Водородный показатель рН растворов. Индикаторы. 10
Литература: 12
1. Дисперсные системы. Истинные растворы:
Кристаллы любого вещества, например сахара или хлорида натрия, можно получить разного размера – крупные и мелкие. Каков бы ни был размер кристаллов, все они имеют одинаковую для данного вещества внутреннюю структуру – молекулярную или ионную кристаллическую решетку.
При растворении в воде кристаллов сахара и хлорида натрия образуются соответственно молекулярные и ионные растворы. Таким образом, одно и то же вещество может находиться в различной степени раздробленности: макроскопически видимые частицы (>0,2 мм, разрешающая способность глаза), микроскопически видимые частицы (от 0,2-0,1мм до 400-300нм, разрешающая способность микроскопа при освещении белым светом) и в молекулярном (или ионном) состоянии.
Если толщина плёнок, поперечник волокон или частиц (корпускул) меньше разрешающей способности оптического микроскопа то они не могут быть обнаружены с его помощью. Такие невидимые в оптический микроскоп частицы называют коллоидными, а раздробленное (диспергированное) состояние веществ с размером частиц от 400-300нм до 1нм – коллоидным состоянием вещества.
Дисперсные (раздробленные) системы являются гетерогенными. Они состоят из сплошной непрерывной фазы – дисперсионной среды и находящихся в этой среде раздробленных частиц того или иного размера и формы – дисперсной фазы.
Поскольку дисперсная (прерывная) фаза находится в виде отдельных небольших частиц, то дисперсные системы, в отличие от гетерогенных со сплошными фазами, называют микрогетерогенными, а коллоиднодисперсные системы называют также ультрамикрогетерогенными, чтобы подчеркнуть, что в этих системах граница раздела фаз не может быть обнаружена в световом микроскопе.
Когда вещество находится в окружающей среде в виде молекул или ионов, то такие растворы называют истинными, т.е. гомогенными однофазными растворами.
Обязательным условием получения дисперсных систем является взаимная нерастворимость диспергируемого вещества и дисперсионной среды. Например, нельзя получить коллоидные растворы сахара или хлорида натрия в воде, но они могут быть получены в керосине или в бензоле, в которых эти вещества практически нерастворимы.
Дисперсные системы классифицируют по дисперсности, агрегатному состоянию дисперсной фазы и дисперсионной среды, интенсивности взаимодействия между ними, отсутствию или образованию структур в дисперсных системах.
 |
Здесь а равно либо диаметру сферических или волокнистых частиц, либо длине ребра кубических частиц, либо толщине плёнок.
Степень дисперсности численно равна числу частиц, которые можно плотно уложить в ряд (или стопку плёнок) на протяжении одного сантиметра.
Если все частицы дисперсной фазы имеют одинаковые размеры, то такие системы называют монодисперсными. Частицы дисперсной фазы неодинакового размера образуют полидисперсные системы.
 |
 |
где r — радиус шара; d – его диаметр; l – длина ребра куба.
Следовательно, с повышением дисперсности вещества всё большее значение имеют его свойства, определяемые поверхностными явлениями, т.е. совокупностью процессов, происходящих в межфазовой поверхности. Таким образом, своеобразие дисперсных систем определяется большой удельной поверхностью дисперсной фазы и физико-химическим воздействием дисперсной среды на границе раздела фаз.
Многообразие дисперсных систем обусловлено тем, что образующие их фазы могут находиться в любом из трёх агрегатных состояний (Ж, Г, Т).
Дисперсные системы с газообразной дисперсной средой называют аэрозолями. Туманы представляют собой аэрозоли с жидкой дисперсной фазой, а пыль и дым – аэрозоли с твёрдой дисперсной фазой; пыль образуется при диспергировании веществ, а дым – при конденсации летучих веществ.
Пены – это дисперсия газа в жидкости, причем в пенах жидкость вырождается до тонких плёнок, разделяющих, разделяющих отдельные пузырьки газа. Эмульсиями называют дисперсные системы, в которых одна жидкость раздроблена в другой, не растворяющей её жидкость. Низкодисперсные системы твёрдых частиц в жидкостях, называют суспензиями, или взвесями, а предельно-высокодисперсные – коллоидными растворами, или золями, часто лизолями, чтобы подчеркнуть, что дисперсной средой является жидкость. Если дисперсной средой является вода, то такие золи называют гидрозолями, а если органическая жидкость – органозолями.
Дисперсные системы могут быть свободнодисперсными и связнодисперсными в зависимости от отсутствия или наличия взаимодействия между частицами дисперсной фазы. К свободнодисперсным системам относятся аэрозоли, лиозоли, разбавленные суспензии и эмульсии. Они текучи. В этих системах частицы дисперсной фазы не имеют контактов, участвуют в беспорядочном тепловом движении, свободно перемещаются под действием силы тяжести. Связнодисперсные системы – твердообразны, они возникают при контакте частиц дисперсной фазы, приводящим к образованию структуры в виде каркаса или сетки. Такая структура ограничивает текучесть дисперсной системы и придаёт ей способность сохранять форму. Подобные структурированные коллоидные системы называют гелями. Переход золя в гель, происходящий в результате понижения устойчивости золя, называют гелеобразованием (или желатинированием ). Сильно вытянутая и плёночно-листочковая форма дисперсных частиц повышает вероятность контакта между ними и благоприятствует образованию гелей при малой концентрации дисперсной фазы. Порошки, концентрированные эмульсии и суспензии (пасты), пены – примеры связнодисперсных систем. Почва, образовавшаяся в результате контакта и уплотнения дисперсных частиц почвенных минералов и гумусовых (органических) веществ, также представляет собой связнодисперсную систему.
Сплошную массу вещества могут пронизывать поры и капилляры, образующие капиллярнодисперсные системы. К ним относятся, например, дерево, разнообразные мембраны идиафрагмы, кожа, бумага, картон, ткани.
2. Растворимость твёрдых веществ и жидкостей в жидкостях. Влияние природы веществ и температуры на растворимость.
Раствором называется твёрдая или жидкая гомогенная система, состоящая из двух или более компонентов, относительные количества которых могут изменяться в широких пределах.
Всякий раствор состоит из растворённых веществ и растворителя, т.е. среды, в которой эти вещества равномерно распределены в виде молекул или ионов. Обычно растворителем считают тот компонент, который в чистом виде существует в таком же агрегатном состоянии, что и полученный раствор. Если же оба компонента до растворения находились в одинаковом агрегатном состоянии, то растворителем считается компонент, находящийся в большем количестве.
Однородность растворов делает их очень сходными с химическими соединениями. Выделение теплоты при растворении некоторых веществ тоже указывает на химическое взаимодействие между растворителем и растворяемым веществом. Отличие растворов от химических соединений состоит в том что, состав раствора может изменяться в широких пределах. Кроме того, в свойствах раствора можно обнаружить многие свойства его отдельных компонентов, чего не наблюдается в случае химического соединения. Непостоянство состава растворов приближает их к механическим смесям, но от последних они резко отличаются своею однородностью. Таким образом, растворы занимают промежуточное положение между механическими смесями и химическими соединениями.
Растворимостью называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества при данных условиях служит содержание его в насыщенном растворе. Поэтому численно растворимость может быть выражена теми же способами, что и состав, например, процентным отношением массы растворённого вещества к массе насыщенного раствора или количеством растворённого вещества, содержащимся в 1 л насыщенного раствора. Часто растворимость выражают также числом единиц массы безводного вещества, насыщающего при данных условиях 100 единиц массы растворителя; иногда выраженную этим способом растворимость называют коэффициентом растворимости.
Растворимость различных веществ в воде изменяется в широких пределах. Если в 100 г воды растворяется более 10 г вещества, то такое вещество принято называть хорошо растворимым; если растворяется менее 1 г вещества – малорастворимым и, наконец, практически нерастворимыми, если в раствор переходит менее 0,01 г вещества.
Принципы, позволяющие предсказать растворимость вещества, пока не известны. Однако обычно вещества, состоящие из полярных молекул, и вещества с ионным типом связи лучше растворяются в полярных растворителях (вода, спирты, жидкий аммиак), а неполярные вещества – неполярных растворителях (бензол, сероуглерод).
Растворение большинства твёрдых тел сопровождается поглощением теплоты. Это объясняется затратой значительного количества энергии на разрушение кристаллической решётки твёрдого тела, что обычно не полностью компенсируется энергией, выделяющейся при образовании гидратов (сольватов). Прилагая принцип Ле Шателье к равновесию между веществом в кристаллическом состоянии и его насыщенным раствором
 Кристалл + Растворитель Насыщенный раствор ± Q
Кристалл + Растворитель Насыщенный раствор ± Q
приходим к выводу, что в тех случаях, когда вещество растворяется с поглощением энергии, повышение температуры должно приводить к увеличению его растворимости. Если же, однако, энергия гидратации достаточно велика, чтобы образование раствора сопровождалось выделением энергии, растворимость с ростом температуры понижается. Это происходит, например, при растворении в воде многих солей лития, магния, алюминия.
При растворении твёрдых тел в воде объём системы обычно изменяется незначительно. Поэтому растворимость веществ, находящихся в твёрдом состоянии, практически не зависит от давления.
Жидкости также могут растворяться в жидкостях. Некоторые из них неограниченно растворимы одна в другой, т.е. смешиваются друг с другом в любых пропорциях, как, например, спирт и вода, другие – взаимно растворяются лишь до известного предела. Так если взболтать диэтиловый эфир с водой, то образуется два слоя: верхний представляет собой насыщенный раствор воды в эфире, а нижний – насыщенный раствор эфира в воде. В большинстве подобных случаев с повышением температуры взаимная растворимость жидкостей увеличивается до тех пор, пока не будет достигнута температура, при которой обе жидкости смешиваются любых пропорциях.
Температура, при которой ограниченная взаимная растворимость жидкостей переходит в неограниченную, называется критической температурой растворения.
Как и в случае растворения твёрдых тел, взаимное растворение жидкостей обычно не сопровождается значительным изменением объёма. Поэтому взаимная растворимость жидкостей мало зависит от давления и заметно возрастает лишь при очень высоких давлениях (порядка тысяч атмосфер).
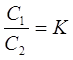 |
Здесь С1 и С2 – концентрации растворённого вещества в первом и втором растворителях; К – так называемый коэффициент распределения .
3. Способы выражения концентрации растворов: массовая – С%, молярная – См и нормальная (эквивалентная) – Сн .
· Массовая доля – отношение (обычно – процентное) массы растворённого вещества к массе раствора. Например, 15% (масс.) водный раствор хлорида натрия – это такой раствор в 100 единицах массы которого содержится 15 единиц массы NaCl и 85 единиц массы воды.
· Молярная концентрация, или молярность – отношение количества растворённого вещества к объёму раствора. Обычно молярность обозначается СМ или (после численного значения молярности) М. Так, 2М h3 SO4 означает раствор, в каждом литре которого содержится 2 моля серной кислоты, т.е. СМ =2моль/л.
· Эквивалентная, или нормальная концентрация – отношение числа эквивалентов растворённого вещества к объёму раствора. Концентрация, выраженная этим способом, обозначается СН или (после численного значения нормальности) буквой н. Так 2н h3 SO4 означает раствор, в каждом литре которого содержится 2 эквивалента серной кислоты, т.е. СН (1/2 h3 SO4 ) =2моль/л.
4. Растворы электролитов. Электролитическая диссоциация кислот, оснований, солей. Ступенчатая диссоциация.
Водные растворы солей, кислот и оснований обладают особенностью – они проводят электрический ток. При этом большинство твёрдых солей и оснований в безводном состоянии, а также безводные кислоты обладают очень слабой электрической проводимостью: плохо проводит электрический ток и вода. Очевидно что при образовании растворов подобные вещества претерпевают какие-то изменения, обуславливающие возникновение высокой электрической проводимости. Эти изменения заключаются в диссоциации соответствующих веществ на ионы, которые и служат переносчиками электрического тока.
Вещества проводящие электрический ток своими ионами, называются электролитами. При растворении в воде и в ряде неводных растворителей свойства электролитов проявляют соли, кислоты и основания. Электролитами являются также многие расплавленные соли, оксиды и гидроксиды, некоторые соли и оксиды в твёрдом состоянии.
При диссоциации любой кислоты образуются ионы водорода. Поэтому все свойства, которые являются общими для водных растворов кислот, объясняются присутствием гидратированных ионов водорода. Это они вызывают красный цвет лакмуса, сообщают кислотам кислый вкус и т.д. С устранением ионов водорода, например при нейтрализации, исчезают и кислотные свойства. Поэтому теория электролитической диссоциации определяет кислоты как электролиты, диссоциирующие в растворах с образованием ионов водорода. У сильных кислот, диссоциирующих нацело, свойства кислот проявляются в большей степени, у слабых в меньшей. Чем лучше кислота диссоциирует, тем она сильнее.
Поскольку общим для всех растворов оснований является присутствие в них гидроксид-ионов, то ясно, что носителем основных свойств является гидроксид-ион. Поэтому с точки зрения теории электролитической диссоциации основания – это электролиты, диссоциирующие в растворах с отщеплением гидроксид-ионов.
Сила оснований, как и сила кислот, зависит от величины константы диссоциации.Чем больше константа диссоциации данного основания, тем оно сильнее.
Соли можно определить как электролиты, которые при растворении в воде диссоциируют, отщепляя положительные ионы, отличные от ионов водорода, и отрицательные ионы, отличные от гидроксид-ионов. Таких ионов, которые были бы общими для водных растворов всех солей, нет; поэтому соли и не обладают общими свойствами. Как правило, соли хорошо диссоциируют, и тем лучше, чем меньше заряды ионов, образующих соль.
При растворении кислых солей в растворе образуются катионы металла, сложные анионы кислотного остатка, а также ионы, являющиеся продуктами диссоциации этого сложного кислотного остатка, в том числе ионы Н+ .
При диссоциации основных солей образуются анионы кислоты и сложные катионы, состоящие из металла и гидроксогрупп. Эти сложные катионы также способны к диссоциации. Поэтому в растворе основной соли присутствуют ионы ОН- .
К равновесию, которое устанавливается в растворе слабого электролита между молекулами и ионами, можно применить законы химического равновесия. Константа равновесия, отвечающая диссоциации слабого электролита, называется константой диссоциации. Величина К зависит от природы электролита и растворителя, а также от температуры, но не зависит от С раствора. Она характеризует способность данной кислоты или данного основания распадаться на ионы: чем выше К, тем легче электролит диссоциирует.
Многоосновные кислоты, а также основания двух- и более валентных металлов диссоциируют ступенчато. В растворах этих веществ устанавливаются сложные равновесия, в которых участвуют ионы различного заряда.
Первое равновесие – диссоциация по первой ступени – характеризуется константой диссоциации, обозначаемой К1 , а второе — диссоциация по второй ступени – константой диссоциации К2 . ВеличиныК, К1 иК2 связаны друг с другом соотношением
К= К1 К2
При ступенчатой диссоциации веществ распад по последующей ступени всегда происходит в меньшей степени, чем по предыдущей. Соблюдается неравенство:
К1 >К2 >К3 …
Это объясняется тем, что энергия, которую нужно затратить для отрыва иона, минимальна при отрыве его от нейтральной молекулы и становится больше при диссоциации по каждой следующей ступени.
5. Классификация электролитов. Степень диссоциации. Сильные и слабые электролиты.
Если бы электролиты полностью диссоциировали на ионы, то осмотическое давление (и другие пропорциональные ему величины) всегда было бы в целое число раз больше значений, наблюдаемых в растворах неэлектролитов. Но ещё Вант-Гофф установил, что коэффициент i выражается дробными числами, которые с разбавлением раствора возрастают, приближаясь к целым числам.
Аррениус объяснил этот факт тем, что лишь часть электролита диссоциирует в растворе на ионы, и ввёл понятие степени диссоциации. Степенью диссоциации электролита называется отношение числа его молекул, распавшихся в данном растворе на ионы, к общему числу его молекул в растворе.
Позже было установлено что электролиты можно разделить на две группы: сильные и слабые электролиты. Сильные электролиты в водных растворах диссоциированны практически нацело. Понятие степени диссоциации к ним по существу неприменимо, а отклонение изотонического коэффициента i от целочисленных значений объясняется другими причинами. Слабые электролиты в водных растворах диссоциируют только частично. Поэтому число ионов в растворах сильных электролитов больше, чем в растворах слабых той же концентрации. И если в растворах слабых электролитов С ионов мала, расстояние между ними велики и взаимодействие ионов друг с другом незначительно, то в не очень разбавленных растворах сильных электролитов среднее расстояние между ионами вследствие значительной концентрации сравнительно мало. В таких растворах ионы не вполне свободны, движение их стеснено взаимным притяжением друг к другу. Благодаря этому притяжению каждый ион как бы окружен шарообразным роем противоположно заряженных ионов, получившим название «ионной атмосферы».
К сильным электролитам принадлежат все соли; из важнейших кислот и оснований к ним относятся HNO3, h3 SO4, HClO4, HCl, HBr, HI, KOH, NaOH, Ba(OH)2, и Ca(OH)2 .
К слабым электролитам относятся большинство органических кислот, а из важнейших неорганических соединений к ним принадлежат h3 CO3, h3 S, HCN, h3 SiO3 и Nh5 OH.
Степень диссоциации принято обозначать греческой буквой a и выражать либо в долях единицы, либо в процентах.
6. Реакции обмена в растворах электролитов и условия их протекания. Ионные уравнения.
 При нейтрализации любой сильной кислоты любым сильным основанием на каждый моль образующейся воды выделяется около 57,6 кДж теплоты. Это говорит о том, что подобные реакции сводятся к одному процессу. Если перепишем уравнение, записывая сильные электролиты в ионной форме, поскольку они существуют в растворе в виде ионов, а слабые – в молекулярной, поскольку они находятся в растворе преимущественно в виде молекул.
При нейтрализации любой сильной кислоты любым сильным основанием на каждый моль образующейся воды выделяется около 57,6 кДж теплоты. Это говорит о том, что подобные реакции сводятся к одному процессу. Если перепишем уравнение, записывая сильные электролиты в ионной форме, поскольку они существуют в растворе в виде ионов, а слабые – в молекулярной, поскольку они находятся в растворе преимущественно в виде молекул.
 |
Таким образом, реакции нейтрализации любой сильной кислоты любым сильным основанием сводится к одному и тому же процессу – к образованию молекул воды из ионов водорода и гидроксид-ионов. Ясно, что тепловые эффекты этих реакций тоже должны быть одинаковы.
Строго говоря, реакция образования воды из ионов обратима, что можно выразить уравнением:
 |
 При смешивании раствора какой-либо соли серебра с соляной кислотой или с раствором любой её соли всегда образуется характерный белый творожистый осадок хлорида серебра:
При смешивании раствора какой-либо соли серебра с соляной кислотой или с раствором любой её соли всегда образуется характерный белый творожистый осадок хлорида серебра:
 Подобные реакции также сводятся к одному процессу. Для того чтобы получить его ионно-молекулярное уравнение, перепишем уравнение первой реакции, записывая сильные электролиты в ионной форме а вещество, находящееся в осадке, в молекулярной:
Подобные реакции также сводятся к одному процессу. Для того чтобы получить его ионно-молекулярное уравнение, перепишем уравнение первой реакции, записывая сильные электролиты в ионной форме а вещество, находящееся в осадке, в молекулярной:
 Как видно, ионы Н+ и NО3- не претерпевают изменений в ходе реакции. Поэтому исключим их и перепишем уравнение ещё раз:
Как видно, ионы Н+ и NО3- не претерпевают изменений в ходе реакции. Поэтому исключим их и перепишем уравнение ещё раз:
Это и есть ионно-молекулярное уравнение рассматриваемого процесса.
 |
Однако, вследствие малой растворимости хлорида серебра, это равновесие очень сильно смещено вправо. Поэтому можно считать, что реакция образования AgCl из ионов практически доходит до конца.
Для составления ионно-молекулярных уравнений необходимо знать, какие соли растворимы в воде и какие практически нерастворимы.
Ионно-молекулярные уравнения помогают понять особенности протекания реакций между электролитами.
7. Ионное произведение воды. Водородный показатель рН растворов. Индикаторы.
Чистая вода очень плохо проводит электрический ток, но всё же обладает измеримой электрической проводимостью, которая объясняется небольшой диссоциацией воды на ионы водорода и гидроксид-ионы. Для воды и разбавленных водных растворов при неизменной температуре произведение концентраций ионов водорода и гидросид-ионов есть величина постоянная. Эта постоянная величина называется ионным произведением воды. Растворы, в которых концентрация ионов водорода и гидроксид-ионов одинаковы, называются нейтральными растворами.
Если концентрация ионов водорода в водном растворе известна, то тем самым определена и концентрация гидроксид-ионов. Поэтому как степень кислотности, так и степень щёлочности раствора можно количественно охарактеризовать концентрацией ионов водорода. Кислотность и щелочность раствора можно выразить другим, более удобным способом: вместо концентрации ионов водорода указывают её десятичный логарифм, взятый с обратным знаком. Эта величина называется водородным показателем и обозначается через рН :
рН =-lg [H+ ]
Для измерения рН существуют различные методы. Приближённо реакцию раствора можно определить с помощью специальных реактивов, называемых индикаторами, окраска которых меняется в зависимости от концентрации ионов водорода. Наиболее распространённый индикатор – метиловый оранжевый, метиловый красный, фенолфтолеин.
Литература:
1. Глинка Н.Л.
Общая химия: — Л.: Химия 1985.-704с.
Под ред. В.А. Рабиновича.
2. Фролов В.В.
Химия: — М.: Высш. Шк., 1986.- 543с.
www.ronl.ru
В.А. Волков
По степени раздробленности (дисперсности) системы делятся на следующие классы: грубодисперсные, размер частиц в которых более 10-5 м; тонкодисперсные (микрогетерогенные) с размером частиц от 10-5 до 10-7 м; коллоидно-дисперсные (ультрамикро-гетерогенные) с частицами размером от 10-7 до 10-9м. Если фиксировать внимание на двух основных компонентах дисперсных систем, то одному из них следует приписать роль дисперсионной среды, а другому — роль дисперсной фазы. В этом случае все дисперсные системы можно классифицировать по агрегатным состояниям фаз.
Эта классификация была предложена Оствальдом и широко используется до настоящего времени. Недостатком классификации следует считать невозможность отнесения дисперсных систем, приготовленных с твердой или жидкой дисперсной фазой, к какому-либо классу, если размер частиц составляет несколько нанометров. Пример такой классификации приведен в табл. 1.
Академик П.А. Ребиндер предложил более совершенную классификацию дисперсных систем по агрегатным состояниям фаз. Он разделил все дисперсные системы на два класса: свободнодисперсные системы и сплошные (или связнодисперсные) системы (табл. 2 и 3). В свободнодисперсных системах дисперсная фаза не образует сплошных жестких структур (сеток, ферм или каркасов). Эти системы называют золями. В сплошных (связнодисперсных) системах частицы дисперсной фазы образуют жесткие пространственные структуры (сетки, каркасы, фермы). Такие системы оказывают сопротивление деформации сдвига. Их называют гелями.
Дисперсная система по классификации Ребиндера обозначается дробью, в которой дисперсная фаза ставится в числителе, а дисперсионная среда – в знаменателе. Например: Т1/Ж2. Индекс 1 обозначает дисперсную фазу, а индекс 2 – дисперсионную среду.
Коллоидная химия изучает свойства как тонко-, так и грубодисперсных систем; как свободно-, так и связнодисперсных систем.
Включение в одну науку столь большого количества разнообразных систем, различных как по природе фаз, так и по размерам частиц и агрегатному состоянию фаз, основано на том, что все они обладают общими свойствами — гетерогенностью и принципиальной термодинамической неустойчивостью. Центральное место в коллоидной химии занимают ультрамикрогетерогенные системы со свободными частицами. Это — так называемые, коллоидные системы.
Таблица 1
Классификация дисперсных систем по агрегатным состояниям фаз.
| Дисперсион-ная среда | Дисперс-ная фаза | Примеры дисперсных систем |
| Твердая | Твердая | Рубиновое стекло; пигментированные волокна; сплавы; рисунок на ткани, нанесенный методом пигментной печати |
| Твердая | Жидкая | Жемчуг, вода в граните, вода в бетоне, остаточный мономер в полимерно-мономерных частицах |
| Твердая | Газо- образная | Газовые включения в различных твердых телах: пенобетоны, замороженные пены, пемза, вулканическая лава, полимерные пены, пенополиуретан |
| Жидкая | Твердая | Суспензии, краски, пасты, золи, латексы |
| Жидкая | Жидкая | Эмульсии: молоко, нефть, сливочное масло, маргарин, замасливатели волокон |
| Жидкая | Газо- образная | Пены, в том числе для пожаротушения и пенных технологий замасливания волокон, беления и колорирования текстильных материалов |
| Газообразная | Твердая | Дымы, космическая пыль, аэрозоли |
| Газообразная | Жидкая | Туманы, газы в момент сжижения |
| Газообразная | Газо- образная | Коллоидная система не образуется |
Коллоидные системы необычайно лабильны, т.е. неустойчивы. Для многих из них достаточно прибавления ничтожного количества электролита, чтобы вызвать выпадение осадка. Причина столь легкого изменения состояния коллоидных систем связана с непостоянством степени их дисперсности. Различают два вида устойчивости любой раздробленной системы — кинетическую и агрегативную.
Таблица 2
Примеры свободнодисперсных систем
| 1. Дисперсные системы в газах | 2. Дисперсные системы в жидкостях |
Коллоидная дисперсность Т1/Г2 – пыль в верхних слоях атмосферы, аэрозоли. | Коллоидная дисперсность Т1/Ж2 – лиозоли, дисперсные красители в воде, латексы синтетических полимеров. |
| Грубая дисперсность | Грубая дисперсность |
Т1/Г2 – дымы Ж1/Г2 – туманы | Т1/Ж2 – суспензии Ж1/Ж2 – жидкие эмульсии Г1/Ж2 – газовые эмульсии |
| 3. Дисперсные системы в твердых телах | |
Т1/Т2 – твердые золи, например, золь золота в стекле, пигментированные волокна, наполненные полимеры |
В основу этой классификации положено агрегатное состояние фаз дисперсной системы.
Понятие агрегативной устойчивости, которое впервые ввел Н.П. Песков, подразумевает отсутствие агрегирования, т.е. снижения степени дисперсности коллоидной системы при хранении. Для определения кинетической устойчивости необходимо изучать условия выделения диспергированных частиц в гравитационном или центробежном поле. Скорость подобного выделения зависит от интенсивности броуновского движения частиц, т.е. от степени дисперсности системы и разности плотности дисперсионной среды и дисперсной фазы, а также от вязкости среды.
Таблица 3
Связнодисперсные системы
| 1. Системы с жидкой поверхностью раздела фаз | 2. Системы с твердой поверхностью раздела фаз |
Г1/Ж2 – пены Ж1/Ж2 – пенообразные эмульсии | Г1/Т2 — пористые тела, натуральные волокна, пемза, губка, древесные угли Ж1/Т2 – влага в граните Т1/Т2 – взаимопроникающие сетки полимеров |
Если хотят определить агрегативную устойчивость системы, то исследуют условия постоянства (или напротив — непостоянства) степени дисперсности системы. Одно из самых резких и характерных отличий коллоидной системы как от истинного раствора, так и от грубодисперсных систем состоит в том, что их степень дисперсности является чрезвычайно непостоянной величиной и может изменяться в зависимости от самых разнообразных причин.
В основе этой классификации лежит агрегатное состояние поверхности раздела фаз.
На основании изложенного выше дадим определение коллоидным системам.
Коллоидными системами называют двух-или многофазные системы, в которых одна фаза находится в виде отдельных мелких частиц, распределенных в другой фазе. Такие ультрамикрогетерогенные системы с определенной (коллоидной) дисперсностью проявляют способность к интенсивному броуновскому движению и обладают высокой кинетической устойчивостью.
Имея высокоразвитую поверхность раздела фаз и, следовательно, громадный избыток свободной поверхностной энергии, эти системы являются принципиально термодинамически неустойчивыми, что выражается в агрегации частиц, т.е. в отсутствии агрегативной устойчивости. Однако этими свойствами не исчерпываются все особенности, которыми коллоидные системы отличаются от других систем. Так, например, на первый взгляд кажется непонятным, почему коллоидные частицы, совершая энергичные движения и сталкиваясь между собой, не всегда слипаются в более крупные агрегаты и не выпадают в осадок, как этого следовало бы ожидать на основании второго закона термодинамики, так как при этом уменьшалась бы общая поверхность, а с ней и свободная энергия.
Оказывается, во многих случаях устойчивость таких систем связана с наличием слоя стабилизатора на поверхности коллоидных частиц. Таким образом, необходимым условием создания устойчивых коллоидных систем является присутствие третьего компонента — стабилизатора. Стабилизаторами коллоидных систем могут быть электролиты или некоторые другие вещества, не имеющие электролитной природы, например высокомолекулярные соединения (ВМС) или поверхностно-активные вещества (ПАВ). Механизм стабилизации электролитами и неэлектролитами существенно различен.
Влияние электролитов на устойчивость коллоидных систем носит сложный характер. В одних случаях ничтожные добавки электролита способны привести к нарушению устойчивости системы. В других — введение электролита способствует увеличению стабильности.
Образование адсорбционных слоев таких стабилизаторов, как ПАВ, приобретает особенно большое значение при наличии двухмерных структур, обладающих повышенными структурно-механическими свойствами. Во многих случаях стабилизация достигается при покрытии монослоем всего 40-60 % поверхности коллоидных частиц, когда защитный слой имеет прерывистый характер (в форме островков). Максимальная устойчивость достигается, естественно, при образовании полностью насыщенного мономолекулярного слоя. Структурно-механические свойства адсорбционных слоев в значительной мере определяют поведение коллоидных систем. Эти слои могут быть образованы или изменены небольшими количествами каких-либо растворенных веществ, поэтому создается возможность регулирования ряда свойств коллоидных систем, что широко используется в различных практических приложениях.
Коллоидные системы, состоящие из частиц диспергированного вещества, способных свободно перемещаться в жидкой дисперсионной среде совместно с адсорбированными на их поверхности молекулами или ионами третьего компонента (стабилизатора), называют лиозолями, а сами частицы, обладающие сложным строением — мицеллами.
По характеру взаимодействия коллоидных частиц с дисперсионной средой лиозоли могут быть разделены на лиофильные и лиофобные. Впервые эта классификация была предложена немецким ученым-коллоидником Фрейндлихом. Он разделил все системы на два класса – лиофильные и лиофобные. В соответствии с представлениями, развитыми Фрейндлихом, лиофобными называют системы, частицы дисперсной фазы которых не взаимодействуют с дисперсионной средой, не сольватируются и не растворяются в ней. Лиофильные- это системы, частицы дисперсной фазы которых интенсивно взаимодействуют с дисперсионной средой.
К лиофобным системам относятся золи драгоценных металлов, золи металлоидов (серы, селена, теллура), дисперсии полимеров в воде (например, полистирола, фторолона), золи сульфидов мышьяка, сурьмы, кадмия, ртути, золи гидроксидов железа, алюминия и т.д. Эти системы характеризуются, так называемой, кинетической устойчивостью и агрегативной неустойчивостью и требуют стабилизации. К лиофильным коллоидным системам Фрейндлих отнес растворы, образующиеся при растворении природных или синтетических ВМС. Таковы растворы белков, крахмала, пектинов, камедей, эфиров целлюлозы и разнообразных смол, как природных так и синтетических.
Таким образом, растворы ВМС рассматривались ранее как лиофильные коллоидные системы. Они считались двухфазными дисперсными системами и таким образом сущность классификации Фрейндлиха сводилась к молекулярным взаимодействиям между дисперсной фазой и дисперсионной средой. Именно на этом основании проводилось разделение на лиофильные и лиофобные системы. Лиофильные системы считались двух- или многофазными, термодинамически неустойчивыми, неподчиняющимися правилу фаз Гиббса. Но такое представление оказалось неправильным. На самом деле в настоящее время достоверно установлено, что растворы ВМС — это истинные растворы, т.е. однофазные системы, гомогенные, термодинамически устойчивые и подчиняющиеся правилу фаз Гиббса. Считалось, что обратимость — это характерное свойство лиофильных коллоидных систем, но это не так, потому что в данном случае растворы ВМС не являются дисперсными системами.
В связи с этим академик В.А. Каргин еще в 1948 г. обратил внимание на то, что классификация Фрейндлиха совершенно неверна и даже более того — вредна.
Чтобы не менять смысла этих терминов, П.А. Ребиндер предложил оформить понятия лиофильные и лиофобные коллоидные системы. Дисперсные много-или двухфазные системы он разделил на два класса, исходя из величины удельной межфазовой энергии (поверхностного натяжения).
К лиофобным системам были отнесены дисперсные системы с достаточно высоким межфазовым натяжением (s12), большим некоторого граничного значения sm:
s12 > sm. (1)
Эти системы характеризуются большой межфазовой свободной энергией, поэтому граница раздела фаз выражена резко: система является агрегативно неустойчивой и требует введения стабилизатора. Дисперсность таких систем является произвольной.
Лиофильные системы – это двухфазные коллоидные системы с низкой, хотя и положительной межфазовой свободной энергией, меньшей или равной граничному значению,
s12 ≤ sm. (2)
Это системы с очень малой межфазовой энергией, они термодинамически устойчивы и образуются самопроизвольно. Дисперсность их вполне определенна и находится в коллоидной области.
Тот факт, что дисперсные системы классифицируются по величине свободной поверхностной энергии показывает, что коллоидные явления тесно связаны со свойствами поверхности раздела фаз.
К лиофильным системам относят:
1) так называемые критические эмульсии, образующиеся в результате снижения поверхностного натяжения при нагревании до температуры, близкой к температуре неограниченного смешения, или в результате прибавления очень больших количеств ПАВ;
2) ассоциативные коллоидные системы, образуемые в водной среде веществами типа мыл, некоторых красителей и дубителей, а в неводной среде некоторыми ПАВ. Такие вещества в разбавленных растворах находятся в молекулярном состоянии, при увеличении концентрации происходит агрегация молекул с образованием частиц коллоидного размера, т.е. образуются мицеллы. Концентрацию вещества в растворе, при которой происходит переход от истинного раствора к коллоидному, принято называть критической концентрацией мицеллообразования (ККМ).
Классификацию дисперсных систем можно проводитьпо удельной поверхности и пористости дисперсной фазы.
В тех процессах, в которых участвуют две соприкасающиеся фазы, большое значение имеют свойства поверхности раздела, или пограничного слоя, отделяющего одну фазу от другой. Молекулы, составляющие такие слои, обладают особыми свойствами. Если рассматривать монолитную фазу, то числом молекул, образующих поверхностный слой, можно пренебречь по сравнению с огромным количеством молекул в объеме тела. Можно считать, что запас энергии системы пропорционален массе, содержащейся в объеме тела.
При измельчении сплошного тела число молекул в поверхностном слое возрастает и достигает максимального значения в коллоидно-дисперсных системах. Поэтому процессы, протекающие в дисперсных системах, обусловлены свойствами поверхностных слоев на границе раздела. Образование пен, эмульсий, туманов, процессы флотации, смачивания и диспергирования, сорбционная техника и многие-многие другие основаны на свойствах межфазовых поверхностей в дисперсных системах.
Удельной поверхностью называют отношение поверхности тела к его объему или массе:
Ауд= А/V или Ауд =А/Vr, (3)
где Ауд, А – удельная и суммарная поверхность, соответственно; r – плотность вещества, V – объем тела.
Для кубических частиц
Ауд = 6а2/а3= 6а-1
или
Ауд = 6a2/а3r = 6/ar (м2/кг). (4)
Для сферических частиц
Ауд = 4 r2/(4/3 r3) (м-1),
т.е.
Ауд = 3/r (м-1),
или
Ауд = 3/rr (м2/кг). (5)
Если взять кубик вещества, три его стороны разделить на 10 частей и провести плоскости в трех направлениях, то получим более мелкие кубики. Такой процесс можно рассматривать как моделирование процесса диспергирования. Изменение удельной поверхности в процессе диспергирования показано в табл. 4.
Таблица 4
Зависимость удельной поверхности от дисперсности
| Длина стороны куба а, см | Число кубов | Суммарная поверхность, м2 | Удельная поверхность, см-1 |
1 10-1 10-2 10-3 10-4 10-5 10-6 10-7 | 1 103 106 109 1012 1015 1018 1021 | 6·10-4 6·10-3 6·10-1 6 6·101 6·102 6·103 6·104 | 6 6·101 6·102 6·103 6·104 6·105 6·106 6·107 |
В текстильных коллоидных системах большую роль играют волокна, нити и пленки. Удельную поверхность таких систем можно рассчитать по формулам:
для пленки
Ауд = 2l2/l2а = 2/а, (6)
где а- толщина пленки, l- ее ширина и длина;
для цилиндра (волокна, нити)
Ауд= 2lr /r2l = 2/r, (7)
где r — радиус цилиндра, l- его длина.
Связнодисперсные системы — пористые тела — наряду с внешней удельной поверхностью можно характеризовать размером (радиусом) пор, их объемом и внутренней удельной поверхностью. Удобную классификацию пор по размерам предложил М.М. Дубинин. В соответствии с этой классификацией все пористые тела можно разделить на три класса (в зависимости от адсорбционных свойств): микропористые тела с радиусом пор 2·10-9 м, мезопористые (переходнопористые) — (2/50) ·10-9м, макропористые 50·10-9 м.
Микропористые тела в последнее время разделяют на ультра- и супермикропористые. Такая классификация весьма приближенно отражает весь спектр возможных размеров пор ( от макропор через мезопоры и микропоры до субатомных «пор» в виде промежутков между макрокристаллами в полимерах или точечных дефектов в кристаллах). В этой связи следует отметить, что любая классификация не может полностью охватить все многообразие дисперсных систем, существующих в природе и технологической практике.
www.ronl.ru