Контрольная работа по химии в 9 классе за 1 четверть
Контрольная работа по химии в 9 классе за 1 четверть.
1 вариант
Определите степени окисления элементов и назовите следующие соединения:
FeCl3. K2Cr2O7. h3SO4. Na2O. P2O3. Li2O. h3S.
Определить тип реакции и вычислить сколько сгорело угля, если при этом выделилось 33520 кДж теплоты: С(тв) + О2(г) –СО (г)+ 402,24 кДж
Расставить коэффициенты методом электронного баланса, указать окислитель и восстановитель: Си + HNO3 –Cu(NO3)2 + h3O + NO2
Реакция протекает по уравнению А+В=2С. Начальная концентрация вещества А равна 4 моль/л, а через 10с – 3 моль/л. Вычислите среднюю скорость реакции.
Реакция, схема которой: h3SO4 + BaCl2—BaSO4 (ос) + 2HCl , записать в молекулярном и сокращенно ионном виде.
2 вариант
1. Определите степени окисления элементов и назовите следующие соединения:
Fe2О3. NaNO3. h4СO3. NaCl. P2O5. CaO. KOH.
Определить тип реакции и рассчитайте, сколько теплоты необходимо затратить на разложение 360 г воды 2Н2О (ж) –2Н2 (г)+ О2 (г) — 484 кДж
Расставить коэффициенты методом электронного баланса, указать окислитель и восстановитель: Са + h3SO4 –CаSO4 + h3O + SO2
Реакция протекает по уравнению А+В=2С. Начальная концентрация вещества А равна 0,8 моль/л, а через 20с – 0,4 моль/л. Вычислите среднюю скорость реакции.
Реакция, схема которой: СаО + Н2СО3—СaСO3 (ос) + h3О, записать в молекулярном и сокращенно ионном виде.
Полугодовая контрольная работа по химии в 9 классе(базовый уровень)
Контрольная работа по химии за первое полугодие в 9 классе
Вариант 1
-
Вещество, которое в водном растворе диссоцирует на ионы:
- (NH4)2SO4;
- Сa3(PO4)2;
- CaCO3;
- CaSiO3;
- Уравнению химической реакции
H2SO4 + 2NaOH → Na2SO4 + 2H2O
соответствует сокращенное ионное уравнение:
- H+ + OH — = H2O
- H2SO4 = H+ + SO42-
- HSO4— = H+ + SO42-
-
Степень окисления серы в сернистой кислоте;
- -2;
- +6;
- +4;
-
0.

-
Сера и кислород по строению атома сходны:
- зарядом ядра;
- количеством заполненных энергетических уровней;
- номером группы;
- не завершенностью внешнего энергетического уровня.
-
Массовая доля серы в серной кислоте равна:
- 16,33%;
- 32,65 %;
- 39,02 %;
- 98%.
-
. рН-среда не бывает:
- кислая;
- амфотерная;
- щелочная;
-
нейтральная.

-
Разбавленная серная кислота не взаимодействует::
- NaOH;
- Mg;
- BaCl2
- Hg:.
В1. В цепи превращения H2S => S => A => SO3 => Na2SO4.
Вещество А ___________. Напишите уравнение реакции получения вещества А
В2. Осуществите реакцию взаимодействия соляной кислоты с гидроксидом натрия . Запишите полное и сокращенное ионные уравнения.
В3. При взаимодействии цинка с концентрированной серной кислотой получится ______________________________.
С1. Какой объем оксид серы (VI) получили из оксида серы (IV) объемом 20 л, содержащего 20% примесей?
С2. Используя метод электронного баланса, в уравнении реакции
Используя метод электронного баланса, в уравнении реакции
H2SO4 (конц)+ С => SO2 + CO2 + H2O
Расставьте коэффициенты и укажите окислитель и восстановитель.
Контрольная работа по химии за первое полугодие в 9 классе
Вариант 2
-
Вещество, которое в водном растворе не диссоциирует на ионы, — это:
- NaNO3;
- KI;
- NH4NO3;
- BaSO4;
- Сокращенное ионное уравнение
Al+3 + 3OH— = Al(OH)3↓
соответствует уравнению химической реакции
- Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O;
- Al(NO3)3 + 3KOH = Al(OH)3 + 3KNO3O
- Al(OH)3 + 3HCl = AlCl3 + 3H2O;
- AlCl3 + 3AgNO3 = AgCl + Al(NO3)3;
-
Степень окисления серы в серной кислоте равна;
- +5;
- 0;
- -3;
- -4;
-
Общая характеристика не металлов:
- Имеют мало электронов на последнем уровне;
- Имеют постоянную валентность;
- Чаще являются окислителями;
-
Чаще являются восстановителями.

-
Массовая доля азота в аммиаке равна
- 33%
- 16,5%
- 8,2%
- 49%
-
Формула сульфита кальция:
- СaSO4;
- CaSO3;
- CaS2O3;.
-
Разбавленная серная кислота не взаимодействует::
- Na;
- KOH;
- Cu,
- BaCl2.
В1.
Вещество А ___________. Напишите реакцию получения вещества А
В2. Осуществите реакцию взаимодействия соляной кислоты с нитратом серебра. Запишите полное и сокращенное ионные уравнения.
В3. При взаимодействии гидроксида меди (II) с серной кислотой получится ______________________________.
С2. Какой объем воздуха потребуется на получение оксида серы (VI) объемом 10 л из оксида серы (IV).
С2. Используя метод электронного баланса, в уравнении реакции
SO2+ I2 + H2O=> H2SO4 + HI
Расставьте коэффициенты методом электронного баланса и укажите окислитель и восстановитель.
Административная работа по химии за 1 полугодие 9 класс | Контрольные работы по Химии
Рассмотрено на МО______
Административная работа по химии за 1 полугодие
9 класс
1 вариант
1. Как изменяются окислительные свойства в ряду элементов:
F→ Сl→ Br→ I?
a) ослабевают
b) не изменяются
c) усиливаются
d) сначала усиливаются, а потом ослабеваю
2. Укажите электронную формулу атома серы
a) 1S22S22P63S23P4
b) 1S22S22P63S23P0
c) 1S22S22P63S23P6
d) 1S22S22P63S03P0
3. Свойства какого вещества описаны в тексте: «… — газ с характерным запахом грозы, светло-фиолетового цвета, разрушает органические вещества. Окисляет металлы, в том числе золото и платину, производит белящее и дезинфицирующее действие»
a) пары йода
b) кислород
c) озон
d) азот
4. Укажите вид химической связи в молекуле хлороводорода?
Укажите вид химической связи в молекуле хлороводорода?
a) ионная
b) ковалентная полярная
c) ковалентная неполярная
d) металлическая
5. Вещество, которое в водном растворе диссоциирует на ионы:
a) (Nh5)2SO4
b) Сa3(PO4)2
c) CaCO3
d) CaSiO3
6.Уравнению химической реакции
h3SO4 + 2NaOH → Na2SO4 + 2h3O соответствует сокращенное ионное уравнение:
a. H+ + OH — = h3O
b. NAOH = Na+ + OH-
c. h3SO4 = H+ + SO42-
d. HSO4- = H+ + SO42-
7. Степень окисления серы в сернистой кислоте;
a. -2
b. +6
c. +4
d. 0.
8. Сера и кислород по строению атома сходны:
a. зарядом ядра
b. количеством заполненных энергетических уровней
c. количеством электронов на внешнем энергетическом уровне
d. не завершенностью внешнего энергетического уровня.
9. Массовая доля серы в серной кислоте равна:
a. 16,33%
b. 32,65 %
c. 39,02 %
d. 98%
10. Формула нитрита магния:
a.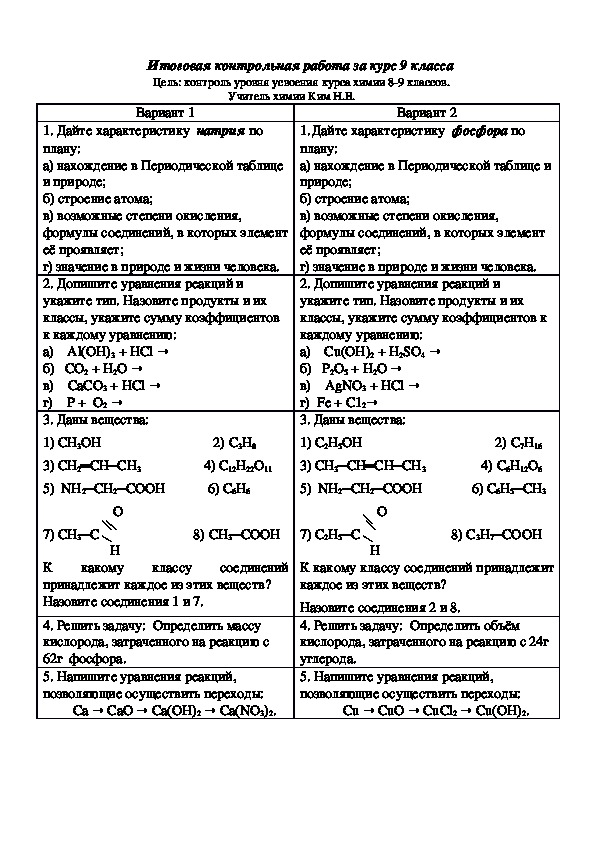 Mg(NO3)2
Mg(NO3)2
b. Mg(NO2)2
c. Mg3N2
d. Mn(NO3)2
11. Разбавленная серная кислота не взаимодействует
a. NaOH
b. Mg
c. BaCl2
d. Hg.
12. Степень окисления -3 азот проявляет в соединении
a. N2О3
b. HNO3
c. NF3
d. Nh5Cl
13. Аммиак не вступает во взаимодействие с:
a. кислородом
b. водородом
c. соляной кислотой
d. водой
14. Оксид серы (IV) способен реагировать с :
a. Н2О
b. СН4
c. Н3РО4
d. SO3.
15. Какие из элементов образуют простые вещества, молекулы которых двухатомны, выберите правильный ответ:
a) водород, азот, сера
b) водород, азот, кислород
c) кислород, медь, кальций
d) кислород,фтор,франций.
16. Какие из перечисленных групп элементов относятся к неметаллам:
a) K, O, S
b) Na, H, S
c) H, S, Cl
d) Li, S, F.
17. Определите массу 5 моль гидроксида Na.
a) 200г/моль
b) 100г
c) 200г
d) 345г
18. Определите, в какой из групп элементов они расположены в порядке повышения электроотрицательности:
Определите, в какой из групп элементов они расположены в порядке повышения электроотрицательности:
a) Li, S, F, O
b) Li, S, O, F
c) O, F, S, Li
d) H, S, Cl
19. Какие из нижеприведенных групп оксидов относятся к основным оксидам:
a) CaO, Na2O, Al2O3
b) ZnO, SO2, h3O
c) Li2O, BaO, CuO
d) CaO, Nh4, KOH.
20. Выберите формулу неэлектролита.
a) KCl
b) h3 SO4
c) C 6h22O6
d) h4PO4
Рассмотрено на МО______
Административная работа по химии за 1 полугодие
9 класс
2 вариант
1. Как изменяются восстановительные свойства в ряду элементов:
O→ S→ Se→T?
a) ослабевают
b) не изменяются
c) усиливаются
d) сначала усиливаются, а потом ослабевают
2. Укажите электронную формулу атома хлора
a) 1S22S22P5
b) 1S22S22P63S23P5
c) 1S22S22P63S23P6
d) 1S22S22P63S23P7
3. Свойства какого вещества описаны в тексте: «… — газ, не имеющий цвета, запаха, мало растворим в воде, при t= — 183° превращается в жидкость бледно-синего цвета, сильный окислитель, самый распространённый элемент в природе.
a) водород
b) кислород
c) озон
d) азот
4. Оксид серы (IV) способен реагировать с :
a. Н2О
b. СН4
c. Н3РО4
d. SO3.
5. Какой вид химической связи в молекуле хлорида алюминия?
a) ионная
b) ковалентная полярная
c) ковалентная неполярная
d) металлическая
6. Вещество, которое в водном растворе не диссоциирует на ионы, — это:
a) NaNO3
b) KI
c) Nh5NO3
d) BaSO4
7. Сокращенное ионное уравнение
Al+3 + 3OH- = Al(OH)3↓соответствует уравнению химической реакции
a. Al2O3 + 3h3SO4 = Al2(SO4)3 + 3h3O
b. Al(NO3)3 + 3KOH = Al(OH)3 + 3KNO3O
c. Al(OH)3 + 3HCl = AlCl3 + 3h3O
d. AlCl3 + 3AgNO3 = AgCl + Al(NO3)3
8. Степень окисления азота в азотной кислоте равна;
a. +5
b. 0
c. -3
d. -4
9. Сера и кислород по строению атома различаются:
a. зарядом ядра
b. количеством заполненных энергетических уровней
c. количеством электронов на внешнем энергетическом уровне
d. не завершенностью внешнего энергетического уровня.
не завершенностью внешнего энергетического уровня.
10. Массовая доля азота в нитрате натрия равна
a. 33%
b. 16,5%
c. 8,2%
d. 49%
11. Формула сульфита кальция:
a. СaSO4
b. CaS
c. CaSO3
d. CaS2O3
12. Азотная кислота не взаимодействует:
a. с оксидом углерода (IV)
b. с оксидом меди (II)
c. с карбонатом калия
d. с гидроксидом железа
13. Кислород проявляет положительную степень окисления в соединении:
a. SO2
b. CuO
c. OF2
d. h3O
14. Сероводород не взаимодействует:
a. с кислородом
b. с водородом
c. с хлоридом меди
d. с нитратом свинца
15. Оксид азота (IV) взаимодействует
a. с водой при наличии кислорода
b. с кислородом
c. с водородом
d. с серной кислотой
16. 1.Выберите формулу неэлектролита.
a) NaCl
b) Ch5
c) Na2SO4
d) HCl
17. В атомах элементов II группы главной подгруппы на последнем энергетическом уровне:
a) 1 электрон
b) 2 электрона
c) 3 электрона
d) 4 электрона
18. Выберите сокращенное ионное уравнение, отражающее взаимодействие карбоната магния с азотной кислотой.
Выберите сокращенное ионное уравнение, отражающее взаимодействие карбоната магния с азотной кислотой.
a) Mg2++ CO32-= MgCO3
b) CO32- +2H+= h3O+ CO2
c) MgCO3 +2H+= Mg2++ CO2 ↑ +h3O
d) (Nh5)3PO4 + 3 AgNO3 – Ag3PO4 + 3Nh5NO3
19. .Массовая доля кислорода больше в соединении:
a) h3O
b) Li2O
c) MgO
d) SO2
20. Атомы элементов, имеющие одинаковое число энергетических уровней, расположены:
a) в одной группе периодической системы;
b) в одном периоде периодической системы
c) в одной подгруппе периодической системы
d) В разныз подгруппах периодической системы
Рассмотрено на МО______
Административная работа по химии за 1 полугодие
9 класс
3 вариант
1. Укажите электронную формулу атома серы
a) 1S22S22P63S23P4
b) 1S22S22P63S23P0
c) 1S22S22P63S23P6
d) 1S22S22P63S03P0
2. Как изменяются окислительные свойства в ряду элементов:
F→ Сl→ Br→ I?
a) ослабевают
b) не изменяются
c) усиливаются
d) сначала усиливаются, а потом ослабеваю
3. Вещество, которое в водном растворе диссоциирует на ионы:
Вещество, которое в водном растворе диссоциирует на ионы:
a) (Nh5)2SO4
b) Сa3(PO4)2
c) CaCO3
d) CaSiO3
4. Свойства какого вещества описаны в тексте: «… — газ с характерным запахом грозы, светло-фиолетового цвета, разрушает органические вещества. Окисляет металлы, в том числе золото и платину, производит белящее и дезинфицирующее действие»
a) пары йода
b) кислород
c) озон
d) азот
5. Укажите вид химической связи в молекуле хлороводорода?
a) ионная
b) ковалентная полярная
c) ковалентная неполярная
d) металлическая
6.Уравнению химической реакции
h3SO4 + 2NaOH → Na2SO4 + 2h3O соответствует сокращенное ионное уравнение:
a) H+ + OH — = h3O
b) h3SO4 = H+ + SO42
c) NAOH = Na+ + OH-
d) HSO4- = H+ + SO42
7. Степень окисления серы в сернистой кислоте;
a. -2
b. +6
c. +4
d. 0.
8. Сера и кислород по строению атома сходны:
a. зарядом ядра
b. количеством заполненных энергетических уровней
c. количеством электронов на внешнем энергетическом уровне
количеством электронов на внешнем энергетическом уровне
d. не завершенностью внешнего энергетического уровня.
9. Аммиак не вступает во взаимодействие с:
a. кислородом
b. водородом
c. соляной кислотой
d. водой
10. Массовая доля серы в серной кислоте равна:
a. 16,33%
b. 32,65 %
c. 39,02 %
d. 98%
11. Разбавленная серная кислота не взаимодействует
a. NaOH
b. Mg
c. BaCl2
d. Hg.
12. Формула нитрита магния:
a. Mg(NO3)2
b. Mg(NO2)2
c. Mg3N2
d. Mn(NO3)2
13. Степень окисления -3 азот проявляет в соединении
a. N2О3
b. HNO3
c. NF3
d. Nh5Cl
14. Выберите формулу неэлектролита.
a) KCl
b) h3 SO4
c) C 6h22O6
d) h4PO4
15. Оксид серы (IV) способен реагировать с :
a. Н2О
b. СН4
c. Н3РО4
d. SO3.
16. Какие из перечисленных групп элементов относятся к неметаллам:
a) K, O, S
b) Na, H, S
c) H, S, Cl
d) Li, S, F.
17. Какие из элементов образуют простые вещества, молекулы которых двухатомны, выберите правильный ответ:
a) водород, азот, сера
b) водород, азот, кислород
c) кислород, медь, кальций
d) кислород,фтор,франций
18. Определите массу 5 моль гидроксида Na.
a) 800г
b) 100г
c) 200г
d) 345г
19. Определите, в какой из групп элементов они расположены в порядке повышения электроотрицательности:
a) Li, S, F, O
b) Li, S, O, F
c) O, F, S, Li
d) H, S, Cl
20. Какие из нижеприведенных групп оксидов относятся к основным оксидам:
a) CaO, Na2O, Al2O3
b) ZnO, SO2, h3O
c) Li2O, BaO, CuO
d) CaO, Nh4, KOH.
Рассмотрено на МО______
Административная работа по химии за 1 полугодие
9 класс
4 вариант
1. Оксид серы (IV) способен реагировать с :
a. Н2О
b. СН4
c. Н3РО4
d. SO3.
2. Какой вид химической связи в молекуле хлорида алюминия?
a) ионная
b) ковалентная полярная
c) ковалентная неполярная
d) металлическая
3. Вещество, которое в водном растворе не диссоциирует на ионы, — это:
Вещество, которое в водном растворе не диссоциирует на ионы, — это:
a) NaNO3
b) KI
c) Nh5NO3
d) BaSO4
4. Свойства какого вещества описаны в тексте: «… — газ, не имеющий цвета, запаха, мало растворим в воде, при t= — 183° превращается в жидкость бледно-синего цвета, сильный окислитель, самый распространённый элемент в природе.
a) водород
b) кислород
c) озон
d) азот
5. Как изменяются восстановительные свойства в ряду элементов:
O→ S→ Se→T?
a) ослабевают
b) не изменяются
c) усиливаются
d) сначала усиливаются, а потом ослабевают
6 Сокращенное ионное уравнение
Al+3 + 3OH- = Al(OH)3↓соответствует уравнению химической реакции
a. Al2O3 + 3h3SO4 = Al2(SO4)3 + 3h3O
b. Al(NO3)3 + 3KOH = Al(OH)3 + 3KNO3O
c. Al(OH)3 + 3HCl = AlCl3 + 3h3O
d. AlCl3 + 3AgNO3 = AgCl + Al(NO3)3
7. Степень окисления азота в азотной кислоте равна;
a. +5
b. 0
c. -3
d. -4
8. Массовая доля азота в нитрате натрия равна
a. 33%
33%
b. 16,5%
c. 8,2%
d. 49%
9. Сера и кислород по строению атома различаются:
a. зарядом ядра
b. количеством заполненных энергетических уровней
c. количеством электронов на внешнем энергетическом уровне
d. не завершенностью внешнего энергетического уровня.
10. Укажите электронную формулу атома хлора
a) 1S22S22P5
b) 1S22S22P63S23P5
c) 1S22S22P63S23P6
d) 1S22S22P63S23P7
11. Азотная кислота не взаимодействует:
a. с оксидом углерода (IV)
b. с оксидом меди (II)
c. с карбонатом калия
d. с гидроксидом железа
12. Формула сульфита кальция:
a. СaSO4
b. CaS
c. CaSO3
d. CaS2O3
13. Кислород проявляет положительную степень окисления в соединении:
a. SO2
b. CuO
c. OF2
d. h3O
14. Сероводород не взаимодействует:
a. с кислородом
b. с водородом
c. с хлоридом меди
d. с нитратом свинца
15. Оксид азота (IV) взаимодействует
a. с водой при наличии кислорода
с водой при наличии кислорода
b. с кислородом
c. с водородом
d. с серной кислотой
16. В атомах элементов II группы главной подгруппы на последнем энергетическом уровне:
a) 1 электрон
b) 2 электрона
c) 3 электрона
d) 4 электрона
17. Выберите формулу неэлектролита.
a) NaCl
b) Ch5
c) Na2SO4
d) HCl.
18. . Выберите сокращенное ионное уравнение, отражающее взаимодействие карбоната магния с азотной кислотой.
a) Mg2++ CO32-= MgCO3
b) CO32- +2H+= h3O+ CO2
c) MgCO3 +2H+= Mg2++ CO2 ↑ +h3O
d) (Nh5)3PO4 + 3 AgNO3 – Ag3PO4 + 3Nh5NO3
19. Атомы элементов, имеющие одинаковое число энергетических уровней, расположены:
a) в одной группе периодической системы;
b) в одном периоде периодической системы;
c) в одной подгруппе периодической системы.
d) В разныз подгруппах периодической системы
20. Массовая доля кислорода больше в соединении:
a) h3O
b) Li2O
c) MgO
d) SO2
Рассмотрено на МО______
Административная работа по химии за 1 полугодие
9 класс
5 вариант
1. Аммиак не вступает во взаимодействие с:
Аммиак не вступает во взаимодействие с:
a) Кислородом
b) Водородом
c) соляной кислотой
d) водой
2. Укажите электронную формулу атома серы
a) 1S22S22P63S23P4
b) 1S22S22P63S23P0
c) 1S22S22P63S23P6
d) 1S22S22P63S03P0
3. Атомы элементов, имеющие одинаковое число энергетических уровней, расположены:
a) в одной группе периодической системы;
b) в одном периоде периодической системы;
c) в одной подгруппе периодической системы.
d) В разныз подгруппах периодической системы
4. Свойства какого вещества описаны в тексте: «… — газ с характерным запахом грозы, светло-фиолетового цвета, разрушает органические вещества. Окисляет металлы, в том числе золото и платину, производит белящее и дезинфицирующее действие»
a) пары йода
b) кислород
c) озон
d) азот
5. Укажите вид химической связи в молекуле хлороводорода?
a) ионная
b) ковалентная полярная
c) ковалентная неполярная
d) металлическая
6. Как изменяются окислительные свойства в ряду элементов:
Как изменяются окислительные свойства в ряду элементов:
F→ Сl→ Br→ I?
a) ослабевают
b) не изменяются
c) усиливаются
d) сначала усиливаются, а потом ослабеваю
7. Вещество, которое в водном растворе диссоциирует на ионы:
a) (Nh5)2SO4
b) Сa3(PO4)2
c) CaCO3
d) CaSiO3
8. Массова я доля кислорода больше в соединении:
a) h3O
b) Li2O
c) MgO
d) SO2
9. Степень окисления серы в сернистой кислоте;
a. -2
b. +6
c. +4
d. 0.
10. Уравнению химической реакции
h3SO4 + 2NaOH → Na2SO4 + 2h3O соответствует сокращенное ионное уравнение:
a. H+ + OH — = h3O
b. NAOH = Na+ + OH-
c. h3SO4 = H+ + SO42-
d. HSO4- = H+ + SO42-
11. Сера и кислород по строению атома сходны:
a. зарядом ядра
b. количеством заполненных энергетических уровней
c. количеством электронов на внешнем энергетическом уровне
d. не завершенностью внешнего энергетического уровня.
12. Массовая доля серы в серной кислоте равна:
a. 16,33%
b. 32,65 %
c. 39,02 %
d. 98%
13. Формула нитрита магния:
a. Mg(NO3)2
b. Mg(NO2)2
c. Mg3N2
d. Mn(NO3)2
14. Разбавленная серная кислота не взаимодействует
a. NaOH
b. Mg
c. BaCl2
d. Hg.
15. Степень окисления -3 азот проявляет в соединении
a. N2О3
b. HNO3
c. NF3
d. Nh5Cl
16. Оксид серы (IV) способен реагировать с :
a. Н2О
b. СН4
c. Н3РО4
d. SO3.
17. Оксид азота (IV) взаимодействует
a. с водой при наличии кислорода
b. с кислородом
c. с водородом
d. с серной кислотой
18. 1.Выберите формулу неэлектролита.
a) NaCl
b) Ch5
c) Na2SO4
d) HCl
19. В атомах элементов II группы главной подгруппы на последнем энергетическом уровне:
a) 1 электрон
b) 2 электрона
c) 3 электрона
d) 4 электронa
20. Выберите сокращенное ионное уравнение, отражающее взаимодействие карбоната магния с азотной кислотой.
a) Mg2++ CO32-= MgCO3
b) CO32- +2H+= h3O+ CO2
c) MgCO3 +2H+= Mg2++ CO2 ↑ +h3O
d) (Nh5)3PO4 + 3 AgNO3 – Ag3PO4 + 3Nh5NO3
Диагностирующая вводная контрольная работа в 9 классе за курс химии 8 класс
ФИ ученика_____________________________________________ Класс__________ Дата_________
Вводная диагностирующая контрольная работа по химии в 9 классе за курс 8 класса.
Вариант 1
1. Заполни таблицу кислот:
Название кислоты | Формула кислоты | Название соот-щей соли |
HCl | ||
серная | ||
HNO2 | ||
фосфорная | ||
h3S |
2. Как устроен атом?
3. Дай определение оксида.
4. Определи С.О. элементов в веществах: CO2, h4PO4, Na2SO4.
5. Приведи 5 аргументов, говорящих о пользе применения продуктов химической промышленности.
6. Заполни таблицу физ. величин:
Название величины | Обозначение величины | Соот-щая формула нахождения физ. величины |
масса | ||
объём | ||
кол-во частиц | ||
кол-во в-ва |
7. Приведи примеры: а)5 кислот; б) 5 оснований (только формулы!).
8. Дай определение химии.
9. Реши задачу: HgO=Hg+O2, m(Hg)=4 гр, V(O2)-? .
10. Перечисли частицы, образующие физическое тело.
11. Определи тип ХР:
Уравнение ХР | Тип ХР |
Li+N2=Li3N | |
Ch5=C+h3 | |
Cl2+NaBr=NaCl+Br2 | |
Fe2(SO4)3+KOH=Fe(OH)3+K2SO4 |
12. Дай определение соли.
13.Что такое вещество?
14. Заполни таблицу:
Название вещества | Формула вещества | Название соот-щий класс в-ва |
Гидроксид цинка | ||
Оксид магния | ||
Хлорид серебра | ||
Карбонат натрия | ||
Силикат цинка |
15. Уравняй химическую реакцию:
Уравняй химическую реакцию:
a) Fe2O3+ h3= Fe+ h3O
б) Na2CO3+ HNO3= NaMO3+ h3C03
16. Перечисли типы химических реакций (названия и подтипы).
17. Дай определение: а) восстановителя; б) процесса окисления.
ФИ ученика_____________________________________________ Класс__________ Дата_________
Вводная диагностирующая контрольная работа по химии в 9 классе за курс 8 класса.
Вариант 2
1. Приведи 5 аргументов, говорящих о вреде применения продуктов химической промышленности.
2. Как устроен атом?
3. Заполни таблицу:
Название вещества | Формула вещества | Название соот-щий класс в-ва |
ОКСИД КАЛИЯ | ||
НИТРАТ АЛЮМИНИЯ | ||
ФОСФАТ КАЛЬЦИЯ | ||
СИЛИКАТ НАТРИЯ | ||
ГИДРОКСИД АЛЮМИНИЯ |
4. Дай определение основания.
Дай определение основания.
5. Определи С.О. элементов в веществах: P2O5, h3SIO3, K2SO3.
6. Заполни таблицу физ. величин:
Название величины | Обозначение величины | Соот-щая формула нахождения физ. величины |
V | ||
N | ||
m | ||
n |
7. Приведи примеры: а)5 солей; б) 5 оксидов ( только формулы!).
8. Перечисли типы химических реакций (названия и подтипы).
9. Дай определение химии.
10. Уравняй химическую реакцию:
а) Na3PO4+ Ca(NO3)2= Ca3(PO4)2+ NaNO3
б) Zn+ HCl= ZnCl2+ h3
11. Дай определение кислоты.
12. Перечисли частицы, образующие физическое тело.
13. Что такое физическое тело?
14. Реши задачу: HgO=Hg+O2, n(O2)=2,3 моль, N(HgO)-?.
15. Заполни таблицу кислот:
Название кислоты | Формула кислоты | Название соот-щей соли |
СЕРНИСТАЯ | ||
HBr | ||
УГОЛЬНАЯ | ||
h3SiO3 | ||
HNO3 |
16.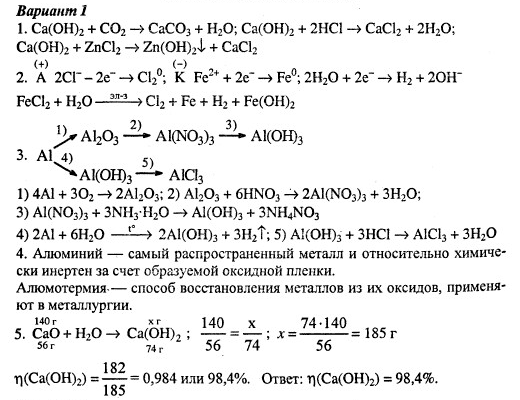 Дай определение: а) окислителя: б) процесса восстановления.
Дай определение: а) окислителя: б) процесса восстановления.
17. Определи тип ХР:
Уравнение ХР | Тип ХР |
F2+h3O=HF+O2 | |
N2+h3=Nh4 | |
Na3PO4+Ca(NO3)2=Ca3(PO4)2+NaNO3 | |
HgO=Hg+O2 |
Система оценивания:
на «5» — 15-17 вопросов;
на «4» — 10-14 вопросов ;
на «3» — 6-9 вопросов;
на «2» — менее 6 вопросов.
Вводная диагностирующая контрольная работа по химии в 9 классе за курс 8 класса.
Учитель: Кумскова И.В.
2015-2016 уг
Итоговая контрольная работа по химии за 9 класс.
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А 1. Схема распределения электронов по слоям в атоме химического элемента, образующего соединения, соответствующие общим формулам Н2Э и ЭО3
1) 2е,6е 3) 2е,8е,6е
2) 2е,8е,5е 4) 2е,8е,7е
А 2. Ряд элементов, расположенных в порядке увеличения атомных радиусов:
Ряд элементов, расположенных в порядке увеличения атомных радиусов:
1) S, P, Si 3) Se, S, O
2) P, S, О 4) Be, B, Al
А 3. Оксид углерода (IV) является
1) амфотерным 3) несолеобразующим
2) кислотным 4) основным
А 4. Необратимая химическая реакция произойдет при сливании растворов веществ, формулы которых:
1) KOH и NaCl 3) CuCl2 и KOH
2) MgCl2и HNO3 4) Al2(SO4 )3 и Cu(NO3)2
А 5. Уравнению реакции 2NO + O2 = 2NO2 соответствует схема превращения:
1) N+2 ? N+5 3) N-3 ? N+2
2) N+4 ? N0 4) N+2 ? N+4
А 6. Верны ли следующие высказывания?
А. Степень окисления атома хрома в соединении CrO равна +3
Б. Степень окисления атома хрома в соединении Cr2O3 равна +3
Степень окисления атома хрома в соединении Cr2O3 равна +3
1) верно только А 3) верно только Б
2) верны оба суждения 4) оба суждения не верны
Часть 2.
В задании В1 на установление соответствия запишите последовательность цифр без пробелов и других символов.
В1. Установите соответствие между формулой вещества и классом соединения:
ФОРМУЛА ВЕЩЕСТВА: КЛАСС СОЕДИНЕНИЯ
А) НСОН 1) Алкан
Б) С4Н10 2) Алкен
В) СН3ОН 3) Альдегид
Г) СН3СООН 4) Спирт
5) Карбоновая кислота
6) Простой эфир
Ответом к заданию В 2 является последовательность цифр в порядке возрастания.
В 2. С разбавленной серной кислотой реагируют:
1) Cu 4) Mg
2) CuO 5) BaCl2
3) NaOH 6) SO2
Часть 3
Запишите номер задания и полное решение
C1. Какой объем оксида углерода (IV) образуется при сгорании 11,2л пропана?
Какой объем оксида углерода (IV) образуется при сгорании 11,2л пропана?
Контрольная Итоговая контрольная 📝 работа по химии за курс 9 класса Хими
1. Сколько стоит помощь?
Цена, как известно, зависит от объёма, сложности и срочности. Особенностью «Всё сдал!» является то, что все заказчики работают со экспертами напрямую (без посредников). Поэтому цены в 2-3 раза ниже.
2. Каковы сроки?
Специалистам под силу выполнить как срочный заказ, так и сложный, требующий существенных временных затрат. Для каждой работы определяются оптимальные сроки. Например, помощь с курсовой работой – 5-7 дней. Сообщите нам ваши сроки, и мы выполним работу не позднее указанной даты. P.S.: наши эксперты всегда стараются выполнить работу раньше срока.
P.S.: наши эксперты всегда стараются выполнить работу раньше срока.
3. Выполняете ли вы срочные заказы?
Да, у нас большой опыт выполнения срочных заказов.
4. Если потребуется доработка или дополнительная консультация, это бесплатно?
Да, доработки и консультации в рамках заказа бесплатны, и выполняются в максимально короткие сроки.
5. Я разместил заказ. Могу ли я не платить, если меня не устроит стоимость?
Да, конечно — оценка стоимости бесплатна и ни к чему вас не обязывает.
6. Каким способом можно произвести оплату?
Работу можно оплатить множеством способом: картой Visa / MasterCard, с баланса мобильного, в терминале, в салонах Евросеть / Связной, через Сбербанк и т.д.
7. Предоставляете ли вы гарантии на услуги?
На все виды услуг мы даем гарантию. Если эксперт не справится — мы вернём 100% суммы.
8. Какой у вас режим работы?
Мы принимаем заявки 7 дней в неделю, 24 часа в сутки.
Решения NCERT для науки класса 9 в формате PDF на 2020-2021 гг.
Решения NCERT для класса 9 Science
| Class: 9 | Science — विज्ञान |
| Содержание: | Решения NCERT на хинди и английском Medium |
9th Science Solutions на английском и хинди
Бесплатные ссылки для скачивания решений Class 9 Science NCERT и UP Board Solutions в формате PDF приведены ниже.Все решения обновлены для новой академической сессии 2020-21 для UP Board, Delhi Board, MP Board, Gujrat Board, Uttarakhand Board и т. Д., Которые следуют NCERT Books 2020-2021 для своих заключительных экзаменов.
Решения NCERT для науки класса 9 на 2020-2021 годы
Основные положения науки класса 9 и решения NCERT
Глава 1. Материя в нашем окружении
Наука класса 9 Глава 1 описывает физическую природу материи, например материя состоит из частиц и размера этих частиц.Это также объясняет характеристики частиц материи, как будто между ними есть пространство, они движутся с некоторой кинетической энергией и притягиваются друг к другу с определенной силой. Все мы знаем, что существует три состояния материи — твердое, жидкое и газообразное. В главе 1 по химии научного курса 9 класса мы рассмотрим свойства материи в различных состояниях. Изменение состояния под воздействием температуры, давления или других факторов также важно для экзаменов.
Все мы знаем, что существует три состояния материи — твердое, жидкое и газообразное. В главе 1 по химии научного курса 9 класса мы рассмотрим свойства материи в различных состояниях. Изменение состояния под воздействием температуры, давления или других факторов также важно для экзаменов.
Глава 2.Вокруг нас чистая материя
Наука класса 9 Глава 2 объясняет все типы веществ, будь то чистые вещества или смесь двух или более чистых веществ. Однородные и неоднородные смеси и их свойства часто задают на школьных экзаменах 9 класса естествознания. Здесь мы должны узнать о том, сколько типов растворов существует, как их приготовить и как определить концентрацию данного раствора. После этого мы также сможем понять, что такое суспензия и коллоид.Свойства суспензии и коллоида также имеют решающее значение с точки зрения экзаменов. Разделение компонентов смеси с использованием различных методов описано в конце этой главы. Мы можем применять эти способы в повседневной жизни, чтобы лучше понимать.
Глава 3. Атомы и молекулы
Наука класса 9 Глава 3 посвящена закону химического соединения, закону сохранения массы и закону постоянной пропорции. Здесь мы изучим, что атомы и молекулы являются фундаментальными строительными блоками всей материи.Что такое атом? Насколько они большие? Каковы древние или современные символы атомов? Этот тип вопросов является новым для девяти стандартных учеников. Атомная масса и их символы обычно начинаются с 9 класса и играют важную роль в старших классах. Мы должны тщательно понимать важные молекулы и их валентность, а также знать ионы — катион или анион. Написание формулы любого соединения с использованием метода крест-накрест является наиболее важной частью главы 3 химии научного класса 9.Вопросы, основанные на концепциях «Молекулярная масса» и «Молекулярность», также имеют решающее значение для школьных экзаменов или выпускных экзаменов.
Глава 4. Структура атома
Наука класса 9 Глава 4 основана на субатомных частицах, таких как протон — p, нейтрон — n и электрон — e. Он также объясняет различные этапы открытия структуры атомов и ее частей. Структура атома включает атомные модели Дж. Дж. Томсона, Резерфорда и Бора. Эксперимент Резерфорда, его наблюдение и выводы считаются важными темами главы 4 по химии в науке 9 класса.Здесь мы должны узнать о валентности, атомном числе, массовом числе и их соотношении друг с другом. Мы должны понимать разницу между изотопами и изобарами, чтобы устранить путаницу в следующих классах.
Он также объясняет различные этапы открытия структуры атомов и ее частей. Структура атома включает атомные модели Дж. Дж. Томсона, Резерфорда и Бора. Эксперимент Резерфорда, его наблюдение и выводы считаются важными темами главы 4 по химии в науке 9 класса.Здесь мы должны узнать о валентности, атомном числе, массовом числе и их соотношении друг с другом. Мы должны понимать разницу между изотопами и изобарами, чтобы устранить путаницу в следующих классах.
Глава 5. Фундаментальная единица жизни
Наука класса 9 Глава 5 является первой главой биологии в стандарте 9. В этой главе рассказывается, как Роберт Гук открыл клетку с помощью кусочка пробки. Клетки слишком малы, чтобы их можно было увидеть невооруженным глазом, но мы можем увидеть клетку в микроскоп, сделав временные насадки из кожуры лука.Здесь мы сможем узнать о клетках человеческого тела, таких как костные клетки, клетки крови, клетки гладких мышц, нервные клетки и т. Д. Структурная организация клетки, плазменная мембрана и ее явления с изотоническими, гипотоническими и гипертоническими растворами кратко описано в 9 классе естественных наук, в главе 5 раздела биологии. Мы должны знать о функции клеточной стенки, ядра и цитоплазмы в клетке. Полное описание растительной клетки и животной клетки с их компонентами, такими как аппарат Гольджи, лизосомы, митохондрии, пластиды, вакуоли и деление клеток, является основной темой этой главы для изучения.
Мы должны знать о функции клеточной стенки, ядра и цитоплазмы в клетке. Полное описание растительной клетки и животной клетки с их компонентами, такими как аппарат Гольджи, лизосомы, митохондрии, пластиды, вакуоли и деление клеток, является основной темой этой главы для изучения.
Глава 6. Ткани
Наука класса 9 В главе 6 рассказывается о тканях растений и животных. Растительные ткани включают объяснение о меристематической ткани — для роста растений и постоянной ткани — постоянной по форме, размеру и функции (простые и сложные постоянные ткани). Ткани животных охватывают темы, связанные с эпителиальной тканью (также известной как покровная или защитная ткань), соединительной тканью, мышечной тканью и нервной тканью. Нервные клетки или нейроны — фундаментальные единицы нервной системы.Нервные ткани состоят из этих нейронов. Нейроны — самые длинные клетки человеческого тела. Отдельная нервная клетка может иметь длину до метра.
Глава 7. Разнообразие живых организмов
Класс 9 Наука В главе 7 объясняется систематическая классификация живых существ. Мы изучим здесь, что классификация форм жизни будет тесно связана с их эволюцией. Биологи Эрнст Геккель, Роберт Уиттакер и Карл Вёзе попытались разделить все живые организмы на названные царства.Согласно классификации, Уиттакер разделил все живые существа на пять царств: Монера, Протиста, Грибы, Плантаэ и Животное. Дальнейшая классификация осуществляется путем обозначения подгрупп типа или подразделения, класса, порядка, семейства, рода и вида. В главе 7 по науке класса 9 мы должны сравнить живое существо в том же царстве или в какое-то время с другим царством. В конце мы изучим Номенклатуру — систематическое именование живых организмов.
Мы изучим здесь, что классификация форм жизни будет тесно связана с их эволюцией. Биологи Эрнст Геккель, Роберт Уиттакер и Карл Вёзе попытались разделить все живые организмы на названные царства.Согласно классификации, Уиттакер разделил все живые существа на пять царств: Монера, Протиста, Грибы, Плантаэ и Животное. Дальнейшая классификация осуществляется путем обозначения подгрупп типа или подразделения, класса, порядка, семейства, рода и вида. В главе 7 по науке класса 9 мы должны сравнить живое существо в том же царстве или в какое-то время с другим царством. В конце мы изучим Номенклатуру — систематическое именование живых организмов.
Глава 8. Движение
Наука класса 9 Глава 8 включает все термины, которые описывают движение объекта.Большинство сюжетов основаны на движении по прямой или равномерном движении. Во время изучения равномерного или неравномерного движения мы научимся определять среднюю скорость или скорость в течение определенного периода времени. Глава 8 Науки 9-го класса содержит множество численных задач по физике, соответствующих трем уравнениям движения. Мы должны понимать разницу между скоростью и скоростью, а также расстоянием и смещением. Графическое представление движения и вывод трех уравнений движения графическим методом часто задаются на школьных экзаменах.Понятия равномерного кругового движения и его числовой основы также важны для экзаменов.
Мы должны понимать разницу между скоростью и скоростью, а также расстоянием и смещением. Графическое представление движения и вывод трех уравнений движения графическим методом часто задаются на школьных экзаменах.Понятия равномерного кругового движения и его числовой основы также важны для экзаменов.
Глава 9. Сила и законы движения
Наука класса 9 Глава 9 начинается с сосредоточения внимания на уравновешенной и неуравновешенной силе. Позже сюда входит также влияние силы трения и инерции. Главный мотив изучения главы 9 Науки 9 класса — понять законы движения под действием силы. Здесь мы начнем с Первого закона движения и инерции тела. Позже Второй закон движения вместе с законом сохранения количества движения.Мы должны ответить на все интерактивные вопросы и задать вопросы, основанные на определенных законах движения и импульса. В конце концов, есть много вопросов-рассуждений, основанных на Третьем законе движения, которые необходимо понять о законе действия-противодействия.
Глава 10. Гравитация
Наука класса 9 Глава 10 основана на концепциях гравитации, всемирного закона гравитации и гравитации. Мы должны знать, что каждый объект притягивается другими объектами с переменным гравитационным притяжением в соответствии с тем, что гласит Закон гравитации.Связь между универсальной гравитационной постоянной G и гравитационным ускорением g также важна для заключительных экзаменов или классных тестов. В главе 10 «Наука 9 класса» также говорится о разнице между массой и весом с учетом значений g. Мы знаем, что G постоянна, но значение силы тяжести меняется в зависимости от радиуса Земли. Значение g максимально на полюсах и минимум на экваторе из-за эллиптической структуры Земли. Концепции плавучести, выталкивающей силы, давления и тяги, принцип плавучести Архимеда и относительная плотность являются темой для подготовки к экзамену.
Глава 11. Работа и энергия
Наука класса 9 Глава 11 объясняет, что Работа и Энергия — это одно и то же, только состояния меняются. Работа направлена на то, чтобы отличаться от Энергии или Энергии, которую мы можем выполнять. Вопросы, основанные на постоянной силе и равномерных движениях, представлены в виде intext вопросов. Механическая энергия в основном делится на два вида: кинетическая энергия и потенциальная энергия. Кинетическая энергия объекта обусловлена его движением, тогда как потенциальная энергия обусловлена его текущим положением.Сумма потенциальной и кинетической энергии считается механической энергией. Другие формы энергии — это тепловая энергия, химическая энергия, электрическая энергия и световая энергия. Закон сохранения энергии, проделанная работа, мощность и коммерческая единица энергии — основные темы для численной практики. Соотношение между 1 единицей и джоулями важно для вывода, а также для численных задач.
Глава 12. Звук
Наука класса 9 Глава 12 посвящена производству и движению звука.Мы знаем, что звук распространяется с разной скоростью в разных материалах, но не распространяется в вакууме, поскольку для его перемещения требуется материальная среда. Характеристики звуковой волны или продольной волны и концепции сжатия и разрежения с частотой, амплитудой и скоростью важны для этого сегмента науки класса 9. Мы также должны знать об интенсивности, мягкости, громкости, низкой и высокой высоте звуковых волн. Большая часть числовых значений в главе 12 Науки 9 класса основана на скорости, длине волны и частоте.Отражение звука, включая концепцию эха, важны для концептуальных вопросов. В конце 12-й главы «Девятой физики» для практики даются концепции реверберации, инструментов, основанных на множественных отражениях звука, диапазона слуха, сонара и применения ультразвуковых волн.
Глава 13. Почему мы болеем?
Наука класса 9 Глава 13 посвящена здоровью и связанной с ним терминологии. Мы изучим, что такое Здоровье, каковы критерии для здорового человека или человека, не имеющего болезней, и другие подобные вопросы.Мы также постараемся узнать, каковы основные причины заболевания и в чем разница между острым и хроническим заболеванием. Многие заболевания могут быть инфекционными или неинфекционными. Средство распространения, меры предосторожности от болезней, принцип лечения и излечения от болезней — вот концепции, которые необходимо понять.
Глава 14. Природные ресурсы
Наука класса 9 Глава 14 в основном сосредоточена на природных ресурсах, доступных на Земле. Темы для изучения: роль атмосферы в контроле климата, появление областей с низким и высоким давлением, направление, в котором будет течь воздух днем или ночью, причины дождя и способы загрязнения.Мы должны изучить доступность водных ресурсов и методы предотвращения загрязнения. В конце мы прочитаем о биохимических циклах, таких как водный цикл, азотный цикл, углеродный цикл, кислородный цикл и парниковый эффект.
Глава 15. Улучшение пищевых ресурсов
Класс 9 Наука Глава 15 основана на различных методах улучшения пищевых ресурсов. Повышение урожайности различных культур, таких как пшеница, рис, кукуруза, просо и др., И улучшение разнообразия сельскохозяйственных культур — это интересная тема для чтения.Управление растениеводством включает управление питательными веществами, такими как компост и верми-компост, сидераты и т. Д., Навоз и удобрения. Орошение, структура посевов, управление растениеводством, складские помещения, животноводство, животноводство, птицеводство, производство яиц и бройлеров, а также производство рыбы — вот основные моменты.
Решения NCERT для науки класса 9 на хинди Средний
Вопросы практики MCQ в PDF
Решения NCERT для науки 9 класса на 2020-21 годы
Мы обновили все решения NCERT 2020 -21 для новой сессии в формате PDF.PDF-файлы, относящиеся ко всем главам, представлены на странице главы. Если вы столкнулись с проблемой загрузки этих страниц, свяжитесь с нами для получения помощи. Оффлайн-приложения NCERT Solutions 2020-2021 также основаны на последних книгах NCERT 2020-21. Загрузите эти приложения для автономного использования. Если вы скачали эти приложения один раз, в дальнейшем подключение к Интернету не потребуется.
Отзывы и предложения
Наряду с решениями каждой главы, в том же разделе заданий, также даются вопросы прошлых лет с решениями.В задания будут включены важные вопросы в соответствии с последней программой NCERT Syllabus 2020-21 из популярных книг Лахмира Сингха и Манджита Каура, С. Чанда, фундаментальной книги Прадипа, Вместе с наукой, U-Like и других важных книг. Решения NCERT Books для UP Board также доступны на хинди и английском языке. Если вам нужны ответы на вопросы, относящиеся к какой-либо главе, загрузите их через ФОРУМ обсуждения, мы предоставим решения в течение 48 часов.
Важные вопросы по науке 9 класса
स्विमिंग पूल में गोताखोर पानी काट पाता है। इससे पदार्थ का कौन-सा गुण प्रेक्षित होता है?
जल के कणों के बीच दूरी अधिक होने के बल कम होता है। इसलिए स्विमिंग पूल में गोताखोर पानी काट पाता है।
किसी भी पदार्थ की अवस्था परिवर्तन के दौरान तापमान स्थिर क्यों रहता है?
पदार्थ की अवस्था परिवर्तन के दौरान दी गयी ऊष्मा (गुप्त ऊष्मा), पदार्थ के कणों की बीच बन्धो को तोड़ने में खर्च होती है। इसीलिए अवस्था परिवर्तन के दौरान दी गयी ऊष्मा पदार्थ का तापमान बढ़ा पाती।
Опишите чистое вещество с помощью примера.
Чистая субстанция: Чистая субстанция состоит из одной материи или частиц и не может быть разделена на другой вид материи никаким физическим процессом. Чистые вещества всегда имеют одинаковый цвет, вкус и текстуру при заданной температуре и давлении. Например, чистая вода всегда бесцветна, без запаха и вкуса и кипит при 373 К при нормальном атмосферном давлении.
Перевести в моль: 12 г газообразного кислорода.
32 г газообразного кислорода = 1 моль
Тогда 12 г газообразного кислорода = 12/32 моль = 0.375 моль
Каковы ограничения модели атома Резерфорда?
Согласно модели атома Резерфорда, электроны вращаются вокруг ядра по фиксированным орбитам. Но электрон, вращающийся по круговым орбитам, не будет стабильным, потому что во время вращения он будет испытывать ускорение. Из-за ускорения электроны теряют энергию в виде излучения и попадают в ядро. В таком случае атом будет крайне нестабильным и разрушится.
यदि किसी परमाणु में इलेक्ट्रॉनों की संख्या 8 है और प्रोटॉनों की संख्या भी 8 है तब, (a) परमाणु की परमाणु संख्या क्या है? (б) परमाणु का क्या आवेश है?
(а) हम जानते हैं कि, परमाणु संख्या = प्रोटॉनों की संख्याअतः, परमाणु की परमाणु संख्या = 8
(б) परमाणु का आवेश = प्रोटॉनों की संख्या — इलेक्ट्रॉनों की संख्या = 8-8 = 0
अतः, परमाणु पर कोई आवेश नहीं है और परमाणु उदासीन है।
कोशिका की खोज किसने और कैसे की?
कोशिका की खोज सर्वप्रथम राबर्ट हुक ने की। उन्होंने 1665 में कॉर्क की पतली छीलन को अपने बनाए गए सूक्ष्मदर्शी में देखा जिसमें मधुमखी के छत्ते जैसे छोटी कोठरियाँ दिखायी दी जिन्हे उन्होंने (सेल) कोशिका नाम दिया।
लाइसोसोम को आत्मघाती थैली क्यों कहते हैं?
लाइसोसोम के अंदर अत्यंत शक्तिशाली पाचक रस कोशिका के अंदर प्रवेश करने वाले विषाक्त, विजातीय पदार्थो को तो नष्ट करते ही है, कोशिका के ठीक कार्य न करने वाले अंगको को करके उसे साफ करने करते कभी-कभी पूरी कोशिका ही बीमार हो जाती है और नहीं करती, तब पूरी कोशिका को लिए, लाइसोसोम फट जाते हैं और अपनी ही कोशिकाओं को पाचित कर देते हैं। इसलिए लाइसोसोम को कोशिका की आत्मघाती थैली भी कहते हैं।
बहुकोशिक जीवों में ऊतकों का क्या उपयोग है?
बहुकोशिक जीवों में ऊतक भोजन का पाचन, स्वसन, उत्सर्जन, परिसंचरण, गमन तथा जनन आदि कार्य करते हैं।
उस ऊतक का नाम बताएँ जो हमारे शरीर में गति के लिए उत्तरदायी है।
पेशी ऊतक शरीर को गति प्रदान करते है। पेशी ऊतक में एक विशेष प्रकार का है जिसके प्रसार के कारण गति होती है।
अपने चारों ओर फैले जीव रूपों की विभिन्नता के तीन उदाहरण दें।
में तीन प्रकार विभिन्ता प्रायः देखी जाती हैं:
: कुछ जीव जैसे बैक्टीरिया अतिसूक्ष्म है तो दूसरी ओर ह्वेल जैसे मीटर लम्बे होते हैं।
जीवन काल: कुछ जीवों जैसे मच्छर का जीवन काल अति न्यून होता है जबकि कुछ पौधे सैकड़ों साल रहते है।
रंग: कुछ जीव रंगहीन (पारदर्शी तक) होते है तो कुछ विभिन्न आकर्षक रंगों युक्त होते हैं।
वर्गीकरण के विभिन्न पदानुक्रमों में किस समूह में सर्वाधिक समान लक्षण वाले सबसे कम जीवों को और किस समूह में सबसे ज्यादा संख्या जीवों को रखा जाएगा?
सर्वाधिक समान लक्षणों वालें सबसे कम संख्या वाले वर्ग को जाति (स्पसीज) कहते है क्योंकि वर्गीकरण जबकि सर्वाधिक संख्या वालें समूह की जगत कहते है क्योंकि वर्गीकरण यह उच्चतम स्तर पर है।
विस्थापन के लिए निम्न में कौन सही है? (а) यह शून्य नहीं हो सकता है। (б) इसका परिमाण वस्तु के द्वारा तय की गई दूरी से अधिक है।
(а) और (б) दोनों में से कोई भी सत्य नहीं है। क्योंकि यह शून्य हो सकता है तथा वस्तु के की गई दूरी से कम या बराबर होता है।
Почему рекомендуется привязать любой багаж, хранящийся на крыше автобуса, веревкой?
Когда автобус ускоряется и движется вперед, он переходит в состояние движения.Однако багаж, хранящийся на крыше, из-за своей инерции имеет тенденцию оставаться в состоянии покоя. Следовательно, при движении автобуса вперед багаж имеет тенденцию оставаться в исходном положении и в конечном итоге падает с крыши автобуса. Чтобы этого не произошло, рекомендуется привязать любой багаж, хранящийся на крыше автобуса, веревкой.
Гравитационная сила действует на все объекты пропорционально их массе. Почему же тогда тяжелый предмет не падает быстрее легкого?
Все объекты падают на землю с постоянным ускорением, называемым ускорением силы тяжести (при отсутствии сопротивления воздуха).Он постоянен и не зависит от массы объекта. Следовательно, тяжелые предметы не падают быстрее легких.
पानी की सतह पर रखने पर कोई वस्तु क्यों तैरती या डूबती है?
यदि वस्तु का घनत्व पानी के घनत्व से कम है या बराबर है तो वस्तु पानी पर रहेगी अन्यथा वस्तु पानी में जाएगी।
या
यदि वस्तु का भार उसके द्वारा विस्थापित जल के भार से कम या बराबर है तो पानी में तैरेगी अन्यथा डूब जाएगी।
Лампочка загорается от батареи. Опишите изменения энергии, вовлеченные в процесс.
Аккумулятор преобразует химическую энергию в электрическую. Эта электрическая энергия в дальнейшем преобразуется в световую и тепловую энергию.
Человек 30 минут держит над головой пучок сена и устает. Он поработал или нет? Обосновать ответ.
Человек, держащий пучок сена, устает, потому что его мышечная энергия превращается в тепловую. Смещения нет вообще, поэтому работы у него не было. Выполненная работа = Сила × смещение.
मान लीजिए आप अपने मित्र के साथ चंद्रमा पर गए हुए है। क्या आप अपने मित्र द्वारा उत्पन्न ध्वनि को सुन पाएँगे?
ध्वनि तरंगों को चलने के लिए द्रव्यात्मक माध्यम (जैसे: लोहा, ताँबा, वायु आदि) की आवश्यकता होती है। चंद्रमा पर वायुमंडल नहीं है। इसलिए अपने मित्र द्वारा उत्पन्न ध्वनि को माध्यम के आभाव में हम नहीं सुन पाएँगे।
प्रतिरक्षीकरण क्या है?
एक बार रोग होने पर उसी रोग से बचने को प्रतिरक्षीकरण कहते हैं। इस प्रक्रिया में रोगाणुओं (कमजोर रोगाणुओं) को शरीर में प्रवेश कराया जाता है। जब रोगाणु प्रतिरक्षा तंत्र पर पहली बार आक्रमण तंत्र रोगाणुओं के प्रति क्रिया करता है और इसका विशिष्ट रूप से कर लेता है। इस प्रकार जब वही रोगाणु या उससे मिलता — जुलता रोगाणु संपर्क में आता है तो पूरी शक्ति से उसे नष्ट कर देता है। इससे पहले संक्रमण की अपेक्षा दूसरा संक्रमण शीघ्र ही समाप्त हो जाता है।
वायुमंडल एक कंबल की तरह कैसे कार्य करता है?
वायु ताप का कुचालक होता है। अतः, दिन के समय वायुमंडल होने के कारण सूर्य से पृथ्वी आ और रात के समय ऊष्मा से रोकता है। इस प्रकार वायुमंडल, पृथ्वी के औसत तापमान को दिन और रात समय पुरे वर्ष लगभग नियत बनाए रखता है।
Каковы преимущества междурядья и севооборота?
Как совмещение культур, так и севооборот играют важную роль в повышении урожайности сельскохозяйственных культур.Обработка культур помогает предотвратить распространение вредителей и болезней по полю. Это также увеличивает плодородие почвы, тогда как севооборот предотвращает истощение почвы, увеличивает плодородие почвы и снижает эрозию почвы. Оба эти метода уменьшают потребность в удобрениях. Это также помогает в борьбе с сорняками и контролирует рост патогенов и вредителей в сельскохозяйственных культурах.
PPT — Добро пожаловать в 9 класс химии! PowerPoint Presentation, скачать бесплатно
Добро пожаловать в класс химии 9! Первый триместр 2011-2012 гг. Введение в PPT от г-на Федли http: // www.shagtees.com/cgi-bin/store/cpshop.cgi/1826209118/shagtees/5696358
Сегодняшний урок • Немного о мистере Федли • Темы этого года • Как я буду отмечен? • Основные правила и ожидания класса • Небольшое мероприятие (буклеты) • Присоединяйтесь к Wiki • Раздайте учебники и таблицу Менделеева.
Немного о MrFedley • Откуда я? Мельбурн — Австралия • Любимые увлечения: домашний кинотеатр (фильмы), баскетбол, AFL, настольный теннис и геология (скалы).• Братья и сестры? Одна старшая, но очень надоедливая сестра.
Моя последняя школа? • Я преподавал в Международной школе И-Шоу в Гаосюне, Тайвань. • Я преподавал естественные науки для 7 и 8 классов, а также группу наставников 8-го класса и английский стандарт B.
Моя школа в Австралии: Средний колледж Кисборо — Кампус Кумура. • Большинство моих студентов переехали из Камбоджи, Вьетнама, Китая и Судана вместе со своими семьями в Австралию.• Раздражение домашних животных: люди не слушают, их избивают в спорте.
Химия 9 класс — Темы • Итак, что мы будем изучать в естественных науках в этом триместре? • Частичная природа вещества • Экспериментальные методы • Периодическая таблица • Соединения элементов атомов • Крот • Обратите внимание, что они могут измениться. Я подтвердю как можно скорее. http://www.lovespeaks.net/dating-funnies-stories/
Как нас отметят ?? • В 10 классе вы получили оценку с помощью теста с несколькими вариантами ответов (30%) из 45 вопросов. • Вы выполняете тест на краткие ответы и структурированные вопросы (50%). • Остальные 20% проходят через курсовую работу или практический тест.http://igcse-specialist.blogspot.com/
ЧТО-ТО ОЧЕНЬ ВАЖНОЕ !! ХОРОШЕЕ ПОВЕДЕНИЕ = БОЛЬШЕ ЭКСПЕРИМЕНТОВ
Основные правила класса • Не разговаривать, пока кто-то разговаривает с классом (включая учителя или других учеников) • Мы передвигаемся по классу только по уважительной причине (не ради этого) или во время эксперимента • Еда или питье в классе — большой запрет (*) • Когда кто-то говорит, мы его слушаем • Во время эксперимента мы следуем инструкциям учителей, если они говорят нам сесть.• Мы веселимся!
Буклеты • Теперь мы будем делать небольшие буклеты. После того, как буклеты будут созданы, нам нужно завершить приведенную ниже работу на следующих страницах: • Страница 1: 9 класс Chem – TrimeterOne (заголовок) • Страница 2 и 3: Расскажите мне кое-что о себе. Есть ли у вас братья / сестры, любимый фильм, любимый вид спорта, что вас раздражает и т. Д. • Стр. 4 и 5: Расскажите, что вам понравилось и не понравилось в 8-м классе науки. • Стр. 6 и 7: Что бы вы хотели сделать / узнать в 9 классе по химии • Стр. 8: Что вы собираетесь делать больше в естественных науках в этом году?
Наша Wiki • Перейдите на следующую вики: • http: // yis9chem.wikispaces.com • Затем присоединяйтесь к википространствам, а затем присоединяйтесь к вики, используя свой адрес электронной почты YIS. • На данный момент вики немного, но она будет включать большинство раздаточных материалов и PPT, а также является областью для общей информации. • Есть область для обсуждения. Пожалуйста, задавайте вопросы здесь, а также отвечайте на вопросы нуждающимся в помощи !!!
Рабочий лист периодической таблицы • Зайдите в вики — http://yis9chem.wikispaces.com и загрузите рабочий лист под названием Рабочий лист периодической таблицы 1 • Заполните рабочий лист, используя свой учебник (P266 / 267 наиболее полезен) и Интернет при необходимости.
GCSE 9-1 Комбинированная наука Биология Химия Физика AQA Edexcel OCR Gateway OCR Спецификация научных курсов двадцать первого века на 2020 2021 2022 Примечания к пересмотру экзаменов
УКАЗАТЕЛЬ РЕЗУЛЬТАТОВ РЕДАКЦИИ СПРАВОЧНЫЕ ССЫЛКИ и ПРОШЛЫЕ СТАТЬИ для последнего GCSE НАУКИ — биология, химия и физика пересмотр
Для последнего GCSE (оценка 9-1) Спецификация естественно-научного курса с 2020 г. и далее
Ссылки на редакцию AQA GCSE Sciences
Ссылки на редакцию Edexcel GCSE Sciences
OCR GCSE Gateway Sciences A Revision Ссылки
OCR GCSE 21st Century Sciences B Ссылки на редакцию
и Другие научные курсы GCSE или IGCSE
ПОЖАЛУЙСТА, ПРОЧИТАЙТЕ ДАННЫЕ РУКОВОДСТВА ОЧЕНЬ ВНИМАТЕЛЬНО заранее !!
ВНИМАНИЕ: НОМЕРА ТЕМ и НОМЕРА ДОКУМЕНТОВ специально для комбинированных наук
Мои сводки тем примечания к редакции НЕОФИЦИАЛЬНО, НО все, что я делаю, основано на последних ОФИЦИАЛЬНЫХ выпусках НОВАЯ учебная программа GCSE (9-1 класс) для курсы AQA, Edexcel, OCR Gateway, OCR 21st Century Science GCSE в биология, химия, физика или комбинированные науки.Первые экзамены май-июнь 2018г.
БУМАГА 1 / БУМАГА 2 (индекс ниже) означает первую / вторую работу по биологии / химии / физике, которую вы выполняете отдельные науки GCSE или комбинированные науки. Фактическая бумага число может быть любым от 1 до 10, так что будьте осторожны!
- Если вы думаете, что в моем кратном есть какая-то ОШИБКА тесты по химии на выбор, ПОЖАЛУЙСТА, НАПИШИТЕ НА ЭЛЕКТРОННУЮ ПОЧТУ мне ссылку на URL и цитату номер ссылки в квадратных скобках в конце вопроса e.грамм. [xx-yy]. Некоторые викторины, особенно сборники, довольно большие и требуют некоторых время скачивать.
ОЧЕНЬ ВАЖНО : Убедитесь, что вы знаете, делаете ли вы отдельные науки GCSE 9-1 класс биологии, химии или физики ИЛИ комбинированных Science и перепроверьте свою экзаменационную таблицу в школе, колледже или академии .
Убедитесь, что вы знаете, занимаетесь ли вы более высокого уровня ( HT ) или ярус фундамента (FT), обратите внимание на (Только HT) примечание.
I надеюсь, что мои страницы исправлений помогут, и когда вы узнаете мой сайт, он очень большой и не всегда легко ориентироваться, но это не замена конспекты уроков, стараясь изо всех сил выполнять домашние задания, изучая свой учебник, выполнение прошлых заданий для практики экзаменационных вопросов и, прежде всего, ваши учительская!
- Очень важно, чтобы ВЫ перепроверили, с моих веб-страниц, цели обучения из спецификации учебной программы с ВАШИМИ собственными примечаниями к урокам / исправлениям и учебниками / справочниками для ВАШЕГО курса GCSE 9-1.
«Химия Доктора Би» — большой веб-сайт, так что он Поле Google [SEARCH] вверху или внизу каждого индекса или примечания к редакции страница может быть ОЧЕНЬ ПОЛЕЗНОЙ — иногда лучше, чем индексы!
Что касается выпускных экзаменов , в этот момент ВЫ НЕСЕТЕ ОТВЕТСТВЕННОСТЬ ЗА ДОСТИЖЕННЫЙ УРОВЕНЬ, а не за свой учителя или я или мой сайт (что не идеально!) , так что убедитесь, что вы правильно подготовились!
Если есть что-нибудь о веб-сайт, которым вы недовольны, или вы думаете, что произошла ошибка, или вы думаете что-то не было должным образом освещено, пожалуйста, вежливо напишите мне запрос к chem55555 @ hotmail.com
ПРИМЕЧАНИЕ к классам: Уровень фундамента FT классы с 1 по 5 и выше Tier HT классы с 4 по 9. In По старым классам примерное сравнение: 7-9 классы (A-A *), 4-6 (C-B), 1-3 (G-D), U (U) (с OFQUAL января 2018)
На других страницах …
Тесты по химии специально для Спецификации химии GCSE — согласованы с темами модуля химии (ссылка повторяется в каждом разделе на этой странице)
ВСЕ тесты и задания по химии GCSE
Подробные примечания к редакции биологии GCSE
Подробные примечания к редакции химии GCSE
Подробные примечания к редакции физики GCSE
, а конкретные ссылки справки начинаются ниже (make конечно знаешь свой курс!)
Резюме AQA Revision для биологии GCSE, экзаменационные работы по трилогии по химии, физике и комбинированным наукам
ALL AQA GCSE (Grade 9-1) Уровень 1 / Уровень 2 НАУКИ спецификации и резюме пересмотренной программы ссылки
Мои страницы справки по биологии AQA GCSE
AQA GCSE (9-1 класс) БИОЛОГИЯ 8461 GCSE BIOLOGY 1-я статья 1 (отдельный естественные темы 1-4)
AQA GCSE (9-1 класс), комбинированный Научная трилогия биологии 8464 комбинированная наука биология 1-й доклад 1 (темы 1-4)
AQA GCSE (9-1 класс) БИОЛОГИЯ 8461 GCSE BIOLOGY 2-я статья 2 (отдельный научные темы 5-7)
Комбинированная научная трилогия по биологии AQA GCSE (9–1 класс) 8464 комбинированная наука биология 2-я статья 2 темы 5-7)
Мои страницы справки по химии AQA GCSE
AQA GCSE (9-1 класс) ХИМИЯ 8462 GCSE CHEMISTRY 1st Paper 1 (отдельный естественные науки 1-5)
AQA GCSE (9-1 класс), комбинированный Научная трилогия Химия 8464 объединенная наука химия 1-я статья 3 (темы 8–12)
AQA GCSE (9-1 класс) ХИМИЯ 8462 GCSE CHEMISTRY 2nd Paper 2 (отдельный естественные темы 6-10)
AQA GCSE (9-1 класс), комбинированный Научная трилогия по химии 8464 вместе взятые научная химия 2-я статья 4 (темы 13-17)
Тесты по химии специально для Спецификации химии GCSE — соответствуют темам модуля химии
Мои страницы справки по физике AQA GCSE
AQA GCSE (9–1 класс) ФИЗИКА 8463 GCSE PHYSICS 1st Paper 1 (отдельный естественные темы 1-4)
AQA GCSE (9-1 класс), комбинированный Научная трилогия по физике 8464 физика комбинированных наук 1-я статья 5 (Темы 18-21)
AQA GCSE (9–1 класс) ФИЗИКА 8463 GCSE PHYSICS 2nd Paper 2 (отдельный естественные темы 5-8)
AQA GCSE (9-1 класс), комбинированный Science Trilogy Physics 8464 вместе взятые научная физика 2-й доклад 6 (темы 22-24)
Следите за разделами только HT И убедитесь, что вы точно знаете, какой у вас курс GCSE. делаешь!
ВЕРХ СТР.
Обзоры редакций Edexcel для GCSE экзаменационные работы по биологии, химии, физике и комбинированным наукам
ALL EDEXCEL GCSE (Grade 9-1) Уровень 1 / Уровень 2 НАУКИ спецификации и резюме пересмотренной программы ссылки
Мои страницы справки по биологии Edexcel GCSE
Edexcel GCSE (9-1 класс) БИОЛОГИЯ 1-й экзамен GCSE BIOLOGY paper 1 (отдельный естественные науки 1-5)
Edexcel GCSE (9-1 класс), комбинированный Наука Биология 1 1-й вместе научная биология бумага (Темы 1-5)
Edexcel GCSE (9-1 класс) БИОЛОГИЯ 2-е место Документ 2 по БИОЛОГИИ GCSE (отдельные темы науки 1, 6-9)
Edexcel GCSE (9-1 класс), комбинированный Наука Биология 1 2-й вместе научная биология (Темы 1, 6–9)
Мои страницы справки по химии Edexcel GCSE
Edexcel GCSE (9-1 класс) ХИМИЯ 1-й выпуск GCSE ХИМИЯ Документ 1 (отдельный естественные науки 1-5)
Edexcel GCSE (9-1 класс), комбинированный Наука Химия 1-е объединенные науки химия бумага (Темы 1-4)
Edexcel GCSE (9-1 класс) ХИМИЯ 2-й выпускной экзамен по химии Документ 2 (отдельный естественные науки 1, 6-9)
Edexcel GCSE (9-1 класс), комбинированный Наука Химия 2-е объединенные науки химия бумага (Темы 1, 6-8)
Тесты по химии специально для Спецификации химии GCSE — соответствуют темам модуля химии
Мои страницы справки по физике Edexcel GCSE
Edexcel GCSE (9-1 класс) Физика 1-й экзамен GCSE PHYSICS Paper 1 (отдельный естественные темы 1-8)
Edexcel GCSE (9-1 класс), комбинированный Наука Физика 1-е объединение научная работа по физике (темы 1-6)
Edexcel GCSE (9-1 класс) Физика 2-й экзамен GCSE PHYSICS Paper 2 (отдельный Естественные науки Темы 1, 8-15)
Edexcel GCSE (9-1 класс), комбинированный Естественная физика 2-я объединенная физика науки бумага (темы 1, 8-15)
Остерегайтесь секций только HT И убедитесь, что вы точно знаете, какой у вас курс GCSE. делаешь!
ВЕРХ СТР.
Шлюз OCR Science Suite Обзорные обзоры для GCSE биологии, химии, экзамены по физике и комбинированным наукам
ALL OCR GCSE (Grade 9-1) Level 1 / Level 2 GATEWAY SCIENCE А ссылки на спецификации и ревизию учебной программы
My OCR Gateway GCSE Biology страницы справки
OCR (класс 9-1) GCSE Gateway наука БИОЛОГИЯ Бумага для первого выпускного экзамена по биологии (отдельные научные темы B1-3)
OCR (класс 9-1) GCSE Gateway Комбинированная наука А биология 1-я комбинированная научная биология (Темы B1-3)
OCR (класс 9-1) GCSE Gateway наука БИОЛОГИЯ Документ по БИОЛОГИИ для 2-го курса GCSE (отдельные научные темы B4-6)
OCR (класс 9-1) GCSE Gateway Комбинированная наука А биология 2-я комбинированная научная биология бумага (Темы B4-6)
My OCR Gateway GCSE Chemistry страницы справки
OCR (класс 9-1) GCSE Gateway естествознание ХИМИЯ A 1st GCSE ХИМИЯ бумага (отдельные научные темы C1-3)
OCR (класс 9-1) GCSE Gateway Комбинированная наука, химия, 1-е место комбинированная научная химия (Темы C1-3)
OCR (9–1 класс) GCSE Gateway science ХИМИЯ A 2nd Бумага GCSE CHEMISTRY (отдельные научные темы C4-6)
OCR (9–1 класс) GCSE Gateway Комбинированная наука и химия, 2-е место комбинированная наука химия бумага (Темы C4-6)
Тесты по химии специально для Спецификации химии GCSE — соответствуют темам модуля химии
My OCR Gateway GCSE Physics справочные страницы
OCR (9–1 класс) GCSE Gateway science ФИЗИКА A 1st GCSE Бумага по ФИЗИКЕ (отдельные научные темы P1-4)
OCR (9–1 класс) GCSE Gateway Комбинированная наука и физика 1-я комбинированная научная работа по физике (Темы P1-4)
OCR (9–1 класс) GCSE Gateway science ФИЗИКА A 2nd Документ по GCSE PHYSICS (отдельные научные темы P5-8)
OCR (9–1 класс) GCSE Gateway Комбинированная наука, физика, вторая комбинированная научная работа по физике (Темы P5-8)
Остерегайтесь секций только HT И убедитесь, что вы точно знаете, какой у вас курс GCSE. делаешь!
ВЕРХ СТР.
OCR 21-е Century Science Suite, версия Резюме для экзаменов GCSE по биологии, химии, физике и комбинированным естественным наукам
ВСЕ OCR GCSE (9–1 классы) Уровень 1 / Уровень 2 ДВАДЦАТЬ ПЕРВЫЙ CENTURY SCIENCE B — спецификации и обзорная версия программы — ссылки
Имейте в виду, что и Документ 1, и Документ 2 по биологии, химия или физика оценка содержания из ВСЕХ 6 глав 1-6 !!!
Работа 1 называется « Ширина по биологии / химии / физике » и Работа 2 называется « Глубина в биологии / химии / физике »
Моя помощь OCR 21st Century GCSE Biology страницы
OCR (9-1 класс) GCSE 21-й Вековая наука GCSE БИОЛОГИЯ B GCSE Бумага по БИОЛОГИИ (отдельные научные главы B1-3)
OCR (9-1 класс) GCSE 21-й Century Combined Science B биология Комбинированная научная статья по биологии (главы B1-3)
OCR (класс 9-1) GCSE 21 век наука GCSE БИОЛОГИЯ B GCSE БИОЛОГИЯ статья (отдельные научные главы B4-6)
OCR (9-1 класс) GCSE 21-й Century Combined Science B биология Комбинированная научная статья по биологии (главы B4-6)
Моя помощь OCR 21st Century GCSE Chemistry страницы
OCR (класс 9-1) GCSE 21 век наука ХИМИЯ B Документ GCSE CHEMISTRY (отдельные научные главы C1-3)
OCR (9-1 класс) GCSE 21-й Century Combined Science B химия Комбинированный доклад по естествознанию и химии (главы C1-3)
OCR (9-1 класс) GCSE 21-й Century Science ХИМИЯ B GCSE Статья по ХИМИИ (отдельные научные главы C4-6)
OCR (9-1 класс) GCSE 21-й Century Combined Science B химия Комбинированная статья по естествознанию и химии (главы C4-6)
Тесты по химии специально для Спецификации химии GCSE — соответствуют темам модуля химии
Моя помощь OCR 21st Century GCSE Physics страницы
OCR (9–1 класс) GCSE 21 Century Science PHYSICS B GCSE Работа по ФИЗИКЕ (отдельные научные главы P1-3)
OCR (9-1 класс) GCSE 21-й Century Combined Science B Physics Комбинированная научная работа по физике (главы P1-3)
OCR (класс 9-1) GCSE 21 век Наука ФИЗИКА B GCSE ФИЗИКА статья (отдельные научные главы P4-6)
OCR (класс 9-1) GCSE 21 век Комбинированная научная работа по физике B Комбинированная научная работа по физике (главы P4-6)
Следите за разделами только для HT И убедитесь, что вы точно знаете, какой у вас курс GCSE.
