Контрольная работа по химии в 11 классе (базовый уровень) | Методическая разработка по химии (11 класс) на тему:
Контрольная работа по химии 11 класс (УМК О.Габриеляна базовый уровень)
по темам «Строение атома», «Строение вещества».
Вариант 1
ЧастьА.
1) Модель атома «пудинг с изюмом» была предложена
А). Н.Бором. В). Дж. Томсоном.
Б). Э.Резерфордом. Г). Д.Чедвигом.
2) Порядковый номер элемента в периодической системе определяет:
А). Заряд ядра атома.
Б). Число электронов в наружном слое атома.
В). Число электронных слоёв в атоме.
Г). Число нейтронов в атоме.
3) Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней:
А). B и Si. Б). S и Sе. В). K и Са. Г). Mn и Fe.
4) s-элементом является:
А). Барий. Б). Америций. В). Галлий. Г). Ванадий.
5) Электронная конфигурация …3d64s2 соответствует элементу:
A). Аргону. Б). Железу. В). Криптону. Г). Рутению
Железу. В). Криптону. Г). Рутению
6) Амфотерным гидроксидом является вещество, формула которого:
А). Be(OH)2. Б). h3SiO3. В). Mg(OH)2 . Г). Ba(OH)2.
7) Ряд элементов, расположенных в порядке усиления металлических свойств:
А). Sr-Rb-K. Б). Na-K-Ca. В). Na-K-Cs. Г). Al-Mg-Be.
8) Элемент Э с электронной формулой 1s22s22p63s23p3 образует высший оксид, соответствующий формуле:
А). Э2О. Б). Э2О3. В). ЭО2. Г). Э2О5.
9) Изотоп железа, в ядре которого содержится 28 нейтронов, обозначают:
А). 54/26Fe. Б). 56/26Fe. В). 57/26Fe. Г). 58/26Fe.
10) Установите соответствие:
А).1s22s2 1). Бериллий.
Б).1s22s22p3 2). Натрий.
В).1s22s22p63s1 3). Хлор.
Г).1s22s22p63s23p5 4). Азот.
Формула высшего оксида.
1.Э2O 2. ЭО 3. Э2О5 4.Э2О7.
Формула высшего гидроксида
1.ЭOН 2. Э(ОН) 2 3. НЭО3 4.НЭО4.
11). Формула вещества с ковалентной полярной связью:
А) Cl2. Б). KCl. В). Nh4. Г). O2.
Б). KCl. В). Nh4. Г). O2.
12) Вещество, между молекулами которого существует водородная связь, -это:
А). Этанол. Б). Метан. В). Водород. Г). Бензол.
13). Число общих электронных пар в молекуле водорода:
А). Одна. Б). Две. В). Три. Г). Четыре
14) Полярность химической связи увеличивается в ряду соединений, формулы которых:
А). Nh4, HI, O2. Б). Ch5, h3O, HF. В). Ph4, h3S, h3. Г). HCl, Ch5, Cl2.
15) Кристаллическая решетка хлорида магния:
А). Атомная. Б). Металлическая. В). Ионная. Г). Молекулярная.
16) Молоко — это:
А). Суспензия. Б). Эмульсия. В). Золь. Г). Гель.
17) Самопроизвольное уменьшение объема геля, сопровождаемое отделением жидкости, называется
А). Коагуляция. Б). Седиментация. В). Синерезис. Г). Эффект Тиндаля.
Часть Б.
1). Составьте электронную формулу элемента с порядковым номером 32 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер. Запишите формулу его летучего водородного соединения.
Запишите формулы его высшего оксида и гидроксида, укажите их характер. Запишите формулу его летучего водородного соединения.
2) Составьте схемы образования соединений (электронную и структурную формулы), состоящих из химических элементов А). Кремния и хлора. Б). Натрия и азота.
Укажите тип химической связи и тип решетки в каждом соединении.
3) В 280 г 15% раствора хлорида цинка растворили 12 г этой же соли. Какова масса хлорида цинка в полученном растворе?
Вариант 2
Часть А.
1) (2 балла). Планетарная модель атома была предложена
А. Д.Менделеевым. В. Дж. Томсоном.
Б. Э.Резерфордом. Г. Д.Чедвигом.
2) (2 балла). Номер периода в Периодической системе определяет:
А). Заряд ядра атома.
Б). Число электронов в наружном слое атома.
В). Число электронных слоёв в атоме.
Г). Число электронов в атоме.
3) (2балла). Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней:
А). S и Cl. Б). Be и B. В). Kr и Xe. Г). Mo и Se.
S и Cl. Б). Be и B. В). Kr и Xe. Г). Mo и Se.
4) (2 балла). p-Элементом является:
А). Скандий. Б). Барий. В). Мышьяк. Г). Гелий.
5) (2 балла). Электронная конфигурация …3d104s2 соответствует элементу:
A). Кальцию. Б). Криптону. В). Кадмию. Г). Цинку.
6) ( 2 балла). Амфотерным гидроксидом является вещество, формула которого:
А). Zn(OH)2. Б). Mg(OH)2. В). Ca(OH)2 . Г). Cr(OH)2.
7) (2 балла). Ряд элементов, расположенных в порядке усиления металлических свойств:
А). Mg-Ca-Zn. Б). Al-Mg-Ca. В). Sr-Rb-K. Г).Ge-Si-Sb.
8) ( 2 балла). Элемент Э с электронной формулой 1s22s22p63s23p63d104s24p1 образует высший оксид, соответствующий формуле:
А). Э2О. Б). Э2О3. В). ЭО2. Г). ЭО3.
9) (2 балла) Изотоп кальция, в ядре которого содержится 22 нейтрона, обозначают:
А). 40/20Ca. Б). 42/20Ca. В). 44/20Ca. Г). 48/20Ca.
10) (9баллов). Установите соответствие.
А). 1s22s22p63s23p1 1). Алюминий.
1s22s22p63s23p1 1). Алюминий.
Б).1s22s22p63s2 2). Калий.
В).1s22s22p63s23p63d104s24p4 3). Селен.
Г).1s22s22p63s23p64s1 4). Магний.
Формула высшего оксида.
1.Э2O 2. Э2О3 3. ЭО 4.ЭО3.
Формула высшего гидроксида
1.ЭOН 2. Э(ОН)2 3. Э(ОН)3 4.Н2ЭО4.
11). (2 балла). Формула вещества с ионной связью:
А). HCl. Б). KBr. В). P4. Г). Ch4OH.
12). (2 балла). Вещество с металлической связью:
А). Оксид калия. Б). Медь. В). Кремний. Г). Гидроксид магния.
13). (2 балла). Число общих электронных пар в молекуле азота:
А). Одна. Б). Две. В). Три. Г). Четыре
14). (2 балла). Полярность химической связи уменьшается в ряду соединений, формулы которых:
А). Cl2, h3S, CO2. Б). Nh4, Ph4, SO2. В). HCl, HBr, HI. Г). Bh4, Nh4, HF.
15). (2 балла). Кристаллическая решетка оксида кремния (VI):
А). Атомная. Б). Металлическая. В). Ионная. Г). Молекулярная.
Атомная. Б). Металлическая. В). Ионная. Г). Молекулярная.
16). (2 балла). Эмалевая краска — это:
А). Суспензия. Б). Эмульсия. В). Золь. Г). Гель.
17). (2 балла). Слипание коллоидных частиц – это
А). Коагуляция. Б). Седиментация. В). Синерезис. Г). Эффект Тиндаля.
Часть Б.
1).(6 баллов). Составьте электронную формулу элемента с порядковым номером 30 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
2). (8 баллов). Составьте схему образования соединений (электронную и структурную формулы) , состоящих из химических элементов А). Азота и Водорода. Б). Натрия и Хлора
Укажите тип химической связи и тип решетки в каждом соединении.
3) (4 балла) Смешали 80 г раствора нитрата натрия с массовой долей 5% и 200 г 8% раствора той же соли. Какова процентная концентрация соли в полученном растворе?
Вариант 3
Часть А.
1) (2 балла). Квантовая модель атома была предложена
А. Н.Бором. В. Г.Мозли.
Б. Д.Менделеевым. Г. Д.Чедвигом.
2) (2 балла). Номер группы (для элементов главных подгрупп) в Периодической системе определяет:
А). Число протонов в атоме.
Б). Число электронов в наружном слое атома.
В). Число электронных слоёв в атоме.
Г). Число нейтронов в атоме.
3) (2балла). Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней:
А). Ba и K. Б). Sb и Bi. В). Ti и Ge. Г). Kr и Fe.
4) (2 балла). d-Элементом является:
А). Калий. Б). Кремний. В). Аргон. Г). Медь.
5) (2 балла). Электронная конфигурация …3d54s2 соответствует элементу:
A). Брому. Б). Кальцию. В). Марганцу. Г). Хлору.
6) ( 2 балла). Амфотерным оксидом является вещество, формула которого:
А). CrO. Б). Cr2O3. В). CrO3. Г). FeO.
7) (2 балла). Ряд элементов, расположенных в порядке усиления металлических свойств:
А). Al-Ga-Ge. Б). Ca-Sr-Ba. В). K-Na-Li. Г). Mg-Ca-Zn.
Al-Ga-Ge. Б). Ca-Sr-Ba. В). K-Na-Li. Г). Mg-Ca-Zn.
8) ( 2 балла). Элемент Э с электронной формулой 1s22s22p63s23p63d104s24p1 образует высший оксид, соответствующий формуле:
А). ЭО. Б). Э2О3. В). Э2О5. Г). ЭО3.
9) (2 балла) Изотоп железа, в ядре которого содержится 30 нейтронов, обозначают:
А). 54/26Fe. Б). 56/26Fe. В). 57/26Fe. Г). 58/26Fe.
10) (9 баллов). Установите соответствие.
А).1s22s22p1 1). Бор.
Б).1s22s1 2). Бром.
В).1s22s22p63s23p3 3). Фосфор.
Г).1s22s22p63s23p63d104s24p5 4). Литий.
Формула высшего оксида.
1.Э2O 2. Э2О3 3. Э2О5 4.Э2О7.
Формула высшего гидроксида
1.ЭOН 2. Н3ЭО4 3. Н3ЭО3 4.НЭО4.
11). (2 балла). Формула вещества с ковалентной неполярной связью:
А). MgCl2. Б). HF. В). N2. Г).Al.
12). (2 балла). Вещество с металлической связью:
(2 балла). Вещество с металлической связью:
А). Кислород. Б). Метан. В).Фторид натрия. Г). Этаналь.
13). (2 балла). Число общих электронных пар в молекуле фтора:
А). Одна. Б). Две. В). Три. Г). Четыре
14). (2 балла). Полярность химической связи уменьшается в ряду соединений, формулы которых:
А). HI, HCl2, HF. Б). HBr, O2, h3S. В). h3S, Nh4, Ch5. Г). h3O, Ph4, HI.
15). (2 балла). Кристаллическая решетка сахарозы:
А). Атомная. Б). Металлическая. В). Ионная. Г). Молекулярная.
16). (2 балла). Плазма крови — это:
А). Суспензия. Б). Эмульсия. В). Золь. Г). Гель.
17). (2 балла). Осаждение крупных частиц под действием силы тяжести называется
А). Коагуляция. Б). Седиментация. В). Синерезис. Г). Эффект Тиндаля.
Часть Б.
1).(6 баллов). Составьте электронную формулу элемента с порядковым номером 38 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
Запишите формулы его высшего оксида и гидроксида, укажите их характер.
2). (8 баллов). Составьте схемы образования соединений (электронную и структурную формулы), состоящих из химических элементов А). Магния и Фтора. Б). Углерода и Кислорода.
3) (4 балла) Смешали 120 г 2,5% раствора сульфата натрия и 10г 5% раствора той же соли. Какова масса сульфата натрия в полученном растворе?
Вариант 4
Часть А.
1) (2 балла). «Заряд ядра атома каждого элемента в таблице Менделеева возрастает на единицу по сравнению с зарядом ядра атома предыдущего элемента» — это формулировка закона
А. Г.Паули. В. Д.Менделеева
Б. Э.Резерфорда. Г. Г.Мозли
2) (2 балла). Общее число нейтронов в ядре атома элемента равно
А). Заряду ядра. Б). Атомной массе. В).Разности атомной массы и порядкового номера. Г). Порядковому номеру
3) (2балла). Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней:
А). Na и Li. Б). Cl и Br . В). Zn и Ca. Г). Mn и Fe.
Na и Li. Б). Cl и Br . В). Zn и Ca. Г). Mn и Fe.
4) (2 балла). d-Элементом является:
А). Германий. Б). Калий. В). Селен. Г). Уран.
5) (2 балла). Электронная конфигурация …4s24p6 соответствует элементу:
A). Брому. Б). Железу. В). Неону. Г). Криптону.
6) ( 2 балла). Амфотерным оксидом является вещество, формула которого:
А). Ga(OH)3. Б). Mg(OH)2. В). LiOH. Г). Sc(OH) 3 .
7) (2 балла). Ряд элементов, расположенных в порядке усиления металлических свойств:
А). K-Rb-Sr. Б). Al-Mg-Be. В). Be-Li-Cs. Г).Ge-Sn-Sb.
8) ( 2 балла). Элемент Э с электронной формулой 1s22s22p63s23p63d104s24p1 образует высший оксид, соответствующий формуле:
А). Э2О. Б). Э2О3. В). ЭО2. Г). ЭО3.
9) (2 балла) Изотоп кальция, в ядре которого содержится 24 нейтрона, обозначают:
А). 40/20Ca. Б). 42/20Ca. В). 44/20Ca. Г). 48/20Ca.
10) (9 баллов). Установите соответствие.
А).1s22s22p3 1). Азот.
Азот.
Б).1s22s22p63s23p4 2). Кальций.
В).1s22s22p63s23p2 3). Кремний.
Г).1s22s22p63s23p64s2 4). Сера.
Формула высшего оксида.
1.ЭO 2. ЭО2 3. Э2О5 4.ЭО3.
Формула высшего гидроксида
1.Н2ЭО4 2. Э(ОН)2 3. НЭО3 4.Н2ЭО3.
11). (2 балла). Формула вещества с металлической связью:
А). O2. Б). h3O. В). Ca. Г).Nh4.
12). (2 балла). Вещество только с ковалентной полярной связью:
А). Фтороводород. Б). Хлор. В).Пероксид натрия. Г). Фторид натрия.
13). (2 балла). Число общих электронных пар в молекуле бромоводорода:
А). Одна. Б). Две. В). Три. Г). Четыре
14). (2 балла). Полярность химической связи уменьшается в ряду соединений, формулы которых:
А). Ph4, HCl, HF. Б). HF, h3O, Nh4. В). Ch5, Ph4, h3O. Г). h3O, HI , Nh4.
15). (2 балла). Кристаллическая решетка белого фосфора:
А). Атомная. Б). Металлическая. В). Ионная. Г). Молекулярная.
Атомная. Б). Металлическая. В). Ионная. Г). Молекулярная.
16). (2 балла). Хрящи, сухожилия — это:
А). Суспензия. Б). Эмульсия. В). Золь. Г). Гель.
17). (2 балла). К истинным растворам относятся гомогенные система с размером частиц фазы
А). Более 100нм. Б). М енее 1 нм. В). От 1 до 100 нм Г). Размер не имеет значения.
Часть Б.
1).(6 баллов). Составьте электронную формулу элемента с порядковым номером 34 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
2). (8 баллов). Составьте схему образования соединений(электронную и структурную формулы), состоящих из химических элементов А). Серы и Водорода. Б). Натрия и Кислорода. Укажите тип химической связи и тип решетки в каждом соединении.
3) (4 балла) 8% раствор ацетата натрия массой 200 г разбавили 120 мл воды. Какова процентная концентрация соли в полученном растворе?
Вариант 5
Часть А.
1) (2 балла). «Свойства химических элементов и образованных ими соединений находятся в периодической зависимости от их относительных атомных масс» — это формулировка закона
А) .Г.Паули. В). Д.Менделеева
Б.) Э.Резерфорда. Г) .Г.Мозли
2) (2 балла). Общее число электронов в атоме элемента определяют, используя Периодическую систему по номеру:
А). Группы. Б). Периода. В). Ряда. Г). Порядковому.
3) (2балла). Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней:
А). Sn и Si. Б). As и Se. В). Zn и Ca. Г). Mo и Te.
4) (2 балла). f-Элементом является:
А). Германий. Б). Кальций. В). Самарий. Г). Лантан
5) (2 балла). Электронная конфигурация …5s25p4 соответствует элементу:
A). Цирконию. Б). Молибдену. В). Теллуру. Г). Олову.
6) ( 2 балла). Амфотерным оксидом является вещество, формула которого:
А). Fe(OH)3. Б). Mg(OH)2.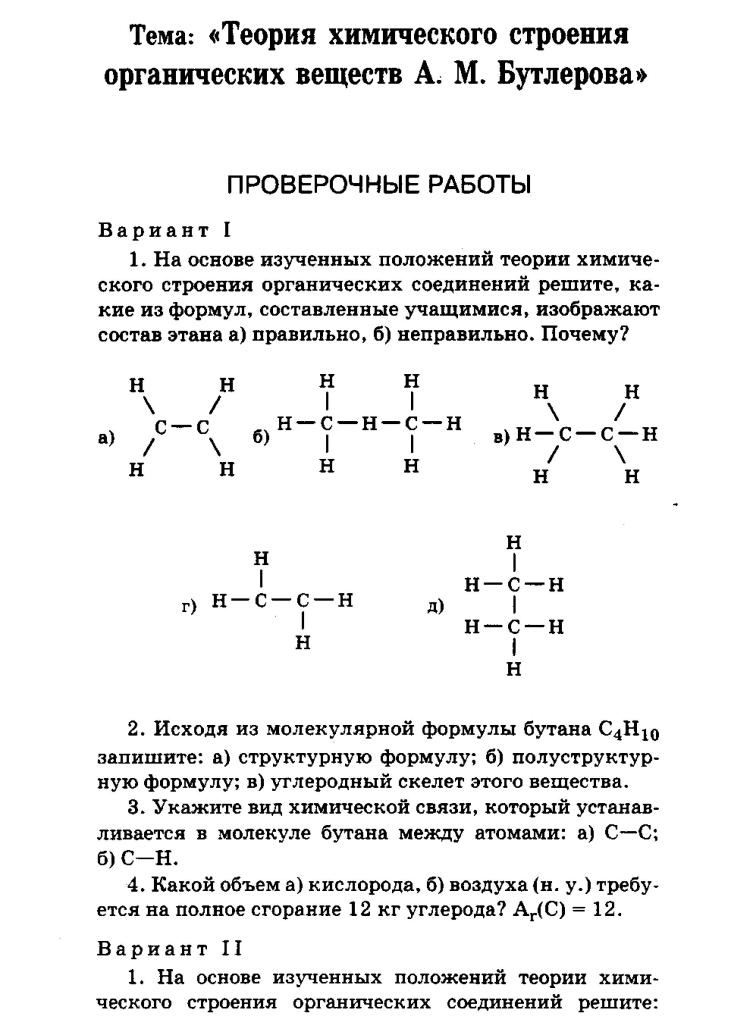 В). LiOH. Г). RbOH.
В). LiOH. Г). RbOH.
7) (2 балла). Ряд элементов, расположенных в порядке усиления металлических свойств:
А). K-Cs-Ba. Б). Al-Mg-Be. В). Be-Li-Al. Г).Ge-Sn-Pb.
8) ( 2 балла). Элемент Э с электронной формулой 1s22s22p63s23p63d104s24p2 образует высший оксид, соответствующий формуле:
А). Э2О. Б). Э2О3. В). ЭО2. Г). ЭО3.
9) (2 балла) Изотоп титана, в ядре которого содержится 22 нейтрона, обозначают:
А). 40/22Ti. Б). 42/22Ti. В). 44/22Ti. Г). 48/22Ti.
10) (9баллов). Установите соответствие.
А).1s22s22p3 1). Азот.
Б).1s22s22p63s23p4 2). Калий.
В).1s22s22p2 3). Углерод.
Г).1s22s22p63s23p64s1 4). Сера.
Формула высшего оксида.
1.Э2O 2. ЭО2 3. Э2О5 4.ЭО3.
Формула высшего гидроксида
1.Н2ЭО4 2. ЭОН 3. НЭО3 4.Н2ЭО3.
11). (2 балла). Формула вещества с ионной связью:
А). NaCl. Б). HBr. В). P4. Г). Ch3O.
12). (2 балла). Вещество с металлической связью:
А). Оксид кальция. Б). Ртуть. В).Аммиак. Г). Гидроксид алюминия.
13). (2 балла). Число общих электронных пар в молекуле кислорода:
А). Одна. Б). Две. В). Три. Г). Четыре
14). (2 балла). Полярность химической связи уменьшается в ряду соединений, формулы которых:
А). Cl2, h3S, SO2. Б). Nh4, Ph4, NO2. В). HF,HCl, HBr,. Г). Bh4, Nh4, BF3.
15). (2 балла). Кристаллическая решетка чугуна:
А). Атомная. Б). Металлическая. В). Ионная. Г). Молекулярная.
16). (2 балла). Дым — это:
А). Суспензия. Б). Эмульсия. В). Золь. Г). Аэрозоль.
17). (2 балла). Образование светящего конуса при пропускании через коллоидный раствор луча света называется
А). Коагуляция. Б). Седиментация. В). Синерезис. Г). Эффект Тиндаля.
Часть Б.
1).(6 баллов). Составьте электронную формулу элемента с порядковым номером 37 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
2). (8 баллов). Составьте схему образования соединений(электронную и структурную формулы), состоящих из химических элементов А). Углерода и Хлора. Б). Бария и Кислорода. Укажите тип химической связи и тип решетки в каждом соединении.
3) (4 балла) 200 г 10% раствора серной кислоты нагрели. При этом выпарилось 20 мл воды. Какова процентная концентрация кислоты в полученном растворе?
№ задания | Вариант 1 | Вариант 2 | Вариант 3 | Вариант 4 | Вариант 5 |
А1 | |||||
А2 | |||||
А3 | |||||
А4 | |||||
А5 | |||||
А6 | |||||
А7 | |||||
А8 | |||||
А9 | |||||
А10 | |||||
А11 | |||||
А12 | |||||
А13 | |||||
А14 | |||||
А15 | |||||
А16 | |||||
А17 | |||||
Б1 | |||||
Б2 | |||||
Б3 |
Методическая разработка по химии (11 класс) на тему: Методическая разработка по химии «Контрольная работа по теме «Строение вещества» для учащихся 11 классов
Контрольная работа № 1 по теме «Строение вещества»
Вариант 2
Часть 1
Для выполнения заданий 1-3 используйте следующий ряд химических элементов. Ответом в заданиях 1-3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
|
1.Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns2 np3. Запишите в поле ответа номера выбранных элементов.
Ответ:
2. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе Д. И. Менделеева находятся в главной подгруппе одной группы. Расположите выбранные элементы в порядке возрастания электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Ответ:
3. Из числа указанных в ряду элементов выберите два элемента, которые могут проявлять степень окисления, равную -3. Запишите в поле ответа номера выбранных элементов.
Ответ:
4. Из предложенного перечня выберите два вещества, в молекулах которых присутствует ионная химическая связь.
1) Ch4NO2 2) KNO2 3) Ch4Cl 4) NF3 5) HCOONh5
Запишите в поле ответа номера выбранных соединений.
Ответ:
5. Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА А) Na2O Б) MnO3 В) BeO | КЛАСС/ГРУППА
|
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ:
Контрольная работа по теме «Строение вещества»
Вариант 2
Часть 2
Ответом к заданиям 6-8 является число. Запишите это число в поле в тексте работы, соблюдая при этом указанную степень точности. |
6. Какую массу воды надо добавить к 150 г раствора гидроксида натрия с массовой долей 10%, чтобы получить раствор с массовой долей 2%. Определите массу воды ( в граммах) в полученном растворе.
Ответ: ____________г. (Запишите число с точностью до целых).
7. Какой объём (н.у.) углекислого газа теоретически образуется при сжигании 5 л (н.у.) угарного газа?
Ответ: ____________л. (Запишите число с точностью до целых).
8. Какой объём (н.у.) кислорода образуется при разложении 4 моль пероксида водорода?
Ответ: ____________л. (Запишите число с точностью до десятых).
КОНТРОЛЬНАЯ РАБОТА №1 по темам «Строение атома и периодический закон», «Строение вещества» I вариант 1.(2 балла).H2, O2, N2 – данные вещества образованы: а) ковалентной полярной б) ионной в) металлической г) ковалентной неполярной 2.(2 балла).Только ковалентная связь наблюдается в соединении с формулой: а) Ba(OH)2б) NH4NO3в) H2SO4г) Li2CO3 3.(2 балла).Полярная ковалентная связь наблюдается в следующем веществе: а) углекислый газ б) алмаз в) сера г) фосфор 4.(2 балла).Найдите вещество, имеющее металлический тип связи: а) мышьяк б) галлий в) фосфор г) иод 5.(2 балла).Укажите название вещества, молекулы которого способны к образованию водородных связей: а) водород б) гидрид натрия в) муравьиная кислота г) метан 6.(2 балла).Вещество, образованное элементами с порядковыми номерами 1 и 9, имеет кристаллическую решетку: а) атомную б) молекулярную в) ионную г) металлическую 7.(2 балла).Воск имеет строение: а) твердое кристаллическое б) жидкое в) газообразное г) твердое аморфное 8.(4 балла). Установите соответствие между составом атома и положением элемента в Периодической системе. Состав атома: Положение элемента в Периодической системе: 19р, 20п, 19ē; А) 4-й период IIIБ группы; 21 р, 24п, 21ē; Б) 4-й период IA группы; 29р, 35n, 29ē; В) 4-й период IIIA группы; 31 р, 39п, 31ē. Г) 4-й период IБ группы. 9.(4 балла). Установите соответствие между типом элемента и химическим элементом. Тип элемента:Химический элемент: s;А) калий; р; Б) фосфор; d.В) неон; Г) цинк. 10.(3 балла). Установите соответствие между дисперсной системой и агрегатным состоянием дисперсной фазы и дисперсионной среды. Дисперсная система:Агрегатное состояние дисперсной фазы / дисперсионной среды: минеральная вода;А) газ / жидкость; 2) снежный наст;Б) газ / твердое вещество; 3)нержавеющая сталь. В) твердое вещество / твердое вещество. 11.(4 балла). Вычислите массовые доли элементов в этанале СН3СНО. 12. (4 балла). Какова массовая доля поваренной соли в растворе, полученном при разбавлении 100 г 20% -го раствора 100 г воды. 13. (4 балла). Найти объем азота в 250л воздуха, если содержание его в воздухе составляет 78%. 14. (4 балла). Найти массу цинка в 50 г технического цинка, содержащего 25% примесей. КОНТРОЛЬНАЯ РАБОТА №1 по темам «Строение атома и периодический закон», «Строение вещества» III вариант 1.(2 балла).Между атомами каких элементов химическая связь будет иметь ионный характер : а) К и О б) Si и Cl в) S и O г) P и Br 2.(2 балла).Только ковалентная связь наблюдается в соединении с формулой: а) H2SO3б) NH4NO3в) Fe(OH)2г) Li2SiO3 3.(2 балла).Полярная ковалентная связь наблюдается в следующем веществе: а) водород б) алмаз в) аммиак г) хлор 4.(2 балла).Найдите вещество, имеющее металлический тип связи: а) кремний б) висмут в) фосфор г) иод 5.(2 балла).Укажите название вещества, молекулы которого способны к образованию водородных связей: а) водород б) гидрид калия в) муравьиная кислота г) бутан 6.(2 балла).Вещество, образованное элементами с порядковыми номерами 3 и 1, имеет кристаллическую решетку: а) атомную б) молекулярную в) ионную г) металлическую 7.(2 балла).Полиэтилен имеет строение: а) твердое кристаллическое б) жидкое в) газообразное г) твердое аморфное 8.(4 балла). Установите соответствие между составом атома и положением элемента в Периодической системе. Состав атома: Положение элемента в Периодической системе: 1)55р, 78п, 55ē; А) 6-й период IБ группы; 2) 83 р, 126п, 83ē; Б) 6-й период VA группы; 3)73р, 108n, 73ē; В) 6-й период VБ группы; 4)79 р, 118п, 79ē. Г) 6-й период IА группы. 9.(4 балла). Установите соответствие между типом элемента и химическим элементом. Тип элемента:Химический элемент: 1)s;А) германий; 2)р; Б) кобальт; 3)d. В) криптон; Г) стронций. 10.(3 балла). Установите соответствие между дисперсной системой и агрегатным состоянием дисперсной фазы и дисперсионной среды. Дисперсная система:Агрегатное состояние дисперсной фазы / дисперсионной среды: 1)смог;А) твёрдое вещество/ газ; 2) пенобетон;Б) газ / твердое вещество; 3)гранит. В) твердое вещество / твердое вещество. 11.(4 балла). Вычислите массовые доли элементов в муравьиной кислоте НСООН. 12. (4 балла). В 200 г воды растворили. Вычислите массовую долю сахара в полученном растворе. 13. (4 балла). Найти объем азота в 40л воздуха, если содержание его в воздухе составляет 78%. 14. (4 балла). Найти массу железа в 50 г технического железа, содержащего 10% примесей. | КОНТРОЛЬНАЯ РАБОТА №1 по темам «Строение атома и периодический закон», «Строение вещества» II вариант 1.(2 балла).Между атомами каких элементов химическая связь будет иметь ионный характер : а) Li и F б) C и O в) S и CI г) Si и H 2.(2 балла).Только ковалентная связь наблюдается в соединении с формулой: а) Mg(OH)2б) NH4NO3в) K2SO4г) H2CO3 3.(2 балла).Только ионные связи наблюдается в веществе: а) оксид натрия б) сульфат меди в) гидроксид кальция г) сероводород 4.(2 балла).Найдите вещество, имеющее металлический тип связи: а) ртуть б) хлор в) сера г) кремний 5.(2 балла).Укажите название вещества, молекулы которого способны к образованию водородных связей: а) водород б) гидрид кальция в) уксусная кислота г) пропан 6.(2 балла).Вещество, образованное элементами с порядковыми номерами 35 и 12, имеет кристаллическую решетку: а) атомную б) молекулярную в) ионную г) металлическую 7.(2 балла).Метан имеет строение: а) твердое кристаллическое б) жидкое в) газообразное г) твердое аморфное 8.(4 балла). Установите соответствие между составом атома и положением элемента в Периодической системе. Состав атома: Положение элемента в Периодической системе: 1)38р, 50п, 38ē; А) 5-й период IIБ группы; р, 64п, 48ē; Б) 5-й период VIA группы; 3)42р, 54n, 42ē; В) 5-й период IIA группы; 4)52 р, 76п, 72ē. Г) 5-й период VIБ группы. 9.(4 балла). Установите соответствие между типом элемента и химическим элементом. Тип элемента:Химический элемент: 1)s;А) кальций; 2)р; Б) ванадий; 3)d.В) теллур; Г) молибден. 10.(3 балла). Установите соответствие между дисперсной системой и агрегатным состоянием дисперсной фазы и дисперсионной среды. Дисперсная система:Агрегатное состояние дисперсной фазы / дисперсионной среды: 1)чугун;А) твёрдое вещество / газ; 2) смог;Б) газ / твердое вещество; 3)пористый шоколад . В) твердое вещество / твердое вещество. 11.(4 балла). Вычислите массовые доли элементов в этаноле С2Н5ОН. 12. (4 балла). В 300 г морской воды содержится 15 г солей. Вычислите массовую долю солей в этом образце морской воды. 13. (4 балла). Найти объем кислорода в 50л воздуха, если содержание его в воздухе составляет 21%. 14. (4 балла). Найти массу магния в 14 г технического магния, содержащего 2% примесей. КОНТРОЛЬНАЯ РАБОТА №1 по темам «Строение атома и периодический закон», «Строение вещества» IV вариант 1.(2 балла).Na2O,K2O,Ca3N2 – данные вещества образованы: а) ковалентной полярной б) ионной в) металлической г) ковалентной неполярной 2.(2 балла).Только ковалентная связь наблюдается в соединении с формулой: а)NaOH б) NH4NO3 в) H3PO4 г) CaSO3 3.(2 балла).Полярная ковалентная связь наблюдается в следующем веществе: а) кислород б) алмаз в) сероводород г) бром 4.(2 балла).Найдите вещество, имеющее металлический тип связи: а) хром б) азот в) неон г) углерод 5.(2 балла).Укажите название вещества, молекулы которого способны к образованию водородных связей: а) водород б) гидрид натрия в) салициловая кислота г) этан 6.(2 балла).Вещество, образованное элементами с порядковыми номерами 1 и 17, имеет кристаллическую решетку: а) атомную б) молекулярную в) ионную г) металлическую 7.(2 балла).Янтарь имеет строение: а) твердое кристаллическое б) жидкое в) газообразное г) твердое аморфное 8.(4 балла). Установите соответствие между составом атома и положением элемента в Периодической системе. Состав атома: Положение элемента в Периодической системе: 1)53р, 73п, 53ē; А) 5-й период IIА группы; 2)30р, 35п, 30ē; Б) 5-й период VIIA группы; 3)38р, 50n, 38ē; В) 5-й период IIБ группы; 4)43 р, 56п, 43ē. Г) 5-й период VIIБ группы. 9.(4 балла). Установите соответствие между типом элемента и химическим элементом. Тип элемента:Химический элемент: 1)s;А) рубидий; 2)р; Б) бром; 3)d.В) серебро; Г) никель. 10.(3 балла). Установите соответствие между дисперсной системой и агрегатным состоянием дисперсной фазы и дисперсионной среды. Дисперсная система:Агрегатное состояние дисперсной фазы / дисперсионной среды: 1)дым;А) газ / твёрдое вещество; 2) цветное стекло;Б) твёрдое вещество / газ; 3)кирпич В) твердое вещество / твердое вещество. 11.(4 балла). Вычислите массовые доли элементов в анилине С6Н5NH2. 12. (4 балла). Какова массовая доля поваренной соли в растворе, полученном при упаривании 200 г 10% -го раствора до 100 г воды. 13. (4 балла). Найти объем кислорода в 55л воздуха, если содержание его в воздухе составляет 21%. 14. (4 балла). Найти массу цинка в 24 г технического цинка, содержащего 15% примесей. |
Строение вещества
Цель урока: проверить уровень усвоения знаний по теме “Строение вещества”.
Ход урока
1. Организационный момент
2. Вступительное слово
Сегодня вы выполняете контрольную тестированную работу по теме “Строение вещества”, которая включает 4 блока. 1 - “Химическая связь”, 2 — “Состояние вещества”, 3 - “Дисперсные системы”, 4 — “Решение задач на смеси”. В три блока включены задания в тестовой форме со свободной формой ответа и задание на соотнесение, в четвертом блоке даны расчетные задачи на смеси (вычисления, связанные с понятием “доля”). Контрольная работа оценивается в 64 балла, каждое задание с выбором и решение задач оценивается тремя баллами, а задание на соотнесение — четырьмя баллами. Выставляется отметка “5”, если за выполнение контрольной работы вы набираете не менее 59 баллов. Система оценки следующая: 0-20 баллов – “2”, 21-41 балла – “3”, 41-58 балла — “4”, 59-64 балла – “5”. Желаю удачи в выполнении работы.
Контрольная тестированная работа по теме “Строение вещества” 11 класс.
I вариант
I. Химическая связь
1. Между атомами, каких элементов химическая связь будет иметь ионный характер:
а) N и O
б) Si и CI
в) Na и O
г) P и Br
2. Только ковалентная связь наблюдается в соединении с формулой:
а) Ba(OH)2
б) NH4NO3
в) H2SO4
г) Li2CO3
3. Соотнесите:
| Название вещества: | Тип связи: |
| 1. кремний | а) металлическая |
| 2. хлорид калия | б) ковалентная полярная |
| 3. сульфид фосфора | в) ионная |
| 4. натрий | г) ковалентная неполярная |
| 5. хлороводород | |
| 6. сера |
4. Неполярная ковалентная связь наблюдается в следующем веществе:
а) углекислый газ
б) алмаз
в) аммиак
г) хлороформ
5. Найдите вещество, имеющее металлический тип связи:
а) мышьяк
б) галлий
в) фосфор
г) иод
6. Укажите название вещества, молекулы которого способны к образованию водородных связей:
а) водород
б) гидрид натрия
в) муравьиная кислота
г) метан
II. Состояние вещества
1. Вещество, образованное элементами с порядковыми номерами 37 и 17, имеет кристаллическую решетку:
а) атомную
б) молекулярную
в) ионную
г) металлическую
2. Стекло имеет строение:
а) твердое кристаллическое
б) жидкое
в) газообразное
г) твердое аморфное
3. Вещества: фосфор, алмаз, магний – имеют кристаллические решетки соответственно:
а) молекулярную, ионную, металлическую
б) атомную, молекулярную, ионную
в) молекулярную, атомную, металлическую
г) атомную, металлическую, молекулярную
4. Какие из перечисленных признаков характерны для веществ с металлическим типом связи:
а) электропроводность
б) теплопроводность
в) диэлектрические свойства
г) пластичность
д) растворимость в полярных растворителях
5. Газы отличаются от твердых веществ:
а) расстоянием между частицами
б) наличием формы, объема
в) образованием упорядоченных структур
г) наличием кристаллической решетки
III. Дисперсные системы
1. Взвесями называются:
а) грубодисперсными
б) тонкодисперсными
в) коллоидами
г) истинными растворами
2. Поваренная соль в воде образует:
а) молекулярный
б) ионно-молекулярный
в) ионный
г) коллоид
3. Коагуляция – это:
а) выделение воды
б) дробление частиц
в) оседание частиц
г) растворение частиц
4. Пищеварительные соки – это:
а) суспензии
б) эмульсии
в) коллоидный раствор
г) истинный раствор
5. Эмульсия – это:
а) жидкость в жидкости
б) твердое вещество в жидкости
в) жидкость в газе
г) Газ в жидко
Контрольная работа №2 по теме «Строение вещества»( химии 11 класс)
Контрольная работа №2 по теме «Строение вещества»
Вариант 1
- Определите типы химических связей в веществах: PCL3, Rb2O, O3, Zn. Представьте схему образования PCL3
- В каком из оксидов: Аl2O3 или Fe2O3 массовая доля металла выше? Ответ подтвердите расчетами.
- Вычислите объем газа который образуется при разложении 300г известняка, содержащего 10% примесей, если выход продукта составил 97% от теоретически возможного.
Контрольная работа №2 по теме «Строение вещества»
Вариант 2
- Определите типы химических связей в веществах: AlCL3, Р2O3, S8, Hg. Представьте схему образования Р2O3.
- В каком из оксидов: Mn2O3 или MnO2 массовая доля металла выше? Ответ подтвердите расчетами.
- Вычислите объем газа, который образуется при растворении 40г цинка в 100г 60%-ного раствора соляной кислоты, если выход продукта составил 95% от теоретически возможного.
Контрольная работа №2 по теме «Строение вещества»
Вариант 3
- Определите типы химических связей в веществах: BaCL2, P2O5, P4, Cu. Представьте схему образования BaCL2.
- В каком из оксидов: Cr2O3 или CrO, массовая доля металла выше? Ответ подтвердите расчетами.
- Вычислите объем газа, который образуется при взаимодействии 33,6 л азота и 44,8л водорода, если выход продукта составил 85% от теоретически возможного.
Контрольная работа №2 по теме «Строение вещества»
Вариант 4
- В каком из оксидов: Cr2O3 или CrO массовая доля металла выше? Ответ подтвердите расчетами.
Вычислите объем газа, который образуется при дегидратации 300г 96%-ного этилового спирта, если выход продукта составил 90% от тео
Просмотр содержимого документа
«Контрольная работа №2 по теме «Строение вещества»( химии 11 класс)»
Читать контрольная по химии: «Химическая связь и строение вещества» Страница 1
(Назад) (Cкачать работу)
Функция «чтения» служит для ознакомления с работой. Разметка, таблицы и картинки документа могут отображаться неверно или не в полном объёме!
1ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Вологодский государственный Технический Университет
Кафедра: электроснабжение
Контрольная работа
по химии
ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ ВЕЩЕСТВА
Выполнил: Артамонов Евгений Николаевич
Группа: ЗЭСВ-11
Шифр:09013203102
Вологда 2010
СОДЕРЖАНИЕ
I Химическая связь
1.1 Химическая связь и типы химической связи
1.2 Ковалентная связь
1.3 Ионная связь
1.4 Ионные кристаллы
1.5 Металлическая связь
1.6 Связь в комплексных соединениях
1.7 Валентность и степень окисления элементов
1.8 Стеохимическая валентность
1.9 Заряд ионов
II Строение вещества
2.1 Молекулы химических соединений
2.2 Размеры и масса атомов и молекул
2.3 Строение многоатомных молекул
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
I Химическая связьХимические элементы встречаются в природе главным образом не в виде отдельных атомов, а в виде сложных или простых веществ. Лишь благородные газы – гелий, неон, аргон, криптон и ксеон – находятся в природе в атомном состоянии, что объясняется устойчивостью электронных оболочек атомов благородных газов. Во всех других простых и сложных веществах атомы связаны химическими силами. Существует несколько типов химической связи, важнейшие из них – ковалентная, ионная и металлическая.
В общем случае химическая связь образуется, если полная энергия системы, состоящей из взаимно-действующих атомов, при сближении атомов понижается.
Пользуясь понятием электроотрицательности элементов, можно предвидеть основные три случая химического взаимодействия между атомами:
Химические реакции происходят между атомами элементов, электроотрицательности которых резко отличаются, например, атомами щелочных металлов и атомами галогенов.Химические реакции происходят между атомами элементов, электроотрицательности которых одинаковы. Такое взаимодействие наблюдается при образовании газов (Н2 ,Р2, Cl 2, О2, N2), молекулы которых состоят из 2-х одинаковых атомов.Вступать в химические реакции могут атомы элементов, электроотрицательности которых отличаются, но не очень сильно. Этот случай является промежуточным между двумя первыми крайними и встречаются особенно часто. Примерами его является образование молекул водорода Н2О, хлородоводорода HCl, метана СН4, и многих других веществ.
В зависимости от того, к какому случаю следует отнести данное химическое взаимодействие элементов, различают определенный тип химической связи. Надо учесть, что между этими типами химических связей нет резких границ. Между ними существует постепенный взаимопереход. Поэтому во многих химических соединениях одновременно существуют разные типы связей. Это объясняет последовательным изменением электроотрицательностей химических элементов.
- Химическая связь и типы химической связи
Химическая связь – это взаимное сцепление атомов в молекуле и кристаллической решетке в результате действия между атомами электрических сил применения.
Появления атомной модели бора, впервые объяснившей строение электронной оболочки атома, способствовало созданию представления о химической связи и ее
Что такое химия? | Живая наука
Вы можете думать о химии только в контексте лабораторных тестов, пищевых добавок или опасных веществ, но область химии включает в себя все, что нас окружает.
«Все, что вы слышите, видите, запах, вкус и прикосновение, связано с химией и химическими веществами (материей)», — согласно Американскому химическому обществу (ACS), некоммерческой научной организации по развитию химии, учрежденной США. Конгресс. «А слышание, видение, дегустация и прикосновение — все это связано с запутанной серией химических реакций и взаимодействий в вашем теле.»
Итак, даже если вы не работаете химиком, вы занимаетесь химией или чем-то, что связано с химией, практически со всем, что вы делаете. В повседневной жизни вы занимаетесь химией, когда готовите, когда используете уборку. моющие средства, чтобы вытереть столешницу, когда вы принимаете лекарства или разбавляете концентрированный сок, чтобы вкус не был таким интенсивным.
Связанный: Вау! Огромный взрыв «сахарной ваты» в детской химической лаборатории
Согласно ACS, химия — это исследование материи, определяемой как все, что имеет массу и занимает пространство, а также изменения, которые материя может претерпеть, когда она находится в различных средах и условиях.Химия стремится понять не только свойства материи, такие как масса или состав химического элемента, но также то, как и почему материя претерпевает определенные изменения — трансформировалось ли что-то из-за того, что оно соединилось с другим веществом, замерзло, потому что оно оставалось на две недели в морозильник или изменил цвет из-за слишком сильного воздействия солнечного света.
Основы химии
Причина, по которой химия затрагивает все, что мы делаем, заключается в том, что почти все, что существует, можно разбить на химические строительные блоки.
Основными строительными блоками в химии являются химические элементы, которые представляют собой вещества, состоящие из одного атома. Каждое химическое вещество уникально, состоит из определенного количества протонов, нейтронов и электронов и идентифицируется по названию и химическому символу, например «C» для углерода. Элементы, которые ученые обнаружили на данный момент, перечислены в периодической таблице элементов и включают как элементы, встречающиеся в природе, такие как углерод, водород и кислород, так и созданные человеком, например Лоуренсий.
Связанный: Как элементы сгруппированы в периодической таблице?
Химические элементы могут соединяться вместе, образуя химические соединения, которые представляют собой вещества, состоящие из нескольких элементов, таких как диоксид углерода (который состоит из одного атома углерода, соединенного с двумя атомами кислорода), или нескольких атомов одного элемента, как газообразный кислород (который состоит из двух атомов кислорода, соединенных вместе). Эти химические соединения могут затем связываться с другими соединениями или элементами, образуя бесчисленное множество других веществ и материалов.
Химия — это физическая наука
Химия обычно считается физической наукой в соответствии с определением Британской энциклопедии, поскольку изучение химии не связано с живыми существами. Большая часть химии, связанной с исследованиями и разработками, такими как создание новых продуктов и материалов для клиентов, относится к этой сфере.
Но, по мнению Биохимического общества, различие как физическая наука становится немного размытым в случае биохимии, которая исследует химию живых существ.Химические вещества и химические процессы, изучаемые биохимиками, технически не считаются «живыми», но их понимание важно для понимания того, как устроена жизнь.
Химия — это физическая наука, что означает, что она не касается «живых» существ. Один из способов, которым многие люди регулярно занимаются химией, возможно, даже не осознавая этого, — это приготовление пищи и выпечка. (Изображение предоставлено Shutterstock)Пять основных разделов химии
Согласно онлайн-учебнику химии, опубликованному LibreText, химия традиционно делится на пять основных направлений.Существуют также более специализированные области, такие как пищевая химия, химия окружающей среды и ядерная химия, но в этом разделе основное внимание уделяется пяти основным субдисциплинам химии.
Аналитическая химия включает в себя анализ химических веществ и включает качественные методы, такие как изучение изменений цвета, а также количественные методы, такие как определение точной длины (длин) волны света, которую поглощает химическое вещество, что приводит к изменению цвета.
Эти методы позволяют ученым охарактеризовать множество различных свойств химических веществ и могут принести пользу обществу разными способами.Например, аналитическая химия помогает пищевым компаниям делать замороженные обеды вкуснее, обнаруживая, как химические вещества в продуктах питания меняются с течением времени. Аналитическая химия также используется для мониторинга состояния окружающей среды, например, путем измерения химических веществ в воде или почве.
Биохимия , как упоминалось выше, использует химические методы, чтобы понять, как биологические системы работают на химическом уровне. Благодаря биохимии исследователи смогли составить карту генома человека, понять, что различные белки делают в организме, и разработать лекарства от многих болезней.
Связано: Раскрытие генома человека: 6 молекулярных вех
Неорганическая химия изучает химические соединения в неорганических или неживых объектах, таких как минералы и металлы. Традиционно неорганическая химия рассматривает соединения, которые не , а содержат углерод (которые охватываются органической химией), но это определение не совсем точное, согласно ACS.
Некоторые соединения, изучаемые в неорганической химии, такие как «металлоорганические соединения», содержат металлы, которые связаны с углеродом — основным элементом, изучаемым в органической химии.Таким образом, такие соединения считаются частью обеих областей.
Неорганическая химия используется для создания множества продуктов, включая краски, удобрения и солнцезащитные кремы.
Органическая химия занимается химическими соединениями, содержащими углерод — элемент, который считается необходимым для жизни. Химики-органики изучают состав, структуру, свойства и реакции таких соединений, которые наряду с углеродом содержат другие неуглеродные элементы, такие как водород, сера и кремний.Органическая химия используется во многих областях, как описано в ACS, таких как биотехнология, нефтяная промышленность, фармацевтика и пластмассы.
Физическая химия использует концепции физики, чтобы понять, как работает химия. Например, выяснить, как атомы движутся и взаимодействуют друг с другом, или почему некоторые жидкости, включая воду, превращаются в пар при высоких температурах. Физические химики пытаются понять эти явления в очень малом масштабе — на уровне атомов и молекул — чтобы сделать выводы о том, как работают химические реакции и что придает конкретным материалам их собственные уникальные свойства.
Согласно ACS, этот тип исследований помогает информировать другие отрасли химии и важен для разработки продуктов. Например, физико-химики могут изучать, как определенные материалы, такие как пластик, могут реагировать с химическими веществами, с которыми материал предназначен для контакта.
Чем занимаются химики?
Химики работают в различных областях, включая исследования и разработки, контроль качества, производство, защиту окружающей среды, консалтинг и право. Согласно ACS, они могут работать в университетах, в правительстве или в частном секторе.
Вот несколько примеров того, чем занимаются химики:
Исследования и разработки
В академических кругах химики, выполняющие исследования, стремятся получить дополнительные знания по определенной теме и не обязательно имеют в виду конкретное приложение. Однако их результаты все еще могут быть применены к соответствующим продуктам и приложениям.
В промышленности химики, занимающиеся исследованиями и разработками, используют научные знания для разработки или улучшения конкретного продукта или процесса.Например, пищевые химики улучшают качество, безопасность, хранение и вкус продуктов; химики-фармацевты разрабатывают и анализируют качество лекарств и других лекарственных форм; а агрохимики разрабатывают удобрения, инсектициды и гербициды, необходимые для крупномасштабного растениеводства.
Иногда исследования и разработки могут включать не улучшение самого продукта, а скорее производственный процесс, связанный с его изготовлением. Инженеры-химики и инженеры-технологи придумывают новые способы сделать производство своей продукции более простым и рентабельным, например, увеличить скорость и / или выход продукта при заданном бюджете.
Охрана окружающей среды
Химики-экологи изучают, как химические вещества взаимодействуют с окружающей средой, характеризуя химические вещества и химические реакции, присутствующие в естественных процессах в почве, воде и воздухе. Например, ученые могут собирать почву, воду или воздух в интересующем месте и анализировать их в лаборатории, чтобы определить, загрязнила ли деятельность человека окружающую среду или повлияет ли она на нее иным образом. Некоторые химики-экологи также могут помочь восстановить или удалить загрязнители из почвы, по словам У.С. Бюро статистики труда.
Связано: Почему удобрения опасны (инфографика)
Ученые с опытом работы в области химии окружающей среды могут также работать в качестве консультантов в различных организациях, таких как химические компании или консалтинговые фирмы, предоставляя рекомендации о том, как можно выполнять практические действия и процедуры. соответствие экологическим нормам.
Закон
Химики могут использовать свое академическое образование, чтобы давать советы или защищать научные вопросы.Например, химики могут работать в сфере интеллектуальной собственности, где они могут применять свои научные знания к вопросам авторского права в науке, или в области экологического права, где они могут представлять группы с особыми интересами и подавать заявки на одобрение регулирующих органов до того, как будут осуществляться определенные действия.
Химики также могут выполнять анализы, помогающие правоохранительным органам. Судебные химики собирают и анализируют вещественные доказательства, оставленные на месте преступления, чтобы помочь установить личности причастных к делу людей, а также ответить на другие жизненно важные вопросы о том, как и почему было совершено преступление.Судебные химики используют широкий спектр методов анализа, таких как хроматография и спектрометрия, которые помогают идентифицировать и количественно определять химические вещества.
Дополнительные ресурсы:
Чем занимается химик? — CareerExplorer
Career ExplorerВаш Совместимость
Карьера Обзор
Средняя зарплата
72 тыс. Долл. США
Рынок труда
6 %
Как к Стали
Вакансии
Образование
Бакалавр
В дальнейшем Ресурсы
Удовлетворение
Низкий
Личность
Следственный
Демография
Работа Окружающая среда
- Просмотреть все физические науки
- Карьера
- Наука
- Физические науки
- Химик
- Обзор
Chem4Kids.com: Атомы
Что такое атом? Атомы — это строительные блоки. Если вы хотите создать язык, вам понадобится алфавит. Если вы хотите построить молекулы, вам понадобятся атомы из разных элементов. Элементы — это алфавит на языке молекул.
Каждый элемент немного отличается от остальных. В английском языке вы знаете, что «B» отличается от «C.» В химии «B» также отличается от «C», потому что бор (B) и углерод (C) — это разные элементы с атомами, которые имеют разную структуру.Атомы определяются как наименьшие единицы материи, которые обладают свойствами отдельного элемента.
Есть ли частицы вещества меньше атома? Конечно. Атомы состоят из более мелких и даже более мелких частиц вещества. Однако эти более мелкие частицы не обладают свойствами элемента. Электроны в атоме золота (Au) такие же, как электроны в атоме неона (Ne). В химии нам нравится изучать атомы, потому что Вселенная вращается вокруг свойств элементов, а не обязательно свойств электрона или протона.
Например, у вас есть слиток золота. Вы знаете, что этот стержень состоит из материи, потому что все состоит из материи. Поскольку это чистое золото, в слитке есть только атомы золота. Если бы у вас в руке был только один атом золота, он имел бы те же свойства, что и любой другой атом золота в этом слитке. Но что, если бы у вас был только один электрон от атома золота? Этот электрон больше не обладал бы свойствами золота. Это был бы просто электрон, делающий электронные вещи. Атом — это наименьшая единица, обладающая свойствами элемента.
Мы можем научить вас общей структуре атома, но вам нужно изучить атомы из разных элементов, чтобы действительно узнать, как атомы работают.
Давайте снова поработаем с идеей алфавита. Если вы читаете книгу, вы найдете слова на каждой странице. Эти слова составляют буквы. В английском языке всего двадцать шесть букв, но мы можем составить тысячи слов. В химии вы работаете почти со 120 элементами. Когда вы их объединяете, вы можете получить миллионы разных молекул.
Молекулы — это группы атомов, точно так же, как слова — это группы букв. «А» всегда будет «А», независимо от того, в каком слове он находится. Атом натрия (Na) всегда будет атомом натрия, независимо от того, в какой молекуле он находится. Хотя атомы разных элементов имеют разные массы и структуры, все они построены из одинаковых деталей. Электроны, протоны и нейтроны — основные субъединицы всех атомов во Вселенной.
Если вы хотите немного подумать, представьте мельчайшие частицы материи.Сверхмалые субатомные частицы используются для создания частей атомов. Протоны, нейтроны и электроны могут затем организовать атомов . Затем атомы используются для создания молекул вокруг нас. Как мы только что узнали, в известных нам молекулах содержится почти 120 элементов. Более мелкие молекулы могут работать вместе и строить макромолекул . Это просто продолжается. Все, что вы видите или представляете, построено на чем-то другом.
Вы можете начать с малого…
— Частицы материи
— Атомы
— Молекулы
— Макромолекулы
— Органеллы клетки
— Ячейки
— Салфетки
— Органы
— Системы
— Организмы
— Население
чел.
— Экосистемы
— Биомы
— Планеты
— Системы со звездами
— Галактики
— Вселенная
…И финиш действительно большой.
Вау! Все это возможно благодаря атомам.
Звезда выворачивается наизнанку (видео НАСА)
ВВЕДЕНИЕ В ХИМИЮ
Химия — это отрасль науки, изучающая состав и свойства вещества, а также изменения, которым оно претерпевает. Химия — это гораздо больше, чем набор фактов и совокупности знаний. Все дело в материи, то есть всем, что имеет массу и занимает пространство.
Химию иногда называют «центральной наукой», потому что она связывает друг с другом другие естественные науки, такие как физика, геология и биология.
Этимология слова «химия» вызывает много споров. Происхождение химии можно проследить до определенных практик, известных как алхимия, которые практиковались на протяжении нескольких тысячелетий в различных частях мира, особенно на Ближнем Востоке.
Слово химия происходит от слова алхимия , более раннего набора практик, которые включали элементы химии, металлургии, философии, астрологии, астрономии, мистицизма и медицины; это обычно рассматривается как стремление превратить свинец или другой обычный исходный материал в золото.Алхимия, которая практиковалась около 330 г., — это изучение состава воды, движения, роста, воплощения, развоплощения, извлечения духов из тел и связывания духов в телах (Зосим). Алхимика в просторечии называли «химиком», и позже к этому слову был добавлен суффикс «-ry», чтобы описать искусство химика как «химия».
Оглядываясь назад, можно сказать, что определение химии со временем изменилось, так как новые открытия и теории увеличивали функциональность науки.Термин «химия», по мнению известного ученого Роберта Бойля в 1661 году, означал предмет материальных принципов смешанных тел. В 1663 году «химия» означала научное искусство, с помощью которого человек учится растворять тела и извлекать из них различные вещества, входящие в их состав, а также как снова объединять их и возносить их к более высокому совершенству — это определение использовалось химик Кристофер Глейзер.
Определение слова «химия» 1730 года, которое использовал Георг Эрнст Шталь, означало искусство разделения смешанных, составных или агрегатных тел на их принципы; и составления таких органов на основе этих принципов.В 1837 году Жан-Батист Дюма считал, что слово «химия» относится к науке, связанной с законами и эффектами молекулярных сил. Это определение продолжало развиваться, пока в 1947 году оно не стало означать науку о веществах: их структуру, их свойства и реакции, которые превращают их в другие вещества — характеристика, принятая Линусом Полингом. Совсем недавно, в 1998 году, определение «химия» было расширено, чтобы обозначить изучение материи и изменений, которым она претерпевает, как сформулировал профессор Раймонд Чанг.
Химия как наука была сформирована к концу 18 века французским химиком Антуаном Лавуазье , который считается «отцом современной химии».
Общая область химии настолько огромна, что изначально была разделена на несколько основных дисциплин. Но сейчас существует огромное количество совпадений между различными областями химии, как и между различными науками.
Вот традиционные отрасли химии:
Аналитическая химия — это анализ образцов материалов с целью понимания их химического состава и структуры.Аналитическая химия включает стандартизированные экспериментальные методы в химии. Эти методы могут использоваться во всех разделах химии, за исключением чисто теоретической химии.
Биохимия — это исследование химических веществ, химических реакций и химических взаимодействий, происходящих в живых организмах. Биохимия и органическая химия тесно связаны, как в медицинской химии или нейрохимии. Биохимия также связана с молекулярной биологией и генетикой.
Неорганическая химия — это исследование свойств и реакций неорганических соединений. Различие между органическими и неорганическими дисциплинами не является абсолютным, и есть много общего, особенно в суб-дисциплине металлоорганической химии.
Органическая химия — это исследование структуры, свойств, состава, механизмов и реакций органических соединений. Органическое соединение определяется как любое соединение на основе углеродного скелета.
Физическая химия — это изучение физических и фундаментальных основ химических систем и процессов. В частности, для физиков-химиков интересны энергетика и динамика таких систем и процессов. Важные области исследования включают химическую термодинамику, химическую кинетику, электрохимию, статистическую механику, спектроскопию и, в последнее время, астрохимию.
Химия окружающей среды — это исследование источников, реакций, переноса, эффектов и судьбы химических веществ в воздухе, почве и водной среде; и влияние человеческой деятельности и биологической активности на них.
Другие дисциплины в химии традиционно сгруппированы по типу изучаемого вопроса или виду изучения. К ним относятся неорганическая химия, изучение неорганических веществ; органическая химия, изучение органического (углеродного) вещества; биохимия, изучение веществ, содержащихся в биологических организмах; физическая химия, изучение химических процессов с использованием таких физических понятий, как термодинамика и квантовая механика; и аналитическая химия, анализ образцов материалов для понимания их химического состава и структуры.
В последние годы появилось много более специализированных дисциплин, например нейрохимия, химические исследования нервной системы.
:
9 Условные обозначения, которые необходимо знать — Мастер органической химии
Изучение химической номенклатуры может быть неприятным. Это серия соглашений, которые объединялись в течение длительного периода времени, некоторые из которых относятся к XIX веку. Язык содержит архаичные термины, которые прошли свой полезный период, но глубоко укоренились в языке химии и почти невозможно исключить на данном этапе.Цель этой статьи — выйти за рамки общепринятых терминов cis , trans , (E, Z), (S, R) — которые абсолютно необходимы , чтобы знать — чтобы указать на некоторые из менее часто встречающихся столкнулись с аспектами номенклатуры, которые могут заставить вас нахмуриться и спросить: «Что значит , что ?»
1. Обозначения скобок.
- Когда используется: В сокращенных формулах.
- Что это означает: Означает, что заместитель присоединен непосредственно к предшествующему атому углерода.
- Пример : Ch4C (O) Ch3Ch4 (2-бутанон)
- Почему это полезно: Без скобок структура будет написана Ch4COCh3Ch4, что можно спутать с эфиром. Скобка проясняет, что это кетон.
- Примечания : Хотя это и не совсем неясно, это аспект номенклатуры, который может привести к путанице.
2. n- , s- и t-
- Когда используется: для короткоцепочечных алканов и спиртов.
- Что это означает: n- означает «нормальный» — неразветвленная цепь с функциональной группой (если присутствует) в положении 1. s — означает «вторичный», t — означает « терт ».
- Почему это полезно: Просто сокращенный способ описания различных структурных изомеров.
- Примечания : n -гексан — еще одно часто встречающееся название, которое просто представляет линейную шестиуглеродную цепь. «Гексаны», которые вы можете увидеть в лаборатории, относится к смеси различных (разветвленных) изомеров гексана.(он очищается дистилляцией, а изомеры имеют очень похожие точки кипения, поэтому он продается как «гексан». Чистый гексан n стоит дороже, потому что отделение его от изомеров — королевская боль).
3. Префикс N-
- Когда он используется: для аминов и амидов.
- Что это означает : N — означает, что заменитель связан с азотом.
- Пример : N -метилбутиламин, N, N -диметилформамид.
- Почему это полезно : устраняет двусмысленность. «Метилбутиламин», например, может относиться к изомеру, в котором метильная группа находится на углеродной цепи.
- Банкноты; , когда у азота присутствуют разные заместители, терминология — N- ( заместитель ), N- ( заместитель ), например N -метил, N -этилбутиламин.
4. L и D
- Когда используется : для сахаров и аминокислот.
- Что это означает : Это восходит к Эмилю Фишеру, который обозначил два энантиомера глицеральдегида (простейшего сахара) L-глицеральдегидом и D-глицеральдегидом. В то время (1890 г.), когда методы определения абсолютной структуры были недоступны, он УГДАЛ (!) , что структура левераторной (левовращающейся) и правовращающей (правовращающейся) структур глицеральдегида была такой, как изображено в проекции Фишера. , и дал им префиксы L и D соответственно.К счастью, когда была разработана рентгеновская кристаллография, оказалось, что его предположение было правильным. В L-сахарах кислород на втором от конца углероде находится в левой части проекции Фишера. В D-сахарах кислород находится справа.
- Почему это полезно : Первоначально он использовался для соотнесения абсолютных структур сахаров с двумя глицеральдегидами. Он больше не пригоден для этой цели, но, как и приложение, он все равно остается. Как и приложение, его замечают только тогда, когда возникают проблемы.
- Примечания: Это обозначение вызывает большую путаницу. То, что что-то обозначено буквой «D», не означает, что оно вращает поляризованный свет вправо и наоборот [это функция (+) — и (-)]. Например, D-фруктоза вращает поляризованный свет влево (-). Более того, любая корреляция между L / D и S / R — это совпадение . 20 незаменимых аминокислот в организме — это L-аминокислоты. Все они (S), за исключением цистеина, который является (R) (из-за того, что сера имеет более высокий приоритет в правилах Кана-Ингольда-Прелога).Рацематы обозначаются как DL (например, DL-глюкоза — это рацемическая смесь).
5. (+) и (-)
- Когда используется: для любого оптически активного соединения
- Что это означает: (+) и (-) относятся к направлению, в котором чистый энантиомеры этого соединения вращают плоско-поляризованный свет. (+) — указывает вращение по часовой стрелке, а (-) — указывает вращение против часовой стрелки.
- Пример: (+) — глюкоза, (-) — цистеин
- Почему это полезно : показывает направление оптического вращения.
- Примечания: Рацемические смеси обозначаются (+/–), например (+/–) — фруктоза
6. Vicinal и Geminal ( vic — и gem- ) 9002 9000
- Когда используется: часто используется в ЯМР для описания взаимосвязей между атомами водорода, а также для описания определенных типов продуктов (например,грамм. бромирование дает vic -дибромиды).
- Что это означает: Vicinal относится к двум функциональным группам на соседних атомах углерода . Geminal относится к двум функциональным группам на том же углероде .
- Почему это полезно: Вместо того, чтобы говорить «протоны находятся на соседних атомах углерода» или «протоны находятся на тех же атомах углерода», вы можете сказать «протоны вицинальные» или «протоны близнецы».
- Примечания: помните «драгоценный камень», такой как «Близнецы», созвездие и астрологический знак, что означает «близнецы».
7. Метил, метилен, метин
- Когда используется: чаще всего относится к протонам в ЯМР
- Что это означает: метильных протонов находятся на первичном углероде (Ch4). Протоны метилена находятся на вторичном углероде (Ch3). Протоны метина находятся на третичном атоме углерода (СН).
- Почему это полезно: В случае метина, удобное сокращение для выражения «протон на третичном углероде».
8.Альфа и бета (α / β)
- Когда используется: Преимущественно встречается в названиях сахаров. Также используется для стероидов.
- Что это означает: Когда сахар вытягивается в показанной ориентации (атомы углерода с 1 по 5 следуют по ac по часовой стрелке ), если аномерный кислород UP (экваториальный), это «бета», а если «Вниз» это альфа. [ РЕДАКТИРОВАТЬ: , как отмечает Брюс, это неполно и работает только для D-сахаров. Более правильно, сахар является «альфа», если C-1 OH и заместитель на предпоследнем атоме углерода (CH 2 OH, присоединенный к C5) находятся на противоположных сторонах кольца, и «бета», если эти два заместителя являются на той же стороне.См. «Проклятый пост сахарной номенклатуры» для более подробного описания. ]
- Почему это полезно: Полезное сокращение для описания ориентации аномерного кислорода, которая может иметь решающее значение в биохимии. Целлюлоза и крахмал отличаются только тем, как субъединицы глюкозы связаны друг с другом. Мы можем переваривать крахмал (α-связанный), но не целлюлозу (β-связанный)
- Примечания: Сахар должен быть нарисован в этой конкретной ориентации, чтобы применить α, β (это соглашение).
9. Эритро и трео
- Когда используется: Вроде старомодно, но указывает на диастереомерные отношения между двумя соединениями с соседними стереоцентрами.
- Что это означает: Эритроза и треоза — это 4-углеродные альдозы, и они являются диастереомерами. В эритрозе атомы кислорода ориентированы с одной стороны в проекции Фишера. Фактически они ориентированы на транс. Префиксы erythro- и Treo — обобщают эту взаимосвязь на другие диастереомеры.
- Почему это полезно. Если честно, если вы не выходите за рамки органической химии для второкурсников, это, вероятно, не так уж и полезно.
Вопросы, комментарии, чего-либо не хватает — как всегда, я хочу услышать об этом.
14 вакансий в области неорганической химии — Академические должности
Спонсируемый Программа стипендиатовПрограмма стипендиатов на 2021 год — это программа для проживания макс.8 исследователей из сторонних организаций CY Initiative на период от 4 месяцев до одного года. Эта программа направлена на содействие междисциплинарным обменам, международному сотрудничеству и …
3 дня назад | Закрытие 31 декабря Профессорство (§ 36 HG NRW) в области «Неорганическая химия»«Исследования и исследования с перспективой» Университет Вупперталя — это современный, динамичный и ориентированный на исследования университетский городок с междисциплинарным профилем в области исследований и обучения.В совокупности более 25000 исследователей, преподавателей и студентов сталкиваются с …
11 дней назад | Закрытие 24 ноября. Техник-исследователь, металлургия и неорганическая химияВы хотите присоединиться к нашей команде, которая стремится решать материальные проблемы в экстремальных условиях? Основная деятельность нашей команды связана с пониманием поведения материалов в экстремальных условиях.Эти условия включают высокое давление и температуру, агрессивные химические вещества …
15 дней назад | Закрытие 01 января Позиция постдока по высоковольтным литий-ионным аккумуляторамЛаборатория энергетических материалов UCL специализируется на инновациях в материалах и устройствах для устойчивых технологий хранения энергии.Мы предлагаем позицию Postdoc по высоковольтным литий-ионным аккумуляторам. Исследовательский проект сосредоточен на разработке литий-ионных аккумуляторов поколения 3b. Вы…
15 дней назад | Закрытие 18 ноября. Postdoc в электролитах на водной основе для литий-ионных батарейКоролевский технологический институт KTH в Стокгольме превратился в один из ведущих технических и инженерных университетов Европы, а также в ключевой центр интеллектуальных талантов и инноваций.Мы — крупнейшее в Швеции научно-исследовательское и учебное заведение в области технологий, в котором …
24 дней назад | Закрытие 15 ноября. Научный сотрудник (органический синтез)Университет Тампере и Университет прикладных наук Тампере создают уникальную среду для междисциплинарных, вдохновляющих и высокоэффективных исследований и образования.Сообщество наших университетов имеет свои конкурентные преимущества в области технологий, здравоохранения и общества. www.tuni.fi/en …
24 дней назад Профессор «Материаловедение для водно-энергетической взаимосвязи»Мы ищем кандидата, который продемонстрировал опыт в разработке и внедрении неорганических наноматериалов для процессов очистки воды.Области исследований, представляющие интерес, включают электрокаталитические, электрохимические, солнечные или световые процессы очистки воды.
.