Тест по химии (9 класс) на тему: Контрольная работа по химии по теме «Металлы» для учащихся 9 класса по программе ОСГабриеляна
Предварительный просмотр:
li{counter-increment:lst-ctn-kix_list_4-1}#doc9688789 ol.lst-kix_list_7-0{list-style-type:none}#doc9688789 .lst-kix_list_2-1>li{counter-increment:lst-ctn-kix_list_2-1}#doc9688789 ol.lst-kix_list_9-0.start{counter-reset:lst-ctn-kix_list_9-0 0}#doc9688789 .lst-kix_list_8-1>li{counter-increment:lst-ctn-kix_list_8-1}#doc9688789 ol.lst-kix_list_8-2.start{counter-reset:lst-ctn-kix_list_8-2 0}#doc9688789 ol.lst-kix_list_3-1.start{counter-reset:lst-ctn-kix_list_3-1 0}#doc9688789 ol.lst-kix_list_7-4.start{counter-reset:lst-ctn-kix_list_7-4 0}#doc9688789 .lst-kix_list_7-0>li{counter-increment:lst-ctn-kix_list_7-0}#doc9688789 .lst-kix_list_9-0>li{counter-increment:lst-ctn-kix_list_9-0}#doc9688789 ol.lst-kix_list_2-3.start{counter-reset:lst-ctn-kix_list_2-3 0}#doc9688789 ol.lst-kix_list_7-5{list-style-type:none}#doc9688789 ol.lst-kix_list_7-6{list-style-type:none}#doc9688789 ol. lst-kix_list_7-7{list-style-type:none}#doc9688789 ol.lst-kix_list_7-8{list-style-type:none}#doc9688789 ol.lst-kix_list_7-1{list-style-type:none}#doc9688789 ol.lst-kix_list_1-5.start{counter-reset:lst-ctn-kix_list_1-5 0}#doc9688789 ol.lst-kix_list_7-2{list-style-type:none}#doc9688789 ol.lst-kix_list_7-3{list-style-type:none}#doc9688789 ol.lst-kix_list_7-4{list-style-type:none}#doc9688789 ol.lst-kix_list_9-6.start{counter-reset:lst-ctn-kix_list_9-6 0}#doc9688789 .lst-kix_list_2-3>li{counter-increment:lst-ctn-kix_list_2-3}#doc9688789 .lst-kix_list_4-3>li{counter-increment:lst-ctn-kix_list_4-3}#doc9688789 ol.lst-kix_list_4-5.start{counter-reset:lst-ctn-kix_list_4-5 0}#doc9688789 .lst-kix_list_1-2>li{counter-increment:lst-ctn-kix_list_1-2}#doc9688789 ol.lst-kix_list_3-7.start{counter-reset:lst-ctn-kix_list_3-7 0}#doc9688789 ol.lst-kix_list_8-8.start{counter-reset:lst-ctn-kix_list_8-8 0}#doc9688789 .lst-kix_list_3-2>li{counter-increment:lst-ctn-kix_list_3-2}#doc9688789 ol.lst-kix_list_10-4.start{counter-reset:lst-ctn-kix_list_10-4 0}#doc9688789 .
lst-kix_list_7-7{list-style-type:none}#doc9688789 ol.lst-kix_list_7-8{list-style-type:none}#doc9688789 ol.lst-kix_list_7-1{list-style-type:none}#doc9688789 ol.lst-kix_list_1-5.start{counter-reset:lst-ctn-kix_list_1-5 0}#doc9688789 ol.lst-kix_list_7-2{list-style-type:none}#doc9688789 ol.lst-kix_list_7-3{list-style-type:none}#doc9688789 ol.lst-kix_list_7-4{list-style-type:none}#doc9688789 ol.lst-kix_list_9-6.start{counter-reset:lst-ctn-kix_list_9-6 0}#doc9688789 .lst-kix_list_2-3>li{counter-increment:lst-ctn-kix_list_2-3}#doc9688789 .lst-kix_list_4-3>li{counter-increment:lst-ctn-kix_list_4-3}#doc9688789 ol.lst-kix_list_4-5.start{counter-reset:lst-ctn-kix_list_4-5 0}#doc9688789 .lst-kix_list_1-2>li{counter-increment:lst-ctn-kix_list_1-2}#doc9688789 ol.lst-kix_list_3-7.start{counter-reset:lst-ctn-kix_list_3-7 0}#doc9688789 ol.lst-kix_list_8-8.start{counter-reset:lst-ctn-kix_list_8-8 0}#doc9688789 .lst-kix_list_3-2>li{counter-increment:lst-ctn-kix_list_3-2}#doc9688789 ol.lst-kix_list_10-4.start{counter-reset:lst-ctn-kix_list_10-4 0}#doc9688789 . lst-kix_list_7-2>li{counter-increment:lst-ctn-kix_list_7-2}#doc9688789 .lst-kix_list_9-2>li{counter-increment:lst-ctn-kix_list_9-2}#doc9688789 ol.lst-kix_list_8-7.start{counter-reset:lst-ctn-kix_list_8-7 0}#doc9688789 .lst-kix_list_5-0>li:before{content:»\0025cf «}#doc9688789 .lst-kix_list_1-4>li{counter-increment:lst-ctn-kix_list_1-4}#doc9688789 ol.lst-kix_list_1-6.start{counter-reset:lst-ctn-kix_list_1-6 0}#doc9688789 .lst-kix_list_5-3>li:before{content:»\0025cf «}#doc9688789 ol.lst-kix_list_9-5.start{counter-reset:lst-ctn-kix_list_9-5 0}#doc9688789 .lst-kix_list_5-2>li:before{content:»\0025aa «}#doc9688789 .lst-kix_list_8-3>li{counter-increment:lst-ctn-kix_list_8-3}#doc9688789 .lst-kix_list_5-1>li:before{content:»o «}#doc9688789 .lst-kix_list_5-7>li:before{content:»o «}#doc9688789 .lst-kix_list_5-6>li:before{content:»\0025cf «}#doc9688789 .lst-kix_list_5-8>li:before{content:»\0025aa «}#doc9688789 .lst-kix_list_9-4>li{counter-increment:lst-ctn-kix_list_9-4}#doc9688789 .lst-kix_list_5-4>li:before{content:»o «}#doc9688789 .
lst-kix_list_7-2>li{counter-increment:lst-ctn-kix_list_7-2}#doc9688789 .lst-kix_list_9-2>li{counter-increment:lst-ctn-kix_list_9-2}#doc9688789 ol.lst-kix_list_8-7.start{counter-reset:lst-ctn-kix_list_8-7 0}#doc9688789 .lst-kix_list_5-0>li:before{content:»\0025cf «}#doc9688789 .lst-kix_list_1-4>li{counter-increment:lst-ctn-kix_list_1-4}#doc9688789 ol.lst-kix_list_1-6.start{counter-reset:lst-ctn-kix_list_1-6 0}#doc9688789 .lst-kix_list_5-3>li:before{content:»\0025cf «}#doc9688789 ol.lst-kix_list_9-5.start{counter-reset:lst-ctn-kix_list_9-5 0}#doc9688789 .lst-kix_list_5-2>li:before{content:»\0025aa «}#doc9688789 .lst-kix_list_8-3>li{counter-increment:lst-ctn-kix_list_8-3}#doc9688789 .lst-kix_list_5-1>li:before{content:»o «}#doc9688789 .lst-kix_list_5-7>li:before{content:»o «}#doc9688789 .lst-kix_list_5-6>li:before{content:»\0025cf «}#doc9688789 .lst-kix_list_5-8>li:before{content:»\0025aa «}#doc9688789 .lst-kix_list_9-4>li{counter-increment:lst-ctn-kix_list_9-4}#doc9688789 .lst-kix_list_5-4>li:before{content:»o «}#doc9688789 . lst-kix_list_5-5>li:before{content:»\0025aa «}#doc9688789 .lst-kix_list_10-3>li{counter-increment:lst-ctn-kix_list_10-3}#doc9688789 ol.lst-kix_list_1-0.start{counter-reset:lst-ctn-kix_list_1-0 0}#doc9688789 .lst-kix_list_6-1>li:before{content:»o «}#doc9688789 .lst-kix_list_6-3>li:before{content:»\0025cf «}#doc9688789 .lst-kix_list_6-0>li:before{content:»\0025cf «}#doc9688789 .lst-kix_list_6-4>li:before{content:»o «}#doc9688789 .lst-kix_list_3-0>li{counter-increment:lst-ctn-kix_list_3-0}#doc9688789 ol.lst-kix_list_4-0.start{counter-reset:lst-ctn-kix_list_4-0 0}#doc9688789 .lst-kix_list_3-6>li{counter-increment:lst-ctn-kix_list_3-6}#doc9688789 .lst-kix_list_6-2>li:before{content:»\0025aa «}#doc9688789 .lst-kix_list_2-5>li{counter-increment:lst-ctn-kix_list_2-5}#doc9688789 .lst-kix_list_2-8>li{counter-increment:lst-ctn-kix_list_2-8}#doc9688789 ol.lst-kix_list_3-2.start{counter-reset:lst-ctn-kix_list_3-2 0}#doc9688789 .lst-kix_list_6-8>li:before{content:»\0025aa «}#doc9688789 .lst-kix_list_6-5>li:before{content:»\0025aa «}#doc9688789 .
lst-kix_list_5-5>li:before{content:»\0025aa «}#doc9688789 .lst-kix_list_10-3>li{counter-increment:lst-ctn-kix_list_10-3}#doc9688789 ol.lst-kix_list_1-0.start{counter-reset:lst-ctn-kix_list_1-0 0}#doc9688789 .lst-kix_list_6-1>li:before{content:»o «}#doc9688789 .lst-kix_list_6-3>li:before{content:»\0025cf «}#doc9688789 .lst-kix_list_6-0>li:before{content:»\0025cf «}#doc9688789 .lst-kix_list_6-4>li:before{content:»o «}#doc9688789 .lst-kix_list_3-0>li{counter-increment:lst-ctn-kix_list_3-0}#doc9688789 ol.lst-kix_list_4-0.start{counter-reset:lst-ctn-kix_list_4-0 0}#doc9688789 .lst-kix_list_3-6>li{counter-increment:lst-ctn-kix_list_3-6}#doc9688789 .lst-kix_list_6-2>li:before{content:»\0025aa «}#doc9688789 .lst-kix_list_2-5>li{counter-increment:lst-ctn-kix_list_2-5}#doc9688789 .lst-kix_list_2-8>li{counter-increment:lst-ctn-kix_list_2-8}#doc9688789 ol.lst-kix_list_3-2.start{counter-reset:lst-ctn-kix_list_3-2 0}#doc9688789 .lst-kix_list_6-8>li:before{content:»\0025aa «}#doc9688789 .lst-kix_list_6-5>li:before{content:»\0025aa «}#doc9688789 . lst-kix_list_6-7>li:before{content:»o «}#doc9688789 ol.lst-kix_list_2-4.start{counter-reset:lst-ctn-kix_list_2-4 0}#doc9688789 .lst-kix_list_6-6>li:before{content:»\0025cf «}#doc9688789 ol.lst-kix_list_1-3{list-style-type:none}#doc9688789 ol.lst-kix_list_10-6.start{counter-reset:lst-ctn-kix_list_10-6 0}#doc9688789 ol.lst-kix_list_1-4{list-style-type:none}#doc9688789 .lst-kix_list_2-7>li:before{content:»» counter(lst-ctn-kix_list_2-7,lower-latin) «. «}#doc9688789 .lst-kix_list_2-7>li{counter-increment:lst-ctn-kix_list_2-7}#doc9688789 ol.lst-kix_list_1-5{list-style-type:none}#doc9688789 .lst-kix_list_7-4>li:before{content:»» counter(lst-ctn-kix_list_7-0,decimal) «.» counter(lst-ctn-kix_list_7-1,decimal) «.» counter(lst-ctn-kix_list_7-2,decimal) «.» counter(lst-ctn-kix_list_7-3,decimal) «.» counter(lst-ctn-kix_list_7-4,decimal) «. «}#doc9688789 .lst-kix_list_7-6>li:before{content:»» counter(lst-ctn-kix_list_7-0,decimal) «.» counter(lst-ctn-kix_list_7-1,decimal) «.» counter(lst-ctn-kix_list_7-2,decimal) «.
lst-kix_list_6-7>li:before{content:»o «}#doc9688789 ol.lst-kix_list_2-4.start{counter-reset:lst-ctn-kix_list_2-4 0}#doc9688789 .lst-kix_list_6-6>li:before{content:»\0025cf «}#doc9688789 ol.lst-kix_list_1-3{list-style-type:none}#doc9688789 ol.lst-kix_list_10-6.start{counter-reset:lst-ctn-kix_list_10-6 0}#doc9688789 ol.lst-kix_list_1-4{list-style-type:none}#doc9688789 .lst-kix_list_2-7>li:before{content:»» counter(lst-ctn-kix_list_2-7,lower-latin) «. «}#doc9688789 .lst-kix_list_2-7>li{counter-increment:lst-ctn-kix_list_2-7}#doc9688789 ol.lst-kix_list_1-5{list-style-type:none}#doc9688789 .lst-kix_list_7-4>li:before{content:»» counter(lst-ctn-kix_list_7-0,decimal) «.» counter(lst-ctn-kix_list_7-1,decimal) «.» counter(lst-ctn-kix_list_7-2,decimal) «.» counter(lst-ctn-kix_list_7-3,decimal) «.» counter(lst-ctn-kix_list_7-4,decimal) «. «}#doc9688789 .lst-kix_list_7-6>li:before{content:»» counter(lst-ctn-kix_list_7-0,decimal) «.» counter(lst-ctn-kix_list_7-1,decimal) «.» counter(lst-ctn-kix_list_7-2,decimal) «. » counter(lst-ctn-kix_list_7-3,decimal) «.» counter(lst-ctn-kix_list_7-4,decimal) «.» counter(lst-ctn-kix_list_7-5,decimal) «.» counter(lst-ctn-kix_list_7-6,decimal) «. «}#doc9688789 ol.lst-kix_list_1-6{list-style-type:none}#doc9688789 ol.lst-kix_list_1-0{list-style-type:none}#doc9688789 .lst-kix_list_2-5>li:before{content:»» counter(lst-ctn-kix_list_2-5,lower-roman) «. «}#doc9688789 ol.lst-kix_list_1-1{list-style-type:none}#doc9688789 ol.lst-kix_list_1-2{list-style-type:none}#doc9688789 .lst-kix_list_7-2>li:before{content:»» counter(lst-ctn-kix_list_7-0,decimal) «.» counter(lst-ctn-kix_list_7-1,decimal) «.» counter(lst-ctn-kix_list_7-2,decimal) «. «}#doc9688789 .lst-kix_list_7-6>li{counter-increment:lst-ctn-kix_list_7-6}#doc9688789 .lst-kix_list_8-6>li{counter-increment:lst-ctn-kix_list_8-6}#doc9688789 ol.lst-kix_list_10-3.start{counter-reset:lst-ctn-kix_list_10-3 0}#doc9688789 ol.lst-kix_list_9-4.start{counter-reset:lst-ctn-kix_list_9-4 0}#doc9688789 ol.lst-kix_list_4-6.start{counter-reset:lst-ctn-kix_list_4-6 0}#doc9688789 ol.
» counter(lst-ctn-kix_list_7-3,decimal) «.» counter(lst-ctn-kix_list_7-4,decimal) «.» counter(lst-ctn-kix_list_7-5,decimal) «.» counter(lst-ctn-kix_list_7-6,decimal) «. «}#doc9688789 ol.lst-kix_list_1-6{list-style-type:none}#doc9688789 ol.lst-kix_list_1-0{list-style-type:none}#doc9688789 .lst-kix_list_2-5>li:before{content:»» counter(lst-ctn-kix_list_2-5,lower-roman) «. «}#doc9688789 ol.lst-kix_list_1-1{list-style-type:none}#doc9688789 ol.lst-kix_list_1-2{list-style-type:none}#doc9688789 .lst-kix_list_7-2>li:before{content:»» counter(lst-ctn-kix_list_7-0,decimal) «.» counter(lst-ctn-kix_list_7-1,decimal) «.» counter(lst-ctn-kix_list_7-2,decimal) «. «}#doc9688789 .lst-kix_list_7-6>li{counter-increment:lst-ctn-kix_list_7-6}#doc9688789 .lst-kix_list_8-6>li{counter-increment:lst-ctn-kix_list_8-6}#doc9688789 ol.lst-kix_list_10-3.start{counter-reset:lst-ctn-kix_list_10-3 0}#doc9688789 ol.lst-kix_list_9-4.start{counter-reset:lst-ctn-kix_list_9-4 0}#doc9688789 ol.lst-kix_list_4-6.start{counter-reset:lst-ctn-kix_list_4-6 0}#doc9688789 ol. lst-kix_list_9-7{list-style-type:none}#doc9688789 .lst-kix_list_10-1>li:before{content:»» counter(lst-ctn-kix_list_10-1,decimal) » «}#doc9688789 ol.lst-kix_list_9-8{list-style-type:none}#doc9688789 ol.lst-kix_list_3-0.start{counter-reset:lst-ctn-kix_list_3-0 0}#doc9688789 ol.lst-kix_list_9-3{list-style-type:none}#doc9688789 ol.lst-kix_list_9-4{list-style-type:none}#doc9688789 .lst-kix_list_7-7>li{counter-increment:lst-ctn-kix_list_7-7}#doc9688789 ol.lst-kix_list_9-5{list-style-type:none}#doc9688789 .lst-kix_list_7-8>li:before{content:»» counter(lst-ctn-kix_list_7-0,decimal) «.» counter(lst-ctn-kix_list_7-1,decimal) «.» counter(lst-ctn-kix_list_7-2,decimal) «.» counter(lst-ctn-kix_list_7-3,decimal) «.» counter(lst-ctn-kix_list_7-4,decimal) «.» counter(lst-ctn-kix_list_7-5,decimal) «.» counter(lst-ctn-kix_list_7-6,decimal) «.» counter(lst-ctn-kix_list_7-7,decimal) «.» counter(lst-ctn-kix_list_7-8,decimal) «. «}#doc9688789 ol.lst-kix_list_9-6{list-style-type:none}#doc9688789 ol.lst-kix_list_4-3.
lst-kix_list_9-7{list-style-type:none}#doc9688789 .lst-kix_list_10-1>li:before{content:»» counter(lst-ctn-kix_list_10-1,decimal) » «}#doc9688789 ol.lst-kix_list_9-8{list-style-type:none}#doc9688789 ol.lst-kix_list_3-0.start{counter-reset:lst-ctn-kix_list_3-0 0}#doc9688789 ol.lst-kix_list_9-3{list-style-type:none}#doc9688789 ol.lst-kix_list_9-4{list-style-type:none}#doc9688789 .lst-kix_list_7-7>li{counter-increment:lst-ctn-kix_list_7-7}#doc9688789 ol.lst-kix_list_9-5{list-style-type:none}#doc9688789 .lst-kix_list_7-8>li:before{content:»» counter(lst-ctn-kix_list_7-0,decimal) «.» counter(lst-ctn-kix_list_7-1,decimal) «.» counter(lst-ctn-kix_list_7-2,decimal) «.» counter(lst-ctn-kix_list_7-3,decimal) «.» counter(lst-ctn-kix_list_7-4,decimal) «.» counter(lst-ctn-kix_list_7-5,decimal) «.» counter(lst-ctn-kix_list_7-6,decimal) «.» counter(lst-ctn-kix_list_7-7,decimal) «.» counter(lst-ctn-kix_list_7-8,decimal) «. «}#doc9688789 ol.lst-kix_list_9-6{list-style-type:none}#doc9688789 ol.lst-kix_list_4-3. start{counter-reset:lst-ctn-kix_list_4-3 0}#doc9688789 ol.lst-kix_list_1-7{list-style-type:none}#doc9688789 .lst-kix_list_4-7>li{counter-increment:lst-ctn-kix_list_4-7}#doc9688789 ol.lst-kix_list_9-0{list-style-type:none}#doc9688789 ol.lst-kix_list_1-8{list-style-type:none}#doc9688789 ol.lst-kix_list_9-1{list-style-type:none}#doc9688789 ol.lst-kix_list_9-2{list-style-type:none}#doc9688789 .lst-kix_list_10-7>li:before{content:»» counter(lst-ctn-kix_list_10-7,lower-latin) «. «}#doc9688789 .lst-kix_list_7-8>li{counter-increment:lst-ctn-kix_list_7-8}#doc9688789 ol.lst-kix_list_2-5.start{counter-reset:lst-ctn-kix_list_2-5 0}#doc9688789 .lst-kix_list_10-5>li:before{content:»» counter(lst-ctn-kix_list_10-5,lower-roman) «. «}#doc9688789 .lst-kix_list_9-8>li{counter-increment:lst-ctn-kix_list_9-8}#doc9688789 .lst-kix_list_10-3>li:before{content:»» counter(lst-ctn-kix_list_10-3,decimal) «. «}#doc9688789 .lst-kix_list_2-6>li{counter-increment:lst-ctn-kix_list_2-6}#doc9688789 .lst-kix_list_4-1>li:before{content:»» counter(lst-ctn-kix_list_4-1,decimal) «.
start{counter-reset:lst-ctn-kix_list_4-3 0}#doc9688789 ol.lst-kix_list_1-7{list-style-type:none}#doc9688789 .lst-kix_list_4-7>li{counter-increment:lst-ctn-kix_list_4-7}#doc9688789 ol.lst-kix_list_9-0{list-style-type:none}#doc9688789 ol.lst-kix_list_1-8{list-style-type:none}#doc9688789 ol.lst-kix_list_9-1{list-style-type:none}#doc9688789 ol.lst-kix_list_9-2{list-style-type:none}#doc9688789 .lst-kix_list_10-7>li:before{content:»» counter(lst-ctn-kix_list_10-7,lower-latin) «. «}#doc9688789 .lst-kix_list_7-8>li{counter-increment:lst-ctn-kix_list_7-8}#doc9688789 ol.lst-kix_list_2-5.start{counter-reset:lst-ctn-kix_list_2-5 0}#doc9688789 .lst-kix_list_10-5>li:before{content:»» counter(lst-ctn-kix_list_10-5,lower-roman) «. «}#doc9688789 .lst-kix_list_9-8>li{counter-increment:lst-ctn-kix_list_9-8}#doc9688789 .lst-kix_list_10-3>li:before{content:»» counter(lst-ctn-kix_list_10-3,decimal) «. «}#doc9688789 .lst-kix_list_2-6>li{counter-increment:lst-ctn-kix_list_2-6}#doc9688789 .lst-kix_list_4-1>li:before{content:»» counter(lst-ctn-kix_list_4-1,decimal) «. «}#doc9688789 ol.lst-kix_list_7-3.start{counter-reset:lst-ctn-kix_list_7-3 0}#doc9688789 .lst-kix_list_9-2>li:before{content:»» counter(lst-ctn-kix_list_9-2,lower-roman) «. «}#doc9688789 .lst-kix_list_4-3>li:before{content:»» counter(lst-ctn-kix_list_4-3,decimal) «. «}#doc9688789 .lst-kix_list_4-5>li:before{content:»» counter(lst-ctn-kix_list_4-5,lower-roman) «. «}#doc9688789 .lst-kix_list_1-8>li{counter-increment:lst-ctn-kix_list_1-8}#doc9688789 .lst-kix_list_10-5>li{counter-increment:lst-ctn-kix_list_10-5}#doc9688789 ol.lst-kix_list_1-4.start{counter-reset:lst-ctn-kix_list_1-4 0}#doc9688789 .lst-kix_list_3-5>li{counter-increment:lst-ctn-kix_list_3-5}#doc9688789 ol.lst-kix_list_1-1.start{counter-reset:lst-ctn-kix_list_1-1 0}#doc9688789 .lst-kix_list_9-0>li:before{content:»» counter(lst-ctn-kix_list_9-0,decimal) «) «}#doc9688789 .lst-kix_list_3-4>li{counter-increment:lst-ctn-kix_list_3-4}#doc9688789 ol.lst-kix_list_4-4.start{counter-reset:lst-ctn-kix_list_4-4 0}#doc9688789 ol.lst-kix_list_10-7{list-style-type:none}#doc9688789 ol.
«}#doc9688789 ol.lst-kix_list_7-3.start{counter-reset:lst-ctn-kix_list_7-3 0}#doc9688789 .lst-kix_list_9-2>li:before{content:»» counter(lst-ctn-kix_list_9-2,lower-roman) «. «}#doc9688789 .lst-kix_list_4-3>li:before{content:»» counter(lst-ctn-kix_list_4-3,decimal) «. «}#doc9688789 .lst-kix_list_4-5>li:before{content:»» counter(lst-ctn-kix_list_4-5,lower-roman) «. «}#doc9688789 .lst-kix_list_1-8>li{counter-increment:lst-ctn-kix_list_1-8}#doc9688789 .lst-kix_list_10-5>li{counter-increment:lst-ctn-kix_list_10-5}#doc9688789 ol.lst-kix_list_1-4.start{counter-reset:lst-ctn-kix_list_1-4 0}#doc9688789 .lst-kix_list_3-5>li{counter-increment:lst-ctn-kix_list_3-5}#doc9688789 ol.lst-kix_list_1-1.start{counter-reset:lst-ctn-kix_list_1-1 0}#doc9688789 .lst-kix_list_9-0>li:before{content:»» counter(lst-ctn-kix_list_9-0,decimal) «) «}#doc9688789 .lst-kix_list_3-4>li{counter-increment:lst-ctn-kix_list_3-4}#doc9688789 ol.lst-kix_list_4-4.start{counter-reset:lst-ctn-kix_list_4-4 0}#doc9688789 ol.lst-kix_list_10-7{list-style-type:none}#doc9688789 ol. lst-kix_list_9-2.start{counter-reset:lst-ctn-kix_list_9-2 0}#doc9688789 .lst-kix_list_9-6>li:before{content:»» counter(lst-ctn-kix_list_9-6,decimal) «. «}#doc9688789 ol.lst-kix_list_10-8{list-style-type:none}#doc9688789 .lst-kix_list_9-3>li{counter-increment:lst-ctn-kix_list_9-3}#doc9688789 ol.lst-kix_list_10-3{list-style-type:none}#doc9688789 .lst-kix_list_9-4>li:before{content:»» counter(lst-ctn-kix_list_9-4,lower-latin) «. «}#doc9688789 ol.lst-kix_list_10-4{list-style-type:none}#doc9688789 ol.lst-kix_list_10-5{list-style-type:none}#doc9688789 ol.lst-kix_list_10-6{list-style-type:none}#doc9688789 ol.lst-kix_list_10-0{list-style-type:none}#doc9688789 ol.lst-kix_list_10-1{list-style-type:none}#doc9688789 ol.lst-kix_list_1-3.start{counter-reset:lst-ctn-kix_list_1-3 0}#doc9688789 ol.lst-kix_list_10-2{list-style-type:none}#doc9688789 ol.lst-kix_list_2-8.start{counter-reset:lst-ctn-kix_list_2-8 0}#doc9688789 ol.lst-kix_list_8-8{list-style-type:none}#doc9688789 ol.lst-kix_list_1-2.start{counter-reset:lst-ctn-kix_list_1-2 0}#doc9688789 ol.
lst-kix_list_9-2.start{counter-reset:lst-ctn-kix_list_9-2 0}#doc9688789 .lst-kix_list_9-6>li:before{content:»» counter(lst-ctn-kix_list_9-6,decimal) «. «}#doc9688789 ol.lst-kix_list_10-8{list-style-type:none}#doc9688789 .lst-kix_list_9-3>li{counter-increment:lst-ctn-kix_list_9-3}#doc9688789 ol.lst-kix_list_10-3{list-style-type:none}#doc9688789 .lst-kix_list_9-4>li:before{content:»» counter(lst-ctn-kix_list_9-4,lower-latin) «. «}#doc9688789 ol.lst-kix_list_10-4{list-style-type:none}#doc9688789 ol.lst-kix_list_10-5{list-style-type:none}#doc9688789 ol.lst-kix_list_10-6{list-style-type:none}#doc9688789 ol.lst-kix_list_10-0{list-style-type:none}#doc9688789 ol.lst-kix_list_10-1{list-style-type:none}#doc9688789 ol.lst-kix_list_1-3.start{counter-reset:lst-ctn-kix_list_1-3 0}#doc9688789 ol.lst-kix_list_10-2{list-style-type:none}#doc9688789 ol.lst-kix_list_2-8.start{counter-reset:lst-ctn-kix_list_2-8 0}#doc9688789 ol.lst-kix_list_8-8{list-style-type:none}#doc9688789 ol.lst-kix_list_1-2.start{counter-reset:lst-ctn-kix_list_1-2 0}#doc9688789 ol. lst-kix_list_7-6.start{counter-reset:lst-ctn-kix_list_7-6 0}#doc9688789 ol.lst-kix_list_8-4{list-style-type:none}#doc9688789 ol.lst-kix_list_8-5{list-style-type:none}#doc9688789 ol.lst-kix_list_8-6{list-style-type:none}#doc9688789 ol.lst-kix_list_8-7{list-style-type:none}#doc9688789 ol.lst-kix_list_8-0{list-style-type:none}#doc9688789 .lst-kix_list_9-8>li:before{content:»» counter(lst-ctn-kix_list_9-8,lower-roman) «. «}#doc9688789 ol.lst-kix_list_8-1{list-style-type:none}#doc9688789 .lst-kix_list_1-1>li:before{content:»1) «}#doc9688789 ol.lst-kix_list_8-2{list-style-type:none}#doc9688789 ol.lst-kix_list_8-3{list-style-type:none}#doc9688789 .lst-kix_list_8-5>li{counter-increment:lst-ctn-kix_list_8-5}#doc9688789 .lst-kix_list_1-3>li:before{content:»» counter(lst-ctn-kix_list_1-0,decimal) «.» counter(lst-ctn-kix_list_1-1,decimal) «.» counter(lst-ctn-kix_list_1-2,decimal) «.» counter(lst-ctn-kix_list_1-3,decimal) «. «}#doc9688789 .lst-kix_list_10-4>li{counter-increment:lst-ctn-kix_list_10-4}#doc9688789 ol.
lst-kix_list_7-6.start{counter-reset:lst-ctn-kix_list_7-6 0}#doc9688789 ol.lst-kix_list_8-4{list-style-type:none}#doc9688789 ol.lst-kix_list_8-5{list-style-type:none}#doc9688789 ol.lst-kix_list_8-6{list-style-type:none}#doc9688789 ol.lst-kix_list_8-7{list-style-type:none}#doc9688789 ol.lst-kix_list_8-0{list-style-type:none}#doc9688789 .lst-kix_list_9-8>li:before{content:»» counter(lst-ctn-kix_list_9-8,lower-roman) «. «}#doc9688789 ol.lst-kix_list_8-1{list-style-type:none}#doc9688789 .lst-kix_list_1-1>li:before{content:»1) «}#doc9688789 ol.lst-kix_list_8-2{list-style-type:none}#doc9688789 ol.lst-kix_list_8-3{list-style-type:none}#doc9688789 .lst-kix_list_8-5>li{counter-increment:lst-ctn-kix_list_8-5}#doc9688789 .lst-kix_list_1-3>li:before{content:»» counter(lst-ctn-kix_list_1-0,decimal) «.» counter(lst-ctn-kix_list_1-1,decimal) «.» counter(lst-ctn-kix_list_1-2,decimal) «.» counter(lst-ctn-kix_list_1-3,decimal) «. «}#doc9688789 .lst-kix_list_10-4>li{counter-increment:lst-ctn-kix_list_10-4}#doc9688789 ol. lst-kix_list_10-5.start{counter-reset:lst-ctn-kix_list_10-5 0}#doc9688789 .lst-kix_list_4-8>li{counter-increment:lst-ctn-kix_list_4-8}#doc9688789 .lst-kix_list_1-7>li:before{content:»» counter(lst-ctn-kix_list_1-0,decimal) «.» counter(lst-ctn-kix_list_1-1,decimal) «.» counter(lst-ctn-kix_list_1-2,decimal) «.» counter(lst-ctn-kix_list_1-3,decimal) «.» counter(lst-ctn-kix_list_1-4,decimal) «.» counter(lst-ctn-kix_list_1-5,decimal) «.» counter(lst-ctn-kix_list_1-6,decimal) «.» counter(lst-ctn-kix_list_1-7,decimal) «. «}#doc9688789 ol.lst-kix_list_2-7.start{counter-reset:lst-ctn-kix_list_2-7 0}#doc9688789 .lst-kix_list_1-3>li{counter-increment:lst-ctn-kix_list_1-3}#doc9688789 .lst-kix_list_1-5>li:before{content:»» counter(lst-ctn-kix_list_1-0,decimal) «.» counter(lst-ctn-kix_list_1-1,decimal) «.» counter(lst-ctn-kix_list_1-2,decimal) «.» counter(lst-ctn-kix_list_1-3,decimal) «.» counter(lst-ctn-kix_list_1-4,decimal) «.» counter(lst-ctn-kix_list_1-5,decimal) «. «}#doc9688789 ol.lst-kix_list_9-1.
lst-kix_list_10-5.start{counter-reset:lst-ctn-kix_list_10-5 0}#doc9688789 .lst-kix_list_4-8>li{counter-increment:lst-ctn-kix_list_4-8}#doc9688789 .lst-kix_list_1-7>li:before{content:»» counter(lst-ctn-kix_list_1-0,decimal) «.» counter(lst-ctn-kix_list_1-1,decimal) «.» counter(lst-ctn-kix_list_1-2,decimal) «.» counter(lst-ctn-kix_list_1-3,decimal) «.» counter(lst-ctn-kix_list_1-4,decimal) «.» counter(lst-ctn-kix_list_1-5,decimal) «.» counter(lst-ctn-kix_list_1-6,decimal) «.» counter(lst-ctn-kix_list_1-7,decimal) «. «}#doc9688789 ol.lst-kix_list_2-7.start{counter-reset:lst-ctn-kix_list_2-7 0}#doc9688789 .lst-kix_list_1-3>li{counter-increment:lst-ctn-kix_list_1-3}#doc9688789 .lst-kix_list_1-5>li:before{content:»» counter(lst-ctn-kix_list_1-0,decimal) «.» counter(lst-ctn-kix_list_1-1,decimal) «.» counter(lst-ctn-kix_list_1-2,decimal) «.» counter(lst-ctn-kix_list_1-3,decimal) «.» counter(lst-ctn-kix_list_1-4,decimal) «.» counter(lst-ctn-kix_list_1-5,decimal) «. «}#doc9688789 ol.lst-kix_list_9-1. start{counter-reset:lst-ctn-kix_list_9-1 0}#doc9688789 ol.lst-kix_list_7-5.start{counter-reset:lst-ctn-kix_list_7-5 0}#doc9688789 .lst-kix_list_2-1>li:before{content:»» counter(lst-ctn-kix_list_2-1,decimal) «. «}#doc9688789 .lst-kix_list_2-3>li:before{content:»» counter(lst-ctn-kix_list_2-3,decimal) «. «}#doc9688789 .lst-kix_list_4-2>li{counter-increment:lst-ctn-kix_list_4-2}#doc9688789 ol.lst-kix_list_3-1{list-style-type:none}#doc9688789 ol.lst-kix_list_3-2{list-style-type:none}#doc9688789 .lst-kix_list_3-1>li{counter-increment:lst-ctn-kix_list_3-1}#doc9688789 ol.lst-kix_list_3-3{list-style-type:none}#doc9688789 ol.lst-kix_list_3-4.start{counter-reset:lst-ctn-kix_list_3-4 0}#doc9688789 ol.lst-kix_list_3-4{list-style-type:none}#doc9688789 ol.lst-kix_list_3-0{list-style-type:none}#doc9688789 .lst-kix_list_1-1>li{counter-increment:lst-ctn-kix_list_1-1}#doc9688789 .lst-kix_list_7-1>li{counter-increment:lst-ctn-kix_list_7-1}#doc9688789 .lst-kix_list_9-1>li{counter-increment:lst-ctn-kix_list_9-1}#doc9688789 ol.
start{counter-reset:lst-ctn-kix_list_9-1 0}#doc9688789 ol.lst-kix_list_7-5.start{counter-reset:lst-ctn-kix_list_7-5 0}#doc9688789 .lst-kix_list_2-1>li:before{content:»» counter(lst-ctn-kix_list_2-1,decimal) «. «}#doc9688789 .lst-kix_list_2-3>li:before{content:»» counter(lst-ctn-kix_list_2-3,decimal) «. «}#doc9688789 .lst-kix_list_4-2>li{counter-increment:lst-ctn-kix_list_4-2}#doc9688789 ol.lst-kix_list_3-1{list-style-type:none}#doc9688789 ol.lst-kix_list_3-2{list-style-type:none}#doc9688789 .lst-kix_list_3-1>li{counter-increment:lst-ctn-kix_list_3-1}#doc9688789 ol.lst-kix_list_3-3{list-style-type:none}#doc9688789 ol.lst-kix_list_3-4.start{counter-reset:lst-ctn-kix_list_3-4 0}#doc9688789 ol.lst-kix_list_3-4{list-style-type:none}#doc9688789 ol.lst-kix_list_3-0{list-style-type:none}#doc9688789 .lst-kix_list_1-1>li{counter-increment:lst-ctn-kix_list_1-1}#doc9688789 .lst-kix_list_7-1>li{counter-increment:lst-ctn-kix_list_7-1}#doc9688789 .lst-kix_list_9-1>li{counter-increment:lst-ctn-kix_list_9-1}#doc9688789 ol. lst-kix_list_2-6.start{counter-reset:lst-ctn-kix_list_2-6 0}#doc9688789 .lst-kix_list_3-0>li:before{content:»» counter(lst-ctn-kix_list_3-0,decimal) «) «}#doc9688789 ol.lst-kix_list_7-7.start{counter-reset:lst-ctn-kix_list_7-7 0}#doc9688789 ul.lst-kix_list_5-7{list-style-type:none}#doc9688789 ul.lst-kix_list_5-8{list-style-type:none}#doc9688789 .lst-kix_list_3-1>li:before{content:»» counter(lst-ctn-kix_list_3-1,lower-latin) «. «}#doc9688789 .lst-kix_list_3-2>li:before{content:»» counter(lst-ctn-kix_list_3-2,lower-roman) «. «}#doc9688789 ul.lst-kix_list_5-5{list-style-type:none}#doc9688789 ul.lst-kix_list_5-6{list-style-type:none}#doc9688789 .lst-kix_list_8-1>li:before{content:»» counter(lst-ctn-kix_list_8-1,lower-latin) «. «}#doc9688789 ol.lst-kix_list_1-8.start{counter-reset:lst-ctn-kix_list_1-8 0}#doc9688789 .lst-kix_list_4-0>li{counter-increment:lst-ctn-kix_list_4-0}#doc9688789 .lst-kix_list_8-2>li:before{content:»» counter(lst-ctn-kix_list_8-2,lower-roman) «. «}#doc9688789 .lst-kix_list_8-0>li{counter-increment:lst-ctn-kix_list_8-0}#doc9688789 .
lst-kix_list_2-6.start{counter-reset:lst-ctn-kix_list_2-6 0}#doc9688789 .lst-kix_list_3-0>li:before{content:»» counter(lst-ctn-kix_list_3-0,decimal) «) «}#doc9688789 ol.lst-kix_list_7-7.start{counter-reset:lst-ctn-kix_list_7-7 0}#doc9688789 ul.lst-kix_list_5-7{list-style-type:none}#doc9688789 ul.lst-kix_list_5-8{list-style-type:none}#doc9688789 .lst-kix_list_3-1>li:before{content:»» counter(lst-ctn-kix_list_3-1,lower-latin) «. «}#doc9688789 .lst-kix_list_3-2>li:before{content:»» counter(lst-ctn-kix_list_3-2,lower-roman) «. «}#doc9688789 ul.lst-kix_list_5-5{list-style-type:none}#doc9688789 ul.lst-kix_list_5-6{list-style-type:none}#doc9688789 .lst-kix_list_8-1>li:before{content:»» counter(lst-ctn-kix_list_8-1,lower-latin) «. «}#doc9688789 ol.lst-kix_list_1-8.start{counter-reset:lst-ctn-kix_list_1-8 0}#doc9688789 .lst-kix_list_4-0>li{counter-increment:lst-ctn-kix_list_4-0}#doc9688789 .lst-kix_list_8-2>li:before{content:»» counter(lst-ctn-kix_list_8-2,lower-roman) «. «}#doc9688789 .lst-kix_list_8-0>li{counter-increment:lst-ctn-kix_list_8-0}#doc9688789 . lst-kix_list_3-5>li:before{content:»» counter(lst-ctn-kix_list_3-5,lower-roman) «. «}#doc9688789 ul.lst-kix_list_5-0{list-style-type:none}#doc9688789 .lst-kix_list_10-0>li{counter-increment:lst-ctn-kix_list_10-0}#doc9688789 .lst-kix_list_3-4>li:before{content:»» counter(lst-ctn-kix_list_3-4,lower-latin) «. «}#doc9688789 ul.lst-kix_list_5-3{list-style-type:none}#doc9688789 .lst-kix_list_3-3>li:before{content:»» counter(lst-ctn-kix_list_3-3,decimal) «. «}#doc9688789 ol.lst-kix_list_3-5{list-style-type:none}#doc9688789 ul.lst-kix_list_5-4{list-style-type:none}#doc9688789 ol.lst-kix_list_3-6{list-style-type:none}#doc9688789 ul.lst-kix_list_5-1{list-style-type:none}#doc9688789 .lst-kix_list_8-0>li:before{content:»» counter(lst-ctn-kix_list_8-0,decimal) «) «}#doc9688789 ol.lst-kix_list_3-7{list-style-type:none}#doc9688789 ul.lst-kix_list_5-2{list-style-type:none}#doc9688789 ol.lst-kix_list_3-8{list-style-type:none}#doc9688789 .lst-kix_list_8-7>li:before{content:»» counter(lst-ctn-kix_list_8-7,lower-latin) «.
lst-kix_list_3-5>li:before{content:»» counter(lst-ctn-kix_list_3-5,lower-roman) «. «}#doc9688789 ul.lst-kix_list_5-0{list-style-type:none}#doc9688789 .lst-kix_list_10-0>li{counter-increment:lst-ctn-kix_list_10-0}#doc9688789 .lst-kix_list_3-4>li:before{content:»» counter(lst-ctn-kix_list_3-4,lower-latin) «. «}#doc9688789 ul.lst-kix_list_5-3{list-style-type:none}#doc9688789 .lst-kix_list_3-3>li:before{content:»» counter(lst-ctn-kix_list_3-3,decimal) «. «}#doc9688789 ol.lst-kix_list_3-5{list-style-type:none}#doc9688789 ul.lst-kix_list_5-4{list-style-type:none}#doc9688789 ol.lst-kix_list_3-6{list-style-type:none}#doc9688789 ul.lst-kix_list_5-1{list-style-type:none}#doc9688789 .lst-kix_list_8-0>li:before{content:»» counter(lst-ctn-kix_list_8-0,decimal) «) «}#doc9688789 ol.lst-kix_list_3-7{list-style-type:none}#doc9688789 ul.lst-kix_list_5-2{list-style-type:none}#doc9688789 ol.lst-kix_list_3-8{list-style-type:none}#doc9688789 .lst-kix_list_8-7>li:before{content:»» counter(lst-ctn-kix_list_8-7,lower-latin) «. «}#doc9688789 .lst-kix_list_3-8>li:before{content:»» counter(lst-ctn-kix_list_3-8,lower-roman) «. «}#doc9688789 .lst-kix_list_8-5>li:before{content:»» counter(lst-ctn-kix_list_8-5,lower-roman) «. «}#doc9688789 ol.lst-kix_list_10-7.start{counter-reset:lst-ctn-kix_list_10-7 0}#doc9688789 .lst-kix_list_8-6>li:before{content:»» counter(lst-ctn-kix_list_8-6,decimal) «. «}#doc9688789 .lst-kix_list_2-0>li{counter-increment:lst-ctn-kix_list_2-0}#doc9688789 .lst-kix_list_8-3>li:before{content:»» counter(lst-ctn-kix_list_8-3,decimal) «. «}#doc9688789 .lst-kix_list_3-6>li:before{content:»» counter(lst-ctn-kix_list_3-6,decimal) «. «}#doc9688789 .lst-kix_list_3-7>li:before{content:»» counter(lst-ctn-kix_list_3-7,lower-latin) «. «}#doc9688789 .lst-kix_list_8-4>li:before{content:»» counter(lst-ctn-kix_list_8-4,lower-latin) «. «}#doc9688789 .lst-kix_list_10-2>li{counter-increment:lst-ctn-kix_list_10-2}#doc9688789 ol.lst-kix_list_8-5.start{counter-reset:lst-ctn-kix_list_8-5 0}#doc9688789 ol.lst-kix_list_4-2.
«}#doc9688789 .lst-kix_list_3-8>li:before{content:»» counter(lst-ctn-kix_list_3-8,lower-roman) «. «}#doc9688789 .lst-kix_list_8-5>li:before{content:»» counter(lst-ctn-kix_list_8-5,lower-roman) «. «}#doc9688789 ol.lst-kix_list_10-7.start{counter-reset:lst-ctn-kix_list_10-7 0}#doc9688789 .lst-kix_list_8-6>li:before{content:»» counter(lst-ctn-kix_list_8-6,decimal) «. «}#doc9688789 .lst-kix_list_2-0>li{counter-increment:lst-ctn-kix_list_2-0}#doc9688789 .lst-kix_list_8-3>li:before{content:»» counter(lst-ctn-kix_list_8-3,decimal) «. «}#doc9688789 .lst-kix_list_3-6>li:before{content:»» counter(lst-ctn-kix_list_3-6,decimal) «. «}#doc9688789 .lst-kix_list_3-7>li:before{content:»» counter(lst-ctn-kix_list_3-7,lower-latin) «. «}#doc9688789 .lst-kix_list_8-4>li:before{content:»» counter(lst-ctn-kix_list_8-4,lower-latin) «. «}#doc9688789 .lst-kix_list_10-2>li{counter-increment:lst-ctn-kix_list_10-2}#doc9688789 ol.lst-kix_list_8-5.start{counter-reset:lst-ctn-kix_list_8-5 0}#doc9688789 ol.lst-kix_list_4-2. start{counter-reset:lst-ctn-kix_list_4-2 0}#doc9688789 ol.lst-kix_list_9-3.start{counter-reset:lst-ctn-kix_list_9-3 0}#doc9688789 .lst-kix_list_8-8>li:before{content:»» counter(lst-ctn-kix_list_8-8,lower-roman) «. «}#doc9688789 ol.lst-kix_list_2-2{list-style-type:none}#doc9688789 ol.lst-kix_list_2-3{list-style-type:none}#doc9688789 ol.lst-kix_list_2-4{list-style-type:none}#doc9688789 ol.lst-kix_list_7-2.start{counter-reset:lst-ctn-kix_list_7-2 0}#doc9688789 ol.lst-kix_list_2-5{list-style-type:none}#doc9688789 ol.lst-kix_list_10-1.start{counter-reset:lst-ctn-kix_list_10-1 0}#doc9688789 .lst-kix_list_4-4>li{counter-increment:lst-ctn-kix_list_4-4}#doc9688789 ol.lst-kix_list_2-0{list-style-type:none}#doc9688789 ol.lst-kix_list_2-1{list-style-type:none}#doc9688789 .lst-kix_list_4-8>li:before{content:»» counter(lst-ctn-kix_list_4-8,lower-roman) «. «}#doc9688789 .lst-kix_list_4-7>li:before{content:»» counter(lst-ctn-kix_list_4-7,lower-latin) «. «}#doc9688789 ol.lst-kix_list_4-1.start{counter-reset:lst-ctn-kix_list_4-1 6}#doc9688789 .
start{counter-reset:lst-ctn-kix_list_4-2 0}#doc9688789 ol.lst-kix_list_9-3.start{counter-reset:lst-ctn-kix_list_9-3 0}#doc9688789 .lst-kix_list_8-8>li:before{content:»» counter(lst-ctn-kix_list_8-8,lower-roman) «. «}#doc9688789 ol.lst-kix_list_2-2{list-style-type:none}#doc9688789 ol.lst-kix_list_2-3{list-style-type:none}#doc9688789 ol.lst-kix_list_2-4{list-style-type:none}#doc9688789 ol.lst-kix_list_7-2.start{counter-reset:lst-ctn-kix_list_7-2 0}#doc9688789 ol.lst-kix_list_2-5{list-style-type:none}#doc9688789 ol.lst-kix_list_10-1.start{counter-reset:lst-ctn-kix_list_10-1 0}#doc9688789 .lst-kix_list_4-4>li{counter-increment:lst-ctn-kix_list_4-4}#doc9688789 ol.lst-kix_list_2-0{list-style-type:none}#doc9688789 ol.lst-kix_list_2-1{list-style-type:none}#doc9688789 .lst-kix_list_4-8>li:before{content:»» counter(lst-ctn-kix_list_4-8,lower-roman) «. «}#doc9688789 .lst-kix_list_4-7>li:before{content:»» counter(lst-ctn-kix_list_4-7,lower-latin) «. «}#doc9688789 ol.lst-kix_list_4-1.start{counter-reset:lst-ctn-kix_list_4-1 6}#doc9688789 . lst-kix_list_7-3>li{counter-increment:lst-ctn-kix_list_7-3}#doc9688789 ol.lst-kix_list_4-8.start{counter-reset:lst-ctn-kix_list_4-8 0}#doc9688789 .lst-kix_list_8-4>li{counter-increment:lst-ctn-kix_list_8-4}#doc9688789 ol.lst-kix_list_3-3.start{counter-reset:lst-ctn-kix_list_3-3 0}#doc9688789 ol.lst-kix_list_10-8.start{counter-reset:lst-ctn-kix_list_10-8 0}#doc9688789 ol.lst-kix_list_2-6{list-style-type:none}#doc9688789 ol.lst-kix_list_2-7{list-style-type:none}#doc9688789 ol.lst-kix_list_2-8{list-style-type:none}#doc9688789 ol.lst-kix_list_7-8.start{counter-reset:lst-ctn-kix_list_7-8 0}#doc9688789 ol.lst-kix_list_7-1.start{counter-reset:lst-ctn-kix_list_7-1 0}#doc9688789 ol.lst-kix_list_8-6.start{counter-reset:lst-ctn-kix_list_8-6 0}#doc9688789 .lst-kix_list_3-3>li{counter-increment:lst-ctn-kix_list_3-3}#doc9688789 ol.lst-kix_list_10-2.start{counter-reset:lst-ctn-kix_list_10-2 1}#doc9688789 ol.lst-kix_list_8-0.start{counter-reset:lst-ctn-kix_list_8-0 0}#doc9688789 .lst-kix_list_7-0>li:before{content:»» counter(lst-ctn-kix_list_7-0,decimal) «.
lst-kix_list_7-3>li{counter-increment:lst-ctn-kix_list_7-3}#doc9688789 ol.lst-kix_list_4-8.start{counter-reset:lst-ctn-kix_list_4-8 0}#doc9688789 .lst-kix_list_8-4>li{counter-increment:lst-ctn-kix_list_8-4}#doc9688789 ol.lst-kix_list_3-3.start{counter-reset:lst-ctn-kix_list_3-3 0}#doc9688789 ol.lst-kix_list_10-8.start{counter-reset:lst-ctn-kix_list_10-8 0}#doc9688789 ol.lst-kix_list_2-6{list-style-type:none}#doc9688789 ol.lst-kix_list_2-7{list-style-type:none}#doc9688789 ol.lst-kix_list_2-8{list-style-type:none}#doc9688789 ol.lst-kix_list_7-8.start{counter-reset:lst-ctn-kix_list_7-8 0}#doc9688789 ol.lst-kix_list_7-1.start{counter-reset:lst-ctn-kix_list_7-1 0}#doc9688789 ol.lst-kix_list_8-6.start{counter-reset:lst-ctn-kix_list_8-6 0}#doc9688789 .lst-kix_list_3-3>li{counter-increment:lst-ctn-kix_list_3-3}#doc9688789 ol.lst-kix_list_10-2.start{counter-reset:lst-ctn-kix_list_10-2 1}#doc9688789 ol.lst-kix_list_8-0.start{counter-reset:lst-ctn-kix_list_8-0 0}#doc9688789 .lst-kix_list_7-0>li:before{content:»» counter(lst-ctn-kix_list_7-0,decimal) «. «}#doc9688789 .lst-kix_list_2-2>li{counter-increment:lst-ctn-kix_list_2-2}#doc9688789 ol.lst-kix_list_4-7.start{counter-reset:lst-ctn-kix_list_4-7 0}#doc9688789 .lst-kix_list_2-6>li:before{content:»» counter(lst-ctn-kix_list_2-6,decimal) «. «}#doc9688789 .lst-kix_list_3-7>li{counter-increment:lst-ctn-kix_list_3-7}#doc9688789 ol.lst-kix_list_9-7.start{counter-reset:lst-ctn-kix_list_9-7 0}#doc9688789 .lst-kix_list_2-4>li:before{content:»» counter(lst-ctn-kix_list_2-4,lower-latin) «. «}#doc9688789 .lst-kix_list_2-8>li:before{content:»» counter(lst-ctn-kix_list_2-8,lower-roman) «. «}#doc9688789 ]]>
«}#doc9688789 .lst-kix_list_2-2>li{counter-increment:lst-ctn-kix_list_2-2}#doc9688789 ol.lst-kix_list_4-7.start{counter-reset:lst-ctn-kix_list_4-7 0}#doc9688789 .lst-kix_list_2-6>li:before{content:»» counter(lst-ctn-kix_list_2-6,decimal) «. «}#doc9688789 .lst-kix_list_3-7>li{counter-increment:lst-ctn-kix_list_3-7}#doc9688789 ol.lst-kix_list_9-7.start{counter-reset:lst-ctn-kix_list_9-7 0}#doc9688789 .lst-kix_list_2-4>li:before{content:»» counter(lst-ctn-kix_list_2-4,lower-latin) «. «}#doc9688789 .lst-kix_list_2-8>li:before{content:»» counter(lst-ctn-kix_list_2-8,lower-roman) «. «}#doc9688789 ]]>
Контрольная работа по химии для 9 класса по теме «Металлы»
Всероссийский дистанционный конкурс для учителей естественнонаучного цикла «Контрольная работа в формате теста»Контрольная работа по теме «Металлы»
химия 9 класс
Автор: учитель биологии и химии МОУ «Кушалинская СОШ» Тверская обл.
Артемьева Елена Юрьевна
Цель работы: оценить уровень усвоения учебного материала по химии по теме «Металлы» в 9 классе
Структура и содержание контрольной работы
Работа состоит из 2 частей, различающихся по форме и уровню сложности.
Часть 1 содержит 12 закрытых тестовых заданий базового и повышенного уровня сложности.
Часть 2 содержит 2 задания высокого уровня сложности (открытого типа). Для заданий открытого типа необходимо дать развернутый ответ.
К контрольной работе прилагаются:
бланк ответов для учащихся
инструкция
ответы
критерии оценивания
шкала перевода баллов в оценки.
Инструкция по выполнению работы.
На выполнение контрольной работы отводится 45 минут. Работа состоит из двух частей, включающих в себя 14 заданий.
Часть 1 содержит 12 заданий с кратким ответом.
При выполнении заданий 1-10 выберите номер одного правильного ответа из четырех предложенных и внесите его в бланк ответов. Максимальное количество баллов – 10 (по 1 баллу за задание)
При выполнении заданий 11-12 вам необходимо установить соответствие. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. Цифры занесите в бланк ответов. Максимальное количество баллов за каждое задание -2.
К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. Цифры занесите в бланк ответов. Максимальное количество баллов за каждое задание -2.
Часть 2 содержит 2 задания с развёрнутым ответом.
Для заданий 13-14 запишите развёрнутый ответ. Вам необходимо составить УХР, произвести расчеты. Максимальное количество баллов за каждое задание — 3.
Ответы заносите в бланк, записывайте чётко и разборчиво.
При выполнении работы вы можете пользоваться ПСХЭ Д.И. Менделеева, таблицей растворимости, электрохимическим рядом напряжений металлов и непрограммируемым калькулятором.
Ответы на задания необходимо вносить в бланк ответов.
Контрольная работа по теме «Металлы». 9 класс
1 часть
При выполнении заданий 1-10 выберите номер одного правильного ответа и внесите его в бланк ответов.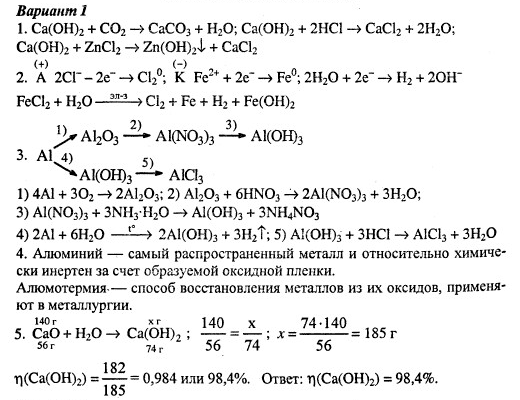
1. Наиболее ярко металлические свойства проявляет:
2. Ряд, в котором элементы расположены в порядке возрастания их атомного радиуса:
1) Al→Mg→Na
2) Ca→Ba→Be
3) K→Na→Li
4) K→Ca→Al
3. Электронная конфигурация внешнего электронного слоя….3s23p1 соответствует атому
1) скандия
2) бора
3) алюминия
4) калия
4. Реактивом на ион является ион:
1) СО32-
2) Na+
3) OH-
4) Cl-
5. Наиболее активно с водой при комнатной температуре будут взаимодействовать оба металла из пары:
1) Na и Cu
2) Na и K
3) K и Zn
4) Cu и Hg
6. С растворами кислот будут взаимодействовать оба металла
1) Na и Cu
2) K и Hg
3) Al и Zn
4) Cu и Hg
7. При взаимодействии цинка с водой при нагревании образуется
При взаимодействии цинка с водой при нагревании образуется
1) соль и вода
2) основание и водород
3) оксид металла и водород
4) реакция не протекает
8. С водой с образованием основания и водорода будет взаимодействовать
9.Амфотерный оксид образуется при взаимодействии кислорода и
1) натрия
2) магния
3) бария
4) алюминия
10. Для вытеснения меди из раствора её соли можно использовать
1) кальций
2) цинк
3) литий
4) серебро
При выполнении заданий 11-12 вам необходимо установить соответствие. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. Цифры занесите в бланк ответов.
11. Установите соответствие между исходными веществами и продуктами реакций
Установите соответствие между исходными веществами и продуктами реакций
Исходные вещества | Продукты реакции |
А) NaCl+AgNO3→ Б) CuSO4+BaCl2→ В) Fe+CuCl2→ Г) NaOH+CuCl2→ | 1) CuOH↓+NaCl 2) Cu↓+FeCl2 3) Cu(OH)2+NaCl 4) NaNO3+AgCl 5) CuCl2+BaSO4↓ 6) Cu↓+FeCl3 |
12. Установите соответствие между веществами, вступающими в химическое взаимодействие и признаками данной реакции.
Взаимодействующие вещества | Признаки реакции |
А) цинк и соляная кислота Б) железо и раствор хлорида меди(II) В) раствор сульфата меди и раствор гидроксида калия Г) медь и конц. | 1) выделение бесцветного газа с резким запахом 2) выделение газа без цвета и запаха 3) выпадение красного осадка 4) выпадение голубого осадка |
2 часть
Для заданий 13-14 запишите развёрнутый ответ. Ответы заносите в бланк, записывайте чётко и разборчиво.
13. Мысленный эксперимент. Требуется получить гидроксид железа(II) в результате проведения двух последовательных реакций. Выберите необходимые для этого реактивы из числа тех, которые Вам предложены. Fe, НCl, NaOH, Н2О, Cl2
Запишите уравнения двух реакций. Для реакции обмена составьте сокращённое ионное уравнение.
14. Какая масса меди образуется при взаимодействии 2 моль железа с раствором, содержащим 16г сульфата меди(II)?
БЛАНК ОТВЕТОВ
Ф. И.______________________________ класс ____________________
И.______________________________ класс ____________________
1 часть
11.
12.
2 часть
13. Мысленный эксперимент
______________________________________________________________________
14. Задача
_________________________________________________________________________
Ответы и критерии оценивания
1 часть. Задания 1-10. Верное выполнение каждого из заданий оценивается 1 баллом. Неправильный ответ или его отсутствие – 0 баллов.
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
1 | 1 | 3 | 4 | 2 | 3 | 3 | 1 | 4 | 2 |
Задание 11, 12. Полный правильный ответ на каждое задание оценивается 2 баллами. Если допущена одна ошибка, то ответ оценивается в 1,5 балла, если две ошибки — 1 балл, 3 ошибки – 0,5 балла, 4 ошибки или отсутствие ответа — 0 баллов.
Полный правильный ответ на каждое задание оценивается 2 баллами. Если допущена одна ошибка, то ответ оценивается в 1,5 балла, если две ошибки — 1 балл, 3 ошибки – 0,5 балла, 4 ошибки или отсутствие ответа — 0 баллов.
11.
12.
2 часть. Критерии оценивания заданий с развёрнутым ответом
Часть 2
Критерии оценивания заданий с развёрнутым ответом
13. Мысленный эксперимент. Требуется получить гидроксид железа(II) в результате проведения двух последовательных реакций. Выберите необходимые для этого реактивы из числа тех, которые Вам предложены. Fe, НCl, NaOH, Н2О, Cl2
Запишите уравнения двух реакций. Для реакции обмена составьте сокращённое ионное уравнение.
Содержание верного ответа | Баллы |
Элементы ответа: Fe + 2HCl = FeCl2+ h3↑ FeCl2 + 2NaOH = 2NaCl + Fe(ОН)2↓ Fe2+ +2OH- = Fe(ОН)2 | 1 1 1 |
Максимальный балл | 3 |
14. Какая масса меди образуется при взаимодействии 2 моль железа с раствором, содержащим 16г сульфата меди(II)?
Какая масса меди образуется при взаимодействии 2 моль железа с раствором, содержащим 16г сульфата меди(II)?
Содержание верного ответа | Баллы |
Элементы ответа: Составлено уравнение реакции: CuSO4+ Fe → FeSO4+Cu Найдено количество вещества CuSO4 = 16г/160г/моль = 0,1 моль Определен избыток Fe; n(Fe) > n(CuSO4) Определено количество меди: n(Cu) = n(CuSO4) = 0,1 моль Рассчитана масса меди m(Cu) = 0,1моль × 64г/моль= 6,4 г. | 1 0,5 0,5 0,5 0,5 |
Максимальный балл | 3 |
Максимальный балл за работу – 20.
Перевод баллов в оценку
Кол-во баллов | Менее 6 | 6-12 | 12,5-17 | 17,5-20 |
оценка | 2 | 3 | 4 | 5 |
Контрольная работа по теме «Металлы», 9 класс
Контрольная работа по теме «Металлы» 9 класс.
Вариант 1
Обязательная часть
Расположите химические элементы: Sr, Ca, Ba, Be, Mg в порядке уменьшения восстановительных свойств (согласно ПСХЭ Д. И.Менделеева)
И.Менделеева)
Укажите названия четырёх щёлочных металлов:
А. … Б. … В. … Г. …
Выберите ряд металлов, которые будут вытеснять водород из раствора разбавленной серной кислоты (согласно ряда напряжений металлов)
А. Ag, Mg, Zn. Б. Al, Zn, Fe. B. Li, Ca, Cu.
Дополните фразу: «Кальций имеет важное значение для живых организмов, так как …»
Допишите схемы химических реакций получения металлов из их оксидов. Расставьте коэффициенты. Назовите окислитель и восстановитель.
А. Cu2O+C Б. HgO+C
Для пар веществ, которые взаимодействуют, напишите уравнения химических реакций:
А. Na + S Б. Cu + H2O B. FeO + HCl
Масса железа, образовавшегося при взаимодействии 144 г. оксида железа (II) с водородом по уравнению реакции:
оксида железа (II) с водородом по уравнению реакции:
FeO + H2 = Fe + H2O равна:
А. 5,6 г. Б. 56 г. В. 11,2 г. Г. 112 г.
Дополнительная часть
(3 балла) Напишите уравнения химических реакций, с помощью которых можно осуществить превращения:
NaOH Cu(OH)2 CuO Cu
(5 баллов) в схеме реакции: ZnS + O2 ZnO + SO2 расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель, процессы окисления и восстановления.
(3 балла) При разложении 1 кг. Карбоната кальция получили 504 г. Оксида кальция. Массовая доля выхода продукта реакции равна:
90%; 2) 80% 3) 70% 4) 60%
Вариант 2
Обязательная часть
Расположите химические элементы: Rb, K, Cs, Li, Na. в порядке возрастания восстановительных свойств (согласно ПСХЭ Д.И.Менделеева)
в порядке возрастания восстановительных свойств (согласно ПСХЭ Д.И.Менделеева)
Укажите физические свойства металлов:
А. … Б. … В. … Г. …
Выберите ряд металлов, которые будут вытеснять медь из раствора сульфата меди (согласно ряда напряжений металлов)
А. Ni, Fe, Zn.. Б. Ba, Fe, Au. B. Ag, Fe, Zn.
Дополните фразу: «Калий необходим для организма человека и растений, так как …»
Допишите схемы химических реакций получения металлов из их оксидов. Расставьте коэффициенты. Назовите окислитель и восстановитель.
А. CuO+C Б. Ag2O + H2
Для пар веществ, которые взаимодействуют, напишите уравнения химических реакций:
А. Ag + HCl Б. Mg + O2 В. CaO + HNO3
Масса железа, образовавшегося при взаимодействии 288 г. оксида железа (II) с оксидом углерода (II) по уравнению реакции:
оксида железа (II) с оксидом углерода (II) по уравнению реакции:
FeO + CO = Fe + CO2 равна
А. 22,4 г. Б. 224г. В. 56 г. Г. 5,6 г.
Дополнительная часть
(3 балла) Напишите уравнения химических реакций, с помощью которых можно осуществить превращения:
Сa(OH)2 CaCO3 CaO CaCl2
(5 баллов) в схеме реакции: Fe2O3 + H2 Fe + H2O расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель, процессы окисления и восстановления.
(3 балла) В реакции восстановления водородом оксида меди (II) массой 8 г. Образовалось 3,84 г. меди. Массовая доля выхода продукта реакции равна:
50% 2) 60% 3) 70 % 4) 80%
Вариант 3.
Обязательная часть
Расположите химические элементы:Mg, Sr, Be, Ba, Ca. в порядке возрастания восстановительных свойств (согласно ПСХЭ Д.И.Менделеева)
Укажите названия четырех металлов III группы главной подгруппы .
А. … Б. … В. … Г. …
Выберите ряд металлов, которые будут вытеснять водород из раствора соляной кислоты (согласно ряда напряжений металлов)
А. Сu, Zn, Mg… Б. Ag, Cu, Zn . B. Al, Fe, Zn.
Дополните фразу: «Магний имеет важное значение для живых организмов, так как …»
Допишите схемы химических реакций получения металлов из их оксидов. Расставьте коэффициенты. Назовите окислитель и восстановитель.
А. Cu2O + H2 Б. ZnО + C
ZnО + C
Для пар веществ, которые взаимодействуют, напишите уравнения химических реакций:
А. K + Cl2 Б. Fe + HCl В. Hg + CuSO4
Масса цинка, полученная при взаимодействии 243 г. оксида цинка с водородом по уравнению реакции:
ZnO + H2 = Zn + H2O равна
А. 19,5 г. Б. 195г. В. 6,5г. Г. 65 г.
Дополнительная часть
(3 балла) Напишите уравнения химических реакций, с помощью которых можно осуществить превращения:
FeCl2 Fe(OH)2 FeO Fe
(5 баллов) в схеме реакции: Al + HCl AlCl3 + H2 коэффициенты методом электронного баланса. Укажите окислитель и восстановитель, процессы окисления и восстановления.
(3 балла) При нейтрализации 40 г гидроксида натрия серной кислотой образовалось 49,7г. Сульфата натрия. Массовая доля выхода продукта реакции равна:
1) 70% 2) 75% 3) 80% 4) 85%
Вариант 4.
Обязательная часть
Расположите химические элементы: Rb, K, Cs, Li, Na. в порядке уменьшения восстановительных свойств (согласно ПСХЭ Д.И.Менделеева)
Укажите названия четырёх щелочноземельных металлов:
А. … Б. … В. … Г. …
Выберите ряд металлов, которые будут вытеснять медь из раствора хлорида меди (согласно ряда напряжений металлов)
А. Ag, Al, Zn.. Б. Mg, Fe, Zn B. Au, Fe, Ba.
Дополните фразу: «Железо играет важную роль в жизни млекопитающих животных и человека, так как…»
Допишите схемы химических реакций получения металлов из их оксидов. Расставьте коэффициенты. Назовите окислитель и восстановитель.
Расставьте коэффициенты. Назовите окислитель и восстановитель.
А. Cu2O + CO Б. FeO + C
6. Для пар веществ, которые взаимодействуют, напишите уравнения химических реакций:
А. ZnCl2 + Fe Б. MgO + HNO3 В. Zn + HCl
Масса меди полученнаая при взаимодействии 320 г. оксида меди (II) с оксидом углерода (II) по уравнению реакции:
CuO + CO = Cu + CO2 равна
А. 6,4 г. Б. 64 г
Контрольная работа по химии 9 класс тема «Металлы»
9класс.
Контрольная работа по теме «Металлы»
Пояснительная записка
Цель:
Осуществление контроля над уровнем усвоения темы учащимися, систематизация и обобщение материала по теме «Металлы»
Задачи:
Закрепить представление о положении металлов в периодической системе, зависимости строения их атомов и свойств от положения в периодической системе химических элементов.

Закрепить навыки в составлении оксидов металлов первых трёх групп химических элементов, а также в составлении уравнений химических реакций.
Закрепить умение решать задачи на практический выход продукта реакции.
Ставить перед учащимися предельно конкретную коррекционно-развивающую задачу, учитывая специфику обучения.
Помочь ребятам со стойкими трудностями в обучении.
Контрольная работа в 9 классе завершает тему «Металлы», она рассчитана на академический час и позволяет проверить качество знаний, умений и навыков у учащихся коррекционных классов.
Работа выполняется по вариантам и по уровням. Она включает в первом уровне три обязательных и одно дополнительное задание, которым можно воспользоваться при не знании какого-либо из заданий.
Во втором уровне обязательными являются все четыре задания.
В первом уровне во втором задании использую приём коррекции и переключения внимания.
Во втором уровне все задания, кроме задачи на коррекцию распределения внимания.
В заключении хочется ещё раз повторить, что дети, имеющие временную задержку в развитии, ни в коей мере не относятся к умственно отсталым детям, поскольку хорошо воспринимают предлагаемую помощь, сознательно выполняют поставленные перед ними задачи и правильно оперируют теми понятиями, которые они имеют. При своевременной коррекции большинство из них хорошо продвигаются и постепенно выравниваются в знании.
9класс.
Контрольная работа №2 по теме: «Металлы».
Вариант 1.
Первый уровень (оценка «3»)
ЗАДАНИЕ 1
Охарактеризуйте металлы 1 группы периодической системы химических элементов Д.И. Менделеева.
ЗАДАНИЕ 2
Установите соответствие между правой и левой частями уравнений
1) NaCl+AgNO3→ | А)Fe(OH)3↓+3NaCl |
2)CuSO4+BaCl2→ | Б)Cu↓+FeCl2 |
3)Fe+CuCl | B)Fe(OH)2+2NaCl |
4)2NaOH+FeCl2→ | Г)NaNO3+AgCl |
Д)CuCl2+BaSO4↓ |
ЗАДАНИЕ 3
Какие физические свойства характерны для металлов?
Второй уровень (оценка «5»)
ЗАДАНИЕ 1
Проведите все возможные реакции Fe с : O2 , Br2, H2, CuCl2, NaOH, HCl, H
ЗАДАНИЕ 2
Напишите уравнения реакций, соответствующих превращениям, укажите условия их протекания:
Рассмотрите реакцию № 1 как ОВР и реакцию № 3 в свете ТЭД
Ca→ CaO→ Ca(OH)2→ CaSO4→ BaSO4
ЗАДАНИЕ 3
Какая масса меди образуется при взаимодействии железа с раствором, содержащим 16г сульфата меди(II)?
9класс.
Контрольная работа №2 по теме: «Металлы».
Первый уровень (оценка «3»)
ЗАДАНИЕ 1
Охарактеризуйте металлы 2 группы периодической системы химических элементов Д.И. Менделеева.
ЗАДАНИЕ 2
Установите соответствие между правой и левой частями уравнений
1) CaCl2+2NaOH→ | А)FeCl2+H2↑ |
2)2K+2H2O→ | Б) FeCl3+H2↑ |
3)3NaOH+FeCl3→ | B)Ca(OH)2↓+2NaCl |
4)2HCl+Fe→ | Г)3NaCl+Fe(OH)3↓ |
Д)2KOH+H2↑ |
ЗАДАНИЕ 3
Опишите области применения металлов и их соединении.
Второй уровень (оценка «5»)
ЗАДАНИЕ 1
Проведите все возможные реакции Ca с : O2 , Br2, H2, CuCl2, NaOH, HCl,
ЗАДАНИЕ 2
Напишите уравнения реакций, соответствующих превращениям, укажите условия их протекания:
Рассмотрите реакцию № 1 как ОВР и реакцию № 3 в свете ТЭД
Al→Al2O3→AlCl3→Al(OH)3→Al(NO3)3
ЗАДАНИЕ 3
Какая масса осадка образуется при взаимодействии 4г гидроксида натрия с хлоридом железа (II)?
9класс.
Контрольная работа №2 по теме: «Металлы».
Вариант 3

Первый уровень (оценка «3»)
ЗАДАНИЕ 1
Охарактеризуйте химический элемент №13 периодической системы Д.И. Менделеева.
ЗАДАНИЕ 2
Установите соответствие между правой и левой частями уравнений
ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
А) NaОН + СО2 (И3б) Б) 2Na + О2 В) 2Na + Н2О | 1) 2NaОН + Н2 2) Nа2О2 3) Nа2О 4)NаНСО3 5) NaCl + H2O |
ЗАДАНИЕ 3
Расскажите о нахождении металлов в природе.
Второй уровень (оценка «5»)
ЗАДАНИЕ 1
Проведите все возможные реакции Zn с : O2 , Br2, H2, CuCl2, NaOH, HCl, H2O, Cu)
ЗАДАНИЕ 2
Напишите уравнения реакций, соответствующих превращениям, укажите условия их протекания:
Рассмотрите реакцию № 1 как ОВР и реакцию № 3 в свете ТЭД
Mg→MgO →MgCl2→ Mg(OH)2→Mg(NO3)2
ЗАДАНИЕ 3
Вычислите массу соли, образующейся при взаимодействии 81 г алюминия с соляной кислотой?
9класс.
Контрольная работа №2 по теме: «Металлы».
Первый уровень (оценка «3»)
ЗАДАНИЕ 1
Охарактеризуйте химический элемент №26 периодической системы Д.И. Менделеева.
ЗАДАНИЕ 2
Установите соответствие между правой и левой частями уравнений
ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
А) Na + Н2 Б) Zn + О2 В) Fe+ Н2О Г) NaOH + HCl | 1) 2NaН 2) NaН2 3) 2ZnО 4) Zn2О 5) Fe 6) Fe2О3+ H2 7) NaCl + H2O |
ЗАДАНИЕ 3
Расскажите историю открытия металлов.
Второй уровень (оценка «5»)
ЗАДАНИЕ 1
Проведите все возможные реакции Mg с : O2 , Br2, H2, CuCl2, NaOH, HCl, H2O, Cu)
ЗАДАНИЕ 2
Напишите уравнения реакций, соответствующих превращениям, укажите условия их протекания:
Рассмотрите реакцию № 1 как ОВР и реакцию № 3 в свете ТЭД
Zn→ ZnO→Zn(NO3)2→Zn(OH)2 → ZnO→Zn
ЗАДАНИЕ 3
Определите массу натрия, который потребуется для получения 80 гр. гидроксида натрия.
Контрольная работа по химии в 9 классе по теме :»Металлы»
Контрольная работа : «Металлы» Вариант №1
А1. Элемент, атом которого содержит 11 протонов
Элемент, атом которого содержит 11 протонов
1) Na 2) C 3) Mg 4) Si
А2.У какого элемента металлические свойства наиболее выражены ?
1) Fr 2) Al 3) Na 4) Mg
А3.В порядке уменьшения восстановительных свойств металлы расположены в ряду
1) Mg, Zn, Ag 3)Na, Zn, K
2) Al, Fe, Na 4)Ni, Al, Cr
А4.Электронная конфигурация атома Al
2 2 6 1 2 2 5 2 2 4 2 2 6 2 1
1)1s 2s 2p 3s 2)1s 2s 2p 3)1s 2s 2p 4)1s 2s 2p 3s 3p
А5.За счёт электронов предвнешнего уровня степень окисления железа равна
1)+1 2)+2 3)+3 4)+11
А6.Химическая реакция возможна между
1)Fe+MgSO4 2)Zn+CuCl2 3)Cu+HCl 4)Ag+h3SO4
А7.Сумма коэффициентов в сокращённом ионном уравнении CuO+2HNO3=Cu(NO3)2+h3O равна
1)4 2)3 3)5 4)6
В1.Железо может реагировать с каждым из двух веществ:
1)аммиак, водород 4)гидроксид натрия , бром
2)соляная кислота, кислород 5)оксид углерода(2), азот
Ответ:______________.
(Запишите соответствующие цифры в порядке возрастания.)
В2.Первое вещество является окислителам в реакциях :
1)NO+h3-N2+h3O 3)O2+Mg-MgO 5)Fe+Cl2-FeCl3
2)N2+Li-Li3N 4)Fe+S-FeS
Ответ:______________.
(Запишите соответствующие цифры в порядке возрастания.)
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Al-AlCl3-Al(OH)3-Al2O3-NaAlO2
Составьте 2 уравнения в ионном виде .
Ответы : А1 А2 А3 А4 А5 А6 А7 В1 В2 С1
1 1 1 4 3 2 3 12 123
Контрольная работа : «Металлы» Вариант №2
А1.Элемент, атом которого содержит 12 протонов
1) Na 2) C 3) Mg 4) Si
А2.У какого элемента металлические свойства наиболее выражены ?
1) Li 2) Fe 3) Na 4) Mg
А3.В порядке уменьшения восстановительных свойств металлы расположены в ряду
1) Mg, Zn, Au 3)Na, Zn, Mg
2) Al, Fe, Zn 4)Ni, Al, Zn
А4.Электронная конфигурация атома Na
2 2 6 1 2 2 5 2 2 4 2 2 6 2
1)1s 2s 2p 3s 2)1s 2s 2p 3)1s 2s 2p 4)1s 2s 2p 3s
А5. Наиболее устойчивой степенью окисления меди является
Наиболее устойчивой степенью окисления меди является
1)+1 2)+2 3)+3 4)+11
А6.Химическая реакция возможна между
1)Fe+CuSO4 2)Zn+MgSO4 3)Cu+HCl 4)Ag+h3SO4
А7.Сумма коэффициентов в сокращённом ионном уравнении FeCl2+NaOH -Fe(OH)2+NaCL равна
1)4 2)3 3)8 4)6
В1.Гидроксид калия может реагировать с
1)сульфитом натрия 4)серной кислотой
2)оксидом цинка 5)нитратом меди (2)
3)оксидом серы(4)
Ответ:______________.
(Запишите соответствующие цифры в порядке возрастания.)
В2.Первое вещество является восстановителем в реакциях :
1)Si+C-SiC 3)SO2+O2-SO3 5)N2O5+Ca-CaO+NO2
2)Mg+NO2-MgO+N2 4)NO2+SO2-SO3+NO
Ответ:______________.
(Запишите соответствующие цифры в порядке возрастания.)
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Fe-FeCl2-Fe(OH)2-FeO
Ответы : А1 А2 А3 А4 А5 А6 А7 В1 В2 С1
3 3 1 1 2 1 3 2345 123
Контрольная работа : «Металлы» Вариант №3
А1. Элемент, атом которого содержит 20 протонов
Элемент, атом которого содержит 20 протонов
1) Na 2) Ca 3) Mg 4) Si
А2.У какого элемента металлические свойства наиболее выражены ?
1) Li 2) K 3) Na 4) Mg
А3.В порядке уменьшения восстановительных свойств металлы расположены в ряду
1) Ba, Zn, Cu 3)Na, Zn, Mg
2) Al, Fe, Cr 4)Ni, Al, Li
А4.Электронная конфигурация атома Li
2 2 6 1 2 1 2 2 4 2 2 6 2
1)1s 2s 2p 3s 2)1s 2s 3)1s 2s 2p 4)1s 2s 2p 3s
А5. Cтепенью окисления кальция является
1)+1 2)+2 3)+3 4)+11
А6.Химическая реакция возможна между
1)NaOH+CuSO4 2)Cu+MgSO4 3)Cu+HCl 4)Au+h3SO4
А7.Сумма коэффициентов в сокращённом ионном уравнении BaCl2+h3SO4=BaSO4+HCl равна
1)4 2)3 3)8 4)6
В1.Оксид алюминия может реагировать с
1)водой 4)медью
2)хлором 5)гидроксидом натрия
3)водородом
Ответ:______________.
(Запишите соответствующие цифры в порядке возрастания.)
В2.Второе вещество является восстановителем в реакциях :
1)N2O5+Ca-CaO+NO2 3)HCl+ K=KCl+h3
2)Mg+NO2-MgO+N2 4)Fe2O3+Al=2Fe+Al2O3
Ответ:______________.
(Запишите соответствующие цифры в порядке возрастания.)
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
CaCO3-CaO-Ca(OH)2-CaSO4
Ответы : А1 А2 А3 А4 А5 А6 А7 В1 В2 С1
2 2 1 2 2 1 3 5 134
Металлы. Контрольная работа по химии 9 класс
Контрольная работа по теме «Металлы» — 9 класс
Вариант 1
На вопросы 1-6 в ответе укажите последовательность цифр или значение ответа.
1. На приведѐнном рисунке изображена модель атома химического элемента. В ответе запишите последовательно номер периода и номер группы, в которой расположен химический элемент, модель
которого изображена на рисунке
2. Расположите химические элементы – 1) калий 2) натрий 3) лития в порядке увеличения их радиуса атома. В ответе запишите номера выбранных элементов в соответствующей последовательности.
В ответе запишите номера выбранных элементов в соответствующей последовательности.
3. Выберите два высказывания, в которых говорится о железе как о химическом элементе.
1) Железо реагирует с хлором.
2) Железо быстро ржавеет во влажном воздухе.
3) Пирит является сырьѐм для получения железа.
4) Гемоглобин, содержащий железо, переносит кислород.
5) В состав ржавчины входит железо
4. Какие два утверждения верны для характеристики как натрия, так и калия?
1) Электроны в атоме расположены на четырѐх электронных слоях
2) Соответствующее простое вещество — металл
3) Является s-элементом
4) Число протонов в ядре атома химического элемента равно
11
5) Число нейтронов в ядре атома (наиболее распространѐнного изотопа) химического элемента равно 12
5. Какие два из перечисленных веществ вступают в реакцию с алюминием? 1) Оксид лития
Какие два из перечисленных веществ вступают в реакцию с алюминием? 1) Оксид лития
2) Хлорид магния
3) Бром
4) Кислород
5) Карбонат кальция
6. Определите массовую долю (в %) лития в силикате лития. Ответ округлите до десятых.
На вопросы 7-9 представьте развернутые решения
7. Составьте уравнения химических реакций:
1) Mg + Cl2 →
2) Ba + H2O →
3) K + N2 →
4) Al + H2SO4 →
8. Составите молекулярные и ионные уравнения:
1) Na2S + HCl →
2) KOH + Zn(NO3)2 →
9. Решить задачу:
Решить задачу:
Какой объем водорода выделится (н.у.) при взаимодействии цинка с 294 г 10% раствора серной кислоты.
Контрольная работа по теме «Металлы» — 9 класс
Вариант 2
На вопросы 1-6 в ответе укажите цифры.
1. На приведѐнном рисунке изображена схема строения электронных оболочек атома химического элемента. В ответе запишите последовательно номер периода и номер группы, в которой расположен химический элемент.
2. Расположите химические элементы – 1) бром 2) йод 3) хлор в порядке увеличения неметаллических свойств. В ответе запишите номера выбранных элементов в соответствующей последовательности.
В ответе запишите номера выбранных элементов в соответствующей последовательности.
3. Выберите два высказывания, в которых говорится о сере как о химическом элементе:
1) Сера входит с состав некоторых аминокислот
2) Сера — это порошок жѐлтого цвета, который не смачивается водой
3) Молекула сероводорода состоит из двух атомов водорода и одного атома серы
4) Сера не притягивается магнитом
5) Серу применяют для вулканизации каучука
4. Какие два утверждения верны для характеристики как натрия, так и алюминия?
1) Наличие 12 протонов в ядрах их атомов
2) Нахождение валентных электронов в третьем электронном слое
3) Образование простых веществ-металлов
4) Существование в природе в виде двухатомных молекул
5) Образование ими высших оксидов с общей формулой Э2О
5. Какие два из перечисленных веществ вступают в реакцию с калием? 1) H2О 2) O2
Какие два из перечисленных веществ вступают в реакцию с калием? 1) H2О 2) O2
3) Ba
4) NaOH
5) Cu
6. Определите массовую долю (в %) натрия в сульфите натрия. Ответ округлите до десятых.
На вопросы 7-9 представьте развернутые решения
7. Составьте уравнения химических реакций:
1) Ca + Br2 →
2) Ba + S →
3) Na + H2O →
4) Fe + AgNO3 →
8. Составите молекулярные и ионные уравнения:
1) FeSO4 + BaCl2 →
2) Li2SO3 + HBr →
9. Решить задачу:
Решить задачу:
Какой объем водорода выделится (н.у.) при растворении в
воде 92 г натрия, содержащего 20% примесей
ЭКОЛОГИЧЕСКАЯ ХИМИЯ
Химия окружающей среды — это научное исследование химических и биохимических явлений, происходящих в естественных местах. Его не следует путать с «зеленая химия» , целью которой является снижение потенциального загрязнения в его источнике. Его можно определить как изучение источников, реакций, переноса, эффектов и судьбы химических веществ в воздухе, почве и водной среде; и влияние человеческой деятельности и биологической активности на них.Химия окружающей среды — это междисциплинарная наука, которая включает химию атмосферы, воды и почвы, а также в значительной степени опирается на аналитическую химию и связана с экологическими и другими областями науки. Химия окружающей среды включает в себя сначала понимание того, как работает незагрязненная среда, какие химические вещества в каких концентрациях присутствуют в природе и с какими эффектами. Без этого было бы невозможно точно изучить влияние человека на окружающую среду в результате выделения химических веществ.Химики-экологи используют ряд концепций из химии и различных наук об окружающей среде, чтобы помочь в изучении того, что происходит с химическими веществами в окружающей среде. Важные общие концепции химии включают понимание химических реакций и уравнений, растворов, единиц, отбора проб и аналитических методов.
Химия окружающей среды включает в себя сначала понимание того, как работает незагрязненная среда, какие химические вещества в каких концентрациях присутствуют в природе и с какими эффектами. Без этого было бы невозможно точно изучить влияние человека на окружающую среду в результате выделения химических веществ.Химики-экологи используют ряд концепций из химии и различных наук об окружающей среде, чтобы помочь в изучении того, что происходит с химическими веществами в окружающей среде. Важные общие концепции химии включают понимание химических реакций и уравнений, растворов, единиц, отбора проб и аналитических методов.
Загрязнение. Загрязнитель — это вещество, присутствующее в природе на уровне, превышающем типичный уровень, или которого иначе не было бы.Это может быть связано с деятельностью человека. Термин «загрязнитель» часто используется взаимозаменяемо с загрязняющим веществом , которое является веществом, оказывающим пагубное воздействие на окружающую среду. Хотя загрязнитель иногда определяется как вещество, присутствующее в окружающей среде в результате деятельности человека, но не имеющее вредных последствий, иногда бывает так, что токсические или вредные эффекты от загрязнения становятся очевидными только позднее. «Среда» (например, почва) или организм (например, рыба), на который воздействует загрязнитель или загрязнитель, называется рецептором , а приемник представляет собой химическую среду или виды, которые удерживают загрязнитель и взаимодействуют с ним.
Хотя загрязнитель иногда определяется как вещество, присутствующее в окружающей среде в результате деятельности человека, но не имеющее вредных последствий, иногда бывает так, что токсические или вредные эффекты от загрязнения становятся очевидными только позднее. «Среда» (например, почва) или организм (например, рыба), на который воздействует загрязнитель или загрязнитель, называется рецептором , а приемник представляет собой химическую среду или виды, которые удерживают загрязнитель и взаимодействуют с ним.
Экологические показатели. Химические показатели качества воды включают растворенный кислород (DO), химическую потребность в кислороде (COD), биохимическую потребность в кислороде (BOD), общее количество растворенных твердых веществ (TDS), pH, питательные вещества (нитраты и фосфор), тяжелые металлы (включая медь, цинк). , кадмий, свинец и ртуть) и пестициды.
Приложения. Основные области применения химии окружающей среды указаны ниже.
Оценка риска или опасности воздействия на окружающую среду . Фактор риска химикатов определен для безопасности окружающей среды. Это обнаруживается различными методами.
Управление окружающей средой . Химия окружающей среды изучает появление новых химических продуктов и их поведение в атмосфере. Полный жизненный цикл химического вещества используется для правильного обращения и методов хранения химикатов, которые помогают обнаружить неблагоприятное воздействие на окружающую среду.
Охрана подземных вод .Грунтовые воды загрязнены загрязненной почвой и сточными водами. Таким образом, идентификация загрязняющих веществ выполняется в химии окружающей среды, зная концентрацию, распределение и судьбу опасных химических веществ.
Защита поверхностных вод. Влияние загрязняющих веществ в фазе воды и отложений измеряется для проверки качества поверхностных вод. Это осуществляется процессами седиментации, бактериологическими процессами, радиационными процессами и т. Д.
Д.
Защита почвы . Качество почвы проверяется путем измерения воздействия на нее загрязняющих веществ. Это анализируется различными химическими и экотоксикологическими показателями.
Более чистое производство и управление отходами . Это включает управление отходами и их повторное использование, а также восстановление территории. Повторное использование и восстановление участка производятся путем анализа загрязняющих веществ в пробах окружающей среды и знания об их природе. Повторное использование отходов включает новаторское использование отходов.
:
Grade9chemistry Worksheets — Printable Worksheets
- Рабочие листы [все новое]
- Рабочие листы Common Core Math Science Grammar Phonics Read / Write Kindergarten US
- Common Core UK England Primary Australian F10 Canada Elementary South African Primary
- Home
- COMMON CORE
- Math
- Kindergarten
- Grade 1
- Grade 2
- Grade 3
- 4 класс
- 5 класс
- 6 класс
- 7 класс
- 8 класс
- ELA
- Детский сад
- 1 класс
- 2 класс
- 3 класс
- 4 класс
- 5 класс
- Сорт 6
- Сорт 7
- Gr ade 8
- РАБОЧИЕ ЛИСТЫ
- Математика
- Сложение
- Алгебра
- Десятичное число
- Деление
- Дробь
- Геометрия
- График
- Больше чем меньше
- Сотни
- Целые числа
- Входящие и выходящие
- Измерение
- Умножение
- Разрядное значение
- Вычитание
- Время
- Наука
- Животное
- Человеческое тело
- Насекомые
- Материя
- Растение
- Пространство
- Погода
- Грамматика
- Прилагательные
- Наречия
- Грамматика
- Существительные
- Местоимения
- Пунктуация
- Глаголы
- Звук
- Согласные
- Гласные
- Чтение / запись
- 1-й класс Чтение во 2-м классе
- Чтение в 3-м классе
- Курсивное письмо
- Детский сад
- Алфавиты
- Числа
- Формы
- Согласные
- Гласные
- УЧЕБНАЯ ИНФОРМАЦИЯ US Common Core
HSC Chemistry
Программное обеспечение Outotec для химических реакций и равновесия HSC Chemistry — это самое популярное в мире термохимическое программное обеспечение с универсальным модулем моделирования технологических схем.HSC предназначен для различных видов химических реакций и расчетов равновесий, а также для моделирования процессов.
Преимущества
Программное обеспечение HSC позволяет быстро и легко выполнять обычные термодинамические расчеты на персональных компьютерах. Таким образом, HSC имеет широкий спектр применения в научном образовании, промышленности и исследованиях. Термохимические расчеты полезны, например, при разработке новых химических процессов и улучшении старых. HSC Chemistry также является полезным инструментом для университетов и школ в области химии и исследований.
Традиционно в термодинамических расчетах, основанных на экспериментальных или оценочных данных, использовались функции устойчивости из различных сборников термодинамических данных и статей в научных журналах. Сложный этап поиска и сложные расчеты, а также несоответствия, возникающие из-за различного выбора стандартных и эталонных состояний, сделали эту процедуру расчета довольно трудоемкой.
HSC Chemistry предлагает мощные методы расчетов для изучения влияния различных переменных на химическую систему в состоянии равновесия.Например, если пользователь указывает сырье, количества и другие условия почти любого химического процесса, программа в результате выдаст количество продукта. HSC также делает расчеты теплового и материального баланса различных процессов намного проще, чем любой ручной метод. Опция Eh-pH-диаграммы также предлагает очень быстрый способ изучения растворения и коррозионного поведения различных материалов.
Конечно, ГСК не может решить все химические задачи, так как не учитывает кинетику (скорость) химических реакций и неидеальность растворов.Однако во многих случаях это очень недорогой и полезный инструмент, который помогает найти оптимальные условия реакции и выходы для экспериментальных исследований без дорогостоящих химических методов проб и ошибок.
О программном обеспечении
Название программы основано на том, что вычислительные модули автоматически используют ту же обширную термохимическую базу данных, которая содержит данные энтальпии (H), энтропии (S) и теплоемкости (C), для более подробной информации более 29 000 химических соединений.Эта база данных эквивалентна более чем двадцати толстым книгам данных.
Текущий HSC содержит вычислительные модули:
1. Sim — Моделирование процесса
2. Уравнения реакций
3. Тепловой и материальный баланс
4. Калькулятор тепловых потерь
5. Расчет равновесия
6. Равновесия электрохимической ячейки
7. Диаграммы Eh-pH — Pourbaix
8. Диаграммы H, S, C и Эллингема
9. Диаграммы Tpp — диаграммы стабильности
10. Диаграммы Lpp — диаграммы стабильности
11.Вода — паровые таблицы и т. Д.
12. H, S, Cp Оценки
13. Преобразование — виды в элементы
14. PTr — отслеживание частиц (бета-версия)
15. Периодическая диаграмма — элементы
16. Единицы измерения
17. Дополнительные функции HSC
18. Данные — Статистический анализ
19. Гео — Минералогические расчеты
20. Мат — База данных материалов
21. Aqua
22. Оценка Бена — Бенсона
23. Mod — Модель Base
24. Nav — Navigator
25 Sam — Sampler
26. Exe — Exergy Balance
HSC также содержит:
1.База данных термохимических веществ H, S и Cp
2. База данных водяного пара / жидкости
3. База данных теплопроводности
4. База данных теплопроводности
5. База данных поверхностного излучения
6. Калькулятор излучения газа
7. Калькулятор излучения частиц
8. База данных элементов
9. База данных единиц измерения
10. База данных минералов с 3581 минералом
11. База данных плотности водных растворов
12. База данных параметров Питцера
Курсы
— для нынешних студентов — Программы бакалавриата — Химия
Перейти к основному содержанию Переключить навигациюПенсильванский университет Индианы
- Imagine Unlimited
- A – Z Index
- Найдите людей
- Прием
- Прием
- Прием в бакалавриат
- Прием в магистратуру
- Прием в колледж с отличием повара
- Международный прием
- Прием на кулинарию
- Летние сессии
- Зимняя сессия
- Подать заявку сейчас
- Визиты в виртуальный кампус
- Академики
- Программы бакалавриата
- Программы магистратуры
- Колледжи и факультеты
- Колледж с отличием повара
- Междисциплинарное образование
- Стажировки и международное образование
- Онлайн-обучение
- Наши студенты
- Наш факультет
- Специальные программы
- Академический Поддержка
- Центр ИТ-поддержки
- Регистратор
- Центр карьеры и профессионального развития
- Библиотеки IUP
- MyIUP
- Исследования
- Исследования
- Research News
- Research Events
- Центры и институты
- Экспертиза
- Ресурсы для исследователей
- Исследовательский институт
- Отдел исследований в бакалавриате
- Исследования студентов
- Студенческая жизнь
- Студенческая жизнь
- События и мероприятия
- Питание, жилье и жизнь в кампусе
- Финансовая помощь
- Занятость студентов
- Центр здоровья и благополучия
- Поддержка студентов
- Центр вопросов и ответов Hawks
- Hawk’s Nest
- Родители
- Студенческий кооператив
- Oak Grove
- Центр мультикультурного лидерства и взаимодействия студентов
- Выпускники
- Выпускники
- Возвращение в кампус и Дом выпускников
- Ассоциация выпускников
- Знакомьтесь с нашими выпускниками
- Новости выпускников и друзей
- О IUP
- О программе IUP 9 0067
- Краткий обзор IUP
- Кампусы и центры
- Общественные службы
- Карта, маршруты и парковка
- Работа в IUP
- Администрация
- Поддержка IUP
- Новости и события
- Новости и события
- IUP Новости
- Центральный календарь
- Журнал IUP
- Возвращение домой
- Семейные выходные
- IUP Mobile
- Экстренная информация
- Планы академической реструктуризации
- Планы академической реструктуризации на 2020-2021 годы и информация о коронавирусе
- Imagine Unlimited
- A – Z Index
- Найдите людей

 серная кислота
серная кислота