Материал по химии (11 класс) на тему: 11 класс контрольная Строение вещества
Контрольная работа по теме «Строение вещества»
Вариант1
1. В ковалентных соединениях состава Н3Э число общих электронных пар равно:
1) 1 2) 2 3) 3 4) 4
2. Ионные и ковалентные полярные связи присутствуют в молекуле:
1) оксида кремния (IV) 2) хлорида натрия
3) гидрокарбоната аммония 4) хлороводорода
3. Наибольшее число ковалентных неполярных связей в молекуле:
1) N2 2) O2 3) P4 4) S8
4. Химическая связь в молекулах брома и бромоводорода отличается:
1) числом общих электронных пар
2) числом электронов, принимающих участие в образовании связи
3) числом валентных электронов у атомов водорода и брома
4)смещением электронной пары к атому с большей электроотрицательностью
5. В молекуле азота число общих электронных пар равно:
В молекуле азота число общих электронных пар равно:
1) 1 2) 2 3) 3 4) 4
6. Хлор образует ковалентную полярную связь с элементом, химический знак которого:
1) Mg 2) C 3) Nа 4) Li
7. Какие из утверждений являются верными?
А) Все гибридные орбитали имеют одинаковую форму
Б) Чем больше энергия химической связи, тем меньше ее прочность
1) верно только А 2) верно только Б
3) оба утверждения верны 4) оба утверждения неверны
8. Ковалентная связь между атомами образована по донорно-акцепторному механизму в соединении:
1) Nh4 2) Nh5Cl 3) СCl4 4) НCl
9. Из щелочных металлов наибольшую тенденцию к образованию ковалентных связей проявляет:
1) Li 2) Na 3) K 4) Rb
10. Водородные связи есть в веществе:
Водородные связи есть в веществе:
1) брома 2) иода 3) льда 4) сахарозы
11. Водородная связь не образуется между молекулами:
1) воды 2) фтора 3) аммиака 4) фтороводорода
12. Металлическую связь образует элемент с электронной конфигурацией атома:
1) 1s22s22p63s23p3 2) 1s22s22p4
3) 1s22s22p63s23p1 4) 1s22s22p3
13. Вещество с наибольшей температурой плавления:
1) сахароза 2) лед
3) иод 4) хлорид кальция
14. Наиболее выражена ионная связь между атомами:
1) K и Cl 2) Mg и Cl 3) Al и Cl 4) P и Cl
15. Заряд атома кремния равен:
1) +14 2) +28 3) 0 4) +4
16. Число атомов в формульной единице фосфата натрия равно:
Число атомов в формульной единице фосфата натрия равно:
1) 2 2) 4 3) 6 4) 8
17. Заполнение электронами последнего энергетического уровня происходит в атоме элемента:
1) скандия 2) брома 3) титана 4) железа
18. Последний электрон заполняет s-подуровень у атома элемента:
1) хлора 2) кремния 3) натрия 4) кобальта
19. Укажите пару элементов, атомы которых в основном состоянии содержат равное число электронов на внешнем р-подуровне:
1) N и O 2) S и Cl 3) Cи Si
10. Изотопы данного элемента не отличаются между собой:
1) атомной массой 2) физическими свойствами
3) числом протонов 4) числом нейтронов
20. Во втором и третьем периодах периодической системы слева направо:
1) уменьшается электроотрицательность 2) уменьшается радиус ионов
3) металлические свойства усиливаются 4) неметаллические свойства
ослабевают
21. В одной подгруппе периодической системы расположены:
В одной подгруппе периодической системы расположены:
1) марганец, бром, технеций 2) азот, ванадий, мышьяк
3) цинк, кадмий, ртуть 4) углерод, кремний, титан
22. В ряду химических элементов: Si → P → S → Cl неметаллические свойства:
1) не изменяются 2) усиливаются
3) ослабевают 4) изменяются периодически
Контрольная работа по теме «Строение вещества»
Вариант2
1. В ковалентных соединениях состава Н2Э число общих электронных пар равно:
1) 1 2) 2 3) 3 4) 4
2. Только ковалентные полярные связи присутствуют в молекуле:
1) оксида кремния (IV) 2) хлорида натрия
3) хлороводорода 4) сульфата аммония
3. Наименьшее число ковалентных неполярных связей в молекуле:
Наименьшее число ковалентных неполярных связей в молекуле:
1) N2 2) O2 3) P4 4) S8
4. Химическая связь в молекулах брома и бромоводорода отличается:
1) числом общих электронных пар
2) числом электронов, принимающих участие в образовании связи
3) числом валентных электронов у атомов водорода и брома
4)смещением электронной пары к атому с большей электроотрицательностью
5. В молекуле азота число общих электронных пар равно:
1) 1 2) 2 3) 3 4) 4
6. Хлор образует ковалентную полярную связь с элементом, химический знак которого:
1) Mg 2) C 3) Nа 4) Li
7. Какие из утверждений являются верными?
А) Все гибридные орбитали имеют одинаковую форму
Б) Чем больше энергия химической связи, тем меньше ее прочность
1) верно только А 2) верно только Б
3) оба утверждения верны 4) оба утверждения неверны
8. Ковалентная связь между атомами образована по донорно-акцепторному механизму в соединении:
Ковалентная связь между атомами образована по донорно-акцепторному механизму в соединении:
1) Nh4 2) Nh5Cl 3) СCl4 4) НCl
9. Из щелочных металлов наибольшую тенденцию к образованию ковалентных связей проявляет:
1) Li 2) Na 3) K 4) Rb
10. Водородные связи есть в веществе:
1) брома 2) иода 3) льда 4) сахарозы
11. Водородная связь не образуется между молекулами:
1) воды 2) фтора 3) аммиака 4) фтороводорода
12. Металлическую связь образует элемент с электронной конфигурацией атома:
1) 1s22s22p63s23p3 2) 1s22s22p4
3) 1s22s22p63s23p1 4) 1s22s22p3
13. Вещество с наибольшей температурой плавления:
Вещество с наибольшей температурой плавления:
1) сахароза 2) лед
3) иод 4) хлорид кальция
14. Наиболее выражена ионная связь между атомами:
1) K и Cl 2) Mg и Cl 3) Al и Cl 4) P и Cl
15. Заряд атома кремния равен:
1) +14 2) +28 3) 0 4) +4
16. Число атомов в формульной единице фосфата натрия равно:
1) 2 2) 4 3) 6 4) 8
17. Заполнение электронами последнего энергетического уровня происходит в атоме элемента:
1) скандия 2) брома 3) титана 4) железа
18. Последний электрон заполняет s-подуровень у атома элемента:
1) хлора 2) кремния 3) натрия 4) кобальта
19. Укажите пару элементов, атомы которых в основном состоянии содержат равное число электронов на внешнем р-подуровне:
Укажите пару элементов, атомы которых в основном состоянии содержат равное число электронов на внешнем р-подуровне:
1) N и O 2) S и Cl 3) Cи Si
10. Изотопы данного элемента не отличаются между собой:
1) атомной массой 2) физическими свойствами
3) числом протонов 4) числом нейтронов
20. Во втором и третьем периодах периодической системы слева направо:
1) уменьшается электроотрицательность 2) уменьшается радиус ионов
3) металлические свойства усиливаются 4) неметаллические свойства
ослабевают
21.В одной подгруппе периодической системы расположены:
1) марганец, бром, технеций 2) азот, ванадий, мышьяк
3) цинк, кадмий, ртуть 4) углерод, кремний, титан
22. В ряду химических элементов: Si → P → S → Cl неметаллические свойства:
В ряду химических элементов: Si → P → S → Cl неметаллические свойства:
1) не изменяются 2) усиливаются
3) ослабевают 4) изменяются периодически
Контрольная работа по химии на тему»Строение вещества» (11 класс)
Пояснительная записка
Контрольная работа проводится после изучения темы «Строение вещества»
Контрольная работа состоит из трех вариантов. В каждом варианте содержатся две части.
Часть А: Тестовые задания с выбором ответа. Проверяемые понятия: тип химической связи, степень окисления, электроотрицательнось, типы кристаллических решеток, изомерия и номенклатура.
Часть В: Задания со свободным ответом. Проверяемые понятия: изомерия, решение задач по уравнению реакции, решение задач на вывод формулы вещества. Время выполнения 45 минут. Ответы не прилагаются, т.к. ученики ими могут воспользоваться.
Оценивание
0-13 баллов — «2» (0-35%)
14-23 баллов- «3» (36-61%)
24-32 баллов- «4» (62-88%)
33-37 баллов-«5»(89-100%)
Контрольная работа по теме: «Строение вещества».
Вариант 1
Часть А: Тестовые задания с выбором ответа.
( 2 балла за 1 правильный ответ)
1. В молекуле СО2 химическая связь:
а) ионная, б) ковалентная неполярная, в) ковалентная полярная, г) водородная.
2. В каком ряду записаны вещества только с ионной связью:
а) SiO2, CaO, Na 2SO4 ; б) HClO4, CO2 ,NaBr; в) MgO. NaI, Cs 2O ; г) H 2O, AlCl3, RbI.
3. Дисперсная система, в которой в газовой дисперсионной среде распределены частицы жидкости, — это:
а) аэрозоль , б) пена, в) эмульсия, г) золь.
4. По донорно-акцепторному механизму образована одна из ковалентных связей в соединении или ионе:
а) NH3, б) (NH4)2 S, в) CCl4, г) SiF4.
5.Наибольшую электроотрицательность имеет элемент:
а) азот, б) сера, в) бром, г) кислород.
6.Степень окисления -3 фосфор проявляет в соединении:
а) P2O3, б) P2O5, в) Ca3P2 г) Ca(H2PO4)2.
7.Валентность
а) Ca, б) P, в) O, г) Si.
8. Истинным раствором является:
а) речной ил, б) кровь, в) соляная кислота, г) молоко.
9. Молекулярную кристаллическую решётку имеет:
а) H2S, б) NaCl, в) SiO2, г) Cu.
10. Гомологом вещества, формула которого СН2=СН-СН3, является:
а) бутан, б) бутен-1, в) бутен-2, г) бутин-1.
11. Вещество, формула которого NaHS называют:
а) сульфид натрия, б) сульфат натрия, в) гидросульфид натрия, г) гидросульфат натрия.
Часть В: Задания со свободным ответом.
(3 балла)
Составьте структурные формулы не менее трёх возможных изомеров вещества состава С4Н8. Назовите эти вещества.
( 5 балла)
Какой объём кислорода потребуется для полного сгорания 1 кг этилена (этена)?
( 7 баллов)
Найдите молекулярную формулу углеводорода, массовая доля углерода в котором составляет 81,8%. Относительная плотность вещества по азоту равна 1,57. Определите число связей и их тип в молекуле данного вещества.
Контрольная работа по теме: «Строение вещества»
Вариант 2
Часть А: Тестовые задания с выбором ответа.
( 2 балла за 1 правильный ответ)
1. В молекуле азота N2 химическая связь:
а) ионная, б) ковалентная неполярная, в) ковалентная полярная, г) водородная.
2. В каком ряду записаны вещества только с ионной связью:
а) SO2, CaO, К 2SO4 ; б) H 2S, AlCl3 ,NaI; в) CO. C
3.Дисперсная система, в которой в которой в жидкой дисперсионной среде распределены частицы жидкости , — это:
а) гель, б) эмульсия, в) аэрозоль , г) суспензия.
4.Вещесто, между молекулами которого существует водородная связь:
а) этанол, б) метан, в) водород, г) бензол.
5.Наибольшая степень окисления серы в соединении:
а) K 2 SO3, б) Na2S, в) H2SO4, г) S8.
6. Среди элементов IVА группы наиболее электроотрицательным является:
Среди элементов IVА группы наиболее электроотрицательным является:
а) Si, б) Ge, в) C г) Sn.
7.Валентность IV характерна для:
а) Ca, б) P, в) O, г) Si.
8. Истинным раствором является :
а) кисель, б) раствор сульфата меди (II), в) известковое молоко, г) молоко.
9.Атомную кристаллическую решётку имеет каждое из двух веществ:
а) хлорид натрия и алмаз, б) оксид углерода и кремний, в) алмаз и графит,
г) оксид кремния (IV) и красный фосфор.
10. Изомером вещества, формула которого СН 3 -СН=СН-СН3, является:
а) бутан, б) бутин-2, в) бутен-1, г) 2- метилпропан.
11. Вещество, формула которого СН
а) гидрокарбонат натрия, б) ацетат натрия, в) формиат натрия, г) карбонат натрия.
Часть В: Задания со свободным ответом.
(3 балла)
Составьте структурные формулы не менее трёх возможных изомеров вещества состава С4Н10 О. Назовите эти вещества.
( 5 балла)
Какая масса кислорода потребуется для полного сгорания 67,2 л (н.у.) фосфина (РН3), если в результате реакции образуется оксид фосфора (V) и вода?
( 7 баллов)
Найдите молекулярную формулу циклоалкана, если известно, что массовая доля углерода в нём составляет 85,71% .относительная плотность паров этого вещества по воздуху равна 1,931. Определите число связей и их тип в молекуле данного вещества.
Контрольная работа по теме: «Строение вещества»
Вариант 3
Часть А: Тестовые задания с выбором ответа.
( 2 балла за 1 правильный ответ)
1. В хлориде натрия химическая связь:
а) ионная, б) ковалентная неполярная, в) ковалентная полярная, г) водородная.
2 Соединениями с ковалентной неполярной и ионной связью являются соответственно:
а)P4 и N 2O ; б) P4 и SO3; в) P4 и LiCl; г)P4 и РН3.
3. По донорно-акцепторному механизму образована одна из ковалентных связей в соединении или ионе:
а) NH3, б) NaNO3, в) CO2, г) SiH4.
4.Наибольшую электроотрицательность имеет элемент:
а) натрий, б) литий, в) рубидий, г) калий.
5.Наибольшая степень окисления азота в соединении:
а) HNO3, б) Na 3N, в) N 2O г ) N2 H4.
6.Верны ли следующие утверждения?
А. Высшая валентность элемента определяется номером группы.
Б.Высшая валентность элемента определяется номером периода.
а) верно только Б, б) верно только А в) верны ода утверждения, г) оба утверждения неверны.
7. Все элементы в ряду могут проявлять степени окисления +7:
а) Sb, Al, Be, б) Te, Sn, F, в) Cl, I, Br, г) P, N,O.
8. Молекулярную кристаллическую решётку имеет:
а) хлорид калия, б) «сухой» лёд, в) сульфид натрия, г) чилийская селитра.
9. . Изомером вещества, формула которого СН3 –СН2-СН2-ОН , является:
а) метилэтиловый эфир, б) бутанол-1, в) диметиловый эфир, г) бутанол-2.
10. Вещество, формула которого НСОН не называют:
а) формальдегид, б) метаналь, в) муравьиная кислота , г) муравьиный альдегид.
11. Ионную кристаллическую решётку имеет каждое из двух веществ:
а) хлорид натрия и карбонат меди, б) оксид углерода и кремний,
в) алмаз и графит, г) оксид кремния (IV) и красный фосфор.

(3 балла)
Составьте структурные формулы не менее трёх возможных изомеров вещества состава С4Н8О2 . Назовите эти вещества.
( 5 балла)
Какая масса воды может быть получена при взаимодействии с кислородом 224л водорода (н.у.)?
( 7 баллов)
Найдите молекулярную формулу алкена, массовая доля углерода, в котором составляет 85,7%. Относительная плотность паров этого вещества по оксиду углерода (IV) равна 1,593. Определите число связей и их тип в молекуле данного вещества.
Контрольная работа проводится после изучения темы «Строение вещества»
Контрольная работа состоит из трех вариантов. В каждом варианте содержатся две части.
Часть А: Тестовые задания с выбором ответа. Проверяемые понятия: тип химической связи, степень окисления, электроотрицательнось, типы кристаллических решеток, изомерия и номенклатура.
Часть В: Задания со свободным ответом. Проверяемые понятия: изомерия, решение задач по уравнению реакции, решение задач на вывод формулы вещества. Время выполнения 45 минут. Ответы не прилагаются, т.к. ученики ими могут воспользоваться.
Проверяемые понятия: изомерия, решение задач по уравнению реакции, решение задач на вывод формулы вещества. Время выполнения 45 минут. Ответы не прилагаются, т.к. ученики ими могут воспользоваться.
Оценивание
0-13 баллов — «2» (0-35%)
14-23 баллов- «3» (36-61%)
24-32 баллов- «4» (62-88%)
33-37 баллов-«5»(89-100%)
11 класс. Контрольная работа №4 (проф). Строение вещества
Глухова С. Н. ____.02
Контрольная работа по химии №4 для учащихся 11 класса,
обучающихся по учебнику
В. В. Еремин, Н. Е. Кузьменко (профильный класс).
Цель: работы является проверка знаний по теме «Строение вещества», степень подготовленности учащихся к сдаче ЕГЭ. В работе рассматриваются вопросы, связанные с характеристикой химической связи, особенностями строения кристаллических решеток и свойствами, характерными для них.
Тип урока: контроль и коррекция знаний.
Оборудование: два варианта текста контрольной работы.
Форма работа: индивидуальная;
На выполнение работы отводится 40 минут. Текстовая контрольная работа состоит из 3 заданий разного уровня сложности. За первое задание даётся 10 баллов; за второе – 14 баллов; за третье – 6 балла;
Шкала оценок:
30-27 баллов — «5»
26-21 баллов – «4»
20-16 баллов – «3»
менее 16 баллов — неудовлетворительно.
Ключ.
ЧАСТЬ А.
ЧАСТЬ Б. Часть СВ-1. 1. 23,5%
В-2. 1. 19,28%
Ход работы
I. Организационный момент.
Ознакомтесь с текстами заданий. Какие вопросы возникли?
II. Выполнение контрольной работы.
Рефлексия.
(11 класс). Контрольная работа по химии № 4. СТРОЕНИЕ ВЕЩЕСТВА.
Вариант 1
ЧАСТЬ А. Тестовые задания с выбором ответа. (10 б)
(10 б)
1. Формула вещества с ковалентной полярной связью: А) Cl2. Б) KCl. В) NH3 Г) O2.
2. Вещество, между молекулами которого существует ионная связь:
А) Этанол. Б) хлорид аммония. В) аммиак. Г) азот.
3. Число общих электронных пар в молекуле водорода: А) 1. Б) 2 В) 3. Г) 4.
4. Полярность химической связи увеличивается в ряду соединений, формулы которых:
А) NH3, HI, O2 Б) CH4, H2O, HF. В) PH3, H2S, H2 Г) HCl, CH4, Cl2.
5. Кристаллическая решётка оксида углерода(II):
А) Атомная. Б) Ионная. В) Металлическая. Г) Молекулярная.
6. 6. Количество нейтронов у трития: А) 1; Б) 2; В) 3; Г) 4.
7. Определить тип кристаллической решетки вещества, которое характеризуется тугоплавкостью, хрупкостью, хорошей растворимостью:
А) молекулярная; Б) ионная; В) атомная; Г) металлическая;
8. Протонное число алюминия: А) 27; Б) 26; В) 13; Г) 14;
Протонное число алюминия: А) 27; Б) 26; В) 13; Г) 14;
9. Металлическая связь характерна для: А) германий; Б) мышьяк; В) селен; Г) бром;
10. Выберите вещество в молекуле которого присутствует ковалентная неполярная связь:
А) CH3CI Б) CCI4 В) CI2 Г) CO2
ЧАСТЬ Б. Задания с ДВУМЯ ответами: (12 б)
11. Определить, у каких изотопов в составе атомного ядра число протонов равно числу нейтронов: А) Na Б) O В) Al Г) F Д) Si
12. Выбрать элементы, которые проявляют в оксидах степень окисления как +2, так и +3:
А) Cr Б) Al В) B Г) O Д) N
13. Определите пару элементов, которые имеют одинаковое число неспаренных р-электронов
А) N Б) Mn В) Al Г) F Д) Sn
14. Выбрать два элемента, которые имеют постоянную степень окисления.
А) N Б) Mn В) Sn Г) F Д) Al
15. Определить катионы каких элементов имеют электронную формулу, совпадающую с электронной формулой атома неона: А) C Б) N В) Mg Г) Al Д) Li
16. Выбрать элементы, у атомов которых электроны находятся как на s -, так и на d-подуровнях: А) Si Б) Fe В) Sn Г) Pb Д) Cr
Выбрать элементы, у атомов которых электроны находятся как на s -, так и на d-подуровнях: А) Si Б) Fe В) Sn Г) Pb Д) Cr
Задания с тремя ответами: (2 б)
17. Выберите три элемента, которые находятся в одной группе ПСХЭ, расположите их в порядке усиления кислотных свойств образуемых ими оксидов:
А) Sn Б) Fe В) Pb Г) Cr Д) Si
18. Выберите три элемента, которые находятся в одном периоде ПСХЭ, расположите их в порядке уменьшения электроотрицательности:
А) Cr Б) Al В) B Г) O Д) N
Часть С
1. В 180 г 15%-го раствора гидроксида натрия растворили еще 20 г щелочи. Рассчитайте массовую долю щелочи в полученном растворе. (2 б)
2. Назовите два вещества, обладающие свойствами: проводят электричество в жидком состоянии и не проводят в твердом состоянии. Объясните почему. (3 б)
3. Составьте электронную формулу катиона железа (II): Fe2+ (1 б)
(11 класс).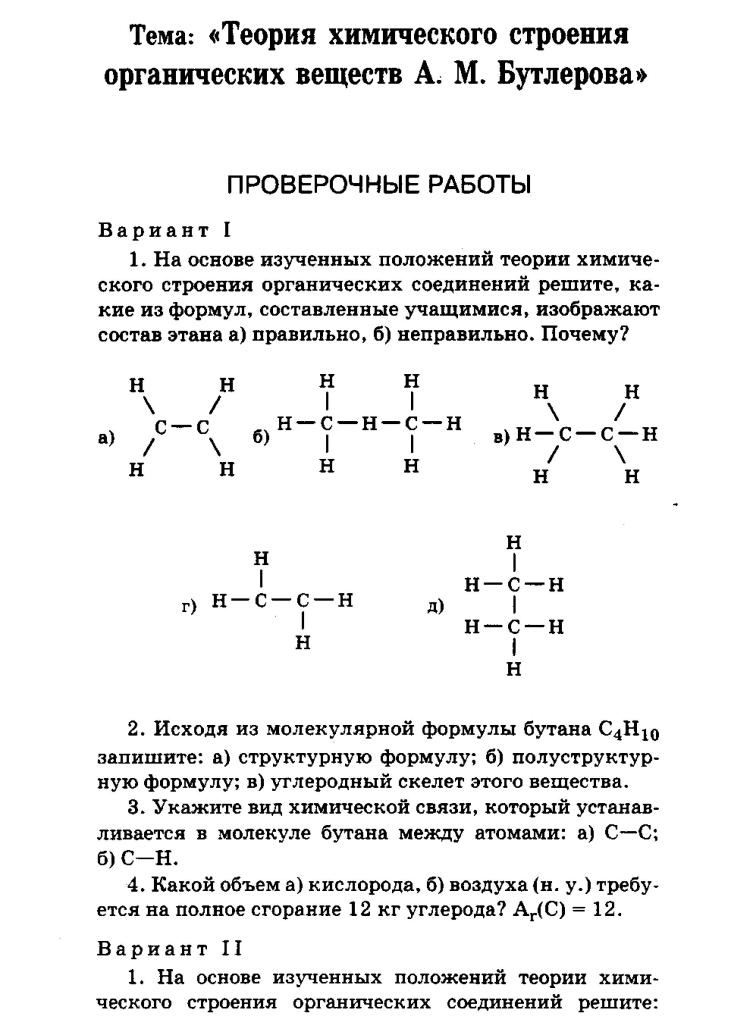 Контрольная работа по химии № 4. СТРОЕНИЕ ВЕЩЕСТВА.
Контрольная работа по химии № 4. СТРОЕНИЕ ВЕЩЕСТВА.
Вариант 2
ЧАСТЬ А. Тестовые задания с выбором ответа (10 б)
1. Формула вещества с ионной связью: А) НCl. Б) KBr. В) P4 Г) CH3 OH.
2. Вещество c металлической связью: А) Мышьяк. Б) Вор. В) Галий. Г) Алмаз
3. Число общих электронных пар в молекуле кислорода: А) Одна. Б) Две. В) Три. Г) Четыре.
4. Полярность химической связи уменьшается в ряду соединений, формулы которых:
А) Cl2, H2S, CO2 Б) CH4, H2O, HF В) Nh4, Ph4, SO2 Г) HCl, HBr, HI.
5. Кристаллическая решётка алмаза:
А) Атомная. Б) Ионная. В) Металлическая. Г) Молекулярная.
6. Количество нейтронов у дейтерия: А) 1; Б) 2; В) 3; Г) 4.
7. Определить тип кристаллической решетки вещества, которое характеризуется легкоплавкостью, хрупкостью, хорошей растворимостью:
А) металлическая; Б) ионная; В) атомная; Г) молекулярная;
8. Нуклонное число меди: А) 29; Б) 63; В) 64; Г) 63,5;
Нуклонное число меди: А) 29; Б) 63; В) 64; Г) 63,5;
9. Металлическая связь характерна для: А) мышьяк; Б) индия; В) селен; Г) теллура;
10. Вещество, между молекулами которого существует ионная связь:
А) сульфат аммония; Б) кристаллическая сера; В) серная кислота; Г) сероводород.
ЧАСТЬ Б. Задания с ДВУМЯ ответами: (12 б)
11. Определить, у каких изотопов в составе атомного ядра число протонов равно числу нейтронов: А) Na Б) Са В) Al Г) F Д) Ne
12. Выбрать элементы, которые не проявляют отрицательной степени окисления:
А) Na Б) O В) Al Г) F Д) Si
13. Определите пару элементов, которые в возбужденном состоянии имеют электронную формулу внешнего энергетического уровня ns1np3
А) Mg Б) Si В) Al Г) C Д) Se
14. Выбрать два элемента, которые имеют только положительную степень окисления.
А) Mg Б) Si В) Al Г) C Д) Se
15. Определить анионы каких элементов имеют электронную формулу, совпадающую с электронной формулой атома аргона: А) S Б) Са В) Mg Г) Cl Д) K
Определить анионы каких элементов имеют электронную формулу, совпадающую с электронной формулой атома аргона: А) S Б) Са В) Mg Г) Cl Д) K
16. Выбрать элементы, которые в соединениях могут проявлять степень окисления +6:
А) Sn Б) Fe В) Pb Г) Cr Д) Si
Задания с тремя ответами: (2 б)
17. Выберите три элемента, которые находятся в одном периоде ПСХЭ, расположите их в порядке уменьшения кислотных свойств образуемых ими высших гидроксидов:
А) C Б) N В) Mg Г) Al Д) Li
18. Выберите три элемента- металла, расположите их в порядке уменьшения числа валентных электронов: А) K Б) Br В) I Г) Mn Д) Ca
Часть С
1. Слили два раствора серной кислоты: 240 г 30%-го и 180 г 5%-го. Рассчитайте массовую долю кислоты в полученном растворе. (2 б)
2. . Назовите два вещества, обладающие свойствами: проводят электричество как в жидком так и в твердом состоянии. Объясните почему. (3 б)
3. Составьте электронную формулу катиона меди (II): Cu2+ (1 б)
Составьте электронную формулу катиона меди (II): Cu2+ (1 б)
11 класс Контрольная работа №2: «Строение вещества» |
Вариант 1 |
Задание 1 (1 балл) Формула вещества с ковалентной полярной связью: 1)Cl2 2)KCl 3)NH3 4)O2 |
Задание №2 (1 балл) Вещество между молекулами которого существует водородная связь: 1)этанол 2)метан 3)водород 4)бензол |
Задание №3 (1 балл) Число общих электронных пар в молекуле водорода: 1)одна 2)две 3)три 4)четыре |
Задание №4 (1 балл) Полярность химической связи увеличивается в ряду: 1)NH3, HI, O2 2)CH4, H2O, HF 3)PH3, H2S, H2 4)HCl, CH4, Cl2 |
Задание №5 (1 балл) Вид гибридизации электронных орбиталей атома фосфора в молекуле PH3: 1)sp3 2)sp2 3)sp 4)не гибридизированны |
Задание №6 (1 балл) 1)Кристаллическая решетка хлорида магния: 1)атомная 2)молекулярная 3)металлическая 4)ионная |
Задание №7 (1 балл) Число σ- и π-связей в молекуле этина: 1)5 σ 2)2σ, 3π 3)3σ, 2π 4)4σ, 1π |
Задание №8 (1 балл) Вещества, формулы которых СН3-СН2-ОН и СН3-О-СН3 это: 1)гомологи 2)изомеры 3)одно и тоже вещество |
Задание №9 (1 балл) Гомологом вещества, формула которого СН2=СН-СН3, является: 1)Бутан 2)Бутен-1 3)Бутен-2 4)Бутин-1 |
Задание №10 (1 балл) Вещество формула которого называется: 1)2-метилбутанол-3 2)1,3-диметилпропанол-1 3)3-метилбутанол-2 4)пентанол-2 |
Задание №11 (2 балл) Составьте схему образования соединения магния и фтора; водорода и селена. |
Задание №12 (1 балл) Какую геометрическую фигуру имеет молекула соединения с ковалентной связью из задания 11? |
Задание№13(2 балл) Как изменяется полярность химической связи в ряду соединений СН4 – Н2S – HCl? Дайте обоснованный ответ. |
Задание №14 (5 баллов) Определите степени окисления в веществах, формулы которых Na2S,SO2,KNO3,Al2(SO4)3,OF2. |
Задание №15 (5 баллов) Напишите структурные формулы веществ по их названиям: 1)3,3-диметилгексан 3)2,2-диметилпропаналь 2)4-метилпентен-2 4)3-метилбутановая кислота |
Задание №16 (3 балла) Составьте структурные формулы не менее трех возможных изомеров веществ состава С4Н6. Назовите эти вещества. |
Задание №17 (2 балл) Какой объем кислорода потребуется для полного сгорания 1 кг этилена (этена). |
Задание №18(2 балла) Расположите соединения формулы которых СН2СlСООН, С6Н5ОН, СН3СООН, С2Н5ОН в порядке возрастания кислотных свойств. Ответ объясните. |
Задание №19 (3 балла) Напишите структурные формулы всех изомеров, отвечающих составу С4Н8О2. Назовите все вещества. |
Задание №20 (3 балла) Сколько граммов бензола вступило в реакцию с азотной кислотой, если при этом получилось 82г нитробензола. |
Контрольная работа по теме «Строение вещества. Дисперсные системы»-11(профильный) класс.
Контрольная работа № 1 по теме
«Строение вещества. Дисперсные системы».
Вариант — 1.
1.Дать характеристику элемента под № 31. Показать строение его атома.
Показать строение его атома.
Дать характеристику 22 электрона.
2.Из приведенного перечня формул выписать вещества с различными видами связи:
Br2, HI, K, Cl2, SiH4, Ga, PCl3, BaO, Na2S, CO2, Sr, CH3COOH, NH4Br, C4H10
Для двух видов связи показать образование молекулы (по выбору).
3.Для веществ H2O, AlF3 определить тип гибридизации, геометрическую форму молекулы, полярность молекулы.
4.Задача.
Смешали 250 г раствора с массовой долей соли 15% и 400 г раствора с массовой долей 45%. Чему равна массовая доля соли в полученном растворе?
5.Задача.
Чему равна масса газа, выделившегося при действии избытка воды на 1,5 моль карбида кальция?
____________________________________________________________________________
Контрольная работа № 1 по теме
«Строение вещества. Дисперсные системы».
Дисперсные системы».
Вариант — 2.
1.Дать характеристику элемента под № 24. Показать строение его атома.
Дать характеристику 19 электрона.
2.Из приведенного перечня формул выписать вещества с различными видами связи:
F2, CBr4, HF, Mg, C3H7OH, Zn, H2, NF3, С3Н6, CaF2, K3N, (NH4)2CO3, H2Se, Rb.
Для двух видов связи показать образование молекулы (по выбору).
3.Для веществ NH3, ZnCl2 определить тип гибридизации, геометрическую форму молекулы, полярность молекулы.
4.Задача.
К 90 г раствора гидроксида натрия с массовой долей вещества 3% добавили ещё 1,3 г этого вещества. Рассчитать массовую долю вещества в полученном растворе.
5.Задача.
Чему равна масса соли, образовавшаяся при растворении оксида железа(3) массой 80 г в избытке азотной кислоты?
Контрольная работа № 1 по теме
«Строение вещества. Дисперсные системы».
Вариант — 3.
1.Дать характеристику элемента под № 21. Показать строение его атома.
Дать характеристику 12 электрона.
2.Из приведенного перечня формул выписать вещества с различными видами связи:
H2, NH4NO3, CaBr2, Zn, C5H12, S8, SiCl4, Li, RbCl, CH3COOK, Ag2O, BaS, SiO2, P.
Для двух видов связи показать образование молекулы (по выбору).
3.Для веществ SiF4, AsH3 определить тип гибридизации, геометрическую форму молекулы, полярность молекулы.
4.Задача.
Из 150 г раствора хлорида натрия с массовой долей вещества 5% выпарили 10 г воды. Рассчитать массовую долю соли в полученном растворе.
5.Задача.
Какой объём водорода можно получить при взаимодействии 0,25 моль цинка с избытком разбавленной серной кислоты?
_________________________________________________________________
Контрольная работа № 1 по теме
«Строение вещества. Дисперсные системы».
Вариант — 4.
1.Дать характеристику элемента под № 29. Показать строение его атома.
Дать характеристику 24 электрона.
2.Из приведенного перечня формул выписать вещества с различными видами связи:
N2, HBr, Cs, CH3OH, C, SiH4, (NH4)2SO4,Pb, NCl3, K2O, Na2S, C2H4, CO, Al.
Для каждого вида связи показать образование молекулы (по выбору).
3.Для веществ BeH2, PCl3 определить тип гибридизации, геометрическую форму молекулы, полярность молекулы.
4.Задача.
Из 150 г раствора хлорида натрия с массовой долей вещества 5% выпарили 10 г воды и добавили 3 г соли. Рассчитать массовую долю соли в полученном растворе.
5.Задача.
Какая масса йода выделится при взаимодействии 3 моль йодида калия с необходимым количеством хлора?
Гнутова ольга анатольевна — Контрольная работа
ГНУТОВА ОЛЬГА АНАТОЛЬЕВНА
МБОУ СОШ №8 г.о. Самара
КОНТРОЛЬНЫЕ РАБОТЫ ПО ХИМИИ В ФОРМАТЕ ЕГЭ
Контроль качества учебных достижений является неотъемлемой частью учебного процесса. В последние годы в педагогической практике широкое распространение получили тесты, ориентированные на проверку знаний, умений и навыков. Главная цель применения педагогических тестов – систематическое измерение и получение достоверных сведений о качестве результатов учебной деятельности. На сегодняшний день тесты являются лидером в системе средств педагогического контроля в среднем образовании за счет ряда преимуществ перед традиционными формами, к таковым можно отнести: технологичность, оперативность, объективность, систематичность, комплексность, универсальность и т.д.
В последние годы в педагогической практике широкое распространение получили тесты, ориентированные на проверку знаний, умений и навыков. Главная цель применения педагогических тестов – систематическое измерение и получение достоверных сведений о качестве результатов учебной деятельности. На сегодняшний день тесты являются лидером в системе средств педагогического контроля в среднем образовании за счет ряда преимуществ перед традиционными формами, к таковым можно отнести: технологичность, оперативность, объективность, систематичность, комплексность, универсальность и т.д.
Для проверки эффективности изучения тем курса химии 11 класса мною был разработан банк тестовых заданий в формате ЕГЭ для проведения контрольных работ (программа О.С.Габриеляна).
Свою разработку использую как тренажёр для подготовки к ЕГЭ по химии, обобщающего повторения материала в 11 классе, для фронтальной, групповой, парной и индивидуальной работы.
Краткие рекомендации. Контрольная работа составлена по аналогии с контрольно-измерительным материалом ЕГЭ и выполняется на бланке ЕГЭ. Каждый из десяти вариантов контрольной работы состоит из трех частей.
Контрольная работа составлена по аналогии с контрольно-измерительным материалом ЕГЭ и выполняется на бланке ЕГЭ. Каждый из десяти вариантов контрольной работы состоит из трех частей.
Задание с выбором ответа (Часть 1) считается выполненным верно, если указан код правильного ответа. Во всех остальных случаях (выбран другой ответ; выбрано два или больше ответов, среди которых может быть и правильный; ответ на вопрос отсутствует) задание считается невыполненным. Ответ оформляется на бланке ответов №1.
Задание с кратким свободным ответом (Часть 2) представляет собой тест – соответствие, или тест – множественный выбор, или задачу.
Задание считается выполненным верно, если правильно указана последовательность цифр (число). Ответ оформляется на бланке ответов №1.
Ответом к заданиям (В1 – В2) является набор букв, слово или число. Каждую букву, цифру, символ (запятая в десятичной дроби) следует писать в отдельной клетке без пробелов.
Задание с развернутым ответом (Часть 3) требует подробного решения задачи или ответа на вопрос. Ответ оформляется на бланке ответов №2.
Контрольная работа рассчитана на академический час (40 мин).
Критерии оценивания ответов: Задание с выбором ответа (Часть 1) считается выполненным верно, если учащийся указал код правильного ответа. Во всех остальных случаях (выбран другой ответ; выбрано два или больше ответов, среди которых может быть и правильный; ответ на вопрос отсутствует) задание считается невыполненным. Каждый правильный ответ оценивается в 1 балл.
Задание с кратким свободным ответом (Часть 2) считается выполненным верно, если правильно указана последовательность цифр (число). За полный правильный ответ на задания В1 – В2 ставится 2 балла, за правильный неполный – 1 балл, за неверный ответ (или при его отсутствии) – 0 баллов.
Контрольная работа по теме «;Химические реакции»;
1 вариант
Часть 1
При выполнении заданий этой части в бланке ответов № 1 под номером выполняемого вами задания (А1 – А6) поставьте знак «;×»; в клеточку, номер которой соответствует номеру выбранного вами ответа.
Р
А1
еакция, уравнение которой CaCO3 → CaO + CO2 – Q относится к реакциям1) соединения, экзотермическим 2) разложения, эндотермическим
3) соединения, эндотермическим 4) разложения, экзотермическим
П
А2
ри комнатной температуре с наибольшей скоростью протекает реакция между1) NaOH(р-р) и HCl (р-р) 2) CuO (тв) и H2SO4 (р-р)
3) CaCO3 (тв) и HCl (р-р) 4) Zn (тв) и H2SO4 (р-р)
В
А3
уравнении окислительно-восстановительной реакции расставьте коэффициенты. Укажите коэффициент перед формулой восстановителя.PH3 + KMnO4 + HCl → H3PO4 + KCl + MnCl2 + H2O
1) 3 2) 4 3) 5 4) 6
Х
А4
имическое равновесие в системеCO2 (г) + C (т) → 2 CO (г) – Q сместится вправо при
1) повышении давления 2) понижении температуры
3) повышении концентрации CO 4) повышении температуры
Н
А5
ейтральную среду имеет водный раствор соли1) NaNO3 2) (NH4)2SO4 3) FeSO4 4) Na2S
С
А6
окращенное ионное уравнениеAl +3 + 3OH— Al(OH)3 соответствует взаимодействию
1) хлорида алюминия с водой
2) оксида алюминия с водой
3) хлорида алюминия с гидроксидом калия
4) хлорида алюминия с гидроксидом меди
Часть 2
Ответом к заданиям (В1 – В2) является набор букв, слово или число. Каждую букву, цифру, символ (запятая в десятичной дроби) пишите в отдельной клетке без пробелов.
Каждую букву, цифру, символ (запятая в десятичной дроби) пишите в отдельной клетке без пробелов.
У
В1
становите соответствия между солью и реакцией среды в ее водном раствореСоль Реакция среды
1) нитрат бария А) кислая
2) хлорид железа (III) Б) нейтральная
3) сульфат алюминия В) щелочная
4) ацетат калия
П
В2
о термохимическому уравнению реакции вычислите количество теплоты, выделившейся при сжигании 33,6 л (н.у) водорода.H2 + 1/2 O2 → H2O + 242 кДж
Ответ: _______ кДж
(запишите число в бланке ответов с точностью до целых)
Часть 3
П
C1
еречислите факторы, смещающие равновесие в системеCO + 2H2 CH3OH (г) + Q в сторону образования продуктов реакции. Ответ поясните.
Ответ поясните.
П
C2
ри охлаждении реакционной смеси с 50ºC до 20ºC скорость химической реакции уменьшилась в 27 раз. Вычислите температурный коэффициент этой реакции.2 вариант
Часть 1
При выполнении заданий этой части в бланке ответов № 1 под номером выполняемого вами задания (А1 – А6) поставьте знак «;×»; в клеточку, номер которой соответствует номеру выбранного вами ответа.
П
А1
роцесс 2PCl3 2P + 3Cl2 – Q называется1) эндотермической реакцией соединения
2) экзотермической реакцией разложения
3) экзотермической реакцией соединения
4) эндотермической реакцией разложения
С
А2
корость реакции между железом и серной кислотой будет наибольшей при использовании1) порошка Fe и 15%-ного раствора H2SO4
2) стружек Fe и 1,5%-ного раствора H2SO4
3) порошка Fe и 1,5%-ного раствора H2SO4
4) стружек Fe и 15%-ного раствора H2SO4
В
А3
уравнении окислительно-восстановительной реакции расставьте коэффициенты. Укажите коэффициент перед формулой восстановителя.
Укажите коэффициент перед формулой восстановителя.K2S + K2MnO4 + H2O → S + MnO2 + KOH
1) 1 2) 2 3) 3 4) 4
Н
А4
а смещение равновесия системыN2 (г) + O2 (г) 2NO (г) – Q не оказывает влияние
1) повышение температуры 2) повышение концентрации NO
3) повышение давления 4) уменьшение концентрации N2
С
А5
оль, раствор которой имеет щелочную среду1) Rb2CO3 2) RbCl 3) AgCl 4) CaCO3
С
А6
окращенное ионное уравнение H+ + OH— → H2O соответствует взаимодействию веществ1) Fe(OH)2 + HCl 2) NaOH + Al(OH)3
3) NaOH + HNO3 4)Ba(OH)2 + H2SO4
Часть 2
Ответом к заданиям (В1 – В2) является набор букв, слово или число. Каждую букву, цифру, символ (запятая в десятичной дроби) пишите в отдельной клетке без пробелов.
Каждую букву, цифру, символ (запятая в десятичной дроби) пишите в отдельной клетке без пробелов.
У
В1
становите соответствия между исходными веществами, вступающими в реакцию обмена и краткими ионными уравнениями этих реакцийИсходные вещества Краткие ионные уравнения
1) H2SO4 и BaCl2 А)Al3++3OH—→Al(OH)3
2) Ba(OH)2 и K2CO3 Б)Ba2++SO42-→ BaSO4
3) Al(NO3)3 и KOH В)Na++Br—→ NaBr
4) BaBr2 и Na2SO4 Г)Ba2++CO32- → BaSO3
Д) K++ NO3— → KNO3
К
В2
акое количество теплоты выделяется при образовании 5 моль оксида азота (IV)? Термохимическое уравнение реакции2NO + O2 2NO2 + 114 кДж
Ответ: _______ кДж (запишите число в бланке ответов с точностью до целых)
Часть 3
П
C1
ри сжигании 6 г магния выделилось 152,5 кДж теплоты. Составьте термохимическое уравнение процесса.
Составьте термохимическое уравнение процесса.К
C2
ак изменится скорость химической реакции при увеличении давления в 3 раза? 2NO (г) + O2 (г) 2NO2 (г)Обработка результатов контрольной работы «;Химические реакции»;
Максимальный балл за контрольную работу – 15.
Примерная шкала перевода в пятибалльную систему оценки
15—14 баллов — «5» (90—100%).
13—10 баллов — «4» (66—90%),
9—5 баллов — «3» (33—65%),
Менее 5 баллов — «2» (0—32%).
Контрольная работа по теме «;Вещества и их свойства»;
1 вариант
Часть 1
При выполнении заданий этой части в бланке ответов № 1 под номером
выполняемого вами задания (А1 – А6) поставьте знак «;×»; в клеточку,
номер которой соответствует номеру выбранного вами ответа.
И
А1
з приведенных ниже металлов наиболее активным является1) бериллий 2) магний 3) кальций 4) стронций
Ж
А2
елезо реагирует с каждым из двух веществ1) хлоридом натрия и азотом
2) кислородом и хлором
3) оксидом алюминия и карбонатом калия
4) водой и гидроксидом алюминия
О
А3
бщая формула гомологического ряда алкенов1) CnH2n-6 2) CnH2n-2 3) CnH2n 4) CnH2n+2
А
А4
миноуксусная кислота реагирует с каждым из двух веществ1) HCl и KOH 2) NaCl и NH3
3) C2H5OH и KCl 4) CO2 и HNO3
В
А5
ряду F2 – Cl2 – Br2 – I2 окислительная активность1) увеличивается 2) уменьшается
3) не изменяется 4) изменяется периодически
С
А6
каким веществом не взаимодействует раствор серной кислоты1) Cu 2) MgO 3) Fe(OH)3 4) Na2CO3
Часть 2
Ответом к заданиям этой части является набор букв или цифр, который надо перенести в бланк ответов без пробелов и других символов
У
В1
становите соответствОдиннадцатый класс (11 класс) Вопросы по химии для тестов и рабочих листов
Вы можете создавать печатные тесты и рабочие листы из этих 11 класс по химии вопроса!
Выберите один или несколько вопросов, установив флажки над каждым вопросом. Затем нажмите кнопку добавить выбранные вопросы к кнопке теста перед переходом на другую страницу.
Затем нажмите кнопку добавить выбранные вопросы к кнопке теста перед переходом на другую страницу.
- комбинация чистых веществ, образованных за счет химической связи.
- любое вещество, имеющее однородный состав.

- физическое сочетание двух или более типов веществ, каждое из которых сохраняет свои характерные свойства.
- любой набор элементов, химически связанных друг с другом.
- мельчайшая единица вещества, сохраняющая свою химическую идентичность.
- простейшая единица соединения.

- всегда состоит из углерода.
- будучи меньше электрона.
- коэффициенты реагентов равны коэффициентам продуктов.
- количество атомов каждого элемента в реагентах равно количеству атомов каждого соответствующего элемента в продуктах.

- продукты и реагенты — одни и те же химические вещества.
- индексы реагентов равны индексам продуктов.
[математика] «Pb (OH)» _ 2 [/ математика] + [математика] «HCl» [/ математика] [математика] rarr [/ математика] [математика] «H» _2 «O» [/ math] + [math] «PbCl» _2 [/ math]
Какие коэффициенты следует использовать для правильного баланса этого уравнения?
- 1,3,1,2
- 1,2,2,1
- 2,1,3,2
- 2,4,1,3
Материя и ее классификация | Примечания, видео, контроль качества и тесты | 11 класс> Химия> Язык химии
Материя и ее классификация
Что такое химия?
Химия — это отрасль науки, изучающая свойства, преобразование и состав вещества.
Если взять известняк, например, его химический состав CaCO 3 , он реагирует с разбавленной соляной кислотой (разбавленной HCl) с образованием хлорида кальция (CaCl 2 ), воды (H 2 O) и углерода. диоксид (CO 2 ).
$$ CaCO_3 + дил. HCl \ rightarrow CaCl_2 + CO_2 + H_2O $$
Химия далее делится на следующие группы:
1) Физическая химия
2) Неорганическая химия
3) Органическая химия
4) Биохимия
5) Промышленная химия e .t.c.
Материя
Проще говоря, материя — это все, что занимает пространство, имеет массу и оказывает сопротивление. Материя может ощущаться нами через наши органы чувств, такие как нос, глаза, кожа и т. Д. Примеры: тряпка, книга, стол, стол, вода, газ и т. Д.
Масса: Количество вещества, содержащегося в теле, известно как его масса. Его можно определить с помощью балансира. Его величина постоянна. Это значит, что независимо от места масса тела остается неизменной.
Вес: Сила, действующая на объект гравитационной силой, называется его весом.Вес не является постоянной величиной и может отличаться от места к месту. Значение веса зависит от значения силы тяжести «g». Это означает, что чем выше значение «g», тем выше будет его вес, и наоборот.
Классификация материи
В приведенной ниже таблице показана простая классификация материи:
Классификация материиФизическая классификация
Физически материя подразделяется на три состояния. Они широко известны как:
1) Твердое тело: Материя, имеющая фиксированную форму, размер, объем и массу, называется твердым телом.Межмолекулярная сила в твердом теле очень сильна. Это вызывает сильную связь между молекулами и атомами. Следовательно, твердые тела имеют фиксированную форму и размер. Пример — утюг, книга, ручка и т. Д.
2) Жидкость: Вещество, имеющее фиксированный объем, но не имеющее фиксированной формы, называется жидкостью. Межмолекулярная сила в жидкости промежуточная. Это означает, что молекулы не связаны друг с другом ни слишком сильно, ни слишком слабо. Таким образом, они мобильны по своей природе и, следовательно, принимают форму сосуда, в котором они содержатся.Примеры: вода, молоко, масло и т. Д.
Межмолекулярная сила в жидкости промежуточная. Это означает, что молекулы не связаны друг с другом ни слишком сильно, ни слишком слабо. Таким образом, они мобильны по своей природе и, следовательно, принимают форму сосуда, в котором они содержатся.Примеры: вода, молоко, масло и т. Д.
3) Газ: Материя, не имеющая фиксированного объема или фиксированной формы, называется газом. Межмолекулярная сила в газе очень мала. Это вызывает слабое притяжение между молекулами. Таким образом, они не могут сохранять неизменную форму и размер. Пример — водород, азот, кислород и т. Д.
Химическая классификация
Химически вещества делятся на чистые и нечистые (смесь).
A) Чистое химическое вещество: Чистое химическое вещество состоит только из одного вида материи и не может быть физически разделено на более чем один вид веществ.Пример: железо, вода и т. Д.
Чистые химические вещества далее подразделяются на:
⇒ Элементы: Элементы — это чистые химические вещества, которые нельзя разделить на более простые вещества или получить путем объединения двух или более веществ путем любой простой метод. Водород, кислород, углерод — вот некоторые примеры элементов. На данный момент в периодической таблице Менделеева около 118 элементов. Из этих 118 элементов 98 являются естественными, поскольку они естественным образом встречаются на Земле, тогда как остальные созданы человеком или искусственно.Далее элементы делятся на:
Водород, кислород, углерод — вот некоторые примеры элементов. На данный момент в периодической таблице Менделеева около 118 элементов. Из этих 118 элементов 98 являются естественными, поскольку они естественным образом встречаются на Земле, тогда как остальные созданы человеком или искусственно.Далее элементы делятся на:
- Металл: Металлы — это электроположительные элементы, которые могут легко терять электрон с образованием положительных ионов во время химических реакций. Эти элементы обычно сплошные с металлическим блеском. Металлы ковкие, пластичные (из тонкой проволоки). Металлы имеют свойство проводить электричество и тепло. Медь, золото, серебро — вот некоторые примеры металлов.
- Неметалл: Неметаллы — это электроотрицательные элементы, которые стремятся получить электроны с образованием отрицательных ионов во время химических реакций.Они не блестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут находиться в твердом, жидком или газообразном состоянии.
 Углерод, азот, бор — вот некоторые примеры неметаллов.
Углерод, азот, бор — вот некоторые примеры неметаллов. - Металлоид: Элементы, проявляющие свойства как металлов, так и неметаллов, называются металлоидами. Некоторыми примерами металлоидов являются мышьяк, сурьма, висмут и т. Д.
⇒Соединения: Соединение может быть определено как чистое химическое вещество, которое производится комбинацией двух или более чем двух элементов в определенной пропорции по весу.Соединения однородны, а химические и физические свойства соединений полностью отличаются от составляющих элементов. Соединения можно разделить на два или более элементов подходящими химическими методами. Например, сероводород (H 2 S), который состоит из двух элементов, водорода и серы в соотношении 1:16 по массе.
B) Загрязненные (смесь) химические вещества: Смесь представляет собой комбинацию двух или более веществ, соединений в любом соотношении, так что компоненты не теряют своих свойств. Два или более веществ, которые при соединении не претерпевают никаких химических изменений и сохраняют свою идентичность, в результате получается масса, известная как смесь. Примерами смеси являются воздух, солевой раствор, грязь и т. Д. Смеси бывают следующих двух типов:
Два или более веществ, которые при соединении не претерпевают никаких химических изменений и сохраняют свою идентичность, в результате получается масса, известная как смесь. Примерами смеси являются воздух, солевой раствор, грязь и т. Д. Смеси бывают следующих двух типов:
⇒ Гомогенная смесь: Гомогенная смесь содержит одинаковый состав во всем образце. Примеры — раствор хлорида натрия, воздушная смесь.
⇒ Гетерогенная смесь: Гетерогенная смесь в разных частях смеси содержит разный состав и свойства.Пример — грязевая вода, соленая вода.
Физические и химические изменения
| Физические изменения | Химические изменения | |
| 1) | Это временные изменения, которые можно легко отменить. Например, вода \ rightleftharpoons пар $$ | Это постоянное изменение, которое нельзя отменить. Например, сгоревшая бумага не может быть возвращена в бумагу. |
| 2) | При физическом изменении не образуется новое химическое вещество. | При химическом изменении происходит образование нового химического вещества. |
| 3) | Нет изменения массы во время физического изменения. | Масса продукта отличается от массы реагентов. |
| 4) | Обычно изменение энергии во время физического изменения очень мало. | Изменение энергии при химическом изменении довольно велико. |
Справочный номер
Чаудхари, Ганга Рам; Карна, Шила Кант Лал; Шарма, Канчан; Сингх, Санджай; Гупта, Дипак Кумар. Учебник высшей средней химии XI . Эд. 2-й. Катманду: Видьярти Пустак Бхандар, 2069 (2012).
Адхикари, Рамешвар; Ханал, Сантош; Субба, Бимала; Адхикари, Сантош; Khatiwada, Shankar Pd. Универсальная химия XI . Первый. Vol. 1-й. Катманду: Публикация Оазиса, 2069.
Электронная конфигурация и атомная структура | Примечания, видео, контроль качества и тесты | 8 класс> Наука> Материя
Обзор
Распределение электронов в различных оболочках атома известно как электронная конфигурация. Есть разные способы записи электронной конфигурации. В этой заметке объясняется, что такое электронная конфигурация и как ее записать.
Есть разные способы записи электронной конфигурации. В этой заметке объясняется, что такое электронная конфигурация и как ее записать.Электронная конфигурация и атомная структура
Электрическая конфигурация
Распределение электронов в различных оболочках атома известно как электронная конфигурация. В следующей таблице показана электронная конфигурация некоторых атомов.
Таблица 2: Электрическая конфигурация атомов некоторых элементов
| Элементы | Символ | Атомный номер | Энергетические оболочки и количество электронов в них | |||||||||||
| K (1) L (2) | M (3) | N (4) | ||||||||||||
| Водород | H | 1 | 1 | |||||||||||
| Гелий | He | 2 | ||||||||||||
| Литий | Li | 3 | 2 | 1 | ||||||||||
| Бериллий | Be | 4 | 2 | 9017 | 2 | 3 | ||||||||
| Углерод | C | 6 | 9017 2 24 | |||||||||||
| Азот | N | 7 | 2 | 5 | ||||||||||
| Кислород | O | 8 2 | 8 2 | 8 2 | 8 2 | 8 2 | F | 9 | 2 | 7 | ||||
| Неон | Ne | 10 | 2 | 8 | 9017 9017 9017 9017 9017 9017 9017 9017 9017 9017 9017 9017 | 1 | ||||||||
| Магний | Мг | 12 | 2 | 8 | 2 | |||||||||
| Алюминий | Al | 13 | Кремний | Si | 14 | 2 | 8 | 4 90 175 | ||||||
| Фосфор | P | 15 | 2 | 8 | 5 | |||||||||
| Сера | S | 16 | 2 | Класс | 17 | 2 | 8 | 7 | ||||||
| Аргон | A r | 18 | 2 | 8 | 8 | 9017 2 9017 9017 9017 9017 9017 9017 9017 9017 9017 9017 9017 9017 9017 9017 9017 9017 | 8 | 8 | 1 | |||||
| Кальций | Ca | 20 | 2 | 8 | 8 | 2 | ||||||||
Как создать атомную структуру?
Чтобы нарисовать атомную структуру атома водорода:
- Нарисуйте маленький круг.
 Напишите 1P и 0 N. Это означает ядро.
Напишите 1P и 0 N. Это означает ядро. - Нарисуйте еще один круг за пределами внутреннего круга. Поскольку в атоме водородного элемента содержится 1 протон, то и номер электрона будет таким же. Поэтому напишите e или Q на внешнем круге. Эта ячейка представляет собой k-оболочку.
Атомная структура какого-либо элемента показана следующим образом:
Водород
Атомный номер водорода равен 1, а его массовое число также равно 1.
Количество электронов = Атомный номер = 1
Количество протоны = Атомный номер = 1
Количество нейтронов = Массовое число — Атомный номер
Таким образом, атом водорода содержит только один протон в своем ядре с высокой скоростью на самом низком энергетическом уровне.
| оболочка | K | L | M | N |
| нет. электронов | 1 | 0 | 0 | 0 |
Гелий
Масса нет. = 4
= 4
Атомный номер = 2
Протон = 2
Нейтрон = 2
Электрон = 2
Атомный номер гелия равен 2, а его массовое число равно 4. Следовательно, он содержит 2 электрона, 2 протона и 2 нейтрона.
| оболочка | K | L | M | N |
| нет. электронов | 2 | 0 | 0 | 0 |
Литий
Масса нет. = 7
Атом. = 3
Протон = 3
Нейтрон = 4
Электронов = 3
| оболочка | K | L | M | N |
| нет.электронов | 2 | 1 | 0 | 0 |
Бериллий
Масса нет. = 9
Атомный номер = 4
Протон = 4
Нейтрон = 5
Электрон = 2, 2
| оболочка | K | L | M | N |
нет. электронов электронов | 2 | 2 | 0 | 0 |
Бор
Масса нет.= 11
Атомный номер = 5
Протон = 5
Нейтрон = 6
Электрон = 2, 3
| оболочка | K | L | M | N |
| нет. электронов | 2 | 3 | 0 | 0 |
Углерод
Масса нет. = 12
Атомный номер = 6
Протон = 6
Нейтрон = 6
Электрон = 2, 4
Атомный вес углерода равен 6, а его масса равна 12.Следовательно, он содержит 6 электронов, 6 протонов и 6 нейтронов.
| оболочка | K | L | M | N |
| нет. электронов | 2 | 4 | 0 | 0 |
Что нужно помнить
- Распределение электронов в различных оболочках атома известно как электронная конфигурация.
- Нарисуйте маленький круг. Напишите 1P и 0 N. Это означает ядро.
- Нарисуйте еще один круг за пределами внутреннего круга. Поскольку в атоме водородного элемента содержится 1 протон, количество электронов будет таким же. Поэтому напишите e или Q на внешнем круге. Эта ячейка представляет собой k-оболочку.
- Точно так же существуют более высокие оболочки, такие как L, M, N, которые содержат разное количество электронов.
- Это включает в себя все отношения, которые установились между людьми.
- В обществе может быть более одного сообщества.Сообщество меньше, чем общество.
- Это сеть социальных отношений, которые нельзя увидеть или потрогать.
- общие интересы и общие цели не нужны обществу.
Видео по электронной конфигурации и атомной структуре
Атомы, молекулы, элементы и соединения
Электронная конфигурация
Электронные конфигурации — электроны и подуровни
Общие сведения об атомах, элементах и молекулах Часть № 1 (9 мин.)
Вопросы и ответы
Молекула — это мельчайшая частица, обладающая свойствами соединения.
Правило 2n 2 — это правило, которое используется для определения количества электронов, которые могут существовать на разных оболочках атомов.Например: для k-оболочки (n) = 1
Количество электронов в k-оболочке = 2n 2
= 2 (1) 2
= 2
Количество электронов в L-оболочке = 2n 2
2. (2) 2
2 x 4
= 8
Стремление атома иметь 8 электронов на внешней оболочке называется октетом.Стремление атома иметь два электрона в своей первой оболочке называется дуплетом.
Те элементы, которые могут легко реагировать с другими элементами во время химических реакций, называются реактивными элементами.
Неон — инертный газ, потому что на его внешней орбите находятся 8 электронов, и он не принимает участия в химической реакции.
Валентность кислорода равна двум, потому что он получает два электрона в ходе химической реакции.
Элементы группы IA называют щелочными металлами, потому что они легко реагируют с водой с образованием щелочи.
Хлор называют реактивным неметаллом, потому что он легко может получить один электрон и обладает единичным отрицательным зарядом.
Модуль 1: Свойства и структура материи
В этой статье представлен обзор свойств и структуры материи — материала, из которого все состоит! Используйте это как часть учебного плана, чтобы убедиться, что вы знаете все ключевые концепции, связанные с этим модулем.
Оглавление:
Свойства и структура материи
Эта часть учебной программы представляет собой введение в химию, являясь началом 11-го класса. Основные различия в состояниях материи представлены и рассмотрены, и вы столкнусь с новой терминологией. Убедитесь, что вы понимаете все введенные новые слова и умеете их определять.
Разделение смесей
Смесь представляет собой смесь двух или более веществ, которые химически не соединяются.Важно отметить, что вещества в смеси сохраняют свои индивидуальные химические и физические свойства.
Есть два типа смесей:
1. Однородный : Равномерное распределение компонентов (например, сталь).
2. Гетерогенный : Неравномерное распределение составляющих веществ (например, грязь).
Смеси можно разделить на отдельные вещества, из которых они состоят, с помощью ряда экспериментальных методов, с которыми вы должны быть знакомы.
Ниже мы проиллюстрировали эти методы с помощью некоторых полезных диаграмм.
1. Фильтрация: Отделение твердых частиц от жидкостей с помощью фильтровальной воронки, фильтровальной бумаги или мембраны.
2. Просеивание : отделяет твердые частицы разных размеров с помощью сита.
3. Дистилляция : разделяет жидкости с помощью конденсатора, используя разницу температур кипения.
4. Испарение : отделяет твердое вещество, растворенное в жидкости, путем выкипания жидкости в емкости для выпаривания.
5. Магнитная сепарация : отделяет магнитные вещества от немагнитных с помощью постоянного магнита или электромагнита.
Чтобы рассчитать процентный состав одного вещества в смеси, используйте следующую формулу:
\ (\ text {Процентный состав} = \ \ frac {\ text {Масса вещества}} {\ text {Всего Масса смеси}} \ times \ 100 \)
Классифицирующие элементы
Элементы — это чистые вещества, состоящие только из одного типа атомов.
Важно, чтобы вы знали, как классифицировать элемент ( как металл, неметалл или полуметалл ) на основе положения, которое элемент занимает в периодической таблице, а также физических и химических свойств элемента.
Металлы находятся в левой части таблицы Менделеева и обычно имеют высокие температуры плавления, хорошую электрическую и теплопроводность, блестящие, податливые и пластичные.
Неметаллы находятся в правой части таблицы Менделеева и обычно имеют низкие температуры плавления, плохие электрические и теплопроводные свойства, тусклые и хрупкие.
Полуметаллы — это бор, кремний, германий, мышьяк, сурьма, теллур и полоний. Полиметаллы обычно имеют очень высокие температуры плавления, являются электрическими полупроводниками, блестящими и хрупкими.
Различные элементы будут иметь очень разные химические свойства.
Вы должны знать об общей реакционной способности металлов, неметаллов и полуметаллов — но имейте в виду, что это более тесно связано с группой периодической таблицы, в которой находится элемент!
Следующие тенденции являются хорошей отправной точкой:
- Металлы группы 1 вступают в реакцию с водой и кислородом из катионов в солях и обладают высокой реакционной способностью.
- Группа 2 Металлы реагируют с водой или кислородом при нагревании, образуют катионы в солях и обладают некоторой реакционной способностью.
- Углерод образует множество ковалентных соединений, некоторые из которых имеют разные химические и физические свойства.
- Кремний является полупроводником, а также образует множество ковалентных соединений.
- Неметаллы различаются по наблюдаемому уровню реакционной способности, за исключением галогенов ( группа 17 ), которые очень реактивны и получают один электрон для достижения стабильной валентной электронной конфигурации.
Вы также должны уметь определять состояние данного элемента при комнатной температуре и давлении.
Большинство элементов представляют собой твердые тела при комнатной температуре, но ртуть и бром — жидкости.
Водород, азот, кислород, фтор, хлор и элементы группы 18 являются газами при комнатной температуре и давлении.
Атомная структура и атомная масса
Итак, мы немного поговорили о различных элементах в предыдущем разделе, и их очень много — на самом деле 118!
Но что делает элемент элементом? Почему одни отличаются от других?
Все сводится к атомной структуре!
Итак, здесь мы собираемся глубоко погрузиться в состав атомов и посмотреть, что отличает их друг от друга.
Атом
Как вы, наверное, знаете, атомы состоят из протонов, нейтронов и электронов.
- Протоны несут положительный заряд
- Нейтроны не имеют заряда
- Электроны несут отрицательный заряд
- Протоны и нейтроны благополучно проживают в ядре
- Электроны расположены на энергетических уровнях около ядро
Таблица Менделеева дает вам всю информацию, необходимую для определения атомной структуры элемента.Взгляните на Ключ периодической таблицы ИЮПАК, если вы не знаете, как читать предоставленные данные.
Атомный номер уникален для каждого элемента и показывает количество протонов, присутствующих в ядре.
Атомная масса элемента — это сумма количества протонов и нейтронов. Вы можете заметить, что большинство элементов не имеют целых значений атомной массы в периодической таблице. Это потому, что атомная масса — это среднее значение типичного образца элемента, найденного на Земле, который будет содержать разные изотопы.{18} O \) содержит 10 нейтронов.
Можно вычислить относительную атомную массу элемента на основе количества каждого изотопа.
Для этого следует использовать следующую формулу.
\ (\ text {Стандартная атомная масса} = \ (\% _ A \ times M_A) + (\% _ B \ times M_B) + (\% _ C \ times M_C) \ text {…} \)
\ ( \% _ A \) — процентное содержание изотопа \ (A \), \ (M_A \) — масса изотопа \ (A \) и так далее.
Нейтральный элемент содержит такое же количество протонов и электронов .
Электронная структура атома
Есть два способа, с помощью которых вам нужно научиться думать об электронной структуре атома в курсе химии 11-го года обучения: модель Бора и модель Шредингера.
1. Модель атома Бора утверждает, что электроны вращаются вокруг ядра в оболочках фиксированного размера и энергии.
Схема модели Бора показана ниже.
2. Модель Шредингера изображает электроны как волны материи, которые описываются волновой функцией.{5} \)
При построении электронной спин-орбитальной диаграммы с использованием модели Шредингера важно придерживаться трех следующих правил:
- Принцип Ауфбау : Орбитали атома должны заполняться сначала с самого низкого энергетического уровня.
- Принцип исключения Паули : На одной атомной орбитали может находиться не более двух электронов, а спаренные электроны должны иметь противоположный спин.
- Правило Хунда : Каждая орбиталь в подоболочке должна быть занята одним электроном, прежде чем она может быть спарена с другим электроном, а спин неспаренных электронов на однократно занятых орбиталях должен быть выровнен.
Испытания на пламя
Испытания на пламя — это эксперимент, который может быть проведен для различения образцов, содержащих различные металлические элементы.
По сути, когда элемент нагревается, излучается свет определенного цвета.
При обосновании наблюдаемых явлений полезно рассмотреть модель атома Бора.
- Когда атом в основном состоянии нагревается, электроны могут получить квантованное количество энергии, и атом переходит в возбужденное состояние.
- Затем электроны релаксируют обратно на более низкие энергетические уровни, излучая свет определенной длины волны.
- Эта длина волны соответствует разности энергий между оболочками атома.
Схема ниже иллюстрирует этот процесс:
Ядерная химия
До сих пор мы говорили о поведении электронов в каждом элементе, но теперь мы можем узнать больше о поведении атомных ядер:
- Когда они стабильны, а когда нестабильны ?
- Что это вообще за радиация?
Во-первых, нам нужно ввести понятие радиоизотопа — это слово представляет собой сочетание слов «радиоактивный» и «изотоп».{12} C \) и подвергается радиоактивному распаду с излучением.
Ниже приведена диаграмма некоторых возможных комбинаций протонов и нейтронов в ядре (ядра, показанные черным цветом, стабильны, а ядра, показанные темно-бордовым, нестабильны). Обратите внимание, что стабильные ядра попадают в узкий диапазон отношения протон: нейтрон .
Радиоактивные ядра при распаде испускают излучение, и вам нужно знать три типа излучения: альфа , бета и гамма .{-} \). Он несет отрицательный заряд и отклоняется к положительной пластине электрического поля.
Гамма-излучение состоит из электромагнитного излучения высокой энергии и обозначается символом \ (\ gamma \) — оно не несет заряда и не отклоняется электрическим полем.
Мы можем написать уравнения для ядерного распада так же, как мы пишем уравнения для химических реакций. Вы должны уметь делать это для трех разных типов излучения.{\ \ 0} \ beta \)
Есть много применений радиоизотопов — излучение не должно пугать, если использовать его правильно! Например, йод-131 может помочь в лечении рака щитовидной железы, поскольку он накапливается в щитовидной железе и доставляет локализованную дозу радиации для уничтожения раковых клеток, а америций-241 используется в детекторах дыма в качестве альфа-излучателя для генерации ионизированного газа.
Периодичность
Периодичность относится к повторяющимся тенденциям — эти повторяющиеся тенденции позволили ранним химикам разработать систему классификации элементов.Конечным результатом является таблица Менделеева, созданная Дмитрием Менделеевым (этот парень).
Тенденции в Периодической таблице
Элементы расположены в Периодической таблице таким образом, что некоторые тенденции можно легко запомнить. Тенденции, которые вам необходимо знать, показаны в таблице Менделеева ниже.
Группа, частью которой является элемент, также будет определять валентность иона, который образует элемент. Заряд иона, образованного в каждой группе, показан над группой в таблице выше.(Вы не можете определить заряд иона переходного металла по позиции, которую он занимает в периодической таблице.)
Связывание
Чтобы понять химическую связь, нам сначала нужно проверить понятие, известное как электроотрицательность.
Электроотрицательность — это способность элемента притягивать связывающие электроны.
Очень важно, чтобы вы это понимали!
1. большая разница в электроотрицательности приведет к ионной связи
2.Меньшая разница в электроотрицательности приведет к ковалентной связи или металлической связи .
Обозначение соединений
При наименовании неорганических веществ просто перечисляйте катион и анион.
Если используется переходный металл, укажите также степень окисления.
Например, название для \ (FeCl_3 \) — хлорид железа (III), а название для \ (MgSO_4 \) — сульфат магния.
При именовании органических веществ перечисляйте элементы по порядку и включайте префиксы для обозначения номера данного типа атома.
Например, имя \ (PCl_3 \) — трихлорид фосфора, а имя \ (N_2O_4 \) — четырехокись азота.
Для 11-го класса химии и HSC вы должны знать следующие префиксы.
| Номер | Префикс | Номер | Префикс | ||||
| 1 | Моно | 5 | 5 | 809 | 9000 | Hexa | |
| 3 | Tri | 7 | Hepta | ||||
| 4 | Tetra | 72 | 73 8 написание формул неорганических и органических веществ из их названий.Точечные структуры ЛьюисаЭлектронно-точечные структуры Льюиса помогают нам описывать ковалентные связи внутри различных молекул. « точки » в этих структурах представляют собой валентные электроны, участвующие в химической связи. Точечные структуры Льюиса элементов 2-го периода показаны ниже. При организации электронов для образования ковалентных связей цель состоит в том, чтобы гарантировать, что каждый электрон окружен полной валентной оболочкой.Это известно как правило октетов . Вы должны быть уверены в рисовании точечных структур Льюиса для множества простых ковалентных соединений, подобных тем, которые проиллюстрированы ниже. Начните с рисования точечной структуры Льюиса для каждого атома и начните делить электроны. Это нормально, если пару раз ошибиться и найти решение методом проб и ошибок! ПолярностьНесмотря на то, что ковалентные связи образуются за счет обмена электронами между различными элементами, электроны будут проводить больше времени ближе к более электроотрицательному элементу. Это создает постоянный диполь в ковалентной молекуле. Одна сторона имеет слегка положительный заряд, а другая — слегка отрицательный. Это часто обозначается с помощью греческого символа дельты нижнего регистра \ (\ delta \). Это свойство хорошо проявляется в молекуле, такой как \ (HCl \), где электроны болтаются вокруг более электроотрицательного атома хлора.
Молекула с симметричным распределением электронов неполярна. В простой двухатомной молекуле, такой как \ (HCl \), большая разница в электроотрицательности приведет к более полярной связи. Теория VSEPRМы можем использовать наши знания о рисовании точечных структур Льюиса, чтобы предсказать форму молекулы с помощью теории VSEPR. Принцип VSEPR заключается в том, что отрицательно заряженных электронов будут отталкиваться друг от друга, приводя к предсказуемым формам, основанным на количестве групп и неподеленных пар, прикрепленных к центральному атому молекулы. Давайте посмотрим на все формы VSEPR, которые вам необходимо знать. Мы даже сделали несколько полезных вращающихся диаграмм, чтобы вы могли видеть их в 3D! (Чтобы увидеть 3D-версии, нажмите ссылку под изображением, и оно откроется в новом окне. Имейте в виду, что они большие — 2-3 Мб) Ожидается, что вы сможете нарисовать точечную структуру Льюиса для молекулу и определите форму согласно теории VSEPR. Линейный (две группы VSEPR) Нажмите здесь, чтобы увидеть 3d версию. Изогнутый / угловой (три группы VSEPR, одна неподеленная пара ИЛИ четыре группы VSEPR, две неподеленные пары) Нажмите здесь, чтобы увидеть 3d версию. Тригональный планарный (три группы VSEPR) Нажмите здесь, чтобы увидеть 3d версию. Тригональная пирамида (четыре группы VSEPR, одна неподеленная пара) Нажмите здесь, чтобы увидеть 3d версию. Тетраэдр (четыре группы VSEPR) Ошибка 404 | Успех учащихсяПерейти к основному содержанию Учебный план Британской Колумбии
Leave a Reply
|


