Контрольная работа по химии 9 класс (Электролитическая диссоциация)
Контрольная работа по химии 9 класс (Электролитическая диссоциация).
I. Тест.
1. Из приведенных ниже веществ выберите электролит:
а)
раствор сахара;
б) раствор поваренной
соли;
в) бензин;
г) растительное
масло.
2. Из приведенных ниже частиц укажите катион:
а)
К0;
б)
H2;
в)
S2–;
г)
Na+.
3. Частица, имеющая отрицательный заряд, называется:
а)
анион;
б) катион;
в) атом;
г) молекула.
4. Процесс распада электролита на ионы при его растворении или расплавлении называется:
а)
гидролиз;
б) гидратация;
в)
диссоциация;
г) сублимация.
5. Положительно заряженный электрод в химии называют:
а)
катод;
б) анод;
в) соленоид;

6. Отношение числа диссоциированных молекул к общему числу молекул, находящихся в растворе, для сильных электролитов близко к:
а)
1;
б) 0,5;
в) 0,25;
г) 0,1.
7. Степень диссоциации некоторого электролита = 0,1. Можно сказать, что этот электролит:
а)
сильный;
б) средней силы;
в) слабый;
г)
практически неэлектролит.
8. Реакция
Mg + H2SO4 = MgSO4 + H2
протекает до конца, т. к. выделяется:
а)
вода;
б) осадок;
в) соль;
г) газ.
9. Из приведенных ниже реакций выберите ту, которая не протекает до конца:
а)
KCl + NaNO3 = …
б)
K2CO3 + HCl = …
в)
CuO + HNO3 = …
г)
NaOH + H2SO4 = …
10.
В трех пробирках находятся растворы
KOH, HCl, Na2SO4. Имеются три реактива: синий лакмус (1),
BaCl2 (2), фенолфталеин (3). Укажите верную
последовательность прибавления
реактивов 1, 2, 3 в пробирки для обнаружения
веществ в растворах. Варианты ответа:
Имеются три реактива: синий лакмус (1),
BaCl2 (2), фенолфталеин (3). Укажите верную
последовательность прибавления
реактивов 1, 2, 3 в пробирки для обнаружения
веществ в растворах. Варианты ответа:
а)
1, 3, 2;
б) 3, 1, 2;
в) 1, 2, 3;
г) 2, 3, 1.
11. В какой из приведенных ниже реакций наблюдаются два признака, позволяющих говорить о том, что данная реакция ионного обмена идет до конца?
а)
KCl + NaOH = … ;
б) НCl + КOH = … ;
в) Na2CO3 + HNO3 =
… ;
г) CaO + HNO3 = … .
12. Какие реакции никогда не являются ОВР?
а)
обмена;
б) замещения;
в) разложения;
г)
соединения.
Контрольная работа по теме «Электролитическая диссоциация»
Дата _____________ Класс ___________________
Контрольная работа по теме
«Электролитическая диссоциация»
Цель – проверить усвоение основных понятий темы: “Электролитическая диссоциация”, “Реакции ионного обмена”, « Гидролиз», проконтролировать умения составлять полные и сокращенные ионные уравнения реакций на основе знания условий и признаков реакций ионного обмена, умения решать задачи.
Ход урока
1. Организационный момент урока.
2. Выполнение контрольной работы.
Вариант 1
1) Докажите химические свойства щелочей на примере гидроксида стронция. Запишите уравнения в молекулярном и в ионном виде.
2) Какие вещества, формулы которых приведены ниже, подвергаются гидролизу:
а) CaSO4, б) AgNO3, в) K 2CO3?
Укажите характер среды растворов указанных веществ при их гидролизе.
3) По сокращенному ионному уравнению запишите полное ионное и молекулярное:
Ва2+ + S042- = BaS04 ↓
4) Задача: Какова масса соли, образующейся при взаимодействии 200г 2%-го раствора гидроксида натрия с 200 г 10%-го раствора соляной кислоты?
Вариант 2
1) Докажите свойства кислот на примере ортофосфорной кислоты. Запишите уравнения реакций в молекулярном и в ионном виде.
2) Какие вещества, формулы которых приведены ниже, подвергаются гидролизу:
а) Fe2(SO4)3, б) K 2SO3, в) NaNO3?
Укажите характер среды растворов указанных веществ при их гидролизе.
3) По сокращенному ионному уравнению запишите полное ионное и молекулярное:
Н+ + ОН— = Н 2
4) Задача: При взаимодействии 168 г гидроксида калия и раствора сульфата меди (II) массой 200 г, в котором 0,08 массовых долей соли, выпадает осадок. Определите массу осадка.
3. Домашнее задание
Повторить п.1-п.7
Контрольная работа по химии «Электролитическая диссоциация»
1 вариант.
1. Составить возможные уравнения диссоциации веществ:
КОН, Na2SO4, Fe2O3, H3PO4, Mg(NO3)2.
2. Составить уравнения реакций между парами веществ в молекулярной, полной ионной и краткой ионной формах:
а) СаО + НNO3
б) Ba(OH) 2 + Na2SO4
3. К данному краткому ионному уравнению подобрать пару веществ и составить молекулярное, полное и краткое ионные уравнения:
К данному краткому ионному уравнению подобрать пару веществ и составить молекулярное, полное и краткое ионные уравнения:
Fe+2 + 2OH-1 = Fe(OH) 2↓
4. Разобрать окислительно-восстановительную реакцию: проставить степени окисления атомов, составить схемы процессов окисления и восстановления, указать окислитель и восстановитель, уравнять:
CuO + H2
5. Задача. В 40 граммах раствора гидроксида натрия NaOH 25% концентрации растворяли углекислый газ СО2. Сколько литров углекислого газа растворили, если в результате реакции образовалась вода и карбонат натрия Na2CO3.
2 вариант.
1. Составить возможные уравнения диссоциации веществ:
Ca(OH) 2, K2CO3, SO2, H2SiO3, Al2(SO4) 3.
а) KОH + ZnCl2
б) Na2CO3 + HNO3
3. К данному краткому ионному уравнению подобрать пару веществ и составить молекулярное, полное и краткое ионные уравнения:
Н+ 1 + ОH— 1 = Н2О
4. Разобрать окислительно-восстановительную реакцию: проставить степени окисления атомов, составить схемы процессов окисления и восстановления, указать окислитель и восстановитель, уравнять:
Zn + HBr → ZnBr2 + H2↑
5. Задача. Сколько граммов осадка гидроксида меди Cu(OH)
Весь материал — в документе.
▶▷▶ контрольная работа по химии.тема электролитическая диссоциация
▶▷▶ контрольная работа по химии.тема электролитическая диссоциацияконтрольная работа по химиитема электролитическая диссоциация — Yahoo Search Results Yahoo Web Search Sign in Mail Go to Mail» data-nosubject=»[No Subject]» data-timestamp=’short’ Help Account Info Yahoo Home Settings Home News Mail Finance Tumblr Weather Sports Messenger Settings Yahoo Search query Web Images Video News Local Answers Shopping Recipes Sports Finance Dictionary More Anytime Past day Past week Past month Anytime Get beautiful photos on every new browser window Download Контрольная работа по химии на тему «Электролитическая infourokru/kontrolnaya-rabota-po-himii-na-temu Cached Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления Контрольная работа по теме «Электролитическая диссоциация wwwmetod-kopilkaru/kontrolnaya_rabota_po_teme Cached Контрольная работа содержит 4 основных варианта для обычных классов и 2 базовых варианта для очень слабых классов Контрольная Работа По Химиитема Электролитическая Диссоциация — Image Results More Контрольная Работа По Химиитема Электролитическая Диссоциация images Контрольная работа в 9 классе по теме «Электролитическая pedportalnet/starshie-klassy/raznoe/kontrolnaya Cached Контрольная работа предназначена для проведения аттестации обучающихся 9 класса за 1 Контрольная работа №1 по химии для учащихся 9 класса Тема infourokru/kontrolnaya-rabota-po-himii-dlya Cached › Конспекты › Контрольная работа №1 по химии для учащихся 9 класса Тема Классификация химических реакций контрольная работа по теме «Электролитическая диссоциация pedportalnet/starshie-klassy/raznoe/kontrolnaya Cached Контрольная работа по теме «Действия с десятичными дробями» Контрольная работа № 8 Контрольная работа № 8 Лыгина Ольга Владимировна Тесты по химии 9 класс Электролитическая диссоциация allengorg/d/chem/chem318htm Cached Контрольная работа по темам «Кислород и сера», «Азот и фосфор», «Углерод и кремний» 146 Ответы 157 Урок №15 Контрольная работа №1 по теме «Электролитическая sitesgooglecom/site/himulacom/zvonok-na-urok/9 Версия 1 1 Напишите уравнения электролитической диссоциации следующих веществ: Контрольная работа №2 по теме: «Электролитическая диссоциация» lib2podeliseru/docs/16302/index-27299-6html Cached ХИМИЯ Контрольная работа № 2 по теме: « Электролитическая диссоциация » Автор: Русецкая ОП Контрольная работа по теме электролитическая диссоциация по niks-allru/kontrolnie-raboti/kontrolnaya-rabota Cached Электролиты и неэлектролиты ВО 1 2 Электролитическая диссоциация ВО 1 3 Контрольная работа Проверочные и контрольные работы по теме «Электролитическая videourokinet/razrabotki/provierochnyie-i Cached Теория электролитической диссоциации Проверочная работа « Электролитическая диссоциация Promotional Results For You Free Download | Mozilla Firefox ® Web Browser wwwmozillaorg Download Firefox — the faster, smarter, easier way to browse the web and all of Yahoo 1 2 3 4 5 Next 19,800 results Settings Help Suggestions Privacy (Updated) Terms (Updated) Advertise About ads About this page Powered by Bing™
контрольная работа по химиитема электролитическая диссоциация — Все результаты Контрольная работа по химии в 8 классе по теме — Инфоурок › Химия 9 мар 2018 г — Контрольная работа № 4 по теме : « Электролитическая диссоциация » 1 вариант Задание на «стандарт» 1 Напишите возможные Контрольная работа по теме: «Электролитическая диссоциация» (9 › Химия Похожие 6 янв 2016 г — Инфоурок › Химия › Другие методич материалы › Контрольная работа по теме : » Электролитическая диссоциация » (9 класс) Контрольная работа на тему Электролитическая диссоциация › Химия 25 апр 2018 г — Контрольная работа на тему Электролитическая диссоциация Напишите уравнения химических реакций соответственно схеме: Контрольная работа по теме: «Электролитическая диссоциация Похожие 6 янв 2015 г — Контрольная работа по теме : » Электролитическая диссоциация Закончите молекулярные уравнения химических реакций, составьте Контрольная работа по теме «Электролитическая диссоциация» Похожие 19 нояб 2015 г — Урок для для педагогов для 9 класса Методические разработки по Химии для 9 класса Тема I Электролитическая диссоциация Работа 1 Решебник по химии за 9 класс к дидактическому материалу АМРадецкий Тема I Электролитическая диссоциация Работа 1 Электролитическая Урок №15 Контрольная работа №1 по теме «Электролитическая Похожие Изучаем химию, решаем химические задачи Урок №15 Контрольная работа №1 по теме « Электролитическая диссоциация » Версия 1 1 Напишите уравнения электролитической диссоциации следующих веществ: Контрольная работа № 1 по теме «Электролитическая wwwcompendiumsu/chemistry/9klas/13html Контрольная работа № 1 по теме « Электролитическая диссоциация » — ХИМИЯ 9 класс — поурочные разработки — разработки уроков — авторские уроки Контрольная работа по химии 9 класс (Электролитическая Контрольная работа по химии 9 класс ( Электролитическая диссоциация ) I Тест 1 Из приведенных ниже веществ выберите электролит: а) раствор Контрольная работа по химии 9 класс электролитическая Контрольная работа по химии 9 класс электролитическая диссоциация Вещества, образующие при диссоциации в качестве анионов только Контрольная работа 2 по теме «Электролитическая диссоциация Контрольная работа 2 по теме « Электролитическая диссоциация » Указать степени окисления атомов химических элементов в соединении: АlРO Контрольная работа по химии по теме «Электролитическая 29 нояб 2013 г — Задания контрольной работы по химии в 9 классе по теме » Электролитическая диссоциация » Контрольная работа по теме «Электролитическая диссоциация» Похожие Скачать к уроку химии Контрольная работа по теме «Электролитическая усвоение основных понятий темы : “ Электролитическая диссоциация ”, Контрольная работа по теме: «Электролитическая диссоциация» Категория: Химия 07112015 12:27 Контрольная работа по теме : « Электролитическая диссоциация » для общеобразовательных классов и классов Контрольная работа №2 по теме «Электролитическая 20 дек 2015 г — Данная контрольная работа составлена для обучающихся 11 класса по УМК Г Е Рудзитиса, Ф Г Фельдмана и Контрольная работа №2 по теме » Электролитическая диссоциация Химические реакции» 11 класс [DOC] Электролитическая диссоциация chemistryturovoschooledusiteru//proektyelektroliticheskayadissociaciyadoc Похожие Проект реализуется в рамках химии темы «Теория электролитической диссоциации », после чего следовала контрольная работа , результаты Контрольная работа по теме: «Теория электролитической 12 янв 2017 г — Представлен текст контрольной работы по химии в 9 классе по теме Теория электролитической диссоциации химия 9 wwwsc109ru/content/distant/chime/9html Похожие Закончится повторение контрольной работой , которая определит готовность учащихся к Тема 1 Теория электролитической диссоциации (10 уроков) Контрольная работа по теме «Электролитическая диссоциация» Печать Контрольная работа по теме « Электролитическая диссоциация » ( УМК ГЕ Рудзитиса, ФГ Фельдмана; НН Гара, Химия уроки в 9 классе, химия_9 ciurru/jab/jab_jsi/DocLib2/рабочие%20программы%202016-2017//химия_9pdf Рабочая программа по химии в 9 классе составлена на основе: • Федерального Электролитическая диссоциация веществ в процессе растворения Электролиты и Тема раздела Количество 21 15 Контрольная работа №2 Проверочные и контрольные работы по теме «Электролитическая 11 июл 2017 г — диссоциация» Курс проверочных и контрольных работ на 4 варианта Проверочная работа « Электролитическая диссоциация Свойства Электронная тетрадь по химии 9 класс Химия Вводный курс Контрольная работа 9 класс химия электролитическая — mbb-org mbb-orgeu/component/k2/itemlist/user/16391 Контрольная работа 9 класс химия электролитическая диссоциация Диссоциация» ( 9 класс контрольная работа в 9 по теме «электролитическая Контрольная работа по химии 9 класс по теме «Теория newteacherjournalru//1438-kontrolnaya-rabota-po-khimii-9-klass-po-teme-teoriya Контрольная работа по химии 9 класс по теме «Теория электролитической диссоциации » Автор: Виктория Юрьевна Сергеева вкл 13 Февраль 2017 Опубликовано в Химия Напишите уравнения диссоциации 5) Какую массу [DOC] РП по химии — Региональный интернет-портал Департамента промежуточный контроль- контрольная(тестовая) работа классификация веществ, химические реакции и их классификация, электролитическая диссоциация ; 1, Контрольная работа № 1 по теме «Методы познания в химии » Интерактивный тест по химии для 9 класса по теме — Pedsovetsu pedsovetsu › Файлы для скачивания › Химия › Презентации Похожие 20 мар 2015 г — Тест по электролитической диссоциации и ионным уравнениям поможет учащимся более подробно усвоить процесс распада Контрольная работа №1 по теме «Электролитическая диссоциация pedsovetpro/indexphp?option=com_contentview=articleid03 Математика / Геометрия · Химия · Физика · Искусствоведение / Культурология · География · Информатика · Физическая культура · Правоведение ЗАВУЧинфо — Контрольная работа по теме: «Химические реакции wwwzavuchru/methodlib/134/108282/ Похожие Контрольная работа по теме : » Химические реакции Растворы Электролитическая диссоциация » Методической библиотеки портала Завуч инфо) Тест Электролитическая диссоциация — Dist-TutorInfo Похожие Подготовка к ЕГЭ по химии Двухзарядные катионы образуются при диссоциации 1) h3SO4 2) Na2CO3 3) Cu(NO3)2 4) Fe2(SO4)3 1 2 3 4 Тестовая контрольная работа по теме: «Электролитическая Похожие Тестовая контрольная работа по теме : » Электролитическая диссоциация «, 9 класс (Разное) Учебное пособие для учителей Коваленко Л | Теория электролитической диссоциации — Химия him1septemberru/articlephp?ID=200404512 Похожие Контрольная работа должна быть составлена после контрольной работы по теме «Теория электролитической диссоциации », и примерную структуру Разработка обобщающего урока химии по теме открытыйурокрф/статьи/649697/ Методы и приемы: фронтальный опрос, работа в группах, лабораторная работа , тестирование Уметь: составлять уравнения электролитической диссоциации кислот, 1 этап — Контрольный пункт «Подготовка к путешествию» Электролитическая диссоциация – разработки уроков по химии › › Конкурс «Мастерская учителя химии» Работа с цифровыми лабораториями готовит учащихся к Тема урока: « Электролитическая диссоциация » Контрольные и проверочные работы [DOC] РАБОЧАЯ ПРОГРАММА по ХИМИИ — Константиновская средняя ramkonstantinovskayaedumskoru/uploads/3000/2642/section/183907/rp//h9docx Рабочая программа по химии составлена на основе Федерального Тема 3 Электролитическая диссоциация (15 ч) Электролиты и неэлектролиты 14/28, Контрольная работа №2 по теме « Электролитическая диссоциация » Контрольная работа по теме Электролитическая диссоциация 9 27 нояб 2017 г — Контрольная работа №1 по теме « Электролитическая диссоциация » Вариант №1 № п/п Текст задания Варианты ответов 1 2 3 Контрольная работа по теме электролитическая диссоциация по Download » Тема ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ 2 Контрольная работа 1 год Учебник ГЕ, Рудзитис, ФГФельдман « Химия 8 класс», [PDF] Тема ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ РЕАКЦИИ Тема ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ РЕАКЦИИ ИОННОГО Химические свойства растворов электролитов КО Контрольная работа № 1 Химия — 10 класс Химия Контрольная работа Химическая связь Электролитическая диссоциация Каталог сочинений Сочинения на любую тему Химия Контрольная работа по теме : Алканы, Циклоалканы Химия Теория электролитической диссоциации (3) — Лабораторная работа Главная Лабораторная работа Химия Сохрани ссылку в одной из Лабораторная работа №1 Тема : Теория электролитической диссоциации 1 ИНТЕРАКТИВНЫЕ ТЕХНОЛОГИИ В ПРОЦЕССЕ ИЗУЧЕНИЯ ТЕМЫ «ТЕОРИЯ При изучении темы «Теории электролитической диссоциации » в Поэтому в процессе изучения школьного курса химии следует обращать особое работа в малых группах — в парах, ротационных тройках, “два, четыре, вместе”; Саратова В контрольном классе изучение темы проходило по [DOC] Государственное бюджетное образовательное учреждение Центр химбиозрф/wp-content/uploads/2013/09/химия-9doc Химические свойства кислот в свете электролитической диссоциации Систематизация и обобщение знаний по теме « Электролитическая диссоциация » Анализ контрольной работы №1, коррекция ЗУН учащихся, работа над Самостоятельная работа по химии 8 класс Тема www1variantru › Химия › Самостоятельные работы по химии 8 класс Похожие Самостоятельная работа по химии для 8 класса Тема : Электролитическая диссоциация Вариант 1 Задания и ответы [DOC] Пояснительная записка Настоящая рабочая программа по химии ,9(1)doc Похожие примерной программы основного общего образования по химии класс, М: Контрольная работа №1 по теме « Электролитическая диссоциация » УКЗ Контрольная работа по теме «Электролитическая диссоциация wwwuchsovetru/publikacii/oo/18869 17 нояб 2017 г — Предназначена работа для обучающихся 9 го класса Тема : Контрольная работа по теме » Электролитическая диссоциация » в воде вещества ( осадки), напишите их химические формулы: 1) Сульфат меди (II), Урок по теме: «Практическая работа №1 Решение — DocBaseorg › Химия Похожие 2 окт 2016 г — Здесь Вы можете скачать Урок по теме : «Практическая работа №1 по теме « Электролитическая диссоциация »» для предмета : Химия Данный Контрольная работа по теме » Электролитическая диссоциация » [DOC] Министерство народного образования Российской Федерации Самостоятельная работа по темам «Способы выражения концентрации растворов», Решение задач по теме » Электролитическая диссоциация Сильные и Контрольная работа № 1 2 ПЛАН ЗАНЯТИЙ ПО КУРСУ » ХИМИЯ » Химия 9 контрольная работа по теме электролитическая — itchi dorpaovheadinfo/39/ 13 мар 2018 г — Проверка знаний по теме Скачать: контрольная работа по химии в 9 классе на тему теория электролитической Скачать: Тесты по Химия 9 класс Тема: Контрольная работа «Электролитическая Химия 9 класс Тема : Контрольная работа « Электролитическая диссоциация » Цель: провести контроль знаний учащихся по теме «Теория Химия в школе: Тест по теме «Электролитическая диссоциация», 9 vvplatunovablogspotcom/2014/10/9html Похожие 19 окт 2014 г — Блог » Химия в школе» адресован моим ученикам Тест по теме » Электролитическая диссоциация «, 9 класс [PDF] Контрольная работа по химии wwwkbmk45ru/2010-03-16-19-58-47pdf Похожие « Электролитическая диссоциация » Составьте уравнения диссоциации следующих электролитов Напишите выражения для константы диссоциации контрольная работа по химии 9 класс Классификация химических контрольная работа по химии 9 класс Классификация химических реакций Электролитическая диссоциация — в разделе Контроль знаний, по Вместе с контрольная работа по химиитема электролитическая диссоциация часто ищут контрольная работа по теме электролитическая диссоциация 8 класс контрольная работа по химии по теме электролитическая диссоциация ответы контрольная работа номер 1 по теме электролитическая диссоциация ответы контрольная работа электролитическая диссоциация 9 класс ответы тестовая контрольная работа по теме электролитическая диссоциация 9 класс ответы контрольная работа по теме электролитическая диссоциация с ответами самостоятельная работа по химии 8 класс электролитическая диссоциация контрольная работа по теме электролитическая диссоциация реакции ионного обмена Навигация по страницам 1 2 3 4 Следующая Ссылки в нижнем колонтитуле Россия — Подробнее… Справка Отправить отзыв Конфиденциальность Условия Аккаунт Поиск Карты YouTube Play Новости Почта Контакты Диск Календарь Google+ Переводчик Фото Ещё Документы Blogger Hangouts Google Keep Подборки Другие сервисы Google
Контрольная работа по теме «Теория электролитической диссоциации».
 11 класс.
11 класс.Вариант 1
- Какие из следующих жидкостей проводят электрический ток: формалин, раствор медного купороса, этанол, соляная кислота? Дайте обоснованный ответ.
- Могут ли одновременно находится в растворе ионы Ва2+, СО
- Составьте молекулярные уравнения реакций, сущность которых выражают следующие сокращенные ионные уравнения:
А. Fе3+ + 3ОН— = Fе(ОН)3?.
Б. NН4+ + ОН— = NН3? + Н2О.
Вариант 2
- Какие из следующих жидкостей проводят электрический ток: ацетон, раствор гидроксида натрия, ледяная уксусная кислота, раствор поваренной соли? Дайте обоснованный ответ.
- Почему мыло не мылится в жесткой воде? Ответ поясните, написав ионные уравнения.

- Составьте молекулярные уравнения реакций, сущность которых выражают следующие сокращенные ионные уравнения:
А. SО32- + 2Н+ = SО2? + Н2О.
Б. Рb2+ + S2- = РbS?.
Вариант 3
- Приведите по два примера веществ, образующих при диссоциации ионы SО42- и Nа+. Запишите уравнения их диссоциации.
- Какие изменения происходят в пробирке с раствором хлорида меди (II) при последующем добавлении гидроксида калия, а затем раствора серной кислоты? Запишите уравнения реакций.
- Для снижения кислотности почвы применяют доломитовую муку (СаСО3 ? МgСО3) и известняк. Напишите уравнения реакций, происходящих при этом в почве.
Вариант 4
- Приведите по два примера веществ, образующих при диссоциации:
А. Хлорид-ионы.
Хлорид-ионы.
Б. Карбонат-ионы.
Запишите уравнения их диссоциации.
- Какие изменения происходят в пробирке с карбонатом натрия при последовательном добавлении раствора гидроксида бария, а затем азотной кислоты? Запишите уравнения реакций.
- Объясните, можно ли одновременно вносить в почву аммиачную селитру и золу, которая содержит карбонат калия. Подтвердите ответ, записав уравнения соответствующих реакций.
Разбор контрольной работы. Химия (9 класс)
ХИМИЯ9 класс
Разбор КР
Мария Дмитриевна Смирнова
[email protected]
Vk.com/masha2101
1
Контрольная Работа №1
Всего было 11 заданий.
Пятёрок –
Четверок –
Троек –
Двоек Переписать любую оценку можно сегодня и в следующий вторник после 16:00
Контрольная Работа №1
Контрольная Работа №1
https://periodic.artlebedev.ru/
Контрольная Работа №1
Контрольная Работа №1
Контрольная Работа №1
3. В воде растворили 100 грамм сахара (С6Н12О6).
 Сколько частиц будет в
Сколько частиц будет врастворе?
Контрольная Работа №1
4. Напишите определение и пример диссоциации для кислот.
Контрольная Работа №1
5. Какое утверждение не является основным положением электролитической
диссоциации
Направленное движение происходит в
результате притяжения их противоположно
заряженными электродами.
Электролиты могут диссоциировать в
разных условиях по разным механизмам.
Наиболее часто вещества диссоциируют на
катионы и анионы.
Под действием электрического тока ионы
приобретают направленное движение:
положительные ионы стремятся к катоду,
отрицательные — к аноду.
Контрольная Работа №1
6. Напишите диссоциацию сильного двухосновного основания и очень слабой
одноосновной кислоты.
Контрольная Работа №1
6. Напишите диссоциацию сильного двухосновного основания и очень слабой
одноосновной кислоты.
Контрольная Работа №1
7. Что такое степень диссоциации? Как она считается? Привести пример расчета
если известно, что при диссоциации вещества A2X, получилось 3 моль A+, а
изначально его было 6 моль?
Контрольная Работа №1
8*.
 Вещество Н3РО4 диссоциирует ступенчато. Каких частиц (ионов) в растворе
Вещество Н3РО4 диссоциирует ступенчато. Каких частиц (ионов) в растворебудет больше, если степени диссоциации по ступеням следующие: 77%, 0.001%,
0.0000005%
Контрольная Работа №1
9* Взяли 74.5 г. KCl, потом растворили в воде.Сколько частиц оказалось в
растворе, если альфа равна 86%?
Контрольная Работа №1
10. Степень диссоциации KCl — 86%, КОН — 89%. Кто из них более сильный
электролит?
Контрольная Работа №1
Контрольная работа № 4 по теме «Растворы. Электролитическая диссоциация»
Категория: Химия.
Контрольная работа № 4 по теме «Растворы. Электролитическая диссоциация»
| № | Вариант I | Вариант II |
1 | Ответьте на вопрос: | |
Что такое электролитическая диссоциация? Приведите примеры веществ-электроли-тов, относящихся к классу оснований, напишите уравнения их диссоциации. | Что такое «электролиты»? Приведите при-меры веществ-электролитов, относящихся к классу солей, напишите уравнения их диссоциации. | |
2 | А: Расставить коэффициенты, составить полные и сокращенные ионные уравнения реакций. Назовать продукты реакций. Б, В: Составить молекулярные уравнения (ФОРМУЛЫ веществ, КОЭФФИЦИЕНТЫ), полные и сокращенные ионные уравнения реакции. | |
А) MgСO3 + HNO3 = Mg(NO3)2 + H2O + СО2 Б) Al(NO3)3 + NaOH = В) гидроксид меди (II) + соляная кислота = хлорид меди (II) + вода | А) NaOH + H2SO4 = Na2SO4 + H2O Б) KOH + MgCl2 = В) оксид натрия + азотная кислота = нитрат натрия + вода | |
3 | Укажите вещества, в растворах которых лакмус окрасится в синий цвет. | Укажите вещества, в растворах которых мети-ловый оранжевый окрасится в розовый цвет. |
HNO3, Mg(NO3)2, KOH, Cu(OH)2 | HCl, CaCl2, KOH, H2SiO3 | |
4 | Какой объем газа (СО2) выделится при взаимодействии 16,8 грамм карбоната маг-ния с избытком раствора азотной кислоты? | Рассчитайте массу соли, которую можно получить при взаимодействии 40 грамм гидроксида натрия с избытком серной кислоты. |
№ | Вариант III | Вариант IV |
1 | Ответьте на вопрос: | |
Что такое «неэлектролиты»? Приведите примеры веществ-неэлектролитов. Почему их растворы не проводят электриче-ский ток? | Что такое «электролиты»? Приведите при-меры веществ-электролитов, относящихся к классу кислот, напишите уравнения их диссоциации. | |
2 | А: Расставить коэффициенты, составить полные и сокращенные ионные уравнения реакций. Назовать продукты реакций. Б, В: Составить молекулярные уравнения (ФОРМУЛЫ веществ, КОЭФФИЦИЕНТЫ), полные и сокращенные ионные уравнения реакции. | |
А) MgСO3 + HNO3 = Mg(NO3)2 + H2O +СО2 Б) Fe2O3 + HCI = В) гидроксид меди (II) + серная кислота = сульфат меди (II) + вода | А) NaOH + H2SO4 = Na2SO4 + H2O Б) Cu(OH)2 + HCl = В) оксид магния + азотная кислота = нитрат магния + вода | |
3 | Укажите вещества, в растворах которых лакмус окрасится в красный цвет. | Укажите вещества, в растворах которых мети-ловый оранжевый окрасится в желтый цвет |
KOH, HNO3, KNO2, H2SO4 | NaOH, H2SO4, Na2SO4, Ba(OH)2 | |
4 | Какой объем газа (СО2) выделится при взаимодействии 16,8 грамм карбоната маг-ния с избытком раствора азотной кислоты? | Рассчитайте массу соли, которую можно получить при взаимодействии 40 грамм гидроксида натрия с избытком серной кислоты. |
Л. Е. Иванова, МБОУ СОШ № 32 им. С. А. Лавочкина, г. Смоленск
Метки: Химия
Растворы электролитов и неэлектролитов | Введение в химию
Цель обучения
- Распознавать свойства раствора электролита.
Ключевые моменты
- Электролиты — это соли или молекулы, которые полностью ионизируются в растворе.
 В результате растворы электролитов легко проводят электричество.
В результате растворы электролитов легко проводят электричество. - В растворе неэлектролиты не диссоциируют на ионы; поэтому растворы неэлектролитов не проводят электричество.
Условия
- неэлектролит Вещество, не диссоциирующее на ионы в растворе.
- раствор — гомогенная смесь, которая может быть жидкостью, газом или твердым телом, образованная растворением одного или нескольких веществ.
- растворенное вещество: Любое вещество, растворенное в жидком растворителе для создания раствора.
- электролит: Вещество, которое в растворе диссоциирует на ионы.
- соль — ионное соединение, состоящее из катионов и анионов, которые удерживаются вместе за счет электростатического притяжения.
Растворы электролитов
Электролит — это любая соль или ионизируемая молекула, которая при растворении в растворе придает этому раствору способность проводить электричество. Это происходит потому, что когда соль растворяется, ее диссоциированные ионы могут свободно перемещаться в растворе, позволяя заряду течь.
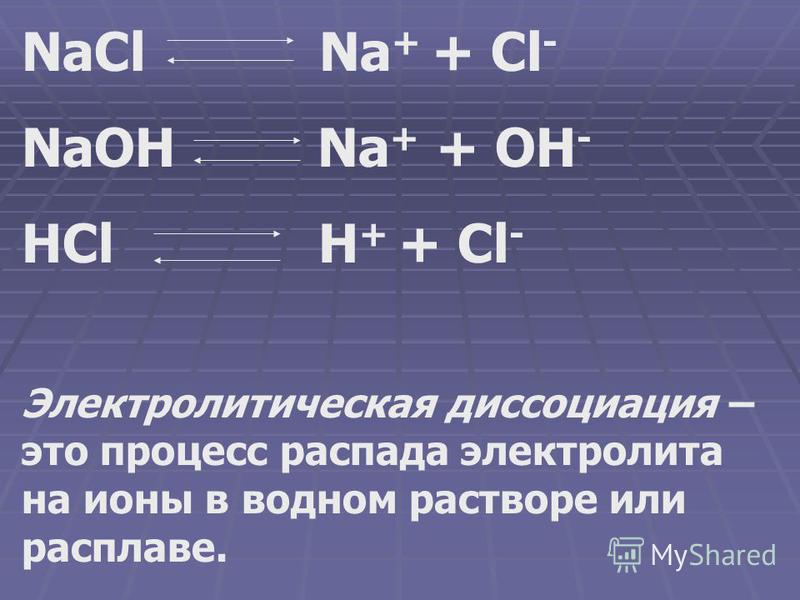
Растворы электролитов обычно образуются, когда соль помещается в растворитель, такой как вода. Например, когда поваренная соль NaCl помещается в воду, соль (твердое вещество) растворяется на составляющие ионы в соответствии с реакцией диссоциации:
NaCl ( с ) → Na + ( водн. ) + Cl — ( водн. )
Кроме того, вещества могут реагировать с водой с образованием ионов в растворе.Например, углекислый газ, CO2, растворяется в воде с образованием раствора, содержащего ионы водорода, карбонат и ионы гидрокарбоната:
2 CO 2 ( г ) + 2 H 2 O ( л ) → 3 H + ( водн. ) + CO 3 2- ( водн. ) + HCO 3 — ( водн. )
Полученный раствор будет проводить электричество, потому что он содержит ионы. Однако важно иметь в виду, что CO 2 — это , а не электролит, потому что CO 2 сам по себе не диссоциирует на ионы. Только соединения, которые в растворе диссоциируют на составляющие ионы, считаются электролитами.
Только соединения, которые в растворе диссоциируют на составляющие ионы, считаются электролитами.
Сильный и слабый электролиты
Как упоминалось выше, когда ионизируемое растворенное вещество диссоциирует, полученный раствор может проводить электричество. Следовательно, соединения, которые легко образуют ионы в растворе, известны как сильные электролиты . (По этой причине все сильные кислоты и сильные основания являются сильными электролитами.)
Напротив, если соединение диссоциирует в небольшой степени, раствор будет слабым проводником электричества; соединение, которое только слабо диссоциирует, поэтому известно как слабый электролит.
Сильный электролит полностью распадается на составляющие ионы в растворе; С другой стороны, слабый электролит останется в растворе в основном недиссоциированным. Примером слабого электролита является уксусная кислота, которая также является слабой кислотой.
Gatorade как раствор электролита Спортивный напиток Gatorade рекламирует, что он содержит электролиты, поскольку он содержит ионы натрия, калия, магния и других веществ. Когда люди потеют, мы теряем ионы, необходимые для жизненно важных функций организма; чтобы восполнить их, нам нужно потреблять больше ионов, часто в виде раствора электролита.В организме человека электролиты имеют множество применений, в том числе помогают нейронам проводить электрические импульсы.
Когда люди потеют, мы теряем ионы, необходимые для жизненно важных функций организма; чтобы восполнить их, нам нужно потреблять больше ионов, часто в виде раствора электролита.В организме человека электролиты имеют множество применений, в том числе помогают нейронам проводить электрические импульсы.Растворы безэлектролитов
Неэлектролиты — это соединения, которые совсем не ионизируются в растворе. В результате растворы, содержащие неэлектролиты, не будут проводить электричество. Как правило, неэлектролиты в основном удерживаются вместе ковалентными, а не ионными связями. Типичным примером неэлектролита является глюкоза, или C 6 H 12 O 6 . Глюкоза (сахар) легко растворяется в воде, но, поскольку она не диссоциирует на ионы в растворе, считается неэлектролитом; поэтому растворы, содержащие глюкозу, не проводят электричество.
Показать источники Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Этот конкретный ресурс использовал следующие источники:
Сильные и слабые электролиты Учебное пособие по химии
Рабочие примеры: определение сильного или слабого электролита
Вопрос 1: Соляная кислота полностью диссоциирует в воде с образованием ионов водорода и ионов хлора.
Соляная кислота — сильный электролит или слабый электролит?
Решение:
(На основе подхода StoPGoPS к решению проблем.)
- Что вас просят сделать?
Определить, является ли соляная кислота сильным электролитом или слабым электролитом.
- Какие данные (информацию) вы указали в вопросе?
соляная кислота полностью диссоциирует в воде
- Какая связь между тем, что вы знаете, и тем, что вам нужно выяснить?
HCl (водн.) полностью диссоциирует в воде с образованием ионов водорода H + (водн.) и ионов хлорида Cl — (водн.
 )
) HCl (водн.) → H + (водн.) + Cl — (водн.)
Следовательно, в растворе много ионов. - Определите концентрацию соляной кислоты как электролита:
Соляная кислота, HCl (водн.) , полностью диссоциирует, поэтому в растворе много ионов, проводящих электричество, поэтому соляная кислота является сильным электролитом.
- Ваш ответ правдоподобен?
Используйте Рекомендации, чтобы проверить свой ответ:
Рекомендация (1): большинство кислот являются слабыми электролитами.
ЗА ИСКЛЮЧЕНИЕМ HCl (водн.) и некоторых других кислот, таких как HNO 3 (водн.) и H 2 SO 4 (водн.) , которые являются сильными кислотами и, следовательно, сильными электролитами
Следовательно, соляная кислота является сильным электролитом в соответствии с инструкциями.Поскольку ответ, который мы получаем из руководящих принципов, совпадает с ответом, который мы получаем с использованием информации о диссоциации HCl (водн.
 ) из вопроса, мы уверены, что наш ответ правильный.
) из вопроса, мы уверены, что наш ответ правильный. - Укажите свое решение проблемы «сильным или слабым электролитом является соляная кислота»:
Соляная кислота — сильный электролит.
Вопрос 2: Является ли водный раствор гидроксида натрия сильным электролитом или слабым электролитом?
Решение:
(На основе подхода StoPGoPS к решению проблем.)
- Что вас просят сделать?
Определить, является ли водный раствор гидроксида натрия сильным электролитом или слабым электролитом.
- Какие данные (информацию) вы указали в вопросе?
водный раствор гидроксида натрия: NaOH (водн.)
- Какая связь между тем, что вы знаете, и тем, что вам нужно выяснить?
Рекомендация (2): гидроксиды металлов группы 1 (щелочные) и металлов группы 2 (щелочно-земельные) являются сильными электролитами.
(Ba (OH) 2 является исключением)
Натрий — металл группы 1 (щелочной).
- Определите концентрацию гидроксида натрия как электролита:
Гидроксид натрия — сильный электролит, поскольку он является гидроксидом металла группы 1.
- Ваш ответ правдоподобен?
Гидроксид натрия, NaOH (s) , используется в очистителях канализации.
Это ионное твердое вещество, состоящее из ионов натрия Na + и гидроксид-ионов OH —.
При добавлении воды для образования водного раствора мы видим, что он растворяется, то есть решетка ионов разрушается, так что каждый ион полностью окружен водой, то есть гидроксид натрия полностью диссоциирует в воде:NaOH (водн.) → Na + (водн.) + OH — (водн.)
Следовательно, в растворе будет много ионов, проводящих электричество.
Следовательно, водный раствор гидроксида натрия является сильным электролитом.Поскольку ответ, который мы получаем, размышляя о диссоциации гидроксида натрия в воде, такой же, как ответ, который мы получаем с помощью Руководства, мы уверены, что наш ответ правильный.

- Укажите свое решение проблемы «гидроксид натрия — сильный или слабый электролит»:
Водный раствор гидроксида натрия — сильный электролит.
Вопрос 3: Хлорид натрия полностью диссоциирует в воде с образованием ионов натрия и ионов хлора.
Хлорид натрия — сильный электролит или слабый электролит?
Решение:
(на основе подхода StoPGoPS к решению проблем.)
- Что вас просят сделать?
Определите, является ли хлорид натрия сильным электролитом или слабым электролитом.
- Какие данные (информацию) вы указали в вопросе?
Натрия хлорид полностью диссоциирует в воде
- Какая связь между тем, что вы знаете, и тем, что вам нужно выяснить?
Хлорид натрия, NaCl (s) , представляет собой соль (получается нейтрализацией соляной кислоты гидроксидом натрия)
Если соль полностью диссоциирует, 100% диссоциация, в растворе много ионов.
NaCl (водн.) → Na + (водн.) + Cl — (водн.)
Чем больше ионов, тем лучше раствор проводит электричество.
- Определите концентрацию хлорида натрия как электролита:
Хлорид натрия — сильный электролит, потому что это соль, полностью диссоциирующая в воде.
- Ваш ответ правдоподобен?
Используйте инструкции, чтобы проверить свой ответ:
Рекомендация (3): большинство солей являются сильными электролитами.
Исключения: HgCl 2 и CdSO 4 — слабые электролиты.Хлорид натрия — сильный электролит, потому что это соль, не указанная в списке слабых солей.
Поскольку ответ, который мы получили при рассмотрении процентной диссоциации хлорида натрия, такой же, как и при рассмотрении руководящих принципов, мы уверены, что наш ответ правильный.
- Укажите свое решение проблемы «является ли хлорид натрия сильным или слабым электролитом»:
Хлорид натрия — сильный электролит.

Вопрос 4: Уксусная кислота (этановая кислота), CH 3 COOH, имеет небольшую константу диссоциации кислоты (K a = 1,8 × 10 -5 ).
Уксусная кислота (этановая кислота) — сильный электролит или слабый электролит?
Решение:
(на основе подхода StoPGoPS к решению проблем.)
- Что вас просят сделать?
Определите, является ли уксусная кислота сильным электролитом или слабым электролитом.
- Какие данные (информацию) вы указали в вопросе? Уксусная кислота
имеет небольшую константу диссоциации (K a мало)
- Какая связь между тем, что вы знаете, и тем, что вам нужно выяснить?
Если константа диссоциации кислоты, K a , мала, то диссоциация (ионизация) очень немногих молекул кислоты означает, что в растворе будет мало ионов.
Малая константа диссоциации означает, что в растворе мало ионов, проводящих электричество.
Положение равновесия для реакции диссоциации:CH 3 COOH (водн.) ⇋ CH 3 COO — (водн.) + H + (водн.)
лежит левее, то есть предпочтение отдается недиссоциированным молекулам. - Определите концентрацию уксусной кислоты как электролита:
Уксусная кислота — слабый электролит, поскольку ее константа диссоциации мала, что означает, что в растворе будет мало ионов, проводящих электричество.
- Ваш ответ правдоподобен?
Используйте Рекомендации, чтобы проверить свой ответ:
Рекомендация (1): большинство кислот являются слабыми электролитами.
Исключения (сильные электролиты): HCl (водн.) , HNO 3 (водн.) , H 2 SO 4 (водн.) , HClO 3 (водн.) , HClO 4 (водн. ) , HBr (водн.) и HI (водн.)
Уксусная кислота (этановая кислота, CH 3 COOH) не указана в качестве исключения, поэтому уксусная кислота является слабым электролитом.
Поскольку мы пришли к одному и тому же ответу, используя как малую константу диссоциации кислоты, так и Рекомендации, мы уверены, что наш ответ правильный.
- Укажите свое решение проблемы «уксусная кислота — сильный или слабый электролит»:
Уксусная кислота — слабый электролит.
1. Серная кислота — сильная полипротонная кислота.
Первая константа диссоциации очень велика, поэтому мы предполагаем, что реакция идет до завершения:
H 2 SO 4 (водн.) → HSO 4 — (водн.) + H + (водн.)
Вторая константа диссоциации намного меньше первой, поэтому реакция в котором HSO 4 — теряет протон, H + , не доходит до завершения, ионы находятся в равновесии с недиссоциированными молекулами кислоты:
HSO 4 — (водн.) ⇋ SO 4 2- (водн. ) + H + (водн.)
) + H + (водн.)
2.Молекулы воды в очень незначительной степени подвергаются самодиссоциации.
K w = 10 -14 при 25 ° C
То есть K w очень маленький.
Решения ICSE для химии 10 класса — электролиз
Решения ICSE для химии 10 класса — электролиз
Решения ICSE Решения Selina ICSE
APlusTopper.com предоставляет решения ICSE для химии 10 класса — Электролиз Глава 6 для экзаменов ICSE.Мы предоставляем пошаговые решения для решений ICSE Chemistry Class 10 Pdf. Вы можете загрузить учебники ICSE по химии для 10 класса с возможностью бесплатной загрузки в формате PDF.
Загрузить справочник формул для классов 9 и 10 ICSE
Краткие вопросы
Вопрос 1: Классифицируйте следующие вещества под тремя заголовками:
Сильные электролиты, Слабые электролиты, Неэлектролиты.
Уксусная кислота, хлорид аммония, гидроксид аммония, четыреххлористый углерод, разбавленная соляная кислота, ацетат натрия, разбавленная серная кислота.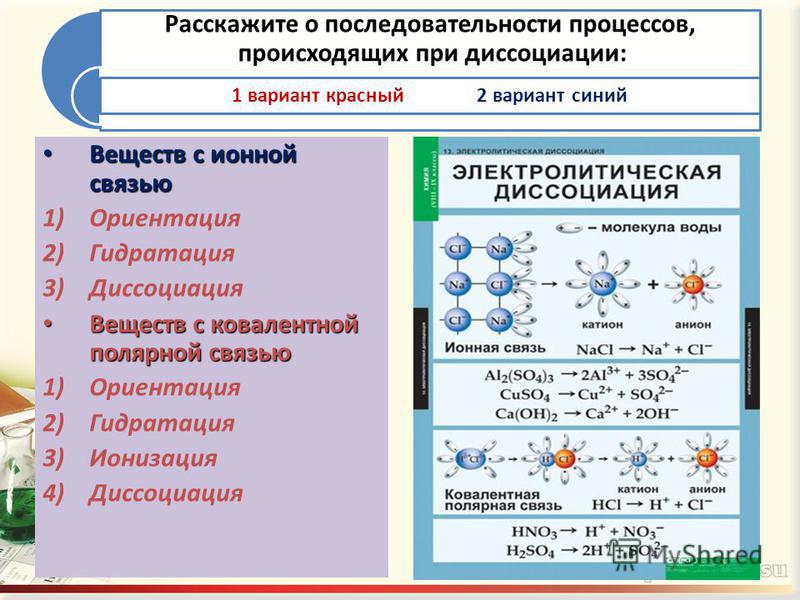
Ответ: Сильные электролиты — хлорид аммония, разбавленная соляная кислота, разбавленная серная кислота.
Слабые электролиты — гидроксид аммония, уксусная кислота, ацетаты натрия.
Неэлектролит — четыреххлористый углерод.
Вопрос 2: Как вы будете различать металлическую проводимость и электрическую проводимость?
Ответ:
| Металлическая проводимость | Электрическая проводимость |
| (i) За счет движения электронов. | Движением ионов. |
| (ii) Не включает передачу материи. | Он включает перенос вещества в виде ионов. |
| (iii) Никаких изменений химических свойств проводника. | Это связано с разложением электролита в результате химических реакций. |
| (iv) Увеличение сопротивления при повышении температуры. | Снижение сопротивления с повышением температуры. |
Вопрос 3: Различия между электролитической ячейкой и электрохимической ячейкой.
Ответ:
| Электролитическая ячейка | Электрохимическая ячейка |
| Это устройство (сосуд), в котором химические изменения происходят с помощью электроэнергии. | Это устройство, в котором электроэнергия вырабатывается в результате химических изменений. |
Вопрос 4: Различайте электрическую проводимость раствора сульфата меди и металлической меди.
Ответ: Различия между электропроводностью раствора сульфата меди и металлической меди:
| Раствор сульфата меди | Медь металлическая |
| Электрический ток протекает за счет потока ионов. | Электрический ток — это поток электронов. |
| Это водный раствор ионного соединения. | Это металл в твердом состоянии. |
| Сульфат меди претерпевает химические изменения. | Металлическая медь химически не изменяется. |
Вопрос 5: Выберите A, B, C или D в соответствии с описаниями (i) — (v) ниже. Некоторые алфавиты могут повторяться.
A. Неэлектролит
B. Сильный электролит
C. Слабый электролит
D. Металлический проводник
(i) Расплавленное ионное соединение
(ii) Тетрахлорид углерода
(iii) Алюминиевая проволока
(iv) Раствор, содержащий молекулы растворителя , молекулы растворенных веществ и ионы, образованные при диссоциации молекул растворенных веществ.
(v) Раствор сахара с молекулами сахара и молекулами воды.
Ответ: (i) B, (ii) A, (iii) D, (iv) C, (v) A.
Вопрос 6: Укажите три различия между атомом натрия и ионом натрия.
Ответ: (i) Атом натрия нейтрален по природе, а ион натрия — положительно заряженная частица.
(ii) Атом натрия активно взаимодействует с водой с выделением газообразного водорода, в то время как ион натрия не реагирует с водой.
(iii) Атом натрия имеет тенденцию терять электрон с образованием иона натрия с полным октетом во внешней оболочке.
Вопрос 7: Объясните, как электролиз является примером окислительно-восстановительной реакции.
Ответ: Окислительно-восстановительные реакции называются одновременными окислительно-восстановительными реакциями. В электродных реакциях положительно заряженные ионы (катионы) принимают электроны от катода с образованием нейтральных атомов, т. Е. При катодном восстановлении происходит восстановление. На аноде отрицательно заряженные ионы (анионы) теряют электроны с образованием нейтральных атомов, т.е. на аноде происходит окисление. Итак, электродные реакции означают также окислительно-восстановительные реакции.Следовательно, их также называют окислительно-восстановительными реакциями.
Вопрос 8: (i) Напишите уравнения, показывающие электролитическую диссоциацию:
(a) двух кислот (b) двух оснований.
(ii) При электролизе расплавленного хлорида натрия объясните, что именно происходит с электродами, и объясните, как проводится электричество?
Ответ: (i) (a) Кислоты:
H 2 SO 4 ⇌ 2H + + SO 4 2-
HNO 3 ⇌ H + + NO 3 —
(b) Основания:
NaOH ⇌ Na + + OH —
KOH ⇌ K + + OH —
(ii) Когда электричество проходит через плавленый хлорид натрия электролиз начинается следующим образом:
NaCl ⇌ Na + + Cl —
Na + + e — ⟶ Na (на катоде)
Cl — — e — ⟶ Cl
Cl + Cl ⟶ Cl 2 (На аноде)
Металлический натрий осаждается на катоде, а газообразный хлор выделяется на аноде. Электричество проводится с помощью свободных ионов натрия и хлорида, которые присутствуют в расплавленном хлориде натрия.
Электричество проводится с помощью свободных ионов натрия и хлорида, которые присутствуют в расплавленном хлориде натрия.
Вопрос 9: Как можно разрядить ионы Na + вместо ионов H + при электролизе раствора NaCl?
Ответ: При использовании катода, сделанного из движущейся ртути, ионы Na + разряжаются, а не ионы H + из-за природы электрода. Ртуть имеет сильную тенденцию к образованию амальгамы с: натрием
Na + + e — ⟶ Na
Na + Hg ⟶ Na / Hg
При растворении амальгамы натрия в воде происходит реакция
2Na / Hg + 2H 2 0 ⟶ 2NaOH + H 2 + Hg
Вопрос 10: Определенный металл, скажем M, не выделяет водород из разбавленной серной кислоты, но вытесняет медь из водного сульфата меди (II).Укажите наиболее вероятное место металла в электрохимическом ряду.
Ответ: Ряд активности получается, когда мы исследуем замену одного иона металла из его раствора другим металлом. Металл (M), который вытесняет медь из водного сульфата меди (II), занимает более высокое положение по сравнению с медью в ряду активности.
Металл (M), который вытесняет медь из водного сульфата меди (II), занимает более высокое положение по сравнению с медью в ряду активности.
Вопрос 11: M — это металл выше водорода в ряду активности, и его оксид имеет формулу M 2 O. Этот оксид при растворении в воде образует соответствующий гидроксид, который является хорошим проводником электричества.В приведенном выше контексте ответьте следующее:
(i) Какого рода комбинация существует между M и O?
(ii) Сколько электронов находится на внешней оболочке M?
(iii) Назовите группу, к которой принадлежит M.
(iv) Укажите реакцию, происходящую на катоде.
(v) Назовите продукт на аноде.
Ответ: (i) Электровалентная связь существует между M и O.
(ii) Один электрон находится во внешней оболочке.
(iii) M принадлежит к Первой группе.
(iv) M + + e — M (на катоде).
M + M ⟶ M 2
(v) Газообразный кислород выделяется на аноде.
Вопрос 12: Как вы будете электролизовать расплавленный раствор бромида свинца?
Ответ: Образуется расплавленный бромид свинца (PbBr 2 ) и ионы Br — . Положительные ионы свинца (Pb 2 ) движутся к катоду, получают два электрона и превращаются в атом свинца.
Pb 2 + + 2e — ⟶ Pb (Свинец)
Свинец осаждается на катоде.Отрицательный ион бромида мигрирует к аноду. Он теряет электрон и становится атомом бромида. Два атома брома присоединяются к молекуле брома. Он выделяется в виде газообразного брома.
Br — — e — ⟶ Br
Br + Br ⟶ Br 2
Вопрос 13: (i) Какие частицы присутствуют в неэлектролите?
(ii) Чем обусловлена проводимость металлов?
(iii) Каким должно быть физическое состояние бромида свинца, если он должен проводить электричество?
(iv) Какие частицы присутствуют в чистом бромиде свинца?
Ответ: (i) Молекулы присутствуют в неэлектролите.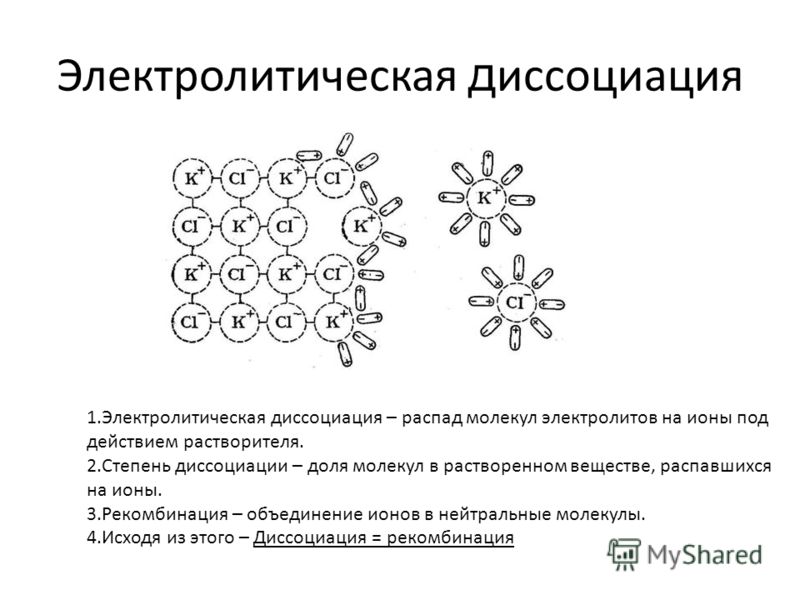
(ii) Электропроводность металлов обусловлена движением электронов.
(iii) Бромид свинца должен быть в расплавленном состоянии, если он должен проводить электричество.
(iv) Ионы свинца и ионы бромида присутствуют в чистом бромиде свинца в расплавленном состоянии.
Вопрос 14: (i) Когда проводится электролиз подкисленной воды:
(a) Каково отношение объема произведенного водорода к объему кислорода?
(b) Приведите уравнение для разряда ионов на катоде.
(ii) Для проведения так называемого «электролиза воды» в воду добавляют серную кислоту. Как добавление серной кислоты дает проводящий раствор?
Ответ: (i) (a) Соотношение 2: 1
(b) H + + e — ⟶ H; 2H + 2H ⟶ 2H 2
(ii) Добавление серной кислоты вызывает диссоциацию молекул воды на ионы [H + ] и [OH — ].
Вопрос 15: Что бы произошло, если бы при электролизе подкисленной воды использовать медные электроды вместо платиновых?
Ответ: На аноде: OH — и S0 3 2- мигрируют на анод, но ни один из них не разряжается, вместо этого атомы меди окисляются до Cu 2+ и входят в раствор
Cu ⟶ Cu 2+ + 2e —
Электролитический раствор станет синего цвета. Анод растворяется.
Анод растворяется.
На катоде: ионы H + будут мигрировать на катод и восстанавливаться. Таким образом, газ H 2 будет выделяться на катоде
2H + + 2e — ⟶ 2H ⟶ H 2
Позже, когда раствор станет синим из-за образования ионов Cu ++ , Cu Ионы ++ будут разряжены на ионы 2H + , поскольку они менее электроположительны
Cu 2+ + 2e — ⟶ Cu ↓
Вопрос 16: Во время электролиза водного сульфата меди между медью электродов, ионы сульфата и гидроксила остаются как ионы-наблюдатели.
Ответ: Во время электролиза водного раствора сульфата меди с использованием медных электродов два аниона OH —. И S0 4 2- мигрируют к аноду, но ни один из них не разряжается, потому что медь анода растворяется. в растворе образуются ионы меди и электроны. Следовательно, ионы OH – и S0 4 2– остаются в качестве ионов-наблюдателей./001.jpg)
Вопрос 17: Следующие вопросы относятся к электролизу раствора сульфата меди с медными электродами.
(i) Сравните изменение массы катода с изменением массы анода.
(ii) Что происходит, когда происходит электролиз водного раствора сульфата меди между платиновым электродом.
(iii) Каково практическое применение электролиза раствора сульфата меди? Кратко опишите одно такое приложение.
Ответ: (i) Масса катода увеличивается, а масса анода уменьшается из-за осаждения чистой меди на катоде.
(ii) Синий цвет сульфата меди обусловлен присутствием ионов меди (Cu ++ ).Ионы Cu ++ разряжаются на катоде и осаждаются в виде розоватой металлической меди, а ионы OH — разряжаются на аноде. Электролит состоит из ионов водорода и сульфата, которые образуют бесцветную серную кислоту.
(iii) Электролиз раствора сульфата меди используется для очистки меди с использованием пластины из чистой меди в качестве катода и пластины из нечистой меди в качестве анода.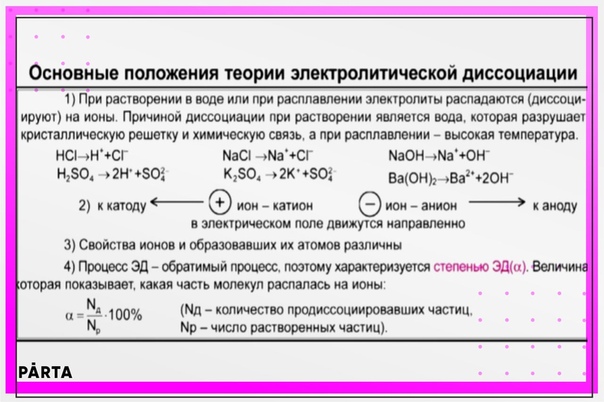
Вопрос 18: Во время электролиза раствора сульфата меди (II) с использованием платины в качестве катода и углерода в качестве анода:
(i) Что вы наблюдаете на катоде и на аноде?
(ii) Какое изменение наблюдается в электролите?
(iii) Запишите реакции на катоде и аноде.
Ответ: (i) На катоде красные блестящие металлические отложения.
На аноде видны выходящие пузырьки бесцветного газа без запаха.
(ii) Цвет электролита постепенно бледнеет от синего до бесцветного.
(iii) Реакция на катоде:
Cu 2+ + 2e — ⟶ Cu
Реакция на аноде:
OH — — 1e — ⟶ OH
4OH ⟶ 2H 2 O + O 2 ↓
Вопрос 19: Объясните, как блекнет синий цвет электролита при электролизе раствора CuSO 4 ?
Ответ: Синий цвет электролита обусловлен наличием в нем ионов меди.Как есть электролиз. При этом ионы меди разряжаются на катоде.
Cu 2+ + 2e — ⟶ Cu
Однако ионы меди не попадают в электролит с анода. Таким образом, концентрация ионов меди продолжает уменьшаться. Это приводит к выцветанию синего цвета. Когда ионы меди полностью заканчиваются, электролит становится бесцветным.
Реакция катода:
H + + e — ⟶ H
H + H ⟶ H 2
Реакция анода:
OH — — 1e — ⟶ OH
4OH ⟶ 2H 2 O + O 2 (g)
Вопрос 20: Объясните, как синий цвет электролита остается неизменным при электролизе водного сульфата меди?
Ответ: Уменьшение веса медного анода равно увеличению веса медного катода.
Из приведенных выше уравнений можно вывести, что для каждого разряда Cu 2+ на катоде атом меди ионизируется от анода с образованием иона Cu 2+ .
При этом концентрация ионов меди в электролите остается неизменной. Поскольку синий цвет электролита обусловлен присутствием ионов Cu ++ , он не меняется.
Вопрос 21: Укажите тип присутствующих ионов, полученные продукты и электродные реакции, которые происходят при электролизе следующих веществ:
(i) Расплавленный бромид свинца между стальным катодом и графитовым анодом.
(ii) Вода, подкисленная серной кислотой между платиновыми электродами.
(iii) Водный сульфат меди между медными электродами.
(iv) Водный сульфат меди между медным катодом и платиновым анодом.
Ответ:
Вопрос 22: В отношении гальваники ответьте следующим образом:
(i) Почему изделия покрываются гальваническим покрытием?
(ii) Почему небольшой ток, пропускаемый в течение более длительного периода, предпочтительнее сильного тока в течение более короткого периода?
(iii) Почему на гальваническое изделие делается катод?
(iv) Почему используется постоянный ток?
Ответ: (i) На изделия наносится гальваническое покрытие по следующим причинам:
(a) Для предотвращения коррозии.
(b) Для улучшения внешнего вида металлических изделий.
(ii) Чтобы получить однородное и гладкое покрытие из высококачественного металла, следует использовать небольшой ток — в течение более длительного времени.
(iii) Изделие, на которое наносится гальваническое покрытие, всегда помещают на катод, потому что металл всегда осаждается на катоде.
(iv) Для получения гладкого покрытия используется постоянный ток, и его фаза всегда одинакова.
Вопрос 23: Как на ложку наносится гальваническое покрытие серебром?
Ответ: В стакан берут раствор нитрата серебра.В раствор погружают серебряную проволоку и ложку, которую нужно покрыть серебром. Серебряный провод соединен с положительной клеммой батареи, которая действует как анод, а ложка соединена с отрицательной клеммой батареи, которая действует как катод.
Когда электрический ток пропускается через раствор нитрата серебра, происходит электролиз, и серебро осаждается в виде тонкой тонкой пленки на поверхности ложки. Ложка покрыта серебром и выглядит как серебряная ложка.
Ложка покрыта серебром и выглядит как серебряная ложка.
Вопрос 24: Элемент X — металл с валентностью 2.
Элемент Y — неметалл с валентностью 3.
(i) Напишите уравнения, чтобы показать, как X и Y образуют ионы.
(ii) Если Y — двухатомный газ, напишите уравнение для прямой комбинации X и Y с образованием соединения.
(iii) Напишите два применения электролиза, в которых масса анода уменьшается.
(iv) Если соединение, образованное между X и Y, расплавляется и через расплавленное соединение проходит электрический ток, элемент X будет получен в… и Y в… электролитической ячейки.
(укажите пропущенные слова.)
Ответ: (i) X — 2e — ⟶ X 2+
Y + 3e — ⟶ Y 3-
(ii) 3X +2 + 2Y -3 ⟶ X 3 Y 2
(iii) (1) Гальваника металлов.
(2) Электролитическое рафинирование металлов.
(iv) Если соединение, образованное между X и Y, и электрический ток проходит через расплавленное соединение, элемент X будет получен на катоде, а Y — на аноде электролитической ячейки.
Вопрос 25: Г-н Раму хочет покрыть свою цепочку для ключей никелем, чтобы предотвратить ржавчину. Для этого гальванического покрытия:
(i) Назовите электролит
(ii) Назовите катод
(iii) Назовите анод
(iv) Назовите реакцию на катоде
(v) Назовите реакцию на аноде.
Ответ: (i) Сульфат никеля (ii) Брелок для ключей
(iii) Пластина из чистого никеля
(iv) Ni 2+ + 2e — ⟶ Ni
(v) Ni — 2e — ⟶ Ni 2+ .
Вопрос 26: Три разных электролизера A, B и C соединены в отдельных цепях. Электролитическая ячейка А содержит раствор хлорида натрия. Когда цепь замкнута, лампочка в цепи ярко светится. Электролитическая ячейка B содержит раствор уксусной кислоты, и в этом случае лампочка в цепи горит тускло. Электролитическая ячейка C содержит раствор сахара, и колба не горит. Объясните причину каждого из этих наблюдений.
Ответ: В ячейке A: хлорид натрия, являющийся сильным электролитом, полностью диссоциирует, и поэтому ток течет лучше.
В ячейке B: уксусная кислота, являясь слабым электролитом, ионизируется только частично, и поэтому протекает только слабый ток.
В ячейке C: сахар, являющийся ковалентным соединением, вообще не ионизируется, и поэтому ток не течет.
Вопросы на основе рисунков / таблиц
Вопрос 1:
(i) Назовите катод и анод, используемые во время гальваники серебра.
(ii) Назовите электролит, используемый в этих процессах.
(iii) Дайте возможность протекать реакциям диссодации.
(iv) Приведите реакции, происходящие на катоде и аноде.
(y) Общая сила ионов серебра в реакции остается постоянной. Почему?
Ответ: (i) Катод: хорошо очищенное изделие, например, медная чашка.
Анод: пластина или серебряный стержень.
(ii) аргентоцианид натрия (Na [Ag (CN) 2 ]) и синильная кислота (HCN).
(v) Общая сила ионов серебра в электролите не меняется, поскольку количество ионов Ag + , поступающих в электролит, равно количеству ионов Ag + , разряженных на катоде.
Вопрос 2: Раствор сульфата меди подвергают электролизу с помощью медных электродов. Изучите приведенную ниже схему и ответьте на следующий вопрос:
(i) Какой электрод слева или справа от вас называется окислительным электродом и почему?
(ii) Напишите уравнение, представляющее протекающую реакцию.
(iii) Укажите два соответствующих наблюдения для указанной выше реакции электролиза.
Ответ: (i) Электрод с левой стороны является окислительным электродом, потому что атомы меди теряют электроны на этом электроде.
(ii) Cu — 2e — ⟶ Cu 2+
(iii) Красновато-коричневая металлическая медь осаждается на катоде, а синий цвет водного раствора сульфата меди (II) остается неизменным.
Вопрос 3: (i) Изучите приведенную ниже схему и ответьте на следующие вопросы:
(a) Назовите электроды A и B.
(b) Какой электрод является окисляющим электродом?
(ii) Полоску меди помещают в четыре различных бесцветных солевых раствора. Это KNO 3 , AgNO 3 , Zn (NO 3 ) 2 , Ca (NO 3 ) 2 . Какое из решений окончательно станет синим?
Это KNO 3 , AgNO 3 , Zn (NO 3 ) 2 , Ca (NO 3 ) 2 . Какое из решений окончательно станет синим?
(iii) Напишите уравнения реакций, протекающих на катоде и аноде при электролизе подкисленной воды.
Ответ: (i) (a) A — Анод
B — Катод
(b) A
(ii) Раствор AgNO 3
Вопрос 4: Изучите данный рисунок и ответьте на следующий вопрос :
(i) Почему кварцевый тигель используется в этом типе электролиза?
(ii) Какой анод предпочтительнее и почему?
(iii) Почему тигель нагревается снаружи?
(iv) Напишите уравнения реакции, протекающей на катоде и аноде.
Ответ: (i) Кремнезем не реагирует. Он может выдерживать высокие температуры и почти не проводит электричество.
(ii) Графитовый анод предпочтителен, поскольку на него не действуют пары реактивного брома.
(iii) Тигель нагревается снаружи, чтобы бромид свинца оставался в расплавленном состоянии. Чтобы ионы стали свободными.
Чтобы ионы стали свободными.
Вопрос 5: Электролитический комплекс — это установка, в которой используются два платиновых электрода и водный раствор сульфата меди (II).
(i) Нарисуйте помеченную схему электролитической ячейки.
(ii) Назовите ионы, присутствующие в клетке.
(iii) Назовите ионы, мигрирующие к аноду.
(iv) Назовите ios, мигрирующие к катоду.
(v) Назовите ионы, которые не будут разряжаться на электродах во время электролиза.
(vi) Запишите реакцию на катоде.
(vii) Запишите реакцию на аноде.
(viii) Назовите ионы-наблюдатели в растворе.
(ix) Почему подкисляется раствор электролита.
Ответ: (i)
(ii) В ячейке присутствуют ионы: Cu 2+ + H + , SO 4 2- и OH —.
(iii) Ионы, мигрирующие к аноду, — это SO 4 2- и OH —.
(iv) Ионы, мигрирующие к катоду, — это Cu 2+ .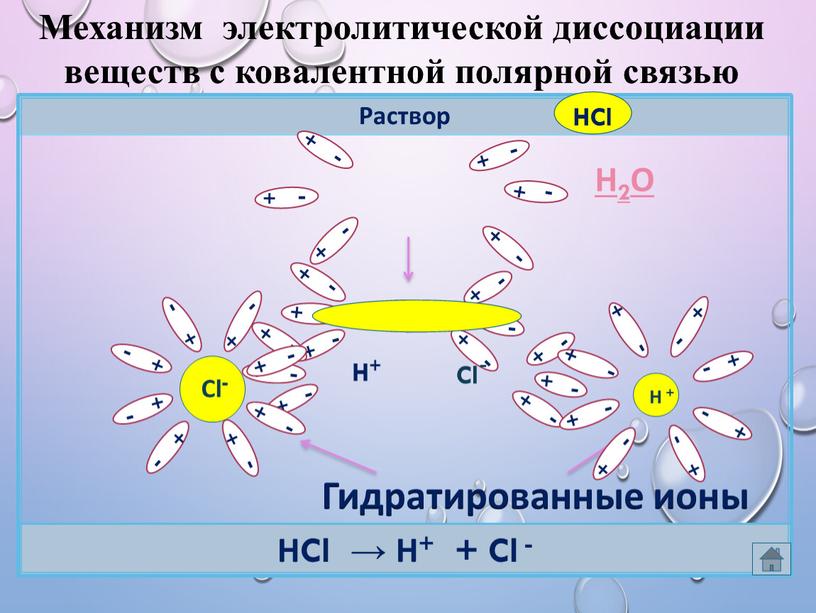
(v) Ионы не будут разряжаться на электроде во время электролиза: H + и OH —.
(viii) Разделительные ионы, присутствующие в растворе: SO 4 2- и OH —.
(ix) Для увеличения электропроводности электролита.
Вопрос 6: Насыщенный водный раствор хлорида меди (II) подвергается электролизу с использованием графитового анода и медного катода, как показано на схеме, приведенной ниже:
(i) Назовите ионы, которые будут мигрировать на катод.
(ii) Назовите ионы, которые будут мигрировать на анод.
(iii) Какой ион может разрядиться на катоде и почему?
(iv) Напишите ионное уравнение для реакции, протекающей на катоде.
(v) Какой ион может разряжаться на аноде и почему?
(vi) Напишите ионное уравнение реакции, протекающей на аноде.
(vii) Если электрический ток пропускается в течение очень длительного времени, изменение цвета состояния электролита. Назовите одну причину изменения.
(viii) Назовите одну причину использования графитового анода, а не медного анода.
(ix) Назовите газ, выделяющийся на катоде после изменения цвета электролита.
Ответ: (i) Ионы меди (Cu 2+ ) и ионы водорода H + мигрируют на катод.
(ii) Ионы хлорида (Cl — ) и гидроксильные ионы OH — мигрируют к аноду.
(iii) Ионы меди (Cu 2+ ), вероятно, разряжаются на катоде, потому что их положение ниже, чем ионы водорода H + в электрохимическом ряду.
(iv) Cu 2+ + 2e — ⟶ Cu
(v) Гидроксильные ионы (OH — ), вероятно, разряжаются на аноде, поскольку их положение ниже, чем хлорид-иона (Cl — ) в электрохимический ряд.
(vi) 4OH — — 4e — ⟶ 2H 2 O + O 2 (г)
(vii) Электролит обесцвечивается.Это связано с тем, что синий цвет электролита обусловлен присутствием ионов Cu 2+ . По мере разряда ионов Cu 2+ на катоде их концентрация в электролите уменьшается. Таким образом постепенно тускнеет синий цвет.
По мере разряда ионов Cu 2+ на катоде их концентрация в электролите уменьшается. Таким образом постепенно тускнеет синий цвет.
(viii) В такой ситуации атомы меди на медном аноде ионизируются и попадают в электролит. Таким образом, размер медного анода постепенно уменьшается. В случае графитового анода это невозможно.
(ix) На катоде выделяется газообразный водород.
Вопросы, основанные на рассуждениях
Вопрос 1: Почему добавки, основания и соли классифицируются как электролиты?
Ответ: Кислоты, основания и соли классифицируются как электролиты, потому что эти соединения диссоциируют на ионы, проводят электричество и одновременно подвергаются химическому разложению.
Вопрос 2: Металлы, такие как калий, кальций, натрий и т. Д., Можно извлечь только электролизом.
Ответ: Металлы, такие как K, Ca, Na и т. Д., Могут быть извлечены только электролизом, потому что обычные восстановители, такие как кокс, монооксид углерода, водород, не обеспечивают достаточной энергии для разрыва ионных связей между активными металлами и их хлоридами. или оксиды.
или оксиды.
Вопрос 3: Разбавленные кислоты — сильные электролиты. Почему?
Ответ: Разбавленные кислоты производят большое количество ионов гидроксония, поэтому они ведут себя как сильные электролиты.
Вопрос 4: Морская вода — сильный электролит. Почему?
Ответ: Морская вода — сильный электролит, потому что растворенный в ней хлорид натрия полностью диссоциирует на свободные подвижные ионы.
Na + Cl- Na + + Cl —
Вопрос 5: Медь является хорошим проводником электричества, но не является электролитом. Почему?
Ответ: При металлической проводимости химические свойства меди сохраняются, поскольку она не подвергается химическому разложению.Поскольку поток электричества производит только тепло и энергию, а новые продукты не образуются, металлическая медь, таким образом, является хорошим проводником электричества, но не является электролитом.
Вопрос 6: Раствор ионного соединения является электролитом, а раствор ковалентного соединения не является электролитом?
Ответ: В растворе ионного соединения есть свободные ионы, которые могут мигрировать на катод и анод и разряжаться. Таким образом, раствор ионного соединения является хорошим проводником электричества и, следовательно, электролитом.
Однако раствор ковалентного соединения состоит только из молекул и не имеет свободных ионов, которые могли бы мигрировать на катод или анод. Следовательно, это не электролит.
Вопрос 7: Объясните, почему соляная кислота является проводником электричества?
Ответ: Соляная кислота диссоциирует на ионы в водном растворе следующим образом:
HCl ⇌ H + + Cl —
Когда через водный раствор HCl пропускается ток, ионы движутся к своим электродам.Таким образом, соляная кислота является проводником электричества.
Вопрос 8: Проводит ли воск электричество? Обоснуйте свой ответ.
Ответ: Нет, воск не проводит электричество, потому что воск, являясь ковалентным соединением, не имеет положительно или отрицательно заряженных ионов, которые нельзя ослабить нагреванием или в водном растворе. Следовательно, из-за отсутствия свободных ионов воск не проводит электричество.
Вопрос 9: Ртуть является жидкостью и позволяет течь электричеству, но не является электролитом.
Ответ: Электролит — это вещество, которое при растворении в воде распадается на положительно и отрицательно заряженные ионы. Но ртуть — это металл, поэтому, растворяясь в воде, она не может распадаться на катионы и анионы. Когда электрический ток проходит через ртуть, она не подвергается разложению, и новое вещество не образуется. Электрический ток проходит через ртуть из-за наличия свободных электронов в ее предпоследней оболочке, а не из-за образования ионов.
Следовательно, ртуть — это металлический проводник, а не электролит.
Вопрос 10: Раствор тростникового сахара не проводит электричество, но раствор хлорида натрия является хорошим проводником.
Ответ: Раствор сахарного тростника представляет собой ковалентное соединение. Когда он растворяется в воде, он не диссоциирует с образованием свободных ионов, которые могут мигрировать на катод или анод. Следовательно, сахарный раствор — плохой проводник электричества. Раствор хлорида натрия в основном состоит из свободных ионов натрия и хлорида, которые могут мигрировать на положительно заряженные электроды.Следовательно, раствор хлорида натрия является хорошим проводником электричества.
Вопрос 11: Почему синий цвет раствора CuSO 4 медленно исчезает при погружении в него железного стержня?
Ответ: Когда железный стержень погружается в раствор CuSO 4 , железо вытесняет медь из CuSO 4 с образованием FeSO 4 светло-зеленого цвета.
Вопрос 12: Во время электролиза высокое напряжение не приветствуется.Почему ?
Ответ: Во время электролиза высокое напряжение не приветствуется, потому что электролитическая проводимость увеличивается с повышением температуры, т. Е. Снижается сопротивление. Повышение сопротивления можно получить только при подаче низкого напряжения во время электролиза.
Таким образом, в качестве восстановителя подходит только электричество, которое обеспечивает неограниченное количество энергии для легкого разрыва ионных связей.
Вопрос 13: При электролизе концентрированной серной кислоты лампа светится очень тускло, но при разбавлении лампа светится ярко.Почему ?
Ответ: Концентрированная (99%) серная кислота ведет себя как слабый электролит, поскольку в ней очень мало ионов гидроксония. Но при добавлении в воду он становится разбавленным и производит большое количество ионов гидроксония. Теперь он ведет себя как более сильный электролит, поэтому лампа ярко светится.
Теперь он ведет себя как более сильный электролит, поэтому лампа ярко светится.
Вопрос 14: Почему электролиз подкисленной воды считается примером электролиза?
Ответ: Это потому, что количество серной кислоты не меняется при электролизе воды.Серная кислота просто помогает увеличить проводимость воды.
Вопрос 15: Почему воду следует подкислять перед проведением электролиза воды?
Ответ: Это происходит потому, что вода не является электролитом, поэтому она может быть электролитически разложена путем непрерывного удаления ионов H + и OH —, поскольку пренебрежимо малая ионизация воды дает H + и OH . — ионов, которые рекомбинируют с образованием молекулы воды, затем ионизируется другая молекула.Для удаления этих ионов используется серная кислота.
Вопрос 16: Гидроксильный (OH — ) ион в ряду активности ниже, чем хлорид-ион.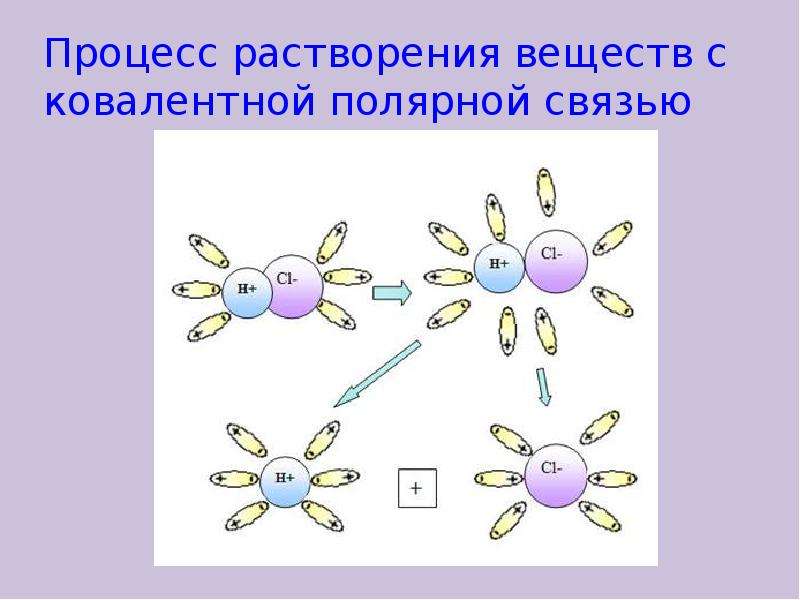 Тем не менее, когда концентрированный раствор соляной кислоты подвергается электролизу, гидроксильный ион не выделяется.
Тем не менее, когда концентрированный раствор соляной кислоты подвергается электролизу, гидроксильный ион не выделяется.
Ответ: Если электролит имеет гораздо более высокую концентрацию ионов, которые выше в электрохимическом ряду, чем те, которые ниже, то более высокий разряжается, а не более низкий.Концентрированная соляная кислота, являющаяся сильным электролитом, полностью диссоциирует с образованием ионов H + и Cl —. Вода меньше диссоциирует на ионы H + и OH —. Таким образом, концентрация хлорид-иона больше по сравнению с ионом OH —, и, следовательно, хлорид-ион выделяется предпочтительнее, чем ион OH —.
Балансировка / запись химических уравнений
Вопрос 1: Напишите уравнения для реакций, происходящих на катоде и аноде во время электролиза:
1.Подкисленный раствор сульфата никеля с никелевым электродом.
2. Подкисленный раствор медного купороса с медным электродом.
3. Подкисленный раствор медного купороса с платиновым электродом.
4. Подкисленная вода с инертным электродом.
5. Расплав бромистого свинца с инертными электродами.
6. Гальваника ложки серебром.
Ответ:
Вопрос 2: Заполните и сбалансируйте следующие уравнения:
Ответ:
Дополнительные ресурсы
Теория Аррениуса электролитической диссоциации | Закон Ома | Закон массового действия | Теплота нейтрализации | Ионная реакция | Коллигативные свойства
Чтобы объяснить свойства электролитических растворов, Аррениус в 1884 году выдвинул всеобъемлющую теорию, известную как теория электролитической диссоциации или ионная теория.
Электролит при растворении в воде распадается на два типа заряженных частиц, одна из которых несет положительный заряд, а другая — отрицательный.
 Эти заряженные частицы называются ионами. Положительно заряженные ионы называются катионами, а отрицательно заряженные — анионами.
Эти заряженные частицы называются ионами. Положительно заряженные ионы называются катионами, а отрицательно заряженные — анионами.
В своей современной форме теория предполагает, что твердые электролиты состоят из ионов, которые удерживаются вместе за счет электростатических сил притяжения.Когда электролит растворяется в растворителе, эти силы ослабляются, и электролит подвергается диссоциации на ионы. Ионы сольватированы.
Процесс разделения молекул электролита на ионы называется ионизацией . Доля от общего числа молекул, присутствующих в растворе в виде ионов, известна как степень ионизации или степень диссоциации. Обозначается номером
.Было замечено, что все электролиты не ионизируются в одинаковой степени.
Некоторые из них почти полностью ионизированы, а другие слабо ионизированы. Степень ионизации зависит от ряда факторов.Ионы, присутствующие в растворе, постоянно повторно объединяются, образуя нейтральные молекулы, и, таким образом, существует состояние динамического равновесия между ионизированными, ионизированными и неионизированными молекулами, то есть AB A + + B —
Применение закона действия масс к вышеупомянутому равновесию [A + ] [B — ] / [AB] = K
K известен как константа ионизации.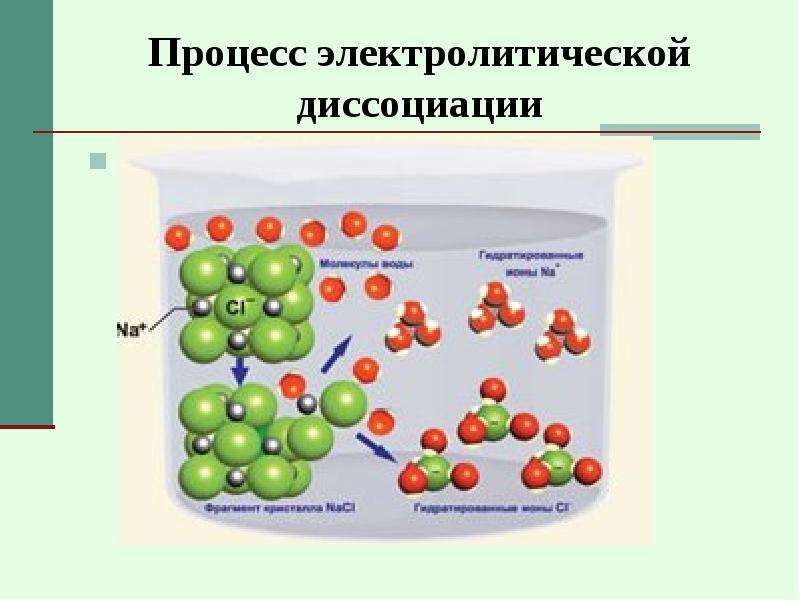 Электролиты с высоким значением K называются сильными электролитами, а электролиты с низким значением K — слабыми электролитами.
Электролиты с высоким значением K называются сильными электролитами, а электролиты с низким значением K — слабыми электролитами.Когда через раствор электролита пропускается электрический ток, положительные ионы (катионы) движутся к катоду, а отрицательные ионы (анионы) движутся к аноду и разряжаются, т. Е. Происходит электролиз.
Ионы разряжаются всегда в эквивалентных количествах, независимо от их относительной скорости.Электролитические растворы всегда нейтральны по своей природе, поскольку полный заряд одного набора ионов всегда равен полному заряду другого набора ионов.Однако не обязательно, чтобы количество двух наборов ионов всегда было одинаковым.
AB A + + B —
NaCl Na + + Cl —
(Оба иона равны)
AB 2 A 2+ + 2B —
BaCl 2 Ba 2+ + 2Cl —
(Анионы вдвое больше, чем катионы)
A 2 B 2a + + B 2-
Na 2 SO 4 2 Na + +
(Анионы вдвое больше, чем катионы)
Свойства электролитов в растворе — это свойства ионов, присутствующих в растворе.
 Например, кислый раствор всегда содержит ионы H + , в то время как основной раствор содержит ионы OH — , а характерные свойства растворов — это свойства ионов H — и ионов OH — соответственно.
Например, кислый раствор всегда содержит ионы H + , в то время как основной раствор содержит ионы OH — , а характерные свойства растворов — это свойства ионов H — и ионов OH — соответственно.Ионы действуют как молекулы, понижая температуру замерзания, повышая температуру кипения, понижая давление пара и устанавливая осмотическое давление.
Электропроводность раствора электролита зависит от природы и количества ионов, так как ток проходит через раствор за счет движения ионов.
Имеется большое количество экспериментальных наблюдений, подтверждающих теорию Аррениуса. Некоторые из них приведены ниже:
- Ионы, присутствующие в твердых электролитах
Рентгеноструктурные исследования показали, что электролиты состоят из ионов. Например, кристалл NaCl содержит не элементы NaCl, а ионы Na + и Cl — . Каждый ион Na + окружен шестью ионами Cl — , а каждый ион Cl — , в свою очередь, окружен шестью ионами Na + и Cl — . Ионные соединения в расплавленном состоянии ведут себя как хорошие проводники. Это может быть возможно только в том случае, если ионы уже присутствуют в ионных твердых телах.
Каждый ион Na + окружен шестью ионами Cl — , а каждый ион Cl — , в свою очередь, окружен шестью ионами Na + и Cl — . Ионные соединения в расплавленном состоянии ведут себя как хорошие проводники. Это может быть возможно только в том случае, если ионы уже присутствуют в ионных твердых телах.
Электролитические растворы, такие как металлические проводники, подчиняются закону Ома, т. Е. Сила тока в проводнике прямо пропорциональна разности потенциалов (E), приложенной к проводнику, и обратно пропорциональна сопротивлению проводника. Математически, I = E / R
Это возможно только в том случае, если ионы уже присутствуют в растворе, и никакая часть тока не имеет только направленного воздействия на ионы.
- Ионная реакция
Доказательством существования ионов в водных растворах электролитов являются хорошо известные реакции неорганической химии.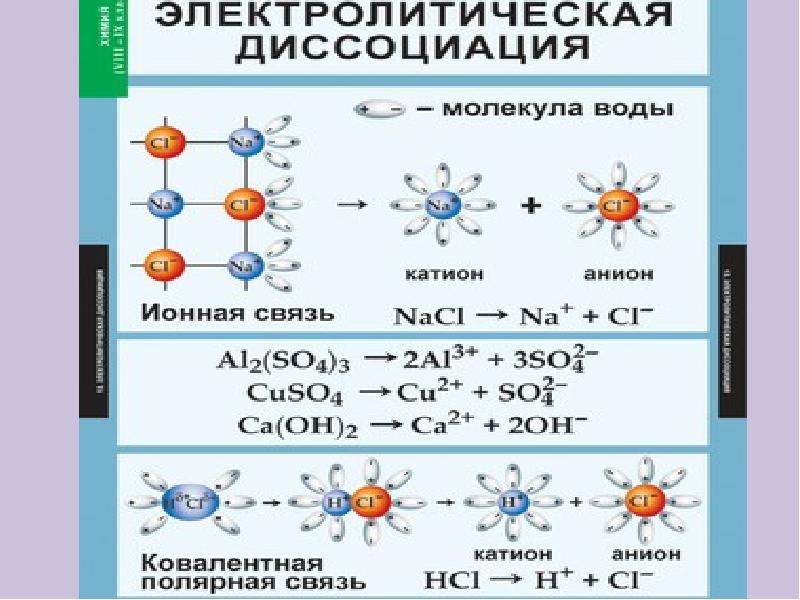 Белый осадок хлорида серебра получается всякий раз, когда ионы Ag + вступают в контакт с ионами хлорида.
Белый осадок хлорида серебра получается всякий раз, когда ионы Ag + вступают в контакт с ионами хлорида.
Ag + + Na + Cl — → AgCl + Na + + NO 3 —
Но не происходит осаждения, когда раствор AgNO 3 добавляется к CCl 4 , CHCl 3 или C 2 H 5 Cl, поскольку эти вещества, не являясь электролитами, не выделяют ионы Cl — в растворе. .
Кислота, которая дает все тесты на ионы H + в водном растворе, не дает одинаковых тестов при растворении в любом органическом растворителе, потому что ионизация кислоты не происходит в обычной реакции.
- Теплота нейтрализации
Когда один грамм эквивалента сильной кислоты нейтрализуется одним граммовым эквивалентом сильного основания, выделяемое тепло всегда одно и то же, то есть 13,7 ккал. Это можно объяснить на основе теории Аррениуса, согласно которой кислота доставляет ионы H + , а основные ионы OH — при растворении в воде, и процесс нейтрализации включает обычную реакцию.
H + + OH — H 2 O + 13.7 ккал.
Таким образом, теплота нейтрализации фактически является теплотой образования H 2 O из ионов H + и OH — .
- Аномальные коллигативные свойства
Ненормальное поведение по отношению к коллигативным свойствам, наблюдаемое в случае электролитов, можно объяснить на основе ионной теории. Когда электролит растворяется в воде, количество молекул, фактически растворенных в результате ионизации.Фактор не может Хоффа,
всегда больше единицы, то есть i = 1 + (n-1) , где n — количество ионов, образующихся в результате ионизации одной молекулы электролита, а ‘- степень ионизации.
Цвет электролитов в растворе. Если таковые имеются, из-за их ионов, CuSO 4 в растворе имеет синий цвет из-за присутствия ионов Cu 2+ . Перманганат калия (KMnO 4 ) имеет фиолетовый цвет в растворе из-за присутствия ионов.
Перманганат калия (KMnO 4 ) имеет фиолетовый цвет в растворе из-за присутствия ионов.
- Объяснение некоторых других явлений
Ионная теория дает удовлетворительные объяснения различных явлений, таких как электролиз, проводимость, гидролиз солей, произведение растворимости и т. Д.
Закон разбавления Оствальда, основанный на теории Аррениуса, не применим к сильным электролитам.
Сильные электролиты проводят электричество под напряжением, т.е.е., в отсутствие воды. это противоречит теории Аррениуса, согласно которой присутствие растворителя является обязательным для ионизации.
Теория Аррениуса предполагает независимое существование ионов, но не учитывает факторы, влияющие на подвижность ионов.
Степень ионизации электролита в растворе зависит от следующих факторов:
Когда ионизируемые части молекулы вещества удерживаются в большей степени ковалентной связью, чем электровалентной связью, в раствор поступает меньше ионов. Такие вещества называют слабыми электролитами. H 2 S, HCN, NH 4 OH, CH 3 COOH являются примерами этого класса. NaCl, Ba (NO 3 ) 2 , KOH и т. Д. Являются сильными электролитами, в которых перенос электронов кажется более или менее полным, при растворении сразу же выделяются ионы. Сильные электролиты почти полностью ионизируются в растворе.
Такие вещества называют слабыми электролитами. H 2 S, HCN, NH 4 OH, CH 3 COOH являются примерами этого класса. NaCl, Ba (NO 3 ) 2 , KOH и т. Д. Являются сильными электролитами, в которых перенос электронов кажется более или менее полным, при растворении сразу же выделяются ионы. Сильные электролиты почти полностью ионизируются в растворе.
Основная функция растворителя — ослабить электростатические силы притяжения между двумя ионами и разделить их.Сила притяжения, удерживающая ионы вместе в любой среде, выражается как
.F = 1 / (К) (q 1 q 2 ) / r 2
где K — диэлектрическая проницаемость среды.
Любой растворитель с высоким значением диэлектрической проницаемости обладает способностью разделять ионы. Вода считается лучшим растворителем, так как у нее самая высокая диэлектрическая проницаемость. Диэлектрические постоянные некоторых растворителей приведены ниже при температуре 25 0 C.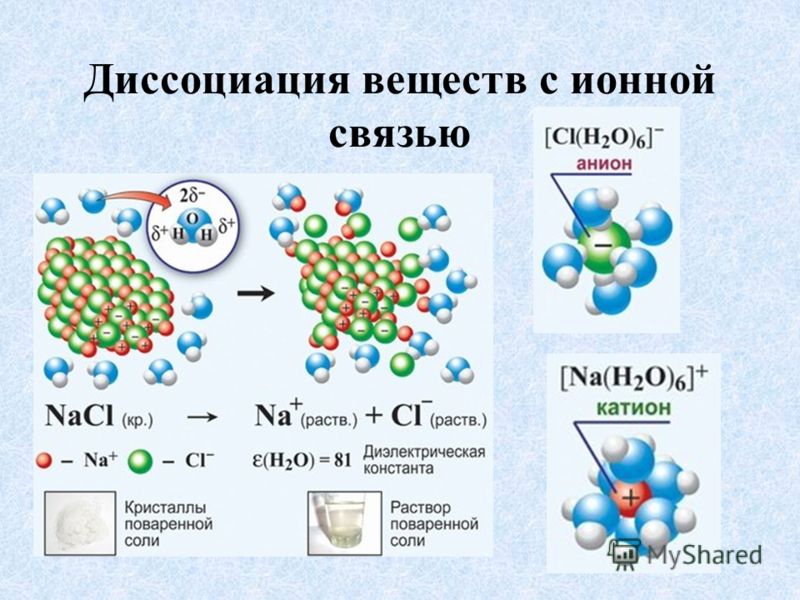
Растворитель | Диэлектрическая постоянная |
Вода | 81 |
Метиловый спирт | 35 |
Этиловый спирт | 27 |
Ацетон | 21 |
Степень ионизации электролита обратно пропорциональна концентрации его раствора.Таким образом, степень ионизации увеличивается с увеличением разбавления раствора, т. Е. С уменьшением концентрации раствора.
Степень ионизации увеличивается с повышением температуры. Это связано с тем, что при более высокой температуре скорость молекул увеличивается, что преодолевает силы притяжения между ионами.
Вопрос 1: Процесс расщепления молекул электролита на ионы называется ..
а.ионизация
г. электролиз
г. сольватация
г. протонирование
Вопрос 2: Цвет электролитов в растворе обусловлен ..
а. ионы
г. сольватация
г. электролиз
г. роспуск
Вопрос 3: Степень ионизации не зависит от ..
а. температура
г. давление
г. концентрация
г.природа растворителя
Вопрос 4: Цвет CuSO 4 раствор
а. зеленый
г. желтый
г. синий
г. красный
Связанные ресурсы
Чтобы узнать больше, купите учебные материалы по электрохимии, включая учебные заметки, заметки о пересмотре, видеолекции, решенные вопросы за предыдущий год и т. Д. Также просмотрите дополнительные учебные материалы по химии здесь.
Электролиты, ионизация и проводимость | Реакции в водном растворе
18.3 Электролиты, ионизация и проводимость (ESAFP)
Вы узнали, что вода — это полярная молекула и что она может растворять ионные вещества в воде. Когда в воде присутствуют ионы, вода может проводить электричество. Раствор известен как электролит.
- Электролит
Электролит — это вещество, которое содержит свободные ионы и ведет себя как электропроводящая среда.
Поскольку электролиты обычно состоят из ионов в растворе, они также известны как ионные растворы.Сильный электролит — это тот, в котором много ионов присутствует в растворе, а слабый электролит — это тот, в котором присутствует мало ионов. Сильные электролиты являются хорошими проводниками электричества, а слабые электролиты — слабыми проводниками электричества. Неэлектролиты вообще не проводят электричество. Электропроводность в водных растворах — мера способности воды проводить электрический ток. Чем больше в растворе ионов , тем выше его проводимость. Кроме того, чем больше ионов в растворе, тем сильнее электролит.
Чем больше в растворе ионов , тем выше его проводимость. Кроме того, чем больше ионов в растворе, тем сильнее электролит.
Факторы, влияющие на проводимость электролитов (ESAFQ)
Следовательно, на проводимость электролита влияют следующие факторы:
Концентрация ионов в растворе. Чем выше концентрация ионов в растворе, тем выше будет его проводимость.
Вещество типа , растворяется в воде. Является ли материал сильным электролитом (например,грамм. нитрат калия, \ (\ text {KNO} _ {3} \)), слабый электролит (например, уксусная кислота, \ (\ text {CH} _ {3} \ text {COOH} \)) или неэлектролит (например, сахар, спирт, масло) будут влиять на проводимость воды, потому что концентрация ионов в растворе будет разной в каждом случае. Сильные электролиты легко образуют ионы, слабые электролиты не образуют легко ионы, а неэлектролиты не образуют ионы в растворе.

Температура. Чем теплее раствор, тем выше растворимость растворяемого материала и, следовательно, выше проводимость.
Электропроводность
Цель
Для исследования электропроводности различных веществ и растворов.
Аппарат
Кристаллы твердой соли (\ (\ text {NaCl} \))
различных жидкостей, таких как дистиллированная вода, водопроводная вода, морская вода, сахар, масло и спирт
раствора солей e.грамм. \ (\ text {NaCl} \), \ (\ text {KBr} \), \ (\ text {CaCl} _ {2} \), \ (\ text {NH} _ {4} \ text {Cl} \)
раствор кислоты (например, \ (\ text {HCl} \)) и раствор основания (например, \ (\ text {NaOH} \))
фонари
амперметр
провод, зажимы типа «крокодил» и 2 угольных стержня.

Метод
Проведите эксперимент, подключив схему, как показано на схеме ниже. На схеме X обозначает вещество или раствор, которые вы будете тестировать.
При использовании твердых кристаллов зажимы типа «крокодил» могут быть прикреплены непосредственно к каждому концу кристалла. Когда вы используете растворы, в жидкость помещают два угольных стержня, и к каждому стержню прикрепляют зажимы.
В каждом случае замкните цепь и дайте току течь примерно 30 секунд.
Проверить, показывает ли амперметр значение.
Результаты
Запишите свои наблюдения в таблицу, подобную приведенной ниже:
Тестовое вещество | Показания амперметра |
Что вы заметили? Вы можете объяснить эти наблюдения?
Выводы
Растворы, содержащие свободно движущиеся ионы, могут проводить электричество из-за движения заряженных частиц. Растворы, не содержащие свободно движущихся ионов, не проводят электричество.
Растворы, не содержащие свободно движущихся ионов, не проводят электричество.
Помните, что для протекания электричества необходимо движение заряженных частиц, например ионы. В случае твердых кристаллов \ (\ text {NaCl} \) ток электричества не регистрировался амперметром. Хотя твердое тело состоит из ионов, они очень плотно удерживаются вместе внутри кристаллической решетки, и поэтому ток не будет течь. Дистиллированная вода, масло и спирт также не проводят ток, потому что они ковалентные соединения и, следовательно, не содержат ионов.{-} \ text {(aq)} \]
Практические вопросы по химии стр. 46
Вопросы с множественным выбором по химии в наборах по 10 на одной странице с вопросами и ответами. Все наборы пригодятся при подготовке предметных тестов при приеме на работу или поступлении. Вопрос: 3338 Ион с большей плотностью заряда будет иметь тенденцию притягивать молекулы воды- подробнее
- меньше
- равно
- ноль
- напрямую
- обратно
- линейно
- не ранее
- кристаллическая решетка
- молекулярная геометрия
- молекулярная сфера
- молекулярная связь
- Фарадей
- Вольта
- Отказ
- Аррениус

- гидролиз
- раствор
- сольвализис
- гидратация
- 1
- 2
- 3
- 4
- анионы
- катион
- радикалы
- комплексов
- бесплатно
- свободно в одном направлении
- свободно во все стороны
- свободно к стенам
- рекомбинация
- гидратация
- ионизация
- гидролиз
- — полная реакция
- — обратимая реакция
- достигает равновесия
- — постоянная реакция
- в одну сторону
- нереверсивный
- двусторонний
- двухсторонний
- друг к другу
- стен
- электрод
- соответствующих электродов
Ответы на вопросы по химии на этой странице
Следующий список дает правильный выбор для ответа MCQs по химии.
3338. А 3339. B 3340. А 3341. D 3342. D 3343. B 3344. B 3346. С 3347. А 3348. С 3349. С 3350. D
MCQ для практических предметных тестов
Демонстрация проводимости электролитов | Chemdemos
Эту демонстрацию можно использовать для иллюстрации того, как по количеству ионных частиц в растворе водный раствор классифицируется как сильный электролит, слабый электролит или неэлектролит.Эту демонстрацию можно использовать для обсуждения таких тем, как процесс растворения, межмолекулярные силы или относительная сила химических связей по сравнению с IMF. Эффективность этой демонстрации увеличивается, когда 1) учащиеся делают свои собственные прогнозы, наблюдения и заключения; 2) построить диаграммы уровней всех протестированных растворов и твердых веществ; и 3) отвечать на вопросы и писать пояснения к решениям.
Существует черновик занятия для учащихся в стиле POGIL, который может сопровождать (и улучшать) эту демонстрацию.
Задачи обучения
1. Объясните, почему вода является полярной молекулой и как пять или шесть молекул воды взаимодействуют с веществами, участвуя в процессе растворения.
2. Из физики примените концепции «притяжения разнородных зарядов», дипольного момента и векторов, чтобы помочь объяснить, почему полярные вещества и растворимые ионные вещества растворяются в воде.
3. Отнесите водный раствор к категории с сильным электролитом, слабым электролитом или неэлектролитом.
4. Представьте твердые ионные вещества, полярные ковалентные вещества и ковалентные вещества с помощью диаграмм уровней частиц.
5. Изобразите процесс растворения твердых ионных веществ и полярных ковалентных веществ, а также ковалентных веществ, используя диаграммы уровней частиц и химические уравнения.
6. Ясно проиллюстрируйте и объясните различия между растворами сильного электролита, слабого электролита и неэлектролитного раствора.

