Контрольные работы по химии 8 класс
Контрольные работы
ХИМИЯ
К учебнику О. С. Габриеляна «Химия – 8»
8 класс
г. Орск, 2015
Содержание:
Контрольная работа № 1 «Атомы химических элементов»………………………………..
5
Вариант 1……………………………………………………………………………..
5
Вариант 2…………………………………………………………………………….
7
Вариант 3…………………………………………………………………………….
9
Вариант 4…………………………………………………………………………….
11
Контрольная работа № 2 «Простые вещества. Количественные соотношения»…………
13
Вариант 1…………………………………………………………………………….
13
Вариант 2…………………………………………………………………………….
15
Вариант 3…………………………………………………………………………….
17
Вариант 4…………………………………………………………………………….
19
Контрольная работа № 3 «Соединения химических элементов»………………………….
21
Вариант 1…………………………………………………………………………….
21
Вариант 2…………………………………………………………………………….
23
Вариант 3…………………………………………………………………………….
25
Вариант 4…………………………………………………………………………….
27
Контрольная работа № 4 «Изменения, происходящие с веществами»……………………
29
Вариант 1…………………………………………………………………………….
29
Вариант 2…………………………………………………………………………….
31
Вариант 3…………………………………………………………………………….
33
Вариант 4…………………………………………………………………………….
35
Контрольная работа № 5 «Классы неорганических соединений»…………………………
37
Вариант 1…………………………………………………………………………….
37
Вариант 2…………………………………………………………………………….
Вариант 3…………………………………………………………………………….
41
Вариант 4…………………………………………………………………………….
43
Контрольная работа № 6 «Итоговая контрольная работа за курс 8 класса»………………
45
Вариант 1…………………………………………………………………………….
45
Вариант 2…………………………………………………………………………….
47
Вариант 3…………………………………………………………………………….
49
Вариант 4…………………………………………………………………………….
51
Приложение……………………………………………………………………………………
53
Ответы…………………………………………………………………………………………
57
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания — 1 балл.
Часть 2 состоит из 3 заданий повышенного уровня (В1-В3), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания — 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 15 баллов. Желаю успеха!
Система оценивания работы:
0-6 баллов – «2»
7-10 баллов – «3»
11-13 баллов – «4»
14-15 баллов – «5»
Контрольная работа № 1
Атомы химических элементов
ВАРИАНТ-1
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Элемент третьего периода главной подгруппы III группы ПСХЭ — это:
1) алюминий
3) магний
2) бериллий
4) бор
А2. Обозначение изотопа, в ядре которого содержится 8 протонов и 10 нейтронов:
1)
3)
2)
4)
А3. Атом химического элемента, электронная оболочка которого содержит 17 электронов:
1) кислород
3) хлор
2) сера
4) фтор
А4. Два электронных слоя (энергетических уровня) имеет атом:
1) азота
3) калия
2) магния
4) гелия
А5. Пара химических элементов, имеющих на внешнем электронном уровне по 5 электронов:
1) P и С
3) Si и Са
2) С и Si
4) N и P
А6. Верны ли следующие высказывания?
А. В периоде металлические свойства атомов элементов с увеличением порядкового номера усиливаются.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между частицей и распределением электронов по энергетическим уровням:
Частица:
Распределение электронов:
А) Ca
1) 2е, 8е, 8е, 2е
Б) Al3+
2) 2е, 8е, 2е
В) N3-
3) 2е, 5е
Г) N
4) 2е, 8е, 3е
5) 2е, 8е,18е,4е
6) 2е, 8е
А
Б
В
Г
Ответом к заданию В2 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
В2. Соединениями с ионной связью являются:
1) NH3
3) BaCl2
5) ZnS
2) CO2
4) Al I3
6) O2
Ответом к заданию В3 является число. Запишите это число в бланк ответов без указания единиц измерения.
В3. Относительная молекулярная масса хлорида бария BaCl2 равна __________.
Часть 3
Запишите номер задания и полное решение
С1. Дайте характеристику элемента c Z = 11 (Приложение 3, пункты I (1-5), II (1-4)). Запишите схему строения его иона Na
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания — 1 балл.
Часть 2 состоит из 3 заданий повышенного уровня (В1-В3), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания — 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 15 баллов. Желаю успеха!
Система оценивания работы:
0-6 баллов – «2»
7-10 баллов – «3»
11-13 баллов – «4»
14-15 баллов – «5»
Контрольная работа № 1
Атомы химических элементов
ВАРИАНТ-2
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Элемент второго периода главной подгруппы III группы ПСХЭ — это:
1) литий
3) кальций
2) бор
4) магний
А2. Обозначение изотопа, в ядре которого содержится 26 протонов и 30 нейтронов:
1)
3)
2)
4)
А3. Атом химического элемента, ядро которого содержит 14 протонов — это:
1) азот
3) калий
2) кремний
4) цинк
А4. Три электронных слоя (энергетических уровня) имеет атом:
1) бора
3) фтора
2) кальция
4) серы
А5. Пара химических элементов, имеющих на внешнем электронном уровне по 3 электрона:
1) Mg и Al
3) N и S
2) O и S
4) B и Al
А6. Верны ли следующие высказывания?
А. В главной подгруппе неметаллические свойства атомов элементов с увеличением порядкового номера усиливаются.
Б. В главной подгруппе неметаллические свойства атомов элементов с увеличением порядкового номера ослабевают.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между частицей и распределением электронов по энергетическим уровням:
Частица:
Распределение электронов:
А) Mg
1) 2е, 8е, 7е
Б) K
2) 2е, 8е, 2е
В) Na+
3) 2е, 7е
Г) Cl —
4) 2е, 8е, 8е
5) 2е, 8е
6) 2е, 8е, 8е,1е
А
Б
В
Г
Ответом к заданию В2 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
В2. Соединениями с ковалентной полярной связью являются:
1) NH3
3) BaCl2
5) O2
2) CO2
4) H2S
6) ZnS
Ответом к заданию В3 является число. Запишите это число в бланк ответов без указания единиц измерения.
В3. Относительная молекулярная масса оксида алюминия Al2O3 равна _______.
Часть 3
Запишите номер задания и полное решение
С1. Дайте характеристику элемента c Z = 16 (Приложение 3, пункты I (1-5), II (1-4)). Запишите схему строения его иона S2-.
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания — 1 балл.
Часть 2 состоит из 3 заданий повышенного уровня (В1-В3), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания — 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 15 баллов. Желаю успеха!
Система оценивания работы:
0-6 баллов – «2»
7-10 баллов – «3»
11-13 баллов – «4»
14-15 баллов – «5»
Контрольная работа № 1
Атомы химических элементов
ВАРИАНТ-3
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Элемент третьего периода главной подгруппы V группы ПСХЭ — это:
1) азот
3) фосфор
2) алюминий
4) углерод
А2. Атом химического элемента, имеющий в своем составе 9 протонов, 10 нейтронов, 9 электронов:
1) бор
3) фтор
2) бериллий
4) калий
А3. Атом химического элемента, электронная оболочка которого содержит 10 электронов:
1) кальций
3) неон
2) фтор
4) бор
А4. Четыре электронных слоя (энергетических уровня) имеет атом:
1) железа
3) углерода
2) бария
4) аргона
А5. Пара химических элементов, имеющих на внешнем электронном уровне по 4 электрона:
1) углерод и кремний
3) азот и углерод
2) азот и фосфор
4) калий и кальций
А6. Верны ли следующие высказывания?
А. В периоде неметаллические свойства атомов элементов с увеличением порядкового номера не изменяются.
В периоде неметаллические свойства атомов элементов с увеличением порядкового номера не изменяются.
Б. В периоде неметаллические свойства атомов элементов с увеличением порядкового номера ослабевают.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между частицей и распределением электронов по энергетическим уровням:
Частица:
Распределение электронов:
А) C4+
1) 2е, 6е
Б) Li
2) 2е, 1е
В) O
3) 2е, 8е, 3е
Г) S2-
4) 2е, 8е, 8е,1е
5) 2е, 8е, 8е
6) 2е
А
Б
В
Г
Ответом к заданию В2 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
В2. Соединениями с ионной связью являются:
1) NaCl
3) K
5) Al2O3
2) H2
4) ZnI2
6) HCl
Ответом к заданию В3 является число. Запишите это число в бланк ответов без указания единиц измерения.
В3. Относительная молекулярная масса нитрата калия KNO3 равна __________.
Часть 3
Запишите номер задания и полное решение
С1. Дайте характеристику элемента c Z = 14 (Приложение 3, пункты I (1-5), II (1-4)). Запишите схему строения его иона Si 4+.
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания — 1 балл.
Часть 2 состоит из 3 заданий повышенного уровня (В1-В3), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания — 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 15 баллов. Желаю успеха!
Система оценивания работы:
0-6 баллов – «2»
7-10 баллов – «3»
11-13 баллов – «4»
14-15 баллов – «5»
Контрольная работа № 1
Атомы химических элементов
ВАРИАНТ-4
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Элемент четвертого периода главной подгруппы II группы ПСХЭ — это:
1) натрий
3) калий
2) кальций
4) углерод
А2. Атом химического элемента, имеющий в своем составе 15 протонов, 16 нейтронов, 15 электронов:
1) кислород
3) фтор
2) цинк
4) фосфор
А3. Атом химического элемента, ядро которого содержит 24 протона — это:
1) хром
3) медь
2) магний
4) криптон
А4. Пять электронных слоев (энергетических уровней) имеет атом:
1) брома
3) мышьяка
2) йода
4) бора
А5. Пара химических элементов, имеющих на внешнем электронном уровне по 7 электронов:
1) кремний и фосфор
3) хлор и йод
2) азот и фосфор
4) серебро и кадмий
А6. Верны ли следующие высказывания?
А. В главной подгруппе металлические свойства атомов элементов с увеличением порядкового номера усиливаются.
В главной подгруппе металлические свойства атомов элементов с увеличением порядкового номера усиливаются.
Б. В главной подгруппе электроотрицательность атомов элементов с увеличением порядкового номера ослабевает.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между частицей и распределением электронов по энергетическим уровням:
Частица:
Распределение электронов:
А) S
1) 2е, 8е, 7е
Б) Ca2+
2) 2е, 8е, 4е
В) О2-
3) 2е, 8е
Г) Si
4) 2е, 8е, 6е
5) 2е
6) 2е, 8е, 8е
А
Б
В
Г
Ответом к заданию В2 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
В2. Соединениями с ковалентной неполярной связью являются:
1) H2
3) Cl2
5) KCl
2) SO2
4) Na
6) C
Ответом к заданию В3 является число. Запишите это число в бланк ответов без указания единиц измерения.
В3. Относительная молекулярная масса сульфата натрия Na2SO4 равна _________.
Часть 3
Запишите номер задания и полное решение
С1. Дайте характеристику элемента c Z = 20 (Приложение 3, пункты I (1-5), II (1-4)). Запишите схему строения его иона Ca 2+.
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания — 1 балл.
Часть 2 состоит из 3 заданий повышенного уровня (В1-В3), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания — 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 15 баллов. Желаю успеха!
Система оценивания работы:
0-6 баллов – «2»
7-10 баллов – «3»
11-13 баллов – «4»
14-15 баллов – «5»
Контрольная работа № 2
Простые вещества. Количественные соотношения
ВАРИАНТ-1
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Больше металлических свойств проявляет:
1) магний
3) алюминий
2) натрий
4) железо
А2. Аллотропная модификация кислорода:
1) графит
3) озон
2) белый фосфор
4) алмаз
А3. Атому элемента, образующему простое вещество — металл, соответствует электронная схема:
1) +18)2)8)8
3) +3)2)1
2) +15)2)8)5
4) +8)2)6
А4. Запись 3О2 означает:
1) 2 молекулы кислорода
3) 5 атомов кислорода
2) 3 молекулы кислорода
4) 6 атомов кислорода
А5. Масса 3 моль сероводорода Н2S равна:
1) 33 г
3) 34 г
2) 99 г
4) 102 г
А6. Верны ли следующие высказывания?
А. При нормальных условиях ртуть жидкая.
При нормальных условиях ртуть жидкая.
Б. При нормальных условиях ртуть твердая.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между типом химической связи и химической формулой вещества:
Тип химической связи:
Химическая формула вещества:
А) Ионная
1) C12
Б) Ковалентная полярная
2) NaCl
В) Металлическая
3) Fe
Г) Ковалентная неполярная
4) NH3
А
Б
В
Г
Ответом к заданиям В2, В3 является число. Запишите это число в бланк ответов без указания единиц измерения.
Запишите это число в бланк ответов без указания единиц измерения.
В2. Количество вещества углекислого газа СO2, в котором содержится 36•1023 молекул, равно_____ моль. (Запишите число с точностью до десятых).
В3. Объем, который занимает 2 моль газообразного вещества с формулой SO2 (н.у.) равен ____л. (Запишите число с точностью до десятых).
Часть 3
Запишите номер задания и полное решение
C1. Рассчитайте объем для 160 г кислорода O2.
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания — 1 балл.
Часть 2 состоит из 3 заданий повышенного уровня (В1-В3), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания — 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 15 баллов. Желаю успеха!
Система оценивания работы:
0-6 баллов – «2»
7-10 баллов – «3»
11-13 баллов – «4»
14-15 баллов – «5»
Контрольная работа № 2
Простые вещества. Количественные соотношения
ВАРИАНТ-2
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Больше неметаллических свойств проявляет:
1) углерод
3) фтор
2) азот
4) кислород
А2. Аллотропная модификация углерода:
1) озон
3) красный фосфор
2) сера кристаллическая
4) алмаз
А3. Атому элемента, образующему простое вещество — неметалл, соответствует электронная схема:
1) +11)2)8)1
3) +12)2)8)2
2) +8)2)6
4) +4)2)2
А4. Запись 5N2 означает:
1) 2 молекулы азота
3) 7 атомов азота
2) 5 молекул азота
4) 10 атомов азота
А5. Масса 2 ммоль углекислого газа СО2 равна:
1) 28 мг
3) 56 мг
2) 44 мг
4) 88 мг
А6. Верны ли следующие высказывания?
Верны ли следующие высказывания?
А. При нормальных условиях озон жидкий.
Б. При нормальных условиях озон твердый.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответ
Химия 8 Контрольные Габриелян (КиСР Павлова)
Контрольные работы по химии в 8 классе (УМК Габриелян)
Химия 8 Контрольные Габриелян (КиСР Павлова) — это контрольные работы (цитаты) в 4-х вариантах из пособия для учащихся Контрольные и самостоятельные работы по химии: 8 класс: к учебнику О. С. Габриеляна «Химия 8 класс» / Н. С. Павлова. — М. : Издательство «Экзамен», 2015 (Серия «Учебно-методический комплект»).
С. Габриеляна «Химия 8 класс» / Н. С. Павлова. — М. : Издательство «Экзамен», 2015 (Серия «Учебно-методический комплект»).
Цитаты из вышеуказанного учебного пособия использованы на сайте в незначительных объемах, исключительно в учебных и информационных целях (пп. 1 п. 1 ст. 1274 ГК РФ): цитаты переработаны в удобный формат (каждая работа на 1-й странице), что дает экономию денежных средств учителю и образовательному учреждению я в использовании бумаги и ксерокопирующего оборудования.
При постоянном использовании контрольных работ по химии в 8 классе рекомендуем купить книгу:
«Наталья Павлова: Химия 8 класс. Контрольные и самостоятельные работы по химии. К учебнику О. С. Габриеляна. ФГОС», которая содержит 5 контрольных работ, 6 тестов по основным темам курса, 39 самостоятельных работ. Все работы представлены в 4 вариантах. Данное пособие полностью соответствует ФГОС (второго поколения). В пособии отражены новые требования к результатам освоения химии в виде совокупностей не только предметных, но и метапредметных и личностных результатов учащихся.
В пособии отражены новые требования к результатам освоения химии в виде совокупностей не только предметных, но и метапредметных и личностных результатов учащихся.
Контрольная К-1. Атомы химических элементов. Простые вещества
Контрольная работа № 1 + Ответы
Контрольная К-2. Соединения химических элементов
Контрольная работа № 2 + Ответы
Контрольная К-3. Изменения, происходящие с веществами
Контрольная работа № 3 + Ответы
Контрольная К-4. Растворение. Растворы. Свойства растворов электролитов
Контрольная работа № 4 + Ответы
Контрольная К-5. ИТОГОВАЯ за год
Контрольная работа № 5 + Ответы
Основные темы уроков по учебнику О.С. Габриелян «Химия 8 класс»
Предмет химии. Вещества. Превращение веществ. Знаки химических элементов. Периодическая система химических элементов Д.И. Менделеева. Химические формулы. Относительная атомная и молекулярная масса.
Тема № 1. Атомы химических элементов.
Атомы химических элементов.
Основные сведения о строении атомов. Изменения в составе ядер атомов химических элементов. Изотопы. Строение электронных оболочек атомов. Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов. Взаимодействие атомов элементов-неметаллов между собой. Ковалентная полярная связь. Обобщение и систематизация знаний о видах химической связи.
Тема № 2. Простые вещества.
Простые вещества — металлы. Простые вещества — неметаллы. Аллотропия. Количество вещества. Молярная масса вещества. Молярный объем газообразных веществ.
Тема № 3. Соединения химических элементов.
Степень окисления. Важнейшие классы бинарных соединений — оксиды и летучие водородные соединения. Основания. Кислоты. Соли как производные кислот и оснований. Основные классы соединений. Кристаллические решетки. Массовая и объемная доля компонента в смеси, в том числе и доля примесей.
Тема № 4. Изменения, происходящие с веществами.
Изменения, происходящие с веществами.
Физические явления в химии. Химические реакции. Химические реакции. Закон сохранения массы веществ. Расчеты по химическим уравнениям. Химические уравнения. Реакции разложения. Реакции соединения. Реакции замещения. Реакции обмена. Типы химических реакций на примере свойств воды.
Тема № 5. Растворение. Растворы. Свойства растворов электролитов.
Растворение как физико-химический процесс. Растворимость. Типы растворов. Электролитическая диссоциация. Основные положения теории электролитической диссоциации. Ионные уравнения реакций. Кислоты в свете ТЭД, их классификация и свойства. Основания в свете ТЭД, их классификация и свойства. Оксиды. Соли в свете ТЭД, их свойства. Генетическая связь между классами неорганических веществ. Окислительно-восстановительные реакции.
Вы смотрели Химия 8 Контрольные Габриелян (КиСР Павлова) контрольные работы (цитаты) в 4-х вариантах из пособия для учащихся Контрольные и самостоятельные работы по химии: 8 класс: к учебнику О. С. Габриеляна «Химия 8 класс» / Н. С. Павлова.
С. Габриеляна «Химия 8 класс» / Н. С. Павлова.
Контрольная Атомы химических элементов | ВСЕ КОНТРОЛЬНЫЕ
Контрольная Атомы химических элементов
Химия 8. Контрольная работа № 1 «Атомы химических элементов. Простые вещества»
Контрольная Атомы химических элементов — это ответы на контрольную работу № 1 «Атомы химических элементов. Простые вещества» (в 4-х вариантах) из пособия для учащихся Контрольные и самостоятельные работы по химии: 8 класс: к учебнику О. С. Габриеляна «Химия 8 класс» / Н. С. Павлова. — М. : Издательство «Экзамен». Цитаты из указанного учебного пособия использованы на сайте в незначительных объемах, исключительно в учебных и информационных целях.
Химия 8 класс (УМК Габриелян)
Контрольная Атомы химических элементов. Простые вещества
Химия 8 класс. Габриелян Павлова. Контрольная работа 1ВАРИАНТ 3
- Рассчитайте относительные молекулярные массы веществ: Li2CО3, Р2О3.

- Расположите элементы в порядке возрастания их:
а) неметаллических свойств: F, О, Li;
б) металлических свойств: Rb, Na, К.
Ответ поясните.
- Определите тип связи в веществах: КВг, Вг2, НВг. Приведите схему образования связи для любого из веществ.
- Определите число электронов, протонов и нейтронов для частиц: 16О, 18О, 18О-2.
- Укажите положение кремния в Периодической системе. Приведите его электронную формулу.
- Определите массовую долю кислорода в веществе Fe2О3.
ВАРИАНТ 4
- Рассчитайте относительные молекулярные массы веществ: CaSО3, NО2.
- Расположите элементы в порядке возрастания их:
а) неметаллических свойств: Se, О, Те;
б) металлических свойств: Na, Al, Mg.
Ответ поясните.
- Определите тип связи в веществах: OF2, F2, CaF2.
 Приведите схему образования связи для любого из веществ.
Приведите схему образования связи для любого из веществ. - Определите число электронов, протонов и нейтронов для частиц: 42Са, 43Са, 42Са+2.
- Укажите положение серы в Периодической системе. Приведите его электронную формулу.
- Определите массовую долю хлора в веществе FeCl3.
Химия 8 класс (КиСР Павлова)
ОТВЕТЫ на КР-1 Химия 8 Габриелян
Контрольная Атомы химических элементов — это ответы на контрольную работу № 1 «Атомы химических элементов. Простые вещества» (в 4-х вариантах) из пособия для учащихся Контрольные и самостоятельные работы по химии: 8 класс: к учебнику О. С. Габриеляна «Химия 8 класс» / Н. С. Павлова. — М. : Издательство «Экзамен».
Вернуться к Списку контрольных работ.
Контрольная Соединения химических элементов | Химия 8
Контрольная Соединения химических элементов
Химия 8 класс. Контрольная работа № 2 «Соединения химических элементов«
Контрольная Соединения химических элементов — это ответы на контрольную работу № 2 «Соединения химических элементов» (в 4-х вариантах) из пособия для учащихся Контрольные и самостоятельные работы по химии: 8 класс: к учебнику О. С. Габриеляна «Химия 8 класс» / Н. С. Павлова. — М. : Издательство «Экзамен». Цитаты из указанного учебного пособия использованы на сайте в незначительных объемах, исключительно в учебных и информационных целях.
С. Габриеляна «Химия 8 класс» / Н. С. Павлова. — М. : Издательство «Экзамен». Цитаты из указанного учебного пособия использованы на сайте в незначительных объемах, исключительно в учебных и информационных целях.
Химия 8 класс (УМК Габриелян)
Контрольная Соединения химических элементов
Химия 8 класс. Габриелян Павлова. Контрольная работа 2ВАРИАНТ 3
- Выпишите отдельно формулы кислот, оснований, солей и оксидов. Назовите все вещества: NО, Са3(РО4)2, Mg(OH)2, FeCl2, H2S, Sr(OH)2, FeO, HNО3.
- Какой объем (н.у.) занимают 15,36 г оксида серы (IV)? Сколько молекул газа содержится в этой массе оксида серы (IV)?
- Определите степени окисления элементов в следующих соединениях: Al2(SO4)3, NH3, Р2O3, КСlO3, МnO2.

- Составьте формулы бинарных соединений: сульфида хрома (III), оксида натрия, хлорида серы (II).
- Определите объем метана (СН4), содержащегося в 5 л природного газа, содержащего 95% метана.
- В 150 г воды растворили 75 г соли. Определите массовую долю соли в полученном растворе.
ВАРИАНТ 4
- Выпишите отдельно формулы кислот, оснований, солей и оксидов. Назовите все вещества: СО, АlСl3, H2SO3, CuO, BaSO4, H3PO4, K2S, Ва(ОН)2.
- Рассчитайте массу и объем (н.у.) 1,806 • 1023 молекул оксида азота (IV).
- Определите степени окисления элементов в следующих соединениях: NaHSO3, H2Se, WO3, Са(СlO)2, Ag2O.
- Составьте формулы бинарных соединений: оксида хрома (II), нитрида калия, бромида железа (III).
- Определите массу карбоната кальция, содержащегося в 10 кг известняка, содержащего 15% примесей.

- Какая масса гидроксида натрия и воды потребуется для приготовления 80г ее 40%-ного раствора?
Химия 8 класс (КиСР Павлова)
ОТВЕТЫ на КР-2 Химия 8 Габриелян
Контрольная Соединения химических элементов — это ответы на контрольную работу № 2 «Соединения химических элементов» (в 4-х вариантах) из пособия для учащихся Контрольные и самостоятельные работы по химии: 8 класс: к учебнику О. С. Габриеляна «Химия 8 класс» / Н. С. Павлова. — М. : Издательство «Экзамен».
Вернуться к Списку контрольных работ.
Первоначальные понятия и законы химии. Контрольная работа по химии 8 класс.
Контрольная работа – 8 класс
Вариант 1
Ответами к заданиям 1-4 является последовательность цифр.
1. Выберите два высказывания, в которых говорится о водороде как о простом веществе.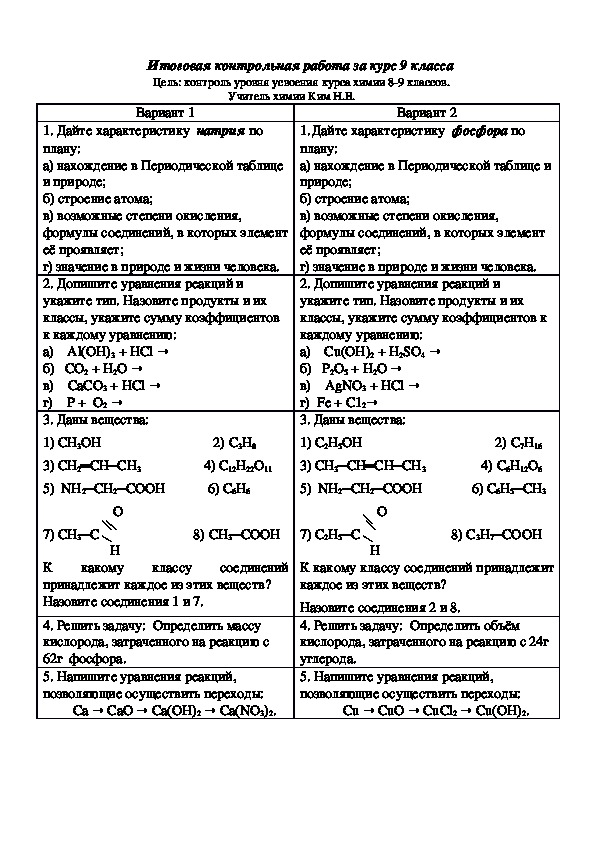
1) водород самый легкий газ
2) водород располагается в 1 периоде
3) водород чаще всего имеет степень окисления (-1)
4) водород входит в состав серной кислоты
5) водородом используют в химической промышленности
2. Укажите два примера твердых смесей
1) железные и древесные опилки
2) смесь воды и соли
3) смесь серебра и золота
4) воздух
5) яблочный сок
3. Укажите относительная молекулярная масса, какого вещества больше
1) MgSO4
2) LiOH
3) N2O5
4) PH3
4. Укажите два примера реакций обмена:
1) Al(OH)3 + 3HCl→ AlCl3 + 3H2O
2) 2HF → H2 + F2
3) 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
4) 2Na + 2H2O → 2NaOH + H2
5) SiO2 + 4HF → SiF4 + 2H2O
_____________________________________________
Ответами к заданиям 5-8 является развернутый ответ.
5. Составьте уравнения бинарных соединений по названиям:
фторид алюминия, хлорид железа (III), карбид магния, оксид азота (IV),
оксид бора, нитрид лития
6. Перепишите уравнения химических реакций. Расставьте коэффициенты в уравнениях. Укажите тип химических реакций.
1) TiO2 + Ca → CaO + Ti
2) S + C → CS2
3) P2O5 + H2O→ H3PO4
4) Al2(SO4)3 + Ba(NO3)2 → Al(NO3)3 + BaSO4
7. Составьте уравнения реакций соединения.
1) Al + S →
2) Mg + O2 →
3) Li + F2→
4) H2 + C →
8. Укажите массовая доля кислорода, в каком веществе больше: в оксиде лития Li2O или оксиде серы (VI) SO3 Проведите вычисления.
Укажите массовая доля кислорода, в каком веществе больше: в оксиде лития Li2O или оксиде серы (VI) SO3 Проведите вычисления.
|
Составитель: Маланина Е. А. учитель химии, МБОУ Одинцовская гимназия № 13, Московская область |
Вариант 2
Ответами к заданиям 1-6 является последовательность цифр.
1. Выберите два высказывания, в которых говорится о кислороде как о химическом элементе.
1) кислород тяжелее воздуха
2) кислород мало растворим в воде
3) кислород используют в медицине для дыхания
4) кислород входит в состав сахарозы
5) кислород располагается в 6А группе
2. Укажите два примера газообразных смесей
Укажите два примера газообразных смесей
1) природный газ
2) воздух 3) апельсиновый сок
4) сметана
5) туман
3. Укажите относительная молекулярная масса, какого вещества меньше
1) KHCO3
2) NaOH
3) P2O3
4) SF6
4. Укажите два примера реакций разложения:
1) CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
2) Fe2O3 + 3Mg → 3MgO +2Fe
3) 4Al + 3O2→ 2Al2O3
4) CaCO3 → CaO + CO2
5) 2Al(OH)3 → Al2O3 +3H2O
_____________________________________________
Ответами к заданиям 5-8 является развернутый ответ.
5. Составьте уравнения бинарных соединений по названиям:
хлорид бериллия, оксид кремния, оксид хлора (VII), нитрид бария,
бромид хрома (III), сульфид фосфора (V)
6. Перепишите уравнения химических реакций. Расставьте коэффициенты в уравнениях. Укажите тип химических реакций.
1) KClO3 → KCl + O2
2) LiOH + AlCl3 → Al(OH)3 + LiCl
3) TiO2 + Ca → CaO + Ti
4) Li+P→Li3 P
7. Составьте уравнения реакций соединения.
1) Li + S →
2) B + O2 →
3) Na + I2→
4) H2 + N2 →
8. Укажите массовая доля кислорода, в каком веществе больше: в оксиде меди (II) CuO или оксиде натрия Na2O Проведите вычисления.
Химия 8 класс. Тесты, тренажеры, контрольные работы
Тесты и тренажеры по химии
Контрольные работы по химии
УМК Габриелян — Павлова. Контр. и самост. работы по химии: 8 класс.
УМК Габриелян — Ястребова. Поурочные планы по химии 8кл.
К любому УМК — Добротин. Химия 8. Контрольные работы в новом формате (итоговая КР)
Химия 8 класс. Основные темы
Введение
§ 1. Химия — часть естествознания
§ 2. Предмет химии. Вещества
§ 3. Превращения веществ. Роль химии в жизни человека
§ 4. Краткий очерк о истории развития химии
§ 5. Периодическая система химических элементов Д. И. Менделеева. Знаки химических элементов
§ 6. Химические формулы. Относительная атомная и молекулярная массы
Глава первая. Атомы химических элементов
Атомы химических элементов
§ 7. Основные сведения о строении атомов
§ 8. Изменения в составе ядер атомов химических элементов. Изотопы
§ 9. Строение электронных оболочек атомов
§ 10. Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов
§ 11. Взаимодействие атомов элементов-неметаллов между собой
§ 12. Ковалентная полярная химическая связь
§ 13. Металлическая химическая связь
Глава вторая. Простые вещества
§ 14. Простые вещества — металлы
§ 15. Простые вещества — неметаллы
§ 16. Количество вещества
§ 17. Молярный объём газов
Глава третья. Соединения химических элементов
§ 18. Степень окисления
§ 19. Важнейшие классы бинарных соединений — оксиды и летучие водородные соединения
§ 20. Основания
§ 21. Кислоты
§ 22. Соли
§ 23. Кристаллические решётки
§ 24. Чистые вещества и смеси
§ 25. Массовая и объёмная доли компонентов смеси (раствора)
Глава четвёртая. Изменения, происходящие с веществами
Изменения, происходящие с веществами
§ 26. Физические явления в химии
§ 27. Химические реакции
§ 28. Химические уравнения
§ 29. Расчёты по химическим уравнениям
§ 30. Реакции разложения
§ 31. Реакции соединения
§ 32. Реакции замещения
§ 33. Реакция обмена
§ 34. Типы химических реакций на примере свойств воды
Глава пятая. Растворение. Растворы. Реакции ионного обмена
§ 35. Растворение. Растворимость веществ в воде
§ 36. Электролитическая диссоциация
§ 37. Основные положения теории электролитической диссоциации
§ 38. Ионные уравнения
§ 39. Кислоты, их классификация и свойства
§ 40. Основания, их классификация и свойства
§ 41. Оксиды, их классификация и свойства
§ 42. Соли, их классификация и свойства
§ 43. Генетическая связь между классами веществ
§ 44. Окислительно-восстановительные реакции
Рекомендуемые материалы для очного контроля знаний
по предмету «Химия 8 класс»:
- Контрольно-измерительные материалы по химии 8 класс / Н.
 П.Троегубова, Е.Н.Стрельникова — М.:ВАКО, 2016
П.Троегубова, Е.Н.Стрельникова — М.:ВАКО, 2016 - Химия. 8 класс. Тетрадь для оценки качества знаний. Габриелян О.С., Купцова А.В. (2015, 112с.)
- Химия. 8 класс. Контрольные и проверочные работы. Габриелян О.С. и др. (2014, 224с.)
- Химия в тестах, задачах, упражнениях. 8 класс. Габриелян О.С., Смирнова Т.В., Сладков С.А. (2014, 224с.)
- Контрольные и самостоятельные работы по химии. 8 класс: к учебнику Габриеляна О.С. — Павлова Н.С. (2015, 256с.)
- Тесты по химии. 8 класс. Первоначальные химические понятия… К учебнику Рудзитиса Г.Е., … (2013, 144с.)
- Тесты по химии. 8 класс. Периодический закон и периодическая система… К учебнику Рудзитиса Г.Е., …(2013, 96с.)
- Химия 8 класс. Тесты. В 2 ч. Ким Е.П. (2011; 64с., 64с.)
- Химия 8 класс. Экспресс-диагностика. Расулова Г.Л. (2014, 112с.)
Перейти на Главную страницу сайта.
Эфиопия 12 класс химии, блок 1: решения Вопросы и ответы
Эфиопия Химия для 12 класса Блок 1: Решения Вопросы Ответы: Учебник Выполните примерный вопрос с несколькими вариантами ответов для вступительного экзамена по химии в 12 классе.
Эфиопия 12 класс, химия
Раздел 1: Решения
1. Что означает Mg (OH) 2
- A) Магнезийное молоко
- B) Магний
- C) Гидроксид
- D) Все вышеперечисленное
Ответы: A) Молоко магнезии Гидроксид магния — неорганическое соединение с химической формулой Mg (OH) ₂.Встречается в природе как минерал брусит.
2. Коллоид состоит из двух частей
Ответы: A) Верно: Коллоид — это смесь, в которой одно вещество из микроскопически диспергированных нерастворимых частиц взвешено в другом веществе.
3. Какой пример коллоида?
- A) Молоко,
- B) Желе,
- C) Мутная вода,
- D) Все вышеперечисленное
Ответов: Г) Все вышеперечисленное
4.Луч света может проходить через коллоидную смесь.
Ответов: А) Верно
5. Какой пример газа?
Какой пример газа?
- A) Воздух,
- Б) Вода,
- C) Мутная вода,
- D) Напиток алкогольный
Ответов: А) Воздух
6. Какой пример жидкости?
- А) Ацетон
- Б) Вода,
- C) Этанол
- D) Все вышеперечисленное
Ответов: Г) Все вышеперечисленное
7.Соответствует следующему
Решения | Пример |
| А) газ-газ | I) Кока-кола |
| Б) жидкость-жидкость | II) Воздух |
| C) Газ-жидкость | III) сплавы |
| D) Твердое-жидкое | IV) Вода |
| E) твердый-твердый | V) Морская вода |
Ответы:
- А): II)
- В): IV)
- С): I)
- D): V)
- E): III)
8) Этанол, смешанный с водой, но старый — нет.Зачем?
- A) Потому что обе жидкости смешиваются
- B) Из-за сильного растворителя
- C) Из-за того, что подобное растворяется как
- D) Из-за неприязни растворяется как
Ответы: C. «Подобное растворяется в подобном» — это выражение, используемое химиками. Он относится к «полярным» и «неполярным» растворителям и растворенным веществам. Базовый пример: вода полярная. Масло неполярное. вода не растворяет масло .
09. Что из перечисленного НЕ является несмешивающейся жидкостью?
- A) Нефть и вода
- B) Пентан и уксусная кислота
- C) Бензол и четыреххлористый углерод
- D) Все вышеперечисленное
Ответы: C) Бензол (C 6 H 6 ) и четыреххлористый углерод (CCl 4 ), эти две жидкости считаются смешиваемыми
10.) Лондонские силы относятся к
- A) Взаимодействие между атомами и молекулами
- B) Это временная сила притяжения
- C) это самая слабая межмолекулярная сила.
- D) Все вышеперечисленное
Ответы: D) LDF (Лондонская дисперсионная сила) названа в честь немецко-американского физика Фрица Лондона.
Вопрос самообучения Блок 1: Решения
1. Решение:
- А) гетерогенная смесь
- Б) однородный
- C) Подвеска
- D) коллоид
2.Газированная вода — пример:
- А) жидкость-жидкость
- B) твердо-жидкий раствор
- C) раствор gzs-жидкость
- D) газ-газовый раствор
Cambridge IGCSE (9-1) Chemistry 0971
Мы регулярно пересматриваем нашу квалификацию, чтобы убедиться, что она по-прежнему соответствует потребностям учащихся, школ и высших учебных заведений по всему миру и отражает текущее мышление. Мы обновили эту программу и все оценочные материалы, чтобы они были более четкими и последовательными по трем наукам.Это полезно для учителей, которые преподают несколько программ по естественным наукам, и для студентов, которым понравится более согласованный опыт по каждой науке. Подробную информацию об изменениях см. В учебной программе на 2023–2025 годы.
Каковы основные изменения в учебной программе?
Для поддержки учителей и учащихся у нас есть:
- обновлены цели обучения, чтобы продемонстрировать глубину преподавания каждой темы. Формулировка во многих местах выглядит по-разному, но содержание обучения остается в основном прежним.
- обновил структуру тем, чтобы убедиться, что темы и подтемы четко связаны между собой
- удалил и добавил темы; убедиться, что время обучения по-прежнему находится в пределах установленных часов
- рассмотрел баланс и прогрессию между ядром и дополнением.
Какие основные изменения в оценке?
- Мы предоставим «Примечания для использования в качественном анализе» к Документу 6.
Когда произойдут эти изменения?
Обновленный учебный план подлежит рассмотрению с июня 2023 года. Пожалуйста, смотрите программу обучения на 2023-2025 годы для получения полной информации.
Поддержка
Мы разрабатываем широкий спектр материалов, которые помогут вам преподавать по обновленной программе. Эти ресурсы будут доступны с июня 2021 года (до начала обучения) через наш Центр поддержки школ и включают:
- Схема работы
- Руководство для учащихся
- Руководство для учителя
- Образец бумаги Ответы
- Resource Plus, обновление
- Пример ответов кандидата (после первого экзамена).
Обучение
Будет доступно очное и онлайн-обучение. Актуальную информацию можно найти в нашем календаре мероприятий и тренировок.
Подтвержденные ресурсы
Просмотрите последние ресурсы, которые разрабатываются нашими партнерами по программе поддержки Кембриджской программы химии IGCSE (9-1) (0971).Кембриджская химия IGCSE (четвертое издание) (Hodder Education)
Написанные известными авторами-экспертами, наши обновленные ресурсы позволяют учащимся эффективно ориентироваться в содержании обновленной программы Cambridge IGCSE Chemistry.
Подробнее на сайте Hodder Education
Кембриджская химия IGCSE (третье издание) (Коллинз)
Этот курс обеспечивает полное покрытие обновленной программы Кембриджа по химии IGCSE и наполнен вопросами, подробным содержанием, особенностями практических навыков расследования и многим другим.
Подробнее на сайте Collins
Маршалл Кавендиш Образование Кембриджская химия IGCSE (Маршалл Кавендиш образование)
Эта серия состоит из печатных и цифровых учебных материалов, которые способствуют активному обучению на основе запросов.Он предоставляет множество возможностей для расширения обучения и изучения концепций с помощью своих действий и соответствующих реальных приложений.
Дополнительная информация на сайте Marshall Cavendish Education
Химия для Кембриджского IGCSE (пятое издание)
(Издательство Кембриджского университета)
Благодаря обширным исследованиям, включая наблюдения за уроками, интервью с учителями и работу с нашим онлайн-исследовательским сообществом, эти новые выпуски наших ресурсов по химии были разработаны для решения конкретных задач учителей и учащихся естественных наук.
Подробнее на сайте Cambridge University Press
MCQ по химии — Вопросы викторины по химии для 9 класса
Следующие рабочие листы для подготовки к экзамену включают вопросы с несколькими вариантами ответов (MCQ) и тесты на основе ответов для онлайн-обучения химии в 9 классе, включая темы, перечисленные в алфавитном порядке как:
- MCQ Allotropes 2 контрольных вопроса
- MCQ водного раствора растворенного вещества и растворителя 3 контрольных вопроса
- MCQ по атомным и массовым числам 3 контрольных вопроса
- MCQ экспериментов по атомной структуре 9 контрольных вопросов
- MCQ реакции с атомами 3 контрольных вопроса
- Avogadro Number and Mole MCQ 6 вопросов опроса
- MCQ по природе и свойствам склеивания 4 вопроса опроса
- MCQ ветвей химии 6 вопросов опроса
- MCQ химические связи 2 вопроса опроса
- Химические расчеты MCQ 4 вопроса опроса
- Единицы концентрации MCQ 7 вопросов опроса
- Коррозия и предотвращение MCQ 2 контрольных вопроса
- MCQ электрохимических элементов 9 контрольных вопросов
- Electrochemical Industries MCQs 9 контрольных вопросов
- MCQ электронной конфигурации 5 контрольных вопросов
- Элементы и соединения Частицы MCQ 2 контрольных вопроса
- Элементы, соединения и смеси MCQ 6 контрольных вопросов Que Вопросы
- Эмпирические и молекулярные формулы MCQ 4 контрольных вопроса
- MCQs законы газа 4 контрольных вопроса
- грамм атомной массы Молекулярная масса и граммовая формула MCQ 2 контрольных вопроса
- MCQ межмолекулярных сил 5 контрольных вопросов
- MCQ Ионы и свободные радикалы 9 контрольных вопросов Вопросы
- MCQ по изотопам 6 вопросов теста
- MCQ состояния и свойств жидкости 8 вопросов теста
- MCQ по металлам 12 вопросов теста
- MCQ по молекулярной и формульной массе 5 вопросов теста
- MCQ по неметаллам 6 вопросов теста
- MCQ по окислению и восстановлению 6 вопросов опроса
- MCQ восстановления окисления и реакций 2 вопроса опроса
- MCQ состояний окисления 3 вопроса опроса
- MCQ окисляющих и восстанавливающих агентов 1 вопрос опроса
- MCQ периодической таблицы 13 вопросов опроса
- Периодичность и свойства MCQ 12 вопросов опроса
- Физические состояния материи MCQ 1 Контрольные вопросы 9001 6
- MCQ относительной атомной массы и единицы массы 3 контрольных вопроса
- Насыщенные ненасыщенные перенасыщенные и разбавление раствора MCQ 3 контрольных вопроса
- MCQ твердого тела и свойств 3 контрольных вопроса
- MCQs растворимости 4 контрольных вопроса
- растворов MCQ по суспензии и коллоидам 4 Вопросы викторины
- Типы связей MCQ 13 вопросов викторины
- Типы решений MCQ 9 вопросов викторины
- Типичные свойства MCQ 10 вопросов викторины
Планы уроков химии в шестом классе, домашние задания, викторины
Планы уроков химии в шестом классе, домашние задания, викториныШестой класс Химия
- Шестой класс
Седьмой класс, Восьмой класс еще 2…, Седьмой класс, Восьмой класс - 12,823 Просмотры
- 3 Избранное
Анализирующая точка зрения через сказки
Линдси Джозеф
Местонахождение: Остров Авторская…..
Задача: Студенты смогут: -Описывать ключевую информацию текста с заданной точки зрения -Обсудить разные точки зрения -Откройте для себя важность просмотра…
- Шестой класс
Седьмой класс, Восьмой класс еще 2 …, Седьмой класс, Восьмой класс
- Шестой класс
- Пятый класс
Шестой класс, Седьмой класс, Восьмой класс еще 3…, Шестой класс, Седьмой класс, Восьмой класс - 6,838 Просмотры
- 3 Избранное
Великая гонка вязкости и типы лавы
Дэвид Куявски из Bird Middle
Местонахождение: Геология
Цель: YWBAT: 1.) Определите и объясните вязкость 2.) Проверка вязкости различных жидкостей. 3.) Объясните роль содержания кремнезема и температуры в…
- Пятый класс
Шестой класс, Седьмой класс, Восьмой класс еще 3 …, Шестой класс, Седьмой класс, Восьмой класс
- Пятый класс
- Третий класс
Четвертый класс, Пятый класс, Шестой класс, Седьмой класс еще 4…, четвертый класс, пятый класс, шестой класс, седьмой класс - 4,806 Просмотры
Написание поводка или крючка
Кэти Бирнс
Расположение: Writing Strategies
Цель: Учащиеся будут использовать примеры талантливых писателей, чтобы построить свои собственные творческие зацепки / поводки для своего письма.
- Третий класс
Четвертый класс, Пятый класс, Шестой класс, Седьмой класс Еще 4 …, Четвертый класс, Пятый класс, Шестой класс, Седьмой класс
- Третий класс
Элементы 1
Джон Функ из подготовительной группы Summit International
Местонахождение: Химия I
Задача: SWBAT указать, что такое элемент, и ответить на вопрос о модуле.
Большая идея: «Имею ли я значение?» извечный вопрос. Студенты исследуют этот вопрос философски и научно.
Ресурсы (19)
Размышления (1)
Избранное (234)
Типы энергии (C-MELTS)
Джон Функ из подготовительной группы Summit International
Местонахождение: Physics I
Цель: SWBAT Определить 6 типов энергии
Химические изменения
Джон Функ из подготовительной группы Summit International
Местонахождение: Химия I
Сохранение массы
Джон Функ из подготовительной группы Summit International
Местонахождение: Химия I
Химические свойства
Джон Функ из подготовительной группы Summit International
Местонахождение: Химия I
- Пятый класс
Шестой класс, Седьмой класс, Восьмой класс еще 3…, Шестой класс, Седьмой класс, Восьмой класс - 1,939 Просмотры
Написание выражений и уравнений для реальных сценариев, день 3
Уилл Остин из Roxbury Prep, кампус Mission Hill
Расположение: 6.Цены
Цель: Учащиеся смогут писать выражения и уравнения для реальных сценариев.
- Пятый класс
Шестой класс, Седьмой класс, Восьмой класс еще 3 …, Шестой класс, Седьмой класс, Восьмой класс
- Пятый класс
Соединения
Джон Функ из подготовительной группы Summit International
Местонахождение: Химия I
Что-то пошло не так.Смотрите подробности для получения дополнительной информации
Язык химии 11 класс Химия | Решения
Очень короткие ответы Вопросы:
1. Определите материю.
Ответ: Любая субстанция во Вселенной, которая занимает пространство, имеет вес и претерпевает преобразование массы и энергии, называется материей. Например, почва, воздух и вода — это материя.
2. Различия между чистым и нечистым веществом.
Ответ — Различия между чистыми и нечистыми веществами представлены в следующей таблице:
Чистое вещество | Загрязненное вещество |
Материя, которая состоит только из одного вида компонентов и не может быть далее разделена на более простые единицы, называется чистым веществом. | Материя, состоящая из двух или более чем двух компонентов в любом соотношении, называется нечистой субстанцией. |
Совершенно однородный. | Он может быть однородным или неоднородным. |
Например, элементы, соединения и т. Д. | Например, смеси, сплавы и т. Д. |
3. Что такое элементы? Как они классифицируются по основным классам?
Ans- Самая маленькая форма i.е. основные составляющие вещества, которые не могут быть разделены на какие-либо более простые части с помощью физических или химических процессов, называются элементом. Элементы подразделяются на три основных класса:
и. Металлы — Блестящие электроположительные элементы, обладающие свойствами производства положительных ионов и способностью проводить тепло и электричество, являются металлами. Например, натрий, железо и т. Д.
ii. Неметаллы — Элементы, которые являются электроотрицательными и плохо проводят как тепло, так и электричество, за исключением графита и присутствуют во всех состояниях, являются неметаллами.Например, хлор, водород и т. Д.
iii. Металлоиды — те элементы, которые являются полупроводниками металлов и неметаллов и ведут себя как полупроводники, являются металлоидами. Например бор, кремний и др.
4. Напишите любые два различия между неорганическими и органическими соединениями.
Ответ — Различия между неорганическими и органическими соединениями приведены в таблице ниже;
Неорганические соединения | Органические соединения |
Соединения, в которых не обязательно присутствуют углерод и водород, называются неорганическими соединениями. | Те соединения, в которых углерод и водород являются основными составляющими, называются органическими соединениями. |
Неорганические соединения встречаются относительно реже. | Благодаря способности углерода связываться с органическими соединениями, наиболее распространены органические соединения. |
Например, AgCl 3 , MgO и т. Д. | Например — CH 3 COOH, C 2 H 5 |
5. Классифицируйте следующие соединения на чистые и нечистые по уважительной причине.
А. Воздух
Анс-Воздух является нечистым веществом, поскольку представляет собой смесь нескольких газов, таких как O 2 , CO 2 , N 2 , H 2 и т. Д.
Б. к эрозен
Ans- Керосин
C. Бронза
Анс- Бронза — это сплав меди и олова. Итак, это нечистая субстанция.
D. Солевой раствор
Ans- Солевой раствор — это однородный раствор соли и воды. Таким образом, это нечистая субстанция.
6. Какие типы примесей отделяются с помощью процесса седиментации и декантации?
Ответ — Если компоненты смеси являются жидкостью и твердым веществом, которое тяжелее жидкости, для отделения примесей используется осаждение и декантация.
7. Определите фильтрацию, фильтрат и остаток.
Ans-
Фильтрация — Процесс отделения нерастворимых твердых примесей от жидкости путем пропускания смеси через пористые мембраны называется фильтрацией. Например, пропускание смеси песка и воды через фильтровальную бумагу — это фильтрация.
Фильтрат- Жидкость, содержащая растворенное вещество, которое проходит через поры фильтровальной бумаги, называется фильтратом.Например, вода — это фильтрат в смеси песка и воды.
Остаток — Нерастворимое твердое вещество, оставшееся на фильтровальной бумаге после фильтрации, называется остатком. Например, песок — это остаток смеси песка и воды.
8. Напишите две основные характеристики химического соединения.
Ans- Основные характеристики химического состава:
Их получают как от живых, так и от неживых существ
Они однородны по своей массе.
9. У вас есть смесь поваренной соли, песка и камфоры, в какой последовательности процесса вы можете получить все компоненты в чистом и сухом состоянии?
Ответ. В процессе сублимации мы можем удалить камфору, присутствующую в смеси. Теперь мы можем растворить смесь в воде и представить процесс осаждения и декантации для отделения поваренной соли и песка.
Сублимация → Растворение в воде → Седиментация и декантация
10.Дайте определение химическому изменению и укажите два его важных характера.
Ответ. Постоянное изменение, при котором химическое поведение веществ также изменяется в результате изменения состава молекул, называется химическим изменением. Двумя важными характеристиками химического изменения являются:
1. Образуется / образуются новые вещества.
2. Это необратимое изменение.
11. Определите валентность с помощью подходящих примеров.
Ответ — Объединяющая способность атома или радикала называется валентностью i.е. число электронов, потерянных, полученных или разделенных атомом или радикалом, чтобы получить ближайшее стабильное состояние конфигурации. Например, валентность водорода равна 1, а валентность цинка 2.
12. Напишите молекулярные формулы следующих соединений.
Ans-
Глауберова соль — Na 2 SO 4 .10H 2 O
Aqua fortis- HNO 3
Купорос белый — ZnSO 4 .7H 2 O
Веселящий газ — N 2 O
13. Определите символ. Запишите символ для любых четырех элементов, образованных от их латинского названия.
Ans — символ определяется как краткое буквенное представление элементов в терминах алфавита (ов). Например, символ водорода — H.
.Символ любых четырех элементов, образованных от их латинских названий, — Pb (свинец), K (калий), Na (натрий) и Sn (олово).
14.Сколько электронов и нейтронов присутствует в символе 13 27 Al +3 ?
Ответ — Как показано в символе, имеется 10 электронов и (27-13) = 14 нейтронов.
15. В чем суть химического уравнения?
Ответ — Основы химического уравнения:
Это должна быть настоящая химическая реакция.
Он должен быть сбалансирован.
Должен быть молекулярным
Например, реакция трех молекул водорода и молекулы газообразного азота, катализируемая Fe и промотируемая молибденом, при высоком давлении и низкой температуре дает две молекулы газообразного аммиака.
16. Определите реакции полимеризации на примере.
Ответ — Это можно определить как процесс, в котором несколько маленьких мономеров объединяются с образованием большого полимера.
Например, n (H 2 C = CH 2 ) (этен) → — (CH 2 -CH 2 ) n — (полиэтилен)
17. Определите молекулярную формулу.Какую информацию вы получаете из молекулярной формулы HNO 3 ?
Ans — символическое представление любой молекулы соединения в виде алфавита (ов) и числа (а) называется молекулярной формулой. Например, H 2 O — это молекулярная формула воды.
Информация получена из молекулярной формулы HNO 3 :
I. Данное соединение представляет собой азотную кислоту.
II. Водород, азот и кислород — элементы, присутствующие в соединении.
III. Это молекула азотной кислоты.
IV. Моль азотной кислоты, т.е. 6,023 * 10 23 молекул азотной кислоты.
В. Молекулярная масса соединения составляет 63, т.е. (1 + 14 + 48).
VI. 63 части по весу азотной кислоты состоят из 1 части по весу водорода, 14 частей по весу азота и 48 частей по весу кислорода.
18. Определите реакцию перегруппировки. Приведите пример этой реакции.
Ответ — Тип химической реакции, в которой новый продукт образуется из-за внутреннего изменения атомов без какой-либо потери или увеличения количества атомов, называется реакцией перегруппировки.\ Delta $ NH 2 CONH 2
(цианат аммония) (Мочевина)
19. Напишите химическую формулу пищевой соды, каустической соды и стиральной соды. Каковы их основные применения?
Ответ: пищевая сода имеет химическую формулу NaHCO 3 . Пищевая сода используется в пекарнях.
Химическая формула каустической соды — NaOH. Используется как щелочь.
Химическая формула стиральной соды: Na 2 CO 3 .10H 2 O. Используется в производстве мыла и моющих средств.
20. Напишите любые два основных различия между составами и смесью.
Ответ — Это:
Соединение | Смесь |
Соединения — это чистые вещества, состоящие из двух или более атомов разных элементов. | Загрязненные вещества, полученные при смешивании двух или более чистых веществ, называются смесью. |
Образуется в результате химического изменения. | Образуется в результате физического изменения. |
Например, вода, азотная кислота и т. Д. | Например, раствор соли, камфора, песок и т. Д. |
21. Какую информацию вы получите из следующего уравнения?
2H 2 (г) + O 2 (г) → 2H 2 O (л)
Ответ — Информация, которую мы получаем из данного уравнения:
I. Газообразный водород и газообразный кислород участвуют в реакции с образованием воды.
II. 2 молекулы водорода реагируют с молекулой кислорода, давая 2 молекулы воды.
III. 2 моля водорода реагируют с 1 моль кислорода с образованием 2 моль воды.
IV. 4 грамма водорода реагируют с 32 граммами кислорода, давая 36 моль воды.
V. Масса водорода и кислорода объединяется в соотношении 1: 8, а объем водорода и кислорода объединяется в соотношении 1: 2 с образованием воды.
22. Почему необходимо сбалансировать химическое уравнение?
Ответ: необходимо сбалансировать химическое уравнение, чтобы удовлетворить закону сохранения массы и передать правильную информацию.
23. Определите радикал на примере.
Ans — Атом или группа атомов, которые несут определенное количество заряда и действуют как единое целое во время химических реакций, называются радикалами. Например, CuSO 4 состоит из радикалов Cu 2+ и SO 4 2-.
24. Укажите закон, лежащий в основе балансирования химического уравнения.
Ответ — За балансированием химического уравнения стоит закон сохранения массы.В нем говорится: «Общая масса прореагировавших реагентов равна общей массе образовавшихся продуктов».
25. Определите реакцию гидролиза на примере.
Ans — реакция гидролиза определяется как химическая реакция, осуществляемая водой с любым веществом, выходящим из продукта. Вода здесь является гидролизующим агентом.
Например, FeCl 3 (s) + 3H 2 O (l) ↔ Fe (OH) 3 + 3HCl
26.Определите уравнение скелета.
Ans- Уравнение скелета определяется как уравнение, которое представляет истинную химическую реакцию, но не является химически сбалансированным. Например, Zn + HCl → ZnCl 2 + H 2
27. Отнести следующее к чистому веществу или смеси
Воздух- Смесь
Вода дистиллированная — Чистое вещество
Железо — Чистое вещество
Йодированная соль — Смесь
Бензин — Смесь
Графит- Чистое вещество
Молоко- Смесь
Алмаз — Чистое вещество
Короткие ответы на вопросы:
1.Как классифицируется материя? Напишите краткое описание физической и химической классификации веществ.
Ответ: Любая субстанция во Вселенной, которая занимает пространство, имеет вес и претерпевает преобразование массы и энергии, называется материей. Например, почва, воздух и вода — это материя. Материя классифицируются на основе компонентов и их свойств.
Физическая классификация веществ — На основе физических свойств вещества подразделяются на три состояния.Их:
i) Твердое тело — Состояние вещества, в котором молекулы и ионы прочно удерживаются, а форма и размер вещества фиксированы из-за высокого межмолекулярного взаимодействия, является твердым. Например — соль.
ii) Жидкость — Состояние вещества, в котором межмолекулярной силы притяжения достаточно только для того, чтобы удерживать молекулы друг к другу, но не связывать их, является жидким состоянием. Жидкости имеют фиксированный объем, но не форму. Например — вода.
iii) Газ — Состояние вещества, в котором межмолекулярная сила пренебрежимо мала, а межмолекулярное пространство достаточно велико для свободного движения молекул, — это газовое состояние.Газы не имеют определенной формы или объема. Например, кислород.
Химическая классификация веществ — По химическим свойствам вещества подразделяются на чистые и нечистые;
i) Чистое вещество — Материя, которая состоит только из одного типа компонентов и не может быть далее разделена на какие-либо более простые единицы, называется чистым веществом. Чистые вещества идеально однородны и имеют фиксированный состав, который не меняется с течением времени и массы.Это может быть элемент или соединение. Например, кислород, вода и металлы — чистые вещества.
ii) Загрязненное вещество — Вещество, состоящее из двух или более чистых гомогенных веществ в любой произвольной пропорции, называется нечистым веществом. Его также можно назвать смесью. Загрязненное вещество может быть гомогенным или гетерогенным. Все составляющие вещества сохраняют свои свойства в смеси. Их можно разделить с помощью определенных методов разделения. Например, молоко, бензин и сплавы — нечистые вещества.
2. Различия между
а. Гомогенная и неоднородная смесь.
Гомогенная смесь | Гетерогенная смесь |
1. Гомогенная смесь имеет однородный состав по всей пробе. | 1. Гетерогенная смесь не имеет однородного состава по всей пробе. |
2. Составляющие гомогенной смеси трудно увидеть невооруженным глазом. | 2. Составляющие гетерогенной смеси хорошо видны невооруженным глазом. |
3. Гомогенная смесь требует специального процесса разделения компонентов. | 3. Гетерогенную смесь иногда легко разделить даже вручную. |
Например, солевой раствор представляет собой однородную смесь. | Например, песок и соль — неоднородная смесь. |
г. Элементы и соединения.
Элементы | Соединения |
1.Наименьшая форма, то есть основные составляющие вещества, которые не могут быть разделены на какие-либо более простые части с помощью физических или химических процессов, называется элементом. | 1. Соединения — это чистые вещества, состоящие из двух или более атомов разных элементов. |
2. На сегодняшний день известно всего 92 природных элемента. | 2. Существуют миллионы соединений. |
3. Элемент — это простейшая форма материи. | 3. Для образования соединения необходимы два или более атома. |
Например, водород и кислород являются элементами. | Например, вода — это соединение. |
3.Определите химическое уравнение. Какая информация получается из сбалансированного химического уравнения? Каковы ограничения химического уравнения скелета?
Ans — символическое представление химической реакции в виде букв, цифр и знаков называется химическим уравнением. Например,
Реакция трех молекул водорода и молекулы газообразного азота, катализируемая Fe и промотируемая молибденом, при высоком давлении и низкой температуре дает две молекулы газообразного аммиака.
Информация, которую мы получаем из сбалансированного химического уравнения:
и. Название реактивов и продуктов.
ii. Количество атомов или молекул реагентов и продуктов.
iii. Количество молей реагентов и продуктов.
iv. Масса задействованных реагентов и образовавшихся продуктов.
v. Соотношение масса-масса, объем-объем, массово-объемное отношение реагентов и продуктов.
Ограничения химического уравнения:
и.Он не отражает общее количество атомов / молекул, вступающих в реакцию и образующих вовлеченные частицы.
ii. Он не следует закону сохранения массы.
iii. Стехиометрические соотношения не могут быть получены.
iv. Это не истинное представление о химической реакции.
4. Опишите любые три типа химических реакций с примерами каждой.
Ответ — Они описаны следующим образом:
i) Реакция объединения — Химическая реакция, в которой два или более реагентов объединяются с образованием химического соединения, называется реакцией объединения.Комбинированная реакция осуществляется путем приложения тепла, давления, электричества или света. Например,
H 2 (г) + O 2 (г) 2H 2 O (л)
ii) Реакция кислотно-щелочной нейтрализации — В этом типе реакции, в которой реагирующие частицы являются кислотой и основанием, и, как говорят, они нейтрализуют друг друга с образованием соли и воды. Ее также называют «реакцией образования воды». Например,
HCl (водн.) + NaOH (водн.) → NaCl (водн.) + H 2 O (л)
iii) Реакция полимеризации — Ее можно определить как процесс, в котором несколько небольших мономеров объединяются с образованием полимера.
Например, n (H 2 C = CH 2 ) (этен) → — (CH 2 -CH 2 ) n — (полиэтилен)
5. Какие факторы необходимы, чтобы вызвать химическую реакцию?
Ans — Химические реакции — это процесс, вызывающий химические изменения в реагентах за счет применения тепла, света, давления и электричества и производящий химически различные продукты.Факторы, необходимые для химической реакции:
i) Контакт. Простой контакт между реагентами необходим для возникновения любой реакции.
ii) Тепло. Как правило, для разрыва прочных межъядерных связей и инициирования реакции требуется тепло.
iii) Давление — Для протекания некоторых реакций требуется высокое давление
iv) Электричество. Для объединения, разложения или любых других химических изменений требуется электричество.
v) Свет — Фотохимические реакции протекают только в присутствии света.
vi) Катализатор — Катализатор необходим для ускорения или замедления скорости реакции.
vii) Звук. В присутствии звука происходит некоторая химическая реакция, такая как разложение ацетилена на углерод и водород.
6. Делайте короткие записи на
a) Реакция замещения — Реакция, в которой компонент одного соединения замещает другой компонент другого соединения, занимая свое положение, называется реакцией замещения.
Существует два типа реакции смещения:
Реакция одиночного замещения — В этом типе реакции один элемент вытесняет другой из соединения
Представление этой реакции: A + BX → AX + B.
Примеры реакции однократного вытеснения:
Zn (т) + H 2 SO 4 (водн.) → ZnSO 4 + H 2
Fe (тв) + CuSO 4 (водн.) → Cu (тв) + FeSO 4
Реакция двойного вытеснения — Процесс взаимного обмена радикалами соединений, участвующих в образовании двух новых соединений, называется реакцией двойного вытеснения.Этот тип реакции включает разложение и рекомбинацию. Представление этой реакции: AX + BYAY + BX
.Примеры реакций двойного вытеснения:
NaCl + AgNO 3 (водн.) → AgCl (т.) NaNO 2 (водн.)
H 2 SO 4 + NaCl → HCl (г) + Na 2 SO 4
б) Реакция нейтрализации — Реакция нейтрализации означает просто кислотно-щелочную реакцию с образованием соли и воды.В этом типе реакции, в которой реагирующие частицы являются кислотой и основанием, и говорят, что они нейтрализуют друг друга с образованием соли и воды. Ее также называют «реакцией образования воды». Например,
HCl (водн.) + NaOH (водн.) → NaCl (водн.) + H 2 O (л)
H 2 SO 4 (водн.) + KOH (водн.) → K 2 SO 4 (водн.) + H 2 O (л)
7. Балансировка по уравнениям методом проб и ошибок.
a) Na 2 S 2 O 3 + I 2 → Na 2 S 4 O 6 + NaI
Ans-S содержит максимальное количество атомов, сначала он сбалансирован, а затем — Na.
Na 2 S 2 O 3 + I 2 → Na 2 S 4 O 6 + 2NaI
б) CuFeS 2 + O 2 → Cu 2 S + FeS + SO 2
Ans- Cu сбалансирован первым, за ним следует S.
2CuFeS 2 + O 2 → Cu 2 S + 2FeS + SO 2
c) H 2 SO 4 + Al (OH) 3 → Al 2 (SO 4 ) 3 + H 2 O
Ans-SO 4 сначала уравновешивается, затем уравновешивается Al и, наконец, H, чтобы получить сбалансированное уравнение.
3H 2 SO 4 + 2Al (OH) 3 → Al 2 (SO 4 ) 3 + 3H 2 O
d) K 4 [Fe (CN) 6 ] + FeCl 3 → Fe 4 [Fe (CN) 6 ] 3 + KCl
Ans — сначала баланс K, затем Fe и Cl.Cl наконец-то как оказывается минимум раз.
3K 4 [Fe (CN) 6 ] + 4FeCl 3 → Fe 4 [Fe (CN) 6 ] 3 + 12KCl
д) S + NaOH → Na 2 S + Na 2 S 2 O 3 + H 2 O
Ans — сначала балансировка S, затем Na и O балансируются за один шаг.
3S + 4NaOH → Na 2 S + Na 2 S 2 O 3 + H 2 O
f) Ag 2 S + NaCN → Na [Ag (CN) 2 ] + Na 2 S
Ans- баланс сначала Ag, а затем Na, остальные уравновешиваются.
Ag 2 S + 4NaCN → 2Na [Ag (CN) 2 ] + Na 2 S
г) NO + H 2 O + O 2 → HNO 3
Ответ: сначала сбалансируйте H, а затем N и O, потому что O является наиболее распространенным.
4НО + 2H 2 O + 3O 2 → 4HNO 3
ч) NH 3 + O 2 → NO + H 2 O
Ответ — сначала сбалансируйте H и N и сбалансируйте O, чтобы получить следующую сбалансированную реакцию.
4NH 3 + 5O 2 → 4NO + 6H 2 O
Научные эксперименты для детей с доставкой прямо к вам
Искусно построенный учеными и родителями
В нашей команде 10 кандидатов наук, а число детей всех возрастов растет.Как ученые и родители, мы знаем, что мы делаем (и для кого мы это делаем).
Новейшие технологии
Мы используем виртуальную реальность, чтобы вывести обучение на новый уровень понимания. Наши уроки виртуальной реальности охватывают все основные темы стандартной школьной программы.
Доказано, что улучшает успеваемость
Исследования, проведенные Технологическим институтом Нью-Джерси, показывают, что наши уроки помогают детям лучше сдавать экзамены.
Тщательно протестировано в лабораториях
Наши наборы соответствуют европейским нормам безопасности (EN 71-4), отвечают самым строгим стандартам и делают их полностью безопасными для домашнего использования.
Образование, замаскированное под развлечение
Более 2,5 миллионов подписчиков по всему миру с удовольствием смотрят наши научные видео в социальных сетях. А экспериментировать самому — еще веселее!
.