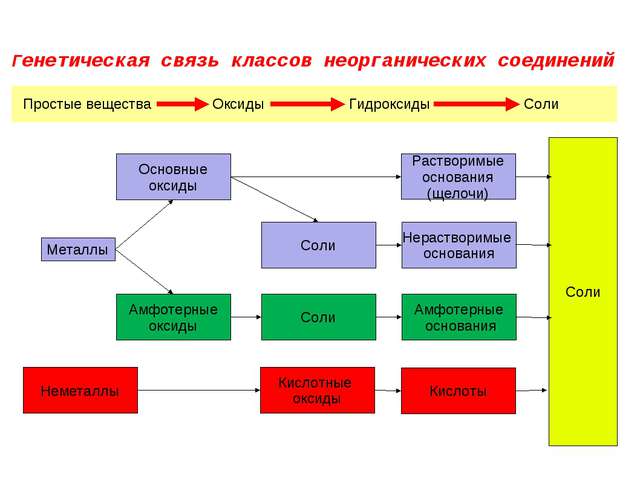
Контрольная работа №3 по теме: «Классы неорганических соединений»
Контрольная работа 3
Вариант 1
Из приведенного списка выпишите формулы солей и назовите их. Нерастворимые соли в этом списке подчеркните:
K2SO4, Na2O, CO2, NaOH, CaCO3, Cu(OH)2, H2SO4, AgCl, N2O5, Fe2O3, Ba(OH)2, HCl
2. К основным оксидам относится
а) ZnO б) SiO2 в) BaO г) Al2 О3
3. Оксид серы(VI) взаимодейсвует с
К 2) К2О 3) Р2О5 4) Н2SО4
4. Группа формул веществ, включающая формулы основания, кислоты, соли и кислотного оксида:
1) CuO, Zn(OH)2, AlCl3, K2S | 3) SO2, H2SO4, NaCl, CuO |
2) Cu(OH)2, HCl, NaNO3, SO3 | 4) Zn(OH)2 ,HCl, K2S, Na2O |
5. Металлы, реагирующие с раствором соляной кислоты:
Металлы, реагирующие с раствором соляной кислоты:
1) Ca | 3) Zn | 5) Ag |
2) Mg | 4) Cu | 6) Fe |
6. К кислотам относится каждое из 2-х веществ:
а) H2S, Na2CO3 б) K2SO4, Na2SO4 в) H3PO4, HNO3 г) KOH, HCl
7. С какими из веществ, приведенных ниже, реагирует соляная кислота?
Выберите номера правильных ответов.
Cu 2) CuO 3) Fe(OH)3 4) CaCO3 5) CaSO4.
8. Установите соответствие между формулой исходных веществ и продуктами реакций
Продукты взаимодействия | |
а) Mg + HCl → | 1) MgCl2 |
б) Mg(OH)2 + CO2 → | 2) MgCl2 + H2 |
в) Mg(OH)2 + HCl → | 3) MgCl2 + H2O |
4) MgCO3 + H2 | |
5) MgCO3 + H2O |
9.
10. Завершите уравнения реакций, определите тип реакций.
Мg + HCl →
CO2 + K2O →
Ca(NO3)2 + Na2CO3 →
11. Какая масса сульфата калия образуется при взаимодействии 49 г серной кислоты с гидроксидом калия?
12.* Определите массу соли, которая образуется, если к ортофосфорной кислоте прилили 10%-ный раствор гидроксида натрия массой 60 г.
Вариант 2
1. Из приведенного списка выпишите формулы гидроксидов и назовите их. Формулы щелочей подчеркните: K
2. Серная разбавленная кислота взаимодействует с (выпишите все возможные варианты): 1) Zn 2) ВаО 3) N2О 3) КОН.
3. Оксид натрия реагирует с каждым из двух веществ:
а) водой и оксидом кальция б) кислородом и водородом
в) сульфатом калия и гидроксидом натрия
г) фосфорной кислотой и оксидом серы (IV)
4. Установите соответствие между формулой исходных веществ и продуктами реакций
Формулы веществ | Продукты взаимодействия |
а) Fe + HCl → | 1) FeCl2 |
б) Fe(OH)2 + CO2 → | 2) FeCl2 + H2 |
в) Fe(OH)2 + HCl → | 3) FeCl2 + H2O |
4) FeCO3 + H2 | |
5) FeCO3 |
5. Группа формул веществ, включающая формулы основания, кислоты, соли и основного оксида:
Группа формул веществ, включающая формулы основания, кислоты, соли и основного оксида:
1) BaO, AlCl3, H3PO4, Pb(NO3)2 | 3) FeSO4 , SO2 , H2CO3, Fe(OH)2 |
2) CuO, H2SO3, KNO3, Ba(OH)2 | 4) Ca(OH)2 ,NaCl, Na |
6. С какими из веществ, приведенных ниже, реагирует гидроксид натрия? Выберите номера правильных ответов.
1) CuO 2) CO2 3) Ba(OH)2 4) CuCl2 5) H2SO4
7. Металл, реагирующий с водным раствором сульфата меди (II):
1) цинк | 3) ртуть |
2) платина | 4) серебро |
8. Пара формул веществ, реагирующих с оксидом углерода (IV):
Пара формул веществ, реагирующих с оксидом углерода (IV):
1) H2O, P2O5 | 3) К2О, О2 |
2) NaOH, H2O | 4) Ca(OH)2, H2SO4 |
9. Запишите уравнения реакций, изображенные в виде схемы:
SО3 → H2SO4 → Na2SO4 → СaSO4
10. Завершите уравнения реакций, определите тип реакций.
CuO + HCl→ К2О + SO3 → H2SO4 + Na2CO
11. Какая масса сульфата бария образуется при взаимодействии 30,6 г оксида бария с достаточным количеством серной кислоты?
12. *Какая масса азотной кислоты необходима для полной нейтрализации 20 %-ного раствора гидроксида бария массой 342 г.
Основания | Кислоты | Соли | |
Основания | Кислоты | Соли | |
Контрольная работа по теме» Классы неорганических соединений»
Работа состоит из трех заданий. Дописать уравнение реакции и расставить коэффициенты.Решить задачуи осуществить превращение.
Дописать уравнение реакции и расставить коэффициенты.Решить задачуи осуществить превращение.
Просмотр содержимого документа
«Контрольная работа по теме» Классы неорганических соединений»»
Вариант 1
1. Написать уравнение реакций в молекулярном и ионном виде:
Са(NО3)2 + К2СО3
-HNО3 + Ba(OH)2
2. Какой объём водорода можно получить, при взаимодействии 13 г цинка и серной кислоты?
3. Осуществить превращение и написать уравнение реакций:
Zn ZnO Zn(OH)2 ZnSO4 BaSO4.
Вариант 2
1. Написать уравнение реакций в молекулярном и ионном виде:
Н2SO4 + Zn(OH)2
Мg (ОН)2 + НСl
2. К раствору, содержащему 14,2 г сульфата натрия, добавили раствор
К раствору, содержащему 14,2 г сульфата натрия, добавили раствор
хлорида бария. Сколько граммов сульфата бария образовалось?
3. Осуществить превращение и написать уравнение реакций:
Fe FeСl3 Fe (ОН)3 Fe2(SO4)3 BaSO4.
Вариант 3
1. Написать уравнение реакций в молекулярном и ионном виде:
Н2SО4 + ZnS
Na2SO4 + ВаСl2
2. Сколько граммов гидроксида меди (11) образуется при взаимодействии 32г сульфата меди и гидроксида натрия?
3. Осуществить превращение и написать уравнение реакций:
Са СаО Са(ОН)2 Са(NO3)2 Са(ОН)2
Вариант 4
1. Написать уравнение реакций в молекулярном и ионном виде:
Zn(ОН)2 + H2SO4
СаСО3 + НNО3
2. Сколько граммов хлорида серебра образуется при взаимодействии 17г нитрата серебра и хлорида бария?
Сколько граммов хлорида серебра образуется при взаимодействии 17г нитрата серебра и хлорида бария?
3. Осуществить превращение и написать уравнение реакций:
Сu (ОН)2 CuO Сu (NО3)2 Сu (ОН)2 СuС12
Контрольная работа для 8 класса по теме «Основные классы неорганических соединений»
8 класс Контрольная работа
«Основные классы неорганических соединений»
Вариант 1
уровень ( на 3 балла)
1.Распределите вещества по классам:
SnCl2, P2O5, ZnO, AgNO3, Ba(OH)2, H2CO3, H2SO4, LiOH, HJ, Al(OH)3, HgO, CaCO3. Назовите вещества.
2. Установите соответствие между формулой исходных веществ и продуктами реакций
HgO + HNO3 а) Al2(SO4)3 + Н2О
Аl + H2SO4 б) К3РO4 + Н2O
К2O + Н3РO4 в) Hg(NO3)2 + Н2O
г) Al2(SO4)3 + Н2
2 уровень (на 4 балла)
3. Выберите вещества, которые будут взаимодействовать с NaOH и составьте уравнения реакций : а) К2O, б) Ba(OH)2, в) H2SiO3, г) Al(OH)3.
Выберите вещества, которые будут взаимодействовать с NaOH и составьте уравнения реакций : а) К2O, б) Ba(OH)2, в) H2SiO3, г) Al(OH)3.
3 уровень (на 5 баллов)
4. Осуществите цепочку следующих превращений:
Р → P2O5 → Н3РO4 Na3PO4
8 класс Контрольная работа
«Основные классы неорганических соединений»
Вариант 2
1 уровень ( на 3 балла)
1.Распределите вещества по классам:
CO2, FeCl2, ZnO, MgSO4, Ba(OH)2, FeS, H2SiO3, KOH, H2SO4, CuSO4, HBr, Al(OH)3. Назовите вещества.
2. Установите соответствие между формулой исходных веществ и продуктами реакций
1) NaOH + СO2 A) FeO + H2O
2) Fe (ОН)2 + HCl Б) Na2CO3 + H2O
3) Fe(ОН)2 В) Na2CO3
Г) FeCl2+ H2O
2 уровень (на 4 балла)
3. Выберите вещества, которые будут взаимодействовать соляной кислотой и составьте уравнения реакций : а)P2O5, б)ZnO, в)AgNO3, г)H2CO3.
Выберите вещества, которые будут взаимодействовать соляной кислотой и составьте уравнения реакций : а)P2O5, б)ZnO, в)AgNO3, г)H2CO3.
3уровень (на 5 баллов)
4. Осуществите цепочку следующих превращений:
Ca → CaO→ Ca(OH)2 → CaCl2 .
8 класс Контрольная работа № 2
«Основные классы неорганических соединений»
Вариант 3
1 уровень ( на 3 балла)
1.Распределите вещества по классам: Al2(SO4)3, H2CO3, BaO, CO2, Ca(OH)2, ZnS, SO3, H3PO4, NaOH, Fe(OH)2, N2O5, HNO3. Назовите вещества
2. Установите соответствие между формулой исходных веществ и продуктами реакций
1. Fe + HCl → а) FeCl2
2. Fe(OH)2 + CO2 → б) FeCl2 + h3
3. Fe(OH)2 + HCl → в) FeCl2 + h3O
г) FeCO3 + h3
д) FeCO3 + h3O
2 уровень (на 4 балла)
3. Выберите вещества, которые будут взаимодействовать с водой и составьте уравнения реакций : а)P2O5, б) ZnO, в)BaО, г)H2CO3
Выберите вещества, которые будут взаимодействовать с водой и составьте уравнения реакций : а)P2O5, б) ZnO, в)BaО, г)H2CO3
3уровень (на 5 баллов)
4. Осуществите цепочку следующих превращений:
а) ZnO→ Zn SO4→ Zn(OH)2 → ZnO
8 класс Контрольная работа № 2
«Основные классы неорганических соединений»
Вариант 4
1 уровень ( на 3 балла)
1.Распределите вещества по классам:
K3PO4, Na2CO3, CO2, Cr(OH)3, Ca(OH)2, SO3, HCl, K2SO4, NaOH, K2O, NaNO3, HNO3. Назовите вещества.
2. Установите соответствие между формулой исходных веществ и продуктами реакций
NaOH + Р2O5 → а)Na3PO4 + H2O
2. NaOH + H2SO4 б)Na3PO4 + H2
NaOH + H2SO4 б)Na3PO4 + H2
3. Na2O + SO3 в) Na2SO4
г) Na2SO4 + H2O
2 уровень (на 4 балла)
3. Выберите вещества, которые будут взаимодействовать с КОН и составьте уравнения реакций: а)CO2, б)FeCl2, в)KOH, г) HBr.
3уровень (на 5 баллов)
4. Осуществите цепочку следующих превращений:
Mg → MgCl2→Mg(OH)2 → MgO
Контрольная работа по теме Классы неорганических соединений
Контрольная работа
по теме «Классы неорганических соединений».
Вариант 1
1. Напишите уравнения всех возможных реакций между следующими веществами: фосфорная кислота, оксид магния, гидроксид лития, оксид углерода (IV).
2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ:
углерод оксид углерода (IV) угольная кислота карбонат натрия сульфат
натрия
3. Вычислите массу сульфата бария, образовавшегося в результате смешивания раствора, содержащего 17 г гидроксида бария и раствором серной кислоты.
Вычислите массу сульфата бария, образовавшегося в результате смешивания раствора, содержащего 17 г гидроксида бария и раствором серной кислоты.
Контрольная работа
по теме «Классы неорганических соединений».
Вариант 2
1. Напишите уравнения всех возможных реакций между следующими веществами: нитрат натрия, хлороводородная кислота, гидроксид натрия, хлорид магния.
2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ:
Магний оксид магния гидроксид магния сульфат магния нитрат магния
3. Вычислите массу хлорида серебра, образовавшегося при взаимодействии 135 г нитрата серебра и соляной кислоты.
Контрольная работа
по теме «Классы неорганических соединений».
Вариант 1
1. Напишите уравнения всех возможных реакций между следующими веществами: фосфорная кислота, оксид магния, гидроксид лития, оксид углерода (IV).
2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ:
Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ:
углерод оксид углерода (IV) угольная кислота карбонат натрия сульфат
натрия
3. Вычислите массу сульфата бария, образовавшегося в результате смешивания раствора, содержащего 17 г гидроксида бария и раствором серной кислоты.
Контрольная работа
по теме «Классы неорганических соединений».
Вариант 2
1. Напишите уравнения всех возможных реакций между следующими веществами: нитрат натрия, хлороводородная кислота, гидроксид натрия, хлорид магния.
2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ:
Магний оксид магния гидроксид магния сульфат магния нитрат магния
3. Вычислите массу хлорида серебра, образовавшегося при взаимодействии 135 г нитрата серебра и соляной кислоты.
Повторная Контрольная работа
по теме «Классы неорганических соединений».
1. Напишите уравнения всех возможных реакций между следующими веществами: серная кислота, оксид калия, гидроксид натрия, оксид фосфора (V), натрий.
2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ:
кремний оксид кремния (IV) кремниевая кислота силикат калия сульфат
калия
3. Вычислите массу карбоната магния, образовавшегося в результате смешивания раствора, содержащего 56 г нитрата магния и раствором карбоната натрия.
Адрес публикации: https://www.prodlenka.org/metodicheskie-razrabotki/130857-kontrolnaja-rabota-po-teme-klassy-neorganiche
Контрольная работа на тему «Классы неорганических соединений» (8 класс Габриелян – 3 вариант)
Часть А. Тестовые задания с выбором одного правильного ответа и на соотнесение
Тестовые задания с выбором одного правильного ответа и на соотнесение
1. Группа формул оксидов:
2. Формула хлорида железа (II):
3. Группа формул, в которой содержатся основание, кислота, соль и основный оксид:
4. Изменение свойств оксидов от кислотных к основным происходит в ряду веществ с формулами:
5. Пара формул веществ, реагирующих с оксидом углерода(IV):
6. Пара формул металлов, реагирующих с раствором разбавленной серной кислоты:
7. Пара формул веществ, реагирующих с раствором гидроксида калия:
8. С водным раствором нитрата серебра взаимодействует:
9. Пара формул веществ, вступающих в реакцию друг с другом:
10. В уравнении реакции:
CaO + X = CaSO4 + h3O
веществом Х является вещество с формулой:
11. Соотнесите.
Соотнесите.
Формула оксида: 1. Fe2O3 2. CO2 3. CaO 4. P2O5
Формула гидроксида: А. h3CO3 Б. Fe(OH)3 В. Fe(OH)2 Г. Ca(OH)2 Д. h4PO4
Часть Б. Задания со свободным ответом
12. С какими из перечисленных веществ вступает в реакцию соляная кислота: оксид цинка, оксид углерода (IV), железо, медь? Составьте уравнения возможных реакций в молекулярном и ионном виде.
13. Предложите не менее двух способов получения ортофосфата натрия. Составьте уравнения реакций в молекулярном виде, укажите типы реакций.
14. Даны вещества, формулы которых: Na2O, SO3, h3O, CuO. Составьте уравнения возможных реакций между ними.
15. Выберите формулу «лишнего» вещества в каждом ряду, используя знания о классификации веществ:
|
|
| ||||||||||||||
химическое соединение | Определение, примеры и типы
Химическое соединение , любое вещество, состоящее из идентичных молекул, состоящих из атомов двух или более химических элементов.
молекула метанаМетан, в котором четыре атома водорода связаны с одним атомом углерода, является примером основного химического соединения. На структуру химических соединений влияют сложные факторы, такие как валентные углы и длина связи.
Encyclopædia Britannica, Inc.Британская викторина
Подводки к химии
Возможно, вы знаете, что элементы составляют воздух, которым мы дышим, и воду, которую мы пьем, но знаете ли вы о них больше? Какой элемент почти такой же легкий, как водород? Что вы называете смесью двух химических элементов? Узнайте ответы в этой викторине.
Вся материя Вселенной состоит из атомов более чем 100 различных химических элементов, которые встречаются как в чистом виде, так и в сочетании в химических соединениях.Образец любого данного чистого элемента состоит только из атомов, характерных для этого элемента, и атомы каждого элемента уникальны. Например, атомы углерода отличаются от атомов железа, которые, в свою очередь, отличаются от атомов золота. Каждый элемент обозначается уникальным символом, состоящим из одной, двух или трех букв, возникающих либо из текущего имени элемента, либо из его исходного (часто латинского) имени. Например, символы углерода, водорода и кислорода — это просто C, H и O соответственно.Символ железа — Fe, от оригинального латинского названия ferrum . Фундаментальный принцип химической науки состоит в том, что атомы различных элементов могут объединяться друг с другом с образованием химических соединений. Известно, что, например, метан, который образован из элементов углерода и водорода в соотношении четыре атома водорода на каждый атом углерода, содержит отдельные молекулы CH 4 . Формула соединения — например, CH 4 — указывает типы присутствующих атомов, с нижними индексами, представляющими относительное количество атомов (хотя цифра 1 никогда не записывается).
Формула соединения — например, CH 4 — указывает типы присутствующих атомов, с нижними индексами, представляющими относительное количество атомов (хотя цифра 1 никогда не записывается).
Молекула воды состоит из двух атомов водорода и одного атома кислорода. Один атом кислорода содержит шесть электронов в своей внешней оболочке, которая может содержать в общей сложности восемь электронов. Когда два атома водорода связаны с атомом кислорода, внешняя электронная оболочка кислорода заполняется.
Encyclopædia Britannica, Inc. Вода, которая представляет собой химическое соединение водорода и кислорода в соотношении два атома водорода на каждый атом кислорода, содержит молекулы H 2 O.Хлорид натрия — это химическое соединение, образованное из натрия (Na) и хлора (Cl) в соотношении 1: 1. Хотя формула хлорида натрия — NaCl, соединение не содержит реальных молекул NaCl. Скорее, он содержит равное количество ионов натрия с положительным зарядом (Na + ) и ионов хлора с отрицательным зарядом (Cl — ). ( См. Ниже Тенденции в химических свойствах элементов для обсуждения процесса превращения незаряженных атомов в ионы [i.е., виды с положительным или отрицательным суммарным зарядом].) Упомянутые выше вещества представляют собой два основных типа химических соединений: молекулярные (ковалентные) и ионные. Метан и вода состоят из молекул; то есть они являются молекулярными соединениями. С другой стороны, хлорид натрия содержит ионы; это ионное соединение.
( См. Ниже Тенденции в химических свойствах элементов для обсуждения процесса превращения незаряженных атомов в ионы [i.е., виды с положительным или отрицательным суммарным зарядом].) Упомянутые выше вещества представляют собой два основных типа химических соединений: молекулярные (ковалентные) и ионные. Метан и вода состоят из молекул; то есть они являются молекулярными соединениями. С другой стороны, хлорид натрия содержит ионы; это ионное соединение.
Атомы различных химических элементов можно сравнить с буквами алфавита: так же, как буквы алфавита объединяются, образуя тысячи слов, атомы элементов могут объединяться различными способами, образуя бесчисленное множество соединений. .На самом деле известны миллионы химических соединений, и многие миллионы возможны, но еще не открыты или синтезированы. Большинство веществ, встречающихся в природе, таких как древесина, почва и камни, представляют собой смеси химических соединений. Эти вещества могут быть разделены на составляющие их соединения физическими методами, которые не изменяют способ агрегирования атомов в соединениях. Соединения можно разделить на составные элементы путем химических изменений.Химическое изменение (то есть химическая реакция) — это изменение, при котором организация атомов изменяется. Пример химической реакции — горение метана в присутствии молекулярного кислорода (O 2 ) с образованием диоксида углерода (CO 2 ) и воды. CH 4 + 2O 2 → CO 2 + 2H 2 O В этой реакции, которая является примером реакции горения, происходят изменения в том, как атомы углерода, водорода и кислорода связаны друг с другом. в соединениях.
Соединения можно разделить на составные элементы путем химических изменений.Химическое изменение (то есть химическая реакция) — это изменение, при котором организация атомов изменяется. Пример химической реакции — горение метана в присутствии молекулярного кислорода (O 2 ) с образованием диоксида углерода (CO 2 ) и воды. CH 4 + 2O 2 → CO 2 + 2H 2 O В этой реакции, которая является примером реакции горения, происходят изменения в том, как атомы углерода, водорода и кислорода связаны друг с другом. в соединениях.
Химические соединения обладают поразительным набором характеристик. При обычных температурах и давлениях некоторые из них являются твердыми телами, некоторые — жидкостями, а некоторые — газами. Цвета различных составных частей совпадают с цветами радуги. Некоторые соединения очень токсичны для человека, тогда как другие необходимы для жизни. Замена только одного атома в соединении может быть причиной изменения цвета, запаха или токсичности вещества.Чтобы понять это огромное разнообразие, были разработаны системы классификации. В приведенном выше примере соединения классифицируются как молекулярные или ионные. Соединения также подразделяются на органические и неорганические. Органические соединения ( см. Ниже Органические соединения), названные так потому, что многие из них были первоначально изолированы от живых организмов, обычно содержат цепи или кольца из атомов углерода. Из-за огромного разнообразия способов связывания углерода и других элементов существует более девяти миллионов органических соединений.Соединения, которые не считаются органическими, называются неорганическими соединениями ( см. Ниже Неорганические соединения).
Замена только одного атома в соединении может быть причиной изменения цвета, запаха или токсичности вещества.Чтобы понять это огромное разнообразие, были разработаны системы классификации. В приведенном выше примере соединения классифицируются как молекулярные или ионные. Соединения также подразделяются на органические и неорганические. Органические соединения ( см. Ниже Органические соединения), названные так потому, что многие из них были первоначально изолированы от живых организмов, обычно содержат цепи или кольца из атомов углерода. Из-за огромного разнообразия способов связывания углерода и других элементов существует более девяти миллионов органических соединений.Соединения, которые не считаются органическими, называются неорганическими соединениями ( см. Ниже Неорганические соединения).
Ртуть (химический символ: Hg) — единственный металлический элемент, который находится в жидком состоянии при комнатной температуре.
В рамках широкой классификации органических и неорганических веществ существует множество подклассов, в основном основанных на конкретных элементах или группах присутствующих элементов. Например, среди неорганических соединений оксиды содержат ионы O 2- или атомы кислорода, гидриды содержат ионы H — или атомы водорода, сульфиды содержат ионы S 2- и т. Д.Подклассы органических соединений включают спирты (содержащие группу OH), карбоновые кислоты (характеризующиеся группой COOH), амины (содержащие группу NH 2 ) и так далее.
Различные способности различных атомов объединяться с образованием соединений лучше всего можно понять с помощью периодической таблицы. Периодическая таблица Менделеева была первоначально построена для представления закономерностей, наблюдаемых в химических свойствах элементов ( см. химическая связь). Другими словами, по мере развития науки химии было обнаружено, что элементы можно сгруппировать в соответствии с их химической реакционной способностью. Элементы с подобными свойствами перечислены в вертикальных столбцах периодической таблицы и называются группами. По мере раскрытия деталей атомной структуры стало ясно, что положение элемента в периодической таблице коррелирует с расположением электронов, которыми обладают атомы этого элемента ( см. Атом ). В частности, было замечено, что электроны, которые определяют химическое поведение атома, находятся в его внешней оболочке. Такие электроны называются валентными электронами.
Элементы с подобными свойствами перечислены в вертикальных столбцах периодической таблицы и называются группами. По мере раскрытия деталей атомной структуры стало ясно, что положение элемента в периодической таблице коррелирует с расположением электронов, которыми обладают атомы этого элемента ( см. Атом ). В частности, было замечено, что электроны, которые определяют химическое поведение атома, находятся в его внешней оболочке. Такие электроны называются валентными электронами.
Периодическая таблица элементов.
Encyclopædia Britannica, Inc. Например, атомы элементов в группе 1 периодической таблицы все имеют один валентный электрон, атомы элементов в группе 2 имеют два валентных электрона, и так далее, до группы 18 , элементы которого содержат восемь валентных электронов. Самое простое и самое важное правило для предсказания того, как атомы образуют соединения, состоит в том, что атомы имеют тенденцию объединяться таким образом, чтобы они могли либо опустошить свою валентную оболочку, либо завершить ее (т. е., заполните его), в большинстве случаев всего с восемью электронами. Элементы в левой части таблицы Менделеева имеют тенденцию терять свои валентные электроны в химических реакциях. Натрий (в Группе 1), например, имеет тенденцию терять свой одинокий валентный электрон с образованием иона с зарядом +1. Каждый атом натрия имеет 11 электронов ( e — ), каждый с зарядом -1, чтобы просто уравновесить заряд +11 на его ядре. Потеря одного электрона оставляет его с 10 отрицательными зарядами и 11 положительными зарядами, что дает суммарный заряд +1: Na → Na + + e —.Калий, расположенный непосредственно под натрием в Группе 1, также образует в своих реакциях +1 ион (K + ), как и остальные члены Группы 1: рубидий (Rb), цезий (Cs) и франций (Fr). Атомы элементов в правом конце периодической таблицы имеют тенденцию вступать в реакции, так что они получают (или разделяют) достаточно электронов, чтобы заполнить свою валентную оболочку.
е., заполните его), в большинстве случаев всего с восемью электронами. Элементы в левой части таблицы Менделеева имеют тенденцию терять свои валентные электроны в химических реакциях. Натрий (в Группе 1), например, имеет тенденцию терять свой одинокий валентный электрон с образованием иона с зарядом +1. Каждый атом натрия имеет 11 электронов ( e — ), каждый с зарядом -1, чтобы просто уравновесить заряд +11 на его ядре. Потеря одного электрона оставляет его с 10 отрицательными зарядами и 11 положительными зарядами, что дает суммарный заряд +1: Na → Na + + e —.Калий, расположенный непосредственно под натрием в Группе 1, также образует в своих реакциях +1 ион (K + ), как и остальные члены Группы 1: рубидий (Rb), цезий (Cs) и франций (Fr). Атомы элементов в правом конце периодической таблицы имеют тенденцию вступать в реакции, так что они получают (или разделяют) достаточно электронов, чтобы заполнить свою валентную оболочку. Например, кислород в группе 16 имеет шесть валентных электронов и, следовательно, нуждается в двух дополнительных электронах для завершения своей внешней оболочки. Кислород достигает этого за счет реакции с элементами, которые могут терять или делиться электронами.Атом кислорода, например, может реагировать с атомом магния (Mg) (в Группе 2), принимая два валентных электрона магния, образуя ионы Mg 2+ и O 2−. (Когда нейтральный атом магния теряет два электрона, он образует ион Mg 2+ , а когда нейтральный атом кислорода получает два электрона, он образует ион O 2-.) Получающийся в результате Mg 2+ и O 2- затем объединяют в соотношении 1: 1 с получением ионного соединения MgO (оксид магния). (Хотя составной оксид магния содержит заряженные частицы, у него нет чистого заряда, потому что он содержит равное количество ионов Mg 2+ и O 2-.) Аналогичным образом кислород реагирует с кальцием (чуть ниже магния в группе 2) с образованием CaO (оксид кальция).
Например, кислород в группе 16 имеет шесть валентных электронов и, следовательно, нуждается в двух дополнительных электронах для завершения своей внешней оболочки. Кислород достигает этого за счет реакции с элементами, которые могут терять или делиться электронами.Атом кислорода, например, может реагировать с атомом магния (Mg) (в Группе 2), принимая два валентных электрона магния, образуя ионы Mg 2+ и O 2−. (Когда нейтральный атом магния теряет два электрона, он образует ион Mg 2+ , а когда нейтральный атом кислорода получает два электрона, он образует ион O 2-.) Получающийся в результате Mg 2+ и O 2- затем объединяют в соотношении 1: 1 с получением ионного соединения MgO (оксид магния). (Хотя составной оксид магния содержит заряженные частицы, у него нет чистого заряда, потому что он содержит равное количество ионов Mg 2+ и O 2-.) Аналогичным образом кислород реагирует с кальцием (чуть ниже магния в группе 2) с образованием CaO (оксид кальция). Кислород аналогичным образом реагирует с бериллием (Be), стронцием (Sr), барием (Ba) и радием (Ra), остальными элементами группы 2. Ключевым моментом является то, что, поскольку все элементы в данной группе имеют одинаковое количество валентных электронов, они образуют аналогичные соединения.
Кислород аналогичным образом реагирует с бериллием (Be), стронцием (Sr), барием (Ba) и радием (Ra), остальными элементами группы 2. Ключевым моментом является то, что, поскольку все элементы в данной группе имеют одинаковое количество валентных электронов, они образуют аналогичные соединения.
Химические элементы можно классифицировать по-разному. Наиболее фундаментальное разделение элементов — на металлы, которые составляют большинство элементов, и неметаллы.Типичные физические свойства металлов — это блестящий внешний вид, пластичность (способность растираться в тонкий лист), пластичность (способность вытягиваться в проволоку), а также эффективная тепло- и электропроводность. Самым важным химическим свойством металлов является тенденция отдавать электроны с образованием положительных ионов. Например, медь (Cu) — типичный металл. Он блестящий, но легко тускнеет; это отличный проводник электричества и обычно используется для электрических проводов; и из него легко превращаться в изделия различной формы, такие как трубы для систем водоснабжения. Медь содержится во многих ионных соединениях в форме иона Cu + или Cu 2+ .
Металлические элементы находятся на левой стороне и в центре таблицы Менделеева. Металлы групп 1 и 2 называются типичными металлами; те, что находятся в центре периодической таблицы, называются переходными металлами. Лантаноиды и актиноиды, показанные под периодической таблицей, представляют собой особые классы переходных металлов.
Неметаллы, которых относительно немного, находятся в верхнем правом углу таблицы Менделеева, за исключением водорода, единственного неметаллического члена Группы 1.У неметаллов отсутствуют физические свойства, характерные для металлов. В химических реакциях с металлами неметаллы приобретают электроны с образованием отрицательных ионов. Неметаллические элементы также реагируют с другими неметаллами, в этом случае образуя молекулярные соединения. Хлор — типичный неметалл. При обычных температурах элементарный хлор содержит молекулы Cl 2 и реагирует с другими неметаллами с образованием таких молекул, как HCl, CCl 4 и PCl 3 . Хлор реагирует с металлами с образованием ионных соединений, содержащих ионы Cl — .
Хлор реагирует с металлами с образованием ионных соединений, содержащих ионы Cl — .
Разделение элементов на металлы и неметаллы является приблизительным. Некоторые элементы вдоль разделительной линии проявляют как металлические, так и неметаллические свойства и называются металлоидами или полуметаллами.
Реакции с неорганическими соединениями — предметный тест GRE: химия
Если вы считаете, что контент, доступный через Веб-сайт (как определено в наших Условиях обслуживания), нарушает
или больше ваших авторских прав, сообщите нам, отправив письменное уведомление («Уведомление о нарушении»), содержащее
то
информацию, описанную ниже, назначенному ниже агенту.Если репетиторы вуза предпримут действия в ответ на
ан
Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент
средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении может быть направлено стороне, предоставившей доступ к контенту, или третьим лицам, таким как в качестве ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатам), если вы искажать информацию о том, что продукт или действие нарушает ваши авторские права.Таким образом, если вы не уверены, что контент находится на веб-сайте или по ссылке с него нарушает ваши авторские права, вам следует сначала обратиться к юристу.
Чтобы отправить уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись владельца авторских прав или лица, уполномоченного действовать от их имени;
Идентификация авторских прав, которые, как утверждается, были нарушены;
Описание характера и точного расположения контента, который, по вашему мнению, нарушает ваши авторские права, в \
достаточно подробностей, чтобы позволить репетиторам университетских школ найти и точно идентифицировать этот контент; например нам требуется
а
ссылка на конкретный вопрос (а не только на название вопроса), который содержит содержание и описание
к какой конкретной части вопроса — изображению, ссылке, тексту и т. д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Ваше заявление: (а) что вы добросовестно считаете, что использование контента, который, по вашему мнению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство, что вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Ваше заявление: (а) что вы добросовестно считаете, что использование контента, который, по вашему мнению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство, что вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
Отправьте жалобу нашему уполномоченному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105
Или заполните форму ниже:
Органические соединения | Химия жизни
1.4 Органические соединения (ESG49)
Учащиеся будут изучать углеводы, липиды, белки и нуклеиновые кислоты под следующими заголовками:
- Молекулярный состав : основные элементы, составляющие класс соединений.

- Структурный состав : как мономеры соединяются вместе с образованием полимеров.
- Биологическая роль : важность этих молекул для животных и растений.
- Химический тест : как определить присутствие каждого класса соединений.
Есть также объяснение ферментов в разделе белков. Этот раздел главы содержит наиболее практическую работу, поэтому следует уделить много времени рассмотрению этого раздела.
Органическое соединение — это соединение, молекулы которого содержат C и обычно по крайней мере одну связь C-C или C-H. Очень маленькие углеродсодержащие молекулы, которые не подчиняются указанным выше правилам, такие как \ (\ text {CO} _ {2} \) и простые карбонаты, считаются неорганическими. Жизнь на Земле была бы невозможна без углерода. Помимо воды, большинство молекул живых клеток основаны на углероде и, следовательно, называются органическими соединениями. Основные классы органических соединений, которые мы исследуем в этом разделе, включают углеводы, липиды, белки и нуклеиновые кислоты.
Каждый из этих классов соединений состоит из больших молекул, построенных из малых субъединиц. Наименьшая из этих субъединиц называется мономером . Несколько мономеров связываются вместе с образованием полимеров . Каждый из этих полимеров характеризуется определенной структурой за счет образующихся химических связей. Эти структуры связаны с функцией соединения в живых организмах. Поэтому мы будем изучать каждый класс соединений под следующими заголовками:
- Молекулярный состав : основные элементы, составляющие класс соединений.
- Структурный состав : как мономеры соединяются вместе с образованием полимеров.
- Биологическая роль : важность этих молекул для животных и растений.
- Химический тест : как определить присутствие каждого класса соединений.
Углеводы (ESG4B)
Молекулярный состав
Углеводы состоят из углерода (C), водорода (H) и кислорода (O).
Рис. 1.6: Молекула глюкозы состоит из углерода (серые сферы), водорода (белые сферы) и кислорода (красные сферы).
Конструкционный состав
Углеводы состоят из мономеров, известных как моносахаридов . Моносахарид, из которого состоит большинство углеводов, — это глюкоза. Другие моносахариды включают фруктозу, галактозу и дезоксирибозу (обсуждается позже). Эти мономеры могут быть соединены гликозидными связями. Когда два моносахарида химически связаны вместе, они образуют дисахаридов . Примером дисахарида является сахароза (столовый сахар), состоящий из глюкозы и фруктозы.Другие диссахариды включают лактозу, состоящую из глюкозы и галактозы, и мальтозу, состоящую из двух молекул глюкозы. Моносахариды и диссахариды часто называют сахарами или простыми углеводами. Несколько моносахаридов объединяются с образованием полисахаридов . Примеры полисахаридов, с которыми вы столкнетесь, включают гликоген, крахмал и целлюлозу. Полисахариды обычно называют сложными углеводами, так как они дольше расщепляются.
Полисахариды обычно называют сложными углеводами, так как они дольше расщепляются.
Рисунок 1.7: Примеры пищевых источников различных моносахаридов, дисахаридов и полисахаридов.
Роль у животных и растений
Основная функция углеводов — это молекулы хранения энергии и субстраты (исходный материал) для производства энергии. Углеводы расщепляются живыми организмами с выделением энергии. Каждый грамм углеводов обеспечивает около 17 килоджоулей (кДж) энергии. Крахмал и гликоген представляют собой запасные полисахариды (полимеры, состоящие из мономеров глюкозы) и, таким образом, действуют как хранилище энергии в живых организмах.Крахмал является запасным полисахаридом в растениях, а гликоген — запасным полисахаридом для животных. Целлюлоза содержится в стенках клеток растений и придает им силы. Все полисахариды состоят из мономеров глюкозы, но различие в свойствах этих веществ можно объяснить тем, как молекулы глюкозы соединяются вместе, образуя разные структуры. Ниже представлены изображения гликогена и крахмала.
Ниже представлены изображения гликогена и крахмала.
Рис. 1.8: Сравнение крахмала и гликогена. Гликоген более разветвлен, чем крахмал.
Химические тесты для определения наличия крахмала
Вещества, содержащие крахмал, приобретают сине-черный цвет в присутствии раствора йода. Таким образом, наблюдаемое изменение цвета является основой химического испытания соединения.
Рис. 1.9: Гранулы пшеничного крахмала, окрашенные раствором йода и сфотографированные с помощью светового микроскопа.
В следующем исследовании мы проверим несколько различных продуктов на наличие крахмала.
Тест на наличие крахмала
(Essential research-CAPS)Цель
Для проверки наличия крахмала.
Аппарат
- кусок картофеля или хлеба
- лист салата
- чашка Петри
- раствор йода
- капельница
- других блюд на ваш выбор
Метод
- Поместите кусок картофеля или хлеба, лист салата и другие образцы пищи в отдельные чашки Петри.
- С помощью пипетки добавьте несколько капель раствора йода в продукт в каждой чашке Петри.
Рисунок 1.10: Схема эксперимента: испытание на наличие крахмала с использованием раствора йода.
Наблюдения
Запишите свои наблюдения.
Картофель или хлеб становятся сине-черными в присутствии раствора йода, а лист салата — нет.
Вопросы
Можно ли этим методом определить , сколько крахмала ? Поясните свой ответ.
Да. Чем насыщеннее сине-черный цвет, тем выше содержание крахмала. Если присутствует только немного крахмала, полученный цвет будет более бледным и более фиолетовым, чем черный.Если крахмала нет совсем, видны только цвет исходного материала (например, зеленого листа) и желто-коричневый цвет раствора йода.
Посмотрите видео демонстрацию теста на крахмал.
Видео: 2CMK
Посмотрите видео демонстрацию теста на крахмал.
Видео: 2 см
Посмотрите видео демонстрацию теста на крахмал.
Видео: 2CMN
Химический тест для определения присутствия редуцирующих сахаров
Некоторые моносахариды, такие как глюкоза, известны как редуцирующие сахара .Они определены как сахара, которые могут легко подвергаться реакциям окисления (т.е. терять электрон или приобретать атом кислорода) и действовать как восстановитель . Для проверки углеводов мы обычно проверяем наличие редуцирующих сахаров с помощью теста Бенедикта или Фелинга . Оба раствора (Бенедикта и Фелинга) содержат сульфат меди, который вступает в реакцию с редуцирующими сахарами, вызывая изменение цвета.
Посмотрите видео демонстрацию теста на глюкозу.{\ circ} \) C)
Меры предосторожности
- Следуйте процедурам безопасности (перечисленным в главе 1) при розжиге горелки Бунзена.
 Не зажигайте его на полке или в замкнутом пространстве. Уберите с места все блокноты, бумаги и излишки химикатов. Соберите длинные волосы, свисающие украшения и свободную одежду и никогда не оставляйте открытое пламя без присмотра, пока оно горит.
Не зажигайте его на полке или в замкнутом пространстве. Уберите с места все блокноты, бумаги и излишки химикатов. Соберите длинные волосы, свисающие украшения и свободную одежду и никогда не оставляйте открытое пламя без присмотра, пока оно горит. - При нагревании пробирок в горячей воде в мензурках убедитесь, что устья пробирок направлены в сторону от вас и других учеников.
- При работе с пробирками, особенно когда они горячие, используйте держатель для пробирок и надевайте защитные очки.
Метод
Приготовьте водяную баню, наполнив стакан водой до половины. Поместите химический стакан на штатив над пламенем Бунзена, как показано на рисунке 1.11. Это послужит вашей водяной баней.
ПРИМЕЧАНИЕ ДЛЯ УЧИТЕЛЯ: Использование водяной бани для этого занятия не обязательно. Пробирки можно нагревать напрямую. Однако необходимо иметь водяную баню, если у учителя нет газа и он вынужден пользоваться плиткой.
Пока вода не достигнет желаемой температуры, выполните следующие инструкции:
- Пометьте пробирки 1–4.
- С помощью шприца или мерного цилиндра добавьте в пробирки следующее:
- пробирка 1: \ (\ text {5} \) \ (\ text {ml} \) раствора крахмала \ (\ text {1} \% \)
- пробирка 2: \ (\ text {5} \) \ (\ text {ml} \) из \ (\ text {10} \% \) раствора глюкозы
- пробирка 3: \ (\ text {5} \) \ (\ text {ml} \) \ (\ text {1} \% \) раствор белка
- пробирка 4: \ (\ text {5} \) \ (\ text {ml} \) вода.
- Добавьте \ (\ text {5} \) \ (\ text {ml} \) раствор Бенедикта в каждую пробирку.{\ circ} \) В.
- Примерно через \ (\ text {5} \) минут, когда в некоторых пробирках произошло изменение цвета, погасите пламя или выньте пробирки из водяной бани.
- Поместите четыре пробирки в штатив для пробирок и сравните цвета.
Рисунок 1.11: Тест на восстановление сахара с помощью теста Бенедикта
Результаты
Создайте таблицу для записи результатов этого эксперимента. Важно наблюдать и записывать любые произошедшие изменения.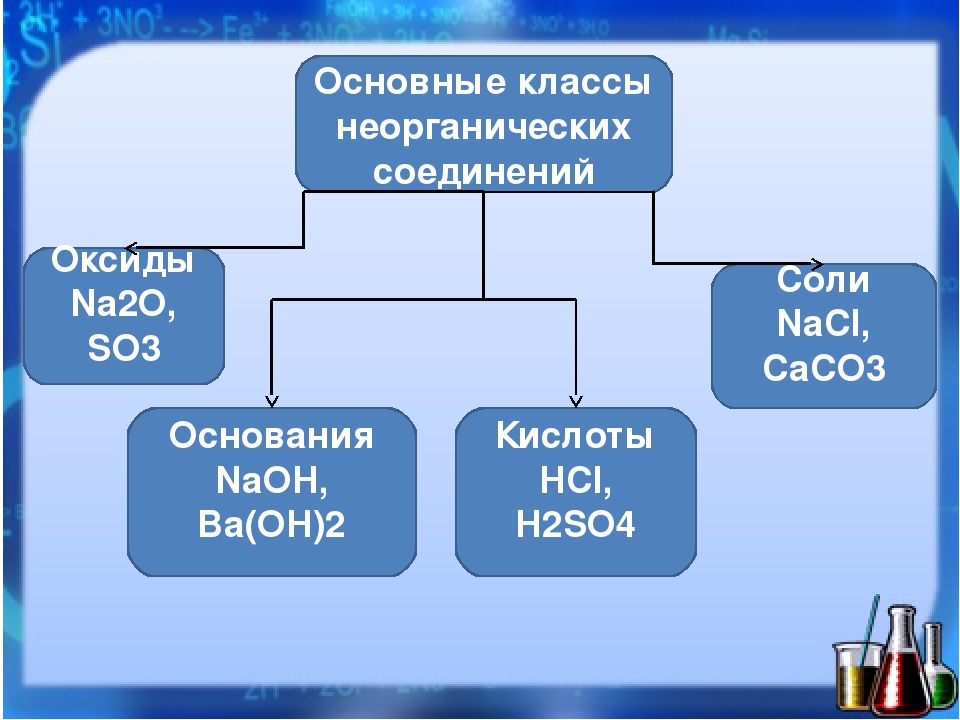
Ответы
- Содержимое пробирки 2 становится желто-оранжевым, остальные остаются синими.
- Только глюкоза.
- Он стал немного гуще / свернулся.
- Любое другое тестируемое нами вещество, которое также становится желто-оранжевым при нагревании с раствором Бенедикта, содержит глюкозу или редуцирующий сахар.
- Это контроль, чтобы показать, что раствор Бенедикта вступает в реакцию с другим веществом в пробирке, а не с водой, в которой растворена глюкоза.
Посмотрите видео-демонстрацию теста на снижение содержания сахара.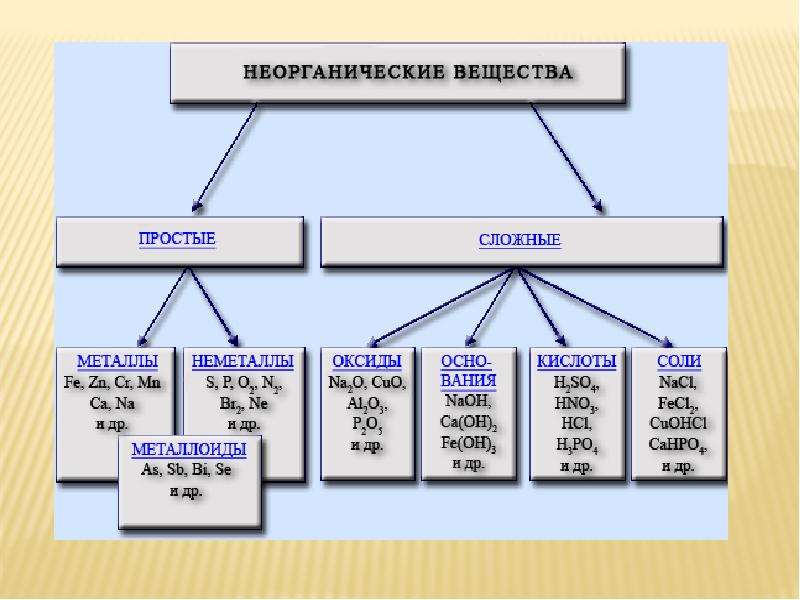
Видео: 2CMQ
Посмотрите видео-демонстрацию теста на снижение содержания сахара.
Видео: 2CMR
Липиды (ESG4C)
Молекулярный состав
Липиды содержат углерод (C), водород (H) и кислород (O), но содержат меньше кислорода, чем углеводы. Примеры липидов в рационе включают кулинарные масла, такие как подсолнечное и оливковое масло, сливочное масло, маргарин и сало. Многие орехи и семена также содержат большое количество липидов.
Конструкционный состав
Триглицериды — один из наиболее распространенных типов липидов.Молекулы триглицеридов состоят из глицерина и трех жирных кислот (рис. 1.12). Хвосты жирных кислот состоят из множества атомов углерода, соединенных вместе. Количество атомов углерода в цепях жирных кислот может быть разным.
При рисовании органических молекул легко запутаться, выписывая все буквы «C» и «H» для углерода и водорода соответственно. Ученые преодолевают это, вытягивая углеродную основу и исключая водород. Углерод всегда образует 4 связи с другими атомами, поэтому легко вычислить, сколько должно быть атомов водорода.Углерод обозначен точкой, а связи между молекулами углерода обозначены линиями, соединяющими точки.
Углерод всегда образует 4 связи с другими атомами, поэтому легко вычислить, сколько должно быть атомов водорода.Углерод обозначен точкой, а связи между молекулами углерода обозначены линиями, соединяющими точки.
Рис. 1.12: Молекула триглицерида.
Роль у животных и растений
Липиды являются важным запасом энергии и содержат 37,8 килоджоулей (кДж) энергии на грамм. Липиды триглицеридов расщепляются с высвобождением глицерина и жирных кислот. Глицерин можно преобразовать в глюкозу и использовать в качестве источника энергии, однако большая часть энергии, обеспечиваемой липидами, происходит за счет разрушения цепей жирных кислот.Некоторые жирные кислоты являются незаменимыми питательными веществами, которые не могут вырабатываться организмом и должны потребляться в небольших количествах. Заменимые жирные кислоты могут вырабатываться в организме из других соединений.
Липиды важны для пищеварения и транспортировки основных витаминов, помогают защитить органы от шока и помогают поддерживать температуру тела. Липиды также играют важную роль в клеточных мембранах.
Липиды также играют важную роль в клеточных мембранах.
Вы узнаете о важной роли, которую липиды играют в клеточных мембранах, из следующей главы, посвященной основным единицам жизни .
Насыщенные и ненасыщенные жиры
Углерод может образовывать четыре связи с другими атомами. Большинство атомов углерода в цепи жирной кислоты связано с двумя соседними атомами углерода и двумя атомами водорода. Когда каждый атом углерода в цепи жирной кислоты образует четыре одинарные связи и имеет максимальное количество атомов водорода, цепь жирной кислоты называется насыщенной , потому что она «насыщена» атомами водорода. Однако иногда два соседних атома углерода связаны с двойной связью. В этом случае каждый углерод, участвующий в двойной связи, присоединен только к одному водороду.Жирные кислоты, которые имеют двойные углерод-углеродные двойные связи, известны как ненасыщенные , потому что двойная связь может быть «разорвана» и может образоваться дополнительная связь с водородом. Двойные связи сильнее одинарных, и они придают цепи жирной кислоты «изгиб». Эти изгибы означают, что молекулы не могут плотно упаковываться вместе, и липиды более жидкие. Вот почему ненасыщенные жиры имеют тенденцию быть жидкими при комнатной температуре, а насыщенные — твердыми. Жирная кислота
цепи с множеством двойных связей
называются полиненасыщенными жирными кислотами.
Двойные связи сильнее одинарных, и они придают цепи жирной кислоты «изгиб». Эти изгибы означают, что молекулы не могут плотно упаковываться вместе, и липиды более жидкие. Вот почему ненасыщенные жиры имеют тенденцию быть жидкими при комнатной температуре, а насыщенные — твердыми. Жирная кислота
цепи с множеством двойных связей
называются полиненасыщенными жирными кислотами.
Рисунок 1.13: Жирные кислоты могут быть насыщенными, мононенасыщенными или полиненасыщенными в зависимости от количества присутствующих двойных связей. Двойные связи приводят к «перегибам» в цепи жирных кислот.
Холестерин
Холестерин — это органическое химическое вещество, известное как стерол . От вас не требуется понимать его молекулярный состав или структурный состав. Это важный компонент клеточных мембран. Основные пищевые источники холестерина включают сыр, яйца, свинину, птицу, рыбу и креветки.Холестерин переносится через организм с помощью белков крови, известных как липопротеинов . Липопротеин — это любая комбинация липида и белка.
Липопротеин — это любая комбинация липида и белка.
Холестерин переносится с кровью через организм липопротеином высокой плотности , липопротеином низкой плотности и триглицеридами.
- Липопротеины низкой плотности (ЛПНП) : Липопротеины низкой плотности переносят холестерин по всему телу. В нем более высокая доля холестерина по сравнению с белком.Его часто называют «плохим» холестерином, потому что более высокий уровень ЛПНП связан с сердечными заболеваниями.
- Липопротеин высокой плотности (ЛПВП) : Липопротеин высокой плотности — самый маленький из липопротеинов. Он имеет высокую долю белка по отношению к холестерину и поэтому часто известен как «хороший» холестерин. ЛПВП переносит холестерин от клеток в печень, где он расщепляется или выводится из организма в виде отходов.
Вы узнаете больше о том, как холестерин может закупорить артерии и привести к сердечным заболеваниям, в главе о транспортных системах у животных
Высокий уровень ЛПНП может вызвать сердечные заболевания.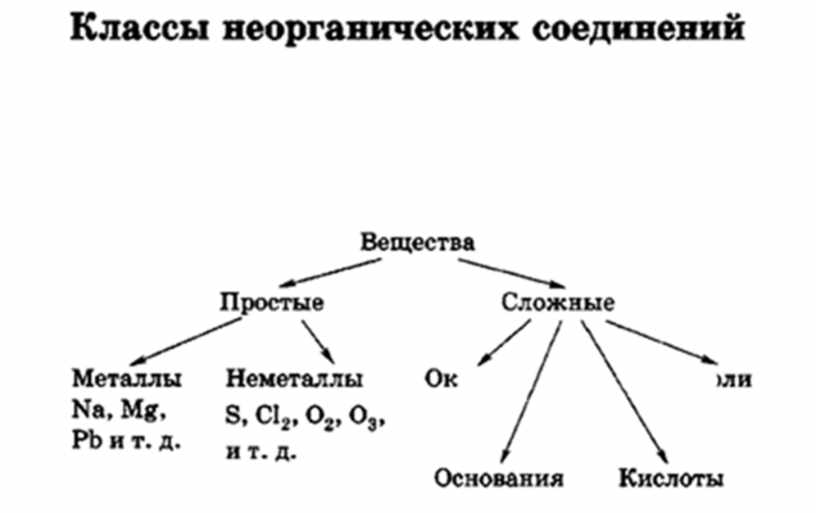 Холестерин накапливается в кровеносных сосудах, по которым кровь идет от сердца к тканям и органам тела, называемым артериями. Это приводит к затвердеванию и сужению этих сосудов, что препятствует транспортировке крови и потенциально может привести к сердечному приступу. Самый большой вклад в количество холестерина в крови — это тип жиров, которые вы едите. Насыщенные жиры менее полезны, чем ненасыщенные, поскольку они увеличивают количество холестерина ЛПНП в крови.
Холестерин накапливается в кровеносных сосудах, по которым кровь идет от сердца к тканям и органам тела, называемым артериями. Это приводит к затвердеванию и сужению этих сосудов, что препятствует транспортировке крови и потенциально может привести к сердечному приступу. Самый большой вклад в количество холестерина в крови — это тип жиров, которые вы едите. Насыщенные жиры менее полезны, чем ненасыщенные, поскольку они увеличивают количество холестерина ЛПНП в крови.
Тест на липиды
Тест на липиды основан на том факте, что липиды оставляют полупрозрачное «жирное пятно» на коричневых бумажных пакетах, а нелипидные вещества — нет.
Посмотрите видео, демонстрирующее тест на липиды.
Видео: 2CMS
Translucent означает, что объект пропускает свет.
Тест на наличие липидов
(Essential research-CAPS)Aim
Для проверки на наличие липидов.
Аппарат
- кусок бумаги или бумажный пакет «рыба с жареным картофелем»
- пищевые продукты, например картофель фри, кусок горячего мяса и т.
 Д.
Д. - 10 мл растительного масла (положительный контроль)
- 10 мл воды (отрицательный контроль)
Метод
- Положительный контроль : добавьте кулинарное масло в коричневый бумажный пакет, пока оно не впитается.Часть бумаги, впитывающая масло, должна быть полупрозрачной по сравнению с той, которая не пропускает масло.
- Отрицательный контроль : смочите бумагу водой. Бумага может стать влажной и намокшей, но она не должна стать полупрозрачной.
- Экспериментальные образцы : испачкайте коричневый бумажный пакет испытуемым продуктом и поднесите его к свету. Если он полупрозрачный, как и в положительном контроле, пищевой продукт содержит липид.
Наблюдения
Запишите свои наблюдения, отмечая все ключевые различия между контролем и экспериментальным образцом.
Бумага стала полупрозрачной, когда на нее была помещена маслянистая пища, как и полупрозрачное пятно на бумаге, содержащей растительное масло. Бумага, содержащая воду, была влажной, но легко высыхала и никогда не была полупрозрачной, поэтому мы можем сделать вывод, что еда содержала масла или липиды, а не воду.
Бумага, содержащая воду, была влажной, но легко высыхала и никогда не была полупрозрачной, поэтому мы можем сделать вывод, что еда содержала масла или липиды, а не воду.
Альтернативные методы определения липидов
Альтернативный метод проверки наличия липидов в образце — раздавить или растворить образец в этаноле. Жиры и липиды растворяются в спирте.После приготовления раствора этанола есть два способа проверить, содержит ли этот образец липиды:
- Отфильтруйте раствор этанола через фильтровальную бумагу: липидов, растворенных в этаноле, сделают фильтровальную бумагу полупрозрачной. Как только спирт испарится, останется полупрозрачное пятно.
- Добавьте образец этанола в воду: липидов не растворяются в воде. Следовательно, если раствор этанола содержит липиды, липиды будут выпадать в осадок из раствора при смешивании с водой, в результате чего раствор становится молочным.
Белки (ESG4D)
Молекулярный состав
Белки содержат углерод (C), водород (H), кислород (O), азот (N) и могут содержать другие элементы, такие как железо (Fe), фосфор (P) и серу (S).
Конструкционный состав
Белки состоят из аминокислот . Есть \ (\ text {20} \) обычные аминокислоты, из которых состоят все белки в живых организмах. Девять из них считаются незаменимыми аминокислотами , поскольку они не могут синтезироваться в организме из других соединений и должны быть получены с пищей.Аминокислоты связаны вместе пептидными связями с образованием пептидов . Длинная пептидная цепь образует белок, который складывается в очень специфическую трехмерную форму. Эта трехмерная форма полностью определяется идентичностью и порядком аминокислот в пептидной цепи. Мы часто называем четырьмя различными уровнями структуры белка (рис. 1.14):
Поскольку последовательность аминокислот определяет способ сворачивания белка, если вы начнете с определенной пептидной цепи, вы всегда получите одну и ту же трехмерную структуру!
- Первичная структура : Это относится к последовательности аминокислот, соединенных вместе пептидными связями с образованием полипептидной цепи.
 Некоторые белки содержат менее сотни аминокислот, а другие — несколько тысяч.
Некоторые белки содержат менее сотни аминокислот, а другие — несколько тысяч. - Вторичная структура : Это первый уровень трехмерного складывания. Он полностью приводится в действие водородной связью . Водородная связь обычно приводит к тому, что области намотки цепи и другие области образуют листы.
- Третичная структура : Это второй уровень трехмерного фолдинга и общая окончательная форма белковой молекулы.Вторичные структуры и неструктурированные области цепи дополнительно складываются в глобулярную форму за счет гидрофобных взаимодействий (неполярные области, пытающиеся покинуть воду в клеточной среде) и электростатических взаимодействий (полярные и заряженные области, желающие взаимодействовать с водной средой). и друг друга).
- Четвертичная структура : Некоторые белки являются сложными: две или более пептидных цепей складываются в свои третичные структуры, затем эти полные структуры связываются вместе посредством гидрофобных и электростатических взаимодействий с образованием конечного белка.
Рисунок 1.14: Первичный, вторичный, третичный и четвертичный уровни структуры белка
Роль у животных и растений
Белки играют важную роль в нескольких важнейших биологических функциях. Белки содержатся в волосах, коже, костях, мышцах, сухожилиях, связках и других структурах и выполняют ключевые структурные и механические функции. Белки также важны для клеточной коммуникации и иммунной системы. Белки также могут действовать как запас энергии при расщеплении в процессе пищеварения.Каждый грамм белка может быть расщеплен, чтобы высвободить 17 кДж энергии. Определенные белки, называемые ферментами , играют важную роль в катализе клеточных реакций, которые являются частью метаболизма.
Белки необходимы для любой диеты. Недостаток белка приводит к болезни, называемой квашиоркор (рис. 1.15) или маразм (рис. 1.16). Маразм вызывается общим дефицитом питания (голоданием), а квашиоркор — именно недостатком белка.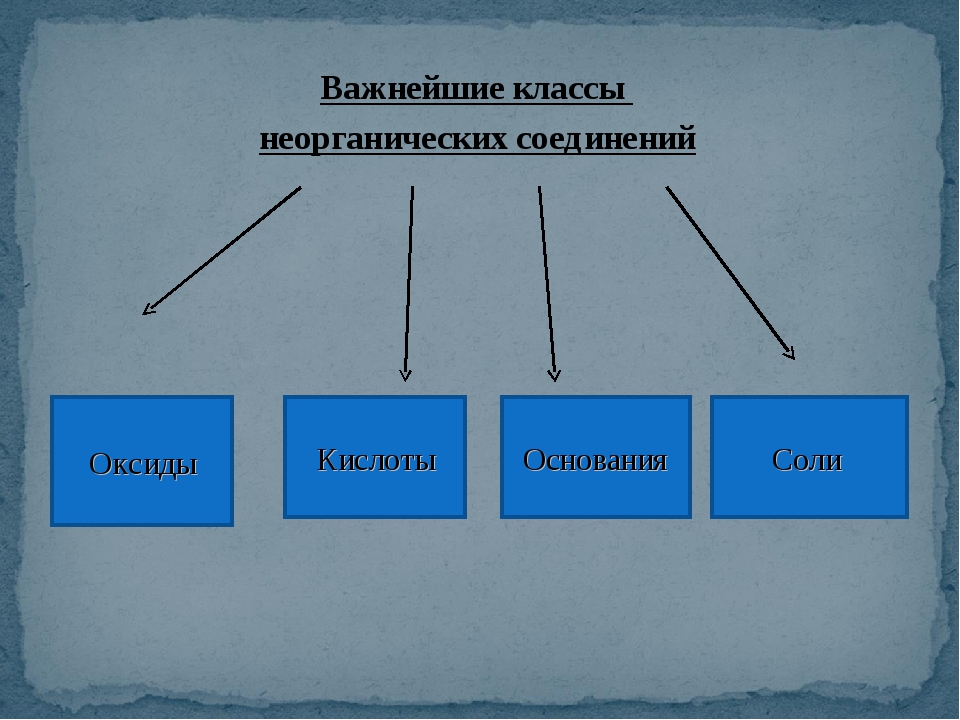
Рисунок 1.15: Ребенок, страдающий от квашиоркора | Рисунок 1.16: Ребенок, страдающий маразмом |
Мясо или овощи: какой источник белка лучше?
И животный белок, и белок овощей полезны для здоровья. Но каждый вид содержит другие питательные вещества. Итак, какой «пакет» питательных веществ — мясо или овощи — лучше для здоровья?
- 180-граммовый стейк содержит 40 г белка, НО также содержит 38 г жира, что превышает Рекомендуемую норму потребления
- Из такого же количества лосося получается 34 г белка и 18 г жира.
- В стакане вареной чечевицы содержится 18 г белка и 1 г жира.
Тест на белки
Тест Biuret Test для использования белков включает тестирование на наличие пептидной связи. Реагент биурета — это реагент на основе меди, который становится пурпурным при связывании с белком в щелочном растворе (рис. 1.17). Чем больше присутствует пептидных связей, тем больше интенсивность пурпурного цвета, что указывает на более высокую концентрацию белка.
1.17). Чем больше присутствует пептидных связей, тем больше интенсивность пурпурного цвета, что указывает на более высокую концентрацию белка.
Наличие белка также можно определить с помощью реагента Миллона .Реагент Миллона вступает в реакцию с аминокислотами тирозина, общими для большинства белков, и приводит к образованию красновато-коричневого осадка при нагревании.
В таблице 1.5 ниже приведены основные тесты и их ожидаемые результаты в присутствии и отсутствии белка.
Посмотрите видеодемонстрацию теста на белок Биурета.
Видео: 2CMT
| Тестовый реагент | Положительный результат | Отрицательный результат |
| Биуретовый реагент | Фиолетовый / пурпурный цвет | Красный цвет |
| Мельница | ||
| белый цвет |
Таблица 1. {\ circ} \) C)
{\ circ} \) C)
- два с раствором альбумина (положительный контроль)
- два с сахарной водой (отрицательный контроль)
- пробирок с образцами для исследования на наличие белка
- пробирка с реагентом Миллона
- пробирка с раствором для биуретовой пробы
( ПРИМЕЧАНИЕ: Реагент Миллона и раствор Биурета в этом эксперименте должны быть приготовлены для вас вашим учителем).
Метод
Тест на белок с реактивом Миллона
ВНИМАНИЕ! Реагент Миллона очень токсичен! Избегайте вдыхания его паров.
- С помощью пипетки или пипетки добавьте несколько капель реагента Миллона в пробирку, содержащую альбумин.
- С помощью пипетки или пипетки добавьте несколько капель реагента Миллона в пробирку, содержащую сахарную воду.
- Используя пипетку или пипетку, добавьте несколько капель реагента Миллона в пробирку, содержащую образцы вашей пищи, которую нужно проверить.

- Нагрейте смеси в кипящей воде в течение 5 минут.
- Обратите внимание на любые изменения цвета.
Тест на белок с помощью теста Biuret
- С помощью капельницы или пипетки добавьте несколько капель раствора биурета в пробирку, содержащую альбумин.
- Используя пипетку или пипетку, добавьте несколько капель раствора Биурета в пробирку, содержащую сахарную воду.
- Используя пипетку или пипетку, добавьте несколько капель раствора Биурета в пробирку, содержащую образцы вашей пищи, которую нужно проверить.
- Обратите внимание на любые изменения цвета.
Рисунок 1.17: Биуретовый тест: это ожидаемое изменение цвета, если присутствует белок
Наблюдения
Запишите свои наблюдения, отмечая все ключевые различия между положительным контролем, отрицательным контролем и экспериментальными образцами
Наблюдения: Реагент Миллона
Белок приобретает кирпично-красный цвет и становится твердым. Красноватый цвет указывает на положительный результат теста на белок. Вода с сахаром не становится красной — она остается прозрачной, что свидетельствует об отсутствии белков.Любые образцы пищевых продуктов, которые становятся красновато-коричневыми при нагревании с реактивом Миллонса, также содержат белки.
Красноватый цвет указывает на положительный результат теста на белок. Вода с сахаром не становится красной — она остается прозрачной, что свидетельствует об отсутствии белков.Любые образцы пищевых продуктов, которые становятся красновато-коричневыми при нагревании с реактивом Миллонса, также содержат белки.
Наблюдения: биуретовый тест
Белок становится фиолетовым, что указывает на присутствие белков. Сахарная вода остается синего цвета добавленного сульфата меди — она не становится фиолетовой, что указывает на отсутствие белков. Любые образцы продуктов питания, которые становятся фиолетовыми при добавлении химикатов Biuret, содержат белок.
Посмотреть видео-демонстрацию эксперимента по тестированию белков:
Видео: 2CMV
Ферменты (ESG4F)
Ферменты — это белковые молекулы, которые помогают протекать химическим реакциям в живых организмах.Термин фермент имеет особое значение: фермент — это биологический катализатор, который ускоряет скорость химической реакции, но не используется в самой химической реакции.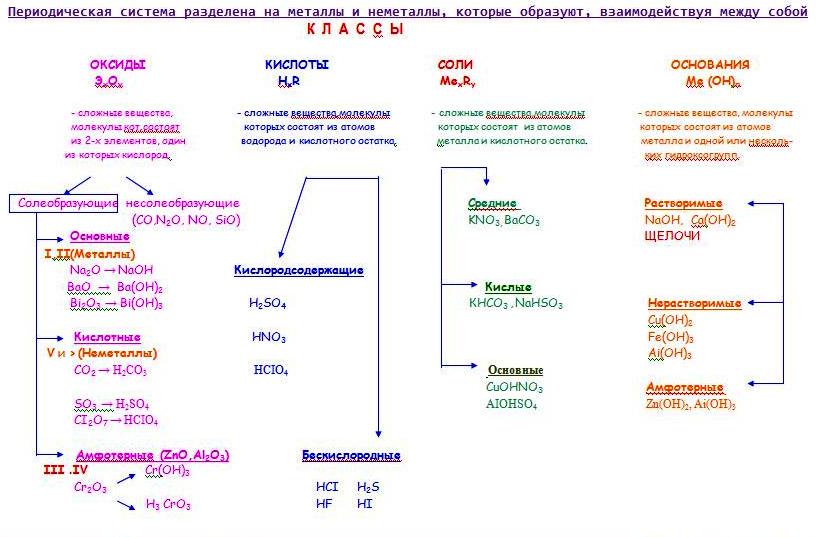 Разберем это определение подробнее.
Разберем это определение подробнее.
Узнайте, что такое ферменты и как они работают.
Видео: 2CMW
Биологический : Ферменты — это белковые молекулы, состоящие из длинных цепочек аминокислот. Они складываются в уникальные трехмерные структуры с областью, известной как активный центр , где происходят реакции.
Катализатор : Ферменты ускоряют химические реакции, но сами по себе не расходуются. Все химические реакции требуют определенного минимального количества энергии. Эта энергия известна как свободная энергия активации . Ферменты снижают энергию активации, тем самым ускоряя химические реакции (рис. 1.18).
Рис. 1.18: Ферменты снижают энергию активации, что ускоряет реакцию.
Ферменты не расходуются в реакциях, которые они катализируют : они не изменяют равновесия реакций, таким образом, они катализируют как прямые, так и обратные реакции. Направление, в котором протекает реакция, определяется концентрацией субстратов и продуктов реакции.
Направление, в котором протекает реакция, определяется концентрацией субстратов и продуктов реакции.
Ферменты могут участвовать в реакциях разрушения или образования молекул. Реакции разложения известны как катаболических реакций. Нарастающие реакции известны как анаболических реакций.
Модель действия фермента «замок и ключ»
Ферменты очень специфичны в отношении реакций, которые они катализируют.Специфичность зависит от связей, образованных между активным центром фермента и его субстратом. Активные сайты имеют определенную форму, которая позволяет связывать очень специфический субстрат. Высокоспецифичный характер связывания фермента с субстратом сравнивают с «замком и ключом», где фермент выступает в качестве «замка», а субстрат — в качестве «ключа» (рис. 1.19). Субстрат связывает активный центр с образованием комплекса фермент-субстрат. Происходит реакция, затем продукт покидает активный центр, поскольку он больше не соответствует «замку» так же, как субстрат. Фермент остается неизменным.
Фермент остается неизменным.
Рис. 1.19: Эта диаграмма иллюстрирует модель действия фермента «замок и ключ».
Исследование того, как действуют биологические стиральные порошки
(Essential research-CAPS)Цель
Для проверки действия ферментов в биологических стиральных порошках.
Аппарат
- два яйца всмятку (яйца, сваренные вкрутую, содержат денатурированные белки, не оставляющие пятен)
- два стакана
- биологический стиральный порошок (с ферментами)
- Небиологический стиральный порошок (старый тип стирального порошка)
- вода
- две мерные ложки
Метод
- Пометьте 3 стакана «Био», «Небио» и «Контроль», которые будут содержать биологический стиральный порошок, небиологический стиральный порошок и воду (отрицательный контроль) соответственно.
- В стакане с надписью «Био» растворите \ (\ text {5} \) \ (\ text {g} \) биологический стиральный порошок в \ (\ text {30} \) \ (\ text {ml} \) воды.

- В стакане с надписью «Non-Bio» растворите \ (\ text {5} \) \ (\ text {g} \) небиологический стиральный порошок в \ (\ text {30} \) \ (\ text { мл} \) воды.
- Налейте \ (\ text {30} \) \ (\ text {ml} \) водопроводной воды в контрольный стакан.
- Выньте небольшое количество яичного желтка.
- Поместите по чайной ложке яичного желтка в каждый стакан.
- Оставьте ложки в мензурках на 1-2 часа.
- Наблюдайте за своими результатами.
Результаты
- Запишите свои наблюдения.
- Укажите причину ваших наблюдений.
- Напишите заключение на расследование.
Результаты
Яичный желток в биологическом стиральном порошке медленно растворяется с ложки. Яичный желток в небиологическом стиральном порошке частично поднимается с ложки, но не распадается и не растворяется в воде.В контрольном стакане изменений нет — желток остается на ложке.
Причины наблюдений
Ферменты биологического стирального порошка разбивают яичный желток на более мелкие молекулы, которые отрываются от ложки и растворяются в воде. Этого не произошло ни с небиологическим порошком, ни с контролем.
Этого не произошло ни с небиологическим порошком, ни с контролем.
Заключение
Биологические стиральные порошки лучше, чем небиологические стиральные порошки, удаляют органические пятна с одежды.
Ферменты в повседневной жизни
Свойства ферментов контролировать реакции широко используются в коммерческих целях. Примеры некоторых из этих применений перечислены ниже:
- Биологические стиральные порошки содержат ферменты, такие как липазы (расщепляет липиды) и протеазы (расщепляет белок), которые способствуют разрушению пятен от продуктов, крови, жира или жира. Эти биологические стиральные порошки экономят энергию, так как эффективны при низких температурах.
- Размягчители для мяса содержат ферменты, полученные из таких фруктов, как папайя или ананас. При использовании в смягчителях мяса эти ферменты смягчают мясо.
- Молоко без лактозы производится в первую очередь для людей с непереносимостью лактозы.
 У людей с непереносимостью лактозы отсутствует фермент лактаза, который переваривает лактозу (молочный сахар). Лактоза предварительно переваривается путем добавления в молоко лактазы.
У людей с непереносимостью лактозы отсутствует фермент лактаза, который переваривает лактозу (молочный сахар). Лактоза предварительно переваривается путем добавления в молоко лактазы.
Факторы, влияющие на действие ферментов
1.Температура
У человека ферменты лучше всего работают при \ (\ text {37} \) \ (\ text {° C} \) (рис. 1.20). Это оптимальная температура. При очень высоких температурах белки денатурируют ; это означает, что водородное, гидрофобное и электростатическое взаимодействия, которые приводят к трехмерной форме белка, разрушаются, превращая белок в его первичную структуру, длинную цепочку аминокислот. Когда белок денатурируется, изменяется форма его активного центра, а также остальная часть формы белка.Субстрат больше не может соответствовать активному центру фермента, и химические реакции не могут иметь место. Низкие температуры могут замедлить или даже деактивировать ферменты, поскольку низкая температура означает меньшую доступную кинетическую энергию, так что даже более низкая энергия активации, которую допускает фермент, недоступна.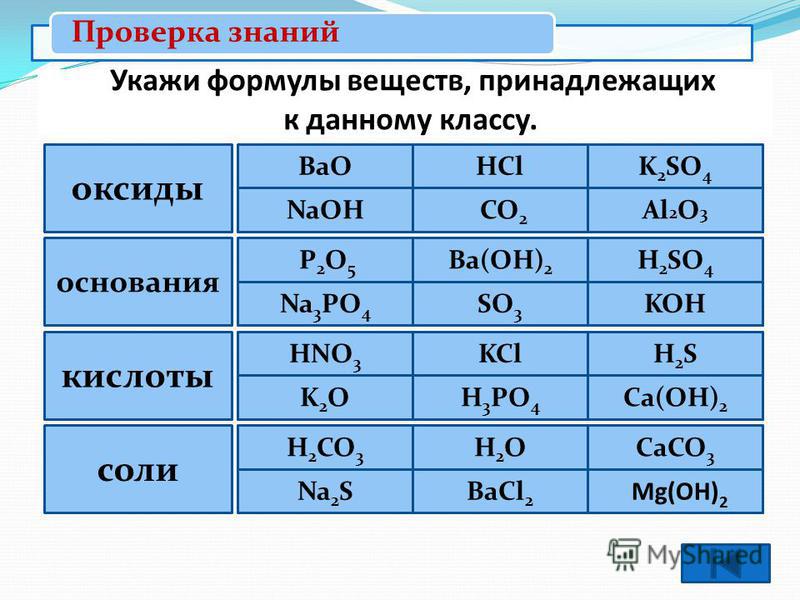 Первый график показывает влияние температуры на активность фермента.
Первый график показывает влияние температуры на активность фермента.
2. pH
Активность фермента чувствительна к pH. Ферменты имеют оптимальный pH, как показано на графике, но они могут эффективно функционировать в пределах диапазона pH.Эффективность фермента резко падает, когда pH выходит за пределы оптимального диапазона. Фермент может денатурироваться при воздействии pH за пределами диапазона pH, поскольку pH влияет на заряд некоторых аминокислот и, следовательно, влияет на электростатические взаимодействия, удерживающие вместе третичную структуру. Второй график показывает влияние pH на активность фермента.
Оптимальные значения pH и температуры для фермента будут определяться видом живого существа, в котором он находится. Оптимальная температура ферментов в организме человека составляет 37 ° C.Бактерии, которые живут в компостных кучах, имеют ферменты с оптимальным диапазоном значений в 40, а бактерии, называемые гипертермофилами (любители очень высоких температур), которые живут в горячих источниках, имеют ферменты с оптимальными температурами выше 80 ° C.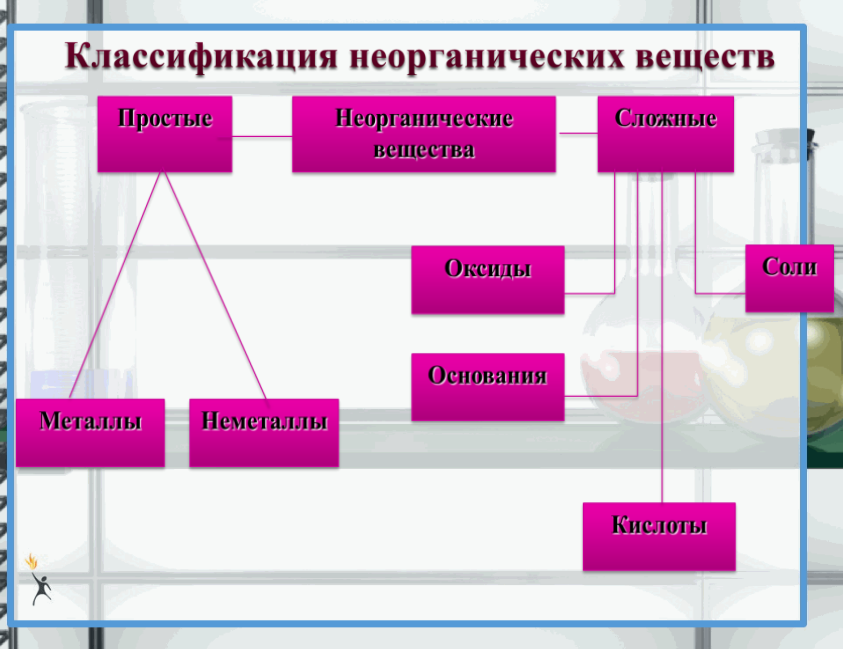
Рис. 1.20: Графики, показывающие влияние температуры и pH на активность фермента соответственно.
В последующем исследовании будет изучено влияние температуры на активность фермента каталазы. Перекись водорода потенциально токсична, поэтому живые ткани содержат фермент под названием каталаза, который расщепляет его на нетоксичные соединения, а именно воду и кислород.Вы изучите влияние фермента каталазы на расщепление перекиси водорода. Далее вы изучите влияние pH и температуры на активность ферментов.
Изучение влияния каталазы из куриной печени на перекись водорода
(Essential research-CAPS)Цель
Чтобы продемонстрировать действие каталазы на перекись водорода.
Аппарат
- Мерные цилиндры 10 мл
- пипетка
- \ (\ text {3} \% \) Раствор перекиси водорода
- скальпель
- зажим
- баланс
- печень куриная при комнатной температуре
- Печень куриная отварная
- печень куриная замороженная
- стержень для перемешивания
Метод
Следуйте инструкциям ниже:
- Отрежьте два квадратных куска весом 0.
 1 г образца свежей печени и поместите каждый в отдельный мерный цилиндр на 10 мл.
1 г образца свежей печени и поместите каждый в отдельный мерный цилиндр на 10 мл. - Используйте чистый мерный цилиндр для измерения 3 мл воды. Перелейте в один из цилиндров, содержащих свежую печень. Это ваш негативный контроль.
- Используйте чистый мерный цилиндр для измерения 3 мл перекиси водорода. Перелейте в оставшийся цилиндр, содержащий свежую печень. Это ваш положительный контроль.
- Подождите четыре минуты, а затем измерьте и запишите высоту образовавшихся пузырьков кислорода в каждом баллоне.
Вопросы
- Назовите три переменные, которые должны оставаться стабильными на протяжении этих экспериментов, и объясните, почему они должны оставаться стабильными.
- Какая реакция происходит?
- Как бы вы могли сделать этот эксперимент более точным?
- Какие еще факторы влияют на скорость реакции, кроме температуры?
Ответы
- Факторы остались прежними: [любые три из следующих]
- Используйте одинаковое количество куриной печени в каждом мерном цилиндре, чтобы контролировать количество присутствующего фермента.

- Используйте 3 мл воды и 3 мл перекиси водорода в двух разных цилиндрах, чтобы количество жидкости оставалось постоянным.
- Дайте двум цилиндрам одинаковое время для прохождения реакции, чтобы можно было надежно сравнить барботажные колонки.
- Содержимое обоих мерных цилиндров должно иметь одинаковую температуру, чтобы температура не мешала исследуемой реакции.
- Используйте одинаковое количество куриной печени в каждом мерном цилиндре, чтобы контролировать количество присутствующего фермента.
- Это катаболическая реакция / реакция разложения, поскольку перекись водорода распадается на кислород (пузырьки) и воду (оставшаяся жидкость).Реакция также является экзотермической, поскольку мерный цилиндр нагрелся — во время реакции выделялось тепло.
- Повышение точности:
- Заливайте жидкость в оба цилиндра в одно и то же время.
- Более точно отмерьте количество куриной печени.
- Должна быть возможность вычислить объем кислорода, выделяемого при пропускании его через воду, и более точно рассчитать объем кислорода, используя принцип вытеснения.
 В существующем методе при лопании пузырьков часть кислорода улетучивалась в воздух, поэтому измерение высоты является приблизительным значением объема выделившегося кислорода.
В существующем методе при лопании пузырьков часть кислорода улетучивалась в воздух, поэтому измерение высоты является приблизительным значением объема выделившегося кислорода.
- Другие факторы, влияющие на скорость реакции:
- Количество фермента в печени.
- Количество доступного субстрата.
- pH среды.
- Состояние куриной печени — если она не свежая, некоторые ферменты могут быть неактивными.
- Температура печени и жидкости.
Каковы лучшие условия для фермента каталазы? Что происходит, когда фермент или живая ткань помещается в перекись водорода? Узнайте в этом видео.
Видео: 2CMX
Изучение влияния каталазы из куриной печени на перекись водорода — ЧАСТЬ B
Цель
Для демонстрации влияния температуры на активность каталазы.
Метод
- Добавьте 3 мл перекиси водорода в три отдельных градуированных мерных цилиндра на 10 мл. Пометьте один цилиндр «печень куриная замороженная»; второй — «вареная куриная печень» и третий — «куриная печень комнатной температуры».

- Вырежьте по 0,1 г квадрата из замороженной и вареной куриной печени комнатной температуры.Добавьте кусочки печени в мерный цилиндр с соответствующей маркировкой, в котором находится перекись водорода.
- Оставьте кусочки печени на четыре минуты и измерьте высоту образовавшихся пузырьков.
Вопросы
- Объясните причины различий, наблюдаемых для трех измерительных цилиндров.
- Назовите зависимые и независимые переменные в этом эксперименте.
- Как бы вы могли сделать этот эксперимент более точным?
- Что бы вы сделали из своих наблюдений?
Ответы
- Печень при комнатной температуре реагирует очень быстро и производит большое количество больших пенистых белых пузырьков, потому что ферменты очень активны — они близки к своей оптимальной температуре и легко расщепляют перекись водорода на воду и кислород.Замороженная печень сначала реагирует очень медленно и образует очень мало пузырьков, так как ферменты неактивны при таких низких температурах — им не хватает энергии активации.
 Когда реакция выделяет тепло, фермент немного позже ускоряется и образует более крупные пузырьки с большей скоростью, но никогда не так быстро, как при комнатной температуре. Вареная печень не проявляет никакой реакции — пузырьки не образуются, потому что ферменты денатурировались при кипячении. Их форма изменилась, и они вообще не могут катализировать реакцию.
Когда реакция выделяет тепло, фермент немного позже ускоряется и образует более крупные пузырьки с большей скоростью, но никогда не так быстро, как при комнатной температуре. Вареная печень не проявляет никакой реакции — пузырьки не образуются, потому что ферменты денатурировались при кипячении. Их форма изменилась, и они вообще не могут катализировать реакцию. - Зависимой переменной является скорость реакции, то есть количество образовавшегося кислорода, которое было измерено как высота барботажной колонны.
- Независимая переменная — температура — печень была комнатной температуры, заморожена или вареная.
- Более точно измерьте количество печени и объем перекиси водорода и держите их одинаковыми.
- Убедитесь, что все 3 мерных цилиндра идентичны — одинаковой ширины.
- Залейте перекись водорода в баллоны одновременно.
- Улавливайте количество выделившегося кислорода и используйте принцип вытеснения для более точного расчета объема газа.

- Температура влияет на активность ферментов. Ферменты наиболее активны при температуре, близкой к их оптимальным температурам, но они денатурируют и не могут функционировать, если температура слишком высока. При очень низких температурах ферменты не могут эффективно функционировать из-за недостатка энергии активации — они работают очень медленно.
Нуклеиновые кислоты (ESG4G)
Нуклеиновые кислоты, такие как ДНК и РНК, представляют собой большие органические молекулы, которые являются ключевыми для всех живых организмов. Строительные блоки нуклеиновых кислот называются нуклеотидами . Каждый нуклеотид состоит из сахара, фосфата и азотистого основания. Нуклеотиды соединены вместе фосфодиэфирными связями , которые соединяют фосфат одного нуклеотида с сахаром другого. Нити фосфат-сахар-фосфат-сахар образуют «основу», на которой выставлены азотсодержащие основания.Следовательно, нуклеиновые кислоты представляют собой полимеров , состоящих из множества нуклеотидов. ДНК представляет собой двухцепочечный полимер из-за водородной связи между азотистыми основаниями двух комплементарных цепей. РНК — одноцепочечный полимер. Нуклеиновые кислоты не нужно получать с пищей, потому что они синтезируются с использованием промежуточных продуктов метаболизма углеводов и аминокислот.
ДНК представляет собой двухцепочечный полимер из-за водородной связи между азотистыми основаниями двух комплементарных цепей. РНК — одноцепочечный полимер. Нуклеиновые кислоты не нужно получать с пищей, потому что они синтезируются с использованием промежуточных продуктов метаболизма углеводов и аминокислот.
Нуклеиновые кислоты включают:
- Дезоксирибонуклеиновая кислота ( ДНК ): которая содержит «инструкции» по синтезу белков в форме генов.ДНК находится в ядре каждой клетки, а также в меньших количествах присутствует в митохондриях и хлоропластах.
- Рибонуклеиновая кислота ( РНК ): важна для передачи генетической информации от ДНК для образования белков. Он находится на рибосомах, в цитоплазме и ядре.
также можно найти внутри хлоропластов и митохондрий.
Рис. 1.21: Схематическая диаграмма ДНК и РНК: ДНК двухцепочечная, а РНК одноцепочечная.
Структура и функция ядра будут подробно объяснены в следующей главе: Основные единицы жизни .
Что такое органическое соединение? [Видео]
Органические соединения
Здравствуйте, и добро пожаловать в это видео о органических и неорганических соединениях. Сегодня мы рассмотрим как исторические, так и современные определения и попутно представим несколько примеров каждого из них.
Первоначальная классификация органических и неорганических соединений была сделана много веков назад, но с тех пор изменилась.Испытывая трепет перед живыми организмами, ранние ученые предположили, что между живыми и неживыми предметами должна быть фундаментальная разница. Это было основано на теории витализма , которая утверждала, что живые организмы приводятся в движение жизненной силой, которая делает их по своей сути отличными от их неодушевленных собратьев. Таким образом, ученые-виталисты классифицировали химические соединения живых организмов как органические, а соединения неживых вещей — как неорганические. Считая, что люди не могут создавать или манипулировать жизненной силой живых организмов, химики считали невозможным синтез органических веществ из безжизненных неорганических соединений.
Лишь в начале 1800-х химики развенчали эту виталистическую теорию. Фридрих Велер синтезировал мочевину, основное азотсодержащее соединение в моче и, таким образом, органическое соединение, используя цианат калия и хлорид аммония, два неорганических соединения. При этом он продемонстрировал, что никакая жизненная сила не отделяет органические соединения от неорганических, и что последние могут быть использованы для создания первых.
Однако, хотя витализм был полностью опровергнут, номенклатура органического и неорганического продолжает жить в современной химии, но с обновленными определениями.
В широком смысле, по сегодняшнему определению, органические соединения — это вещества на основе углерода . Это на самом деле соответствует первоначальному виталистскому определению, потому что земные формы жизни фактически основаны на углероде. Следовательно, большинство химических соединений в организмах являются органическими по сегодняшнему определению. Например, ДНК, белков, , жиры и углеводы являются органическими соединениями.
Однако, в отличие от определения виталистов, органические соединения не обязательно должны быть получены из живого организма, но могут быть синтезированы в лаборатории.Например, нейлон, полезный и популярный полимер, представляет собой синтетическое органическое соединение.
От простых углеродных цепочек, называемых алканами , насыщенных только водородом, до длинных сложных молекул, наполненных различными функциональными группами, есть миллионы органических соединений. Функциональные группы состоят из элементов в правом верхнем углу периодической таблицы (кислород, азот, сера, фосфор, кремний и галогены).
Органические соединения обычно представляют собой молекулярные твердые вещества, что означает, что они образуют автономные молекулярные единицы за счет ковалентной связи.В твердой и жидкой фазах эти единицы удерживаются вместе за счет слабых межмолекулярных взаимодействий, что приводит к более низким температурам плавления и кипения по сравнению со многими неорганическими соединениями.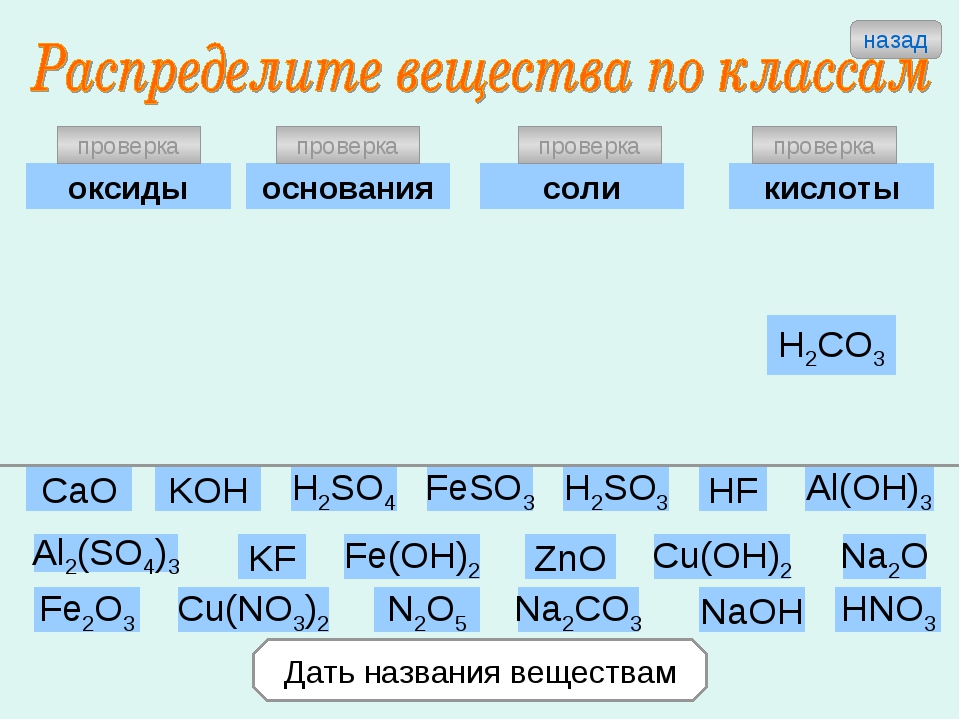
Неорганические соединения в целом можно определить как соединения, не содержащие углерода. Это, очевидно, охватывает большую часть таблицы Менделеева, поэтому физические характеристики неорганических соединений сильно различаются, и их трудно резюмировать. Мы ежедневно сталкиваемся с множеством неорганических соединений, например, ионных соединений, таких как хлорид натрия; кварц в ваших часах — диоксид кремния; и вода, наиболее известное неорганическое соединение.
Может быть, в этот момент вы думаете про себя: «Ну, если в соединении есть углерод, я буду считать его органическим». К сожалению, хотя все органические соединения содержат углерод, не все углеродсодержащие соединения являются органическими.
Например, сплавы, содержащие углерод, считаются неорганическими. Это включает сталь, сплав железа и углерода. А аллотропы углерода, такие как графит и алмаз, не считаются органическими соединениями, потому что они просто один элемент, а не соединение элементов. Кроме того, простые оксиды, такие как монооксид углерода и диоксид углерода, также часто определяют как неорганические. На самом деле это может быть пережитком витализма, который считал углекислый газ неорганическим, потому что он был произведен из неодушевленных источников, таких как вулканы и минералы.
Таким образом, более строгое и, возможно, более полезное определение органических соединений требует, чтобы соединение имело углерод-водородные связи. Хотя даже это определение имеет заметные исключения, такие как мочевина и четыреххлористый углерод, которые не содержат углерод-водородных связей, но считаются органическими.Кроме того, некоторые органические соединения образуют комплексы с металлами, которые обычно находятся в центре внимания химиков-неоргаников. Это дает начало промежуточным классификациям, таким как металлоорганические соединения и металлопротеины. Здесь, в геме, металлопротеине в гемоглобине, вы можете увидеть органическую структуру, сосредоточенную вокруг атома железа.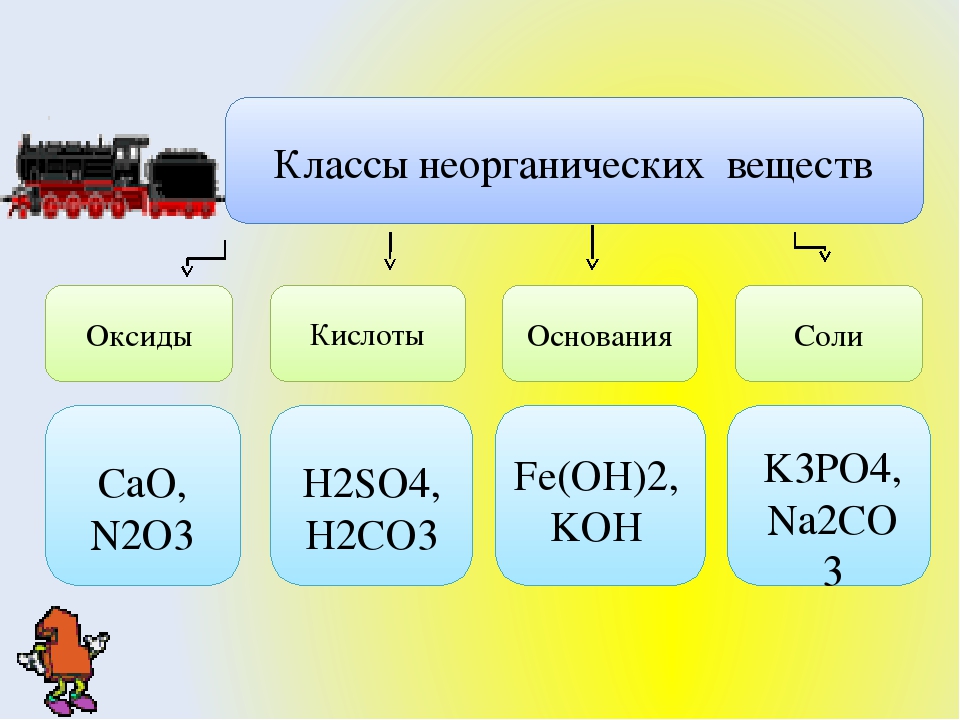
Если все это кажется немного произвольным, это понятно, но на самом деле нет идеальных определений для органических и неорганических соединений. Даже ИЮПАК не дает конкретных определений.
Однако, несмотря на это, все же практично признать разницу между органическими и неорганическими веществами. Химия органических и неорганических соединений настолько различна, что имеет смысл преподавать их отдельно, а химикам — специализироваться на одном или другом. Например, поведение более крупных атомов металла может сильно отличаться от поведения более мелких атомов в органических соединениях, а синтетические методы, используемые для создания сложных органических молекул, требуют глубоких знаний, которые могут не иметь отношения к химикам-неорганикам.Таким образом, несмотря на некоторую двусмысленность в определениях, полезно иметь общее представление о том, какие соединения являются органическими, а какие неорганическими, поскольку для понимания каждого класса необходимы химические знания.
Наконец, оглянитесь на секунду. Выберите несколько объектов и решите, будут ли они считаться органическими или неорганическими. Подумайте, были ли они получены из организмов, являются ли они ионными соединениями или содержат металл. ЖК-экраны имеют слои диоксида кремния. Вы сидите за деревянным столом? Эта древесина состоит из сложных органических соединений.Чтобы лучше классифицировать соединения как органические или неорганические, каждый день рассматривайте несколько объектов вокруг себя.
Спасибо за просмотр и удачной учебы!
Неорганические соединения, необходимые для функционирования человека — анатомия и физиология
OpenStaxCollege
Цели обучения
К концу этого раздела вы сможете:
- Сравнить и сопоставить неорганические и органические соединения
- Определите свойства воды, которые делают ее необходимой для жизни
- Объясните роль солей в функционировании организма
- Различайте кислоты и основания и объясняйте их роль в pH
- Обсудить роль буферов в поддержании гомеостаза pH в организме
Концепции, которые вы изучили до сих пор в этой главе, управляют всеми формами материи и будут работать как основа для геологии, а также биологии.Этот раздел главы сужает фокус до химии человеческой жизни; то есть соединения, важные для структуры и функций организма. Как правило, эти соединения могут быть неорганическими или органическими.
- Неорганическое соединение — это вещество, не содержащее ни углерода, ни водорода. Многие неорганические соединения действительно содержат атомы водорода, такие как вода (H 2 O) и соляная кислота (HCl), вырабатываемая вашим желудком. Напротив, только несколько неорганических соединений содержат атомы углерода.Двуокись углерода (CO 2 ) — один из немногих примеров.
- Таким образом, органическое соединение — это вещество, содержащее как углерод, так и водород. Органические соединения синтезируются ковалентными связями в живых организмах, в том числе в организме человека. Вспомните, что углерод и водород являются вторым и третьим по распространенности элементами в вашем теле. Вскоре вы обнаружите, как эти два элемента сочетаются в пищевых продуктах, которые вы едите, в соединениях, составляющих структуру вашего тела, и в химических веществах, которые питают ваше функционирование.
В следующем разделе рассматриваются три группы неорганических соединений, необходимых для жизни: вода, соли, кислоты и основания. Органические соединения рассматриваются далее в этой главе.
До 70 процентов веса взрослого человека составляет вода. Эта вода содержится как внутри клеток, так и между клетками, из которых состоят ткани и органы. Несколько функций делают воду незаменимой для функционирования человека.
Вода как смазка и амортизатор
Вода является основным компонентом многих смазочных жидкостей организма.Подобно тому, как масло смазывает петлю на двери, вода в синовиальной жидкости смазывает работу суставов тела, а вода в плевральной жидкости помогает легким расширяться и отскакивать при дыхании. Водянистые жидкости помогают пище течь по пищеварительному тракту и обеспечивают отсутствие трения в движениях соседних органов брюшной полости.
Вода также защищает клетки и органы от физических травм, смягчая, например, мозг внутри черепа и защищая нежную нервную ткань глаз.Вода также смягчает развивающийся плод в утробе матери.
Вода как теплоотвод
Радиатор — это вещество или объект, которые поглощают и рассеивают тепло, но не испытывают соответствующего повышения температуры. В организме вода поглощает тепло, выделяемое в результате химических реакций, без значительного повышения температуры. Более того, когда температура окружающей среды стремительно растет, вода, хранящаяся в теле, помогает ему сохранять прохладу. Этот охлаждающий эффект возникает, когда теплая кровь из ядра тела течет к кровеносным сосудам под кожей и переносится в окружающую среду.В то же время потовые железы выделяют теплую воду вместе с потом. Когда вода испаряется в воздух, она уносит тепло, а затем более холодная кровь с периферии циркулирует обратно к сердцевине тела.
Вода как компонент жидких смесей
Смесь — это комбинация двух или более веществ, каждое из которых сохраняет свою химическую идентичность. Другими словами, составляющие вещества не связаны химически в новое химическое соединение большего размера. Эту идею легко представить, если вы подумаете о порошкообразных веществах, таких как мука и сахар; когда вы перемешиваете их в миске, очевидно, что они не связываются с образованием нового соединения.Воздух в помещении, которым вы дышите, представляет собой газовую смесь, содержащую три отдельных элемента — азот, кислород и аргон — и одно соединение — диоксид углерода. Есть три типа жидких смесей, все из которых содержат воду в качестве ключевого компонента. Это растворы, коллоиды и суспензии.
Чтобы клетки организма выжили, они должны оставаться влажными в жидкости на водной основе, называемой раствором. В химии жидкий раствор состоит из растворителя, который растворяет вещество, называемое растворенным веществом. Важной характеристикой растворов является их однородность; то есть молекулы растворенного вещества равномерно распределяются по всему раствору.Если бы вы размешали чайную ложку сахара в стакане воды, сахар растворился бы в молекулах сахара, разделенных молекулами воды. Соотношение сахара и воды в левой части стакана будет таким же, как соотношение сахара и воды в правой части стакана. Если бы вы добавили больше сахара, соотношение сахара к воде изменилось бы, но распределение — при условии, что вы хорошо перемешали — все равно было бы равномерным.
Вода считается «универсальным растворителем», и поэтому считается, что без воды жизнь не может существовать.Вода, безусловно, является самым распространенным растворителем в организме; практически все химические реакции организма происходят между соединениями, растворенными в воде. Поскольку молекулы воды полярны, с областями положительного и отрицательного электрического заряда, вода легко растворяет ионные соединения и полярные ковалентные соединения. Такие соединения называют гидрофильными или «водолюбивыми». Как было сказано выше, сахар хорошо растворяется в воде. Это связано с тем, что молекулы сахара содержат области полярных водородно-кислородных связей, что делает его гидрофильным.Неполярные молекулы, которые с трудом растворяются в воде, называются гидрофобными или «водобоязненными».
Концентрации растворенных веществ
В химии описаны различные смеси растворенных веществ и воды. Концентрация данного растворенного вещества — это количество частиц этого растворенного вещества в данном пространстве (кислород составляет около 21 процента атмосферного воздуха). В кровотоке человека концентрация глюкозы обычно измеряется в миллиграммах (мг) на децилитр (дл), а у здорового взрослого человека в среднем составляет около 100 мг / дл.Другой метод измерения концентрации растворенного вещества — его молярность, которая составляет моль (M) молекул на литр (L). Моль элемента — это его атомный вес, а моль соединения — это сумма атомных весов его компонентов, называемая молекулярной массой. Часто используемый пример — вычисление моля глюкозы по химической формуле C 6 H 12 O 6 . Согласно периодической таблице, атомный вес углерода (C) составляет 12,011 грамма (г), а в глюкозе шесть атомов углерода, что дает общий атомный вес 72.066 г. Проведя те же вычисления для водорода (H) и кислорода (O), молекулярная масса равна 180,156 г («грамм молекулярной массы» глюкозы). Когда вода добавляется для получения одного литра раствора, у вас есть один моль (1М) глюкозы. Это особенно полезно в химии из-за отношения родинок к «числу Авогадро». В моль любого раствора такое же количество частиц: 6,02 × 10 23 . Многие вещества в кровотоке и других тканях тела измеряются в тысячных долях моля или миллимолях (мМ).
Коллоид — это смесь, которая чем-то похожа на тяжелый раствор. Частицы растворенного вещества состоят из крошечных сгустков молекул, достаточно больших, чтобы сделать жидкую смесь непрозрачной (поскольку частицы достаточно большие, чтобы рассеивать свет). Знакомые примеры коллоидов — молоко и сливки. В щитовидной железе гормон щитовидной железы хранится в виде густой белковой смеси, также называемой коллоидом.
Суспензия — это жидкая смесь, в которой более тяжелое вещество временно суспендировано в жидкости, но со временем оседает.Такое отделение частиц от суспензии называется седиментацией. Пример седиментации происходит в анализе крови, который устанавливает скорость седиментации или скорость седиментации. Тест измеряет, насколько быстро красные кровяные тельца в пробирке выделяются из водянистой части крови (известной как плазма) в течение определенного периода времени. Быстрое осаждение клеток крови обычно не происходит в здоровом организме, но некоторые заболевания могут вызывать слипание клеток крови, и эти тяжелые скопления клеток крови оседают на дно пробирки быстрее, чем нормальные клетки крови.
Роль воды в химических реакциях
Два типа химических реакций включают образование или потребление воды: дегидратационный синтез и гидролиз.
- При дегидратационном синтезе один реагент отдает атом водорода, а другой реагент отдает гидроксильную группу (ОН) при синтезе нового продукта. При образовании их ковалентной связи в качестве побочного продукта выделяется молекула воды ([ссылка]). Это также иногда называют реакцией конденсации.
- При гидролизе молекула воды разрушает соединение, разрывая его связи. Сама вода расщепляется на H и OH. Одна часть разъединенного соединения затем связывается с атомом водорода, а другая часть связывается с гидроксильной группой.
Эти реакции обратимы и играют важную роль в химии органических соединений (которая будет обсуждена ниже).
Дегидратационный синтез и гидролиз
Мономеры, основные единицы для построения более крупных молекул, образуют полимеры (два или более химически связанных мономера).(а) При дегидратационном синтезе два мономера ковалентно связаны в реакции, в которой один отдает гидроксильную группу, а другой — атом водорода. Молекула воды выделяется как побочный продукт во время реакций дегидратации. (b) При гидролизе ковалентная связь между двумя мономерами расщепляется путем присоединения атома водорода к одному и гидроксильной группы к другому, что требует участия одной молекулы воды.
Напомним, что соли образуются, когда ионы образуют ионные связи.В этих реакциях один атом отдает один или несколько электронов и, таким образом, становится положительно заряженным, тогда как другой атом принимает один или несколько электронов и становится отрицательно заряженным. Теперь вы можете определить соль как вещество, которое при растворении в воде диссоциирует на ионы, отличные от H + или OH — . Этот факт важен для отличия солей от кислот и оснований, обсуждаемых далее.
Типичная соль NaCl полностью диссоциирует в воде ([ссылка]). Положительные и отрицательные области молекулы воды (концы водорода и кислорода соответственно) притягивают отрицательные ионы хлорида и положительные ионы натрия, отталкивая их друг от друга.Опять же, в то время как неполярные и полярные ковалентно связанные соединения распадаются на молекулы в растворе, соли диссоциируют на ионы. Эти ионы являются электролитами; они способны проводить в растворе электрический ток. Это свойство имеет решающее значение для функции ионов при передаче нервных импульсов и стимулировании сокращения мышц.
Диссоциация хлорида натрия в воде
Обратите внимание, что кристаллы хлорида натрия диссоциируют не на молекулы NaCl, а на катионы Na + и анионы Cl — , каждый из которых полностью окружен молекулами воды.
Многие другие соли важны для организма. Например, желчные соли, вырабатываемые печенью, помогают расщеплять пищевые жиры, а соли фосфата кальция образуют минеральную часть зубов и костей.
Кислоты и основания, как и соли, разлагаются в воде на электролиты. Кислоты и основания могут сильно изменить свойства растворов, в которых они растворены.
Кислоты
Кислота — это вещество, которое выделяет ионы водорода (H + ) в растворе ([ссылка] a ).Поскольку атом водорода имеет только один протон и один электрон, положительно заряженный ион водорода — это просто протон. Этот уединенный протон с большой вероятностью участвует в химических реакциях. Сильные кислоты — это соединения, которые выделяют весь свой H + в растворе; то есть они полностью ионизируются. Соляная кислота (HCl), которая выделяется из клеток слизистой оболочки желудка, является сильной кислотой, потому что она выделяет весь свой H + в водянистой среде желудка. Эта сильная кислота помогает пищеварению и убивает микробы.Слабые кислоты не ионизируются полностью; то есть некоторые из их ионов водорода и остаются связанными внутри соединения в растворе. Примером слабой кислоты является уксус или уксусная кислота; он называется ацетатом после того, как отдает протон.
Кислоты и основания
(a) В водном растворе кислота диссоциирует на ионы водорода (H + ) и анионы. Почти каждая молекула сильной кислоты диссоциирует, образуя высокую концентрацию H + . (b) В водном растворе основание диссоциирует на гидроксильные ионы (OH — ) и катионы.Почти каждая молекула сильного основания диссоциирует, образуя высокую концентрацию OH —.
Базы
Основание — это вещество, которое выделяет гидроксильные ионы (OH — ) в растворе, или вещество, которое принимает H + , уже присутствующий в растворе (см. [Ссылка] b ). Ионы гидроксила (также известные как ионы гидроксида) или другие основные вещества объединяются с присутствующим H + с образованием молекулы воды, тем самым удаляя H + и снижая кислотность раствора.Сильные основания выделяют большую часть или все гидроксильные ионы; слабые основания высвобождают только некоторые гидроксильные ионы или поглощают только несколько H + . Пища, смешанная с соляной кислотой из желудка, сожгла бы тонкий кишечник, следующую часть пищеварительного тракта после желудка, если бы не высвобождение бикарбоната (HCO 3 — ), слабого основания, которое привлекает H + . Бикарбонат принимает часть протонов H + , тем самым снижая кислотность раствора.
Концепция pH
Относительную кислотность или щелочность раствора можно определить по его pH. PH раствора — это отрицательный десятичный логарифм концентрации ионов водорода (H + ) в растворе. Например, раствор с pH 4 имеет концентрацию H + , которая в десять раз больше, чем у раствора с pH 5. То есть раствор с pH 4 в десять раз более кислый, чем раствор с pH 5. Понятие pH станет более понятным, когда вы изучите шкалу pH, как показано в [ссылка].Шкала состоит из серии приращений от 0 до 14. Раствор с pH 7 считается нейтральным — ни кислым, ни основным. Чистая вода имеет pH 7. Чем ниже число ниже 7, тем кислее раствор или тем выше концентрация H + . Концентрация ионов водорода при каждом значении pH в 10 раз отличается от следующего значения pH. Например, значение pH 4 соответствует концентрации протонов 10 –4 M или 0,0001M, тогда как значение pH 5 соответствует концентрации протонов 10 –5 M или 0.00001M. Чем выше число выше 7, тем более щелочной (щелочной) раствор или тем ниже концентрация H + . Например, человеческая моча в десять раз более кислотная, чем чистая вода, а HCl в 10 000 000 раз более кислая, чем вода.
Шкала pH
Буферы
pH крови человека обычно находится в диапазоне от 7,35 до 7,45, хотя обычно его определяют как pH 7,4. При таком слегка щелочном pH кровь может снижать кислотность, возникающую из-за того, что диоксид углерода (CO 2 ) постоянно попадает в кровоток триллионами клеток организма.Гомеостатические механизмы (наряду с выдыханием CO 2 при дыхании) обычно поддерживают pH крови в этом узком диапазоне. Это очень важно, потому что колебания — слишком кислые или слишком щелочные — могут привести к опасным для жизни расстройствам.
Все клетки организма зависят от гомеостатической регуляции кислотно-щелочного баланса при pH примерно 7,4. Таким образом, в организме есть несколько механизмов для этой регуляции, включая дыхание, выделение химических веществ с мочой и внутреннее высвобождение химических веществ, вместе называемых буферами, в жидкости организма.Буфер — это раствор слабой кислоты и сопряженного с ней основания. Буфер может нейтрализовать небольшое количество кислот или оснований в жидкостях организма. Например, если имеется даже небольшое снижение pH жидкости организма ниже 7,35, буфер в жидкости — в данном случае действующий как слабое основание — будет связывать избыточные ионы водорода. Напротив, если pH поднимается выше 7,45, буфер будет действовать как слабая кислота и вносить ионы водорода.
Гомеостатический дисбаланс
Кислоты и основания
Чрезмерная кислотность крови и других жидкостей организма известна как ацидоз.Распространенными причинами ацидоза являются ситуации и нарушения, которые снижают эффективность дыхания, особенно способность человека полностью выдохнуть, что вызывает накопление CO 2 (и H + ) в кровотоке. Ацидоз также может быть вызван метаболическими проблемами, которые снижают уровень или функцию буферов, которые действуют как основания или способствуют выработке кислот. Например, при тяжелой диарее организм может потерять слишком много бикарбоната, что приведет к накоплению кислот в жидкостях организма.У людей с плохо управляемым диабетом (неэффективное регулирование уровня сахара в крови) кислоты, называемые кетонами, вырабатываются в качестве топлива для организма. Они могут накапливаться в крови, вызывая серьезное заболевание, называемое диабетическим кетоацидозом. Почечная недостаточность, печеночная недостаточность, сердечная недостаточность, рак и другие заболевания также могут вызывать метаболический ацидоз.
Напротив, алкалоз — это состояние, при котором кровь и другие жидкости организма слишком щелочные (щелочные). Как и в случае с ацидозом, основной причиной являются респираторные расстройства; однако при респираторном алкалозе уровни углекислого газа падают слишком низко.Заболевания легких, передозировка аспирином, шок и обычное беспокойство могут вызвать респираторный алкалоз, который снижает нормальную концентрацию H + .
Метаболический алкалоз часто возникает в результате продолжительной сильной рвоты, которая вызывает потерю ионов водорода и хлорида (как компонентов HCl). Лекарства также могут вызвать алкалоз. К ним относятся диуретики, которые заставляют организм терять ионы калия, а также антациды при приеме в чрезмерных количествах, например, у кого-то с постоянной изжогой или язвой.
Неорганические соединения, необходимые для функционирования человека, включают воду, соли, кислоты и основания. Эти соединения неорганические; то есть они не содержат ни водорода, ни углерода. Вода — это смазка и подушка, теплоотвод, компонент жидких смесей, побочный продукт реакций синтеза дегидратации и реагент в реакциях гидролиза. Соли — это соединения, которые при растворении в воде диссоциируют на ионы, отличные от H + или OH —. Напротив, кислоты выделяют в растворе H + , делая его более кислым.Основания принимают H + , тем самым делая раствор более щелочным (едким).
pH любого раствора — это его относительная концентрация H + . Раствор с pH 7 нейтрален. Растворы с pH ниже 7 являются кислотами, а растворы с pH выше 7 — основаниями. Изменение одной цифры на шкале pH (например, от 7 до 8) представляет собой десятикратное увеличение или уменьшение концентрации H + . У здорового взрослого человека pH крови колеблется от 7,35 до 7,45. Механизмы гомеостатического контроля, важные для поддержания крови в здоровом диапазоне pH, включают химические вещества, называемые буферами, слабые кислоты и слабые основания, выделяемые, когда pH крови или других жидкостей организма колеблется в любом направлении за пределами этого нормального диапазона.
CH 4 — метан. Это соединение ________.
- неорганическое
- органические
- реактивная
- кристалл
Что из следующего, скорее всего, будет равномерно распределено в воде в гомогенном растворе?
- ионы натрия и ионы хлорида
- молекул NaCl
- кристаллов соли
- эритроцитов
Дженни смешивает тесто для блинов, затем вмешивает шоколадную стружку.Ожидая, когда приготовятся первые несколько блинов, она замечает, как шоколадная стружка опускается на дно прозрачной стеклянной миски. Тесто с шоколадной крошкой является примером ________.
- растворитель
- растворенное вещество
- раствор
- подвеска
Вещество диссоциирует в растворе на K + и Cl — . Вещество a (n) ________.
- кислота
- база
- соль
- буфер
Тай три года, и в результате «желудочного недуга» его рвало около 24 часов.Его pH крови 7,48. Что это значит?
- Кровь Тая слегка кислая.
- Кровь Тая слегка щелочная.
- Кровь Тая очень кислая.
- Кровь Тая в пределах нормы
pH лимонного сока равен 2, а pH апельсинового сока равен 4. Какой из них более кислый и насколько? Что это значит?
Лимонный сок в сто раз более кислый, чем апельсиновый сок. Это означает, что в лимонном соке концентрация ионов водорода в сто раз выше.
Во время вечеринки Эли проигрывает пари и вынужден выпить бутылку лимонного сока. Вскоре после этого он начинает жаловаться на затрудненное дыхание, и его друзья отвозят его в местное отделение неотложной помощи. Там ему внутривенно вводят раствор бикарбоната. Почему?
Лимонный сок, как и любая кислота, выделяет ионы водорода в растворе. Когда избыток H + попадает в пищеварительный тракт и всасывается в кровь, pH крови Эли падает ниже 7,35. Напомним, что бикарбонат — это буфер, слабое основание, которое принимает ионы водорода.Вводя бикарбонат внутривенно, врач отделения неотложной помощи помогает поднять pH крови Эли до нейтрального.
Глоссарий
- кислота
- соединение, выделяющее ионы водорода (H + ) в растворе
- основание
- соединение, которое принимает ионы водорода (H + ) в растворе
- буфер
- раствор, содержащий слабую кислоту или слабое основание, противодействующий широким колебаниям рН жидкостей организма
- коллоид
- жидкая смесь, в которой частицы растворенного вещества состоят из сгустков молекул, достаточно больших, чтобы рассеивать свет
- неорганическое соединение
- вещество, не содержащее ни углерода, ни водорода
- органическое соединение
- вещество, содержащее углерод и водород
- pH
- отрицательный логарифм иона водорода (H + ) концентрации раствора
- раствор
- гомогенная жидкая смесь, в которой растворенное вещество растворено в молекулах в растворителе
- подвеска
- жидкая смесь, в которой распределенные в жидкости частицы оседают с течением времени
Примеры неорганических соединений
Неорганические соединенияНеорганическое соединение — это любое соединение, в котором отсутствует атом углерода из-за отсутствия более подробного определения.Эти соединения с атомом углерода называются органическими соединениями из-за того, что их корневая основа находится в атоме, который жизненно важен. Есть небольшое количество неорганических соединений, которые действительно содержат углерод, учитывая его склонность к образованию молекулярных связей; к ним относятся окись углерода и двуокись углерода, и это лишь некоторые из них.
Неорганические соединения часто довольно просты, поскольку они не образуют сложных молекулярных связей, которые возможны при использовании углерода. Типичным примером простого неорганического соединения может быть хлорид натрия, более известный как бытовая соль.Это соединение содержит только два атома натрия (Na) и хлор (Cl).
Примеры неорганических соединений:
1. H 2 O — Вода — простое неорганическое соединение, хотя оно содержит водород, ключевой атом (наряду с углеродом) во многих органических соединениях. Атомы в молекуле воды образовали очень простые связи из-за отсутствия углерода.
2. HCl — гидрохлорид, также известный как соляная кислота, когда он растворен в воде, представляет собой бесцветную коррозионную кислоту с довольно высоким pH.Он содержится в желудочном соке многих животных, помогает пищеварению, расщепляя пищу.
3. CO 2 — Двуокись углерода, несмотря на наличие атома углерода в формуле, классифицируется как неорганическое соединение. Это вызвало спор в научном сообществе, и были подняты вопросы относительно достоверности наших текущих методов классификации соединений. В настоящее время органические соединения содержат углерод или углеводород, образующий более прочную связь. Связь, образованная углеродом в CO 2 , не является прочной.
4. NO 2 — Двуокись азота имеет различные цвета при разных температурах. Он часто образуется при ядерных испытаниях в атмосфере и отвечает за характерный красноватый цвет грибовидных облаков. Он очень токсичен и образует довольно слабые связи между атомами азота и кислорода.
5. Fe 2 O 3 — Оксид железа (III) является одним из трех основных оксидов железа и является неорганическим соединением из-за отсутствия атома углерода или углеводорода.Оксид железа (III) встречается в природе в виде гематита и является источником большей части железа для сталелитейной промышленности. Он широко известен как ржавчина и имеет ряд общих характеристик с его естественным аналогом.
Примеры неорганических соединений
Chem 211 — Классификационные испытания
Качественный анализ органических соединений
Анализ и идентификация неизвестных органических соединений составляет очень важный аспект экспериментальной органической химии.Нет четкой установленной процедуры которые могут применяться в целом к качественному органическому анализу. Разное книги есть разные подходы, но системный подход, основанный на схеме приведенные ниже, дадут удовлетворительные результаты. Качественные тесты, которые требовать значительное количество ряда (часто опасных) химикатов для храниться в лаборатории для экспериментального использования, часто прекращено органической химии в пользу современных спектроскопических методов.В чтобы установить идентичность двух ваших неизвестных, вы объедините один качественный тест для классификации галогенидов с помощью современных аналитических методы инфракрасной спектроскопии (ИК) и масс-спектрометрии (МС). Разработка о качественных тестах можно найти в этом Приложении и Hornback на стр. 291.
Общая схема анализа
A. Предварительный тест
Обратите внимание на физические характеристики: твердое вещество, жидкость, цвет и запах.Соединения
от желтого до красного цвета часто сильно конъюгированы. Амины часто
есть
запах рыбы, а эфиры обычно имеют приятный фруктовый или цветочный запах.
Кислоты имеют резкий резкий запах. Запахи могут привести к незаконной информации о вашем
неизвестный; разумно обнюхать их с осторожностью. Некоторые соединения могут иметь
едкие пары
или вызвать тошноту.
B. Физические константы
Определите точку кипения или точку плавления.Рекомендуется дистилляция
в случае жидкостей. Он служит двойной цели определения температуры кипения.
точка, а также очистка жидкости для последующих испытаний.
C. Тесты на растворимость
Растворимость неизвестного в следующих реагентах обеспечивает очень полезную
Информация. Обычно используется около 1 мл растворителя с приблизительно
0,1 г или 0,2 мл (2-3 капли) неизвестного соединения. Помощь в анализе
результаты ваших тестов на растворимость можно найти в блок-схеме растворимости
приведено у Физера и Уильямсона на странице 606.(Осторожно, эта блок-схема
намного сложнее, чем требуется в нашей лаборатории, и часто может усложнить
чтобы сделать выводы из ваших данных о растворимости .


 Допишите правую или левую часть уравнения химических реакций
Допишите правую или левую часть уравнения химических реакций Формулы только бескислородных кислот приведены в ряду
Формулы только бескислородных кислот приведены в ряду
 5Kb, doc]. Диагностическая работа [скачать, 612.0Kb, pptx].
5Kb, doc]. Диагностическая работа [скачать, 612.0Kb, pptx]. 
 Тема: «Попытки классификации химических элементов».
Тема: «Попытки классификации химических элементов». Становление в науке представлений о строении атома. состав атомных ядер. Изотопы».
Становление в науке представлений о строении атома. состав атомных ядер. Изотопы».