Контрольная работа по химии за первое полугодие (10 класс)
Административная контрольная работа за 1 полугодие
Химия, 10 класс
Вариант — 1
Часть А (с выбором краткого ответа)
1.Основные источники углеводородов – это:
А) крахмал Б) природный газ В) древесина Г) нефть
2.Четыре гибридные орбитали образуются при:
1) sp3-гибридизации; 2) sp2-гибридизации; 3) sp-гибридизации.
3.Установите соответствие между структурной формулой вещества и названием гомологического ряда, к которому оно принадлежит
ФОРМУЛА ВЕЩЕСТВА А) СН ≡ СН Б) СН3 – СН2 – СН2 — СОН В) СН3 – СН2 – СН2 – СН2 ОН Г) С6Н6 | ГОМОЛОГИЧЕСКИЙ РЯД
|
4. Какие из перечисленных соединений являются гомологами этанола:
Какие из перечисленных соединений являются гомологами этанола:
А) пропанол Б) этилен В) ацетилен Г) метанол
5.Изомерами являются
1) бензол и циклогексан
2) этанол и этандиол
3) бутен-2 и бутадиен
4) этанол и диметиловый эфир
6.Вещество, из которого получают ацетилен
1.Карбид кальция; 2.Карбонат кальция; 3.Углерод; 4.Гидроксид кальция.
7.При взаимодействии пропена с бромоводородом преимущественно образуется
1) 2,2-дибромпропан
2) 1,1-дибромпропан
3) 1-бромпропан
4) 2-бромпропан
8. Водород может присоединяться к обоим углеводородам:
1) метану и ацетилену
2) бензолу и гексану
3) циклопропану и пропину
4) бутадиену и 2-метилпропану
9. Гидратацией какого вещества можно получить этанол?
1) этилен
2) ацетилен
3) хлорэтан
4) 1,2-дихлорэтан
10. Массовая доля углерода в ацетилене С2Н2
Массовая доля углерода в ацетилене С2Н2
А. 77,7 % б. . 83,3% в.. 92,3% г. 93,2%
Часть Б (с развернутым ответом)
11.Осуществите превращения, укажите условия протекания реакций:
CH₄→C₂H₂→C₂H₄→C₂H₅Br→ C₂H₅OH→ CН3-СОН→СН3 -СООН
12.Выведите формулу вещества, содержащего 85,7% углерода и 14,3% водорода, если относительная плотность по водороду равна 28.
Административная контрольная работа за 1 полугодие
Химия, 10 класс
Вариант — 2
Часть А с выбором краткого ответа)
1.По А.М. Бутлерову, соединение атомов в молекулах органических веществ в определённой последовательности происходит в соответствии с их:
а) относительной атомной массой; б) валентностью;
в) электроотрицательностью; г) атомным радиусом.
2.Две гибридные орбитали образуются при:
1) sp3-гибридизации; 2) sp2-гибридизации; 3) sp-гибридизации.
3.Установите соответствие между структурной формулой вещества и названием гомологического ряда, к которому оно принадлежит
ФОРМУЛА ВЕЩЕСТВА А) С6Н Б) СН3 – СН2 – СН2 ОН В) СН3 – СН2 – СН2 – СОН Г) СН3 – С ≡ СН | ГОМОЛОГИЧЕСКИЙ РЯД
|
4.Функциональную группу – ОН содержат:
1) альдегиды; 2) амины; 3) спирты; 4) карбоновые кислоты.
5.К алкенам относится:
а) С3Н8; б) С8Н18; в) С12Н24; г) С15Н32.
6.Бутадиен-1,3 является структурным изомером
1) бутена-1
2) бутена-2
3) бутина-1
4) циклобутана
7. Бромная вода взаимодействует с обоими углеводородами
Бромная вода взаимодействует с обоими углеводородами
1) пропаном и бутаном
2) бензолом и толуолом
3) пропеном и пропином
4) этаном и этиленом
8.Пропан вступает в реакцию с
1) металлическим натрием
2) хлором на свету
3) водой
4) бромной водой
9.Пропен образуется при отщеплении воды от
1) пропанола-1
2) пропаналя
3) ацетона
4) пропионовой кислоты
10.Массовая доля углерода в ацетилене С2Н2
А. 77,7 % б. . 83,3% в.. 92,3% г. 93,2%
Часть Б (с развернутым ответом)
11.Осуществите превращения, укажите условия протекания реакций:
СН4 → С2Н2 → С2Н4 → С2Н5Сl → С2Н5 ОН → СН3 – СОН →СН3 — СООН
12. Выведите формулу вещества, содержащего 85,7% углерода и 14,3% водорода, если относительная плотность по водороду равна 28.
Контрольная работа №1 10 класс профиль
С этим файлом связано 1 файл(ов). Среди них: Testy_OMZ_1.docx.
Показать все связанные файлы
Подборка по базе: Курсовая работа экономика организаций.docx, Лабораторная работа 8.docx, Курсовая работа1.docx, .Практическая работа №3 Куценосова Ольга Ивановна.docx, КОНТРОЛЬНАЯ РАБОТА.docx, выпускная работа.docx, Практическая работа №1МДК 01.01 «Медико-биологические и социальн, Дипломная работа ОБЩАЯ ФИЗИЧЕСКАЯ ПОДГОТОВКА ЮННЫХ ТЕННИСИСТОВ , Контрольная работа.docx, Контрольная работа!.doc
Контрольная работа №1 по теме «Основы химии»
Указаны химические элементы в данном ряду:
1) Br; 2) Li; 3) CI; 4) Na; 5) Mg;
1. Определите, атомам, каких из указанных в ряду химических элементов в основном состоянии до завершения внешнего электронного слоя недостает одного электрона.
2. Выберите три элемента, которые в ПСХЭ находятся в одном периоде.
3. Выберите 2 элемента, которые в соединениях проявляют степень окисления -1.
4. Установите соответствия между формулой вещества и классом /группой , к которому (-ой) это вещество принадлежит.
Формула вещества Класс/группа
А) СO2 1) оксид кислотный
Б) ВаO 2) кислота
В) АI2O3 3)оксид основный
4) оксид амфотерный
5. Из предложенного перечня выберите два вещества, в молекулах которых присутствует ионная химическая связь:
а) хлорид цезия; б) оксид рубидия; в) оксид углерода (II), г) серная кислота; д) хлороводород;
6. Из предложенного перечня выберите два вещества, которые имеют атомную кристаллическую решетку:
а) йод; б) лед; в) поваренная соль; г) кремнезем; д) алмаз;
7. Сокращенное ионное уравнение Н+ + ОН-=Н2О соответствует взаимодействию
1) оксида кальция и водорода
2) соляной кислоты и гидроксидом железа(II)
3) водорода с гидроксидом цинка
4) серной кислоты с гидроксидом натрия.
8. Установите соответствие между ОВР и изменение степени окисления серы в ней
Уравнение реакции Изменение степени окисления серы
А) 2AI + 3S = A2S3 1) от -2 до +4
Б) 2SO2 + O2 = 2SO3 2) от -2 до 0
В) 2H2S +3O2 = 2SO2 + 2H2O 3) от 0 до -2
Г) H2S + Br2 = 2HBr + S 4) от +6 до +4
5) от +4 до +6
9. Установите соответствие между названием соли и отношением этой соли к гидролизу
Название соли Отношение к гидролизу
А) сульфид натрия 1) гидролизу не подвергается
Б) иодид калия 2) гидролизуется по катиону
В) сульфид алюминия 3) гидролизуется по аниону
Г) карбонат калия 4) гидролизуется по аниону и катиону
10.Расставьте коэффициенты в уравнениях окислительно-восстановительных реакций, укажите окислитель и восстановитель.
FCI3 + HI → FCI2 +I2 +HCI
11. Определите объем водорода, который можно получить, действуя на 16,25 г цинка соляной кислотой
Определите объем водорода, который можно получить, действуя на 16,25 г цинка соляной кислотой
Химия 8 Контрольные Габриелян (КиСР Павлова)
Контрольные работы по химии в 8 классе (УМК Габриелян)
Химия 8 Контрольные Габриелян (КиСР Павлова) — это контрольные работы (цитаты) в 4-х вариантах из пособия для учащихся Контрольные и самостоятельные работы по химии: 8 класс: к учебнику О. С. Габриеляна «Химия 8 класс» / Н. С. Павлова. — М. : Издательство «Экзамен», 2015 (Серия «Учебно-методический комплект»).
Цитаты из вышеуказанного учебного пособия использованы на сайте в незначительных объемах, исключительно в учебных и информационных целях (пп. 1 п. 1 ст. 1274 ГК РФ): цитаты переработаны в удобный формат (каждая работа на 1-й странице), что дает экономию денежных средств учителю и образовательному учреждению я в использовании бумаги и ксерокопирующего оборудования.
При постоянном использовании контрольных работ по химии в 8 классе рекомендуем купить книгу:
«Наталья Павлова: Химия 8 класс. Контрольные и самостоятельные работы по химии. К учебнику О. С. Габриеляна. ФГОС», которая содержит 5 контрольных работ, 6 тестов по основным темам курса, 39 самостоятельных работ. Все работы представлены в 4 вариантах. Данное пособие полностью соответствует ФГОС (второго поколения). В пособии отражены новые требования к результатам освоения химии в виде совокупностей не только предметных, но и метапредметных и личностных результатов учащихся.
Контрольные и самостоятельные работы по химии. К учебнику О. С. Габриеляна. ФГОС», которая содержит 5 контрольных работ, 6 тестов по основным темам курса, 39 самостоятельных работ. Все работы представлены в 4 вариантах. Данное пособие полностью соответствует ФГОС (второго поколения). В пособии отражены новые требования к результатам освоения химии в виде совокупностей не только предметных, но и метапредметных и личностных результатов учащихся.
Контрольная К-1. Атомы химических элементов. Простые вещества
Контрольная работа № 1 + Ответы
Контрольная К-2. Соединения химических элементов
Контрольная работа № 2 + Ответы
Контрольная К-3. Изменения, происходящие с веществами
Контрольная работа № 3 + Ответы
Контрольная К-4. Растворение. Растворы. Свойства растворов электролитов
Контрольная работа № 4 + Ответы
Контрольная К-5. ИТОГОВАЯ за год
Контрольная работа № 5 + Ответы
Основные темы уроков по учебнику О.
 С. Габриелян «Химия 8 класс»
С. Габриелян «Химия 8 класс»Предмет химии. Вещества. Превращение веществ. Знаки химических элементов. Периодическая система химических элементов Д.И. Менделеева. Химические формулы. Относительная атомная и молекулярная масса.
Тема № 1. Атомы химических элементов.
Основные сведения о строении атомов. Изменения в составе ядер атомов химических элементов. Изотопы. Строение электронных оболочек атомов. Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов. Взаимодействие атомов элементов-неметаллов между собой. Ковалентная полярная связь. Обобщение и систематизация знаний о видах химической связи.
Тема № 2. Простые вещества.
Простые вещества — металлы. Простые вещества — неметаллы. Аллотропия. Количество вещества. Молярная масса вещества. Молярный объем газообразных веществ.
Тема № 3. Соединения химических элементов.
Степень окисления. Важнейшие классы бинарных соединений — оксиды и летучие водородные соединения. Основания. Кислоты. Соли как производные кислот и оснований. Основные классы соединений. Кристаллические решетки. Массовая и объемная доля компонента в смеси, в том числе и доля примесей.
Основания. Кислоты. Соли как производные кислот и оснований. Основные классы соединений. Кристаллические решетки. Массовая и объемная доля компонента в смеси, в том числе и доля примесей.
Тема № 4. Изменения, происходящие с веществами.
Физические явления в химии. Химические реакции. Химические реакции. Закон сохранения массы веществ. Расчеты по химическим уравнениям. Химические уравнения. Реакции разложения. Реакции соединения. Реакции замещения. Реакции обмена. Типы химических реакций на примере свойств воды.
Тема № 5. Растворение. Растворы. Свойства растворов электролитов.
Растворение как физико-химический процесс. Растворимость. Типы растворов. Электролитическая диссоциация. Основные положения теории электролитической диссоциации. Ионные уравнения реакций. Кислоты в свете ТЭД, их классификация и свойства. Основания в свете ТЭД, их классификация и свойства. Оксиды. Соли в свете ТЭД, их свойства. Генетическая связь между классами неорганических веществ. Окислительно-восстановительные реакции.
Окислительно-восстановительные реакции.
Вы смотрели Химия 8 Контрольные Габриелян (КиСР Павлова) контрольные работы (цитаты) в 4-х вариантах из пособия для учащихся Контрольные и самостоятельные работы по химии: 8 класс: к учебнику О.С. Габриеляна «Химия 8 класс» / Н. С. Павлова.
▶▷▶ контрольная работа алканы и циклоалканы 10 класс
▶▷▶ контрольная работа алканы и циклоалканы 10 класс| Интерфейс | Русский/Английский |
| Тип лицензия | Free |
| Кол-во просмотров | 257 |
| Кол-во загрузок | 132 раз |
| Обновление: | 24-12-2018 |
контрольная работа алканы и циклоалканы 10 класс — Yahoo Search Results Yahoo Web Search Sign in Mail Go to Mail» data-nosubject=»[No Subject]» data-timestamp=’short’ Help Account Info Yahoo Home Settings Home News Mail Finance Tumblr Weather Sports Messenger Settings Want more to discover? Make Yahoo Your Home Page See breaking news more every time you open your browser Add it now No Thanks Yahoo Search query Web Images Video News Local Answers Shopping Recipes Sports Finance Dictionary More Anytime Past day Past week Past month Anytime Get beautiful photos on every new browser window Download Контрольная работа по химии 10 класс «Алканы и циклоалканы» infourokru/kontrolnaya-rabota-po-himii-klass Cached Контрольная работа по химии « Алканы и циклоалканы » Вариант 1 Чему равно количество электронов у атома углерода? Контрольная работа по теме «Алканы» (10 класс) infourokru/kontrolnaya-rabota-po-teme-alkani Cached cкачать: Контрольная работа по теме » Алканы » 10 класс Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления Контрольная работа по химии10 класс Тема : Алканы и wwwinfourokinet/kontrolnaya-rabota-po-himii 10 Cached ☑ Скачать бесплатно Контрольная работа по химии 10 класс Тема : Алканы и циклоалканы в формате docx Тесты по предмету Химия Контрольная работа по темам алканы и циклоалканы ( 10 кл ) libdocsru/docs/98100/index-3419-15html Cached / 10 класс / Контрольная работа Альдегиды и карбоновые кислотыdoc 5 / 10 класс / Контрольная работа 10 класс Расчетные задачиdoc 6 / 10 класс / Контрольная работа 10 -11 класс по теме Амины,аминокислоты,беdoc 7 10 класс Химия Контрольная работа по теме: Алканы, Циклоалканы wwwkursotekaru/course/5433 Cached 11 класс Химия Строение атома Валентные возможности атомов химических элементов Химия 11 класс Химия Решение задач из ЕГЭ и учебника на смещение химического равновесия Химия 11 класс Алканы, Циклоалканы разработка теста-контроля по химии для 10 globuss24ru/doc/alkani-tsikloalkani-razrabotka Cached Алканы , Циклоалканы разработка теста-контроля по химии для 10 класса Разработал: Самохвалов Андрей Сергеевич, учитель биологии и химии ГБОУ СОШ №336 Невского района Санкт-Петербург 2015 год Контрольная работа по химии на тему «Углеводороды» videourokinet/razrabotki/kontrolnaya-rabota-po Cached Контрольная работа включает классы алканы , циклоалканы , алкены, диены, алкины и арены, состоит из 9 тестовых вопросов и одной задачи Химия 10 класс Контрольные работы в новом формате Добротин allengorg/d/chem/chem280htm Cached Тема 1 Теория химического строения органических соединений Алканы и циклоалканы 9 Вариант 1 10 Вариант 2 13 Вариант 3 16 Вариант 4 19 Тема 2 Контрольная работа «Алканы и алкены» (10 класс) libdocsru/docs/98100/index-3419-9html Cached Контрольная работа « Алканы и алкены» ( 10 класс ) Вариант 1 Изобразите все возможные формулы изомеров гексана, назовите их КОНТРОЛЬНЫЕ РАБОТЫ, 10 класс Контрольная работа 1 «Предельные docplayerru/29128725-Kontrolnye-raboty- 10 -klass Cached 1 КОНТРОЛЬНЫЕ РАБОТЫ, 10 класс Контрольная работа 1 «Предельные углеводороды» Приложение 2 Вариант 1 1 Promotional Results For You Free Download | Mozilla Firefox ® Web Browser wwwmozillaorg Download Firefox — the faster, smarter, easier way to browse the web and all of Yahoo 1 2 3 4 5 Next 3,000 results Settings Help Suggestions Privacy (Updated) Terms (Updated) Advertise About ads About this page Powered by Bing™
- потренироваться в решении задач и получить объективную оценку своих знаний Рейтинг теста А какую оценку получите вы? Чтобы узнать — пройдите тест Скрыть 4 Алканы
- 2-диметилпропан 3) 1
- Циклоалканы разработка теста -контроля по химии для 10 класса Разработал: Самохвалов Андрей Сергеевич
плотность паров по водорода которого равна 43
3-диметилпентан и 2
- назовите их КОНТРОЛЬНЫЕ РАБОТЫ
- размещенные на сайте
- циклоалканы
Яндекс Яндекс Найти Поиск Поиск Картинки Видео Карты Маркет Новости ТВ онлайн Знатоки Коллекции Музыка Переводчик Диск Почта Все Ещё Дополнительная информация о запросе Показаны результаты для Нижнего Новгорода Москва 1 Контрольная работа по химии 10 класс » Алканы » infourokru › kontrolnaya-rabota…himii-klass-alkani… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Подробнее о сайте Инфоурок › Химия › Другие методич материалы › Контрольная работа по химии 10 класс » Алканы и циклоалканы » » Алканы и циклоалканы » библиотека материалов Читать ещё Инфоурок › Химия › Другие методич материалы › Контрольная работа по химии 10 класс » Алканы и циклоалканы » Контрольная работа по химии 10 класс » Алканы и циклоалканы » библиотека материалов Контрольная работа по химии « Алканы и циклоалканы » Вариант 1 Чему равно количество электронов у атома углерода? Скрыть 2 Тест по химии ( 10 класс ) на тему: Проверочная работа nsportalru › Школа › Химия › …-rabota-po-teme-alkany Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Подробнее о сайте КОНТРОЛЬНАЯ РАБОТА № 1 по теме: « АЛКАНЫ » ( 10 класс ) Вариант 1 Задание A1 Общая формула циклоалканов 1) Сnh3n–6 2) Cnh3n–2 Предварительный просмотр: КОНТРОЛЬНАЯ РАБОТА № 1 по теме: « АЛКАНЫ » Читать ещё КОНТРОЛЬНАЯ РАБОТА № 1 по теме: « АЛКАНЫ » ( 10 класс ) Вариант 1 ЧАСТЬ А При выполнении заданий этой части для каждого задания (А1 – А10) запишите цифру, которая соответствует номеру выбранного вами ответа Задание A1 Общая формула циклоалканов 1) Сnh3n–6 2) Cnh3n–2 Предварительный просмотр: КОНТРОЛЬНАЯ РАБОТА № 1 по теме: « АЛКАНЫ » ( 10 класс ) Вариант 2 ЧАСТЬ А При выполнении заданий этой части для каждого задания (А1 – А10) запишите цифру, которая соответствует номеру выбранного вами ответа Задание A1 Общая формула алканов Скрыть 3 Циклоалканы тест с ответами по теме ( 10 класс ) obrazovakaru › test/cikloalkany-s…10-klasshtml Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Решить тесты по теме « Алканы циклоалканы » можно у нас на сайте в режиме онлайн, одновременно достигнув нескольких результатов: повторить весь материал по теме, потренироваться в решении задач и получить объективную оценку своих знаний Рейтинг теста А какую оценку получите вы? Чтобы узнать Читать ещё Решить тесты по теме « Алканы циклоалканы » можно у нас на сайте в режиме онлайн, одновременно достигнув нескольких результатов: повторить весь материал по теме, потренироваться в решении задач и получить объективную оценку своих знаний Рейтинг теста А какую оценку получите вы? Чтобы узнать — пройдите тест Скрыть 4 Алканы , Циклоалканы разработка теста -контроля по doc4webru › himiya/alkani…testakontrolya…klasshtml Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Невского района санкт-петербурга Алканы , Циклоалканы разработка теста -контроля по химии для 10 класса Разработал: Самохвалов Андрей Сергеевич, учитель биологии и химии ГБОУ СОШ №336 Невского района Санкт-Петербург 2015 год Тест -контроль по темам: » Алканы » Читать ещё Невского района санкт-петербурга Алканы , Циклоалканы разработка теста -контроля по химии для 10 класса Разработал: Самохвалов Андрей Сергеевич, учитель биологии и химии ГБОУ СОШ №336 Невского района Санкт-Петербург 2015 год Тест -контроль по темам: » Алканы «, » Циклоалканы » 1) Связи в молекуле алканов: а) двойные; б) тройные; в) полуторные; г) одинарные? 2) Укажите молекулярную формулу этана: а) C8h28 ; б) C6H6 ; в) C6H5Ch4 ; г) C2H6 ? 3) Укажите формулу вещества , относящегося к классу » Алканы «: а) C4h20 ; б) C6h22 ; в) C6H6 ; г) C13h36 ? 4) Скрыть 5 Контрольная работа » Алканы » 10 класс (с ответами) uchitelyacom › …kontrolnaya…alkany-10-klasshtml Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте КОНТРОЛЬНАЯ РАБОТА № 1 по теме: « АЛКАНЫ » ( 10 класс ) Вариант 1 ЧАСТЬ А При выполнении заданий этой части для каждого цифру, которая соответствует номеру выбранного вами ответа Задание A1 Общая формула циклоалканов 6 Тест по химии ( 10 класс ) на тему: Тест Алканы nsportalru › …test-alkanytsikloalkany-10-klass Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Подробнее о сайте Тест Алканы Циклоалканы 14) При сгорании углеводорода массой 10 ,32 г, плотность паров по водорода которого равна 43, образовался углекислый газ объемом 16,128 л(ну) и вода массой 15,12 гВыведите молекулярную формулу этого углеводорода 1 2 Читать ещё Тест Алканы Циклоалканы Вариант 1 1)К алканам относятся оба вещества пары А)С3Н8,С3Н6 Б) С3Н8,С4Н 10 В) С3Н6,С4Н8 Г) С2Н2,С2Н4 14) При сгорании углеводорода массой 10 ,32 г, плотность паров по водорода которого равна 43, образовался углекислый газ объемом 16,128 л(ну) и вода массой 15,12 гВыведите молекулярную формулу этого углеводорода 1 2 Скрыть 7 10 класс Химия Контрольная работа по теме: Алканы kursotekaru › course/5433 Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Длительность: 10 минут 11 Проверка знаний Тест 2 Вариант 2 — Базовый уровень Длительность: 10 минут Что будет изучено Контрольная работа по теме: Алканы Циклоалканы Требования к обучаемому Читать ещё Длительность: 10 минут 11 Проверка знаний Тест 2 Вариант 2 — Базовый уровень Длительность: 10 минут 21 Проверка знаний Тест Отзывы пользователей, который прошли этот курс 06112018 Эмилия Что будет изучено Контрольная работа по теме: Алканы Циклоалканы Требования к обучаемому ученик 10 класса Онлайн помощь Не знаешь, как выполнить домашнее задание ? Здесь тебе помогут! Скрыть 8 Контрольная работа по химии Алканы 10 класс testschoolru › …kontrolnaya…himii-alkanyi-10-klass/ Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте testschoolru — школьные тесты , контрольные , самостоятельные и проверочные работы с ответами по школьным предметам Контрольная работа состоит из 3 вариантов в каждом по 6 заданий 1 вариант 1 Структурная формула алкана Читать ещё testschoolru — школьные тесты , контрольные , самостоятельные и проверочные работы с ответами по школьным предметам Главная Обратная связь Контрольная работа по химии Алканы 10 класс Контрольная работа по химии Алканы с ответами для учащихся 10 класса Контрольная работа состоит из 3 вариантов в каждом по 6 заданий 1 вариант 1 Структурная формула алкана : 2 Изомерами являются: 1) бутан и пентан 2) 2-метилбутан и 2,2-диметилпропан 3) 1,3-диметилпентан и 2-метилпентан 4) 3,3-диметилпентан и 2,2-диметилбутан 3 Верны ли следующие суждения о физических свойствах алканов? Скрыть 9 Контрольная работа Алканы и Циклоалканы 10 класс — смотрите картинки ЯндексКартинки › контрольная работа алканы и циклоалканы 10 класс Пожаловаться Информация о сайте Ещё картинки 10 Видео по запросу контрольная работа алканы ЯндексВидео › контрольная работа алканы Пожаловаться Информация о сайте 5:30 HD 5:30 HD Примеры задач на тему « Алканы и циклоалканы » youtubecom 8:49 8:49 Химия 10 класс Урок 21 Примеры задач на тему vkcom 10:43 10:43 Химия 10 класс Урок 20 Циклоалкан ы vkcom 10:15 FullHD 10:15 FullHD 51 Циклоалканы : Строение, изомерия youtubecom 9:19 FullHD 9:19 FullHD 11 Алканы : Строение, номенклатура, изомерия youtubecom 6:01 FullHD 6:01 FullHD 53 Циклоалканы : Химические свойства youtubecom 4:23 HD 4:23 HD ЕГЭ Химия 2016 Задание 34 Органическая Алканы youtubecom 7:54 HD 7:54 HD Номенклатура и изомерия алканов | Химия 10 класс youtubecom 7:02 7:02 Химия 10 класс Урок 16 Алкан ы vkcom 6:04 HD 6:04 HD Химия 10 класс Урок 19 Алкан ы vkcom 5:31 5:31 Химия 10 класс Урок 18 Алкан ы vkcom + 2 млн Все видео Контрольная работа по химии 10 класс Тема : Алканы InfoUrokinet /…po-himii10-klass…i-cikloalkanyhtml Информация о сайте Контрольная работа № 1 Тема: « Алканы Циклоалканы » Задание № 1 – 17 баллов Циклоалканы 10 класс — Промежуточная диагностика по органической химии 10 класс Тест с ответами на тему: « Циклоалканы » liketestru › ximiya/test…otvetami…cikloalkanyhtml Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте 6 Молярная масса циклоалкана , содержащего 6 атомов углерода в одной 11 Циклоалканы – это насыщенные углеводороды: а) атомы углерода которых не 27 Чему равно число изомеров вещества С5Н 10 с трехчленным карбоциклом: а) пяти б) трем + в) двум Читать ещё 6 Молярная масса циклоалкана , содержащего 6 атомов углерода в одной молекуле, равна в г/моль: а) 48 б) 84 + в) 74 7 Какая реакция не характерна для циклогексана: а) замещения б) присоединения в) изомеризации + 11 Циклоалканы – это насыщенные углеводороды: а) атомы углерода которых не замкнуты в цикл б) атомы углерода которых замкнуты в цикл периодически в) атомы углерода которых замкнуты в цикл + 12 Малые циклы содержат именно столько атомов углерода: а) 5 – 7 б) 3 – 4 + в) 6 13 Макроциклы содержат именно такое количество атомов углерода: а) 4 б) 5 в) 8 и более + 27 Чему равно число изомеров вещества С5Н 10 с трехчленным карбоциклом: а) пяти б) трем + в) двум Скрыть Вместе с « контрольная работа алканы и циклоалканы 10 класс » ищут: контрольные работы по математике 3 класс контрольная закупка контрольные работы итоговая контрольная работа по математике 6 класс готовые контрольные работы контрольные работы по математике 2 класс итоговая контрольная работа по алгебре 7 класс итоговая контрольная работа по математике 5 класс контрольные работы по математике 4 класс итоговая контрольная работа по математике 3 класс школа россии фгос 1 2 3 4 5 дальше Bing Google Mailru Нашлось 164 млн результатов 59 показов в месяц Дать объявление Регистрация Войти ЯндексБраузер борется с вирусными угрозами 0+ Закрыть Установить Попробовать ещё раз Включить Москва Настройки Клавиатура Помощь Обратная связь Для бизнеса Директ Метрика Касса Телефония Для души Музыка Погода ТВ онлайн Коллекции Яндекс О компании Вакансии Блог Контакты Мобильный поиск © 1997–2018 ООО «Яндекс» Лицензия на поиск Статистика Поиск защищён технологией Protect Алиса в ЯндексБраузере Помогает искать в интернете и поддерживает беседы 0+ Установить
Контрольная работа по химии Теория химического строения органических соединений 10 класс
Контрольная работа по химии Теория химического строения органических соединений с ответами для учащихся 10 класса.
1 вариант
1. Число разных веществ, изображённых структурными формулами
равно:
1) одному
2) двум
3) трем
4) четырем
2. Число изомеров, соответствующих веществу с молекулярной формулой С5Н12 равно:
1) одному
2) двум
3) трем
4) четырем
3. Количество вещества, содержащееся в 33,6 л (н. у.) пропана С
4. Составьте три структурные формулы гомологов вещества, структурная формула которого
2 вариант
1. Молекулярной формулой углеводорода является:
2. Изомерами являются вещества, формулы которых:
3. Количество вещества, содержащееся в 43 г гексана С6Н14, составляет _____ моль. (Впишите ответ с точностью до десятых.)
(Впишите ответ с точностью до десятых.)
4. Запишите три варианта возможных структурных формул вещества состава С
3 вариант
1.Валентность углерода, хлора, кислорода в органических соединениях равна соответственно:
1) IV, VII, II
2) II, I, II
3) IV, I, II
4) II, VII, II
2. В перечне формул веществ
гомологами являются:
1) АБВ
2) АВЕ
3) АВД
4) БВД
3. Пропан С3Н8, количеством вещества 0,3 моль, занимает объём (н. у.), равный _____ л. (Впишите ответ с точностью до сотых.)
4. Составьте три структурные формулы изомеров углеводорода, формула которого С6
1 вариант
1.
 4
42. 3
3. 1,5
4.
2 вариант
1. 3
2. 4
3. 0,5
4.
3 вариант
1. 3
2. 2
3. 6,72
4.
Итоговая контрольная работа по химии 10 класс. Базовый уровень.
1. Два элемента, которые обязательно входят в состав органических веществ, — это:
1. С и О
2. Н и О
3. Н и N
4. С и Н
2. Углерод в органических соединениях имеет валентность:
1. IV
2. III
3. II
4. I
3. Валентность углерода в этане С2Н6 равна:
1. I
2. II
3. III
4. IV
4. Укажите какое суждение является правильным: А) органическая химия – это химия соединений углерода; Б) валентность атома определяется числом химических связей, образованных данным атомом.
1. Верно только А
2. Верно только Б
Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
5. Укажите верное суждение: А) ферменты ускоряют химические реакции в организме независимо от температуры и реакции среды; Б) способность фермента ускорять одну реакцию или группу однотипных реакций называется селективностью:
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
6. Укажите название спирта С4Н9ОН:
1. Метиловый
2. Пропиловый
3. Бутиловый
4. Этиловый
7. Укажите общую формулу гомологического ряда метана:
1. СnН2n+2
2. СnН2n
3. СnН2n-2
4. СnН2n-6
8. Формула этиленгликоля:
1. CH2-CH2OH
2. CH2OH- CHOH- CH2OH
CH2OH- CHOH- CH2OH
3. CH3— CH2— CH2OH
4. CH2OH- CH2OH
9. Реакции в ходе которых от молекулы вещества отщепляется вода, называют реакциями:
1. Дегидратации
2. Дегалогенирования
3. Дегидрогалогенирования
4. Дегидрирования
10. В молекуле ацетилена (этина) связь между атомами углерода:
1. Одинарная
2. Двойная
3. Тройная
4. Никакая
11. Гомологами являются :
1) С2Н6 и С2Н4
2) С3Н8 и С5Н12
3) С4Н8 и С7Н16
4) СН4 и С6Н10
12.Вещества, соответствующие общей формуле С nH2n-2, относятся к классу:
1. Алканов
Алканов
2. Алкенов
3. Алкадиенов
4. Аренов
13. Как назывались первые непромокаемые плащи из каучука:
1. Манто
2. Макинтош
3. Дождевик
4. Пыльники
14. Ученый, разработавший способ получения синтетического каучука:
1. И.Берцелиус
2. С. Лебедев
3. Ф. Кекуле
4. А. Бутлеров
15. Химическая связь между атомами углерода в молекуле этена:
1) одинарная
2) полуторная
3) двойная
4) тройная
1) пропан
2) бутин-1
3) пропин
4) бутин-2
17. Установите соответствие между названием элемента и характерной валентностью его атома. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту :
НАЗВАНИЕ ЭЛЕМЕНТА
А) Кислород
Б) Водород
В) Углерод
Г) Азот
ВАЛЕНТНОСТЬ
1. I
2. II
3. III
4. IV
IV
18. Охарактеризуйте три структуры белка, выполнив следующее задание ( в тетрадь вносятся только ответы к заданию).
Установите соответствие между характеристикой структуры белка и структурой белковой молекулы. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
ХАРАКТЕРИСТИКА
А) упаковка вторичной спирали в клубок
Б) порядок чередования аминокислот в полипептидной цепи
В) Спиралевидный характер полипептидной цепи
СТРУКТУРА
1) Первичная
2) Вторичная
3) Третичная
19. Установите соответствие между названием соединения и общей формулой гомологического ряда, к которому оно принадлежит
НАЗВАНИЕ СОЕДИНЕНИЯ
А) бутин
Б) циклогексан
В) пропан
Г) бутадиен
ОБЩАЯ ФОРМУЛА
1)CnH2n+2
2) CnH2n
3) CnH2n-2
4) CnH2n-4
5) CnH2n-6
20. Установите соответствие между свойством и применением спирта и его названием. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту:
Установите соответствие между свойством и применением спирта и его названием. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту:
Свойство и применение спирта Название спирта
А) Ядовитая жидкость, 1. Метанол
используемая в качестве
антифриза
Б) Жидкость, используемая 2.Этанол
для смягчения кожи
рук и лица
В) Ядовитая жидкость 3.Этиленгликоль
(небольшое количество
приводит к слепоте), используемая
в качестве растворителя
Г) Жидкость, применяемая 4. Глицерин
Глицерин
для изготовления спиртных напитков
Введение в химию — Тест № 1 Ответы на вопросы | ХИМ 1015
Химия 1015 Тест 1 Весна 1998 г. 3 февраля 1998 г. Для следующих 25 вопросов выберите правильный ответ (только по одному на вопрос) и
заполните соответствующее поле на вашем opscan. Ключ ответа будет вывешен снаружи Davidson 3G сегодня в 9:15. Кодекс чести: этот тест проводится в соответствии с положениями Кодекса чести Технологического института штата Вирджиния.
Никакая помощь не может быть предоставлена или получена от другого студента, а также никаких заметок и / или учебы.
вспомогательные средства разрешены.Каждому студенту будет предоставлена таблица Менделеева. Пожалуйста, сообщите мне
или Систему чести, если вы подозреваете, что имело место нарушение Кодекса чести. 1. Единицы измерения: кварты (qt}, миллилитры (мл), кубические сантиметры (см *) и кубические дюймы.
(in) используются для выражения измерения 33 на
1) масса 2) вес 3) длина / 4) объем
2. Укажите количество значащих цифр в следующем измерении: 24,60 мл.
tt AY
1 222 3) 3. 44
3. Округлите следующее число до трех значащих цифр: 1,598 x 10 °.
1) 1.59 x 10 ° 2) 1,50 x 10 ° 3) 15,9x шф 1,60 x 10 °
/ 4. Выполните следующую операцию и выберите ответ, приемлемый с точки зрения терминологии.
чисел значащих цифр. Помните, что я подчеркивал в классе. 12,5 г + 4,10 мл
эо
2) 4,0 г / мл 3) 3,05 г / мл 4) 3,048 г / мл 1) 3,04878 гнл 5. Учитывая, что масса атома неона составляет 0,000 000 000 000 000 000 000 0335 г,
выразить массу в научных обозначениях. fo
(1) 335 · 10 2) 3,35 107
у \, 6. «Выполните следующую математическую операцию на вашем калькуляторе и выразите
ответ в экспоненциальном представлении с правильным числом значащих цифр.3,111 x 10% 4,55 «10 °
2,08 х 107 9 х 10 ° оо 1) 7,56x 10 ° | 2) 10 ° 3) 7,6 x 10 дюймов 4) 7,5 x 10 °
\
\
10. tH. 12. 13. Учитывая, что 1 миля = 5280 футов, выберите единичные коэффициенты, которые могут быть получены из
это отношения. f 1) \ миля 2) 5280 футов 3) _5280 миля 4) 1 фут ML Sh80 футов 1 миля 1 фут 5280 миль Сколько ярдов длится марафон? (Марафон — 26 миль, 385 ярдов,
и одна миля равна 1760 ярдам.
Укажите количество значащих цифр в следующем измерении: 24,60 мл.
tt AY
1 222 3) 3. 44
3. Округлите следующее число до трех значащих цифр: 1,598 x 10 °.
1) 1.59 x 10 ° 2) 1,50 x 10 ° 3) 15,9x шф 1,60 x 10 °
/ 4. Выполните следующую операцию и выберите ответ, приемлемый с точки зрения терминологии.
чисел значащих цифр. Помните, что я подчеркивал в классе. 12,5 г + 4,10 мл
эо
2) 4,0 г / мл 3) 3,05 г / мл 4) 3,048 г / мл 1) 3,04878 гнл 5. Учитывая, что масса атома неона составляет 0,000 000 000 000 000 000 000 0335 г,
выразить массу в научных обозначениях. fo
(1) 335 · 10 2) 3,35 107
у \, 6. «Выполните следующую математическую операцию на вашем калькуляторе и выразите
ответ в экспоненциальном представлении с правильным числом значащих цифр.3,111 x 10% 4,55 «10 °
2,08 х 107 9 х 10 ° оо 1) 7,56x 10 ° | 2) 10 ° 3) 7,6 x 10 дюймов 4) 7,5 x 10 °
\
\
10. tH. 12. 13. Учитывая, что 1 миля = 5280 футов, выберите единичные коэффициенты, которые могут быть получены из
это отношения. f 1) \ миля 2) 5280 футов 3) _5280 миля 4) 1 фут ML Sh80 футов 1 миля 1 фут 5280 миль Сколько ярдов длится марафон? (Марафон — 26 миль, 385 ярдов,
и одна миля равна 1760 ярдам. ) fo ‘1 H6. 5 ярдов 2) 45 760 ярдов 3): 385.014 ярдов
NN Как далеко проходит свет за час? (Скорость света составляет 186000 миль в секунду.
второй.L) В КАЧЕСТВЕ \ C 1) 4,70 x 10 ° миль 2) 67000 миль 3) 1,5 x 10 ° миль Класс химии начался с 135 студентов. Из первоначального набора —
11,1% получили выпускную оценку А. Сколько учеников получили пятерку? лиса» 1) 12 (2) 15) 3) 18 4 21 «
В 1982 году Монетный двор Китая прекратил производство медных грошей из-за высокой цены на них.
медь, и начал фазировку в монетах из цинка, покрытых 2 тонкими слоями
медь. Копейка Ifa 1990 года весит 2,554 г и содержит 2,490 г цинка, какая масса
меди присутствует в копейке? против
1 Olg 2) 0.078 (_3) .9064 8 Какое процентное содержание меди и цинка, соответственно, присутствует в вышеуказанном?
монета? / 1) 39,99%, 60,01% | 23%, 97,49% 3) 10,2%, 89,8%
Какие из следующих утверждений относительно метрической системы верны? 1. Jt использует базовую единицу для длины, массы и объема. 2. Это десятичная система счисления, в которой используются префиксы, связанные с точностью до 10.
) fo ‘1 H6. 5 ярдов 2) 45 760 ярдов 3): 385.014 ярдов
NN Как далеко проходит свет за час? (Скорость света составляет 186000 миль в секунду.
второй.L) В КАЧЕСТВЕ \ C 1) 4,70 x 10 ° миль 2) 67000 миль 3) 1,5 x 10 ° миль Класс химии начался с 135 студентов. Из первоначального набора —
11,1% получили выпускную оценку А. Сколько учеников получили пятерку? лиса» 1) 12 (2) 15) 3) 18 4 21 «
В 1982 году Монетный двор Китая прекратил производство медных грошей из-за высокой цены на них.
медь, и начал фазировку в монетах из цинка, покрытых 2 тонкими слоями
медь. Копейка Ifa 1990 года весит 2,554 г и содержит 2,490 г цинка, какая масса
меди присутствует в копейке? против
1 Olg 2) 0.078 (_3) .9064 8 Какое процентное содержание меди и цинка, соответственно, присутствует в вышеуказанном?
монета? / 1) 39,99%, 60,01% | 23%, 97,49% 3) 10,2%, 89,8%
Какие из следующих утверждений относительно метрической системы верны? 1. Jt использует базовую единицу для длины, массы и объема. 2. Это десятичная система счисления, в которой используются префиксы, связанные с точностью до 10.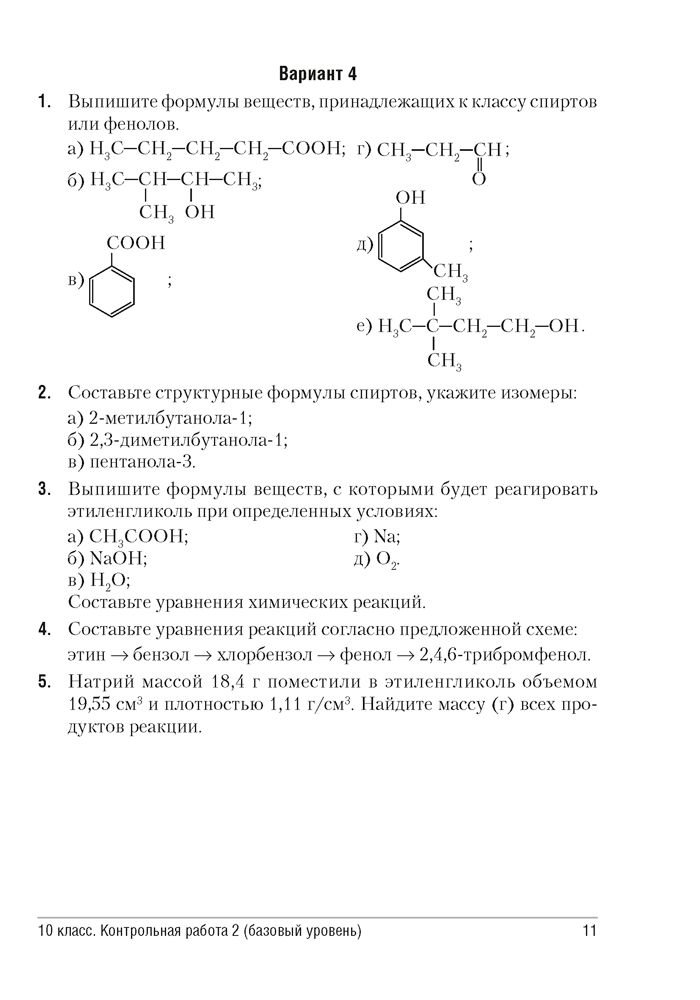 3. Он используется во всем научном сообществе. 4. Это официальная система измерения в США. 1 22 3) 3 4) 4 5) 1,2 и 3 ° 6) 12,3 и 4 о
3. Он используется во всем научном сообществе. 4. Это официальная система измерения в США. 1 22 3) 3 4) 4 5) 1,2 и 3 ° 6) 12,3 и 4 о
10-й класс по главе химии, мудрый онлайн-тест mcq с ответами по химии
Изучение состава веществ, строения, свойств и реакций веществ называется химией.Химия — это основная отрасль науки, и она преподается на более высоком уровне образования. Здесь тепло приветствуются все те студенты, которые изучают предмет химии на уровне аттестата зрелости. Это потому, что здесь, на этой странице, мы предлагаем лучший способ хорошей подготовки. Здесь студенты могут найти онлайн-систему тестирования по предмету химия. В системе онлайн-тестирования учащимся предоставляется тестовая система по главам, полукнижам и полных книг в форме вопросов с несколькими вариантами ответов, MCQ.Эти вопросы предложены таким образом, чтобы учащиеся сталкивались с ежегодным экзаменом . После прохождения этих тестов студенты получат полное представление о том, как подготовиться и сдать выпускной экзамен.
После прохождения этих тестов студенты получат полное представление о том, как подготовиться и сдать выпускной экзамен.
10th Chemistry Chapter Wise Test
(средний английский)
Считается, что это лучший способ оценить вашу подготовку. Это связано с тем, что учащимся предоставляется быстрый результат теста и правильные ответы.Это будет первый случай, когда учащимся будет предоставлена система онлайн-тестирования . Студентам также сообщается, что они могут бесплатно зарегистрироваться для участия в этой тестовой системе. Ilmkidunya.com — это платформа, которая предоставляет практически любую помощь, связанную с системой образования Пакистана. Студентам также сообщают, что они не ограничиваются только системой онлайн-тестирования по химии. Однако они могут найти тестовую систему почти по всем предметам, преподаваемым на уровне аттестата зрелости.Кроме того, учащиеся от начального до среднего уровня могут найти онлайн-тестовую систему для хорошей подготовки . Кроме того, здесь, на сайте ilmkidunya.com, предлагается система онлайн-тестов для подготовки к вступительным или конкурсным экзаменам.
Кроме того, здесь, на сайте ilmkidunya.com, предлагается система онлайн-тестов для подготовки к вступительным или конкурсным экзаменам.
6.4D: Индивидуальные тесты — Chemistry LibreTexts
Beilstein Test
Тест Бейльштейна подтверждает присутствие галогена в растворе, но не делает различий между хлором, бромом или йодом. Медную проволоку погружают в галогенсодержащий раствор и втыкают в пламя.Оксид меди на проволоке реагирует с органическим галогенидом с образованием галогенида меди, который придает сине-зеленый цвет пламени.
Процедура : В вытяжном шкафу очистите медный провод с петлей, вставив его в кончик синего конуса пламени горелки Бунзена, пока он не загорится (Рисунок 6.46a). Обязательно «сожгите» всю остаточную жидкость на проводе (перед началом убедитесь, что все зеленое пламя от предыдущих тестов погасло).
Дайте меди остыть до комнатной температуры, затем окуните ее в пробирку, содержащую 5-10 капель вашего образца, как можно больше покрывая ее (Рисунок 6. 46б). Если образец твердый, прикрепите часть твердого вещества к медной проволоке, сначала смочив проволоку дистиллированной водой, а затем прикоснувшись к твердому телу.
46б). Если образец твердый, прикрепите часть твердого вещества к медной проволоке, сначала смочив проволоку дистиллированной водой, а затем прикоснувшись к твердому телу.
Немедленно погрузите проволоку с образцом в синий конус пламени. Положительный результат — зеленое пламя, хотя оно может быть недолговечным и слабым (может быть легче увидеть, выключен ли свет вытяжного шкафа). Отрицательный результат — отсутствие этого зеленого цвета (рис. 6.46c + d).
Рисунок 6.46: а) Очистка медной проволоки в пламени, б) Погружение медной проволоки в реагент, в) Отрицательный результат (гексаны), г) Положительный результат (1-хлорбутан).{2 +}} \) в реагенте Бенедикта (который образует комплекс с цитрат-ионами для предотвращения осаждения \ (\ ce {Cu (OH) _2} \) и \ (\ ce {CuCO_3} \)). Нерастворимый \ (\ ce {Cu_2O} \) — неорганический продукт этой реакции, который обычно имеет красно-коричневый цвет (рис. 6.47). Углеводы, содержащие только ацетальные связи, являются невосстанавливающими сахарами и дают отрицательный результат в этом тесте. Рисунок 6.47: Структура полуацеталей и ацеталей, а также реакция полуацеталя с реактивом Бенедикта.
Рисунок 6.47: Структура полуацеталей и ацеталей, а также реакция полуацеталя с реактивом Бенедикта.Процедура : Растворите \ (10 \) — \ (30 \: \ text {mg} \) твердый или 3 капли жидкого образца в минимальном количестве воды \ (\ left (0.9 \) Нагрейте синий раствор на кипящей водяной бане в течение 2 минут (рис. 6.48a). Положительный результат — образование красновато-коричневого раствора или осадка через некоторое время, отрицательный результат — сохранение синего цвета (рис. 6.48c + d).
Рисунок 6.48: а) Нагревание раствора Бенедикта в кипящей водяной бане, б) Результаты теста Бенедикта: левая пробирка — сахароза (отрицательный), правая пробирка — глюкоза (положительный результат), в) отрицательный результат, г) положительный результат. Конъюгированные альдегиды не реагируют в тесте Бенедикта, и автор обнаружил, что многие неконъюгированные альдегиды также не реагируют.Образование коллоидов, по-видимому, предотвращает образование красного осадка (Рисунок 6. 49 показывает появление пропионового альдегида в горячей водяной бане, образуя мутный коллоид).
49 показывает появление пропионового альдегида в горячей водяной бане, образуя мутный коллоид).
Реакция может работать только с соединениями, которые являются водорастворимыми (например, углеводами), поскольку реакция, по-видимому, начинается на поверхности (Рисунок 6.{2 +}} \) в комплекс с двумя тартрат-ионами.
Тест на бикарбонат
Карбоновые кислоты и сульфоновые кислоты могут реагировать с бикарбонатом натрия \ (\ left (\ ce {NaHCO_3} \ right) \) с образованием диоксида углерода и воды (рис. 6.51). Другие основные функциональные группы (большинство фенолов и спиртов) недостаточно кислые, чтобы производить газ с бикарбонатом.
Рисунок 6.51: Реакция карбоновых и сульфоновых кислот с бикарбонат-ионом. Процедура : Добавьте \ (2 \: \ text {mL} \) of \ (5 \% \: \ ce {NaHCO_3} \ left (aq \ right) \) в пробирку и добавьте 5 капель или \ (50 \: \ text {mg} \) вашего образца. Смешайте раствор, взбалтывая пробирку. Положительным результатом теста на карбоновые кислоты является образование пузырьков или вспенивания (рис. 6.52).
Смешайте раствор, взбалтывая пробирку. Положительным результатом теста на карбоновые кислоты является образование пузырьков или вспенивания (рис. 6.52).
Тест на бром
Раствор брома в \ (\ ce {CH_2Cl_2} \) — это тест на ненасыщенность (алкены и алкины) и в некоторых случаях на способность к окислению (альдегиды). Раствор брома оранжевый, и после реакции раствор становится бесцветным из-за потребления брома.Бром реагирует с алкенами и алкинами посредством реакций присоединения и с альдегидами посредством окисления (рис. 6.53). Он не вступает в реакцию с ароматическими соединениями, что делает его хорошим тестом для отличия алкенов от ароматических соединений.
Рисунок 6.53: Реакция алкена, алкина и альдегида с бромом. Процедура : Растворите 4 капли или \ (50 \: \ text {mg} \) образца в \ (1 \: \ text {mL} \) дихлорметана \ (\ left (\ ce {CH_2Cl_2} \ right ) \) или 1,2-диметоксиэтан. Добавьте в пробирку 2 капли оранжевого раствора \ (5 \% \: \ ce {Br_2} \) в \ (\ ce {CH_2Cl_2} \) и наблюдайте.Положительный результат — немедленное исчезновение оранжевого цвета с образованием прозрачного или слегка желтого раствора (рис. 6.54). Отрицательный результат — сохранение оранжевого цвета. Альдегиду может потребоваться небольшое количество времени для обесцвечивания раствора и получения положительного результата (примерно 1 мин, рис. 6.55), а конъюгированные альдегиды нереактивны (рис. 6.55).
Добавьте в пробирку 2 капли оранжевого раствора \ (5 \% \: \ ce {Br_2} \) в \ (\ ce {CH_2Cl_2} \) и наблюдайте.Положительный результат — немедленное исчезновение оранжевого цвета с образованием прозрачного или слегка желтого раствора (рис. 6.54). Отрицательный результат — сохранение оранжевого цвета. Альдегиду может потребоваться небольшое количество времени для обесцвечивания раствора и получения положительного результата (примерно 1 мин, рис. 6.55), а конъюгированные альдегиды нереактивны (рис. 6.55).
Тест на хромовую кислоту (по Джонсу)
Раствор \ (\ ce {CrO_3} \) в \ (\ ce {H_2SO_4} \) — это тест на полярные функциональные группы, которые могут быть окислены, включая альдегиды, первичные спирты и вторичные спирты (рис. {3 +}} \), которые часто осаждаются в ацетоне.{3 +}} \) виды.
{3 +}} \), которые часто осаждаются в ацетоне.{3 +}} \) виды.
2,4-DNPH (Brady’s) Тест
Раствор 2,4-динитрофенилгидразина (2,4-ДНФГ) в этаноле — это тест на альдегиды или кетоны (рис. 6.59). Большинство альдегидов или кетонов реагируют с оранжевым реагентом с образованием красного, оранжевого или желтого осадка.Сложные эфиры и другие карбонильные соединения обычно недостаточно реактивны, чтобы дать положительный результат этого теста.
Цвет осадка может свидетельствовать о количестве конъюгации, присутствующей в исходном карбониле: оранжевый осадок образуется для неконъюгированных карбонилов (Рисунок 6.60c показывает результат для 2-бутанона), а красный осадок образуется для конъюгированных карбонилов. (Рисунок 6.60d показывает результат для коричного альдегида).
(Рисунок 6.60d показывает результат для коричного альдегида).
Положительный результат — немедленное образование большого количества ярко окрашенного осадка (красного, оранжевого или желтого). Отрицательный результат — отсутствие этого осадка и прозрачный желто-оранжевый раствор (рис. 6.60).
Рисунок 6.60: а) результаты 2,4-ДНФГ (слева направо) этилацетат (отрицательный), 2-бутанон (положительный), бензальдегид (положительный), коричный альдегид (положительный), б) отрицательный результат, в) положительный результат от несопряженный карбонил, d) Положительный результат от сопряженного карбонила.{3 +}} \), что привело бы к ложноположительному результату. Рисунок 6.61: Реакция сложного эфира с гидроксамовой кислотой. Процедура : Выполните предварительный тест, чтобы убедиться, что этот тест не даст ложного срабатывания. Добавьте следующее в небольшую пробирку (\ (13 \) x \ (100 \: \ text {mm} \)): \ (1 \: \ text {mL} \) этанол, 2 капли или \ (20 \ : \ text {mg} \) вашего образца, \ (1 \: \ text {mL} \) из \ (1 \: \ text {M} \: \ ce {HCl} \ left (aq \ right) \ ) и 2 капли раствора \ (5 \% \: \ ce {FeCl_3} \ left (aq \ right) \).{3 +}} \) даже без гидроксиламина.
Добавьте следующее в небольшую пробирку (\ (13 \) x \ (100 \: \ text {mm} \)): \ (1 \: \ text {mL} \) этанол, 2 капли или \ (20 \ : \ text {mg} \) вашего образца, \ (1 \: \ text {mL} \) из \ (1 \: \ text {M} \: \ ce {HCl} \ left (aq \ right) \ ) и 2 капли раствора \ (5 \% \: \ ce {FeCl_3} \ left (aq \ right) \).{3 +}} \) даже без гидроксиламина.
В чистую пробирку среднего размера (\ (18 \) x \ (150 \: \ text {mm} \)) добавьте \ (1 \: \ text {mL} \) из \ (0,5 \: \ text {M} \) водный гидрохлорид гидроксиламина \ (\ left (\ ce {NH_2OH} \ cdot \ ce {HCl} \ right) \), \ (0.5 \: \ text {mL} \) of \ ( 6 \: \ text {M} \: \ ce {NaOH} \ left (aq \ right) \) и 5 капель или \ (50 \: \ text {mg} \) образца. Нагрейте смесь на кипящей водяной бане около 3 минут (объем уменьшится примерно вдвое, рисунок 6.62b).
Быстро охладите раствор, погрузив его в водопроводную ванну, затем добавьте \ (2 \: \ text {mL} \) из \ (1 \: \ text {M} \: \ ce {HCl} \ left (aq \Правильно)\). Если раствор станет мутным, добавьте этанола, чтобы он стал прозрачнее. Затем добавьте 6-10 капель желтого раствора \ (5 \% \: \ ce {FeCl_3} \ left (aq \ right) \). Трубку энергично перемешайте.
Если раствор станет мутным, добавьте этанола, чтобы он стал прозрачнее. Затем добавьте 6-10 капель желтого раствора \ (5 \% \: \ ce {FeCl_3} \ left (aq \ right) \). Трубку энергично перемешайте.
Положительный результат — глубокий бордовый, темно-коричневый или пурпурный цвет (красный / коричневый), а отрицательный результат — любой другой цвет (рис. 6.62c + d).-} \ right) \) in \ (\ ce {NaOH} \) может использоваться для проверки метилкетонов или вторичных спиртов, примыкающих к метильной группе. Это очень специфический тест, который даст положительный результат (образование канареечного желтого осадка) только для соединений со структурой \ (\ ce {RCH (OH) CH_3} \) или \ (\ ce {RC = OCH_3} \ ) (Рисунок 6.63). Он не подходит для всех спиртов и кетонов, а также для нерастворимых в воде соединений.
Рисунок 6.63: Реакция вторичного спирта или метилкетона с йодоформным реагентом.{12} \) (\ (\ ce {I_2} / \ ce {KI} \) раствор) и энергично перемешайте пробирку путем встряхивания.
Положительный результат — мутно-желтый раствор или желтый осадок. Отрицательный результат — прозрачный, желтый или оранжевый раствор без осадка (рис. 6.64).
Если образец не растворим в воде, можно увидеть небольшой органический слой, отдельный от раствора (вероятно, он будет сверху). Этот слой может стать темно-желтым или коричневым из-за растворения йода. Энергично перемешайте пробирку, чтобы вызвать реакцию, но если темный органический слой остается и осадок не образуется, это все равно является отрицательным результатом (Рисунок 6.64d).
Примечание: ложноположительный результат может быть получен, если пробирка была очищена ацетоном перед использованием, а в пробирке остался ацетон.
Рисунок 6.64: a) Результаты по йодоформу (слева направо): 1-пропанол, 2-пропанол, ацетон, 1-октанол (b) Отрицательный результат, c) Положительный результат, d) Отрицательный результат, когда образец не растворяется в реагенте.Тест Лукаса
Реагент Лукаса (концентрированный \ (\ ce {HCl} \) и \ (\ ce {ZnCl_2} \)) — это тест на некоторые спирты. Спирты могут реагировать по механизму \ (S_ \ text {N} 1 \) с образованием алкилгалогенидов, которые нерастворимы в водном растворе и появляются в виде белого осадка или мутности.\ text {o} \: \ ce {ROH} + \ ce {HCl} / \ ce {ZnCl_2} \ rightarrow \ ce {RCl} \ left (s \ right) \]
Спирты могут реагировать по механизму \ (S_ \ text {N} 1 \) с образованием алкилгалогенидов, которые нерастворимы в водном растворе и появляются в виде белого осадка или мутности.\ text {o} \: \ ce {ROH} + \ ce {HCl} / \ ce {ZnCl_2} \ rightarrow \ ce {RCl} \ left (s \ right) \]
Поскольку механизм — \ (S_ \ text {N} 1 \), третичный спирт должен реагировать немедленно, вторичный спирт — медленнее (возможно, через 5 минут, если вообще), а первичные спирты часто вообще не реагируют. Бензиловые спирты \ (\ left (\ ce {Ph-C-OH} \ right) \), аллильные спирты \ (\ left (\ ce {C = CC-OH} \ right) \) и пропаргиловые спирты \ (\ left (\ ce {C \ Equiv CC-OH} \ right) \) часто дают немедленные результаты, как и третичные спирты.{14} \) Отрицательный результат — отсутствие облачности или только один слой (рис. 6.65).
Рисунок 6.65: a) Результаты теста Лукаса (слева направо): 1-пропанол (первичный, отрицательный), 2-пропанол (вторичный, отрицательный), трет-бутанол (третичный, положительный), бензиловый спирт (бензиловый, положительный), b ) Отрицательный результат, в) Положительный результат.
Перманганат (Baeyer) Тест
Раствор перманганата калия \ (\ left (\ ce {KMnO_4} \ right) \) — это тест на ненасыщенность (алкены и алкины) или функциональные группы, которые могут быть окислены (альдегиды и некоторые спирты, Рисунок 6.-} \ right) \) имеет темно-фиолетовый цвет и при восстановлении превращается в коричневый осадок \ (\ left (\ ce {MnO_2} \ right) \). Перманганат не может вступать в реакцию с ароматическими соединениями, поэтому это хороший тест для различения алкенов и ароматических соединений. Положительная реакция со спиртами не всегда надежна (отрицательный результат показан для бензиловых спиртов на рис. 6.67).
Рисунок 6.66: Реакция алкена и альдегида с перманганат-ионом. Процедура : Растворите 4 капли или \ (40 \: \ text {mg} \) образца в \ (1 \: \ text {mL} \) этанола (или 1,2-диметоксиэтана) в небольшом тесте. трубка (\ (13 \) x \ (100 \: \ text {mm} \)).В перчатках добавьте 3 капли раствора темно-фиолетового \ (1 \% \: \ ce {KMnO_4} \ left (aq \ right) \) в пробирку (примечание по безопасности : реагент вызывает коррозию и оставляет пятна на коже. коричневый!). Перемешайте пробирку при встряхивании и оставьте на 1 минуту. Положительный результат — появление коричневого цвета или осадка. Отрицательный результат — темно-фиолетовый без осадка (непрореагировавший \ (\ ce {KMnO_4} \), рис. 6.67).
коричневый!). Перемешайте пробирку при встряхивании и оставьте на 1 минуту. Положительный результат — появление коричневого цвета или осадка. Отрицательный результат — темно-фиолетовый без осадка (непрореагировавший \ (\ ce {KMnO_4} \), рис. 6.67).
Тест pH
Карбоновые кислоты и сульфоновые кислоты образуют кислые водные растворы (рис. 6.68a), что можно подтвердить, сделав голубую лакмусовую бумажку розовой. Бумага меняет цвет (рис. 6.68c), когда молекулы индикатора вступают в реакцию с пониженным pH и образуют структуру другого цвета.
Рисунок 6.68: a) Реакция карбоновой кислоты с водой с образованием слабокислого раствора, b) Результаты отрицательного теста pH, c) Результаты положительного теста pH. Процедура : Растворите 3 капли или \ (30 \: \ text {mg} \) образца в \ (1 \: \ text {mL} \) воды. {3 +}} \) (часто темно-синим).{3 +}} \) с фенолом.
{3 +}} \) (часто темно-синим).{3 +}} \) с фенолом.
Процедура : Налейте воду \ (1 \: \ text {mL} \) в небольшую пробирку (\ (13 \) x \ (100 \: \ text {mm} \)) вместе с 3 каплями или \ (30 \: \ text {mg} \) образца. Добавьте 3 капли желтого раствора \ (5 \% \: \ ce {FeCl_3} \ left (aq \ right) \) и перемешайте встряхиванием.
Положительный результат — это интенсивный синий, фиолетовый, красный или зеленый цвет, а отрицательный результат — желтый цвет (исходный цвет раствора \ (\ ce {FeCl_3} \), рисунок 6.70).
Рисунок 6.70: a) Результаты фенолового теста (слева направо) для молочной кислоты (отрицательный), п-крезол (положительный), пирогаллол (положительный), b) Отрицательный результат, c) Положительный результат (типичный цвет), d) Положительный результат ( реже окрашивается пирогаллолом, бидентатным лигандом).Тест нитрата серебра
Разбавленный раствор нитрата серебра в этаноле — это тест на некоторые алкилгалогениды. Серебро имеет высокое сродство к галогенам (образует сильные ионные связи \ (\ ce {AgX} \)) и поэтому поддерживает механизм \ (S_ \ text {N} 1 \). По этой причине третичные алкилгалогениды реагируют быстрее, чем вторичные алкилгалогениды (которые могут или не могут реагировать даже при нагревании), а первичные алкилгалогениды или ароматические галогениды не дают реакции.Бензильные \ (\ left (\ ce {PhCH_2X} \ right) \) и аллильные \ (\ left (\ ce {CH_2 = CHCH_2X} \ right) \) алкилгалогениды также будут давать быструю реакцию. Положительный результат теста — образование нерастворимого \ (\ ce {AgX} \) (рис. 6.71). \ (\ ce {AgCl} \) и \ (\ ce {AgBr} \) — белые твердые тела, а \ (\ ce {AgI} \) — желтые твердые тела.
По этой причине третичные алкилгалогениды реагируют быстрее, чем вторичные алкилгалогениды (которые могут или не могут реагировать даже при нагревании), а первичные алкилгалогениды или ароматические галогениды не дают реакции.Бензильные \ (\ left (\ ce {PhCH_2X} \ right) \) и аллильные \ (\ left (\ ce {CH_2 = CHCH_2X} \ right) \) алкилгалогениды также будут давать быструю реакцию. Положительный результат теста — образование нерастворимого \ (\ ce {AgX} \) (рис. 6.71). \ (\ ce {AgCl} \) и \ (\ ce {AgBr} \) — белые твердые тела, а \ (\ ce {AgI} \) — желтые твердые тела.
Процедура : В небольшой пробирке (\ (13 \) x \ (100 \: \ text {mm} \)) добавьте \ (2 \: \ text {mL} \) из \ (1 \% \: \ ce {AgNO_3} \) в растворе этанола.\ text {o} \ text {C} \) — отрицательный результат (рисунки 6.72 + 6.73).
Рисунок 6.72: a) Результаты нитрата серебра при комнатной температуре (слева направо) для 1-хлорбутана (первичный, отрицательный), 2-хлорбутана (вторичный, отрицательный), 2-хлор-2-метилпропана (третичный, положительный), b) Баня с кипящей водой, c) Результаты после кипячения воды, средняя трубка слегка мутная (вторичная, положительная).
Для реакций, в которых образуется интенсивный осадок, раствор может также стать синей лакмусовой бумажкой и стать розовой (рис. 6.73c + d).Анализ механизма реакции может объяснить источник этой кислотности.
Рисунок 6.73: a) Отрицательный результат, b) Положительный результат, c) Лакмусовая проба при отрицательном результате \ (\ ce {AgNO_3} \), d) Лакмусовая проба (кислая) при положительном результате \ (\ ce {AgNO_3} \) тестовое задание.Тест на йодид натрия (Финкельштейн)
Раствор йодида натрия в ацетоне — это тест на некоторые алкилхлориды и бромиды. Механизм в основном \ (S_ \ text {N} 2 \), поэтому первичные алкилгалогениды реагируют быстрее, чем вторичные алкилгалогениды, а третичные алкилгалогениды обычно не дают реакции.Реакция вызвана осаждением \ (\ ce {NaCl} \) или \ (\ ce {NaBr} \) в ацетоновом растворителе. Следовательно, положительный результат теста — это появление белого помутнения (твердое вещество \ (\ ce {NaX} \)).
\ [\ begin {array} {ccccccccc} \ ce {CH_3CH_2X} & + & \ ce {NaI} \: \ text {(ацетон)} & \ rightarrow & \ ce {CH_3CH_2I} & + & \ ce {NaX} \ left (s \ right) & & \ left (\ ce {X} = \ ce {Cl}, \ ce {Br} \ right) \\ & & & & & & & \ text {white solid} & & \ end {array} \]
Процедура : В небольшой пробирке (\ (13 \) x \ (100 \: \ text {mm} \)) добавьте \ (2 \: \ text {mL} \) из \ (15 \% \: \ ce {NaI} \) в растворе ацетона. \ text {o} \ text {C} \) водяной бане (вторичный), в) Отрицательный результат (третичный).+} \ right) \) — мягкий окислитель, который может окислять альдегиды, но не спирты или другие карбонильные соединения. Положительный результат теста — образование элементарного серебра (рис. 6.76), которое выпадает в виде «серебряного зеркала» на пробирке или в виде черного коллоидного осадка.
\ text {o} \ text {C} \) водяной бане (вторичный), в) Отрицательный результат (третичный).+} \ right) \) — мягкий окислитель, который может окислять альдегиды, но не спирты или другие карбонильные соединения. Положительный результат теста — образование элементарного серебра (рис. 6.76), которое выпадает в виде «серебряного зеркала» на пробирке или в виде черного коллоидного осадка.
Процедура : В перчатках смешайте \ (1 \: \ text {mL} \) из \ (5 \% \: \ ce {AgNO_3} \ left (aq \ right) \) ( примечание по безопасности: токсично!) с \ (1 \: \ text {mL} \) из \ (10 \% \: \ ce {NaOH} \ left (aq \ right) \) в пробирке среднего размера (\ (18 \) х \ (150 \: \ текст {мм} \)).+} \) (Рисунок 6.77c).
Растворите 3 капли или \ (30 \: \ text {mg} \) образца в нескольких каплях диэтилового эфира (не используйте растворитель, если соединение растворимо в воде). Добавьте этот раствор в \ (2 \) — \ (3 \: \ text {mL} \) предварительно приготовленный реагент Толленса. Перемешайте пробирки встряхиванием. Положительный результат — серебряное зеркало по краям пробирки или образование черного осадка. Отрицательный результат — четкое решение (рисунки 6.77d + 6.78).
Перемешайте пробирки встряхиванием. Положительный результат — серебряное зеркало по краям пробирки или образование черного осадка. Отрицательный результат — четкое решение (рисунки 6.77d + 6.78).
Очистка : Реагент может со временем образовывать очень взрывоопасное вещество (фульминат серебра), поэтому тест следует немедленно очистить.Подкислите раствор с помощью \ (5 \% \: \ ce {HCl} \ left (aq \ right) \), затем выбросьте в стакан для отходов. Серебряное зеркало можно снять со стеклянной посуды, добавив небольшое количество \ (6 \: \ text {M} \: \ ce {HNO_3} \ left (aq \ right) \).
Рисунок 6.77: а) Раствор нитрата серебра б) осадок \ (\ ce {Ag_2O} \), образовавшийся после добавления \ (\ ce {NaOH} \), в) Осветленный раствор после добавления гидроксида аммония, г) Результаты теста Толленса для (слева направо) 2-пентанон (отрицательный), изобутиральдегид, бензальдегид (положительный).{16} \) Этот раствор часто имеет желтую олово.Автор
Лиза Николс (Общественный колледж Бьютта).
 Organic Chemistry Laboratory Techniques находится под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Полный текст доступен онлайн.
Organic Chemistry Laboratory Techniques находится под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Полный текст доступен онлайн.
Chem 101 test 1 notes — Краткое руководство по экзамену 1 для изучения — Лекция по общей химии
CHEM 101 05/31/
Глава 1:
Единицы измерения
— Единицы СИ:
o Использует базовую единицу для каждого количества
o Базовые единицы для всех остальных единиц
-Базовые блоки мы рассматриваем для:
— Длина в метрах (м)
— Масса в килограммах (кг) * Количество материала в объекте
— Температура в кельвинах (K) * мера тепла или холода в объекте
Префиксы: используются для обозначения долей или кратных различных единиц.
— Преобразование основных единиц в единицы, соответствующие измеряемому объекту.
Пример: Милли 10-3 дробь = одна тысячная единицы.
Пример: 1 миллиметр (мм) составляет 10-3 метра м)
1 мм = 1×10-3 м
1 кг = 1000 г
* Если что-то является точным, с этим связана неопределенность
* Каждый префикс связан со своим базовым блоком
Производные единицы СИ:
— Объем — наиболее часто используемые единицы
— М 3 или см 3 (используется для твердых веществ)
o Куб: Д x Ш x В
— Литр (л), миллилитр (мл) (используется для жидкостей)
o 1 мл = 1 см 3 (прямая зависимость)
— Плотность: количество массы в единице объема вещества
o г / см 3 или г / мл
o В зависимости от температуры (плотность = масса / объем; d = m / v)
o Плотность воды: 1. 00 г / см 3 при замораживании объем увеличивается, поэтому плотность
00 г / см 3 при замораживании объем увеличивается, поэтому плотность
становится меньше. Следовательно, лед плавает в воде, так как менее плотный, чем вода
)
Анализ размеров
— Анализ размеров: процедура изменения единиц для обеспечения получения правильной единицы
с использованием коэффициентов пересчета
o Коэффициент преобразования: дробь с числителем и знаменателем, равным
, но с разными единицами измерения
§ Заданная единица x (желаемая единица / данная единица) = желаемая единица
§ * Данные единицы аннулируются)
— Преобразование одной единицы в другую для той же меры
o 1 дюйм = 2.54 см
§ Два коэффициента преобразования: 1 дюйм / 2,54 см или 2,54 см / 1 дюйм
§ Пример: 20,2 дюйма в см?
— (20,2 дюйма) (2,54 см / 1 дюйм) = 51,3 см Требуется дюйм в знаменателе
, чтобы сократить с помощью 20,2 дюйма )
* Мы никогда не начинаем с переводного коэффициента! Всегда начинайте с числа, которое имеет
одна единица
Пример: сколько сантиметров в 6. 51 миля? Mi- & amp; gt; см
— 1 mi = 5280 футов 1 фут = 12 дюймов 1 дюйм = 2,54 см
— * Настроить способ отмены юнитов
6,51 м (5280 футов / 1 м) (12 дюймов / 1 фут) (2,54 см / 1 дюйм) = 1047682944 см
51 миля? Mi- & amp; gt; см
— 1 mi = 5280 футов 1 фут = 12 дюймов 1 дюйм = 2,54 см
— * Настроить способ отмены юнитов
6,51 м (5280 футов / 1 м) (12 дюймов / 1 фут) (2,54 см / 1 дюйм) = 1047682944 см
3 SF Точно Точно Точно = 1050000 см
= 1,05 x 10 6 см
= 3 SF
— Все, что исходит из измерений, неточно, поэтому нужно посчитать сиг
фиг)
Пример: ведро содержит 4 штуки.65 л воды. Сколько это галлонов воды?
— 1л = 1.057qt 1gal = 4qt
4,65 л (1,057 кварты / 1 л) (1 галлон / 4 кварты) = 1,23 галлона
3SFs 4SFs точные 3 SF
* ИДТИ с меньшим количеством сиг-инжиров (какое бы соотношение не было точным; запомнить диаграмму
; использовать сиг-инжир)
Пример: преобразовать 1,36 x 10 9 км 3 в литры км 3 — & amp; gt; L
— 1L = 10-3 м 3 1 км = 10 3 м 4
— 1.36 x 10 9 км 3 (10 3 м / 1 км) (1L / 10 -3 м 3) = 1,36 x 10 21 L
— Увеличьте коэффициент преобразования до того же коэффициента: (10 3 м / 1 км) 3 = 10 9 м 3
— 3 км
Пример: Объем скважины 40,0 футов 3. Сколько килограммов бетона потребуется
Сколько килограммов бетона потребуется
для заполнения колодца, если плотность бетона составляет 2,85 г / см 3?
Никогда не начинайте наше уравнение с коэффициента преобразования!
* 1 кг = 1000 г Ft 3 — & amp; gt; кг ( Из-за погрешности измерения, определить сигн.)
40.0 футов 3 (12 дюймов / 1 фут) 3 (2,54 см / 1 дюйм) 3 (2,85 г / 1 см 3) (1 кг / 1000 г) = 3228,12 кг
* Мы используем 3 сиг-инжира, поэтому окончательный ответ: 3230 кг или 3,23 x 10 3 кг
Связь между префиксом и базовым блоком: 1 кг = 1000 г — & amp; gt; пример точного отношения
Глава 2: Атомы, молекулы и ионы
Структуры атомов
Атомный вес, AW: общие массы всех изотопов элемента с учетом
их относительных содержаний.
-Также называется Средняя атомная масса
Атомный вес = 휀 [(масса изотопа) (% содержания изотопа)]
Пример: количество хлора естественного происхождения — 75.78% 35 Cl (атомная масса 34,969 а.е.м.) и
24,22% 37 Cl (атомная масса 36,966 а. е.м.). Рассчитайте атомный вес хлора.
е.м.). Рассчитайте атомный вес хлора.
Содержание 35 Cl = 75,78%
Атомная масса = 34,969 а.е.м.
37 Cl Изобилие = 24,22%
Атомная масса = 36.966 а.е.
* Используя формулу атомного веса:
Атомный вес = [(масса изотопа) (% содержания изотопа)]
AW = (34.969amu) (0,7578) + (36,966amu) (0,2422)
= 26,50amu + 8,953amu * Запишите в виде десятичной дроби!
= 35,45amu * Для сложения & amp; amp; вычитание, за вычетом цифр после десятичных чисел в sig figs
* Для умножения & amp; amp; деление, без инжира
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА:
- Элементы расположены в порядке возрастания атомного номера
- Каждая горизонтальная строка представляет собой период
- Элементы со схожими свойствами, помещенные в вертикальные столбцы, называемые группами
1-я группа — щелочной металл
2-я группа — щелочноземельный металл
Середина: переходный металл - 8 основных групп.(Элементы в одной группе имеют схожие свойства)
- Элементы слева от ступенчатой линии, металлы
- За исключением водорода
- Элементы справа от ступенчатой линии, неметаллы и водород (в основном газ
и мягкие металлы) - Элементы на границе ступенчатой линии, металлоиды
- За исключением алюминия (в зависимости от того, с какой стороны линии он коснется,
будет действовать как металл или неметалл) - Алюминий = металл
МОЛЕКУЛЫ & amp; ХИМИЧЕСКИЕ ФОРМУЛЫ:
-Молекулярные соединения: Состоят из молекул, содержащих более одного типа
атомов H 2 O CO 2
-Химическая формула: Указывает состав каждого вещества буквами и цифрами
a. Молекулярная формула: дает фактическое количество атомов в молекуле
Молекулярная формула: дает фактическое количество атомов в молекуле
* Перекись водорода: H 2 O 2 Нитрат кальция: Ca (NO 3) 2
(1 атом Ca, 2 атома N, 6 атомов O)
b. Эмпирическая формула: дает простейшее соотношение атомов в молекуле
* Перекись водорода: HO Нитрат кальция: Ca (NO 3) 2
НАИМЕНОВАНИЕ ХИМИЧЕСКИХ ВЕЩЕСТВ:
Органические соединения: содержат углерод и водород, часто с кислородом, азотом
или другими элементами
Неорганические соединения: Все остальные:
— Ионные: Металлы и неметаллы: KBr
— Молекулярные: Только неметаллы: SO 2
o Двухатомный: молекулярное соединение, состоящее из двух одинаковых атомов:
§ Br 2 H 2
- Кислоты: содержат и начинаются с водорода: HNO 3
ИОНЫ И ИОННЫЕ СОЕДИНЕНИЯ:
— Ионы: образуются, когда атом приобретает или теряет электроны
o Катионы: атом металла теряет электроны, в результате чего образуется ион с положительным зарядом
: Ca2 +, Na +
o Анион: атом неметалла получил электроны, что привело к образованию иона с отрицательным зарядом
: O 2
— Ионные соединения: комбинации металлов и неметаллов »CaF 2, Na 2 O
— Сколько электронов у Na +?
o 10 (потому что Z (атомный номер) = 11 — & gt; 11 протонов и положительный заряд
означает, что он потерял электрон. Итак, 11-1 = 10 электронов
Итак, 11-1 = 10 электронов
НАИМЕНОВАНИЕ КАТИОНА:
1) Катионы, образованные из атомов металла, образующих катион с одним фиксированным зарядом.
-Имеют то же имя, что и металл.
-Металлы групп 1A и 2A и 3A с зарядом, равным номеру группы
-Два переходных металла: Zn2 + , Ag +
Na +: ион натрия Mg2 +: ион магния Zn2 +: ион цинка
2) Катионы, образованные из атомов металлов, образующих катионы с разным зарядом:
— Положительный заряд обозначается римской цифрой в скобках после названия металла
— В основном переходные металлы в середине таблицы Менделеева
Fe2 + ион железа (II) Cu + ион меди (I)
3) Катионы, образованные из металлов:
-Имеют имена, оканчивающиеся на –ium
NH 4 + ион аммония
H 3 O + ион гидроксония
Именование анионов:
Одноатомные атомы: окончание имени элемента заменяется на — ide
Первое, что вы видите, это металл, поэтому он ионный.- & amp; gt; катион: ион меди * образует катион с
различными зарядами
(ионное соединение имеет один катион и один анион)
è Анион является многоатомным: ClO 4 —
Определите заряды: соединение должно быть нейтральным
è 1 (Cu) + 2 (-1) = 0 ( Cu — неизвестное значение: x)
è Cu = + 2 — & amp; gt; Перхлорат меди (II)
Пример: CaCl 2 (ионное соединение, поскольку Ca является металлом)
Катион: ион кальция, группа 2, фиксированный заряд 2+
Анион: Cl-, одноатомный, ide
è Хлорид кальция
Пример: NH 4 NO 3
Катион: NH 4 + ион аммония
Анион: NO 3 —
Нитрат аммония
Написание химических формул для ионных соединений
- Сначала катион, затем анион
- Определите заряд после определения, является он ионным или нет.
 è Заряды не записываются в формуле
è Заряды не записываются в формуле
è В целом электрически нейтральный, общий положительный заряд должен равняться общему отрицательному заряду - Торговые сборы
Хлорид магния: Mg2 + и Cl- превращается в MgCl 2
Хлорид натрия: Na ++ и Cl- превращается в NaCl
* Торговые сборы не требуются, если они равны.
è Используйте самую низкую норму ионов
o Запишите в виде эмпирической формулы
§ Ca2 + и S2- превращается в Ca 2 S 2 — & amp; gt; CaS
Пример: дайте химическую формулу для каждого из следующих соединений:
a.Нитрат цинка
* Группы 1-3 имеют фиксированную плату, поэтому цинк фиксируется.
* Окончание определяет, является ли оно одноатомным или многоатомным. –Ate является многоатомным, — заряд 1
.
è Zn2 + NO 3 —
è Zn (NO 3) 2 * Многоатомный ион в скобках
г. Нитрид железа (III) * Римская цифра обозначает заряд
Fe3 + N3- — & amp; gt; Fe 3 N 3 — & amp; gt; FeN
г.Карбонат железа (III) Fe3 + CO 3 2- Fe 2 (CO 3) 3
г. Гидоксид алюминия
Гидоксид алюминия
Al3 + OH-
Al (OH) 3
Пример: Каков заряд Fe в FeSO 4?
Fe? SO 4 2-
1 (Fe) + 1 (-2) =
Fe = +2
* Они также обменивают сборы, поэтому Fe должно быть 2, поэтому они отменяют с 2-
Обозначение бинарных молекулярных соединений
è Изготовлен из двух неметаллов
è Первый элемент, крайний левый в периодической таблице, исключение: Кислород всегда
последним, если только он не объединен с фтором
è Второму элементу дается отрицательное окончание
è Греческие префиксы для обозначения количества атомов.
è Префикс моно никогда не используется с первым элементом.
Пример: NF 3 Трифлурид азота (имя не изменилось)
Не нужно говорить моно, если есть только один азот.
3 F, поэтому префикс –ide
è Если префикс заканчивается на a или o, а имя второго элемента начинается с гласной,
отбрасывает a или o префикса.
o Окись углерода CO
Пример: укажите название или молекулярную формулу
Двуокись серы — & amp; gt; SO 2
BrF 3 Трифлурид брома
PCl 5 Пентахлорид фосфора
N 2 O 5 Пентаоксид диазота
* Всегда –ide для молекулярных соединений
Двухатомные молекулы
-Эти семь элементов встречаются в природе в виде молекул, содержащих два атома:
H 2, N 2, O 2, F 2, Cl 2, Br 2, I 2
являются газами
-Кислоты: молекулярные соединения, состоящие из металлов
Начните с водорода
Состоит из аниона и
* дополнительные примечания на слайде
Анионы оканчиваются на –ide: добавьте префикс hydro и замените ide на ic, за которым следует слово acid. Пример: хлорид, Cl- — & amp; gt; соляная кислота, HCl
è Анионы оканчиваются на –ate: замените ate на ic.
è Хлорат, ClO 3 — — & amp; gt; Хлорная кислота, HClO 3
Пример: хлорид, Cl- — & amp; gt; соляная кислота, HCl
è Анионы оканчиваются на –ate: замените ate на ic.
è Хлорат, ClO 3 — — & amp; gt; Хлорная кислота, HClO 3
è Анионы заканчиваются на: замените его на ous
è Хлорит, ClO 2 — — & amp; gt; Хлористая кислота, HClO 2
Приставки в названиях анионов сохраняются в названии кислоты
Пример: Напишите сбалансированное уравнение, когда водный раствор нитрата серебра реагирует с водным раствором хлорида кальция
с образованием твердого хлорида серебра и водного раствора нитрата кальция
* Серебро: переходный металл
Ag + NO 3 -1 + Ca 2 + Cl-1 — & amp; gt; Ag + Cl-1 + Ca2 + NO 3 -1
AgNO 3 (водн.) + CaCl 2 (водн.) — & amp; gt; AgCl (s) + Ca (NO 3) 2 (водн.)
Ag: 1 — & amp; gt; 2 Ag: 1 — & gt;
№ 3: 1 — & amp; gt; 2 NO 3:
Ca: 1 Ca:
Cl: 1 Cl: 1 — & amp; gt;
Типы химических реакций:
Ø В разделе:
1.Комбинированные реакции: два или более химических вещества реагируют с образованием одного продукта. — Если металл и неметалл объединяются, продукт будет ионным
— Если металл и неметалл объединяются, продукт будет ионным
o X + Y — & amp; gt; XY
о 4Fe (s) + 3O 2 (г) — & amp; gt; 2Fe 2 O 3 (s)
o N 2 (г) + 3H 2 (г) — & amp; gt; 2NH 3 (г)
Пример: Когда Mg и N 2 подвергаются реакции сочетания, каков химический
формула продукта?
— Mg (s) + N 2 (г) — & amp; gt; Mg2 + N3-
— Mg (s) + N 2 (г) — & amp; gt; Mg 3 N 2
— 3Mg (s) + N 2 (г) — & amp; gt; Магний 3 N 2
2.Реакции разложения: одно химическое вещество реагирует с образованием двух или более продуктов
— В исходном состоянии
— XY — & amp; gt; X + Y
— 2NH 3 (г) — & amp; gt; N 2 (г) + 3H 2 (г)
Уравновесить следующую реакцию разложения:
2 N 2 O 5 (г) — & amp; gt; NO 2 (г) + O 2 (г)
O: 5 4 2 =
O: 10 8 2 =
Сбалансированное уравнение: 2N 2 O 5 (г) — & amp; gt; 4NO 2 (г) + O 2 (г)
Ø Пример: Напишите реакцию разложения твердого нитрида натрия.
Нитрид натрия: Na + N3-
Na 3 N
— Na 3 N (s) — & amp; gt; Na (s) + N 2 (г)
-2Na 3 N (s) — & amp; gt; 3Na (т. ) + 1 / 2N 2 (г)
) + 1 / 2N 2 (г)
— 2Na 3 N (т.) — & amp; gt; 6Na (s) + N 2 (г)
3. Реакции горения: или горение, углеводороды реагируют с O 2
— Образует пламя
— Вырабатывает CO 2 и H 2 O
- H 2 O может быть жидкостью или газом, H 2 O (г) образуется при высокой температуре
Углеводороды + O 2 (г) — & amp; gt; CO 2 (г) + H 2 O (г или л) - ** Углеводороды: соединения, содержащие C и H
Пример: Напишите сбалансированное уравнение реакции, которая происходит, когда этанол,
C 2 H 5 OH, сжигает воздух? - C 2 H 5 OH (l) + O 2 (г) — & amp; gt; CO 2 (г) + H 2 O (г)
- C 2 H 5 OH (l) + O 2 (г) — & amp; gt; 2CO 2 (г) + 3H 2 O (г)
- C 2 H 5 OH (l) + 3O 2 (г) — & amp; gt; 2CO 2 (г) + 3H 2 O (г) Первый элемент, который появляется только один раз в самой сложной молекуле, — это C .
- Начать с C
Пример: Напишите сбалансированное уравнение реакции, которая происходит, когда изооктан,
C 8 H 18, сжигает воздух? C 8 H 18 (1) + O 2 (г) — & amp; gt; CO 2 (г) + H 2 O (г) - C 8 H 18 (l) + 25O 2 (г) — & amp; gt; 8CO 2 (г) + 9H 2 O (г)
- 16O + 9O = 25O Исключите дробь, умножив каждую сторону на 2
- 2C 8 H 18 (l) + 25O 2 (г) — & amp; gt; 16CO 2 (г) + 18H 2 O (г)
Группа 1: 1+
Группа 2: 2+
* Средний: переходные металлы
Группа 3: 3+
Группа 4: 3-
Группа 5: 2-
Группа 6: 2-
Группа 7: 1-
Молекулярная и формульная масса:
Молекулярная масса, MW: сумма атомных масс всех элементов в одной молекуле
-Также называется формульной массой (FW), или молекулярной массой, или формульной массой
-Единица: amu
Молекулярная масса H 2 SO 4:
2 (AW of H) + (AW of S) + 4 (AW of O) =
2 (1. 008) + 32,07 + 4 (16,00) = 98,09 а.е.м.
008) + 32,07 + 4 (16,00) = 98,09 а.е.м.
Число Авогадро и моль:
-Моль: (моль) — единица вещества, которая представляет известное количество частиц
, достаточно большое, чтобы их можно было взвесить на лабораторных весах.
-Один моль вещества содержит 6,002 x 10 23 молекул, атомов или ионов
- 6,002 x 10 23 называется числом Авогадро, NA
- Моль — это просто ряд вещей:
- 1 моль = 6.022 x 10 23 штуки
- Правильное название для частицы вещества основано на типе вещества
- Атом: типичная частица для элемента (например: Fe, S)
Ø Химическое соединение всегда содержит одинаковые пропорции элемента по массе
Ø Зная химическую формулу
% Состав элемента: [(Количество атомов) (AW элемента)] / (FW вещества
) x
Пример: Рассчитайте массовый процент каждого элемента в Al 2 O 3
% Состав элемента: [(Количество атомов) (AW элемента)] / (FW вещества
) x
FW = (2) (26 . 98) + (3) (16.00) = 101.96 а.е.м.
98) + (3) (16.00) = 101.96 а.е.м.
% Al = [((2) (26.98)) / 101.96amu] x 100 = 52.92% Al
% O = [((3) (16.00)) / 101.96 а.е.м.] x 100 = 47,08% O
Химические формулы:
Ø Химические формулы: Указывает состав каждого вещества буквами
и цифрами
Определение эмпирической формулы:
— Эмпирическая формула
Шаг 1: Рассчитайте количество молей каждого элемента
-Если масса дана в процентах, общая масса составляет 100 г
Шаг 2: Разделите на наименьшее моль
* -Убедитесь, что наименьшее целое числовое соотношение индексы
* -При необходимости умножить на целое число
Пример: A 3.78 г образца железа (Fe) реагирует с серой с образованием 5,95 г сульфида железа
. Определите эмпирическую формулу этого соединения
— Fe & amp; amp; S
— Fe: 3,78 г
— S: 5,95 г продукта — 3,78 = 2,71 г
— 3,78 г Fe (1 моль Fe / 55,85 г Fe) = 0,0677 моль / 0,0677 моль = 1Fe
— 2,71 г S (1 моль S / 32,07 г S) = 0,0677 моль / 0,0677 моль = 1S
— Эмпирическая формула: FeS
Определение молекулярной формулы:
- Молекулярная формула соединения кратна его эмпирической формуле
- Молекулярный вес = n x вес по эмпирической формуле
o N = молекулярный вес / вес по эмпирической формуле - Умножение индексов молекулярной формулы веса
- Молекулярный вес = n x вес по эмпирической формуле
Пример: Определите эмпирическое значение для соединения, содержащего 38. 77% кальция,
77% кальция,
19,97% фосфора и 41,27% кислорода. Если молекулярная масса
примерно 620,35 а.е.м., какова молекулярная формула?
— 38,77 г Ca (1 мольCa / 40,08 г Ca) = 0,9673 моль Ca / 0,6448 моль = 1,500Ca
x2 = 3Ca
— 19,97 г P (1 мольP / 30,97 г P) = 0,6448 моль P / 0,6448 моль = 1P x2 = 2P
— 41,27 г O (1 мольO / 16,00 г O) = 2,579 моль O / 0,6448 моль = 4.000 O x2 = 😯
— Эмпирическая формула: Ca 3 P 2 O 8
Пример: Если молекулярная масса составляет приблизительно 620.35 а.е.м., какова молекулярная формула
?
Эмпирическая формула: Ca 3 P 2 O 8
Молекулярный вес = nx вес по эмпирической формуле
Вес по эмпирической формуле = 3 (40,08) + 2 (30,97) + 8 (16,00) = 310,18 а.е.м.
520,35 а.е.м. = (n) (310,18 а.е.м. ) n = 2
Умножить индексы на 2 (Ca 3 P 2 O 8)
Молекулярная формула: Ca 6 P 4 O 16
Стехиометрия
Стехиометрия: количественные отношения между реагентами и продуктами сбалансированного уравнения
Пример: чтобы рассчитать количество реагентов и продуктов в химическом веществе rxn, используя числовое соотношение между ними
:
— Шаг 1: Напишите сбалансированное уравнение
Пример: Определите, сколько граммов Co 2 образуется при окислении 45. 3 г
3 г
глюкозы, C 6 H 12 O 6
C 6 H 12 O 6 (т.) + 6O 2 (г) — & amp; gt; 6CO 2 + 6H 2 O (л)
45,3 г? г
45,3 г C 6 H 12 O 6 (1 моль C 6 H 12 O 6 / 180,16 г C 6 H 12 O 6) x (6 моль CO 2/1 моль C 6 H 12 O 6) x
(44,01 г CO 2/1 моль CO 2) = 66,4 г CO 2
мм C 6 H 12 O 6: (6) (12,01) + (12) (1,008) + 6 (16,00) = 180,16 г / моль
мм CO 2: (1) ( 12.01) + (2) (16.00) = 44.01 г / моль
Пример: Сколько граммов HCl реагирует с 5,00 г MnO 2 в соответствии с реакцией
ниже:
4HCl (водн.) + MnO 2 (s) — & amp; gt; 2H 2 O (1) + MnCl 2 (водн.) + Cl 2 (г)
? г 5,00 г
5,00 г MnO 2 (1 моль MnO 2 / 86,94 г MnO 2) x (4 моль HCl / 1 моль MnO 2) x
(36,46 г HCl / 1 моль HCl) = 8,39 г HCl
ммоль MnO 2 = (1) (54.94) + (2) (16,00) = 86,94 г / моль
мм HCl = (1) (1,008) + (1) (35,45) = 36,46 г / моль
(b) Сколько граммов Fe 2 O 3 и CO присутствует после завершения реакции?
Fe 2 O 3 (тв) + 3СО (г) — & amp; gt; 2 Fe (ов) + 3CO 2 Осталось
г?
Избыток = начальный — израсходовано
Израсходовано Fe 2 O 3:
10,0 г CO (1 моль CO / 28,01 г CO) (1 моль Fe 2 O 3/3 моль CO) (159. 7 г Fe 2 O 3/1 моль Fe 2 O 3) =
7 г Fe 2 O 3/1 моль Fe 2 O 3) =
; 19,0 г Fe 2 O 3 — & amp; gt; израсходовано
Избыток Fe 2 O 3: 30,0 г — 19,0 г = 11,0 г Fe 2 O 3
Теоретический выход и выход в процентах:
— Теоретический выход: количество продукта, рассчитанное в соответствии с химическим уравнением
.
— Фактический выход: количество продукта, фактически полученное в эксперименте
— Процентный выход:% выхода = (фактический выход / теоретический выход) x
Пример: Если 6.1 грамм метилового спирта получается из 1,2 грамма водорода
, реагирующего с избыточным количеством CO 2. Рассчитайте теоретический и процентный выход.
CO (г) + 2H 2 (г) — & amp; gt; CH 3 OH (л)
1,2 г 6,1 г
1,2 г H 2 (1 моль H 2 / 2,02 г H 2) (1 моль CH 3 OH / 2 моль H 2) (32,04 г CH 3 OH / 1 моль
CH 3 OH) = 9,5 г CH 3 OH (теоретический выход)
% выход = (6,1 г CH 3 OH / 9.5 г CH 3 OH) x 100 = 64%
Пример: Бензол (C 6 H 6) реагирует с бромом с образованием бромбензола (C 6 H 6 Br)
и бромистоводородной кислоты. Если 30 г бензола реагирует с 65 г брома и дает
Если 30 г бензола реагирует с 65 г брома и дает
56,7 г бромбензола, каков процент выхода реакции?
C 6 H 6 + Br 2 (г) — & amp; gt; C 6 H 5 Br + HBr
30,0 г 65 г 56.7 г
30,0 г C 6 H 6 (1 моль C 6 H 6 / 78,11 г C 6 H 6) (1 моль C 6 H 5 Br / 1 моль C 6 H 6) (157 г C 6 H 5 Br / 1 моль
C 6 H 5 Br) = 60,3 г C 6 H 5 Br
65,0 г Br 2 (1 моль Br 2 / 159,8 г Br 2) (1 моль C 6 H 5 Br / 1 моль Br 2) (157 г
C 6 H 7 Br / 1 моль C 6 H 5 Br) = 63,9 г C 6 H 5 Br
C 6 H 6 + Br 2 (г) — & amp; gt; C 6 H 5 Br + HBr (56,7 г C 6 H 6 Br 2 / 60,3 C 6 H 6 Br 2) x 100 = 94.0% (процентная доходность)
Пройдите сами, используя эти 20 практических тестов по химии
Этот сборник вопросов теста по химии сгруппирован по предметам. В конце каждого экзамена есть ответы. Они представляют собой полезный инструмент обучения для студентов. Для инструкторов они являются хорошим ресурсом для выполнения домашних заданий, викторин или контрольных вопросов, а также для практики к тесту AP Chemistry.
Измерение — важное понятие во всей науке. Ваша общая точность измерения настолько хороша, насколько это наименее точное измерение.Эти контрольные вопросы касаются значимых цифр и научных обозначений.
Преобразование одной единицы измерения в другую — это базовый научный навык. Этот тест охватывает преобразование единиц между метрическими и английскими единицами. Не забывайте использовать отмену единиц измерения, чтобы легко вычислить единицы в любой научной задаче.
Температурные преобразования — это обычные вычисления в химии. Это набор вопросов, касающихся преобразования единиц измерения температуры.Это важная практика, потому что температурные преобразования являются обычными расчетами в химии.
Важным лабораторным методом в химической лаборатории является возможность точного измерения жидкости в мерном цилиндре. Это сборник вопросов, связанных с чтением мениска жидкости. Помните, что мениск — это кривая, видимая в верхней части жидкости в ответ на ее емкость.
Когда вас просят рассчитать плотность, убедитесь, что ваш окончательный ответ дан в единицах массы — граммах, унциях, фунтах или килограммах — на объем, например кубических сантиметрах, литрах, галлонах или миллилитрах.Другая потенциально сложная часть заключается в том, что вас могут попросить дать ответ в единицах, отличных от тех, которые вам даны. Просмотрите приведенные выше тестовые вопросы по преобразованию единиц измерения, если вам нужно освежить знания о преобразовании единиц.
Именование ионных соединений — важный навык в химии. Это набор вопросов, касающихся наименования ионных соединений и предсказания химической формулы по названию соединения. Помните, что ионное соединение — это соединение, образованное ионами, связывающимися вместе за счет электростатических сил.
Моль — это стандартная единица СИ, используемая в основном в химии. Это набор тестовых вопросов, касающихся крота. В их заполнении будет полезна таблица Менделеева.
Молярная масса вещества — это масса одного моля вещества. Эти контрольные вопросы касаются расчета и использования молярных масс. Примером молярной массы может быть: GMM O 2 = 32,0 г или KMM O 2 = 0,032 кг.
Определение массового процента элементов в соединении полезно для поиска эмпирической формулы и молекулярных формул соединения.Эти вопросы касаются расчета массового процента и нахождения эмпирических и молекулярных формул. Отвечая на вопросы, помните, что молекулярная масса молекулы — это общая масса всех атомов, составляющих молекулу.
Молекулярная формула соединения представляет собой представление количества и типа элементов, присутствующих в одной молекулярной единице соединения. Этот практический тест посвящен поиску молекулярной формулы химических соединений. Обратите внимание, что молекулярная масса или молекулярная масса — это общая масса соединения.
Стехиометрические соотношения реагентов и продуктов реакции можно использовать для определения теоретического выхода реакции. Эти соотношения также можно использовать для определения того, какой реагент будет первым реагентом, который будет израсходован в реакции. Этот реагент известен как ограничивающий реагент. Этот сборник из 10 контрольных вопросов посвящен расчету теоретических выходов и определению ограничивающего реагента химических реакций.
Вы, вероятно, не продвинетесь далеко в химии, пока вам не понадобится сбалансировать химическое уравнение.Эта викторина из 10 вопросов проверяет вашу способность находить баланс между основными химическими уравнениями. Всегда начинайте с определения каждого элемента уравнения.
Умение уравновесить химические уравнения достаточно важно, чтобы провести второй тест. В конце концов, химическое уравнение — это тип соотношения, с которым вы будете сталкиваться каждый день в химии.
Концентрация — это количество вещества в заранее определенном объеме пространства. Основным измерением концентрации в химии является молярность.Эти вопросы касаются молярности измерения.
Важно понимать расположение электронов, составляющих атом. Электронная структура определяет размер, форму и валентность атомов. Его также можно использовать для предсказания того, как электроны будут взаимодействовать с другими атомами с образованием связей. Этот тест охватывает концепции электронной структуры, электронных орбиталей и квантовых чисел.
Закон идеального газа можно использовать для прогнозирования поведения реальных газов в ситуациях, отличных от низких температур или высоких давлений.Этот сборник вопросов касается концепций, связанных с законами идеального газа. Закон идеального газа — это взаимосвязь, описываемая уравнением:
PV = nRT
где P — давление, V — объем, n — количество молей идеального газа, R — постоянная идеального газа, а T — температура.
Химическое равновесие для обратимой химической реакции возникает, когда скорость прямой реакции равна скорости обратной реакции. Отношение прямого курса к обратному называется константой равновесия.Проверьте свои знания о константах равновесия и их использовании с помощью этого практического теста, состоящего из 10 вопросов.
Измерения в химии — Химия
Глава 1 — Измерения в химииЭто содержимое также можно загрузить в виде PDF-файла для печати или интерактивного PDF-файла. Для интерактивного PDF-файла требуется Adobe Reader для полной функциональности.
Этот текст опубликован под лицензией Creative Commons, для ссылки и адаптации нажмите здесь.
Разделы: Раздел 1: Химия и вещества Что такое химия? Физико-химические свойства Элементы и соединения Смеси Состояния вещества Раздел 2: Как ученые изучают химию Научный метод Раздел 3: Научная нотация Видеоуроки Практические задачи Раздел 4: Единицы измерения Международная система единиц и метрическая системаПроизводные единицы СИ Раздел 5: Проведение измерений в лаборатории Precision vs.Точность
Значимые цифры
Точные номера
Правила округления
Видеоурок
Расчеты со значащими цифрами
Конверсии и значение единиц
Коэффициенты преобразования Краткое содержание главы Список литературы
Раздел 1: Химия и вещества Что такое химия?
Все вокруг нас состоит из химикатов.От цвета, который делает розу такой красной, до бензина, которым наполняют наши автомобили, и кремниевых чипов, питающих наши компьютеры и сотовые телефоны… Химия повсюду! Понимание того, как химические молекулы образуются и взаимодействуют для создания сложных структур, позволяет нам использовать силу химии и использовать ее, как набор инструментов, для создания многих современных достижений, которые мы наблюдаем сегодня. Это включает в себя достижения в медицине, связи, транспорте, строительной инфраструктуре, науке о продуктах питания и сельском хозяйстве, а также почти во всех других технических областях, которые вы можете себе представить.
Химия — одна из отраслей науки. Наука — это процесс, с помощью которого мы узнаем о естественной Вселенной, наблюдая, проверяя, а затем создавая модели, объясняющие наши наблюдения. это процесс, с помощью которого мы узнаем о естественной Вселенной, наблюдая, проверяя, а затем создавая модели, которые объясняют наши наблюдения. Поскольку физическая вселенная настолько обширна, существует множество различных областей науки (рис. 1.1). Таким образом, химия изучает материю, биология изучает живые существа, а геология изучает горные породы и землю.Математика — это язык науки, и мы будем использовать его для передачи некоторых идей химии.
Хотя мы разделяем науку на разные области, между ними есть много общего. Например, некоторые биологи и химики так много работают в обеих областях, что их работа называется биохимией. Точно так же геология и химия пересекаются в области, называемой геохимией. На рисунке 1.1 показано, сколько отдельных областей науки связаны между собой.
Рисунок 1.1: Отношения между некоторыми из основных отраслей науки. Химия находится более или менее посередине, что подчеркивает ее важность для многих областей науки.
Физические и химические свойстваЧасть понимания материи заключается в том, чтобы ее описать. Один из способов, которым химики описывают материю, — это относить разные свойства к разным категориям. Свойства, которые химики используют для описания материи, делятся на две основные категории.Физические свойства — это характеристики, которые описывают вещество, такие как температура кипения, точка плавления и цвет. Физические изменения, такие как плавление твердого вещества в жидкость, не изменяют химическую структуру этого вещества. Химические свойства — это характеристики, которые описывают, как химическая структура вещества изменяется во время химической реакции. Примером химического свойства является воспламеняемость — способность материалов гореть — потому что горение (также известное как горение) изменяет химический состав материала.
Элементы и соединенияЛюбой образец вещества, который имеет одинаковые физические и химические свойства во всем образце, называется веществом. Есть два типа веществ. Вещество, которое не может быть разбито на химически более простые компоненты, является элементом. Алюминий, который используется в банках с газировкой, является элементом. Вещество, которое можно разбить на химически более простые компоненты (поскольку оно состоит из более чем одного элемента), представляет собой соединение. Вода — это соединение, состоящее из водорода и кислорода.Сегодня в известной вселенной около 118 элементов, которые организованы на фундаментальной диаграмме, называемой Периодической таблицей элементов (рис. 1.2). Напротив, на сегодняшний день ученые идентифицировали десятки миллионов различных соединений.
Наименьшая часть элемента, которая поддерживает идентичность этого элемента, называется атомом. Атомы очень крошечные; чтобы сделать линию длиной в 1 дюйм, вам понадобится 217 миллионов атомов железа! Точно так же самая маленькая часть соединения, которая поддерживает идентичность этого соединения, называется молекулой.Молекулы состоят из атомов, которые соединены вместе и ведут себя как единое целое (рис. 1.2). Ученые обычно работают с миллионами атомов и молекул одновременно. Когда ученый работает
Рисунок 1.2: ( Верхняя панель) Периодическая таблица элементов — это организованная диаграмма, которая содержит все известные химические элементы. ( Нижняя панель ) Слева от стрелки показан один атом кислорода и два атома водорода. Каждый из них представляет собой отдельные элементы.Когда они объединяются с правой стороны, они образуют единую молекулу воды (H 2 O). Обратите внимание, что вода определяется как соединение, потому что каждая отдельная молекула состоит из более чем одного типа элементов, в данном случае из одного атома кислорода и двух атомов водорода.
с большим количеством атомов или молекул одновременно, ученый изучает макроскопическое представление Вселенной. Однако ученые могут также описывать химические явления на уровне отдельных атомов или молекул, что называется микроскопической точкой зрения.В этой книге мы увидим примеры как макроскопических, так и микроскопических точек зрения (рис. 1.3).
Рисунок 1.3: Сколько молекул необходимо для точки в предложении? Хотя мы не замечаем этого с макроскопической точки зрения, материя состоит из микроскопических частиц, настолько крошечных, что нужны миллиарды их, чтобы образовать пятнышко, которое мы можем увидеть невооруженным глазом. X25 и X400000000 указывают, сколько раз изображение было увеличено.
СмесиМатериал, состоящий из двух или более веществ, представляет собой смесь.В смеси отдельные вещества сохраняют свою химическую идентичность. Многие смеси представляют собой очевидные комбинации двух или более веществ, например, смесь песка и воды. Такие смеси называют гетерогенными смесями. В некоторых смесях компоненты настолько тесно связаны, что действуют как единое вещество, хотя это не так. Смеси с однородным составом называются гомогенными смесями. Гомогенные смеси, которые перемешаны настолько тщательно, что ни один компонент не может наблюдаться независимо от другого, называются растворами.Растворенный в воде сахар является примером решения. Металлический сплав, такой как сталь, является примером твердого раствора. Воздух, состоящий в основном из азота и кислорода, представляет собой газообразный раствор.
Рисунок 1.4: Гетерогенные и однородные смеси. Смесь содержит более одного вещества. На верхней панели вы видите пример неоднородной смеси масла и воды. Смесь неоднородна, потому что вы можете визуально увидеть два разных компонента в смеси.На нижней панели вы видите пример однородной смеси, кофе. Он однороден, потому что вы не можете различить множество различных компонентов, из которых состоит чашка кофе (вода; кофеин; кофейные алкалоиды и дубильные вещества). Все выглядит одинаково. Если смесь однородная, а также прозрачная или прозрачная, ее называют раствором. В нашем примере кофе — это раствор; однако концентрированный эспрессо может быть очень непрозрачным и представлять собой только гомогенную смесь, а не раствор.
Состояния веществаДругой способ классификации материи — описать ее как твердое тело, жидкость или газ, как это было сделано в примерах растворов выше. Эти три описания, каждое из которых подразумевает, что материя обладает определенными физическими свойствами, представляют три фазы материи. Твердое тело имеет определенную форму и определенный объем. Жидкости имеют определенный объем, но не определенную форму; они принимают форму своих контейнеров. У газов нет ни формы, ни объема, они расширяются, заполняя свои сосуды.Каждый день мы сталкиваемся с материей в каждой фазе. Фактически, мы регулярно встречаем воду во всех трех фазах: лед (твердая), вода (жидкость) и пар (газ).
Из нашего опыта работы с водой мы знаем, что вещества могут переходить из одной фазы в другую при подходящих условиях. Обычно изменение температуры вещества (и реже оказываемого на него давления) может вызвать фазовый переход или физический процесс, в котором вещество переходит из одной фазы в другую (рис. 1.5). Фазовые изменения имеют определенные названия в зависимости от того, какие фазы задействованы, как показано в Таблице 1.1.
Рисунок 1.5. Анализ фазовых изменений. ( Верхняя панель ) Фотография кипящей воды демонстрирует фазовый переход воды из жидкой фазы в газообразную. Обратите внимание, что фазовые изменения — это физическое свойство молекулы. Вода остается химически такой же (H 2 O) в твердом, жидком или газообразном состоянии. ( Нижняя панель ) Изменение температуры может вызвать фазовые изменения. Выше — температурная шкала фазовых переходов воды.Если вы добавите тепло к твердому льду, вода будет таять при 0 o C и закипать при 100 o C. 0 o C.
Таким образом, рисунок 1.6 «Классификация материи» иллюстрирует взаимосвязь между различными способами классификации материи.
Рисунок 1.6 Классификация материи. Вещество можно классифицировать по-разному в зависимости от его свойств
(Вернуться к началу)
Раздел 2: Как ученые изучают химию
Научный методКак работают ученые? Как правило, они следуют процессу, называемому научным методом.Научный метод — это организованная процедура изучения ответов на вопросы. Чтобы найти ответ на вопрос (например, «Почему птицы летают к экватору Земли в холодные месяцы?»), Ученый выполняет следующие шаги, которые также показаны на рисунке 1.7.
Рисунок 1.7 Общие этапы научного метода. В реальной жизни шаги могут быть не такими четкими, как описано здесь, но большинство научных работ следует этому общему плану.
Предложите гипотезу. Ученый генерирует проверяемую идею или гипотезу, чтобы попытаться ответить на вопрос или объяснить, как устроена естественная вселенная. Некоторые люди используют слово теория вместо гипотезы, но слово гипотеза — правильное слово в науке. В научных приложениях слово теория — это общее утверждение, описывающее большой набор наблюдений и данных. Теория представляет собой высший уровень научного понимания и построена на широком спектре фактических знаний или данных.
Проверить гипотезу. Ученый оценивает гипотезу, разрабатывая и проводя эксперименты для ее проверки. Если гипотеза проходит проверку, это может быть правильным ответом на вопрос. Если гипотеза не проходит проверку, это может быть плохой ответ.
При необходимости уточните гипотезу. В зависимости от результатов экспериментов, ученый может захотеть изменить гипотезу, а затем снова проверить ее. Иногда результаты показывают, что исходная гипотеза полностью ошибочна, и в этом случае ученому придется разработать новую гипотезу.
Не все научные исследования достаточно просты, чтобы их можно было разделить на эти три отдельных этапа. Но эти шаги представляют собой общий метод, с помощью которого ученые узнают о нашей естественной вселенной.
(Вернуться к началу)
Раздел 3: Научная нотация
Изучение химии может включать очень большие числа. Он также может включать в себя очень маленькие числа. Записать такие числа и использовать их в длинной форме проблематично, потому что мы потратим слишком много времени на написание нулей и, вероятно, сделаем много ошибок! Решение этой проблемы есть.Это называется научным обозначением.
Научная нотация позволяет нам выражать очень большие и очень маленькие числа, используя степень 10.
Напомним, что:
10
0 = 1 10 1 = 10 10 2 = 10010
3 = 1000 10 4 = 10000 10 5 = 100000 Как видите, степень возведения 10 равна количеству нулей, следующих за 1. Это поможет определить, какой показатель использовать, когда мы выражаем числа в экспоненциальной нотации.
Возьмем очень большое число:
579, 000, 000, 000
и выразите его в экспоненциальной нотации.
Сначала мы находим коэффициент, который представляет собой число от 1 до 10, которое будет умножено на 10 в некоторой степени.
Наш коэффициент: 5,79
Это число будет умножено на 10 в некоторой степени. Теперь давайте разберемся, что это за сила.
Мы можем сделать это, посчитав количество позиций, которые стоят между концом исходного числа и новой позицией десятичной точки в нашем коэффициенте.
5. 7 9 0 0 0 0 0 0 0 0 0
↑ ↑
Сколько там позиций?
Мы видим, что между десятичной запятой и концом исходного числа есть 11 позиций. Это означает, что наш коэффициент 5,79 будет умножен на 10 в 11-й степени.
Наше число, выраженное в экспоненциальной шкале:
5,79 x 10
11 А как насчет очень маленьких чисел?
Вы можете вспомнить, что:
10
-1 = 0.1 10 -2 = 0,01 10 -3 = 0,00110
-4 = 0,0001 10 -5 = 0,00001Количество пробелов справа от десятичной точки для нашей 1 равно числу в экспоненте, стоящему за отрицательным знаком. Это полезно иметь в виду, когда мы выражаем очень маленькие числа в научных обозначениях.
Вот очень маленький номер:
0,0000642
Выразим это число в научных обозначениях.
Наш коэффициент будет 6.42
Это число будет умножено на 10 в некоторой степени, которая будет отрицательной. Давайте выясним правильную мощность. Мы можем выяснить это, посчитав, сколько позиций находится между десятичной точкой в нашем коэффициенте и десятичной точкой в нашем исходном числе.
0. 0 0 0 0 6 4 2
↑ ↑
Сколько позиций?
Между нашей новой десятичной точкой и десятичной точкой в исходном числе 5 позиций, поэтому наш коэффициент будет умножен на 10 в отрицательной пятой степени.
Наше число, записанное в экспоненциальном формате:
6,42 x 10
-5Вы можете использовать эти методы для выражения любого большого или малого числа в экспоненциальной нотации.
ВИДЕОУЧЕБНИК ДЛЯ ЗНАЧИТЕЛЬНЫХ ЦИФРОВ:(Вернуться к началу)
Раздел 4: Единицы измерения Международная система единиц и метрическая система
Международная система единиц, сокращенно SI от французской Système International D’unités, является основной системой единиц измерения, используемой в науке.С 1960-х годов Международная система единиц была принята на международном уровне как стандартная метрическая система. Базовые единицы СИ основаны на физических стандартах. Определения базовых единиц СИ изменялись и продолжают изменяться, а новые базовые единицы добавляются по мере развития науки. Каждая базовая единица СИ, кроме килограмма, описывается стабильными свойствами Вселенной.
Существует семь базовых единиц, которые перечислены в Таблице 1.2. В химии в основном используются пять основных единиц измерения: моль для количества, килограмм для массы, метр для длины, второй для времени и кельвин для температуры.Градус Цельсия ( o C) также обычно используется для измерения температуры. Числовое соотношение между градусами Кельвина и градусами Цельсия выглядит следующим образом:
К =
o С + 273Размер каждой базовой единицы определяется международным соглашением. Например, килограмм определяется как масса специального металлического цилиндра, хранящегося в хранилище во Франции (рис. 1.8). Другие базовые единицы имеют аналогичные определения. Размеры базовых блоков не всегда удобны для всех измерений.Например, метр — довольно большая единица измерения ширины чего-то столь узкого, как человеческий волос. Вместо того, чтобы сообщать диаметр волоса как 0,00012 м или даже 1,2 × 10 -4 м, SI также предоставляет серию префиксов, которые могут быть прикреплены к единицам измерения, создавая единицы, которые больше или меньше по степени 10, известные как метрическая система.
Рисунок 1.8 Килограмм. Эталон килограмма — платино-иридиевый цилиндр, хранящийся в особом хранилище во Франции.Источник: Wikimedea (https://commons.wikimedia.org/wiki/File:National_prototype_kilogram_K20_replica.jpg)
Общие префиксы и их мультипликативные коэффициенты перечислены в Таблице 1.3 «Префиксы, используемые с единицами SI». (Возможно, вы уже заметили, что базовая единица измерения килограмм представляет собой комбинацию префикса килограмм, означающего 1000 ×, и единицы массы, грамма.) Некоторые префиксы образуют кратную исходной единице: 1 килограмм равен 1000 граммов ( или 1 кг = 1 000 г), а 1 мегаметр равен 1 000 000 метров (или 1 Мм = 1 000 000 м).Другие префиксы составляют часть исходной единицы. Таким образом, 1 сантиметр равен 1/100 метра, 1 миллиметр равен 1/1000 метра, 1 микрограмм равен 1/1000000 грамма и так далее.
Масса
Основной единицей массы в Международной системе единиц является килограмм. Килограмм равен 1000 граммам. Грамм — это относительно небольшое количество массы, поэтому большие массы часто выражаются в килограммах. Когда измеряются очень крошечные количества вещества, мы часто используем миллиграммы, которые равны 0.001 грамм. Есть множество больших, меньших и средних единиц массы, которые также могут быть подходящими. В конце 18 века килограмм был массой литра воды. В 1889 году из платино-иридиевого сплава был изготовлен новый международный прототип килограмма. Килограмм равен массе этого международного прототипа, который хранится в Париже, Франция.
Масса и вес — это не одно и то же. Хотя мы часто используем термины масса и вес как синонимы, каждый из них имеет свое определение и использование.Масса объекта — это мера количества вещества в нем. Масса (количество вещества) объекта остается неизменной независимо от того, где он находится. Например, перемещение кирпича на Луну не приводит к исчезновению или удалению какой-либо находящейся в нем материи.
Вес объекта определяется силой, которую гравитация оказывает на объект. Вес равен массе объекта, умноженной на местное ускорение свободного падения. Таким образом, на Земле вес определяется силой притяжения между объектом и Землей.Поскольку сила тяжести неодинакова в каждой точке поверхности Земли, вес объекта не постоянен. Гравитационное притяжение объекта меняется в зависимости от его положения относительно Земли или другого объекта, создающего гравитацию. Например, человек, который весит 180 фунтов на Земле, весил бы всего 45 фунтов, если бы он находился в неподвижном положении на высоте 4000 миль над поверхностью Земли. Этот же человек весил бы на Луне всего 30 фунтов, потому что гравитация Луны составляет лишь одну шестую гравитации Земли.Однако масса этого человека будет одинаковой в каждой ситуации. Для научных экспериментов важно измерять массу вещества, а не вес, чтобы сохранить согласованность результатов независимо от того, где вы проводите эксперимент.
ДлинаЕдиница измерения длины в системе СИ — метр. В 1889 году измеритель представлял собой слиток из платино-иридиевого сплава, хранившийся в условиях, установленных Международным бюро стандартов.В 1960 году это определение стандартного измерителя было заменено определением, основанным на длине волны излучения криптона-86. В 1983 году это определение было заменено следующим: метр — это длина пути, пройденного светом в вакууме за интервал времени в секунду.
ТемператураВ научном контексте слова тепло и температура НЕ означают одно и то же. Температура представляет собой среднюю кинетическую энергию частиц, составляющих материал.Повышение температуры материала увеличивает его тепловую энергию. Тепловая энергия — это сумма кинетической и потенциальной энергии частиц, из которых состоит материал. Предметы не «содержат» тепло; скорее они содержат тепловую энергию. Тепло — это движение тепловой энергии от более теплого объекта к более холодному. Когда тепловая энергия переходит от одного объекта к другому, температура обоих объектов изменяется.
Термометр — это прибор, измеряющий температуру. Название состоит из слова «термо», что означает тепло, и «метр», что означает измерение.Температура вещества прямо пропорциональна средней кинетической энергии, которую оно содержит. Чтобы средняя кинетическая энергия и температура вещества были прямо пропорциональны, необходимо, чтобы при нулевой температуре средняя кинетическая энергия также была равна нулю. Это было необходимо для использования в расчетах в науке для третьей шкалы температур, в которой ноль градусов соответствует нулевой кинетической энергии, то есть точке, в которой молекулы перестают двигаться. Эта температурная шкала была разработана лордом Кельвином.Лорд Кельвин заявил, что не существует верхнего предела того, насколько горячо может быть, но есть предел того, насколько холодным может стать. В 1848 году Уильям лорд Кельвин разработал идею абсолютного нуля, то есть температуры, при которой молекулы перестают двигаться и, следовательно, имеют нулевую кинетическую энергию. Это известно как температурная шкала Кельвина.
Шкала Цельсия основана на температуре замерзания и кипения воды. Таким образом, 0 o C — это точка замерзания воды, тогда как 100 o C — температура кипения воды.Большинство из нас знакомы с температурами ниже точки замерзания воды. Должно быть очевидно, что даже несмотря на то, что температура воздуха может составлять -5 o C, молекулы воздуха все еще движутся (т.е. 0 o C не является абсолютным нулем). Такие вещества, как газообразный кислород и газообразный азот, уже расплавились и превратились в пар при температурах ниже -150 o C.
Шкала Фаренгейта также определяется точкой замерзания и температурой кипения воды. Однако шкала отличается от шкалы Кельвина и Цельсия.По шкале Фаренгейта точка замерзания воды составляет 32 o F, а точка кипения воды составляет 212 o F. Для преобразования шкалы Фаренгейта в шкалу Цельсия можно использовать следующие преобразования:
[
o C] = ([ o F] -32) × 5/9 или [ o F] = [ o C] × 9/5 + 32Температурная шкала Кельвина имеет нулевое значение при абсолютном нуле (определено как -273,15 o C) и использует ту же шкалу градусов, что и шкала Цельсия.Следовательно, математическая связь между шкалой Цельсия и шкалой Кельвина составляет
.К =
o С + 273,15В случае шкалы Кельвина знак градуса не используется. Температуры выражаются просто как 450 К и всегда положительны.
ВремяЕдиницей измерения времени в системе СИ является секунда. Второй изначально определялся как крошечная часть времени, необходимого Земле для обращения вокруг Солнца. С тех пор его определение несколько раз менялось.Определение секунды (установлено в 1967 г. и подтверждено в 1997 г.): продолжительность 9 192 631 770 периодов излучения, соответствующих переходу между двумя сверхтонкими уровнями основного состояния атома цезия-133.
СуммаХимики используют термин «моль» для обозначения большого количества атомов или молекул. Подобно тому, как дюжина подразумевает 12 вещей, моль (моль) представляет 6,022 × 10 23 вещей. Число 6,022 × 10 23 , названное числом Авогадро в честь химика XIX века Амедео Авогадро, — это число, которое мы используем в химии для обозначения макроскопических количеств атомов и молекул.Таким образом, если у нас есть 6,022 × 10 23 атомов кислорода, мы говорим, что у нас есть 1 моль атомов кислорода. Если у нас есть 2 моля атомов Na, у нас будет 2 × (6,022 × 10 23 ) атомов Na, или 1,2044 × 10 24 атомов Na. Аналогично, если у нас есть 0,5 моль молекул бензола (C 6 H 6 ), мы имеем 0,5 × (6,022 × 10 23 ) C 6 H 6 молекул, или 3,011 × 10 23 C 6 H 6 молекул.
Производные единицы СИПроизводные единицы представляют собой комбинации базовых единиц СИ.Единицы можно умножать и делить, так же как числа можно умножать и делить. Например, площадь квадрата со стороной 2 см составляет 2 см × 2 см или 4 см2 (читается как «четыре сантиметра в квадрате» или «четыре квадратных сантиметра»). Обратите внимание, что мы возведем в квадрат единицу длины, сантиметр, чтобы получить производную единицу площади, квадратный сантиметр.
ОбъемОбъем — важная величина, в которой используется производная единица. Объем — это количество пространства, которое занимает данное вещество, геометрически определяемое как длина × ширина × высота.Каждое расстояние может быть выражено с помощью единицы измерения, поэтому объем имеет производную единицу m × m × m, или m 3 (читается как «кубические метры» или «кубические метры»). Кубический метр — это довольно большой объем, поэтому ученые обычно выражают объемы в единицах 1/1000 кубического метра. У этой единицы есть собственное название — литр (L). Литр немного больше 1 кварты США по объему. (Таблица 1.4) дает приблизительные эквиваленты для некоторых единиц, используемых в химии.) Как показано на Рисунке 1.9 «Литр», литр также равен 1 000 см 3 .По определению, в 1 л содержится 1000 мл, поэтому 1 миллилитр и 1 кубический сантиметр представляют собой один и тот же объем.
1 мл = 1 см 3Рисунок 1.9: Литр. Литр — это куб со стороной 10 см (1/10 метра). Миллилитр, 1/1000 литра, равен 1 кубическому сантиметру (1 см 3 ).
ЭнергетикаЭнергия, еще одна важная величина в химии, — это способность выполнять работу.Например, перемещение коробки с книгами из одной стороны комнаты в другую требует энергии. Производная единица: кг · м 2 / с 2 . (Точка между килограммами и м 2 единиц означает, что единицы умножаются вместе, а затем весь член делится на s 2 .) Поскольку эта комбинация громоздка, эта совокупность единиц переопределяется как джоуль (Дж) , которая является единицей измерения энергии в системе СИ. Также широко используется более старая единица энергии — калория (cal). Всего:
4.184 Дж = 1 ккал
Обратите внимание, что это отличается от нашего обычного использования больших «калорий» или «кал», указанных на пищевых упаковках в США. Большой «Cal» на самом деле является килокалорией или ккал (рис. 1.10). Обратите внимание, что все химические процессы или реакции происходят с одновременным изменением энергии, и эта энергия может храниться в химических связях.
Рисунок 1.10: Разница между килокалориями в научном и обычном использовании . Калории, представленные на упаковке пищевых продуктов, на самом деле относятся к килокалориям с научной точки зрения.
ПлотностьПлотность определяется как масса объекта, деленная на его объем; он описывает количество вещества, содержащегося в данном объеме пространства.
плотность = масса / объемТаким образом, единицы плотности — это единицы массы, разделенные на единицы объема: г / см3 или г / мл (для твердых и жидких веществ соответственно), г / л (для газов), кг / м3 и т. Д. . Например, плотность воды составляет около 1,00 г / мл, а плотность ртути — 13.6 г / мл. Ртуть более чем в 13 раз плотнее воды, а это означает, что она содержит в 13 раз больше вещества в том же объеме пространства. Плотность воздуха при комнатной температуре около 1,3 г / л.
Раздел 5: Проведение измерений в лаборатории Точность в сравнении с точностьюВажно отметить различную терминологию, которую мы используем, когда говорим в науке. Один из таких наборов терминов — точность и аккуратность. Хотя в ненаучном сообществе термины «точность» и «аккуратность» часто используются как взаимозаменяемые, очень важно понимать разницу между этими терминами.Точность говорит вам, насколько близки два измерения друг к другу, а точность говорит вам, насколько близко измерение к известному значению. Измерение может быть точным, но не точным, или точным, но неточным; эти два термина НЕ связаны. Хорошую аналогию можно найти в игре в дартс (рис. 1.11). Игрок, который всегда попадает в одно и то же место слева от доски для дротика, будет точным, но не очень точным. Однако игрок в дартс, который находится по всей доске, но в среднем попадает в центр доски, будет точным, но не точным.Хороший игрок в дартс, как и хороший ученый, хочет быть точным и аккуратным.
Рисунок 1.11: Разница между точностью и точностью. С помощью игры в дартс можно показать разницу между точностью и точностью.
По материалам: https://upload.wikimedia.org/wikipedia/commons/thumb/5/5d/Reliability_and_validity.svg/717px-Reliability_and_validity.svg.png
Обычно в лаборатории точность — это мера того, насколько хорошо откалибровано ваше оборудование.Например, если ваши весы откалиброваны правильно, вы можете проводить очень точные, повторяющиеся измерения, но измерения не будут отражать истинное значение. С другой стороны, точность обычно определяется тем, насколько осторожен ученый при проведении измерений. Если вы проявите неосторожность и пролили часть образца по пути, ваши измерения в повторных экспериментах не будут точными, даже если ваши весы будут точными.
Значимые цифрыВажно понимать, что значения в научных измерениях никогда не бывают точными на 100%.Наши инструменты измеряют только с определенной степенью точности. Таким образом, мы можем выбрать разные инструменты для измерения в зависимости от уровня точности, который нам нужен для эксперимента. Из-за присущей неточности любого измеряемого числа мы должны отслеживать различные уровни точности каждого числа со значащими цифрами. Под значащими цифрами измеряемой величины понимаются все достоверно известные цифры и первая неопределенная или оценочная цифра. Нет смысла сообщать какие-либо цифры после первой неопределенной, поэтому это последняя цифра, указанная в измерении.Нули используются, когда необходимо поставить значащие цифры на их правильные позиции. Таким образом, нули могут быть значащими цифрами, а могут и не быть. Значимые цифры применимы в реальном мире, поскольку они позволяют количественно оценить точность любого типа измерения. Чтобы определить, сколько чисел в измерении имеет значение, вы можете следовать осторожному набору правил, показанных ниже и справа.
Рисунок 1.12: Измерение объекта по правильному количеству значащих цифр.
Сколько цифр должно быть показано в этом измерении?
Правильный ответ — 3! Два, которые вы знаете наверняка + предполагаемое положение… для этого значения оно будет близко к 1.37
Точные числаТочные числа — это числа, которые не измеряются научными приборами. Они либо используются в качестве определений для определения понятия или терминологии, либо создаются путем подсчета всего чего-то присутствующего. Примером точного числа может быть количество яиц в коробке или определенная единица измерения, например 100 см на 1 м. Точные числа, такие как количество людей в комнате, НЕ влияют на количество значащих цифр в расчетах, сделанных с измеренными значениями.
Правила округленияВ научных операциях правила округления могут немного отличаться от тех, к которым вы привыкли. Обычные правила округления предполагают, что если число 4 или меньше, оно должно быть округлено до меньшего числа, тогда как если оно равно 5 или больше, оно должно быть округлено в большую сторону. Однако обратите внимание, что 5 находится прямо посередине и вызывает проблемы при использовании этих обычных правил округления. Если у вас есть большой набор данных, который нужно округлить, использование этого правила округления приведет к смещению в вашем наборе данных (т.е. 4/9 времени вы будете округлять в меньшую сторону, и 5/9 времени вы будете округлять в большую сторону). В большом наборе данных такое смещение недопустимо.
В научном округлении мы обычно используем правило под названием «Округление до четного». В этой системе округления правила одинаковы для 4 и ниже, вы округляете до меньшего числа, а для 6 и выше вы округляете до большее число. Однако, если число, которое вы округляете, равно 5, вы округляете до четного числа. Это помогает уменьшить смещение выборки, которое может возникнуть при округлении больших наборов данных.
Расчеты со значащими цифрамиПрежде чем выполнять какие-либо научные вычисления, необходимо осознать, что все измеряемые числа хороши ровно настолько, насколько хорош инструмент, используемый для их измерения. Даже с использованием самого лучшего доступного инструмента измеренное число никогда не будет точным на 100%. Ученые используют правило «достаточно хорошей» точности, означающее, что мы допускаем некоторую погрешность, присущую каждому измерению, которое мы делаем, до тех пор, пока конечный результат достаточно близок к желаемому.Эта концепция становится опасной, когда мы начинаем использовать эти «достаточно хорошие» числа для любых расчетов, если мы не будем внимательно следить за нашими значащими цифрами, наши числа могут быстро потерять свой «достаточно хороший» статус. Чтобы защитить свои «достаточно хорошие» числа, научное сообщество установило определенные правила для выполнения любых расчетов; в этом разделе нам нужно уделить внимание только двум очень важным правилам: правилу сложения / вычитания и правилу умножения / деления.
Правило сложения / вычитания:- Найдите число с наименьшим количеством десятичных знаков и отслеживайте количество десятичных знаков
- Выполнить сложение / вычитание
- Округлите окончательный ответ до наименьшего числа десятичных знаков, найденных на этапе 1
- Подсчитайте количество значащих цифр в каждом числе (отслеживайте количество значащих цифр)
- Выполните умножение / деление
- Округлите окончательный ответ до наименьшего числа значащих цифр, найденных на этапе 1
- Используя порядок операций, разбейте проблему на несколько этапов
- Выполните любые шаги сложения / вычитания в соответствии с правилом сложения / вычитания (пока не округляйте, просто отслеживайте правильное количество десятичных знаков при нахождении количества значащих цифр)
- Выполните умножение / деление по правилу умножения / деления
- Округлите окончательный ответ до правильного числа значащих цифр
Умение конвертировать из одного юнита в другой — важный навык.Например, медсестра с таблетками аспирина 50 мг, которая должна дать пациенту 0,2 г аспирина, должна знать, что 0,2 г равняется 200 мг, поэтому необходимо 4 таблетки. К счастью, есть простой способ преобразовать одну единицу в другую.
Коэффициенты преобразованияЕсли вы выучили единицы СИ и префиксы, описанные в разделе 1.4 «Единицы измерения», то вы знаете, что 1 см составляет 1/100 метра или:
100 см = 1 мПредположим, мы делим обе части уравнения на 1 м (как число, так и единицу; обратите внимание, что критически важно всегда записывать ваши единицы! Это позволяет избежать путаницы и ошибок при преобразовании.):
Пока мы выполняем одну и ту же операцию с обеими сторонами знака равенства, выражение остается равенством. Посмотрите на правую часть уравнения; теперь у него такое же количество в числителе (вверху), что и в знаменателе (внизу). Любая дробь, имеющая одинаковое количество в числителе и знаменателе, имеет значение 1:
.Мы знаем, что 100 см — это 1 м, поэтому у нас одинаковое количество сверху и снизу нашей дроби, хотя оно выражается в разных единицах.Дробь, у которой в числителе и знаменателе есть эквивалентные величины, но выраженные в разных единицах, называется коэффициентом преобразования
.Обратите внимание, что коэффициенты преобразования могут быть записаны с использованием любого члена в числителе или знаменателе и использоваться в зависимости от проблемы, которую вы хотите решить. Это потому, что оба члена равны 1
.Вот простой пример. Сколько сантиметров в 3.55 м? Возможно, вы сможете определить ответ в уме. Если в каждом метре 100 см, то 3,55 м равняется 355 см. Чтобы решить проблему более формально с коэффициентом преобразования, мы сначала записываем заданное нам количество, 3,55 м. Затем мы умножаем это количество на коэффициент преобразования, который совпадает с умножением на 1. Мы можем записать 1 как 100 см / 1 м и умножить:
Поскольку m, сокращение от метров, встречается как в числителе, так и в знаменателе нашего выражения, они сокращаются.Последний шаг — выполнить расчет, который остается после отмены единиц. Обратите внимание, что КРИТИЧНО сохранить правильные единицы в окончательном ответе, иначе это не будет иметь смысла. Обобщенное описание этого процесса выглядит следующим образом:
количество (старые единицы) × коэффициент пересчета = количество (новые единицы) Вам может быть интересно, почему мы используем кажущуюся сложной процедуру прямого преобразования. В более поздних исследованиях проблемы преобразования, с которыми вы столкнетесь, не всегда будут такими простыми.Если вы овладеете техникой применения коэффициентов пересчета, вы сможете решить большое количество разнообразных задач.
В предыдущем примере мы использовали дробь 100 см / 1 м в качестве коэффициента преобразования. Равен ли коэффициент преобразования 1 м / 100 см также 1? Да; в числителе у него такое же количество, что и в знаменателе (за исключением того, что они переворачиваются). Почему мы не использовали этот коэффициент преобразования? Если бы мы использовали второй коэффициент преобразования, исходная единица не была бы отменена, и результат был бы бессмысленным.Вот что мы получили бы:
НЕПРАВИЛЬНОЕ ИСПОЛЬЗОВАНИЕ ФАКТОРА ПРЕОБРАЗОВАНИЯ !!
Вы можете видеть, что ни одна из единиц не отменена. Чтобы ответ был осмысленным, мы должны сконструировать коэффициент преобразования в форме, которая приведет к отмене исходной единицы. На рис. 1.13 «Концептуальная карта конверсий» показана концептуальная карта для построения правильного преобразования.
Рис. 1.13. Концептуальная карта конверсий. Вот как вы создаете коэффициент преобразования для преобразования одной единицы в другую.
(Вернуться к началу)
Краткое содержание главы Артикул:
Материалы Главы 1 были адаптированы и изменены из следующих ресурсов Creative Commons, если не указано иное:
1. Анонимно. (2012) Введение в химию: общие, органические и биологические (V1.0). Опубликовано по лицензии Creative Commons by-NC-sa 3.0. Доступно по адресу: http://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological/index.html
2. Поульсен Т. (2010) Введение в химию. Опубликовано по лицензии Creative Commons by-NC-sa 3.0. Доступно по адресу: http://openedgroup.org/books/Chemistry.pdf
3. OpenStax (2015) Атомы, изотопы, ионы и молекулы: строительные блоки. OpenStax CNX. Доступно по адресу: http://cnx.org/contents/be8818d0-2dba-4bf3-859a-737c25fb2c99@12.
Калькулятор оценки химии AP® на 2020-2021 годы
Внимание: Для наших калькуляторов мы используем только официально опубликованную информацию College Board, которая может не отражать всех последних изменений в различных тестах AP®.Если мы представим вам калькулятор, помеченный как (Прогноз), мы использовали тенденции из предыдущих версий экзамена и относительные проценты для каждого раздела экзамена для расчета диапазонов баллов. Пока Совет колледжа не предоставит дополнительную информацию, мы не сможем обновлять наши (Прогнозные) калькуляторы с полной точностью.
Хотите знать, наберете ли вы высокий балл на экзамене AP® Chemistry? Прогнозируйте свой химический состав AP® с помощью нашего калькулятора показателей химического состава AP®, приведенного ниже, и получите лучшее представление о том, где вы находитесь.
В настоящее время Совет колледжа официально не выпустил таблицу оценок, отражающую последние изменения в химии AP®. Чтобы построить нашу прогнозируемую кривую, мы взяли относительные проценты MCQ и FRQ, а также значения баллов по каждому вопросу, как указано в руководстве по выставлению оценок, опубликованном здесь на 2019-2020 годы.
Введите свои результаты
Результаты
Общий составной балл50/100
Общий составной балл50/100
Общий составной балл75/150
Общий составной балл80/160
Считаете ли вы это полезным? Щелкните здесь, чтобы опубликовать этот калькулятор в Твиттере. Ищете материалы для изучения химии AP®?Также ознакомьтесь с этим справочником, чтобы найти лучшие обзорные книги AP® Chemistry.
Какой балл по химии AP® хороший?Результаты 3, 4 или 5 считаются «проходными» на экзамене AP® Chemistry Exam. Совет колледжей описывает 3 как «квалифицированный», 4 как «хорошо квалифицированный» и 5 как «чрезвычайно высококвалифицированный». Оценка 3 или выше может дать вам право на получение кредита колледжа, но многие колледжи и университеты принимают только 4 или 5 баллов. 5 ком.Найдите здесь кредитную политику AP® для школ, в которые вы хотите поступить.
Обдумывая свой результат на экзамене AP® Chemistry, вы должны учитывать его в контексте экзамена. По AP® Chemistry в 2020 году 56,1% тестируемых получили проходной балл (3+). Вы можете ознакомиться с последним распределением оценок студентов за 2020 год здесь.
Какой средний балл по химии AP®? ПоказателиAP® Chemistry незначительно колеблются, изменившись всего на несколько процентных пунктов за последние годы.Основным исключением является период между экзаменом AP® Chemistry Exam 2013 и 2014 гг. AP® Chemistry был изменен на 2013–2014 учебный год, и на экзамене было значительно меньше оценок «1», «4», «5» и больше, «2» и «3». С 2014 года средний балл AP® Chemistry составлял около 2,80.
Почему показатели AP® Chemistry изогнуты?College Board включает экзамены AP® каждый год, чтобы учесть обычные различия в сложности вопросов и поддерживать определенную степень стандартизации.AP® Chemistry — это сложный курс на уровне колледжа. Кривая предназначена для учета сложности этого курса и для точной оценки навыков и знаний тестируемого.
Как мне получить 5 по AP® Chemistry?Учись с умом! Только около 10% студентов получают 5 баллов за экзамен по химии AP®, и вы тоже можете это сделать при правильном сочетании прикладного обучения, отличных учебных навыков и осознанной практики. Экзамены по естественным наукам, проводимые Советом колледжей, смещаются в сторону научных практик, в которых особое внимание уделяется навыкам и концептуальному пониманию, а не механическому запоминанию.Еще предстоит запомнить много фактов, но вам также потребуется знать взаимосвязь между фактами и уметь интерпретировать научные идеи различными способами.
Мы написали множество бесплатных обзорных статей и учебных пособий, чтобы помочь развить необходимые навыки для AP® Chemistry. Вот несколько примеров для начала:
Ищете практические вопросы? У Альберта сотен практических вопросов по химии AP®, согласованных с AP, и бесплатных ответов на них, которые вы можете изучить во время подготовки к экзамену AP®.Учитесь на ходу, в любое время в любом месте с Альбертом. В 2015–2016 учебном году школьники, которые использовали Albert для AP® Chem, превзошли национальные баллы успеваемости на 14,26%.
Почему мне следует использовать этот калькулятор результатов по химии AP®? Калькуляторы— отличный способ отслеживать ваши успехи во время подготовки к экзаменам AP®. Понимание того, сколько вопросов с несколькими вариантами ответов и бесплатных ответов вам понадобится, чтобы набрать 3, 4 или 5 баллов, может сыграть большую роль в том, чтобы не напрягаться в день экзамена.
