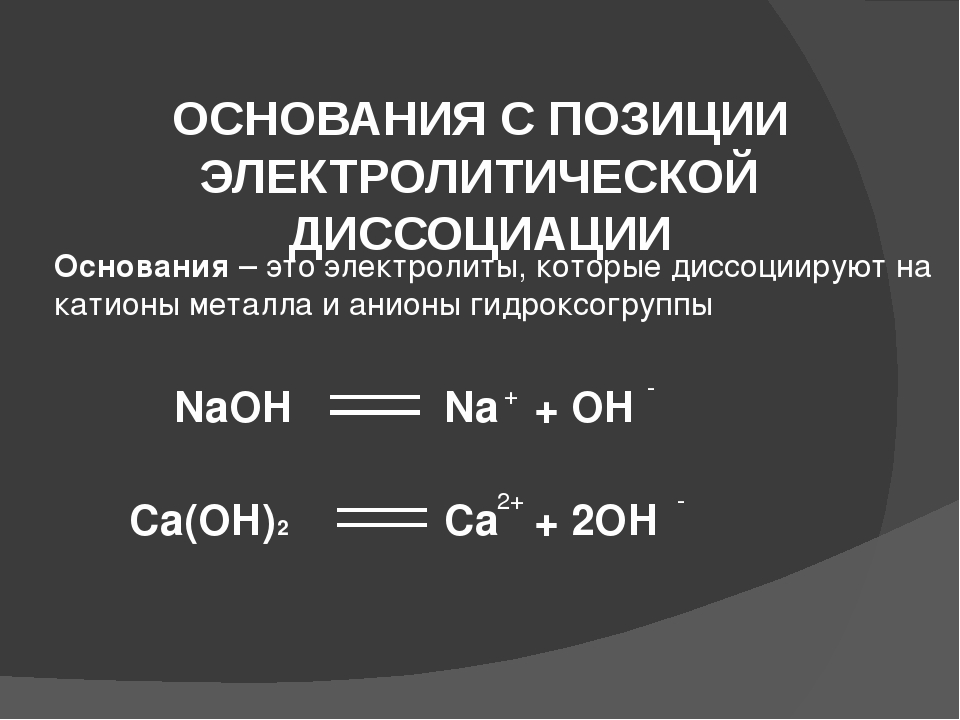
Контрольная работа № 1 по теме: «Электролитическая диссоциация»
Контрольная работа № 1
по теме: «Электролитическая диссоциация»
1 вариант.
Часть 1.
1. К электролитам относится:
а) сахар б) оксид меди (II) в) оксид углерода (IV) г) соляная кислота
2. Формула слабого электролита:
а) CuCl2 б) HCl в) H2SO4 г) H2S
3. Вещества, которые при диссоциации образуют в качестве катионов ионы водорода, являются
а) кислотами б) солями в) щелочами г) оксидами
4. Вещество, которое в растворе полностью распадается на ионы.
а) аммиак б) вода в) серная кислота г) гидроксид цинка
5. Все ионы являются анионами в ряду:
а) Cl ̄, SO4 2¯ , NO3 ̄ в) Н
б) Сl¯ , H+, K+ г) CO3 2¯ ,Ca 2+ , NO3 ̄
6. Наибольшее число катионов образуется при диссоциации 1 моль
Наибольшее число катионов образуется при диссоциации 1 моль
а) AlCl3 б) H2S в) Na3РO4 г) Mg(NO3)2
7. Одновременно находиться в водном растворе не могут ионы
а) Zn2+ и ОН— б) Zn2+ и Cl ̄, в) Na + и SO
8. Сумма коэффициентов в уравнении электролитической диссоциации сульфата железа (III) равна
а) 3 б) 4 в) 5 г) 6
Часть 2.
Установите соответствие между сокращенными ионными уравнениями реакций обмена и веществами, вступающими в реакцию:Часть 3.
10.Составить реакции ионного обмена, написать молекулярные, полные и сокращенные ионные уравнения:
а) KOH + H2 SO4 =
б) Na2 CO3 + HNO3 =
в) CuCI2 + NaOH =
11.
а) HCIO +Br2 + h3O = HBrO3 + HCI
б) PbO2 + Na3CrO3 + NaOH = Na2CrO4 + Na2PbO2 + h3O
12.Определить природу соли и указать, возможен ли гидролиз соли? Какая среда?
а) FeCI3
б) Na2S
в) K2SO4
г) CuCO3
13.Дать расшифровку понятиям:
Контрольная работа № 1
по теме: «Электролитическая диссоциация»
1 вариант.
Часть1.
1. К неэлектролитам относится:
а) сахар б) хлорид натрия в) гидроксид натрия г) серная кислота
2. Формула сильного электролита
а) H2SO3 б) CaCO3 в) HNO3 г) Cu(OH)2
3. Вещества, которые при диссоциации образуют в качестве анионов только гидроксид-ионы, являются
а) кислотами б) солями в) щелочами г) оксидами
4. Вещество, которое в растворе полностью распадается на ионы.
Вещество, которое в растворе полностью распадается на ионы.
а) вода в) соляная кислота
б) оксид углерода (IV) г) гидроксид алюминия
5. Все ионы являются катионами в ряду:
а) Cl ̄, SO4 2¯ , NO3 ̄ в) Н+, Na + , Ca 2+
б) Сl¯ , H+, K+ г) CO3 2¯ ,Ca 2+ , NO3 ̄
6. Наибольшее число анионов образуется при диссоциации 1 моль
а) AlCl3 б)Mg(NO3)2 в) Na2СO3 г) Na2S
7. Одновременно находиться в водном растворе не могут ионы
а) Ba2+ и SO4
8. Сумма коэффициентов в уравнении электролитической диссоциации нитрата алюминия равна
Сумма коэффициентов в уравнении электролитической диссоциации нитрата алюминия равна
а) 3 б) 4 в) 5 г) 6
Часть 2.
Установите соответствие между сокращенными ионными уравнениями реакций обмена и веществами, вступающими в реакцию:Часть 3.
10.Составить реакции ионного обмена, написать молекулярные, полные и сокращенные ионные уравнения:
а) NaOH + h4PO4 =
в) FeCI2 + NaOH =
11.Составить электронный баланс, указать окислитель и восстановитель и уравнять реакцию:
а) I2 + KOH = KIO3 + KI + h3O
б) CuCI + K2Cr2O7 + HCI = CuCI2 + CrCI3 + KCI + h3O
12.Определить природу соли и указать, возможен ли гидролиз соли? Какая среда?
а) CuCI2
б) K3PO4
в) Li2SO4
г) CuS
13.Дать расшифровку понятиям:
неэлектролит
кислоты
окислитель
ионы
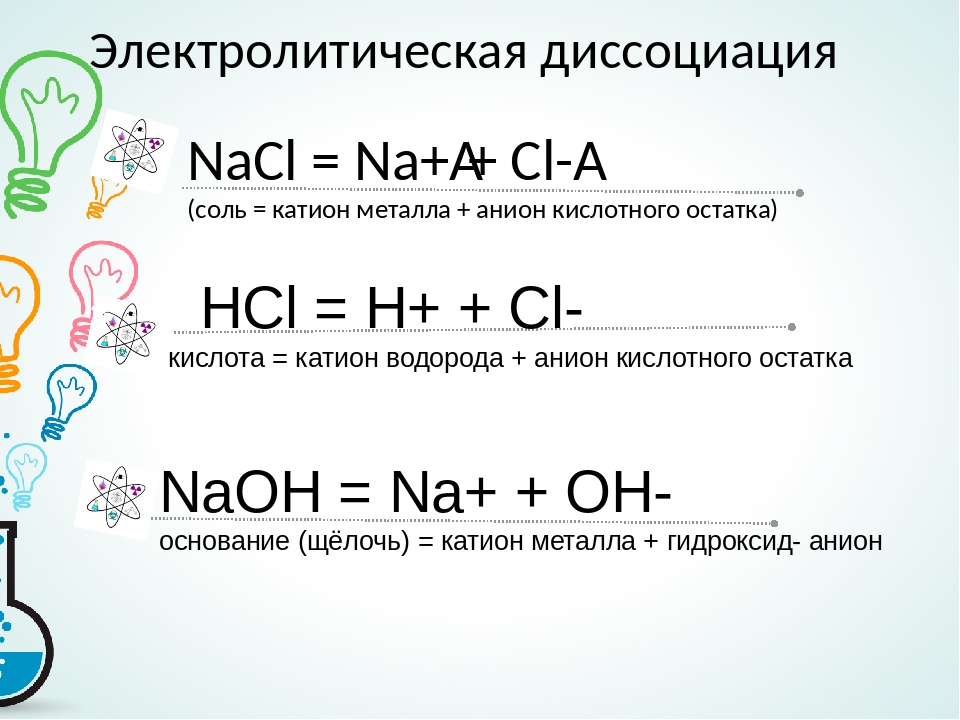
Контрольная работа по химии 9 класс Классификация химических реакций.
 Электролитическая диссоциация.
Электролитическая диссоциация.государственное бюджетное общеобразовательное учреждение Самарской области
средняя общеобразовательная школа села Кротково
муниципального района Похвистневский Самарской области
Контрольная работа №1 по химии для учащихся 9 класса
Тема. Классификация химических реакций. Электролитическая диссоциация.
Составитель:
учитель химии первой категории: Аникина Наталья Николаевна
Контрольная работа №1
Тема. Классификация
химических реакций. Электролитическая диссоциация.
Электролитическая диссоциация.
Цель: определить уровень знаний учащихся по теме: «Химические реакции и «Электролитическая диссоциация», выявить затруднения в усвоении учебного материала и определить пути их преодоления.
Базовые термины и понятия: химические реакции: окислительно- восстановительные, экзо- и эндотермические, термохимические, реакции ионного обмена, обратимые и необратимые; окислитель, восстановитель, химическое равновесие, катализаторы, ионы, катод и анод.
Методы обучения: методы контроля.
Тип урока: контроль знаний.
Вариант 1
1. Дайте определение окислительно – восстановительные реакции и степень окисления. (0,5 балла)
2. Будут ли подвергаться гидролизу соли АlCl3,BaSO4? Ответ обосновать. Какова реакция среды в растворах этих солей? (0,5 балла)
3. Составьте две реакции ионного обмена, соответствующие данному ионному
уравнению: Al
Составьте две реакции ионного обмена, соответствующие данному ионному
уравнению: Al
Привести молекулярные и полные ионные уравнения. (1 балл)
4.Подберите коэффициент методом электронного баланса. Укажите окислитель и восстановитель.
А. FeCl3 + Кl= FeCl2 +l2+КСl (1,5 балла)
Б. Mg + N2= Mg3N2
5. Определите возможные химические реакции для следующих пар веществ:
А. азотная кислота и хлорид бария;
Б. хлорид железа (ll) и гидроксид натрия;
В. Сульфат алюминия и хлорид кальция.
Составьте для них молекулярные, полные и сокращенные ионные уравнения реакций.
Контрольная работа №1
Классификация химических реакций. Электролитическая диссоциация.
Вариант 2
1. Дайте определение солей, оснований с точки зрения теории электролитической
диссоциации. (0,5 балла)
Дайте определение солей, оснований с точки зрения теории электролитической
диссоциации. (0,5 балла)
2. Будут ли подвергаться гидролизу основания Cr(ОН)2, Ba(ОН)2? Ответ обосновать. Какова реакция среды в растворах этих оснований? (0,5 балла)
3. Составьте две реакции ионного обмена, соответствующие данному ионному уравнению: Мg2+
Привести молекулярные и полные ионные уравнения. (1 балл)
4.Подберите коэффициент методом электронного баланса. Укажите окислитель и восстановитель.
А. НСl + CrO3=Сl2 +CrCl3 + Н2О (1,5 балла)
Б. Аg+Н2SO4 (кон) =Аg2 SO4+ SO2 +Н2О
5. Определите возможные химические реакции для следующих пар веществ:
А. серная кислота и хлорид бария;
серная кислота и хлорид бария;
Б. хлорид натрия и гидроксид калия;
В. Сульфат алюминия и хлорид калия.
Составьте для них молекулярные, полные и сокращенные ионные уравнения реакций.
Контрольная работа №1
Классификация химических реакций. Электролитическая диссоциация.
Вариант 3
1. Дайте определение обратимые и необратимые реакции. (0,5 балла)
2. Будут ли подвергаться гидролизу соли NaHCO3, АgСl? Ответ обосновать. Какова реакция среды в растворах этих оснований? (0,5 балла)
3. Составьте две реакции ионного обмена, соответствующие данному ионному уравнению: Са2+ + S2- = СаS
Привести молекулярные и полные ионные уравнения. (1 балл)
4.Подберите коэффициент методом электронного баланса. Укажите окислитель и восстановитель.
А. Mg
+ N2= Mg3N2 (1,5
балла)
Mg
+ N2= Mg3N2 (1,5
балла)
Б. Fe2О3+Н2= Fe + Н2О
5. Определите возможные химические реакции для следующих пар веществ:
А. серная кислота и хлорид натрия;
Б. хлорид серебра и гидроксид калия;
В. Карбонат натрия и соляная кислота.
Составьте для них молекулярные, полные и сокращенные ионные уравнения реакций.
Контрольная работа №1
Классификация химических реакций. Электролитическая диссоциация.
Вариант 4
1. Дайте определение экзотермические и эндотермические реакции. (0,5 балла)
2. Будут ли подвергаться гидролизу соли Na2CO3, АgI? Ответ обосновать. Какова реакция среды в растворах этих оснований? (0,5 балла)
3. Составьте две реакции ионного обмена, соответствующие данному ионному
уравнению: Ве2+ +2 ОН— = Ве(ОН)2
Составьте две реакции ионного обмена, соответствующие данному ионному
уравнению: Ве2+ +2 ОН— = Ве(ОН)2
Привести молекулярные и полные ионные уравнения. (1 балл)
4.Подберите коэффициент методом электронного баланса. Укажите окислитель и восстановитель.
А. НСl + CrO3=Сl2 +CrCl3 + Н2О (1,5 балла)
Б. Se+Н2О+НNO3 (раз)= Н2SeO4+NO
5. Определите возможные химические реакции для следующих пар веществ:
А. серная кислота и нитрат натрия;
Б. хлорид магния и гидроксид калия;
В. Карбонат натрия и хлорид бария.
Составьте для них молекулярные, полные и сокращенные ионные уравнения реакций.
Контрольная работа №1
Классификация
химических реакций. Электролитическая диссоциация.
Электролитическая диссоциация.
Вариант 5
1. Дайте определение электролиты и неэлектролиты. (0,5 балла)
2. Будут ли подвергаться гидролизу соли AlCl3, Hg3PO4? Ответ обосновать. Какова реакция среды в растворах этих солей? (0,5 балла)
3. Составьте две реакции ионного обмена, соответствующие данному ионному уравнению: Си2+ +SO3 2- = Си SO3
Привести молекулярные и полные ионные уравнения. (1 балл)
4.Подберите коэффициент методом электронного баланса. Укажите окислитель и восстановитель.
А. Fe + Cl2 = FeCl3 (1,5 балла)
Б. NH3+О2=NО+Н2О
5. Определите возможные химические реакции для следующих пар веществ:
А. соляная кислота и нитрат серебра;
соляная кислота и нитрат серебра;
Б. сульфат меди (ll) и азотная кислота;
В. хлорид алюминия и бромид натрия.
Составьте для них молекулярные, полные и сокращенные ионные уравнения реакций.
Контрольная работа №1
Классификация химических реакций. Электролитическая диссоциация.
Вариант 6
1. Дайте определение сильные и слабые электролиты. (0,5 балла)
2. Будут ли подвергаться гидролизу основания Cr(ОН)2, Ba(ОН)2? Ответ обосновать. Какова реакция среды в растворах этих оснований? (0,5 балла)
3. Составьте две реакции ионного обмена, соответствующие данному ионному уравнению: Мg2+ +2 F— = Мg F2.
Привести молекулярные и полные ионные уравнения. (1 балл)
4.Подберите
коэффициент методом электронного баланса. Укажите окислитель и восстановитель.
Укажите окислитель и восстановитель.
А. СrCl3 + Zn= Сr+ ZnCl2 (1,5 балла)
Б. Аg+Н2SO4 (кон) =Аg2 SO4+ SO2 +Н2О
5. Определите возможные химические реакции для следующих пар веществ:
А. серная кислота и хлорид бария;
Б. хлорид натрия и гидроксид калия;
В. Сульфат алюминия и хлорид калия.
Составьте для них молекулярные, полные и сокращенные ионные уравнения реакций.
Контрольная работа №1
Классификация химических реакций. Электролитическая диссоциация.
Вариант 7
1. Дайте определение обратимые реакции и катализатор. (0,5 балла)
2. Будут ли подвергаться гидролизу соли NaHCO3, АgСl? Ответ обосновать. Какова реакция среды в растворах этих оснований? (0,5 балла)
3. Составьте две реакции ионного обмена, соответствующие данному ионному
уравнению: Са2+ + SО32- = СаSО3
Составьте две реакции ионного обмена, соответствующие данному ионному
уравнению: Са2+ + SО32- = СаSО3
Привести молекулярные и полные ионные уравнения. (1 балл)
4.Подберите коэффициент методом электронного баланса. Укажите окислитель и восстановитель.
А. Mg + О2= MgО (1,5 балла)
Б. Аl2О3+Н2= Аl + Н2О
5. Определите возможные химические реакции для следующих пар веществ:
А. серная кислота и хлорид натрия;
Б. хлорид серебра и гидроксид калия;
В. Карбонат натрия и соляная кислота.
Составьте для них молекулярные, полные и сокращенные ионные уравнения реакций.
Контрольная работа №1
Классификация химических реакций. Электролитическая
диссоциация.
Вариант 8
1. Дайте определение экзотермические и эндотермические реакции. (0,5 балла)
2. Будут ли подвергаться гидролизу соли NaНCO3, АgВr? Ответ обосновать. Какова реакция среды в растворах этих оснований? (0,5 балла)
3. Составьте две реакции ионного обмена, соответствующие данному ионному уравнению: Мg2+ + 2ОН— = Mg(ОН)2
Привести молекулярные и полные ионные уравнения. (1 балл)
4.Подберите коэффициент методом электронного баланса. Укажите окислитель и восстановитель.
А. НСl + FeO=Сl2 +FeCl3 + Н2О (1,5 балла)
Б. Se+Н2О+НNO3 (раз)= Н2SeO4+NO
5. Определите возможные химические реакции для следующих пар веществ:
А. серная кислота и нитрат натрия;
серная кислота и нитрат натрия;
Б. хлорид магния и гидроксид калия;
В. Карбонат натрия и хлорид бария.
Составьте для них молекулярные, полные и сокращенные ионные уравнения реакций.
Контрольная работа №1
Классификация химических реакций. Электролитическая диссоциация.
Вариант 9
1. Дайте определение химическое равновесие и обратимые реакции. (0,5 балла)
2. Будут ли подвергаться гидролизу соли ВеCl2, Мg3PO4? Ответ обосновать. Какова реакция среды в растворах этих солей? (0,5 балла)
3. Составьте две реакции ионного обмена, соответствующие данному ионному уравнению: Са2+ +СO3 2- = СаСO3
Привести молекулярные и полные ионные уравнения. (1 балл)
4. Подберите
коэффициент методом электронного баланса. Укажите окислитель и восстановитель.
Подберите
коэффициент методом электронного баланса. Укажите окислитель и восстановитель.
А. Mg + Cl2 = MCl2 (1,5 балла)
Б. Са+О2=СаО
5. Определите возможные химические реакции для следующих пар веществ:
А. соляная кислота и нитрат серебра;
Б. сульфат меди (ll) и азотная кислота;
В. хлорид алюминия и бромид натрия.
Составьте для них молекулярные, полные и сокращенные ионные уравнения реакций.
Контрольная работа №1
Классификация химических реакций. Электролитическая диссоциация.
Вариант 10
1. Чем отличается экзотермическая реакция от эндотермической? (0,5 балла)
2. Будут ли подвергаться гидролизу основания КОН, Ba(ОН)2? Ответ обосновать. Какова реакция среды в растворах этих оснований? (0,5 балла)
3. Составьте две реакции ионного обмена, соответствующие данному ионному
уравнению: Мg2+ +2 F— = Мg F2.
Составьте две реакции ионного обмена, соответствующие данному ионному
уравнению: Мg2+ +2 F— = Мg F2.
Привести молекулярные и полные ионные уравнения. (1 балл)
4.Подберите коэффициент методом электронного баланса. Укажите окислитель и восстановитель.
А. НCl + Zn= Н2+ ZnCl2 (1,5 балла)
Б. С+Н2SО4= СО2 + SO2 +Н2
5. Определите возможные химические реакции для следующих пар веществ:
А. серная кислота и хлорид бария;
Б. хлорид натрия и гидроксид калия;
В. Сульфат алюминия и хлорид калия.
Составьте для них молекулярные, полные и сокращенные ионные уравнения реакций.
Контрольная работа №1
Классификация
химических реакций. Электролитическая диссоциация.
Вариант 11
1. Дайте определение следующим понятиям: катион, катод. (0,5 балла)
2. Укажите простые вещества, имеющие только окислительные свойства:
1) F2; 2)S; 3)Fe; 4)Аr (0,5 балла)
3. Укажите правильно написанное уравнение эндотермической реакции:
1)2Н2(г) + O2(г)=2 Н2О(ж) + 484кДж
2) 3O2(г)= 2O3(г) – 284кДж (1 балл)
4.Подберите коэффициент методом электронного баланса. Укажите окислитель и восстановитель.
А. Н2+ N2 =NH3 (1,5 балла)
Б. SO2+О2= SO3
SO2+О2= SO3
5. Определите массовую долю воды в гипсе СаSO4*2 Н2О (1,5 балла)
Контрольная работа №1
Классификация химических реакций. Электролитическая диссоциация.
Вариант 12
1. Дайте определение экзотермической реакции. Приведите пример подобной реакции. (0,5 балла)
2. Вещество, являющееся электролитом:
1) кислород 2) метан 3)азот 4)хлорид калия. (0,5 балла)
3. Составьте ступенчатую диссоциацию для Н2SO3 и NaHCO3 (1 балл)
4.Подберите
коэффициент методом электронного баланса. Укажите окислитель и восстановитель.
Укажите окислитель и восстановитель.
А. Мg + НCl = МgCl2 + Н2 (1,5 балла)
Б. МnО2+ НCl = МnCl2 + Cl2 +Н2О
5. Определите возможные химические реакции для следующих пар веществ:
А. гидроксид меди (II) и серная кислота;
Б. гидроксид натрия и соляная кислота;
В. Сульфат алюминия и хлорид калия.
Составьте для них молекулярные, полные и сокращенные ионные уравнения реакций.
Контрольная работа №1
Классификация химических реакций. Электролитическая диссоциация.
Вариант 13
1. Дайте определение следующим понятиям: анион, анод. (0,5 балла)
2. Укажите простые вещества, имеющие только восстановительные свойства:
1) F2; 2)S; 3)Fe; 4)Аr (0,5 балла)
3. Укажите правильно написанное уравнение экзотермической реакции:
Укажите правильно написанное уравнение экзотермической реакции:
1)2Н2(г) + O2(г)=2 Н2О(ж) + 484кДж
2) 3O2(г)= 2O3(г) – 284кДж (1 балл)
4.Подберите коэффициент методом электронного баланса. Укажите окислитель и восстановитель.
А. Н2+ О2 =H2О (1,5 балла)
Б. NaI+Cl2= NaCl+ I2
5. Определите массовую долю воды в медном купоросе СиSO4*5 Н2О
(1,5 балла)
Контрольная работа №1
Классификация химических реакций. Электролитическая
диссоциация.
Электролитическая
диссоциация.
Вариант 14
1. Дайте определение экзотермической реакции. Приведите пример подобной реакции. (0,5 балла)
2. Укажите заряды и напишите формулы следующих анионов:
1) хлорид 2) нитрат 3)карбонат (0,5 балла)
3. Напишите уравнение диссоциации одноосновных кислот: НСl, HClO4 и НNO3 (1 балл)
4.Подберите коэффициент методом электронного баланса. Укажите окислитель и восстановитель.
А. СrCl3 + Zn= Сr+ ZnCl2 (1,5 балла)
Б. Аg+Н2SO4 (кон) =Аg2 SO4+ SO2 +Н2О
Аg+Н2SO4 (кон) =Аg2 SO4+ SO2 +Н2О
5. Определите возможные химические реакции для следующих пар веществ:
А. гидроксид меди (II) и серная кислота;
Б. гидроксид натрия и соляная кислота;
В. Сульфат алюминия и хлорид калия.
Составьте для них молекулярные, полные и сокращенные ионные уравнения реакций.
Контрольная работа №1
Классификация химических реакций. Электролитическая диссоциация.
Вариант 15
1. Дайте определение следующим понятиям: анион, катод. (0,5 балла)
2. Укажите характерные степени окисления в сложных веществах для следующих атомов: 1) Н; 2)О; 3)Вe; 4)Аl (0,5 балла)
3. Среди ниже перечисленных соединений укажите те, которые относятся к сильным электролитам:
а) H2О б) NaСl в) Н2SO4 г)КОН (1 балл)
4. Подберите
коэффициент методом электронного баланса. Укажите окислитель и восстановитель.
Подберите
коэффициент методом электронного баланса. Укажите окислитель и восстановитель.
А. Си + О2 =СиО (1,5 балла)
Б. Na+ H2О = NaОН+ Н2
5. Определите массовую долю воды в кристаллической соде Na 2CO3*10 Н2О
(1,5 балла)
Контрольная работа №1
Классификация химических реакций. Электролитическая диссоциация.
Вариант 16
1. Дайте определение эндотермической реакции. Приведите пример подобной реакции. (0,5 балла)
2. Укажите заряды и напишите формулы следующих катионов:
Укажите заряды и напишите формулы следующих катионов:
1) натрия 2) алюминия 3)цинк (0,5 балла)
3. Напишите уравнение диссоциации кислых солей: NaНSO3, К2НРO4 и NaНS (1 балл)
4.Подберите коэффициент методом электронного баланса. Укажите окислитель и восстановитель.
А. NH3+О2=NО+Н2О (1,5 балла)
Б. Mg + N2= Mg3N2
5. Определите возможные химические реакции для следующих пар веществ:
А. гидроксид меди (II) и серная кислота;
Б. гидроксид натрия и соляная кислота;
В. Сульфат алюминия и хлорид калия.
Сульфат алюминия и хлорид калия.
Составьте для них молекулярные, полные и сокращенные ионные уравнения реакций.
Литература:
1. Учебник Г.Е. Рудзитис, Ф. Г. Фельдман Химия 9 класс
М; «Просвещение» 2014г.
2. Сборник задач и упражнений по химии к учебнику Г.Е. Рудзитис, Ф. Г. Фельдман Химия 9 класс М.А. Рябов «Экзамен» М.2014
3. Дидактический материал 8/9 класс А. М. Радецкий М. «Просвещение» 2016.
Контрольная работа 2 по теме «Электролитическая диссоциация».
Варианты контрольных работ по «Химии»
Варианты контрольных работ по «Химии» Задание к контрольной работе составлено в 4 вариантах. Студент должен выполнить работу по варианту, номер которого соответствует начальной букве фамилии. Вариант 1
Вариант 1
ID_589 1/6 neznaika.pro
Вариант 1 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 Четыре электрона находятся во внешнем электронном слое атомов каждого из химических
ПодробнееID_593 1/8 neznaika.pro
Вариант 5 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 Химическому элементу, в атоме которого распределение электронов по слоям 2е,
Подробнеес. Веселая Лопань, 2015 год
Муниципальное общеобразовательное учреждение «Веселолопанская средняя общеобразовательная школа Белгородского района Белгородской области» Контрольное тестирование по химии 9 класс (промежуточный контроль)
ПодробнееID_591 1/6 neznaika.
 pro
proВариант 3 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 На приведенном рисунке 1 изображен модель атома 1) кремния 2) серы 3) кислорода
ПодробнееЧасть 3 С3. Часть 3 С4
ШИФР Часть 1 Часть 2 С1 С2 С3 С4 С5 С6 Итоговый балл (из 100 баллов) Вступительная работа для поступающих в 10 ФХ и ХБ классы Часть 1 Обведите номер одного правильного ответа кружком. При правильном ответе
ПодробнееПояснительная записка
Пояснительная записка Рабочая тетрадь рекомендована для студентов очной формы обучения, реализующих образовательную программу среднего (полного) общего образования технического профиля. Данная рабочая
ПодробнееID_590 1/7 neznaika.pro
Вариант 2 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 Химический элемент, в атомах которого распределение электронов по слоям: 2,
При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 Химический элемент, в атомах которого распределение электронов по слоям: 2,
ID_731 1/8 neznaika.pro
Вариант 12 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 Укажите заряд ядра атома и число неспаренных электронов у атома фосфора в основном
ПодробнееБанк заданий 11 класс химия
Банк заданий 11 класс химия 1. Электронная конфигурация соответствует иону: 2. Одинаковую кофигурацию имеют частицы и и и и 3. Сходную конфигурацию внешнего энергетического уровня имеют атомы магния и
Подробнее1) IV 2) V 3) VI 4) VII
2 1. В ряду: Na Mg Al Si 1) увеличивается число энергетических уровней в атомах 2) усиливаются металлические свойства элементов 3) уменьшается высшая степень окисления элементов 4) ослабевают металлические
ПодробнееID_831 1/8 neznaika.
 pro
proВариант 24 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 Число электронов в атоме равно 1 1) числу протонов 2) числу нейтронов 3) сумме
ПодробнееЗАДАНИЕ 3. Примеры решения задач
ЗАДАНИЕ 3 Примеры решения задач Пример 1. В четырех пробирках без надписей находятся растворы следующих веществ: сульфата натрия, карбоната натрия, нитрата натрия и йодида натрия. Покажите, с помощью каких
Подробнееk.com/gia2013realgro/
Используется с бланками ответов. Вариант 3001-1 Государственная (итоговая) аттестация по ХИМИИ Вариант 3001 Инструкция по выполнению работы На выполнение работы отводится 2 часа (120 минут). Работа состоит
ПодробнееИнструкция по выполнению работы
Тренировочная работа 1 по ХИМИИ Химия. 11 класс. Вариант 1 m00090 2 Инструкция по выполнению работы Район. Город (населенный пункт). Школа. Класс Фамилия. Имя. Отчество 24 октября 2012 года 11 класс Вариант
11 класс. Вариант 1 m00090 2 Инструкция по выполнению работы Район. Город (населенный пункт). Школа. Класс Фамилия. Имя. Отчество 24 октября 2012 года 11 класс Вариант
ID_591 1/6 neznaika.pro
Вариант 3 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 На приведенном рисунке 1 1 2 3 4 изображен модель атома 1) кремния 2) серы 3)
ПодробнееКонтрольная Работа По Химии 9 Электролитическая Диссоциация – Telegraph
>>> ПОДРОБНЕЕ ЖМИТЕ ЗДЕСЬ <<<
Контрольная Работа По Химии 9 Электролитическая Диссоциация
Опубликовано 10.12.2013 — 22:22 — Нагайцева Юлия Николаевна
Работа состоит из заданий разного уровня сложности, составленных в соответствии с требованиями и спецификацией государственной итоговой аттестации. Имеются задания части С, предполагающие свободный ответ учеников.
Имеются задания части С, предполагающие свободный ответ учеников.
А2. Вещества, образующие при диссоциации в качестве анионов только гидроксид-ионы, являются
А3. В результате диссоциации нитрата натрия образуются
А4. Сульфат-ион образуется при диссоциации
А5. Правильно записано полное ионное уравнение реакции, схема которой
Н 2 SО 4 + LiОН → Li 2 SО 4 + Н 2 О
2Н + + SО 4 2- + Li + + ОН — = 2Li + + SО 4 2- + Н 2 О
2Н + + SО 4 2- + 2Li + + 2ОН — = 2Li + + SО 4 2- + 2Н 2 О
2Н + + SО 4 2- + 2Li + + 2ОН — = 2Li + + SО 4 2- + 4Н + + 2ОН — .
Н 2 + + SО 4 2- + Li + + ОН — = Li 2 + + SО 4 2- + Н 2 О
А6. Реакция между растворами NaOH и HNO 3 протекает до конца, так как
оба вещества являются электролитами
образуется растворимый нитрат натрия
А7. К образованию осадка приведет смешивание растворов, содержащих ионы
А8.Сокращённому ионному уравнению Fе 2+ + 2ОН — = Fе(ОН) 2 ↓ соответствует реакция между
хлоридом железа(III) и гидроксидом калия
хлоридом железа(II) и гидроксидом натрия
А9. Процессу окисления соответствует схема
Процессу окисления соответствует схема
А10. В реакции, протекающей по схеме WO 3 + H 2 → W + H 2 O
коэффициент перед формулой восстановителя
Б1. Установите соответствие между левой и правой частями уравнения диссоциации.
Б2. Установите соответствие между реагентами и сокращёнными ионными уравнениями реакций, протекающих между ними.
Fе(ОН) 2 + 2Н + = Fе 2+ + 2Н 2 О
2Н + + FеСО 3 = Fе 2+ + Н 2 О + СО 2 ↑
Б3. Установите соответствие между формулами веществ и степенями окисления атома азота в них.
Определите вещество « Х » в цепочке превращений
гидроксид меди(II) → Х → сульфат меди(II)
Для реакции обмена составьте полное и сокращенное ионное уравнения
А2. Вещества, образующие при диссоциации в качестве катионов только ионы водорода , являются
А3. Диссоциация какого вещества могла бы проходить в соответствии со схемой Me(OH) 2 → Me 2+ +2OH —
А4. Сульфид-ион образуется при диссоциации
А5. Сокращённому ионному уравнению Fе 2+ + 2ОН — = Fе(ОН) 2 ↓ соответствует реакция между
Сокращённому ионному уравнению Fе 2+ + 2ОН — = Fе(ОН) 2 ↓ соответствует реакция между
хлоридом железа(III) и гидроксидом калия
хлоридом железа(II) и гидроксидом натрия
А6. Реакция между растворами NaOH и СиSO 4 протекает до конца, так как
оба вещества являются электролитами
А7. В растворе одновременно не могут находиться ионы
1) SO 4 2- , Fe 3+ 2) Na + , NO 3 —
3) Ca 2+ , Cl – 4) Cu 2+ , OH –
А8 . Сумма всех коэффициентов в молекулярном и сокращенном ионном уравнениях реакции между хлоридом железа (III) и гидроксидом калия
А9. Процессу восстановления соответствует схема
А10. В уравнении горения алюминия в кислороде коэффициент перед формулой окислителя равен:
Б1. Установите соответствие между реагентами и уравнениями реакций в сокращенной ионной форме между ними.
Mg(NО 3 ) 2 и К 2 СО 3
MgСО 3 и НNО 3
2Н + + MgСО 3 = Mg 2+ + Н 2 О + СО 2 .
Mg(ОН) 2 и НCl
2Н + + СО 3 2- = Н 2 О + СО 2 .
Mg(ОН) 2 + 2Н + = Mg 2+ + 2Н 2 О
Ответ запишите в виде таблицы:
Б2 Осадок выпадает при добавлении раствора серной кислоты к раствору
Б3. Установите соответствие между формулами веществ и степенями окисления атома серы в них.
Определите вещество « Х » в цепочке превращений
К 2 О → Х → К 2 СО 3
Для реакции обмена составьте полное и сокращенное ионное уравнения
А2. Веществом, при диссоциации которого в качестве катионов образуются только ионы Н + , является
А3. Наибольшее количество ионов Na + образуется при диссоциации 1 моль
А4. Карбонат-ион образуется при диссоциации
А5. Сокращённому ионному уравнению Сu 2+ + 2ОН — = Сu(ОН) 2 ↓ соответствует реакция между
нитратом меди(II) и гидроксидом калия
хлоридом меди(II) и гидроксидом цинка
А6. Выделение газа наблюдается при сливании растворов
гидроксида натрия и соляной кислоты
гидроксида меди (II) и азотной кислоты
А7.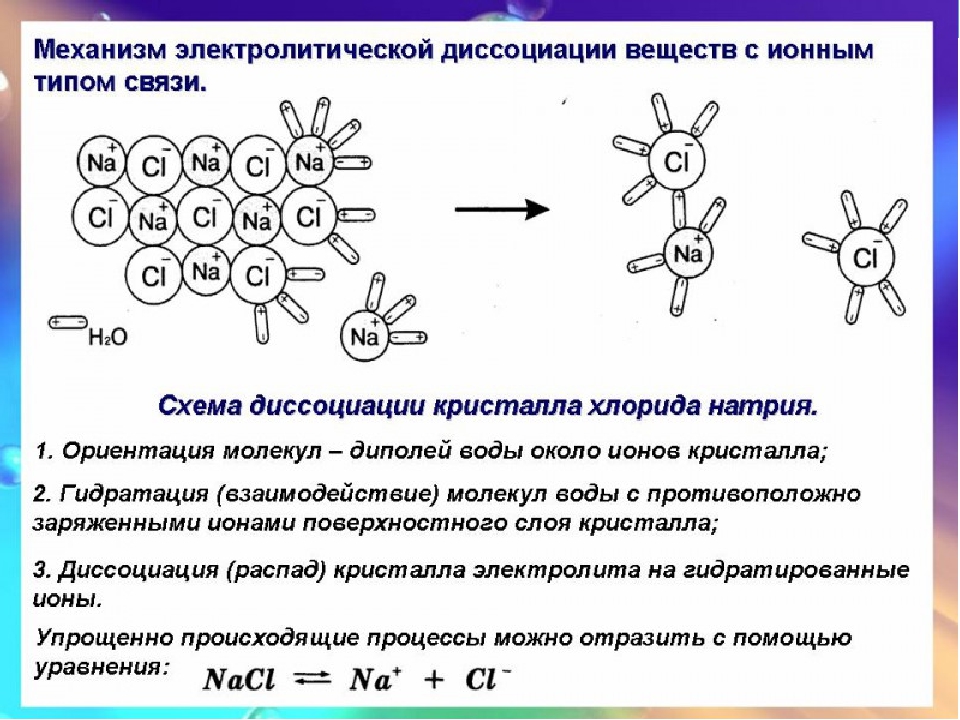 Сумма положительных зарядов в правой части уравнения диссоциации сульфата железа (III) равна
Сумма положительных зарядов в правой части уравнения диссоциации сульфата железа (III) равна
А8 . Сумма всех коэффициентов в молекулярном и сокращенном ионном уравнениях реакции между карбонатом кальция и соляной кислотой равна соответственно:
А9. Процессу восстановления соответствует схема:
1) H 0 → H + 2) Cu 0 → Cu +2 3) N 0 → N -3 4) C +2 → C +4
А10. В уравнении реакции фосфора с кислородом коэффициент перед формулой восстановителя равен
Б1. Установите соответствие между исходными веществами и сокращенным ионным уравнением реакции между ними.
Б2 Необратимо протекает взаимодействие растворов
хлорида алюминия и гидроксида калия
Б3. Установите соответствие между уравнением реакции и веществом, являющимся восстановителем в каждом из них.
Определите вещество « Х » в цепочке превращений
Х → СО 2 → К 2 СО 3
Для реакции обмена составьте полное и сокращенное ионное уравнения
А1 Только сильные электролиты представлены в ряду
А3. Наибольшее количество ионов ОН – образуется при диссоциации 1 моль
Наибольшее количество ионов ОН – образуется при диссоциации 1 моль
А. Серная кислота диссоциирует ступенчато.
Б. В растворе серной кислоты присутствуют только ионы H + и SO 4 2– .
А5. Сокращённому ионному уравнению Н + + ОН — = Н 2 О соответствует реакция между
нитратом меди(II) и гидроксидом калия
Гидроксидом калия и соляной кислотой
А6. Выпадение осадка наблюдается при сливании растворов
хлорида алюминия и гидроксида кальция
А7. При взаимодействии серы с кислородом окислителем является
А8 В растворе одновременно не могут находиться ионы
1) SO 4 2- , Fe 3+ 2) Na + , NO 3 — 3) Ca 2+ , Cl – 4) Cu 2+ , OH –
А9. Сумма отрицательных зарядов в правой части уравнения диссоциации хлорида железа (III) равна
А10. В уравнении реакции алюминия с хлором коэффициент перед формулой окислителя равен
Б1. Установите соответствие между исходными веществами и сокращенным ионным уравнением реакции между ними.
CaCO 3 + 2H + = Ca 2+ + CO 2 + H 2 O
2H + + SO 4 2– + Ca 2+ + 2OH – = CaSO 4 + H 2 O
Б2 Установите соответствие между левой и правой частями уравнения диссоциации.
Ва(ОН) 2
Б3. Окислительно-восстановительные процессы происходят при взаимодействии
Определите вещество « Х » в цепочке превращений
СО 2 → Х → К 2 СО 3
Для реакции обмена составьте полное и сокращенное ионное уравнения
Цель данной контрольной работы – проверить усвоение основных понятий темы: “Электролитическая диссоциация” , “Реакции ионного обмена”, «Гидролиз» проконтролировать умения составлять полные и сок…
Данная контрольная работа проводится после изучения темы «Электролитическая диссоциация». Работа тестовая на два варианта. Содержит задания, аналогичные заданиям ГИА….
Контрольная работа по теме «Электролитичекая диссоциация»…
Контрольная работа по химии. 9 класс. Тема «Электролитическая диссоциация»…
9 класс. Тема «Электролитическая диссоциация»…
Тестовые задания позволяют проверить знания по теме «Электролитическая диссоциация»…
Контрольная работа по теме «Электролитическая диссоциация» 9 класс…
Разноуровневая контрольная работа по теме «Электролитическая диссоциация». Химия . 9 класс…
Тестовая контрольная работа по теме: «…
Контрольная работа по химии . 9 класс. » Электролитическая …»
Контрольная работа по химии » Электролитическая …»
Контрольная работа по химии » Электролитическая …»
Контрольная работа по теме » Электролитическая диссоциация .»
Загрязнение Почвы Тяжелыми Металлами Реферат
Сочинение На Тему Культура Поведения
Почему Важно Беречь Природу Сочинение
Реферат Описать Систему Физического Воспитания
Реферат Конструкторское Техническое Обеспечение Производства
Самостоятельная работа по химии. 8 класс. Тема: «Электролитическая диссоциация». Вариант 1
САМОСТОЯТЕЛЬНАЯ РАБОТА ПО ХИМИИ
8 КЛАСС
ТЕМА: «ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ»
ВАРИАНТ 1
Самостоятельные работы предназначены для текущей проверки знаний учащихся по всем программным темам 8 класса.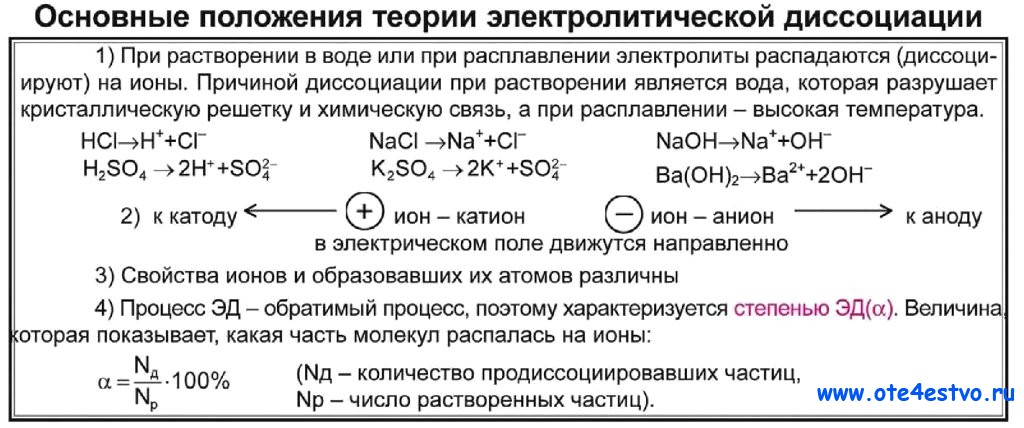 Самостоятельные работы включают в себя 2 — 4 задания, на выполнение которых отводится от 10 до 20 минут. По усмотрению учителя задания самостоятельных работ могут быть использованы для индивидуального опроса учащихся или в качестве практических заданий во время зачетов или переводных экзаменов.
Самостоятельные работы включают в себя 2 — 4 задания, на выполнение которых отводится от 10 до 20 минут. По усмотрению учителя задания самостоятельных работ могут быть использованы для индивидуального опроса учащихся или в качестве практических заданий во время зачетов или переводных экзаменов.
1. Заполните таблицу, распределив вещества в соответствующие колонки:
|
Электролиты |
Неэлектролиты | |
| Сильные | Слабые | |
Вещества: сахар, серная кислота, сульфид свинца, гидроксид натрия, сероводородная кислота, нитрат меди (II).
Для неорганических веществ в таблицу занесите их формулы.
2. Степень диссоциации фтороводородной кислоты равна 8%. Определите количество молекул (в молях) кислоты, не распавшихся на ионы, в 220 г ее 2%-го раствора.
Химия / 8 класс / Самостоятельные работы / Электролитическая диссоциация
Преподавателю: Данная самостоятельная работа по химии проводится с учащимися 8 класса общеобразовательной школы. По структуре и сложности задания самостоятельной работы соответствуют обязательному минимуму содержания по химии в полной средней школе, а также соответствуют тематическому поурочному планированию к учебнику О.С. Габриеляна для 2-х часовой программы. Данная самостоятельная работа может быть использована для контроля знаний учащихся по химии учителями, работающими по любым другим учебникам.
Целью данной самостоятельной работы является контроль усвоения учащимися темы «Электролитическая диссоциация».
| < Предыдущая | Следующая > |
|---|
Тестовая контрольная работа «ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ»
Тестовая контрольная работа
«ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ»
ВАРИАНТ 1.
1. Электролитом не является: а) FeSO4; б) Al(OH)3; в) AgNO3; г) HBr.
2. В какой группе содержатся только анионы?
а) OH–; SO32–; SO42–; SiO32–.
б) Al3+; Fe3+; H+; Zn2+
в) Cu2+; SiO32–; OH–; K+
г) CO32–; COOH–; NO3–;
S2–.
3. В результате диссоциации алюминий нитрата в растворе образуются ионы:
а) Al3+ и NO3–;
б) Al3+ и SO42–;
в) H+ и NO3–;
г) Al3+ и NO2–.
1. Какие реакции ионного обмена протекают в растворе практически до конца:
а) 2KCl + Na2SO4 → 2NaCl + K2SO4;
б) Zn(NO3)2 + 2KOH → 2KNO3 + Zn(OH)2;
в) CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O;
г) NaOH + LiCl → NaCl + LiOH.
2. Какие из уравнений диссоциации записаны неверно?
а) H3PO4 = 3H+ + PO43–;
б) CaCl2 → Ca2+ + 2Cl–;
в) Fe(NO3)3 Fe3+ + 3NO3–;
г) CuSO4 Cu2+ + SO4–.
С образованием карбонат-иона СО32– диссоциируют:
а) Na2СO3;
б) CaCO3;
в) Cu (NO3)2;
г) СН3СООН.
1. Из указанных ниже ионов не могут одновременно находиться в растворе:
а) Ag+, I–, Cl–;
б) Al3+, I–, K+;
в) Al3+, OH–, NO3–;
г) Na+, Br –, HCO3–.
2. Какой из реакций будет соответствовать следующая сокращенная ионная форма: ОН– + Н+ Н2О?
а) между NaОН и HCl;
б) между KOH и Н2О;
в) между H2SO3 и Al(OH)3;
г) между KHSO4 и Ba(ОН)2.
3. Обнаружить
бромид-ион в растворе можно при помощи раствора вещества:
Обнаружить
бромид-ион в растворе можно при помощи раствора вещества:
а) CuSO4;
б) AgNO3;
в) NH4Cl;
г) СаBr2.
Выберите правильное утверждение.
Возможна ли диссоциация вещества по схеме: H+ + RO– ROH R+ + OH–?
а) невозможна, поскольку веществ, диссоциирующих по этой схеме не существует;
б) возможна для вещества Zn(ОН)2;
в) возможна для вещества Са(ОН)2;
г) невозможна для всех веществ кроме Zn(ОН)2.
2. Какой группой веществ в данной последовательности можно воспользоваться для осуществления превращений: Cu0 Cu2+ Cu0 Cu2+?
а) Cl2, Fe, AgNO3;
б) O2, Mg, H2SO4;
в) HNO3, Mg, AgNO3;
г) Mg, AgNO3, Br2.
3. В какую сторону сместится равновесие реакции диссоциации:
Cu SO4 Cu2+ + SO42– при добавлении сульфатной ислоты?
а) влево,
б) вправо,
в) не сместится.
ВАРИАНТ 2.
1. Электролитами являются: а) NaCl; б) C2H5OH; в) K2O; г) CuSO4.
2. При диссоциации электролитов образуются:
а) атомы,
б) ионы,
в) молекулы,
г) простые вещества.
3. Вещества, 25% молекул которых в растворе диссоциируют на ионы, называются:
а) сильными электролитами,
б) слабыми электролитами,
в) электролитами средней силы,
г) неэлектролитами.
1. Практически осуществима реакция:
а) HNO3 + Ba(OH)2,
б) KCl + HNO3,
в) NaOH + Li2SO4,
г) Zn + HCl
.
2. При повышении концентрации электролита степень диссоциации:
а) увеличивается,
б) уменьшается,
в) сначала увеличивается, а потом уменьшается,
г) остается без изменений.
Раствор CuSO4 имеет голубую окраску вследствие наличия ионов:
а) SO42–,
б) Cu2+,
в) H+,
г) OH–.
1. Общая сумма коэффициентов в уравнениях ступенчатой диссоциации серной кислоты равна:
а) 3, б) 6, в) 4, г) 2 .
2. Взаимодействию каких веществ соответствует данное сокращенное ионное уравнение: Al3+ + 3ОН – Al(OH)3?
а) AlCl3 и KOH,
б) Al2(SO4)3 и BaCl2,
в) Al2S3 и H2O,
г) Al2O3 и HCl.
3. Для
осуществления превращений в данной последовательности: K KOH KCl КNO3 необходимо воспользоваться реактивами:
Для
осуществления превращений в данной последовательности: K KOH KCl КNO3 необходимо воспользоваться реактивами:
а) H2O, HCl, Ba(NO3)2;
б) H2O, HCl, AgNO3;
в) NaOH, HCl, Ca(NO3)2;
г) KOH, NaCl, HNO3.
В растворе каких веществ фенолфталеин приобретает малиновую окраску?
а) Са(ОН)2, б) AlCl3, в) Na2СО3, г) NH4СN.
2. В какую сторону сместится равновесие реакции: 2H+ + ZnО22 – Zn(ОН)2 Zn 2+ + 2OH–?
а) влево,
б) вправо,
в) не сместится.
3. В данной схеме:
Y
Х Х
Z
Веществами Х, Y и Z могут быть: а) Al(OH)3, NaCl, AlCl3;
б) Al(OH)3, AlCl3, Na[Al(OH)4];
в) Cl2, HCl, CuCl2;
г) H2O, Mg(OH)2, HNO3.
ВАРИАНТ 3.
1. С точки зрения теории электролитической диссоциации при диссоциации кислот в растворе образуются:
а) катионы водорода и анионы кислотного остатка;
б) гидроксид-анионы и катионы металла;
в) атомы металла и анионы кислотного остатка;
г) атомы водорода и анионы кислотного остатка.
2. Электрический ток проводят растворы веществ:
а) НCl; б) О3; в) C12H22O11; г) NаOH.
3. Ионы Cl– и Mg2+ образуются в результате диссоциации:
а) NaCl;
б) MgCl 2;
в) HCl;
г) Mg(OH)2.
1. Реакции ионного обмена, протекающие с образованием осадка – это реакции между веществами:
а) CuSO4 и NaOH;
б) BaCl2 и H2SO4;
в) Mg(OH)2 и HCl ;
г) KOH и HNO3 .
2. В ряду растворов: 10% H2SO4; 50% H2SO4 и 90% H2SO4 степень диссоциации:
а) возрастает;
б) убывает;
в) остается неизменной.
Какие из приведенных схем реакций характеризуют химические свойства солей?
а) KOH + H2SO4 ; д) Fe + CuSO4 ;
б) FeSO4 + KOH ; е) Na2S + Cl2 ;
в) FeSO4 + BaCl2 ; ж) Mg(OH)2 + HCl ;
г) NaOH и Al(OH)3; з) Na + H2O .
1. Сколько различных кислых солей можно получить, используя следующие вещества: Al(OH)3, KOH, H2SO4, H3РO4?
а) 4; б) 6; в) 3; г) 7.
2. Какие из следующих реакций не могут протекать в растворах?
а) LiOH + Cr(OH)3 ; в) Cu + FeSO4 ; д) СаCl2
+ H2SO3;
б) KHSO4 + KOH
; г) Al(OH)2Cl + NaOH
; е) К2S + FeSO4.
3. Наибольшее число различных ионов образуется при диссоциации:
а) ортофосфатной кислоты;
б) натрий дигидрогенфосфата;
в) сульфатной кислоты;
г) кальций гидроксохлорида.
В каком из перечней веществ представлены только формулы кислот:
а) H3РO4, Cu(ОН)2, СаCl2;
б) HNO3, AlCl3, H2SO4;
в) HCl, НIО3, H2SO3;
г) Ca(NO3)2, NН3, СН4.
2. В каком из растворов содержится больше ионов?
а) 0,1М H2SO4;
б) 0,1М HCl;
в) 0,1М HCN;
г) 0,1М H3РO4.
3. В ряду: NaH2PO4, AlCl3, (CH3COO)3Cr, KHСO3, Ca(OH)2 рН растворов:
а) возрастает;
б) убывает;
в) убывает, а потом возрастает;
г) остается неизменным.
Контрольная работа «Электролитическая диссоциация» 8 Класс
Рубаник Анна Иосифовна
Учитель биологии и химии
МБОУ «СОШ№14»,г. Нижневартовск
Дифференцированный подход в обучении химии
Одной из перспективных и эффективных педагогических технологий обучения является дифференцированный подход обучения школьников, основанный на личностно-ориентированном характере образования. Цель дифференциации — обучение каждого на уровне его возможностей, способностей, адаптации обучения к особенностям различных групп учащихся.
Задания уровня «А» зафиксированы как базовый стандарт – минимальный, или репродуктивный. Здесь особенностью обучения является многократность повторения, умение выделять смысловые группы. Задание уровня «А» должен уметь выполнить каждый, прежде чем приступить к заданиям «В», «С». Уровень «В» – аналитико-синтетический уровень, руководствуется приемами умственной деятельности, которые необходимы для решения задач на применение. Здесь, кроме конкретных знаний вводятся дополнительные сведения, расширяющие материал уровня «А». Уровень «С» – творческий уровень, выводящий учащихся на уровень осознанного, творческого применения знаний, предусмотрены сведения, углубляющие материал, требующие логического обоснования. Этот уровень позволяет учащимся проявлять способность к дополнительной самостоятельной работе.
Здесь, кроме конкретных знаний вводятся дополнительные сведения, расширяющие материал уровня «А». Уровень «С» – творческий уровень, выводящий учащихся на уровень осознанного, творческого применения знаний, предусмотрены сведения, углубляющие материал, требующие логического обоснования. Этот уровень позволяет учащимся проявлять способность к дополнительной самостоятельной работе.
Опыт использования дифференциального подхода к контролю знаний учащихся покажу на примерах: разноуровневые контрольные работы по химии в 9 классе. Дифференцированные контрольные работы представлены в нескольких вариантах. Задания работы сгруппированы в три уровня: «А», «В», «С». В уровень «А» включены задания, проверяющие усвоение необходимого минимума конкретных знаний по химии. Выполнение ее требует от учащихся репродуктивной деятельности, оцениваю ее выполнение на «3». При выполнении уровня «В» учащиеся должны уметь раскрыть причинно-следственные связи, применять теоретические знания для объяснения конкретных явлений. Выполнение уровней «А» и «В» оцениваю на «4». Уровень «С» содержит задания, требующие целостного восприятия материала, самостоятельно проводить обобщение и сравнение. Выполнение этого уровня оцениваю на «5».
Выполнение уровней «А» и «В» оцениваю на «4». Уровень «С» содержит задания, требующие целостного восприятия материала, самостоятельно проводить обобщение и сравнение. Выполнение этого уровня оцениваю на «5».
Источники материалов:
Царева Т. В., Реализация дифференцированного подхода в обучении химии как одно из направлений современных педагогических технологий. Http://sarschool76.narod. ru/Tv_pab_ctv. pdf
Зуева М. В., Гара Н. Н. Контрольные и проверочные работы по химии. 8-9 кл.: методическое пособие. М.: Дрофа, 2002.
Иванова Р. Г. Вопросы, упражнения и задания по химии: пособие для учащихся 8-9 кл. М.: Просвещение, 2002.
Радецкий А. М. Проверочные работы по химии в 8-11 классах: пособие для учителя. М.: Просвещение, 2001.
Контрольная работа № 1
Электролитическая диссоциация
1 вариант
Уровень А
1.Какие из перечисленных веществ являются Электролитами: сахар, h3, KCl, h4PO4, CuO, Ba(OH)2 , Fe(NO3)3, бензин?
2.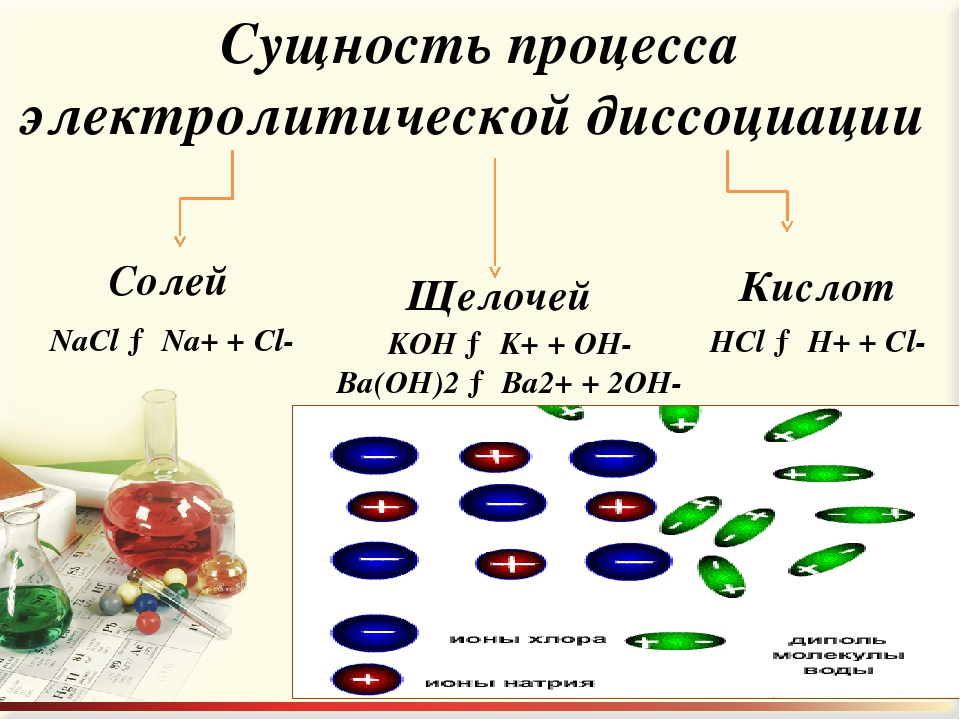 Напишите уравнения диссоциации следующих электролитов:
Напишите уравнения диссоциации следующих электролитов:
h3SO3 → BaCl2 →
NaOH → Fe2(SO4)3 →
3.Приведите формулы 2-3 веществ, при растворении которых в водном растворе образуются ионы железа Fe3+.
Уровень В
4.Допишите уравнения реакций, составьте полные и сокращенные ионные уравнения:
А) HCl + KOH →
Б) MgCl2 + NaOH →
Уровень С
5. Допишите уравнение реакции. Составьте ионные уравнения в полной и сокращенной форме:
K2CO3 + … → … + h3O + CO2
6. Составьте в молекулярной форме уравнение реакции, которому соответствует следующее ионное уравнение:
2H+ + SiO32- =h3SiO3
Контрольная работа № 1
Электролитическая диссоциация
2 вариант
Уровень А
1.Какие из перечисленных веществ являются Неэлектролитами: сахар, h3, NaCl, h3SO4, MgO, KOH, Ba(NO3)2, спирт?
2.Напишите уравнения диссоциации следующих электролитов:
HNO3 → ZnCl2 →
Ca(OH)2 → Na3PO4 →
3.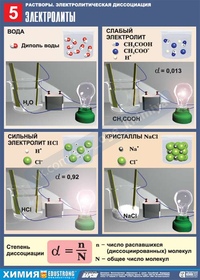 Напишите химические формулы электролитов, если известно, как они диссоциируют:
Напишите химические формулы электролитов, если известно, как они диссоциируют:
А) ? ↔ Mg2+ + 2NO3 — Б) ? ↔ 2К+ + SO42-
Уровень В
4.Допишите уравнения реакций, составьте полные и сокращенные ионные уравнения:
А) KCl + AgNO3 →
Б) Ba(NO3)2 + Na2SO4 →
Уровень С
5. Допишите уравнение реакции. Составьте ионные уравнения в полной и сокращенной форме:
Cu(NO3)2 + … → Cu(OH)2 +
6. Составьте в молекулярной форме уравнение реакции, которому соответствует следующее ионное уравнение:
3Ca2+ + 2PO43- = Ca3(PO4)2
Контрольная работа № 1
Электролитическая диссоциация
3 вариант
Уровень А
1.Какие из перечисленных веществ являются Неэлектролитами: сахар, O2, MgCl2, h3SO4, FeO, KOH, Zn(NO3)2, спирт?
2.Напишите уравнения диссоциации следующих электролитов:
KNO3 → AlCl3 →
Ba(OH)2 → Na2SO4 →
3. Напишите химические формулы электролитов, если известно, как они диссоциируют:
Напишите химические формулы электролитов, если известно, как они диссоциируют:
А) ? ↔ Fe2+ + 2NO3 — Б) ? ↔ 3Na+ + PO43-
Уровень В
4.Допишите уравнения реакций, составьте полные и сокращенные ионные уравнения:
А) NaBr + AgNO3 →
Б) BaCl2 + CuSO4 →
Уровень С
5. Допишите уравнения реакций. Составьте ионные уравнения в полной и сокращенной форме:
CuCl2 + … → Cu(OH)2 + …
6. Составьте в молекулярной форме уравнение реакции, которому соответствует следующее ионное уравнение:
3Zn2+ + 2PO43- = Zn3(PO4)2
Контрольная работа № 1
Электролитическая диссоциация
4 вариант
Уровень А
1.Какие из перечисленных веществ являются Электролитами: сахар, N2, BaCl2, HNO3, CO, Ca(OH)2 , FeSO4, бензин?
2.Напишите уравнения диссоциации следующих электролитов:
Na2SO3 → MgCl2 →
KOH → Al2(SO4)3 →
3. Приведите формулы 2-3 веществ, при растворении которых в водном растворе образуются карбонат-ионы СО32-.
Приведите формулы 2-3 веществ, при растворении которых в водном растворе образуются карбонат-ионы СО32-.
Уровень В
4.Допишите уравнения реакций, составьте полные и сокращенные ионные уравнения:
А) HNO3 + NaOH →
Б) ZnCl2 + KOH →
Уровень С
5. Допишите уравнения реакций. Составьте ионные уравнения в полной и сокращенной форме:
FeCl3 + … → AgCl + …
6. Составьте в молекулярной форме уравнение реакции, которому соответствует следующее ионное уравнение:
Ba2+ + SiO32- =BaSiO3
Контрольная работа по теме “Неметаллы»
1 вариант
Уровень А
Выберите один правильный ответ.
Какой заряд ядра атома кремния:
+14
+28
+3
+4
Количество валентных электронов углерода:
Возможная валентность серы:
II, IV
II, IV, VI
II, IV, VI, VIII
Возможная валентность фосфора:
III, V
I, III, V, VII
Степень окисления углерода:
+2; -2
+4
-4
-4; +4; +2
Может быть красным или белым:
Основной компонент воздуха:
углекислый газ
Графит и алмаз состоят из:
Формула оксида углерода (II):
Явление аллотропии не свойственно:
Формула летучего водородного соединения азота:
Формула сильного окислителя, который обугливает органические вещества:
Ядовитое вещество, светится в темноте, воспламеняется при 400 С:
Пластическая сера
Красный фосфор
Белый фосфор
Формула оксида кремния IV:
Какой газ нельзя собрать в сосуд методом вытеснения воды:
Формула соды:
Уровень В
Допишите правильный ответ
Какое вещество используют в медицине, для приведения человека в чувства ______.
Для получения газированной воды используют _______ газ.
Это газообразное соединение углерода является сильным ядом ________.
Вещества, образующиеся при взаимодействии аммиака с кислотами называются _______.
Самый твердый природный минерал — ______.
Основные отрасли силикатной промышленности – это ________.
Уровень С
Допишите уравнения реакций
S + O2
h3S + Zn
h3SO4 + CuO
HNO3 + NaOH
HCl + K2CO3
h3SO4 + BaCl2
Nh4 + HСl
CO2 + CaO
Составьте уравнения реакций по схеме:
h3 → Nh4 → (Nh5)2SO4 → BaSO4
Запишите уравнение реакции по схеме в молекулярном и ионном виде:
Na2SiO3 → h3SiO3
Контрольная работа по теме “Неметаллы»
2 вариант
Уровень А
Выберите один правильный ответ.
1.Какой заряд ядра атома азота:
+14
+28
+7
+5
Количество валентных электронов серы:
Возможная валентность углерода:
II, IV
II, IV, VI
II, IV, VI, VIII
Возможная валентность азота:
III, V
I, II, III, IV, V
Степень окисления фосфора:
+3; +5; -3
+3; +7
-5; +5
+3; +5
Может быть кристаллической или пластической:
Явление аллотропии свойственно:
Очень твердый, прозрачный минерал:
Формула оксида углерода (IV):
Явление адсорбции свойственно:
Формула аммиака:
Формула сильного окислителя, который с белками образует вещества желтого цвета:
Ядовитое вещество с неприятным запахом тухлых яиц:
Пластическая сера
Сернистый газ
Белый фосфор
Формула кремниевой кислоты:
Какой газ в промышленности получают из азота и водорода:
оксид азота (II)
угарный газ
Формула известняка, мела:
Уровень В
Допишите правильный ответ
Какое вещество используют в производстве спичек, для вулканизации каучука ______.
«Сухой лед» — это твердый _______.
В быту нашатырным спиртом называют водный раствор ________.
Распознать кислород и оксид углерода (IV) можно с помощью _______.
Ядовитое, желтоватое вещество с чесночным запахом, светящееся в темноте — ______.
Основное сырье силикатной промышленности – это ________.
Уровень С
Допишите уравнения реакций
P + O2
h3SO4(разб) + Zn
HNO3 + CaO
HNO3 + Na2CO3
h3SO4 + Nh4
Na2SiO3 + HCl
Nh5Сl
SO3 + MgO
Составьте уравнения реакций по схеме:
CO2 → Na2CO3 → CO2 → CaCO3
Запишите уравнение реакции по схеме в молекулярном и ионном виде:
h3SO4 → BaSO4
Контрольная работа по теме «Металлы»
1 вариант
Уровень А. Выберите один правильный ответ.
Электролитическая диссоциация — обзор
1.
 1.1 ОПРЕДЕЛЕНИЯ ЧАСТИЦ, ОБЛАДАЮЩИХ КИСЛОТНЫМИ ИЛИ ОСНОВНЫМИ СВОЙСТВАМИ
1.1 ОПРЕДЕЛЕНИЯ ЧАСТИЦ, ОБЛАДАЮЩИХ КИСЛОТНЫМИ ИЛИ ОСНОВНЫМИ СВОЙСТВАМИОпределение Аррениуса, известное как теория электролитической диссоциации (TED), подходящее для описания водных растворов, исторически было первым определением этого Добрый. В нем говорится, что кислота — это вещество, склонное к диссоциации с образованием протонов, H + :
(1.1.1) HCl⇌H ++ Cl-,
, тогда как основание является донором гидроксид-ионов, OH — :
(1.1.2) NaOH⇌Na ++ OH−.
В ионной форме кислотно-основное взаимодействие (нейтрализация) можно записать следующим образом:
(1.1.3) H ++ OH − ⇌h3O.
Подобные взаимодействия в молекулярных растворах характеризуются константой собственной кислотно-основной автоионизации, которая является важным параметром, описывающим кислотно-основные свойства растворителя. Например, константа автоионизации воды определяется следующим произведением:
(1.1.4) Kw⇌H + OH− = 10-14 298.15К.
Чем ниже значение этой константы, тем больше разница в показателях кислотности (pH) между стандартными растворами сильных кислот и оснований, что приводит к более широкому кислотно-щелочному диапазону для растворителя. Это относится не только к кислотно-основным равновесиям в водных растворах, но также относится к любому донорно-акцепторному взаимодействию в молекулярных растворителях, которые склонны к гетеролитической диссоциации с образованием «кислотных» и «основных» частиц, как предусмотрено соответствующим определением. кислот и оснований.Из уравнений (1.1.3) и (1.1.4) следует, что определение Аррениуса можно использовать только для описания кислотно-основных взаимодействий в водных растворах, поскольку реакция между «кислотой» растворителя и «основанием» растворителя может привести к образованию только молекул растворителя. В рассматриваемом случае этим растворителем является вода.
Это относится не только к кислотно-основным равновесиям в водных растворах, но также относится к любому донорно-акцепторному взаимодействию в молекулярных растворителях, которые склонны к гетеролитической диссоциации с образованием «кислотных» и «основных» частиц, как предусмотрено соответствующим определением. кислот и оснований.Из уравнений (1.1.3) и (1.1.4) следует, что определение Аррениуса можно использовать только для описания кислотно-основных взаимодействий в водных растворах, поскольку реакция между «кислотой» растворителя и «основанием» растворителя может привести к образованию только молекул растворителя. В рассматриваемом случае этим растворителем является вода.
Более общее определение кислотно-щелочного равновесия в молекулярных растворителях было независимо предложено Бронстедом и Лоури, которые расширили термин «основание».По их словам, кислота является донором протонов, а основание они определили только как акцептор H + . Согласно определению Бренстеда – Лоури, диссоциация кислоты приводит к образованию протона и «сопряженного» основания:
(1. 1.5) A⇌B + H +.
1.5) A⇌B + H +.
В молекулярных растворителях процесс (1.1.5) накладывается на другие кислотно-основные реакции, а именно на реакцию с нейтральными молекулами растворителя или с другими растворенными веществами кислотного или основного характера. Полный кислотно-основной процесс представлен уравнением типа:
(1.16) A1 + B2L⇌A2LH ++ B1.
Конечно, протоны не могут существовать как свободные частицы в молекулярных растворителях: они должны реагировать с молекулами растворителя, и такое взаимодействие в водных растворах приводит к образованию H 5 O 2 + (H + · 2H 2 O или [H 2 O · · · H · · · OH 2 ] + ) частиц. Точно так же ионы гидроксида в водных растворах существуют как H 3 O 2 — (OH 2 · · · OH — ).Чем сильнее кислота A 1 по сравнению с кислотой A 2 , тем полнее смещение реакции (1. 1.6) вправо. Таким образом, определение Бренстеда-Лоури расширяет термин «кислотно-основное взаимодействие» на реакции, сопровождающиеся переносом протона от одного основания к другому. Например, согласно этому определению, гидролиз — это разновидность кислотно-основного взаимодействия
1.6) вправо. Таким образом, определение Бренстеда-Лоури расширяет термин «кислотно-основное взаимодействие» на реакции, сопровождающиеся переносом протона от одного основания к другому. Например, согласно этому определению, гидролиз — это разновидность кислотно-основного взаимодействия
(1.1.7) HCO3- + h3O⇌CO2⋅h3O + OH−
с участием двух пар сопряженных пар, состоящих из кислоты и основание, отличающееся на один протон:
(1.1.8) HCO3− + H + ⇌h3O,
(1.1.9) h3O − H + ⇌OH−.
Очевидным преимуществом определения Бренстеда – Лоури по сравнению с TED является тот факт, что кислотно-основное взаимодействие достигает равновесия между двумя парами конъюгатов в растворителе. При формулировке этого определения в качестве подходящих растворителей рассматривались только различные протолитические среды, процесс диссоциации которых можно описать следующей схемой:
(1.1.10) HL⇌H ++ L-.
Тем не менее, позже оно использовалось для описания реакций протонного обмена в апротонных средах, поскольку это определение не имеет ограничений, касающихся химического состава частиц растворителя, а точнее их склонности к диссоциации с образованием сольватированного протон.
Следует отметить, что термины «кислота» и «основание» в теории Бренстеда – Лоури относятся только к функции данного вещества в протолитической реакции. Одно и то же вещество при определенных условиях может реагировать как кислота, а в других случаях оно может проявлять основные свойства. Кроме того, на относительную силу кислот и оснований значительно влияет сольватация реагентов и продуктов реакции.
Льюис [13] предложил электронную теорию кислот и оснований и дал более общее определение кислот и оснований в ее рамках.Кислоты определяются как акцепторы электронной пары, а ее доноры классифицируются как основания. Принципиальная схема кислотно-основного взаимодействия Льюиса описывается следующим уравнением:
(1.1.11) A +: B⇌A: B.
Согласно этому уравнению, оба рассмотренных выше определения протонной кислотности являются просто частными случаями определения Льюиса. В самом деле, протон — это электронодефицитная частица и акцептор электронной пары, поэтому его называют кислотой, а его акцепторами являются основания. Помимо протонов, к кислотам Льюиса можно отнести и другие электронодефицитные частицы, независимо от их заряда (Ni 2 + , BF 3 и т. Д.).
Помимо протонов, к кислотам Льюиса можно отнести и другие электронодефицитные частицы, независимо от их заряда (Ni 2 + , BF 3 и т. Д.).
Наиболее общее определение кислот и оснований было сформулировано Усановичем [14,15], который предложил определение кислот как участников химической реакции, доставляющей катионы (среди них протон) или фиксирующих анион (включая один электрон). . Таким образом, основания являются донорами анионов (электронов) или акцепторами катиона (протонов).Однако это определение не стало общепринятым, главным образом из-за его чрезмерной универсальности, поскольку большинство химических реакций можно отнести к кислотно-основным в рамках определения Усановича. Например, следующая окислительно-восстановительная реакция будет кислотно-основной реакцией:
(1.1.12) Fe3 ++ Cu + ⇌Fe2 ++ Cu2 +.
здесь Fe 3 + (донор электронов) — кислота, а Cu + (акцептор электрона) — основание.
Обычно определения кислот и оснований необходимы для классификации различных видов химических реакций, т. е.е. для разделения их на кислотно-основные и «прочие». Например, определение Бренстеда – Лоури делит реакции на кислотно-основные, которые характеризуются перераспределением протонов, и другие. В более широком определении Льюиса реакции делятся на кислотно-основные и окислительно-восстановительные, что означает, что в первом случае происходит перераспределение электронной плотности за счет электронных пар, а во втором случае речь идет о реакциях с переносом отдельных электронов. Поскольку химия касается как раз перераспределения электронов внешних оболочек, мы можем классифицировать все химические реакции как кислотно-основные по определению Усановича.
е.е. для разделения их на кислотно-основные и «прочие». Например, определение Бренстеда – Лоури делит реакции на кислотно-основные, которые характеризуются перераспределением протонов, и другие. В более широком определении Льюиса реакции делятся на кислотно-основные и окислительно-восстановительные, что означает, что в первом случае происходит перераспределение электронной плотности за счет электронных пар, а во втором случае речь идет о реакциях с переносом отдельных электронов. Поскольку химия касается как раз перераспределения электронов внешних оболочек, мы можем классифицировать все химические реакции как кислотно-основные по определению Усановича.
Тем не менее, в определении Усановича есть и положительные моменты. Итак, кислоты и основания классифицируются на основе их реакций с ионами (анионами и катионами), которыми являются основания и кислоты Льюиса. Следовательно, эту особенность следует добавить к определению Льюиса, чтобы дать наиболее общее определение кислот и оснований [16]: кислоты являются либо акцепторами неразделенной электронной пары (или аниона), либо донорами катиона, а основания являются либо донорами электронная пара (или анион) или акцепторы катиона.
Однако рассмотрим следующую реакцию, являющуюся кислотно-основной (по принципу Люкса – Флуда):
(1.1.13) S2O72− + O2 − ⇌2SO42−.
Согласно приведенным выше определениям, оба реагента в левой части реакции (1.1.13) являются акцепторами аниона и, следовательно, должны рассматриваться как кислоты. Однако это не так, и известно, что расплавленные пиросульфаты являются очень агрессивной кислой средой. Определение Lux предоставляет один из возможных способов устранить это кажущееся противоречие.Напомним, что в 1939 г. Люкс предложил определение, в котором кислоты определялись как акцепторы оксидных ионов, а основания — как доноры оксид-ионов [17]. Итак, основное кислотно-основное взаимодействие Люкс-Флада можно описать уравнением (0.1). Позже некоторые исследования были выполнены Flood et al. на расплав пиросульфата калия [18–20]. Раздел исследований, изучающий реакции оксидного ионного обмена в расплавленных солях, теперь получил название «оксокислотность».
Следует отметить, что в литературе есть несколько любопытных интерпретаций оксокислотности, которые в большей или меньшей степени искажают исходное определение.Например, Делимарский и Барчук [3] дают «определение Люкс», где основание является донором оксидных или галогенид-ионов. Более того, по крайней мере, в русском переводе книги [21], «определение Lux – Flood» означает, что кислота является донором оксидных ионов, а основание — акцептором O 2 — . Конечно, эти «определения» ошибочны, как можно убедиться, прочитав исходную статью Lux [17].
Настройка морфологии неорганических наноматериалов, выращенных осаждением, посредством контроля электролитической диссоциации и перенасыщения
Го, Ю. Г., Ху, Дж. С. и Ван, Л. Дж. Наноструктурированные материалы для электрохимических устройств преобразования и хранения энергии. Adv. Матер. 20 , 2878–2887 (2008).
CAS Статья Google ученый
Peng, S. et al. Изготовление одномерной архитектуры шпинели методом электропрядения с одной фильерой для накопления энергии. САУ Нано 9 , 1945–1954 (2015).
CAS Статья Google ученый
Zhou, Z.-Y., Tian, N., Li, J.-T., Broadwell, I. & Sun, S.-G. Наноматериалы с высокой поверхностной энергией с исключительными свойствами в катализе и накоплении энергии. Chem. Soc. Ред. 40 , 4167–4185 (2011).
CAS Статья Google ученый
Ван З. Л. Нанопроволока и нанопояса: материалы, свойства и устройства.Том 1: Металлические и полупроводниковые нанопроволоки, (Springer Science & Business Media, 2013).
Xia, Y. et al. Одномерные наноструктуры: синтез, характеристика и приложения. Adv. Матер. 15 , 353–389 (2003).
CAS Статья Google ученый
Sun, Z. et al. Обобщенная самосборка масштабируемых двумерных нанолистов из оксидов переходных металлов. Nat. Commun. 5 , 3813 (2014).
CAS Статья Google ученый
Яна, Н. Р., Гирхарт, Л. и Мерфи, К. Дж. Подход к выращиванию с использованием семян для синтеза сфероидальных и стержневидных наночастиц золота с контролируемой формой с использованием шаблона поверхностно-активного вещества. Adv. Матер. 13 , 1389–1393 (2001).
CAS Статья Google ученый
Хучко А. Шаблонный синтез наноматериалов. Заявл. Phys. А 70 , 365–376 (2000).
CAS Статья Google ученый
Тао, А. Р., Хабас, С. и Янг, П. Контроль формы коллоидных металлических нанокристаллов. Малый 4 , 310–325 (2008).
CAS Статья Google ученый
Li, Y.и другие. Электрохимически управляемый синтез трапецеидальных нанокристаллов платины с высокой электрокаталитической активностью. Chem. Commun. 48 , 9531–9533 (2012).
CAS Статья Google ученый
Лифшиц И. М., Слёзов В. В. Кинетика осаждения из перенасыщенных твердых растворов. J. Phys. Chem. Твердые тела 19 , 35–50 (1961).
Артикул Google ученый
Li, W., Zhang, S. и Chen, J. Синтез, характеристика и электрохимическое применение Ca (OH) 2 -, Co (OH) 2 — и Y (OH) 3 — с покрытием Ni (OH) 2 трубок. J. Phys. Chem. B 109 , 14025–14032 (2005).
CAS Статья Google ученый
Lin, H.-X. и другие. Эволюция структуры поверхности в зависимости от пересыщения: от ионных, молекулярных до металлических микро / нанокристаллов. J. Am. Chem. Soc. 135 , 9311–9314 (2013).
CAS Статья Google ученый
Маллин Дж. У. Кристаллизация (Butterworth-Heinemann, 2001).
Зонель О. и Гарсайд Дж. Осадки: основные принципы и промышленное применение (Баттерворт-Хайнеманн, 1992).
Пенг, X. Механизмы контроля формы и эволюции формы коллоидных полупроводниковых нанокристаллов. Adv. Матер. 15 , 459–463 (2003).
CAS Статья Google ученый
Майерсон А.С. и Траут Б.Л. Зарождение нуклеации из раствора. Наука 341 , 855–856 (2013).
CAS Статья Google ученый
Гебауэр, Д., Фёлькель, А. и Кёльфен, Х. Стабильные кластеры карбоната кальция до нуклеации. Наука 322 , 1819–1822 (2008).
CAS Статья Google ученый
Kaplan, C. N. et al. Контролируемый рост и форма выпадающих микроскульптур. Наука 355 , 1395–1399 (2017).
CAS Статья Google ученый
Ли С. М., Чо С. Н. и Чеон Дж. Контроль анизотропной формы коллоидных неорганических нанокристаллов. Adv. Матер. 15 , 441–444 (2003).
CAS Статья Google ученый
Pauling, L. General Chemistry (Courier Corporation, 1988).
Чжан, X. и Се, Y. Последние достижения в области отдельно стоящих двумерных кристаллов атомной толщины: разработка, сборка и стратегии переноса. Chem. Soc. Ред. 42 , 8187–8199 (2013).
CAS Статья Google ученый
Guan, H. et al. Октаэдрические наноклетки CoO для высокопроизводительных литий-ионных аккумуляторов. Chem. Commun. 48 , 4878–4880 (2012).
CAS Статья Google ученый
Jiang, J. et al. Прямой синтез массивов пористых нанопроволок CoO на Ti-подложке и их применение в качестве электродов литий-ионных аккумуляторов. J. Phys. Chem. С 114 , 929–932 (2009).
Артикул Google ученый
Яо В., Ян Дж., Ван Дж. И Нули Ю. Многослойные пластинки из оксида кобальта для материала отрицательного электрода литий-ионной батареи. J. Electrochem. Soc. 155 , A903 – A908 (2008).
CAS Статья Google ученый
Qiao, H. et al. Однореакторный синтез гибридных микросфер CoO / C в качестве анодных материалов для литий-ионных аккумуляторов. J. Источники энергии 185 , 486–491 (2008).
CAS Статья Google ученый
Wu, F. D. и Wang, Y. Самособирающиеся эхиноподобные наноструктуры мезопористых наностержней CoO @ CNT для литий-ионных батарей. J. Mater. Chem. 21 , 6636–6641 (2011).
CAS Статья Google ученый
Sun, Y., Hu, X., Luo, W. и Huang, Y. Самособирающиеся мезопористые нанодиски CoO в качестве долговечного анодного материала для литий-ионных аккумуляторов. J. Mater. Chem. 22 , 13826–13831 (2012).
CAS Статья Google ученый
Liu, J. et al. Самособирающиеся пористые иерархически подобные микросхемы CoO @ C, преобразованные из неорганических органических прекурсоров, и их применение в литий-ионных батареях. CrystEngComm 14 , 2669–2674 (2012).
CAS Статья Google ученый
Cao, K. et al. Литий-ионные аккумуляторы сверхвысокой емкости с иерархическими кластерами нанопроволок CoO в качестве электродов без связующего. Adv. Func. Матер. 25 , 1082–1089 (2015).
CAS Статья Google ученый
Сванте Август Аррениус | Институт истории науки
В 1903 году Сванте Август Аррениус (1859–1927) получил Нобелевскую премию по химии за свою электролитическую теорию диссоциации, согласно которой молекулы кислот, оснований и солей диссоциируют на ионы при растворении в воде.
Он также был одним из первых исследователей эффектов увеличения содержания углекислого газа в атмосфере, предполагая, что температура воздуха повысится, что, по его мнению, окажет положительное влияние на холодный климат Швеции.
Ранние теории электролитической диссоциации
Аррениус получил образование как по химии, так и по физике. Он начал в университете Упсалы, но затем подал прошение о работе в Шведской королевской академии наук в Стокгольме, потому что он нашел профессоров химии в университете жесткими и скучными.
Его докторская диссертация, представленная в 1883 году, описывала его экспериментальную работу по электропроводности разбавленных растворов; он также содержал умозрительный раздел, в котором излагалась ранняя форма его теории о том, что молекулы кислот, оснований и солей диссоциируют на ионы, когда эти вещества растворяются в воде — в отличие от идеи Майкла Фарадея и других, что ионы образуются только когда электрический ток начинает течь. Согласно Аррениусу, кислоты были веществами, которые содержали водород и давали ионы водорода в водном растворе; основания содержали группу ОН и давали гидроксид-ионы в водном растворе.
Аррениус, Оствальд и Вант Хофф
Диссертация Аррениуса была холодно принята руководством университета и чуть не испортила его перспективы академической карьеры. В то время его теория многим казалась невероятной, потому что, помимо прочего, раствор хлорида натрия не обладает ни натриевыми, ни хлорными характеристиками. Кроме того, профессора, которых он избегал в своих исследованиях, не были к нему благосклонны.
Но он предусмотрительно отправил копии своей диссертации нескольким химикам из разных стран, и некоторые были впечатлены его работой, в том числе молодые химики Вильгельм Оствальд и Якобус Хенрикус ван’т Хофф, которые также должны были стать отцами-основателями физической химии. .Оствальд предложил Аррениусу должность в Риге, Латвия, которую Аррениус не мог принять тогда из-за болезни своего отца. Вместо этого ему дали должность в Швеции, а затем грант на поездку от Шведской академии, который позволил ему работать с Оствальдом и Ван’т Хоффом. Впоследствии он развил свою теорию электролитической диссоциации в количественном выражении и написал тексты, пропагандирующие физическую химию.
Дальнейшие исследования и Нобелевская премия
Аррениус также применил физико-химические принципы к изучению метеорологии, космологии и биохимии.В метеорологии он предвосхитил научный вывод о том, что увеличение концентрации парниковых газов в атмосфере вызывает глобальное потепление.
Хотя ему предлагали возможность переехать в другие европейские университеты, и он читал серию важных лекций в университетах США, Аррениус всегда возвращался в Стокгольм.
В 1903 году он получил Нобелевскую премию по химии, а в 1905 году он стал директором только что созданного Нобелевского института физической химии.
Информация, содержащаяся в этой биографии, последний раз обновлялась 14 ноября 2019 г.
7: Электропроводность водных растворов (эксперимент)
- Последнее обновление
- Сохранить как PDF
- Сильные электролиты
- Слабые электролиты
- Неэлектролиты
- Процедура
- Тестирование проводимости — свидетельство наличия ионов в водном растворе
- Лабораторный отчет: Электропроводность водных растворов
- Подтверждение проводимости — свидетельство Решение
- Вопросы
- Подтверждение проводимости — свидетельство Решение
Цели
- Для наблюдения за электропроводностью веществ в различных водных растворах
- Для определения в растворе сильного или слабого электролита
- Для интерпретации химической реакции путем наблюдения за проводимостью водного раствора.
Электропроводность основана на потоке электронов. Металлы являются хорошими проводниками электричества, потому что они позволяют электронам проходить через весь кусок материала. Таким образом, электроны текут сквозь металлы, как «море электронов». Для сравнения, дистиллированная вода — очень плохой проводник электричества, поскольку через воду проходит очень мало электричества. Сильноионизированные вещества — это сильные электролиты . Сильные кислоты и соли являются сильными электролитами, поскольку они полностью ионизируются (диссоциируют или разделяются) в растворе.Ионы переносят электрический заряд через раствор, создавая электрический ток. При достаточном токе загорится один или оба светодиода на измерителе проводимости , показанном справа.
Слабоионизированные вещества — это слабые электролиты . Слабые кислоты и основания можно отнести к категории слабых электролитов, потому что они не полностью диссоциируют в растворе.
Вещества, не проводящие электрический ток, называются неэлектролитами .Неэлектролиты не ионизируются; они не содержат подвижных ионов. Светодиоды кондуктометра не горят, потому что нет ионов, переносящих электрический ток. В таблице ниже приведены примеры сильных, слабых и неэлектролитов.
Сильные электролиты
Сильные кислоты
Кислота соляная | \ (\ ce {HCl} \) ( водн. ) |
Кислота бромистоводородная | \ (\ ce {HBr} \) ( водн. ) |
Йодоводородная кислота | \ (\ ce {HI} \) ( водн. ) |
Азотная кислота | \ (\ ce {HNO3} \) ( водн. ) |
Серная кислота | \ (\ ce {h3SO4} \) ( вод. ) |
Хлорная кислота | \ (\ ce {HClO4} \) ( водн. ) |
Хлорная кислота | \ (\ ce {HClO3} \) ( водн. ) |
Прочные основания
Натрия гидроксид | \ (\ ce {NaOH} \) ( водн. ) |
Гидроксид калия | \ (\ ce {KOH} \) ( водн. ) |
Гидроксид кальция | \ (\ ce {Ca (OH) 2} \) ( водн. ) |
Гидроксид бария | \ (\ ce {Ba (OH) 2} \) ( водн. ) |
Соли растворимые
Натрия хлорид | \ (\ ce {NaCl} \) ( водн. ) |
Карбонат калия | \ (\ ce {K2CO3} \) ( водн. ) |
Сульфат меди (II) | \ (\ ce {CuSO4} \) ( водн. ) |
Слабые электролиты
Слабые кислоты
Уксусная кислота | \ (\ ce {HC2h4O2} \) ( водн. ) |
Угольная кислота | \ (\ ce {h3CO3} \) ( водн. ) |
Лимонная кислота | \ (\ ce {C6H8O7} \) ( водн. ) |
Фосфорная кислота | \ (\ ce {h4PO4} \) ( водн. ) |
Слабые основания
Аммиак | \ (\ ce {Nh4} \) ( водн. ) |
Гидроксид аммония | \ (\ ce {Nh5OH} \) ( водн. ) |
Гидроксид магния | \ (\ ce {Mg (OH) 2} \) ( водн. ) |
| Большинство других баз |
Слаборастворимые соли
Хлорид серебра | \ (\ ce {AgCl} \) ( s ) |
Карбонат кальция | \ (\ ce {CaCO3} \) ( s ) |
Сульфат бария | \ (\ ce {BaSO4} \) ( s ) |
Неэлектролиты
Вода дистиллированная | \ (\ ce {h3O} \) ( л ) |
Метанол | \ (\ ce {Ch4OH} \) ( вод. ) |
Процедура
Материалы и оборудование
кондуктометр, промывочная бутыль с дистиллированной водой, большой стакан для ополаскивания / слива, маленькие стаканы, Kimwipes, твердый хлорид натрия, твердый карбонат кальция
Растворы: уксусная кислота, нитрат алюминия, гидроксид аммония, гидроксид кальция, лимонная кислота, этанол, соляная кислота, гидроксид магния, сульфат магния, азотная кислота, йодид калия, хлорид натрия, гидроксид натрия, сахароза
Безопасность
Будьте осторожны с соляной кислотой, азотной кислотой, серной кислотой и концентрированной уксусной кислотой.Несмотря на низкую концентрацию, некоторые люди могут иметь чрезмерную чувствительность кожи. Если вы чувствуете покалывание или обесцвечивание кожи, немедленно промойте большим количеством воды в течение 15 минут. Сообщите своему инструктору как можно скорее.
Необходимые средства индивидуальной защиты (СИЗ): лабораторный халат, защитные очки, обувь с закрытым носком
Тестирование проводимости — свидетельство наличия ионов в водном растворе
- Измеритель имеет батарею 9 В и два параллельных медных электрода.Используйте промывочную бутылку с дистиллированной водой и большой стакан с надписью «отходы», чтобы промыть медные электроды. Высушите салфеткой Kimwipe. При включении фары не должны гореть ни одного цвета. Если они есть, повторите промывку и сушку.
Примечание
НЕ ПОДВЕРГАЙТЕ ЭЛЕКТРИЧЕСКУЮ ПЛАТУ ВОДЕ. Промывать водой следует только медные электроды.
- Поместите измеритель так, чтобы печатная плата была обращена вверх (батарея будет внизу). Всегда размещайте измеритель таким образом, чтобы печатная плата не намокала.На этой стороне есть руководство по возможным измерениям проводимости:
| Масштаб | Красный светодиод | Зеленый светодиод | Электропроводность |
|---|---|---|---|
| 0 | от | от | низкий или нет |
| 1 | тусклый | от | низкий |
| 2 | средний | от | средний |
| 3 | светлый | тусклый | высокая |
| 4 | очень яркий | средний | очень высокий |
Примечание
Включите измеритель и опустите медные электроды, чтобы проверить проводимость.Тщательно промойте дистиллированной водой после каждого теста и просушите салфеткой Kimwipes. Выключайте глюкометр между использованием.
- Налейте 5 мл дистиллированной воды в небольшой чистый стакан. Протестируйте и запишите свои результаты.
- Налейте 5 мл водопроводной воды в небольшой чистый стакан. Протестируйте и запишите свои результаты.
- Поместите около 0,2 г твердого хлорида натрия (\ (\ ce {NaCl} \)) в небольшой чистый стакан и проверьте проводимость. Добавьте к хлориду натрия 5 мл дистиллированной воды; проверить проводимость раствора.Слейте раствор в раковину и промойте стакан.
- Поместите около 0,2 г твердого карбоната кальция (\ (\ ce {CaCO3} \) в небольшой чистый стакан и проверьте проводимость. Добавьте 5 мл дистиллированной воды в карбонат кальция; проверьте проводимость раствора. Утилизируйте этот раствор. в раковину и ополосните стакан.
- Используйте по 5 мл каждого из следующих веществ в стакане емкостью 100 мл для проверки электропроводности.
Обязательно ополаскивайте и сушите электроды между тестами, используя промывочную емкость со стаканом для отходов и салфетки Kimwipes.
Утилизируйте раствор и промойте стакан в раковине между тестами. Утилизируйте раствор для отработанного химического стакана вместе с неопасными отходами в вытяжном шкафу.
- уксусная кислота, 0,1 M \ (\ ce {HC2h4O2} \)
- нитрат алюминия, 0,1 M \ (\ ce {Al (NO3) 3} \)
- гидроксид аммония, 0,1 M \ (\ ce {Nh5OH} \) ( водн. )
- гидроксид кальция, насыщенный \ (\ ce {Ca (OH) 2} \)
- лимонная кислота, 0,1 М \ (\ ce {C6H8O7} \)
- этанол, \ (\ ce {Ch4Ch3OH} \)
- соляная кислота, 0.1 M \ (\ ce {HCl} \)
- гидроксид магния, насыщенный \ (\ ce {Mg (OH) 2} \)
- сульфат магния, 0,1 M \ (\ ce {MgSO4} \)
- азотная кислота, 0,1 M \ (\ ce {HNO3} \)
- иодид калия, 0,1 M \ (\ ce {KI} \)
- хлорид натрия, 0,1 M \ (\ ce {NaCl} \)
- гидроксид натрия, 0,1 M \ (\ ce {NaOH} \)
- сахароза, 0,1 M \ (\ ce {C12h32O11} \)
Лабораторный отчет: Электропроводность водных растворов
Тестирование проводимости — свидетельство наличия ионов в водном растворе
Раствор | Наблюдения: красный светодиод | зеленый светодиод | Электропроводность | Сильный, слабый или неэлектролитный | Ионизированный, частично ионизированный или неионизированный |
|---|---|---|---|---|
примеров: \ (\ ce {LiOH} \) ( вод. ), \ (\ ce {HNO2} \) ( водн. ), метанол (л) | красный яркий, зеленый тусклый красный тусклый, зеленый выкл красный выкл, зеленый выкл | высокий / низкий / нет | сильный электролит / слабый электролит / неэлектролит | ионизированный / частично ионизированный / неионизированный |
вода дистиллированная, \ (\ ce {h3O} \) ( л ) | ||||
водопроводная вода, \ (\ ce {h3O} \) ( л ) | ||||
твердый хлорид натрия, \ (\ ce {NaCl} \) ( s ) | ||||
раствор хлорида натрия, \ (\ ce {NaCl} \) ( водн. ) | ||||
твердый карбонат кальция, \ (\ ce {CaCO3} \) ( s ) | ||||
раствор карбоната кальция, \ (\ ce {CaCO3} \) ( водн. ) | ||||
уксусная кислота, \ (\ ce {HC2h4O2} \) ( водн. ) |
нитрат алюминия, \ (\ ce {Al (NO3) 3} \) ( водн. ) | ||||
гидроксид аммония, \ (\ ce {Nh5OH} \) ( водн. ) | ||||
гидроксид кальция, \ (\ ce {Ca (OH) 2} \) ( водн. ) | ||||
угольная кислота, \ (\ ce {h3CO3} \) ( водн. ) | ||||
этанол, \ (\ ce {Ch4Ch3OH} \) | ||||
соляная кислота, \ (\ ce {HCl} \) ( водн. ) | ||||
гидроксид магния, \ (\ ce {Mg (OH) 2} \) ( водн. ) | ||||
сульфат магния, \ (\ ce {MgSO4} \) ( водн. ) | ||||
азотная кислота, \ (\ ce {HNO3} \) ( водн. ) | ||||
йодид калия, \ (\ ce {KI} \) ( водн. ) | ||||
хлорид натрия, \ (\ ce {NaCl} \) ( водн. ) | ||||
гидроксид натрия, \ (\ ce {NaOH} \) ( водн. ) | ||||
сахароза, \ (\ ce {C12h32O11} \) ( водн. ) |
Вопросы
- Почему электроды на кондуктометрическом аппарате, а также все стаканы необходимо промывать дистиллированной водой после каждого теста на электропроводность?
- Почему дистиллированная вода более слабый проводник, чем водопроводная вода?
- Почему твердый хлорид натрия действует как неэлектролит, тогда как водный, а водный раствор \ (\ ce {NaCl} \) действует как сильный электролит?
- Классифицируйте каждый из следующих элементов как неионизированный, частично ионизированный или ионизированный .- (водн.)} \)
- \ (\ ce {HCl} \) ( aq ) — сильная кислота
- \ (\ ce {Ca (OH) 2} \) ( aq ) — сильное основание
- \ (\ ce {HC2h4O2} \) ( aq ) — слабая кислота
- \ (\ ce {Ba (OH) 2} \) ( aq ) — слабое основание
- Для химической реакции
\ [\ ce {h3SO4 (водн.) + 2 NaOH (водн.) -> Na2SO4 (водн.) + 2 h3O (l)} \]
Напишите полное ионное уравнение:
Напишите чистое ионное уравнение:
- Для химической реакции
\ [\ ce {KNO3 (водн.) + NaCl (водн.) -> NaNO3 (водн.) + KCl (водн.)} \]
Напишите полное ионное уравнение:
Напишите чистое ионное уравнение:
Растворы электролитов и неэлектролитов | Протокол
4.6. Растворы электролитов и неэлектролитов
Вещества, которые претерпевают физические или химические изменения в растворе с образованием ионов, способных проводить электричество, называются электролитами. Если вещество выделяет ионы в растворе, то есть если соединение подвергается 100% диссоциации, то это вещество является сильным электролитом. Полная диссоциация обозначена единственной стрелкой, направленной вперед. Например, водорастворимые ионные соединения, такие как хлорид натрия, диссоциируют на катионы натрия и анионы хлорида в водном растворе.
Другими примерами сильных электролитов являются гидроксиды металлов группы 1 и группы 2, а также сильные кислоты, такие как HCl и HNO 3 .
Если только крошечная часть вещества диссоциирует на ионы, то есть если соединение подвергается частичной диссоциации в растворе, это называется слабым электролитом. На частичную диссоциацию указывает обратимая стрелка. Например, слабые кислоты, такие как уксусная кислота, частично ионизируются в воде с образованием ионов ацетата и ионов гидроксония.
Другими примерами слабых электролитов являются плохо растворимые соли, такие как AgCl и PbCl 2 , и слабые основания, такие как аммиак.
Электростатическое притяжение между ионом и молекулой с диполем, называемое ионно-дипольным притяжением, играет важную роль в растворении ионных соединений в воде. Когда ионные соединения растворяются в воде, ионы в твердом веществе разделяются и равномерно диспергируются по всему раствору, поскольку молекулы воды окружают и сольватируют ионы, уменьшая сильные электростатические силы между ними.
Растворы ковалентных соединений проводят электричество, потому что молекулы растворенных веществ химически реагируют с растворителем с образованием ионов. Например, чистый хлористый водород — это газ, состоящий из ковалентных молекул HCl. Этот газ не содержит ионов. Однако водный раствор HCl является очень хорошим проводником, что указывает на то, что в растворе существует значительная концентрация ионов.
Поскольку HCl представляет собой кислоту, ее молекулы реагируют с водой, передавая ионы H + с образованием ионов гидроксония (H 3 O + ) и ионов хлорида (Cl — ):
Эта реакция практически на 100% завершена для HCl (сильного электролита).Точно так же слабые кислоты и основания, которые реагируют только частично, при растворении в воде генерируют относительно низкие концентрации ионов и классифицируются как слабые электролиты.
Вещества, не выделяющие ионы при растворении в воде, называются неэлектролитами. Такие вещества растворяются в растворе как нейтральные молекулы, каждая из которых окружена молекулами воды. Например, такое молекулярное соединение, как сахароза, растворяется в воде в виде целых молекул.
Таким образом, вещества могут быть определены как сильные, слабые или неэлектролиты путем измерения электропроводности водного раствора, содержащего это вещество.Чтобы проводить электричество, вещество должно содержать свободно подвижные заряженные частицы. Наиболее знакомо проведение электричества по металлическим проводам, и в этом случае подвижными заряженными объектами являются электроны. Растворы также могут проводить электричество, если они содержат растворенные ионы, причем проводимость увеличивается с увеличением концентрации ионов. Подача напряжения на электроды, погруженные в раствор, позволяет оценить относительную концентрацию растворенных ионов либо количественно, измеряя электрический ток, либо качественно, наблюдая за яркостью лампочки, включенной в цепь.
Этот текст адаптирован из Openstax, Chemistry 2e, раздел 11.2: Электролиты.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
«Подсчет ионов» в координационной химии Альфреда Вернера с использованием измерений электропроводности
Введение Краткий обзор жизни и личности Альфреда ВернераАльфред Вернер считается основателем координационной химии. Он поднял целую область химии от темного и мистического восприятия до уровня светлого и рационального существа. Чтобы достичь этого, ему оставалось совсем немного времени на то, чтобы он жил интенсивной жизнью, которая была в основном посвящена химии (Kauffman, 1979; 1994).Альфред Вернер был искренним ученым. Все его усилия были движимы сильным любопытством, что делало его постоянным искателем новинок в науке. Основными источниками его химического творчества были интуитивные умозаключения и концептуальное мышление, которые сделали его исследования очень эффективными. В связи с этим многие современники сообщали, что Альфред Вернер был человеком огромного воображения и вдохновения.
Основные этапы его жизни перечислены в следующем сборнике, который будет упоминаться в более позднем контексте этой статьи:
Убежище Альфреда ВернераАльфред Вернер был химиком, всегда пытавшимся заглянуть в другие области науки.В его время физика была на пороге превращения в количественную дисциплину, которая его очень привлекала. Возможно, это было его не столь сознательно выраженное желание, но неуклонно продвигавшееся в химии, чтобы вывести химию, особенно координационную химию, из мира качественных и в то время часто даже плохо определенных и мистических представлений в сторону более количественной и более определенной науки. Брак химии с физикой — это физическая химия, которая имела место примерно в начале научной карьеры Альфреда Вернера в 1880-х годах вместе с тенденциями количественной оценки в физике.Взгляд через забор на физику означал, что Альфред Вернер рассматривал химию более количественно через физические измерения, но также понимал ее более концептуально и фундаментально.
Хорошим, но не полностью завершенным примером этого последнего понятия являются разработки его теории координации, которая действительно выражает тенденцию к тому, чтобы более ранняя теория координации Блумстранда-Йоргенсена (Kauffman, 2003; Berke, 2009) была более приспособлена к физическим условиям. реальность путем переноса координационной химии из двухмерного пространства («плоские молекулы») в трехмерное пространство, изобретая, таким образом, стереохимию координационных соединений.
В этом контексте и имея в виду данное убеждение, Альфред Вернер осознал тот факт, что его новые стереохимические взгляды на координационные соединения нуждаются также в новой теории связывания для комплексов, которую он, в конце концов, создал. Он попытался достичь более количественного взгляда на неорганическую и координационную химию (Werner, 1905), но по своей сути теория связывания Альфреда Вернера смогла, наконец, достичь этого, хотя она и не была полностью построена на твердых физических основаниях. Его теория координации могла служить эвристическим репрезентативным методом для обширного сопоставления реальности с выводами по аналогии, но не могла служить для большего.Атомистическая физическая картина химической связи не существовала во времена Альфреда Вернера и не существовала по частям, что «вынудило» Альфреда Вернера стремиться восполнить этот недостаток с физической стороны. Несмотря на то, что концептуальное мышление Альфреда Вернера намного опережало свое время, и его «теория координации», созданная на рубеже 1892 года (опубликованная в 1893 году), наконец достигла согласованности сама по себе, она не могла справиться с фактическим физическим уровнем, например времена 1920-х годов, когда квантовая физика вызвала развитие новой картины молекул.Теория координации Альфреда Вернера не достигла того уровня количественной оценки и сложности, которые требовались для того, чтобы стать всеобъемлющей. Это, например, критиковал в свое время его аспирант А. Пфайффер, ставший впоследствии его коллегой (Вернер, 1923). В принципе, в его теории не было ничего неправильного, но, как уже было сказано, уровень сложности был недостаточно высок, чтобы выжить навсегда. Теория Альфреда Вернера около 20 лет служила хорошо принятой индуктивной формулой, используемой в качестве ценной платформы для создания идей и объяснений.
Еще одним, так сказать, «истинным» примером, более подходящим для демонстрации взглядов Альфреда Вернера через забор в сторону физики, была УФ-видимая спектроскопия (во времена Альфреда Вернера называлась спектральный анализ (Spektralanalyse)), которую он пытался реализовать как структурный анализ. метод характеристики комплексов в его группе (Fox, Berke, 2014). Альфред Вернер заинтересовался этим методом в период с 1912 по 1914 год, который в то время был известен как метод спектральной характеристики только органических соединений и неорганических твердых веществ.Но после 1914 года Альфред Вернер прекратил исследования с помощью УФ-видимой спектроскопии. Мы не знаем истинной причины этого, но можем предположить, что в то время УФ-видимая спектроскопия казалась слишком трудоемкой с учетом того, чего можно было достичь в отношении выяснения структур координационных соединений.
Эти два примера физического влияния на исследования Альфреда Вернера сопровождались поисками количественной оценки неорганической и, в частности, координационной химии. Но эти примеры были не единственными новыми физическими методами, которые Альфред Вернер продвигал для применения в координационной химии в своей группе: на очень раннем этапе своей научной карьеры Альфред Вернер познакомился с кондуктометрией или измерениями электропроводности, что заставило его попробовать рассмотреть брак координационной химии с электролитической диссоциацией в растворе.Применение электропроводности в координационной химии является основной темой этой статьи, широко известной как «подсчет ионов» ионных комплексов в воде. Этот метод оказался полезным для структурной характеристики комплексов.
Электропроводность координационных соединений в воде и значение электролитической диссоциации для развития координационной теории Альфреда ВернераТот факт, что многие координационные соединения представляют собой соли, которые разделяются на ионы в воде, делает их идеальным примером для изучения электропроводности.Альфред Вернер, основатель координационной химии, осознал это обстоятельство на очень раннем этапе своей научной карьеры и провел исследования по этому вопросу еще до того, как стал адъюнкт-профессором в Цюрихском университете в 1893 году. Его любопытство, импульс и близость к физическому и физическому развитию. Методологии физической химии заставили Альфреда Вернера задуматься о полезности электропроводности в координационной химии, как только он узнал о возможности определения электролитической диссоциации, и это произошло, когда он стал членом группы Артура Ханча, сначала как аспирант, а затем в качестве «Habilitand» (аналогично несостоявшемуся доценту) в Политехникуме в Цюрихе (сегодня называется Eidgenössische Technische Hochschule Zürich (сокращенно ETH Zurich).Там он встретил Артуро Миолати из Турина, который был в группе Артура Ганча с 1899 г. и вернулся в Италию в 1893 г., чтобы присоединиться к группе молодых химиков Института химии Римского университета, возглавляемой С. Канниццаро. После этого Артуро Миолати стал профессором в Турине и Падуе (Кауфман, 1970). Артуро Миолати был гениальным универсалом. В течение своей научной жизни он работал во многих областях химии, но никогда полностью не покидал области координационной химии и электропроводности.Его часто называют первым физиком-химиком Италии.
Сотрудничество Альфреда Вернера и Артуро Миолати оказалось очень плодотворным и завершилось несколькими совместными работами. Основными из них являются «Beiträge zur Konstitution anorganischer Verbindungen, Abhandlungen I. and II.», Которые были опубликованы в Zeitschrift für Anorganische Chemie в 1893 и 1894 годах (Miolati, 1893; 1894). Были опубликованы и другие отчеты, детализирующие фундаментальные идеи Альфреда Вернера (Miolati, 1896; 1897), включая статью с К.Херти (1901). Всю свою научную жизнь Альфред Вернер был очень благодарен Артуро Миолати за сотрудничество. Он не только посвятил первое издание своей книги (Вернер, 1905) Артуро Миолати, но также был благодарен Артуро Миолати за его Нобелевскую лекцию на немецком языке в Стокгольме в 1913 году. В этом выступлении он также дал объяснение. о том, как измерения электропроводности повлияли на его теорию координации. Для лучшего понимания немецкий текст соответствующей части Нобелевской лекции дан здесь в виде отрывка, переведенного на английский язык, главное предложение в глазах автора этой статьи также дано на немецком языке (Werner, 1913; 1914):
Разнообразная функция кислотных остатков (комментарий автора: «кислотные остатки» здесь означают анионные лиганды) в обсуждаемых соединениях может, в соответствии с электролитической теорией диссоциации, выдвинутой вашим знаменитым членом, профессором Аррениусом, также быть интерпретируется постулированием, что кислотные остатки, находящиеся в прямой связи с атомом металла, не диссоциируют в растворе, тогда как те, которые не связаны напрямую с атомом металла, встречаются как независимые ионы.Следовательно, должна быть возможность предоставить экспериментальные физико-химические доказательства сделанных выводов путем определения электролитической проводимости. Результат исследования, проведенного мной совместно с моим другом А. Миолати, полностью подтвердил наши выводы, поскольку мы обнаружили, что соединения, в которых предполагалось, что они содержат все кислотные остатки, непосредственно связанные с атомом металла, так мало диссоциированы. электролитически, что они ведут себя практически как непроводники. Позднее этот важный результат был вновь подтвержден совместным исследованием с Ч.Херти. Таким образом мы получили экспериментальную основу, на которой могла бы быть основана новая теория строения неорганических соединений…
Последнее предложение данного отрывка Нобелевской лекции очень важно, поэтому оно также дано на немецком языке. :
Damit war die sichere Experimentelle Grundlage gewonnen auf der das neue Lehrgebäude von der Konstitution der anorganischen Verbindungen errichtet werden konnte.
Здесь Альфред Вернер говорил, что электрическая проводимость имеет решающее значение для развития его новой теории координации, которая, по сути, различает первичную и вторичную валентности лигандов в комплексах (Вернер, 1905).Согласно этому, анионные лиганды, непосредственно связанные с атомами металлов, были связаны первичным образом, в то время как нейтральные лиганды типа основания Льюиса в современной терминологии были связаны с атомами металлов в комплексах вторичным способом. Теперь становится ясно, как Альфред Вернер рассматривал электропроводность как подходящий метод для «надежного основания» своей теории координации. Следуя рисунку, объясненному в Нобелевской лекции (Вернер, 1913), как и во всех изданиях своей книги (Вернер, 1905), первично связанный анионный лиганд также может быть заменен лигандом вторичного валентного типа; более ранний останется за пределами координационной сферы, следовательно, комплексная единица приобрела за счет этого электрический заряд, и весь комплекс стал бы электролитом.С помощью этого формализма можно установить целый ряд последующих замен, как показано на рис. 1 (взятом из Нобелевской лекции, стр. 6 немецкой версии), с достижением различных зарядов сложных единиц и путем электролитической диссоциации различных общих количеств ионов одно соединение.
Каждый из видов, представленных на рис. 1, в принципе может отличаться электропроводностью, которая в первом приближении кажется по своей величине зависимой только от общего числа ионов, на которые каждое отдельное соединение может электролитически диссоциировать.
Помимо стереохимических аспектов координационных соединений, различие между первичной и вторичной валентностями комплексов было сутью координационной теории Альфреда Вернера и сложного ряда, как показано на рис. 1, которое подтвердило вместе с измерениями проводимости понятие его теории. После краткого описания устройства Альфреда Вернера для измерения электропроводности в главе 3, в главах 4 и 5 будет рассказано о нескольких примерах сложных серий, показанных на рис.1.
Основная установка прибора Альфреда Вернера для измерения электропроводности растворов координационных соединенийКак упоминалось ранее, первые измерения электропроводности Альфредом Вернером проводились вместе с Артуро Миолати в 1898-1891 гг. магистр химии и докторская диссертация) в группе Артура Ханча в ETH Zurich. В течение двух лет Альфред Вернер, в то время также входивший в группу Артура Ханча, был старшим после Артуро Миолати.Прибор для измерения электропроводности, использованный и показанный на рис. 2, уже существовал в группе Артура Ханча, который, например, использовался для определения кислотности оксимов (Hantzsch, and Miolati, 1893), что также является частью научной работы Артуро Миолати.
Устройство для измерения проводимости было основано на конструкции, предложенной Вильгельмом Оствальдом из Лейпцигского университета, Германия, занимавшего одну из первых кафедр физической химии в Европе с 1887 года. Устройство было усовершенствованием так называемого моста Кольрауша.Это схематично показано на схеме 1, взятой из оригинальной публикации Вильгельма Оствальда (Ostwald, 1892).
Устройство для измерения проводимости состояло из источника переменного тока (индукционный прибор, совмещенный с молотком Вагнера) (6), электролитической ячейки (в термостатической ванне) (2) с пластинчатыми электродами (5), погружаемыми в клетка. Измерения были физически основаны на параллельных резисторах от ячейки и реостатического устройства, состоящих из резисторов фиксированного номинала (1) и переменного резистора реостата (3).Когда так называемый телефон (4), который был физически эквивалентен зуммеру, показывал самый низкий уровень гудящего шума (тон, зависящий от частоты переменного тока), известное удельное сопротивление или его обратное значение, проводимость, реостатного устройство и неизвестное удельное сопротивление измерительной ячейки, включая электроды, по-видимому, были одинаковыми. Поскольку вода, используемая в качестве растворителя, в то время часто была не очень чистой, ее проводимость приходилось измерять отдельно и вычитать из определенных значений для электролита.Согласно Вильгельму Оствальду, данный прибор можно было построить без больших финансовых вложений, а измерения можно было бы провести быстро (Оствальд, 1892). Эта ситуация также облегчила бы Альфреду Вернеру создание прибора для измерения электропроводности на более позднем этапе его карьеры после того, как он перешел в Цюрихский университет в качестве адъюнкт-профессора в 1893 году, основав свою собственную исследовательскую группу. Независимо от того, построил ли он наконец прибор для измерения электропроводности в Цюрихском университете в своей группе или использовал прибор из Физического института Цюрихского университета (рис.3) или продолжал ли он пользоваться аппаратом от группы Hantzsch в ETH — неизвестно.
Во времена Альфреда Вернера все эти институты или учреждения располагались в Цюрихе в непосредственной близости, что не создавало больших препятствий для использования приборов «друг друга». Измерения проводимости проводились путем измерения молярной проводимости. Это условие позволяло подсчитать количество ионов на моль комплекса, но часто казалось невозможным сравнить абсолютные значения этих измерений с данными, полученными с помощью других установок (Peterson, 1901).В своих публикациях и во всех изданиях своей книги Альфред Вернер (1905) ссылался на значения μ без обозначений, которые, как предполагается, относятся к сущности молярной проводимости, установленной Фридрихом Кольраушем (1927). Однако в наше время молярная проводимость имеет обозначение [S-L / cm-mol], что означает, что всегда существует постоянная, установленная устройством, которую необходимо учитывать. Если эта константа явно не сообщается, ожидается, что измерения дадут только сравнимые числа, когда измерения проводились с одним и тем же устройством, но при смене измерительного устройства будут несопоставимые числа.По-видимому, в этом заключалась основная трудность Альфреда Вернера, когда он сравнивал свою работу с работами других людей того времени (Peterson, 1901).
Примеры измерений электропроводности комплексов Альфредом Вернером и Артуро МиолатиАльфред Вернер и Артуро Миолати описали в своей первой соответствующей публикации «Beitrage zur Konstitution anorganischer Verbindungen» I. Abhandlung ’(Werner, and Miolati, 1893) кондуктометрическое определение молярных проводимостей координационного ряда соединений амминхлорокобальта и амминхлорплатины (II) и (IV).Они вывели их из измерений существования постоянного координационного числа для каждой из этих сложных серий. Фактически это было рождением термина «координационное число», которое стало очень фундаментальным для координационной химии. Здесь следует упомянуть, что в более ранней теории координации Бломстранда и Йоргенсена (Kauffman, 2003) термин координационное число не был известен. Кроме того, как объяснялось в более раннем контексте этой статьи, это число отличается от числа валентности, которое относится к максимальному количеству ковалентно связанных партнеров в комплексе, как это сформулировал вскоре Альфред Вернер.Однако эта статья «I. Абхандлунг явился первым исследовательским исследованием в этой области. Следует также отметить, что Альфред Вернер и Артуро Миолати должны были в этих первых экспериментах (как и во многих последующих экспериментах) бороться с техническими проблемами измерения проводимости, т.е. часто в значительной степени со временем. О причинах этого явления мы можем только догадываться, но очень рационально было бы предположить, что в качестве физической причины данный индукционный аппарат на рис.2 и 3 не обеспечивали стабильной альтернативной валюты. Кроме того, по химическим причинам комплексы часто были термодинамически и кинетически недостаточно стабильными, так что ко времени измерения комплексы изменили свой состав и привели к образованию различных частиц с различной молярной проводимостью.
Вторая статья в этой серии сотрудничества с Артуро Миолати была опубликована под тем же названием, что и первая статья (Beiträge zur Konstitution anorganischer Verbindungen ’II.Abhandlung ’) (Вернер и Миолати, 1894). Очевидно, для этой статьи экспериментальная отделка была подготовлена более стандартным способом, чтобы были получены более надежные значения проводимости и можно было сделать более определенные выводы. Это также согласуется с тем фактом, что многие эксперименты второй статьи были повторением первой статьи.
Совершенно не случайно, что Альфред Вернер и Артуро Миолати выбрали кинетически достаточно стабильный комплекс хлораминов Pt (II) из а), хлораминов Pt (IV) из б) и нитротоамминов Со (III) из в) для своих измерения (рис.4). Чем больше вовлеченное число ионов в комплексе, тем выше молярная проводимость была в пределах одного ряда, и изменения молярной проводимости одним ионом находились в определенном диапазоне, независимо от типа ионов. Таким образом, подсчет ионов с помощью измерений проводимости действительно может быть использован для установления состава комплексов, сообщающих нам с допущением о постоянном координационном числе, сколько ионов было лигандами, а сколько противоионами. Здесь следует отметить, что полная независимость молекулярной проводимости от типа иона привела к «почти» V-образной форме кривых на рис.4 и позволили структурные отнесения в пределах квадратной плоской четырехкоординированной серии а) или октаэдрической шестикоординированной сложной серии б) и в) просто на основе элементного анализа и электропроводности. Кроме того, следует упомянуть, что в некоторых случаях фиг. 4 полная серия замещения анионных остатков не могла быть получена из-за того, что соединения, необходимые для измерения, не были известны.
Примеры измерений электропроводности комплексов группы Альфреда Вернера в Цюрихском университетеВ группе Альфреда Вернера было подготовлено семь кандидатских диссертаций, которые, по крайней мере частично, также содержали измерения электропроводности координационных соединений группа, 1896-1902).
Следует отметить, что все эти процитированные кандидатские диссертации были подготовлены на ранней стадии карьеры Альфреда Вернера в течение первых 10 лет его пребывания в Цюрихском университете. Результаты только двух диссертаций были опубликованы в научных журналах (Werner and Gubser, 1901; 1906; Werner, Kalkmann and Gubser, 1902), и в большинстве кандидатских диссертаций измерения проводимости использовались как аналитический метод в контексте структурных заданий. для комплексов, что означает, что они просто время от времени применялись в кандидатских диссертациях и не имели главной цели — основать физико-химическую область кондуктометрии в неорганической химии.Здесь следует упомянуть, что в течение короткого периода времени в 1900 году в группе Альфреда Вернера был Ч. Херти (имя упоминается в Нобелевской лекции Альфреда Вернера, Вернер, 1913 г.), который ушел в творческий отпуск с химического факультета Франклина. Колледж, Франклин, США. Результатом этого сотрудничества стала одна публикация («Beiträge zur Konstitution anorganischer Verbindungen (IV. Abhandlung)») (Werner, 1901), в которой Х. Херти пытался установить в основном ряд проводимости комплексов аммина кобальта и этиленамина с хлоридом и роданидом в качестве анионных остатков.В большинстве случаев комплексы были кинетически нестабильными и меняли молярную проводимость в процессе эксперимента.
В качестве примера были выбраны две из «неопубликованных» кандидатских диссертаций для частичного рецензирования. Их заголовки показаны на рис. 5.
Ф. Беддоу и А. Р. Клиен приехали в Цюрихский университет из Соединенного Королевства, чтобы подготовить докторскую диссертацию в группе Альфреда Вернера. Оба тезиса можно переделать, поскольку диссертация Беддау была написана на английском языке, который в то время был довольно необычным языком в Цюрихском университете, в то время как диссертация Клиена была написана на немецком языке, который, по-видимому, был необычным языком для кандидатов наук.В их основные задачи входила подготовка новых комплексов. Однако оба они используются для структурных характеристик определенных ионных комплексов, а также электропроводности.
На рис. 6 (слева) показано, что измерения проводимости F. Beddow были выполнены с установлением рядов разбавления (столбцы v) в двух сериях с получением молярных проводимостей (столбец μ), которые были усреднены по двум сериям измерений. Структурное предложение Беддау, представленное на рис. 7, действительно будет представлять собой 3-ионный электролит на кобальт.Но предлагаемый мостиковый оксо-комплекс, похоже, не очень хорошо согласуется с реальностью современных знаний. Поэтому автор данной статьи предполагает, что структура комплекса в растворе может соответствовать нестабильному комплексу [(Nh4) 5 (OH) Co] Cl2, который может существовать в растворе в течение определенного периода времени (Миронов и др., 1995; Исаев и др., 1990; Норман, 1988).
На рис. 6 (справа) показано, что измерения электропроводности A.R. Klien снова были выполнены с рядами разбавления (столбец v) в двух сериях с получением молярных проводимостей (столбец μ), которые были усреднены по двум сериям измерений.Структурное предложение Клиена, представленное на рис. 7, действительно указывает на 2-ионный электролит. Это предложение кажется очень реалистичным и действительно соответствует структуре цис-нитрито (тиоцианато) тетрамминкобальтового комплекса.
ВыводыСтатья может наглядно продемонстрировать, что в то время, начиная с 1888 года, группа Альфреда Вернера и Артуро Миолати и Альфреда Вернера могла достаточно количественно определять электролитическую диссоциацию ионных комплексов путем измерения электропроводности.Применение этого типа измерений Альфредом Вернером было истолковано с точки зрения его особой склонности и любопытства к количественной оценке координационной химии с использованием физических методов. Благодаря этим измерениям стало возможным «подсчитывать ионы» определенного электролита, что также позволило определять структуры моноядерных комплексов на основе их координационных чисел. Данный структурный анализ пришел к выводу о количестве «анионных остатков», которые могут действовать как лиганды в комплексах или как противоионы комплексов.Измерения проводились Альфредом Вернером или его группой с помощью кондуктометра типа Оствальда, который в то время был дешевым прибором, и измерения можно было проводить быстро. Возникает вопрос, почему Альфред Вернер применил этот метод только между 1889 и 1902 годами, а не вообще на протяжении всей своей научной деятельности. Ответ можно только строить предположения, потому что, насколько известно автору, Альфред Вернер никогда не делал заявлений по этому поводу. Одна из причин, по-видимому, заключалась в том, что Альфред Вернер понял, что с помощью этого метода можно было бы сделать «безопасные» структурные выводы только для моноядерных комплексов.Но с 1900 года Альфред Вернер начал также проводить исследования полиядерных комплексов (Kauffman, 1973; Blacque, and Berke, 2014), для которых «подсчет ионов», возможно, помог более или менее только в процессе идентификации известного координационное соединение, но не для структурных предсказаний таких сложных видов. Более того, с 1900 года Альфред Вернер перешел также в область хиральности комплексов (Ernst, and Berke, 2011; Ernst, Wild, Blacque, and Berke, 2011). Для определения структуры и определения электропроводности энантиомеров метод определенно был неподходящим.Таким образом, чем больше продвигалась координационная химия в руках Альфреда Вернера, тем больше электропроводность теряла значение как аналитический метод для его химии. Его прогрессивная химия также больше касалась кинетически нестабильных (лабильных) комплексов, склонных к легкому обмену лигандами. Если бы первичный и вторичный лиганды могли быть заменены другим лигандом того же типа, электропроводность не указала бы на это должным образом, поскольку изменения электропроводности часто были незначительными. Например, вода в качестве лиганда во всех случаях, присутствующая в избытке в качестве растворителя, в конечном итоге делает метод непригодным для структурного отнесения, если комплексы имеют лабильные лиганды, такие как аммины.Наконец, следует предположить, что воздержание Альфреда Вернера от электропроводности на более позднем этапе своей карьеры могло также иметь отношение к физической нестабильности электропроводных устройств, особенно индукционных, что иногда могло приводить к большим экспериментальным расстройствам и даже неправильным интерпретациям. могло быть следствием этого обстоятельства. Сегодняшние кондуктометры лишены этого недостатка, они физически стабильны. Несмотря на все эти не столь положительные суждения об измерениях электропроводности координационных соединений, метод заслуживает большой признательности, поскольку измерения кинетически стабильных комплексов стали для Альфреда Вернера методом, на котором он мог основывать, а затем проверять свои идеи теории координации.В конце концов, это достижение принесло ему Нобелевскую премию.
ЭпилогСпустя более чем 100 лет после измерения проводимости Альфредом Вернером большого количества комплексов в растворе, стало возможным измерить проводимость одной молекулы комплекса (молекулярная проводимость), зажатого между золотыми электродами, используя, например, метод контролируемого разрыва соединения. (CBJ) (Рис.8, вверху). В отличие от измерений проводимости Альфреда Вернера, экспериментальные усилия по экспериментам CBJ огромны и ни в коем случае не могут проводиться как обычные химические эксперименты.Автор и его группа сотрудничают с группой H. Riel и E. Lörtscher, IBM Research, Rüschlikon, Switzerland, чтобы определить молекулярную проводимость металлоорганических соединений, подобных тем, которые схематически изображены на рис. 8, внизу (Schwarz et al. , 2014), в некотором роде последовав за Альфредом Вернером, который всегда добивался максимума в союзе физики и химии, или, точнее говоря, в координационной химии.

 1906), писатель
1906), писатель