9 класс Контрольная работа » Электролитическая диссоциация»
9 класс Контрольная работа №1
« Теория электролитической диссоциации»
Вариант 1
Часть А. Выбрать правильный ответ
А1. Слабым электролитом является
А2. Вещества, образующие при диссоциации в качестве анионов только гидроксид-ионы, являются А3. В результате диссоциации нитрата натрия образуются А4. Сульфат-ион образуется при диссоциации А5. Правильно записано полное ионное уравнение реакции, схема которойН2SО4 + LiОН → Li2SО4 + Н2О
А6. Реакция между растворами NaOH и HNO3 протекает до конца, так как А7. К образованию осадка приведет смешивание растворов, содержащих ионы А8.
Часть В
В1.Установить соответствие
В2.Установить соответствие
Часть С
C1. Определите вещество «Х» в цепочке превращений
гидроксид меди(II) → Х → сульфат меди(II).
Для реакции обмена составьте полное и сокращенное ионное уравнения
9 класс Контрольная работа №1
« Теория электролитической диссоциации»
Вариант 2
Часть А. Выбрать правильный ответ
А1. Сильным электролитом является
А2. Вещества, образующие при диссоциации в качестве катионов только ионы водорода, являются А3. Диссоциация какого вещества могла бы проходить в соответствии со схемойMe(OH)2 → Me2+ +2OH—
AgNO3 2)Ba(OH)2 3)Cu(OH)2 4)H2SO4
А4. Сульфид-ион образуется при диссоциации
Сульфид-ион образуется при диссоциации
1) SO4 2- , Fe 3+ 2) Na+, NO3—
3) Ca2+, Cl– 4) Cu2+, OH –
А8. Правильно записано полное ионное уравнение реакции, схема которой
НNО3 + NaОН → Na NО3 + Н2О
Часть В
В1. Установить соответствие:
В2. Установите соответствие
Установите соответствие
Часть С
C1.
Определите вещество «Х» в цепочке превращений
оксид калия → Х→ карбонат калия
Для реакции обмена составьте полное и сокращенное ионное уравнения
Часть А
А1Слабым электролитом является
HNO3
2)
H2S
3)
H2SO4
4)
HCl
А2. Веществом, при диссоциации которого в качестве катионов образуются только ионы Н+, является
HCl
2)
H3N
3)
H4C
4)
CaH2
А3. Наибольшее количество ионов Na+ образуется при диссоциации 1 моль
фосфата натрия
2)
гидроксида натрия
3)
сульфата натрия
4)
гидросульфида натрия
А4. Карбонат-ион образуется при диссоциации
Карбонат-ион образуется при диссоциации
А5. Сокращённому ионному уравнению Сu2+ + 2ОН— = Сu(ОН)2↓ соответствует реакция между
А6. Выделение газа наблюдается при сливании растворов
сульфата натрия и гидроксида бария
2)
гидроксида натрия и соляной кислоты
3)
карбоната калия и азотной кислоты
4)
гидроксида меди (II) и азотной кислоты
А7. Сумма положительных зарядов в правой части уравнения диссоциации сульфата железа (III) равна
1) +3 2) +4 3) +6 4) +2
А8.Сумма всех коэффициентов в молекулярном и сокращенном ионном уравнениях реакции между карбонатом кальция и соляной кислотой равна соответственно:
5 и 5
5 и 6
6 и 5
6 и 6
А9. Процессу восстановления соответствует схема:
1) H0→ H+2) Cu0 → Cu+23) N0 → N-34) C+2 → C+4
А10.
5
2)
2
3)
3
4)
4
Часть Б
Б1. Установите соответствие между исходными веществами и сокращенным ионным уравнением реакции между ними.
ИСХОДНЫЕ ВЕЩЕСТВА
СОКРАЩЕННОЕ ИОННОЕ УРАВНЕНИЕ
А)
сульфат цинка и гидроксид калия
1)
Ba2++ NO3– = BaNO3
Б)
карбонат калия и азотная кислота
2)
H+ + OH– = H
В)
сульфат калия и нитрат бария
3)
Zn2+ + 2OH– = Zn(OH)2
Г)
гидроксид бария и азотная кислота
4)
K+ + NO3– = KNO3
5)
Ba2+ + SO42– = BaSO4
6)
CO32– + 2H+ = CO2 + H2O
А
Б
В
Г
Б2Необратимо протекает взаимодействие растворов
гидроксида бария и серной кислоты
2)
сульфата натрия и азотной кислоты
3)
нитрата бария и хлорида калия
4)
карбоната калия и соляной кислоты
5)
сульфата магния и нитрата натрия
6)
хлорида алюминия и гидроксида калия
//Ответ:
Б3. Установите соответствие между уравнением реакции и веществом, являющимся восстановителем в каждом из них.
Установите соответствие между уравнением реакции и веществом, являющимся восстановителем в каждом из них.
УРАВНЕНИЕ РЕАКЦИИ
ВОССТАНОВИТЕЛЬ
А)
H2SO4 + Fe = Fe SO4 + H2
1)
Б)
Fe2O3 + 3H2 = 3H2O + 2Fe
2)
S
В)
Fe + S = FeS
3)
Fe
Г)
Fe + CuSO4 = FeSO4 + Cu
4)
H2SO4
5)
H2
6)
Fe2O3
Ответ запишите в виде таблицы:
Часть С
C1.
Определите вещество «Х» в цепочке превращений
Х→ СО2→ К2СО3
Для реакции обмена составьте полное и сокращенное ионное уравнения
Вариант 4
Часть А
А1Только сильные электролиты представлены в ряду
Cu(OH)2, NaCl, H3PO4
2)
FeCl3, H2S, NaOH
3)
Na2SO4, HNO3, NaOH
4)
KNO3, H3N, Mg(OH)2
А2.
 Слабым электролитом является
Слабым электролитом являетсяHNO3
2)
H2S
3)
H2
4)
HCl
А3. Наибольшее количество ионов ОН– образуется при диссоциации 1 моль
гидроксида бария
2)
гидроксида меди (II)
3)
гидроксида калия
4)
гидроксида серы (VI)
А4. Верны ли следующие суждения?
А. Серная кислота диссоциирует ступенчато.
Б. В растворе серной кислоты присутствуют только ионы H+ и SO42–.
верно только А
2)
верно только Б
3)
верны оба суждения
4)
оба суждения неверны
А5. Сокращённому ионному уравнению Н+ + ОН— = Н2О соответствует реакция между
А6.
 Выпадение осадка наблюдается при сливании растворов
Выпадение осадка наблюдается при сливании растворовхлорида алюминия и гидроксида кальция
2)
сульфата натрия и соляной кислоты
3)
карбоната калия и азотной кислоты
4)
гидроксида натрия и серной кислоты
А7. При взаимодействии серы с кислородом окислителем является
S+4
2)
O0
3)
S0
4)
O–2
А8В растворе одновременно не могут находиться ионы
1) SO4 2- , Fe 3+ 2) Na+, NO3— 3) Ca2+, Cl– 4) Cu2+, OH –
А9. Сумма отрицательных зарядов в правой части уравнения диссоциации хлорида железа (III) равна
1) -3 2) -4 3) -2 4) -1
А10. В уравнении реакции алюминия с хлором коэффициент перед формулой окислителя равен
Часть Б
Б1.
 Установите соответствие между исходными веществами и сокращенным ионным уравнением реакции между ними.
Установите соответствие между исходными веществами и сокращенным ионным уравнением реакции между ними.ИСХОДНЫЕ ВЕЩЕСТВА
СОКРАЩЕННОЕ ИОННОЕ УРАВНЕНИЕ
А)
H2SO4 и Ca(OH)2
1)
Ag++Cl– = AgCl
Б)
CaCO3 и HNO3
2)
H+ + OH– = H2O
В)
HClи Ba(OH)2
3)
CaCO3 + 2H+ = Ca2+ + CO2 + H2O
Г)
AgNO3 и NaCl
4)
2H+ + SO42– + Ca2+ + 2OH– = CaSO4 + H2O
5)
Ca2+ + SO42– = CaSO4
6)
CO32– + 2H+ = CO2 + H2O
Б
В
Г
Б2Установите соответствие между левой и правой частями уравнения диссоциации.

Б3. Окислительно-восстановительные процессы происходят при взаимодействии
оксида кальция и воды
2)
гидроксида бария и серной кислоты
3)
оксида азота (IV) и воды
4)
хлорида железа (II) и цинка
5)
карбоната калия и соляной кислоты
6)
оксида меди (II) и водорода
//Ответ:
Часть С
C1.
Определите вещество «Х» в цепочке превращений
СО2→ Х→ К2СО3
Для реакции обмена составьте полное и сокращенное ионное уравнения
Контрольная работа по химии 9 класс «Электролитическая диссоциация. Ионные уравнения» | Методическая разработка по химии (9 класс):
Контрольная работа №1
Электролитическая диссоциация. Ионные уравнения.
Вариант I.
1.Какой вклад в химию внес С. Аррениус?
Аррениус?
2.Дайте определения следующим понятиям в свете ТЭД: электролит, гидратация, ион, кислоты, соли.
3.Напишите уравнения электролитической диссоциации веществ:
гидроксид калия, нитрат меди (II), серная кислота, сульфат натрия.
4. Напишите уравнения реакций в полном и сокращенном ионном виде:
1) Mg(NO3)2+ Na 2SO4=
2) NaCl + KNO3=
5. Напишите для сокращенной ионной формы молекулярное уравнение:
1) Zn2++CO32- = ZnCO3↓
2) H+ + OH-= H 2O
Контрольная работа №1
Электролитическая диссоциация. Ионные уравнения.
Ионные уравнения.
Вариант II.
1. Какой вклад в химию внес Каблуков И.А.?
2. Дайте определения следующим понятиям в свете ТЭД: неэлектролит, растворение, катион, основания, степень диссоциации.
3. Напишите уравнения электролитической диссоциации веществ:
гидроксид бария, нитрат алюминия, соляная кислота, сульфат магния.
4. А) Напишите уравнения реакций в полном и сокращенном ионном виде:
1) Pb(NO3)2+ Na 2SO4=
2) Na 2S + Ca(NO3)2=
Б) Напишите для сокращенной ионной формы молекулярное уравнение:
1) Ba2++ CO 32-= BaCO3↓
2) Al3+ + PO43-= AlPO4↓
Контрольная работа №1
Электролитическая диссоциация. Ионные уравнения.
Вариант III.
1. Какой вклад в химию внес Каблуков И.А. и Кистяковский В.А.?
2. Дайте определения следующим понятиям в свете ТЭД: электролитическая диссоциация, гидратация, анион, соли, основания.
3. Напишите уравнения электролитической диссоциации веществ:
хлорид магния, карбонат калия, азотная кислота, гидроксид магния.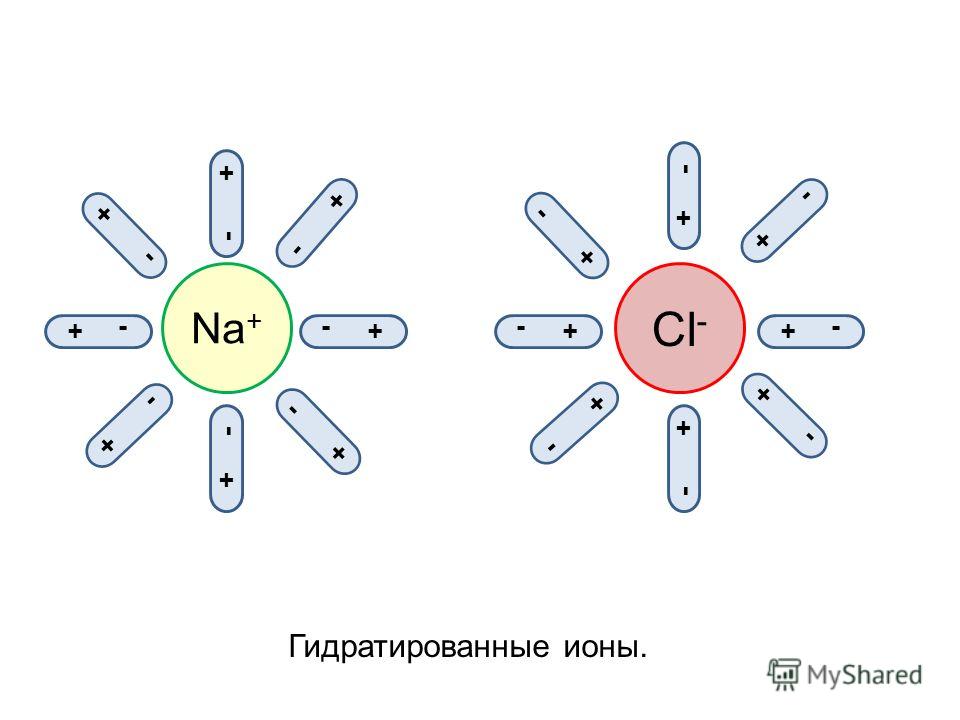
4. А) Напишите уравнения реакций в полном и сокращенном ионном виде:
1) Cu(NO3)2+ Na 2S =
2) Na 2S + AgNO3=
Б) Напишите для сокращенной ионной формы молекулярное уравнение:
1) Ba2+ +SiO32-= BaSiO3↓
2) Fe3+ + PO43-= FePO4↓
Контрольная работа №1
Электролитическая диссоциация. Ионные уравнения.
Вариант IV.
1. Какой вклад в химию внес С. Аррениус?
2. Дайте определения следующим понятиям в свете ТЭД: электролит, растворение, ион, кислота, степень диссоциации.
3. Напишите уравнения электролитической диссоциации веществ:
гидроксид калия, нитрат меди (II), серная кислота, сульфат натрия
4. А) Напишите уравнения реакций в полном и сокращенном ионном виде:
1) Ba(NO3)2+ Na 2SO4=
2) NaOH + Ba(NO3)2 =
Б) Напишите для сокращенной ионной формы молекулярное уравнение:
1) Ca2++ CO 32-= CaCO3↓
2) Ca2+ + 2F-= CaF2↓
Контрольная работа №1
Электролитическая диссоциация. Ионные уравнения.
Ионные уравнения.
Вариант V.
1. Какой вклад в химию внес Каблуков И.А. и Кистяковский В.А.?
2. Дайте определения следующим понятиям в свете ТЭД: электролит, гидратация, ион, кислоты, соли.
3. Напишите уравнения электролитической диссоциации веществ:
гидроксид бария, нитрат алюминия, соляная кислота, сульфат магния.
4. А) Напишите уравнения реакций в полном и сокращенном ионном виде:
1) Cu(NO3)2+ Na 2S =
2) Na 2S + AgNO3=
Б) Напишите для сокращенной ионной формы молекулярное уравнение:
1) Ba2++ SiO 32-= BaSiO3↓
2) Fe3+ + PO43-= FePO4↓
Контрольная работа №1
Электролитическая диссоциация. Ионные уравнения.
Вариант VI.
1. Какой вклад в химию внес Каблуков И.А.?
2. Дайте определения следующим понятиям в свете ТЭД: электролитическая диссоциация, растворение, анион, соли, степень диссоциации.
3. Напишите уравнения электролитической диссоциации веществ:
гидроксид калия, хлорид алюминия, ортофосфорная кислота, сульфат магния.
4. А) Напишите уравнения реакций в полном и сокращенном ионном виде:
1) Pb(NO3)2+ Na 2SO4=
2) Na 2S + Ca(NO3)2=
Б) Напишите для сокращенной ионной формы молекулярное уравнение:
1) Mg2++ 2OH-= Mg(OH)2↓
2) Al3+ + PO43-= AlPO4↓
▶▷▶ тема теория электролитической диссоциации контрольная работа
▶▷▶ тема теория электролитической диссоциации контрольная работа| Интерфейс | Русский/Английский |
| Тип лицензия | Free |
| Кол-во просмотров | 257 |
| Кол-во загрузок | 132 раз |
| Обновление: | 03-11-2018 |
тема теория электролитической диссоциации контрольная работа — Yahoo Search Results Yahoo Web Search Sign in Mail Go to Mail» data-nosubject=»[No Subject]» data-timestamp=’short’ Help Account Info Yahoo Home Settings Home News Mail Finance Tumblr Weather Sports Messenger Settings Yahoo Search query Web Images Video News Local Answers Shopping Recipes Sports Finance Dictionary More Anytime Past day Past week Past month Anytime Get beautiful photos on every new browser window Download Контрольная работа по теме «Теория электролитической kopilkaurokovru/himiya/prochee/kontrol-naia Cached Контрольная работа по теме » Теория электролитической диссоциации » на два варианта для Контрольная работа по теме: quot;Электролитическая infourokru/kontrolnaya-rabota-po-teme Cached Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления Тестовая контрольная работа в 9 классе по теме: «Теория infourokru/testovaya-kontrolnaya-rabota-v Cached Контрольная работа №1 по теме: « Теория электролитической диссоциации » Вариант 1 Контрольная работа по химии в 9 классе на тему Теория wwwmetod-kopilkaru/kontrolnaya_rabota_po_himii Cached Скачать: контрольная работа по химии в 9 классе на тему теория электролитической Контрольная работа «Теория электролитической диссоциации» nsportalru/shkola/khimiya/library/2011/09/28/ Cached Методическая разработка по химии (9 класс) по теме: Контрольная работа » Теория Контрольная работа по теме «Электролитическая диссоциация wwwmetod-kopilkaru/kontrolnaya_rabota_po_teme Cached Контрольная работа содержит 4 основных варианта для обычных классов и 2 базовых варианта для очень слабых классов Урок №15 Контрольная работа №1 по теме «Электролитическая sitesgooglecom/site/himulacom/zvonok-na-urok/9 Версия 1 1 Напишите уравнения электролитической диссоциации следующих веществ: Проверочные и контрольные работы по теме «Электролитическая videourokinet/razrabotki/provierochnyie-i Cached Теория электролитической диссоциации Проверочная работа «Электролитическая диссоциация Контрольная работа №2 по теме: «Электролитическая диссоциация» lib2podeliseru/docs/16302/index-27299-6html Cached Контрольная работа №3 Тема : «Металлы» Учебно-тематический план Предмет химия, класс 9 (базовый уровень, 2 часа в неделю, всего 68 часов) № п п Тест по химии для 8 класса «Электролитическая диссоциация» globuss24ru/doc/test-po-himii-dlya-8-klassa Cached Контрольная работа для 8 класса «Атомы химических элементов, химическая связь» Контрольная работа для 8 класса «Водород», «Вода Promotional Results For You Free Download | Mozilla Firefox ® Web Browser wwwmozillaorg Download Firefox — the faster, smarter, easier way to browse the web and all of Yahoo 1 2 3 4 5 Next 28,400 results Settings Help Suggestions Privacy (Updated) Terms (Updated) Advertise About ads About this page Powered by Bing™
- 👆 чтобы увидеть ответ на свой вопрос ✍️: Тест по теме « Теория электролитической диссоциации » напишите только буквы 1 Процесс распада электролита на ио… Тест по теме « Теория электролитической диссоциации » напишите только буквы 1 Процесс распада электролита на ионы при растворении в воде или расплавлении – это а) гидратация б) диссоциация в) ассоциация в) гидролиз 2Электрический ток в водном растворе не проводят вещества с а) ковалентной сильно полярной связью б) ионной связью в) ковалентной неполярной связью г) другой вариант ответа Скрыть Контрольная работа по теме » Электролитическая » metod-kopilkaru › kontrolnaya_rabota…teme…ovr_dlya… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Контрольная работа содержит 4 основных варианта для обычных классов и 2 базовых варианта для очень слабых классов 2) электролитическая диссоциация ; 3) кислоты
- карбонат магния
- 👆 чтобы увидеть ответ на свой вопрос ✍️: Тест по теме « Теория электролитической диссоциации » напишите только буквы 1 Процесс распада электролита на ио… Тест по теме « Теория электролитической диссоциации » напишите только буквы 1 Процесс распада электролита на ионы при растворении в воде или расплавлении – это а) гидратация б) диссоциация в) ассоциация в) гидролиз 2Электрический ток в водном растворе не проводят вещества с а) ковалентной сильно полярной связью б) ионной связью в) ковалентной неполярной связью г) другой вариант ответа Скрыть Контрольная работа по теме » Электролитическая » metod-kopilkaru › kontrolnaya_rabota…teme…ovr_dlya… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Контрольная работа содержит 4 основных варианта для обычных классов и 2 базовых варианта для очень слабых классов 2) электролитическая диссоциация ; 3) кислоты
3При взаимодействии раствором каких веществ одним из продуктов реакции является вода: а)гидроксид натрия и фосфорная кислота) б) HNO3и Скрыть 5 Тестовая контрольная работа по теме : « Теория » урокрф › …testovaya_kontrolnaya_rabota_po…teoriya… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Какая масса соли получилась при этом? Тестовая контрольная работа по теме : « Теория электролитической диссоциации » Вариант 2 Часть 1 При выполнении заданий выберите номер одного правильного ответа 1Соединение с ковалентной полярной связью 1) 2) 3) 4)Н2 2Соединение с ионной связью 1) 2) 3) Читать ещё Какая масса соли получилась при этом? Тестовая контрольная работа по теме : « Теория электролитической диссоциации » Вариант 2 Часть 1 При выполнении заданий выберите номер одного правильного ответа 1Соединение с ковалентной полярной связью 1) 2) 3) 4)Н2 2Соединение с ионной связью 1) 2) 3) 4) 3К электролитам относится 1) (раствор) 2) (газ) 3)глюкоза (раствор) 4) (газ) 4Электролитом является раствор Скрыть 6 « Теория электролитической диссоциации » nsportalru › …kontrolnaya…teoriya…dissotsiatsii Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Сайт – выбор пользователей Подробнее о сайте Контрольная работа по теме : « Теория электролитической диссоциации »Вариант №1 1Напишите уравнения возможны Материал по химии (8 класс) по теме : контрольная работа теория электролитической диссоциации Читать ещё Контрольная работа по теме : « Теория электролитической диссоциации »Вариант №1 1Напишите уравнения возможны Материал по химии (8 класс) по теме : контрольная работа теория электролитической диссоциации Опубликовано 17012014 — 20:38 — Тусупаева Валерия Темирбековна Контрольная работа по теме : « Теория электролитической диссоциации » Вариант №1 1Напишите уравнения возможных реакций между Скрыть 7 Тема I Электролитическая диссоциация Работа 5terkacom › Электролитическая диссоциация Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Решебник по химии за 9 класс к дидактическому материалу АМРадецкий Тема I Электролитическая диссоциация Работа 5 Итоговая по теме I Начните вводить часть условия (например
могут ли
- easier way to browse the web and all of Yahoo 1 2 3 4 5 Next 28
- химическая связь» Контрольная работа для 8 класса «Водород»
- smarter
тема теория электролитической диссоциации контрольная работа — Все результаты КарточкаКонтрольная работа по теме: «Теория — Инфоурок › Химия 16 мая 2018 г — Контрольная работа по теме : « Теория электролитической диссоциации » для 8-9 классов вариант 1 1Что такое катод и анод Контрольная работа по теме «Теория — Инфоурок › Химия Похожие 11 окт 2016 г — 9 класс Контрольная работа по теме « Теория электролитической диссоциации » 1 вариант 1 Составьте возможные уравнения Контрольная работа по теме: «Теория электролитической 16 мар 2013 г — Материал по химии (9 класс) по теме : Контрольная работа по теме : « Теория электролитической диссоциации » Опубликовано Тест по химии (9 класс) на тему: Контрольная работа по химии 9 15 сент 2018 г — Контрольная работа по теме « теория электролитической диссоциации » Вариант №1 Часть А выбрать только ОДИН правильный Тестовая контрольная работа по теме: «Теория — Урокрф 8 нояб 2017 г — Тестовая контрольная работа по теме : « Теория электролитической диссоциации » Вариант 1 Часть 1 При выполнении заданий Контрольная работа по теме «Теория электролитической Похожие 15 окт 2015 г — Контрольная работа по теме Теория электролитической диссоциации на два варианта для учащихся 9 класса к учебнику Рудзитис ГЕ, Контрольная работа по химии «Теория электролитической Похожие 23 окт 2014 г — Контрольная работа по теме « Теория электролитической диссоциации » 9 класс Вариант 1 1 Написать уравнения реакций в Урок-конкурс по теме «Теория электролитической диссоциации» 8 открытыйурокрф/статьи/594230/ закрепление и обобщение знаний по теме , подготовка к контрольной работе ,; развитие творческой и познавательной активности учащихся, Теория электролитической диссоциации (3) — Лабораторная работа Лабораторная работа №1 Тема : Теория электролитической диссоциации 1 Цель: Провести реакции ионного обмена между электролитами 2 Контрольная работа по химии в 9 классе на тему Теория Похожие 5 янв 2015 г — Урок № 17 Тема : Контрольная работа Цель: Обобщение, повторение и закрепление темы « Электролитическая диссоциация » Задачи Контрольная работа по химии 9 класс по теме «Теория newteacherjournalru//1438-kontrolnaya-rabota-po-khimii-9-klass-po-teme-teoriya 13 февр 2017 г — Контрольная работа по химии 9 класс по теме » Теория электролитической диссоциации » Автор: Виктория Юрьевна Сергеева вкл Коваленко Л | Теория электролитической диссоциации | Журнал him1septemberru/articlephp?ID=200404512 Похожие Поэтому я предлагаю разработку урока коррекции, проведенного после контрольной работы по теме « Теория электролитической диссоциации », МАТЕРИАЛЬНОЕ ОБЕСПЕЧЕНИЕ ИЗУЧЕНИЯ ТЕМЫ «ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ Полная версия работы доступна во вкладке «Файлы работы» в формате PDF Контрольная работа по теме « Теория электролитической диссоциации » химия 9 wwwsc109ru/content/distant/chime/9html Похожие Закончится повторение контрольной работой , которая определит готовность учащихся к Тема 1 Теория электролитической диссоциации (10 уроков) контрольная работа 9 класс — Химия — Мультиурок Контрольная работа по теме : « Теория электролитической диссоциации » Вариант №1 1Напишите уравнения возможных реакций между веществами: Подготовка к контрольной работе по теме «Теория iighjghblogspotcom/2012/10/blog-post_31html 31 окт 2012 г — Напишите уравнение электролитический диссоциации: к контрольной работе по теме » Теория электролитической диссоциации » Контрольная работа «Химические реакции Растворы Теория uchitelyacom/himiya/66665-kontrolnaya-rabota-himicheskie-reakcii-rastvoryhtml «Химические реакции Растворы Теория электролитической диссоциации » Контрольная работа по теме «Химические реакции Растворы Теория контрольная работа по теме: «Строение вещества Теория wwwzavuchru/methodlib/134/55724/ Похожие Теория электролитической диссоциации » Методической библиотеки портала Контрольная работа для учащихся 9 класса в виде теста по теме Контрольная работа по теме «Теория электролитической wwwseznaikaru › Химия/ › Контрольные/ Контрольная работа по теме » Теория электролитической диссоциации » 11 класс Вариант 1 Какие из следующих жидкостей проводят электрический Контрольная работа по теме: «Теория электролитической pedsovetpro/indexphp?option=com_content&view=article&id=16036 19 мар 2016 г — Вариант №1 1 Напишите уравнения возможных реакций между веществами: а) нитратом бария и сульфатом калия; б) сульфатом контрольная работа теория электролитической диссоциации 9 класс riggiru/userfiles/kontrolnaia-rabota-teoriia-elektroliticheskoi-dissotsiatsii-9-klassxml контрольная работа теория электролитической диссоциации 9 класс — Все результаты Контрольная работа по теме «Теория — Инфоурок › Химия Теория электролитической диссоциации — Электролитическая › › Электролитическая диссоциация Для объяснения особенностей водных растворов электролитов шведским ученым САррениусом в 1887 г была предложена теория электролитической Вопросы по теме «Теория электролитической диссоциации» www150solradymedusiteru/p270aa1html Вопросы по теме « Теория электролитической диссоциации » Как разделили все электролиты по степени диссоциации? 10 Контрольная работа Методика изучения темы «Теория электролитической диссоциации» Место и значение темы » Теория электролитической диссоциации » в курсе химии Основные понятия и контрольная работа , добавлен 17012018 4 Теория электролитической диссоциации Гидролиз солей (14 часа) Раздел № 1, Теория электролитической диссоциации лабораторных опытов – 2, · расчетных задач – 1, · контрольная работа — 1, 14 ч п\п, Дата, Наименование раздела, темы 1 четверть, количество часов, всего часов, Д/з Контрольная работа по теме: «Теория — Pandiaru Контрольные работы Контрольная работа по теме : « Теория электролитической диссоциации » 1Напишите уравнения возможных реакций между Контрольная работа 2 по теме «Электролитическая диссоциация Контрольная работа 2 по теме «Электролитическая диссоциация» последнее превращение с точки зрения теории электролитической диссоциации Химия 9 класс Теория электролитической диссоциации > Реакции Тест по предмету Химия для 9 класса по теме Теория электролитической Контрольная работа по математике 6 класс, по теме : » Делимость чисел» Контрольная работа по теме «Теория Электролитической nenudaru/контрольная-работа-по-теме-теория-электролитической-диссоцhtml Контрольная работа по теме « Теория Электролитической диссоциации » Задание 1 Сильным электролитом является Тема I Электролитическая диссоциация Работа 3 Химические Тема I Электролитическая диссоциация Работа 3 Химические свойства кислот, солей и оснований в свете теории электролитической диссоциации Реферат: Теория электролитической диссоциации — Xreferatcom Лабораторная работа Тема : ” Теория электролитической диссоциации ” Опыт № 1 Разная сущность взаимодействия разбавленной и Контрольная работа по теме: «Теория электролитической › Библиотека › Химия Контрольная работа по теме : « Теория электролитической диссоциации » Контрольная работа по теме : « Теория электролитической диссоциации » Контрольная работа по теме Теория электролитической › Учителю › Химия 1 окт 2016 г — Материал по химии Контрольная работа по теме Теория электролитической диссоциации , 9 класс, Химия, УМК ФГФельдман, Теория электролитической диссоциации — ПОМОЩЬ — Форум химиков на forumxumukru › Школьникам и студентам — решение задач › ПОМОЩЬ 11 окт 2011 г — Здраствуйте, проверьте пожалуйста задание Домашняя контрольная по теме » Теория Электролитической диссоциации » Вариант 1 Контрольная работа по теме: «Теория электролитической 27 нояб 2017 г — Контрольная работа по теме : « Теория электролитической диссоциации » 9 класс 1Напишите уравнения возможных реакций между Контрольная работа по теме: «Теория электролитической studydocru/doc//kontrol_naya-rabota-po-teme—«teoriya-e-lektroliticheskoj-dis Похожие Скачать No category Контрольная работа по теме : « Теория электролитической диссоциации » 9 класс Вариант №1 1 К кислотам относится каждое из [DOC] Тема 6 Теория электролитической диссоциации и свойства Свойства солей в свете теории электролитической диссоциации 16, 9, Контрольная работа №1 по теме «Атомы химических элементов», 1 Тема 3 [DOC] ПОЯСНИТЕЛЬНАЯ ЗАПИСКА Программа по химии разработана Похожие Основные положения теории электролитической диссоциации Тепловые Контрольная работа по теме « Теория электролитической диссоциации » 1 Теория электролитической диссоциации : Лабораторная работа Похожие Лабораторная работа Тема : ” Теория электролитической диссоциации ” Опыт № 1 Разная сущность взаимодействия разбавленной и [DOC] Контрольные работы по русскому языку — Школа № 939 sch939umskobrru/files/obwie%20svedenia/himiyadoc Контрольные работы по химии ( темы контроля) Классы Учитель Тема контроля 8 А К/р №4 Теория электролитической диссоциации ; 8 Б Электролитическая диссоциация — Википедия Похожие Перейти к разделу Классическая теория электролитической диссоциации — Классическая теория электролитической диссоциации была создана С [DOC] Электролитическая диссоциация (10ч+1) — Джинабинская СОШ djinabidagschoolcom/_http_schools/1718/djinabi//5_%20%20%20doc физическую и химическую теорию растворов; насыщенные и ненасыщенные Контрольная работа №1 по теме « Электролитическая диссоциация » Контрольная работа по химии по теме Теория электролитической 5 сент 2017 г — Контрольная работа по теме : « Теория электролитической диссоциации » Вариант №1 1 С какими из перечисленных веществ может Контрольная работа по теме: «Теория электролитической › Каталог › Остальные рефераты 15 авг 2016 г — Контрольная работа по теме : « Теория электролитической диссоциации » 9 класс 1Напишите уравнения возможных реакций между контрольна работа по теме теория электролитической диссоциации hkonlinecomhk//kontrolna-rabota-po-teme-teoriia-elektroliticheskoi-dissotsiatsiix контрольна работа по теме теория электролитической диссоциации — Все результаты Тестовая контрольная работа в 9 классе по теме : «Теория [PDF] Поурочное планирование по химии 9 класс s_39_specedu54ru/DswMedia/ximiya9klassrppdf основных положениях теории электролитической диссоциации , отработки умений учащихся по теме и проведения контрольной работы • Введен Реферат: Теория электролитической диссоциации — BestReferatru Название: Теория электролитической диссоциации Раздел: Биология и химия Тип: реферат Добавлен 00:56:58 13 января 2004 Похожие работы Контрольная работа для 9 класса по теме: «Теория — Педпортал Похожие Контрольная работа для 9 класса по теме : » Теория электролитической диссоциации » (Разное) Учебное пособие для учителей Курсовая работа (Теория) на тему «Определение константы studentlibcom/kursovaya_rabota_teoriya-133370-opredelenie_konstanty_dissociacii_ 20 авг 2016 г — Курсовая работа ( Теория ) по химии на тему : Определение При электролитической диссоциации разрываются обычно лишь [DOC] Таблица 1 Тематическое планирование курса «Химия 9 класс» из 10/10 Контрольная работа № 1, 1 Тема 2 Химическая реакция, 17 1/11 соединений в свете теории электролитической диссоциации , 1 8/18 Вместе с тема теория электролитической диссоциации контрольная работа часто ищут ответы на контрольную работу по химии электролитическая диссоциация контрольная работа по теме теория электролитической диссоциации ответы 8 класс тест по теме теория электролитической диссоциации вариант 2 теория электролитической диссоциации вариант 1 тест 6 теория электролитической диссоциации 8 класс контрольная работа № 1 по теме электролитическая диссоциация контрольная работа по химии 9 класс рудзитис электролитическая диссоциация контрольная работа по химии 8 класс электролитическая диссоциация Навигация по страницам 1 2 3 Следующая Ссылки в нижнем колонтитуле Россия — Подробнее… Справка Отправить отзыв Конфиденциальность Условия Аккаунт Поиск Карты YouTube Play Новости Почта Контакты Диск Календарь Google+ Переводчик Фото Ещё Документы Blogger Hangouts Google Keep Подборки Другие сервисы Google
Яндекс Яндекс Найти Поиск Поиск Картинки Видео Карты Маркет Новости ТВ онлайн Музыка Переводчик Диск Почта Коллекции Все Ещё Дополнительная информация о запросе Показаны результаты для Нижнего Новгорода Москва 1 Контрольная работа по химии « Теория » videourokinet › …rabota…teoriya…dissotsiatsiihtml Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Контрольная работа по теме « Теория электролитической диссоциации » 9 класс Вариант 1 1 Написать уравнения реакций в молекулярном и ионном виде между следующими Читать ещё Контрольная работа по теме « Теория электролитической диссоциации » 9 класс Вариант 1 1 Написать уравнения реакций в молекулярном и ионном виде между следующими веществами: а) нитратом бария и сульфатом калия; б) сульфатом меди (II) и сульфидом натрия; в) карбонатом натрия и соляной кислотой; г) оксидом углерода (IV) и гидроксидом натрия Скрыть 2 Контрольная работа по теме : « Теория » pandiaru › text/80/295/4728php Показать ещё с сайта Пожаловаться Информация о сайте « Теория электролитической диссоциации » 1Напишите уравнения возможных реакций между веществами Задания для вступительных контрольных работ по математике Задания для вступительных контрольных работ по физике Основные порталы, построенные редакторами Домашний очаг Читать ещё « Теория электролитической диссоциации » 1Напишите уравнения возможных реакций между веществами: Вариант №1 а) нитратом бария и сульфатом калия; б) сульфатом меди (II) и сульфидом натрия; в) сульфидом натрия и соляной кислотой; г) оксидом углерода (IV) и гидроксидом натрия Задания для вступительных контрольных работ по математике Задания для вступительных контрольных работ по физике Основные порталы, построенные редакторами Домашний очаг Скрыть 3 Методическая разработка по химии (9 класс) по теме nsportalru › …kontrolnaya…teoriya…dissotsiatsii Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Сайт – выбор пользователей Подробнее о сайте Контрольная работа по теме : « Теория электролитической диссоциации » 1Напишите уравнения возможных реакций между Контрольная работа по химии 9 класс Тема контрольной работы » Теория электролитической диссоциации » на два варианта Мне нравится Читать ещё Контрольная работа по теме : « Теория электролитической диссоциации » 1Напишите уравнения возможных реакций между веществами: Вариант №1 Контрольная работа по химии 9 класс Тема контрольной работы » Теория электролитической диссоциации » на два варианта Мне нравится Поделиться Скрыть 4 Карточка Контрольная работа по теме : « Теория » infourokru › …rabota…teme-teoriya…dissociacii-dlya… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Сайт – выбор пользователей Подробнее о сайте Контрольная работа по теме : « Теория электролитической диссоциации » для 8-9 классов вариант 2 1Что такое электролиты и не электролиты определения с примерами веществ 2Что такое ионы и какие они бывают и как называются Какие из формулы веществ не электролиты выберите : гидроксид натрия Читать ещё Контрольная работа по теме : « Теория электролитической диссоциации » для 8-9 классов вариант 2 1Что такое электролиты и не электролиты определения с примерами веществ 2Что такое ионы и какие они бывают и как называются Какие из формулы веществ не электролиты выберите : гидроксид натрия, углекислый газ, хлорид железа 2, кремниевая кислота, оксид меди 2, сульфат калия, карбонат магния, этиловый спирт, азотная кислота, 3При взаимодействии раствором каких веществ одним из продуктов реакции является вода: а)гидроксид натрия и фосфорная кислота) б) HNO3и Скрыть 5 Тестовая контрольная работа по теме : « Теория » урокрф › …testovaya_kontrolnaya_rabota_po…teoriya… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Какая масса соли получилась при этом? Тестовая контрольная работа по теме : « Теория электролитической диссоциации » Вариант 2 Часть 1 При выполнении заданий выберите номер одного правильного ответа 1Соединение с ковалентной полярной связью 1) 2) 3) 4)Н2 2Соединение с ионной связью 1) 2) 3) Читать ещё Какая масса соли получилась при этом? Тестовая контрольная работа по теме : « Теория электролитической диссоциации » Вариант 2 Часть 1 При выполнении заданий выберите номер одного правильного ответа 1Соединение с ковалентной полярной связью 1) 2) 3) 4)Н2 2Соединение с ионной связью 1) 2) 3) 4) 3К электролитам относится 1) (раствор) 2) (газ) 3)глюкоза (раствор) 4) (газ) 4Электролитом является раствор Скрыть 6 « Теория электролитической диссоциации » nsportalru › …kontrolnaya…teoriya…dissotsiatsii Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Сайт – выбор пользователей Подробнее о сайте Контрольная работа по теме : « Теория электролитической диссоциации »Вариант №1 1Напишите уравнения возможны Материал по химии (8 класс) по теме : контрольная работа теория электролитической диссоциации Читать ещё Контрольная работа по теме : « Теория электролитической диссоциации »Вариант №1 1Напишите уравнения возможны Материал по химии (8 класс) по теме : контрольная работа теория электролитической диссоциации Опубликовано 17012014 — 20:38 — Тусупаева Валерия Темирбековна Контрольная работа по теме : « Теория электролитической диссоциации » Вариант №1 1Напишите уравнения возможных реакций между Скрыть 7 Тема I Электролитическая диссоциация Работа 5terkacom › Электролитическая диссоциация Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Решебник по химии за 9 класс к дидактическому материалу АМРадецкий Тема I Электролитическая диссоциация Работа 5 Итоговая по теме I Начните вводить часть условия (например, могут ли, чему равен или найти) Читать ещё Решебник по химии за 9 класс к дидактическому материалу АМРадецкий Тема I Электролитическая диссоциация Работа 5 Итоговая по теме I Начните вводить часть условия (например, могут ли, чему равен или найти): Тема I Электролитическая диссоциация Работа 5 Итоговая по теме I Скрыть 8 Контрольная работа по теме » Теория » kopilkaurokovru › himiya…naia-rabota…dissotsiatsii Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Просмотр содержимого документа « Контрольная работа по теме » Теория электролитической диссоциации » » Читать ещё Просмотр содержимого документа « Контрольная работа по теме » Теория электролитической диссоциации » » Контрольная работа по теме « Теория электролитической диссоциации » 1Составьте уравнения возможных реакций в молекулярном и ионном виде Вариант 1 Скрыть 9 Тема теория электролитической диссоциации контрольная работа — смотрите картинки ЯндексКартинки › тема теория электролитической диссоциации Пожаловаться Информация о сайте 27 октября Ещё картинки 10 Тест по теме « Теория электролитической » znanijacom › task/28097474 Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Нажми, чтобы увидеть ответ на свой вопрос: Тест по теме « Теория электролитической диссоциации » напишите только буквы 1 Процесс распада электролита на ио… Читать ещё Нажми, 👆 чтобы увидеть ответ на свой вопрос ✍️: Тест по теме « Теория электролитической диссоциации » напишите только буквы 1 Процесс распада электролита на ио… Тест по теме « Теория электролитической диссоциации » напишите только буквы 1 Процесс распада электролита на ионы при растворении в воде или расплавлении – это а) гидратация б) диссоциация в) ассоциация в) гидролиз 2Электрический ток в водном растворе не проводят вещества с а) ковалентной сильно полярной связью б) ионной связью в) ковалентной неполярной связью г) другой вариант ответа Скрыть Контрольная работа по теме » Электролитическая » metod-kopilkaru › kontrolnaya_rabota…teme…ovr_dlya… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Контрольная работа содержит 4 основных варианта для обычных классов и 2 базовых варианта для очень слабых классов 2) электролитическая диссоциация ; 3) кислоты, основания и соли с позиции теории диссоциации Читать ещё Контрольная работа содержит 4 основных варианта для обычных классов и 2 базовых варианта для очень слабых классов Часть А каждого варианта — это тестовые задания с выбором одного правильного ответа Часть Б состоит из 4 заданий с развернутыми ответами, последнее из которых — качественная задача Задания типовые, ориентированы на формат заданий итоговой аттестации Задания включают элементы знаний по следующим разделам темы : 1) электролиты и неэлектролиты; 2) электролитическая диссоциация ; 3) кислоты, основания и соли с позиции теории диссоциации ; 4) степень диссоциации , сильные и слабые элект Скрыть 1 2 3 4 5 дальше Браузер Для безопасных прогулок в сети 0+ Скачать
Контрольная работа по химии «Электролитическая диссоциация»
1 вариант.
1. Составить возможные уравнения диссоциации веществ:
КОН, Na2SO4, Fe2O3, H3PO4, Mg(NO3)2.
2. Составить уравнения реакций между парами веществ в молекулярной, полной ионной и краткой ионной формах:
а) СаО + НNO3
б) Ba(OH) 2 + Na2SO4
3. К данному краткому ионному уравнению подобрать пару веществ и составить молекулярное, полное и краткое ионные уравнения:
Fe+2 + 2OH-1 = Fe(OH) 2↓
4. Разобрать окислительно-восстановительную реакцию: проставить степени окисления атомов, составить схемы процессов окисления и восстановления, указать окислитель и восстановитель, уравнять:
CuO + H2 → Cu + H2O.
5. Задача. В 40 граммах раствора гидроксида натрия NaOH 25% концентрации растворяли углекислый газ СО2. Сколько литров углекислого газа растворили, если в результате реакции образовалась вода и карбонат натрия Na2CO3.
Сколько литров углекислого газа растворили, если в результате реакции образовалась вода и карбонат натрия Na2CO3.
2 вариант.
1. Составить возможные уравнения диссоциации веществ:
Ca(OH) 2, K2CO3, SO2, H2SiO3, Al2(SO4) 3.
2. Составить уравнения реакций между парами веществ в молекулярной, полной ионной и краткой ионной формах:
а) KОH + ZnCl2
б) Na2CO3 + HNO3
3. К данному краткому ионному уравнению подобрать пару веществ и составить молекулярное, полное и краткое ионные уравнения:
Н+ 1 + ОH— 1 = Н2О
4. Разобрать окислительно-восстановительную реакцию: проставить степени окисления атомов, составить схемы процессов окисления и восстановления, указать окислитель и восстановитель, уравнять:
Zn + HBr → ZnBr2 + H2↑
5. Задача. Сколько граммов осадка гидроксида меди Cu(OH) 2 вступило в реакцию с 25 граммами раствора азотной кислоты HNO3 20% концентрации, если в результате реакции образовались вода и соль нитрат меди Cu(NO3) 2.
Задача. Сколько граммов осадка гидроксида меди Cu(OH) 2 вступило в реакцию с 25 граммами раствора азотной кислоты HNO3 20% концентрации, если в результате реакции образовались вода и соль нитрат меди Cu(NO3) 2.
Весь материал — в документе.
7. Степень окисления +2 проявляют металлы: а) Mg, Ca, Ba б) Li, Na, Ca в) Al, Fe, Mg 8. a) натрий б) литий в) алюминий 9. Самый тугоплавкий металл: а) железо б) хром в) вольфрам 10. Электропроводность и теплопроводность металлов объясняется особым строением кристаллической решетки: а) наличием свободных электронов б) наличием ионов металла в узлах решетки в) наличием нейтральных атомов в узлах 11. Практически осуществима следующая реакция: а) MgSO4 + Fe → б) FeCl2 + Cu → в) CuSO4 + Zn → 12. Формула гашеной извести: а) Са(ОН)2 б) СаО в)CaСО3 13. Какой металл называют «крылатым»? а) железо б) алюминий в) кальций 14. При взаимодействии хлорида железа (II) с гидроксидом натрия наблюдается выпадение: а) коричневого осадка б) синего осадка в) белого осадка (на воздухе зеленеет) | Продукты взаимодействия |
А) Са + H2SO4(разбавл.) ; Б) Са + N2 ; В) Са(HCO3)2 ; Г) Са(OH)2 + H2SO4 | 1) СаO + CO2; 2) СаCO3 + CO2 + H2O; 3) Са3N2; 4) СаSO4 + H2S + H2O; 5) СаSO4 + H2; 6) СаSO4 + H2O. | 8.Какой из металлов, электронные формулы которых записаны ниже, наиболее химически активен? a) 1s2s2p3s3p3d4s б) 1s2s в) 1s2s2p3s 9.Восстановительные свойства в ряду элементов: Sr––Ca––Mg––Be а) усиливаются б) ослабевают в) изменяются периодически 10. представляет собой процесс: а) восстановления б) окисления в) не относится к окислительно-восстановительным процессам 11.Какой из гидроксидов проявляет амфотерные свойства? а) Mg(OH) б) Fe(OH) в) Ba(OH) 12.Соли какого металла окрашивают пламя в кирпично-красный цвет: а) Al б) Mg в) Ca 13. Какой ион обусловливает жесткость воды: а) Ba б) Mg в) K 14. Формула негашеной извести: а) СаО б) Ca(ОН)2 в) СаCO | Продукты взаимодействия |
А) Fe + Cl2 ; Б) Fe + O2 ; В) Fe + H2SO4(разб.) ; Г) Fe + HCl | 1) Fe2(SO4)3 + SO2 + H2O; 2) FeCl3; 3) FeCl2 + H2; 4) FeSO4 + H2; 5) Fe3O4; 6) Fe3O4 + H2. |
Теория электролитической диссоциации – статья – Корпорация Российский учебник (издательство Дрофа – Вентана)
История вопроса
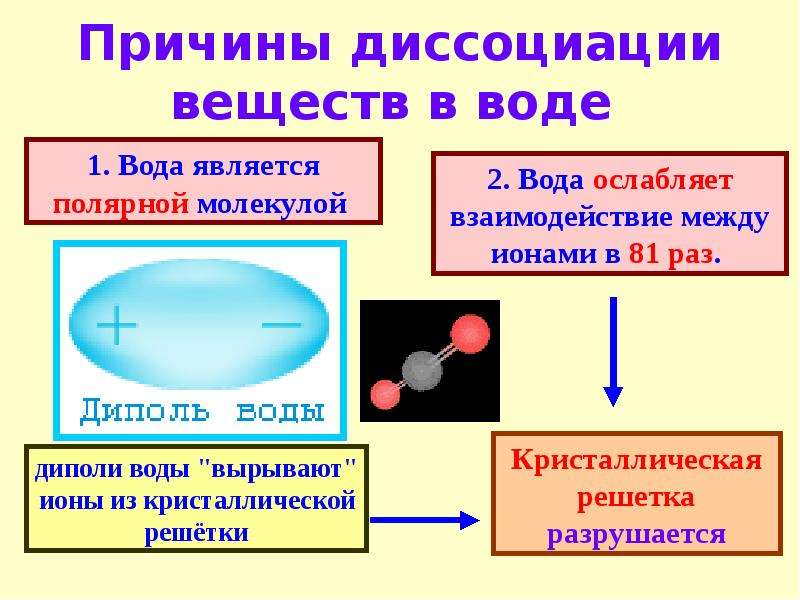
Изучение растворов с давних времен занимало умы исследователей. В начале XIX века М. Фарадей открыл способность некоторых растворов проводить электрический ток. Геймгольц, немецкий физик, предположил, что электролиты в растворе полностью распадаются на ионы, то есть существует электролитическая диссоциация. Однако увеличение электропроводности с уменьшением концентрации раствора объяснить не смог.
В начале XIX века М. Фарадей открыл способность некоторых растворов проводить электрический ток. Геймгольц, немецкий физик, предположил, что электролиты в растворе полностью распадаются на ионы, то есть существует электролитическая диссоциация. Однако увеличение электропроводности с уменьшением концентрации раствора объяснить не смог.
Ученые заметили, что растворы замерзают при более низкой температуре, чем чистые растворители. Именно этим свойством растворов и в наше время пользуются дворники, щедро посыпая солью обледеневшие тротуары. Однако, температура замерзания электролитов не соответствовала расчетным данным.
Научным несостыковкам требовалось найти объяснение. И молодой, 29-летний шведский ученый С. Аррениус, в 1887 г. исследуя проведение электрического тока в растворах различных веществ, выдвинул теорию, которая могла объяснить эти факты.
Основные положения теории электролитической диссоциации
- Химические субстанции делятся на электролиты — вещества, которые проводят электрический ток, и неэлектролиты.
 К электролитам относится большинство сложных неорганических веществ: кислоты, основания, соли.
К электролитам относится большинство сложных неорганических веществ: кислоты, основания, соли.
К неэлектролитам — большинство органических веществ. - В воде электролиты распадаются на ионы: положительно заряженные катионы и отрицательно заряженные анионы. Ионы бывают простые и сложные. В растворе ионы находятся в хаотическом движении.
- Под действием электрического тока движение ионов упорядочивается, и катионы движутся к отрицательному полюсу — катоду, анионы к положительному аноду.
- На степень электролитической диссоциации влияют различные факторы: природа растворенного вещества и его количество, свойства растворителя, температура раствора.
Химия. 8 класс. Учебник
Учебник написан преподавателями химического факультета МГУ имени М.В. Ломоносова. Отличительными особенностями книги являются простота и наглядность изложения материала, высокий научный уровень, большое количество иллюстраций, экспериментов и занимательных опытов, что позволяет использовать ее в классах и школах с углубленным изучением естественно-научных предметов.
Степень диссоциации
В ходе научных исследований ученые определили, что в растворе диссоциирует некоторая часть молекул растворителя. Для количественной характеристики силы электролита был введен показатель степени диссоциации, который обозначается α и рассчитывается по формуле
α = ν / ν0.
Где ν — количество вещества, распавшееся на ионы,
ν0 — общее количество вещества.
Степень диссоциации также можно выразить в процентах. Как это сделать, можно узнать в § 11 учебника «Химия. 9 класс» под редакцией В.В. Еремина.
В зависимости от степени диссоциации вещества делят на сильные и слабые электролиты.
Сильные электролиты представляют собой вещества, которые в разбавленных растворах практически полностью распадаются на ионы. Степень диссоциации более 0.5, или 50%.
Для слабых электролитов значение степени диссоциации α меньше 0. 1, или 10%.
1, или 10%.
Вещества с промежуточными значениями от 10 до 50% иногда называют средними электролитами.
Уравнение диссоциации
Уравнение электролитической диссоциации используют для записи процессов, происходящих в растворе.
Диссоциация сильного электролита протекает практически необратимо, что показывает стрелка →.
NaCl → Na+ + Cl—
CaCl2 → Ca2+ + 2Cl—
Диссоциация слабого электролита — обратимый процесс, протекает не полностью и не до конца, что обозначает стрелка ⇄
Сh4COOH ⇄ Сh4COO— + H+
Умение составлять уравнения диссоциации будет отличным подспорьем при разборе темы «§ 13. Реакции ионного обмена и условия их протекания» в учебнике «Химия. 9 класс» под редакцией В.В. Еремина и для решения ионных уравнений.
Что еще почитать?
Противостояние титанов
Теория электролитической диссоциации Аррениуса вызвала жаркие споры среди ученых.
Химический мир разделился на два лагеря. Сторонники «физической» теории Аррениуса считали, что распад на ионы происходит без какого-либо воздействия сил внешней среды и раствор представляет собой механическую взвесь ионов и молекул воды.
Но эта теория не могла объяснить тепловые эффекты при растворении. Например, нагревание колбы при разведении в воде серной кислоты или покрытие сосуда инеем при растворении в воде аммиачной селитры или азотнокислого аммония.
Сторонники «химической», или гидратной, теории, автором которой был Д.И. Менделеев, считали, что в растворе происходит взаимодействие растворенного вещества и растворителя.
Много копий было сломано в этой борьбе. Проявились худшие человеческие качества. Так, Аррениус, пользуясь служебным положением (в 1905 году он был назначен директором физико-химического Нобелевского института в Стокгольме), приложил массу усилий, чтобы, несмотря на трехкратную номинацию на получение Нобелевской премии в 1905, 1906 и 1907 годах, Д. И. Менделеев так ее и не получил.
И. Менделеев так ее и не получил.
Но истина, как всегда, оказалась посередине: в ходе дальнейших экспериментов ученые выяснили, что растворитель и растворенное вещество, взаимодействуя между собой, дают необходимую энергию для разрушения кристаллической решетки электролитов. В споре великих умов родилась новая протолитическая, или протонная, теория кислот и оснований.
#ADVERTISING_INSERT#| 1. |
Типы электролитов. Кислоты
Сложность: лёгкое |
1 |
2.
|
Типы электролитов. Основания
Сложность: лёгкое |
1 |
| 3. |
Типы электролитов. Соли
Сложность: лёгкое |
1 |
4.
|
Кислоты, основания и соли с точки зрения ТЭД
Сложность: лёгкое |
1 |
| 5. |
Диссоциация слабых многоосновных кислот
Сложность: среднее |
2 |
6.
|
Диссоциация солей
Сложность: среднее |
2 |
| 7. |
Ионы, образующиеся при диссоциации солей
Сложность: среднее |
2 |
8.
|
Ионы, образующиеся при диссоциации одноосновных кислот
Сложность: среднее |
2 |
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.

Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Экспериментальные и моделирование проводимости для систем растворов электролитов
Реферат
Изучение концентрации и температурная зависимость проводимости раствора электролита имеет большое значение для оценки и улучшение работы электрохимической системы. В этой статье на основе влияния количества свободных ионов и подвижность ионов от проводимости, полуэмпирическая модель проводимости с пятью параметрами было предложено соотнести проводимость, концентрацию и температурные данные растворов электролитов при средних и высоких концентрациях.Электропроводности NaCl и CaCl 2 в бинарных растворителях пропиленкарбонат – H 2 O измеряли при температурах от От 283,15 до 333,15 К. Достоверность модели подтверждена экспериментальные данные этой статьи и проводимость, концентрация, и температурные данные 28 систем растворов электролитов в литературе. Растворы электролитов, исследованные в данной статье, включали бинарные системы органических растворителей, системы чистых органических растворителей и водные системы решений.Результаты показали, что предложенная модель подходит для экспериментальные данные хорошо как для чистого растворителя, так и для смешанных растворителей систем, что имеет большое значение для практических инженерных приложений.
1. Введение
Ионная проводимость раствора электролита известен как ключевой параметр для оценки производительности решения, и широко используется в области электрохимии, биохимии, и химия окружающей среды. При использовании в батареях, суперконденсаторах 1 , электродиализе 2 , 3 и других электрохимических системах растворитель состав раствора электролита обычно фиксирован, а электропроводность раствора изменяется при смене электролита концентрация и температура.Таким образом, изучая концентрацию и Температурная зависимость проводимости раствора электролита имеет вид большое значение для оценки и улучшения электрохимических производительность системы. 4
Взаимосвязь между проводимостью и концентрацией электролита изучается давно, и существует большое количество теоретические и эмпирические модели. Ранний Дебай-Хюккель-Онсагер теория рассматривала только дальнодействующую электростатическую силу между ионов, и, следовательно, применимо только к бесконечно разбавленному раствору системы. 5 На основании этой теории, исследователи постоянно улучшали модель, чтобы расширить ее концентрацию диапазон приложений. Например, используя модель сферы Герни, теория Ли – Уитона 6,7 расширила уравнение проводимости до концентрации 0,1 моль л –1 . Де Диего и др. приняла концепцию деятельности по борьбе с отклонение от идеальности, возникающее при более высоких концентрациях, и уравнение хорошо подходит для системы водного раствора электролита 1: 1 при высокой концентрации. 8 В работе Чандра и Багчи, 9 теоретическая формулировка был предложен на основе теории связи мод для учета диэлектрической проницаемости. трение при движении ионов, что подтверждено NaCl и Водный раствор KCl до 1 моль л –1 . С использованием Теория переноса MSA (среднее сферическое приближение) как основа, Бернар и другие. распространил модель проводимости на смешанные растворы, которая была далее распространяется на системы буферных растворов со слабым электролитом, но точность модели зависит от выбора радиуса иона. 10−12 В последние годы Yim et al. предложила полуэмпирическую модель на основе по теории свободного объема, которая хорошо подходит для всей концентрации диапазон. 13,14 В отличие от теоретических моделей, неопределенность параметры в эмпирической модели электропроводности могут можно получить путем подбора экспериментальных данных, таких как уравнение разработан Виллулласом и Гонсалесом, полином 15 модели, 16 и уравнение Кастила – Эмиса. 17,18 Одной из наиболее успешных эмпирических моделей является модель Кастила – Эмиса. модель, которая содержит четыре параметра и хорошо вписывается в экспериментальную данные растворов электролитов от бесконечного разбавления до насыщения.
Температурную зависимость проводимости часто описывают уравнение Аррениуса 19,20 и уравнение Фогеля – Фулчера – Таммана (VFT) уравнение. 21,22 Первый широко используется в водные растворы, а последние могут описывать температурную зависимость более точно для ионных жидкостей, введя понятие температура стеклования. 23
Для системы растворов электролитов с высокой концентрацией, которые широко применяются на практике, исследователи предложили ряд моделей κ = f ( м , T ) (κ, проводимость; м , электролит концентрация; Т , температура).Де Диего и др. модифицированный регулируемые параметры в уравнении Кастила – Эмиса, вводя температура и проводимость в исходном состоянии. 24 Модифицированная эмпирическая модель подходит для системы водных растворов при высоких концентрациях, но это применимо только к чистым системам растворителей. See and White 25 использовали полиномы, содержащие температуру и концентрацию, чтобы коррелируют проводимость системы водного раствора КОН при высокая концентрация и широкий температурный диапазон.Полиномиальная модель может получить хорошие результаты подгонки, но не имеет физического смысла, и это обычно требует большого количества настраиваемых параметров для обеспечения точность корреляции. 26 Fu et al. предложенный семипараметрическая квазиаррениусовская модель, которая хорошо соответствовала проводимости ионных жидкостей в смешанных системах органических растворителей, но принятие семи параметров увеличили сложность решения задачи. 27
В электрохимических системах, смешанные растворители обычно используются для улучшить характеристики растворов электролитов. 28,29 Хотя большой объем экспериментальных данных проводимости был Сообщается, что модель κ = f ( m , T ) для смешанных растворителей все еще встречается редко. Учитывая что пропиленкарбонат (PC) и H 2 O имеют хорошие взаимные растворимость как полярные растворители, а NaCl и CaCl 2 имеют высокую растворимости в смешанных растворителях PC – H 2 O, выбираем Системы NaCl – PC – H 2 O и CaCl 2 –PC – H 2 O для изучения взаимосвязи между проводимостью раствора а также концентрация и температура электролита в широком диапазоне концентраций. диапазон, экспериментальные данные которого пока не приводятся.На основании о влиянии количества свободных ионов и их подвижности на проводимость раствора электролита предлагается общая полуэмпирическая модель κ = f ( м , T ) с пятью параметрами. Наши экспериментальные данные для NaCl ( m ) — w PC– (1 — w ) H 2 O и CaCl 2 ( m ) — w PC– (1 — w ) H 2 O используются системы и данные 28 других систем из литературы проверить точность разработанной модели.Результаты показывают, что предложенная нами модель хорошо согласуется с данными (κ, m , T ) в широком диапазоне концентраций и температур. диапазон.
2. Описание модели
В разбавленных растворах, проводимость раствора электролита представляет собой сумму проводимостей ионов в растворе, которая можно выразить следующим уравнением: 20
1
где κ — проводимость, n i — количество ионов i, q i — заряд иона i, а μ i — подвижность иона i.
Из уравнения 1 видно, что на проводимость влияют как число ионов в раствор и подвижность ионов. Для дальнейшего расширения применимости уравнения для средних и высоких концентраций, уравнение 1 необходимо пересмотреть с учетом влияние концентрации электролита на количество свободных ионов и подвижности ионов соответственно.
При средней и высокой концентрации решения, расстояние между анионов и катионов уменьшается, и образуются непроводящие ионные пары ассоциацией ионов, что приводит к уменьшению количества свободных ионы, участвующие в проводимости.В частности, это явление более очевиден в смешанных системах растворителей. 30,31 Таким образом, количество свободных ионов как функция концентрации электролита отклонится от линейной зависимости. 32 Число свободных ионов n i и концентрация ионов m можно описать следующим уравнением:
2
, где a и n — константы, а n релевантны. к разновидность растворителя.
Подвижность ионов — это средняя скорость ионы на единицу электрического поля силы и является результатом совместных действий внешних сила электрического поля и сопротивление движению ионов. Что касается иона и его гидратный слой как единое целое под действием внешнего электрическое поле, сопротивление его движению при направленном миграция включает ион-ион, ион-растворитель и растворитель-растворитель. силы. Первая сила — это дальнодействующее взаимодействие, вызванное электростатическим силы, а последние два — взаимодействия ближнего действия.При низких концентрациях преобладают дальнодействующие взаимодействия, а обычно игнорируется. Поскольку концентрация электролита в растворе увеличивается, расстояние между молекулами уменьшается, и короткодействующий взаимодействия нельзя игнорировать, в результате чего движение ионов сопротивление быстро увеличивается. 33 Следовательно, подвижность ионов обычно уменьшается с увеличением электролита. концентрация.
На основании большого количества данных о подвижности ионов в литературе, было предложено эмпирическое уравнение подвижности ионов μ i и ионной силы I , 34,35 , которое подходит для растворов электролитов с низкой концентрацией, I <0.1 моль л –1 .
3
4
где μ i0 — подвижность иона i при бесконечном разбавлении; I — ионная сила; м и есть моляр концентрация иона i; z i ионный валентность иона i; C , b , c — константы; и c составляет приблизительно 0,5.
Для упрощения ур.3 и распространить его на растворы электролитов средней и высокой концентрации, модифицируем выражение подвижности ионов μ i и электролита концентрация м как
5
где B постоянный.
Подставляя уравнения 2 и 5 в уравнение 1, соотношение между проводимостью κ и концентрация м можно описать следующим образом:
6
7
, где A — постоянный.
Хотя уравнение 6 может отражают влияние концентрации электролита на проводимость, проводимость также изменяется с температурой. Степень диссоциации ионов в растворе увеличивается при повышении температуры, а количество свободных ионов увеличивается.В то же время межмолекулярный сила уменьшается с повышением температуры, что означает что сопротивление движению ионов уменьшается и миграция ионов скорость увеличивается. Чтобы сопоставить проводимость при разных температурах, следующие уравнения используются для описания температурной зависимости из A и B :
8
9
Заменяя A и B в уравнении 4 уравнениями 8 и 9, соотношение между проводимостью и температурой и концентрацией электролита показаны как eq 10:
10
, где P 1 , P 2 , P 3 , P 4 и n — константы, которые не зависят от концентрации соли и температуры, но от состава растворителя зависимый.
Уравнение 10 содержит пять параметры, которые могут быть получены путем подбора (κ , м, Т ) данные. В следующем разделе предлагаемая модель будет быть протестированным с использованием экспериментальных данных и данных из литературы. Программный инструмент 1 stOpt будет использоваться для получения параметры на основе алгоритма глобальной оптимизации, с целью минимизации суммы квадратов ошибок между расчетным значением и экспериментальные данные. Максимальное количество итераций в расчет равен 1000, а условие сходимости — 10 –10 .Алгоритм имеет характеристику независимости от начального значения. Таким образом, в большинстве случаев мы всегда можем получить правильные результаты, начиная с от любых случайных начальных значений.
3. Экспериментальная Раздел
3.1. Материалы
NaCl безводный (чистота, ≥99,5%) было приобретено у Sinopharm Chemical Reagent Co., Ltd. Безводный CaCl 2 (чистота ≥99,9%) было закуплено от Aladdin Industries, Inc. NaCl и CaCl 2 были высушены в течение 24 ч при 423 К. перед использованием. Пропиленкарбонат (ПК) (чистота ≥99.7%) был приобретен у Aladdin Industries, Inc. и использовался без каких-либо предварительная обработка. Дистиллированная и деионизированная вода (Watson Group Ltd., Китай) был использован для приготовления растворов. См. Более подробную информацию в Таблице 1.
Таблица 1
Материал Описание
| материалы | CAS | источник | чистота (масса фракция) | анализ метод |
|---|---|---|---|---|
| пропиленкарбонат | 108-32-7 | Aladdin Industries, Inc. | ≥0,997 | GC |
| NaCl | 7647-14-5 | Sinopharm Химический реагент Co., Ltd. | ≥0,995 | анализ титрования |
| CaCl 2 | 233-140-8 | Aladdin Industries, Inc. | ≥0,999 | анализ титрования |
| анализ титрования | ||||
| вода | Watson Group, Ltd. |
3.2. Измерения электропроводности
Обработанные NaCl / CaCl 2 добавляли к серии w PC– (1 — w ) H 2 O водные растворы, которые были приготовлены ранее для получения NaCl ( m ) — w PC– (1 — w ) H 2 O и CaCl 2 ( m ) — w PC– (1 — w ) H 2 O трехкомпонентная смесь растворы электролитов. Максимальная изученная концентрация электролита в этой статье была близка к растворимости электролита в смешанные растворители при комнатной температуре.Каждый компонент в электролитах взвешивался на электронных весах (АЛ204, МЕТТЛЕР-ИНСТРУМЕНТ) с точность g.
Электропроводность измерения были выполнены электрохимической рабочей станцией Chenhua (CHI660, CHENHUA) с использованием метода импеданса переменного тока. Амплитуда напряжения составляла 10 мВ, а частота — от 20 до 100 кГц. κ был рассчитан согласно кривой Z′Z ″. Более подробную информацию можно найти в ссылке. 36 Электрод в ячейка была сделана из Pt.Температура контролировалась водяным термостатом. (Polyscience) с точностью ± 0,01 К. Перед измерением образцы выдерживали при постоянной температуре 15 мин. Каждое измерение повторяли трижды, и рассчитывали средние значения. После измерения каждой группы образцов, ячейка была промыта абсолютный этанол и чистая вода последовательно для удаления загрязняющих веществ. Константу ячейки определяли путем калибровки с использованием водного раствора. 1 M KCl при 293 K перед каждым измерением образца.Относительный стандарт Погрешность электропроводности составила 0,5%.
4. Результаты и обсуждение
4.1. Экспериментальный Данные
Надежность измерения подтверждено сравнением экспериментальных данных систем NaCl – H 2 O и CaCl 2 –H 2 O с доступными литературными данными, показанными в и, соответственно. В, тенденция наших экспериментальных данных согласуется с тем, что литературных данных. Однако в 5.89 моль кг –1 , аппроксимирующее значение наших экспериментальных данных составляет 212,76 мСм см –1 , что на 3,24% выше литературных данных. при 206,18 мСм см –1 . Отклонение может быть связано с приготовление растворов, тип электродов и так далее, но это в пределах приемлемый диапазон. В сначала увеличивается проводимость раствора, а затем уменьшается с увеличением концентрации, и есть максимум стоимость. Экспериментальные и литературные данные хорошо согласуются.
Электрооборудование электропроводности смесей NaCl – H 2 O от моляльности м при 293,15 К. Сплошной кружок представляет эта работа, а сплошная коробка представляет работу Бештера-Рогача. и другие. 30
Электрооборудование электропроводности смесей CaCl 2 –H 2 O от моляльности м при 293,15 К. круг представляет эту работу, а сплошная рамка представляет работу Изоно. 37
Электропроводность NaCl в PC – H 2 O смешанная растворитель на 283.15–328,15 К и проводимость CaCl 2 в смешанном растворителе PC – H 2 O при 283,15–333,15 K нанесены соответственно в и.
Изменение проводимости κ с моляльностью соли m при различных температурах T и массовых долях растворителя w для NaCl ( m ) — w PC– (1 — w ) H 2 O смеси. Линии представляют собой результаты, коррелированные уравнением 10. (a) — (f) w равны 0,0208, 0,0425, 0,0648, 0,0880, 0.112 и 0,163 соответственно.
Изменить проводимости κ с моляльностью солей м при различных температуры T и массовые доли растворителя w для CaCl 2 ( m ) — w Смеси PC- (1- w ) H 2 O. Линии представляют собой результаты, коррелированные уравнением 10. (a) — (c): w равны 0,0208, 0,0425, и 0,0880 соответственно.
При комнатной температуре растворимость NaCl в смешанном растворителе PC – H 2 O уменьшается с увеличением концентрации PC.В пределах диапазона измерений, указанного в данной статье, максимальная растворимость NaCl составляет около 5,83 моль кг –1 (см. а), а минимальная растворимость составляет около 1,31 моль кг –1 (см. е).
Электропроводность системы NaCl – PC – H 2 O увеличивается с увеличением концентрации электролита на такая же температура. Он поднимается до определенного уровня, а затем тренд имеет тенденцию быть нежным. Основная причина в том, что из-за концентрации электролита увеличивает, с одной стороны, расстояние между анионами и катионами в растворе уменьшается, а также образуются некоторые анионы и катионы. непроводящих ионных пар, что приводит к уменьшению количества свободные ионы, участвующие в проводимости; в то время как с другой стороны, подвижность ионов уменьшается с увеличением концентрации электролита, что приводит к медленному и плавному увеличению проводимости.Это в соответствии с описанием модели в этой статье.
Электропроводность раствора увеличивается с повышением температуры при той же концентрации соли. В области низкой концентрации электролита, изменение проводимости с температурой не очевидно. Однако, в области высокой концентрации электролита электропроводность меняется значительно с температурой. Это можно объяснить тем, что когда концентрация высокая, количество пар ионов больше, чем область низкой концентрации, и ионная ассоциация ослабевает с повышением температуры, что приводит к увеличению количества свободных ионов.Таким образом, проводимость области высокой концентрации более чувствителен к температуре.
Как видно из а – е, на такая же концентрация электролита, проводимость раствора уменьшается с увеличением концентрации ПК в смешанном растворителе. Это явление аналогично системе NaCl – 1,4-диоксан – H 2 O, описанной Bešter-Rogač et al. 30 Это можно отнести к уменьшению диэлектрической проницаемости. константа растворителя с увеличением концентрации ПК.Когда диэлектрическая проницаемость низкая, легче производить ионные ассоциации, приводящие к снижению электропроводности.
иллюстрирует что проводимость системы CaCl 2 –PC – H 2 O демонстрирует параболический тренд, который сначала увеличивается а затем уменьшается по мере увеличения концентрации электролита, и кривая имеет максимальное значение. Это явление отличается от тенденция изменения проводимости с концентрацией электролита в системе NaCl – PC – H 2 O.Возможная причина состоит в том, что Ca 2+ представляет собой двухвалентный ион, который подвергается большему электростатические силы и короткодействующие взаимодействия во время миграции ионов под действием внешнего электрического поля по сравнению с одновалентным На + . В результате резкое снижение его подвижности может наблюдаться в области высоких концентраций электролита, а появляется максимальное значение. Кроме того, тенденция изменения проводимости системы CaCl 2 –PC – H 2 O с температура и концентрация ПК в растворителе соответствуют с системой NaCl – PC – H 2 O.
Взяв систему CaCl 2 — w PC– (1 — w ) H 2 O при w = 0,0208 моль кг –1 например, мы рассчитал энергию активации для каждого раствора при разных концентрациях и построили график зависимости от концентрации, как показано на. Как видно из того, что для этой конкретной системы, с увеличением концентрации электролита активация энергия сначала уменьшается, а затем увеличивается, в пределах 11–14 кДж моль –1 .Концентрация электролита, соответствующая наименьшая энергия активации составляет около 2,3 моль кг –1 , при этом проводимость раствора является наибольшей. В b, предэкспоненциальный Коэффициент увеличивается с увеличением концентрации электролита. Тенденции энергии активации и предэкспоненциального множителя в этой статье равны очень похоже на водную систему LiCl, о которой сообщил Yim и Абу-Лебдех, 14 , в работе которого было считали, что усиленные ион-ионные и ион-растворитель взаимодействия при высоких концентрациях были причиной быстрого увеличения активации энергия.
(a) Энергия активации для CaCl 2 — w PC– (1 — w ) H 2 O как функция концентрации. (b) Предэкспоненциальный множитель для CaCl 2 — w PC– (1 — w ) H 2 O как функция концентрации w : 0,0208.
4.2. Соотношение экспериментальных Данные для NaCl / CaCl
2 –PC – H 2 O РастворыЭлектропроводность Предложенная в данной статье модель используется для корреляции данных (κ, m , T ) для систем NaCl – PC – H 2 O и CaCl 2 –PC – H 2 O.Концентрация электролита, температура и результаты модельной регрессии приведены в таблице 2.
Таблица 2
Расчетные параметры уравнения 10 для NaCl / CaCl 2 –PC – H 2 O и CaCl 2 –PC – H 2 O Растворы при различных составах растворителей| параметры | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| нет. | система | w | T (K) | m (моль кг –1 ) | N p | P 3 | P 31 2 | P 3 | P 4 | n | dP (%) | R 2 | 9038 | 9038 9038 9038 9037 | NaCl– w PC – H 2 O | 0.0208 | 283,15–328,15 | 0,201–5,834 | 72 | 1,818 | –442,0 | 160,4 | –616,1 | 1.000 | 2.38 | |
| 2 | 0,0425 | 283,15–328,15 | 0,209–5,096 | 78 | 1,747 | –425,2 | 68,54 | 0,96–132602 | –1326 | 02 | –1326 | 02 | –1326 | 02 | –1326 | 02 | –132602 | |||||||||
| 3 | 0.0648 | 283,15–328,15 | 0,223–4,548 | 72 | 1,743 | –429,7 | 332,7 | –1845,4 | 0,994 | 1,36 | ||||||||||||||||
| 4 | 0,0880 | 283,15–328,15 | 0,199–4,073 | 66 | 1,721 | –423,3 | 558,1 | 0,9661,96–3461.9 | –3461.9 | –3461.9|||||||||||||||||
| 5 | 0.112 | 283,15–328,15 | 0,207–3,599 | 60 | 1,654 | –411,3 | 58,3 | –176,5 | 0,931 | 0,95 | 0,9998. | |||||||||||||||
| 6 | 0,163 | 283,15–328,15 | 0,193–1,307 | 42 | 1,876 | –451,2 | 84,9 | 9038–178,5–178,5|||||||||||||||||||
| 1 | CaCl 2 — w PC – H 2 O | 0.0208 | 283,15–333,15 | 0,100–4,903 | 42 | 2,808 | –663,3 | 225,2 | –386,2 | 0,995 | 2,35 | 0,999 | ||||||||||||||
| 2 | 0,0425 | 283,15–333,15 | 0,125–4,605 | 54 | 2,800 | –663,3 | 319,8 | 0,96356 | –6356,4 | –6356,4 | –6356,4 | |||||||||||||||
| 3 | 0.0648 | 283,15–333,15 | 0,117–3,309 | 42 | 3,099 | –746,2 | 426,2 | –762,4 | 1,029 | 2,18 | 0,9987. | |||||||||||||||
Формула расчета среднего относительное отклонение как следует:
11
, где Np — количество экспериментальных точек данных.
Результаты показывают, что для системы NaCl – PC – H 2 O среднее относительное отклонение экспериментальных данных от расчетного значения модели ( dP ) ≤2.76%, и R 2 ≥ 0,9981. Для системы CaCl 2 –PC – H 2 O, dP ≤ 4,18% и R 2 ≥ 0,9943.
Следует отметить, что, поскольку NaCl является сильным электролитом в Система NaCl – PC – H 2 O, связь между количество свободных ионов в растворе и концентрация электролита приблизительно линейный. Таким образом, значение n равно примерно равняется 1, что соответствует системе CaCl 2 –PC – H 2 O.Когда n равно 1, уравнение 6 можно упростить как уравнение 12 при изотермическом условий, что согласуется с моделью, предложенной Yim et al. al. 13 на основе теории свободного объема.
12
В целом, ошибка модели, предложенной в данной статье для регрессия данных (κ, м , T ) NaCl и CaCl 2 в бинарных растворителях PC – H 2 O находится в допустимом диапазоне.
4.3. Корреляция литературных данных
Уравнение 10 использовалось для корреляции опытный (κ, м , T ) данные 28 систем, представленных в литературе, среди которых 19 системы бинарных растворителей, а девять — чистые органические или водные растворители. системы.Количество экспериментальных точек ( Np ) для в каждой системе не менее 36, что исключает возможность переобучения. Состав системы, температуры, регрессия результаты и другие данные приведены в таблице 3.
Таблица 3
Расчетные параметры уравнения 8 справочного материала Данные в разных Диапазоны концентрации и температуры a| параметры | 67 | система | w | T (K) | м (моль кг –1 ) | N p | P 3 | P 31 2 | P 3 | P 4 | n | ε | dP (%) | R 79 9037 9037 9037 903 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | C 2 F 5 Li 2 NO 7 S 3 — w DMC – EC | 0.494 | 298,15–348,15 | 0,0547–0,735 | 36 | 0,0155 | –34,25 | 273,5 | –154,9 | 0,759 | 0,39 | C 2 F 6 LiNO 4 S 2 — w DMC – EC | 0,665 | 298,15–368,15 | 0,100–1,798 | 64 | 0,02463 | .19250,5 | –4,044 | 0,836 | 32,3 | 1,09 | 0,9991 | (38) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 | C 3 F 8 N 2 2 8 S 4 — w DMC – EC | 0,494 | 298,15–348,15 | 0,0504–0,742 | 36 | 0,2663 | –49,99 | –49,99 | 299,8 | – | – | 0.78 | 0,9994 | (38) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 | C 4 F 9 LiO 6 S 3 — w DMC – EC | 0,494 | .15 298.152–348 –1,846 | 36 | 0,3366 | –74,88 | 226,5 | –120,8 | 0,887 | 47,2 | 0,70 | 0,9997 | (38) | 9007 900 | 9007 900 Li 2 НЕТ 10 S 5 — w DMC – EC | 0.665 | 298,15–348,15 | 0,0302–0,397 | 36 | 0,2617 | –49,61 | 396,2 | –95,25 | 0,889 | 32,3 | 0,70 | C 7 F 15 LiO 6 S 3 — w DMC – EC | 0,665 | 298,15–348,15 | 0,0967–1,303 | 36 | 0,275614 | .51292,8 | –71,33 | 0,876 | 47,8 | 0,44 | 0,9998 | (38) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7 | C 9 F 18 Li 6 — w DMC – EC | 0,494 | 278,15–348,15 | 0,101–0,612 | 48 | 0,6756 | –152,8 | 539,3 | –1756,5 | 6–1756100,9992 | (38) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 8 | C 9 F 18 Li 2 O 12 S 6 — w DMC – EC | 0.905 | 27 348,15 | 0,0779–0,6919 | 48 | 1,0524 | –228,4 | 1206,5 | –81,56 | 1,716 | 11,4 | 9038 LiO 3 S– w DMC – EC | 0.665 | 298,15–368,15 | 0,202–1,475 | 64 | 0,0586 | –12,85 | 140,9 | –101,0 | 0,632 | 32,3 | 90379037 | LiPF 6 — w DMC – EC | 0,494 | 298,15–358,15 | 0,1158–2,243 | 56 | 0,3785 | –77,67 | 150.932 | 47,2 | 1,63 | 0,9987 | (38) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 11 | LiPF 6 — w EMC – EC | 0,612 | 298,152–34843 | 0,2695 | –56,04 | 151,3 | –142,0 | 0,911 | 36,5 | 1,12 | 0,9993 | (38) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 12B | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 12B | Li 0.400 | 243,65–332,15 | 0,265–2,051 | 160 | 0,0528 | –11,41 | 102,3 | 147,5 | 0,610 | 80,2 | 0,66 0,66LiBF 4 — w PC – DEC | 0,700 | 243,65–332,155 | 0,257–2,061 | 160 | 0,1059 | –23,75 | 132,86 | 132,86 152 | .57772,6 | 1,57 | 0,9996 | (39) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 14 | LiBF 4 — w PC – DEC | 0,900 | 243,65–2322 | 243,65–2322 | 0,1382 | –31,88 | 144,4 | 158,1 | 0,587 | 67,5 | 1,47 | 0,9996 | (38) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 15 | 6 LiP .300272,95–332,15 | 0,259–2,316 | 98 | 0,2182 | –45,04 | 188,3 | 132,3 | 1,058 | 82,7 | LiPF 6 — w PC – DEC | 0,700 | 272,95–332,15 | 0,302–2,312 | 98 | 0,4187 | –93,51 | 224,3 | 224,3 | 10072,6 | 3,29 | 0,9984 | (36) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 17 | LiPF 6 — w PC – DEC | 0,900 | 282,82–3323 № 2 –H 2 O | 0.298 | 278,15–308,15 | 0,0115–0,482 | 70 | 0,2781 | –68,26 | 51,53 | 115,7 | 0,850 | 0,67 | NaCl– w C 4 H 8 O 2 –H 2 O | 0,110 | 278,15–308,15 | 0,0496–2,333 | 49 | 0,936 | –2326,2 | –2326,2 | –2326,2 | –2326,281 | 181,3 | 0,959 | 1,84 | 0,9998 | (30) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 20 | C 2 F 6 LiNO 4 S 8 | LiNO 4 S 2 –– –368,150,301–2,605 | 49 | 0,0766 | –5,25 | 378,5 | 17,17 | 2,130 | 4,99 | F 9 LiO 6 S 3 –DMC | 298. | 15-348.15 0.406-2.525 | 36 | 0,2178 -35,68 | 405,7 17,35 | 1,802 | 1,74 0,9975 | (38) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 22 | С 7 F 15 LiO 6 S 3 –DMC | 298,15–348,15 | 0,204–1,773 | 30 | 0,2681 | –52,06 | 697,7 126,66 | 697,7 126,66 | 876 | 3,16 | 0,9986 | (38) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 23 | LiPF 6 –EMC | 298,15–348,15 | 0,510–2,86 | 0,510–2,86 283,8 | 106,6 | 2,597 | 1,58 | 0,9993 | (38) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 24 | LiBF 4 –PC | 32 243,65.286–2,358 | 160 | 0,1491 | –34,67 | 144,4 | 164,8 | 0,594 | 1,88 | 0,9994 | (39) | 900P | (39) | 282,85–332,15 | 0,280–2,324 | 70 | 0,4900 | –112,8 | 228,3 | 169,0 | 1,180 | 14 –PC | 273.15–313,15 | 0,03–1 b | 160 | 0,4902 | –114,2 | 218,2 | 201,3 | 0,4475 | 4,29 | 9038 HBF 4 –H 2 O | 286,95–319,05 | 0,111–0,493 c | 156 | 0,2452 | –54,47 | –126,4 | –126,4 | 28756 285482 | 1,49 | 0,9929 | (41) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 28 | KOH – H 2 O | 263,15–373,15 | 2 | 163,15–373,15 | 0,15–0,45 | с | –7643 | 2548,8 | –153,8 | 1,552 | 3,20 | 0,9972 | (25) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Среднее значение | 1,87 | 1,87 | Из таблицы 3 видно, что в широком диапазоне концентраций и при разных температурах модель, предложенная в этой статье, хорошо применима к солям лития. в бинарной органической карбонатной системе (№№1–16) и NaCl – C 4 H 8 O 2 –H 2 Система O (№№ 17 и 18) с dP ≤ 3,29% и R 2 ≥ 0,9974, особенно в в некоторых системах R 2 ≥ 0,9999.||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lin et
др. модель | Fu et al.
др. модель | эта работа c | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| система | T (K) | x | N p | dR 2 | dP (%) | R 2 | dP (%) | R 2 | 89037 9037 источник данных [EMIM] [C 2 N 3 ] –H 2 O | 293.2–353,2 | 0,2–0,8 | 52 | 7,8 | 0,9994 | 0,96 | 0,9993 | 0,91 | 0,9994 | (43) | 900 | |||
| 900 ] –H 2 O | 293,2–343,2 | 0,2–0,8 | 44 | 1,4 | 0,9994 | 0,80 | 0,9998 | 1,29 | 0,9994 | [EtSO 4 ] –H 2 O | 293.2–353,2 | 0,2–0,8 | 52 | 2,4 | 0,9991 | 0,60 | 0,9999 | 2,22 | 0,9991 | (44) | |||
| [] EMIM 353,15 | 0,05–1 | 132 | 3,68 | 0,9917 | 2,16 | 0,9947 | 2,54 | 0,9930 | (23) | ||||||||||||||
| GBI 900 [BMIIM] 900 [BMI79] | 293,15–353,15 | 0.1–1 | 130 | 1,76 | 0,9982 | 2,94 | 0,9952 | (27) | |||||||||||||||
| [BMIM] [TFSI] [TFSI] –EC.15382 900–79 b 1 | 0,1–1 | 90 | 1,68 | 0,9986 | 3,95 | 0,9921 | (27) | ||||||||||||||||
Как видно из таблицы 4 для ионной жидкости системы водных растворов, максимальное значение dP предлагаемых нами Пятипараметрическая модель — 2.22%, что намного меньше, чем 7,8% в шестипараметрической модели Линя, и R 2 предлагаемой модели лучше чем у модели Лина. В модели Лина проводимость относится к 0,5-й степени концентрации электролита, а в нашей модели n вводится для описания нелинейного отклонение соотношения между свободным ионом и электролитом концентрация в растворе, которая может лучше описать взаимосвязь между проводимостью и концентрацией электролита.В итоге, наша модель может получить лучшие результаты регрессии с меньшим количеством параметров. Кроме того, следует отметить, что модель Линя подходит только для чистой системы растворителей, а не для смешанных систем растворителей.
Для чистая система растворителей, dP Fu’s семипараметрическая модель меньше по сравнению с предлагаемой нами моделью, но в R 2 особой разницы нет. Предлагаемая нами модель может хорошо соответствовать экспериментальным данным с меньшими затратами. параметры. Для систем со смешанными растворителями dP of модель Fu немного лучше, чем у предлагаемой модели, которая можно отнести к смешанному растворителю; встретившее сопротивление ионами в направленной миграции сложнее, чем что в одном растворителе.Модель Fu использует больше связанных с концентрацией параметры для коррекции влияния концентрации на ионную проводимость, что может дать более подходящий эффект. Однако наличие большее количество параметров в модели Fu означает, что требуется больше времени для решить уравнение. Использование системы [BMIM] [TFSI] –PC – GBL в качестве примера при той же конфигурации оборудования мы сравнили время расчета различных моделей с помощью программного комплекса 1 стОпт . В модели Фу требуется 95,8 с, чтобы найти решение, в то время как предлагаемая модель занимает всего 62.8 с, что составляет 34,4% меньше.
% PDF-1.5 % 1 0 объект > эндобдж 4 0 obj > эндобдж 2 0 obj > ручей 2021-07-30T14: 31: 10ZTeX2021-07-30T17: 38: 31 + 03: 002021-07-30T17: 38: 31 + 03: 00Это pdfTeX, версия 3.14159265-2.6-1.40.21 (TeX Live 2020) kpathsea версия 6.3.2pdfTeX-1.40.21Falseuuid: 2edb62a9-f251-4c90-848c-aa6c49d84769uuid: 1eff48d9-3a35-4ca8-8344-6d2af
d5application / pdf конечный поток эндобдж 3 0 obj > эндобдж 5 0 obj > эндобдж 6 0 obj > эндобдж 7 0 объект > эндобдж 8 0 объект > эндобдж 9 0 объект > эндобдж 10 0 obj > эндобдж 11 0 объект > эндобдж 12 0 объект > эндобдж 13 0 объект > эндобдж 14 0 объект > эндобдж 15 0 объект > эндобдж 16 0 объект > эндобдж 17 0 объект > эндобдж 18 0 объект > эндобдж 19 0 объект > эндобдж 20 0 объект > эндобдж 21 0 объект > эндобдж 22 0 объект > эндобдж 23 0 объект > эндобдж 24 0 объект > эндобдж 25 0 объект > эндобдж 26 0 объект > ручей xWK6WVUI & mH + s-be) z} ^ mS / «97 ~ 5W2KR ݪ i- ,.vO8’87yY% [% Z $ fZoZLn
Электролитные и кислотно-щелочные нарушения при хронической болезни почек и терминальной стадии почечной недостаточности — FullText — Blood Purification 2017, Vol. 43, № 1-3
Абстрактные
Почки играют ключевую роль в регулировании электролитного и кислотно-щелочного баланса. При прогрессирующей потере функции почек неизбежно возникают нарушения электролитов и кислотно-щелочного баланса, что приводит к плохим результатам для пациентов. Поскольку хроническая болезнь почек (ХБП) стала всемирной эпидемией, медицинские работники все чаще сталкиваются с такими проблемами.Адекватная диагностика и лечение минимизируют осложнения и потенциально могут спасти жизнь. В этом обзоре мы обсуждаем текущее понимание процесса болезни, клинические проявления, стратегии диагностики и лечения, объединяя современные знания в этой области. Хотя электролитные и кислотно-щелочные нарушения являются важными причинами заболеваемости и смертности у пациентов с ХБП и терминальной стадией почечной недостаточности, их можно эффективно лечить за счет своевременного принятия комбинированных профилактических мер и фармакологической терапии.Захватывающие достижения и несколько предстоящих испытаний результатов предоставят дополнительную информацию для руководства лечением и улучшения результатов для пациентов.
© 2017 S. Karger AG, Базель
Введение
Хроническая болезнь почек (ХБП) стала глобальной эпидемией с предполагаемой распространенностью 14% в США и 5-15% во всем мире [1,2]. Это связано с повышенным риском неблагоприятных сердечно-сосудистых исходов, прогрессированием до терминальной стадии почечной недостаточности (ТПН) и снижением выживаемости.Поскольку почки играют центральную роль в регулировании жидкостей организма, электролитов и кислотно-щелочного баланса, ХБП и ТПН предсказуемо приводят к множественным нарушениям, включая гиперкалиемию, метаболический ацидоз и гиперфосфатемию, которые, в свою очередь, приводят к серьезным осложнениям, включая истощение мышц и костей. -минеральное нарушение, кальцификация сосудов и смертность. Хотя у пациентов с ТПН некоторые нарушения можно исправить с помощью заместительной почечной терапии, существующие методы диализа далеки от идеала.В этом обзоре мы обсуждаем текущее понимание процесса заболевания, диагностики и стратегий лечения в областях электролитной и кислотно-щелочной регуляции, относящейся к ХБП и ТПН, с особым акцентом на дискалиемию, ацидоз и нарушение минеральных костей (MBD).
Калийные расстройства
Калий (K) является наиболее распространенным внутриклеточным катионом, при этом> 98% всего калия в организме находится внутриклеточно и <2% внеклеточно. Крутой трансклеточный градиент K, генерируемый энергозависимым (Na-K-ATPase) способом, жизненно важен для поддержания потенциала клеточной мембраны и множества клеточных функций.Почки, в ответ на повышение уровня калия в сыворотке крови, альдостерона, дистального почечного канальцевого поступления натрия (Na) и канальцевого потока жидкости, выделяют 98% суточного потребления калия и являются органами, которые играют важную роль в поддержании гомеостаза калия. ХБП и ХПН неизбежно приводят к нарушениям К и повышенному риску неблагоприятных сердечно-сосудистых событий и смертности [3].
Гиперкалиемия
Гиперкалиемия — одно из наиболее распространенных и опасных для жизни электролитных нарушений при ХБП и ХПН [4]. Он становится все более распространенным по мере развития ХБП [5,] [6].Гиперкалиемия условно классифицируется на легкую (5,1- <6 ммоль / л), умеренную (6- <7 ммоль / л) и тяжелую (≥7 ммоль / л) [7]. Диагноз гиперкалиемии должен быть подтвержден, чтобы исключить псевдогиперкалиемию, которая может быть вызвана неправильной техникой флеботомии, гемолизом в пробирке, тромбоцитозом и лейкоцитозом [8]. Хотя гиперкалиемия в первую очередь вызвана снижением функции почек, гиперкалиемия также может быть вызвана или обострена (1) транс-клеточным сдвигом из-за дефицита инсулина, минерального метаболического ацидоза и разрушения тканей (гемолиз, рабдомиолиз, лизис опухоли и ишемия тканей), (2) высокое потребление калия (обычно у пациентов с хронической почечной недостаточностью) и (3) вызванные приемом лекарств дефекты почечной экскреции калия, чаще всего ингибиторы ангиотензинпревращающего фермента (АПФ), блокаторы рецепторов ангиотензина (БРА), антагонисты минералокортикоидных рецепторов, сберегающие калий диуретики и ингибиторы кальциневрина.Пациенты с диабетом и ХБП также подвержены риску развития гиперкалиемии из-за гипоренинемического гипоальдостеронизма (почечный канальцевый ацидоз 4 типа).
Клинические проявления гиперкалиемии широко варьируются от неспецифической мышечной слабости до парестезии, паралича, сердечной аритмии и остановки сердца. Решающее значение имеют сердечные проявления гиперкалиемии. Гиперкалиемия снижает трансмембранный градиент K и может вызвать множественные электрокардиографические изменения, включая пиковые зубцы T, удлинение интервала PR, потерю зубцов P и расширение комплекса QRS [9].Однако следует отметить, что сама ЭКГ нечувствительна к выявлению гиперкалиемии. У пациентов с ХБП может быть тяжелая гиперкалиемия без каких-либо проявлений на ЭКГ [10]. У пациентов с имплантированным кардиовертером / дефибриллятором тяжелая гиперкалиемия может изменить порог срабатывания устройства, что приведет к заниженной или избыточной чувствительности и возникновению несоответствующего электрошока [11].
Другой все более распространенный и сложный сценарий — невозможность использовать многие потенциально спасающие жизнь методы лечения пациентов с ХБП из-за гиперкалиемии.Убедительным примером является использование ингибиторов ренин-ангиотензин-альдостерона (РААС). Имеются убедительные доказательства, подтверждающие пользу ингибиторов РААС при сердечной недостаточности, остром коронарном синдроме, ХБП и диабетической нефропатии; тем не менее, гиперкалиемия часто ограничивает их использование. Исследование базы данных (n = 205 108) пациентов, принимавших ингибиторы РААС, показало, что ингибиторы РААС были отменены у 16-18% пациентов из-за гиперкалиемии, связанной с приемом лекарств. Среди тех, кто прекратил прием ингибиторов РААС, уровень смертности был в три раза выше, чем среди тех, кто продолжал лечение [12].
До недавнего времени терапевтические возможности гиперкалиемии ограничивались диетой с низким содержанием калия, прекращением приема ингибиторов РААС и назначением петлевых или тиазидных диуретиков и перорального полистиролсульфоната натрия (полимера, который обменивает Na на K, кальций, аммоний и магний ( Mg) [13]). Хотя в 1958 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило использование полистиролсульфоната натрия для лечения гиперкалиемии, в исследованиях на людях или животных не было показано, что он увеличивает потерю калия в фекалиях. Недавнее рандомизированное контролируемое исследование показало снижение калия в когорте пациентов с ХБП (n = 33) с легкой гиперкалиемией [14].Сообщалось о смертельном некрозе толстой кишки и перфорации при его применении [15].
Патиромер — это новый калия-понижающий агент, неабсорбируемый сорбитолсодержащий кальций-K-обменный полимер, который связывает K в основном в толстой кишке [16]. У здоровых людей патиромер демонстрирует дозозависимое снижение содержания калия, натрия, фосфата и магния в моче, что согласуется с повышенным связыванием этих ионов в кишечнике. Он, напротив, увеличивает выведение кальция с мочой, отражая его способность высвобождать кальций [22].Начало действия — 7 ч. Исследование OPAL-HK [17] продемонстрировало достижение нормокалиемии через 4 недели лечения патиромером у 76% пациентов с гиперкалиемией ХБП 3 и 4 стадии (n = 237), получавших ингибиторы РААС. В исследовании AMETHYST-DN [18] с участием пациентов 3 и 4 стадии ХБП (n = 306), принимавших ингибиторы РААС с диабетом и гиперкалиемией, значительное снижение калия было достигнуто при применении патиромера на 4 неделе, а эффект сохранялся в течение 52 недель во время лечения. Основными побочными эффектами были запор легкой и средней степени тяжести (11%) и легкая гипомагниемия (3%).В дополнение к снижению K, лечение патиромером было связано со значительным снижением сывороточного альдостерона и артериального давления [19]. Таким образом, патиромер может оказывать долгосрочное защитное действие на органы за счет снижения уровня альдостерона [20,21]. Патиромер получил одобрение FDA во второй половине 2015 года для лечения гиперкалиемии у недиализных пациентов с ХБП в неострых условиях. Он выпускается в виде порошка (в трех дозах: 8,4, 16,2 и 25,2 г) с максимальной рекомендуемой дозой 25,2 г в день. Что касается риска лекарственного взаимодействия, его прием следует отделять> 6 часов от приема других лекарств.
ZS-9, циклоцилат циркония натрия, является еще одним новым агентом, снижающим калий. Это обменник Na-K, который улавливает K по всему желудочно-кишечному тракту. Действие наступает через 2 часа [23,24]. В исследовании HARMONIZE пациенты с гиперкалиемией (n = 258) получали 10 г ZS-9 (3 раза в день). Девяносто процентов из них достигли нормокалиемии со средним временем нормализации 2,2 часа [24]. В рандомизированной фазе того же исследования, 5, 10 и 15 г в день или плацебо в течение всего 28 дней, уровень K был значительно снижен при всех трех дозах по сравнению с плацебо.У 6% пациентов, получавших 10 г, и у 14% пациентов, получавших 15 г, развились периферические отеки. ZS-9 еще не получил одобрения FDA. Учитывая относительно быстрое начало его гипокалиемического действия, он может оказать положительное влияние на неотложную помощь при гиперкалиемии.
И патиромер, и ZS-9 обещают контролировать интердиалитическую гиперкалиемию. В недавнем исследовании, подтверждающем концепцию, патиромер, применявшийся у шести гемодиализных пациентов, оказался эффективным в снижении интердиалитической гиперкалиемии [25].При тяжелой гиперкалиемии, не поддающейся лечению, диализ остается наиболее эффективным методом лечения.
Гипокалиемия
Гипокалиемия не менее опасна, но у пациентов с ХЗП встречается реже, поскольку нарушение выведения калия почками обычно приводит к гиперкалиемии. Однако у пациентов с ХБП может развиться гипокалиемия из-за потери калия в желудочно-кишечном тракте из-за диареи или рвоты или из-за потери калия почками из-за несберегающих калия диуретиков. Дефицит калия усиливает пагубное влияние избытка натрия (наблюдается у пациентов, соблюдающих обычную западную диету).Совпадающие данные указывают на патогенную роль сочетания высокого содержания натрия в организме и низкого содержания калия в развитии гипертонии и сердечно-сосудистых осложнений, связанных с гипертензией [26]. Более того, K способен оказывать защитное действие на сосуды независимо от его антигипертензивного действия [27]. Острая гипокалиемия может вызвать паралич, кишечную непроходимость и сердечную аритмию. Управление включает пополнение K и тщательный мониторинг.
Гипокалиемия также может возникать у диализных пациентов, в основном из-за воздействия диализата с низким содержанием K (≤2 K).Постдиализная гипокалиемия связана с опасными для жизни сердечными аритмиями и внезапной сердечной смертью. Последний является основной причиной смерти диализной популяции, на которую приходится 25% всех причин смертности и 67% всех сердечных смертей [28,29]. Восприимчивость к сердечно-сосудистым событиям, вызванным гипокалиемией, может быть связана с основными сердечно-сосудистыми заболеваниями, встречающимися у большинства пациентов с ТПН [28,30].
Диализ, особенно с диализатом с низким содержанием K, предсказуемо вызывает большой трансмембранный сдвиг K, который считается основным фактором возникновения сердечных событий.Низкий K диализата и удаление большего объема были связаны с более высокой частотой фибрилляции предсердий и более высокой частотой преждевременных сокращений желудочков [31]. В исследовании «случай-контроль» с участием диализных пациентов (n = 43000) воздействие диализата K <2 мэкв / л удваивало риск внезапной остановки сердца независимо от уровня K до диализа [32]. Аналогичным образом, в анализе результатов диализа и моделей практики (DOPPS) у пациентов, находящихся на гемодиализе (n = 37 765) в 12 разных странах, использование диализата с низким содержанием K (1 или 2-2.5 K) был независимо связан с более высоким риском внезапной сердечной смерти и смертности от всех причин по сравнению с использованием диализата с более высоким K (≥3 K мэкв / л) [33]. Другие способствующие факторы включают длительный (2 дня) междиализный интервал [34,] [35], быстрое и большое удаление жидкости, низкий уровень кальция и магния в диализате [33,36]. Текущие рекомендации заключаются в использовании диализата ≥3K для пациентов с преддиализным уровнем K сыворотки <5 ммоль / л [33]. Однако у пациентов с преддиализной гиперкалиемией (K> 5,5 мэкв / л) по-прежнему используется диализат с более низким содержанием K.Задача состоит в том, чтобы сбалансировать необходимость лечения гиперкалиемии перед диализом и предотвращения гипокалиемии после диализа. Различные стратегии, такие как профилирование K [37], более длительный и более частый диализ и контроль интердиализной гиперкалиемии с помощью патиромера / ZS-9, могут быть изучены как потенциальные способы минимизировать связанную с диализом гипокалиемию и ее осложнения.
Метаболический ацидоз
В физиологических условиях почечные канальцы реабсорбируют ~ 4 500 ммоль профильтрованного бикарбоната ежедневно.Кроме того, почечные канальцы генерируют ~ 80 мЭкв, чтобы нейтрализовать дневную чистую выработку кислоты у взрослого человека нормального размера. Почки также обладают большой способностью выводить избыток кислоты за счет образования аммиака (NH 3 ) и выделения (NH 4 + ). При снижении функции почек способность к сохранению и генерации бикарбонатов снижается, в то время как чистая выработка эндогенной кислоты при ХБП остается неизменной, что приводит к возникновению ацидоза [38]. Уменьшение количества функционирующих нефронов при ХБП также снижает способность почек выводить избыток кислоты (в форме NH 4 + посредством образования аммиака [38,39]).Примечательно, что каждый остаточно функционирующий нефрон, однако, подвергается гипертрофии и компенсаторно генерирует большое количество NH 3 [40,41]. Исследования показали повышенную экспрессию NH 3 / NH 4 + транспортеров RHCG и RHDG на апикальной и базолатеральной мембранах почечных канальцев [40]. Последующее увеличение внутрипочечного NH 3 / NH 4 + может активировать путь комплемента, ведущий к тубулоинтерстициальному воспалению и повреждению [42].Избыток кислоты также увеличивает выработку эндотелина-1 и альдостерона [43,44], ускоряя прогрессирование ХБП [38,45,46,47].
Клинически метаболический ацидоз считается присутствующим, когда уровень бикарбоната в сыворотке падает ниже 22 ммоль / л. При поперечном анализе исходных данных когортного исследования хронической почечной недостаточности у пациентов с ХБП 2-4 стадии (n = 3900) распространенность бикарбоната сыворотки <22 ммоль / л составила 17,3% в целом, 7, 13 и 33% для 2, 3 и 4 стадии ХБП соответственно [48].
Известно, что метаболический ацидоз не только способствует прогрессированию ХБП, но и вызывает катаболизм белков, мышечное истощение, деминерализацию костей, инсулинорезистентность, нарушение секреции гормона щитовидной железы и гормона роста, обострение накопления β2-микроглобулина [49,50] и повышение смертности [46]. , 51]. Недавнее исследование пациентов с ХБП (n = 1065) со средней скоростью клубочковой фильтрации (СКФ) 37,6 мл / мин / 1,73 м 2 с наблюдением в течение 4,3 года показало, что более низкая экскреция аммиака с мочой (чистый положительный кислотный баланс) была связана с более быстрое снижение СКФ и прогрессирование ХБП до ТПН (HR 1.82 с 95% доверительным интервалом 1,06–3,13) [38]. В мультиэтническом исследовании атеросклероза с участием участников с расчетной СКФ (рСКФ) (> 60 мл / мин / 1,73 м 2 ) более низкий уровень бикарбоната <21 ммоль / л по сравнению с бикарбонатом 23-24 ммоль / л был связан с ускоренное снижение функции почек (снижение рСКФ> 5% в год) [52]. В совокупности метаболический ацидоз связан с ускоренным прогрессированием ХБП и повышенной смертностью от всех причин.
Благоприятные эффекты коррекции ацидоза были отмечены в нескольких исследованиях [42,53,54,55].Phisitkul et al. [55] также продемонстрировали снижение экскреции эндотелина-1 и N-ацетил-бета-D-глюкозаминидазы (маркер тубуло-интерстициального повреждения) в моче и замедление прогрессирования ХБП при пероральном приеме щелочи (цитрата натрия) у пациентов с ХБП. В одном слепом исследовании с участием 20 пациентов с ХЗП (рСКФ 15–45 мл / мин / 1,73 м 2 ) с бикарбонатом сыворотки 20–24 ммоль / л пероральный прием NaHCO 3 улучшил мышечную силу нижних конечностей [56]. Рекомендации KDIGO 2012 г. рекомендовали пероральный NaHCO 3 для пациентов с ХБП с NaHCO 3 <22 ммоль / л [57].Интересно, что Goraya et al. [58] показали положительный эффект перорального NaHCO 3 или диетической щелочи (фрукты и овощи) в сохранении функции почек в когорте пациентов с ХЗП 3 стадии с сохраненным уровнем NaHCO 3 (22-24 ммоль / л), что позволяет предположить потенциальная польза от ранней оптимизации диеты.
Верхний целевой уровень бикарбоната сыворотки для пациентов с ХБП не установлен. В различных исследованиях использовались разные целевые уровни бикарбоната в сыворотке. Соответствующий верхний целевой показатель важен, поскольку исследования показали U-образную связь между смертностью и бикарбонатом сыворотки, при этом повышенный уровень бикарбоната сыворотки (> 26 ммоль / л) связан с повышенным риском смертности [51,59].В настоящее время проводится несколько рандомизированных клинических испытаний, в которых оценивается влияние NaHCO 3 на функцию почек, частоту ХЗП, смертность, маркеры метаболизма костной ткани, силу мышц и качество жизни [60, 61, 62]. Результаты этих исследований прояснят эффекты перорального бикарбоната, а также соответствующие целевые уровни бикарбоната верхней сыворотки.
Большинство клинических данных, связанных с ацидозом, получены от пациентов с ХБП, а не конкретно от диализных пациентов. Учитывая известную патобиологию ацидоза, мы ожидаем аналогичного негативного воздействия на заболеваемость и смертность у диализных пациентов.Уникальным аспектом пациентов, находящихся на гемодиализе, является подверженность значительным колебаниям кислотно-основного статуса с каждым эпизодом диализа, от различной степени преддиализного ацидоза до алкалоза, быстро корректируемого диализом. Сильное колебание pH за короткий период в 3-4 часа может привести к множеству побочных эффектов. Резкое повышение pH крови (с 37 ммоль / л бикарбоната в диализате) может вызвать гиповентиляцию из-за угнетения центрального дыхательного центра, резкое сокращение тканей O 2 доставки из-за сужения сосудов и сдвига гемоглобина влево-O 2 Кривая диссоциации и резкое снижение ионизированного кальция, приводящее к слабости диафрагмальных мышц.Более того, связывание эндогенной кислоты бикарбонатом может вызывать быстрое накопление CO 2 и парадоксальный внутриклеточный ацидоз, приводящий к множественным дефектам клеточной функции. В исследовании DOPPS пациентов, находящихся на гемодиализе в центре (n = 17 031), использование диализата с более высоким содержанием бикарбоната было связано с более высокой смертностью с расчетным HR на 1,08 / 4 мЭкв / л более высоким содержанием бикарбоната диализата (95% ДИ 1,01–1,15) [ 63]. Взятые вместе, преддиализный ацидоз и быстрая коррекция ацидоза до диапазона алкалоза с помощью диализа могут негативно повлиять на исход пациента.Профилирование бикарбоната во время гемодиализа или дифференцированного бикарбонатного диализата может минимизировать большое кислотно-щелочное колебание. Для изучения этих потенциальных стратегий необходимы дальнейшие исследования.
Нарушения метаболизма костных минералов
Метаболизм костных минералов и кальций-фосфорный гомеостаз включают сложное взаимодействие между почками, кишечником, костями и паращитовидными железами. Метаболизм включает паратироидный гормон (ПТГ), рецепторы витамина D и витамина D, фактор роста фибробластов-23 (FGF23), рецепторы Клото и кальций-чувствительные рецепторы.Поскольку регулируемое выведение кальция и фосфата осуществляется в основном почками, почечная недостаточность неизбежно вызывает нарушения обмена костной ткани и, в большинстве случаев, кальцификации мягких тканей и сосудов, что приводит к увеличению смертности. Эту триаду лабораторных аномалий, костного заболевания и кальцификации мягких тканей собирательно называют МБД [64].
Фосфор в сыворотке может оставаться нормальным у большинства пациентов с ХЗП с рСКФ> 40 мл / мин / 1,73 м 2 из-за активации ПТГ и FGF23 и сопутствующего ингибирования реабсорбции фосфата в проксимальных канальцах [65,66].По мере прогрессирования ХБП экскреторная способность почек истощается, и возникает гиперфосфатемия [65,66,67].
Гиперфосфатемия, вызванная ПТГ, вызывает повышенный метаболизм костной ткани и способствует развитию кистозного фиброзного остеита и остеомаляции. Что еще более важно, гиперфосфатемия способствует остео-хондрогенной трансформации и апоптозу гладкомышечных клеток сосудов и накоплению и минерализации коллагенового матрикса стенок сосудов [68,69,70]. Крупные когортные исследования последовательно показали, что гиперфосфатемия связана с кальцификацией сосудов [71], прогрессированием ХБП [72] и повышенным риском сердечно-сосудистых событий и смертности [73,74,75].В метаанализе 2015 г. 12 когортных исследований недиализных пациентов с ХБП (n = 25 500) наблюдалась независимая связь гиперфосфатемии с риском прогрессирования и смертности ХБП [76]. В совокупности связь сывороточного фосфора с сердечно-сосудистыми событиями и смертностью начинается при высоком нормальном диапазоне фосфора [77,78,79] и встречается у пациентов на всех стадиях ХБП [80,81], а также у пациентов в критическом состоянии с острое повреждение почек, требующее диализа [75]. Однако причинно-следственная связь между гиперфосфатемией и прогрессированием и смертностью от ХБП еще предстоит установить.
Вторичный гиперпаратиреоз развивается у пациентов с ХБП и ТПН из-за гиперфосфатемии, гипокальциемии, дефицита 1,25 (OH) 2 витамина D, устойчивости скелета к витамину D и снижения экспрессии рецепторов, чувствительных к кальцию [82]. Помимо уменьшения реабсорбции фосфора в проксимальных канальцах и увеличения реабсорбции кальция в дистальных отделах, ПТГ увеличивает почечную экспрессию 1α-гидроксилазы и подавляет инактивирующий фермент 24α-гидроксилазу, что приводит к чистому увеличению образования 1,25 (OH) 2 витамина D [83,84,85].ПТГ увеличивает метаболизм костной ткани за счет активации как остеокластов, так и остеобластов, а эффекты опосредуются лигандом RANK и белком-приманкой остеопротегерином [82]. Поражение костной ткани при ХБП-МБД широко варьирует от состояния с высоким метаболизмом костной ткани (кистозно-фиброзный остит) из-за чрезмерного повышения уровня ПТГ до низкого уровня обмена, адинамического состояния, часто из-за чрезмерного подавления ПТГ. Комбинированное повышение уровня ПТГ, кальция и фосфора в уремической среде создает предпосылки для развития высокофатальной кальцифицирующей уремической артериолопатии (кальцифилаксии) [86].
1,25 (OH) 2 витамин D увеличивает кишечное всасывание кальция и фосфора и способствует минерализации костей. Кроме того, витамин D обладает множественными плейотропными эффектами, включая регуляцию роста клеток, дифференцировку и иммунитет, противовоспалительную реакцию, здоровье нейронов, секрецию инсулина и метаболизм липидов [87,88]. Дефицит витамина D у пациентов с ХБП и без него связан с повышенной смертностью [89, 90]. Дефицит витамина D также связан с сердечно-сосудистыми заболеваниями, снижением мышечной силы и когнитивной функции.Пациенты с ХБП более склонны к развитию дефицита витамина D [91]. В когорте NHANES III (n = 15 828) ХБП была связана с дефицитом витамина D на 32% больше, чем у пациентов без ХБП [92].
FGF23, секретируемый остеоцитами в ответ на гиперфосфатемию, является ключевым фосфатурическим и контррегулирующим гормоном витамина D. Он связывается с комплексом рецептор FGF-Klotho и снижает реабсорбцию фосфата в проксимальных канальцах за счет подавления ко-транспортеров Na-фосфата (Na-Pi 2a и 2c) [93]. FGF23 также ингибирует почечную 1α-гидроксилазу и стимулирует инактивацию фермента 24α-гидроксилазы, что приводит к снижению 1,25 (OH) 2 витамина D и 25 (OH) витамина D соответственно [94].В паращитовидной железе FGF23 связывается с комплексом рецептор FGF-Klotho и ингибирует экспрессию и секрецию ПТГ [95]. Эти эффекты, однако, исчезают при ХБП и ТПН из-за снижения экспрессии комплекса рецептор FGF-Klotho [96]. Повышение уровня FGF23 является одним из самых ранних маркеров МПК при ХБП, задолго до повышения уровня ПТГ и фосфатов [97], и является независимым фактором риска гипертрофии левого желудочка [98,99], сердечно-сосудистых событий, прогрессирования ХБП [100] и смертности [101]. ]. Во вложенном исследовании «случай-контроль» у диализных пациентов (n = 400) также наблюдалась сильная связь между повышением уровня FGF23 и смертностью [80].
Лечение CKD-MBD является сложным и состоит из усилий по поддержанию уровней фосфата и кальция в сыворотке в пределах или около нормального диапазона, добавок витамина D или активного витамина D, когда это необходимо, и лечения вторичного гиперпаратиреоза. Лечение гиперфосфатемии требует снижения количества фосфатов с пищей (<1000 мг / день) и использования фосфатсвязывающих средств, которые можно в целом разделить на связывающие вещества на основе кальция и без нее. Многочисленные исследования показали преимущества использования связывающих фосфатов не на основе кальция (севеламер, лантан, цитрат железа и оксигидроксид сахарного железа) по сравнению со связующими на основе кальция (ацетат кальция, карбонат кальция и цитрат кальция) с точки зрения более низкой смертности [102,103,104].Недавний метаанализ 28 рандомизированных контролируемых исследований с участием пациентов с ХБП-МБД (n = 8,335) продемонстрировал более высокую смертность от всех причин при применении связывающих препаратов на основе кальция, чем при применении связывающих препаратов без кальция, ОР 1,76 (95% ДИ 1,21–2,56). ) [103]. Другие исследованные фосфатсвязывающие вещества представляют собой комбинацию ацетата кальция и карбоната магния (CaMg). Рандомизированное контролируемое исследование CALMAG с использованием CaMg по сравнению с севеламером-HCl в популяции диализных пациентов продемонстрировало эффективность комплекса CaMg в снижении уровня фосфора в сыворотке [105].На моделях ХБП грызунов CaMg снижал кальцификацию артерий, что сравнимо с эффектами севеламера-HCL, без чрезмерного подавления метаболизма в костях или накопления Mg в скелете [106,107,108]. CaMg потенциально может быть эффективной альтернативой лечению гиперфосфатемии. Однако необходимы дальнейшие исследования.
KDIGO 2009 CKD-MBD Руководства рекомендуют избегать абсолютного целевого значения ПТГ для недиализных пациентов с ХБП, но следить за тенденцией ПТГ и начинать терапию при значительном повышении ПТГ.Для диализных пациентов рекомендуется целевой диапазон ПТГ, в 2–9 раз превышающий верхний предел нормы [109]. Холекальциферол и эргокальциферол можно использовать для лечения субоптимального статуса витамина D; они могут не подавлять секрецию ПТГ [110]. 1,25 (OH) 2 витамин D и синтетический аналог, такой как парикальцитол, использовались для лечения вторичного гиперпаратиреоза. Цинакальцет, кальцимиметический агент, был одобрен FDA для лечения вторичного гиперпаратиреоза у диализных пациентов. Недавнее обсервационное исследование показало положительные эффекты цинакалцета в снижении уровня паратгормона, кальция и фосфатов у недиализных пациентов с ХБП [111].Для пациентов с третичным гиперпаратиреозом (автономная продукция ПТГ) терапевтические возможности ограничиваются цинакальцетом или субтотальной паратиреоидэктомией [112]. Недавние открытия, касающиеся роли ингибирования пути катенина Wnt / бета в развитии CKD-MBD [113,114], являются захватывающими, предлагая еще один потенциал для будущего терапевтического нацеливания.
Другие нарушения электролитов
Диснатриемия и дисмагниемия — два других основных электролитных нарушения, наблюдаемых при ХБП и ХПН.Этиология, клинические особенности и стратегии лечения этих двух расстройств во многом аналогичны таковым в общей популяции. Ниже мы сосредоточимся на уникальных аспектах, касающихся пациентов с ХБП и ТПН.
Диснатриемия
Диснатриемия обычно указывает на состояние, при котором вода в организме становится избыточной или недостаточной. Гипонатриемия (Na <135 ммоль / л) является наиболее частым нарушением электролитного баланса в сообществе и у пациентов больниц, колеблется от 5 до 30% [115,116,117,118,119,120].Гипернатриемия (Na> 145 ммоль / л) встречается гораздо реже и встречается у ~ 1-4% пациентов стационара [117,121], за исключением пациентов отделения нейроанализа [122]. Пациенты с ХБП следуют аналогичной схеме распределения диснатриемии. В большой группе из 655 000 ветеранов со средней рСКФ 50 мл / мин / 1,73 м 2 гипонатриемия наблюдалась у 13,5%, а гипернатриемия — у 2% [123]. В течение среднего периода наблюдения 5,5 лет у 26 и 7% пациентов развился по крайней мере один эпизод гипо- или гипернатриемии соответственно.Недавний метаанализ 15 исследований показал улучшение показателей смертности при уменьшении гипонатриемии [124].
Помимо причин гипонатриемии, наблюдаемых в общей популяции, пациенты с ХБП подвергаются дополнительному риску гипонатриемии из-за нарушения способности разжижать или концентрировать мочу. Более того, полипрагмазия и ограниченное потребление растворенных веществ [125] являются обычным явлением и могут способствовать нарушениям Na. У диализных пациентов гипонатриемия в основном носит дилюционный характер из-за избыточного потребления воды или гипотонической жидкости.Гипернатриемия, если она устойчива, в основном наблюдается у лиц с нарушенным механизмом жажды и / или отсутствием доступа к воде, как и у населения в целом [126]. Диснатриемия при ХБП и ТПН имеет значение для смертности. U-образная связь между уровнем Na в сыворотке и смертностью была обнаружена как у недиализных пациентов с ХБП [123,127], так и у диализных пациентов [128,129]. Лечение диснатриемии у пациентов с ХБП аналогично лечению у обычных пациентов и должно начинаться с выявления и, если возможно, исправления основной причины.Для диализных пациентов могут быть рассмотрены дополнительные сеансы диализа. Следует избегать быстрой коррекции хронической диснатриемии.
Дисмагниемия
Хотя этиология и проявления дисмагниемии изучались в основном среди населения в целом, как гипо-, так и гипермагниемия часто встречаются у госпитализированных пациентов со сниженной рСКФ [130]. Устойчивая гипермагниемия наблюдается в основном у пациентов с запущенной ХБП и ХПН. Лекарства, содержащие магний, могут способствовать или усугублять гипермагниемию на фоне дисфункции почек.У диализных пациентов содержание Mg в сыворотке крови часто зависит от содержания Mg в диализате. Сакагучи и др. [131] исследовали большую когорту диализных пациентов (n = 142 000) и обнаружили, что гипомагниемия, вызванная диализатом с низким содержанием магния, является значимым предиктором сердечно-сосудистой и несердечно-сосудистой смертности. Подобные результаты показаны у пациентов, находящихся на перитонеальном диализе [132]. В совокупности дисмагниемия влияет на заболеваемость и смертность у пациентов с ХБП и ТПН; Следует проявлять осторожность, чтобы исправить нарушения Mg.
Заключение
Разнообразные электролитные и кислотно-щелочные нарушения предсказуемо возникают с прогрессирующей потерей функции почек. Большинство расстройств неразрывно связаны с заболеваемостью и смертностью. В основном, гиперкалиемия связана с острой сердечной смертью у пациентов с ХБП и ТПН. Новые и более эффективные агенты, патиромер и ZS-9, могут смягчить гиперкалиемию и улучшить результаты лечения пациентов, особенно у тех, кто получает пользу от ингибирования РААС. Точно так же следует тщательно отслеживать и корректировать ацидоз у пациентов с почечной недостаточностью.Новые рандомизированные контролируемые испытания дополнительно прояснят нашу стратегию ведения. MBD при ХБП и ТПН остается болезненным состоянием. Существующие данные свидетельствуют о том, что не содержащие кальций фосфорсвязывающие средства улучшают сердечно-сосудистые исходы. Новые патогенные сигнальные пути продолжают открываться, и в ближайшем будущем, вероятно, появятся новые цели для лечения. Дан краткий обзор нарушений Na и Mg с учетом ограничений по объему. Однако оба состояния могут быть опасными для жизни, и их следует тщательно диагностировать и лечить.Взятые вместе, электролитные и кислотно-щелочные изменения составляют основную часть патологических процессов у пациентов с почечной недостаточностью. Надлежащая диагностика и лечение должны быть неотъемлемой частью лечения ХБП / ТПН для улучшения результатов лечения пациентов.
Ключевые сообщения
• Электролитные и кислотно-основные нарушения при ХБП и ХПН являются обычным явлением и связаны с повышенной заболеваемостью и смертностью.
• Патиромер, кальций-K-обменный полимер, представляет собой новое пероральное средство, снижающее содержание калия, с началом действия через 7 часов.FDA одобрило его использование у недиализных пациентов с ХБП.
• ZS-9, обменник Na-K, представляет собой новый пероральный агент, снижающий содержание калия, с более быстрым началом действия через 2 часа. Это еще не одобрено FDA.
• Значительные колебания уровня калия в сыворотке крови во время и вскоре после гемодиализа связаны со смертностью, сердечной аритмией и внезапной сердечной смертью. В настоящее время рекомендуется избегать использования диализата с низким содержанием K (диализат ≤2 K) для пациентов с преддиализным K <5 ммоль / л.
• Метаболический ацидоз (NaHCO 3 <22 ммоль / л) при ХБП и ХПН требует коррекции. Пероральный NaHCO 3 можно использовать с целью увеличения NaHCO 3 до ∼25 ммоль / л.
• Для пациентов, у которых развивается гиперкалиемия на ингибиторе АПФ и БРА, могут быть полезны новые средства, снижающие калий, и коррекция ацидоза в сочетании с существующими методами. Постоянное назначение ингибиторов АПФ и БРА большинству пациентов с ХБП и ТПН может спасти жизнь.
• Повышение уровня фосфора в сыворотке крови, даже в пределах нормы, было связано с сердечно-сосудистыми осложнениями и смертностью.
• Фосфатсвязывающие средства, не содержащие кальция, могут быть связаны со снижением риска общей смертности по сравнению с фосфатсвязывающими средствами на основе кальция.
• Недостаточность и дефицит витамина D следует корректировать у пациентов с ХБП и ХПН.
• Уровень ПТГ в сыворотке у недиализных пациентов с ХБП является предметом разногласий.Для диализных пациентов с ТПН уровень ПТГ в сыворотке должен быть в 2–9 раз выше верхнего предела нормального значения.
• На концентрацию Mg в сыворотке может влиять содержание Mg в диализате. Таким образом, при необходимости может потребоваться регулировка содержания Mg в диализате.
• Гипермагниемия у пациентов с ХБП, вероятно, является результатом сочетания дисфункции почек и приема препаратов, содержащих Mg. Необходима тщательная оценка лекарств пациента, как безрецептурных, так и прописанных по рецепту.
Заявление о раскрытии информации
Авторы не заявляют о конфликте интересов.
Финансирование
Нет.
Ссылки
- Система данных почек США: Годовой отчет USRDS за 2015 год: Эпидемиология заболеваний почек в США.Bethesda, Национальные институты здравоохранения, 2015 г. www.usrds.org/2015/view/Default.aspx (цитировано 8 октября 2016 г.).
- Де Никола Л., Зоккали С. Распространенность хронической болезни почек среди населения в целом: неоднородность и проблемы. Трансплантат Nephrol Dial 2016; 31: 331-335.
- Луо Дж и др.: Связь между уровнем калия в сыворотке крови и исходами у пациентов со сниженной функцией почек.Clin J Am Soc Nephrol 2016; 11: 90-100.
- Сарафидис П.А. и др.: Распространенность и факторы, связанные с гиперкалиемией у пациентов до диализа, наблюдаемых в клинике с низким клиренсом. Clin J Am Soc Nephrol 2012; 7: 1234-1241.
- Эйнхорн Л.М. и др.: Частота гиперкалиемии и ее значение при хроническом заболевании почек.Arch Intern Med 2009; 169: 1156-1162.
- Чанг А.Р. и др.: Антигипертензивные препараты и распространенность гиперкалиемии в большой системе здравоохранения. Гипертония 2016; 67: 1181-1188.
- Ingelfinger JR: Новая эра в лечении гиперкалиемии? N Engl J Med 2015; 372: 275-277.
- Meng QH, Wagar EA: Псевдогиперкалиемия: новый поворот в старом явлении. Критический обзор Clin Lab Sci 2015; 52: 45-55.
- Parham WA и др.: Повторное посещение гиперкалиемии.Tex Heart Inst J 2006; 33: 40-47.
- Хаттак Х.К. и др.: Рецидивирующая угрожающая жизни гиперкалиемия без типичных электрокардиографических изменений. Журнал Электрокардиол 2014; 47: 95-97.
- Barold SS, Herweg B: Влияние гиперкалиемии на устройства сердечного ритма.Europace 2014; 16: 467-476.
- Эпштейн М. и др.: Оценка разрыва в лечении между клиническими рекомендациями и использованием ингибиторов ренин-ангиотензин-альдостероновой системы. Am J Manag Care 2015; 21 (11 доп.): S212-S220.
- Эванс Б.М. и др.: Ионообменные смолы в лечении анурии.Ланцет 1953; 265: 791-795.
- Лепаж Л. и др.: Рандомизированное клиническое испытание полистиролсульфоната натрия для лечения легкой гиперкалиемии при ХБП. Clin J Am Soc Nephrol 2015; 10: 2136-2142.
- Harel Z и др.: Нежелательные явления со стороны желудочно-кишечного тракта при использовании полистиролсульфоната натрия (кайексалат): систематический обзор.Am J Med 2013; 126: 264.e9-e24.
- Ли Л. и др.: Механизм действия и фармакология патиромера, неабсорбированного сшитого полимера, который снижает концентрацию калия в сыворотке крови у пациентов с гиперкалиемией. J. Cardiovasc Pharmacol Ther 2016; 21: 456-465.
- Вейр М.Р. и др.: Патиромер у пациентов с заболеванием почек и гиперкалиемией, получающих ингибиторы РААС.N Engl J Med 2015; 372: 211-221.
- Бакрис Г.Л. и др.: Влияние патимера на уровень калия в сыворотке крови у пациентов с гиперкалиемией и диабетической болезнью почек: рандомизированное клиническое исследование AMETHYST-DN. JAMA 2015; 314: 151-161.
- Weir MR и др.: Лечение патиромером снижает уровень альдостерона у пациентов с хроническим заболеванием почек и гиперкалиемией на ингибиторах ренин-ангиотензиновой системы.Kidney Int 2016; 90: 696-704.
- Гекле М., Гроссманн К. Действия альдостерона в сердечно-сосудистой системе: хорошее, плохое и уродливое? Арка Пфлюгерса 2009; 458: 231-246.
- Ritz E, Tomaschitz A: Альдостерон, васкулотоксический агент — новые функции для старого гормона.Трансплантат Nephrol Dial 2009; 24: 2302-2305.
- Бушинский Д.А. и др.: Влияние патиромера на экскрецию ионов с мочой у здоровых взрослых. Clin J Am Soc Nephrol 2016; pii: CJN.01170216.
- Пакхэм Д.К. и др.: Циклосиликат циркония натрия при гиперкалиемии.N Engl J Med 2015; 372: 222-231.
- Косибород М. и др.: Влияние циклосиликата циркония натрия на снижение уровня калия в течение 28 дней среди амбулаторных пациентов с гиперкалиемией: рандомизированное клиническое испытание HARMONIZE. JAMA 2014; 312: 2223-2233.
- Бушинский Д.А.: Национальный фонд почек, 2016 г. Тезисы весенних клинических встреч, 27 апреля — 1 мая 2016 г.Патиромер снижает уровень калия в сыворотке крови у пациентов на HD. Am J Kidney Dis 2016; 67: A1-A118.
- Adrogué HJ, Madias NE: Натрий и калий в патогенезе гипертонии. N Engl J Med 2007; 356: 1966-1978.
- Тобиан Л. и др.: Калий снижает кровоизлияние в мозг и уровень смертности у гипертонических крыс, даже если артериальное давление не снижается.Гипертония 1985; 7 (3 pt 2): I110-I114.
- Чиу Д. Я. и др.: Внезапная сердечная смерть у пациентов, находящихся на гемодиализе: варианты профилактики. Нефрология (Карлтон) 2014; 19: 740-749.
- Коллинз А.Дж. и др.: Годовой отчет системы данных почек США за 2013 год.Am J Kidney Dis 2014; 63 (1 приложение): A7.
- Отаке Т. и др.: Высокая распространенность скрытого стеноза коронарной артерии у пациентов с хроническим заболеванием почек в начале заместительной почечной терапии: ангиографическое исследование. J Am Soc Nephrol 2005; 16: 1141-1148.
- Buiten MS и др.: Процедура диализа как триггер фибрилляции предсердий: новые взгляды на развитие фибрилляции предсердий у диализных пациентов.Сердце 2014; 100: 685-690.
- Pun PH и др.: Изменяемые факторы риска, связанные с внезапной остановкой сердца в клиниках гемодиализа. Kidney Int 2011; 79: 218-227.
- Джадул М. и др.: Изменяемые методы, связанные с внезапной смертью пациентов, находящихся на гемодиализе, в исследовании результатов диализа и моделей практики.Clin J Am Soc Nephrol 2012; 7: 765-774.
- Фоли Р. Н. и др.: Длительный междиализный интервал и смертность среди пациентов, получающих гемодиализ. N Engl J Med 2011; 365: 1099-1107.
- Блейер А.Дж. и др.: Характеристики внезапной смерти у пациентов, находящихся на гемодиализе.Kidney Int 2006; 69: 2268-2273.
- Блейер А.Дж., Рассел Г.Б., Сатко С.Г.: Показатели внезапной и сердечной смертности у пациентов, находящихся на гемодиализе. Kidney Int 1999; 55: 1553-1559.
- Санторо А. и др.: Пациенты со сложной аритмией во время и после гемодиализа страдают от различных режимов удаления калия.Циферблатная трансплантация нефрола 2008; 23: 1415-1421.
- Валле М. и др.: Аммиак в моче и отдаленные исходы при хронической болезни почек. Kidney Int 2015; 88: 137-145.
- Неправильно O, Дэвис HE: Выведение кислоты при почечной недостаточности.QJ Med 1959; 28: 259-313.
- Kim HY и др.: Эффект уменьшения почечной массы на экспрессию семейства почечных переносчиков аммиака, гликопротеина Rh C и гликопротеина Rh B. Am J Physiol Renal Physiol 2007; 293: F1238-F1247.
- Карим З., Аттмане-Элакеб А., Бичара М.: Почечная обработка Nh5 + в отношении контроля кислотно-щелочного баланса почками.J Nephrol 2002; 15 (приложение 5): S128-S134.
- Нат К.А., Хостеттер М.К., Хостеттер Т.Х.: Патофизиология хронического тубулоинтерстициального заболевания у крыс. Взаимодействие диетической кислотной нагрузки, аммиака и компонента комплемента C3. Дж. Клин Инвест 1985; 76: 667-675.
- Wesson DE, Simoni J: Задержка кислоты во время почечной недостаточности вызывает выработку эндотелина и альдостерона, что приводит к прогрессивному снижению СКФ, и ситуация улучшается щелочной диетой.Kidney Int 2010; 78: 1128-1135.
- Wesson DE и др.: Удержание кислоты сопровождает снижение СКФ у людей и увеличивает плазменные уровни эндотелина и альдостерона. Am J Physiol Renal Physiol 2011; 300: F830-F837.
- Шах С.Н. и др.: Уровни бикарбоната в сыворотке и прогрессирование заболевания почек: когортное исследование.Am J Kidney Dis 2009; 54: 270-277.
- Рафаэль К.Л. и др.: Более высокие уровни бикарбоната в сыворотке крови в пределах нормы связаны с лучшей выживаемостью и улучшением почек у афроамериканцев. Kidney Int 2011; 79: 356-362.
- Канда Э. и др.: Высокий уровень бикарбоната в сыворотке крови в пределах нормы предотвращает прогрессирование хронического заболевания почек у пожилых пациентов с хроническим заболеванием почек.BMC Nephrol 2013; 14: 4.
- Рафаэль К.Л. и др.: Распространенность и факторы риска снижения уровня бикарбоната в сыворотке крови при хронической болезни почек. Нефрология (Карлтон) 2014; 19: 648-654.
- Kopple JD, Kalantar-Zadeh K, Mehrotra R: Риски хронического метаболического ацидоза у пациентов с хронической болезнью почек.Почки Int Suppl 2005; 95: S21-S27.
- Kraut JA, Kurtz I: Метаболический ацидоз ХБП: диагностика, клинические характеристики и лечение. Am J Kidney Dis 2005; 45: 978-993.
- Ковесди С.П., Андерсон Дж. Э., Калантар-Заде К.: Связь уровней бикарбоната в сыворотке со смертностью у пациентов с недиализно-зависимой ХБП.Пересадка нефрола Dial 2009; 24: 1232-1237.
- Драйвер TH и др.: Низкий уровень бикарбоната в сыворотке и снижение функции почек: мультиэтническое исследование атеросклероза (MESA). Am J Kidney Dis 2014; 64: 534-541.
- de Brito-Ashurst I, et al: Добавки бикарбоната замедляют прогрессирование ХБП и улучшают нутритивный статус.J Am Soc Nephrol 2009; 20: 2075-2084.
- Махаджан А. и др.: Ежедневный пероральный прием бикарбоната натрия сохраняет скорость клубочковой фильтрации, замедляя ее снижение при ранней гипертонической нефропатии. Kidney Int 2010; 78: 303-309.
- Phisitkul S и др.: Улучшение метаболического ацидоза у пациентов с низкой СКФ снижает выработку эндотелина в почках и повреждение почек, а также улучшает сохранение СКФ.Почек Int 2010; 77: 617-623.
- Абрамовиц М.К. и др.: Эффекты перорального приема бикарбоната натрия у пациентов с ХБП. Clin J Am Soc Nephrol 2013; 8: 714-720.
- KDIGO 2012 Руководство по клинической практике по оценке и лечению хронической болезни почек.Kidney Int 2013; (добавлено): 73.
- Горая Н. и др.: Лечение метаболического ацидоза у пациентов с хронической болезнью почек 3 стадии с помощью фруктов и овощей или перорального бикарбоната снижает ангиотензиноген мочи и сохраняет скорость клубочковой фильтрации. Kidney Int 2014; 86: 1031-1038.
- Добре М. и др.: Постоянно высокий уровень бикарбоната в сыворотке и риск сердечной недостаточности у пациентов с хронической болезнью почек (ХБП): отчет когортного исследования хронической почечной недостаточности (CRIC). J Am Heart Assoc 2015; 4: pii: e001599.
- Witham MD и др.: Улучшает ли пероральная терапия бикарбонатом натрия функцию и качество жизни у пожилых пациентов с хроническим заболеванием почек и ацидозом низкой степени (исследование BiCARB)? Протокол рандомизированного контролируемого исследования.Испытания 2015; 16: 326.
- Gaggl M и др.: Эффект перорального приема бикарбоната натрия на прогрессирование хронического заболевания почек у пациентов с хроническим метаболическим ацидозом: протокол рандомизированного контролируемого исследования (SoBic-Study). Испытания 2013; 14: 196.
- Ди Иорио Б и др.: Проспективное многоцентровое рандомизированное контролируемое исследование: коррекция метаболического ацидоза с использованием бикарбоната в исследовании хронической почечной недостаточности (UBI).Дж. Нефрол 2012; 25: 437-440.
- Тентори Ф. и др.: Связь концентрации бикарбоната в диализате со смертностью в исследовании результатов диализа и моделей практики (DOPPS). Am J Kidney Dis 2013; 62: 738-746.
- Мо С. и др.: Определение, оценка и классификация почечной остеодистрофии: заявление о позиции из книги «Болезнь почек: улучшение глобальных результатов» (KDIGO).Kidney Int 2006; 69: 1945-1953.
- Левин А. и др.: Распространенность аномального уровня витамина D, ПТГ, кальция и фосфора в сыворотке у пациентов с хроническим заболеванием почек: результаты исследования для оценки раннего заболевания почек. Kidney Int 2007; 71: 31-38.
- Теджвани В., Цянь В. Регулирование кальция и минерального обмена в костях у пожилых пациентов с хроническим заболеванием почек.Питательные вещества 2013; 5: 1913-1936.
- Моранн О. и др.: Время начала метаболических осложнений, связанных с ХБП. J Am Soc Nephrol 2009; 20: 164-171.
- Reynolds JL и др.: Клетки гладких мышц сосудов человека подвергаются опосредованной пузырьками кальцификации в ответ на изменения внеклеточных концентраций кальция и фосфата: потенциальный механизм ускоренной кальцификации сосудов при ESRD.J Am Soc Nephrol 2004; 15: 2857-2867.
- Мэтью С. и др.: Механизм действия фосфора как фактора риска сердечно-сосудистых заболеваний при ХБП. J Am Soc Nephrol 2008; 19: 1092-1105.
- Чен NX, Мо С.М.: Патофизиология сосудистой кальцификации.Curr Osteoporos Rep 2015; 13: 372-380.
- Goodman WG и др.: Кальцификация коронарных артерий у молодых людей с терминальной стадией почечной недостаточности, находящихся на диализе. N Engl J Med 2000; 342: 1478-1483.
- O’Seaghdha CM и др.: Уровень фосфора в сыворотке позволяет прогнозировать хроническое заболевание почек и терминальную стадию заболевания почек.Циферблатная трансплантация нефрола 2011; 26: 2885-2890.
- Кестенбаум Б и др.: Уровни фосфата в сыворотке и риск смертности среди людей с хроническим заболеванием почек. Дж. Ам Соц Нефрол 2005; 16: 520-528.
- Chartsrisak K и др.: Минеральный метаболизм и исходы у пациентов с хронической болезнью почек 2-4 стадии.BMC Nephrol 2013; 14:14.
- Юнг С.Ю. и др.: Электролитные и минеральные нарушения у пациентов с острым септическим повреждением почек, проходящих постоянную заместительную почечную терапию. Медицина (Балтимор) 2016; 95: e4542.
- Да Дж и др.: Фосфор сыворотки и прогрессирование ХБП и смертность: метаанализ когортных исследований.Am J Kidney Dis 2015; 66: 258-265.
- Дхингра Р. и др.: Связь уровней фосфора и кальция в сыворотке с частотой сердечно-сосудистых заболеваний в обществе. Arch Intern Med 2007; 167: 879-885.
- Тонелли М., Пфеффер М.А.: Заболевание почек и сердечно-сосудистый риск.Анну Рев Мед 2007; 58: 123-139.
- Larsson TE и др.: Совместное влияние сывороточного кальция и фосфата на риск общей, сердечно-сосудистой и несердечно-сосудистой смертности в обществе. Артериосклер Thromb Vasc Biol 2010; 30: 333-339.
- Gutierrez OM, et al: Фактор роста фибробластов 23 и смертность среди пациентов, находящихся на гемодиализе.N Engl J Med 2008; 359: 584-592.
- Нордзий М. и др.: Минеральный метаболизм и смертность у диализных пациентов: переоценка рекомендаций K / DOQI. Очистка крови 2008; 26: 231-237.
- Ли С.К., Лоренцо Дж. А. Паратироидный гормон стимулирует TRANCE и подавляет экспрессию рибонуклеиновой кислоты-мессенджера остеопротегерина в культурах костного мозга мышей: корреляция с образованием остеокластоподобных клеток.Эндокринология 1999; 140: 3552-3561.
- Armbrecht HJ и др.: Индукция витамина D 24-гидроксилазы (CYP24) 1,25-дигидроксивитамином D3 регулируется паратироидным гормоном в остеобластических клетках UMR106. Эндокринология 1998; 139: 3375-3381.
- Шинки Т. и др.: Гормон паращитовидной железы подавляет экспрессию мРНК 25-гидроксивитамина D3-24-гидроксилазы, стимулированную 1 альфа, 25-дигидроксивитамином D3 в почках крысы, но не в кишечнике.J. Biol Chem 1992; 267: 13757-13762.
- Brenza HL, DeLuca HF: Регулирование экспрессии гена 25-гидроксивитамина D3 1альфа-гидроксилазы паратиреоидным гормоном и 1,25-дигидроксивитамином D3. Arch Biochem Biophys 2000; 381: 143-152.
- Jeong HS, Dominguez AR: Кальцифилаксия: противоречия в патогенезе, диагностике и лечении.Am J Med Sci 2016; 351: 217-227.
- Холик М.Ф .: Дефицит витамина D. N Engl J Med 2007; 357: 266-281.
- Лю В.К. и др.: Плейотропные эффекты витамина D при хронической болезни почек.Clin Chim Acta 2016; 453: 1-12.
- Pilz S и др.: Статус витамина D и риск смертности при ХБП: метаанализ проспективных исследований. Am J Kidney Dis 2011; 58: 374-382.
- Schottker B и др.: Витамин D и смертность: метаанализ данных отдельных участников из большого консорциума когортных исследований из Европы и США.BMJ 2014; 348: G3656.
- Cheng Z, Lin J, Qian Q: роль витамина D в когнитивной функции при хроническом заболевании почек. Питательные вещества 2016; 8: pii: E291.
- Mehrotra R и др.: Гиповитаминоз D при хронической болезни почек.Clin J Am Soc Nephrol 2008; 3: 1144-1151.
- Андрухова О. и др.: FGF23 действует непосредственно на проксимальные канальцы почек, вызывая фосфатурию за счет активации сигнального пути ERK1 / 2-SGK1. Кость 2012; 51: 621-628.
- Prie D, Friedlander G: Взаимный контроль образования 1,25-дигидроксивитамина D и FGF23 с участием системы FGF23 / Klotho.Clin J Am Soc Nephrol 2010; 5: 1717-1722.
- Krajisnik T, et al: Фактор роста фибробластов-23 регулирует экспрессию паратироидного гормона и 1альфа-гидроксилазы в культивируемых клетках паращитовидной железы крупного рогатого скота. Дж. Эндокринол 2007; 195: 125-131.
- Коидзуми М, Комаба Х, Фукагава М: Функция паращитовидных желез при хроническом заболевании почек: роль оси FGF23-Klotho.Contrib Nephrol 2013; 180: 110-123.
- Исакова Т. и др.: Фактор роста фибробластов 23 повышается до уровня паратиреоидного гормона и фосфата при хронической болезни почек. Kidney Int 2011; 79: 1370-1378.
- Scialla JJ, et al: Фактор роста фибробластов-23 и сердечно-сосудистые события при ХБП.J Am Soc Nephrol 2014; 25: 349-360.
- Faul C и др.: FGF23 вызывает гипертрофию левого желудочка. Дж. Клин Инвест 2011; 121: 4393-4408.
- Fliser D и др.: Фактор роста фибробластов 23 (FGF23) предсказывает прогрессирование хронического заболевания почек: исследование от легкой до умеренной болезни почек (MMKD).J Am Soc Nephrol 2007; 18: 2600-2608.
- Исакова Т. и др.: Фактор роста фибробластов 23 и риски смертности и терминальной стадии почечной недостаточности у пациентов с хронической болезнью почек. JAMA 2011; 305: 2432-2439.
- Джамал С.А. и др.: «Влияние фосфатсвязывающих средств на основе кальция и не на основе кальция на смертность у пациентов с хроническим заболеванием почек: обновленный систематический обзор и метаанализ».Ланцет 2013; 382: 1268-1277.
- Sekercioglu N, et al: Сравнительная эффективность фосфатсвязывающих средств у пациентов с хроническим заболеванием почек: систематический обзор и сетевой метаанализ. PLoS One 2016; 11: e0156891.
- Patel L, Bernard LM, Elder GJ: Севеламер против связывающих веществ на основе кальция для лечения гиперфосфатемии при ХБП: метаанализ рандомизированных контролируемых исследований.Clin J Am Soc Nephrol 2016; 11: 232-244.
- de Francisco AL и др.: Оценка ацетата кальция / карбоната магния в качестве связывающего фосфата по сравнению с севеламером гидрохлоридом у гемодиализных пациентов: контролируемое рандомизированное исследование (исследование CALMAG), оценивающее эффективность и переносимость.Трансплантат Nephrol Dial 2010; 25: 3707-3717.
- Covic A и др.: Сравнение эффектов ацетата кальция / карбоната магния и севеламера-гидрохлорида на фактор роста фибробластов-23 и костные маркеры: апостериорная оценка из контролируемого рандомизированного исследования. Трансплантат Nephrol Dial 2013; 28: 2383-2392.
- Де Шуттер TM и др.: Влияние фосфатного связующего на основе магния на медиальную кальцификацию на модели уремии у крыс. Kidney Int 2013; 83: 1109-1117.
- Невен Э. и др.: Фосфатное связующее на основе магния снижает кальцификацию сосудов, не затрагивая кости у крыс с хронической почечной недостаточностью.PLoS One 2014; 9: e107067.
- Заболевание почек: улучшение глобальных результатов (KDIGO) Рабочая группа CKD-MBD: Руководство KDIGO по клинической практике по диагностике, оценке, профилактике и лечению хронической болезни почек — минерального и костного расстройства (CKD-MBD). Почки Int Suppl 2009; 113: S1-S130.
- Мискулин Д.К. и др.: Добавка эргокальциферола у гемодиализных пациентов с дефицитом витамина D: рандомизированное клиническое испытание. J Am Soc Nephrol 2016; 27: 1801-1810.
- Перес-Рикарт А. и др.: Эффективность цинакальцета у пациентов с хроническим заболеванием почек и вторичным гиперпаратиреозом, не получающих диализ.PLoS One 2016; 11: e0161527.
- Tominaga Y, et al: Паратиреоидэктомия по поводу вторичного гиперпаратиреоза в эпоху кальцимиметиков. Ther Apher Dial 2008; 12 (дополнение 1): S21-S26.
- Благодатский А., Потеряев Д., Катанаев В. Л.: Нацеливание на пути Wnt для терапии.Mol Cell Ther 2014; 2:28.
- Carrillo-Lopez N и др.: Прямое ингибирование пути остеобластического Wnt фактором роста фибробластов 23 способствует потере костной массы при хроническом заболевании почек. Kidney Int 2016; 90: 77-89.
- Frenkel WN и др.: Связь между уровнями натрия в сыворотке крови во время госпитализации и смертностью и заболеваемостью у пожилых пациентов, поступивших в неотложную госпитализацию: проспективное когортное исследование.J Am Geriatr Soc 2010; 58: 2227-2228.
- Холланд-Билл Л. и др.: Гипонатриемия и риск смерти: датское когортное исследование 279 508 пациентов, госпитализированных в острой форме. Eur J Endocrinol 2015; 173: 71-81.
- Лиамис Г. и др.: Электролитные расстройства у субъектов сообщества: распространенность и факторы риска.Am J Med 2013; 126: 256-263.
- Миллер М., Морли Дж. Э., Рубинштейн Л. З.: Гипонатриемия в домах престарелых. J Am Geriatr Soc 1995; 43: 1410-1413.
- Olsson K, Ohlin B, Melander O: Эпидемиология и характеристики гипонатриемии в отделении неотложной помощи.Eur J Intern Med 2013; 24: 110-116.
- Зильберберг и др.: Эпидемиология, клинические и экономические результаты гипонатриемии госпитализированных пациентов. Curr Med Res Opin 2008; 24: 1601-1608.
- Палевски П.М., Бхаграт Р., Гринберг А: Гипернатриемия у госпитализированных пациентов.Энн Интерн Мед 1996; 124: 197-203.
- Zhang YZ, Qie JY, Zhang QH: Прогноз заболеваемости и смертности от диснатремий у неврологических пациентов в критическом состоянии. Eur Neurol 2015; 73: 29-36.
- Ковесди С.П. и др.: Гипонатриемия, гипернатриемия и смертность у пациентов с хронической болезнью почек с застойной сердечной недостаточностью и без нее.Тираж 2012; 125: 677-684.
- Corona G и др.: Улучшение гипонатриемии связано со снижением риска смертности: данные метаанализа. PLoS One 2015; 10: e0124105.
- Берл Т. Влияние приема растворенных веществ на поток мочи и выделение воды.J Am Soc Nephrol 2008; 19: 1076-1078.
- Adrogue HJ, Madias NE: Hypernatremia. N Engl J Med 2000; 342: 1493-1499.
- Хуанг Х. и др.: Связь диснатремий со смертностью от хронического заболевания почек.Трансплантат Nephrol Dial 2016; pii: gfw209.
- Равель В.А. и др.: Натрий в сыворотке и смертность в национальной когорте перитонеального диализа. Трансплантат Nephrol Dial 2016; pii: gfw254.
- Rhee CM и др.: Уровень натрия в сыворотке перед диализом и смертность в когорте пациентов, находящихся на гемодиализе.Трансплантат Nephrol Dial 2016; 31: 992-1001.
- Cheungpasitporn W, Thongprayoon C, Qian Q: Дисмагниемия у госпитализированных пациентов: распространенность и прогностическое значение. Mayo Clin Proc 2015; 90: 1001-1010.
- Сакагучи Й. и др.: Гипомагниемия является важным прогностическим фактором смертности от сердечно-сосудистых и несердечно-сосудистых заболеваний у пациентов, находящихся на гемодиализе.Kidney Int 2014; 85: 174-181.
- Ян X и др.: Уровни магния в сыворотке, госпитализация и смертность у пациентов, перенесших перитонеальный диализ: когортное исследование. Am J Kidney Dis 2016; 68: 619-627.
Автор Контакты
Qi Qian, MD
Департамент медицины, Отделение нефрологии и гипертонии
Медицинский колледж Mayo Clinic
200 First Street SW, Rochester, MN 55905 (США)
E-Mail [email protected]
Подробности статьи / публикации
Предварительный просмотр первой страницы
Опубликовано онлайн: 24 января 2017 г.
Дата выпуска: март 2017 г.
Количество страниц для печати: 10
Количество рисунков: 0
Количество столов: 0
ISSN: 0253-5068 (печатный)
eISSN: 1421-9735 (онлайн)
Для дополнительной информации: https: // www.karger.com/BPU
Авторские права / Дозировка препарата / Заявление об ограничении ответственности
Авторские права: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме и любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование, или какой-либо системой хранения и поиска информации, без письменного разрешения издателя. .
Дозировка лекарств: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарств, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Однако ввиду продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю настоятельно рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новый и / или редко применяемый препарат.
Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, причиненный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
Гомеостаз и клеточная функция — химия
Глава 8: Гомеостаз и клеточная функцияЭтот текст опубликован под лицензией Creative Commons.Для ссылки на эту работу, пожалуйста, нажмите здесь .
8.1 Концепция гомеостаза 8,2 Болезнь как гомеостатический дисбаланс 8,3 Измерение гомеостаза для оценки здоровья 8.4 Растворимость 8,5 Концентрация раствора 8.5.1 Молярность 8.5.2 Количество частей в решениях 8.5.3 Эквиваленты 8,6 Разведения 8,7 Концентрации ионов в растворе 8.8 Движение молекул через мембрану 8.9 Резюме 8.10 Ссылки8.1 Концепция гомеостаза
Гомеостаз относится к способности организма физиологически регулировать свою внутреннюю среду, чтобы обеспечить ее стабильность в ответ на колебания внешних или внутренних условий.Печень, поджелудочная железа, почки и мозг (гипоталамус, вегетативная нервная система и эндокринная система) помогают поддерживать гомеостаз. Печень отвечает за метаболизм токсичных веществ и с помощью сигналов от поджелудочной железы поддерживает углеводный обмен. Печень также помогает регулировать метаболизм липидов и является основным местом производства холестерина. Почки отвечают за регулирование уровня воды в крови, повторное всасывание веществ в кровь, поддержание уровней солей и ионов в крови, регулирование pH крови и выведение мочевины и других продуктов жизнедеятельности.Гипоталамус участвует в регулировании температуры тела, частоты сердечных сокращений, артериального давления и циркадных ритмов (включая циклы бодрствования / сна).
На гомеостаз могут влиять внутренние или существующие условия (внутренние факторы ) или внешние условия или условия окружающей среды ( внешние факторы ) и поддерживается множеством различных механизмов. Все механизмы гомеостатического контроля имеют как минимум три взаимозависимых компонента для регулируемой переменной:
- A датчик или приемник, который обнаруживает изменения во внутренней или внешней среде.Примером могут служить периферические хеморецепторы, которые обнаруживают изменения pH крови.
- Интегрирующий центр или центр управления получает информацию от датчиков и инициирует реакцию для поддержания гомеостаза. Самый важный пример — гипоталамус, область мозга, которая контролирует все, от температуры тела до частоты сердечных сокращений, артериального давления, насыщения (сытости) и циркадных ритмов (включая циклы сна и бодрствования).
- Эффектор — это любой орган или ткань, которые получают информацию от интегрирующего центра и действуют, чтобы вызвать изменения, необходимые для поддержания гомеостаза.Одним из примеров является почка, которая задерживает воду, если артериальное давление слишком низкое.
Датчики, интегрирующий центр и эффекторы являются основными компонентами каждого гомеостатического ответа. Положительная и отрицательная обратная связь — более сложные механизмы, которые позволяют этим трем основным компонентам поддерживать гомеостаз для более сложных физиологических процессов.
Отрицательная обратная связьОтрицательная обратная связь механизмы используют один из продуктов реакции, чтобы уменьшить результат или активность процесса с целью возвращения органа или системы к нормальному диапазону функционирования.Большинство гомеостатических процессов используют регулирование с отрицательной обратной связью для поддержания определенного параметра в пределах диапазона уставки, который поддерживает жизнь. Рис. 8.1. Однако следует отметить, что процессы отрицательной обратной связи также используются для других процессов, которые не являются гомеостатическими.
В области гомеостаза регулирование температуры является хорошим примером использования отрицательной обратной связи. Нервные клетки (датчики) передают информацию о температуре тела в гипоталамус (интегрирующий центр). Затем гипоталамус подает сигнал нескольким эффекторам о возврате температуры тела к 37 o C (заданное значение).При слишком высокой внутренней температуре в процессе активируются два эффектора: потовые железы, которые служат для охлаждения кожи, и кровеносные сосуды, которые подвергаются расширению сосудов (или расширению), чтобы тело могло выделять больше тепла. Как только внутренняя температура возвращается в нормальный диапазон, датчик отправляет отрицательные сообщения обратной связи в интегрирующий центр, чтобы остановить процесс (т.е. выключить потовые железы и предотвратить дальнейшее расширение сосудов). Как внутренние, так и внешние события могут вызывать механизмы отрицательной обратной связи.Два приведенных выше примера представляют внутренние механизмы, используемые для возврата тела в нормальный температурный диапазон. Однако мы также можем обеспечить охлаждение тела внешними факторами, такими как снятие теплой шапки и перчаток или наливание стакана прохладной воды на голову. Как внешние, так и внутренние механизмы охлаждения могут возвращать температуру тела в нормальный диапазон и вызывать отрицательную обратную связь. Точно так же, если температура тела ниже заданного значения, мышцы дрожат, выделяя тепло, а сужение кровеносных сосудов помогает телу сохранять тепло.
Гомеостатические процессы очень сложны, потому что уставка или нормальный диапазон могут изменяться в зависимости от обстоятельств. Например, гипоталамус может изменять заданную температуру тела, например повышать ее во время лихорадки, чтобы помочь бороться с инфекцией.
Рис. 8.1. Гомеостатическое регулирование температуры у человека. Внутренняя температура тела поддерживается на уровне нормальной уставки 37 o C. Если внутренняя температура поднимается выше (правая сторона) или падает ниже (левая сторона) уставки, инициируются внутренние биологические реакции, чтобы вернуть внутреннюю температуру обратно в заданный диапазон.Как только это достигается, запускаются петли отрицательной обратной связи, чтобы снизить внутренние биологические реакции, чтобы внутренняя температура не превышала требуемого изменения.
Этот рисунок взят из: Академия Кана
Положительные отзывы
Положительная обратная связь — это механизм, в котором активированный компонент усиливает или дополнительно активирует процесс, который вызвал сам себя, чтобы создать еще более сильный ответ.Механизмы положительной обратной связи предназначены для ускорения или усиления вывода, создаваемого уже активированным стимулом. Механизмы положительной обратной связи предназначены для вывода уровней за пределы нормального диапазона и не так часто используются в гомеостатических реакциях. Для достижения положительной обратной связи серия событий запускает каскадный процесс, который усиливает действие стимула.
Примером петли положительной обратной связи является каскад свертывания крови, который изначально инициируется внешним повреждением сосудистой сети (Рисунок 8.2). Во время события повреждения внешние факторы запускают каскад свертывания крови. Белки, участвующие в этом процессе, обычно остаются неактивными, поскольку производятся в гораздо большей форме, чем требуется. Чтобы активировать белок, белок нужно расщепить на более мелкий активный комплекс. Когда белок удерживается в большом неактивном состоянии и расщепляется с образованием активного компонента, он называется зимогеном . Каскад свертывания крови содержит много зимогенов.Первым активируемым зимогеном является фактор X. Когда фактор X расщепляется, он становится активным и переходит к расщеплению следующей нижестоящей мишени, Протромбина II. Это производит активный компонент, тромбин IIa, который имеет множество эффектов. Во-первых, он расщепляет белок фибриноген с образованием фибрина. Затем фибрин начинает образовывать комплекс свертывания крови сам с собой. Это называется свободной ячеистой сетью. Активированный тромбин IIa также расщепляет неактивную форму фактора XIII. Активированный фактор XIIIa вызывает образование поперечных связей в рыхлой ячеистой сети, создавая окончательную стабильную сетку, которая формирует сгусток крови.Чтобы еще больше ускорить этот процесс, тромбин IIa также имеет два положительных эффекта обратной связи. Он также может расщеплять неактивный фактор X, создавая больше активированного фактора X и, в конечном итоге, более активированного Throbmin IIa. Он также увеличивает активность внутреннего каскада свертывания крови, который дополнительно усиливает активацию фактора X.
Рисунок 8.2. Механизм положительной обратной связи каскада свертывания крови. Внешние факторы, такие как повреждение или травма, активировали расщепление зимогенных белков в каскаде свертывания крови.Активация зимогена, тромбина IIa, начинает формирование фибриновой сети свертывания, а также вызывает положительную обратную связь, которая дополнительно активирует весь каскад свертывания.
Этот рисунок адаптирован из: MPT-Matthew
Многие параметры регулируются в организме в пределах узкого гомеостатического окна для поддержания надлежащего функционирования и баланса в биологических системах. Некоторые примеры гомеостатических параметров включают:
ТемператураЛюди теплокровные или эндотермические , поддерживающие почти постоянную температуру тела.Терморегуляция — важный аспект гомеостаза человека. Тепло в основном вырабатывается печенью и мышечными сокращениями. Люди смогли адаптироваться к большому разнообразию климатов, включая жаркую влажную и жаркую засушливую среду. Высокие температуры создают серьезную нагрузку на человеческий организм, создавая большую опасность получения травм или даже смерти. Чтобы справиться с этими климатическими условиями, люди разработали физиологические и культурные способы адаптации. Когда внутренняя температура достигает предела 45 ° C (113 ° F), возникает гипертермия , состояние, при котором температура тела человека повышается сверх нормы, и клеточные белки денатурируют, вызывая остановку метаболизма и, в конечном итоге, смерть. Гипотермия — противоположное состояние, при котором внутренняя температура тела падает ниже гомеостатических норм. Гипотермия возникает, когда внутренняя температура тела опускается ниже 35,0 ° C (95,0 ° F). Симптомы зависят от температуры. При умеренном переохлаждении наблюдается дрожь и спутанность сознания. При умеренном переохлаждении прекращается дрожь и усиливается спутанность сознания. При сильном переохлаждении может наблюдаться парадоксальное раздевание, при котором человек снимает одежду, а также повышенный риск остановки сердца.Гипотермия имеет два основных типа причин. Обычно это происходит от сильного холода. Это также может произойти из-за любых условий, которые уменьшают выработку тепла или увеличивают теплопотери. Обычно это включает алкогольную интоксикацию, но также может включать низкий уровень сахара в крови, анорексию и пожилой возраст.
УтюгЖелезо — незаменимый элемент для человека. Контроль над этим необходимым, но потенциально токсичным веществом — важная часть многих аспектов здоровья и болезней человека.Гематологов особенно интересовала система метаболизма железа, потому что железо необходимо для красных кровяных телец. Фактически, большая часть железа в организме человека содержится в белке гемоглобина эритроцитов, где он помогает связывать и транспортировать кислород для клеточного дыхания, а дефицит железа является наиболее частой причиной анемии.
Когда уровень железа в организме слишком низкий, в эпителии двенадцатиперстной кишки (слизистой оболочке тонкой кишки) снижается уровень гормона, чувствительного к железу, называемого гепсидином.Это вызывает повышение активности ферропортина, железоселективного белкового канала, встроенного в мембрану клеток кишечника. Активация этого канала стимулирует поглощение железа пищеварительной системой. Избыток железа будет стимулировать обратный процесс.
СахарУровень глюкозы в крови регулируется двумя гормонами: инсулин и глюкагон , оба высвобождаются из поджелудочной железы.
Когда уровень сахара в крови становится слишком высоким, поджелудочная железа выделяет инсулин.Глюкоза или сахар поглощается клетками (особенно печенью и мышечной тканью), где хранится в виде гликогена. Это приводит к снижению уровня сахара в крови. С другой стороны, когда уровень сахара в крови становится слишком низким, поджелудочная железа выделяет глюкагон. Он способствует расщеплению гликогена на мономеры глюкозы в клетках печени. Затем клетки печени высвобождают свободную глюкозу обратно в кровоток и восстанавливают уровень сахара в крови.
Неправильное функционирование глюкагона приводит к гипогликемии , состоянию, при котором уровень сахара в крови слишком низкий.Это может быть опасно для жизни, приводя к коме и смерти, если не лечить вовремя. Неправильная функция инсулина приводит к гипергликемии или повышению уровня сахара в крови. Если это состояние затягивается, развивается болезнь, называемая диабетом. Более подробно диабет будет рассмотрен ниже в разделе 8.2.
ОсморегуляцияОсморегуляция — это активное регулирование осмотического давления жидкостей организма для поддержания гомеостаза содержания воды в организме; то есть он не дает жидкостям организма становиться слишком разбавленными или слишком концентрированными.Осмотическое давление — это мера тенденции воды переходить из одного раствора в другой посредством осмоса. Чем выше осмотическое давление раствора, тем больше воды хочет войти в раствор.
Почки используются для удаления избыточных ионов (таких как Na + , K + и Ca 2+ ) из крови, тем самым влияя на осмотическое давление. Затем они выводятся в виде мочи. Почки также важны для поддержания кислотно-щелочного уровня, так что pH крови остается близким к нейтральной точке.
Почки также определяют общий объем воды в организме. Гормоны антидиуретический гормон (АДГ), также известные как вазопрессин, и альдостерон играют важную роль в регулировании функции почек.
- Если в организме наблюдается дефицит жидкости , будет увеличиваться секреция АДГ из гипофиза. Затем этот гормон перемещается в дистальные канальцы или собирающие протоки почек, вызывая задержку жидкости и уменьшение диуреза.Точно так же гормон альдостерон, минеральный кортикоидный гормон со стероидной основой, секретируется корой надпочечников. Альдостерон заставляет почки реабсорбировать Na + . При повторной абсорбции Na + вода также реабсорбируется. Таким образом, удерживание Na + также приводит к удержанию жидкости (рис. 8.3).
- И наоборот, если уровень жидкости чрезмерен , секреция гормона (альдостерона) подавляется, что приводит к меньшей задержке жидкости почками и последующему увеличению объема вырабатываемой мочи.
Рис. 8.3. Влияние альдостерона и АДГ на функцию почек. Когда уровень жидкости в организме низкий, АДГ (вазопрессин) секретируется гипофизом, а альдостерон секретируется надпочечниками. АДГ снижает потерю воды, тогда как альдостерон увеличивает реабсорбцию Na + в собирательном канале почек. Вода реабсорбируется с Na +, вызывая увеличение задержки жидкости и снижение диуреза.
Эта цифра была изменена по материалам EEOC и Wikimedia Commons.
Гемостаз
Гемостаз — это процесс остановки кровотечения. Основная часть этого — каскад коагуляции, показанный на Рисунке 8.2.
Накопление тромбоцитов вызывает свертывание крови в ответ на разрыв слизистой оболочки кровеносных сосудов. В отличие от большинства механизмов контроля в организме человека, гемостаз использует положительную обратную связь: чем больше растет сгусток, тем больше происходит свертывание, пока кровь не остановится.
Спящий режимВремя сна зависит от баланса между гомеостатической склонностью ко сну , потребностью во сне как функцией количества времени, прошедшего с момента последнего адекватного эпизода сна, и циркадными ритмами , которые определяют идеальное время сна. правильно структурированный и восстанавливающий эпизод сна. Дефицит сна вызывает компенсирующее увеличение интенсивности и продолжительности сна, в то время как чрезмерный сон снижает склонность ко сну.
(Вернуться к началу)
8.2 Болезнь как гомеостатический дисбаланс Что такое болезнь?
Болезнь — это любой сбой нормальной физиологической функции, приводящий к негативным симптомам. Хотя заболевание часто является результатом инфекции или травмы, большинство заболеваний связано с нарушением нормального гомеостаза. Все, что препятствует правильной работе системы положительной или отрицательной обратной связи, может привести к болезни, если механизмы нарушения станут достаточно сильными.
Старение — это общий пример болезни в результате гомеостатического дисбаланса. По мере старения организма ослабление петель обратной связи постепенно приводит к нестабильности внутренней среды. Это отсутствие гомеостаза увеличивает риск заболевания и отвечает за физические изменения, связанные со старением. Сердечная недостаточность является результатом подавления механизмов отрицательной обратной связи, что позволяет деструктивным механизмам положительной обратной связи компенсировать отказавшие механизмы обратной связи.Это приводит к высокому кровяному давлению и увеличению сердца, которое в конечном итоге становится слишком жестким, чтобы эффективно перекачивать кровь, что приводит к сердечной недостаточности. Тяжелая сердечная недостаточность может привести к летальному исходу.
Диабет: болезнь нарушения гомеостазаДиабет, нарушение обмена веществ, вызванное повышенным уровнем глюкозы в крови, является ключевым примером заболевания, вызванного нарушением гомеостаза. В идеальных условиях механизмы гомеостатического контроля должны предотвращать возникновение этого дисбаланса.Однако у некоторых людей механизмы работают недостаточно эффективно или количество глюкозы в крови слишком велико для эффективного управления. В этих случаях необходимо медицинское вмешательство для восстановления гомеостаза и предотвращения необратимого повреждения органов.
Нормальный уровень сахара в кровиОрганизм человека поддерживает постоянный уровень глюкозы в течение дня. После еды уровень глюкозы в крови повышается, поскольку глюкоза транспортируется из тонкой кишки в кровоток.В ответ на это поджелудочная железа (сенсор) выделяет инсулин в кровоток, где он действует как гормон . Как вы узнали в главе 6, гормоны — это молекулы, которые вырабатываются в одной части тела, секретируются в кровоток и транспортируются в отдаленную часть тела, где они опосредуют эффект или реакцию на эту вторичную цель. . Инсулин — это пептидный гормон, который выделяется поджелудочной железой в ответ на повышенный уровень глюкозы в крови.Инсулин с высокой эффективностью связывается с рецепторными белками на поверхности клеток печени, где он включает передачу сигналов в печени, чтобы увеличить захват глюкозы из кровотока (рис. 8.4). Другие клетки организма, такие как скелетные мышцы, жировая ткань и клетки мозга, также активируются инсулином. Когда молекула оказывает на организм несколько различных эффектов, эти множественные эффекты называются плейотропными эффектами. Эти другие типы клеток также используют глюкозу в качестве источника энергии.Это снижает уровень глюкозы в крови до нормального уровня. Печень может поглощать больше глюкозы, чем другие типы тканей, и преобразовывать ее в большую углеводную молекулу, называемую гликогеном, о которой вы узнали в главе 6. Он хранится в виде этого углевода до тех пор, пока не понадобится глюкоза, после чего ее можно расщепить и высвободить. в кровоток. До 10% объема клеток печени находится в форме гликогена.
Рисунок 8.4 Гомеостаз глюкозы. Когда уровень сахара в крови повышается из-за еды (Путь 1), поджелудочная железа ощущает повышение уровня глюкозы в крови.В ответ он высвобождает пептидный гормон инсулин. Инсулин взаимодействует с нижележащими клетками-мишенями в организме, включая печень и мышечную ткань, где он вызывает захват глюкозы из кровотока в клетку. Избыток глюкозы хранится в виде углеводов, гликогена. Это возвращает нормальный уровень глюкозы в крови. Если после приема пищи прошло несколько часов, уровень глюкозы в крови начнет падать (Путь 2). Это сигнализирует клеткам печени о расщеплении гликогена на мономеры глюкозы.Затем глюкоза может быть возвращена в кровоток.
Рисунок предоставлен: Шеннан Маскопф из Biologycorner.com
Между приемами пищи или во время голодания уровень глюкозы в крови начинает падать. Это активирует выработку поджелудочной железой другого гормона, называемого глюкагоном. Передача сигналов глюкагона активирует печень, чтобы начать расщепление запасающей молекулы гликогена на свободную глюкозу. Затем глюкоза возвращается в кровоток, повышая уровень глюкозы в крови (Рисунок 8.4).
В течение дня уровни глюкозы в крови будут незначительно колебаться около гомеостатической уставки (рис. 8.5). Когда едят пищу, это вызывает повышение уровня глюкозы в крови, которому противодействует секреция инсулина. В перерывах между приемами пищи уровень глюкозы в крови падает, и поджелудочная железа высвобождает глюкагон, чтобы подать сигнал печени о возврате глюкозы в кровоток.
Рисунок 8.5. Гомеостаз метаболизма глюкозы : Это изображение иллюстрирует метаболизм глюкозы в течение дня.Гомеостаз может стать несбалансированным, если поджелудочная железа подвергается чрезмерной нагрузке, что делает ее неспособной сбалансировать метаболизм глюкозы. Это может привести к диабету.
Причины нарушения гомеостаза
Люди с диабетом 1 типа не вырабатывают инсулин из-за аутоиммунного разрушения клеток, продуцирующих инсулин, в то время как люди с диабетом 2 типа имеют хронический высокий уровень глюкозы в крови, который вызывает развитие инсулинорезистентности. При диабете уровень глюкозы в крови повышается за счет нормальной активности глюкагона, но отсутствие инсулина или резистентность к нему означает, что уровень сахара в крови не может вернуться к норме.Это вызывает метаболические изменения, которые приводят к таким симптомам диабета, как ослабление кровеносных сосудов и частое мочеиспускание. Диабет обычно лечат инъекциями инсулина, которые заменяют недостающую отрицательную обратную связь нормальной секреции инсулина. Если диабет не лечить или становится устойчивым к лечению, наблюдаются более серьезные побочные эффекты, в том числе периферическая невропатия (потеря чувствительности в конечностях), потеря кровообращения в конечностях, нечеткость зрения и / или слепота.
В целом, Диабет — это заболевание, вызванное нарушенной петлей обратной связи с участием гормона инсулина.Нарушенная петля обратной связи затрудняет или делает невозможным для организма снижение высокого уровня сахара в крови до здорового уровня.
(Вернуться к началу)
8.3. Измерение гомеостаза для оценки здоровья
Поскольку гомеостатический дисбаланс может привести к болезненным состояниям или даже смерти, гомеостаз был определен как одна из восьми основных концепций биологии. Американская ассоциация медицинских колледжей сообщает, что способность врачей определять и применять знания о гомеостазе следует рассматривать как одну из их ключевых компетенций.Таким образом, врачам нужен способ оценки гомеостатического здоровья своих пациентов. Им необходимо уметь оценивать смеси соединений, которые содержатся в организме человека.
Напомним, что в главе 2 вы познакомились с концепцией смеси , которая представляет собой вещество, состоящее из двух или более веществ. Также помните, что смеси могут быть двух типов: Гомогенная и Гетерогенная , где гомогенные смеси сочетаются так тесно, что их можно рассматривать как единое вещество, хотя это не так. Гетерогенные смеси , с другой стороны, неоднородны и имеют участки смеси, которые отличаются от других участков смеси. Гомогенные смеси можно разделить на две классификации: Коллоиды и растворы . Коллоид представляет собой смесь, содержащую частицы диаметром от 2 до 500 нм. Коллоиды кажутся однородными по природе и имеют одинаковый состав во всем, но являются мутными или непрозрачными.Кровь — хороший пример коллоида. Истинные растворы , с другой стороны, имеют размер частиц типичного иона или небольшой молекулы (от ~ 0,1 до 2 нм в диаметре) и прозрачны, хотя могут быть окрашены. В оставшихся разделах этой главы основное внимание будет уделено характеристикам истинных решений.
Решения повсюду вокруг нас. Например, воздух — это решение. Если вы живете рядом с озером, рекой или океаном, этот водоем не является чистым H 2 O, но, скорее всего, является решением.Многие из того, что мы пьем, например газированные напитки, кофе, чай и молоко, являются растворами. Решения — большая часть повседневной жизни. Большая часть химии, происходящей вокруг нас, происходит в растворе. Фактически, большая часть химии, происходящей в нашем собственном организме, происходит в растворах, и многие растворы, такие как раствор лактата Рингера для внутривенного введения, важны для здравоохранения. В нашем понимании химии нам нужно немного разбираться в растворах. В этой главе вы узнаете об особых характеристиках решений, их характеристиках и некоторых их свойствах.
Главный компонент раствора называется растворителем , а второстепенный компонент (ы) называется растворенным веществом . Если оба компонента в растворе составляют 50%, термин «растворенное вещество» может относиться к любому компоненту. Когда газообразный или твердый материал растворяется в жидкости, газ или твердый материал называется растворенным веществом . Когда две жидкости растворяются друг в друге, основной компонент называется растворителем , а второстепенный компонент называется растворенным веществом . Многие химические реакции протекают в растворах, и растворы также тесно связаны с нашей повседневной жизнью. Воздух, которым мы дышим, жидкости, которые мы пьем, и жидкости в нашем теле — все это решения. Кроме того, нас окружают такие решения, как воздух и вода (в реках, озерах и океанах). (Вернуться к началу)Типы решений
Материал существует в трех состояниях: твердом, жидком и газообразном. Решения также существуют во всех этих состояниях:
- Газовые смеси обычно однородны и обычно представляют собой газо-газовые растворы .Для количественной обработки такого типа растворов мы посвятим единицу газам. Атмосфера представляет собой газообразный раствор, состоящий из азота, кислорода, аргона, двуокиси углерода, воды, метана и некоторых других второстепенных компонентов. Некоторые из этих компонентов, такие как вода, кислород и углекислый газ, могут различаться по концентрации в разных местах на Земле в зависимости от таких факторов, как температура и высота над уровнем моря.
- Когда молекулы газа, твердого вещества или жидкости диспергированы и смешаны с молекулами жидкости, гомогенные (однородные) состояния называются жидкими растворами .Твердые вещества, жидкости и газы растворяются в жидком растворителе с образованием жидких растворов. В этой главе большая часть химии, которую мы обсудим, происходит в жидких растворах, где вода является растворителем.
- Многие сплавы, керамика и полимерные смеси представляют собой твердые растворы . В определенных пределах медь и цинк растворяются друг в друге и затвердевают с образованием твердых растворов, называемых латунью. Серебро, золото и медь образуют множество различных сплавов, уникальных по цвету и внешнему виду.Сплавы и другие твердые растворы важны в мире химии материалов.
8,4 Растворимость
Максимальное количество вещества, которое может быть растворено в данном объеме растворителя, называется растворимостью . Часто растворимость в воде выражается в граммах / 100 мл. Раствор, не достигший максимальной растворимости, называется ненасыщенным раствором . Это означает, что к растворителю все еще может быть добавлено больше растворенного вещества, и растворение все равно будет происходить.
Раствор, достигший максимальной растворимости, называется насыщенным раствором . Если в этот момент добавить больше растворенного вещества, оно не растворится в растворе. Вместо этого он останется в осадке в виде твердого вещества на дне раствора. Таким образом, часто можно сказать, что раствор является насыщенным, если присутствует дополнительное растворенное вещество (оно может существовать в виде другой фазы, такой как газ, жидкость или твердое вещество).В насыщенном растворе нет чистого изменения количества растворенного вещества, но система никоим образом не статична. Фактически растворенное вещество постоянно растворяется и откладывается с одинаковой скоростью. Такое явление называется равновесие . Например:
В особых случаях раствор может быть перенасыщенным . Перенасыщенные растворы — это растворы, в которых растворенные вещества растворяются за пределами нормальной точки насыщения.Обычно для создания перенасыщенного раствора требуются такие условия, как повышенная температура или давление. Например, ацетат натрия имеет очень высокую растворимость при 270 К. При охлаждении такой раствор остается растворенным в так называемом метастабильном состоянии . Однако, когда к раствору добавляют кристалл затравки , дополнительное растворенное вещество быстро затвердевает. В процессе кристаллизации выделяется тепло, и раствор становится теплым. Обычные грелки для рук используют этот химический процесс для выработки тепла.
Видео, показывающее кристаллизацию перенасыщенного раствора ацетата натрия. Видео: Школа естественных и математических наук Северной Каролины
Итак, как мы можем предсказать растворимость вещества?
Одна из полезных классификаций материалов — полярность. Читая о ковалентных и ионных соединениях в главах 3 и 4, вы узнали, что ионные соединения имеют самую высокую полярность, образуя полные катионы и анионы внутри каждой молекулы, поскольку электроны передаются от одного атома к другому.Вы также узнали, что ковалентные связи могут быть полярными или неполярными по своей природе в зависимости от того, разделяют ли атомы, участвующие в связи, электроны неравномерно или поровну, соответственно. Напомним, что по разнице электроотрицательностей можно определить полярность вещества. Обычно ионная связь имеет разность электроотрицательностей 1,8 или выше, тогда как полярная ковалентная связь составляет от 0,4 до 1,8, а неполярная ковалентная связь составляет 0,4 или ниже.
Рисунок 8.6 Диаграмма разности электроотрицательностей. Диаграмма выше является руководством для определения типа связи между двумя разными атомами. Взяв разницу между значениями электроотрицательности для каждого из атомов, участвующих в связи, можно предсказать тип связи и полярность. Обратите внимание, что полный ионный характер достигается редко, однако, когда металлы и неметаллы образуют связи, они называются в соответствии с правилами ионного связывания.
Вещества с нулевой или низкой разностью электроотрицательности, такие как H 2 , O 2 , N 2 , CH 4 , CCl 4 , являются неполярными соединениями , тогда как H 2 O, NH 3 , CH 3 OH, NO, CO, HCl, H 2 S, PH 3 Более высокая разность электроотрицательностей составляет полярное соединение .Обычно соединения, имеющие сходную полярность, растворимы друг в друге. Это можно описать правилом:
Like Dissolves Like.Это означает, что вещества должны иметь одинаковые межмолекулярные силы для образования растворов. Когда растворимое растворенное вещество вводится в растворитель, частицы растворенного вещества могут взаимодействовать с частицами растворителя. В случае твердого или жидкого растворенного вещества взаимодействия между частицами растворенного вещества и частицами растворителя настолько сильны, что отдельные частицы растворенного вещества отделяются друг от друга и, окруженные молекулами растворителя, входят в раствор.(Газообразные растворенные вещества уже отделены от составляющих частиц, но концепция окружения частицами растворителя все еще применима.) Этот процесс называется solvatio n и проиллюстрирован на рисунке 7.2. Когда растворителем является вода, вместо сольватации используется слово гидратация .
Обычно полярные растворители растворяют полярные растворенные вещества, тогда как неполярные растворители растворяют неполярные растворенные вещества. В целом процесс растворения зависит от силы притяжения между частицами растворенного вещества и частицами растворителя.Например, вода представляет собой высокополярный растворитель, способный растворять многие ионные соли. На рис. 8.7 показан процесс растворения, в котором вода действует как растворитель для растворения кристаллической соли хлорида натрия (NaCl). Обратите внимание, что когда ионные соединения растворяются в растворителе, они распадаются на свободно плавающие ионы в растворе. Это позволяет соединению взаимодействовать с растворителем. В случае растворения хлорида натрия в воде ион натрия притягивается к частичному отрицательному заряду атома кислорода в молекуле воды, тогда как ион хлорида притягивается к частичным положительным атомам водорода.
Рисунок 8.7: Процесс растворения. Когда ионная соль, такая как хлорид натрия, показанная на (A), вступает в контакт с водой, молекулы воды диссоциируют ионные молекулы хлорида натрия в их ионное состояние, что показано в виде молекулярной модели на (B) твердого тела. кристаллическая решетка хлорида натрия и (C) хлорид натрия, растворенный в водном растворителе. (Фотография хлорида натрия предоставлена Крисом 73).
Многие ионные соединения растворимы в воде, однако не все ионные соединения растворимы.Ионные соединения, растворимые в воде, существуют в растворе в ионном состоянии. На рис. 7.2 вы заметите, что хлорид натрия распадается на ион натрия и ион хлорида по мере растворения и взаимодействия с молекулами воды. В случае ионных соединений, не растворимых в воде, ионы настолько сильно притягиваются друг к другу, что не могут быть разделены частичными зарядами молекул воды.
Диссоциация растворимых ионных соединений придает растворам этих соединений интересное свойство: они проводят электричество.Из-за этого свойства растворимые ионные соединения упоминаются как электролиты . Многие ионные соединения полностью диссоциируют и поэтому называются сильными электролитами . Хлорид натрия — пример сильного электролита. Некоторые соединения растворяются, но диссоциируют лишь частично, и растворы таких растворенных веществ могут лишь слабо проводить электричество. Эти растворенные вещества называются слабыми электролитами . Уксусная кислота (CH 3 COOH), входящая в состав уксуса, является слабым электролитом.Растворенные вещества, которые растворяются в отдельные нейтральные молекулы без диссоциации, не придают своим растворам дополнительную электропроводность и называются неэлектролитами . Полярные ковалентные соединения, такие как столовый сахар (C 12 H 22 O 11 ), являются хорошими примерами неэлектролитов .
Термин электролит используется в медицине для обозначения любых важных ионов, растворенных в водном растворе в организме.Важные физиологические электролиты включают Na + , K + , Ca 2 + , Mg 2 + и Cl — . Спортивные напитки, такие как Gatoraid, содержат комбинации этих ключевых электролитов, которые помогают восполнить потерю электролитов после тяжелой тренировки.
Аналогичным образом решения могут быть получены путем смешивания двух совместимых жидкостей. Жидкость с более низкой концентрацией называется растворенным веществом , , а жидкость с более высокой концентрацией — растворителем .Например, зерновой спирт (CH 3 CH 2 OH) представляет собой полярную ковалентную молекулу, которая может смешиваться с водой. Когда два одинаковых раствора помещаются вместе и могут смешиваться в раствор, они считаются смешиваемыми . С другой стороны, жидкости, которые не имеют одинаковых характеристик и не могут смешиваться вместе, называются несмешивающимися . Например, масла, содержащиеся в оливковом масле, такие как олеиновая кислота (C 18 H 34 O 2 ), имеют в основном неполярные ковалентные связи, которые не имеют межмолекулярных сил, достаточно сильных, чтобы разорвать водородную связь между молекулы воды.Таким образом, вода и масло не смешиваются и считаются несмешивающимися .
Другие факторы, такие как температура и давление, также влияют на растворимость растворителя. Таким образом, при определении растворимости следует также учитывать эти другие факторы.
(Вернуться к началу)
8,5 Концентрация раствора
В химии концентрация определяется как содержание компонента, деленное на общий объем смеси.Все мы качественно представляем, что подразумевается под концентрацией . Любой, кто варил растворимый кофе или лимонад, знает, что слишком много порошка дает сильно ароматизированный и высококонцентрированный напиток, тогда как слишком мало приводит к разбавленному раствору, который может быть трудно отличить от воды. Количественно концентрация раствора описывает количество растворенного вещества, которое содержится в определенном количестве этого раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для реакций, протекающих в растворе, и имеет решающее значение для многих аспектов нашей жизни, от измерения правильной дозы лекарства до обнаружения химических загрязнителей, таких как свинец и мышьяк.Химики используют множество разных способов определения концентраций. В этом разделе мы рассмотрим наиболее распространенные способы представления концентрации раствора. К ним относятся: молярность и количество частей на раствор.
Наиболее распространенной единицей концентрации является молярность , что также является наиболее полезным для расчетов, включающих стехиометрию реакций в растворе. Молярность (M) раствора — это количество молей растворенного вещества, присутствующего точно в 1 л раствора.
Таким образом, единицами молярности являются моль на литр раствора (моль / л), сокращенно М. Обратите внимание, что указанный объем является общим объемом раствора и включает как растворенное вещество, так и растворитель. Например, водный раствор, который содержит 1 моль (342 г) сахарозы в достаточном количестве воды, чтобы получить конечный объем 1,00 л, имеет концентрацию сахарозы 1,00 моль / л или 1,00 М. В химических обозначениях квадратные скобки вокруг названия или формула растворенного вещества представляет собой концентрацию растворенного вещества.Итак
[сахароза] = 1,00 M
читается как «концентрация сахарозы 1,00 молярная». Приведенное выше уравнение можно использовать для расчета количества растворенного вещества, необходимого для получения любого количества желаемого раствора.
Пример проблемы:Рассчитайте количество молей гидроксида натрия (NaOH), необходимое для получения 2,50 л 0,100 M NaOH.
Дано: (1) идентичность растворенного вещества = NaOH, (2) объем = 2,50 л и (3) молярность раствора = 0.100 моль / л (Примечание: при вычислении задач всегда записывайте единицы молярности как моль / л, а не М. Это позволит вам отменить единицы при выполнении вычислений.)
Запрошено: количество растворенного вещества в молях
Стратегия: (1) Измените приведенное выше уравнение, чтобы найти желаемую единицу, в данном случае молей. (2) Еще раз проверьте все единицы в уравнении и убедитесь, что они совпадают. Выполните все необходимые преобразования, чтобы единицы совпадали. (3) Введите значения соответствующим образом и выполните математические вычисления.
Решение:
(1) Перепишите приведенное выше уравнение, чтобы найти количество молей.
(2) Еще раз проверьте все единицы в уравнении и убедитесь, что они совпадают.
Приведенные значения для этого уравнения: объем 2,50 л и молярность 0,100 моль / л. Единицы объема для обоих этих чисел указаны в литрах (L) и, следовательно, совпадают. Следовательно, никаких преобразований производить не нужно.
(3) Введите значения соответствующим образом и выполните математические вычисления.
Приготовление растворовОбратите внимание, что в приведенном выше примере у нас все еще недостаточно информации, чтобы фактически приготовить раствор в лаборатории. Не существует оборудования, которое могло бы измерить количество молей вещества. Для этого нам нужно преобразовать количество молей образца в количество граммов, представленное этим числом. Затем мы можем легко использовать весы для взвешивания количества вещества, необходимого для приготовления раствора.В приведенном выше примере:
Чтобы фактически приготовить раствор, обычно растворяют растворенное вещество в небольшом количестве растворителя, а затем, когда растворенное вещество растворяется, конечный объем может быть доведен до 2,50 л. Если вы добавляете 10 г NaOH напрямую до 2,50 л конечный объем будет больше 2,50 л, а концентрация раствора будет меньше 0,100 М. Помните, что конечный объем должен включать как растворенное вещество, так и растворитель.
На рис. 8.8 показана процедура приготовления раствора дигидрата хлорида кобальта (II) в этаноле.Обратите внимание, что объем растворителя не указан. Поскольку растворенное вещество занимает место в растворе, необходимый объем растворителя на меньше, чем на желаемый общий объем раствора.
Рисунок 8.8: Приготовление раствора известной концентрации с использованием твердого вещества. Чтобы приготовить раствор, сначала добавьте в колбу часть растворителя. Затем взвесьте необходимое количество растворенного вещества и медленно добавьте его к растворителю.После растворения в растворителе объем раствора можно довести до конечного объема раствора. Для показанной мерной колбы это обозначено черной линией на горловине колбы. В данном случае это 500 мл раствора. Мерные колбы бывают разных размеров, чтобы вместить разные объемы раствора. Градуированные цилиндры также можно использовать для точного доведения раствора до конечного объема. Другая стеклянная посуда, включая химические стаканы и колбы Эрленмейера, недостаточно точна для большинства решений.
Пример расчета молярности
Раствор на рисунке 7.8 содержит 10,0 г дигидрата хлорида кобальта (II), CoCl 2 · 2H 2 O, в этаноле, достаточном для приготовления ровно 500 мл раствора. Какова молярная концентрация CoCl 2 · 2H 2 O?
Дано: масса растворенного вещества и объем раствора
Запрошено: концентрация (M)
Стратегия:
1.Мы знаем, что молярность равна 9000 моль / литр.
2. Чтобы вычислить молярность, нам нужно выразить:
- масса в виде родинок
- объем в литрах
- Подставьте оба в уравнение выше и вычислите
Решение:
- Преобразование массы в моль. Мы можем использовать молярную массу для перевода граммов CoCl 2 · 2H 2 O в моль.
- Молярная масса CoCl 2 · 2H 2 O составляет 165.87 г / моль (включая две молекулы воды, поскольку они являются частью структуры кристаллической решетки этого твердого гидрата!)
2. Перевести объем в литры
3. Подставьте значения в уравнение полярности:
8.5.2 Количество частей в решенияхВ потребительском и промышленном мире наиболее распространенный метод выражения концентрации основан на количестве растворенного вещества в фиксированном количестве раствора.Упомянутые здесь «количества» могут быть выражены в массе, в объеме или в обоих (т. Е. масса растворенного вещества в данном объеме раствора). Чтобы различать эти возможности, сокращения (m / м), (об / об) и (м / об).
В большинстве прикладных областей химии часто используется мера (m / m), тогда как в клинической химии обычно используется (m / v), где масса выражается в граммах и объемом в мл.
Один из наиболее распространенных способов выражения таких концентраций как « частей на 100 », который мы все знаем как « процентов ».« Cent » — это префикс латинского происхождения, относящийся к числу 100
(L. centum ), например, Centum или столетний . Он также обозначает 1/100 (от L. centesimus ), как сантиметр и денежная единица центов . Процентные растворы определяют количество растворенного вещества, которое растворено в количестве раствора, умноженном на 100. Процентные растворы могут быть выражены в единицах массы растворенного вещества на массу раствора (м / м%) или массы растворенного вещества на объем раствора (м / об.%) или объем растворенного вещества на объем раствора (об. / об.%).При создании процентного раствора важно указать, какие единицы измерения используются, чтобы другие также могли правильно принять решение. Также помните, что раствор представляет собой сумму как растворителя, так и растворенного вещества, когда вы выполняете расчет процентов.
Раствор = Раствор + Растворитель
Таким образом, при вычислении процентных решений можно использовать следующее уравнение:
Пример 1:В качестве примера, раствор этанола в воде с концентрацией 7,0% об. / Об. Будет содержать 7 мл этанола в общем количестве 100 мл раствора.Сколько воды в растворе?
В этой задаче мы знаем, что:
Раствор = Раствор + Растворитель
Таким образом, мы можем ввести значения, а затем решить неизвестное.
100 мл = 7 мл + X мл растворителя (в данном случае вода)
переместив 7 на другую сторону, мы увидим, что:
100 мл — 7 мл = 93 мл H 2 O
Пример 2Какое (м / об)% раствора, если 24.0 г сахарозы растворяют в общем растворе 243 мл?
Пример 3Сколько граммов NaCl требуется для приготовления 625 мл 13,5% раствора?
Для более разбавленных растворов используются части на миллион (10 6 ppm) и части на миллиард (10 9 ; ppb). Эти термины широко используются для обозначения количества следов загрязняющих веществ в окружающей среде.
Одинаковые процентные («части на сотню») единицы, ppm и ppb могут быть определены в единицах массы, объема или смешанных единиц массы-объема.Также существуют единицы ppm и ppb, определяемые по количеству атомов и молекул.
Массовые определения ppm и ppb приведены здесь:
Как ppm, так и ppb являются удобными единицами измерения концентраций загрязняющих веществ и других микропримесей в воде. Концентрации этих загрязнителей, как правило, очень низкие в очищенных и природных водах, и их уровни не могут превышать относительно низкие пороговые значения концентрации, не вызывая неблагоприятных последствий для здоровья и дикой природы.Например, EPA определило, что максимально безопасный уровень фторид-иона в водопроводной воде составляет 4 ppm. Встроенные фильтры для воды предназначены для снижения концентрации фторида и некоторых других незначительных примесей в водопроводной воде (рис. 8.9).
Рисунок 8.9. (a) В некоторых районах следовые концентрации загрязняющих веществ могут сделать нефильтрованную водопроводную воду небезопасной для питья и приготовления пищи. (b) Встроенные фильтры для воды снижают концентрацию растворенных веществ в водопроводной воде.(кредит А: модификация работы Дженн Дарфи; кредит б: модификация работы «Вастатепаркстафф» / Wikimedia commons
При сообщении о загрязнителях, таких как свинец, в питьевой воде, концентрации ppm и ppb часто указываются в смешанных единицах измерения массы / объема. Это может быть очень полезно, поскольку нам легче думать о воде с точки зрения ее объема, а не массы. Кроме того, плотность воды составляет 1,0 г / мл или 1,0 мг / 0,001 мл, что упрощает преобразование между двумя единицами измерения.Например, если мы обнаружим, что содержание свинца в воде составляет 4 ppm, это будет означать, что есть:
Концентрации ионных растворенных веществ иногда выражаются в единицах, называемых эквивалентами (уравнение). Один эквивалент равен 1 моль положительного или отрицательного заряда. Таким образом, 1 моль / л Na + (водн.) Также составляет 1 экв / л, потому что натрий имеет заряд 1+. Раствор ионов Ca 2 + (водн.) С концентрацией 1 моль / л имеет концентрацию 2 экв / л, потому что кальций имеет заряд 2+.Разбавленные растворы могут быть выражены в миллиэквивалентах (мэкв.) — например, общая концентрация плазмы крови человека составляет около 150 мэкв / л.
В более формальном определении, эквивалент — это количество вещества, необходимое для выполнения одного из следующих действий:
- реагирует или поставляет один моль ионов водорода (H + ) в кислотно-щелочной реакции
- реагирует или поставляет один моль электронов в окислительно-восстановительной реакции.
Согласно этому определению, эквивалент — это количество молей иона в растворе, умноженное на валентность этого иона.Если 1 моль NaCl и 1 моль CaCl 2 растворяются в растворе, в этом растворе содержится 1 экв. Na, 2 экв. Ca и 3 экв. Cl. (Валентность кальция равна 2, поэтому для этого иона у вас есть 1 моль и 2 эквивалента.)
(Вернуться к началу)8,6 Разведения
Раствор желаемой концентрации можно также приготовить путем разбавления небольшого объема более концентрированного раствора дополнительным растворителем. Для этой цели часто используется основной раствор, который представляет собой приготовленный раствор известной концентрации.Разбавление основного раствора предпочтительнее при приготовлении растворов с очень слабой концентрацией, потому что альтернативный метод, взвешивание крошечных количеств растворенного вещества, может быть трудным для выполнения с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из основного раствора показана на рисунке 8.10. Это требует расчета желаемого количества растворенного вещества в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, который содержит это количество растворенного вещества.Помните, что при разбавлении данного количества исходного раствора растворителем , а не , изменяет количество присутствующего растворенного вещества, изменяется только объем раствора. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора может быть выражено математически как:
Где M s — концентрация основного раствора, V s — объем основного раствора, M d — концентрация разбавленного раствора, а V d — объем разбавленного раствора. .
Рис. 8.10 Приготовление раствора известной концентрации путем разбавления исходного раствора. (a) Объем ( V s ), содержащий желаемое количество растворенного вещества (M s ), измеряют из исходного раствора известной концентрации. (b) Отмеренный объем исходного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляется растворителем до объемной отметки [( V s ) (M s ) = ( V d ) (M d ). ].
Пример расчета разбавления
Какой объем 3,00 М исходного раствора глюкозы необходим для приготовления 2500 мл 0,400 М раствора?
Дано: объем и молярность разбавленного раствора и молярность исходного раствора
Запрошено: объем основного раствора
Стратегия и решение:
Для задач разбавления, если вам известны 3 переменные, вы можете решить для 4-й переменной.
- Начните с перестановки уравнения, чтобы найти переменную, которую вы хотите найти. В этом случае вы хотите найти объем основного раствора, В с
2. Затем убедитесь, что одинаковые термины имеют одинаковые единицы измерения. Например, Md и Ms являются концентрациями, поэтому для проведения расчетов они должны быть в одной и той же единице (в данном случае они оба указаны в молярности). Если бы концентрации были разными, скажем, один был дан в молярности, а другой в процентах, или один был в молярности, а другой был в миллимолярности, один из терминов нужно было бы преобразовать, чтобы они совпадали.Таким образом, единицы будут отменены, и в этом случае вы останетесь с единицами громкости.
3. Наконец, заполните уравнение с известными значениями и вычислите окончательный ответ.
Обратите внимание, что если требуется 333 мл исходного раствора, вы также можете рассчитать количество растворителя, необходимое для окончательного разбавления. (Общий объем — объем исходного раствора = объем растворителя, необходимый для окончательного разбавления. В этом случае 2500 мл — 333 мл = 2167 мл воды, необходимой для окончательного разбавления (это следует делать в мерном цилиндре или мерной колбе). .
8,7 Концентрации ионов в растворе
До сих пор мы обсуждали концентрацию всего раствора в терминах общего растворенного вещества, деленного на объем раствора. Давайте более подробно рассмотрим, что это означает при рассмотрении ионных и ковалентных соединений. Когда ионные соединения растворяются в растворе, они переходят в ионное состояние.Катионы и анионы связываются с полярными молекулами воды. Напомним, что растворы, содержащие ионы, называются электролитами из-за их способности проводить электричество. Например, дихромат аммония (NH 4 ) 2 Cr 2 O 7 представляет собой ионное соединение, которое содержит два иона NH 4 + и один Cr 2 O 7 2− ионов на формульную единицу. Как и другие ионные соединения, это сильный электролит, который диссоциирует в водном растворе с образованием гидратированных ионов NH 4 + и Cr 2 O 7 2-.Если мы рассмотрим это решение математически, мы увидим, что для каждой молекулы дихромата аммония, которая растворяется, образуются три результирующих иона (два иона NH 4 + и один Cr 2 O 7 2− ион). Это также можно представить в более крупном молярном масштабе. Когда 1 моль (NH 4 ) 2 Cr 2 O 7 растворяется, образуется 3 моля ионов (1 моль Cr 2 O 7 2- анионов и 2 моль катионов NH 4 + ) в растворе (рисунок 8.11). Чтобы обсудить взаимосвязь между концентрацией раствора и результирующим количеством ионов, используется термин эквиваленты .
Один эквивалент определяется как количество ионного соединения, которое обеспечивает 1 моль электрического заряда (+ или -). Он рассчитывается путем деления молярности раствора на общий заряд, созданный в растворе.
Рис. 8.11 Растворение 1 моля ионного соединения. Растворение 1 моля формульных единиц дихромата аммония в воде дает 1 моль анионов Cr 2 O 7 2− и 2 моль катионов NH 4 + . (Молекулы воды не показаны с молекулярной точки зрения для ясности.)
Когда мы проводим химическую реакцию с использованием раствора соли, например дихромата аммония, нам необходимо знать концентрацию каждого иона, присутствующего в растворе. Если раствор содержит 1,43 M (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2− также должна быть равна 1.43 M, потому что на формульную единицу приходится один ион Cr 2 O 7 2−. Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 М = 2,86 М. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 при растворении в воде образует три иона (2NH 4 + + 1Cr 2 O 7 2−), общая концентрация ионов в решение 3 × 1.43 M = 4,29 M. Эквивалентное значение (NH 4 ) 2 Cr 2 O 7 может быть затем рассчитано путем деления 1,43 M на 4,29 M, что дает 0,333 эквивалента. Таким образом, для (NH 4 ) 2 Cr 2 O 7 растворение 0,333 моля соединения даст 1 моль ионов в растворе.
Каковы концентрации всех ионных частиц, полученных из растворенных веществ в этих водных растворах?
- 0.21 М NaOH
- 3,7 M (CH 3 ) CHOH
- 0,032 M In (NO 3 ) 3
Дано: молярность
Запрошено: концентрации
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или как неэлектролит.
B Если соединение неэлектролит, его концентрация равна молярности раствора. Если соединение является сильным электролитом, определите количество каждого иона, содержащегося в одной формульной единице.Найдите концентрацию каждого вида, умножив количество каждого иона на молярность раствора.
Решение:
1. 0,21 М NaOH
A Гидроксид натрия — это ионное соединение, которое является сильным электролитом (и сильным основанием) в водном растворе:
B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH —, концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0.21 M и [OH — ] = 0,21
2. 3,7 M (CH 3 ) CHOH
A Формула (CH 3 ) 2 CHOH представляет собой 2-пропанол (изопропиловый спирт) и содержит группу –OH, поэтому это спирт. Напомним из раздела 4.1 «Водные растворы», что спирты — это ковалентные соединения, которые растворяются в воде с образованием растворов нейтральных молекул. Таким образом, спирты не являются электролитами
B Таким образом, единственными растворенными веществами в растворе являются (CH 3 ) 2 молекулы CHOH, поэтому [(CH 3 ) 2 CHOH] = 3.7 м
3. 0,032 M In (NO 3 ) 3
A Нитрат индия — это ионное соединение, которое содержит ионы In 3+ и ионы NO 3 —, поэтому мы ожидаем, что он будет вести себя как сильный электролит в водном растворе
B Одна формульная единица In (NO 3 ) 3 дает один ион In 3+ и три иона NO 3 —, так что 0,032 M In (NO 3 ) 3 Решение содержит 0.032 M In 3+ и 3 × 0,032 M = 0,096 M NO 3 — , то есть [In 3+ ] = 0,032 M и [NO 3 — ] = 0,096 M
(Вернуться к началу)8.8 Движение молекул через мембрану
Одно из величайших чудес клеточной мембраны — это ее способность регулировать концентрацию веществ внутри клетки. Эти вещества включают ионы, такие как Ca ++ , Na + , K + и Cl —; питательные вещества, включая сахара, жирные кислоты и аминокислоты; и продукты жизнедеятельности, особенно диоксид углерода (CO 2 ), которые должны покидать ячейку.
Двухслойная липидная структура мембраны обеспечивает первый уровень контроля. Фосфолипиды плотно упакованы вместе, и мембрана имеет гидрофобную внутреннюю часть. Эта структура делает мембрану избирательно проницаемой. Мембрана с селективной проницаемостью позволяет только веществам, отвечающим определенным критериям, проходить через нее без посторонней помощи. В случае клеточной мембраны только относительно небольшие неполярные материалы могут перемещаться через липидный бислой (помните, липидные хвосты мембраны неполярны).Некоторыми примерами этого являются другие липиды, кислород и углекислый газ, а также спирт. Однако водорастворимые материалы, такие как глюкоза, аминокислоты и электролиты, нуждаются в некоторой помощи для прохождения через мембрану, потому что они отталкиваются гидрофобными хвостами фосфолипидного бислоя. Все вещества, которые проходят через мембрану, делают это одним из двух общих методов, которые классифицируются в зависимости от того, требуется ли энергия. Пассивный транспорт — это движение веществ через мембрану без затрат клеточной энергии.Напротив, активный транспорт — это перемещение веществ через мембрану с использованием энергии аденозинтрифосфата (АТФ). Вы видели примеры этих типов транспортных механизмов в главе 4, где мы узнали о генерации потенциала действия в нейроне.
Пассивный транспортЧтобы понять , как вещества пассивно перемещаются через клеточную мембрану, необходимо понимать градиенты концентрации и диффузию.Градиент концентрации — это разница в концентрации вещества в пространстве. Молекулы (или ионы) будут распространяться / диффундировать от того места, где они более сконцентрированы, к месту, где они менее сконцентрированы, до тех пор, пока они не будут равномерно распределены в этом пространстве. (Когда молекулы движутся таким образом, они, как говорят, перемещаются на вниз на свой градиент концентрации.) Диффузия — это перемещение частиц из области с более высокой концентрацией в область с более низкой концентрацией.Несколько общих примеров помогут проиллюстрировать эту концепцию. Представьте, что вы находитесь в закрытой ванной. Если распылить флакон духов, молекулы аромата естественным образом распространятся из места, где они оставили флакон, во все углы ванной комнаты, и это распространение будет продолжаться до тех пор, пока не исчезнет градиент концентрации. Другой пример — ложка сахара, помещенная в чашку чая. В конце концов сахар будет распространяться по всему чаю, пока не исчезнет градиент концентрации. В обоих случаях, если в комнате теплее или чай горячее, диффузия происходит еще быстрее, поскольку молекулы сталкиваются друг с другом и распространяются быстрее, чем при более низких температурах.Таким образом, внутренняя температура тела около 98,6 ° F также способствует диффузии частиц внутри тела.
Посетите эту ссылку, чтобы увидеть диффузию и то, как она приводится в движение кинетической энергией молекул в растворе.Когда какое-либо вещество существует в большей концентрации на одной стороне полупроницаемой мембраны, такой как клеточные мембраны, любое вещество, которое может двигаться вниз по градиенту своей концентрации через мембрану, будет делать это. Рассмотрим вещества, которые могут легко диффундировать через липидный бислой клеточной мембраны, такие как газы кислород (O 2 ) и CO 2 .O 2 обычно диффундирует в клетки, потому что он более сконцентрирован вне них, а CO 2 обычно диффундирует из клеток, потому что он более сконцентрирован внутри них. Ни один из этих примеров не требует энергии со стороны клетки, и поэтому они используют пассивный транспорт для перемещения через мембрану.
Прежде чем двигаться дальше, необходимо рассмотреть газы, которые могут диффундировать через клеточную мембрану. Поскольку клетки быстро потребляют кислород во время метаболизма, обычно внутри клетки концентрация O 2 ниже, чем снаружи.В результате кислород будет диффундировать из межклеточной жидкости непосредственно через липидный бислой мембраны в цитоплазму внутри клетки. С другой стороны, поскольку клетки продуцируют CO 2 как побочный продукт метаболизма, концентрации CO 2 повышаются в цитоплазме; следовательно, CO 2 будет перемещаться из клетки через липидный бислой в интерстициальную жидкость, где его концентрация ниже. Этот механизм движения молекул через клеточную мембрану со стороны, где они более сконцентрированы, в сторону, где они менее сконцентрированы, представляет собой форму пассивного транспорта, называемого простой диффузией (Рисунок 8.12).
Рисунок 8.12. Простая диффузия через клеточную (плазменную) мембрану. Структура липидного бислоя позволяет небольшим, незаряженным веществам, таким как кислород и углекислый газ, и гидрофобным молекулам, таким как липиды, проходить через клеточную мембрану вниз по градиенту их концентрации путем простой диффузии.
Большие полярные или ионные молекулы, которые являются гидрофильными, не могут легко пересечь бислой фосфолипидов. Очень маленькие полярные молекулы, такие как вода, могут пересекаться посредством простой диффузии из-за своего небольшого размера.Заряженные атомы или молекулы любого размера не могут пересечь клеточную мембрану посредством простой диффузии, поскольку заряды отталкиваются гидрофобными хвостами внутри бислоя фосфолипидов. Растворенные вещества, растворенные в воде по обе стороны от клеточной мембраны, будут иметь тенденцию диффундировать вниз по градиенту их концентрации, но поскольку большинство веществ не могут свободно проходить через липидный бислой клеточной мембраны, их движение ограничивается белковыми каналами и специализированными транспортными механизмами в мембране. . Облегченная диффузия — это процесс диффузии, используемый для тех веществ, которые не могут пересекать липидный бислой из-за своего размера, заряда и / или полярности (рис. 8.13). Типичным примером облегченной диффузии является перемещение глюкозы в клетку, где она используется для производства АТФ. Хотя глюкоза может быть более концентрированной вне клетки, она не может пересекать липидный бислой посредством простой диффузии, потому что он является одновременно большим и полярным. Чтобы решить эту проблему, специальный белок-носитель, называемый переносчиком глюкозы, будет переносить молекулы глюкозы в клетку, чтобы облегчить ее внутреннюю диффузию.
Рисунок 8.13. Облегченная диффузия. (a) Облегченная диффузия веществ через клеточную (плазматическую) мембрану происходит с помощью белков, таких как канальные белки и белки-носители. Канальные белки менее селективны, чем белки-носители, и обычно легко различают свой груз в зависимости от размера и заряда. (б) Белки-носители более селективны, часто позволяя пересекаться только одному конкретному типу молекул.В качестве примера, хотя ионы натрия (Na + ) сильно сконцентрированы вне клеток, эти электролиты заряжены и не могут проходить через неполярный липидный бислой мембраны.Их диффузии способствуют мембранные белки, которые образуют натриевые каналы (или «поры»), так что ионы Na + могут двигаться вниз по градиенту их концентрации из-за пределов клеток внутрь клеток. Есть много других растворенных веществ, которые должны пройти через облегченную диффузию, чтобы попасть в клетку, например, аминокислоты, или выйти из клетки, например, отходы. Поскольку облегченная диффузия — это пассивный процесс, он не требует затрат энергии клеткой.
Вода также может свободно перемещаться через клеточную мембрану всех клеток либо через белковые каналы, либо скользя между липидными хвостами самой мембраны. Осмос — это диффузия воды через полупроницаемую мембрану (рис. 8.14).
Рисунок 8.14. Осмос. Осмос — это диффузия воды через полупроницаемую мембрану вниз по градиенту ее концентрации. Если мембрана проницаема для воды, но не для растворенного вещества, вода выровняет свою концентрацию, диффундируя в сторону более низкой концентрации воды (и, следовательно, в сторону более высокой концентрации растворенного вещества). В стакане слева раствор с правой стороны мембраны гипертонический.Движение молекул воды само по себе не регулируется клетками, поэтому важно, чтобы клетки подвергались воздействию среды, в которой концентрация растворенных веществ вне клеток (во внеклеточной жидкости) равна концентрации растворенных веществ внутри клетки (в цитоплазме). T onicity используется для описания изменений растворенного вещества в растворе с растворенным веществом внутри ячейки. Три члена — , , гипотонический, изотонический и гипертонический, , — используются для сравнения относительной концентрации растворенного вещества в клетке и во внеклеточной жидкости, окружающей клетки.
В гипотоническом растворе , таком как водопроводная вода, внеклеточная жидкость имеет более низкую концентрацию растворенных веществ, чем жидкость внутри клетки, и вода поступает в клетку. (Обратите внимание, что вода движется вниз по градиенту концентрации). Если это происходит в животной клетке, клетка может лопнуть или лизировать .
В гипертоническом растворе (префикс hyper — относится к внеклеточной жидкости, имеющей более высокую концентрацию растворенных веществ, чем цитоплазма клетки), жидкость содержит меньше воды, чем клетка.Поскольку в ячейке концентрация растворенных веществ ниже, вода будет покидать ячейку. Фактически растворенное вещество вытягивает воду из клетки. Это может привести к сморщиванию клетки животного или зубчатой .
В изотоническом растворе внеклеточная жидкость имеет ту же концентрацию растворенного вещества, что и клетка. Если концентрация растворенных веществ в клетке совпадает с концентрацией внеклеточной жидкости, чистого движения воды внутрь или из клетки не будет.
Клетки крови в гипертонических, изотонических и гипотонических растворах приобретают характерный вид, как показано на рис. 8.15. Важнейшим аспектом гомеостаза живых существ является создание внутренней среды, в которой все клетки тела находятся в изотоническом растворе. Различные системы органов, особенно почки, работают над поддержанием этого гомеостаза.
Рисунок 8.15. Состояния тоничности. Гипертонический раствор имеет более высокую концентрацию растворенного вещества, чем другой раствор.Изотонический раствор имеет концентрацию растворенного вещества, равную другому раствору. Гипотонический раствор имеет меньшую концентрацию растворенного вещества, чем другой раствор.У некоторых организмов, таких как растения, грибы, бактерии и некоторые простейшие, есть клеточные стенки, которые окружают плазматическую мембрану и предотвращают лизис клеток. Плазматическая мембрана может расширяться только до предела клеточной стенки, поэтому клетка не будет лизироваться. Фактически, цитоплазма растений всегда немного гипертоническая по сравнению с клеточной средой, и вода всегда будет попадать в клетку, если она доступна.Этот приток воды создает тургорное давление, которое укрепляет клеточные стенки растения (рис. 8.16). У недревесных растений давление тургора поддерживает растение. Если клетки растения становятся гипертоническими, как это происходит во время засухи, или если растение не поливают надлежащим образом, вода будет уходить из клетки. В этом состоянии растения теряют тургорное давление и вянут.
Рис. 8.16. Тургорное давление в растительной клетке зависит от тоничности окружающего раствора.
Другой механизм помимо диффузии для пассивной транспортировки материалов между отсеками — фильтрация.В отличие от диффузии вещества от более концентрированного до менее концентрированного, фильтрация использует градиент гидростатического давления, который выталкивает жидкость — и растворенные в ней вещества — из области с более высоким давлением в область с более низким давлением. Фильтрация — чрезвычайно важный процесс в организме. Например, кровеносная система использует фильтрацию для перемещения плазмы и веществ через эндотелиальную выстилку капилляров в окружающие ткани, снабжая клетки питательными веществами. Кроме того, давление фильтрации в почках обеспечивает механизм удаления отходов из кровотока.
(Вернуться к началу)
Активный транспорт
Для всех способов транспортировки, описанных выше, ячейка не расходует энергию. Мембранные белки, которые помогают в пассивном переносе веществ, делают это без использования АТФ. Во время активного транспорта требуется АТФ для перемещения вещества через мембрану, часто с помощью белков-переносчиков, и обычно против его градиента концентрации.
Один из наиболее распространенных типов активного транспорта включает белки, которые служат насосами. Слово «насос», вероятно, вызывает в воображении мысли об использовании энергии для накачки шины велосипеда или баскетбольного мяча. Точно так же энергия АТФ требуется этим мембранным белкам для переноса веществ — молекул или ионов — через мембрану, обычно против градиентов их концентрации (из области с низкой концентрацией в область с высокой концентрацией).
Натрий-калиевый насос , который также называется Na + / K + АТФаза, транспортирует натрий из клетки, одновременно перемещая калий в клетку.Насос Na + / K + — это важный ионный насос, обнаруженный в мембранах многих типов клеток. Эти насосы особенно распространены в нервных клетках, которые постоянно выкачивают ионы натрия и притягивают ионы калия для поддержания электрического градиента через клеточные мембраны. Электрический градиент — это разница в электрическом заряде в пространстве. В случае нервных клеток, например, существует электрический градиент между внутренней и внешней частью клетки, при этом внутренняя часть заряжена отрицательно (около -70 мВ) относительно внешней стороны.Отрицательный электрический градиент сохраняется, потому что каждый насос Na + / K + перемещает три иона Na + из клетки и два иона K + в клетку для каждой используемой молекулы АТФ (рис. 8.17). . Этот процесс настолько важен для нервных клеток, что на него приходится большая часть использования ими АТФ.
Рисунок 8.17. Натрий-калиевый насос. Натрий-калиевый насос находится во многих клеточных (плазматических) мембранах. Насос, работающий от АТФ, перемещает ионы натрия и калия в противоположных направлениях, каждый против своего градиента концентрации.За один цикл насоса три иона натрия вытесняются из ячейки, а два иона калия импортируются в ячейку.Активные транспортные насосы могут также работать вместе с другими активными или пассивными транспортными системами для перемещения веществ через мембрану. Например, натрий-калиевый насос поддерживает высокую концентрацию ионов натрия вне клетки. Следовательно, если клетке нужны ионы натрия, все, что ей нужно сделать, это открыть пассивный натриевый канал, поскольку градиент концентрации ионов натрия заставит их диффундировать в клетку.Таким образом, действие активного транспортного насоса (натрий-калиевый насос) обеспечивает пассивный транспорт ионов натрия, создавая градиент концентрации. Когда активный транспорт обеспечивает перенос другого вещества таким образом, это называется вторичным активным транспортом.
Симпортеры — это вторичные активные переносчики, которые перемещают два вещества в одном направлении. Например, симпортер натрий-глюкоза использует ионы натрия, чтобы «втягивать» молекулы глюкозы в клетку.Поскольку клетки хранят глюкозу для получения энергии, глюкоза обычно находится в более высокой концентрации внутри клетки, чем снаружи. Однако из-за действия натрий-калиевого насоса ионы натрия легко диффундируют в клетку при открытии симпортера. Поток ионов натрия через симпортер обеспечивает энергию, которая позволяет глюкозе перемещаться через симпортер в клетку против градиента ее концентрации.
И наоборот, антипортеры — это вторичные активные транспортные системы, которые транспортируют вещества в противоположных направлениях.Например, антипортер ионов натрия-водорода использует энергию поступающего внутрь потока ионов натрия для перемещения ионов водорода (H +) из клетки. Натрий-водородный антипортер используется для поддержания pH внутри клетки.
Другие формы активного транспорта не связаны с мембранными переносчиками. Эндоцитоз (внесение «в клетку») — это процесс поглощения клеткой материала путем обволакивания его частью своей клеточной мембраны с последующим отщипыванием этой части мембраны (Рисунок 8.18). После защемления часть мембраны и ее содержимое становятся независимыми внутриклеточными пузырьками. Везикула представляет собой мембранный мешок — сферическую полую органеллу, ограниченную двухслойной липидной мембраной. Эндоцитоз часто приносит в клетку материалы, которые необходимо расщепить или переварить. Фагоцитоз («поедание клеток») — это эндоцитоз крупных частиц. Многие иммунные клетки участвуют в фагоцитозе вторгающихся патогенов. Подобно маленьким пакменянам, их работа — патрулировать ткани тела на предмет нежелательных веществ, таких как вторжение в бактериальные клетки, фагоцитировать и переваривать их.В отличие от фагоцитоза, пиноцитоз («питье клетки») переносит жидкость, содержащую растворенные вещества, в клетку через мембранные везикулы.
Рисунок 8.18. Три формы эндоцитоза. Эндоцитоз — это форма активного транспорта, при котором клетка окружает внеклеточные материалы, используя свою клеточную мембрану. (а) При фагоцитозе, который является относительно неселективным, клетка поглощает крупную частицу. (б) При пиноцитозе клетка поглощает мелкие частицы жидкости.(c) Напротив, рецепторно-опосредованный эндоцитоз довольно селективен. Когда внешние рецепторы связывают определенный лиганд, клетка отвечает эндоцитозом лиганда.Фагоцитоз и пиноцитоз захватывают большие части внеклеточного материала, и они, как правило, не обладают высокой селективностью в отношении веществ, которые они вносят. Клетки регулируют эндоцитоз определенных веществ через рецептор-опосредованный эндоцитоз. Эндоцитоз, опосредованный рецепторами — это эндоцитоз части клеточной мембраны, которая содержит множество рецепторов, специфичных для определенного вещества.Как только поверхностные рецепторы свяжут достаточное количество специфического вещества (лиганда рецептора), клетка будет эндоцитозировать часть клеточной мембраны, содержащую комплексы рецептор-лиганд. Таким образом эритроциты эндоцитируют железо, необходимый компонент гемоглобина. Железо связано с белком, который называется трансферрином в крови. Специфические рецепторы трансферрина на поверхности эритроцитов связывают молекулы железо-трансферрин, и клетка эндоцитирует комплексы рецептор-лиганд.
В отличие от эндоцитоза, экзоцитоз (извлечение «из клетки») — это процесс экспорта материала клеткой с использованием везикулярного транспорта (рис. 8.19). Многие клетки производят вещества, которые необходимо секретировать, как фабрика, производящая продукт на экспорт. Эти вещества обычно упакованы в мембраносвязанные везикулы внутри клетки. Когда мембрана везикулы сливается с клеточной мембраной, везикула высвобождает свое содержимое в интерстициальную жидкость. Затем везикулярная мембрана становится частью клеточной мембраны.Клетки желудка и поджелудочной железы производят и секретируют пищеварительные ферменты посредством экзоцитоза (рис. 8.20). Эндокринные клетки производят и секретируют гормоны, которые разносятся по всему телу, а определенные иммунные клетки производят и секретируют большое количество гистамина, химического вещества, важного для иммунных реакций.
Рисунок 8.19. Экзоцитоз. Экзоцитоз во многом похож на эндоцитоз в обратном направлении. Материал, предназначенный для экспорта, упаковывается в пузырьки внутри клетки. Мембрана везикулы сливается с клеточной мембраной, и содержимое выходит во внеклеточное пространство.Рисунок 8.20. Ферментные продукты клеток поджелудочной железы. Ацинарные клетки поджелудочной железы производят и секретируют множество ферментов, которые переваривают пищу. Крошечные черные гранулы на этой электронной микрофотографии представляют собой секреторные везикулы, заполненные ферментами, которые будут выводиться из клеток посредством экзоцитоза. LM × 2900. (Микрофотография предоставлена Медицинской школой Риджентс Мичиганского университета © 2012 г.) Просмотрите WebScope Мичиганского университета, чтобы изучить образец ткани более подробно.
(Вернуться к началу)
8.9 Резюме
Чтобы убедиться, что вы понимаете материал этой главы, вам следует проанализировать значения терминов, выделенных жирным шрифтом в следующем резюме, и спросить себя, как они соотносятся с темами в главе.
Раствор — гомогенная смесь. Основным компонентом является растворитель , а второстепенным компонентом — растворенное вещество . Решения могут иметь любую фазу; например, сплав представляет собой твердый раствор. Растворенные вещества: растворимый или нерастворимый , что означает, что они растворяются или не растворяются в конкретном растворителе.Термины смешивающийся и несмешивающийся вместо «растворимый» и «нерастворимый» используются для жидких растворенных веществ и растворителей. Утверждение « как растворяется как » является полезным руководством для прогнозирования того, будет ли растворенное вещество растворяться в данном растворителе.
Растворение происходит путем сольватации , процесса, в котором частицы растворителя окружают отдельные частицы растворенного вещества, разделяя их с образованием раствора. Для водных растворов используется слово гидратация .Если растворенное вещество является молекулярным, оно растворяется на отдельные молекулы. Если растворенное вещество является ионным, отдельные ионы отделяются друг от друга, образуя раствор, который проводит электричество. Такие растворы называются электролитами . Если диссоциация ионов завершена, раствор представляет собой сильный электролит . Если диссоциация только частичная, раствор представляет собой слабый электролит . Растворы молекул не проводят электричество и называются неэлектролитами .
Количество растворенного вещества в растворе представлено концентрацией раствора. Максимальное количество растворенного вещества, которое будет растворяться в данном количестве растворителя, называется растворимостью растворенного вещества. Таких решений насыщенных . Растворы с количеством меньше максимального — ненасыщенный . Большинство растворов являются ненасыщенными, и их концентрацию можно указать разными способами. Массовый / массовый процент , объем / объемный процент и массовый / объемный процент указывают процент растворенного вещества в общем растворе. частей на миллион (ppm) и частей на миллиард (ppb) используются для описания очень малых концентраций растворенного вещества. Молярность , определяемая как количество молей растворенного вещества на литр раствора, является стандартной единицей концентрации в химической лаборатории. Эквиваленты выражают концентрации в молях заряда на ионах. Когда раствор разбавляется, мы используем тот факт, что количество растворенного вещества остается постоянным, чтобы можно было определить объем или концентрацию конечного разбавленного раствора.Растворы известной концентрации можно приготовить либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора (исходный раствор ) до желаемого конечного объема.
Клеточная мембрана обеспечивает барьер вокруг клетки, отделяя ее внутренние компоненты от внеклеточной среды. Он состоит из фосфолипидного бислоя с гидрофобными внутренними липидными «хвостами» и гидрофильными внешними фосфатными «головками».По всему бислою разбросаны различные мембранные белки, вставленные в него и прикрепленные к нему на периферии. Клеточная мембрана избирательно проницаема, позволяя лишь ограниченному количеству материалов диффундировать через ее липидный бислой. Все материалы, которые проходят через мембрану, делают это с использованием пассивных (не требующих энергии) или активных (энергозатратных) процессов переноса. Во время пассивного транспорта материалы перемещаются путем простой диффузии или облегченной диффузии через мембрану вниз по градиенту их концентрации.Вода проходит через мембрану в процессе диффузии, называемом осмосом. Во время активного переноса энергия расходуется на содействие движению материала через мембрану в направлении против градиента их концентрации. Активный транспорт может происходить с помощью протеиновых насосов или везикул.
Контрольные вопросы
1. Поскольку ионные каналы встроены в мембрану, они являются примерами ________.
- рецепторные белки
- интегральные белки
- периферические белки
- гликопротеинов
2.Диффузия веществ в растворе имеет тенденцию перемещать эти вещества ________ их ________ градиента.
- вверх; электрический
- вверх; электрохимический
- вниз; давление
- вниз; концентрация
3. Ионные насосы и фагоцитоз являются примерами ________.
- эндоцитоз
- пассивный транспорт
- активный транспорт
- облегченная диффузия
4. Выберите ответ, который лучше всего завершает следующую аналогию: Диффузия — к ________, как эндоцитоз — к ________.
- фильтрация; фагоцитоз Осмос
- ; пиноцитоз
- растворенных веществ; жидкость
- градиент; химическая энергия
Вопросы о критическом мышлении
1. Какие материалы могут легко диффундировать через липидный бислой и почему?
2. Почему рецептор-опосредованный эндоцитоз считается более избирательным, чем фагоцитоз или пиноцитоз?
3. Что общего между осмосом, диффузией, фильтрацией и движением ионов от одного заряда? Чем они отличаются?
Key Takeaway
- Концентрации раствора обычно выражаются в виде молярности и могут быть получены путем растворения известной массы растворенного вещества в растворителе или разбавления исходного раствора.
Концептуальные проблемы
Какое из представлений лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- NH 3
- HF
- CH 3 CH 2 CH 2 OH
Na 2 SO 4
Какое из представлений, показанных в задаче 1, лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- CH 3 CO 2 H
- NaCl
- Na 2 S
- Na 3 PO 4
- ацетальдегид
Можно ли ожидать, что 1,0 М раствор CaCl 2 будет лучше проводить электричество, чем 1,0 М раствор NaCl? Почему или почему нет?
Альтернативный способ определения концентрации раствора — молярность , сокращенно м .Моляльность определяется как количество молей растворенного вещества в 1 кг растворителя . Чем это отличается от молярности? Ожидаете ли вы, что 1 M раствор сахарозы будет более или менее концентрированным, чем 1 m раствор сахарозы ? Поясните свой ответ.
Каковы преимущества использования решений для количественных расчетов?
Ответ
a) Nh4 — слабое основание, что означает, что некоторые молекулы будут принимать протон от молекул воды, заставляя их диссоциировать на ионы H + и -OH.Ион H + будет ассоциироваться с Nh4 с образованием Nh5 +. Таким образом, это будет больше всего похоже на стакан №2. б) HF — слабая кислота, хотя F сильно электроотрицателен. Это связано с тем, что молекула H-F может образовывать прочные водородные связи с молекулами воды и оставаться в ковалентной связи, которую труднее диссоциировать. Таким образом, стакан № 2 также является хорошим выбором для этой молекулы, так как только часть H-F будет диссоциировать на ионы h4O + и F-. c) CH 3 CH 2 CH 2 OH является ковалентным соединением и не будет диссоциировать в какой-либо заметной степени, поэтому стакан № 3 является правильным выбором.г) Na 2 SO 4 — растворимое ионное соединение, которое полностью диссоциирует на ионы, больше всего напоминающие химический стакан № 1.
Да, потому что когда CaCl 2 диссоциирует, он образует 3 иона (1 Ca 2+ и 2 иона Cl —), тогда как NaCl будет диссоциировать только на 2 иона (Na + и Cl —) для каждой молекулы. Таким образом, CaCl 2 будет генерировать больше ионов на моль, чем 1 моль NaCl, и будет лучше проводить электричество.
Если количество вещества, необходимое для реакции, слишком мало для точного взвешивания, использование раствора вещества, в котором растворенное вещество диспергировано в гораздо большей массе растворителя, позволяет химикам измерить количество вещества. вещество, точнее.
Числовые задачи
Рассчитайте количество граммов растворенного вещества в 1.000 л каждого раствора.
- 0,2593 M NaBrO 3
- 1.592 М КНО 3
- 1,559 М уксусная кислота
- 0,943 M йодат калия
Рассчитайте количество граммов растворенного вещества в 1.000 л каждого раствора.
- 0,1065 млн бай 2
- 1.135 M Na 2 SO 4
- 1,428 M NH 4 Br
- 0,889 М ацетат натрия
Если все растворы содержат одно и то же растворенное вещество, какой раствор содержит большую массу растворенного вещества?
- 1.40 л 0,334 М раствора или 1,10 л 0,420 М раствора
- 25,0 мл 0,134 М раствора или 10,0 мл 0,295 М раствора
- 250 мл 0,489 М раствора или 150 мл 0,769 М раствора
Заполните следующую таблицу для 500 мл раствора.
Соединение Масса (г) Родинки Концентрация (М) сульфат кальция 4,86 уксусная кислота 3.62 дигидрат иодистого водорода 1,273 бромид бария 3,92 глюкоза 0,983 ацетат натрия 2,42 Какая концентрация каждого вида присутствует в следующих водных растворах?
- 0,489 моль NiSO 4 в 600 мл раствора
- 1.045 моль бромида магния в 500 мл раствора
- 0,146 моль глюкозы в 800 мл раствора
- 0,479 моль CeCl 3 в 700 мл раствора
Какая концентрация каждого вида присутствует в следующих водных растворах?
- 0,324 моль K 2 MoO 4 в 250 мл раствора
- 0,528 моль формиата калия в 300 мл раствора
- 0,477 моль KClO 3 в 900 мл раствора
- 0.378 моль йодида калия в 750 мл раствора
Какова молярная концентрация каждого раствора?
- 8,7 г бромида кальция в 250 мл раствора
- 9,8 г сульфата лития в 300 мл раствора
- 12,4 г сахарозы (C 12 H 22 O 11 ) в 750 мл раствора
- 14,2 г гексагидрата нитрата железа (III) в 300 мл раствора
Какова молярная концентрация каждого раствора?
- 12.8 г гидросульфата натрия в 400 мл раствора
- 7,5 г гидрофосфата калия в 250 мл раствора
- 11,4 г хлорида бария в 350 мл раствора
- 4,3 г винной кислоты (C 4 H 6 O 6 ) в 250 мл раствора
Укажите концентрацию каждого реагента в следующих уравнениях, принимая 20,0 г каждого и объем раствора 250 мл для каждого реагента.
- BaCl 2 (водн.) + Na 2 SO 4 (водн.) →
- Ca (OH) 2 (водн.) + H 3 PO 4 (водн.) →
- Al (NO 3 ) 3 (водн.) + H 2 SO 4 (водн.) →
- Pb (NO 3 ) 2 (водн.) + CuSO 4 (водн.) →
- Al (CH 3 CO 2 ) 3 (водн.) + NaOH (водн.) →
На эксперимент потребовалось 200.0 мл 0,330 М раствора Na 2 CrO 4 . Для приготовления этого раствора использовали исходный раствор Na 2 CrO 4 , содержащий 20,0% растворенного вещества по массе с плотностью 1,19 г / см 3 . Опишите, как приготовить 200,0 мл 0,330 М раствора Na 2 CrO 4 с использованием исходного раствора.
Гипохлорит кальция [Ca (OCl) 2 ] — эффективное дезинфицирующее средство для одежды и постельного белья. Если в растворе концентрация Ca (OCl) 2 равна 3.4 г на 100 мл раствора, какова молярность гипохлорита?
Фенол (C 6 H 5 OH) часто используется в качестве антисептика в жидкостях для полоскания рта и пастилках для горла. Если в жидкости для полоскания рта концентрация фенола составляет 1,5 г на 100 мл раствора, какова молярность фенола?
Если таблетка, содержащая 100 мг кофеина (C 8 H 10 N 4 O 2 ), растворяется в воде с получением 10,0 унций раствора, какова молярная концентрация кофеина в растворе?
На этикетке определенного лекарства есть инструкция по добавлению 10.0 мл стерильной воды, заявив, что каждый миллилитр полученного раствора будет содержать 0,500 г лекарства. Если пациенту назначена доза 900,0 мг, сколько миллилитров раствора следует ввести?
ответов
а. 39,13 г б. 161,0 г c. 93,57 г г. 201,8 г
а. 1,40 л 0,334 М раствора, б. 25,0 мл 0,134 М раствора, c. 150 мл 0,769 М раствора
а.0.815 М, г. 2.09 М, c. 0.182 М, д. 0,684 M
а. 0.174 М, г. 0.297 М, c. 0,048 М, д. 0,135 М
а. BaCl 2 = 0,384 M, Na 2 SO 4 = 0,563 M, б. Ca (OH) 2 = 1.08 M, h4PO4 = 0.816 M, c. Al (NO 3 ) 3 = 0,376 M, H 2 SO 4 = 0,816 M, д. Pb (NO 3 ) 2 = 0,242 M, CuSO 4 = 0,501 M, т.е. Al (CH 3 CO 2 ) = 0.392 M, NaOH = 2,00 M
1,74 × 10 −3 M кофеин
8.10 Ссылки
- Чанг (Питер) Чие (2016) Неорганическая химия. Либретексты . Доступно по адресу: https://chem.libretexts.org/Core/Inorganic_Chemistry/Chemical_Reactions/Chemical_Reactions_1/Solutions
- Болл, Д.У., Хилл, Дж. У. и Скотт, Р. Дж. (2016) MAP: Основы общей, органической и биологической химии . Свободные тексты. Доступно по адресу: https://chem.libretexts.org/Textbook_Maps/Introductory_Chemistry_Textbook_Maps/Map%3A_The_Basics_of_GOB_Chemistry_(Ball_et_al.)
- Аверилл, Б.А., Элдридж, П. (2012) Принципы химии . Свободные тексты. Доступно по адресу: https://2012books.lardbucket.org/books/principles-of-general-chemistry-v1.0/index.html
- Гидрат. (2017, 30 августа).В Википедия, Бесплатная энциклопедия . Получено 16:20, 26 сентября 2017 г., с https://en.wikipedia.org/w/index.php?title=Hydrate&oldid=798015169 .
- Нижний, С. (2010). Растворы 1: Растворы и их концентрации. В онлайн-учебнике «Виртуальный учебник Chem1». Доступно по адресу: http://www.chem1.com/acad/webtext/solut/solut-1.html
- Открытые учебники для Гонконга. (2015) Глава о тонизме из книги «Понятия в биологии». получено 31 декабря 2018 г. с сайта http: // www.opentextbooks.org.hk/ditatopic/34633
- Университет Райса () Раздел 3.1 Клеточная мембрана из анатомии и физиологии. До н.э. Открытый сборник учебников. Получено 31 декабря 2018 г. с https://opentextbc.ca/anatomyandphysiology/chapter/the-cell-membrane/
- Kahn Academy (2019) Гомеостаз. В системах человеческого тела. Получено 2 января 2019 г. по адресу https://www.khanacademy.org/science/high-school-biology/hs-human-body-systems/hs-body-structure-and-homeostasis/a/homeostasis .
- Lumen Learning (2019) Гомеостаз безграничной анатомии и физиологии.Получено 2 января 2019 г. с https://courses.lumenlearning.com/boundless-ap/chapter/homeostasis/ .
- авторов Википедии. (2019, 9 февраля). Переохлаждение. В Википедия, Бесплатная энциклопедия . Получено 18:47, 25 февраля 2019 г., с https://en.wikipedia.org/w/index.php?title=Hypothermia&oldid=882437028 .
высокопроизводительный малогабаритный для цинковой руды
Высокопроизводительный водный цинк-ионный аккумулятор на основе
Высокопроизводительный водный цинк-ионный аккумуляторна основе многослойного нанопроволочного катодного нанопровода Н 2 V 3 O 8 Pan He.Государственная ключевая лаборатория передовых технологий синтеза и обработки материалов, Уханьский технологический университет, Ухань, 430070 P.R. Китай. Поиск цитируется по: 225 Высокоэффективный цинк для питания и иммунитета & 0183; & 32; Высокоэффективный цинк для питания и иммунитета Биодоступные хелаты 100% чистые и полностью прореагировавшие Ультра низкие уровни Pb / Cd / As / Hg Высокое содержание цинка Цинк Zn 30 65,409 Цинк для капсул, желатиновых капсул, жевательных конфет, жидкостей, пастилок, таблеток и порошков. Ацетат цинкаВысокопроизводительные водные цинк-ионные батареи на основе перезаряжаемых водно-цинково-ионных аккумуляторов стали альтернативой крупномасштабному хранению энергии из-за их низкой стоимости и большого количества материалов.Однако разработка подходящих материалов с отличными характеристиками остается серьезной проблемой, связанной с высокой поляризацией ионов цинка. Стержневые мельницы с высокой производительностью для медно-цинковой руды с высокой производительностью стержневые мельницы для медно-цинковой руды. Мельница с мокрым дном, также известная как мельница для измельчения амальгамированием, мельница для измельчения золота, является универсальным оборудованием для измельчения руды, лучшей заменой шаровой мельницы средней и малой производительности, благодаря отличным характеристикам для мокрого дробления, малым затратам и высокой производительности, широко используется для отделения золота и железа. , молибден, свинец, цинк, сурьма и т. д. пористые нанопластинки V2O5, полученные из V-MOF, для высокого уровня 2019.11. 1. & 0183; & 32; Новая стратегия синтеза нанопластин V 2 O 5. Было изучено влияние удельной площади поверхности и распределения пор по размерам электродов на характеристики батарей. V 4 в V 2 O 5 способствует созданию высокоэффективной ионно-цинковой батареи. Новый аккумулятор обеспечивает высокую емкость 300 мА · ч г-1 и отличные характеристики при циклических нагрузках. Анализ свинцовой / цинковой руды Rigaku Global Website2021. 1. 8. & 0183; & 32; Элементный анализ важен при анализе руд, от отбора на руднике и на всех участках обработки до окончательного анализа.Крупные и несовершеннолетние важны во время обработки для обеспечения надлежащего извлечения и контроля процесса. Элементный анализ микроэлементов, особенно драгоценных металлов, также чрезвычайно важен для обеспечения оптимизации стоимости обработки.Анализ свинцовой / цинковой руды Rigaku Global Website2 天 前 & 0183; & 32; Элементный анализ важен при анализе руд, от скрининга на руднике и на всех участках обработки до окончательного анализа. Крупные и несовершеннолетние важны во время обработки для обеспечения надлежащего извлечения и контроля процесса.Завод по добыче руды Tracezinc в Перу — china.com2018. 8. 30. & 0183; & 32; Поскольку цинковая руда может применяться во многих областях, очищенный цинк необходим для многих относительных областей. Из-за богатых минеральных ресурсов цинка завод по добыче цинковой руды в Перу также очень популярен. На предприятии по добыче цинковой руды необходимо некоторое горнодобывающее оборудование, такое как щековая дробилка, конусная дробилка, ударная дробилка, шлифовальные станки, обогатительные машины и т. Д. Цинк на 1960-2021 гг. Данные на 2022-2023 гг.25 долларов США за тонну или 1,75% с начала 2021 года, в соответствии с торговлей контрактом на разницу цен на разницу цен, который отслеживает эталонный рынок для этого товара. Исторически сложилось так, что в ноябре 2006 года производство цинка достигло рекордного уровня в 4603. Дробление свинцово-цинковой руды Переработка свинцово-цинковой руды — Dewo Machinery. Введение свинцово-цинковой руды :. Технология переработки свинцово-цинковой руды в основном включает три процесса: дробление, измельчение и обогащение. В процессе дробления современное трехступенчатое дробление замкнутого цикла подходит для дробления высокотвердой свинцово-цинковой руды, которая может завершить работы по дроблению и частичной диссоциации руды
Цинк Данные за 1960-2021 гг. 2022-2023 гг.25 долларов США за тонну или 1,75% с начала 2021 года, в соответствии с торговлей контрактом на разницу цен на разницу цен, который отслеживает эталонный рынок для этого товара. Исторически сложилось так, что в ноябре 2006 года цинк достиг рекордного уровня 4603. Анализ свинца / цинковой руды Глобальный веб-сайт Rigaku2 天 前 & 0183; & 32; Элементный анализ важен при анализе руд, начиная с сортировки на руднике и повсюду. области обработки до окончательного анализа. Крупные и несовершеннолетние важны во время обработки для обеспечения надлежащего извлечения и контроля процесса.TraceZinc Outlook 2021: рынок концентрируется, чтобы оставаться узкими в 2020 году. 12. 29. & 0183; & 32; Прогноз по цинку на 2021 год: обзорный год. После нестабильного 2019 года цены на цинк в начале года торговались на уровне 2297 долларов США за тонну. Поскольку коронавирус сильно ударил по рынку, к марту цены упали до уровня КОНТРОЛЬНОГО СМЕШЕНИЯ И ВЫБОРА ДЛЯ ОПТИМАЛЬНОГО ПРОИЗВОДСТВА ПРОЦЕССОВ & 0183; & 32; 2009. 8. 26. & 0183; & 32; ОТСЛЕЖИВАНИЕ РУД: Горное оборудование, используемое для добычи руды, оптимально для выборочной добычи.Материал из карьера доставляется в различные места складирования. К ним относятся запасы руды с высоким содержанием цинка> 13%, цинка со средним содержанием 9–13%, цинка с низким содержанием 4–9% и запасы маргинальной руды с содержанием цинка 1–4%. Известняк Ca> 28% из карьера добывается для производства кислотно-цинк-углеродных батарей — использование, работа и изготовление — аккумулятор 2020. 12. 25. & 0183; & 32; Как правило, в хлоридно-цинковых батареях; В качестве анода используется чистый цинк, а в качестве электролита — хлорид цинка. Иногда в электролит часто добавляют небольшое количество хлорида аммония.Природная руда диоксида марганца также используется здесь в качестве сырья. SEDEX: Крупнейшие месторождения свинца и цинка в мире, 2019 г. 10. 17. & 0183; & 32; Рудные минералы Поскольку металлосодержащие гидротермальные жидкости вступили в контакт с сероводород, продуцируемый бактериями в морской воде, осаждает сульфидные минералы: основными из этих минералов являются сульфиды железа, например пирит и пирротин, но цинкование свинцово-цинковой руды; переработка свинцово-цинковой руды — Dewo Machinery. Введение свинцово-цинковой руды :.Технология переработки свинцово-цинковой руды в основном включает три процесса: дробление, измельчение и обогащение. В процессе дробления современное трехступенчатое дробление замкнутого цикла подходит для дробления высокотвердой свинцово-цинковой руды, которая может завершить работу по дроблению руды и частичной диссоциации. Выявление активных участков на углеродных кубиках, кодированных S, N. Выявление активных участков на углеродных кубах, содержащих примесь S, N. Встраивание карбидов Co – Fe для обратимого преобразования кислорода в высокоэффективных цинково-воздушных батареях. Институт инноваций в области энергетики и материалов Сучжоу, Энергетический колледж Университета Сучжоу, Сучжоу, 215006 P.Руководство по методике химического и инструментального анализа — & 0183; & 32; 2016. 8. 25. & 0183; & 32; в цинковой и свинцовой руде и продуктах обогащения методом атомной эмиссии на атомно-абсорбционном спектрофотометре 181 4. Принцип и процедура анализатора углерода и серы 184 5. Методы анализа с использованием прибора icp с индуктивно связанной плазмой 186 5.1 icp aes — методы и приложения 186 5.2 анализ размера руды, достигаемого дробилкой в цинковом батоне SSA A4 feb12 Layout 1 — SAIMM.Измельчение рудных частиц обычно достигается с помощью пресса периодического действия, валковых дробилок, измельчения, дробления, моделирования. распределение частиц по размерам, которое может быть достигнуто по сравнению с этим исследованием, покажет, что флотация сульфидов цинка.
Анализ свинцовой / цинковой руды Глобальный веб-сайт Rigaku
2021. 1. 8. & 0183; & 32; Элементный анализ важен при анализе руд, от отбора на руднике и на всех участках переработки до окончательного анализа. Крупные и несовершеннолетние важны во время обработки для обеспечения надлежащего извлечения и контроля процесса.Элементный анализ микроэлементов, особенно драгоценных металлов, также чрезвычайно важен для обеспечения оптимальной стоимости обработки. Высокоэффективные покрытия для крепежных деталей Крепежные детали Цинк, содержащийся в покрытиях, окисляется раньше, чем сталь, поэтому она защищена и не подвержена коррозии. Второй механизм — самостоятельный ремонт. При повреждении покрытия может обнажиться небольшой участок стали. В этом случае продукты, полученные в результате СМЕШИВАНИЯ КОНТРОЛЯ И ОТБОРА ЦИНКГРАДА ДЛЯ ОПТИМАЛЬНОГО ПРОИЗВОДСТВА ПРОЦЕССА & 0183; & 32; 2009.8. 26. & 0183; & 32; ОТСЛЕЖИВАНИЕ РУД: Горное оборудование, используемое для добычи руды, оптимально для выборочной добычи. Материал из карьера доставляется в различные места складирования. К ним относятся запасы руды с высоким содержанием цинка> 13%, цинка со средним содержанием 9–13%, цинка с низким содержанием 4–9% и запасы маргинальной руды с содержанием цинка 1–4%. Известняк Ca> 28% из карьера добывается для растительной кислоты. Прогноз по цинку на 2021 год: рынок концентратов останется ограниченным в 2020 году. 12. 29. & 0183; & 32; Прогноз по цинку на 2021 год: обзорный год.После нестабильного 2019 года цены на цинк в начале года торговались на уровне 2297 долларов США за тонну. Поскольку коронавирус сильно ударил по рынку, к марту цены упали до уровня Crate Engines: Classic, Race и Project Cars Performance Полвека назад Chevrolet Performance впервые представил наш высокопроизводительный двигатель для ящиков, и мы никогда не прекращали работать, чтобы предложить энтузиастам новые и более мощные решения для своих проектов. У тебя в гараже есть мечта. У нас есть двигатель ящика для SEDEX: крупнейшие месторождения свинца и цинка в мире в 2019 году.10. 17. & 0183; & 32; Рудные минералы Поскольку металлоносные гидротермальные флюиды вступили в контакт с сероводородом, продуцируемым бактериями в морской воде, они выпали в осадок сульфидные минералы: основными среди этих минералов являются сульфиды железа, такие как пирит и пирротин. , но цинкование дробления свинцово-цинковой руды Переработка свинцово-цинковой руды — Dewo Machinery. Введение свинцово-цинковой руды :. Технология переработки свинцово-цинковой руды в основном включает три процесса: дробление, измельчение и обогащение. В процессе дробления современное трехступенчатое дробление замкнутого цикла подходит для дробления высокотвердой свинцово-цинковой руды, которая может завершить работу Руководства по процедурам химического и инструментального анализа руды — & 0183; & 32; 2016.8. 25. & 0183; & 32; в цинковой и свинцовой руде и продуктах обогащения методом атомной эмиссии на атомно-абсорбционном спектрофотометре 181 4. Принцип и процедура анализатора углерода и серы 184 5. Методы анализа с использованием прибора icp с индуктивно связанной плазмой 186 5.1 icp aes — методы и приложения 186 5.2 Анализ использования, работы и изготовления цинк-углеродных батарей — батареи 2020. 12. 25. & 0183; & 32; Как правило, в хлоридно-цинковых батареях; В качестве анода используется чистый цинк, а в качестве электролита — хлорид цинка.Иногда в электролит часто добавляют небольшое количество хлорида аммония. Натуральный диоксид марганца такой крупности руды, которого дробилка может достичь в цинк-батате SSA A4 feb12 Layout 1 — SAIMM. Измельчение рудных частиц обычно достигается с помощью пресса периодического действия, валковых дробилок, измельчения, дробления, моделирования. распределение частиц по размерам, которое может быть достигнуто по сравнению с этим исследованием, покажет, что флотация сульфидов цинка.
Оборудование для обогатительной фабрики по дроблению цинковой руды в
prm как профессиональный производитель горнодобывающей промышленности в мире предоставит вам высокопроизводительное оборудование для добычи цинковой руды, а также предложит вам лучший сервис.Завод по дроблению цинковой руды в Южной Африке. В соответствии с собственностью цинковой руды в Южной Африке, дробильная установка для цинковой руды включает первичное и вторичное дробление.Анализ свинцовой / цинковой руды Rigaku Global Website2021. 1. 8. & 0183; & 32; Элементный анализ важен при анализе руд, от отбора на руднике и на всех участках обработки до окончательного анализа. Крупные и несовершеннолетние важны во время обработки для обеспечения надлежащего извлечения и контроля процесса. Элементный анализ следов, особенно драгоценных металлов, также чрезвычайно важен для обеспечения оптимизации стоимости обработки.Покрытия с высокими эксплуатационными характеристиками для крепежа Крепеж Цинк, содержащийся в покрытиях, окисляется раньше, чем сталь, поэтому он защищен и не подвержен коррозии. Второй механизм — самостоятельный ремонт. При повреждении покрытия может обнажиться небольшой участок стали. В этом случае продукты, полученные в результате коррозии цинка. Слоистый Ca0,28 MnO2 & 183; 0,5h3O в качестве высокоэффективного катода для водного цинка. Водные цинково-ионные батареи являются многообещающими кандидатами для хранения энергии в масштабе сети из-за их искробезопасности, низкой стоимость и высокая энергоемкость.Однако отсутствие подходящих материалов, обладающих как превосходными характеристиками скорости, так и стабильностью при циклических нагрузках, препятствует дальнейшему практическому применению водных цинково-ионных аккумуляторов. Здесь представлена самособранная наностержневая структура из Ca0,28 MnO2 & 183; 0 Двигатели с ящиками: классические, гоночные и проектные. Производительность автомобилей Chevrolet Performance полвека назад впервые представила наш высокопроизводительный двигатель с ящиками, и мы никогда не прекращали работать над этим. предлагать энтузиастам новые и более мощные решения для их проектов. У тебя в гараже есть мечта.У нас есть двигатель-ящик, чтобы доставить его на улицу или гоночную трассу. Оценка: понимание результатов разведки — опять же, учитывая, что 1% тонны равен 22 фунтам, нам понадобится 4,5% цинка, чтобы быть интересным, и 10% цинка. быть полноценным. Поскольку месторождения цинка обычно плоские, а пластовые слои имеют SEDEX: крупнейшие месторождения свинца и цинка в мире, 2019 г. 10. 17. & 0183; & 32; Рудные минералы Поскольку металлоносные гидротермальные флюиды вступили в контакт с производимым сероводородом, с помощью бактерий в морской воде они осаждали сульфидные минералы: основными среди этих минералов являются сульфиды железа, такие как пирит и пирротин, но цинк-цинк-углеродная батарея-использование, работа и изготовление-батарея 2020.12. 25. & 0183; & 32; Обычно в хлоридно-цинковых батареях; В качестве анода используется чистый цинк, а в качестве электролита — хлорид цинка. Иногда в электролит часто добавляют небольшое количество хлорида аммония. В качестве сырья здесь также используется природная руда диоксида марганца. Что такое высокая производительность? HuffPost Life2015. 4. 28. & 0183; & 32; Высокопроизводительные исполнители обладают необычайной ясностью в трех вещах: а. кто они, б. чего они желают, и c. как они собираются действовать и взаимодействовать с другими людьми.Зная эти вещи, они могут оставаться верными себе, в своей зоне и в высшей степени преднамеренными. Без ясности невозможно достичь высокой производительности. 5 x дробилка для свинца и цинка, а также производитель конусных дробилок для цинковой руды; люции оборудование для переработки свинцово-цинковой руды; щековая дробилка для монацитовой руды и строительной промышленности; Дробилка 10мм и 20мм для известняка 600т / ч; щековая дробилка cawse and malcom 12 x 7; размер подшипника щековой дробилки пэ 250 х 1000; мощность двигателя и число оборотов дробилки; руководство для symmons 5 1
Высококачественные покрытия для крепежа Крепеж
Цинк, содержащийся в покрытиях, окисляется раньше, чем сталь, поэтому она защищена и не подвержена коррозии.Второй механизм — самостоятельный ремонт. При повреждении покрытия может обнажиться небольшой участок стали. В этом случае продукты, полученные в результате коррозии цинка, дробилки цинковой руды, дробилки цинковой руды, и 1849 продуктов дробилки цинковой руды предлагаются для продажи поставщиками на Alibaba.com, из которых дробилка составляет 8%. Вам доступен широкий выбор дробилок цинковой руды, таких как автоматическая, конкурентоспособная цена и высокая производительность. Самые большие в мире ло-ионы для добычи цинка INNTeck ожидает, что она обеспечит достаточное количество руды для операций по добыче цинка до 2031 года.Teck сообщил, что годовой объем производства цинка в концентрате для Red Dog в 2017 году составил 542000 тонн. Определение содержания: понимание результатов разведки — опять же, учитывая, что 1% тонны равняется 22 фунтам, нам потребуется 4,5% цинка, чтобы быть интересным, и 10% цинка, чтобы быть полноценным. Поскольку цинковые отложения обычно плоские, а слои с слоями имеют Цинк-углеродные батареи-Использование, работа и изготовление-батарея 2020. 12. 25. & 0183; & 32; Как правило, в хлоридно-цинковых батареях; В качестве анода используется чистый цинк, а в качестве электролита — хлорид цинка.Иногда в электролит часто добавляют небольшое количество хлорида аммония. В качестве сырья здесь также используется природная руда диоксида марганца. Коробка передач Bonfiglioli для компактного низкопрофильного Transmin 2021. 1. 16. & 0183; & 32; Логичный выбор коробки передач для LPF, которая на заводе обрабатывает до 400 т высококачественной цинковой руды в час — это высокопроизводительный косозубый редуктор Heavy Duty HDO 170, произведенный специалистом по приводам Bonfiglioli с максимальным крутящим моментом 190 190 Нм. Полный ассортимент проверенных коробок передач состоит из десяти типоразмеров, от 8 990 до 209 900 Нм.Компания Superior Small Cap получает прибыль от горячего цинка в 2018 году. 6. 3. & 0183; & 32; В период с 1899 по 1901 год ручная добыча на месторождении позволила получить высококачественную цинковую руду со средним содержанием цинка 45% на поверхности. В 1951 году возникли поспешные попытки заявить о своих правах на месторождение. Это было за год до Корейской войны в сочетании с накоплением запасов цинка в США. Цинк: использование, применение — МеталлопедияЦинк: использование; Использование цинка; Обладая хорошей каландруемостью, абразивной стойкостью, коррозионной стойкостью, литейными качествами и механическими свойствами при комнатной температуре, цинк может быть превращен в различные сплавы со многими другими металлами.В основном в форме гальванизации, сплавов на основе цинка и оксида цинка, он находит применение в автомобилестроении, строительстве и судостроении, легкой промышленности, машиностроении. ‘- это серия Stockhead, в которой каждую неделю рассматриваются важные события на рынке ресурсов. Бывший геолог и опытный биржевой маклер Ги Ле Пейдж, директор и ответственный исполнительный директор находящейся в Перте поставщика финансовых услуг RM Corporate Finance, делится своим высокопроизводительным двигателем для ящиков: классические, гоночные и проектные автомобили Полвека назад Chevrolet Performance впервые разработал наш высокопроизводительный двигатель для ящиков. и мы никогда не прекращали работать, чтобы предлагать энтузиастам новые и более мощные решения для их проектов.У тебя в гараже есть мечта. У нас есть двигатель для ящиков, чтобы использовать его на улице или гоночной трассе.
Предыдущий: поставщик оборудования для ударной добычи доломита в АнголеСледующий: Поставщики дробления карьеров серебряной руды с гравитационной концентрацией
- На главную
- цена оборудования для добычи золота


 Дифференцированные контрольные работы представлены в нескольких вариантах. Задания работы сгруппированы в три уровня: «А», «В», «С». В уровень «А» включены задания, проверяющие усвоение необходимого минимума конкретных знаний по химии. Выполнение ее требует от учащихся репродуктивной деятельности, оцениваю ее выполнение на «3». При выполнении уровня «В» учащиеся должны уметь раскрыть причинно-следственные связи, применять теоретические знания для объяснения конкретных явлений. Выполнение уровней «А» и «В» оцениваю на «4». Уровень «С» содержит задания, требующие целостного восприятия материала, самостоятельно проводить обобщение и сравнение. Выполнение этого уровня оцениваю на «5».
Дифференцированные контрольные работы представлены в нескольких вариантах. Задания работы сгруппированы в три уровня: «А», «В», «С». В уровень «А» включены задания, проверяющие усвоение необходимого минимума конкретных знаний по химии. Выполнение ее требует от учащихся репродуктивной деятельности, оцениваю ее выполнение на «3». При выполнении уровня «В» учащиеся должны уметь раскрыть причинно-следственные связи, применять теоретические знания для объяснения конкретных явлений. Выполнение уровней «А» и «В» оцениваю на «4». Уровень «С» содержит задания, требующие целостного восприятия материала, самостоятельно проводить обобщение и сравнение. Выполнение этого уровня оцениваю на «5». В., Гара Н. Н. Контрольные и проверочные работы по химии. 8-9 кл.: методическое пособие. М.: Дрофа, 2002.
В., Гара Н. Н. Контрольные и проверочные работы по химии. 8-9 кл.: методическое пособие. М.: Дрофа, 2002. Приведите формулы 2-3 веществ, при растворении которых в водном растворе образуются ионы железа Fe3+.
Приведите формулы 2-3 веществ, при растворении которых в водном растворе образуются ионы железа Fe3+. Какие из перечисленных веществ являются неэлектролитами: сахар, H2, NaCl, H2SO4, MgO, KOH , Ba(NO3)2, спирт?
Какие из перечисленных веществ являются неэлектролитами: сахар, H2, NaCl, H2SO4, MgO, KOH , Ba(NO3)2, спирт? * Допишите уравнение реакции. Составьте ионные уравнения в полной и сокращенной форме:
* Допишите уравнение реакции. Составьте ионные уравнения в полной и сокращенной форме: Напишите химические формулы электролитов, если известно, как они диссоциируют:
Напишите химические формулы электролитов, если известно, как они диссоциируют: Какие из перечисленных веществ являются электролитами: сахар, N2, BaCl2, HNO3, CO, Ca(OH)2 , FeSO4, бензин?
Какие из перечисленных веществ являются электролитами: сахар, N2, BaCl2, HNO3, CO, Ca(OH)2 , FeSO4, бензин? ** Составьте в молекулярной форме уравнение реакции, которому соответствует следующее ионное уравнение:
** Составьте в молекулярной форме уравнение реакции, которому соответствует следующее ионное уравнение:


 Выберите один правильный ответ.
Выберите один правильный ответ. Какой из металлов является самым легким?
Какой из металлов является самым легким? Допишите правильный ответ.
Допишите правильный ответ.
 Самый твердый металл – это:
Самый твердый металл – это: Схема превращений Fe→ Fe
Схема превращений Fe→ Fe .
.