ОТВЕТЫ — ХИМИЯ 11 класс — КОНТРОЛЬНЫЕ И ПРОВЕРОЧНЫЕ РАБОТЫ к учебнику О. С. Габриеляна
Строение атома
|
ВАРИАНТ 1 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
B3 |
|
2 |
2 |
3 |
3 |
4 |
4 |
4 |
1 |
3 |
1 |
125 |
245 |
2244 |
|
|
ВАРИАНТ 2 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
В3 |
|
2 |
2 |
3 |
|
4 |
4 |
2 |
1 |
3 |
3 |
134 |
234 |
4422 |
Периодический закон и Периодическая система химических элементов Д. И. Менделеева
И. Менделеева
|
ВАРИАНТ 1 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
В3 |
|
3 |
1 |
3 |
2 |
3 |
4 |
3 |
1 |
4 |
2 |
134 |
126 |
6534 |
|
|
С2. |
|||||||||||||
|
ВАРИАНТ 2 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
В3 |
|
2 |
3 |
1 |
3 |
4 |
3 |
4 |
3 |
1 |
1 |
345 |
124 |
2143 |
|
 Se. Se.
|
|||||||||||||
Строение вещества. Дисперсные системы. Растворы
|
ВАРИАНТ 1 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
B3 |
|
3 |
1 |
1 |
2 |
4 |
3 |
2 |
3 |
4 |
3 |
345 |
125 |
1332 |
|
|
С2. |
|||||||||||||
|
2 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
В3 |
|
3 |
2 |
1 |
1 |
3 |
4 |
1 |
2 |
3 |
4 |
235 |
236 |
1243 |
|
|
С2. |
|||||||||||||
Классификация химических реакций
|
ВАРИАНТ 1 |
А1 |
|
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
В3 |
|
2 |
3 |
2 |
2 |
2 |
1 |
4 |
1 |
3 |
3 |
234 |
456 |
3215 |
|
|
С1. |
С2. Нельзя. |
||||||||||||
|
ВАРИАНТ 2 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
В3 |
|
4 |
3 |
2 |
1 |
2 |
2 |
1 |
4 |
4 |
2 |
135 |
156 |
1543 |
|
С1. |
С2. Нельзя. |
||||||||||||
Скорость химических реакций. Обратимость химических реакций. Химическое равновесие
|
ВАРИАНТ 1 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
B3 |
|
2 |
3 |
4 |
2 |
2 |
3 |
4 |
3 |
4 |
3 |
456 |
236 |
30 |
|
|
ВАРИАНТ 2 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
B3 |
|
1 |
4 |
3 |
2 |
2 |
2 |
4 |
3 |
3 |
4 |
145 |
135 |
2,5 |
|
Электролитическая диссоциация
|
ВАРИАНТ 1 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
В3 |
|
3 |
3 |
1 |
4 |
1 |
4 |
3 |
2 |
3 |
1 |
246 |
3215 |
3123 |
|
|
С1. |
|||||||||||||
|
ВАРИАНТ 2 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
В3 |
|
2 |
1 |
4 |
4 |
2 |
3 |
4 |
3 |
3 |
4 |
456 |
3314 |
3211 |
|
|
C1. |
С2. Не выпадет. |
||||||||||||
Гидролиз
|
ВАРИАНТ 1 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
B3 |
|
3 |
1 |
4 |
4 |
3 |
3 |
2 |
3 |
2 |
2 |
234 |
1331 |
3411 |
|
|
С1. |
С2. 12,5 г СаСO3, ω(СаСl2) = 27,3%. |
||||||||||||
|
ВАРИАНТ 2 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
В3 |
|
2 |
1 |
4 |
2 |
4 |
1 |
4 |
3 |
3 |
4 |
136 |
3311 |
5412 |
|
|
С1. |
С2. ω(СН3СООС2Н5) = 42,3%; ω(НСООСН3) = 57,7%. |
||||||||||||
Окислительно-восстановительные реакции
|
ВАРИАНТ 1 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
В3 |
|
2 |
1 |
4 |
4 |
2 |
2 |
3 |
3 |
4 |
1 |
5634 |
5412 |
4131 |
|
|
С2. |
|||||||||||||
|
ВАРИАНТ 2 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
В3 |
|
1 |
2 |
4 |
4 |
1 |
3 |
3 |
4 |
1 |
3 |
1653 |
2313 |
6554 |
|
|
С2. |
|||||||||||||
Классификация неорганических и органических веществ
|
ВАРИАНТ 1 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
B3 |
|
2 |
1 |
4 |
4 |
2 |
3 |
3 |
2 |
2 |
1 |
135 |
6641 |
2413 |
|
|
С1. |
С2. C3H9N. |
||||||||||||
|
ВАРИАНТ 2 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
В3 |
|
4 |
4 |
1 |
4 |
1 |
2 |
2 |
1 |
4 |
4 |
156 |
3562 |
1435 |
|
|
C1. |
С2. С5Н8. |
||||||||||||
Общая характеристика металлов и их соединений
|
ВАРИАНТ 1 |
А1 |
A2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
B1 |
B2 |
В3 |
|
2 |
4 |
4 |
1 |
1 |
2 |
2 |
4 |
2 |
2 |
123 |
5252 |
1431 |
|
|
С2. |
|||||||||||||
|
ВАРИАНТ 2 |
A1 |
A2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
B1 |
B2 |
В3 |
|
2 |
3 |
3 |
3 |
4 |
3 |
2 |
3 |
4 |
1 |
146 |
5531 |
3212 |
|
|
С2. |
|||||||||||||
Коррозия металлов. Способы получения металлов. Электролиз. Химические источники тока
|
ВАРИАНТ 1 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
В3 |
|
2 |
1 |
4 |
3 |
1 |
3 |
1 |
3 |
2 |
1 |
126 |
2211 |
1442 |
|
|
С2. |
|||||||||||||
|
ВАРИАНТ 2 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
В3 |
|
2 |
3 |
3 |
1 |
3 |
3 |
2 |
2 |
3 |
4 |
346 |
1521 |
2523 |
|
|
С2. |
|||||||||||||
Металлы главных подгрупп
|
ВАРИАНТ 1 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
В3 |
|
4 |
3 |
1 |
4 |
2 |
3 |
3 |
3 |
1 |
3 |
146 |
4532 |
4365 |
|
|
С2. |
|||||||||||||
|
ВАРИАНТ 2 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
В3 |
|
2 |
2 |
1 |
4 |
3 |
3 |
4 |
4 |
3 |
1 |
156 |
2153 |
2644 |
|
|
С2. |
|||||||||||||
Металлы побочных подгрупп
|
ВАРИАНТ 1 |
А1 |
A2 |
A3 |
A4 |
A5 |
A6 |
A7 |
A8 |
A9 |
A10 |
B1 |
B2 |
B3 |
|
4 |
1 |
2 |
4 |
4 |
3 |
3 |
2 |
3 |
3 |
125 |
3452 |
5124 |
|
|
С2. |
|||||||||||||
|
ВАРИАНТ 2 |
A1 |
A2 |
A3 |
A4 |
A5 |
A6 |
A7 |
A8 |
A9 |
A10 |
B1 |
B2 |
B3 |
|
2 |
2 |
4 |
2 |
4 |
1 |
3 |
2 |
3 |
2 |
246 |
3214 |
2654 |
|
|
С2. |
|||||||||||||
Общая характеристика неметаллов и их соединений
|
ВАРИАНТ 1 |
A1 |
A2 |
A3 |
A4 |
A5 |
A6 |
A7 |
A8 |
A9 |
A10 |
B1 |
B2 |
B3 |
|
1 |
2 |
2 |
1 |
2 |
4 |
3 |
2 |
3 |
3 |
345 |
3542 |
1213 |
|
|
C2. |
|||||||||||||
|
ВАРИАНТ 2 |
A1 |
A2 |
A3 |
A4 |
A5 |
A6 |
A7 |
A8 |
A9 |
A10 |
B1 |
B2 |
B3 |
|
2 |
4 |
3 |
3 |
3 |
2 |
2 |
2 |
4 |
1 |
136 |
5321 |
2321 |
|
|
C2. |
|||||||||||||
Галогены
|
ВАРИАНТ 1 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
B3 |
|
3 |
2 |
3 |
2 |
4 |
3 |
2 |
4 |
3 |
4 |
456 |
4235 |
2213 |
|
|
С2. |
|||||||||||||
|
ВАРИАНТ 2 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
В3 |
|
1 |
3 |
2 |
4 |
2 |
3 |
4 |
2 |
1 |
4 |
236 |
4312 |
4312 |
|
|
С2. |
|||||||||||||
Халькогены. Сера
|
ВАРИАНТ 1 |
А1 |
A2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
B1 |
B2 |
В3 |
|
2 |
4 |
2 |
2 |
3 |
4 |
3 |
4 |
1 |
1 |
156 |
3612 |
2234 |
|
|
С2. |
|||||||||||||
|
ВАРИАНТ 2 |
A1 |
A2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
B1 |
B2 |
В3 |
|
3 |
4 |
2 |
3 |
3 |
4 |
2 |
4 |
3 |
3 |
246 |
2264 |
4121 |
|
|
С2. |
|||||||||||||
Неметаллы V группы: азот и фосфор
|
ВАРИАНТ 1 |
А1 |
A2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
B1 |
B2 |
В3 |
|
2 |
2 |
3 |
3 |
4 |
2 |
1 |
1 |
2 |
4 |
245 |
5432 |
1144 |
|
|
С2. |
|||||||||||||
|
ВАРИАНТ 2 |
A1 |
A2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
B1 |
B2 |
В3 |
|
4 |
3 |
2 |
4 |
4 |
1 |
3 |
2 |
1 |
2 |
126 |
2244 |
1432 |
|
|
С2. |
|||||||||||||
Неметаллы IV группы: углерод и кремний
|
ВАРИАНТ 1 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
В3 |
|
3 |
1 |
4 |
2 |
2 |
1 |
3 |
3 |
4 |
4 |
356 |
2145 |
4212 |
|
|
С2. |
|||||||||||||
|
ВАРИАНТ 2 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
В3 |
|
1 |
2 |
4 |
2 |
4 |
3 |
1 |
1 |
1 |
4 |
456 |
4234 |
2431 |
|
|
С2. |
|||||||||||||
Органические и неорганические кислоты, основания и амфотерные соединения. Генетическая связь между классами неорганических и органических веществ
|
ВАРИАНТ 1 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
B3 |
|
2 |
4 |
3 |
2 |
1 |
3 |
2 |
4 |
3 |
3 |
123 |
5261 |
2142 |
|
|
ВАРИАНТ 2 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
В3 |
|
3 |
1 |
2 |
2 |
4 |
2 |
1 |
2 |
3 |
3 |
136 |
4132 |
2614 |
Химия в жизни общества
|
ВАРИАНТ 1 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
В3 |
|
3 |
2 |
1 |
4 |
3 |
1 |
3 |
4 |
4 |
2 |
124 |
3211 |
2135 |
|
|
С1. |
С2. 40 кг. |
||||||||||||
|
ВАРИАНТ 2 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
В3 |
|
1 |
1 |
4 |
4 |
3 |
2 |
3 |
3 |
4 |
1 |
135 |
2143 |
4321 |
|
|
С1. |
С2. 5,45 кг. |
||||||||||||
Контрольная работа “Вещества и их свойства”
|
ВАРИАНТ 1 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
B3 |
|
3 |
4 |
2 |
3 |
2 |
2 |
3 |
1 |
2 |
2 |
146 |
1322 |
4351 |
|
|
С2. |
|||||||||||||
|
ВАРИАНТ 2 |
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
В1 |
В2 |
В3 |
|
3 |
4 |
3 |
2 |
4 |
1 |
4 |
2 |
3 |
2 |
234 |
3342 |
5244 |
|
|
С2. |
|||||||||||||
Итоговая контрольная работа
|
ВАРИАНТ 1 |
А1 |
A2 |
A3 |
A4 |
A5 |
A6 |
A7 |
A8 |
A9 |
A10 |
B1 |
B2 |
B3 |
|
3 |
2 |
2 |
4 |
3 |
3 |
4 |
4 |
1 |
3 |
4213 |
2343 |
4233 |
|
|
С2. |
|||||||||||||
|
ВАРИАНТ 2 |
A1 |
A2 |
A3 |
A4 |
A5 |
A6 |
A7 |
A8 |
A9 |
A10 |
B1 |
B2 |
B3 |
|
2 |
3 |
2 |
4 |
3 |
4 |
3 |
1 |
3 |
4 |
4211 |
4325 |
2315 |
|
|
C2. |
|||||||||||||
Химия 11 класс Контрольные и проверочные работы Габриелян
-Содержание-
Комбинированные контрольные работы 5
Периодический закон. … Строение атома 5
Вар-т 1 5
Вар-т 2 7
Вар-т 3 9
Вар-т 4 12
Строение вещества 13
Вар-т 1 13
Вар-т 2 15
Вар-т 3 17
Вар-т 4 21
Скорость химических реакций. 21
Химическое равновесие 21
Вар-т 1 21
Вар-т 2 24
Вар-т 3 27
Вар-т 4 30
Теория электролитической диссоциации. 32
Гидролиз 32
Вар-т 1 32
Вар-т 2 34
Вар-т 3 36
Вар-т 4 39
Химические реакции 40
Вар-т 1 40
Вар-т 2 43
Вар-т 3 45
Вар-т 4 49
Металлы 52
Вар-т 1 51
Вар-т 2 53
Вар-т 3 55
Вар-т 4 59
Неметаллы 61
Вар-т 1 60
Вар-т 2 62
Вар-т 3 64
Вар-т 4 67
Классы неорганических веществ …68
Вар-т 1 68
Вар-т 2 70
Вар-т 3 73
Вар-т 4 76
Генетическая связь … органических — неорганических веществ 78
Вар-т 1 77
Вар-т 2 79
Вар-т 3 82
Вар-т 4 85
Решение расчетных задач 87
Вар-т 1 86
Вар-т 2 90
Вар-т 3 91
Вар-т 4 . 94
Итоговая контрольная работа 96
Вар-т 1 95
Вар-т 2 97
Вар-т 3 100
Вар-т 4 103
Разноуровневые контрольные работы 105
Строение атома 106
Строение вещества 114
Химические реакции 123
Вещества их свойства 133
Проверочные работы 141
Строение атома 142
Периодическая система … Менделеева 143
Химическая связь 145
Теория химического строения … 147
Полимеры 148
Классификация химических реакций 150
Скорость химических реакций 152
Теория электролитической диссоциации 153
Гидролиз 155
Классификация неорганических соединений 157
Классификация органических соединений 158
Металлы 159
Химические свойства металлов 161
Неметаллы 163
Кислоты органические неорганические 165
Основания органические — неорганические 167
Амфотерные соединения 168
Генетическая связь неорганических…169
Генетическая связь … органических соединений 172
Окислительно-восстановительные реакции 174
Скачать
Размер файла: 5 Мб; Формат: pdf/
Вместе с «Химия 11 класс Контрольные и проверочные работы Габриелян» скачивают: AdminХимия. 11 класс. Углубленный уровень. Контрольные работы к учебнику О.С. Габриеляна, Г.Г. Лысовой, Габриелян О.С. | ISBN: 978-5-358-16558-8
Габриелян О.С.
Аннотация
Пособие является частью учебного комплекса по химии, основа которого учебник О. С. Габриеляна, Г.Г. Лысовой «Химия. Углублённый уровень. 11 класс», переработанный в соответствии со ФГОС.
Учебное издание состоит из текстов контрольных и проверочных работ, соответствующих программе по химии для 11 класса О.С. Габриеляна.
Пособие предназначено для проведения текущего и итогового контроля по основным темам курса.
С. Габриеляна, Г.Г. Лысовой «Химия. Углублённый уровень. 11 класс», переработанный в соответствии со ФГОС.
Учебное издание состоит из текстов контрольных и проверочных работ, соответствующих программе по химии для 11 класса О.С. Габриеляна.
Пособие предназначено для проведения текущего и итогового контроля по основным темам курса.
Дополнительная информация
| Год публикации: | 2016 |
| Дополнительный тираж: | Да |
| Страниц: | 96 |
| Формат: | 70×100/16 |
| Ширина издания: | 125 |
| Высота издания: | 200 |
| Язык публикации: | русский |
| Тип бумаги: | офсетная (60-220 г/м2) |
| Полный список лиц указанных в издании: | Габриелян О. С. С. |
11 класс Итоговая контрольная работа 1 вариант |
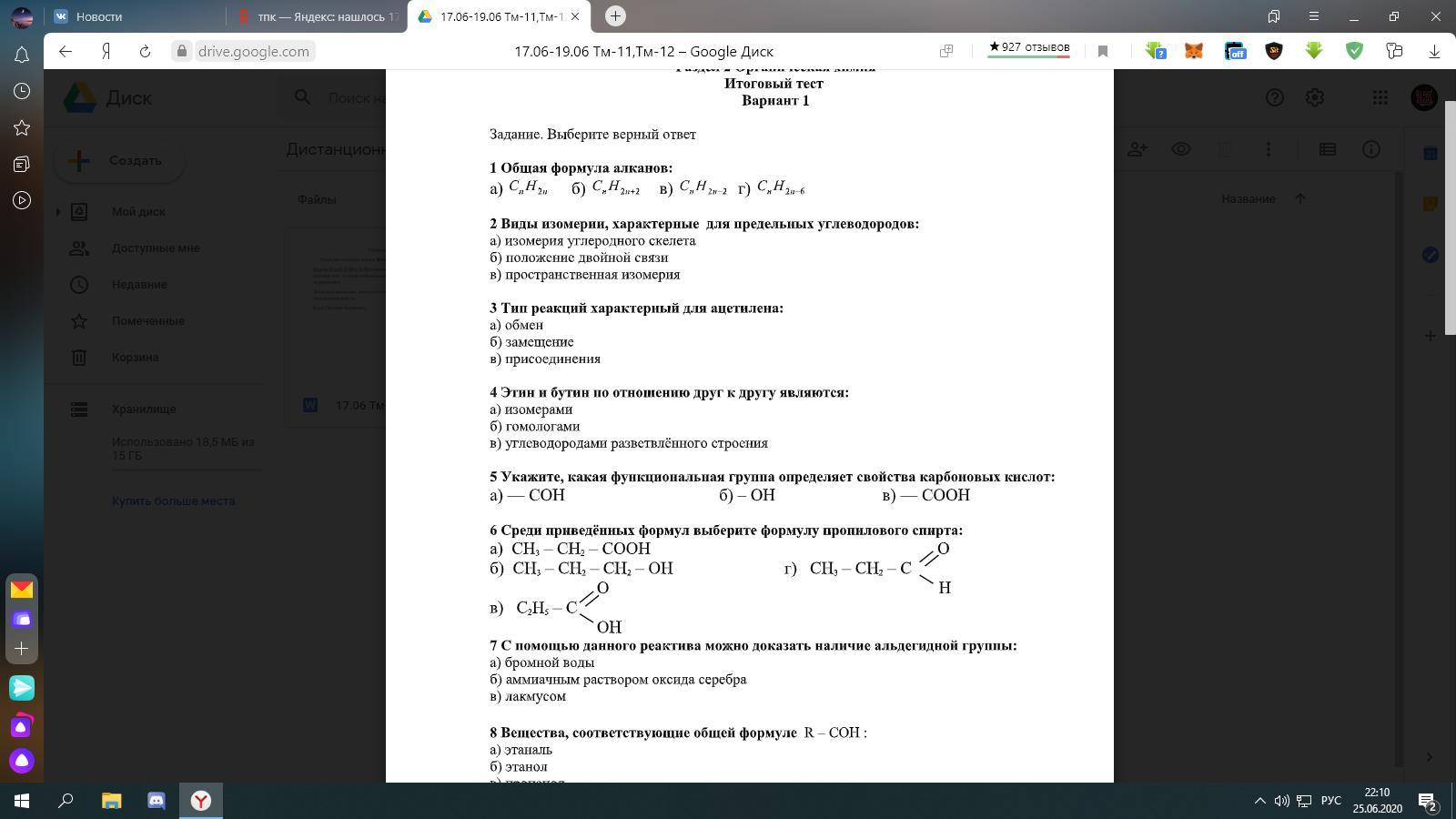
1. (1 балл) Сокращенная электронная конфигурация атома химического элемента Э, высший оксид которого соответствует формуле ЭО2: 1)…4s24p2 2) …4s24p3 3) …4s24p4 4) …4s24p5 |
2. (1 балл) Распределение электронов по энергетическим уровням 2ē, 8ē, 2ē соответствует частице: 1)Mg0 2) O2- 3) Mg2+ 4) S2- |
3. (1 балл) Оксид элемента 3-го периода VI группы главной подгруппы является: 1) кислотным 2) основным 3) амфотерным 4) несолеобразующим |
4. 1) Rb, K, Na, Li 2) Be, Mg, Ca, Sr 3) In, Ga, Al, B 4) Sr, Ga, Si, N |
5. (1 балл) Укажите соединение, которому присуща ковалентная неполярная связь: 1)SiH4 2) Fe2O3 3) I2 4) SO3 |
6. (1 балл) Вещества с металлической кристаллической решеткой: 1) летучие 2) растворимы в воде 3) проводят электрический ток 4) обладают низкой тепло и электропроводностью |
7. (1 балл) Элемент, образующий несколько аллотропных модификаций: 1) водород 2) магний 3) олово 4) хлор |
8. (1 балл) Степень окисления азота в сульфате аммония равна: 1) -3 2) -1 3) +1 4) +3 |
9. (1 балл) Какому классу соединений соответствует общая формула Меn+(ОН)n : 1) оксиды 2) кислоты 3) основания 4) соли |
10. 1)K2SO4 2) K2SO33)CaSO4 4) CaSO3 |
11. (1 балл) Химическое равновесие реакции, уравнение которого 2СО(г) + О2(г)↔ 2СО2(г)+Q сместится в сторону продуктов реакции в случае : 1) применения катализатора 2) увеличение температуры 3) увеличение давления 4) уменьшение концентрации О2 |
12. (1 балл) Окислителем в химической реакции, протекающей в водном растворе согласно уравнению Fe + CuCl2 → Cu + FeCl2 является: 1)Fe0 2) Fe2+ 3) Cu2+ 4) Cu0 |
13. (1 балл) Сокращенное ионное уравнениеSiO32- + 2H+ → H2SiO3↓ соответствует взаимодействию: 1) оксида кремния (IV) с водой 2) оксида кремния (IV) с серной кислотой 3) силиката натрия с серной кислотой 4) силиката кальция с серной кислотой |
14. 1) 40% 2) 8% 3) 10% 4) 25% |
15. (1 балл) Для получения 56 л (н.у.) углекислого газа, согласно уравнению реакции СаСО3(тв)→СаО(тв) + СО2(г) -180 кДж необходимо затратить теплоту в количестве: 1) 90 кДж 2) 180 кДж 3) 450 кДж 4) 540 кДж |
16. (2 балла) Определите класс каждого вещества HCl,HCOH,Fe(OH)3,C6H6,Na2S,C2H4,CO,CH3NH2,H2O,Al и дайте их названия. |
17. (3 балла) Составьте уравнение реакций по следующей схеме: СН4 → СО2 → С6Н12О6 → С2Н5ОН |
Химия. 11 класс. Контрольные и проверочные работы к учебнику О.С. Габриеляна, Г.Г. Лысовой «Химия. 11 класс. Углубленный уровень». Вертикаль.
 ФГОС — Габриелян О.С., Асанова Л.И. | 978-5-358-15405-6 Данный товар есть в наличии в следующих магазинах:
ФГОС — Габриелян О.С., Асанова Л.И. | 978-5-358-15405-6 Данный товар есть в наличии в следующих магазинах:г. Липецк, проспект Победы, 19А
8 (4742) 22-00-28
г. Воронеж, ул. Маршака, д.18А
8 (473) 231-87-02
г. Липецк, пл.Плеханова, д. 7
8 (4742) 47-02-53
г. Воронеж, ул. Г. Лизюкова, д. 66 а
Воронеж, ул. Г. Лизюкова, д. 66 а
8 (473) 247-22-55
г. Воронеж, ул. Ленинский проспект д.153
8 (473) 223-17-02
г. Воронеж, ул. Хользунова, д. 35
8 (473) 246-21-08
г. Воронеж, ул. Пушкинская, 2
8 (473) 300-41-49
г. Липецк, ул.Стаханова,38 б
Липецк, ул.Стаханова,38 б
8 (4742) 78-68-01
Полугодовая контрольная работа по химии в 11 классе(базовый уровень)
Контрольная работа по химии за 1 полугодие
11 класс
Вариант 1
Часть А
Внимательно прочитайте каждое задание части А, из четырех предложенных вариантов ответов выберите один правильный и отметьте его.
А1. Наибольшее число нейтронов содержится в ядре атома
- серы 3) азота
- натрия 4) магния
А2. Атом наиболее активного неметалла имеет электронную конфигурацию
Атом наиболее активного неметалла имеет электронную конфигурацию
1) 1s22s22p6 3) 1s22s22p63s2 3 p4
2) 1s22s22p63s23 p5 4) ls22s22p5
A3. Кислотные свойства высших оксидов химических элементов 5А группы в ряду
N2O5 → P2O5 → As2O5 → Sb2O5
1) усиливаются 3) ослабевают
2) не изменяются 4) сначала усиливаются, а затем ослабевают
А4. Химическая связь в молекулах сероводорода и нитрида кальция соответственно
Химическая связь в молекулах сероводорода и нитрида кальция соответственно
1) ковалентная полярная и металлическая 2) ионная и ковалентная полярная
2) ковалентная полярная и ионная 4) ковалентная неполярная и ионная
А5.Молекулярная кристаллическая решетка характерна для каждого из веществ, расположенных в ряду
- железо, фтор, хлорид кальция
- алмаз, карбид кремния, бор
- цинк, медь, карбид кремния
- метан, хлор, водород
А6. В соединениях NH3, N203 и HN03 азот имеет степени окисления, соответственно равные
- +3, +3, +5 3) -3, +3, +5
- -3, -3, +5 4) -3, +3, -5
А7. Верны ли следующие суждения о правилах безопасной работы в химической лаборатории?
Верны ли следующие суждения о правилах безопасной работы в химической лаборатории?
А. Нагреваемую пробирку нужно держать отверстием от себя.
Б. Для ускорения растворения твердых веществ нужно закрыть отверстие пробирки пальцем и встряхнуть.
1) верно только А; 2) верно только Б; 3) верны оба суждения; 4) оба суждения неверны
А8. В молекуле какого вещества все атомы углерода находятся в состоянии sp- гибридизации
1) гексана 2) гексина 3) этина 4) этена
А9. В каком ряду химические элементы расположены в порядке убывания их атомного радиуса:
1) Na Al Mg Si 2) Li Na Mg B 3) P S Cl Ar 4) F O N
Часть 2
В1. Установите соответствие между формулой вещества и значением степени окисления атомов марганца в нём:
Установите соответствие между формулой вещества и значением степени окисления атомов марганца в нём:
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ
A) Mn(OH)2 1) 0
Б) NaMnO4 2) +2
B) K2MnO4 3) +3
Г) MnO2 4) +4
5) +6
6) +7
В2. Установите соответствие между видом связи в веществе и названием вещества:
ВИД СВЯЗИ НАЗВАНИЕ ВЕЩЕСТВА
А) ковалентная неполярная 1) хлорид бария
Б) ковалентная полярная 2) хлорид фосфора (III)
В) ионная 3) алмаз
Г) металлическая 4) золото
В3. Рассчитайте массу хлорида натрия, которую нужно взять для приготовления раствора этой соли массой 250 г. и концентрацией 0,001моль/л.
Рассчитайте массу хлорида натрия, которую нужно взять для приготовления раствора этой соли массой 250 г. и концентрацией 0,001моль/л.
Контрольная работа по химии за 1 полугодие
11 класс
Вариант 2
Часть А
Внимательно прочитайте каждое задание части А, из четырех предложенных вариантов ответов выберите один правильный и отметьте его
А1 Наибольшее число протонов содержится в ядре атома
- натрия 2) алюминия 3) магния 4) кремния
А2 Атом наиболее активного металла имеет электронную конфигурацию
1) 1s22s22p63s23 p1 3) 1s22s22p63s1
2) 1s22s22p63s2 4) ls22s2
A3 Кислотные свойства высших оксидов химических элементов 2 периода слева направо
1) усиливаются 3) ослабевают
2) не изменяются 4) сначала усиливаются, а затем ослабевают
А4 Химическая связь в молекулах воды и алюминия соответственно
1) ковалентная полярная и ионная 2) ионная и ковалентная полярная
2) ковалентная полярная и металлическая 4) ковалентная неполярная и ионная
А5 Ионная кристаллическая решетка характерна для каждого из веществ, расположенных в ряду
- железо, фтор, хлорид кальция
- алмаз, карбид кремния, бор
- хлорид цинк, нитрат меди (2), карбонат калия
- метан, хлор, водород
А6 В соединениях нитрат калия, азот, нитрид калия степень окисления азота соответственно
1) увеличиваются 3) не изменяются
2) уменьшается 4) сначала увеличивается, а затем уменьшается
А7 Верны ли следующие суждения о правилах безопасной работы в химической лаборатории?
А. Не выливать избыток реактива обратно в склянку
Не выливать избыток реактива обратно в склянку
Б. Осторожно закрывать спиртовку колпачком
1) верно только А; 2) верно только Б; 3) верны оба суждения; 4) оба суждения не верны
А8. В молекуле какого вещества все атомы углерода находятся в состоянии sp2— гибридизации
1) гексана 2) гексена 3) этана 4) этена
А9. В порядке возрастания атомного радиуса химические элементы расположены в ряду:
1) B N P As 2) Rb K Na Mg 3) Sr Ca K Na 4) C Al Ca Sr
Часть 2
В1. Установите соответствие между формулой вещества и значением степени окисления атомов хрома в нём:
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ
A) K2Cr2O7 1) 0
Б) H2CrO4 2) +2
B) Cr(OH)3 3) +3
Г)CrO3 4) +6
В2. Установите соответствие между видом связи в веществе и формулой вещества:
Установите соответствие между видом связи в веществе и формулой вещества:
ВИД СВЯЗИ НАЗВАНИЕ ВЕЩЕСТВА
А) ковалентная неполярная 1) PCl3
Б) ковалентная полярная 2) P4
В) ионная 3) Mg
Г) металлическая 4) Na2O
В3. Определите объём получившегося 0,1 М раствора гидроксида натрия, если для его приготовления было взято 17 г. твердого гидроксида натрия.
ИСКРА Учебно-методические пособия
Все содержащиеся в данном пособии работы рассчитаны на академический час и составлены в пяти вариантах, 4 из которых имеют одинаковый уровень сложности, а пятый выходит за рамки базового уровня для углубленного изучения и подготовки к ЕГЭ. Кроме того они являются комбинированными: часть А содержит тестовые задания с выбором одного правильного ответа и задания на установление соответствия, а часть Б — задания со свободной формой ответа, предусматривающей написание уравнений реакций, условий их проведения, установление последовательности и решение задач.
Кроме того они являются комбинированными: часть А содержит тестовые задания с выбором одного правильного ответа и задания на установление соответствия, а часть Б — задания со свободной формой ответа, предусматривающей написание уравнений реакций, условий их проведения, установление последовательности и решение задач.
Первая часть пособия включает 17 тематических работ, которые могут быть использованы как педагогом в качестве дидактического материала на уроках, так и учащимися для самостоятельной работы и самоконтроля с целью проверки усвоения учебного материала.
Вторая часть — это 3 контрольных работы и разноуровневая итоговая контрольная, составленная по всему курсу общей химии.
Пособие является частью авторского умк по химии, с данным учебником в качестве основного компонента.
| Издатель (производитель) | Дрофа |
| Период обучения | 11 класс |
| ISBN | 978-5-358-14655-6, 978-5-358-12171-3 |
| Автор(ы) (Составитель) |
Габриелян О. С., Березкин П.Н., Ушакова А.А., Майорова Г.В., Кузьмина Н.В., Кириллова А.Е. С., Березкин П.Н., Ушакова А.А., Майорова Г.В., Кузьмина Н.В., Кириллова А.Е.
|
| Год издания | 2013, 2015 |
| Издание | 1-е ФГОС, 4-е стереотипное |
| Вид издания | Тесты, Практикум |
| Формат издания | 84х108/32 (130х200мм) средний |
| Обложка |
Обл – Мягкий переплет. Крепление скрепкой или клеем. Крепление скрепкой или клеем.
|
| Вес (с упаковкой) | 210 г |
| Кол-во страниц | 224 |
| Возрастная категория | 12 + |
| Тип издания (жанр) | Учебное издание |
| Язык | русский |
| Иллюстрации | нет |
Категории: Химия (10-11) ЕГЭ (Итоговая аттестация) Материалы для подготовки в ВУЗы РАСПРОДАЖА !!!
Теги: ЕГЭ 11 класс ФГОС Контрольные работы Дрофа Химия металлы электролиты неметаллы периодическая система Менделеева газы базовый уровень жидкости твердые тела Габриелян Вертикаль химические связи Основания Кислоты Соли химические реакции Полимеры Подготовка к ЕГЭ Строение атома Проверочные работы подготовка в ВУЗ гидролиз химические явления Ушакова Березкин дисперсные системы смеси
Габриелян.
 Химия. 11 класс. Базовый уровень. Контрольные и проверочные работы. Вертикаль. ФГОС. отзывы
Химия. 11 класс. Базовый уровень. Контрольные и проверочные работы. Вертикаль. ФГОС. отзывыОставьте отзыв об этом товаре первым!
Сказал, что атомы — это крошечные частицы, которые нельзя разделить | ||
Придумал теорию электронов | ||
Кто проводил эксперимент с золотой фольгой? | ||
Кто открыл заряд электронов? | ||
Кто открыл нейтрон? | ||
Сколько сиг. | ||
Сколько сиг.цифры? 0,002300 | ||
Атомы элемента, которые химически похожи, но имеют разное количество нейтронов, следовательно, разные массовые числа. | ||
Относительное количество изотопа элемента; выражается в виде полной или десятичной дроби.(Пример C-13 = содержание 1,11%) | ||
Как рассчитать среднюю атомную массу? | ||
Атомный радиус __________ слева направо в таблице Менделеева | ||
Энергия ионизации ____________ слева направо в таблице Менделеева | ||
Что такое электроотрицательность? | мера способности атомов притягивать электроны в химической связи | |
Какой префикс добавляется при добавлении кислорода к многоатомному иону? | ||
Какой префикс добавляется при удалении двух атомов кислорода из многоатомного иона? | ||
Могут ли ковалентные соединения проводить электричество? | ||
Что такое неполярная ковалентная связь? | Связь между двумя атомами с разницей электроотрицательности менее 0. | |
Если молекула симметрична, общая молекула _____________? | ||
Сила притяжения между молекулами | ||
Какая самая слабая межмолекулярная сила? | Лондонская дисперсия, также существует между всеми типами молекул | |
Что такое диполь-дипольные силы? | молекулы с диполями изменят свое направление так, что их противоположно заряженные концы будут рядом друг с другом | |
Какая самая сильная межмолекулярная сила? | ||
способен смешиваться с образованием раствора, не может смешиваться с образованием раствора | ||
Растворенное вещество — это вещество, которое растворяется в растворителе, растворитель растворяет растворенное вещество | ||
Факторы, влияющие на скорость растворения? | Температура, перемешивание, размер частиц | |
Факторы, влияющие на растворимость? | температура, размер молекулы | |
Что такое теория Аррениуса? | кислоты диссоциируют в воде с образованием ионов H +, основания диссоциируют в воде с образованием ионов OH + | |
В чем заключалась проблема теории Аррениуса? | Он включает только растворитель — воду, многие кислотно-основные реакции происходят в других растворителях | |
частица, которая возникает, когда основание получает протон | ||
Газы можно описать как: | объем, температура и давление | |
Как перевести градусы Цельсия в Кельвины? | ||
каковы преобразования давления? | 101. | |
Перевести: 1400 мм рт. Ст. В торр. | ||
Газы состоят из чрезвычайно мелких частиц, постоянного беспорядочного движения, идеально эластичны, силы притяжения незначительны. | ||
частицы газа почти не занимают места | ||
При увеличении давления объем уменьшается, наоборот | ||
Если темп. | ||
давление, оказываемое газом, напрямую связано с температурой при условии, что объем остается постоянным | ||
Стандартные температура и давление | ||
В чем ценность STP? | ||
Какое значение R (газовая постоянная) | R = 8. | |
Какая формула идеального газа? |
Основная структура атома и атомная теория
Атомы — одна из первых тем, рассматриваемых в курсе химии, потому что они являются фундаментальным строительным блоком материи.Атомы связываются друг с другом, образуя чистые элементы, соединения и сплавы. Эти вещества обмениваются атомами друг с другом, образуя новые продукты посредством химических реакций.
Эти вещества обмениваются атомами друг с другом, образуя новые продукты посредством химических реакций.
Ключевые выводы: атомы
- Атомы — это наименьшая единица вещества, которую нельзя разделить никаким химическим методом. Они действительно состоят из более мелких частей, но могут быть разрушены только ядерными реакциями.
- Три части атома — это протоны, нейтроны и электроны. Протоны несут положительный электрический заряд.Нейтроны электрически нейтральны. Электроны несут отрицательный заряд, равный по величине заряду протона.
- Протоны и нейтроны слипаются, образуя атомное ядро. Электроны вращаются вокруг ядра.
- Химические связи и химические реакции происходят из-за электронов вокруг атомов. Атом, у которого слишком много или слишком мало электронов, нестабилен и может связываться с другим атомом, чтобы либо делить, либо существенно отдавать электроны.
Обзор Atom
Химия — это изучение материи и взаимодействия между различными типами материи и энергии. Основным строительным блоком материи является атом. Атом состоит из трех основных частей: протонов, нейтронов и электронов. Протоны имеют положительный электрический заряд. Нейтроны не имеют электрического заряда. Электроны имеют отрицательный электрический заряд. Протоны и нейтроны находятся вместе в так называемом ядре атома. Электроны вращаются вокруг ядра.
Основным строительным блоком материи является атом. Атом состоит из трех основных частей: протонов, нейтронов и электронов. Протоны имеют положительный электрический заряд. Нейтроны не имеют электрического заряда. Электроны имеют отрицательный электрический заряд. Протоны и нейтроны находятся вместе в так называемом ядре атома. Электроны вращаются вокруг ядра.
Химические реакции включают взаимодействие между электронами одного атома и электронами другого атома. Атомы с разным количеством электронов и протонов имеют положительный или отрицательный электрический заряд и называются ионами.Когда атомы связываются вместе, они могут образовывать более крупные строительные блоки материи, называемые молекулами.
Слово «атом» было придумано древними греками Демокритом и Левкиппом, но природа атома была понята лишь позже. В 1800-х годах Джон Дальтон продемонстрировал, что атомы взаимодействуют друг с другом в целых соотношениях с образованием соединений. Открытие электрона принесло Дж. Дж. Томсон получил Нобелевскую премию по физике 1906 года. Атомное ядро было обнаружено в эксперименте с золотой фольгой, проведенном Гейгером и Марсденом под руководством Эрнеста Резерфорда в 1909 году.
Дж. Томсон получил Нобелевскую премию по физике 1906 года. Атомное ядро было обнаружено в эксперименте с золотой фольгой, проведенном Гейгером и Марсденом под руководством Эрнеста Резерфорда в 1909 году.
Важные факты об атомах
Вся материя состоит из частиц, называемых атомами. Вот несколько полезных фактов об атомах:
- Атомы нельзя разделить с помощью химикатов. Они действительно состоят из частей, которые включают протоны, нейтроны и электроны, но атом — это основной химический строительный блок вещества.
- Каждый электрон имеет отрицательный электрический заряд.
- Каждый протон имеет положительный электрический заряд. Заряды протона и электрона равны по величине, но противоположны по знаку.Электроны и протоны электрически притягиваются друг к другу.
- Каждый нейтрон электрически нейтрален. Другими словами, нейтроны не имеют заряда и не притягиваются электрически ни к электронам, ни к протонам.
- Протоны и нейтроны примерно одного размера и намного больше, чем электроны.

- Масса протона по существу такая же, как и у нейтрона. Масса протона в 1840 раз больше массы электрона.
- Ядро атома содержит протоны и нейтроны.Ядро несет положительный электрический заряд.
- Электроны движутся вне ядра.
- Почти вся масса атома находится в его ядре; почти весь объем атома занят электронами.
- Число протонов (также известное как его атомный номер) определяет элемент. Изменение количества нейтронов приводит к образованию изотопов. Изменение количества электронов приводит к образованию ионов. Изотопы и ионы атома с постоянным числом протонов — все вариации одного элемента.
- Частицы внутри атома связаны между собой мощными силами. В общем, электроны легче добавить или удалить из атома, чем протон или нейтрон. В химических реакциях в основном участвуют атомы или группы атомов и взаимодействия между их электронами.
Учебные вопросы и ответы
Попробуйте выполнить эти практические задания, чтобы проверить свое понимание теории атома.
- Напишите символы ядер для трех изотопов кислорода, в которых содержится 8, 9 и 10 нейтронов соответственно.Ответ
- Напишите ядерный символ для атома с 32 протонами и 38 нейтронами. Ответ
- Определите количество протонов и электронов в ионе Sc 3+ . Ответ
- Укажите символ иона, у которого 10 e — и 7 p + . Ответ
Источники
- Льюис, Гилберт Н. (1916). «Атом и молекула». Журнал Американского химического общества . 38 (4): 762–786. DOI: 10.1021 / ja02261a002
- Вюрц, Чарльз Адольф (1881). Теория атома . Нью-Йорк: Д. Эпплтон и компания. ISBN 978-0-559-43636-9.
BJU Press Grade 11 Science
Химия — увлекательный, но зачастую сложный предмет. Обновленный полноцветный учебник для студентов охватывает основные темы, которые студенты должны знать, включая атомы, периодическую таблицу, молекулярные связи, формулы, реакции, растворы, кислоты / основания и различные специализированные темы. Каждая глава включает в себя научную проблему доминиона, которая часто требует решения химии, цели сеанса, выделенные жирным шрифтом термины с определениями на боковой панели, рамки карьеры, рамки «исследования мировоззрения» и доступный текст основной главы.Диаграммы, иллюстрации, фотографии и примеры задач обеспечивают дополнительное раскрытие и ясность, в то время как обзоры разделов обеспечивают оценку, а обзоры глав проверяют полученные знания с помощью множества различных упражнений.
Каждая глава включает в себя научную проблему доминиона, которая часто требует решения химии, цели сеанса, выделенные жирным шрифтом термины с определениями на боковой панели, рамки карьеры, рамки «исследования мировоззрения» и доступный текст основной главы.Диаграммы, иллюстрации, фотографии и примеры задач обеспечивают дополнительное раскрытие и ясность, в то время как обзоры разделов обеспечивают оценку, а обзоры глав проверяют полученные знания с помощью множества различных упражнений.
Это новое 4-е издание содержит новый контент о полупроводниках и ядерной химии, а также дополнительные разделы, влияющие на библейское мировоззрение, которые помогут студентам продумать общие дискуссии между учеными.
Набор из двух книг для учителя содержит репродукции страниц текста учащегося (уменьшенного размера), окруженные заметками учителя на широких полях.Включены полезные обучающие заметки и ответы на обзоры разделов и глав. Главы включают предлагаемое расписание обучения и обзор; значки на протяжении всего урока обозначают контрольные, лабораторные работы, наглядные пособия на компакт-диске учителя и другие компоненты. На прилагаемом компакт-диске «Инструментарий учителя» есть наглядные пособия, опросы по разделам, дополнительные материалы для чтения, дополнительные задачи, дополнительные лабораторные работы и заключительный экзамен по запросу, таблица со списком лабораторного оборудования и материалов и многое другое.
На прилагаемом компакт-диске «Инструментарий учителя» есть наглядные пособия, опросы по разделам, дополнительные материалы для чтения, дополнительные задачи, дополнительные лабораторные работы и заключительный экзамен по запросу, таблица со списком лабораторного оборудования и материалов и многое другое.
Лабораторное руководство включает в себя действия, которые дают возможность закрепить текстовые концепции, развить лабораторные навыки, научиться записывать и интерпретировать данные, развить навыки решения проблем и многое другое.Действия включают цели, необходимое оборудование, процедуры и любую другую необходимую информацию. Полноцветные страницы предоставляют студентам место для записи наблюдений и ответов на заданные вопросы.
Руководство по лабораторной работе Teacher’s Edition включает в себя уменьшенные страницы для учащихся с наложенными правильными ответами; на полях представлены подробные заметки учителя и место для заметок. Алфавитные списки химикатов и оборудования соотнесены с лабораториями, в которых они используются.235 страниц, переплет по спирали, мягкая передняя обложка и твердая задняя обложка.
Алфавитные списки химикатов и оборудования соотнесены с лабораториями, в которых они используются.235 страниц, переплет по спирали, мягкая передняя обложка и твердая задняя обложка.
Тесты предоставляют родителям простой способ оценить усвоение уроков и их усвоение; они не воспроизводятся и имеют клеевое соединение для легкого удаления.
Клавиша ответов теста представляет собой полноразмерные репродукции тестов учащихся с наложенными правильными ответами.
В этот набор входят:
- Учебник для учащихся, 594 страницы, в мягкой обложке. Указатель, глоссарий и периодическая таблица включены.11 класс. 4-е издание.
- Руководство для учителя, 2 тома, всего 591 страница, переплет по спирали, мягкая передняя обложка, твердая задняя обложка.
- Пособие по лабораторной работе для студентов, 214 перфорированных страниц, перфорация с тремя отверстиями, мягкая обложка.
- Lab Manual Teacher’s Edition, 235 страниц, со спиральным переплетом, мягкая передняя обложка и твердая задняя обложка.

- Test Packet
- Test Answer Keys, Looseleaf и с тремя отверстиями с перфорацией.
Программа стажировки по химии IB для 11 класса
Программа стажировки по химии IB для 11 класса
Формальное образование можно получить не только в четырех стенах классной комнаты.Значительное обучение происходит, когда учащиеся подвергаются практическому обучению. Они склонны лучше понимать концепции, которым обучают в школе, когда они знают, как они используются в обществе. Программа стажировки была разработана для студентов химического факультета 11 класса, чтобы дать им возможность испытать, каково это работать в лаборатории механических испытаний в Батаме. Наиболее важным компонентом стажировки является объединение теории и знаний с практическим применением и навыками, приобретенными в профессиональных условиях.Опыт и мероприятия определенно будут полезны для студентов, которые планируют посещать курсы естествознания в университете.
Учащиеся 11 класса IB были размещены для работы с физическим обучением. Hi-Test — компания, которая предлагает различные виды механических испытаний, включая испытание на растяжение, испытание на удар по Шарпи, испытание химического состава и испытание на коррозию. Учащиеся 11 класса IB имели возможность узнать, как работать с современными типами оборудования и как правильно соблюдать стандарты, которые будут использоваться для испытаний и анализа металлических сплавов.Студенты проходили стажировку в течение недели, с 20 по 24 мая 2019 года, где им было дано шесть часов на работу с понедельника по пятницу, и за это время они узнали новые вещи не только в академическом, но и в социальном плане, у студентов была возможность общаться и учиться у сотрудников компании. Это был действительно интересный и изменивший жизнь опыт, студенты познакомились с новыми и сложными методами, применяемыми в лабораториях, но студенты преодолевают эти трудности и превращаются в веселый и запоминающийся опыт.
Hi-Test — компания, которая предлагает различные виды механических испытаний, включая испытание на растяжение, испытание на удар по Шарпи, испытание химического состава и испытание на коррозию. Учащиеся 11 класса IB имели возможность узнать, как работать с современными типами оборудования и как правильно соблюдать стандарты, которые будут использоваться для испытаний и анализа металлических сплавов.Студенты проходили стажировку в течение недели, с 20 по 24 мая 2019 года, где им было дано шесть часов на работу с понедельника по пятницу, и за это время они узнали новые вещи не только в академическом, но и в социальном плане, у студентов была возможность общаться и учиться у сотрудников компании. Это был действительно интересный и изменивший жизнь опыт, студенты познакомились с новыми и сложными методами, применяемыми в лабораториях, но студенты преодолевают эти трудности и превращаются в веселый и запоминающийся опыт.
Студентам было предложено сделать лабораторные отчеты, и в последний день стажировки была проведена заключительная презентация. Группа представлена перед уполномоченными лицами в компании, в которую входят владелец и операционный менеджер компании. Презентация вызвала у студентов нервное напряжение, но они выдержали ее и представили краткую, но впечатляющую презентацию того, что они узнали и испытали за неделю стажировки. Студенты достигли целей и результатов обучения в программе CAS и отдают реализацию целей химии на практическое обучение.Студенты, проходящие практику, были уверены, что это была приятная и полезная программа.
Группа представлена перед уполномоченными лицами в компании, в которую входят владелец и операционный менеджер компании. Презентация вызвала у студентов нервное напряжение, но они выдержали ее и представили краткую, но впечатляющую презентацию того, что они узнали и испытали за неделю стажировки. Студенты достигли целей и результатов обучения в программе CAS и отдают реализацию целей химии на практическое обучение.Студенты, проходящие практику, были уверены, что это была приятная и полезная программа.
Вот некоторые размышления студентов:
Эта стажировка позволяет мне исследовать и понимать мир за пределами теоретической школы. Эта деятельность была очень важна для меня, поскольку она дала мне бесценный опыт, выходящий за рамки нашей программы, я изучил основные теории о металлургии и ее важности для нашей промышленности, я также узнал, как работать с машинами, а также что и что нужно делать. Работаю в лаборатории.Я действительно с нетерпением жду новой стажировки, так как эта деятельность подарила мне прекрасные воспоминания и опыт, которых я не мог получить больше нигде.
Thaddeus Trystan
Стажировка прошла отлично! У меня была возможность узнать новое и узнать, каково это работать в лаборатории. Эта стажировка, безусловно, полезна для меня, потому что я планирую пройти курс металлургии, что позволило мне узнать о ней больше и определенно поднять мой интерес к механическим испытаниям еще больше!
Ashiilah
Эта стажировка позволила мне понять и визуализировать мир за пределами академического мира.Это такая важная деятельность, потому что мы работаем по всему миру и получаем новый опыт, выходящий за рамки учебной программы. Во время этой стажировки я изучил теоретические основы лабораторных работ и важность присутствия металлургии в обществе. Я научился управлять машинами (например, машинами OES), которых никогда раньше не видел. Это послужило прекрасной возможностью. У меня остались некоторые воспоминания об этой программе стажировки, и я действительно с нетерпением жду новых программ стажировки в будущем.
Келли
Математика: | |
TOEFL: | |
IELTS: | |
Американская литература: | |
Академическое письмо: | |
Химия: | |
Биология: | |
Физика: | |
SAT-английский и математика: | |
SAT-Physics: | |
SAT-Chemistry: | |
SAT-Biology: |
Университет Манитобы CRYSTAL | Ссылки
Университет Манитобы КРИСТАЛЛ | Ссылки
Следующие ресурсы были разработаны людьми, работающими в проектах CRYSTAL в области химии.Они в стадии разработки. Если вы воспользуетесь этими ресурсами и обнаружите какие-либо ошибки или способы их улучшения, пожалуйста, свяжитесь с доктором Брайаном Левуэйтом.
- 11 класс
- 12 класс
- 11 класс
- Физические свойства вещества
- Газы и атмосфера
- Химические реакции
- Bubbly Fun с сухим льдом — C11-1-01 и 3-08
- Химическая демонстрация — этанольная ракета C11-1-03, 3-06, 5-15
- Химические реакции — Единичный тест 1 C11-3
- Химические реакции — Ключ ответа на единичный тест 1 C11-3
- Химические реакции — Единичный тест 2 C11-3
- Химические реакции — Код ответа на единичный тест 2 C11-3
- Химические реакции — Редакция C11-3
- Балансировка химических уравнений — C11-3
- Применение изотопов C11-3-01 и C11-3-02
- Beanium Lab — Средняя атомная масса C 11-3-01
- Медный пенни Lab C 11-3-01
- Jellybeanium Lab — Средняя атомная масса C11-3-01
- Относительная атомная масса — копия студента C11-3-01
- Относительная атомная масса — копия для учителя C11-3-01
- Относительная атомная масса — копия студента — C11-3-01
- Относительная атомная масса — Копия для учителя — C11-3-01
- Реакции в пробирке C 11-3-01, 06
- Горелка CD C11-1-05, 3-06, 5-03
- Металлы Демонстрации C11-3-05 и 06
- Angry Bucket — C11-3-06 и C12-3-08
- Buttersweet Popcorn — Справочная информация C11-3-08, 10, 11
- Buttersweet Popcorn — Студенческое расследование C11-3-08, 10, 11
- Carbon Tower Инструкции и вопросы — C11-3-06
- Кричащий мармеладный мишка C12-1-12 и C11-3-6
- Знакомство с кротом — Текст для учащихся — Краткий C11-3-07
- Представляем M0le — Копия для учителя — Краткая C11-3-07
- Молярная масса газа C11-3-08 и 10
- Эмперические формулы — C11-3-11
- Эмперические и молекулярные формулы C30S-3-11
- Формула гидрата C30S-3-11
- Тыква для саморезки C11-3-06, C11-5-12
- Серебряные усы-C11-3-13
- Реакция сульфата железа и меди C11-3-13
- Ограничивающие реагенты C11-3-14, 15
- Горение магния C11-3-14, 15
- Горящий ацетилен C11-3-14 и 15
- Реакция соляной кислоты с бикарбонатом натрия C 11-3-15
- Решения
- Решения Назначить презентацию
- Типы решений C11-4-01
- Интервью — Решения C11-4-1
- Вводные вопросы — решения C11-4-1
- Пылающий снежок — инструкции и вопросы C11-4-01, 02, 05, 5-06
- Flaming Snowball — Словарь единиц решений C11-4-01, 02, 05, 5-06
- Прозрачные пленки для пылающих снежков C11-4-01, 02, 05, 5-06
- Ура! Пленки C11-4-02, 03
- Ура! Превратите воду в вино, молоко и пиво C11-4-02, 03
- Танцующий виноград — C11-4-02, 03, 05
- Изготовление горячих и холодных пакетов C11-4-04
- Горячие упаковки, химические «сталагмиты» и красивые силикатные сады C11-04-04 и 05
- Больше, чем кажется на первый взгляд — C11-4-05
- Растворимость и полярность C11-4-5
- Mentos Geyser — C11-2-05 и 11-4-08 и 09
- Кривая растворимости Lab C11-4-06
- Газы и растворимость — карбонизация — беспорядочное дело C11-4-09 & 10
- Colligative Properties C11-4-11 и 12
- Депрессия точки замерзания и повышение точки кипения — изучение обучающего моделирования C11-4-12
- Точка замерзания соленой воды C11-4-12
- Химические вещества в нашей окружающей среде C11-4-13, 18 и 19
- Инструкции и предварительные лабораторные работы по растворам для загрязнения медью C11-4-13, 14-18
- Лаборатория по борьбе с загрязнением медью C11-4-13, 14-18
- Прозрачные пленки для загрязнения медью C11-4-13, 14-18
- Манипулятор концентрации и разбавления C11-4-14 до 17
- Растворы и разведения C30S-4-15 и 4-16 Instructor
- Растворы и разведения C30S-4-15 и 4-16 Студент
- Приготовление раствора для апельсинового напитка C11-4-15 и 17
- Очистка воды C11-4-19
- Органическая химия
- Химическая демонстрация — этанольная ракета C11-1-03, 3-06, 5-15
- Горелка CD C11-1-05, 3-06, 5-03
- Тыква для саморезки C11-3-06, C11-5-12
- Пылающий снежок — инструкции и вопросы C11-4-01, 02, 05, 5-06
- Flaming Snowball — Словарь единиц решений C11-4-01, 02, 05, 5-06
- Прозрачные пленки для пылающих снежков C11-4-01, 02, 05, 5-06
- Органические соединения C11-5-01
- Органическое или неорганическое C11-5-01
- Люминол Glow Light C11-5-1
- Структурные характеристики углерода C11-5-03
- Обучающие справочные материалы по модели Mania и учебное пособие по eChem C11-5-03, 04, 06, 08
- Рабочий лист и вопросник для учащихся Model Mania C11-5-03, 04, 06, 08
- MP BP Тенденции алканов C11-5-4,5, 6
- Инструкции и вопросы по подводным фейерверкам C11-5-05, 09
- Манипулятивная активность в отношении алканов C11-5-06 и 07
- Насыщенные и ненасыщенные углеводороды C11-5-10
- Использование и источники некоторых органических молекул C11-5-14-21
- Scratch ‘n Sniff Ester Lab & Write Up C11-5-19, 21
- Scratch ‘n Sniff Instructional Background C11-5-19, 21
- Предварительная лаборатория Scratch ‘n Sniff C11-5-19, 21
- Полимеризация C11-5-22
- Время слизи C11-5-22
- Полимеризационный синтез нейлона 6,10 C11-5-22
- Социальные проблемы — Органическая химия 2 — C11-5-24
- Класс 12
- Водные реакции
- Атомная структура
- Кинетика
- Химическое равновесие
- Кислоты и основания
- Электрохимия
Пробные онлайн-тесты CBSE Class 11 Chemistry
Вышеприведенные ссылки на главу Online Mock Tests для CBSE Class 11 Chemistry помогут вам провести тесты на основе MCQ и проверить ваше понимание всех важных концепций, которые были подготовлены на основе последняя программа CBSE Class 11 2021. Студенты должны использовать бесплатные пробные онлайн-тесты для CBSE Class 11, чтобы проверить их понимание своих концепций химии CBSE Class 11. На сайте StudiesToday.com собрана самая большая коллекция онлайн-тестов на основе MCQ класса 11 для экзаменов CBSE по химии 2021 года, которые помогут вам правильно подготовиться и получить наивысший рейтинг на экзаменах. Студенты могут проходить пробные тесты для CBSE Class 11 столько раз, сколько захотят, а также загружать проходной сертификат после прохождения онлайн-теста.Эти имитация онлайн-тестов для 11 класса по химии , которые были разработаны преподавателями StudiesToday.com после тщательного изучения последней книги и основаны на шаблонах вопросов на предстоящих экзаменах для учеников класса CBSE.
Студенты должны использовать бесплатные пробные онлайн-тесты для CBSE Class 11, чтобы проверить их понимание своих концепций химии CBSE Class 11. На сайте StudiesToday.com собрана самая большая коллекция онлайн-тестов на основе MCQ класса 11 для экзаменов CBSE по химии 2021 года, которые помогут вам правильно подготовиться и получить наивысший рейтинг на экзаменах. Студенты могут проходить пробные тесты для CBSE Class 11 столько раз, сколько захотят, а также загружать проходной сертификат после прохождения онлайн-теста.Эти имитация онлайн-тестов для 11 класса по химии , которые были разработаны преподавателями StudiesToday.com после тщательного изучения последней книги и основаны на шаблонах вопросов на предстоящих экзаменах для учеников класса CBSE.
Преимущества пробных онлайн-тестов для химии Standard 11
a) Пробные онлайн-тесты для химии 11 класса CBSE были разработаны опытными преподавателями после серьезных исследований по всем темам.
b) Онлайн-тесты CBSE Class 11 с ответами были созданы таким образом, чтобы предоставить полные и всесторонние знания по каждой теме на легком и понятном языке.
c) Вы также обнаружите, что некоторые из вопросов, которые задаются в наших онлайн-тестах, могут появиться и на предстоящих экзаменах CBSE Class 11 Chemistry .
d) Тысячи студентов класса 11 CBSE прошли эти онлайн-тесты и получили отличные результаты и высокие оценки на экзаменах по химии класса 11 CBSE.
Пробные онлайн-тесты для CBSE Class 11 Chemistry доступны бесплатно для всех студентов, которые хотят участвовать в предстоящих экзаменах. Studiestoday.com предлагает самую эксклюзивную и самую большую последнюю базу данных бесплатных онлайн-пробных тестов для всех студентов. Повторение вопросов снова и снова в тестах даст дополнительное преимущество учащимся класса 11 CBSE. Большинство вопросов взяты из предыдущих экзаменов по химии класса 11 NCERT, поэтому их практика в условиях экзамена определенно поможет вам получить более высокий рейтинг.

 Ti.
Ti. 16,7%; 750 л.
16,7%; 750 л. 30 г; 52,4%.
30 г; 52,4%. -739,9 кДж.
-739,9 кДж. -1113 кДж/моль.
-1113 кДж/моль. 2. С2. 1,26 ∙ 10-4 моль/л.
2. С2. 1,26 ∙ 10-4 моль/л. 11.
11. СН3СООС2Н5.
СН3СООС2Н5. Al2S3.
Al2S3. 4,3%.
4,3%. ω(КОН) = 1,8%.
ω(КОН) = 1,8%. Сr2O3.
Сr2O3. CrO3.
CrO3. ω(CuSO4) = 2,46% ; ω(FeSO4) = 12,97%.
ω(CuSO4) = 2,46% ; ω(FeSO4) = 12,97%. ω(AgNO3) = 12,16% ; ω(Cu(NO3)2) = 1,68% ; m(Ag) = 1,08 г.
ω(AgNO3) = 12,16% ; ω(Cu(NO3)2) = 1,68% ; m(Ag) = 1,08 г. V(O2) = 41,5 л; V(H2) = 83 л.
V(O2) = 41,5 л; V(H2) = 83 л. 8,2%.
8,2%. ω(Аl) = 27,27%; ω(Аl4С3) = 72,73%.
ω(Аl) = 27,27%; ω(Аl4С3) = 72,73%. ω(КСl) = 9,24%; ω(К[Аl(ОН)4]) = 2,77%.
ω(КСl) = 9,24%; ω(К[Аl(ОН)4]) = 2,77%. ω(Fe) = 25,9%; ω(Zn) = 60,2%; ω(Сu) = 13,9%.
ω(Fe) = 25,9%; ω(Zn) = 60,2%; ω(Сu) = 13,9%. ω(FeSO4) = 2,99%; ω(ZnSO4) = 6,34%; ω(H2SO4) = 3,86%.
ω(FeSO4) = 2,99%; ω(ZnSO4) = 6,34%; ω(H2SO4) = 3,86%. 1,04 г/л.
1,04 г/л. 8,3% N2, 66,7% H2, 25% NH3.
8,3% N2, 66,7% H2, 25% NH3. ω(КСlO3) = 4,56%; ω(КСl) = 13,83%; ω(КОН) = 2,5%.
ω(КСlO3) = 4,56%; ω(КСl) = 13,83%; ω(КОН) = 2,5%. ω(NaBr) = 63,19%; ω(NaI) = 36,81%.
ω(NaBr) = 63,19%; ω(NaI) = 36,81%. m(BaSO4) = 23,77 г; ω(H2SO4) = 10,97%; ω(HCl) = 2,81%.
m(BaSO4) = 23,77 г; ω(H2SO4) = 10,97%; ω(HCl) = 2,81%. ω(Na2SO3) = 4,69%; ω(NaOH) = 14,89%.
ω(Na2SO3) = 4,69%; ω(NaOH) = 14,89%. ω(KNO2) = 6,58%, ω(NaNO2) = 16,02%.
ω(KNO2) = 6,58%, ω(NaNO2) = 16,02%. ω(KNO3) = 18,23%; ω(KOH) = 7,95%.
ω(KNO3) = 18,23%; ω(KOH) = 7,95%. ω(КНСO3) = 19,6%.
ω(КНСO3) = 19,6%. ω(К2СO3) = 3,15%; ω(KOH) = 1,6%.
ω(К2СO3) = 3,15%; ω(KOH) = 1,6%. 4219 кг.
4219 кг. 217,8 кг.
217,8 кг. Vp—pa(NaOH) = 27,3 мл; V(H2O) = 48,8 мл.
Vp—pa(NaOH) = 27,3 мл; V(H2O) = 48,8 мл. Vp-pa(KOH) = 41 мл; m(K2SO4) = 2,5 г.
Vp-pa(KOH) = 41 мл; m(K2SO4) = 2,5 г. ω(Mg) = 5,87%; ω(Zn) = 79,46%; ω(SiO2) = 14,67%.
ω(Mg) = 5,87%; ω(Zn) = 79,46%; ω(SiO2) = 14,67%. ω(Cu) = 36,8%; ω(Аl) = 31% ; ω(Fe) = 32,2%.
ω(Cu) = 36,8%; ω(Аl) = 31% ; ω(Fe) = 32,2%.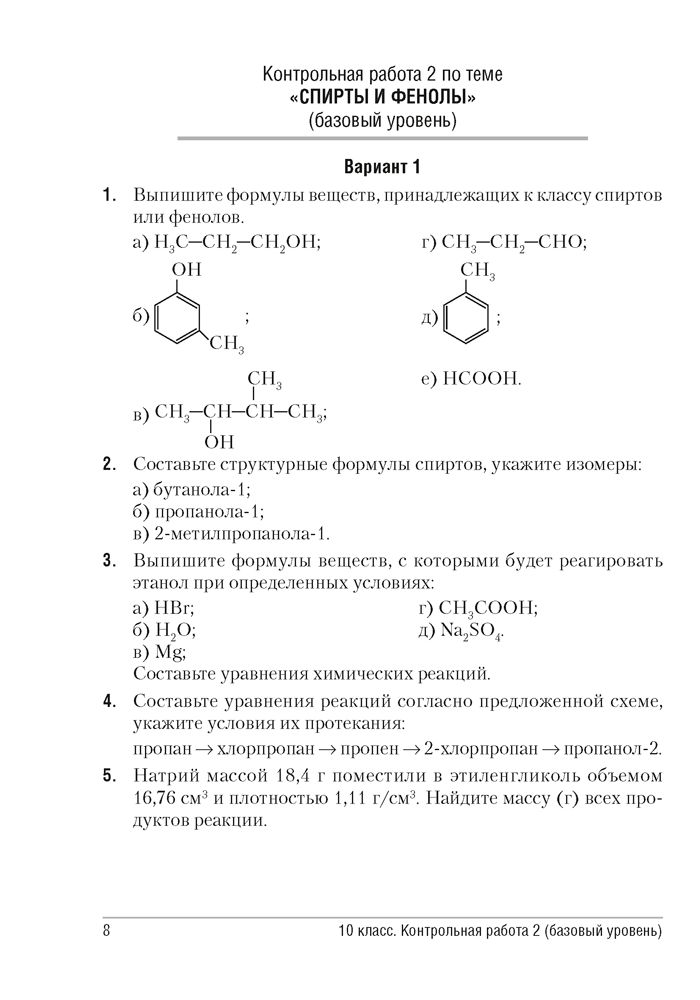 (1 балл) В каком ряду химические элементы расположены в порядке возрастания их атомных радиусов:
(1 балл) В каком ряду химические элементы расположены в порядке возрастания их атомных радиусов: (1 балл) Сульфат калия имеет формулу:
(1 балл) Сульфат калия имеет формулу: (1 балл) К 80 г 10% раствора добавили 20 г воды. Массовая доля полученного раствора равна:
(1 балл) К 80 г 10% раствора добавили 20 г воды. Массовая доля полученного раствора равна: цифры? 0,189
цифры? 0,189
 5
5 3 кПа = 1 атм = 760 мм рт. Ст. = 760 торр
3 кПа = 1 атм = 760 мм рт. Ст. = 760 торр
 увеличивается громкость увеличивается, если температура уменьшается, громкость уменьшается
увеличивается громкость увеличивается, если температура уменьшается, громкость уменьшается 314 (КПа x л) \ (моль x К)
314 (КПа x л) \ (моль x К) Свойства тригонометрических и круговых функций
Свойства тригонометрических и круговых функций  Взлом писательского раздела
Взлом писательского раздела  Решения
Решения  Измерение и анализ
Измерение и анализ  Взлом SAT: продвинутые принципы
Взлом SAT: продвинутые принципы  Очерк
Очерк  Обзорные вопросы
Обзорные вопросы  Колебания
Колебания  Обзорные вопросы
Обзорные вопросы  Оптика
Оптика  Решения вопросов обзора главы
Решения вопросов обзора главы  Введение в химию
Введение в химию  Склеивание
Склеивание  Газы и газовые законы
Газы и газовые законы  Жидкости, твердые вещества и фазовые переходы
Жидкости, твердые вещества и фазовые переходы  Скорость химических реакций
Скорость химических реакций  Окисление-восстановление и электрохимия
Окисление-восстановление и электрохимия  Лаборатория
Лаборатория  Введение
Введение  Молекулы биологии
Молекулы биологии  Митоз и мейоз
Митоз и мейоз  Органные системы
Органные системы  Растения
Растения  Практика SAT Biology E / M предметный тест 2
Практика SAT Biology E / M предметный тест 2