Административная контрольная работа по химии 11 класс
Административная контрольная работа по химии за 1 полугодие (11 класс).
Вариант 1.
Часть А.
При выполнении заданий А1-А10 из предложенных вариантов ответов выберите тот, который вы считаете правильным. 1 балл за каждое верно выполненное задание.
1. Сколько электронов находится на внешнем энергетическом уровне в атоме кислорода:
1)3
2) 4
3)6
4)8.
594233090169002. Определите коэффициент перед окислителем в уравнении реакции по схеме: Al + h3SO4 Al2(SO4)3 + h3
1) 3
2) 1
3) 4
4) 2
3. Максимальное число электронов, которое может быть размещено на первом электронном уровне, равно 2-м, на втором – 8-ти, на третьем – …
1) 12;
2) 14;
3) 16;
4) 18.
4. Электронная конфигурация … 4s 24р5 соответствует элементу:
1) бром
2) криптон
3) кадмий
4) цинк.

5. Степень окисления хлора в соединении HClО4 равна:
1) +2;
2) +7;
3) +6;
4) –2
6. Азот имеет одинаковую степень окисления в каждом из двух соединений:1)Nh4,N2O3;2)HNO2,Li3N;3)Mg3N2,Nh4;4)Nh4, HNO2.
7. Соединением с ковалентной неполярной связью является:
1) N2O
2) S8
3) Na2O
4) SO2
8. Масса 28 г железа соответствует количеству этого вещества (в моль), равному
1) 10
2) 0,5
3) 1
9. Краткому ионному уравнению реакции Ba2+ + SO42- = BaSO4 соответствует молекулярное уравнение.
1) Na2SO4 + Ba(OH)2 = BaSO4 + 2NaOH
2) BaO + h3SO4 = BaSO4 + h3O
3) BaCO3 + h3SO4 = BaSO4+ CO2 + h3O
4) СаSO4 + BaCL2 = BaSO4+СаCL2
Часть В:
1. Установите соответствие между типом химической связи и формулой вещества:
Тип химической связи: Формула вещества:
Контрольная работа по химии №1 11 класс
Ва 11 класс
Контрольная работа №1
Вариант
1 Укажите сколько простых веществ указано в приведённом перечне:
1) CaO 2) NaCl 3) S8 4) h3O 5) N2 6) CuS 7) Ag 8) IF5
а) одно б) два в) три г) четыре д) пять е) шесть
2
Элемент находится в третьем периоде, шестой группе.




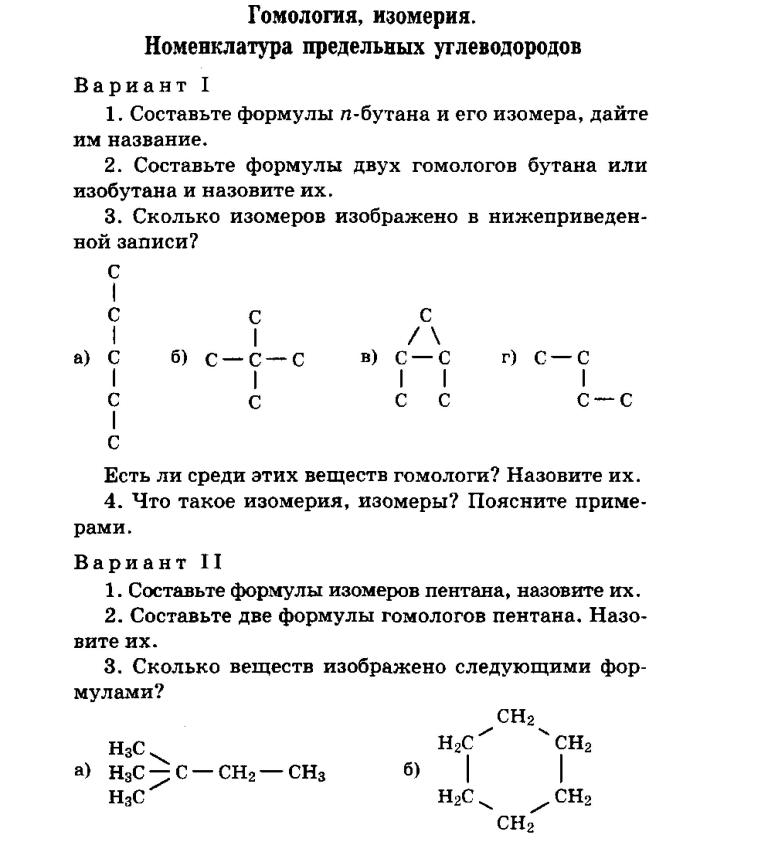
 ∑ = 20
1б
1б
1б
1б
4б
6б
3б
3б
1
2
3
4
5
6
7
8
20 – 18
5
17 — 15
4
14 — 10
3
9 — 1
2
Работа не сдана
1 11 класс
Контрольная работа №1
Вариант
Укажите формулу вещества имеющего молекулярное строение
а) MgO б) CaO в) h3O г) KF д) AlCl3
Укажите число не спаренных электронов у атома фосфора в основном состоянии
а) 1 б) 2 в) 3 г) 4 д) 5 е) 6 ё) 7 ж) 8
Укажите факторы влияющие на скорость химической реакции: СаО(к) + Н2О(ж) =Са(ОН)2(рр) + Q
а) температура б) концентрация кислорода в) площадь поверхности г) цвет реактора
д) скорость пропускания газов через контактный аппарат
1) а, б, в 2) а, в, г 3) а, г, д 4) б, в, г 5) б, в, д 6) а, б, г
Укажите название вещества используемого в виде сырья в производстве гашённой извести
а) гипс б) известняк в) железный колчедан г) английская соль д) азот
Приведите в соответствие закон и его формулировку
А.
∑ = 20
1б
1б
1б
1б
4б
6б
3б
3б
1
2
3
4
5
6
7
8
20 – 18
5
17 — 15
4
14 — 10
3
9 — 1
2
Работа не сдана
1 11 класс
Контрольная работа №1
Вариант
Укажите формулу вещества имеющего молекулярное строение
а) MgO б) CaO в) h3O г) KF д) AlCl3
Укажите число не спаренных электронов у атома фосфора в основном состоянии
а) 1 б) 2 в) 3 г) 4 д) 5 е) 6 ё) 7 ж) 8
Укажите факторы влияющие на скорость химической реакции: СаО(к) + Н2О(ж) =Са(ОН)2(рр) + Q
а) температура б) концентрация кислорода в) площадь поверхности г) цвет реактора
д) скорость пропускания газов через контактный аппарат
1) а, б, в 2) а, в, г 3) а, г, д 4) б, в, г 5) б, в, д 6) а, б, г
Укажите название вещества используемого в виде сырья в производстве гашённой извести
а) гипс б) известняк в) железный колчедан г) английская соль д) азот
Приведите в соответствие закон и его формулировку
А. Масса веществ вступивших в химическую реакцию
равна массе веществ образовавшихся в ходе
химической реакции
Б. Состав сложного вещества постоянен независимо от
способа, места и времени получения
В. В равных объёмах различных газов при одинаковых
условиях содержится одинаковое число молекул
Г. Свойства простых веществ образованных атомами
химических элементов, а также их соединений находятся в
периодической зависимости от зарядов их ядер
Охарактеризуйте химическую реакцию CaCO3(к) = CO2(г) + СaО(к) ΔH 0˃
1.а) соединения б) разложения в) замещения г) обмена 2. а) гомогенная б) гетерогенная
3. а) каталитическая б) некаталитическая 4. а) обратимая б) необратимая
3.Закон постоянства состава
вещества
4.Закон сохранения массы
веществ в химических реакциях
1.Периодический закон
2.Закон Авогадро
5.а) экзотермическая б) эндотермическая
6. а) окислительновосстановительная б) без изменения степеней окисления
Запишите уравнение реакции гидролиза этилового эфира уксусной кислоты
Определите молярную концентрацию раствора серной кислоты с массовой долей растворённого
вещества 19,6% и плотностью равной 1,15 г/мл.
Масса веществ вступивших в химическую реакцию
равна массе веществ образовавшихся в ходе
химической реакции
Б. Состав сложного вещества постоянен независимо от
способа, места и времени получения
В. В равных объёмах различных газов при одинаковых
условиях содержится одинаковое число молекул
Г. Свойства простых веществ образованных атомами
химических элементов, а также их соединений находятся в
периодической зависимости от зарядов их ядер
Охарактеризуйте химическую реакцию CaCO3(к) = CO2(г) + СaО(к) ΔH 0˃
1.а) соединения б) разложения в) замещения г) обмена 2. а) гомогенная б) гетерогенная
3. а) каталитическая б) некаталитическая 4. а) обратимая б) необратимая
3.Закон постоянства состава
вещества
4.Закон сохранения массы
веществ в химических реакциях
1.Периодический закон
2.Закон Авогадро
5.а) экзотермическая б) эндотермическая
6. а) окислительновосстановительная б) без изменения степеней окисления
Запишите уравнение реакции гидролиза этилового эфира уксусной кислоты
Определите молярную концентрацию раствора серной кислоты с массовой долей растворённого
вещества 19,6% и плотностью равной 1,15 г/мл. ∑ = 20
1б
1б
1б
1б
4б
6б
3б
3б
1
2
3
4
5
6
7
8
20 – 18
5
17 — 15
4
14 — 10
3
9 — 1
2
Работа не сдана
1 11 класс
Контрольная работа №1
Вариант
1 Укажите число электронных оболочек у атома железа
а) 1 б) 2 в) 3 г) 4 д) 5 е) 6 ё) 7 ж) 8
2 Укажите название вещества используемого в виде сырья в производстве не гашённой
извести
а) гипс б) известняк в) железный колчедан г) английская соль
д) азот
3 Укажите возможные степени окисления атомов селена
а) +1 б) +1,+3 в) +1,+3,+5 г) +1,+3,+5,+7 д) 2 е) 2,0,+4 ё)
2,0,+4,+6
4 Укажите факторы влияющие на скорость химической реакции: 2СО(г) + О2(г) = 2СО2(г) + Q
а) температура б) концентрация кислорода в) площадь поверхности г)
давление д) скорость пропускания газов через контактный аппарат е) наличие
катализатора
1) а, б, в 2) а, в, г 3) а, г, д 4) б, в, г 5) б, в, д 6) а, б, г
5 Приведите в соответствие тип раствора и его характеристику
А.
∑ = 20
1б
1б
1б
1б
4б
6б
3б
3б
1
2
3
4
5
6
7
8
20 – 18
5
17 — 15
4
14 — 10
3
9 — 1
2
Работа не сдана
1 11 класс
Контрольная работа №1
Вариант
1 Укажите число электронных оболочек у атома железа
а) 1 б) 2 в) 3 г) 4 д) 5 е) 6 ё) 7 ж) 8
2 Укажите название вещества используемого в виде сырья в производстве не гашённой
извести
а) гипс б) известняк в) железный колчедан г) английская соль
д) азот
3 Укажите возможные степени окисления атомов селена
а) +1 б) +1,+3 в) +1,+3,+5 г) +1,+3,+5,+7 д) 2 е) 2,0,+4 ё)
2,0,+4,+6
4 Укажите факторы влияющие на скорость химической реакции: 2СО(г) + О2(г) = 2СО2(г) + Q
а) температура б) концентрация кислорода в) площадь поверхности г)
давление д) скорость пропускания газов через контактный аппарат е) наличие
катализатора
1) а, б, в 2) а, в, г 3) а, г, д 4) б, в, г 5) б, в, д 6) а, б, г
5 Приведите в соответствие тип раствора и его характеристику
А. Мутный, характерен эффект Тиндаля, при стоянии разделяется 1. Истинный
раствор
на два слоя жидкости
Б. Мутный, характерен эффект Тиндаля, при фильтровании через 2. Суспензия
бумажный фильтр, на фильтре обнаруживается осадок
В. Прозрачный, при фильтровании через пергаментную бумагу 3. Эмульсия
на фильтре нет осадка
4. Коллоидный
раствор
6 Охарактеризуйте химическую реакцию CaCl2(к) + h3SO4(ж) = CaSO4(рр) + 2HCl(г)↑ ΔH 0˂
1.а) соединения б) разложения в) замещения г) обмена 2. а) гомогенная б) гетерогенная
3. а) каталитическая б) некаталитическая 4. а) обратимая б) необратимая
5.а) экзотермическая б) эндотермическая
6. а) окислительновосстановительная б) без изменения степеней окисления
Запишите уравнение реакции гидролиза этилового эфира уксусной кислоты
7
8 Определите молярную концентрацию раствора серной кислоты с массовой долей
растворённого вещества 19,6% и плотностью равной 1,15 г/мл.
Мутный, характерен эффект Тиндаля, при стоянии разделяется 1. Истинный
раствор
на два слоя жидкости
Б. Мутный, характерен эффект Тиндаля, при фильтровании через 2. Суспензия
бумажный фильтр, на фильтре обнаруживается осадок
В. Прозрачный, при фильтровании через пергаментную бумагу 3. Эмульсия
на фильтре нет осадка
4. Коллоидный
раствор
6 Охарактеризуйте химическую реакцию CaCl2(к) + h3SO4(ж) = CaSO4(рр) + 2HCl(г)↑ ΔH 0˂
1.а) соединения б) разложения в) замещения г) обмена 2. а) гомогенная б) гетерогенная
3. а) каталитическая б) некаталитическая 4. а) обратимая б) необратимая
5.а) экзотермическая б) эндотермическая
6. а) окислительновосстановительная б) без изменения степеней окисления
Запишите уравнение реакции гидролиза этилового эфира уксусной кислоты
7
8 Определите молярную концентрацию раствора серной кислоты с массовой долей
растворённого вещества 19,6% и плотностью равной 1,15 г/мл. 1б
1б
1б
1б
4б
6б
3б
3б
∑ = 20
Работа не
20 – 18
17 — 15
14 — 10
9 — 1
5
4
3
2
сдана
1 11 класс
Контрольная работа №1
Вариант
1 Укажите химический знак элемента высший оксид которого обладает наиболее
выраженными кислотными свойствами
а) Zn б) Ca в) Ba г) N д) H е) Li ё) Ti ж)
S
2 Укажите в какую сторону сместится равновесие в химической реакции:
4↔ NO(г) + 6Н2О(г) + Q при повышении концентрации кислорода
4NН3(г) + 5O2(г)
а) это необратимая реакция б) продуктов реакции в) исходных веществ
г) на равновесие не влияет
3 Укажите число полностью заполненных атомных орбиталей у атома фтора в возбуждённом
состоянии
а) 1 б) 2 в) 3 г) 4 д) 5 е) 6 ё) 7 ж) 8
4 Укажите среду раствора хлоридной кислоты
˃
˂
1.
1б
1б
1б
1б
4б
6б
3б
3б
∑ = 20
Работа не
20 – 18
17 — 15
14 — 10
9 — 1
5
4
3
2
сдана
1 11 класс
Контрольная работа №1
Вариант
1 Укажите химический знак элемента высший оксид которого обладает наиболее
выраженными кислотными свойствами
а) Zn б) Ca в) Ba г) N д) H е) Li ё) Ti ж)
S
2 Укажите в какую сторону сместится равновесие в химической реакции:
4↔ NO(г) + 6Н2О(г) + Q при повышении концентрации кислорода
4NН3(г) + 5O2(г)
а) это необратимая реакция б) продуктов реакции в) исходных веществ
г) на равновесие не влияет
3 Укажите число полностью заполненных атомных орбиталей у атома фтора в возбуждённом
состоянии
а) 1 б) 2 в) 3 г) 4 д) 5 е) 6 ё) 7 ж) 8
4 Укажите среду раствора хлоридной кислоты
˃
˂
1.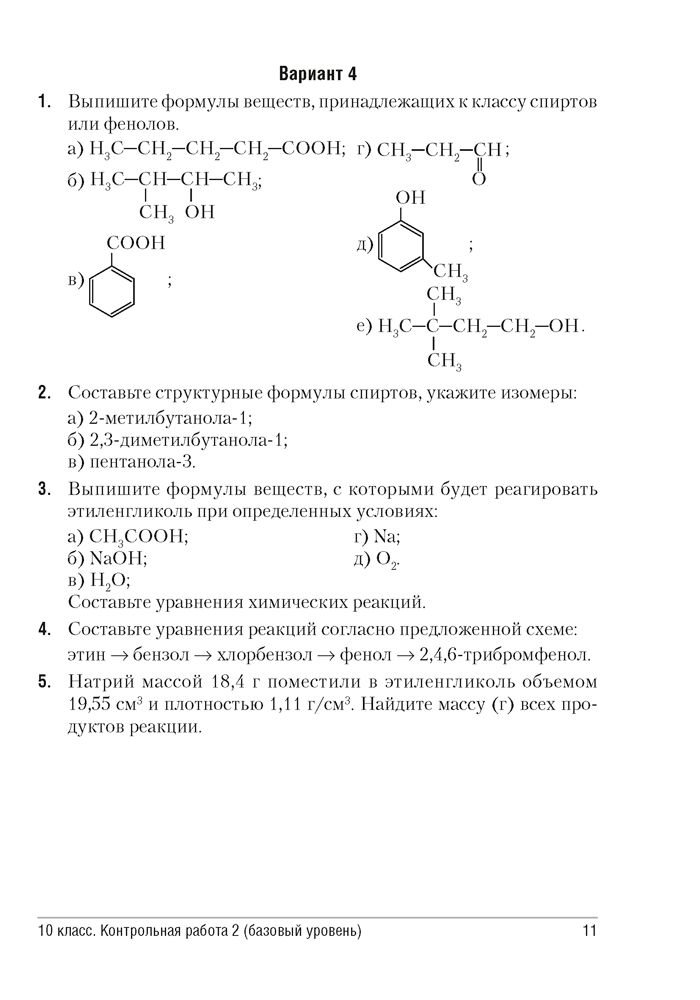 Атомная
а) рН 7 б) рН 7 в) рН = 7 г) периодически изменяется
Приведите в соответствие свойства вещества и тип его кристаллической решётки
А. Твёрдое, хрупкое вещество без запаха, часто
растворимое в воде, раствор проводит электрический ток
Б. Твёрдое пластичное вещество без запаха, хорошо
проводит тепло и электрический ток
В. Летучее вещество с резким запахом с низкой
температурой кипения
Г. Очень твёрдое вещество с очень высокой температурой
плавления, хрупкое, полупроводник
Охарактеризуйте химическую реакцию CuO(к) + h3SO4(рр) = h3O(ж) + СuSO4(рр) ΔH 0˂
1.а) соединения б) разложения в) замещения г) обмена 2. а) гомогенная б) гетерогенная
3. а) каталитическая б) некаталитическая 4. а) обратимая б) необратимая
2. Металлическая
4. Молекулярная
3. Ионная
5.а) экзотермическая б) эндотермическая
6. а) окислительновосстановительная б) без изменения степеней окисления
Запишите уравнение реакции взаимодействия хлорида бария и сульфата цинка в
молекулярном и ионном виде.
Атомная
а) рН 7 б) рН 7 в) рН = 7 г) периодически изменяется
Приведите в соответствие свойства вещества и тип его кристаллической решётки
А. Твёрдое, хрупкое вещество без запаха, часто
растворимое в воде, раствор проводит электрический ток
Б. Твёрдое пластичное вещество без запаха, хорошо
проводит тепло и электрический ток
В. Летучее вещество с резким запахом с низкой
температурой кипения
Г. Очень твёрдое вещество с очень высокой температурой
плавления, хрупкое, полупроводник
Охарактеризуйте химическую реакцию CuO(к) + h3SO4(рр) = h3O(ж) + СuSO4(рр) ΔH 0˂
1.а) соединения б) разложения в) замещения г) обмена 2. а) гомогенная б) гетерогенная
3. а) каталитическая б) некаталитическая 4. а) обратимая б) необратимая
2. Металлическая
4. Молекулярная
3. Ионная
5.а) экзотермическая б) эндотермическая
6. а) окислительновосстановительная б) без изменения степеней окисления
Запишите уравнение реакции взаимодействия хлорида бария и сульфата цинка в
молекулярном и ионном виде. 8 К 200 мл. раствора гидроксида натрия с плотностью равной 1,2 г/мл. с массовой долей
растворённого вещества равной 40% прилили 150 мл. воды. Определите молярную
концентрацию полученного раствора гидроксида натрия.
∑ = 20
Работа не
20 – 18
17 — 15
14 — 10
9 — 1
5
6
7
5
4
3
2
сдана
1
1б
1б
1б
1б
4б
6б
3б
3б 11 класс
Контрольная работа №1
Вариант
1 Укажите последовательность стадий производства серной кислоты: а) гидратация SO3
б) обжиг серного колчедана в) окисление SO2 в SO3 г) очистка SO2 от пыли
2 Укажите в какую сторону сместится равновесие в химической реакции:
2NO(г) + O2(г)
б) продуктов реакции в) исходных веществ г) на равновесие не влияет
2↔ NO2(г) +Q при повышении температуры а) это необратимая реакция
1б
1б
3
Укажите химический элемент с наиболее выраженными металлическими свойствами
1б
а) свинец б) кальций в) сера г) углерод д) кислород
4 Укажите факторы влияющие на скорость химической реакции: 3О2(г) =2О3(г) Q
5
а) температура б) концентрация кислорода в) площадь поверхности г) цвет
реактора д) скорость пропускания газов через контактный аппарат е) давление
1) а, б, в 2) а, в, г 3) а, г, д 4) б, в, г 5) б, в, д 6) а, б, е
Приведите в соответствие свойства вещества и тип его кристаллической решётки
А.
8 К 200 мл. раствора гидроксида натрия с плотностью равной 1,2 г/мл. с массовой долей
растворённого вещества равной 40% прилили 150 мл. воды. Определите молярную
концентрацию полученного раствора гидроксида натрия.
∑ = 20
Работа не
20 – 18
17 — 15
14 — 10
9 — 1
5
6
7
5
4
3
2
сдана
1
1б
1б
1б
1б
4б
6б
3б
3б 11 класс
Контрольная работа №1
Вариант
1 Укажите последовательность стадий производства серной кислоты: а) гидратация SO3
б) обжиг серного колчедана в) окисление SO2 в SO3 г) очистка SO2 от пыли
2 Укажите в какую сторону сместится равновесие в химической реакции:
2NO(г) + O2(г)
б) продуктов реакции в) исходных веществ г) на равновесие не влияет
2↔ NO2(г) +Q при повышении температуры а) это необратимая реакция
1б
1б
3
Укажите химический элемент с наиболее выраженными металлическими свойствами
1б
а) свинец б) кальций в) сера г) углерод д) кислород
4 Укажите факторы влияющие на скорость химической реакции: 3О2(г) =2О3(г) Q
5
а) температура б) концентрация кислорода в) площадь поверхности г) цвет
реактора д) скорость пропускания газов через контактный аппарат е) давление
1) а, б, в 2) а, в, г 3) а, г, д 4) б, в, г 5) б, в, д 6) а, б, е
Приведите в соответствие свойства вещества и тип его кристаллической решётки
А. Твёрдое, хрупкое вещество без запаха, часто
растворимое в воде, раствор проводит электрический ток
Б. Твёрдое пластичное вещество без запаха, хорошо
проводит тепло и электрический ток
В. Летучее вещество с резким запахом с низкой
температурой кипения
Г. Очень твёрдое вещество с очень высокой температурой
плавления, хрупкое, полупроводник
2. Металлическая
4. Молекулярная
1. Атомная
3. Ионная
6 Охарактеризуйте химическую реакцию Cu(к) + 2h3SO4(рр) = h3O(ж) + СuSO4(рр) + SO2(г)↑ ΔH ˂
0
1.а) соединения б) разложения в) замещения г) обмена 2. а) гомогенная б) гетерогенная
3. а) каталитическая б) некаталитическая 4. а) обратимая б) необратимая
5.а) экзотермическая б) эндотермическая
6. а) окислительновосстановительная б) без изменения степеней окисления
7
Запишите уравнение реакции взаимодействия хлоридной кислоты и сульфида натрия в
молекулярном и ионном виде.
8 К 400 мл. раствора гидроксида калия с плотностью равной 1,2 г/мл. с массовой долей
растворённого вещества равной 28% прилили 150 мл.
Твёрдое, хрупкое вещество без запаха, часто
растворимое в воде, раствор проводит электрический ток
Б. Твёрдое пластичное вещество без запаха, хорошо
проводит тепло и электрический ток
В. Летучее вещество с резким запахом с низкой
температурой кипения
Г. Очень твёрдое вещество с очень высокой температурой
плавления, хрупкое, полупроводник
2. Металлическая
4. Молекулярная
1. Атомная
3. Ионная
6 Охарактеризуйте химическую реакцию Cu(к) + 2h3SO4(рр) = h3O(ж) + СuSO4(рр) + SO2(г)↑ ΔH ˂
0
1.а) соединения б) разложения в) замещения г) обмена 2. а) гомогенная б) гетерогенная
3. а) каталитическая б) некаталитическая 4. а) обратимая б) необратимая
5.а) экзотермическая б) эндотермическая
6. а) окислительновосстановительная б) без изменения степеней окисления
7
Запишите уравнение реакции взаимодействия хлоридной кислоты и сульфида натрия в
молекулярном и ионном виде.
8 К 400 мл. раствора гидроксида калия с плотностью равной 1,2 г/мл. с массовой долей
растворённого вещества равной 28% прилили 150 мл. воды. Определите молярную
концентрацию полученного раствора гидроксида натрия.
∑ = 20
20 – 18
5
17 — 15
4
14 — 10
3
9 — 1
2
Работа не
сдана
1
1б
4б
6б
3б
3б 11 класс
Контрольная работа №1
Вариант
Укажите число электронов не хватающих до завершения внешнего слоя у атома селена
а) 1 б) 2 в) 3 г) 4 д) 5 е) 6 ё) 7 ж) 8
˂
˃
Укажите РН раствора гидроксида калия
а) 7 б) 7 в) = 7 г) = 14
Укажите название вещества используемого в виде сырья в производстве серной кислоты
а) гипс б) известняк в) железный колчедан г) мрамор д) азот
Укажите факторы влияющие на скорость химической реакции: 2SO2(г) + O2(г) ↔ 2SO3(г) + Q
а) температура б) давление в) площадь поверхности г) природа реагирующих веществ д)
скорость пропускания газов через контактный аппарат
1) а, б, в 2) а, в, г 3) а, г, д 4) б, в, г 5) б, в, д 6) а, б, г
Приведите в соответствие название вещества и вид химической связи в этом веществе
А.
воды. Определите молярную
концентрацию полученного раствора гидроксида натрия.
∑ = 20
20 – 18
5
17 — 15
4
14 — 10
3
9 — 1
2
Работа не
сдана
1
1б
4б
6б
3б
3б 11 класс
Контрольная работа №1
Вариант
Укажите число электронов не хватающих до завершения внешнего слоя у атома селена
а) 1 б) 2 в) 3 г) 4 д) 5 е) 6 ё) 7 ж) 8
˂
˃
Укажите РН раствора гидроксида калия
а) 7 б) 7 в) = 7 г) = 14
Укажите название вещества используемого в виде сырья в производстве серной кислоты
а) гипс б) известняк в) железный колчедан г) мрамор д) азот
Укажите факторы влияющие на скорость химической реакции: 2SO2(г) + O2(г) ↔ 2SO3(г) + Q
а) температура б) давление в) площадь поверхности г) природа реагирующих веществ д)
скорость пропускания газов через контактный аппарат
1) а, б, в 2) а, в, г 3) а, г, д 4) б, в, г 5) б, в, д 6) а, б, г
Приведите в соответствие название вещества и вид химической связи в этом веществе
А. Вода 1. Ионная
Б. Оксид серебра 2. Металлическая
В. Водород 3. Ковалентная неполярная
Г. Медь 4. Ковалентная полярная
5. Водородная
Охарактеризуйте химическую реакцию CaCO3(к) + CO2(г) + h3O(ж) = Сa(HCO3)2(рр) ΔH 0˂
1.а) соединения б) разложения в) замещения г) обмена 2. а) гомогенная б) гетерогенная
3. а) каталитическая б) некаталитическая 4. а) обратимая б) необратимая
5.а) экзотермическая б) эндотермическая 6. а) окислительновосстановительная б) без изменения
степеней окисления
Уравнение реакции взаимодействия гидроксида натрия и серной кислоты запишите в молекулярном и ионном
виде.
Определите молярную концентрацию раствора азотной кислоты с массовой долей растворённого вещества
25,2% и плотностью равной 1,15 г/мл.
Вода 1. Ионная
Б. Оксид серебра 2. Металлическая
В. Водород 3. Ковалентная неполярная
Г. Медь 4. Ковалентная полярная
5. Водородная
Охарактеризуйте химическую реакцию CaCO3(к) + CO2(г) + h3O(ж) = Сa(HCO3)2(рр) ΔH 0˂
1.а) соединения б) разложения в) замещения г) обмена 2. а) гомогенная б) гетерогенная
3. а) каталитическая б) некаталитическая 4. а) обратимая б) необратимая
5.а) экзотермическая б) эндотермическая 6. а) окислительновосстановительная б) без изменения
степеней окисления
Уравнение реакции взаимодействия гидроксида натрия и серной кислоты запишите в молекулярном и ионном
виде.
Определите молярную концентрацию раствора азотной кислоты с массовой долей растворённого вещества
25,2% и плотностью равной 1,15 г/мл. 1б
1б
1б
1б
4б
6б
3б
3б
∑ = 20
20 – 18
5
17 — 15
4
14 — 10
3
9 — 1
2
Работа не сдана
1
11 класс
Контрольная работа №1
Вариант
Укажите число электронов не хватающих до завершения внешнего слоя у атома селена
а) 1 б) 2 в) 3 г) 4 д) 5 е) 6 ё) 7 ж) 8
˂
˃
Укажите РН раствора гидроксида калия
а) 7 б) 7 в) = 7 г) = 14
Укажите название вещества используемого в виде сырья в производстве серной кислоты
а) гипс б) известняк в) железный колчедан г) мрамор д) азот
Укажите факторы влияющие на скорость химической реакции: 2SO2(г) + O2(г) ↔ 2SO3(г) + Q
а) температура б) давление в) площадь поверхности г) природа реагирующих веществ д)
скорость пропускания газов через контактный аппарат
1) а, б, в 2) а, в, г 3) а, г, д 4) б, в, г 5) б, в, д 6) а, б, г
Приведите в соответствие название вещества и вид химической связи в этом веществе
А.
1б
1б
1б
1б
4б
6б
3б
3б
∑ = 20
20 – 18
5
17 — 15
4
14 — 10
3
9 — 1
2
Работа не сдана
1
11 класс
Контрольная работа №1
Вариант
Укажите число электронов не хватающих до завершения внешнего слоя у атома селена
а) 1 б) 2 в) 3 г) 4 д) 5 е) 6 ё) 7 ж) 8
˂
˃
Укажите РН раствора гидроксида калия
а) 7 б) 7 в) = 7 г) = 14
Укажите название вещества используемого в виде сырья в производстве серной кислоты
а) гипс б) известняк в) железный колчедан г) мрамор д) азот
Укажите факторы влияющие на скорость химической реакции: 2SO2(г) + O2(г) ↔ 2SO3(г) + Q
а) температура б) давление в) площадь поверхности г) природа реагирующих веществ д)
скорость пропускания газов через контактный аппарат
1) а, б, в 2) а, в, г 3) а, г, д 4) б, в, г 5) б, в, д 6) а, б, г
Приведите в соответствие название вещества и вид химической связи в этом веществе
А. Вода 1. Ионная
Б. Оксид серебра 2. Металлическая
В. Водород 3. Ковалентная неполярная
Г. Медь 4. Ковалентная полярная
5. Водородная
Охарактеризуйте химическую реакцию CaCO3(к) + CO2(г) + h3O(ж) = Сa(HCO3)2(рр) ΔH 0˂
1.а) соединения б) разложения в) замещения г) обмена 2. а) гомогенная б) гетерогенная
3. а) каталитическая б) некаталитическая 4. а) обратимая б) необратимая
1б
1б
1б
1б
4б
6б
1
2
3
4
5
6
7
8
1
2
3
4
5
6 5.а) экзотермическая б) эндотермическая 6. а) окислительновосстановительная б) без изменения
степеней окисления
Уравнение реакции взаимодействия гидроксида натрия и серной кислоты запишите в молекулярном и ионном
виде.
Определите молярную концентрацию раствора азотной кислоты с массовой долей растворённого вещества
25,2% и плотностью равной 1,15 г/мл.
Вода 1. Ионная
Б. Оксид серебра 2. Металлическая
В. Водород 3. Ковалентная неполярная
Г. Медь 4. Ковалентная полярная
5. Водородная
Охарактеризуйте химическую реакцию CaCO3(к) + CO2(г) + h3O(ж) = Сa(HCO3)2(рр) ΔH 0˂
1.а) соединения б) разложения в) замещения г) обмена 2. а) гомогенная б) гетерогенная
3. а) каталитическая б) некаталитическая 4. а) обратимая б) необратимая
1б
1б
1б
1б
4б
6б
1
2
3
4
5
6
7
8
1
2
3
4
5
6 5.а) экзотермическая б) эндотермическая 6. а) окислительновосстановительная б) без изменения
степеней окисления
Уравнение реакции взаимодействия гидроксида натрия и серной кислоты запишите в молекулярном и ионном
виде.
Определите молярную концентрацию раствора азотной кислоты с массовой долей растворённого вещества
25,2% и плотностью равной 1,15 г/мл. 7
8
3б
3б
∑ = 20
20 – 18
5
17 — 15
4
14 — 10
3
9 — 1
2
Работа не сдана
1
7
8
3б
3б
∑ = 20
20 – 18
5
17 — 15
4
14 — 10
3
9 — 1
2
Работа не сдана
1РАЗРАБОТКИ | В категории разработок: 73 Фильтр по целевой аудитории — Целевая аудитория -для 1 классадля 2 классадля 3 классадля 4 классадля 5 классадля 6 классадля 7 классадля 8 классадля 9 классадля 10 классадля 11 классадля учителядля классного руководителядля дошкольниковдля директорадля завучейдля логопедадля психологадля соц.педагогадля воспитателя Всероссийская проверочная работа (ВПР) предназначена для итоговой оценки образовательных достижений выпускников средней школы, изучавших химию на базовом уровне.
Целевая аудитория: для 11 класса Всероссийские проверочные работы (ВПР) проводятся с учетом национально-культурной и языковой специфики многонационального российского общества в целях осуществления мониторинга результатов перехода на ФГОС и направлены на выявление качества подготовки обучающихся.
Целевая аудитория: для 8 класса Олимпиада по химии для учащихся 10 класса состоит из 6 заданий. В итоговую оценку из 6 задач засчитываются 5 решений, за которые участник набрал наибольшие баллы, то есть одна из задач с наименьшим баллом не учитывается. За каждое правильно выполненное задание можно получить от 1 до 10 баллов. На выполнение работы отводится 180 минут. Специальное оборудование для выполнения работы не требуется. Разрешено использовать непрограммируемый калькулятор, периодическую систему химических элементов, таблицу растворимости кислот, солей и оснований в воде и ряд активности металлов/электрохимический ряд напряжений.
Источник
Целевая аудитория: для 10 класса Олимпиада по химии для учащихся 9 класса состоит из 6 заданий. В итоговую оценку из 6 задач засчитываются 5 решений, за которые участник набрал наибольшие баллы, то есть одна из задач с наименьшим баллом не учитывается. За каждое правильно выполненное задание можно получить от 1 до 10 баллов.Ща выполнение работы отводится 180 минут. Специальное оборудование для выполнения работы не требуется. Разрешено использовать непрограммируемый калькулятор, периодическую систему химических элементов, таблицу растворимости кислот, солей и оснований в воде и ряд активности металлов/электрохимический ряд напряжений.
Источник Целевая аудитория: для 9 класса Олимпиада по химии для учащихся 8 класса состоит из 6 заданий. В итоговую оценку из 6 задач засчитываются 5 решений, за которые участник набрал наибольшие баллы, то есть одна из задач с наименьшим баллом не учитывается.
Источник Целевая аудитория: для 8 класса Проверочная работа включает в себя 15 заданий. На выполнение работы по химии отводится 1 час 30 минут (90 минут).
Целевая аудитория: для 11 класса Диагностическая работа состоит из двух частей, включающих в себя 14 заданий. Представлено два варианта работы. Есть ответы.
Целевая аудитория: для 10 класса Диагностическая работа состоит из двух частей, включающих в себя 9 заданий. Часть 1 содержит 7 заданий с кратким ответом, часть 2 содержит 2 задания с развёрнутым ответом. Представлено четыре варианта работы. Есть ответы.
Целевая аудитория: для 10 класса Диагностическая работа состоит из двух частей, включающих в себя 11 заданий. Часть 1 содержит 10 заданий с кратким ответом, часть 2 содержит 1 задание с развёрнутым ответом. Представлено четыре варанта работы. Есть ответы.
Целевая аудитория: для 9 класса В архиве опубликованы:
Целевая аудитория: для 11 класса | Конкурсы Диплом и справка о публикации каждому участнику! |
ХИМИЯ. Опорные конспекты на сайте УЧИТЕЛЬ.ПРО
Конспекты по предмету «ХИМИЯ»
Изучение Химии шаг за шагом. Онлайн-учебник и сборник задач.
Химия – это наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения.
Кодификатор ОГЭ Проверить знания Выбрать репетитора
Химия 8 класс
Первоначальные химические понятия. Кислород. Горение. Водород. Вода. Растворы. Количественные отношения в химии. Важнейшие классы неорганических соединений. Периодический закон и строение атома. Строение вещества. Химическая связь.
Кислород. Горение. Водород. Вода. Растворы. Количественные отношения в химии. Важнейшие классы неорганических соединений. Периодический закон и строение атома. Строение вещества. Химическая связь.
- Вещества и их свойства. Чистые вещества и смеси
- Физические и химические явления
- Атомы, молекулы и ионы
- Простые и сложные вещества
- Химические элементы и их знаки
- Относительная атомная масса
- Закон постоянства состава веществ
- Химическая формула. Индекс. Коэффициент
- Массовая доля элемента в соединении
- Химия 8 класс. Все формулы и определения
- Оксиды (названия, классификация, получение)
- Свойства оксидов
- Основания (названия, получение, свойства)
- Строение атома. Массовое число
- Строение электронных оболочек атомов
- Периодическая система химических элементов
- Закономерности изменения свойств элементов
- Строение веществ. Электроотрицательность
- Химическая связь: ковалентная, ионная, металлическая
- Валентность химических элементов
- Определение валентности + примеры
- Кислород: характеристика, свойства, получение
- Кислоты: классификация, свойства, получение
- Соли: классификация, свойства, получение
- Амфотерные оксиды и гидроксиды
- Водород: характеристика, получение
- Химические свойства водорода.
 Применение
Применение - Вода. Свойства воды. Водные растворы
Химия 9 класс
Электролитическая диссоциация. Кислород и сера. Азот и фосфор. Углерод и кремний. Общие свойства металлов. Металлы IA—IIIA-групп периодической таблицы химических элементов. Железо. Металлургия. Краткий обзор важнейших органических веществ (Углеводороды, производные углеводородов).
(остальные конспекты готовятся к публикации)
Химия 10 класс. КонтрольныеОГЭ по Химии
- Химическая реакция (справочник для ОГЭ)
Решения задач по химии
(скоро будут ещё)
Проверить свои знания Подобрать репетитора
Источники идей и источники цитат для конспектов по Химии:
- Учебник по химии для 8 класса / Г. Е. Рудзитис, Ф. Г. Фельдман. — М. : Просвещение.
- Учебник по химии для 9 класса / Г.
 Е. Рудзитис, Ф. Г. Фельдман. — М. : Просвещение.
Е. Рудзитис, Ф. Г. Фельдман. — М. : Просвещение. - Ковалевская Н.Б. ХИМИЯ в таблицах и схемах. 8 класс. Для самостоятельной работы в школе и дома — М.: «Издат-Школа XXI век», 2004.
- ОГЭ. Универсальный справочник по химии / Е.Ю. Шапаренко. — Москва : Эксмо.
- Задачи по химии и способы их решения. 8—9 кл. / О. С. Габриелян, П. В. Решетов, И. Г. Остроумов. — М.: Дрофа.
- Сборник задач и упражнений по химии: Школьный курс / В. В. Еремин, Н. Е. Кузьменко. — М.: ООО «Издательский дом «ОНИКС 21 век»: ООО «Издательство «Мир и Образование», 2005
- Справочник по химии: 8-9 классы. ФГОС / А.Д. Микитюк — М.: Издательство «Экзамен», 2019
- ЕГЭ. Химия: алгоритмы выполнения типовых заданий / Е.В. Крышилович, В.А. Мостовых — М.: Эксмо, 2018
- Химия. Самоучитель. Книга для тех, кто хочет сдать экзамены, а также понять и полюбить химию / Е. Н. Френкель. — Москва : Издательство АСТ, 2017
(с) Цитаты из вышеуказанных учебных пособий использованы на сайте в незначительных объемах, исключительно в учебных и информационных целях (пп. 1 п. 1 ст. 1274 ГК РФ).
1 п. 1 ст. 1274 ГК РФ).
ГДЗ по Химии 11 класс контрольные и проверочные работы Габриелян Базовый уровень
Решебники, ГДЗ
- 1 Класс
- Математика
- Русский язык
- Английский язык
- Информатика
- Немецкий язык
- Литература
- Человек и мир
- Природоведение
- Основы здоровья
- Музыка
- Окружающий мир
- Технология
- 2 Класс
- Математика
- Русский язык
- Белорусский язык
- Английский язык
- Информатика
- Украинский язык
- Французский язык
- Немецкий язык
- Литература
- Человек и мир
- Природоведение
- Основы здоровья
- Музыка
- Окружающий мир
- Технология
- Испанский язык
- 3 Класс
- Математика
- Русский язык
- Белорусский язык
- Английский язык
- Информатика
- Украинский язык
- Французский язык
- Немецкий язык
- Литература
- Человек и мир
ГДЗ по химии 11 класс контрольные работы Габриелян О. С. Углубленный уровень
С. Углубленный уровень
Некоторым выпускникам настолько нравится химия, что они выбирают этот предмет на экзамене. Подготовиться к аттестации они смогут с ГДЗ по химии 11 класс Контрольные работы, Углубленный уровень Габриелян . На последних этапах обучения, дети выполняют много практических заданий. Именно на практике материал можно усвоить полноценно. Они проводят эксперименты, оформляют результаты в виде задач, составляют уравнения реакций, формулируют выводы. Все темы старшеклассники изучают на более углубленном уровне. Это значит, что им потребуются теория не только из школьного учебника, но и дополнительной литературы. При поиске ответов в интернете, подросток может потеряться в разнообразии источников. Чтобы избежать пустой траты времени, рекомендуется воспользоваться решебником.
Чем может помочь онлайн-учебник по химии 11 класс кр Углубленный уровень Габриелян
В ГДЗ рассматривается двадцать один вид проверочных работ по два варианта. А также даются четыре разноуровневых варианта для итоговой контрольной работы. Все решения имеют верные ответы, подробные инструкции, образцы примеров. После выбора номера работы, перед учеником откроется тестирование, которое построено по типу ЕГЭ. В тесте присутствуют задачи с выбором ответа, кратким ответом и подробным решением. Также к некоторым упражнениям приводятся схемы и рисунки, которые позволяют более наглядно и ярче представить материал. С помощью пособия обучающийся легко разберется в теме и подготовится к проверке. Главное при работе над домашним заданием помнить о том, что бездумное списывание, для получения отличной оценки, не поможет усвоить материал. Не стоит заучивать готовые ответы. Ведь учитель, зная о решебнике, может легко поменять условие. Поэтому лучше проработать самостоятельно тест, свериться с решебником и при необходимости найти похожие задания для закрепления материала. Преимущества онлайн-шпаргалки:
А также даются четыре разноуровневых варианта для итоговой контрольной работы. Все решения имеют верные ответы, подробные инструкции, образцы примеров. После выбора номера работы, перед учеником откроется тестирование, которое построено по типу ЕГЭ. В тесте присутствуют задачи с выбором ответа, кратким ответом и подробным решением. Также к некоторым упражнениям приводятся схемы и рисунки, которые позволяют более наглядно и ярче представить материал. С помощью пособия обучающийся легко разберется в теме и подготовится к проверке. Главное при работе над домашним заданием помнить о том, что бездумное списывание, для получения отличной оценки, не поможет усвоить материал. Не стоит заучивать готовые ответы. Ведь учитель, зная о решебнике, может легко поменять условие. Поэтому лучше проработать самостоятельно тест, свериться с решебником и при необходимости найти похожие задания для закрепления материала. Преимущества онлайн-шпаргалки:
- на сайт можно зайти с любого устройства;
- вся необходимая информация собрана в одном месте;
- к некоторым задачам предлагается несколько вариантов решения;
- приводится правильное оформление задачи.

Систематическое использование ГДЗ по химии 11 класс Контрольные работы, Габриелян О.С. Дрофа, Углубленный уровень позволит с легкостью сдать экзамен. Кроме того, школьник расширит кругозор, повысит успеваемость и получит много полезной информации.
Азот и его соединения 11 класс по химии | Растворы
Аммиак Аммиак Аммиак Аммиак Аммиак
1. При каких условиях азот соединяется с водородом с образованием аммиака?
Ответ: Когда азот соединяется с водородом в объемном соотношении 1: 3 при низкой температуре и высоком давлении с железом в качестве катализатора и молибденом в качестве промотора, он образует аммиак.
N 2 + 3H 2 ↔ 2NH 3 + 92.6 кДжмоль -1
2. Что происходит, когда газообразный аммиак пропускается через нагретый CuO?
Ans — Когда газообразный аммиак проходит через нагретый CuO, он восстанавливается до газообразного азота.
3CuO + 2NH 3 → 3Cu + N 2 + 3H 2 O
3. Чем ион аммония отличается от аммиака?
Ans- Ион аммония отличается от аммиака как;
Ион аммония | Аммиак |
Это положительный ион. | Это нейтральный газ. |
В водном растворе ион аммония действует как кислота. | В водном растворе аммиак действует как основание. |
4. Покажите, что азотная кислота содержит водород.
Ans-Металлы, которые являются более электроположительными, чем водород, и располагаются над ним в электрохимической последовательности, реагируют с HNO 3 с образованием образующегося водорода.
Zn + HNO 3 → Zn (NO 3 ) 2 + 2 [H]
Когда такие металлы, как магний и марганец, реагируют с очень разбавленной азотной кислотой, они выделяют газообразный водород, который показывает, что азотная кислота содержит водород
Mg + 2HNO 3 → Mg (NO 3 ) 2 + H 2
Это показывает, что азотная кислота состоит из водорода.
5. Изобразите структуру Льюиса N 2 O 5 .
Ans — структура Льюиса N 2 O 5 :
6. Объясните, почему газ NH 3 нельзя осушать с помощью обычного осушителя, например конц. H 2 SO 4 , P 2 O 5 и CaCl 2 .
Ans — газообразный аммиак, являющийся основанием Льюиса, реагирует с H 2 SO 4 , P 2 O 5 и CaCl 2 с образованием сульфата аммония, фосфата аммония и хлорида аммония.
2NH 3 + H 2 SO 4 → (NH 4 ) 2 SO4
6NH 3 + P 2 O 5 + 3H 2 O $ \ to $ 2 (NH 4 ) 2 PO 4
2NH 3 + CaCl 2 → 2NH 3 Cl + 2Ca
Итак, газ NH 3 нельзя осушить с помощью обычного дегидратирующего агента, такого как конц. H 2 SO 4 , P 2 O 5 и CaCl 2
H 2 SO 4 , P 2 O 5 и CaCl 2
7.Что такое лабораторный тест на азотную кислоту?
Ans-лабораторный тест азотной кислоты объяснен ниже;
Свежеприготовленный раствор сульфата железа (II) добавляют к разбавленной азотной кислоте или водному раствору нитратной соли и осторожно наливают концентрированную серную кислоту вдоль стенки пробирки. На стыке двух слоев образуется темно-коричневое кольцо.
Для нитратной соли реакция будет
NO 3 — + H 2 SO 4 → HNO 3 + HSO 4 — ] * 2
2HNO 3 → 2NO + H 2 O + 3 [O]
H 2 SO 4 + 2FeSO 4 + [O] → Fe 2 (SO 4 ) 3 + H 2 O] * 3
6FeSO 4 + 5 H 2 SO 4 + NO 3 — → 3 Fe 2 (SO 4 ) 3 + 2 HSO 4 — + 4H 2 O
FeSO 4 + NO → FeSO 4 .НЕТ
Закись азота сульфат железа (коричневое кольцо)
8. Почему азотную кислоту обычно хранят в коричневых бутылях?
Ans — Азотная кислота в присутствии солнечного света приобретает желтый цвет и разлагается на оксиды, такие как газ NO 2 и газ O 2 . Чтобы этого избежать, азотную кислоту обычно хранят в темно-коричневых бутылках.
4HNO 3 → 4NO 2 ↑ + 2H 2 O + O 2 ↑
9. Как превратить газообразный аммиак в мочевину? Напишите подходящую химическую реакцию.
Ans-Когда аммиак реагирует с CO 2 при давлении около 220 атм и температуре 130-150 ° C, он дает мочевину.
CO 2 + 2NH 3 → NH 2 CO NH 2 + H 2 O
Мочевина
10. Напишите 2–2 использования i) NH 3 ii) азотной кислоты
Ответ: аммиак используется двумя способами;
i) Аммиак из-за его высокой теплоты испарения используется в холодильном оборудовании.
ii) Используется для изготовления искусственного шелка.
Азотная кислота используется для двух целей:
i) Азотная кислота используется для нитрования различных соединений, таких как бензол, с получением нитробензола.
ii) Используется в производстве удобрений, таких как нитрат аммония, основная нитрат кальция и т. Д.
11. Газ получают действием концентрированной азотной кислоты на медь. Ответить на следующие вопросы;
i) Бесцветный ли газ?
ii) Является ли газ кислым или основным?
Ans- Газ, полученный при воздействии концентрированной азотной кислоты на медь, NO 2 .2HNO 3 → H 2 O + 2NO 2 + 3 [O]
[Cu + [O] → CuO] * 3
CuO + 2HNO 3 → Cu (NO 3 ) 2 + H 2 O
3Cu + 4HNO 3 → Cu (NO 3 ) 2 + 2NO 2 + 2H 2 O
i) Газ, то есть диоксид азота, имеет красновато-коричневый цвет при высокой температуре и бесцветный при низкой температуре.
ii) NO 2 является основным газом, поскольку он имеет тенденцию растворяться в воде и выделять азотную кислоту и азотистую кислоту.
2НО 2 + H 2 O → HNO 3 + HNO 2
12) Комментарий к инертному поведению молекулы азота.
Ans-Nitrogen имеет 3 или 5 валентных электронов. Чтобы быть октетом, требуется как минимум 3 электрона, поэтому требуется тройная связь. Тройные узы очень сложно разорвать. Азот имеет очень высокий потенциал ионизации 1043 кДжмоль -1 . Таким образом, азот сохраняет полную валентную оболочку вместо того, чтобы вступать в реакцию с другими соединениями.Это называется инертным поведением азота.
13) Азот не может образовывать пентагалогениды, но фосфор образует. Объясни.
Ans — Азот не состоит из d-орбитали, поэтому он может образовывать только тригалогенид азота, но в случае фосфора d-орбиталь пуста, а s-орбиталь хорошо защищена d- и f-орбиталями. Итак, фосфор образует нестабильные пентагалогениды.
14) Что происходит, когда аммиак пропускается через раскаленный CuO?
Ans — Когда газообразный аммиак пропускают через раскаленный CuO, он превращается в газообразный азот.
3CuO + 2NH 3 → 3Cu + N 2 ↑ + 3H 2 O
15) Почему газообразный диоксид азота имеет красновато-коричневый цвет при высокой температуре и бесцветный при низкой температуре?
Ans- При низкой температуре NO 2 димеризуется в N 2 O 4 . N 2 O 4 диамагнетик, поэтому он бесцветен. Но NO 2 парамагнитен и выглядит коричневым при высокой температуре.Таким образом, газообразный диоксид азота имеет красновато-коричневый цвет при высокой температуре и бесцветный при низкой температуре.
16) Нарисуйте структуру Льюиса
i) азотная кислота
Анс-структура Льюиса HNO 3
ii) азотистая кислота.
Ans-
17) Укажите условие оптимального выхода аммиака.
Ans — Аммиак образуется в результате обратимой экзотермической реакции, в которой количество молей реагентов превышает количество молей продукта. Итак, условия для оптимального выхода аммиака:
-Низкая температура
-Высокое давление
-Наличие катализатора
-Высокая концентрация реагентов.
18) Запишите ангидриды кислот i) HNO 3 ii) HNO 2
Ans- Кислотный ангидрид HNO 3 и HNO 2 — это N 2 O 5 и N 2 O 3 .
19) Что происходит, когда NH 3 переходит в (i) раствор FeSO 4 (ii) Ртуть-нитратную бумагу?
Ans — Когда аммиак пропускают через раствор FeSO 4 , Fe 3+ выпадает в осадок, приобретая грязно-зеленый цвет.
NH 3 + H 2 O → NH 4 OH
FeSO 4 + 2NH 4 OH → Fe (OH) 2 + (NH 4 ) 2 SO 4
Из-за образования аммиачной азотнокислой ртути и мелкодисперсной ртути, аммиак при прохождении через нее превращается в бумагу из нитрата ртути в черный цвет.
Hg (NO 3 ) 2 + 2NH 3 → Hg + Hg (NH 2 ) N 3 + NH 4 NO 3
Черный ppt
Короткие ответы на вопросы:
1) Опишите экспериментально. Аммиак хорошо растворяется в воде.
Ответ — Растворимость аммиака в воде очень высока i.е. при 273К 1 объем воды может растворить 1300 объемов аммиака. Высокая растворимость аммиака в воде может быть продемонстрирована экспериментом с фонтаном, который объясняется ниже;
Аммиак наливается в сухую колбу и фиксируется через пробку, в которую очень плотно вставляются капельница с водой и трубка, заканчивающаяся жиклером. Как показано на рисунке, колба закрепляется на подставке, а трубка опускается в воду. Вода в стеклянной трубке торопится в виде фонтана, если из капельницы внутри колбы вытечет несколько капель воды.Поскольку газообразный аммиак является щелочным по природе, фенолфталеин окрашивает воду в розовый цвет, если его держать в воде в желобе.
NH 3 + H 2 O → NH 4 OH
NH 4 OH ↔ NH 4 + + OH —
Поскольку аммиак растворяется в воде, как только несколько капель воды попадают внутрь колбы, вода устремляется вверх из-за снижения давления внутри колбы.Этот эксперимент показывает, что аммиак хорошо растворяется в воде.
2) Что происходит, когда:
и. хлорид аммония нагревают с нитратом натрия.
Ans-При нагревании хлорида аммония с нитратом натрия образуются нитрат и соль аммония. Реакция представлена в химическом уравнении как;
NH 4 Cl + Na (NO 3 ) 2 → NH 4 (NO 3 ) 2 + NaCl
ii.аммиачный газ обрабатывают раствором нитрата ртути.
Ответ — Из-за образования аммиачной азотнокислой ртути и мелкодисперсной ртути, аммиак при прохождении через него превращает раствор нитрата ртути в черный цвет.
Hg (NO 3 ) 2 + 2NH 3 → Hg + Hg (NH 2 ) N 3 + NH 4 NO 3
Черный ppt
iii.газообразный аммиак реагирует с нагретым натрием?
Ans — Когда газообразный аммиак реагирует с нагретым натрием при температуре около 300 ° C, образуется газообразный натрий и водород.
Na + 2NH 3 2NaNH 2 + H 2 ↑
3) Объясните следующее:
и. исключительно высокие температуры плавления и кипения аммиака по сравнению с фосфином (PH 3 ).
Ans-Точки кипения и плавления аммиака очень высоки.Это потому, что NH 3 помимо дисперсионных сил демонстрирует водородные связи. Водородная связь увеличивает межмолекулярную силу притяжения и увеличивает как MP, так и BP. Поскольку PH 3 не имеет водородной связи, межмолекулярные силы, удерживающие PH 3 , являются только дисперсионными силами. Вот почему аммиак имеет исключительно высокие значения MP и BP по сравнению с газообразным фосфином.
ii. Белая часть твердого хлорида серебра, растворимого в растворе аммиака.
Ans — Хлорид серебра растворяется в растворе аммиака с образованием сложного растворимого соединения, называемого хлорид диамминсеребря (I).В результате реакции образуется белый осадок твердого AgCl в растворе аммиака.
AgCl + 2NH 4 OH → [Ag (NH 3 ) 2 ] Cl + 2H 2 O
хлорид диамминсеребра (I)
iii. аммиак хорошо растворяется в воде.
Ответ — Растворимость вещества в воде зависит от полярной природы. Поскольку вода является полярной молекулой, она легко растворяет другие полярные молекулы. Как мы говорим, «подобное растворяется в подобном», полярные соединения растворяют полярные молекулы.Растворимость газа в воде также зависит от температуры и давления газа. Газы растворяются в воде при высоком давлении и низкой температуре. Аммиак — это газ, растворимый в воде. Плюс наличие водородной связи увеличивает растворимость аммиака в воде. Таким образом, аммиак хорошо растворяется в воде.
4) Запишите действие азота с (а) карбидом кальция (б) горящей лентой Mg.
Ans — Когда азот реагирует с карбидом кальция при высокой температуре, он образует циамид кальция, который используется в качестве азотного удобрения.
CaC 2 + N 2 + тепло → CaCN 2 + C
Циамид кальция
При реакции аммиака с горящей лентой магния образуется нитрит магния.
3Mg + N 2 → Mg 3 N 2
5) Почему газообразный аммиак нельзя собирать над водой?
Ans- Газообразный аммиак хорошо растворяется в воде. При 273К 1 объем воды может растворить 1300 объемов аммиака.Таким образом, его нельзя собрать над водой, и, поскольку он легче воздуха, он собирается путем вытеснения воздуха вниз или собирается над ртутью.
6) Запишите химическую реакцию, когда
i) аммиак и оксид меди (II)
Ans-Когда аммиак реагирует с оксидом меди (II), образуется медь и газообразный азот.
3CuO + 2NH 3 → 3Cu + 3H 2 O + N 2 ↑
ii) аммиак и хлор.
Ответ: Когда избыток аммиака реагирует с хлором, образуется хлорид аммония и газообразный азот, а когда аммиак реагирует с избытком хлора, образуется трихлорид азота и хлорид аммония.
8NH 3 + 3Cl 2 → 6NH 4 Cl + N 2 ↑
избыток хлорида аммония
4NH 3 + 3Cl 2 → NCl 3 + 3NH 4 Cl
избыток трихлорида азота
7) Обсудите положение азота в таблице Менделеева.
Ans: Азот — элемент, наиболее распространенный в атмосфере Земли. Он находится в свободном состоянии в количестве около 75% по весу и 78% по объему в атмосфере. Атомный номер азота 7, а его атомный вес 14. Он помещен в качестве первого члена группы VA в периодической таблице и находится во 2 периоде. Группа VA также называется семейством пникогенов, а их соединения называются пниктидами. Другими элементами семейства пникогенов являются фосфор (P), мышьяк (As), сурьма (Sb) и висмут (Bi).
Азот демонстрирует аномальное поведение по сравнению с другими элементами той же группы. Азот — единственный газ в группе VA периодической таблицы. Только азот и висмут из группы VA не являются четырехатомными. Оба они двухатомные. Азот образует водородную связь, а другие элементы — нет. Азот относительно инертен и показывает широкий диапазон O.S. от -3 до +5. Он имеет меньший размер и наибольшее значение электроотрицательности в группе. Но азот сохраняется в группе VA, потому что:
i) Он имеет конфигурацию валентной оболочки ns 2 , np 3 , как и все остальные элементы группы.
ii) Он имеет аллотропную форму, как и все другие элементы группы, кроме висмута.
iii) P-орбитали наполовину заполнены и обладают повышенной стабильностью.
Вопросы с длинным ответом:
1) Опишите производство газообразного аммиака по методу Габера с указанием принципа, условий реакции и хорошо обозначенной диаграммы. Как он реагирует с: а) хлором б) реактивом Несслера?
Ans-
В больших масштабах аммиак получают по способу Габера, цианамидному процессу или процессу Серпека.{450 {\ rm {C \: Fe}} \ & Mo \: 200 — 900 \: atm} $ 2Nh4 (г) + 22 ккал
Процесс Хабера
Это экзотермическая обратимая реакция, которая происходит при уменьшении объема. Принцип Ле Шателье предсказывает следующие благоприятные условия реакции:
Низкая температура — Поскольку мы знаем, что эта реакция является экзотермической реакцией, низкая температура благоприятна для образования аммиака. Но если температура ниже 450 ° C, N 2 и H 2 будут реагировать слишком медленно.Так, для лучшей работы растений необходимо поддерживать температуру около 450-500 ° C.
Высокое давление — По мере того, как реакция протекает с уменьшением объема продукта, высокая температура 200-900 атм. способствует образованию аммиака.
Высокая концентрация — Реакция протекает по прямой реакции с уменьшением объема. Следовательно, избыточное количество одного или обоих реагентов дает высокий выход аммиака.
Катализатор- Наличие мелкодисперсного железа, содержащего молибден или оксид алюминия, ускоряет скорость реакции.Итак, железо используется в качестве катализатора, а молибден или оксид алюминия — в качестве промотора.
Чистота реагентов — Если чистота используемых азота и водорода меньше, каталитическая активность снижается, поскольку катализатор отравлен. Итак, газообразный азот и водород должны быть очень чистыми.
Аммиак реагирует с хлором следующим образом:
Когда избыток аммиака реагирует с хлором, образуется хлорид аммония и газообразный азот, а когда аммиак реагирует с избытком хлора, образуется трихлорид азота и хлорид аммония.
8NH 3 + 3Cl 2 → 6NH 4 Cl + N 2 ↑
избыток хлорида аммония
4NH 3 + 3Cl 2 → NCl 3 + 3NH 4 Cl
избыток трихлорида азота
Аммиак реагирует с реактивом Несслера следующим образом:
Аммиак образует красновато-коричневую часть миллионного основания, когда он вступает в реакцию с реактивом Несслера i.е. К 2 HgI 4
K 2 HgI 4 + 2NH 3 → NH 4 I + 2KI + Hg (NH 2 ) I
2Hg (NH 2 ) I + H 2 O → NH 2 .HgO.Hg ↓ + NH 4 I
млн по базе
2) Как аммиак готовится в чистом и сухом состоянии в лаборатории? Объясните, почему H 2 SO 4 , P 2 O 5 и плавленый CaCl 2 нельзя использовать для осушки газа.\ Delta $ CaCl 2 + 2NH 3 ↑ + 2H 2 O
Процедура — Хлорид аммония и гашеная известь в соотношении 1: 3 помещают в колбу RB или в твердую стеклянную трубку, как показано на рисунке. Колба RB или трубка должны иметь наклон вниз, чтобы избежать риска разрушения из-за потока воды. Аппарат также должен быть герметичным. Затем выделяющийся газообразный аммиак сушат, пропуская его через насадочную башню из негашеной извести. Поскольку мы знаем, что аммиак легче воздуха, а также растворим в воде, он собирается над ртутью или путем вытеснения воздуха вниз.
Сушка аммиака — Сушка аммиака осуществляется путем пропускания его через негашеную известь. Газообразный аммиак, являющийся основанием Льюиса, реагирует с H 2 SO 4 , P 2 O 5 и CaCl 2 с образованием сульфата аммония, фосфата аммония и хлорида аммония.
2NH 3 + H 2 SO 4 → (NH 4 ) 2 SO4
6NH 3 + P 2 O 5 + 3H 2 O → 2 (NH 4 ) 2 PO 4
2NH 3 + CaCl 2 → 2NH 3 Cl + 2Ca
H 2 SO 4 , P 2 O 5 и плавленый CaCl 2 нельзя использовать для осушки газа, поскольку газообразный аммиак является основанием Льюиса и реагирует с H 2 SO 4 , P 2 O 5 и плавленый CaCl 2 с образованием сульфата аммония, фосфата аммония и хлорида аммония.
2NH 3 + H 2 SO 4 → (NH 4 ) 2 SO4
6NH 3 + P 2 O 5 + 3H 2 O → 2 (NH 4 ) 2 PO 4
2NH 3 + CaCl 2 → 2NH 3 Cl + 2Ca
С парами конц. HCl — С парами конц. HCl, аммиак реагирует с образованием соли хлорида аммония аммония.
NH 3 + HCl → NH 4 Cl (хлорид аммония)
С раствором хлорида цинка —
В растворе хлорида цинка аммиак дает хлорид аммония и гидроксид цинка.
NH 3 + ZnCl 2 + H 2 O → NH 4 Cl + Zn (OH) 2
3) Изобразите структуру Льюиса пяти различных оксидов азота.
Ответ — Структура Льюиса пяти различных оксидов азота составляет
Закись азота
Пентаоксид динитрогена
4) Опишите производство азотной кислоты каталитическим окислением аммиака. {90 {\ rm {\% \: Pt}} + {\ rm {\:}} 10 {\ rm {\% \: Rb \:}} 800 {\ rm {C \:}}} $ ↑ 6H 2 O + 4NO + 90 кДжмоль -1
1 том 8 том
2НО + O 2 → 2НО 2
4НО 2 + 2H 2 O + O 2 → 4HNO 3
Процесс производства аммиака по Габеру
Производство аммиака по методу Оствальда состоит из трех основных этапов:
i) Окисление аммиака
Аммиак, полученный по технологии Габера, смешивается с чистым и сухим свободным воздухом в соотношении 1: 8 по объему.{90 {\ rm {\% \: Pt}} + {\ rm {\:}} 10 {\ rm {\% \: Rb \:}} 800 {\ rm {C}}} $ 6H 2 O + 4NO + 90 кДжмоль -1
Поскольку эта реакция является экзотермической, конвертер сначала нагревают, и это тепло выделяется в реакции для поддержания температуры.
ii) Окисление оксида азота
Оксид азота, полученный описанным выше способом, охлаждается примерно до 100 ° C, проходя через охладитель. Охлажденный газ поступает в камеру окисления, где воздух окисляет его до диоксида азота.Низкая температура способствует такому окислению.
2НО + O 2 → 2НО 2
iii) Поглощение диоксида азота
Двуокись азота из камеры окисления прошла через абсорбционную башню, заполненную кислотостойким камнем или кварцем. NO 2 затем вступает в контакт с воздухом с образованием азотной кислоты.
4НО 2 + 2H 2 O + O 2 → 4HNO 3
Разбавленная азотная кислота собирается в приемнике в нижней части колонны, которая затем концентрируется путем распыления ее сверху колонны вместо воды.Техническая азотная кислота 68%. Перегонка при пониженном давлении используется для его дальнейшего концентрирования до 98% в присутствии H 2 SO 4 в качестве агента дегидратации. Безводный HNO 3 может быть получен перегонкой водного HNO 3 с P 2 O 5 или P 4 O 10 .
5) Опишите производство азотной кислоты по методу Оствальда, представив четкую схему. Как азотная кислота определяется в лаборатории?
Ans- Процесс производства аммиака Оствальдом
Процесс Оствальда включает каталитическое окисление аммиака с получением азотной кислоты, которая при дальнейшем окислении дает диоксид азота.{90 {\ rm {\% \: Pt}} + {\ rm {\:}} 10 {\ rm {\% \: Rb \:}} 800 {\ rm {C}}} $ 6H 2 O + 4NO + 90 кДжмоль -1 ↑
1 том 8 том
2НО + O 2 → 2НО 2
4НО 2 + 2H 2 O + O 2 → 4HNO 3
Процесс производства аммиака по Габеру
Производство аммиака по методу Оствальда состоит из трех основных этапов:
i) Окисление аммиака
Аммиак, полученный по технологии Габера, смешивается с чистым и сухим свободным воздухом в соотношении 1: 8 по объему.{90 {\ rm {\% \: Pt}} + {\ rm {\:}} 10 {\ rm {\% \: Rb \:}} 800 {\ rm {C}}} $ 6H 2 O + 4NO + 90 кДжмоль -1 ↑
Поскольку эта реакция является экзотермической, конвертер сначала нагревают, и это тепло выделяется в реакции для поддержания температуры.
ii) Окисление оксида азота
Оксид азота, полученный описанным выше способом, охлаждается примерно до 100 ° C, проходя через охладитель. Охлажденный газ поступает в камеру окисления, где воздух окисляет его до диоксида азота.Низкая температура способствует такому окислению.
2НО + O 2 → 2НО 2
iii) Поглощение диоксида азота
Двуокись азота из камеры окисления прошла через абсорбционную башню, заполненную кислотостойким камнем или кварцем. NO 2 затем вступает в контакт с воздухом с образованием азотной кислоты.
4НО 2 + 2H 2 O + O 2 → 4HNO 3
Разбавленная азотная кислота собирается в приемнике в нижней части колонны, которая затем концентрируется путем распыления ее сверху колонны вместо воды.Техническая азотная кислота 68%. Перегонка при пониженном давлении используется для его дальнейшего концентрирования до 98% в присутствии H 2 SO 4 в качестве агента дегидратации. Безводный HNO 3 может быть получен перегонкой водного HNO 3 с P 2 O 5 или P 4 O 10 .
Азотная кислота обнаруживается в лаборатории с помощью теста коричневого кольца, который описан ниже:
Лабораторный тест азотной кислоты объясняется ниже;
Свежеприготовленный раствор сульфата железа (II) добавляют к разбавленной азотной кислоте или водному раствору нитратной соли и осторожно наливают концентрированную серную кислоту вдоль стенки пробирки.На стыке двух слоев образуется темно-коричневое кольцо.
Для нитратной соли реакция будет
NO3- + h3SO4 → HNO3 + HSO4-] * 2
2HNO3 → 2NO + h3O + 3 [O]
h3SO4 + 2FeSO4 + [O] → Fe2 (SO4) 3 + h3O] * 3
6FeSO4 + 5 h3SO4 + NO3- → 3 Fe2 (SO4) 3 + 2 HSO4- + 4h3O
FeSO4 + NO → FeSO4. №
Закись азота сульфат железа (коричневое кольцо)
6) Что происходит, когда:
а) Раствор FeSO 4 добавляют к хорошо охлажденной смеси разбавленной азотной кислоты и концентрированной H 2 SO 4 ?
Ответ — Когда FeSO 4 добавляется в хорошо охлажденную смесь разбавленной HNO 3 и конц.H 2 SO 4 , дает коричневое кольцо из азотистого сульфата железа. Это испытание азотной кислотой.
KNO3- + h3SO4 → HNO3 + HSO4-] * 2
2HNO3 → 2NO + h3O + 3 [O]
h3SO4 + 2FeSO4 + [O] → Fe2 (SO4) 3 + h3O] * 3
6FeSO4 + 5 h3SO4 + 2KNO3- → 3 Fe2 (SO4) 3 + 2 HSO4- + 4h3O
FeSO4 + NO → FeSO4. №
азотистый сульфат железа (коричневое кольцо)
б) Фосфор обрабатывают HNO 3 ?
Ans- Когда фосфор обрабатывают концентрированной азотной кислотой, образуется фосфорная кислота.
2HNO3 → 2NO2 + h3O + [O] * 10
P4 + 10 [O] → 2P2O5
P2O5 + 3h3O → 2h4PO4] * 2
P4 + 20HNO3 → 4h4PO4 + 20NO2 + 4h3O
c) Металлический цинк обрабатывают азотной кислотой (1: 1)?
Ответ — Когда металлический цинк обрабатывают умеренно конц. т.е. азотная кислота 1: 1, она окисляется до нитрата цинка
Zn + 2HNO3 → Zn (NO3) 2 + 2 [H] * 3
HNO3 + 3H → 2h3O + NO] * 2
3Zn + 8HNO3 → 3Zn (NO3) 2 + 2NO + 4h3O
г) Йод обрабатывают конц.HNO 3 ?
Ans- Conc. HNO 3 окисляет йод до йодистой кислоты
2HNO3 → 2NO2 + h3O + [O] * 5
I + 5 [O] → I2O5
I2O5 + h3O → 2HIO3
I2 + 10HNO3 → 2HIO3 + 10NO2 + 4h3O
йодная кислота
д) Чистая азотная кислота подвергается воздействию света?
Ans — Когда чистая азотная кислота подвергается воздействию света, она дает диоксид азота, воду и азот.
4HNO3hv → 4NO2 + O2 + 2h3O
е) Газ, полученный при нагревании нашатырного спирта с каустической содой, пропускают над раствором сульфата меди.
Ans — саламмиаковая кислота реагирует с содой с образованием аммиака
Nh5Cl + NaOH → NaCl + Nh4 + h3O
Когда газообразный аммиак пропускают через раствор сульфата меди, сначала он образует голубовато-белую часть Cu (OH) 2, которая при избыточной подаче Nh4 растворяется, и раствор темно-синего сложного тетрааминного сульфата меди (II) растворяется.
CuSO4 + 2Nh5OH $ \ to $ Cu (OH) 2 + (Nh5) 2SO4
(Nh5) 2SO4 + Cu (OH) 2 + 2Nh5OH $ \ to $ Cu (Nh4) 4SO4 + 4h3O
тетраамин сульфат меди (II)
Уровень 11 Науки о жизни | Образ мышления Изучите
класс 11 Науки о жизни | Образ мышления учиться- Науки о жизни
- 11 класс Науки о жизни
Редакция видео
Редакция видео
Редакция видео
Редакция видео
Редакция видео
Редакция видео
Редакция видео
Редакция видео
Notes for Class 11 Chemistry PDF Download
Важность примечаний и концепций по химии класса 11
Создание заметок о редакции для класса 11 поможет вам интерпретировать все, что вы читаете, своими словами, чтобы вы поняли концепции класса 11 лучше.Были времена, когда ученики 11 класса читали всю страницу тупо, даже не понимая ни единого слова, но если вы сделаете заметок для экзаменов Standard 11 , то ваш мозг попытается выжать смысл из каждого написанного вами предложения, что очень много. полезно для студентов. В заметках о редакции всегда фиксируется вся информация, которую вы узнали. Эти заметки во время экзамена будут действовать как готовые рекомендации для рассмотрения. Этот метод не только помогает сэкономить энергию и время учащихся во время экзамена 11 класса, но также помогает им вспомнить все, что они изучали, за меньшее время.Заметки о пересмотре для класса 11 также помогли ученикам запомнить то, что они изучали, потому что они могли прочитать каждое предложение строка за строкой и подготовить заметки.
Преимущества Заметки по химии 11 класса
a) Поможет вам своевременно пересмотреть все важные концепции перед школьными экзаменами 11 класса
b) Краткие заметки по каждой главе, данной в последнем классе 11 книги по химии помогут выучить и повторить все основные концепции прямо у дверей экзаменационного зала.
c) Примечания, предоставленные Studiestoday.com, были подготовлены специально для студентов, изучающих экзамен Class 11 2020, чтобы они могли получить лучший результат на предстоящем экзамене Class 11
d) Вы почувствуете себя комфортно, потому что вы пересмотрели все важные темы Chemistry , и вам не придется носить с собой всю книгу на экзамене
e) Загрузите все заметки в формате PDF для Class 11 Chemistry и будьте уверены, что вы охватили все
Приведенные выше заметки помогут вам преуспеть на экзаменах .Вы всегда должны пересматривать концепции и заметки по химии 11 класса перед экзаменом, это поможет вам подвести итоги всех важных тем и получить более высокие оценки. Вы также можете щелкнуть ниже, чтобы загрузить решенные последние образцы работ, контрольные работы за прошлый год (за последние 10 лет) в формате pdf для печати, имитирующие онлайн-тесты, последние книги для класса 11, основанные на учебной программе и руководящих принципах, выпущенных CBSE NCERT KVS. Учебный материал подготовлен опытными преподавателями ведущих школ и институтов Индии и доступен для бесплатного скачивания в формате pdf.
PPT — 11 КЛАСС Chemistry SCH 3U1 PowerPoint Presentation, скачать бесплатно
GRADE 11 ChemistrySCH 3U1 MRS. MAUTI
Ожидаемое поведение учащихся Следующие ниже рекомендации основаны на концепции, согласно которой класс — это место, где каждый должен иметь возможность учиться в удобной, упорядоченной и безопасной обстановке. ПО ПРИБЫТИЮ НА УЧАСТИЕ: • Будьте вовремя, в полной форме. Есть последствия для привычного опоздания.• Имейте с собой в каждом классе тетрадь, учебник и принадлежности. • Идите прямо к назначенному месту, откройте книги и будьте готовы к уроку.
Ожидаемое поведение учащихся ВО ВРЕМЯ УРОКА: • В обычной ситуации в классе ГОВОРИТЬ ДОЛЖЕН ТОЛЬКО ОДИН ЧЕЛОВЕК (обычно учитель). Пожалуйста, проявляйте уважение и слушайте других. НЕ выкрикивайте ответы или просьбы. ПОДНИМИТЕ РУКУ И ЖДИТЕ, ЧТО ПОЗВОНИТЕ • Обратите внимание и делайте подробные записи, как указано.• ОСТАВАЙТЕСЬ на своем месте, если вам не было разрешено покинуть его.
Ожидаемое поведение учащихся ВО ВРЕМЯ РАБОТЫ В ЛАБОРАТОРИИ: • ВНИМАТЕЛЬНО СЛУШАЙТЕ ДАННЫЕ ИНСТРУКЦИИ. • Работайте тихо и эффективно со своим партнером (-ами) и оставайтесь на своем рабочем месте, за исключением случаев получения материалов для экспериментов. • Внимательно следуйте процедуре, запишите соответствующие наблюдения. • ОЧИСТИТЕ и верните все оборудование на ПРАВИЛЬНОЕ место. • Оставляйте рабочее место и все оборудование чистыми.
Ожидаемое поведение учащихся ВСЕГДА: • ЕДА и НАПИТКИ (только вода в запечатанных бутылках) НЕ разрешены в классе. • НАРУЖНАЯ одежда должна быть оставлена в вашем шкафчике. • Поездки в УДОБНУЮ и РАЗДЕВАЛКИ следует совершать во время обеда и во время поездки, за исключением исключительных обстоятельств. • Неприемлемый язык НЕ допускается в классе. • I-pods, сотовые телефоны и т. Д. НЕ РАЗРЕШЕНЫ В КЛАССЕ.
Ожидаемое поведение учеников НА КОЛОКОЛЬЧИКЕ: • Услышав звонок, вы МОЖЕТЕ начать собирать свои личные вещи.• Оставайтесь на своем месте, ДО ТОГО, КАК УЧИТЕЛЬ ОТПУСКАЕТ. ПОСЛЕ КЛАССА: • Заполните ВСЕ назначенные рабочие и лабораторные отчеты. • Договоритесь о встрече с учителем, если у вас возникнут трудности. • Перечитывайте свои заметки и назначенный текстовый материал каждую ночь.
SCH 3U1Что мы делаем? 5 ЕДИНИЦ • Материя и химическая связь • Химические реакции • Растворы и растворимость • Количества в химических реакциях • Газы и химия атмосферы
SCH 3U1Как меня оценивают? 4 категории • Знание / понимание: 30% • Мышление: 35% • Коммуникация: 15% • Применение: 20%
SCH 3U1 Как меня оценивают? Срок работы: 70% • Викторины, тесты, лабораторные работы, задания Суммарная оценка: 30% • Заключительный экзамен
Лабораторное оборудование 1.Щипцы для стаканов 2. Стеклянная пластина 3. Щипцы / пинцеты 4. Штативы для пробирок 5. Тигель 6. Стакан 7. Стойка для реторты 8. Капельница для лекарств (глаз) 9. Лабораторные щипцы 10. Колба Эрленмейера 11. Резиновые пробки
Лабораторное оборудование 12. Кольцевой зажим 13. Проволочная сетка 14. Смотровое стекло 15. Стержень для перемешивания 16. Пробирки 17. Держатель для пробирок 18. Щетки для пробирок 19. Бутылка для сбора газа 20. Глиняный треугольник 21. Клещи для тигля 22. Универсальные зажимы
Лабораторное оборудование 23.Воронка 24. Трубка с чертополохом 25. Ложка для дефлаграции 26. Горелка Бунзена 27. Градуированный цилиндр 28. Флорентийская колба 29. Испарительная чашка 30. Ступка и пестик 31. Кремневая зажигалка 32. Лопатка
Домашнее задание: • Классы 9 и 10 Обзор химии — Раздаточный материал • Викторина по безопасности и лабораторному оборудованию в среду !!

 Экспериментальные основы химии. Химия и жизнь». Задания, включённые в проверочную работу, проверяют овладение выпускниками определёнными умениями и способами действий, которые отвечают требованиям к уровню подготовки выпускников.
Экспериментальные основы химии. Химия и жизнь». Задания, включённые в проверочную работу, проверяют овладение выпускниками определёнными умениями и способами действий, которые отвечают требованиям к уровню подготовки выпускников.

 За каждое правильно выполненное задание можно получить от 1 до 10 баллов.Ща выполнение работы отводится 180 минут. Специальное оборудование для выполнения работы не требуется. Разрешено использовать непрограммируемый калькулятор, периодическую систему химических элементов, таблицу растворимости кислот, солей и оснований в воде и ряд активности металлов/электрохимический ряд напряжений.
За каждое правильно выполненное задание можно получить от 1 до 10 баллов.Ща выполнение работы отводится 180 минут. Специальное оборудование для выполнения работы не требуется. Разрешено использовать непрограммируемый калькулятор, периодическую систему химических элементов, таблицу растворимости кислот, солей и оснований в воде и ряд активности металлов/электрохимический ряд напряжений.

 12.2015 г. Роскомнадзором.
12.2015 г. Роскомнадзором.