|
|
|
|
 Far Far |
 WinNavigator WinNavigator |
 Frigate Frigate |
 Norton
Commander Norton
Commander |
 WinNC WinNC |
 Dos
Navigator Dos
Navigator |
 Servant
Salamander Servant
Salamander |
 Turbo
Browser Turbo
Browser |
|
|
 Winamp,
Skins, Plugins Winamp,
Skins, Plugins |
 Необходимые
Утилиты Необходимые
Утилиты |
 Текстовые
редакторы Текстовые
редакторы |
 Юмор Юмор |
|
|
|
File managers and best utilites |
Внутренняя энергия тела. Внутренняя энергия реферат
Внутренняя энергия | Физика. Закон, формула, лекция, шпаргалка, шпора, презентация, доклад, ГДЗ, решебник, конспект, кратко
Внутренняя энергия — важнейшее условие существования и характеристика всех тел живой и неживой природы. Для того чтобы определить её значение в организации жизни на нашей планете, вспомним основные физические понятия термодинамики.
Макроскопические тела состоят из движущихся и взаимодействующих частиц: молекул, атомов, ионов. В свою очередь, атомы и ядра атомов тоже состоят из движущихся и взаимодействующих частиц.
Как известно, движущиеся тела обладают кинетической энергией, следовательно, частицы (молекулы, атомы, ионы), из которых состоит вещество, тоже обладают кинетической энергией.
Взаимодействующие тела обладают энергией взаимодействия, или потенциальной энергией. Поскольку частицы вещества взаимодействуют между собой, то они обладают потенциальной энергией.
Следовательно, частицы, из которых состоят макроскопические тела, обладают кинетической и потенциальной энергией, их сумма и есть внутренняя энергия макроскопической системы.
Внутренней энергией (U) макроскопической системы называют сумму кинетической энергии (EК) движения составляющих его частиц (молекул, атомов, ионов) и потенциальной энергии (EП) их взаимодействия: U = EK + EП.
Единицей измерения внутренней энергии является джоуль (1 Дж).
К внутренней энергии относят и энергию движения и взаимодействия частиц, входящих в состав атомов и ядер вещества, однако в молекулярной физике имеют дело с процессами, которые происходят при не слишком высоких температурах и не связаны с превращением вещества. В этих процессах внутриатомная и внутриядерная энергия не изменяется.
Внутренняя энергия, так же как температура, давление и объём (термодинамические параметры), характеризует состояние системы. При изменении состояния тела изменяется и значение внутренней энергии.
Как известно, кинетическая энергия тела прямо пропорциональна квадрату его скорости. Поскольку молекулы имеют разные скорости и, следовательно, разные кинетические энергии, то их совокупность характеризуется средней кинетической энергией, которая прямо пропорциональна среднему квадрату скорости движения молекул:
Ėk = m0v̇2 / 2. Материал с сайта http://doklad-referat.ru
Так как температура тела прямо пропорциональна средней кинетической энергии составляющих его частиц, то внутренняя энергия тела зависит от его температуры и об изменении внутренней энергии можно судить по изменению температуры тела.
Внутренняя энергия тела зависит и от его агрегатного состояния. Так, она больше у стоградусного пара, чем у воды такой же массы при той же температуре. Это объясняется различием потенциальных энергий взаимодействия молекул пара и воды.
Внутренняя энергия зависит и от деформации тела: она больше у деформированного тела, чем у недеформированного.
Следует иметь в виду, что внутренняя энергия тела не зависит от его движения как целого и от его положения в пространстве. Так, значения внутренней энергии у шарика, лежащего на полу и поднятого на некоторую высоту, одинаковы при одинаковых прочих условиях.
 На этой странице материал по темам:
На этой странице материал по темам: От чего зависит и от чего не зависит внутренняя энергия
Что представляет собой полная и внутренняя энергии кратко
Реферат внутренняя энергия по физике
Реферат про внутреннюю энергию физика
Раздел физики внутреняя энергия
 Вопросы по этому материалу:
Вопросы по этому материалу: Что представляет собой внутренняя энергия?
От чего зависит и от чего не зависит внутренняя энергия макроскопической системы?
doklad-referat.ru
Внутренняя энергия
Количество просмотров публикации Внутренняя энергия - 393
Первоначально люди считали, что в каждом теле содержится неĸᴏᴛᴏᴩᴏᴇ количество теплорода. Чем его больше, тем тело горячее. Вместе с тем, его количество можно увеличить, приведя данное тело в соприкосновение с более горячим. При этом, в случае если коснуться более холодного тела, теплород будет отдаваться ему. Так в физику пришли понятия ʼʼколичество теплаʼʼ, ʼʼполучить теплоʼʼ, ʼʼтеплоемкостьʼʼ. При этом, нагреть тело можно иначе. Совершая над телом механическую работу. Вот здесь и появились серьезные сомнения в теории теплорода. Видя, как закипает вода (охладитель) во время высверливания отверстий в стволах пушек, люди сомневались, что столь большое количество теплорода может так быстро собраться из окружающей среды. Пропуская долгий исторический путь установления истины, сразу заметим, что любое тело характеризуется некоторой величиной внутренней энергии U, которую можно отобрать у тела лишь частично. По этой причине, имеет смысл говорить лишь о ее изменении. Это изменение можно осуществить двумя способами. 1) Совершив над телом механическую работу. При этом - приращение внутренней энергии равно работе внешних сил. 2) С помощью теплопередачи. В этом случае температура нашего тела всегда изменяется, а объём – нет. Изменение внутренней энергии будет
, где С – теплоемкость тела. Она показывает, сколько джоулей механической работы нужно потратить, чтобы нагреть тело на один градус. Заметьте, с помощью первого способа изменения внутренней энергии мы связали механику и теорию тепла! Теперь самое интересное. В случае если у двух соприкоснувшихся тел произошли изменения внутренних энергий ΔU1 и ΔU2 то каковы бы ни были эти тела
. То есть, одно тело как бы отдало другому неĸᴏᴛᴏᴩᴏᴇ количество тепла. Это утверждение, ĸᴏᴛᴏᴩᴏᴇ фактически является законом сохранения энергии в применении к тепловым процессам, несколько продлило жизнь теории теплорода, но не спасло ее. Хотя теплопередачу очень удобно рассматривать как передачу количества тепла ΔQ от горячего тела к холодному. Причем горячее остывает на Δt1= ΔQ/C1 градусов, а холодное нагревается на Δt2= ΔQ/C2 градусов. Обычно считают, что если тело получает тепло, то ΔQ>0, в случае если тело отдает тепло, то ΔQ<0. Тогда в наших формулах Δt2 будет положительным, а Δt1 отрицательным.
Обобщая формулу для изменения внутренней энергии тела, получим Изменение внутренней энергии тела равно совершаемой механической работе внешних сил и переданному телу количеству тепла. Во всех этих процессах температура тела будет меняться. (Лишь работа внешних сил над газом иногда не сопровождается изменением температуры).
Поскольку теплоемкость тела пропорциональна его массе (это легко сообразить, зная, что телу вдвое большей массы для нагревания на один градус нужно сообщить вдвое большее количество тепла), удобно использовать удельную теплоемкость (теплоемкость единицы массы) c=C/m.
В заключение стоит заметить, что по представлениям молекулярно-кинетической теории, которая никак не использовалась в наших рассуждениях, но которая в конечном итоге победила, внутренней энергией называют сумму кинетической (тепловой) энергии молекул и потенциальной энергии их взаимодействия. Теперь понятно, почему у тела нельзя ʼʼотобратьʼʼ всю внутреннюю энергию. Потенциальную энергию не отберешь. И лишь странный, логически необъяснимый факт, что внутренняя энергия одного тела уменьшается ровно на столько, на сколько увеличивается внутренняя энергия другого, приведенного в соприкосновение с ним, наводит нас на мысль о фундаментальности понятия энергии. Мы не знаем, что такое энергия, но мы знаем, что она сохраняется.
Читайте также
Как рассуждали химики Известно, что кислород и водород имеют двухатомные молекулы. Если кислород нагревать, измеряя при этом давление, то при определенной температуре давление скачком возрастет в два раза. Это можно объяснить распадом (диссоциацией) каждой молекулы... [читать подробнее].
Пример 3. Химические реакции и фазовые превращения. В этом случае координатой состояния системы являетсяmi –масса i-тых компонентов системы. У каждого взаимодействия данного рода есть только одна координата состояния системы. Xх\ф является mреагентов или фазовых... [читать подробнее].
Внутренней энергией газа U называется сумма кинетической энергии хаотического (теплового) движения всех молекул газа и энергии взаимодействия молекул газа между собой. Для идеального газа внутренняя энергия – это только кинетическая энергия всех молекул газа. ... [читать подробнее].
Теплоемкость в политропном проессе. Метод определения показателя политропы по двум точкам. Если для процесса известны значения термодинамических параметров только в двух точках, то можно приближенно найти показатель политропы по... [читать подробнее].
Свойства тел при их механическом и тепловом взаимодействия друг с другом достаточно хорошо могут быть описаны на основе молекулярно - кинетической теории. Согласно этой теории все тела состоят из мельчайших частиц – атомов, молекул или ионов, которые находятся в... [читать подробнее].
Внутренняя энергия Термодинамических систем Тема 2 Энергетические характеристики Внутренняя энергия термодинамической системы представляет собой сумму всех видов энергии движения и взаимодействия частиц, составляющих систему.Это... [читать подробнее].
Внутренняя энергия включает в себя энергию всевозможных видов движений внутри системы и энергию взаимодействия всех нее частиц. Из формулы (2.2.11) видно, что внутренняя энергия идеального газа зависит только от его температуры, следовательно, является однозначной функцией... [читать подробнее].
Внутренняя энергия идеального газа целиком определяется кинетической энергией теплового движения молекул и зависит только от его температуры: , (2.5.6) где – молярная теплоемкость газа при постоянном объеме, – число степеней свободы молекул газа. При вычислении... [читать подробнее].
Из молекулярно-кинетического определения идеального газа следует, что единственной формой энергии частиц идеального газа может быть только их кинетическая энергия поступательного движения, вычисленная по отношению к скорости центра масс газа. Тогда под внутренней... [читать подробнее].
Легко видеть, что запись (2.3) противоречит закону сохранения энергии. В самом деле, если, например, ударять по тяжёлому неподвижному телу и/или нагревать его, то оно останется неподвижным, т.е. ни кинетическая, ни потенциальная энергии тела не изменятся, в то время как работа... [читать подробнее].
referatwork.ru
Внутренняя энергия
Энергия представляет собой общую меру различных форм движения материи. Соответственно формам движения материи различают и виды энергии – механическую, электрическую, химическую и т.д. Всякая термодинамическая система в любом состоянии обладает некоторым запасом энергии, существование которой было доказано Р.Клаузиусом (1850) и получило название внутренней энергии.
Внутренняя энергия(U) – это энергия всех видов движения микрочастиц, составляющих систему, и энергия их взаимодействия между собой.
Внутренняя энергия складывается из энергии поступательного, вращательного и колебательного движения частиц, энергии межмолекулярного и внутримолекулярного, внутриатомного и внутриядерного взаимодействий и др.
Энергию внутримолекулярного взаимодействия, т.е. энергию взаимодействия атомов в молекуле, часто называют химической энергией. Изменение этой энергии имеет место при химических превращениях.
Для термодинамического анализа нет необходимости знать из каких форм движения материи складывается внутренняя энергия.
Запас внутренней энергии зависит только от состояния системы. Следовательно, внутреннюю энергию можно рассматривать как одну их характеристик этого состояния наравне с такими величинами, как, давление, температура.
Каждому состоянию системы соответствует строго определенное значение каждого из его свойств.
Если гомогенная система в начальном состоянии имеет объем V1, давление P1, температуру T1, внутреннюю энергию U1, удельную электропроводностьæ1и т.д., а в конечном состоянии эти свойства соответственно равны V2, P2, T2, U2, æ2и т.д., то изменение каждого свойства при переходе системы из начального состояния в конечное будет одним и тем же, независимо от того, каким путем переходит система из одного состояния в другое: первым, вторым или третьим (рис. 1.4).

Рис. 1.4 Независимость свойств системы от пути ее перехода
из обычного состояния в другое
Т.е. (U2 - U1)I = (U2 - U1)II = (U2 - U1)III (1.4)
Где цифры I, II, III и т.д. указывают пути процесса. Следовательно, если система из начального состояния (1) в конечное (2) перейдет по одному пути, а из конечного в начале – по другому пути, т.е. совершится круговой процесс (цикл), то изменение каждого свойства системы будет равно нулю.
Таким образом, изменение функции состояния системы не зависит от пути процесса, а зависит лишь от начального и конечного состояний системы. Бесконечно малое изменение свойств системы обозначается обычно знаком дифференциала d. Например, dU– бесконечное малое изменение внутренней энергии и т.д.
Формы обмена энергией
В соответствии с различными формами движения материи и различными видами энергии существуют различные формы обмена энергией (передача энергии) – формы взаимодействия. В термодинамике рассматриваются две формы обмена энергии между системой и окружающей средой. Это работа и теплота.
Работа.Наиболее наглядной формой обмена энергией является механическая работа, соответствующая механической форме движения материи. Она производится при перемещении тела под действием механической силы. В соответствии с другими формами движения материи различают и другие виды работы: электрическую, химическую и т.д. Работа является формой передачи упорядоченного, организованного движения, так как при совершении работы частицы тела движутся организованно в одном направлении. Например, совершение работы при расширении газа. Молекулы газа, находящегося в цилиндре под поршнем, находятся в хаотическом, неупорядоченном движении. Когда же газ начнет перемещать поршень, то есть совершать механическую работу, на беспорядочное движение молекул газа будет накладываться организованное движение: все молекулы получают некоторое смещение в направлении движения поршня. Электрическая работа так же связана с организованным движением в определенном направлении заряженных частиц материи.
Поскольку, работа является мерой передаваемой энергии, количество ее измеряется в тех же единицах, что и энергия.
Теплота. Форму обмена энергией, соответствующую хаотическому движению микрочастиц, составляющих систему, называюттеплообменом, а количество энергии, переданное при теплообмене, называюттеплотой.
Теплообмен не связан с изменением положения тел, составляющих термодинамическую систему, и состоит в непосредственной передаче энергии молекулами одного тела молекулам другого при их контакте.
П редставим себе изолированный сосуд (систему) разделенную на две части теплопроводной перегородкой ав (рис. 1.5). Допустим, что в обеих частях сосуда находится газ.
редставим себе изолированный сосуд (систему) разделенную на две части теплопроводной перегородкой ав (рис. 1.5). Допустим, что в обеих частях сосуда находится газ.
Т1
Рис. 1.5. К понятию о теплоте
В левой половине сосуда температура газа Т1, а в правой Т2. Если Т1> Т2, то средняя кинетическая энергия ( ) молекул газа в левой части сосуда, будет больше средней кинетической энергии (
) молекул газа в левой части сосуда, будет больше средней кинетической энергии ( ) в правой половине сосуда.
) в правой половине сосуда.
В результате непрерывных соударений молекул о перегородку в левой половине сосуда часть энергии их передается молекулам перегородки. Молекулы же газа, находящегося в правой половине сосуда, сталкиваясь с перегородкой, приобретут какую-то часть энергии от ее молекул.
В результате этих столкновений кинетическая энергия молекул в левой половине сосуда будет уменьшаться, а в правой – увеличиваться; температуры Т1и Т2будут выравниваться.
Поскольку теплота является метой энергии, ее количество измеряется в тех же единицах, что энергия. Таким образом, теплообмен и работа являются формами обмена энергией, а количество теплоты и количество работы - мерами передаваемой энергии. Различие между ними состоит в том, что теплота – это форма передачи микрофизического, неупорядоченного движения частиц (и, соответственно, энергии этого движения), а работа представляет собой форму передачи энергии упорядоченного, организованного движения материи.
Иногда говорят: теплота (или работа) подводится или отводится от системы, при этом следует понимать, что подводиться и отводится не теплота и работа, а энергия, поэтому следует не употреблять такого рода выражений как «запас теплоты» или «теплота содержится».
Являясь формами обмена энергией (формами взаимодействия) системы с окружающей средой, теплота и работа не могут быть связаны с каким-либо определенным состоянием системы, не могут являться ее свойствами, а, следовательно, и функциями ее состояния. Это означает, что если система проходит из начального состояния (1) в конечное (2) различными путями, то теплота и работа будут иметь разные значения для разных путей перехода (рис. 1.6)

Рис. 1. 6
Конечное количество теплоты и работы обозначают Q и A, а бесконечно малые значения соответственно через δQ и δA. Величины δQ и δA в отличие от dU не являются полным дифференциалом, т.к. Q и A не являются функциями состояния.
Когда же путь процесса буде предопределен, работа и теплота приобретут свойства функций состояния системы, т.е. их численные значения будут определяться только начальным и конечным состояниями системы.
studfiles.net
Внутренняя энергия и её применение
rpp.nashaucheba.ru
Внутренняя энергия тела | Физика. Закон, формула, лекция, шпаргалка, шпора, доклад, ГДЗ, решебник, конспект, кратко
Любое макроскопическое тело имеет энергию, обусловленную его микросостоянием. Эта энергия называется внутренней (обозначается U). Она равняется энергии движения и взаимодействия микрочастиц, из которых состоит тело. Так, внутренняя энергия идеального газа состоит из кинетической энергии всех его молекул, поскольку их взаимодействием в данном случае можно пренебречь. Поэтому его внутренняя энергия зависит лишь от температуры газа (U ~ T).
Модель идеального газа предусматривает, что молекулы находятся на расстоянии нескольких диаметров друг от друга. Поэтому энергия их взаимодействия намного меньше энергии движения и ее можно не учитывать.
У реальных газов, жидкостей и твердых тел взаимодействием микрочастиц (атомов, молекул, ионов и т. п.) пренебречь нельзя, поскольку оно существенно влияет на их свойства. Поэтому их внутренняя энергия состоит из кинетической энергии теплового движения микрочастиц и потенциальной энергии их взаимодействия. Их внутренняя энергия, кроме температуры T, будет зависеть также от объема V, поскольку изменение объема влияет на расстояние между атомами и молекулами, а, следовательно, и на потенциальную энергию их взаимодействия между собой.
Внутренняя энергия — это функция состояния тела, которая определяется его температурой T и объемом V.
Внутренняя энергия однозначно определяется температурой T и объемом тела V, характеризующими его состояние: U = U(T, V)
Чтобы изменить внутреннюю энергию тела, нужно фактически изменить или кинетическую энергию теплового движения микрочастиц, или потенциальную энергию их взаимодействия (или и ту и другую вместе). Как известно, это можно сделать двумя способами — путем теплообмена или вследствие выполнения работы. В первом случае это происходит за счет передачи определенного количества теплоты Q; во втором — вследствие выполнения работы A.
Таким образом, количество теплоты и выполненная работа являются мерой изменения внутренней энергии тела:
ΔU = Q + A.
Изменение внутренней энергии происходит за счет отданного или полученного телом некоторого количества теплоты или вследствие выполнения работы.
Если имеет место лишь теплообмен, то изменение внутренней энергии происходит путем получения или отдачи определенного количества теплоты: ΔU = Q. При нагревании или охлаждении тела оно равно:
ΔU = Q = cm(T2 — Т1) = cmΔT.
При плавлении или кристаллизации твердых тел внутренняя энергия изменяется за счет изменения потенциальной энергии взаимодействия микрочастиц, ведь происходят структурные изменения строения вещества. В данном случае изменение внутренней энергии равняется теплоте плавления (кристаллизации) тела: ΔU — Qпл = λm, где λ — удельная теплота плавления (кристаллизации) твердого тела.
Испарение жидкостей или конденсация пара также вызывает изменение внутренней энергии, которая равна теплоте парообразования: ΔU = Qп = rm, где r — удельная теплота парообразования (конденсации) жидкости.
Изменение внутренней энергии тела вследствие выполнения механической работы (без теплообмена) численно равно значению этой работы: ΔU = A.
Если изменение внутренней энергии происходит вследствие теплообмена, то ΔU = Q = cm(T2 — T1), или ΔU = Qпл = λm, или ΔU = Qп = rm.
Следовательно, с точки зрения молекулярной физики: Материал с сайта http://worldofschool.ru
Внутренняя энергия тела является суммой кинетической энергии теплового движения атомов, молекул или других частиц, из которых оно состоит, и потенциальной энергии взаимодействия между ними; с термодинамической точки зрения она является функцией состояния тела (системы тел), которая однозначно определяется его макропараметрами — температурой T и объемом V.
Таким образом, внутренняя энергия — это энергия системы, которая зависит от ее внутреннего состояния. Она состоит из энергии теплового движения всех микрочастиц системы (молекул, атомов, ионов, электронов и т. п.) и энергии их взаимодействия. Полное значение внутренней энергии определить практически невозможно, поэтому вычисляют изменение внутренней энергии ΔU, которое происходит вследствие теплопередачи и выполнения работы.
Внутренняя энергия тела равна сумме кинетической энергии теплового движения и потенциальной энергии взаимодействия составляющих его микрочастиц.
 На этой странице материал по темам:
На этой странице материал по темам: Определения теплового движения и внутренней энергии
Краткое сообщение "об использования внутренней энергии тела"
Интересные факты о внутренней энергии
Способ изменения внутренней энергии тела краткий конспект
Внутренняя энергия твёрдого тела в функции температуры
 Вопросы по этому материалу:
Вопросы по этому материалу: От каких макропараметров системы зависит внутренняя энергия идеального газа?
Какие макропараметры вообще определяют внутреннюю энергию тела?
Чему равно изменение внутренней энергии, если происходит лишь теплообмен?
Каким образом выполненная механическая работа влияет на внутреннюю энергию тела?
Какое толкование дают внутренней энергии молекулярно-кинетическая теория и термодинамика?
worldofschool.ru
Внутренняя энергия | Бесплатные курсовые, рефераты и дипломные работы
Легко видеть, что запись (2.3) противоречит закону сохранения энергии. В самом деле, если, например, ударять по тяжёлому неподвижному телу и/или нагревать его, то оно останется неподвижным, т.е. ни кинетическая, ни потенциальная энергии тела не изменятся, в то время как работа и/или теплота не равны нулю. Это говорит о том, что любая термодинамическая система, кроме механических видов энергии, должна обладать ещё одним видом энергии, её назвали внутренней энергией U, таким образом, что закон сохранения энергии принимает вид:
 (2.4)
(2.4)
По современным представлениям внутренняя энергия тела складывается из всех видов энергий всех частиц, составляющих систему.
Таким образом, если система как целое остаётся неподвижной при воздействии на неё окружающей среды, … то изменяется её внутренняя энергия. Обычно I начало термодинамики записывают для неподвижных систем и формулируют следующим образом: теплота, подведённая к системе, затрачивается на изменение её внутренней энергии и на совершение ею работы. Если система переходит из начального состояния (1) в конечное состояние (2), то I начало записывается в виде:
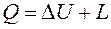 . (2.5)
. (2.5)
Если начальное и конечное состояния дифференциально близки, то I начало записывается в дифференциальной форме:
 , (2.6)
, (2.6)
где  есть малые величины теплоты и работы в процессе, а
есть малые величины теплоты и работы в процессе, а  — малое изменение внутренней энергии. I начало термодинамики требует, чтобы внутренняя энергия U системы была однозначной функцией состояния, а её дифференциал полным. В самом деле, если бы
— малое изменение внутренней энергии. I начало термодинамики требует, чтобы внутренняя энергия U системы была однозначной функцией состояния, а её дифференциал полным. В самом деле, если бы  не был полным дифференциалом, т.е. если бы внутренняя энергия U не была однозначной функцией состояния, то при совершении кругового процесса (цикла) появлялся бы излишек (положительный или отрицательный) внутренней энергии, что приводило бы к возможности построения вечного двигателя I рода.
не был полным дифференциалом, т.е. если бы внутренняя энергия U не была однозначной функцией состояния, то при совершении кругового процесса (цикла) появлялся бы излишек (положительный или отрицательный) внутренней энергии, что приводило бы к возможности построения вечного двигателя I рода.
I начало может быть записано для удельных величин:
 . (2.7)
. (2.7)
В случае простых систем, для которых  , имеем:
, имеем:
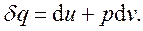 (2.8)
(2.8)
Если в качестве независимых параметров системы выбрать температуру T и удельный объём v, то полный дифференциал внутренней энергии будет записываться в виде:
 . (2.9)
. (2.9)
2.3. Энтальпия. Полезная внешняя работа
Запишем I начало термодинамики для неподвижной простой системы:

и применим к этому выражению преобразование Лежандра:
 .
.
Здесь под знаком полного дифференциала появляется новая функция состояния:

 , (2.10)
, (2.10)
называемая энтальпией. Таким образом, первое начало термодинамики может быть записано в двух эквивалентных формах:
 (2.11)
(2.11)
Физический смысл энтальпии может быть выяснен из смысла произведения  . Рассмотрим следующий пример. Пусть в вертикально расположенном цилиндре под поршнем находится газ (рис.2.1). На поршень давит груз весом G = Mгрg. Если груз вместе с поршнем неподвижны, значит, на поршень снизу действует давление со стороны газа, равное
. Рассмотрим следующий пример. Пусть в вертикально расположенном цилиндре под поршнем находится газ (рис.2.1). На поршень давит груз весом G = Mгрg. Если груз вместе с поршнем неподвижны, значит, на поршень снизу действует давление со стороны газа, равное  , где f — площадь поршня. Это выражение может быть записано в виде
, где f — площадь поршня. Это выражение может быть записано в виде  . Умножив левую и правую части этого равенства на высоту h положения поршня от дна цилиндра, получим
. Умножив левую и правую части этого равенства на высоту h положения поршня от дна цилиндра, получим  . Произведение же
. Произведение же  есть потенциальная энергия груза в поле тяжести Земли.
есть потенциальная энергия груза в поле тяжести Земли.

Таким образом, произведение pV представляет собой в рассмотренном случае потенциальную энергию поршня вместе с грузом, удерживающего газ в заданном объёме V. В общем случае, если система удерживается в объёме V, потенциальная энергия оболочки, удерживающей систему, равняется произведению pV.
Следовательно, энтальпиюнужно понимать как энергию расширенной термодинамической системы, включающей в себя саму систему и оболочку, удерживающую систему в заданном объёме.
В результате преобразования Лежандра, кроме энтальпии появилось ещё одно слагаемое — (-Vdp), имеющее смысл дифференциально малого количества некоторой работы  , т.е.:
, т.е.:
 . (2.12)
. (2.12)
Интеграл:
 (2.13)
(2.13)
носит название полезной внешней работы.
Графически полезная внешняя работа L‘, определяемая интегралом (2.14), изображается площадью слева от кривой зависимости p(V) в координатах p — V ( рис.2.2).
Запишем также полный дифференциал удельной энтальпии, выбрав в качестве независимых переменных T и p системы:
 . (2.14)
. (2.14)
 |
2.4. Теплоёмкость простой термодинамической системы
Запишем математическое выражение I начала термодинамики для простой системы в двух формах (2.11) (с использованием внутренней энергии и энтальпии) в развёрнутом виде с учётом полных дифференциалов для внутренней энергии (2.9) и энтальпии (2.14) и определения количества теплоты (1.4):
 (2.15)
(2.15)
Будем поддерживать постоянным объём системы, т.е. положим  Такой процесс называется изохорным. Тогда, т.к. теплоёмкость системы зависит от процесса, следует положить
Такой процесс называется изохорным. Тогда, т.к. теплоёмкость системы зависит от процесса, следует положить  . Из первого уравнения (2.15) получаем
. Из первого уравнения (2.15) получаем
 , (2.16)
, (2.16)
т.е. теплоёмкость при постоянном объёме есть изменение внутренней энергии системы при изменении температуры на единицу при поддержании постоянным её объёма.
загрузка…
Аналогичным образом, рассмотрев изобарный процесс, т.е. процесс при постоянном давлении  получим определение теплоёмкости при постоянном давлении:
получим определение теплоёмкости при постоянном давлении:
 , (2.17)
, (2.17)
т.е. теплоёмкость при постоянном давлении есть изменение энтальпии тела при изменении температуры на единицу при поддержании постоянным давления.
На основании (2.15) теплоёмкость произвольного термодинамического процесса может быть записана в двух эквивалентных формах (делим обе части уравнения на dT):
 (2.18)
(2.18)
Далее мы увидим, что теплоемкость зависит от того, какой термодинамический процесс происходит.
refac.ru
|
|
..:::Счетчики:::.. |
|
|
|
|
|
|
|
|


