МИКОБАКТЕРИИ Род Mycobacteriurn (сем. Mycobacteriaceae, порядок Actinomycetales) включает более 100 видов, широко распространенных в природе. Большая часть – сапрофиты и условно-патогенные. У человека вызывают туберкулез (М.tuberculosis – в 92% случаев, М.bovis - 5%, М.africanus – в 3%) и лепру (М.lерrае).
М.tuberculosis – туберкулез – хроническое инфекционное заболевание. В зависимости от локализации выделяют туберкулез органов дыхания и внелегочные формы (кожи, костей и суставов, почек и др.). Локализация зависит от путей проникновения и вида возбудителя.
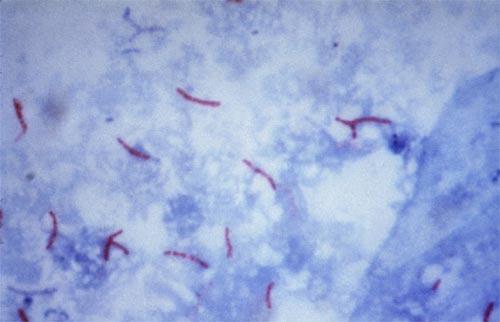
Морфология. Гр+, прямые или слегка изогнутые палочки длиной 2–8 и шириной 0,3 мкм. Высокое содержание липидов придает ряд характерных свойств: устойчивость к кислотам, щелочам и спирту, трудное восприятие анилиновых красителей (для окраски применяют метод Циля–Нильсена). В культурах встречаются зернистые формы, ветвящиеся, зерна Муха (шаровидные кислотоподатливые, легко окрашивающиеся по Грамму). Возможен переход в L-формы. Неподвижны, спор и капсул не образуют.
Для размножения используют сложные пит среды, содержащие яйца, глицерин, картофель. Стимулируют рост микобактерий АСП, соли NН4, альбумин, глюкоза, твин-80. Чаще всего применяют среду Левенштейна–Йенсена (яичная среда с добавлением картофельной муки, глицерина и соли) и среду, содержащую АСП, глицерин, цитрат Fe, фосфат калия. Размножаются медленно. Период генерации длителен – деление клеток в оптимальных условиях 1 раз в 14–15ч. Первые признаки роста обнаруживаются через 8–10 дней после посева. Затем на плотных средах появляются морщинистые, сухие с неровными краями колонии. В жидких средах – сначала нежная пленка на поверхности, затем утолщается и падает на дно. Среда при этом остается прозрачной.
АГ. Выделяют белковые, полисахаридные и липидные соединения. АТ образуются на туберкулиновые протеиды, на полисахариды, фосфатиды, корд-фактор. Специфичность АТ определяется в РСК, РНГА, преципитации в геле. АГ состав М.tuberculosis, М.bovis, M.leprae и других микобактерий (включая многие сапрофитические виды) сходен. Туберкулиновый протеин (туберкулин) обладает выраженными аллергенными свойствами.
Экология и распространение. В естественных условиях М tuberculosis вызывает туберкулез у человека, человекообразных обезьян. Из лабораторных животных высокочувствительными являются морские свинки, менее – кролики. К М.bovis – возбудитель туберкулеза у крупного рогатого скота, свиней и человека – высокочувствительны кролики и менее – морские свинки. М.africanus вызывает туберкулез в странах Африки. Путь заражения воздушно-капельный, возбудитель проникает через верхние дыхательные пути, иногда через слизистые оболочки ЖКТ или через поврежденную кожу.
В окружающей среде длительное время сохраняются (в высохшей мокроте – в течение нескольких недель, в воде – более года).
К действию дезинфицирующих веществ более устойчивы, чем другие бактерии Þ требуются более высокие концентрации и более длительное время воздействия. При кипячении погибают мгновенно, чувствительны к УФ.
Патогенез. Источник заражения – люди и животные с активно протекающим туберкулезом, с наличием воспалительных и деструктивных изменений, выделяющие микобактерии. В зоне проникновения и размножения возникает воспалительный очаг (первичный эффект – инфекционная гранулема), наблюдаются сенсибилизация и специфический воспалительный процесс в регионарных лимфоузлах – формируется первичный туберкулезный комплекс. При доброкачественном течении болезни первичный очаг может рассасываться, пораженный участок кальцинироваться и рубцеваться. Но этот процесс не завершается полным освобождением от возбудителя. В лимфоузлах и других органах туберкулезные бактерии сохраняются много лет, иногда в течение всей жизни. Такие люди, с одной стороны, обладают иммунитетом, а с другой – остаются инфицированными.
При сниженной сопротивляемости организма первичный туберкулезный процесс генерализуется. Диссеминация приводит к образованию в различных органах туберкулезных очагов. Характерна интоксикация. При генерализации – поражение органов мочеполовой системы, костей и суставов, мозговых оболочек, глаз.
Не синтезируют экзотоксин. Поражение тканей вызывает ряд веществ – липиды, мураминдипептид, фтионовые кислоты, сульфатиды, туберкулин, возникают специфические гранулемы и поражение тканей. Токсическое действие оказывает гликолипид, так называемый корд-фактор, разрушает митохондрии клеток, нарушает функцию дыхания.
Патогенетически важным является действие на организм инфицированного человека туберкулина. Очищенный от примесей туберкулин (PPD – очищенный протеиновый дериват) является белком. Внутрикожное введение туберкулина вызывает у инфицированных людей местную воспалительную реакцию в виде инфильтрата и покраснения (реакция Манту). Неинфицированные люди реакции на туберкулин не дают. Эту пробу применяют для выявления инфицированных, сенсибилизированных людей.
Иммунитет. Заражение не всегда приводит к развитию заболевания, это зависит от состояния микроорганизмов. Восприимчивость усиливается в неблагоприятных условиях (изнурительный труд, недостаточное и неполноценное питание, плохие жилищные условия и т.д.). Способствуют развитию туберкулезного процесса и эндогенные факторы – сахарный диабет; психические болезни и др. Значение АТ в формировании сопротивляемости к туберкулезной инфекции до сих пор неясно. Считается, что АТ являются «свидетелями» иммунитета и не оказывают ингибирующего действия на возбудитель.
Большое значение имеет клеточный иммунитет. По РБТЛ, цитотоксическому действию лимфоцитов на клетки-«мишени», содержащие АГ микобактерии, выраженности РТММ судят о течении заболевания. Т-лимфоциты после контакта с АГ синтезируют медиаторы, усиливающие фагоцитарную активность макрофагов. При подавлении функции Т-лимфоцитов туберкулезный процесс становится быстротечным и тяжелым.
Микобактерии туберкулеза разрушаются внутриклеточно в макрофагах. Фагоцитоз является одним из механизмов, приводящих к освобождению организма от микобактерии туберкулеза, но он часто незавершенный.
Другой важный механизм – фиксация микобактерий в очагах благодаря образованию инфекционных гранулем при участии Т-лимфоцитов, макрофагов и других клеток. В этом проявляется защитная роль ГЗТ.
Иммунитет при туберкулезе раньше называли нестерильным. Значение имеет не только сохранение живых бактерий, поддерживающих повышенную сопротивляемость к суперинфекции, но и явление «иммунологической памяти». При туберкулезе развивается реакция ГЗТ.
Лабораторная диагностика. Материалом для микробиологического исследования в зависимости от локализации процесса служат мокрота, гной, моча, спинномозговая жидкость, испражнения.
Бактериоскопическое исследование. Мокроту выливают в чашку Петри, ставят на черную поверхность стола, выбирают гнойные комочки, наносят их на предметное стекло и растирают между двумя стеклами. Спинномозговую жидкость для образования пленки фибрина и фиксации в ней микобактерии туберкулеза оставляют на сутки в холодном месте. Затем ее осторожно распределяют на предметном стекле. Мочу центрифугируют для получения осадка. Сделанные мазки окрашивают по Цилю–Нельсену. Микобактерии туберкулеза окрашиваются в ярко–красный (рубиновый) цвет. Если в материале находится небольшое количество микобактерии и в обычных мазках их нельзя обнаружить, применяют методы обогащения.
Метод гомогенизации. Суточную порцию мокроты выливают во флакон или банку, добавляют равный объем 1% водного раствора натрия гидроксида, плотно закрывают резиновой пробкой и энергично встряхивают до, полной гомогенизации (10–15 мин). Утратившую вязкость мокроту центрифугируют, жидкость сливают, осадок нейтрализуют добавлением 2–3 капель 10% соляной кислоты. Из осадка готовят мазки и окрашивают по Цилю–Нельсену.
Метод флотации. Подвергнутую щелочной гомогенизации мокроту для более полного растворения оставшихся слизистых комков помещают на 30 мин на водяную баню при температуре 55°С. Затем к ней добавляют 1–2 мл ксилола (бензола, бензина) и встряхивают в течение 10 мин, потом отстаивают 20 мин при комнатной температуре. Капельки ксилола с адсорбированными микобактериями всплывают, образуя сливкообразный слой, его снимают пипеткой и несколько раз наносят по мере высыхания на предметное стекло. Сделанные мазки тоже окрашивают по Цилю–Нельсену.
Бактериологический метод. Выделить культуру микобактерии туберкулеза удается при наличии в 1 мл исследуемого материала даже 20–100 микробных тел. При этом определяют ее устойчивость к лекарственным препаратам, для того чтобы разработать индивидуальную схему лечения больных.
Выделяя из мокроты культуру микобактерии туберкулеза, к ней в целях уничтожения кислотоподатливой микрофлоры добавляют двойной объем 6% серной кислоты, встряхивают в течение 10 мин, центрифугируют. Затем жидкость сливают, осадок нейтрализуют 1–2 каплями 3% натрия гидроксида или несколько раз отмывают изотоническим раствором натрия хлорида. Нейтрализованные осадки мокроты засевают на скошенную в пробирках яичную среду Левенштейна–Йенсена с малахитовым зеленым, который угнетает рост банальной микрофлоры.
Спинномозговая жидкость, экссудат, гной, кровь кислотно–щелочной обработке не подвергаются, их засевают на среду Левенштейна–Йенсена пипеткой с последующим втиранием бактериальной петлей. Ватные пробки, которыми закрывают засеянные пробирки, заливают парафином, чтобы избежать высыхания среды. Посевы помещают в термостат при температуре 37°С и выдерживают в течение 6–8 недель.
Биологический метод. Животных, чаще морских свинок, заражают для выделения чистых культур микобактерии туберкулеза и изучения патогенеза заболевания. Поскольку большинство изониазидустойчивых штаммов утратило к ним вирулентность, биологический эксперимент в настоящее время не находит широкого применения.
Аллергическая реакция Манту. Выполняют ее путем внутрикожного введения 0,1 мл альт–туберкулина в ладонную поверхность предплечья. Ее результат учитывают через 24–48 ч. В положительных случаях на месте введения туберкулина появляется инфильтрат с венчиком гиперемии диаметром 10 мм, который чаще всего свидетельствует об инфицированности туберкулезом, а у 2–3–летних детей может также являться диагностическим тестом активно развивающейся болезни.
Профилактика и лечение. Для специфической профилактики – живая вакцина БЦЖ-BCG (Bacille Calmette–Guerin). Штамм БЦЖ был получен при длительном пересеивании палочек на картофельно-глицериновой среде с добавлением желчи. За 13 лет была получена культура со сниженной вирулентностью. В нашей стране в настоящее время вакцинируют всех новорожденных на 5–7-й день жизни внутрикожно. Ревакцинация – лицам с отрицательной туберкулиновой пробой с интервалом в 5–7 лет до 30-летнего возраста. Создают т.о. инфекционный иммунитет, при котором возникает реакция ГЗТ. Для лечения – АБ, химиотерапевтические препараты I ряда: тубазид, фтивазид, изониазид, дигидрострептомицин, ПАСК и II ряда: этионамид, циклосерин, канамицин, рифампицин, виомицин. Также проводится десенсибилизирующая терапия и стимуляция естественных защитных механизмов организма.

studfiles.net
Наиболее характерные изменения в анализах крови.У больных с начальными формами туберкулеза в крови содержится нормальное количество эритроцитов и гемоглобина. По мере нарастания патологических изменений в легочной ткани может развиться гиперхромная анемия, при резком исхудании больного могут наблюдаться явления гипохромной анемии. Может наблюдаться лейкоцитоз в пределах 12—15∙109. или количество лейкоцитов в норме. Более характерен нейтрофильный сдвиг влево.
Тяжелые формы туберкулеза протекают с эозинопенией и лимфопенией. При малых и свежих формах туберкулеза обычно наблюдается лимфоцитоз.
Повышенная СОЭ зависит от процесса туберкулеза, только при туберкулезном менингите она может быть в пределах нормы.
Обнаружение микобактерий.Имеет решающее значение не только для диагностики туберкулеза, оно чрезвычайно важно при прогнозировании течения процесса, выборе рациональной схемы лечения … и правильной оценке его эффективности.
Основными методами лабораторной диагностики туберкулеза являются классические микробиологические методы: бактериоскопия; культуральное исследование, или посев; биологическая проба на чувствительных к туб. инфекции лабораторных животных.
Сбор материала на исследование. От соблюдения правил сбора, хранения и транспортировки биолог. материала зависит не только достоверность результатов, но и эпидемиологическая безопасность окружающих.
Материал для исследования собирают в стерильные контейнеры (стеклянные банки) с плотно завинчивающимися крышками. Это предотвращает попадание содержимого и загрязнение окружающей среды микобактериями и обеспечивает изоляцию исследуемого материала от широко распространенных в окружающей среде кислотоустойчивых бактерий.
Для исследования может быть использован разнообразный патологический материал: мокрота, аспират, содержимое бронхов и другие материалы, получаемые при бронхоскопии, промывные воды бронхов и желудка, экссудаты, гной, отделяемое ран, спинномозговая жидкость, кровь, моча, операционный материал, смывы с предметов и др.
У больных легочными формами объектом исследования чаще служит мокрота. Желательно, чтобы сбор мокроты производился в отдельной, хорошо вентилируемой комнате. Собирают утреннюю порцию. Если больной выделяет мало мокроты, ее следует собирать в течение суток, при этом обязательно собранный материал хранить в холодильнике. Если исследование проводится на фоне лечения, за 2 суток до сбора мокроты прием противотуберкулезных препаратов отменяется. Сбор мокроты должен производиться в присутствии и при непосредственном участии среднего мед. персонала.
Лица, ответственные за сбор мокроты, руководствуются следующими правилами:
1. Объяснить больному причины исследования и необходимость откашливать содержимое глубоких отделов дыхательных путей, а не собирать слюну или носоглоточную слизь. Необходимо предупредить больного, что он должен предварительно почистить зубы и прополоскать полость рта кипяченой водой, чтобы механически удалить основную часть микрофлоры, вегетирующей в ротовой полости.
2. Присутствующий при сборе мокроты мед. работник должен открытьь стерильный контейнер, снять с него крышку и передать больному только донную часть контейнера.
3. Стоя позади больного, следует рекомендоватьему держать контейнер как можно ближе к губам и сразу же сплевывать в него мокроту по мере ее откашливания.
4. По завершении сбора мокроты мед. работник оценивает ее количество и качество; контейнер с порцией мокроты не менее 3-5 мл, содержащей уплотненные или гнойные комочки без слюны, тщательно закрывают завинчивающейся крышкой, маркуруют и помещают в специальный ящик для транспортировки в лабораторию.
Если больной не выделяет мокроту или выделяет ее только эпизодически и в скудном количестве, то накануне и рано утром в день сбора мокроты больному следует дать отхакивающее средство или применить раздражающие аэрозольные ингаляции (усиливаются секреция бронхов, кашль и отделение мокроты). Для этого используют портативные аэрозольные ингаляторы. В качеств ингалируемой смеси можно использовать 15% р-р хлорида натрия в 1% р-ре бикарбоната натрия (150г NaCl и 10г NaHCO3 на 1 литр дистиллированной воды).
Если мокроту не удалось получить, используют промыные воды бронхов или желудка (преимущественно у детей младшего возраста, которые плохо откашливают мокроту и заглатывают ее).
Промывные воды желудка берут натощак, предварительно дав больному выпить или введя через зонд 100—150 мл раствора бикарбоната натрия (питьевой соды). Промывные воды желудка должны исследоваться немедленно, чтобы исключить повреждающее воздействие на возбудителя желудочных ферментов.
Более ценным материалом для исследования при отсутствии мокроты являются аспираты из трахеи и бронхов, бронхоальвеолярная лаважная жидкость, а также материалы прицельной биопсии, получаемые при бронхологических исследованиях.
Исследование кала на микобактерии необходимо производить при наличии признаков туберкулеза кишечника. Для исследования берут несколько комочков кала со слизью или гноем, размешивают с 5%-м изотоническим раствором хлорида натрия и фильтруют. В настоящее время туберкулез кишечника встречается исключительно редко, а поэтому исследование кала на БК практически не производится.
Для обнаружения микобактерии в плевральном экссудате, в пунктатах и отделяемом из свищей препарат приготавливают так же, как и при исследовании мокроты.
Особого методического подхода требует исследование менструальной крови. Этот материал незамедлительно доставляют в лабораторию.
Сбор мочи. Для исследования используют обычно среднюю порцию утренней мочи, полученной после тщательного туалета наружных половых органов растворами антисептиков (слабый раствор перманганата калия, риванола и пр.)
Хранение, консервация и транспортировка диагностического материала. В противотуберкулезных учреждениях функционируют специализированные лаборатории, производящие бактериологические исследования.
В стационарах стерильные контейнеры с мокротой или другим патологическим материалом доставляются непосредственно в лабораторию. Сбор материала от амбулаторных больных производится под непосредственным наблюдением среднего медицинского работника.
Если в лечебном учреждении не проводятся исследования для выявления кислотоустойчивых микобактерий, собранный диагностический материал должен централизованно доставляться в лабораторию. Обычно такая доставка осуществляется один или два раза в неделю. Следовательно, материал должен накапливаться в течение нескольких дней. Для этого используют биксы или специальные транспортировочные ящики, вмещающие 10 — 20 контейнеров, которые хранятся в холодильнике.
Во время транспортировки материал необходимо предохранять от воздействия прямых солнечных лучей и тепла. В определенных ситуациях используют консервант — 2 —3%-й раствор борной кислоты в соотношении 1:1 или глицерин. В качестве консерванта можно также использовать 10%-й раствор трехзамещенного фосфата натрия или 0,05—0,1%-й раствор хлоргексидин биглюконата в соотношении 1:1; Рост микобактерий может быть получен даже после хранения мокроты с консервантом при температуре 30 °С в течение 10—12 дней.
Бактериоскопическое исследование. Оно является одним из основных и наиболее распространенных методов. Преимущества его заключаются в простоте, дешевизне и быстроте получения результатов. Однако возможности метода ограничены. В препарате можно обнаружить единичные микобактерии, если в 1 мл материала содержится не менее 10 000— 100 000 бактериальных клеток (предел метода).
Наиболее распространенным методом окраски для выявления кислотоустойчивых микобактерий является способ Циля—Нильсена.
Мокроту на предметном стекле окрашивают карболовым фуксином, при одновременном воздействии нагревания обесцвечивают мазок в 3%-м растворе солянокислого спирта (приводит к обесцвечиванию всех некислотоустойчивых структур) и докрашивают метиленовым синим. Только микобактерии, обладающие выраженной кислото- и спиртоустоичивостью, стойко удерживают краситель и остаются окрашенными в красный цвет.
Микобактерии обнаруживаются в препарате в виде тонких, прямых или слегка изогнутых ярко-красных палочек.
В настоящее время применяется метод окраски люминисцентными красителями (более высокая информативность).
В тех случаях, когда в патологическом материале не удается обнаружить микобактерии методом бактериоскопии, производят бактериологическое исследование. Культуральный метод — посев материала на питательные среды. Преимущество метода в высокой чувствительности. Достаточно 20—100 микобактерий в 1 мл материала. Недостаток метода заключается в длительности роста колоний: 1 — 3 мес.
Применение двух методов в совокупности позволяет более точно количественно оценить степень бактериовыделения.
Исследуемый материал высевают на специальные среды после предварительной обработки. Наиболее часто используют яичные среды. Первые колонии микобактерий появляются на 18 —30-й день, а иногда и через 3 месяца.
Бактериологическое и бактериоскопическое исследование необходимо проводить в сочетании.
Биологический метод заражения животных сейчас применяется только в научно-исследовательских институтах.
В настоящее время началось использование молекулярно-биологического метода — полимеразной цепной реакции (ПЦР). Сначала выделяется ДНК микобактерии, затем она клонируется и идентифицируется. Метод очень чувствительный (достаточно 1 МБТ), однако без одновременной оценки клинической картины заболевания использовать его надо осторожно. Это — перспективный метод, но его роль еще до конца не определена.
Определение лекарственной устойчивости микобактерий.В настоящее время разработаны и внедрены в практическую деятельность диспансеров методы определения лекарственной чувствительности (устойчивости) микобактерий к туберкулостатическим препаратам. Различают первичную лекарственную устойчивость у больных, не леченных противотуберкулезными препаратами, и вторичную, развивающуяся в процессе лечения. Частота первичной устойчивости составляет 20 —80 %.
Лекарственная устойчивость микобактерий может быть: моно — к одному препарату, множественная — к смеси изониазида и рифампицина, полирезистентная — к двум и более препаратам кроме рифампицина и изониазида, перекрестная — к препаратам со сходной химической структурой.
В настоящее время внедряются генетические методы определения лекарственной устойчивости с помощью ПЦР-метода.
| | | следующая лекция ==> | |
| Туберкулин. | | | Общие принципы лечения больных. |
refac.ru
Бациллы-возбудители сибирской язвы
Для лабораторного исследования на сибирскую язву чаще всего направляют ухо павшего животного. Можно взять кровь из надреза сосуда и нанести толстую каплю на предметное стекло...
Биологические особенности стрептококков как возбудителей гнойно-воспалительных заболеваний человека
...
Биологические особенности стрептококков как возбудителей гнойно-воспалительных заболеваний человека
Исследованию подвергают мокроту, гной, спинномозговую жидкость, кровь, органы трупа. Микроскопия. Из исследуемого материала (кроме крови) готовят два мазка, один из которых окрашивают по Граму, а другой (для обнаружения капсул) - по Бурри...
Ветеринарно-санитарная экспертиза продуктов убоя птицы при инфекционных болезнях бактериальной этиологии
Прижизненная диагностика микоплазмоза основана на сероконверсии, построения на её основе гемо (серо) грамм и расшифровка антител с использованием цветного или эритроцитарного антигенов...
Ветеринарно-санитарная экспертиза продуктов убоя птицы при инфекционных болезнях бактериальной этиологии
Микробиологическая диагностика: 1) микроскопия - ориентировочная; 2) бактериологический метод - применяется, как обязательный и точный; 3) серологическая диагностика - используют при ревматизме...
Ветеринарно-санитарная экспертиза продуктов убоя птицы при инфекционных болезнях бактериальной этиологии
Поражение суставов в сочетании с септицемией и везикулярным дерматитом позволяет лишь подозревать стафилококкоз. Окончательный диагноз ставят при выделении возбудителя. Микробиологическая диагностика...
Ветеринарно-санитарная экспертиза продуктов убоя птицы при инфекционных болезнях бактериальной этиологии
...
Вирусный гепатит С
Диагностика ВГС основывается на сочетании специфических и неспецифических методов исследования. В первую очередь надо выяснить есть ли у пациента в анамнезе: переливания крови, оперативные вмешательства, внутривенное введение наркотиков...
Витамин В1
витамин фармакология тиамин передозировка Существуют критерии обеспеченности организма витамином В1 , основанные на определении плазменного (сывороточного) уровня...
Лимфолейкоз
В зависимости от стадии заболевания костный мозг может быть нормо- или гиперклеточным. Процент лимфоцитов в стернальном пунктате колеблется в широких пределах от 20-30% вплоть до тотальной мономорфной лимфоидной инфильтрации...
Менингококковая инфекция
Менингококковый назофарингит подтверждается высевом и идентификацией менингококка из носа и ротоглотки. При генерализованных формах делают посевы крови и спинномозговой жидкости на питательные среды, содержащие человеческий белок...
Патогенные кокки
Исследуют раневой экссудат, гной абсцессов, ран, молоко при маститах, выделения из половых органов при эндометрите, кровь из яремной вены при септицемии. Из патологического материала готовят мазки, окрашивают по Граму, микроскопируют...
Патогенные кокки
Патологический материал (слизи-стые истечения из носовых отверстий, гнойный экссудат или пунктат подчелюстных лимфоузлов), направленный в лабораторию...
Патогенные кокки
...
Патогенные кокки
В лабораторию направляют трупы молодняка или паренхиматозные органы, трубчатые кости, суставы, кровь сердца в запаянных пипетках, головной мозг...
med.bobrodobro.ru
Стандартной методикой является окраска препарата по Цилю-Нильсену карболфуксином с последующей микроскопией при 1000-кратном увеличении. Эта методика должна выполняться в условиях клинических лаборатории, начиная с уровня поликлиник, и входит в поликлинический и клинический минимум обследования пациента, страдающего кашлем с мокротой (3-кратное микроскопическое исследование мокроты на микобактерии туберкулеза). Бактериоскопия мокроты должна проводиться и больным хроническими заболеваниями органов дыхания и мочевыводящей системы, а также работникам неблагополучных по туберкулезу животноводческих хозяйств.
При обнаружении в мазке в одном поле зрения 5 и более микобактерии вероятность получения положительного результата посева материала на питательные среды значительно возрастает.
Метод люминесцентной микроскопии основан на способности липидов микобактерии туберкулеза связывать флюоресцентные красители (аурамин,родамин), которые светятся под воздействием коротких синих и ультрафиолетовых лучей.
При помощи этого метода дополнительно, по сравнению с возможностями обычной бактериоскопии, можно выявить микобактерии туберкулеза в 17% случаев исследования нативных мазков и в 8% случаев исследования мазков из флотационных колец.
Частота выявления микобактерии у больных туберкулезом при микроскопии мокроты составляет, по данным разных авторов, от 48 до 87%, а плевральной жидкости - до 2%. При этом сравнение данных микроскопических исследований с данными культуральных исследований показывает, что доля ложноположительных результатов составляет до 6%. При исследованиях материала из очагов внелегочной локализации чувствительность и специфичность метода микроскопии еще ниже.
Данные культуральных исследований более информативны, чем бактериоскопических методов, но получить ответ о наличии возбудителя туберкулеза можно лишь через несколько недель.
Посев мокроты на классические элективные среды (Левенштайна - Йенсена и др.) входит в перечень методов, выполняемых бактериологическими лабораториями. Рост первых колоний отмечают через 4-8 нед. Использование современных высокоселективных сред позволяет получать культуры в течение 1-2 нед, однако идентификация требует дополнительного времени.
Кроме мокроты материалом как для мазка, так и для посева является аспират желудочного содержимого, взятый натощак рано утром. Однако частота находок составляет 4-5%. В мокроте у этих же больных выявление микобактерии в 6-10 раз чаще.
Современные бактериологические методы выявления микобактерии туберкулеза в исследуемом материале, к сожалению, характеризуются невысокой чувствительностью.
До появления молекулярно-генетических методов биологический метод считался наиболее чувствительным. Однако, в случаях, когда в исследуемом материале содержатся микобактерии, высоко устойчивые к препаратам изоникотиновой кислоты, не всегда удается получить развитие генерализованного туберкулеза, так как такие микобактерии иногда оказываются невирулентными или маловирулентными для морских свинок.
Современные культуральные и молекулярно-генетические методы считаются достаточно информативными, поэтому биологические пробы с заражением морских свинок являются неперспективными.
4.1.1. Проба Манту
Туберкулинодиагностика используется при первичной диагностике туберкулеза и оценке активности процесса, представляет собой определение реакции организма на внутрикожное введение туберкулина. Основным методом диагностики туберкулеза у детей является массовая туберкулинодиагностика, что обеспечивает выявление преимущественно ограниченных форм туберкулеза. Среди всех, впервые взятых на учет, ежегодно не менее 77% больных детей выявляется с помощью туберкулиновых проб. Применение туберкулиновых проб у взрослых в качестве скрининга нецелесообразно, т.к. до 80% взрослого населения инфицировано микобактериями туберкулеза.
Туберкулин - препарат, приготовленный из культуры микобактерий туберкулеза (протеиновая фракция) и обладающий их антигенными свойствами. В инфицированном организме при нормальной (или повышенной) иммунологической реактивности в ответ на введение антигенов микобактерий туберкулеза развивается реакция гиперчувствительности замедленного типа (ГЗТ)5.
Виды туберкулина
Aльттуберкулин Коха (AТК), или старый туберкулин Коха, представляет собой автоклавированный фильтрат 6-9 недельной культуры M.tuberculosis.
На смену AТК пришли очищенные стандартные препараты туберкулина Зейберта - РРD-3 (Purified Protein Derivative - очищенный белковый дериват) и М. А. Линниковой - РРD-Л. Названные препараты освобождены от белковых составляющих питательной среды, что увеличивает специфичность реакции организма на туберкулин. На практике применяют стандартные растворы РРD-Л, содержащие 2 ТЕ (для массовых обследований).
Метод туберкулинодиагностики
Принятым методом проведения туберкулинодиагностики для массового обследования населения и в практике противотуберкулезных учреждений в России является внутрикожная проба Манту.
Порядок проведения пробы Манту:
-обрабатывают кожу средней трети внутренней поверхности предплечья ватным тампоном с 70% спиртом,
-в туберкулиновый (1 мл) шприц набирают 0,2 мл стандартного раствора РРD-Л,
-через инъекционную иглу в вертикальном положении из шприца выпускают пузырьки воздуха с 0,1 мл РРD-Л,
-вводят в кожу иглу срезом вверх, при этом положение шприца должно быть максимально параллельным поверхности предплечья,
-место инъекции повторно спиртом не обрабатывают (РРD-Л содержит антисептик).
Учет реакции - наличие папулы и гиперемии: измерение диаметра папулы (наибольшего в случае появления клеточного инфильтрата в форме неправильном окружности) проводят прозрачной линейкой через 48-72 ч.
Результат внутрикожной туберкулиновой пробы оценивается как отрицательный (анергическая реакция - папула отсутствует, возможна гиперемия в месте инъекции), либо как положительный, который в свою очередь оценивается как нормергическая ( папула диаметром от 5 мм до 17 мм у детей и до 21 мм у взрослых) или гиперергическая реакция (папула диаметром более 17 мм у детей и 21 мм у взрослых; везикуло-некротическне изменения и/или регионарный лимфангит и лимфаденит независимо от размеров папулы).
Отрицательная реакция (туберкулиновая анергия), как правило, свидетельствует об отсутствии иммунитета к микобактериям туберкулеза, она наблюдается у людей, не контактировавших с М. tuberculosis, и у больных с тяжелой прогрессирующей формой туберкулеза, иммунитет которых не сформировался или подавлен в условиях ослабленного, истощенного организма на фоне злокачественных новообразований, приема иммунодепрессантов, инфекционных и других заболеваний и состояний, приводящих к иммунодефициту. Вирусные гепатиты, корь, коклюш, скарлатина, малярия, саркоидоз, микседема, белковое голодание, прием цитостатиков и глюкокортикондов вызывают у больных туберкулезом снижение или полное отсутствие реактивности к туберкулину. В ряде случаев в результате успешно проводимой терапии туберкулеза и сопутствующего заболевания или отмены иммунодепрессантов реактивность у таких больных восстанавливается.
yaneuch.ru