Курсовая работа: Строение и свойства вещества. Строение вещества реферат химия
Реферат - Строение и свойства вещества
Министерство путей сообщения
Российской Федерации
Дальневосточный Государственный Университет путей сообщения
КАФЕДРА
«Химия»
Курсовой проект
на тему:
«Строение и свойства вещества»
К.П. 1001. 1. 615
Выполнил: Глухих П.А.
Проверил: Рапопорт Т.В.
г. Хабаровск
1999
Цель занятия: изучить свойства веществ в твёрдом состоянии, рассмотреть типы кристаллических решёток, сущность явления проводимости.
1.1 Характеристика вещёства в твёрдом состоянии.
Твёрдые вещества характеризуются следующими показателями: расстояния между частицами (атомами, молекулами) соизмеримы с их размерами, потенциальная энергия частиц значительно превосходит кинетическую, частицы находятся в тепловом колебательном движении.
Твёрдые вещества делятся на аморфные и кристаллические.
Таблица 1.1
Общая характеристика аморфных и кристаллических веществ
Аморфное состояние (стеклообразное) | Кристаллическое состояние |
Ближний порядок расположения частиц Изотропность физических свойств Отсутствие конкретной точки плавления Термодинамическая нестабильность (большой запас внутренней энергии) Текучесть Примеры: органические полимеры – стекло, вар, янтарь и т.д. | Дальний порядок расположения частиц Анизотропность физических свойств Конкретная температура плавления и кристаллизации Термодинамическая устойчивость (малый запас внутренней энергии) Обладают элементами симметрии Примеры: углерод (алмаз, графит), твёрдые соли, металлы, сплавы. |
Геометрическая форма кристалла – это следствие его внутреннего строения, которое характеризуется определённым расположением частиц в пространстве, обуславливающим структуру и свойства данного кристалла (пространственная кристаллическая решётка).
Основные параметры кристаллических решёток описаны в таблице 1.2
Таблица 1.2
Параметры кристаллической решётки (к.р.)
| Параметры | Определения |
1. Энергия кристаллической решётки, кДж/моль 2. Константа к.р. (d,[Ao]) 3.Координационное число | Энергия, которая выделяется при образовании 1моль кристалла из микрочастиц (атомов, молекул, ионов), находящихся в газообразном состоянии и удалённых друг от друга на расстояние, исключающее их взаимодействие Наименьшее расстояние между центрами 2-х частиц в кристалле, соединённых химической связью Число частиц, окружающих в пространстве центральную частицу, связанных с ней химической связью |
В зависимости от вида частиц, находящихся в узлах кристаллической решётки и типа связи между ними, кристаллы бывают различных типов (см. табл. 1.3).
Таблица 1.3
Типы кристаллов и их свойства
| Тип кристалла (по типу хим. связи) | Вид частиц в узлах к.р. | Тип связи между частицами | Основные свойства кристаллов | Примеры веществ |
| Молекулярные | Неполярные или полярные молекулы | Межмолекулярные силы; водородные связи | Низкая теплопроводность и электропроводимость, низкая химическая прочность и темп. плавл.; высокая летучесть | Твёрдые галогены, СН4, Н2, СО2 (кр.), Н2 О (кр), N2 (кр.) |
| Ковалентные (атомные) | Атомы одного или разных элементов | Ковалентные связи | Высокая температура плавл., твёрдость и механ. Прочность; широкий диапазон электропроводности: от изоляторов (алмаз) и полупроводников (Ge, Si) до электронных проводников (Sn) | Кристаллы простых и сложных веществ элементов 3-й и 4-й групп главных подгр. Салм, Si, Ge, Snc, SiC, AlN, BN и др. |
| Ионные | Простые и сложн. ионы | Ионная св. – электростатическое взаимодействие | Промежуточное положение между молекулярными и ковалентными кристаллами; как правило, хор. растворимы в полярн. расторит.; диэлектрики | NaCl, CaF2, LiNO3, CaO и др. |
| Металлические | Атомы и ионы металлов | Металлическая связь | Ковки, пластичны; высокие тепло- и электропроводимость непрозрачность, металич. блеск | Чистые металлы и сплавы |
1.2. Кристаллические проводники, полупроводники, изоляторы. Зонная теория кристаллов.
Все известные кристаллические вещества по величине электропроводимости подразделяются на три класса: проводники, диэлектрики (изоляторы), полупроводники (таблица 1.4).
Таблица 1.4.
Деление кристаллических веществ по величине электропроводимости
 Класс кристаллич. Вещества Класс кристаллич. Вещества | Электропроводность | Общая характеристика | Примеры |
     Проводники 1-го рода Проводники 1-го рода
Диэлектрики Полупроводники | Вещества с металлической кристаллической решёткой, характеризующейся наличием “переносчиков тока” – свободно-перемещающихся электронов Вещества с атомной, молекулярной и реже ионной решёткой, обладающие большой энергией связи между частицами Вещества с атомной или реже ионной решёткой, обладающие более слабой энергией связи между частицами, чем изоляторы; с ростом температуры электропроводимость растет | Fe, Al, Ag, Cu и др. Салмаз, слюда, органич. Полимеры, оксиды и др. Si, Ge, B, серое олово и др. |
Различие в величине электропроводимости металлов, полупроводников и диэлектриков объясняет зонная теория строения твёрдого тела , основные положения которой сводятся к следующему. При образовании кристалла из одиночных атомов происходит перекрытие атомных орбиталей (АО) близких энергий и образование молекулярных орбиталей (МО), число которых равно общему числу перекрывающихся АО.
С ростом числа взаимодействующих атомов в кристалле растет число разрешённых молекулярных энергетических уровней, а энергетический порог между ними уменьшается. Образуется непрерывная энергетическая зона, в которой переход электронов с более низкого энергетического уровня на более высокий не требует больших затрат энергии.
Заполнение электронами МО, составляющих непрерывную энергетическую зону, происходит в порядке возрастания энергии, согласно принципу Паули. В кристалле натрия при образовании N MO, только N/2 MO будут заняты электронами, т.к. у атома Na на каждой валентной 3S АО находится по 1 электрону, а на каждой МО будет располагаться по 2е с противоположными спинами.
Совокупность энергетических уровней, занятых валентными электронами, составляет валентную зону .
Энергетические уровни, незаполненные электронами, составляют зону проводимости.
В кристаллах проводников валентная зона находится в непосредственной близости от зоны проводимости и иногда перекрывается с ней. Е – энергетический барьер близок к нулю. (см. рис.1)
Рис1. Расположение энергетических зон в кристаллах:
— зона проводимости; — валентная зона; ¯DЕ=запрещенная зона
Электроны валентной зоны при их незначительном возбуждении могут легко перейти на свободные энергетические уровни зоны проводимости, что обеспечивает высокую проводимость металлов.
У изоляторов зона проводимости отделена от валентной зоны большим энергетическим барьером (>4эВ). Валентные электроны не могут попасть в зону проводимости даже при передаче им значительного кол-ва энергии, т.к. электроны не могут свободно перемещаться по всему объёму кристалла, проводимость в кристалле отсутствует.
Ширина запрещённой зоны проводников невелика – от 0.1 до 4эВ. При низких температурах они проявляют свойства изоляторов. С повышением температуры энергия валентных электронов возрастает и становится достаточной для преодоления запрещённой зоны. Происходит перенос электрических зарядов, полупроводник становится проводником.
1.3. Собственная и примесная проводимость полупроводников. Дефекты реальных кристаллов.
К типичным собственным полупроводникам относятся В, Si, Ge, Te, Sn(серое)и др. на каждом энергетическом уровне валентной зоны у них находится по 2 электрона (см. рис.2)
Рис2. Собственная проводимость
После получения кванта энергии связь между этой парой электронов нарушается и один электрон покидает валентную зону, переходя зону проводимости. В валентной зоне на его месте остаётся вакансия (+)-дырка. При наложении внешнего электрического поля электроны, перешедшие в зону проводимости, перемещаются к А(+), в валентной зоне электрон, находящийся рядом с дыркой (+), занимает её место, появляется новая дырка и т.д. Таким образом, дрейф электрона к А(+) эквивалентен дрейфу дырки к К(-).
Электропроводность, обусловленная одновременным участием в проводимости е и р, называется собственной или электронно-дырочной проводимостью (n – p) типа. Для каждого полупроводника собственная проводимость наступит при разных величинах температур, которые тем выше, чем больше величина запрещённой зоны полупроводника. В настоящее время известно 13 кристаллических модификаций простых веществ обладающих полупроводниковыми свойствами. Они находятся в главных подгруппах 3 – 7 групп Периодической системы элементов Д.И. Менделеева.
3-я группа – В; 6-я группа – S, Se, Te;
4-я группа – S, Si, Ge, Sn; 7-я группа – I.
5-я группа – P, As, Sb, Bi;
В кристаллах простых веществ этих элементов ковалентный или близкий к нему характер химической связи. Ширина запрещённой зоны зависит от прочности ковалентной связи и структурных особенностей кристаллических решёток полупроводника.
К полупроводникам с узкой запрещённой зоной относятся Sn(серое), Р – чёрный, Те. Заметный перенос электронов в зону проводимости наблюдается уже за счёт лучистой энергии.
К полупроводникам с широкой запрещённой зоной относятся Bi, Si – для осуществления проводимости требуется мощный тепловой импульс; для Салм. — g-облучение.
Получить идеальный кристалл как естественным, так и искусственным путём практически невозможно. Кристаллы, как правило, имеют дефекты в виде структурных нарушений или примесей атомов других элементов. Дефекты кристаллов приводят к усилению дырочной, электронной проводимости или появлению дополнительной ионной проводимости.
Усиление примесной проводимости n-типа происходит, если в кристалле Ge один из атомов замещен атомом Р, на внешнем энергетическом уровне которого находится 5 валентных электронов, 4 из которых образуют ковалентные связи с соседними атомами Ge, а один электрон находится на свободной орбитали у атома фосфора. При передаче кристаллу Ge небольшой энергии (4,4 кДж/моль) этот электрон легко отщепляется от примесного атома Р и проникает из валентной зоны через запрещённую зону в зону проводимости, т.е. служит переносчиком тока. В целом же кристалл Ge остаётся электронейтральным (рис.3). Примеси в кристаллах, атомы которых способны отдавать электроны, усиливая электронную проводимость, называются донорами. По отношению к Ge, Si – это р-элементы 5-й группы, а также Аu и ряд других элементов.
а) б)
=Ge====Ge====Ge= =Ge====Ge====Ge=
=Ge====P=====Ge= =Ge====Al====Ge=
=Ge====Ge====Ge= =Ge====Ge====Ge=
Рис.3 Примесная проводимость: а) n-типа; б) р-типа
Усиление примесной проводимости р-типа происходит, если в кристалле Ge или Si один из атомов замещён атомом Al, на внешнем энергетическом уровне которого находится только 3 электрона, то при образовании 4-х ковалентных связей с атомами Ge образуется дефицит одного электрона в каждом узле кристаллической решётки, содержащей атом Аl (рис.3).
При передаче кристаллу небольшой энергии (до 5,5 кДж/моль), атом Al захватывает электрон с соседней ковалентной связи, превращаясь в (-) заряженный ион. На месте захваченного электрона образуется (+) дырка.
Если поместить кристалл в электрическое поле, (+) дырка становится носителем заряда, а электрическая нейтральность атома сохраняется.
Примеси в кристаллах полупроводников, атомы которых способны усиливать в них дырочную проводимость, называются акцепторами.
Для кристаллов Ge и Si – это атомы р-элементов 3-й группы, а также Zn, Fe и Mn. Таким образом, варьируя природой и концентрациями примесей в полупроводниках, можно получить заданную электрическую проводимость и тип проводимости. Широкое применение полупроводников привело к созданию сложных полупроводниковых систем на основе химических соединений, чаще всего, имеющих алмазоподобную кристаллическую решётку: AlP, InSb, Cu2 O, Al2 O3, PbS, Bi2 S3, CdSe и др.
Дефекты в реальных кристаллах могут возникать не только в результате примесей атомов других элементов, но и теплового движения частиц, формирующих кристалл. При этом атомы, молекулы или ионы покидают свои места в узлах кристаллической решётки и переходят или в междоузлия или на поверхность кристалла, оставляя в решётке незаполненный узел – вакансию (см. рис 4).
а) о о о О б) о о о о
о о о о о о о
О
о о о о о о о
о о о о о о о о
Рис.4 усиление проводимости при наличии дефектов кристаллов:
а) выход частиц из узла решётки на поверхность кристалла;
б) выход частиц из узла решётки в междоузлие.
Точечные дефекты в ионных кристаллах существенно влияют на их проводимость. Под действием электрического поля ближайший к вакансии ион переходит на её место, в точке его прежнего местоположения создаётся новая вакансия, занимаемая в свою очередь соседним ионом. Подобные “перескоки” ионов реализуются с большой частотой, обеспечивая ионную проводимость кристалла.
1.5. Индивидуальное задание
1) Какие связи имеются в кристаллах, образованных элементами с порядковым номером 40, 2, 82? Какие свойства характерны для этих кристаллов?
2) Чем отличается структура кристаллов As и Zn от структуры кристалла Zn3 As2? Какие свойства характерны для этих веществ в кристаллическом состоянии?
3) Охарактеризовать полупроводниковые свойства кристалла Вт. Как изменятся эти свойства, если кристалл содержит примеси: Zn; Sb.
Вопрос №1
Порядковый 2 40 82
номер
элемента
Находим в
Периодической Не Zr Рb
Системе гелий цирконий свинец

 Электронные
Электронные
конфигурации
элементов: S
n=1 ¯ S-элемент, типичный неметалл,

 тронной орбитали 2 электрона не обладает химической активностью
тронной орбитали 2 электрона не обладает химической активностью
– d-элемент, металл

 (на внешнем энергетическом уровне 2 электрона)
(на внешнем энергетическом уровне 2 электрона)
четыре валентных электрона ….
S p d
n=4 ¯¯¯¯
n=5 ¯– в возбуждённом состоянии
 82 Pb
82 Pb
s p
n=6 ¯ — р-элемент, металл; на внешнем энергетическом уровне 4 электрона; два – неспаренных; в возбуждённом состоянии – четыре неспаренных электрона.
В кристаллическом состоянии:
Не – ковалентных связей не образует, так как энергетический уровень полностью заполнен спаренными электронами. При образовании химических связей в кристалле Не атомы связаны друг с другом слабыми Ван-дер-Ваальсовыми силами (силы межмолекулярного взаимодействия). Тип кристалла – молекулярный – с низкой механической прочностью, низкой температурой плавления, способностью к возгонке (низкая энергия связи), неэлектропроводен и нетеплопроводен (изолятор).
Zr – в кристалле циркония небольшое число валентных электронов на внешнем уровне обусловливает металлической связи. Металлическая кристаллическая решётка циркония прочна, непрозрачна, образует металлический блеск, способна деформироваться без разрушения, обусловливает тепло- и электропроводные свойства, высокую твёрдость и температуру плавления.
Pb – четыре электрона на внешнем уровне при большом радиусе атома обусловливает металлическую связь между атомами в кристалле. Металлическая кристаллическая решётка свинца пластична, непрозрачна, тёмно-серого цвета (металл), со средней (для металлов) температурой плавления, металл тепло- и электропроводен.
Вопрос №2
As Zn Zn3 As2
As – мышьяк с конфигурацией внешних электронов ns np:
s p
n=4 ¯
По “правилу октета” в кристалле у As координационное число 3 – каждый атом образует 3 ковалентных связи от 3-х соседних атомов. Ковалентная кристаллическая решётка отличается высокой температурой плавления, твёрдостью и механической прочностью; полупроводниковые свойства.
Zn – металл, d-элемент с конфигурацией внешних электронов
 . Металлическая кристаллическая решётка характеризуется ковкостью и пластичностью, непрозрачностью, тепло- и электропроводимостью. Кристаллы синеватого цвета с металлическим блеском.
. Металлическая кристаллическая решётка характеризуется ковкостью и пластичностью, непрозрачностью, тепло- и электропроводимостью. Кристаллы синеватого цвета с металлическим блеском.
Zn3 As2 – кристалл ковалентного типа с DЭО связи Zn-As»0,2
При обычных условиях Zn3 As2 изолятор, но при повышении температуры появляются полупроводниковые свойства за счёт 2s электронов мышьяка, преодолевших запрещённую зону и перемещённых в зону проводимости. Малая полярность связи придаёт соединению Zn3 As2 специфические для ковалентных соединений свойства.
Вопрос №3
В(тв) примеси Zn(тв) и Sb(тв)
 Распределение электронов по энергетическим уровням атома бора:
Распределение электронов по энергетическим уровням атома бора:
5 В; n=2 ¯ s p
 в возбуждённом состоянии: n=2 — три неспаренных электрона – один неспаренный s-электрон переходит в р-орбиталь, образуется тетрагональная кристаллическая структура с полупроводниковыми свойствами типа. Ширина запрещённой зоны 1,58 эВ (»150кДж/моль).
в возбуждённом состоянии: n=2 — три неспаренных электрона – один неспаренный s-электрон переходит в р-орбиталь, образуется тетрагональная кристаллическая структура с полупроводниковыми свойствами типа. Ширина запрещённой зоны 1,58 эВ (»150кДж/моль).
Полупроводники проводят электрический ток тогда, когда часть электронов из валентной зоны приобретают достаточную энергию, чтобы преодолеть запрещённую зону и перейти в зону проводимости. У бора электрический ток переносится электронами в зоне проводимости (феномен – с увеличением температуры электропроводимость возрастает, т.к. растёт концентрация носителей тока). В месте электронов, перешедших в зону проводимости, образовались вакансии (дырки (+)), обеспечивающие дырочную проводимость в валентной зоне.
 Примесь Zn: s p
Примесь Zn: s p
; n=4 ¯
В возбуждённом состоянии у цинка два неспаренных (s- np-) электрона. В узлах кристаллической решётки полупроводника, где находятся атомы цинка, наблюдается дефицит одного электрона при образовании ковалентных связей с бором. При возбуждении кристалла атом цинка захватывает недостающий электрон с соседней ковалентной связи, приобретая избыточный отрицательный заряд (–). В месте захваченного электрона образуется вакансия (+) дырка, обеспечивающая проводимость р-типа. Примесные атомы Zn являются акцепторами электронов.
 Примесь Sbт: s p d
Примесь Sbт: s p d
; n=5 ¯
На внешнем энергетическом уровне находятся 5 электронов. Три из них образуют ковалентные связи с атомами бора в кристалле; при возбуждении кристалла два Sb-электрона могут перейти в зону проводимости, обеспечив электронную проводимость n-типа. Атомы сурьмы являются донорами. Число электронов, увеличивающих электронную проводимость, возрастают с увеличением температуры:

, где А – предэксионциальный множитель,
DЕ – ширина запрещённой зоны, k – постоянная Больцмана;
Т – температура в шкале Кельвина.
Примеси, изменяющие концентрацию носителей тока в полупроводнике, должны быть строго дозированы.
www.ronl.ru
Химическая связь и строение вещества
23
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Вологодский государственный Технический Университет
Кафедра: электроснабжение
Контрольная работа
по химии
ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ ВЕЩЕСТВА
Выполнил: Артамонов Евгений Николаевич
Группа: ЗЭСВ-11
Шифр:09013203102
Вологда 2010
СОДЕРЖАНИЕ
I Химическая связь
1.1 Химическая связь и типы химической связи
1.2 Ковалентная связь
1.3 Ионная связь
1.4 Ионные кристаллы
1.5 Металлическая связь
1.6 Связь в комплексных соединениях
1.7 Валентность и степень окисления элементов
1.8 Стеохимическая валентность
1.9 Заряд ионов
II Строение вещества
2.1 Молекулы химических соединений
2.2 Размеры и масса атомов и молекул
2.3 Строение многоатомных молекул
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
I Химическая связьХимические элементы встречаются в природе главным образом не в виде отдельных атомов, а в виде сложных или простых веществ. Лишь благородные газы - гелий, неон, аргон, криптон и ксеон - находятся в природе в атомном состоянии, что объясняется устойчивостью электронных оболочек атомов благородных газов. Во всех других простых и сложных веществах атомы связаны химическими силами. Существует несколько типов химической связи, важнейшие из них - ковалентная, ионная и металлическая.
В общем случае химическая связь образуется, если полная энергия системы, состоящей из взаимно-действующих атомов, при сближении атомов понижается.
Пользуясь понятием электроотрицательности элементов, можно предвидеть основные три случая химического взаимодействия между атомами:
1. Химические реакции происходят между атомами элементов, электроотрицательности которых резко отличаются, например, атомами щелочных металлов и атомами галогенов.
2. Химические реакции происходят между атомами элементов, электроотрицательности которых одинаковы. Такое взаимодействие наблюдается при образовании газов (Н2 ,Р2, Cl 2, О2, N2), молекулы которых состоят из 2-х одинаковых атомов.
3. Вступать в химические реакции могут атомы элементов, электроотрицательности которых отличаются, но не очень сильно. Этот случай является промежуточным между двумя первыми крайними и встречаются особенно часто. Примерами его является образование молекул водорода Н2О, хлородоводорода HCl, метана СН4, и многих других веществ.
В зависимости от того, к какому случаю следует отнести данное химическое взаимодействие элементов, различают определенный тип химической связи. Надо учесть, что между этими типами химических связей нет резких границ. Между ними существует постепенный взаимопереход. Поэтому во многих химических соединениях одновременно существуют разные типы связей. Это объясняет последовательным изменением электроотрицательностей химических элементов.
1.1 Химическая связь и типы химической связиХимическая связь - это взаимное сцепление атомов в молекуле и кристаллической решетке в результате действия между атомами электрических сил применения.
Появления атомной модели бора, впервые объяснившей строение электронной оболочки атома, способствовало созданию представления о химической связи и ее электронной природе. В 1915 году немецкий физик Коссель дал объяснение химической связи в солях, в 1916 году. Американский физико-химик Льюис предположил трактовку химической связи в молекулах. Коссель и Льюис исходили из представления о том, что атомы элементов обладают тенденцией к достижению электронной конфигурации благородных газов. Атомы благородных газов, кроме элемента первого периода - гелия имеют во внешнем слое, т.е. на высшем энергетическом уровне, устойчивый объект (восемь) электронов; при таком строении способность атомов к вступлению в химические реакции минимальна, например, в противоположность атомам водорода, кислорода, хлора и другим, атомы благородных газов не образуют двухатомных молекул. Представления Косселя и Льюиса получили в истории химии название октетной теории, или электронной теории валентности.
Валентность элементов главных групп Периодической системы зависит от числа электронов, находящихся во внешнем слое электронной оболочке атома. Поэтому эти внешние электроны принято называть валентными. Все изменения, происходящие в электронных оболочках атомов при химических реакциях, касаются только валентных электронов. Для элементов побочных групп в качестве валентных могут выступать как электроны высшего энергетического уровня, так и электроны внутренних незавершенных подуровней.
Развитие квантово-механических представлений о строении атома и создание орбитальной модели атома привели к выработке двух современных научных подходов для объяснения химической связи - метода валентных связей и метода молекулярных орбиталей. Оба метода не взаимоисключают, а дополняют друг друга и позволяют трактовать процесс формирования химической связи и выяснить внутреннее строение веществ.
Различают три основных (модельных) типа химической связи: ковалентную, ионную и металлическую связи. Эти типы химической связи не существуют изолированно друг от друга в реальных веществах, они являются только моделями различных форм химического связывания, которые реализуются в действительности как в промежуточные формы связи.
Значительно более слабые, чем ковалентная, ионная и металлическая связи, межмолекулярные силы, которые обеспечивают взаимное удерживание твердого диоксида углерода, или в жидкостях, например, в воде. Эти силы называются силами Ван-дер-Ваальса.
1.2 Ковалентная связьХимическая связь, возникающая в результате образования общих (связывающих) электронных пар, называется ковалентной или атомной связью.
Простейший пример ковалентной связи - образование молекулы водорода Н2. Атомы водорода имеют следующую электронную оболочку: 1S1. Внешний энергетический уровень является незавершенным: до завершения не хватает одного электрона. При сближении двух атомов водорода происходит взаимодействие электронов с антипараллельными стенами с формированием общей электронной пары:
S S
Н
Объяснение механизма образования химической связи за счет общих электронных пар лежит в основе метода валентных связей. Схему образования ковалентной связи можно также показать, обозначив неспаренный электрон внешнего энергетического уровня атома одной точкой, а общую электронную пару - двумя точками:
Н + Н Н : Н
Общую электронную пару или ковалентную связь часто обозначают черточкой, например, Н - Н.
Общая электронная пара образуется в результате перекрывания S - орбиталей атомов водорода, на которых находятся электроны с противоположными спиновыми квантовыми числами. При этом в области перекрывания орбиталей создается повышенная электронная плотность.
Рассмотрим возникновение ковалентной связи в молекуле фтора. Атом фтора имеет семь электронов на внешнем энергетическом уровне, причем на
2р - подуровне находится один неспаренный электрон:
9F 1S2 2S2 2P5 2
1 P
S
При сближение двух атомов фтора происходит перекрывание 2р - орбиталей с неспаренными электронами, в результате формируется общая электронная пара:
F + F F F или F - F
У каждого атома фтора в молекуле Р2 сохраняется три неподеленные электронные пары.
Существуют молекулы, в которых между двумя атомами возникают две или три общие электронные пары. Такие ковалентные связи называются двойными и тройными, а общее их название - кратные связи.
Например, в образовании химических связи в молекуле азота N2 участвуют по три электрона каждого атома азота:
7N 1S2 2S2 2p3 2
1 P
S
В этом случае образуется три общие электронные пары:
N N или N N
Таким образом, ковалентной называется связь, осуществляемая одной или несколькими общими электронными парами.
а) Важнейшие характеристики ковалентной связиХарактеристиками химической связи, в том числе ковалентной являются ее полярность, энергия и длина. Особое свойство ковалентной связи - ее направленность.
Если общая электронная пара симметрична относительно атомов, то ковалентная связь называется неполярной. Неполярная ковалентная связь образуется при взаимодействии атомов с одинаковой электроотрицательностью. В рассмотренных выше примерах - молекулах Н2Р2 и N2 существует неполярная связь.
Если взаимодействующие атомы имеют различную электроотрицательность, то общая электронная пара смещена к атому с большей электроотрицательностью. В этом случае возникает полярная ковалентная связь. Например, полярной является связь в молекуле фтороводорода НР. При образовании молекулы происходит перекрывание S - орбитами атома фтора. Общая электронная пара расположена несимметрично относительно центров взаимодействующих атомов. Схему образования связи Н-Р можно представить так:
Н + F H F
Полярность связи в молекуле можно показать стрелкой, направленной в сторону атома с большей электроотрицательностью: НF.
В результате смещения электронной пары в молекуле НF возникает диполь. Диполь - это система из двух зарядов, равных по абсолютной величине, но противоположных по знаку. Принимают, что атом, к которому смещена общая электронная пара, приобретает некоторый отрицательный заряд, а другой атом - положительный заряд:
-
Многие молекулы, в которых возникают диполи, являются полярными. Вместе с тем существуют молекулы, которые не являются полярными, несмотря на полярный характер химических связей в них. К таким молекулам относится, например, молекула оксида углерода (IV), имеющая линейное строение:
Две одинаковые полярные связи, направленные под углом 180 и компенсируют электрические моменты друг друга, поэтому молекула является неполярной.
Прочность химической связи характеризуется энергией связи, т.е. энергией необходимой для разрыва связи. Значения энергии разрыва химических связей обычно приводятся в расчете на 1 моль вещества. Так, для молекулы Н2 энергия связи равна 432,1 КДЖ/моль, Р2 - 155 КДЖ/моль, НР - 565,7 КДЖ/моль. Длина связи - расстояние между ядрами атомов, образующих связь, например, длина связи в молекуле Н2 равна 0,074 нм, F2 - 0.142 нм, НР - 0,092 нм. Кратные связи короче простых, что можно проиллюстрировать примером связей углерод-углерод: длина одинарной связи С - С 0,154 нм, двойной С = С 0,134 нм, тройной С С 0,120 нм.
Ковалентная связь имеет направленность. В рассматриваемых выше примерах химической связи в молекулах Н2, Р2, НР за направление связи принимается линия, проходящая через центры взаимодействующих атомов.
Рассмотрим направленность ковалентных связей в молекулах воды. Строение электронной оболочки атома кислорода, входящего в состав молекул воды, выражается формулой:
8O 1S2 2S2 2p4 2
1 P
S
Ковалентные связи атом кислорода образует за счет 2р - орбиталей с неспаренными электронами, которые расположены под углом 90 друг другу. Эти орбитали перекрываются с S-орбиталями атомов водорода. В результате образуется молекула, в которой связи направлены под углом друг к другу за счет взаимного отталкивания электронных пар угол между связями, в молекуле воды (валентный угол) равен 104,5.
б). Донорно-акцепторный механизм образования ковалентной связиКовалентная связь может образоваться при перекрывании полностью свободной орбитали одного атома и орбитали с неподеленной электронной парой другого атома:
A + : Д А Д или А - Д
Свободная орбиталь неподеленная электронная
акцептора пара донора
В этом случае так же формируется общая электронная пара, только вклад каждого из атомов в химическую связь различен. Атом А, который представляет свободную орбиталь, называется акцептором, атом Д, представляющий электронную пару, является донором. Такой механизм образования ковалентной связи называется донорно-акцепторным.
Примером донорно-акцепторного взаимодействия является реакция между ионом водорода Н+ (1S - свободная S - орбиталь) и молекулой аммиака :Nh4 с образованием катиона аммония:
или акцептор донор.
Следует отметить, что все четыре связи N-H в катионе аммония равноценны.
1.3 Ионная связьЧисто ионной связью называется химически связанное состояние атомов, при котором устойчивое электронное окружение достигается путем полного перехода общей электронной плотности к атому более электроотрицательного элемента.
На практике полный переход электрона от одного атома к другому атому - партнеру по связи не реализуется, поскольку каждый элемент имеет большую или меньшую электроотрицательность, и любая химическая связь будет в некоторой степени ковалентной. Если степень ковалентной связи достаточна высока, то такая химическая связь является полярной ковалентной связью с той или иной степенью ионности. Если же степень ковалентности связей мала, по сравнению со степенью ее ионности, то такая связь считается ионной.
Ионная связь возможна только между атомами электроположительных и электроотрицательных элементов, находящимися в состоянии разноименно заряженных ионов. Процесс образования ионной связи позволяет объяснить электростатическая модель, т.е. рассмотрение химического взаимодействия между отрицательно и положительно заряженными ионами.
Ионы - это электрически заряженные частицы, образующиеся из нейтральных атомов или молекул путем отдачи или приема электронов.
При отдаче или приеме электронов молекулами образуются молекулярные или многоатомные ионы, например, - атион диоксигена, - нитрит-ион.
Одноатомные положительные ионы, или одноатомные отрицательные ионы, или одноатомные анионы, возникают при химической реакции между нейтральными атомами путем взаимопередачи электронов при всём этом атом, электроположительного элемента, обладающий небольшим числом внешних электронов, переходит в более устойчивое состояние одноатомного катиона путем уменьшения числа этих электронов. Наоборот, атом электроотрицательного элемента, имеющий большое число внешних электронов, переходит в более устойчивое для него состояние одноатомного иона путем увеличения числа электронов. Одноатомные катионы образуются, как правило, металлами, а одноатомные анионы - неметаллами.
При передачи электронов атомы металлических и неметаллических элементов стремятся сформироваться вокруг своих ядер устойчивую конфигурацию электронной оболочки. Атом неметаллического элемента создает вокруг своего остова внешнюю оболочку последующего благородного газа. Тогда как атом металлического элемента после отдачи внешних электронов получает устойчивую октетную конфигурацию предыдущего благородного газа.
1.4 Ионные кристаллыПри взаимодействии металлических и неметаллических простых веществ, сопровождающемся отдачей и приемом электронов, образуются соли. Пример:
2Na + Cl2 = 2NaCl ,
2Al + 3F2 = 2AlF3
Ионная связь характерна не только для солей производного бескислородных и кислородосодержащих кислот [типа NaCl, AlF3, NaNO3, Al(SO4)3], но и для других классов неорганических веществ - основных оксидов и гидроксидов [типа Na2O и NaOH], бинарных соединений [типа Li3N и CaC2]. Между ионами с противоположными по знаку зарядами проявляются электростатические силы притяжения. Такие силы притяжения изотропны, т.е. действуют одинаково, во всех направлениях. В результате расположение ионов в твердых солях упорядочивается в пространстве определенным образом. Система упорядочено расположенных катионов и анионов называется ионной кристаллической решеткой, а сами твердые вещества (соли, основные оксиды и гидроксиды) - ионными кристаллами.
Все ионные кристаллы имеют солеобразный характер. Под солеобразным характером понимается определенный набор свойств, отличающий ионные кристаллы от кристаллических веществ с другими типами решеток. Конечно, не все ионные решетки характеризуются таким расположением ионов в пространстве, число ионов - соседей с противоположным зарядом может быть и иным, однако чередование катионов и анионов в пространстве является обязательным для кристаллов.
Вследствие того, что кулоновские силы притяжения распространяются одинаково по всем направлениям, ионы в узлах кристаллической решетки связаны относительно прочно, хотя каждый из ионов не зафиксирован неподвижно, а непрерывно совершает тепловые колебания вокруг своего положения в решетке. Поступательное же движение ионов вдоль решетки отсутствует, поэтому все вещества с ионными связями при комнатной температуре - твердые (кристаллические). Амплитуда тепловых колебаний может быть увеличена нагреванием ионного кристалла, которое приводит в итоге к разрушению решетки и переходу твердого вещества в жидкое состояние (при температуре плавления). Температура плавления ионных кристаллов относительно высока, а температура кипения, при которой совершается переход жидкого вещества в самое неупорядоченное, газовое состояние, имеет очень большие значения. Пример:
|
| NaCl | NaOH | KBr | BaF2 | BaCl2 | |
Темп.плавления, С | 801 | 321 | 734 | 1368 | 961 | |
Темп.кипения, С | 1465 | 1390 | 1380 | 2260 | 2050 | |
|
Многие соли, особенно многоэлементные комплексные, а так же соли органических кислот могут разлагаться при температуре более низких, чем температура кипения и даже температура плавления.
Типичным свойством многих соединений с ионной связью (которые не взаимодействуют с водой или не разлагаются до плавления) является их способность к диссоциации на составляющие ионы; вследствие подвижности ионов водные растворы или расплавы ионных кристаллов проводят электрический ток.
В ионных кристаллах отсутствуют связи между отдельными парами ионов; точнее следует сказать, что все содержащиеся в образце ионного соединения катионы и анионы оказываются связанными.
В ионных кристаллах, построенных из катионов и анионов, молекулы отсутствуют.
Химические формулы ионных веществ передают только соотношение катионов и анионов в кристаллической решетке; в целом образец ионного вещества электронейтрален. Например, в соответствии с формулой ионного кристалла Al2O3 соотношение катионов Al3+ и анионов О2- в решетке равно 2:3; вещество электронейтрально - шесть положительных зарядов (2 Al3+) нейтрализуется шестью отрицательными зарядами (3 О2-).
Хотя реальных молекул в ионных кристаллах не существует для единообразия с ковалентными веществами принято с помощью формул типа NaCl и Al2O3 передавать состав условных молекул, следовательно, характеризовать ионные вещества определенными значениями относительной молекулярной массы. Это тем более оправдано, поскольку переход от ковалентной связи к ионной происходит постепенно и имеют лишь условную границу с х = 1,7.
Относительная молекулярная масса веществ с ионной связью находится сложением относительных атомных масс соответствующих элементов с учетом числа атомов каждого элемента.
Пример: Относительная молекулярная масса Al2O3 составляет:
|
Относительная атомная масса 2 (Al) | 2 26,992 | |
Относительная атомная масса 3 (О) | 3 15,999 | |
| 101,961101,96 | |
|
Строение и форма кристаллов являются предметом исследования кристаллографии, а связь свойств кристаллов и их строения изучает кристаллохимия.
Следует отметить, что соединений в которых существует только ионная связь практически нет. Всегда между соседними атомами в кристалле возникают и ковалентные связи.
1.5 Металлическая связьМеталлы и сплавы металлов кристаллизируются в форме металлических решеток. Узлы в металлической решетке заняты положительными ионами металлов. Все металлы, за редкими исключениями, кристаллизуются в одном из трех типов решеток. При кубической плотнейшей упаковке атомных остатков формируется гранецентрированноя решетка; при гексагональной плотнейшей упаковке - гексагональная решетка. Кристаллы щелочных металлов, бария и некоторых переходных металлов образует объемно центрированную кубическую решетку. Названия решеток соответствуют упаковке атомных остатков в вершинах и серединах граней элементарного куба, в виде гексагональной призмы и в вершинах и геометрическом центре элементарного куба.
Заполнение гранецентрированной кубической и гексагональной решеток атомными остовами является максимально возможным при данных геометрических размерах атомных остатков металлов, поэтому такие виды упаковок атомов называются плотнейшими. Плотнейшим упаковкам атомов соответствует и максимальное координационное число решетки, т.е. число ближайших соседей, окружающих данный атомный остов в пространстве. Для кубической и гексагональной плотнейших упаковок координационное число равно 12; в объемно центрированной кубической решетке координационное число равно 8.
Валентные электроны, отделившиеся от атомов металлов и оставившие в узлах решетки соответствующие атомные остовы (катионы), более или менее свободно перемещаются в пространстве между катионами и обуславливают металлическую электрическую проводимость металлов. По аналогии с молекулами газообразного вещества совершающими хаотическое движение, подвижные электроны рассматривают как электронный газ в металле.
Устойчивость металлической решетки обеспечивается наличием электростатического притяжения между положительно заряженными атомными остовами и отрицательно заряженными подвижными электронами, связывающие кулоновские силы действуют на все соседние атомные оставы равномерно и поэтому они менее прочные, чем силы направленного химического связывания в атомных кристаллических решетках. Вследствие этого большинство металлических простых веществ, в отличие от алмазоподобных веществ, имеют относительно низкие температуры плавления. Пример:
|
| Cs | Na | Sn | Pb | Al | Ba | Ag | Cu | Fe | |
Температ.плавления | 29 | 98 | 232 | 328 | 660 | 727 | 962 | 985 | 1539 | |
|
(Важнейшие исключения: Мо 2620, Re 3190, W 3387 С).
Подобно атомам в атомных решетках и ионам в ионных решетках, катионы в металлических решетках, не обладающие поступательным движением, постоянно совершают колебания вокруг положения узлов решетки. Амплитуда этих колебаний при нагревании возрастает, и при достижении температуры плавления металла решетка разрушается. Температура плавления металлов, как правило, возрастает с увеличением числа валентных электронов в их атомах и с уменьшением расстояния между атомами остовами в решетке - параметра решетки а.
Пример:
|
| | а, м | Температ. плавлен., С | |
Натрий Nа | 1 | 4,3 10-10 | 98 | |
Калий К | 1 | 5,3 10-10 | 64 | |
Кальций Са | 2 | 5,5 10-10 | 842 | |
|
Натрий плавится при более высокой температуре, чем калий, вследствие меньшего значения параметра, а кальций плавится при значительно более высокой температуре, чем калий, в основном по причине удвоенного числа валентных электронов.
Уж упаковки кристаллических решеток зависит пластическая деформируемость металлов. Она тем выше, чем больше в металлической решетке плотнейших шаровых слоев и чем меньше пустот, тормозящих скольжение слоев. Наименьшая ковкость у металлов с гексагональной решеткой промежуточная - с объемно-центрированной кубической решеткой и наибольшая - с гранецентрированной кубической решеткой.
Пример. При нагревании железа до 911С низкотемпературная объемно-центрированная кубическая решетка переходит в гранецентрированную кубическую решетку; по этой причине раскаленное железо значительно легче поддается ковке.
При затвердевании металлических расплавов происходит массовая кристаллизация и возникает одновременно множество мелких кристалликов, они называются кристаллитами. Рост кристаллита протекает в окружении подобных мелких кристаллов; при всём этом исключается значительное увеличение размеров кристаллитов и поэтому они не видны визуально на изломе металла и образец металла кажется монолитным.
Смеси двух или более индивидуальных металлов называются сплавами. В сплавах могут присутствовать в небольших количествах и некоторые неметаллы (С, Si, S). Распространенным методом получения сплавов является совместное нагревание их составных частей до полного расплавления смеси. При этом, есть металлы, которые не сплавляются друг с другом в любых отношениях.
Металлические сплавы можно классифицировать так: твердые растворы внедрения; твердые растворы замещения; смеси индивидуальных кристаллов металлов; смеси кристаллов интерметаллических соединений.
В сплавах, предоставляющих собой твердые растворы внедрения, часть межузельных полостей металлической кристаллической решетки занята атомами другого элемента. Такие примеси часто упрочняют сплав; например, чугун, сталь-железо, содержащее примесные атомы углерода, значительно тверже, чем чистое железо.
В сплавах - твердых растворах замещения часть атомов основного вещества заменена на атомы примесного элемента. Сплавы, состоящие из смеси индивидуальных кристаллических компонентов, образуются при соблюдении строго определенного соотношения; такие сплавы называются так же эвтектическими смесями. Эвтектической смесью является широко известный оловянный припой - третник (64% Sn и 36% Pb) с температурой плавления 181 С.
Сплавляемые металлы могут образовываться между собой химические соединения - интерметаллиды. Например, в бронзе присутствует интерметаллическое соединение состава Си3 Sn, а в латуни - интерметаллид СиZn3. Важнейшей составной частью стали, является карбит железа Fe3 C (цементит), который так же относится к интерметаллическим соединениям. Состав интерметаллидов обычно не отвечает стехиометрической валентности элементов; интерметаллиды - это нестехометрические соединения, составляющие обширный класс неорганических веществ с нестехиометрическим составом. Многие элементы образуют несколько нестехиаметрических соединений: так железо с фосфором дает фосфиды состава Fe3 P, Fe2 P, Fe P, Fe P, Fe P2. Формулы этих соединений указывают лишь на то, что для кристаллических решеток характерно определенное соотношение компонентов, например, в Fe3 С на каждые три атома Fe приходится один атом С.
1.6 Связь в комплексных соединенияхХимия комплексных соединений - один из обширных разделов неорганической химии. Начало изучению комплексных соединений положил швейцарский химик Вернер (1893 г), который разработал основы координационной теории. Он выделял простые соединения, или соединения первого порядка, как образованные в соответствии со стехиометрической валентностью элементов, и комплексные соединения или соединения высшего порядка, в которых атомы тех же элементов присоединяют большее число партнеров по связи. Четкой границы между комплексными и простыми соединениями нет.
Комплексное соединение состоит из разнозаряженных внешней и внутренней сферы; встречаются так же нейтральные комплексы. Формулу комплекса записывают в квадратных скобках; в комплексе различают центральный атом - лиганды, которые связаны с центральным атомом ковалентно и донорно-акцепторному механизму. Если лиганд образует одну - связь с центральным атомом, то число таких лигандов равно координационному числу центрального атома. Заряд всего комплекса определяется суммарным зарядом всех лигандов и зарядом центрального атома выраженным степенью окисления соответствующего элемента.
Центральный атом может быть атом неметалла или металла. Комплексные соединения с центральными атомами неметаллов. Такие комплексные соединения образуются из молекул простых соединений и дополнительных частиц лиганда.
1.7 Валентность и степень окисления элементовТермин валентности был введен в химию в 1853 году английским химиком - органиком Франклендом для обоснования количественных соотношений атомов элементов в химических соединениях. Развитие учения о валентности в большой степени связано с открытием Д.И. Менделеевым Периодического закона (1869 году). Им была установлена связь между валентностью и его положением в Периодической системе, введено понятие о переменной валентности элементов в их соединениях с кислородом и водородом. Учение о строении атомов и молекул способствовало разработке электронной теории валентности.
1.8 Стеохимическая валентностьДля стеохимических расчетов, а так же для составления химических формул и уравнений необходимо знание количественных соотношений атомов различных элементов, в которых они соединяются или реагируют. Такая информация передается стехиометрической валентностью.
Стехиометрическая валентность элемента показывает, со сколькими атомами одновалентного элемента соединяется атом данного элемента.
Одновалентными считаются все элементы, атомы которых в двухэлементных соединениях всегда связаны с одним атомом другого элемента. Примером одновалентного элемента является водород Н. Поэтому считается, что стехиометрическая валентность элемента указывает на то, со сколькими атомами водорода соединен один атом рассматриваемого элемента. Так, в НСl хлор - одновалентен, в Н2О кислород - двухвалентен, NН3 азот - трехвалентен.
Водородные соединения известны не для всех элементов, но почти все стехиометричны двухвалентным и по составу кислородных соединений других элементов можно определить валентность этих элементов. Считают, что все оксиды можно получить формальным замещением атомов водорода в воде на атомы других элементов. Например, из сравнения формул Н2О и Na2O или Н2О и СаО делают заключение об одновалентности натрия и двухвалентности кальция. Таким образом, стехиометрическая валентность элемента определяется числом атомов водорода, которое может быть присоединено или замещено одним атомом данного элемента.
1.9. Заряд ионовЭлектрический заряд ионов определяет, в каком соотношении эти ионы находятся в кристаллической решетке ионного соединения.
Между зарядом одноэлементных ионов и числом валентных электронов нейтральных атомов элементов имеется непосредственная связь:
Положительный заряд иона равен числу электронов, отданных одним атомом элемента; отрицательный заряд иона равен числу электронов, принятых одним атомом элемента.
Пример записи Na+, Ca2+, Al3+ означают, что атомы этих элементов потеряли соответственно 1, 2 и 3 , а записи F-, O2-, N3- означают, что атомы этих элементов приобрели соответственно 1, 2 и 3 .
II Строение вещества2.1 Молекулы химических соединенийХимические соединения, состоящие из атомов не менее двух элементов, имеют в качестве наименьших составных частей молекулы - электрически нейтральные группы атомов, или ионы - электрически заряженные атомы или группы атомов. Из молекул составлены ковалентные соединения, обычно легколетучие.
Пример. Молекулы воды Н2О, аммиака Nh4, диоксида углерода СО2 построены из атомов различных неметаллических элементов, соединенных между собой ковалентными связями. Так, молекула воды Н2О составлена из двух атомов водорода Н и одного атома кислорода О, причем атом кислорода образует отдельные ковалентные связи с каждым атомом водорода.
Молекула - это наименьшая частица химического соединения, обладающая его химическими свойствами.
Это определение молекулы действительно только при учете следующих двух ограничений. Во-первых, в форме молекул могут быть не только соединения, но и простые вещества, молекулы химического соединения, т.е. сложного вещества многоэлементны (h3O, Nh4, CO2, h3SO4), молекулы простых веществ - одноэлементны (h3, O2, N2, Cl2, S8, P4 и др). Поэтому в приведенном выше определении молекулы речь идет о многоэлементных молекулах.
2.2 Размеры и масса атомов и молекулРадиусы атомов и молекул выражаются очень малыми величинами, и в стомиллионных долях сантиметра и обычно измеряются в ангстремах, 1А равен 10-8 см.
Радиус молекулы СО2 равен 1,66 10-8 см, что равно 1,66 А.
Диаметр молекулы N2 равен 3,1 10-8 см, а это равно 3,1 А. Длина молекулы натурального каучука равна 20000 А . масса молекулы кислорода равна 53,12 10-24 г. 1 г. водорода содержит около 6,02 1023 атомов. Чем больше масса молекул газа, тем ниже средняя скорость их движения; средние скорости молекул газообразных веществ обратно пропорциональны квадратным корням из чисел, выражающих их массы:
V1 : V2 =
Скорость движения молекул зависит от температуры: чем выше температура газа, тем больше средняя скорость движения его молекул. Эта зависимость выражается следующим уравнением:
V1 : V2 = ,
где Т - абсолютная температура
2.3 Строение многоатомных молекул|
Молекула | Форма | Межъядерные расстояния (в А) | |
СО2 | Линейная симметричная О = С = О | С = О 1,13 | |
NO2 | Изогнутая < ONO=140? N O O | N = O 1,18 | |
h3O | Изогнутая < HOH=104-106? O H H | O - H 0,97 | |
SO2 | Изогнутая < SOS=124? S O O | S = O 1, 45 | |
Nh4 | Правильная треугольная пирамида < НNH=180? | Высота пирамиды h = 0,3 | |
C2h3 | Симметричная вытянутая Н - С ? С -Н | С - Н 1,06 С ? С 1,22 | |
СН4 | Тетрайдер < при С = 109? 28' H H C H H | C - H 1,09 | |
C2h3 | < HСH = 114? 55' H H C = C H H | C - H 1, 06 C = C 1,34 | |
|
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ1. Воскресенский П.И., Цветков Л.А. и др. Справочник по химии.- М., 1974.
2. Рудзитис Г.Е. Химия.- М., 1989.
3. Третьяков Ю.Д., Дайненко В.И. и др. Химия. Справочные материалы. -М., 1984.
4. Хомченко И.Г Общая химия.. - М., 1987.
referatwork.ru
Доклад - Химическая связь и строение вещества
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Вологодский государственный Технический Университет
Кафедра: электроснабжение
Контрольная работа
по химии
ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ ВЕЩЕСТВА
Выполнил: Артамонов Евгений Николаевич
Группа: ЗЭСВ-11
Шифр:09013203102
Вологда 2010
СОДЕРЖАНИЕ
I Химическая связь
1.1 Химическая связь и типы химической связи
1.2 Ковалентная связь
1.3 Ионная связь
1.4 Ионные кристаллы
1.5 Металлическая связь
1.6 Связь в комплексных соединениях
1.7 Валентность и степень окисления элементов
1.8 Стеохимическая валентность
1.9 Заряд ионов
II Строение вещества
2.1 Молекулы химических соединений
2.2 Размеры и масса атомов и молекул
2.3 Строение многоатомных молекул
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
I Химическая связь
Химические элементы встречаются в природе главным образом не в виде отдельных атомов, а в виде сложных или простых веществ. Лишь благородные газы – гелий, неон, аргон, криптон и ксеон – находятся в природе в атомном состоянии, что объясняется устойчивостью электронных оболочек атомов благородных газов. Во всех других простых и сложных веществах атомы связаны химическими силами. Существует несколько типов химической связи, важнейшие из них – ковалентная, ионная и металлическая.
В общем случае химическая связь образуется, если полная энергия системы, состоящей из взаимно-действующих атомов, при сближении атомов понижается.
Пользуясь понятием электроотрицательности элементов, можно предвидеть основные три случая химического взаимодействия между атомами:
1. Химические реакции происходят между атомами элементов, электроотрицательности которых резко отличаются, например, атомами щелочных металлов и атомами галогенов.
2. Химические реакции происходят между атомами элементов, электроотрицательности которых одинаковы. Такое взаимодействие наблюдается при образовании газов (Н2, Р2, Cl 2, О2, N2), молекулы которых состоят из 2-х одинаковых атомов.
3. Вступать в химические реакции могут атомы элементов, электроотрицательности которых отличаются, но не очень сильно. Этот случай является промежуточным между двумя первыми крайними и встречаются особенно часто. Примерами его является образование молекул водорода Н2О, хлородоводорода HCl, метана СН4, и многих других веществ.
В зависимости от того, к какому случаю следует отнести данное химическое взаимодействие элементов, различают определенный тип химической связи. Надо учесть, что между этими типами химических связей нет резких границ. Между ними существует постепенный взаимопереход. Поэтому во многих химических соединениях одновременно существуют разные типы связей. Это объясняет последовательным изменением электроотрицательностей химических элементов.
Химическая связь – это взаимное сцепление атомов в молекуле и кристаллической решетке в результате действия между атомами электрических сил применения.
Появления атомной модели бора, впервые объяснившей строение электронной оболочки атома, способствовало созданию представления о химической связи и ее электронной природе. В 1915 году немецкий физик Коссель дал объяснение химической связи в солях, в 1916 году. Американский физико-химик Льюис предположил трактовку химической связи в молекулах. Коссель и Льюис исходили из представления о том, что атомы элементов обладают тенденцией к достижению электронной конфигурации благородных газов. Атомы благородных газов, кроме элемента первого периода — гелия имеют во внешнем слое, т.е. на высшем энергетическом уровне, устойчивый объект (восемь) электронов; при таком строении способность атомов к вступлению в химические реакции минимальна, например, в противоположность атомам водорода, кислорода, хлора и другим, атомы благородных газов не образуют двухатомных молекул. Представления Косселя и Льюиса получили в истории химии название октетной теории, или электронной теории валентности.
Валентность элементов главных групп Периодической системы зависит от числа электронов, находящихся во внешнем слое электронной оболочке атома. Поэтому эти внешние электроны принято называть валентными. Все изменения, происходящие в электронных оболочках атомов при химических реакциях, касаются только валентных электронов. Для элементов побочных групп в качестве валентных могут выступать как электроны высшего энергетического уровня, так и электроны внутренних незавершенных подуровней.
Развитие квантово-механических представлений о строении атома и создание орбитальной модели атома привели к выработке двух современных научных подходов для объяснения химической связи – метода валентных связей и метода молекулярных орбиталей. Оба метода не взаимоисключают, а дополняют друг друга и позволяют трактовать процесс формирования химической связи и выяснить внутреннее строение веществ.
Различают три основных (модельных) типа химической связи: ковалентную, ионную и металлическую связи. Эти типы химической связи не существуют изолированно друг от друга в реальных веществах, они являются только моделями различных форм химического связывания, которые реализуются в действительности как в промежуточные формы связи.
Значительно более слабые, чем ковалентная, ионная и металлическая связи, межмолекулярные силы, которые обеспечивают взаимное удерживание твердого диоксида углерода, или в жидкостях, например, в воде. Эти силы называются силами Ван-дер-Ваальса.
Химическая связь, возникающая в результате образования общих (связывающих) электронных пар, называется ковалентной или атомной связью.
Простейший пример ковалентной связи – образование молекулы водорода Н2. Атомы водорода имеют следующую электронную оболочку: 1S1. Внешний энергетический уровень является незавершенным: до завершения не хватает одного электрона. При сближении двух атомов водорода происходит взаимодействие электронов с антипараллельными стенами с формированием общей электронной пары:
 SS
SS
Н 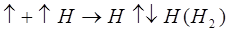
Объяснение механизма образования химической связи за счет общих электронных пар лежит в основе метода валентных связей. Схему образования ковалентной связи можно также показать, обозначив неспаренный электрон внешнего энергетического уровня атома одной точкой, а общую электронную пару – двумя точками:
Н· + ·Н  Н: Н
Н: Н
Общую электронную пару или ковалентную связь часто обозначают черточкой, например, Н – Н.
Общая электронная пара образуется в результате перекрывания S – орбиталей атомов водорода, на которых находятся электроны с противоположными спиновыми квантовыми числами. При этом в области перекрывания орбиталей создается повышенная электронная плотность.
Рассмотрим возникновение ковалентной связи в молекуле фтора. Атом фтора имеет семь электронов на внешнем энергетическом уровне, причем на

 2р — подуровне находится один неспаренный электрон:
2р — подуровне находится один неспаренный электрон:
9 F 1S2 2S2 2P5 2 



1  P
P
S
При сближение двух атомов фтора происходит перекрывание 2р – орбиталей с неспаренными электронами, в результате формируется общая электронная пара:
F+ F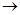 FFили F – F
FFили F – F
У каждого атома фтора в молекуле Р2 сохраняется три неподеленные электронные пары.
Существуют молекулы, в которых между двумя атомами возникают две или три общие электронные пары. Такие ковалентные связи называются двойными и тройными, а общее их название – кратные связи.
Например, в образовании химических связи в молекуле азота N2 участвуют по три электрона каждого атома азота:
7 N 1S2 2S2 2p3 2 




1  P
P
S
В этом случае образуется три общие электронные пары:
N N или N N
N
Таким образом, ковалентной называется связь, осуществляемая одной или несколькими общими электронными парами.
Характеристиками химической связи, в том числе ковалентной являются ее полярность, энергия и длина. Особое свойство ковалентной связи – ее направленность.
Если общая электронная пара симметрична относительно атомов, то ковалентная связь называется неполярной. Неполярная ковалентная связь образуется при взаимодействии атомов с одинаковой электроотрицательностью. В рассмотренных выше примерах – молекулах Н2Р2 и N2 существует неполярная связь.
Если взаимодействующие атомы имеют различную электроотрицательность, то общая электронная пара смещена к атому с большей электроотрицательностью. В этом случае возникает полярная ковалентная связь. Например, полярной является связь в молекуле фтороводорода НР. При образовании молекулы происходит перекрывание S – орбитами атома фтора. Общая электронная пара расположена несимметрично относительно центров взаимодействующих атомов. Схему образования связи Н-Р можно представить так:
Н + F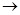 HF
HF
Полярность связи в молекуле можно показать стрелкой, направленной в сторону атома с большей электроотрицательностью: Н F.
F.
В результате смещения электронной пары в молекуле НF возникает диполь. Диполь – это система из двух зарядов, равных по абсолютной величине, но противоположных по знаку. Принимают, что атом, к которому смещена общая электронная пара, приобретает некоторый отрицательный заряд, а другой атом – положительный заряд:
 —
— 
Многие молекулы, в которых возникают диполи, являются полярными. Вместе с тем существуют молекулы, которые не являются полярными, несмотря на полярный характер химических связей в них. К таким молекулам относится, например, молекула оксида углерода (IV), имеющая линейное строение:

Две одинаковые полярные связи, направленные под углом 180° и компенсируют электрические моменты друг друга, поэтому молекула является неполярной.
Прочность химической связи характеризуется энергией связи, т.е. энергией необходимой для разрыва связи. Значения энергии разрыва химических связей обычно приводятся в расчете на 1 моль вещества. Так, для молекулы Н2 энергия связи равна 432,1 КДЖ/моль, Р2 – 155 КДЖ/моль, НР – 565,7 КДЖ/моль. Длина связи – расстояние между ядрами атомов, образующих связь, например, длина связи в молекуле Н2 равна 0,074 нм, F2 – 0.142 нм, НР – 0,092 нм. Кратные связи короче простых, что можно проиллюстрировать примером связей углерод-углерод: длина одинарной связи С – С 0,154 нм, двойной С = С 0,134 нм, тройной С  С 0,120 нм.
С 0,120 нм.
Ковалентная связь имеет направленность. В рассматриваемых выше примерах химической связи в молекулах Н2, Р2, НР за направление связи принимается линия, проходящая через центры взаимодействующих атомов.
Рассмотрим направленность ковалентных связей в молекулах воды. Строение электронной оболочки атома кислорода, входящего в состав молекул воды, выражается формулой:
8 O 1S2 2S2 2p4 2 




1  P
P
S
Ковалентные связи атом кислорода образует за счет 2р — орбиталей с неспаренными электронами, которые расположены под углом 90° друг другу. Эти орбитали перекрываются с S-орбиталями атомов водорода. В результате образуется молекула, в которой связи направлены под углом друг к другу за счет взаимного отталкивания электронных пар угол между связями, в молекуле воды (валентный угол) равен 104,5°.
Ковалентная связь может образоваться при перекрывании полностью свободной орбитали одного атома и орбитали с неподеленной электронной парой другого атома:

 A +: Д
A +: Д  А Д или А — Д
А Д или А — Д
Свободная орбиталь неподеленная электронная
акцептора пара донора
В этом случае так же формируется общая электронная пара, только вклад каждого из атомов в химическую связь различен. Атом А, который представляет свободную орбиталь, называется акцептором, атом Д, представляющий электронную пару, является донором. Такой механизм образования ковалентной связи называется донорно-акцепторным.
Примером донорно-акцепторного взаимодействия является реакция между ионом водорода Н+ (1S° — свободная S – орбиталь) и молекулой аммиака :Nh4 с образованием катиона аммония:
или  акцептор донор.
акцептор донор.
Следует отметить, что все четыре связи N-H в катионе аммония равноценны.
Чисто ионной связью называется химически связанное состояние атомов, при котором устойчивое электронное окружение достигается путем полного перехода общей электронной плотности к атому более электроотрицательного элемента.
На практике полный переход электрона от одного атома к другому атому – партнеру по связи не реализуется, поскольку каждый элемент имеет большую или меньшую электроотрицательность, и любая химическая связь будет в некоторой степени ковалентной. Если степень ковалентной связи достаточна высока, то такая химическая связь является полярной ковалентной связью с той или иной степенью ионности. Если же степень ковалентности связей мала, по сравнению со степенью ее ионности, то такая связь считается ионной.
Ионная связь возможна только между атомами электроположительных и электроотрицательных элементов, находящимися в состоянии разноименно заряженных ионов. Процесс образования ионной связи позволяет объяснить электростатическая модель, т.е. рассмотрение химического взаимодействия между отрицательно и положительно заряженными ионами.
Ионы – это электрически заряженные частицы, образующиеся из нейтральных атомов или молекул путем отдачи или приема электронов.
При отдаче или приеме электронов молекулами образуются молекулярные или многоатомные ионы, например,  — атион диоксигена,
— атион диоксигена,  — нитрит-ион.
— нитрит-ион.
Одноатомные положительные ионы, или одноатомные отрицательные ионы, или одноатомные анионы, возникают при химической реакции между нейтральными атомами путем взаимопередачи электронов при этом атом, электроположительного элемента, обладающий небольшим числом внешних электронов, переходит в более устойчивое состояние одноатомного катиона путем уменьшения числа этих электронов. Наоборот, атом электроотрицательного элемента, имеющий большое число внешних электронов, переходит в более устойчивое для него состояние одноатомного иона путем увеличения числа электронов. Одноатомные катионы образуются, как правило, металлами, а одноатомные анионы – неметаллами.
При передачи электронов атомы металлических и неметаллических элементов стремятся сформироваться вокруг своих ядер устойчивую конфигурацию электронной оболочки. Атом неметаллического элемента создает вокруг своего остова внешнюю оболочку последующего благородного газа. Тогда как атом металлического элемента после отдачи внешних электронов получает устойчивую октетную конфигурацию предыдущего благородного газа.
При взаимодействии металлических и неметаллических простых веществ, сопровождающемся отдачей и приемом электронов, образуются соли. Пример:
2Na + Cl2 = 2NaCl ,

2Al + 3F2 = 2AlF3

Ионная связь характерна не только для солей производного бескислородных и кислородосодержащих кислот [типа NaCl, AlF3, NaNO3, Al(SO4)3], но и для других классов неорганических веществ – основных оксидов и гидроксидов [типа Na2O и NaOH], бинарных соединений [типа Li3N и CaC2]. Между ионами с противоположными по знаку зарядами проявляются электростатические силы притяжения. Такие силы притяжения изотропны, т.е. действуют одинаково, во всех направлениях. В результате расположение ионов в твердых солях упорядочивается в пространстве определенным образом. Система упорядочено расположенных катионов и анионов называется ионной кристаллической решеткой, а сами твердые вещества (соли, основные оксиды и гидроксиды) – ионными кристаллами.
Все ионные кристаллы имеют солеобразный характер. Под солеобразным характером понимается определенный набор свойств, отличающий ионные кристаллы от кристаллических веществ с другими типами решеток. Конечно, не все ионные решетки характеризуются таким расположением ионов в пространстве, число ионов – соседей с противоположным зарядом может быть и иным, однако чередование катионов и анионов в пространстве является обязательным для кристаллов.
Вследствие того, что кулоновские силы притяжения распространяются одинаково по всем направлениям, ионы в узлах кристаллической решетки связаны относительно прочно, хотя каждый из ионов не зафиксирован неподвижно, а непрерывно совершает тепловые колебания вокруг своего положения в решетке. Поступательное же движение ионов вдоль решетки отсутствует, поэтому все вещества с ионными связями при комнатной температуре – твердые (кристаллические). Амплитуда тепловых колебаний может быть увеличена нагреванием ионного кристалла, которое приводит в итоге к разрушению решетки и переходу твердого вещества в жидкое состояние (при температуре плавления). Температура плавления ионных кристаллов относительно высока, а температура кипения, при которой совершается переход жидкого вещества в самое неупорядоченное, газовое состояние, имеет очень большие значения. Пример:
| NaCl | NaOH | KBr | BaF2 | BaCl2 |
| Темп.плавления, °С | 801 | 321 | 734 | 1368 | 961 |
| Темп.кипения, °С | 1465 | 1390 | 1380 | 2260 | 2050 |
Многие соли, особенно многоэлементные комплексные, а так же соли органических кислот могут разлагаться при температуре более низких, чем температура кипения и даже температура плавления.
Типичным свойством многих соединений с ионной связью (которые не взаимодействуют с водой или не разлагаются до плавления) является их способность к диссоциации на составляющие ионы; вследствие подвижности ионов водные растворы или расплавы ионных кристаллов проводят электрический ток.
В ионных кристаллах отсутствуют связи между отдельными парами ионов; точнее следует сказать, что все содержащиеся в образце ионного соединения катионы и анионы оказываются связанными.
В ионных кристаллах, построенных из катионов и анионов, молекулы отсутствуют.
Химические формулы ионных веществ передают только соотношение катионов и анионов в кристаллической решетке; в целом образец ионного вещества электронейтрален. Например, в соответствии с формулой ионного кристалла Al2O3 соотношение катионов Al3+ и анионов О2- в решетке равно 2:3; вещество электронейтрально – шесть положительных зарядов (2 Al3+) нейтрализуется шестью отрицательными зарядами (3 О2-).
Хотя реальных молекул в ионных кристаллах не существует для единообразия с ковалентными веществами принято с помощью формул типа NaClи Al2O3 передавать состав условных молекул, следовательно, характеризовать ионные вещества определенными значениями относительной молекулярной массы. Это тем более оправдано, поскольку переход от ковалентной связи к ионной происходит постепенно и имеют лишь условную границу с Dх = 1,7.
Относительная молекулярная масса веществ с ионной связью находится сложением относительных атомных масс соответствующих элементов с учетом числа атомов каждого элемента.
Пример: Относительная молекулярная масса Al2O3 составляет:
| Относительная атомная масса 2 (Al) | 2 × 26,992 |
| Относительная атомная масса 3 (О) | 3 × 15,999 |
| 101,961»101,96 |
Строение и форма кристаллов являются предметом исследования кристаллографии, а связь свойств кристаллов и их строения изучает кристаллохимия.
Следует отметить, что соединений в которых существует только ионная связь практически нет. Всегда между соседними атомами в кристалле возникают и ковалентные связи.
Металлы и сплавы металлов кристаллизируются в форме металлических решеток. Узлы в металлической решетке заняты положительными ионами металлов. Все металлы, за редкими исключениями, кристаллизуются в одном из трех типов решеток. При кубической плотнейшей упаковке атомных остатков формируется гранецентрированноя решетка; при гексагональной плотнейшей упаковке — гексагональная решетка. Кристаллы щелочных металлов, бария и некоторых переходных металлов образует объемно центрированную кубическую решетку. Названия решеток соответствуют упаковке атомных остатков в вершинах и серединах граней элементарного куба, в виде гексагональной призмы и в вершинах и геометрическом центре элементарного куба.
Заполнение гранецентрированной кубической и гексагональной решеток атомными остовами является максимально возможным при данных геометрических размерах атомных остатков металлов, поэтому такие виды упаковок атомов называются плотнейшими. Плотнейшим упаковкам атомов соответствует и максимальное координационное число решетки, т.е. число ближайших соседей, окружающих данный атомный остов в пространстве. Для кубической и гексагональной плотнейших упаковок координационное число равно 12; в объемно центрированной кубической решетке координационное число равно 8.
Валентные электроны, отделившиеся от атомов металлов и оставившие в узлах решетки соответствующие атомные остовы (катионы), более или менее свободно перемещаются в пространстве между катионами и обуславливают металлическую электрическую проводимость металлов. По аналогии с молекулами газообразного вещества совершающими хаотическое движение, подвижные электроны рассматривают как электронный газ в металле.
Устойчивость металлической решетки обеспечивается наличием электростатического притяжения между положительно заряженными атомными остовами и отрицательно заряженными подвижными электронами, связывающие кулоновские силы действуют на все соседние атомные оставы равномерно и поэтому они менее прочные, чем силы направленного химического связывания в атомных кристаллических решетках. Вследствие этого большинство металлических простых веществ, в отличие от алмазоподобных веществ, имеют относительно низкие температуры плавления. Пример:
| Cs | Na | Sn | Pb | Al | Ba | Ag | Cu | Fe |
| Температ.плавления | 29 | 98 | 232 | 328 | 660 | 727 | 962 | 985 | 1539 |
(Важнейшие исключения: Мо 2620, Re 3190, W 3387° С).
Подобно атомам в атомных решетках и ионам в ионных решетках, катионы в металлических решетках, не обладающие поступательным движением, постоянно совершают колебания вокруг положения узлов решетки. Амплитуда этих колебаний при нагревании возрастает, и при достижении температуры плавления металла решетка разрушается. Температура плавления металлов, как правило, возрастает с увеличением числа валентных электронов в их атомах и с уменьшением расстояния между атомами остовами в решетке – параметра решетки а.
Пример:
 | а, м | Температ. плавлен., ° С |
| Натрий Nа | 1 | 4,3 10-10 | 98 |
| Калий К | 1 | 5,3 10-10 | 64 |
| Кальций Са | 2 | 5,5 10-10 | 842 |
Натрий плавится при более высокой температуре, чем калий, вследствие меньшего значения параметра, а кальций плавится при значительно более высокой температуре, чем калий, в основном по причине удвоенного числа валентных электронов.
Уж упаковки кристаллических решеток зависит пластическая деформируемость металлов. Она тем выше, чем больше в металлической решетке плотнейших шаровых слоев и чем меньше пустот, тормозящих скольжение слоев. Наименьшая ковкость у металлов с гексагональной решеткой промежуточная – с объемно-центрированной кубической решеткой и наибольшая – с гранецентрированной кубической решеткой.
Пример. При нагревании железа до 911°С низкотемпературная объемно-центрированная кубическая решетка переходит в гранецентрированную кубическую решетку; по этой причине раскаленное железо значительно легче поддается ковке.
При затвердевании металлических расплавов происходит массовая кристаллизация и возникает одновременно множество мелких кристалликов, они называются кристаллитами. Рост кристаллита протекает в окружении подобных мелких кристаллов; при этом исключается значительное увеличение размеров кристаллитов и поэтому они не видны визуально на изломе металла и образец металла кажется монолитным.
Смеси двух или более индивидуальных металлов называются сплавами. В сплавах могут присутствовать в небольших количествах и некоторые неметаллы (С, Si, S). Распространенным методом получения сплавов является совместное нагревание их составных частей до полного расплавления смеси. Однако, есть металлы, которые не сплавляются друг с другом в любых отношениях.
Металлические сплавы можно классифицировать так: твердые растворы внедрения; твердые растворы замещения; смеси индивидуальных кристаллов металлов; смеси кристаллов интерметаллических соединений.
В сплавах, предоставляющих собой твердые растворы внедрения, часть межузельных полостей металлической кристаллической решетки занята атомами другого элемента. Такие примеси часто упрочняют сплав; например, чугун, сталь-железо, содержащее примесные атомы углерода, значительно тверже, чем чистое железо.
В сплавах – твердых растворах замещения часть атомов основного вещества заменена на атомы примесного элемента. Сплавы, состоящие из смеси индивидуальных кристаллических компонентов, образуются при соблюдении строго определенного соотношения; такие сплавы называются так же эвтектическими смесями. Эвтектической смесью является широко известный оловянный припой – третник (64% Sn и 36% Pb) с температурой плавления 181° С.
Сплавляемые металлы могут образовываться между собой химические соединения – интерметаллиды. Например, в бронзе присутствует интерметаллическое соединение состава Си3 Sn, а в латуни – интерметаллид СиZn3. Важнейшей составной частью стали, является карбит железа Fe3 C (цементит), который так же относится к интерметаллическим соединениям. Состав интерметаллидов обычно не отвечает стехиометрической валентности элементов; интерметаллиды – это нестехометрические соединения, составляющие обширный класс неорганических веществ с нестехиометрическим составом. Многие элементы образуют несколько нестехиаметрических соединений: так железо с фосфором дает фосфиды состава Fe3 P, Fe2 P, FeP, FeP, FeP2. Формулы этих соединений указывают лишь на то, что для кристаллических решеток характерно определенное соотношение компонентов, например, в Fe3 С на каждые три атома Fe приходится один атом С.
Химия комплексных соединений – один из обширных разделов неорганической химии. Начало изучению комплексных соединений положил швейцарский химик Вернер (1893 г), который разработал основы координационной теории. Он выделял простые соединения, или соединения первого порядка, как образованные в соответствии со стехиометрической валентностью элементов, и комплексные соединения или соединения высшего порядка, в которых атомы тех же элементов присоединяют большее число партнеров по связи. Четкой границы между комплексными и простыми соединениями нет.
Комплексное соединение состоит из разнозаряженных внешней и внутренней сферы; встречаются так же нейтральные комплексы. Формулу комплекса записывают в квадратных скобках; в комплексе различают центральный атом – лиганды, которые связаны с центральным атомом ковалентно и донорно-акцепторному механизму. Если лиганд образует одну 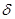 — связь с центральным атомом, то число таких лигандов равно координационному числу центрального атома. Заряд всего комплекса определяется суммарным зарядом всех лигандов и зарядом центрального атома выраженным степенью окисления соответствующего элемента.
— связь с центральным атомом, то число таких лигандов равно координационному числу центрального атома. Заряд всего комплекса определяется суммарным зарядом всех лигандов и зарядом центрального атома выраженным степенью окисления соответствующего элемента.
Центральный атом может быть атом неметалла или металла. Комплексные соединения с центральными атомами неметаллов. Такие комплексные соединения образуются из молекул простых соединений и дополнительных частиц лиганда.
1.7 Валентность и степень окисления элементов
Термин валентности был введен в химию в 1853 году английским химиком – органиком Франклендом для обоснования количественных соотношений атомов элементов в химических соединениях. Развитие учения о валентности в большой степени связано с открытием Д.И. Менделеевым Периодического закона (1869 году). Им была установлена связь между валентностью и его положением в Периодической системе, введено понятие о переменной валентности элементов в их соединениях с кислородом и водородом. Учение о строении атомов и молекул способствовало разработке электронной теории валентности.
1.8 Стеохимическая валентность
Для стеохимических расчетов, а так же для составления химических формул и уравнений необходимо знание количественных соотношений атомов различных элементов, в которых они соединяются или реагируют. Такая информация передается стехиометрической валентностью.
Стехиометрическая валентность элемента показывает, со сколькими атомами одновалентного элемента соединяется атом данного элемента.
Одновалентными считаются все элементы, атомы которых в двухэлементных соединениях всегда связаны с одним атомом другого элемента. Примером одновалентного элемента является водород Н. Поэтому считается, что стехиометрическая валентность элемента указывает на то, со сколькими атомами водорода соединен один атом рассматриваемого элемента. Так, в НСl хлор – одновалентен, в Н2О кислород – двухвалентен, NН3 азот – трехвалентен.
Водородные соединения известны не для всех элементов, но почти все стехиометричны двухвалентным и по составу кислородных соединений других элементов можно определить валентность этих элементов. Считают, что все оксиды можно получить формальным замещением атомов водорода в воде на атомы других элементов. Например, из сравнения формул Н2О и Na2O или Н2О и СаО делают заключение об одновалентности натрия и двухвалентности кальция. Таким образом, стехиометрическая валентность элемента определяется числом атомов водорода, которое может быть присоединено или замещено одним атомом данного элемента.
Электрический заряд ионов определяет, в каком соотношении эти ионы находятся в кристаллической решетке ионного соединения.
Между зарядом одноэлементных ионов и числом валентных электронов нейтральных атомов элементов имеется непосредственная связь:
Положительный заряд иона равен числу электронов, отданных одним атомом элемента; отрицательный заряд иона равен числу электронов, принятых одним атомом элемента.
Пример записи Na+, Ca2+, Al3+ означают, что атомы этих элементов потеряли соответственно 1, 2 и 3  , а записи F-, O2-, N3- означают, что атомы этих элементов приобрели соответственно 1, 2 и 3
, а записи F-, O2-, N3- означают, что атомы этих элементов приобрели соответственно 1, 2 и 3  .
.
II Строение вещества
2.1 Молекулы химических соединений
Химические соединения, состоящие из атомов не менее двух элементов, имеют в качестве наименьших составных частей молекулы – электрически нейтральные группы атомов, или ионы – электрически заряженные атомы или группы атомов. Из молекул составлены ковалентные соединения, обычно легколетучие.
Пример. Молекулы воды Н2О, аммиака Nh4, диоксида углерода СО2 построены из атомов различных неметаллических элементов, соединенных между собой ковалентными связями. Так, молекула воды Н2О составлена из двух атомов водорода Н и одного атома кислорода О, причем атом кислорода образует отдельные ковалентные связи с каждым атомом водорода.
Молекула – это наименьшая частица химического соединения, обладающая его химическими свойствами.
Это определение молекулы действительно только при учете следующих двух ограничений. Во-первых, в форме молекул могут быть не только соединения, но и простые вещества, молекулы химического соединения, т.е. сложного вещества многоэлементны (h3O, Nh4, CO2, h3SO4), молекулы простых веществ – одноэлементны (h3, O2, N2, Cl2, S8, P4 и др). Поэтому в приведенном выше определении молекулы речь идет о многоэлементных молекулах.
2.2 Размеры и масса атомов и молекул
Радиусы атомов и молекул выражаются очень малыми величинами, и в стомиллионных долях сантиметра и обычно измеряются в ангстремах, 1А равен 10-8 см.
Радиус молекулы СО2 равен 1,66 × 10-8 см, что равно 1,66 А.
Диаметр молекулы N2 равен 3,1× 10-8 см, а это равно 3,1 А. Длина молекулы натурального каучука равна 20000 А. масса молекулы кислорода равна 53,12× 10-24 г. 1 г. водорода содержит около 6,02× 1023 атомов. Чем больше масса молекул газа, тем ниже средняя скорость их движения; средние скорости молекул газообразных веществ обратно пропорциональны квадратным корням из чисел, выражающих их массы:
V1: V2 = 
Скорость движения молекул зависит от температуры: чем выше температура газа, тем больше средняя скорость движения его молекул. Эта зависимость выражается следующим уравнением:
V1: V2 =  ,
,
где Т – абсолютная температура
2.3 Строение многоатомных молекул
| Молекула | Форма | Межъядерные расстояния (в А) |
| СО2 | Линейная симметричная О = С = О | С = О 1,13 |
| NO2 | Изогнутая < ONO=140º N OO | N = O 1,18 |
| h3O | Изогнутая < HOH=104-106º O H H | O – H 0,97 |
| SO2 | Изогнутая < SOS=124º S O O | S = O 1, 45 |
| Nh4 |   Правильная треугольная пирамида Правильная треугольная пирамида
< НNH=180º | Высота пирамиды h = 0,3 |
| C2h3 | Симметричная вытянутая Н – С ≡ С –Н | С – Н 1,06 С ≡ С 1,22 |
| СН4 | Тетрайдер < при С = 109º 28' HH C H H | C – H 1,09 |
| C2h3 | < HСH = 114º 55' H H C = C H H | C – H 1, 06 C = C 1,34 |
1. Воскресенский П.И., Цветков Л.А. и др. Справочник по химии.– М., 1974.
2. Рудзитис Г.Е. Химия.– М., 1989.
3. Третьяков Ю.Д., Дайненко В.И. и др. Химия. Справочные материалы. –М., 1984.
4. Хомченко И.Г Общая химия… – М., 1987.
www.ronl.ru
Курсовая работа - Строение и свойства вещества
Министерство путей сообщения
Российской Федерации
Дальневосточный Государственный Университет путей сообщения
КАФЕДРА
«Химия»
Курсовой проект
на тему:
«Строение и свойства вещества»
К.П. 1001. 1. 615
Выполнил: Глухих П.А.
Проверил: Рапопорт Т.В.
г. Хабаровск
1999
Цель занятия: изучить свойства веществ в твёрдом состоянии, рассмотреть типы кристаллических решёток, сущность явления проводимости.
1.1 Характеристика вещёства в твёрдом состоянии.
Твёрдые вещества характеризуются следующими показателями: расстояния между частицами (атомами, молекулами) соизмеримы с их размерами, потенциальная энергия частиц значительно превосходит кинетическую, частицы находятся в тепловом колебательном движении.
Твёрдые вещества делятся на аморфные и кристаллические.
Таблица 1.1
Общая характеристика аморфных и кристаллических веществ
Аморфное состояние (стеклообразное) | Кристаллическое состояние |
Ближний порядок расположения частиц Изотропность физических свойств Отсутствие конкретной точки плавления Термодинамическая нестабильность (большой запас внутренней энергии) Текучесть Примеры: органические полимеры – стекло, вар, янтарь и т.д. | Дальний порядок расположения частиц Анизотропность физических свойств Конкретная температура плавления и кристаллизации Термодинамическая устойчивость (малый запас внутренней энергии) Обладают элементами симметрии Примеры: углерод (алмаз, графит), твёрдые соли, металлы, сплавы. |
Геометрическая форма кристалла – это следствие его внутреннего строения, которое характеризуется определённым расположением частиц в пространстве, обуславливающим структуру и свойства данного кристалла (пространственная кристаллическая решётка).
Основные параметры кристаллических решёток описаны в таблице 1.2
Таблица 1.2
Параметры кристаллической решётки (к.р.)
| Параметры | Определения |
1. Энергия кристаллической решётки, кДж/моль 2. Константа к.р. (d,[Ao]) 3.Координационное число | Энергия, которая выделяется при образовании 1моль кристалла из микрочастиц (атомов, молекул, ионов), находящихся в газообразном состоянии и удалённых друг от друга на расстояние, исключающее их взаимодействие Наименьшее расстояние между центрами 2-х частиц в кристалле, соединённых химической связью Число частиц, окружающих в пространстве центральную частицу, связанных с ней химической связью |
В зависимости от вида частиц, находящихся в узлах кристаллической решётки и типа связи между ними, кристаллы бывают различных типов (см. табл. 1.3).
Таблица 1.3
Типы кристаллов и их свойства
| Тип кристалла (по типу хим. связи) | Вид частиц в узлах к.р. | Тип связи между частицами | Основные свойства кристаллов | Примеры веществ |
| Молекулярные | Неполярные или полярные молекулы | Межмолекулярные силы; водородные связи | Низкая теплопроводность и электропроводимость, низкая химическая прочность и темп. плавл.; высокая летучесть | Твёрдые галогены, СН4, Н2, СО2 (кр.), Н2 О (кр), N2 (кр.) |
| Ковалентные (атомные) | Атомы одного или разных элементов | Ковалентные связи | Высокая температура плавл., твёрдость и механ. Прочность; широкий диапазон электропроводности: от изоляторов (алмаз) и полупроводников (Ge, Si) до электронных проводников (Sn) | Кристаллы простых и сложных веществ элементов 3-й и 4-й групп главных подгр. Салм, Si, Ge, Snc, SiC, AlN, BN и др. |
| Ионные | Простые и сложн. ионы | Ионная св. – электростатическое взаимодействие | Промежуточное положение между молекулярными и ковалентными кристаллами; как правило, хор. растворимы в полярн. расторит.; диэлектрики | NaCl, CaF2, LiNO3, CaO и др. |
| Металлические | Атомы и ионы металлов | Металлическая связь | Ковки, пластичны; высокие тепло- и электропроводимость непрозрачность, металич. блеск | Чистые металлы и сплавы |
1.2. Кристаллические проводники, полупроводники, изоляторы. Зонная теория кристаллов.
Все известные кристаллические вещества по величине электропроводимости подразделяются на три класса: проводники, диэлектрики (изоляторы), полупроводники (таблица 1.4).
Таблица 1.4.
Деление кристаллических веществ по величине электропроводимости
 Класс кристаллич. Вещества Класс кристаллич. Вещества | Электропроводность | Общая характеристика | Примеры |
     Проводники 1-го рода Проводники 1-го рода
Диэлектрики Полупроводники | Вещества с металлической кристаллической решёткой, характеризующейся наличием “переносчиков тока” – свободно-перемещающихся электронов Вещества с атомной, молекулярной и реже ионной решёткой, обладающие большой энергией связи между частицами Вещества с атомной или реже ионной решёткой, обладающие более слабой энергией связи между частицами, чем изоляторы; с ростом температуры электропроводимость растет | Fe, Al, Ag, Cu и др. Салмаз, слюда, органич. Полимеры, оксиды и др. Si, Ge, B, серое олово и др. |
Различие в величине электропроводимости металлов, полупроводников и диэлектриков объясняет зонная теория строения твёрдого тела , основные положения которой сводятся к следующему. При образовании кристалла из одиночных атомов происходит перекрытие атомных орбиталей (АО) близких энергий и образование молекулярных орбиталей (МО), число которых равно общему числу перекрывающихся АО.
С ростом числа взаимодействующих атомов в кристалле растет число разрешённых молекулярных энергетических уровней, а энергетический порог между ними уменьшается. Образуется непрерывная энергетическая зона, в которой переход электронов с более низкого энергетического уровня на более высокий не требует больших затрат энергии.
Заполнение электронами МО, составляющих непрерывную энергетическую зону, происходит в порядке возрастания энергии, согласно принципу Паули. В кристалле натрия при образовании N MO, только N/2 MO будут заняты электронами, т.к. у атома Na на каждой валентной 3S АО находится по 1 электрону, а на каждой МО будет располагаться по 2е с противоположными спинами.
Совокупность энергетических уровней, занятых валентными электронами, составляет валентную зону .
Энергетические уровни, незаполненные электронами, составляют зону проводимости.
В кристаллах проводников валентная зона находится в непосредственной близости от зоны проводимости и иногда перекрывается с ней. Е – энергетический барьер близок к нулю. (см. рис.1)
Рис1. Расположение энергетических зон в кристаллах:
— зона проводимости; — валентная зона; ¯DЕ=запрещенная зона
Электроны валентной зоны при их незначительном возбуждении могут легко перейти на свободные энергетические уровни зоны проводимости, что обеспечивает высокую проводимость металлов.
У изоляторов зона проводимости отделена от валентной зоны большим энергетическим барьером (>4эВ). Валентные электроны не могут попасть в зону проводимости даже при передаче им значительного кол-ва энергии, т.к. электроны не могут свободно перемещаться по всему объёму кристалла, проводимость в кристалле отсутствует.
Ширина запрещённой зоны проводников невелика – от 0.1 до 4эВ. При низких температурах они проявляют свойства изоляторов. С повышением температуры энергия валентных электронов возрастает и становится достаточной для преодоления запрещённой зоны. Происходит перенос электрических зарядов, полупроводник становится проводником.
1.3. Собственная и примесная проводимость полупроводников. Дефекты реальных кристаллов.
К типичным собственным полупроводникам относятся В, Si, Ge, Te, Sn(серое)и др. на каждом энергетическом уровне валентной зоны у них находится по 2 электрона (см. рис.2)
Рис2. Собственная проводимость
После получения кванта энергии связь между этой парой электронов нарушается и один электрон покидает валентную зону, переходя зону проводимости. В валентной зоне на его месте остаётся вакансия (+)-дырка. При наложении внешнего электрического поля электроны, перешедшие в зону проводимости, перемещаются к А(+), в валентной зоне электрон, находящийся рядом с дыркой (+), занимает её место, появляется новая дырка и т.д. Таким образом, дрейф электрона к А(+) эквивалентен дрейфу дырки к К(-).
Электропроводность, обусловленная одновременным участием в проводимости е и р, называется собственной или электронно-дырочной проводимостью (n – p) типа. Для каждого полупроводника собственная проводимость наступит при разных величинах температур, которые тем выше, чем больше величина запрещённой зоны полупроводника. В настоящее время известно 13 кристаллических модификаций простых веществ обладающих полупроводниковыми свойствами. Они находятся в главных подгруппах 3 – 7 групп Периодической системы элементов Д.И. Менделеева.
3-я группа – В; 6-я группа – S, Se, Te;
4-я группа – S, Si, Ge, Sn; 7-я группа – I.
5-я группа – P, As, Sb, Bi;
В кристаллах простых веществ этих элементов ковалентный или близкий к нему характер химической связи. Ширина запрещённой зоны зависит от прочности ковалентной связи и структурных особенностей кристаллических решёток полупроводника.
К полупроводникам с узкой запрещённой зоной относятся Sn(серое), Р – чёрный, Те. Заметный перенос электронов в зону проводимости наблюдается уже за счёт лучистой энергии.
К полупроводникам с широкой запрещённой зоной относятся Bi, Si – для осуществления проводимости требуется мощный тепловой импульс; для Салм. — g-облучение.
Получить идеальный кристалл как естественным, так и искусственным путём практически невозможно. Кристаллы, как правило, имеют дефекты в виде структурных нарушений или примесей атомов других элементов. Дефекты кристаллов приводят к усилению дырочной, электронной проводимости или появлению дополнительной ионной проводимости.
Усиление примесной проводимости n-типа происходит, если в кристалле Ge один из атомов замещен атомом Р, на внешнем энергетическом уровне которого находится 5 валентных электронов, 4 из которых образуют ковалентные связи с соседними атомами Ge, а один электрон находится на свободной орбитали у атома фосфора. При передаче кристаллу Ge небольшой энергии (4,4 кДж/моль) этот электрон легко отщепляется от примесного атома Р и проникает из валентной зоны через запрещённую зону в зону проводимости, т.е. служит переносчиком тока. В целом же кристалл Ge остаётся электронейтральным (рис.3). Примеси в кристаллах, атомы которых способны отдавать электроны, усиливая электронную проводимость, называются донорами. По отношению к Ge, Si – это р-элементы 5-й группы, а также Аu и ряд других элементов.
а) б)
=Ge====Ge====Ge= =Ge====Ge====Ge=
=Ge====P=====Ge= =Ge====Al====Ge=
=Ge====Ge====Ge= =Ge====Ge====Ge=
Рис.3 Примесная проводимость: а) n-типа; б) р-типа
Усиление примесной проводимости р-типа происходит, если в кристалле Ge или Si один из атомов замещён атомом Al, на внешнем энергетическом уровне которого находится только 3 электрона, то при образовании 4-х ковалентных связей с атомами Ge образуется дефицит одного электрона в каждом узле кристаллической решётки, содержащей атом Аl (рис.3).
При передаче кристаллу небольшой энергии (до 5,5 кДж/моль), атом Al захватывает электрон с соседней ковалентной связи, превращаясь в (-) заряженный ион. На месте захваченного электрона образуется (+) дырка.
Если поместить кристалл в электрическое поле, (+) дырка становится носителем заряда, а электрическая нейтральность атома сохраняется.
Примеси в кристаллах полупроводников, атомы которых способны усиливать в них дырочную проводимость, называются акцепторами.
Для кристаллов Ge и Si – это атомы р-элементов 3-й группы, а также Zn, Fe и Mn. Таким образом, варьируя природой и концентрациями примесей в полупроводниках, можно получить заданную электрическую проводимость и тип проводимости. Широкое применение полупроводников привело к созданию сложных полупроводниковых систем на основе химических соединений, чаще всего, имеющих алмазоподобную кристаллическую решётку: AlP, InSb, Cu2 O, Al2 O3, PbS, Bi2 S3, CdSe и др.
Дефекты в реальных кристаллах могут возникать не только в результате примесей атомов других элементов, но и теплового движения частиц, формирующих кристалл. При этом атомы, молекулы или ионы покидают свои места в узлах кристаллической решётки и переходят или в междоузлия или на поверхность кристалла, оставляя в решётке незаполненный узел – вакансию (см. рис 4).
а) о о о О б) о о о о
о о о о о о о
О
о о о о о о о
о о о о о о о о
Рис.4 усиление проводимости при наличии дефектов кристаллов:
а) выход частиц из узла решётки на поверхность кристалла;
б) выход частиц из узла решётки в междоузлие.
Точечные дефекты в ионных кристаллах существенно влияют на их проводимость. Под действием электрического поля ближайший к вакансии ион переходит на её место, в точке его прежнего местоположения создаётся новая вакансия, занимаемая в свою очередь соседним ионом. Подобные “перескоки” ионов реализуются с большой частотой, обеспечивая ионную проводимость кристалла.
1.5. Индивидуальное задание
1) Какие связи имеются в кристаллах, образованных элементами с порядковым номером 40, 2, 82? Какие свойства характерны для этих кристаллов?
2) Чем отличается структура кристаллов As и Zn от структуры кристалла Zn3 As2? Какие свойства характерны для этих веществ в кристаллическом состоянии?
3) Охарактеризовать полупроводниковые свойства кристалла Вт. Как изменятся эти свойства, если кристалл содержит примеси: Zn; Sb.
Вопрос №1
Порядковый 2 40 82
номер
элемента
Находим в
Периодической Не Zr Рb
Системе гелий цирконий свинец

 Электронные
Электронные
конфигурации
элементов: S
n=1 ¯ S-элемент, типичный неметалл,

 тронной орбитали 2 электрона не обладает химической активностью
тронной орбитали 2 электрона не обладает химической активностью
– d-элемент, металл

 (на внешнем энергетическом уровне 2 электрона)
(на внешнем энергетическом уровне 2 электрона)
четыре валентных электрона ….
S p d
n=4 ¯¯¯¯
n=5 ¯– в возбуждённом состоянии
 82 Pb
82 Pb
s p
n=6 ¯ — р-элемент, металл; на внешнем энергетическом уровне 4 электрона; два – неспаренных; в возбуждённом состоянии – четыре неспаренных электрона.
В кристаллическом состоянии:
Не – ковалентных связей не образует, так как энергетический уровень полностью заполнен спаренными электронами. При образовании химических связей в кристалле Не атомы связаны друг с другом слабыми Ван-дер-Ваальсовыми силами (силы межмолекулярного взаимодействия). Тип кристалла – молекулярный – с низкой механической прочностью, низкой температурой плавления, способностью к возгонке (низкая энергия связи), неэлектропроводен и нетеплопроводен (изолятор).
Zr – в кристалле циркония небольшое число валентных электронов на внешнем уровне обусловливает металлической связи. Металлическая кристаллическая решётка циркония прочна, непрозрачна, образует металлический блеск, способна деформироваться без разрушения, обусловливает тепло- и электропроводные свойства, высокую твёрдость и температуру плавления.
Pb – четыре электрона на внешнем уровне при большом радиусе атома обусловливает металлическую связь между атомами в кристалле. Металлическая кристаллическая решётка свинца пластична, непрозрачна, тёмно-серого цвета (металл), со средней (для металлов) температурой плавления, металл тепло- и электропроводен.
Вопрос №2
As Zn Zn3 As2
As – мышьяк с конфигурацией внешних электронов ns np:
s p
n=4 ¯
По “правилу октета” в кристалле у As координационное число 3 – каждый атом образует 3 ковалентных связи от 3-х соседних атомов. Ковалентная кристаллическая решётка отличается высокой температурой плавления, твёрдостью и механической прочностью; полупроводниковые свойства.
Zn – металл, d-элемент с конфигурацией внешних электронов
 . Металлическая кристаллическая решётка характеризуется ковкостью и пластичностью, непрозрачностью, тепло- и электропроводимостью. Кристаллы синеватого цвета с металлическим блеском.
. Металлическая кристаллическая решётка характеризуется ковкостью и пластичностью, непрозрачностью, тепло- и электропроводимостью. Кристаллы синеватого цвета с металлическим блеском.
Zn3 As2 – кристалл ковалентного типа с DЭО связи Zn-As»0,2
При обычных условиях Zn3 As2 изолятор, но при повышении температуры появляются полупроводниковые свойства за счёт 2s электронов мышьяка, преодолевших запрещённую зону и перемещённых в зону проводимости. Малая полярность связи придаёт соединению Zn3 As2 специфические для ковалентных соединений свойства.
Вопрос №3
В(тв) примеси Zn(тв) и Sb(тв)
 Распределение электронов по энергетическим уровням атома бора:
Распределение электронов по энергетическим уровням атома бора:
5 В; n=2 ¯ s p
 в возбуждённом состоянии: n=2 — три неспаренных электрона – один неспаренный s-электрон переходит в р-орбиталь, образуется тетрагональная кристаллическая структура с полупроводниковыми свойствами типа. Ширина запрещённой зоны 1,58 эВ (»150кДж/моль).
в возбуждённом состоянии: n=2 — три неспаренных электрона – один неспаренный s-электрон переходит в р-орбиталь, образуется тетрагональная кристаллическая структура с полупроводниковыми свойствами типа. Ширина запрещённой зоны 1,58 эВ (»150кДж/моль).
Полупроводники проводят электрический ток тогда, когда часть электронов из валентной зоны приобретают достаточную энергию, чтобы преодолеть запрещённую зону и перейти в зону проводимости. У бора электрический ток переносится электронами в зоне проводимости (феномен – с увеличением температуры электропроводимость возрастает, т.к. растёт концентрация носителей тока). В месте электронов, перешедших в зону проводимости, образовались вакансии (дырки (+)), обеспечивающие дырочную проводимость в валентной зоне.
 Примесь Zn: s p
Примесь Zn: s p
; n=4 ¯
В возбуждённом состоянии у цинка два неспаренных (s- np-) электрона. В узлах кристаллической решётки полупроводника, где находятся атомы цинка, наблюдается дефицит одного электрона при образовании ковалентных связей с бором. При возбуждении кристалла атом цинка захватывает недостающий электрон с соседней ковалентной связи, приобретая избыточный отрицательный заряд (–). В месте захваченного электрона образуется вакансия (+) дырка, обеспечивающая проводимость р-типа. Примесные атомы Zn являются акцепторами электронов.
 Примесь Sbт: s p d
Примесь Sbт: s p d
; n=5 ¯
На внешнем энергетическом уровне находятся 5 электронов. Три из них образуют ковалентные связи с атомами бора в кристалле; при возбуждении кристалла два Sb-электрона могут перейти в зону проводимости, обеспечив электронную проводимость n-типа. Атомы сурьмы являются донорами. Число электронов, увеличивающих электронную проводимость, возрастают с увеличением температуры:

, где А – предэксионциальный множитель,
DЕ – ширина запрещённой зоны, k – постоянная Больцмана;
Т – температура в шкале Кельвина.
Примеси, изменяющие концентрацию носителей тока в полупроводнике, должны быть строго дозированы.
www.ronl.ru
Курсовая работа - Химическая связь и строение вещества
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Вологодский государственный Технический Университет
Кафедра: электроснабжение
Контрольная работа
по химии
ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ ВЕЩЕСТВА
Выполнил: Артамонов Евгений Николаевич
Группа: ЗЭСВ-11
Шифр:09013203102
Вологда 2010
СОДЕРЖАНИЕ
I Химическая связь
1.1 Химическая связь и типы химической связи
1.2 Ковалентная связь
1.3 Ионная связь
1.4 Ионные кристаллы
1.5 Металлическая связь
1.6 Связь в комплексных соединениях
1.7 Валентность и степень окисления элементов
1.8 Стеохимическая валентность
1.9 Заряд ионов
II Строение вещества
2.1 Молекулы химических соединений
2.2 Размеры и масса атомов и молекул
2.3 Строение многоатомных молекул
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
I Химическая связь
Химические элементы встречаются в природе главным образом не в виде отдельных атомов, а в виде сложных или простых веществ. Лишь благородные газы – гелий, неон, аргон, криптон и ксеон – находятся в природе в атомном состоянии, что объясняется устойчивостью электронных оболочек атомов благородных газов. Во всех других простых и сложных веществах атомы связаны химическими силами. Существует несколько типов химической связи, важнейшие из них – ковалентная, ионная и металлическая.
В общем случае химическая связь образуется, если полная энергия системы, состоящей из взаимно-действующих атомов, при сближении атомов понижается.
Пользуясь понятием электроотрицательности элементов, можно предвидеть основные три случая химического взаимодействия между атомами:
1. Химические реакции происходят между атомами элементов, электроотрицательности которых резко отличаются, например, атомами щелочных металлов и атомами галогенов.
2. Химические реакции происходят между атомами элементов, электроотрицательности которых одинаковы. Такое взаимодействие наблюдается при образовании газов (Н2, Р2, Cl 2, О2, N2), молекулы которых состоят из 2-х одинаковых атомов.
3. Вступать в химические реакции могут атомы элементов, электроотрицательности которых отличаются, но не очень сильно. Этот случай является промежуточным между двумя первыми крайними и встречаются особенно часто. Примерами его является образование молекул водорода Н2О, хлородоводорода HCl, метана СН4, и многих других веществ.
В зависимости от того, к какому случаю следует отнести данное химическое взаимодействие элементов, различают определенный тип химической связи. Надо учесть, что между этими типами химических связей нет резких границ. Между ними существует постепенный взаимопереход. Поэтому во многих химических соединениях одновременно существуют разные типы связей. Это объясняет последовательным изменением электроотрицательностей химических элементов.
Химическая связь – это взаимное сцепление атомов в молекуле и кристаллической решетке в результате действия между атомами электрических сил применения.
Появления атомной модели бора, впервые объяснившей строение электронной оболочки атома, способствовало созданию представления о химической связи и ее электронной природе. В 1915 году немецкий физик Коссель дал объяснение химической связи в солях, в 1916 году. Американский физико-химик Льюис предположил трактовку химической связи в молекулах. Коссель и Льюис исходили из представления о том, что атомы элементов обладают тенденцией к достижению электронной конфигурации благородных газов. Атомы благородных газов, кроме элемента первого периода — гелия имеют во внешнем слое, т.е. на высшем энергетическом уровне, устойчивый объект (восемь) электронов; при таком строении способность атомов к вступлению в химические реакции минимальна, например, в противоположность атомам водорода, кислорода, хлора и другим, атомы благородных газов не образуют двухатомных молекул. Представления Косселя и Льюиса получили в истории химии название октетной теории, или электронной теории валентности.
Валентность элементов главных групп Периодической системы зависит от числа электронов, находящихся во внешнем слое электронной оболочке атома. Поэтому эти внешние электроны принято называть валентными. Все изменения, происходящие в электронных оболочках атомов при химических реакциях, касаются только валентных электронов. Для элементов побочных групп в качестве валентных могут выступать как электроны высшего энергетического уровня, так и электроны внутренних незавершенных подуровней.
Развитие квантово-механических представлений о строении атома и создание орбитальной модели атома привели к выработке двух современных научных подходов для объяснения химической связи – метода валентных связей и метода молекулярных орбиталей. Оба метода не взаимоисключают, а дополняют друг друга и позволяют трактовать процесс формирования химической связи и выяснить внутреннее строение веществ.
Различают три основных (модельных) типа химической связи: ковалентную, ионную и металлическую связи. Эти типы химической связи не существуют изолированно друг от друга в реальных веществах, они являются только моделями различных форм химического связывания, которые реализуются в действительности как в промежуточные формы связи.
Значительно более слабые, чем ковалентная, ионная и металлическая связи, межмолекулярные силы, которые обеспечивают взаимное удерживание твердого диоксида углерода, или в жидкостях, например, в воде. Эти силы называются силами Ван-дер-Ваальса.
Химическая связь, возникающая в результате образования общих (связывающих) электронных пар, называется ковалентной или атомной связью.
Простейший пример ковалентной связи – образование молекулы водорода Н2. Атомы водорода имеют следующую электронную оболочку: 1S1. Внешний энергетический уровень является незавершенным: до завершения не хватает одного электрона. При сближении двух атомов водорода происходит взаимодействие электронов с антипараллельными стенами с формированием общей электронной пары:
 SS
SS
Н 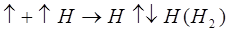
Объяснение механизма образования химической связи за счет общих электронных пар лежит в основе метода валентных связей. Схему образования ковалентной связи можно также показать, обозначив неспаренный электрон внешнего энергетического уровня атома одной точкой, а общую электронную пару – двумя точками:
Н· + ·Н  Н: Н
Н: Н
Общую электронную пару или ковалентную связь часто обозначают черточкой, например, Н – Н.
Общая электронная пара образуется в результате перекрывания S – орбиталей атомов водорода, на которых находятся электроны с противоположными спиновыми квантовыми числами. При этом в области перекрывания орбиталей создается повышенная электронная плотность.
Рассмотрим возникновение ковалентной связи в молекуле фтора. Атом фтора имеет семь электронов на внешнем энергетическом уровне, причем на

 2р — подуровне находится один неспаренный электрон:
2р — подуровне находится один неспаренный электрон:
9 F 1S2 2S2 2P5 2 



1  P
P
S
При сближение двух атомов фтора происходит перекрывание 2р – орбиталей с неспаренными электронами, в результате формируется общая электронная пара:
F+ F FFили F – F
FFили F – F
У каждого атома фтора в молекуле Р2 сохраняется три неподеленные электронные пары.
Существуют молекулы, в которых между двумя атомами возникают две или три общие электронные пары. Такие ковалентные связи называются двойными и тройными, а общее их название – кратные связи.
Например, в образовании химических связи в молекуле азота N2 участвуют по три электрона каждого атома азота:
7 N 1S2 2S2 2p3 2 




1  P
P
S
В этом случае образуется три общие электронные пары:
N N или N N
N
Таким образом, ковалентной называется связь, осуществляемая одной или несколькими общими электронными парами.
Характеристиками химической связи, в том числе ковалентной являются ее полярность, энергия и длина. Особое свойство ковалентной связи – ее направленность.
Если общая электронная пара симметрична относительно атомов, то ковалентная связь называется неполярной. Неполярная ковалентная связь образуется при взаимодействии атомов с одинаковой электроотрицательностью. В рассмотренных выше примерах – молекулах Н2Р2 и N2 существует неполярная связь.
Если взаимодействующие атомы имеют различную электроотрицательность, то общая электронная пара смещена к атому с большей электроотрицательностью. В этом случае возникает полярная ковалентная связь. Например, полярной является связь в молекуле фтороводорода НР. При образовании молекулы происходит перекрывание S – орбитами атома фтора. Общая электронная пара расположена несимметрично относительно центров взаимодействующих атомов. Схему образования связи Н-Р можно представить так:
Н + F HF
HF
Полярность связи в молекуле можно показать стрелкой, направленной в сторону атома с большей электроотрицательностью: Н F.
F.
В результате смещения электронной пары в молекуле НF возникает диполь. Диполь – это система из двух зарядов, равных по абсолютной величине, но противоположных по знаку. Принимают, что атом, к которому смещена общая электронная пара, приобретает некоторый отрицательный заряд, а другой атом – положительный заряд:
 —
— 
Многие молекулы, в которых возникают диполи, являются полярными. Вместе с тем существуют молекулы, которые не являются полярными, несмотря на полярный характер химических связей в них. К таким молекулам относится, например, молекула оксида углерода (IV), имеющая линейное строение:

Две одинаковые полярные связи, направленные под углом 180° и компенсируют электрические моменты друг друга, поэтому молекула является неполярной.
Прочность химической связи характеризуется энергией связи, т.е. энергией необходимой для разрыва связи. Значения энергии разрыва химических связей обычно приводятся в расчете на 1 моль вещества. Так, для молекулы Н2 энергия связи равна 432,1 КДЖ/моль, Р2 – 155 КДЖ/моль, НР – 565,7 КДЖ/моль. Длина связи – расстояние между ядрами атомов, образующих связь, например, длина связи в молекуле Н2 равна 0,074 нм, F2 – 0.142 нм, НР – 0,092 нм. Кратные связи короче простых, что можно проиллюстрировать примером связей углерод-углерод: длина одинарной связи С – С 0,154 нм, двойной С = С 0,134 нм, тройной С  С 0,120 нм.
С 0,120 нм.
Ковалентная связь имеет направленность. В рассматриваемых выше примерах химической связи в молекулах Н2, Р2, НР за направление связи принимается линия, проходящая через центры взаимодействующих атомов.
Рассмотрим направленность ковалентных связей в молекулах воды. Строение электронной оболочки атома кислорода, входящего в состав молекул воды, выражается формулой:
8 O 1S2 2S2 2p4 2 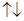




1  P
P
S
Ковалентные связи атом кислорода образует за счет 2р — орбиталей с неспаренными электронами, которые расположены под углом 90° друг другу. Эти орбитали перекрываются с S-орбиталями атомов водорода. В результате образуется молекула, в которой связи направлены под углом друг к другу за счет взаимного отталкивания электронных пар угол между связями, в молекуле воды (валентный угол) равен 104,5°.
Ковалентная связь может образоваться при перекрывании полностью свободной орбитали одного атома и орбитали с неподеленной электронной парой другого атома:

 A +: Д
A +: Д  А Д или А — Д
А Д или А — Д
Свободная орбиталь неподеленная электронная
акцептора пара донора
В этом случае так же формируется общая электронная пара, только вклад каждого из атомов в химическую связь различен. Атом А, который представляет свободную орбиталь, называется акцептором, атом Д, представляющий электронную пару, является донором. Такой механизм образования ковалентной связи называется донорно-акцепторным.
Примером донорно-акцепторного взаимодействия является реакция между ионом водорода Н+ (1S° — свободная S – орбиталь) и молекулой аммиака :Nh4 с образованием катиона аммония:
или  акцептор донор.
акцептор донор.
Следует отметить, что все четыре связи N-H в катионе аммония равноценны.
Чисто ионной связью называется химически связанное состояние атомов, при котором устойчивое электронное окружение достигается путем полного перехода общей электронной плотности к атому более электроотрицательного элемента.
На практике полный переход электрона от одного атома к другому атому – партнеру по связи не реализуется, поскольку каждый элемент имеет большую или меньшую электроотрицательность, и любая химическая связь будет в некоторой степени ковалентной. Если степень ковалентной связи достаточна высока, то такая химическая связь является полярной ковалентной связью с той или иной степенью ионности. Если же степень ковалентности связей мала, по сравнению со степенью ее ионности, то такая связь считается ионной.
Ионная связь возможна только между атомами электроположительных и электроотрицательных элементов, находящимися в состоянии разноименно заряженных ионов. Процесс образования ионной связи позволяет объяснить электростатическая модель, т.е. рассмотрение химического взаимодействия между отрицательно и положительно заряженными ионами.
Ионы – это электрически заряженные частицы, образующиеся из нейтральных атомов или молекул путем отдачи или приема электронов.
При отдаче или приеме электронов молекулами образуются молекулярные или многоатомные ионы, например,  — атион диоксигена,
— атион диоксигена,  — нитрит-ион.
— нитрит-ион.
Одноатомные положительные ионы, или одноатомные отрицательные ионы, или одноатомные анионы, возникают при химической реакции между нейтральными атомами путем взаимопередачи электронов при этом атом, электроположительного элемента, обладающий небольшим числом внешних электронов, переходит в более устойчивое состояние одноатомного катиона путем уменьшения числа этих электронов. Наоборот, атом электроотрицательного элемента, имеющий большое число внешних электронов, переходит в более устойчивое для него состояние одноатомного иона путем увеличения числа электронов. Одноатомные катионы образуются, как правило, металлами, а одноатомные анионы – неметаллами.
При передачи электронов атомы металлических и неметаллических элементов стремятся сформироваться вокруг своих ядер устойчивую конфигурацию электронной оболочки. Атом неметаллического элемента создает вокруг своего остова внешнюю оболочку последующего благородного газа. Тогда как атом металлического элемента после отдачи внешних электронов получает устойчивую октетную конфигурацию предыдущего благородного газа.
При взаимодействии металлических и неметаллических простых веществ, сопровождающемся отдачей и приемом электронов, образуются соли. Пример:
2Na + Cl2 = 2NaCl ,

2Al + 3F2 = 2AlF3

Ионная связь характерна не только для солей производного бескислородных и кислородосодержащих кислот [типа NaCl, AlF3, NaNO3, Al(SO4)3], но и для других классов неорганических веществ – основных оксидов и гидроксидов [типа Na2O и NaOH], бинарных соединений [типа Li3N и CaC2]. Между ионами с противоположными по знаку зарядами проявляются электростатические силы притяжения. Такие силы притяжения изотропны, т.е. действуют одинаково, во всех направлениях. В результате расположение ионов в твердых солях упорядочивается в пространстве определенным образом. Система упорядочено расположенных катионов и анионов называется ионной кристаллической решеткой, а сами твердые вещества (соли, основные оксиды и гидроксиды) – ионными кристаллами.
Все ионные кристаллы имеют солеобразный характер. Под солеобразным характером понимается определенный набор свойств, отличающий ионные кристаллы от кристаллических веществ с другими типами решеток. Конечно, не все ионные решетки характеризуются таким расположением ионов в пространстве, число ионов – соседей с противоположным зарядом может быть и иным, однако чередование катионов и анионов в пространстве является обязательным для кристаллов.
Вследствие того, что кулоновские силы притяжения распространяются одинаково по всем направлениям, ионы в узлах кристаллической решетки связаны относительно прочно, хотя каждый из ионов не зафиксирован неподвижно, а непрерывно совершает тепловые колебания вокруг своего положения в решетке. Поступательное же движение ионов вдоль решетки отсутствует, поэтому все вещества с ионными связями при комнатной температуре – твердые (кристаллические). Амплитуда тепловых колебаний может быть увеличена нагреванием ионного кристалла, которое приводит в итоге к разрушению решетки и переходу твердого вещества в жидкое состояние (при температуре плавления). Температура плавления ионных кристаллов относительно высока, а температура кипения, при которой совершается переход жидкого вещества в самое неупорядоченное, газовое состояние, имеет очень большие значения. Пример:
| NaCl | NaOH | KBr | BaF2 | BaCl2 |
| Темп.плавления, °С | 801 | 321 | 734 | 1368 | 961 |
| Темп.кипения, °С | 1465 | 1390 | 1380 | 2260 | 2050 |
Многие соли, особенно многоэлементные комплексные, а так же соли органических кислот могут разлагаться при температуре более низких, чем температура кипения и даже температура плавления.
Типичным свойством многих соединений с ионной связью (которые не взаимодействуют с водой или не разлагаются до плавления) является их способность к диссоциации на составляющие ионы; вследствие подвижности ионов водные растворы или расплавы ионных кристаллов проводят электрический ток.
В ионных кристаллах отсутствуют связи между отдельными парами ионов; точнее следует сказать, что все содержащиеся в образце ионного соединения катионы и анионы оказываются связанными.
В ионных кристаллах, построенных из катионов и анионов, молекулы отсутствуют.
Химические формулы ионных веществ передают только соотношение катионов и анионов в кристаллической решетке; в целом образец ионного вещества электронейтрален. Например, в соответствии с формулой ионного кристалла Al2O3 соотношение катионов Al3+ и анионов О2- в решетке равно 2:3; вещество электронейтрально – шесть положительных зарядов (2 Al3+) нейтрализуется шестью отрицательными зарядами (3 О2-).
Хотя реальных молекул в ионных кристаллах не существует для единообразия с ковалентными веществами принято с помощью формул типа NaClи Al2O3 передавать состав условных молекул, следовательно, характеризовать ионные вещества определенными значениями относительной молекулярной массы. Это тем более оправдано, поскольку переход от ковалентной связи к ионной происходит постепенно и имеют лишь условную границу с Dх = 1,7.
Относительная молекулярная масса веществ с ионной связью находится сложением относительных атомных масс соответствующих элементов с учетом числа атомов каждого элемента.
Пример: Относительная молекулярная масса Al2O3 составляет:
| Относительная атомная масса 2 (Al) | 2 × 26,992 |
| Относительная атомная масса 3 (О) | 3 × 15,999 |
| 101,961»101,96 |
Строение и форма кристаллов являются предметом исследования кристаллографии, а связь свойств кристаллов и их строения изучает кристаллохимия.
Следует отметить, что соединений в которых существует только ионная связь практически нет. Всегда между соседними атомами в кристалле возникают и ковалентные связи.
Металлы и сплавы металлов кристаллизируются в форме металлических решеток. Узлы в металлической решетке заняты положительными ионами металлов. Все металлы, за редкими исключениями, кристаллизуются в одном из трех типов решеток. При кубической плотнейшей упаковке атомных остатков формируется гранецентрированноя решетка; при гексагональной плотнейшей упаковке — гексагональная решетка. Кристаллы щелочных металлов, бария и некоторых переходных металлов образует объемно центрированную кубическую решетку. Названия решеток соответствуют упаковке атомных остатков в вершинах и серединах граней элементарного куба, в виде гексагональной призмы и в вершинах и геометрическом центре элементарного куба.
Заполнение гранецентрированной кубической и гексагональной решеток атомными остовами является максимально возможным при данных геометрических размерах атомных остатков металлов, поэтому такие виды упаковок атомов называются плотнейшими. Плотнейшим упаковкам атомов соответствует и максимальное координационное число решетки, т.е. число ближайших соседей, окружающих данный атомный остов в пространстве. Для кубической и гексагональной плотнейших упаковок координационное число равно 12; в объемно центрированной кубической решетке координационное число равно 8.
Валентные электроны, отделившиеся от атомов металлов и оставившие в узлах решетки соответствующие атомные остовы (катионы), более или менее свободно перемещаются в пространстве между катионами и обуславливают металлическую электрическую проводимость металлов. По аналогии с молекулами газообразного вещества совершающими хаотическое движение, подвижные электроны рассматривают как электронный газ в металле.
Устойчивость металлической решетки обеспечивается наличием электростатического притяжения между положительно заряженными атомными остовами и отрицательно заряженными подвижными электронами, связывающие кулоновские силы действуют на все соседние атомные оставы равномерно и поэтому они менее прочные, чем силы направленного химического связывания в атомных кристаллических решетках. Вследствие этого большинство металлических простых веществ, в отличие от алмазоподобных веществ, имеют относительно низкие температуры плавления. Пример:
| Cs | Na | Sn | Pb | Al | Ba | Ag | Cu | Fe |
| Температ.плавления | 29 | 98 | 232 | 328 | 660 | 727 | 962 | 985 | 1539 |
(Важнейшие исключения: Мо 2620, Re 3190, W 3387° С).
Подобно атомам в атомных решетках и ионам в ионных решетках, катионы в металлических решетках, не обладающие поступательным движением, постоянно совершают колебания вокруг положения узлов решетки. Амплитуда этих колебаний при нагревании возрастает, и при достижении температуры плавления металла решетка разрушается. Температура плавления металлов, как правило, возрастает с увеличением числа валентных электронов в их атомах и с уменьшением расстояния между атомами остовами в решетке – параметра решетки а.
Пример:
 | а, м | Температ. плавлен., ° С |
| Натрий Nа | 1 | 4,3 10-10 | 98 |
| Калий К | 1 | 5,3 10-10 | 64 |
| Кальций Са | 2 | 5,5 10-10 | 842 |
Натрий плавится при более высокой температуре, чем калий, вследствие меньшего значения параметра, а кальций плавится при значительно более высокой температуре, чем калий, в основном по причине удвоенного числа валентных электронов.
Уж упаковки кристаллических решеток зависит пластическая деформируемость металлов. Она тем выше, чем больше в металлической решетке плотнейших шаровых слоев и чем меньше пустот, тормозящих скольжение слоев. Наименьшая ковкость у металлов с гексагональной решеткой промежуточная – с объемно-центрированной кубической решеткой и наибольшая – с гранецентрированной кубической решеткой.
Пример. При нагревании железа до 911°С низкотемпературная объемно-центрированная кубическая решетка переходит в гранецентрированную кубическую решетку; по этой причине раскаленное железо значительно легче поддается ковке.
При затвердевании металлических расплавов происходит массовая кристаллизация и возникает одновременно множество мелких кристалликов, они называются кристаллитами. Рост кристаллита протекает в окружении подобных мелких кристаллов; при этом исключается значительное увеличение размеров кристаллитов и поэтому они не видны визуально на изломе металла и образец металла кажется монолитным.
Смеси двух или более индивидуальных металлов называются сплавами. В сплавах могут присутствовать в небольших количествах и некоторые неметаллы (С, Si, S). Распространенным методом получения сплавов является совместное нагревание их составных частей до полного расплавления смеси. Однако, есть металлы, которые не сплавляются друг с другом в любых отношениях.
Металлические сплавы можно классифицировать так: твердые растворы внедрения; твердые растворы замещения; смеси индивидуальных кристаллов металлов; смеси кристаллов интерметаллических соединений.
В сплавах, предоставляющих собой твердые растворы внедрения, часть межузельных полостей металлической кристаллической решетки занята атомами другого элемента. Такие примеси часто упрочняют сплав; например, чугун, сталь-железо, содержащее примесные атомы углерода, значительно тверже, чем чистое железо.
В сплавах – твердых растворах замещения часть атомов основного вещества заменена на атомы примесного элемента. Сплавы, состоящие из смеси индивидуальных кристаллических компонентов, образуются при соблюдении строго определенного соотношения; такие сплавы называются так же эвтектическими смесями. Эвтектической смесью является широко известный оловянный припой – третник (64% Sn и 36% Pb) с температурой плавления 181° С.
Сплавляемые металлы могут образовываться между собой химические соединения – интерметаллиды. Например, в бронзе присутствует интерметаллическое соединение состава Си3 Sn, а в латуни – интерметаллид СиZn3. Важнейшей составной частью стали, является карбит железа Fe3 C (цементит), который так же относится к интерметаллическим соединениям. Состав интерметаллидов обычно не отвечает стехиометрической валентности элементов; интерметаллиды – это нестехометрические соединения, составляющие обширный класс неорганических веществ с нестехиометрическим составом. Многие элементы образуют несколько нестехиаметрических соединений: так железо с фосфором дает фосфиды состава Fe3 P, Fe2 P, FeP, FeP, FeP2. Формулы этих соединений указывают лишь на то, что для кристаллических решеток характерно определенное соотношение компонентов, например, в Fe3 С на каждые три атома Fe приходится один атом С.
Химия комплексных соединений – один из обширных разделов неорганической химии. Начало изучению комплексных соединений положил швейцарский химик Вернер (1893 г), который разработал основы координационной теории. Он выделял простые соединения, или соединения первого порядка, как образованные в соответствии со стехиометрической валентностью элементов, и комплексные соединения или соединения высшего порядка, в которых атомы тех же элементов присоединяют большее число партнеров по связи. Четкой границы между комплексными и простыми соединениями нет.
Комплексное соединение состоит из разнозаряженных внешней и внутренней сферы; встречаются так же нейтральные комплексы. Формулу комплекса записывают в квадратных скобках; в комплексе различают центральный атом – лиганды, которые связаны с центральным атомом ковалентно и донорно-акцепторному механизму. Если лиганд образует одну 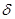 — связь с центральным атомом, то число таких лигандов равно координационному числу центрального атома. Заряд всего комплекса определяется суммарным зарядом всех лигандов и зарядом центрального атома выраженным степенью окисления соответствующего элемента.
— связь с центральным атомом, то число таких лигандов равно координационному числу центрального атома. Заряд всего комплекса определяется суммарным зарядом всех лигандов и зарядом центрального атома выраженным степенью окисления соответствующего элемента.
Центральный атом может быть атом неметалла или металла. Комплексные соединения с центральными атомами неметаллов. Такие комплексные соединения образуются из молекул простых соединений и дополнительных частиц лиганда.
1.7 Валентность и степень окисления элементов
Термин валентности был введен в химию в 1853 году английским химиком – органиком Франклендом для обоснования количественных соотношений атомов элементов в химических соединениях. Развитие учения о валентности в большой степени связано с открытием Д.И. Менделеевым Периодического закона (1869 году). Им была установлена связь между валентностью и его положением в Периодической системе, введено понятие о переменной валентности элементов в их соединениях с кислородом и водородом. Учение о строении атомов и молекул способствовало разработке электронной теории валентности.
1.8 Стеохимическая валентность
Для стеохимических расчетов, а так же для составления химических формул и уравнений необходимо знание количественных соотношений атомов различных элементов, в которых они соединяются или реагируют. Такая информация передается стехиометрической валентностью.
Стехиометрическая валентность элемента показывает, со сколькими атомами одновалентного элемента соединяется атом данного элемента.
Одновалентными считаются все элементы, атомы которых в двухэлементных соединениях всегда связаны с одним атомом другого элемента. Примером одновалентного элемента является водород Н. Поэтому считается, что стехиометрическая валентность элемента указывает на то, со сколькими атомами водорода соединен один атом рассматриваемого элемента. Так, в НСl хлор – одновалентен, в Н2О кислород – двухвалентен, NН3 азот – трехвалентен.
Водородные соединения известны не для всех элементов, но почти все стехиометричны двухвалентным и по составу кислородных соединений других элементов можно определить валентность этих элементов. Считают, что все оксиды можно получить формальным замещением атомов водорода в воде на атомы других элементов. Например, из сравнения формул Н2О и Na2O или Н2О и СаО делают заключение об одновалентности натрия и двухвалентности кальция. Таким образом, стехиометрическая валентность элемента определяется числом атомов водорода, которое может быть присоединено или замещено одним атомом данного элемента.
Электрический заряд ионов определяет, в каком соотношении эти ионы находятся в кристаллической решетке ионного соединения.
Между зарядом одноэлементных ионов и числом валентных электронов нейтральных атомов элементов имеется непосредственная связь:
Положительный заряд иона равен числу электронов, отданных одним атомом элемента; отрицательный заряд иона равен числу электронов, принятых одним атомом элемента.
Пример записи Na+, Ca2+, Al3+ означают, что атомы этих элементов потеряли соответственно 1, 2 и 3  , а записи F-, O2-, N3- означают, что атомы этих элементов приобрели соответственно 1, 2 и 3
, а записи F-, O2-, N3- означают, что атомы этих элементов приобрели соответственно 1, 2 и 3  .
.
II Строение вещества
2.1 Молекулы химических соединений
Химические соединения, состоящие из атомов не менее двух элементов, имеют в качестве наименьших составных частей молекулы – электрически нейтральные группы атомов, или ионы – электрически заряженные атомы или группы атомов. Из молекул составлены ковалентные соединения, обычно легколетучие.
Пример. Молекулы воды Н2О, аммиака Nh4, диоксида углерода СО2 построены из атомов различных неметаллических элементов, соединенных между собой ковалентными связями. Так, молекула воды Н2О составлена из двух атомов водорода Н и одного атома кислорода О, причем атом кислорода образует отдельные ковалентные связи с каждым атомом водорода.
Молекула – это наименьшая частица химического соединения, обладающая его химическими свойствами.
Это определение молекулы действительно только при учете следующих двух ограничений. Во-первых, в форме молекул могут быть не только соединения, но и простые вещества, молекулы химического соединения, т.е. сложного вещества многоэлементны (h3O, Nh4, CO2, h3SO4), молекулы простых веществ – одноэлементны (h3, O2, N2, Cl2, S8, P4 и др). Поэтому в приведенном выше определении молекулы речь идет о многоэлементных молекулах.
2.2 Размеры и масса атомов и молекул
Радиусы атомов и молекул выражаются очень малыми величинами, и в стомиллионных долях сантиметра и обычно измеряются в ангстремах, 1А равен 10-8 см.
Радиус молекулы СО2 равен 1,66 × 10-8 см, что равно 1,66 А.
Диаметр молекулы N2 равен 3,1× 10-8 см, а это равно 3,1 А. Длина молекулы натурального каучука равна 20000 А. масса молекулы кислорода равна 53,12× 10-24 г. 1 г. водорода содержит около 6,02× 1023 атомов. Чем больше масса молекул газа, тем ниже средняя скорость их движения; средние скорости молекул газообразных веществ обратно пропорциональны квадратным корням из чисел, выражающих их массы:
V1: V2 = 
Скорость движения молекул зависит от температуры: чем выше температура газа, тем больше средняя скорость движения его молекул. Эта зависимость выражается следующим уравнением:
V1: V2 =  ,
,
где Т – абсолютная температура
2.3 Строение многоатомных молекул
| Молекула | Форма | Межъядерные расстояния (в А) |
| СО2 | Линейная симметричная О = С = О | С = О 1,13 |
| NO2 | Изогнутая < ONO=140º N OO | N = O 1,18 |
| h3O | Изогнутая < HOH=104-106º O H H | O – H 0,97 |
| SO2 | Изогнутая < SOS=124º S O O | S = O 1, 45 |
| Nh4 |   Правильная треугольная пирамида Правильная треугольная пирамида
< НNH=180º | Высота пирамиды h = 0,3 |
| C2h3 | Симметричная вытянутая Н – С ≡ С –Н | С – Н 1,06 С ≡ С 1,22 |
| СН4 | Тетрайдер < при С = 109º 28' HH C H H | C – H 1,09 |
| C2h3 | < HСH = 114º 55' H H C = C H H | C – H 1, 06 C = C 1,34 |
1. Воскресенский П.И., Цветков Л.А. и др. Справочник по химии.– М., 1974.
2. Рудзитис Г.Е. Химия.– М., 1989.
3. Третьяков Ю.Д., Дайненко В.И. и др. Химия. Справочные материалы. –М., 1984.
4. Хомченко И.Г Общая химия… – М., 1987.
www.ronl.ru
 Класс кристаллич. Вещества
Класс кристаллич. Вещества



 Проводники 1-го рода
Проводники 1-го рода
 Электронные
Электронные
 тронной орбитали 2 электрона не обладает химической активностью
тронной орбитали 2 электрона не обладает химической активностью
 (на внешнем энергетическом уровне 2 электрона)
(на внешнем энергетическом уровне 2 электрона)
 82 Pb
82 Pb . Металлическая кристаллическая решётка характеризуется ковкостью и пластичностью, непрозрачностью, тепло- и электропроводимостью. Кристаллы синеватого цвета с металлическим блеском.
. Металлическая кристаллическая решётка характеризуется ковкостью и пластичностью, непрозрачностью, тепло- и электропроводимостью. Кристаллы синеватого цвета с металлическим блеском. Распределение электронов по энергетическим уровням атома бора:
Распределение электронов по энергетическим уровням атома бора: в возбуждённом состоянии: n=2 — три неспаренных электрона – один неспаренный s-электрон переходит в р-орбиталь, образуется тетрагональная кристаллическая структура с полупроводниковыми свойствами типа. Ширина запрещённой зоны 1,58 эВ (»150кДж/моль).
в возбуждённом состоянии: n=2 — три неспаренных электрона – один неспаренный s-электрон переходит в р-орбиталь, образуется тетрагональная кристаллическая структура с полупроводниковыми свойствами типа. Ширина запрещённой зоны 1,58 эВ (»150кДж/моль). Примесь Zn: s p
Примесь Zn: s p Примесь Sbт: s p d
Примесь Sbт: s p d
 SS
SS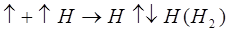
 Н: Н
Н: Н
 2р — подуровне находится один неспаренный электрон:
2р — подуровне находится один неспаренный электрон:



 P
P FFили F – F
FFили F – F





 P
P N
N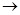 HF
HF F.
F. —
— 

 С 0,120 нм.
С 0,120 нм.
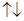




 P
P
 A +: Д
A +: Д  А Д или А — Д
А Д или А — Д акцептор донор.
акцептор донор. — атион диоксигена,
— атион диоксигена,  — нитрит-ион.
— нитрит-ион.


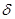 — связь с центральным атомом, то число таких лигандов равно координационному числу центрального атома. Заряд всего комплекса определяется суммарным зарядом всех лигандов и зарядом центрального атома выраженным степенью окисления соответствующего элемента.
— связь с центральным атомом, то число таких лигандов равно координационному числу центрального атома. Заряд всего комплекса определяется суммарным зарядом всех лигандов и зарядом центрального атома выраженным степенью окисления соответствующего элемента. , а записи F-, O2-, N3- означают, что атомы этих элементов приобрели соответственно 1, 2 и 3
, а записи F-, O2-, N3- означают, что атомы этих элементов приобрели соответственно 1, 2 и 3  .
.
 ,
,
 Правильная треугольная пирамида
Правильная треугольная пирамида
