|
 |
|
|
|
|
|
|
|
 |
|
|
|
|
|
|
works.tarefer.ru
Белки – это биологические гетерополимеры, мономерами которых являются аминокислоты. Белки синтезируются в живых организмах и выполняют в них определенные функции.
В состав белков входят атомы углерода, кислорода, водорода, азота и иногда серы. Мономерами белков являются аминокислоты – вещества, имеющие в своем составе неизменяемые части аминогруппу Nh3 и карбоксильную группу СООН и изменяемую часть – радикал. Именно радикалами аминокислоты отличаются друг от друга. Аминокислоты обладают свойствами кислоты и основания (они амфотерны), поэтому могут соединяться друг с другом. Их количество в одной молекуле может достигать нескольких сотен. Чередование разных аминокислот в разной последовательности позволяет получать огромное количество различных по структуре и функциям белков.
В белках встречается 20 видов различных аминокислот, некоторые из которых животные синтезировать не могут. Они получают их от растений, которые могут синтезировать все аминокислоты. Именно до аминокислот расщепляются белки в пищеварительных трактах животных. Из этих аминокислот, поступающих в клетки организма, строятся его новые белки.
Структура белковой молекулы. Под структурой белковой молекулы понимают ее аминокислотный состав, последовательность мономеров и степень скрученности молекулы, которая должна умещаться в различных отделах и органоидах клетки, причем не одна, а вместе с огромным количеством других молекул.
Последовательность аминокислот в молекуле белка образует его первичную структуру. Она зависит от последовательности нуклеотидов в участке молекулы ДНК (гене), кодирующем данный белок. Соседние аминокислоты связаны пептидными связями, возникающими между углеродом карбоксильной группы одной аминокислоты и азотом аминогруппы другой аминокислоты.
Длинная молекула белка сворачивается и приобретает сначала вид спирали. Так возникает вторичная структура белковой молекулы. Между СО и NH – группами аминокислотных остатков, соседних витков спирали, возникают водородные связи, удерживающие цепь.
Молекула белка сложной конфигурации в виде глобулы (шарика), приобретает третичную структуру. Прочность этой структуры обеспечивается гидрофобными, водородными, ионными и дисульфидными S‑S связями.
Некоторые белки имеют четвертичную структуру, образованную несколькими полипептидными цепями (третичными структурами). Четвертичная структура так же удерживается слабыми нековалентными связями – ионными, водородными, гидрофобными. Однако прочность этих связей невелика и структура может быть легко нарушена. При нагревании или обработке некоторыми химическими веществами белок подвергается денатурации и теряет свою биологическую активность. Нарушение четвертичной, третичной и вторичной структур обратимо. Разрушение первичной структуры необратимо.
В любой клетке есть сотни белковых молекул, выполняющих различные функции. Кроме того, белки имеют видовую специфичность. Это означает, что каждый вид организмов обладает белками, не встречающимися у других видов. Это создает серьезные трудности при пересадке органов и тканей от одного человека к другому, при прививках одного вида растений на другой и т.д.
Функции белков. Каталитическая (ферментативная ) – белки ускоряют все биохимические процессы, идущие в клетке: расщепление питательных веществ в пищеварительном тракте, участвуют в реакциях матричного синтеза. Каждый фермент ускоряет одну и только одну реакцию (как в прямом, так и в обратном направлении). Скорость ферментативных реакций зависит от температуры среды, уровня ее рН, а также от концентраций реагирующих веществ и концентрации фермента.
Транспортная – белки обеспечивают активный транспорт ионов через клеточные мембраны, транспорт кислорода и углекислого газа, транспорт жирных кислот.
Защитная – антитела обеспечивают иммунную защиту организма; фибриноген и фибрин защищают организм от кровопотерь.
Структурная – одна из основных функций белков. Белки входят в состав клеточных мембран; белок кератин образует волосы и ногти; белки коллаген и эластин – хрящи и сухожилия.
Сократительная – обеспечивается сократительными белками – актином и миозином.
Сигнальная – белковые молекулы могут принимать сигналы и служить их переносчиками в организме (гормонами). Следует помнить, что не все гормоны являются белками.
Энергетическая – при длительном голодании белки могут использоваться в качестве дополнительного источника энергии после того, как израсходованы углеводы и жиры.
www.ronl.ru
|
ОГЛАВЛЕНИЕ_________________________________________________________ 1
БЕЛКИ________________________________________________________________ 3
СТРУКТУРА БЕЛКОВ__________________________________________________ 5
ФИЗИЧЕСКИЕ СВОЙСТВА_____________________________________________ 7
ХИМИЧЕСКИЕ СВОЙСТВА____________________________________________ 7
СИНТЕЗ БЕЛКОВ______________________________________________________ 8
Литература:___________________________________________________________ 8
ЕЛКИ — это азотсодержащие высокомолекулярные органические вещества со сложным составом и строением молекул.
Белок можно рассматривать как сложный полимер аминокислот.
Белки входят в состав всех живых организмов, но особо важную роль они играют в животных организмах, которые состоят из тех или иных форм белков (мышцы, покровные ткани, внутренние органы, хрящи, кровь).
Растения синтезируют белки (и их составные части a-аминокислоты) из углекислого газа СО2 и воды Н2О за счет фотосинтеза, усваивая остальные элементы белков (азот N, фосфор Р, серу S, железо Fe, магний Mg) из растворимых солей, находящихся в почве.
Животные организмы в основном получают готовые аминокислоты с пищей и на их базе строят белки своей организма. Ряд аминокислот (заменимые аминокислоты) могут синтезироваться непосредственно животными организмами.
Характерной особенностью белков является их многообразие, связанное с количеством, свойствами и способах соединения входящих в их молекулу аминокислот. Белки выполняют функцию биокатализаторов — ферментов, регулирующих скорость и направление химических реакций в организме. В комплексе с нуклеиновыми кислотами обеспечивают функции роста и передачи наследственных признаков, являются структурной основой мышц и осуществляют мышечное сокращение.
В молекулах белков содержатся повторяющиеся амидные связи С(0)—NH, названные пептидными (теория русского биохимика А.Я.Данилевского).
Таким образом, белок представляет собой полипептид, содержащий сотни или тысячи аминокислотных звеньев.
|

|
собый характер белка каждого вида связан не только с длиной, составом и строением входящих в его молекулу полипептидных цепей, но и с тем, как эти цепи ориентируются.
В структуре любого белка существует несколько степеней организации:
Первичная структура белка — специфическая последовательность аминокислот в полипептидной цепи.
|
|
|
|
|
|
дисульфидный мостик (-S-S-) между атомами серы,
сложноэфирный мостик – между карбоксильной группой (-СО-) и гидроксильной (-ОН),
солевой мостик - между карбоксильной (-СО-) и аминогруппами (Nh3).
|
|
Четвертичная структура белка — тип взаимодействия между несколькими полипептидными цепями.
|
елки имеют большую молекулярную массу ( 104—107), многие белки растворимы в воде, но образуют, как правило, коллоидные растворы, из которых выпадают при увеличении концентрации неорганических солей, добавлении солей тяжелых металлов, органических растворителей или при нагревании (денатурация).
Денатурация — разрушение вторичной и третичной структуры белка.
Качественные реакции на белок:
биуретовая реакция: фиолетовое окрашивание при обработке солями меди в щелочной среде (дают все белки),
ксантопротеиновая реакция: желтое окрашивание при действии концентрированной азотной кислоты, переходящее в оранжевое под действием аммиака (дают не все белки),
выпадение черного осадка (содержащего серу) при добавлении ацетата свинца (II), гидроксида натрия и нагревании.
Гидролиз белков — при нагревании в щелочном или кислом растворе с образованием аминокислот.
Белок — сложная молекула, и синтез его представляется трудной задачей. В настоящее время разработано много методов прекращения a-аминокислот в пептиды и синтезированы простейшие природные белки — инсулин, рибонуклеаза и др.
Большая заслуга в создании микробиологической промышленности по производству искусственных пищевых продуктов принадлежит советскому ученому А.Н.Несмеянову.
Справочник школьника
“ХИМИЯ” М.,”СЛОВО” 1995.
Г.Е.Рудзитис, Ф.Г.Фельдман
“Химия 11. Органическая химия”
М., “Просвещение”,1993.
А.И.Артеменко, И.В. Тикунова
“Химия 10-11. Органическая химия”
М., “Просвещение” 1993.
www.referatmix.ru
|
оглавление
ОГЛАВЛЕНИЕ_________________________________________________________ 1
БЕЛКИ________________________________________________________________ 3
СТРУКТУРА БЕЛКОВ__________________________________________________ 5
ФИЗИЧЕСКИЕ СВОЙСТВА_____________________________________________ 7
ХИМИЧЕСКИЕ СВОЙСТВА____________________________________________ 7
СИНТЕЗ БЕЛКОВ______________________________________________________ 8
Литература:___________________________________________________________ 8
белки
ЕЛКИ — это азотсодержащие высокомолекулярные органические вещества со сложным составом и строением молекул.
Белок можно рассматривать как сложный полимер аминокислот.
Белки входят в состав всех живых организмов, но особо важную роль они играют в животных организмах, которые состоят из тех или иных форм белков (мышцы, покровные ткани, внутренние органы, хрящи, кровь).
Растения синтезируют белки (и их составные части a-аминокислоты) из углекислого газа СО2и воды Н2О за счет фотосинтеза, усваивая остальные элементы белков (азот N, фосфор Р, серу S, железо Fe, магний Mg) из растворимых солей, находящихся в почве.
Животные организмы в основном получают готовые аминокислоты с пищей и на их базе строят белки своей организма. Ряд аминокислот (заменимые аминокислоты) могут синтезироваться непосредственно животными организмами.
Характерной особенностью белков является их многообразие, связанное с количеством, свойствами и способах соединения входящих в их молекулу аминокислот. Белки выполняют функцию биокатализаторов — ферментов, регулирующих скорость и направление химических реакций в организме. В комплексе с нуклеиновыми кислотами обеспечивают функции роста и передачи наследственных признаков, являются структурной основой мышц и осуществляют мышечное сокращение.
В молекулах белков содержатся повторяющиеся амидные связи С(0)—NH, названные пептидными (теория русского биохимика А.Я.Данилевского).
Таким образом, белок представляет собой полипептид, содержащий сотни или тысячи аминокислотных звеньев.
Структура белков
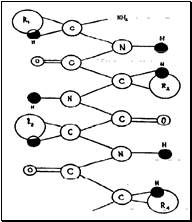 |
собый характер белка каждого вида связан не только с длиной, составом и строением входящих в его молекулу полипептидных цепей, но и с тем, как эти цепи ориентируются.
В структуре любого белка существует несколько степеней организации:
Первичная структура белка — специфическая последовательность аминокислот в полипептидной цепи.
|
|
|
|
дисульфидный мостик (-S-S-) между атомами серы,
сложноэфирный мостик – между карбоксильной группой (-СО-) и гидроксильной (-ОН),
солевой мостик - между карбоксильной (-СО-) и аминогруппами (Nh3).
|
Четвертичная структурабелка — тип взаимодействия между несколькими полипептидными цепями.
|
Физические свойства
елки имеют большую молекулярную массу ( 104—107), многие белки растворимы в воде, но образуют, как правило, коллоидные растворы, из которых выпадают при увеличении концентрации неорганических солей, добавлении солей тяжелых металлов, органических растворителей или при нагревании (денатурация).
Химические свойства
Денатурация — разрушение вторичной и третичной структуры белка.
Качественные реакции на белок:
биуретовая реакция: фиолетовое окрашивание при обработке солями меди в щелочной среде (дают все белки),
ксантопротеиновая реакция: желтое окрашивание при действии концентрированной азотной кислоты, переходящее в оранжевое под действием аммиака (дают не все белки),
выпадение черного осадка (содержащего серу) при добавлении ацетата свинца (II), гидроксида натрия и нагревании.
Гидролиз белков — при нагревании в щелочном или кислом растворе с образованием аминокислот.
Синтез белков
Белок — сложная молекула, и синтез его представляется трудной задачей. В настоящее время разработано много методов прекращения[ГМВ1]a-аминокислот в пептиды и синтезированы простейшие природные белки — инсулин, рибонуклеаза и др.
Большая заслуга в создании микробиологической промышленности по производству искусственных пищевых продуктов принадлежит советскому ученому А.Н.Несмеянову.
Литература:
Справочник школьника
“ХИМИЯ” М.,”СЛОВО” 1995.
Г.Е.Рудзитис, Ф.Г.Фельдман
“Химия 11. Органическая химия”
М., “Просвещение”,1993.
А.И.Артеменко, И.В. Тикунова
“Химия 10-11. Органическая химия”
М., “Просвещение” 1993.
[ГМВ1]
superbotanik.net
|
ОГЛАВЛЕНИЕ_________________________________________________________
БЕЛКИ________________________________________________________________
СТРУКТУРА БЕЛКОВ__________________________________________________
ФИЗИЧЕСКИЕ СВОЙСТВА_____________________________________________
ХИМИЧЕСКИЕ СВОЙСТВА____________________________________________
СИНТЕЗ БЕЛКОВ______________________________________________________
Литература:___________________________________________________________
Белок можно рассматривать как сложный полимер аминокислот.
Белки входят в состав всех живых организмов, но особо важную роль они играют в животных организмах, которые состоят из тех или иных форм белков (мышцы, покровные ткани, внутренние органы, хрящи, кровь).
Растения синтезируют белки (и их составные части a-аминокислоты) из углекислого газа СО2 и воды Н2О за счет фотосинтеза, усваивая остальные элементы белков (азот N, фосфор Р, серу S, железо Fe, магний Mg) из растворимых солей, находящихся в почве.
Животные организмы в основном получают готовые аминокислоты с пищей и на их базе строят белки своей организма. Ряд аминокислот (заменимые аминокислоты) могут синтезироваться непосредственно животными организмами.
Характерной особенностью белков является их многообразие, связанное с количеством, свойствами и способах соединения входящих в их молекулу аминокислот. Белки выполняют функцию биокатализаторов — ферментов, регулирующих скорость и направление химических реакций в организме. В комплексе с нуклеиновыми кислотами обеспечивают функции роста и передачи наследственных признаков, являются структурной основой мышц и осуществляют мышечное сокращение.
В молекулах белков содержатся повторяющиеся амидные связи С(0)—NH, названные пептидными (теория русского биохимика А.Я.Данилевского).
Таким образом, белок представляет собой полипептид, содержащий сотни или тысячи аминокислотных звеньев.
|
В структуре любого белка существует несколько степеней организации:
1. Первичная структура белка — специфическая последовательность аминокислот в полипептидной цепи.
| |
| |
|
3.
|
· дисульфидный мостик (-S-S-) между атомами серы,
· сложноэфирный мостик – между карбоксильной группой (-СО-) и гидроксильной (-ОН),
· солевой мостик - между карбоксильной (-СО-) и аминогруппами (Nh3).
| |
|
2. Качественные реакции на белок:
n биуретовая реакция: фиолетовое окрашивание при обработке солями меди в щелочной среде (дают все белки),
n ксантопротеиновая реакция: желтое окрашивание при действии концентрированной азотной кислоты, переходящее в оранжевое под действием аммиака (дают не все белки),
n выпадение черного осадка (содержащего серу) при добавлении ацетата свинца (II), гидроксида натрия и нагревании.
3. Гидролиз белков — при нагревании в щелочном или кислом растворе с образованием аминокислот.
Большая заслуга в создании микробиологической промышленности по производству искусственных пищевых продуктов принадлежит советскому ученому А.Н.Несмеянову.
“ХИМИЯ” М.,”СЛОВО” 1995.
Г.Е.Рудзитис, Ф.Г.Фельдман
“Химия 11. Органическая химия”
М., “Просвещение”,1993.
А.И.Артеменко, И.В. Тикунова
“Химия 10-11. Органическая химия”
М., “Просвещение” 1993.
www.coolreferat.com