 зависит от частоты излучения
зависит от частоты излучения  :
:  , где (1)
, где (1) Развитие естествознания на границе XIX-XX веков показало, что помимо химических превращенийсуществует целый ряд процессов, в которых атомы выступают как сложные объекты,состоящие из положительно заряженной части — ядра и отрицательно заряженныхэлектронов, суммарный заряд которых в точности компенсирует заряд ядра. Врезультате работ английского физика Дж. Дж. Томсона и американского физика Р.С.Малликена было установлено, что электрон имеет массу 9,1•1031 кг,или 1/1837 массы атома водорода, и заряд 1,6•10 19 Кл. Основнаямасса атома сосредоточена в ядре, которое занимает очень малую часть его объема:диаметр ядра порядка 1СГ14 м, он составляет лишь около 10 4диаметра атома. Наглядно это соотношение размеров можно представить себе, еслиувеличить атом в 1011 раз: тогда ядро диаметром 1 мм разместитсявнутри атома диаметром 10 метров!
Позднее было показано, что атомные ядра состоят изположительно заряженных частиц — протонов и незаряженных частиц — нейтронов. Протонимеет заряд, равный заряду электрона, но со знаком плюс, его масса практическиравна массе нейтрона. Отметим, что в химии принято выражать заряды ионов вединицах заряда электрона с соответствующим знаком, например Н+, Mg2+, СГ.
/>
Таким образом, число протонов в ядре определяет его заряд ипорядковый номер, а сумма чисел протонов и нейтронов — округленную общую массуядра в атомных единицах, или массовое число атома. Очевидно, что вэлектронейтральном атоме число протонов в атомном ядре равно числу электронов вэлектронной оболочке атома.
2. Атомный номер элемента. изотопыПорядковый номер элемента принято называть его атомнымномером и обозначать буквой Z. Атомный номер лежит воснове систематизации химических элементов и определяет их положение впериодической системе.
При определенном атомном номере, т.е. при определенном числепротонов, в ядре могут находиться разные числа нейтронов, поэтому могутсуществовать отличающиеся по массе разновидности атомов одного и того жеэлемента — изотопы.
Например, природный водород представляет собой смесьизотопов с массовыми числами 1 и 2, а.
/>
Клетка периодической таблицы
В ядре атома урана 92 протона, а в его электронной оболочке- 92 электрона
В периодической таблице, элементы расположены в порядкеувеличения заряда ядра, а в отдельных клеточках таблицы принято приводитьсредневзвешенные атомные массы, поэтому они часто сильно отличаются отцелочисленных.
/>
Рис. 2.3, а. Масс-спектрометр.
Газ вводится в вакуумированный прибор через трубку (i) и подвергается ионизации потоком электронов из электроннойпушки (2). Заряженные пластины (3) и (4) разгоняют поток полученныхположительных ионов, который проходит через щель в пластине (4) и попадает вполе магнита (5), отклоняющее отдельные ионы в соответствии с отношением заряд:масса. За второй щелью (в) расположен детектор (7), который регистрирует числочастиц, прошедших через щель. Меняя напряженность магнитного поля, можнопоследовательно регистрировать относительное количество ионов с различноймассой, получая масс-спектр.
В масс-спектрометре молекулы газа превращаются в ионы. Показаначасть масс-спектра, соответствующая нонам ТЮ+ и ТЮ2. Отдельныеполосы отвечают пяти изотопам титана с массой 46, 47, 48, 49, 50 значений массатомов и разделение изотопов стало возможным в результате созданиямасс-спектрометрии — метода, основанного на воздействии магнитного поля нанаправленные пучки заряженных частиц.
3. Ядерная модель атомаПервая модель атома была предложена в начале XX века Э. Резерфордом,новозеландцем, работавшем в Англии. Она предполагала, что электроны движутся сбольшой скоростью по круговым орбитам вокруг ядра, подобно планетам по отношениюк Солнцу. По представлениям классической электромагнитной теории в таком атомеэлектрон должен приближаться по спирали к ядру, непрерывно излучая энергию. Черезкороткое время электрон неизбежно должен упасть на ядро. Это очевидноенесоответствие фактам было не единственным недостатком модели Резерфорда: плавноеизменение энергии электронов в атоме не согласовывалось с появившимисянаблюдениями над спектрами атомов. Одним из достижений второй половины XIX векабыла разработка атомного спектрального анализа — точного и чувствительногометода, сыгравшего важнейшую роль в открытии новых элементов и послужившегоэкспериментальной основой изучения строения атомов. Метод основан на испусканиисвета свободными атомами, получающимися при сильном нагреваний вещества; приэтом атомы переходят из основного состояния с минимальной энергией ввозбужденные состояния с более высокими энергиями.
/>
Возвращаясь в основное состояние, атомы излучают свет. Оказалось,что атомные спектры излучения состоят из отдельных линий, отвечающих толькоопределенным длинам волн.
Чтобы объяснить линейчатый характер атомных спектров иустойчивость атомов, знаменитый датский физик Нильс Бор предложил двапостулата, выходящие за рамки классической физики:
Из бесконечного числа орбит, возможных с точки зренияклассической механики, допустимы лишь определенные орбиты, по которым электрондвижется не излучая.
Частота поглощаемого или испускаемого атомом излучения припереходе из одного разрешенного состояния в другое определяется разностьюэнергий этих состояний.
При этом Бор опирался на идею Макса Планка о квантованииэнергии. Планк установил, что, хотя свет, испускаемый раскаленным телом,кажется сплошным, световая энергия поглощается или излучается отдельнымипорциями — квантами Е = hv, пропорциональными частоте световогоэлектромагнитного колебания. Коэффициент пропорциональности h= 6,6252 • 10 34 Дж • с был назван постоянной Планка. Таким образомв науку было введено понятие кванта света, или некоторого светового пакета — фотона,отражающее не только волновую, но и корпускулярную природу света.
Модель Бора позволила рассчитать точные значения энергииатома водорода и любых одноэлектронных ионов, но оказалась непригодной для объяснениянаблюдаемых энергетических характеристик атомов с двумя и более электронами; главныйже ее недостаток заключался в том, что она не давала логического обоснованияприроды квантования и устойчивости не меняющихся во времени состояний атома. Однако,несмотря на эти недостатки, сами идеи Бора о квантовании и стационарныхсостояниях легли в основу современного описания строения атома с позицийквантовой механики.
4. Волновые свойства электрона/>
Вскоре после 1920 г. был сделан следующий важный шаг впознании микромира: было установлено, что не только световые кванты, но и любыемикрочастицы, в том числе электроны, обладают двойственной природой — частицыкак таковой и волны.
Например, электрону при скорости3 • 10е м/с отвечает длина волны
/>
В частности, удалось обнаружить дифракцию электронов напериодической решетке кристаллов и на молекулах газов. Частице с массой покоят, движущейся со скоростью v, соответствует длина волныX, которая может быть найдена из уравнения де Бройля: сопоставимая с размерамиатома. В то же время можно говорить и об импульсе и даже о массе движущегосяфотона, хотя, конечно, его масса покоя равна нулю. Это обстоятельствосущественным образом влияет на характер информации, которую дает спектроскопия.При столкновении фотона с электроном меняются импульс фотона и частота света,тем самым давая экспериментатору информацию об импульсе электрона. Однако,поскольку импульсы фотона и электрона сопоставимы, при этом меняется и импульсэлектрона, который надо определить. Ситуация в какой-то степени подобна попыткеизмерить скорость бегуна с помощью наблюдателя, который прыгает ему на плечи сразбега. Математически эти соображения описываются принципом неопределенностиГейзенберга, согласно которому возможность одновременного определения положениямикрочастицы в пространстве и ее импульса ограничена постоянной Планка. Это, вчастности, означает, что если мы хотим определить с большой точностью энергиюэлектрона в атоме, то мы не сможем столь же точно определить его положение поотношению к ядру.
5. Квантово-механическая модель атомаПредставления о стационарных состояниях атома и двойственнойприроде электрона, а также требования принципа неопределенности былииспользованы австрийским физиком Эрвином Шредингером, который в 1926 г. предложилмодель, описывающую электрон в атоме как своего рода стоячую волну, причемвместо точного положения электрона в пространстве рассматривалась вероятностьего пребывания в определенном месте.
Для того чтобы представить себе электрон в виде трехмернойстоячей волны, остановимся сначала на более простой одномерной модели стоячейволны, в качестве которой можно взять струну, закрепленную на концах. Струнаспособна издавать звуки только определенных частот, так как на ее длине можетуложиться лишь целое число полуволн — это и есть квантование энергии колебанийструны. Для описания характера стоячих волн одномерной системы достаточноодного числа п, которое однозначно определяет длину волны и число узловыхточек, в которых струна неподвижна, как и на закрепленных концах.
Моделью двумерной системы, испытывающей стационарныеколебания, может служить круглая мембрана, закрепленная по периметру, например,в телефонной трубке. Здесь также возможны лишь определенные, квантованныеколебания, для описания которых необходимы уже два числа.
Теперь очевидно, что для описания пространственного движенияэлектрона в атоме как трехмерной стоячей волны необходимы и достаточны тричисла, получившие название квантовых чисел. Квантово-механическое описаниеатома не требует никаких дополнительных постулатов, квантование энергии электронаестественным образом возникает из природы самого атома или так называемыхграничных условий, которые сводятся к тому, что электрон не покидает атом испособен двигаться с конечной скоростью.
/>
В волновой механике электрон, как и любая микрочастица,описывается с помощью волновой функции. Его движение определяется уравнением,предложенным Шредингером, — знаменитым уравнением Шредингера. Решением этогоуравнения является волновая функция \|/, которая соответствует разрешеннойэнергии электрона и описывает зависимость амплитуды стационарной волны,соответствующей электрону, от трех его пространственных координат. Квадратволновой функции определяет вероятность пребывания электрона в некоторойпространственной области. Здесь мы как раз встречаемся со случаем точногознания энергии электрона и вероятностного описания его положения в пространстве.Во многих случаях удобно рассматривать электрон как размытое в пространствеоблако отрицательного заряда. Плотность такого электронного облака в любойточке пропорциональна V) /2. Модель электронного облака наглядноописывает распределения электронной плотности в пространстве, хотя онафизически несовершенна, так как одноименно заряженные части облака должныотталкиваться друг от друга, вызывая его рассеивание. На самом же деле электронне отталкивается «сам от себя». Это обстоятельство несколькоограничивает аналогию между электроном и облаком, но не мешает нам говорить обэлектронных облаках во всех случаях, когда мы не интересуемся деталями,связанными с их потенциальной энергией. Представлением об электронных облакахмы будем широко пользоваться в этой книге.
6. Одноэлектронный атом. квантовые числаВ случае атома водорода и одноэлектронных ионов уравнениеШредингера может быть решено точно.
/>
Таким образом может быть получен набор волновых функцийэлектрона или атомных орбиталей. Словом «орбиталь», в отличие от«орбиты», подчеркивается волновая природа электрона. Каждая АОзависит от трех пространственных координат электрона и характеризуетсяопределенными значениями трех квантовых чисел п, I, т.д.ля описанияодноэлектронного атома, в котором электрон принимает участие в единственномвзаимодействии — с ядром, обладающим сферически-симметричным электростатическимполем, удобно использовать не декартову систему координат с переменными х, у,г, а сферическую с переменными.
Для наших целей нет необходимости заниматься математическойстороной решения сложного дифференциального уравнения Шредингера, однако длядальнейших химических выводов важно, что в сферических координатах возможноразделение переменных, и само его решение \j/n приобретает более удобный для дальнейшего анализа вид:
/>
Здесь Rnt — радиальнаясоставляющая волновой функции, зависящая от единственной переменной г — расстоянияэлектрон — ядро и характеризуемая только двумя квантовыми числами п и I, а Ylm — угловаясоставляющая волновой функции, описывающая зависимость распределенияэлектронной плотности от углов 9 и ф, т.е. форму и ориентацию АО, ихарактеризуемая квантовыми числами I и т. Рассмотрим последовательно физическийсмысл квантовых чисел п, I, ти характер различных АО.
Квантовое число п называется главным квантовым числом. Величинап определяет номер электронного слоя: чем меньше п, тем прочнее электрон связанс ядром и тем ближе, в среднем, он находится к ядру. Главное квантовое числоможет принимать целочисленные положительные значения 1, 2, 3 и т.д. Набор АО содинаковым п составляет слой. Основному состоянию атома водорода соответствуетп = 1, при этом Е1 = — 1312 кДж. Такое количество энергии выделится приобразовании одного моля атомов водорода из протонов и электронов, находящихсяна бесконечном удалении друг от друга. В одноэлектронном атоме или водноэлектронном ионе с зарядом ядра Z главное квантовоечисло однозначно определяет энергию электрона Еп:
Еп = — Rtf/a2
Здесь R — постоянный множитель,равный 1312 кДж, если энергия отнесена к 1 молю атомов и заряд Z измеряется в единицах заряда электрона.
Второе квантовое число I называется орбитальным, оноопределяет возможные квантованные величины орбитального момента количествадвижения электрона. Число I может принимать целочисленные значения от 0 до п — 1.
/>
/>
По традиции, сложившейся в процессе изучения атомныхспектров, значения I обычно обозначают буквами: s, р, d, f и далее по английскому алфавитувместо 0, 1, 2, 3 и т.д. Для нас самое главное то, что при описании электрона ввиде облака число I определяет его форму. Так, s-электроныимеют шарообразные, сферически симметричные облака, лишь в этом случае волноваяфункция \|/ не зависит от углов Э и ф; р-электроны {I =1) имеют гантелеобразные облака, d-электроны образуютоблака еще более сложной формы.
Вернемся к уравнению, в котором при RM стоят индексы nl. Как ужеотмечалось, это значит, что первое и второе квантовые числа вместе полностьюопределяют характер радиальной части волновой функции. Рассмотрим, как меняетсяплотность электронного облака с расстоянием от ядра. На рис.2.10 по оси ординатотложена вероятность нахождения электрона в пространстве, заключенном междусферами с радиусами г и г + dr. Из рисунка видно, чтовсе эти кривые, которые называются кривыми радиального распределенияэлектронной плотности, проходят через один или несколько максимумов. Еслимаксимумов несколько, то они разделены узловыми точками, в которых плотностьравна нулю. Последний от ядра максимум — самый большой, главный. Числомаксимумов равно п — I, число узловых точек равно — 1. Таким образом, с учетомуглового и радиального распределения облако, соответствующее ls-электрону,можно представить себе как диффузный шар переменной плотности, имеющей одинмаксимум и постепенно сходящей на нет при удалении от центра. Облако 2"-электронаподобно сфере с двумя сгущениями плотности и т.д.
/>
Видно, что среднее расстояние электрона от ядра существенноразлично для разных атомных орбиталей: оно растет с увеличением п, а при равныхп — с уменьшением I. Чем меньше I при одинаковых п, тем дальше от ядра и темниже главный максимум и тем большая часть электронной плотности находится ближек ядру за счет внутренних максимумов.
Третье квантовое число т — магнитное — определяетнаправление орбитального момента электрона, а с точки зрения моделиэлектронного облака — ориентацию его в пространстве. Магнитное квантовое числоможет принимать целочисленные значения от — I до +1, что соответствует разрешеннымквантовой механикой значениям проекции орбитального момента на заданноенаправление в пространстве. Следует отметить, что определенное направлениеможет быть задано внешним полем — электрическим или магнитным. В отсутствиевнешнего поля все разрешенные ориентации электронного облака равновероятны.
Поскольку облако s-электроновсферически симметрично, вопрос о его ориентации просто не имеет смысла. Вслучае р-электронов возможны три значения магнитного квантового числа — 1,0 и+1 и, соответственно, разрешены три взаимно перпендикулярные ориентациигантелеобразного облака. У d-электронов возможны пятьзначений т, у /электронов — семь.
Итак, три квантовых числа — главное, орбитальное и магнитное- позволяют задать атомную орбиталъ и достаточно подробно охарактеризовать одноэлектронныйатом: мы точно знаем энергию электрона и можем качественно описать электронноеоблако — его форму, ориентацию в присутствии внешнего поля, число сгущенийэлектронной плотности и число внутренних узловых поверхностей, где плотностьсходит к нулю.
Однако тремя квантовыми числами не исчерпываются данные,необходимые для полного описания состояния электрона в атоме. Детальноеисследование атомных спектров показало, что электрон обладает собственныммоментом количества движения, который получил название спинового момента илиспина. При вероятностном описании электрона как стоячей волны или какэлектронного облака спин не имеет классических аналогий — это просто свойствомикрочастиц.
Спин электрона характеризуется спиновым квантовым числом ms, которое может иметь два значения +1/2 и — 1/2,т.е. спин может иметь два противоположных направления.
Таким образом, для полной характеристики состояния электронав атоме необходимы четыре квантовых числа. Первые три из них определяютраспределение его плотности в пространстве, а четвертое — его спин. Знаниесмысла и возможных значений квантовых чисел имеет исключительное значение дляхимика, поэтому ниже мы приводим краткую сводку важнейших сведений такого рода.
/>
Решение уравнения Шредингера для атома водорода позволяет, впринципе, рассчитать его основные характеристики с любой точностью, дажеточнее, чем их дает эксперимент. Наиболее важными экспериментальнымихарактеристиками любых атомов являются энергии отрыва и присоедниенияэлектронов. Энергию отрыва электрона от атома, молекулы или иона не совсемправильно принято называть потенциалом ионизации. Потенциал ионизацииобозначают обычно буквой / и измеряют в электрон-вольтах. Экспериментальноизмеренный потенциал ионизации водорода равен 13,6 эВ* или как раз 1312 кДж.
Другой важной энергетической характеристикой атома являетсясродство к электрону — энергия, которая выделяется при присоединении к немудополнительного электрона. Сродство обычно обозначают буквой А с указаниемчастицы, например для водорода Ан = 73 кДж/моль. Знак «плюс»здесь говорит о том, что атом водорода приобретает второй электрон с выделениемэнергии, образуя ион Н.
7. Многоэлектронные атомыПри переходе от одноэлектронного атома к многоэлектронному вдополнение к взаимодействию электрон — ядро появляется новый тип взаимодействий- электронов друг с другом. Взаимодействие любого электрона с остальнымизависит от состояния каждого электрона и не может быть точно учтено, еслинеизвестны волновые функции всех остальных электронов, которые, в свою очередь,не могут быть рассчитаны, если неизвестно взаимодействие данного электрона состальными. Получается замкнутый круг, который принципиально не дает возможноститочно решить уравнение Шредингера для многоэлектронного атома. Эта трудность, ксчастью, может быть преодолена посредством приближенного решения, суть которогозаключается в следующем. Каждый электрон рассматривается отдельно такимобразом, как будто он находится в одноэлектронном атоме, заряд ядра которогочастично экранирован усредненным сферически-симметричным полем остальныхэлектронов. Отдельный электрон при этом испытывает только кулоновскоепритяжение центра, состоящего из ядра и остальных электронов, т.е. действиенекоторого центрально-симметричного положительного эффективного заряда,меньшего, чем заряд ядра. При таком подходе для многоэлектронных атомовсохраняют смысл понятия атомной орбитали и четырех квантовых чисел, толькоистинный заряд ядра заменяется эффективным.
Рассмотрим для примера с этой точки зрения атом гелия восновном состоянии. Если бы в нем совсем не было межэлектронноговзаимодействия, то оба электрона находились бы на орбитали с п = 1 в полезаряда Z = +2 и по формуле имели бы энергию Е = = — 13,6• 4 = — 54,4 эВ, равную экспериментально определенному потенциалу ионизацииодноэлектронного иона Не+. Другой крайний вариант — идеальноеэкранирование заряда ядра одним электроном по отношению к другому, которыйтогда испытывал бы действие заряда ядра, уменьшенного ровно на единицу, т.е. ядрас Z = +1. Тогда мы получаем точно такую же ситуацию,как в атоме водорода, и потенциал ионизации должен быть равен 13,6 эВ.
Для реального атома гелия истина лежит где-то между этимикрайностями, действительно, его потенциал ионизации составляет 24,6 эВ. Поформуле можно подсчитать заряд Z*, который должениспытывать на себе электрон с этой энергией в одноэлектронном атоме: Z* = ^24,6/13,6 = 1,34. Это и есть тот самый эффективныйзаряд, который действует на каждый электрон в атоме гелия.
В общем случае эффективный заряд ядра Z*- это положительный заряд, который «чувствует» электрон вмногоэлектронном атоме на заданной АО. Пользуясь эффективными зарядами ядер, мыможем оценивать энергию атомных орбиталей в многоэлектронном атоме.
8. Электронная конфигурация атомаРаспределение электронов по АО называют электроннойконфигурацией атома. Порядок заполнения АО электронами определяется двумяважнейшими принципами.
Согласно принципу минимума энергии наиболее устойчивому состояниюатома отвечает размещение электронов на орбиталях с наименьшей энергией, т.е. обеспечиваетсяминимум потенциальной энергии системы, состоящей из электронов с ядром.
Согласно принципу Паули любые два электрона в атоме воизбежание бесконечно большого взаимного отталкивания должны отличаться друг отдруга хотя бы одним квантовым числом. Так, если два электрона находятся наодной АО, то они должны иметь противоположные спины.
В соответствии с указанными принципами атом гелия в основномсостоянии имеет электронную конфигурацию Is2,при которой оба электрона находятся на ls-орбитали иимеют противоположные спины. Суммарный спин атома равен нулю. Схематически этуситуацию можно изобразить в виде ячейки с двумя стрелками:
/>
/>
Атом лития, следующий за гелием в периодической системе,содержит три электрона. По принципу минимума энергии два из них расположатся,как и в атоме гелия, на ls-орбитали. Третий электрон всоответствии с принципом Паули должен располагаться на АО с п = 2. Однако такихвозможностей две — 2s — и 2р-орбитали, и электрон будетиметь меньшую энергию на той из них, где он будет испытывать действие болеевысокого эффективного заряда. Рассмотрим с этой точки зрения кривые распределенияэлектронной плотности в атоме лития в зависимости от расстояния от ядра. Изэтих кривых хорошо видно, что замкнутый слой Isрасположен гораздо ближе к ядру, чем основная плотность 2s- или 2р-электрона. Однако внутренний максимум 2в-электрона практическиполностью проникает в ls-электронную плотность вблизкой к ядру области, и определенная часть его плотности «чувствует»на себе почти полный заряд ядра Z=+3. Единственныймаксимум 2р-электрона далек от ядра, а в области сосредоточения ls-электронов находится лишь незначительная его часть. Следовательно,в атоме лития электрон на 2в-орбитали испытывает на себе действие несколькоболее высокого эффективного заряда, он несколько хуже экранирован от ядра ls-электронами, чем электрон на 2р-орбитали, и прочнее связанс ядром. Соответственно, в основном состоянии атом лития будет иметьэлектронную конфигурацию ls22s1, а конфигурация ls22p1 отвечает возбужденному состоянию.
Рассматривая одноэлектронный атом, мы пришли к заключению,что при одинаковых п за счет внутренних максимумов ближе к ядру находитсябольшая часть плотности того электрона, который расположен на орбитали сменьшим значением I. Это в основном и определяет тот важнейший для всей химиифакт, что в одном слое s-электроны испытывают на себесамый большой эффективный заряд, р-электроны — меньший, d-электроны- еще меньше и т.д.
Другими словами, res-электронынаиболее прочно связаны с ядром и находятся на наиболее низком энергетическомуровне, далее следуют яр-электроны, а затем — red-электроны.Таким образом, энергия электронов в многоэлектронных атомах зависит не толькоот п, но и от I; при равных п она возрастает в порядке увеличения I. Порядокзаполнения АО для любого атома описывается эмпирическими правилами Клечковского:
/>
АО заполняются в порядке увеличения суммы п + I. Приодинаковых значениях суммы п + I АО заполняются в порядке увеличения п.
Отметим, что одному и тому же Сочетанию значений п и I могутотвечать несколько атомных орбиталей, различающихся значениями магнитногоквантового числа т. Например, 2р-электрон может находиться в любой из трехячеек с т, равным — 1, 0 или +1:
/>
Во всех этих трех случаях электрон будет иметь одну и ту жеэнергию, но разные волновые функции. В таких случаях говорят, что состояниеэлектрона вырождено.
В данном случае оно трижды вырождено, т.е. три состояния имеютодинаковую энергию. Если в атоме появляется второй р-электрон, гомежэлектронное отталкивание будет минимальным, когда оба электрона находятся вразных ячейках и имеют одинаковые спины.
/>
В общем случае при определении электронной конфигурации основногосостояния атома удобно пользоваться правилом Хунда: минимальной энергииотвечает максимальный суммарный спин.
Например, основному состоянию атома азота отвечаетэлектронная конфигурация:
/>
Указанные принципы позволяют легко определить электроннуюконфигурацию любого атома; для основных состояний электронные конфигурацииатомов приведены в табл.2.1
Энергия электронов, находящихся на различных орбиталяхатома, которую для краткости принято называть энергией атомных орбиталей,показана на рис. в зависимости от атомного номера. При Z= 1 число энергетических уровней соответствует числу значений п. При Z > 1 уровни расщепляются на подуровни с разнымизначениями I, причем энергия подуровней увеличивается в порядке возрастания I. Хотяход отдельных кривых довольно сложен, но в целом он разумно объясняется втерминах эффективных зарядов таким же образом, как и различие 2s — и 2р — подуровней.
Электронные конфигурации атомов восновном состоянии
/>
Возвращаясь к литию, отметим, что этот элемент в какой-тостепени аналогичен водороду из-за того, что его атом содержит один 2в-электрон,и литий легко образует ион Li+. Однакопервый потенциал ионизации лития /i = 5,39 эВсущественно меньше, чем у водорода, здесь уже сказывается рост главногоквантового числа). Поэтому литий легко реагирует с большинством неметаллов,хорошо растворяется в кислотах, теряя электрон и переходя в ион Li*, т.е. проявляет свойства типичного активного металла.
Второй потенциал ионизации лития I2= 75,7 эВ очень велик, так как его ls-электронырасположены гораздо ближе к ядру, чем 2в-электрон. На этом примере хорошо видно,что электроны внутренних замкнутых слоев не распространяются на периферию атомаи настолько прочно связаны с ядром, что, как правило, непосредственно незатрагиваются в химических процессах. В химии оказывается очень полезнымразделение электронов на внешние, или валентные, и внутренние, или основные.«Химическая» роль последних сводится к участию в формированииэффективного заряда, действующего на валентные электроны.
/>
9 ЭлектроотрицательностьИдея эффективного заряда лежит в основе оценки ряда полезныххарактеристик атомов, которыми мы будем широко пользоваться в этой книге. Срединих особенно важна электроотрицательность, которая представляет собойобобщенную характеристику элемента, связанную не с электронами на отдельныхорбиталях, а с внешними электронами вообще. Под электроотрицательностьюпонимают усредненную характеристику способности атома, находящегося всоединении, притягивать электрон. При этом пренебрегают разницей в состоянияхатомов в различных соединениях. В отличие от потенциала ионизации и сродства кэлектрону, электроотрицательность — не строго определенная физическая величина,а полезная условная характеристика.
В табл.2.2 приведены значения электроотрицательности элементовпо шкале Олреда — Рохова, основанной на вычислении силы кулоновскогопритяжения, действующей на внешний электрон. Отметим, что весь диапазонзначений ЭО элементов заключен между 0,9 для наименее электроотрицательныхметаллов 1-й и 2-й групп и 4,1 для наиболее электроотрицательного фтора.
www.ronl.ru
Строение атома
1. Ядро и электроны
Развитие естествознания на границе XIX-XX веков показало, что помимо химических превращений существует целый ряд процессов, в которых атомы выступают как сложные объекты, состоящие из положительно заряженной части — ядра и отрицательно заряженных электронов, суммарный заряд которых в точности компенсирует заряд ядра. В результате работ английского физика Дж. Дж. Томсона и американского физика Р.С. Малликена было установлено, что электрон имеет массу 9,1•1031 кг, или 1/1837 массы атома водорода, и заряд 1,6•10 19 Кл. Основная масса атома сосредоточена в ядре, которое занимает очень малую часть его объема: диаметр ядра порядка 1СГ14 м, он составляет лишь около 10 4 диаметра атома. Наглядно это соотношение размеров можно представить себе, если увеличить атом в 1011 раз: тогда ядро диаметром 1 мм разместится внутри атома диаметром 10 метров!
Позднее было показано, что атомные ядра состоят из положительно заряженных частиц — протонов и незаряженных частиц — нейтронов. Протон имеет заряд, равный заряду электрона, но со знаком плюс, его масса практически равна массе нейтрона. Отметим, что в химии принято выражать заряды ионов в единицах заряда электрона с соответствующим знаком, например Н+, Mg2+, СГ.
/>
Таким образом, число протонов в ядре определяет его заряд и порядковый номер, а сумма чисел протонов и нейтронов — округленную общую массу ядра в атомных единицах, или массовое число атома. Очевидно, что в электронейтральном атоме число протонов в атомном ядре равно числу электронов в электронной оболочке атома.
2. Атомный номер элемента. изотопы
Порядковый номер элемента принято называть его атомным номером и обозначать буквой Z. Атомный номер лежит в основе систематизации химических элементов и определяет их положение в периодической системе.
При определенном атомном номере, т.е. при определенном числе протонов, в ядре могут находиться разные числа нейтронов, поэтому могут существовать отличающиеся по массе разновидности атомов одного и того же элемента — изотопы.
Например, природный водород представляет собой смесь изотопов с массовыми числами 1 и 2, а.
/>
Клетка периодической таблицы
В ядре атома урана 92 протона, а в его электронной оболочке — 92 электрона
В периодической таблице, элементы расположены в порядке увеличения заряда ядра, а в отдельных клеточках таблицы принято приводить средневзвешенные атомные массы, поэтому они часто сильно отличаются от целочисленных.
/>
Рис. 2.3, а. Масс-спектрометр.
Газ вводится в вакуумированный прибор через трубку (i) и подвергается ионизации потоком электронов из электронной пушки (2). Заряженные пластины (3) и (4) разгоняют поток полученных положительных ионов, который проходит через щель в пластине (4) и попадает в поле магнита (5), отклоняющее отдельные ионы в соответствии с отношением заряд: масса. За второй щелью (в) расположен детектор (7), который регистрирует число частиц, прошедших через щель. Меняя напряженность магнитного поля, можно последовательно регистрировать относительное количество ионов с различной массой, получая масс-спектр.
В масс-спектрометре молекулы газа превращаются в ионы. Показана часть масс-спектра, соответствующая нонам ТЮ+ и ТЮ2. Отдельные полосы отвечают пяти изотопам титана с массой 46, 47, 48, 49, 50 значений масс атомов и разделение изотопов стало возможным в результате создания масс-спектрометрии — метода, основанного на воздействии магнитного поля на направленные пучки заряженных частиц.
3. Ядерная модель атома
Первая модель атома была предложена в начале XX века Э. Резерфордом, новозеландцем, работавшем в Англии. Она предполагала, что электроны движутся с большой скоростью по круговым орбитам вокруг ядра, подобно планетам по отношению к Солнцу. По представлениям классической электромагнитной теории в таком атоме электрон должен приближаться по спирали к ядру, непрерывно излучая энергию. Через короткое время электрон неизбежно должен упасть на ядро. Это очевидное несоответствие фактам было не единственным недостатком модели Резерфорда: плавное изменение энергии электронов в атоме не согласовывалось с появившимися наблюдениями над спектрами атомов. Одним из достижений второй половины XIX века была разработка атомного спектрального анализа — точного и чувствительного метода, сыгравшего важнейшую роль в открытии новых элементов и послужившего экспериментальной основой изучения строения атомов. Метод основан на испускании света свободными атомами, получающимися при сильном нагреваний вещества; при этом атомы переходят из основного состояния с минимальной энергией в возбужденные состояния с более высокими энергиями.
/>
Возвращаясь в основное состояние, атомы излучают свет. Оказалось, что атомные спектры излучения состоят из отдельных линий, отвечающих только определенным длинам волн.
Чтобы объяснить линейчатый характер атомных спектров и устойчивость атомов, знаменитый датский физик Нильс Бор предложил два постулата, выходящие за рамки классической физики:
Из бесконечного числа орбит, возможных с точки зрения классической механики, допустимы лишь определенные орбиты, по которым электрон движется не излучая.
Частота поглощаемого или испускаемого атомом излучения при переходе из одного разрешенного состояния в другое определяется разностью энергий этих состояний.
При этом Бор опирался на идею Макса Планка о квантовании энергии. Планк установил, что, хотя свет, испускаемый раскаленным телом, кажется сплошным, световая энергия поглощается или излучается отдельными порциями — квантами Е = hv, пропорциональными частоте светового электромагнитного колебания. Коэффициент пропорциональности h = 6,6252 • 10 34 Дж • с был назван постоянной Планка. Таким образом в науку было введено понятие кванта света, или некоторого светового пакета — фотона, отражающее не только волновую, но и корпускулярную природу света.
Модель Бора позволила рассчитать точные значения энергии атома водорода и любых одноэлектронных ионов, но оказалась непригодной для объяснения наблюдаемых энергетических характеристик атомов с двумя и более электронами; главный же ее недостаток заключался в том, что она не давала логического обоснования природы квантования и устойчивости не меняющихся во времени состояний атома. Однако, несмотря на эти недостатки, сами идеи Бора о квантовании и стационарных состояниях легли в основу современного описания строения атома с позиций квантовой механики.
4. Волновые свойства электрона
/>
Вскоре после 1920 г. был сделан следующий важный шаг в познании микромира: было установлено, что не только световые кванты, но и любые микрочастицы, в том числе электроны, обладают двойственной природой — частицы как таковой и волны.
Например, электрону при скорости 3 • 10е м/с отвечает длина волны
/>
В частности, удалось обнаружить дифракцию электронов на периодической решетке кристаллов и на молекулах газов. Частице с массой покоя т, движущейся со скоростью v, соответствует длина волны X, которая может быть найдена из уравнения де Бройля: сопоставимая с размерами атома. В то же время можно говорить и об импульсе и даже о массе движущегося фотона, хотя, конечно, его масса покоя равна нулю. Это обстоятельство существенным образом влияет на характер информации, которую дает спектроскопия. При столкновении фотона с электроном меняются импульс фотона и частота света, тем самым давая экспериментатору информацию об импульсе электрона. Однако, поскольку импульсы фотона и электрона сопоставимы, при этом меняется и импульс электрона, который надо определить. Ситуация в какой-то степени подобна попытке измерить скорость бегуна с помощью наблюдателя, который прыгает ему на плечи с разбега. Математически эти соображения описываются принципом неопределенности Гейзенберга, согласно которому возможность одновременного определения положения микрочастицы в пространстве и ее импульса ограничена постоянной Планка. Это, в частности, означает, что если мы хотим определить с большой точностью энергию электрона в атоме, то мы не сможем столь же точно определить его положение по отношению к ядру.
5. Квантово-механическая модель атома
Представления о стационарных состояниях атома и двойственной природе электрона, а также требования принципа неопределенности были использованы австрийским физиком Эрвином Шредингером, который в 1926 г. предложил модель, описывающую электрон в атоме как своего рода стоячую волну, причем вместо точного положения электрона в пространстве рассматривалась вероятность его пребывания в определенном месте.
Для того чтобы представить себе электрон в виде трехмерной стоячей волны, остановимся сначала на более простой одномерной модели стоячей волны, в качестве которой можно взять струну, закрепленную на концах. Струна способна издавать звуки только определенных частот, так как на ее длине может уложиться лишь целое число полуволн — это и есть квантование энергии колебаний струны. Для описания характера стоячих волн одномерной системы достаточно одного числа п, которое однозначно определяет длину волны и число узловых точек, в которых струна неподвижна, как и на закрепленных концах.
Моделью двумерной системы, испытывающей стационарные колебания, может служить круглая мембрана, закрепленная по периметру, например, в телефонной трубке. Здесь также возможны лишь определенные, квантованные колебания, для описания которых необходимы уже два числа.
Теперь очевидно, что для описания пространственного движения электрона в атоме как трехмерной стоячей волны необходимы и достаточны три числа, получившие название квантовых чисел. Квантово-механическое описание атома не требует никаких дополнительных постулатов, квантование энергии электрона естественным образом возникает из природы самого атома или так называемых граничных условий, которые сводятся к тому, что электрон не покидает атом и способен двигаться с конечной скоростью.
/>
В волновой механике электрон, как и любая микрочастица, описывается с помощью волновой функции. Его движение определяется уравнением, предложенным Шредингером, — знаменитым уравнением Шредингера. Решением этого уравнения является волновая функция \|/, которая соответствует разрешенной энергии электрона и описывает зависимость амплитуды стационарной волны, соответствующей электрону, от трех его пространственных координат. Квадрат волновой функции определяет вероятность пребывания электрона в некоторой пространственной области. Здесь мы как раз встречаемся со случаем точного знания энергии электрона и вероятностного описания его положения в пространстве. Во многих случаях удобно рассматривать электрон как размытое в пространстве облако отрицательного заряда. Плотность такого электронного облака в любой точке пропорциональна V) /2. Модель электронного облака наглядно описывает распределения электронной плотности в пространстве, хотя она физически несовершенна, так как одноименно заряженные части облака должны отталкиваться друг от друга, вызывая его рассеивание. На самом же деле электрон не отталкивается «сам от себя». Это обстоятельство несколько ограничивает аналогию между электроном и облаком, но не мешает нам говорить об электронных облаках во всех случаях, когда мы не интересуемся деталями, связанными с их потенциальной энергией. Представлением об электронных облаках мы будем широко пользоваться в этой книге.
6. Одноэлектронный атом. квантовые числа
В случае атома водорода и одноэлектронных ионов уравнение Шредингера может быть решено точно.
/>
Таким образом может быть получен набор волновых функций электрона или атомных орбиталей. Словом «орбиталь», в отличие от «орбиты», подчеркивается волновая природа электрона. Каждая АО зависит от трех пространственных координат электрона и характеризуется определенными значениями трех квантовых чисел п, I, т.д.ля описания одноэлектронного атома, в котором электрон принимает участие в единственном взаимодействии — с ядром, обладающим сферически-симметричным электростатическим полем, удобно использовать не декартову систему координат с переменными х, у, г, а сферическую с переменными.
Для наших целей нет необходимости заниматься математической стороной решения сложного дифференциального уравнения Шредингера, однако для дальнейших химических выводов важно, что в сферических координатах возможно разделение переменных, и само его решение \j/n приобретает более удобный для дальнейшего анализа вид:
/>
Здесь Rnt — радиальная составляющая волновой функции, зависящая от единственной переменной г — расстояния электрон — ядро и характеризуемая только двумя квантовыми числами п и I, а Ylm — угловая составляющая волновой функции, описывающая зависимость распределения электронной плотности от углов 9 и ф, т.е. форму и ориентацию АО, и характеризуемая квантовыми числами I и т. Рассмотрим последовательно физический смысл квантовых чисел п, I, ти характер различных АО.
--PAGE_BREAK--Квантовое число п называется главным квантовым числом. Величина п определяет номер электронного слоя: чем меньше п, тем прочнее электрон связан с ядром и тем ближе, в среднем, он находится к ядру. Главное квантовое число может принимать целочисленные положительные значения 1, 2, 3 и т.д. Набор АО с одинаковым п составляет слой. Основному состоянию атома водорода соответствует п = 1, при этом Е1 = — 1312 кДж. Такое количество энергии выделится при образовании одного моля атомов водорода из протонов и электронов, находящихся на бесконечном удалении друг от друга. В одноэлектронном атоме или в одноэлектронном ионе с зарядом ядра Z главное квантовое число однозначно определяет энергию электрона Еп:
Еп = — Rtf/a2
Здесь R — постоянный множитель, равный 1312 кДж, если энергия отнесена к 1 молю атомов и заряд Z измеряется в единицах заряда электрона.
Второе квантовое число I называется орбитальным, оно определяет возможные квантованные величины орбитального момента количества движения электрона. Число I может принимать целочисленные значения от 0 до п — 1.
/>
/>
По традиции, сложившейся в процессе изучения атомных спектров, значения I обычно обозначают буквами: s, р, d, f и далее по английскому алфавиту вместо 0, 1, 2, 3 и т.д. Для нас самое главное то, что при описании электрона в виде облака число I определяет его форму. Так, s-электроны имеют шарообразные, сферически симметричные облака, лишь в этом случае волновая функция \|/ не зависит от углов Э и ф; р-электроны {I = 1) имеют гантелеобразные облака, d-электроны образуют облака еще более сложной формы.
Вернемся к уравнению, в котором при RM стоят индексы nl. Как уже отмечалось, это значит, что первое и второе квантовые числа вместе полностью определяют характер радиальной части волновой функции. Рассмотрим, как меняется плотность электронного облака с расстоянием от ядра. На рис.2.10 по оси ординат отложена вероятность нахождения электрона в пространстве, заключенном между сферами с радиусами г и г + dr. Из рисунка видно, что все эти кривые, которые называются кривыми радиального распределения электронной плотности, проходят через один или несколько максимумов. Если максимумов несколько, то они разделены узловыми точками, в которых плотность равна нулю. Последний от ядра максимум — самый большой, главный. Число максимумов равно п — I, число узловых точек равно — 1. Таким образом, с учетом углового и радиального распределения облако, соответствующее ls-электрону, можно представить себе как диффузный шар переменной плотности, имеющей один максимум и постепенно сходящей на нет при удалении от центра. Облако 2"-электрона подобно сфере с двумя сгущениями плотности и т.д.
/>
Видно, что среднее расстояние электрона от ядра существенно различно для разных атомных орбиталей: оно растет с увеличением п, а при равных п — с уменьшением I. Чем меньше I при одинаковых п, тем дальше от ядра и тем ниже главный максимум и тем большая часть электронной плотности находится ближе к ядру за счет внутренних максимумов.
Третье квантовое число т — магнитное — определяет направление орбитального момента электрона, а с точки зрения модели электронного облака — ориентацию его в пространстве. Магнитное квантовое число может принимать целочисленные значения от — I до +1, что соответствует разрешенным квантовой механикой значениям проекции орбитального момента на заданное направление в пространстве. Следует отметить, что определенное направление может быть задано внешним полем — электрическим или магнитным. В отсутствие внешнего поля все разрешенные ориентации электронного облака равновероятны.
Поскольку облако s-электронов сферически симметрично, вопрос о его ориентации просто не имеет смысла. В случае р-электронов возможны три значения магнитного квантового числа — 1,0 и +1 и, соответственно, разрешены три взаимно перпендикулярные ориентации гантелеобразного облака. У d-электронов возможны пять значений т, у /электронов — семь.
Итак, три квантовых числа — главное, орбитальное и магнитное — позволяют задать атомную орбиталъ и достаточно подробно охарактеризовать одноэлектронный атом: мы точно знаем энергию электрона и можем качественно описать электронное облако — его форму, ориентацию в присутствии внешнего поля, число сгущений электронной плотности и число внутренних узловых поверхностей, где плотность сходит к нулю.
Однако тремя квантовыми числами не исчерпываются данные, необходимые для полного описания состояния электрона в атоме. Детальное исследование атомных спектров показало, что электрон обладает собственным моментом количества движения, который получил название спинового момента или спина. При вероятностном описании электрона как стоячей волны или как электронного облака спин не имеет классических аналогий — это просто свойство микрочастиц.
Спин электрона характеризуется спиновым квантовым числом ms, которое может иметь два значения +1/2 и — 1/2, т.е. спин может иметь два противоположных направления.
Таким образом, для полной характеристики состояния электрона в атоме необходимы четыре квантовых числа. Первые три из них определяют распределение его плотности в пространстве, а четвертое — его спин. Знание смысла и возможных значений квантовых чисел имеет исключительное значение для химика, поэтому ниже мы приводим краткую сводку важнейших сведений такого рода.
/>
Решение уравнения Шредингера для атома водорода позволяет, в принципе, рассчитать его основные характеристики с любой точностью, даже точнее, чем их дает эксперимент. Наиболее важными экспериментальными характеристиками любых атомов являются энергии отрыва и присоедниения электронов. Энергию отрыва электрона от атома, молекулы или иона не совсем правильно принято называть потенциалом ионизации. Потенциал ионизации обозначают обычно буквой / и измеряют в электрон-вольтах. Экспериментально измеренный потенциал ионизации водорода равен 13,6 эВ* или как раз 1312 кДж.
Другой важной энергетической характеристикой атома является сродство к электрону — энергия, которая выделяется при присоединении к нему дополнительного электрона. Сродство обычно обозначают буквой А с указанием частицы, например для водорода Ан = 73 кДж/моль. Знак «плюс» здесь говорит о том, что атом водорода приобретает второй электрон с выделением энергии, образуя ион Н.
7. Многоэлектронные атомы
При переходе от одноэлектронного атома к многоэлектронному в дополнение к взаимодействию электрон — ядро появляется новый тип взаимодействий — электронов друг с другом. Взаимодействие любого электрона с остальными зависит от состояния каждого электрона и не может быть точно учтено, если неизвестны волновые функции всех остальных электронов, которые, в свою очередь, не могут быть рассчитаны, если неизвестно взаимодействие данного электрона с остальными. Получается замкнутый круг, который принципиально не дает возможности точно решить уравнение Шредингера для многоэлектронного атома. Эта трудность, к счастью, может быть преодолена посредством приближенного решения, суть которого заключается в следующем. Каждый электрон рассматривается отдельно таким образом, как будто он находится в одноэлектронном атоме, заряд ядра которого частично экранирован усредненным сферически-симметричным полем остальных электронов. Отдельный электрон при этом испытывает только кулоновское притяжение центра, состоящего из ядра и остальных электронов, т.е. действие некоторого центрально-симметричного положительного эффективного заряда, меньшего, чем заряд ядра. При таком подходе для многоэлектронных атомов сохраняют смысл понятия атомной орбитали и четырех квантовых чисел, только истинный заряд ядра заменяется эффективным.
Рассмотрим для примера с этой точки зрения атом гелия в основном состоянии. Если бы в нем совсем не было межэлектронного взаимодействия, то оба электрона находились бы на орбитали с п = 1 в поле заряда Z = +2 и по формуле имели бы энергию Е = = — 13,6 • 4 = — 54,4 эВ, равную экспериментально определенному потенциалу ионизации одноэлектронного иона Не+. Другой крайний вариант — идеальное экранирование заряда ядра одним электроном по отношению к другому, который тогда испытывал бы действие заряда ядра, уменьшенного ровно на единицу, т.е. ядра с Z = +1. Тогда мы получаем точно такую же ситуацию, как в атоме водорода, и потенциал ионизации должен быть равен 13,6 эВ.
Для реального атома гелия истина лежит где-то между этими крайностями, действительно, его потенциал ионизации составляет 24,6 эВ. По формуле можно подсчитать заряд Z*, который должен испытывать на себе электрон с этой энергией в одноэлектронном атоме: Z* = ^24,6/13,6 = 1,34. Это и есть тот самый эффективный заряд, который действует на каждый электрон в атоме гелия.
В общем случае эффективный заряд ядра Z* — это положительный заряд, который «чувствует» электрон в многоэлектронном атоме на заданной АО. Пользуясь эффективными зарядами ядер, мы можем оценивать энергию атомных орбиталей в многоэлектронном атоме.
8. Электронная конфигурация атома
Распределение электронов по АО называют электронной конфигурацией атома. Порядок заполнения АО электронами определяется двумя важнейшими принципами.
Согласно принципу минимума энергии наиболее устойчивому состоянию атома отвечает размещение электронов на орбиталях с наименьшей энергией, т.е. обеспечивается минимум потенциальной энергии системы, состоящей из электронов с ядром.
Согласно принципу Паули любые два электрона в атоме во избежание бесконечно большого взаимного отталкивания должны отличаться друг от друга хотя бы одним квантовым числом. Так, если два электрона находятся на одной АО, то они должны иметь противоположные спины.
В соответствии с указанными принципами атом гелия в основном состоянии имеет электронную конфигурацию Is2, при которой оба электрона находятся на ls-орбитали и имеют противоположные спины. Суммарный спин атома равен нулю. Схематически эту ситуацию можно изобразить в виде ячейки с двумя стрелками:
/>
/>
Атом лития, следующий за гелием в периодической системе, содержит три электрона. По принципу минимума энергии два из них расположатся, как и в атоме гелия, на ls-орбитали. Третий электрон в соответствии с принципом Паули должен располагаться на АО с п = 2. Однако таких возможностей две — 2s — и 2р-орбитали, и электрон будет иметь меньшую энергию на той из них, где он будет испытывать действие более высокого эффективного заряда. Рассмотрим с этой точки зрения кривые распределения электронной плотности в атоме лития в зависимости от расстояния от ядра. Из этих кривых хорошо видно, что замкнутый слой Is расположен гораздо ближе к ядру, чем основная плотность 2s — или 2р-электрона. Однако внутренний максимум 2в-электрона практически полностью проникает в ls-электронную плотность в близкой к ядру области, и определенная часть его плотности «чувствует» на себе почти полный заряд ядра Z=+3. Единственный максимум 2р-электрона далек от ядра, а в области сосредоточения ls-электронов находится лишь незначительная его часть. Следовательно, в атоме лития электрон на 2в-орбитали испытывает на себе действие несколько более высокого эффективного заряда, он несколько хуже экранирован от ядра ls-электронами, чем электрон на 2р-орбитали, и прочнее связан с ядром. Соответственно, в основном состоянии атом лития будет иметь электронную конфигурацию ls22s1, а конфигурация ls22p1 отвечает возбужденному состоянию.
Рассматривая одноэлектронный атом, мы пришли к заключению, что при одинаковых п за счет внутренних максимумов ближе к ядру находится большая часть плотности того электрона, который расположен на орбитали с меньшим значением I. Это в основном и определяет тот важнейший для всей химии факт, что в одном слое s-электроны испытывают на себе самый большой эффективный заряд, р-электроны — меньший, d-электроны — еще меньше и т.д.
Другими словами, res-электроны наиболее прочно связаны с ядром и находятся на наиболее низком энергетическом уровне, далее следуют яр-электроны, а затем — red-электроны. Таким образом, энергия электронов в многоэлектронных атомах зависит не только от п, но и от I; при равных п она возрастает в порядке увеличения I. Порядок заполнения АО для любого атома описывается эмпирическими правилами Клечковского:
/>
АО заполняются в порядке увеличения суммы п + I. При одинаковых значениях суммы п + I АО заполняются в порядке увеличения п.
Отметим, что одному и тому же Сочетанию значений п и I могут отвечать несколько атомных орбиталей, различающихся значениями магнитного квантового числа т. Например, 2р-электрон может находиться в любой из трех ячеек с т, равным — 1, 0 или +1:
/>
Во всех этих трех случаях электрон будет иметь одну и ту же энергию, но разные волновые функции. В таких случаях говорят, что состояние электрона вырождено.
В данном случае оно трижды вырождено, т.е. три состояния имеют одинаковую энергию. Если в атоме появляется второй р-электрон, го межэлектронное отталкивание будет минимальным, когда оба электрона находятся в разных ячейках и имеют одинаковые спины.
/>
В общем случае при определении электронной конфигурации основного состояния атома удобно пользоваться правилом Хунда: минимальной энергии отвечает максимальный суммарный спин.
Например, основному состоянию атома азота отвечает электронная конфигурация:
/>
Указанные принципы позволяют легко определить электронную конфигурацию любого атома; для основных состояний электронные конфигурации атомов приведены в табл.2.1
Энергия электронов, находящихся на различных орбиталях атома, которую для краткости принято называть энергией атомных орбиталей, показана на рис. в зависимости от атомного номера. При Z = 1 число энергетических уровней соответствует числу значений п. При Z > 1 уровни расщепляются на подуровни с разными значениями I, причем энергия подуровней увеличивается в порядке возрастания I. Хотя ход отдельных кривых довольно сложен, но в целом он разумно объясняется в терминах эффективных зарядов таким же образом, как и различие 2s — и 2р — подуровней.
Электронные конфигурации атомов в основном состоянии
/>
Возвращаясь к литию, отметим, что этот элемент в какой-то степени аналогичен водороду из-за того, что его атом содержит один 2в-электрон, и литий легко образует ион Li+. Однако первый потенциал ионизации лития /i = 5,39 эВ существенно меньше, чем у водорода, здесь уже сказывается рост главного квантового числа). Поэтому литий легко реагирует с большинством неметаллов, хорошо растворяется в кислотах, теряя электрон и переходя в ион Li*, т.е. проявляет свойства типичного активного металла.
Второй потенциал ионизации лития I2 = 75,7 эВ очень велик, так как его ls-электроны расположены гораздо ближе к ядру, чем 2в-электрон. На этом примере хорошо видно, что электроны внутренних замкнутых слоев не распространяются на периферию атома и настолько прочно связаны с ядром, что, как правило, непосредственно не затрагиваются в химических процессах. В химии оказывается очень полезным разделение электронов на внешние, или валентные, и внутренние, или основные. «Химическая» роль последних сводится к участию в формировании эффективного заряда, действующего на валентные электроны.
/>
9 Электроотрицательность
Идея эффективного заряда лежит в основе оценки ряда полезных характеристик атомов, которыми мы будем широко пользоваться в этой книге. Среди них особенно важна электроотрицательность, которая представляет собой обобщенную характеристику элемента, связанную не с электронами на отдельных орбиталях, а с внешними электронами вообще. Под электроотрицательностью понимают усредненную характеристику способности атома, находящегося в соединении, притягивать электрон. При этом пренебрегают разницей в состояниях атомов в различных соединениях. В отличие от потенциала ионизации и сродства к электрону, электроотрицательность — не строго определенная физическая величина, а полезная условная характеристика.
В табл.2.2 приведены значения электроотрицательности элементов по шкале Олреда — Рохова, основанной на вычислении силы кулоновского притяжения, действующей на внешний электрон. Отметим, что весь диапазон значений ЭО элементов заключен между 0,9 для наименее электроотрицательных металлов 1-й и 2-й групп и 4,1 для наиболее электроотрицательного фтора.
www.ronl.ru
Развитие естествознания на границе XIX-XX веков показало, что помимо химических превращенийсуществует целый ряд процессов, в которых атомы выступают как сложные объекты,состоящие из положительно заряженной части — ядра и отрицательно заряженныхэлектронов, суммарный заряд которых в точности компенсирует заряд ядра. Врезультате работ английского физика Дж. Дж. Томсона и американского физика Р.С.Малликена было установлено, что электрон имеет массу 9,1•1031 кг,или 1/1837 массы атома водорода, и заряд 1,6•10 19 Кл. Основнаямасса атома сосредоточена в ядре, которое занимает очень малую часть его объема:диаметр ядра порядка 1СГ14 м, он составляет лишь около 10 4диаметра атома. Наглядно это соотношение размеров можно представить себе, еслиувеличить атом в 1011 раз: тогда ядро диаметром 1 мм разместитсявнутри атома диаметром 10 метров!
Позднее было показано, что атомные ядра состоят изположительно заряженных частиц — протонов и незаряженных частиц — нейтронов. Протонимеет заряд, равный заряду электрона, но со знаком плюс, его масса практическиравна массе нейтрона. Отметим, что в химии принято выражать заряды ионов вединицах заряда электрона с соответствующим знаком, например Н+, Mg2+, СГ.
/>
Таким образом, число протонов в ядре определяет его заряд ипорядковый номер, а сумма чисел протонов и нейтронов — округленную общую массуядра в атомных единицах, или массовое число атома. Очевидно, что вэлектронейтральном атоме число протонов в атомном ядре равно числу электронов вэлектронной оболочке атома.
2. Атомный номер элемента. изотопыПорядковый номер элемента принято называть его атомнымномером и обозначать буквой Z. Атомный номер лежит воснове систематизации химических элементов и определяет их положение впериодической системе.
При определенном атомном номере, т.е. при определенном числепротонов, в ядре могут находиться разные числа нейтронов, поэтому могутсуществовать отличающиеся по массе разновидности атомов одного и того жеэлемента — изотопы.
Например, природный водород представляет собой смесьизотопов с массовыми числами 1 и 2, а.
/>
Клетка периодической таблицы
В ядре атома урана 92 протона, а в его электронной оболочке- 92 электрона
В периодической таблице, элементы расположены в порядкеувеличения заряда ядра, а в отдельных клеточках таблицы принято приводитьсредневзвешенные атомные массы, поэтому они часто сильно отличаются отцелочисленных.
/>
Рис. 2.3, а. Масс-спектрометр.
Газ вводится в вакуумированный прибор через трубку (i) и подвергается ионизации потоком электронов из электроннойпушки (2). Заряженные пластины (3) и (4) разгоняют поток полученныхположительных ионов, который проходит через щель в пластине (4) и попадает вполе магнита (5), отклоняющее отдельные ионы в соответствии с отношением заряд:масса. За второй щелью (в) расположен детектор (7), который регистрирует числочастиц, прошедших через щель. Меняя напряженность магнитного поля, можнопоследовательно регистрировать относительное количество ионов с различноймассой, получая масс-спектр.
В масс-спектрометре молекулы газа превращаются в ионы. Показаначасть масс-спектра, соответствующая нонам ТЮ+ и ТЮ2. Отдельныеполосы отвечают пяти изотопам титана с массой 46, 47, 48, 49, 50 значений массатомов и разделение изотопов стало возможным в результате созданиямасс-спектрометрии — метода, основанного на воздействии магнитного поля нанаправленные пучки заряженных частиц.
3. Ядерная модель атомаПервая модель атома была предложена в начале XX века Э. Резерфордом,новозеландцем, работавшем в Англии. Она предполагала, что электроны движутся сбольшой скоростью по круговым орбитам вокруг ядра, подобно планетам по отношениюк Солнцу. По представлениям классической электромагнитной теории в таком атомеэлектрон должен приближаться по спирали к ядру, непрерывно излучая энергию. Черезкороткое время электрон неизбежно должен упасть на ядро. Это очевидноенесоответствие фактам было не единственным недостатком модели Резерфорда: плавноеизменение энергии электронов в атоме не согласовывалось с появившимисянаблюдениями над спектрами атомов. Одним из достижений второй половины XIX векабыла разработка атомного спектрального анализа — точного и чувствительногометода, сыгравшего важнейшую роль в открытии новых элементов и послужившегоэкспериментальной основой изучения строения атомов. Метод основан на испусканиисвета свободными атомами, получающимися при сильном нагреваний вещества; приэтом атомы переходят из основного состояния с минимальной энергией ввозбужденные состояния с более высокими энергиями.
/>
Возвращаясь в основное состояние, атомы излучают свет. Оказалось,что атомные спектры излучения состоят из отдельных линий, отвечающих толькоопределенным длинам волн.
Чтобы объяснить линейчатый характер атомных спектров иустойчивость атомов, знаменитый датский физик Нильс Бор предложил двапостулата, выходящие за рамки классической физики:
Из бесконечного числа орбит, возможных с точки зренияклассической механики, допустимы лишь определенные орбиты, по которым электрондвижется не излучая.
Частота поглощаемого или испускаемого атомом излучения припереходе из одного разрешенного состояния в другое определяется разностьюэнергий этих состояний.
При этом Бор опирался на идею Макса Планка о квантованииэнергии. Планк установил, что, хотя свет, испускаемый раскаленным телом,кажется сплошным, световая энергия поглощается или излучается отдельнымипорциями — квантами Е = hv, пропорциональными частоте световогоэлектромагнитного колебания. Коэффициент пропорциональности h= 6,6252 • 10 34 Дж • с был назван постоянной Планка. Таким образомв науку было введено понятие кванта света, или некоторого светового пакета — фотона,отражающее не только волновую, но и корпускулярную природу света.
Модель Бора позволила рассчитать точные значения энергииатома водорода и любых одноэлектронных ионов, но оказалась непригодной для объяснениянаблюдаемых энергетических характеристик атомов с двумя и более электронами; главныйже ее недостаток заключался в том, что она не давала логического обоснованияприроды квантования и устойчивости не меняющихся во времени состояний атома. Однако,несмотря на эти недостатки, сами идеи Бора о квантовании и стационарныхсостояниях легли в основу современного описания строения атома с позицийквантовой механики.
4. Волновые свойства электрона/>
Вскоре после 1920 г. был сделан следующий важный шаг впознании микромира: было установлено, что не только световые кванты, но и любыемикрочастицы, в том числе электроны, обладают двойственной природой — частицыкак таковой и волны.
Например, электрону при скорости3 • 10е м/с отвечает длина волны
/>
В частности, удалось обнаружить дифракцию электронов напериодической решетке кристаллов и на молекулах газов. Частице с массой покоят, движущейся со скоростью v, соответствует длина волныX, которая может быть найдена из уравнения де Бройля: сопоставимая с размерамиатома. В то же время можно говорить и об импульсе и даже о массе движущегосяфотона, хотя, конечно, его масса покоя равна нулю. Это обстоятельствосущественным образом влияет на характер информации, которую дает спектроскопия.При столкновении фотона с электроном меняются импульс фотона и частота света,тем самым давая экспериментатору информацию об импульсе электрона. Однако,поскольку импульсы фотона и электрона сопоставимы, при этом меняется и импульсэлектрона, который надо определить. Ситуация в какой-то степени подобна попыткеизмерить скорость бегуна с помощью наблюдателя, который прыгает ему на плечи сразбега. Математически эти соображения описываются принципом неопределенностиГейзенберга, согласно которому возможность одновременного определения положениямикрочастицы в пространстве и ее импульса ограничена постоянной Планка. Это, вчастности, означает, что если мы хотим определить с большой точностью энергиюэлектрона в атоме, то мы не сможем столь же точно определить его положение поотношению к ядру.
5. Квантово-механическая модель атомаПредставления о стационарных состояниях атома и двойственнойприроде электрона, а также требования принципа неопределенности былииспользованы австрийским физиком Эрвином Шредингером, который в 1926 г. предложилмодель, описывающую электрон в атоме как своего рода стоячую волну, причемвместо точного положения электрона в пространстве рассматривалась вероятностьего пребывания в определенном месте.
Для того чтобы представить себе электрон в виде трехмернойстоячей волны, остановимся сначала на более простой одномерной модели стоячейволны, в качестве которой можно взять струну, закрепленную на концах. Струнаспособна издавать звуки только определенных частот, так как на ее длине можетуложиться лишь целое число полуволн — это и есть квантование энергии колебанийструны. Для описания характера стоячих волн одномерной системы достаточноодного числа п, которое однозначно определяет длину волны и число узловыхточек, в которых струна неподвижна, как и на закрепленных концах.
Моделью двумерной системы, испытывающей стационарныеколебания, может служить круглая мембрана, закрепленная по периметру, например,в телефонной трубке. Здесь также возможны лишь определенные, квантованныеколебания, для описания которых необходимы уже два числа.
Теперь очевидно, что для описания пространственного движенияэлектрона в атоме как трехмерной стоячей волны необходимы и достаточны тричисла, получившие название квантовых чисел. Квантово-механическое описаниеатома не требует никаких дополнительных постулатов, квантование энергии электронаестественным образом возникает из природы самого атома или так называемыхграничных условий, которые сводятся к тому, что электрон не покидает атом испособен двигаться с конечной скоростью.
/>
В волновой механике электрон, как и любая микрочастица,описывается с помощью волновой функции. Его движение определяется уравнением,предложенным Шредингером, — знаменитым уравнением Шредингера. Решением этогоуравнения является волновая функция \|/, которая соответствует разрешеннойэнергии электрона и описывает зависимость амплитуды стационарной волны,соответствующей электрону, от трех его пространственных координат. Квадратволновой функции определяет вероятность пребывания электрона в некоторойпространственной области. Здесь мы как раз встречаемся со случаем точногознания энергии электрона и вероятностного описания его положения в пространстве.Во многих случаях удобно рассматривать электрон как размытое в пространствеоблако отрицательного заряда. Плотность такого электронного облака в любойточке пропорциональна V) /2. Модель электронного облака наглядноописывает распределения электронной плотности в пространстве, хотя онафизически несовершенна, так как одноименно заряженные части облака должныотталкиваться друг от друга, вызывая его рассеивание. На самом же деле электронне отталкивается «сам от себя». Это обстоятельство несколькоограничивает аналогию между электроном и облаком, но не мешает нам говорить обэлектронных облаках во всех случаях, когда мы не интересуемся деталями,связанными с их потенциальной энергией. Представлением об электронных облакахмы будем широко пользоваться в этой книге.
6. Одноэлектронный атом. квантовые числаВ случае атома водорода и одноэлектронных ионов уравнениеШредингера может быть решено точно.
/>
Таким образом может быть получен набор волновых функцийэлектрона или атомных орбиталей. Словом «орбиталь», в отличие от«орбиты», подчеркивается волновая природа электрона. Каждая АОзависит от трех пространственных координат электрона и характеризуетсяопределенными значениями трех квантовых чисел п, I, т.д.ля описанияодноэлектронного атома, в котором электрон принимает участие в единственномвзаимодействии — с ядром, обладающим сферически-симметричным электростатическимполем, удобно использовать не декартову систему координат с переменными х, у,г, а сферическую с переменными.
Для наших целей нет необходимости заниматься математическойстороной решения сложного дифференциального уравнения Шредингера, однако длядальнейших химических выводов важно, что в сферических координатах возможноразделение переменных, и само его решение \j/n приобретает более удобный для дальнейшего анализа вид:
/>
Здесь Rnt — радиальнаясоставляющая волновой функции, зависящая от единственной переменной г — расстоянияэлектрон — ядро и характеризуемая только двумя квантовыми числами п и I, а Ylm — угловаясоставляющая волновой функции, описывающая зависимость распределенияэлектронной плотности от углов 9 и ф, т.е. форму и ориентацию АО, ихарактеризуемая квантовыми числами I и т. Рассмотрим последовательно физическийсмысл квантовых чисел п, I, ти характер различных АО.
Квантовое число п называется главным квантовым числом. Величинап определяет номер электронного слоя: чем меньше п, тем прочнее электрон связанс ядром и тем ближе, в среднем, он находится к ядру. Главное квантовое числоможет принимать целочисленные положительные значения 1, 2, 3 и т.д. Набор АО содинаковым п составляет слой. Основному состоянию атома водорода соответствуетп = 1, при этом Е1 = — 1312 кДж. Такое количество энергии выделится приобразовании одного моля атомов водорода из протонов и электронов, находящихсяна бесконечном удалении друг от друга. В одноэлектронном атоме или водноэлектронном ионе с зарядом ядра Z главное квантовоечисло однозначно определяет энергию электрона Еп:
Еп = — Rtf/a2
Здесь R — постоянный множитель,равный 1312 кДж, если энергия отнесена к 1 молю атомов и заряд Z измеряется в единицах заряда электрона.
Второе квантовое число I называется орбитальным, оноопределяет возможные квантованные величины орбитального момента количествадвижения электрона. Число I может принимать целочисленные значения от 0 до п — 1.
/>
/>
По традиции, сложившейся в процессе изучения атомныхспектров, значения I обычно обозначают буквами: s, р, d, f и далее по английскому алфавитувместо 0, 1, 2, 3 и т.д. Для нас самое главное то, что при описании электрона ввиде облака число I определяет его форму. Так, s-электроныимеют шарообразные, сферически симметричные облака, лишь в этом случае волноваяфункция \|/ не зависит от углов Э и ф; р-электроны {I =1) имеют гантелеобразные облака, d-электроны образуютоблака еще более сложной формы.
Вернемся к уравнению, в котором при RM стоят индексы nl. Как ужеотмечалось, это значит, что первое и второе квантовые числа вместе полностьюопределяют характер радиальной части волновой функции. Рассмотрим, как меняетсяплотность электронного облака с расстоянием от ядра. На рис.2.10 по оси ординатотложена вероятность нахождения электрона в пространстве, заключенном междусферами с радиусами г и г + dr. Из рисунка видно, чтовсе эти кривые, которые называются кривыми радиального распределенияэлектронной плотности, проходят через один или несколько максимумов. Еслимаксимумов несколько, то они разделены узловыми точками, в которых плотностьравна нулю. Последний от ядра максимум — самый большой, главный. Числомаксимумов равно п — I, число узловых точек равно — 1. Таким образом, с учетомуглового и радиального распределения облако, соответствующее ls-электрону,можно представить себе как диффузный шар переменной плотности, имеющей одинмаксимум и постепенно сходящей на нет при удалении от центра. Облако 2"-электронаподобно сфере с двумя сгущениями плотности и т.д.
/>
Видно, что среднее расстояние электрона от ядра существенноразлично для разных атомных орбиталей: оно растет с увеличением п, а при равныхп — с уменьшением I. Чем меньше I при одинаковых п, тем дальше от ядра и темниже главный максимум и тем большая часть электронной плотности находится ближек ядру за счет внутренних максимумов.
Третье квантовое число т — магнитное — определяетнаправление орбитального момента электрона, а с точки зрения моделиэлектронного облака — ориентацию его в пространстве. Магнитное квантовое числоможет принимать целочисленные значения от — I до +1, что соответствует разрешеннымквантовой механикой значениям проекции орбитального момента на заданноенаправление в пространстве. Следует отметить, что определенное направлениеможет быть задано внешним полем — электрическим или магнитным. В отсутствиевнешнего поля все разрешенные ориентации электронного облака равновероятны.
Поскольку облако s-электроновсферически симметрично, вопрос о его ориентации просто не имеет смысла. Вслучае р-электронов возможны три значения магнитного квантового числа — 1,0 и+1 и, соответственно, разрешены три взаимно перпендикулярные ориентациигантелеобразного облака. У d-электронов возможны пятьзначений т, у /электронов — семь.
Итак, три квантовых числа — главное, орбитальное и магнитное- позволяют задать атомную орбиталъ и достаточно подробно охарактеризовать одноэлектронныйатом: мы точно знаем энергию электрона и можем качественно описать электронноеоблако — его форму, ориентацию в присутствии внешнего поля, число сгущенийэлектронной плотности и число внутренних узловых поверхностей, где плотностьсходит к нулю.
Однако тремя квантовыми числами не исчерпываются данные,необходимые для полного описания состояния электрона в атоме. Детальноеисследование атомных спектров показало, что электрон обладает собственныммоментом количества движения, который получил название спинового момента илиспина. При вероятностном описании электрона как стоячей волны или какэлектронного облака спин не имеет классических аналогий — это просто свойствомикрочастиц.
Спин электрона характеризуется спиновым квантовым числом ms, которое может иметь два значения +1/2 и — 1/2,т.е. спин может иметь два противоположных направления.
Таким образом, для полной характеристики состояния электронав атоме необходимы четыре квантовых числа. Первые три из них определяютраспределение его плотности в пространстве, а четвертое — его спин. Знаниесмысла и возможных значений квантовых чисел имеет исключительное значение дляхимика, поэтому ниже мы приводим краткую сводку важнейших сведений такого рода.
/>
Решение уравнения Шредингера для атома водорода позволяет, впринципе, рассчитать его основные характеристики с любой точностью, дажеточнее, чем их дает эксперимент. Наиболее важными экспериментальнымихарактеристиками любых атомов являются энергии отрыва и присоедниенияэлектронов. Энергию отрыва электрона от атома, молекулы или иона не совсемправильно принято называть потенциалом ионизации. Потенциал ионизацииобозначают обычно буквой / и измеряют в электрон-вольтах. Экспериментальноизмеренный потенциал ионизации водорода равен 13,6 эВ* или как раз 1312 кДж.
Другой важной энергетической характеристикой атома являетсясродство к электрону — энергия, которая выделяется при присоединении к немудополнительного электрона. Сродство обычно обозначают буквой А с указаниемчастицы, например для водорода Ан = 73 кДж/моль. Знак «плюс»здесь говорит о том, что атом водорода приобретает второй электрон с выделениемэнергии, образуя ион Н.
7. Многоэлектронные атомыПри переходе от одноэлектронного атома к многоэлектронному вдополнение к взаимодействию электрон — ядро появляется новый тип взаимодействий- электронов друг с другом. Взаимодействие любого электрона с остальнымизависит от состояния каждого электрона и не может быть точно учтено, еслинеизвестны волновые функции всех остальных электронов, которые, в свою очередь,не могут быть рассчитаны, если неизвестно взаимодействие данного электрона состальными. Получается замкнутый круг, который принципиально не дает возможноститочно решить уравнение Шредингера для многоэлектронного атома. Эта трудность, ксчастью, может быть преодолена посредством приближенного решения, суть которогозаключается в следующем. Каждый электрон рассматривается отдельно такимобразом, как будто он находится в одноэлектронном атоме, заряд ядра которогочастично экранирован усредненным сферически-симметричным полем остальныхэлектронов. Отдельный электрон при этом испытывает только кулоновскоепритяжение центра, состоящего из ядра и остальных электронов, т.е. действиенекоторого центрально-симметричного положительного эффективного заряда,меньшего, чем заряд ядра. При таком подходе для многоэлектронных атомовсохраняют смысл понятия атомной орбитали и четырех квантовых чисел, толькоистинный заряд ядра заменяется эффективным.
Рассмотрим для примера с этой точки зрения атом гелия восновном состоянии. Если бы в нем совсем не было межэлектронноговзаимодействия, то оба электрона находились бы на орбитали с п = 1 в полезаряда Z = +2 и по формуле имели бы энергию Е = = — 13,6• 4 = — 54,4 эВ, равную экспериментально определенному потенциалу ионизацииодноэлектронного иона Не+. Другой крайний вариант — идеальноеэкранирование заряда ядра одним электроном по отношению к другому, которыйтогда испытывал бы действие заряда ядра, уменьшенного ровно на единицу, т.е. ядрас Z = +1. Тогда мы получаем точно такую же ситуацию,как в атоме водорода, и потенциал ионизации должен быть равен 13,6 эВ.
Для реального атома гелия истина лежит где-то между этимикрайностями, действительно, его потенциал ионизации составляет 24,6 эВ. Поформуле можно подсчитать заряд Z*, который должениспытывать на себе электрон с этой энергией в одноэлектронном атоме: Z* = ^24,6/13,6 = 1,34. Это и есть тот самый эффективныйзаряд, который действует на каждый электрон в атоме гелия.
В общем случае эффективный заряд ядра Z*- это положительный заряд, который «чувствует» электрон вмногоэлектронном атоме на заданной АО. Пользуясь эффективными зарядами ядер, мыможем оценивать энергию атомных орбиталей в многоэлектронном атоме.
8. Электронная конфигурация атомаРаспределение электронов по АО называют электроннойконфигурацией атома. Порядок заполнения АО электронами определяется двумяважнейшими принципами.
Согласно принципу минимума энергии наиболее устойчивому состояниюатома отвечает размещение электронов на орбиталях с наименьшей энергией, т.е. обеспечиваетсяминимум потенциальной энергии системы, состоящей из электронов с ядром.
Согласно принципу Паули любые два электрона в атоме воизбежание бесконечно большого взаимного отталкивания должны отличаться друг отдруга хотя бы одним квантовым числом. Так, если два электрона находятся наодной АО, то они должны иметь противоположные спины.
В соответствии с указанными принципами атом гелия в основномсостоянии имеет электронную конфигурацию Is2,при которой оба электрона находятся на ls-орбитали иимеют противоположные спины. Суммарный спин атома равен нулю. Схематически этуситуацию можно изобразить в виде ячейки с двумя стрелками:
/>
/>
Атом лития, следующий за гелием в периодической системе,содержит три электрона. По принципу минимума энергии два из них расположатся,как и в атоме гелия, на ls-орбитали. Третий электрон всоответствии с принципом Паули должен располагаться на АО с п = 2. Однако такихвозможностей две — 2s — и 2р-орбитали, и электрон будетиметь меньшую энергию на той из них, где он будет испытывать действие болеевысокого эффективного заряда. Рассмотрим с этой точки зрения кривые распределенияэлектронной плотности в атоме лития в зависимости от расстояния от ядра. Изэтих кривых хорошо видно, что замкнутый слой Isрасположен гораздо ближе к ядру, чем основная плотность 2s- или 2р-электрона. Однако внутренний максимум 2в-электрона практическиполностью проникает в ls-электронную плотность вблизкой к ядру области, и определенная часть его плотности «чувствует»на себе почти полный заряд ядра Z=+3. Единственныймаксимум 2р-электрона далек от ядра, а в области сосредоточения ls-электронов находится лишь незначительная его часть. Следовательно,в атоме лития электрон на 2в-орбитали испытывает на себе действие несколькоболее высокого эффективного заряда, он несколько хуже экранирован от ядра ls-электронами, чем электрон на 2р-орбитали, и прочнее связанс ядром. Соответственно, в основном состоянии атом лития будет иметьэлектронную конфигурацию ls22s1, а конфигурация ls22p1 отвечает возбужденному состоянию.
Рассматривая одноэлектронный атом, мы пришли к заключению,что при одинаковых п за счет внутренних максимумов ближе к ядру находитсябольшая часть плотности того электрона, который расположен на орбитали сменьшим значением I. Это в основном и определяет тот важнейший для всей химиифакт, что в одном слое s-электроны испытывают на себесамый большой эффективный заряд, р-электроны — меньший, d-электроны- еще меньше и т.д.
Другими словами, res-электронынаиболее прочно связаны с ядром и находятся на наиболее низком энергетическомуровне, далее следуют яр-электроны, а затем — red-электроны.Таким образом, энергия электронов в многоэлектронных атомах зависит не толькоот п, но и от I; при равных п она возрастает в порядке увеличения I. Порядокзаполнения АО для любого атома описывается эмпирическими правилами Клечковского:
/>
АО заполняются в порядке увеличения суммы п + I. Приодинаковых значениях суммы п + I АО заполняются в порядке увеличения п.
Отметим, что одному и тому же Сочетанию значений п и I могутотвечать несколько атомных орбиталей, различающихся значениями магнитногоквантового числа т. Например, 2р-электрон может находиться в любой из трехячеек с т, равным — 1, 0 или +1:
/>
Во всех этих трех случаях электрон будет иметь одну и ту жеэнергию, но разные волновые функции. В таких случаях говорят, что состояниеэлектрона вырождено.
В данном случае оно трижды вырождено, т.е. три состояния имеютодинаковую энергию. Если в атоме появляется второй р-электрон, гомежэлектронное отталкивание будет минимальным, когда оба электрона находятся вразных ячейках и имеют одинаковые спины.
/>
В общем случае при определении электронной конфигурации основногосостояния атома удобно пользоваться правилом Хунда: минимальной энергииотвечает максимальный суммарный спин.
Например, основному состоянию атома азота отвечаетэлектронная конфигурация:
/>
Указанные принципы позволяют легко определить электроннуюконфигурацию любого атома; для основных состояний электронные конфигурацииатомов приведены в табл.2.1
Энергия электронов, находящихся на различных орбиталяхатома, которую для краткости принято называть энергией атомных орбиталей,показана на рис. в зависимости от атомного номера. При Z= 1 число энергетических уровней соответствует числу значений п. При Z > 1 уровни расщепляются на подуровни с разнымизначениями I, причем энергия подуровней увеличивается в порядке возрастания I. Хотяход отдельных кривых довольно сложен, но в целом он разумно объясняется втерминах эффективных зарядов таким же образом, как и различие 2s — и 2р — подуровней.
Электронные конфигурации атомов восновном состоянии
/>
Возвращаясь к литию, отметим, что этот элемент в какой-тостепени аналогичен водороду из-за того, что его атом содержит один 2в-электрон,и литий легко образует ион Li+. Однакопервый потенциал ионизации лития /i = 5,39 эВсущественно меньше, чем у водорода, здесь уже сказывается рост главногоквантового числа). Поэтому литий легко реагирует с большинством неметаллов,хорошо растворяется в кислотах, теряя электрон и переходя в ион Li*, т.е. проявляет свойства типичного активного металла.
Второй потенциал ионизации лития I2= 75,7 эВ очень велик, так как его ls-электронырасположены гораздо ближе к ядру, чем 2в-электрон. На этом примере хорошо видно,что электроны внутренних замкнутых слоев не распространяются на периферию атомаи настолько прочно связаны с ядром, что, как правило, непосредственно незатрагиваются в химических процессах. В химии оказывается очень полезнымразделение электронов на внешние, или валентные, и внутренние, или основные.«Химическая» роль последних сводится к участию в формированииэффективного заряда, действующего на валентные электроны.
/>
9 ЭлектроотрицательностьИдея эффективного заряда лежит в основе оценки ряда полезныххарактеристик атомов, которыми мы будем широко пользоваться в этой книге. Срединих особенно важна электроотрицательность, которая представляет собойобобщенную характеристику элемента, связанную не с электронами на отдельныхорбиталях, а с внешними электронами вообще. Под электроотрицательностьюпонимают усредненную характеристику способности атома, находящегося всоединении, притягивать электрон. При этом пренебрегают разницей в состоянияхатомов в различных соединениях. В отличие от потенциала ионизации и сродства кэлектрону, электроотрицательность — не строго определенная физическая величина,а полезная условная характеристика.
В табл.2.2 приведены значения электроотрицательности элементовпо шкале Олреда — Рохова, основанной на вычислении силы кулоновскогопритяжения, действующей на внешний электрон. Отметим, что весь диапазонзначений ЭО элементов заключен между 0,9 для наименее электроотрицательныхметаллов 1-й и 2-й групп и 4,1 для наиболее электроотрицательного фтора.
www.ronl.ru
Строениеатома.
В далёком прошлом философы Древней Грециипредполагали, что вся материя едина, но приобретает те или иные свойства взависимости от её «сущности». Некоторые из них утверждали, что вещество состоитиз мельчайших частиц, называемых атомами. Научные основы атомно-молекулярногоучения были заложены позднее в работах русского учёного М.В. Ломоносова,французских химиков Л. Лавуазье и Ж. Пруста, английского химика Д. Дальтона,итальянского физика А. Авогадро и других исследователей.
Периодический закон Д.И. Менделеева показываетсуществование закономерной связи между всеми химическими элементами. Этоговорит о том что в основе всех атомов лежит нечто общее. До концаXIX векав химии царило убеждение, что атом есть наименьшая неделимая частица простоговещества. Считалось, что при всех химических превращениях разрушаются исоздаются только молекулы, атомы же остаются неизменными и не могут дробитьсяна части. И наконец в концеXIXвека были сделаны открытия,показавшие сложность строения атома и возможность превращения одних атомов вдругие.
Это послужило толчком к образованию и развитиюнового раздела химии «Строение атома». Первым указанием на сложную структуруатома — были опыты по изучению катодных лучей, возникающих при электрическомразряде в сильно разреженных газах. Для наблюдения этих лучей из стекляннойтрубки, в которую впаяны дваметаллических электрода, выкачивается по возможности весь воздух и затем пропускается сквозь нее ток высокого напряжения.<span Courier New"; mso-bidi-font-family:«Times New Roman»">
При таких условиях от катода трубки перпендикулярнок его поверхности распространяются«невидимые» катодные лучи, вызывающие яркое зеленое свечение в томместе, куда они попадают. Катодные лучи обладают способностью приводить вдвижение. На их пути легко подвижные тела откланяются от своего первоначального пути вмагнитном и электрическом поле (в последнем в сторону положительно заряженнойпластины). Действие катодных лучей обнаруживается только внутри трубки, так как стекло для них непроницаемо. Изучениесвойств катодных лучей привело к заключению, что они состоят из мельчайшихчастиц, несущих отрицательный заряд и летящих со скоростью, достигающейполовины скорости света. Также удалось определить массу и величину их заряда.Масса каждой частицы равнялась 0,00055 углеродной частицы. Заряд равняется1,602 на 10 в минус 19 степени. Особенно замечательно, что масса частиц и величинаих заряда не зависит ни от природы газа, остающегося в трубке, ни от веществаиз которого сделаны электроды, ни от прочих условий опыта. Кроме того, катодные частицы известны только в заряженномсостоянии и не могут существовать безсвоих зарядов, не могут быть превращены в электронейтральные частицы: электрический заряд составляет,самую сущность их природы. Эти частицы получили название электронов. В катодныхтрубках электроны отделяются от катода под влиянием электрического заряда. Ноони могут возникать и вне всякой связи с электрическим зарядом. Так, напримерпри электронной эмиссии металлы испускают электроны; при фотоэффекте многиевещества также выбрасывают электроны. Выделение электронов самыми разнообразными веществами указывает на то, что этичастицы входят в состав всех атомов; следовательно атомы являются сложными образованиями, построенными из более мелких«составных частей».Изучениестроения атома практически началось в1897-1898 гг., после того как была окончательно установленаприрода катодных лучей как потокаэлектронов и были определены величиназаряда и масса электрона. Факт выделения электронов самыми разнообразными веществами приводил к выводу, что электронывходят в состав всех атомов. Но атом, как известно, электрически нейтрален, изэтого следовало, что в его состав должна была входить ещё одна составная часть,уравновешивавшая сумму отрицательных зарядов электронов. Эта положительно заряженная часть атома былаоткрыта в 1911 г. Резерфордомпри исследовании движения
a-частиц в газах и других веществах.
<img src="/cache/referats/910/image002.jpg" v:shapes="_x0000_i1025">
Резерфорд Эрнест (1871-1937)
a- частицы, выбрасываемыевеществами активных элементов представляют собой положительно заряженные ионы гелия,скорость движения которых достигает 20000 км/сек. Благодаря такой огромнойскорости a-частицы, пролетая черезвоздух и сталкиваясь с молекулами газов, выбивают из них электроны. Молекулы,потерявшие электроны, становятся заряженными положительно, выбитые же электроны тотчасприсоединяются к другим молекулам, заряжая их отрицательно.Таким образом, в воздухе на пути a-частиц образуются положительно и отрицательно заряженные ионы газа.Способность a-частиц ионизироватьвоздух была использована английскимфизиком <span Courier New"; mso-bidi-font-family:«Times New Roman»">Вильсоном
для того, чтобы сделать видимыми путидвижения отдельных частиц и сфотографировать их.Впоследствии аппарат дляфотографирования частиц получил название камеры Вильсона. (Первый трековый детектор заряженных частиц.Изобретена Ч. Вильсоном в 1912. Действие Вильсона камеры основано наконденсации пересыщенного пара (образовании мелких капелек жидкости) на ионах,возникающих вдоль следа (трека) заряженной частицы. В дальнейшем вытесненадругими трековыми детекторами.)
Исследуя пути движениячастиц с помощью камеры, Резерфорд заметил, что в камере они параллельны(пути), а при пропускании пучка параллельных лучей через слой газа или тонкуюметаллическую пластинку, они выходят не параллельно, а несколько расходятся,т.е. происходит отклонение частиц от их первоначального пути. Некоторые частицыотклонялись очень сильно, некоторые вообще не проходили через тонкую пластинку.
<img src="/cache/referats/910/image004.jpg" v:shapes="_x0000_i1026">
Модель атома Бор-Резерфорд
Исходя из этих наблюдений,Резерфорд предложил свою схему строения атома: в центре атома находитсяположительное ядро, вокруг которого по разным орбиталям вращаются отрицательныеэлектроны. Центростремительныесилы, возникающие при их вращении удерживают их на своих орбиталях и не дают имулететь. Эта модель атома легко объясняет явление отклонения a — частиц. Размеры ядра и электронов очень малы по сравнению сразмерами всего атома, которыеопределяются орбитами наиболее удаленных от ядра электронов; поэтомубольшинство a-частиц пролетает через атомы без заметного отклонения. Только в тех случаях, когда a-частицы очень близко подходит к ядру, электрическое отталкиваниевызывает резкое отклонение ее отпервоначального пути. Таким образом,изучение рассеяние a-частиц положило начало ядерной теории атома. Одной из задач, стоявших перед теорией строения атома в начале ее развития,было определение величины заряда ядра различных атомов. Так как атом вцелом электрически нейтрален, то, определив заряд ядра, можнобыло бы установить и число окружающих ядро электронов. В решении этой задачиэтой большую помощь оказало изучение спектров рентгеновских лучей. Рентгеновские лучи возникают приударе быстро летящих электронов о какое-либо твердое тело и отличаются от лучей видимого света только значительноменьшей длиной волны. В то время как короткие световые волны имеют длину около 4000 ангстремов (фиолетовыелучи), длины волн рентгеновских лучейлежат в пределах от 20 до 0,1 ангстрема. Чтобы получить спектр рентгеновских лучей, нельзя пользоваться обыкновенной призмой или дифракционной решеткой. (ДифракционнаяРЕШЕТКА, оптический прибор; совокупностьбольшого количества параллельных щелей в непрозрачном экране или отражающихзеркальных полосок (штрихов), равноотстоящих друг от друга, на которыхпроисходит дифракция света. Дифракционная решетка разлагает падающий на неепучок света в спектр, что используется в спектральных приборах. )
Для рентгеновских лучейтребовалась решётка с очень большим количеством делений на один миллиметр(примерно 1млн./1мм.). Такую решётку искусственно приготовить было невозможно.В 1912 г. у швейцарского физика Лауэвозникла мысль использовать кристаллы в качестве дифракционной решетки для рентгеновских лучей.
<img src="/cache/referats/910/image006.jpg" v:shapes="_x0000_i1027">
Модель кристалла
Упорядоченное расположение атомов в кристаллеи малое расстояние между ними давало повод предполагать что как раз кристаллы иподойдут на роль требуемой дифракционной решётки.
Опыт блестяще подтвердил предположение Лауэ, вскоре удалось построить приборы, которыедавали возможность получать спектр рентгеновских лучей почти всех элементов<span Courier New";mso-bidi-font-family:«Times New Roman»">.
Для получения рентгеновскихспектров антикатод в рентгеновских трубках делают из того металла, спектркоторого хотят получить, или же наносятсоединение исследуемого элемента. Экраном для спектра служитфотобумага; после проявленияна ней видны все линии спектра. В 1913 г.английский ученый Мозли,изучая рентгеновские спектры нашел соотношение между длинами волн рентгеновских лучей ипорядкового номерами соответствующих элементов — это носит название законаМозли и может быть сформулировано следующим образом: Корни квадратные изобратных значений длин волн находятся в линейной зависимости от порядковыхномеров элементов.Еще до работМозли некоторые учёные предполагали, чтопорядковый номер элемента указывает число зарядов ядра его атома. В тоже времяРезерфорд, изучая рассеивание a-частиц при прохождении через тонкие металлическиепластинки, выяснил, что если заряд электрона принять за единицу, то выражаемый в таких единицах заряд ядра приблизительно равен половине атомного веса элемента.Порядковый номер, по крайне мере более легких элементов, тоже равняется примерно половине атомноговеса. Все вместе взятое привело к выводу, что Зарядядра численно равен порядковому номеру элемента. Таким образом, закон Мозли позволил определить зарядыатомных ядер. Тем самым, ввиду нейтральности атомов, было установлено и числоэлектронов, вращающихся вокруг ядра в атоме каждого элемента. Ядерная модель атома Резерфорда получиласвое дальнейшее развитие благодаря работам Нильс Бора, в которых учение о строении атоманеразрывно связывается с учением опроисхождении спектров.
<img src="/cache/referats/910/image008.jpg" v:shapes="_x0000_i1028">
Бор (Bohr) Нильс Хенрик Давид (1885-1962)
Линейчатыеспектры получаются при разложении света испускаемого раскаленными парами илигазами. Каждому элементу отвечает свойспектр, отличающийся от спектров других элементов. Большинство металлов даеточень сложные спектры, содержащие огромное число линий (в железе до 5000), но встречаются исравнительно простые спектры. <span Courier New";mso-bidi-font-family:«Times New Roman»">
Развивая ядерную теорию Резерфорда, ученые пришли к мысли, что сложная структура линейчатых спектровобусловлена происходящими внутри атомов колебаниями электронов. По теории Резерфорда, каждый электрон вращается вокруг ядра, причем сила притяжения ядра уравновешивается центробежной силой, возникающей при вращении электрона. Вращениеэлектрона совершенно аналогично егобыстрым колебаниям и должно вызватьиспускание электромагнитных волн. Поэтому можно предположить, что вращающийся электрон излучает светопределенной длины волны, зависящий от частоты обращения электрона по орбите. Но, излучая свет,электрон теряет часть своей энергии, в следствие чего нарушается равновесие между ним и ядром; для восстановленияравновесия электрон должен постепеннопередвигаться ближе к ядру, причем также постепенно будет изменяться частота обращения электрона и характер испускаемого им света. В конце концов, исчерпав всюэнергию, электрон должен «упасть» на ядро, иизлучение света прекратится. Если бы на самом деле происходило такоенепрерывное изменение движенияэлектрона, то и спектр получался бы всегда непрерывный, а не с лучами определенной длины волны. Кроме того, «падение» электрона на ядро означало бы разрушение атома и прекращения его существования.Таким образом, теория Резерфорда была бессильна объяснить не только закономерности в распределении
<img src="/cache/referats/910/image010.jpg" v:shapes="_x0000_i1029">
Планк (Planck) Макс
(1858-1947)
линий спектра, ни и само существование линейчатыхспектров. В 1913 г. Бор предложил сою теорию строения атома, в которой емуудалось с большим искусством согласовать спектральные явления с ядерной моделью атома, применив к последней так называемую квантовуютеорию излучения, введенную в науку немецким ученым-физиком Планком. Сущность теории квантов сводится к тому, чтолучистая энергия испускается и поглощается не непрерывно, как принималось раньше, а отдельными малыми,но вполне определенными порциями — квантами энергии. Запас энергии излучающего тела изменяется скачками, квант за квантом; дробное число квантов тело не может нииспускать, ни поглощать. Величина квантаэнергии зависит от частоты излучения:чем больше частота излучения, тем большевеличина кванта. Кванты лучистой энергии называются также фотонами. Применив квантовые представления к вращениюэлектронов вокруг ядра, Бор положил в основу своей теории оченьсмелые предположения, илипостулаты. Хотя эти постулаты и противоречат законам классическойэлектродинамики, но они находят свое оправдание в тех поразительных результатах, к которым приводят, и в томполнейшем согласии, которое обнаруживается между теоретическими результатами и огромным числом экспериментальных фактов. Постулаты Бора заключаются в следующем: Электрон может двигаться вокругне по любым орбитам, а только по таким, которые удовлетворяют определенными условиям, вытекающим из теории квантов. Эти орбитыполучили название устойчивых или квантовых орбит. Когда электрон движется по одной из возможных длянего устойчивых орбит, то он не излучает. Переход электрона с удаленной орбиты на более близкую сопровождается потерей энергии.Потерянная атомом при каждом переходе энергия превращается в один квантлучистой энергии. Частота излучаемого при этом света определяется радиусами техдвух орбит, между которыми совершается переход электрона. Чембольше расстояние от орбиты, на которойнаходится электрон, до той, на которую он переходит, тем больше частотаизлучения. Простейшим из атомов является атом водорода; вокруг ядра котороговращается только один электрон. Исходя из приведенных постулатов, Бор рассчиталрадиусы возможных орбит для этого электрона и нашел, что они относятся, какквадраты натуральных чисел: 1: 2: 3:… n Величина n получила названиеглавного квантового числа. Радиус ближайшей к ядру орбиты в атоме водородаравняется 0,53 ангстрема. Вычисленные отсюда частоты излучений,сопровождающих переходы электрона с одной орбиты на другую, оказалисьв точности совпадающими с частотами, найденными на опыте для линий водородногоспектра.Тем самым была доказана правильность расчета устойчивых орбит, а вместе с тем и приложимость постулатов Бора для такихрасчетов. В дальнейшем теория Бора была распространена и на атомную структурудругих элементов, хотя это было связанно с некоторым трудностями из-за ееновизны. <span Courier New";mso-bidi-font-family: «Times New Roman»">
<span Courier New";mso-bidi-font-family: «Times New Roman»">
Теория Бора позволила разрешить очень важный вопрос о расположении электроновв атомах различных элементов и установить зависимость свойств элементов отстроения электронных оболочек их атомов.В настоящее время разработаны схемы строения атомов всех химических элементов.Однако, иметь ввиду, что все эти схемы это лишь более или менее достовернаягипотеза, позволяющая объяснить многиефизические и химические свойства элементов. Как раньше уже было сказано, число электронов, вращающихся вокруг ядра атома, соответствуетпорядковому номеру элемента впериодической системе. Электроны расположены по слоям, т.е. каждому слою принадлежит определенное заполняющие или какбы насыщающее его число электронов. Электроны одного и того же слоя характеризуются почти одинаковым запасомэнергии, т.е. находятся примерно на одинаковом энергетическом уровне. Всяоболочка атома распадаетсяна несколько энергетических уровней. Электроныкаждого следующего слоя находятся на более высоком энергетическом уровне, чем электроны предыдущего слоя. Наибольшее число электронов N, могущих находиться на данном энергетическом уровне, равно удвоенному квадрату номера слоя:
N=2n*n
где n-номерслоя. Кроме того, установлено, что число электронов в наружном слое для всехэлементов, кроме палладия, не превышаетвосьми, а в предпоследнем — восемнадцати. Электроны наружного слоя, как наиболее удаленные от ядра и,следовательно, наименее прочно связанные с ядром, могут отрываться отатома и присоединяться к другим атомам, входя в состав наружного слоя последних. Атомы, лишившиеся одногоили нескольких электронов, становятся заряженныеположительно, так как заряд ядра атомапревышает сумму зарядов оставшихся электронов. Наоборот атомы присоединившие электроны становятся заряженные отрицательно. Образующиеся таким путем заряженные частицы, качественно отличные от соответствующих атомов. называются ионами.Многие ионы в свою очередь могут терять или присоединять электроны, превращаясьпри этом или в электронейтральные атомы, или в новые ионы с другим зарядом.<span Courier New";mso-bidi-font-family:«Times New Roman»">
Теория Бора оказала огромныеуслуги физике и химии, подойдя, с одной стороны, к раскрытию законовспектроскопии и объяснению механизма лучеиспускания, а с другой — к выяснениюструктуры отдельных атомов и установлению связи между ними. Однако оставалось ещемного явлений в этой области, объяснить которые теория Бора не могла.Движение электронов в атомах Бор представлял какпростое механическое, однако оно является сложным и своеобразным. Этосвоеобразие было объяснено новой квантовой теорией. Отсюда и пошло:«Карпускулярно-вролновой дуализм».
И так, электрон в атоме характеризуется:
1.<span Times New Roman"">
Главным квантовым числом n, указывающим на энергиюэлектрона;2.<span Times New Roman"">
Орбитальным квантовым числом l, указывающим на характерорбиты;3.<span Times New Roman"">
Магнитным квантовым числом, характеризующим положение облаков впространстве;4.<span Times New Roman"">
И спиновым квантовым числом, характеризующим веретенообразное движениеэлектрона вокруг своей оси.… В далёком прошлом философы Древней Грециипредполагали, что вся материя едина, но приобретает те или иные свойства взависимости от её «сущности». А сейчас, в наше время, благодаря великим учёным,мы точно знаем, из чего на самом деле она состоит.
Используемая литература:
1)<span Times New Roman"">
Курс общеё химии (Н.В. Коровин)2)<span Times New Roman"">
Курс общей химии (А.Н. Харин )3)<span Times New Roman"">
Строение вещества (В.К. Васильев, А.Н. Шувалова)4)<span Times New Roman"">
Физическая химия ( А.Л. Дайнэко )www.ronl.ru
Реферат по химии на тему
«Строениеатома»
Существование закономернойсвязи между всеми
химическими элементами, ярко выраженное в
периодической системе, наталкивает на мысль о том,
что в основе всех атомов лежит нечтообщее, что все
они находятся в близком родстве друг сдругом. Однако
до конца 19 в. в химии господствовало метафизическое
убеждение, что атом есть наименьшая частица простого
вещества, последний предел делимости материи. При
всех химических превращениях разрушаются и вновь
создаются только молекулы, атомы же остаются
неизменными и не могут дробиться на более мелкие
части.
Но все эти предположения в то время еще не
могли быть подтверждены какими либо
экспериментальными данными. Лишь в конце 19в. были
сделаны открытия, показавшие сложностьстроения атома
и возможность превращения при известных условиях
одних атомов в другие. На основе этихоткрытий начало
быстро развиваться учение о строенииатома. Первые
указания на сложную структуру атомов были получены
при изучении катодных лучей, возникающих при
электрическом разряде в сильноразреженных газах. Для
наблюдения этих лучей из стеклянной трубки, в которую
впаяны два металлическихэлектрода, выкачивается по
возможности весь воздух и затем пропускается сквозь
нее ток высокого напряжения. При таких условиях от
катода трубки перпендикулярно к его поверхности
распространяются «невидимые»катодные лучи, вызывающие
яркое зеленое свечение в том месте, куда они
попадают. Катодные лучи обладают способностью
приводить в движение на их пути легкоподвижные тела и
откланяются от своего первоначального пути в
магнитном и электрическом поле (впоследнем в сторону
положительно заряженнойпластины). Действие катодных
лучей обнаруживается только внутритрубки, так как
стекло для них непроницаемо. Изучение свойств
катодных лучей привело к заключению, что они
представляют собой потокмельчайших частиц, несущих
отрицательный электрический заряд и летящих со
скоростью, достигающей половины скорости света.
Особыми приемами удалось определить массу катодный
частицы и величину их заряда. Оказалось, что масса
каждой частицы равняется 0,00055 углеродной единицы,
что составляет всего 1.1840 часть массы водорода,
самого легкого из всех атомов. Заряд катодной частицы
равняется 1,602 10 кулона, или 4,803 10
электростатических единиц. Особенно замечательно, что
масса частиц и величина их зарядане зависит ни от
природы газа, остающегося в трубке, ниот вещества из
которого сделаны электроды, ни от прочих условий
опыта. Кроме того, катодные частицыизвестны только в
заряженном состоянии и не могут быть лишены своих
зарядов, не могут быть превращены в
электронейтральные частицы: электрический заряд
составляет, самую сущность их природы. Эти частицы
получили название электронов. По современным
воззрениям, заряд электрона есть наименьший
электрический заряд, наименьшее кол-воэлектричества,
какое только может существовать. Вкатодных трубках
электроны отделяются от катода под влиянием
электрического заряда. однако они могут возникать и
вне всякой связи с электрическим зарядом. Так,
например, все металлы испускают электроны при
накаливании; в пламени горелки также присутствуют
электроны; многие вещества выбрасывают электроны при
освещении ультрафиолетовыми, рентгеновскими или
лучами света (фотоэффект). Выделение электронов
самыми разнообразными веществамиуказывает на то, что
эти частицы входят в состав всех атомов;
следовательно атомы являютсясложными образованиями,
построенными из более мелких структурных единиц.
Изучение строение атома практически началось в
1897-1898 гг., после того как была окончательно
установлена природа катодных лучей как потока
электронов и были определены величина заряда и масса
электрона. Факт выделения электронов самыми
разнообразными веществами приводил к выводу, что
электроны входят в состав всех атомов. Но атом в
целом электрически нейтрален; следовательно, он
должен содержать в себе ещедругую составную часть,
заряженную положительно, причем ее заряд должен
уравновешивать сумму отрицательных зарядов
электронов, Эта положительно заряженная часть атома
была открыта в 1911 г. Резерфордом при исследовании
движения -частиц в газах и другихвеществах. -частицы
выбрасываемые атомами радиоактивных элементов,
представляют собой положительно заряженные ионы
гелия, скорость движения которых достигает 20000
км/сек. Благодаря такой огромной скорости -частицы,
пролетая через воздух и сталкиваясь с молекулами
газов, выбивают из них электроны. Молекулы,
потерявшие электроны, становятся заряженные
положительно, выбитые же электроны тотчас
присоединяются к другим молекулам , заряжая их
отрицательно. Таким образом, в воздухе на пути
-частиц образуются положительно и отрицательно
заряженные ионы газа. Способность -частиц
ионизировать воздух была использована английским
физиком Вильсоном для того, чтобы сделать видимыми
пути движения отдельных частиц исфотографировать их.В
последствии аппарат для фотографирования -частиц был
назван камерой Вильсона. Рассматривая пути движения
-частиц в камере Вильсона, мы видим, что они
прямолинейны.В то же время, как показывает теория,
каждая частица на протяжении своего пути. а он
достигает в воздухе 11см, должна встретить сотни
тысяч атомов. Если тем не менее путь ее остается
прямолинейным, то это можно объяснить только тем, что
-частица пролетает сквозь атомы. Более тщательное
исследование этого явления показало, что при
прохождении пучка параллельных лучейсквозь слой газа
или тонкую металлическую пластинку выходят уже не
параллельны, а несколько расходятся: происходит
рассеяние -частиц, т.е. отклонение от их
первоначального пути.Углы отклонения невелики, но
всегда имеется небольшое число частиц (1/8000),
которые отклоняются очень сильно, некоторые частицы
отбрасываются назад, как если бы на пути встретилось
что-то твердое непроницаемое. (добавитьо том, что
это не электроны их масса в 7500 раз меньше массы
-частиц, отклонение из-за положительных частиц того
же порядка, что и -частицы) Исходя из этих
соображений, Резерфорд предложил следующую схему
строения атома. В центре атома находится положительно
заряженное ядро, вокруг которого по разным орбитам
вращаются электроны. Возникающая при их вращении
центробежная сила уравновешивается притяжением между
ядром и электронами, вседствии этого остаются на
определенных расстояниях от ядра. Так как масса
электрона ничтожна мала, то почти вся масса
сосредоточена в его ядре. Размеры атома и его
отдельных частей выражается следующими числами:
диаметр атома - 10 см., диаметр электрона — 10см и
диаметр ядра от 10 до 10 см. Отсюдаясно, что на долю
ядра и электронов, число которых, как увидим дальше,
сравнительно невелико, приходиться лишь, ничтожная
часть всего пространства, занятого атомной системой.
Предложенная Резерфордом схема строения атома или,
как обыкновенной говорят, модель атома, легко
объясняет явления отклонение-частиц. Действительно,
размеры ядра иэлектронов очень малы по сравнению с
размерами всего атома, которые определяются орбитами
наиболее удаленных от ядра электронов; поэтому
большинство -частиц пролетает через атомы без
заметного отклонения. Только в тех случаях, когда
-частицы очень близко подходит кядру, электрическое
отталкивание вызывает резкое отклонение ее от
первоначального пути. Таким образом, изучение
рассеяние -частиц положило начало ядерной теории
атома. Одной из задач, стоявших перед теорией
строения атома в начале ее развития,было определение
величины заряда ядра различных атомов.Так как атом в
целом электрически нейтрален, то, определив заряд
ядра, можно было бы установить и числоокружающих ядро
электронов. В решении этой задачи этойбольшую помощь
оказало изучение спектров рентгеновских лучей.
Рентгеновские лучи возникают при ударебыстро летящих
электронов о какое-либо твердое тело иотличаются от
лучей видимого света толькозначительно меньшей длиной
волны. В то время как короткие световые волны имеют
длину около 4000 ангстремов(фиолетовые лучи), длины
волн рентгеновских лучей лежат впределах от 20 до
0,1 ангстрема. Чтобы получить спектр рентгеновских
лучей, нельзя пользоваться обыкновенной призмой или
дифракционной решеткой. Теоретически для лучей с
такой короткой длиной волны, как рентгеновские лучи,
нужно было приготовить дифракционную решетку с
1000000 делений на 1 мм. Так как искусственно
приготовить такую решетку невозможно,то долгое время
спектр рентгеновских лучей неудавалось получить. В
1912 г. швейцарского физика Лауэ возникла мысль
использовать кристаллы в качестве дифракционной
решетки для рентгеновских лучей. Закономерное
расположение атомов в кристаллах и весьма малые
расстояния между ними давали основание предполагать,
что кристалл как раз и можетсыграть роль требуемой
дифракционной решетки. Опыт блестяще подтвердил
предположение Лауэ, вскоре удалосьпостроить приборы,
которые давали возможность получать спектры
рентгеновских лучей почти всех элементов. Для
получения рентгеновских спектров антикатод в
рентгеновских трубках делают из тогометалла, спектр
которого хотят получить, или же наносятсоединение
исследуемого элемента. Экраном для спектра служит
фотографическая пластинка или бумага; после
проявления на ней видны все линииспектра. В 1913 г.
английский ученый Мозли, изучаярентгеновские спектры
нашел соотношение между длинами волн рентгеновских
лучей и порядкового номерами соответствующих
элементов — это носит название законаМозли и может
быть сформулированно следующим образом: Корни
квадратные из обратных значений длинволн находятся в
линейной зависимости от порядковыхномеров элементов.
Еще до работ Мозли некоторые теоретические
соображения позволяли предположить, что порядковый
номер элемента указывает числоположительных зарядов
ядра его атома. В тоже время Резерфорд, изучая
рассеивание -частиц при прохождении через тонкие
металлические пластинки, нашел, что если заряд
электрона принять за единицу, то выражаемый в
таких единицах заряд ядра приблизительно равен
половине атомного веса элемента.Порядковый номер, по
крайне мере более легких элементов, тоже равняется
примерно половине атомного веса. Все вместе взятое
привело к выводу, что Заряд ядра численно равен
порядковому номеру элемента. Таким образом, закон
Мозли позволил определить зарядыатомных ядер. Тем
самым, ввиду нейтральности атомов,было установлено и
число электронов, вращающихся вокруг ядра в атоме
каждого элемента. Ядерная модель атома
Резерфорда получила свое дальнейшее развитие
благодаря работам Нильс Бора, в которых учение о
строении атома неразрывно связывается с учением о
происхождении спектров. Линейчатыеспектры получаются
при разложении света испускаемогораскаленными парами
или газами. Каждому элементу отвечает свой спектр,
отличающийся от спектров других элементов.
Большинство металлов дает очень сложные спектры,
содержащие огромное число линий (вжелезе до 5000),
но встречаются и сравнительно простые спектры.
Развивая ядерную теориюРезерфорда, ученые пришли к
мысли, что сложная структура линейчатых спектров
обусловлена происходящими внутри атомов колебаниями
электронов. По теории Резерфорда, каждый электрон
вращается вокруг ядра, причем сила притяжения ядра
уравновешивается центробежнойсилой, возникающей при
вращении электрона. Вращение электрона совершенно
аналогично его быстрым колебаниям и должновызвать
испускание электромагнитных волн. Поэтому можно
предположить, что вращающийся электрон излучает свет
определенной длины волны, зависящий от частоты
обращения электрона по орбите. Но, излучая свет,
электрон теряет часть своей энергии, вследствие чего
нарушается равновесие между ним и ядром; для
восстановления равновесия электрондолжен постепенно
передвигаться ближе к ядру, причем так же постепенно
будет изменяться частота обращения электрона и
характер испускаемого им света. В конце концов,
исчерпав всю энергию, электрон должен «упасть» на
ядро, и излучение света прекратится.Если бы на самом
деле происходило такое непрерывноеизменение движения
электрона, то и спектр получался бы всегда
непрерывный, а не с лучами определенной длины волны.
Кроме того, «падение»электрона на ядро означало бы
разрушение атома и прекращения его существования.
Таким образом, теория Резерфорда была бессильна
объяснить не только закономерности в распределении
линий спектра, ни и самосуществование линейчатых
спектров. В 1913 г. Бор предложил соютеорию строения
атома, в которой ему удалось с большим искусством
согласовать спектральные явления с ядерной моделью
атома, применив к последней так называемую квантовую
теорию излучения, введенную в науку немецким
ученым-физиком Планком. Сущность теории квантов
сводится к тому, что лучистая энергия испускается и
поглощается не непрерывно, как принималось раньше, а
отдельными малыми, но вполнеопределенными порциями -
квантами энергии. Запас энергии излучающего тела
изменяется скачками, квант за квантом; дробное число
квантов тело не может ни испускать, ни поглощать.
Величина кванта энергии зависит отчастоты излучения
: чем больше частота излучения, тембольше величина
кванта. Обозначая квант энергии через , можно
написать: = где — постоянная величина, так называемая
константа Планка, равная 6,625 10 эрг сек. Кванты
лучистой энергии называются такжефотонами. Применив
квантовые представления к вращениюэлектронов вокруг
ядра, Бор положил в основу своей теории очень смелые
предположения, или постулаты. Хотя эти постулаты и
противоречат законам классическойэлектродинамики, но
они находят свое оправдание в тех поразительных
результатах, к которым приводят, и в томполнейшем
согласии, которое обнаруживается междутеоретическими
результатами и огромным числом экспериментальных
фактов. Постулаты Бора заключаются в следующем:
Электрон может двигаться вокруг не полюбым орбитам, а
только по таким, которые удовлетворяют определенными
условиям, вытекающим из теории квантов. Эти орбиты
получили название устойчивых или квантовых орбит.
Когда электрон движется по одной извозможных для
него устойчивых орбит, то он не излучает. Переход
электрона с удаленной орбиты на более близкую
сопровождается потерей энергии.Потерянная атомом при
каждом переходе энергия превращается в один квант
лучистой энергии. Частота излучаемого при этом света
определяется радиусами тех двух орбит,между которыми
совершается переход электрона. Обозначив запас
энергии атома при положении электрона на более
удаленной от ядра орбите через Е, ана более близкой
через Е и разделив потерянную атомомэнергию Е — Е на
постоянную Планка, получим искомуючастоту:
=------
Чем больше расстояние от орбиты, на которой
находится электрон, до той, на которую он переходит,
тем больше частота излучения. Простейшим из атомов
является атом водорода; вокруг ядра которого
вращается только один электрон. Исходяиз приведенных
постулатов, Бор рассчитал радиусывозможных орбит для
этого электрона и нашел, что они относятся, как
квадраты натуральных чисел: 1: 2: 3:… n Величина
n получила название главногоквантового числа. Радиус
ближайшей к ядру орбиты в атоме водородаравняется
0,53 ангстрема. Вычисленные отсюдачастоты излучений,
сопровождающих переходы электрона с одной орбиты на
другую, оказались в точности совпадающими с
частотами, найденными на опыте для линий водородного
спектра Тем самым была доказанаправильность расчета
устойчивых орбит, а вместе с тем и приложимость
постулатов Бора для таких расчетов. В дальнейшем
теория Бора была распространена и наатомную структуру
других элементов, хотя это былосвязанно с некоторыми
трудностями из-за ее новизны.
Теория Бора позволила разрешить очень важный
вопрос о расположении электроновв атомах различных
элементов и установить зависимость свойств элементов
от строения электронных оболочек их атомов. В
настоящее время разработаны схемы строения атомов
всех химических элементов. Однако, иметь ввиду, что
все эти схемы это лишь более или менее достоверная
гипотеза, позволяющая объяснить многие физические и
химические свойства элементов. Как раньше уже было
сказанно, число электронов, вращающихся вокруг ядра
атома, соответствует порядковому номеру элемента в
периодической системе.
Электроны расположены по слоям, т.е. каждому
слою принадлежит определенноезаполняющие или как бы
насыщающее его число электронов. Электроны одного и
того же слоя характеризуются почтиодинаковым запасом
энергии, т.е. находятся примерно на одинаковом
энергетическом уровне. Вся оболочкаатома распадается
на несколько энергетических уровней. Электроны
каждого следующего слоя находятся на более высоком
энергетическом уровне, чем электроны предыдущего
слоя. Наибольшее число электронов N, могущих
находиться на данном энергетическомуровне, равно
удвоенному квадрату номера слоя:
N=2n
где n-номер слоя. Таким образомна 1-2, на 2-8,
на 3-18 и т.д. Кроме того, установлено, что число
электронов в наружном слое длявсех элементов, кроме
палладия, не превышает восьми, а впредпоследнем -
восемнадцати.
Электроны наружного слоя, как наиболее
удаленные от ядра и, следовательно, наименее прочно
связанные с ядром, могут отрываться от атома и
присоединяться к другим атомам, входя в состав
наружного слоя последних. Атомы, лишившиеся одного
или нескольких электронов, становятся заряженные
положительно, так как заряд ядра атома превышает
сумму зарядов оставшихсяэлектронов. Наоборот атомы
присоединившие электроны становятся заряженные
отрицательно. Образующиеся таким путем заряженные
частицы, качественно отличные от соответствующих
атомов. называются ионами. Многие ионыв свою очередь
могут терять или присоединятьэлектроны, превращаясь
при этом или в электронейтральныеатомы, или в новые
ионы с другим зарядом.
Теория Бора оказалаогромные услуги физике и
химии, подойдя, с одной стороны, к раскрытию законов
спектроскопии и объяснениюмеханизма лучеиспускания,
а с другой — к выяснению структурыотдельных атомов и
установлению связи между ними. Однако оставалось еще
много явлений в этой области, объяснить которые
теория Бора не могла.
Движение электронов в атомахрисовалось Бору до
известной степени как простое механическое
перемещение, между тем как оно является весьма
сложным и своеобразным. Своеобразие движения
электронов было раскрыто новой теорией — квантовой,
или волновой, механикой. Квантовая механика
показывает, что законы движения электронов имеют
много общего с законамираспространения волн. Я хочу
лишь основное уравнение волновоймеханики, в связи с
ее сложностью: связывающие длину волны для потока
электронов с их скоростью и массой :
=-----
где h- постоянная Планка.
Охватывая более широкий круг явлений, чем
теория Бора, решает ряд вопросов, с которыми теория
Бора справится не смогла.
Так, например, при помощи волновой механики
получает объяснение устойчивость лишь определенных
электронных орбит. «Устойчивыми» являютсялишь те
орбиты, на которых укладывается целоечисло волн. Так
как длина круговой орбиты с радиусомr равна 2 r, то
устойчивость орбиты будет определятсяур-нием:
2 r=------
где n-целое число. Это и есть математическое
выражение первого постулата Бора, которое он в 1913
г. положил в основу расчета движения электрона в
атоме водорода.
В приведенном выше ур-ние n-главное квантовое
число. Принимает значения любого натурального числа.
1) Главное квантовое число nопределяет уровень
энергии, которому отвечает данная орбита, и ее
удаленность от ядра. Главное квантовое число
определяет среднее радиальное распределение
электронной плотности около ядра. Помимо главного
квантового числа, состояние электрона в атоме
характеризуется еще тремя другимиквантовыми числами:
l,m,s.
2) Побочное (азимутальное) квантовое число l
характеризует момент количества движения электрона
относительно центра орбиты. Оно определяет форму
электронного облака (форму орбиты), его сплошность
или разрывы и его вытянутость. (s,p,dорбитали)
3) Магнитное квантовое число m определяет
положение плоскости орбиты электрона в пространстве
или, согласно представления волновой механики, то
направление, в котором вытянуто электронное облако.
Равно по модулю l.
4) Спиновое квантовое число s определяет
направление вращения электрона. может принимать
только два значения.
На основании анализа спектров и учета
положения элементов в периодической системе физиком
Паули был найден общий принцип, позволяющий избрать
те сочетания квантовых чисел, которые отвечают
реальной действительности. Согласно этому принципу
два электрона в атоме не могут иметь четыре
одинаковых квантовых числа.
www.ronl.ru
Электронное строение атома.
Периодический закон.
Квантово-механическая модель атома. Атомные орбитали. Квантовые числа.
Правила заполнения электронами атомных орбиталей. Валентность.
Периодический закон. Периодическая система.
Теория строения атома основана на законах, описывающих движение микрочастиц (электронов, атомов, молекул) и их систем (например, кристаллов). Массы и размеры микрочастиц чрезвычайно малы по сравнению с массами и размерами макроскопических тел. Поэтому свойства и закономерности движения отдельных микрочастиц отличаются от свойств и закономерностей движения макроскопических тел, изучаемых классической физикой. Движение и взаимодействие микрочастиц описывает квантовая механика, которая основывается на представлении о квантовании энергии, волновом характере движения микрочастиц и вероятностном (статистическом) методе описания микрообъектов.
Примерно в начале XX в. исследования явлений (фотоэффект, атомные спектры) привели к выводу, что энергия распространяется и передаётся, поглощается и испускается не непрерывно, а дискретно, отдельными порциями – квантами. Энергия системы микрочастиц также может принимать определённые значения, которые являются кратными частицами квантов.
Предположение о квантовании энергии впервые было высказано М. Планком в 1900 г. и было обосновано Эйнштейном в 1905 г.: энергия кванта  зависит от частоты излучения
зависит от частоты излучения  :
:  , где (1)
, где (1)
 – постоянная Планка (
– постоянная Планка ( )
)
Частота колебаний  и длина волны
и длина волны  связаны соотношением:
связаны соотношением:  ,
,
где  – скорость света.
– скорость света.
Согласно соотношению (1), чем меньше  , тем больше энергия кванта
, тем больше энергия кванта  и наоборот. Таким образом, ультрафиолетовые и рентгеновские лучи обладают большей энергией, чем скажем радиоволны и инфракрасные лучи. Для описания электромагнитного излучения привлекают как волновые, так и корпускулярные представления: с одной стороны монохроматическое излучение распространяется как волна и характеризуется длиной волны
и наоборот. Таким образом, ультрафиолетовые и рентгеновские лучи обладают большей энергией, чем скажем радиоволны и инфракрасные лучи. Для описания электромагнитного излучения привлекают как волновые, так и корпускулярные представления: с одной стороны монохроматическое излучение распространяется как волна и характеризуется длиной волны  , с другой стороны оно состоит из микрочастиц – фотонов, переносящих кванты энергии.
, с другой стороны оно состоит из микрочастиц – фотонов, переносящих кванты энергии.
Явление дифракции электромагнитного излучения доказывает его волновую природу. В то же время электромагнитное излучение обладает энергией, массой, производит давление. Так, вычислено, что за 1 год масса Солнца уменьшается за счёт излучения на  .
.
В 1924 г. Луи де Бройль предложил распространить корпускулярно-волновые представления на все микрочастицы, т.е. движение любой микрочастицы рассматривать как волновой процесс. Математически это выражается соотношением де Бройля, согласно которому частице массой  , движущейся со скоростью
, движущейся со скоростью  , соответствует волна длиной
, соответствует волна длиной  :
:  , (2)
, (2)
 – импульс частицы.
– импульс частицы.
Гипотеза де Бройля была экспериментально подтверждена обнаружением дифракционного и интерферентного эффектов потока электронов.
Согласно соотношению (2) движению электрона ( ,
,  ) отвечает волна длиной
) отвечает волна длиной  , т.е. её длина соизмерима с размерами атомов.
, т.е. её длина соизмерима с размерами атомов.
В 1925 г. Шрёдингер предположил, что состояние движения электрона в атоме должно описываться уравнением стоячей электромагнитной волны. Он получил уравнение, которое энергию электрона связывает с пространством Декартовых координат и так называемой волновой функцией  , которая соответствует амплитуде 3-х мерного волнового процесса:
, которая соответствует амплитуде 3-х мерного волнового процесса:
 , где
, где
 – полная энергия электрона
– полная энергия электрона
 – потенциальная энергия электрона
– потенциальная энергия электрона
 – вторая частная производная
– вторая частная производная

Уравнение Шредингера позволяет найти волновую функцию  как функцию координат. Физический смысл волновой функции в том, что квадрат её модуля определяет вероятность нахождения электрона в элементарном объёме
как функцию координат. Физический смысл волновой функции в том, что квадрат её модуля определяет вероятность нахождения электрона в элементарном объёме  , т.е. характеризует электронную плотность.Т. к. электрон обладает свойствами волны и частицы, мы не можем определить его положение в пространстве в определённый момент времени. Электрон размазан, т.е. делокализирован в пространстве атома. В этом заключается принцип Гейзенберга.
, т.е. характеризует электронную плотность.Т. к. электрон обладает свойствами волны и частицы, мы не можем определить его положение в пространстве в определённый момент времени. Электрон размазан, т.е. делокализирован в пространстве атома. В этом заключается принцип Гейзенберга.
Микрочастица, так же как и волна не имеет одновременно точных значений координат и импульса. Это проявляется в том, что чем точнее определяется координаты частицы, тем неопределеннее её импульс, и наоборот. Поэтому мы говорим о максимально вероятном нахождении электрона в данном месте в определённый момент времени. Та область пространства, где >90% находится электрон называется атомной орбиталью. Уравнение Шредингера имеет множество решений, но физически осмысленное решение только в определённых условиях.
Для описания стоячей волны, образованной в атоме движущимся электроном, т.е. для нахождения волновой функции  необходимы квантовые числа.
необходимы квантовые числа.
В 3-х мерном пространстве 4-мя квантовыми числами описывается состояние электрона:
Главное квантовое число  характеризует удалённость электрона от ядра и определяет его энергию (чем больше
характеризует удалённость электрона от ядра и определяет его энергию (чем больше  , тем больше энергия электрона и тем меньше энергия связи с ядром).
, тем больше энергия электрона и тем меньше энергия связи с ядром).  принимает целочисленные значения от 1 до ¥.
принимает целочисленные значения от 1 до ¥.
Состояние электрона характеризующееся различными значениями главного квантового числа  , называется электронным слоем (электронной оболочкой, энергетическим уровнем). Они обозначаются цифрами 1, 2, 3, 4, 5, … или соответственно буквами K, L, M, N, O ….
, называется электронным слоем (электронной оболочкой, энергетическим уровнем). Они обозначаются цифрами 1, 2, 3, 4, 5, … или соответственно буквами K, L, M, N, O ….
Квантовое состояние атома с наименьшей энергией – основное состояние, а с более высокой – возбуждённое состояние. Переход электрона с одного уровня на другой сопровождается либо поглощением, либо выделением энергии:  .
.
Побочное квантовое (орбитальное, азимутальное) число  (принимает все целочисленные значения от 0 до (n-1)).
(принимает все целочисленные значения от 0 до (n-1)).
|
| Орбиталь |
1 | 1s | |
2 | 0,1 | 2s,2p |
3 | 0,1,2 | 3s,3p,3d |
Состояние электрона характеризующееся различными значениями побочного квантового числа  называется энергетическим подуровнем. В пределах каждого уровня с увеличением
называется энергетическим подуровнем. В пределах каждого уровня с увеличением  , растёт энергия орбитали.
, растёт энергия орбитали.
Каждому значению 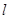 соответствует определённая форма орбитали (например, при
соответствует определённая форма орбитали (например, при  – это сфера, центр которой совпадает с ядром).
– это сфера, центр которой совпадает с ядром).

Магнитное квантовое число  характеризует ориентацию орбитали в пространстве (принимает все целочисленные значения от —
характеризует ориентацию орбитали в пространстве (принимает все целочисленные значения от —  до +
до + ).
).
Например, для 
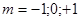 . В пределах каждого подуровня орбиталь имеет одинаковую энергию.
. В пределах каждого подуровня орбиталь имеет одинаковую энергию.
Спиновое квантовое число  характеризует вращательный момент, который приобретает электрон в результате собственного вращения вокруг своей оси (принимает два значения:
характеризует вращательный момент, который приобретает электрон в результате собственного вращения вокруг своей оси (принимает два значения:  – вращение по часовой стрелке,
– вращение по часовой стрелке,  – вращение против часовой стрелки).
– вращение против часовой стрелки).
Атомные орбитали заполняются электронами в соответствии с 3-мя принципами:
Принцип устойчивости (принцип min энергии): Каждая новая орбиталь заполняется только после того, как будут заполнены все предыдущие, т.е. более устойчивые (с min энергией) орбитали.
Энергия атомных орбиталей возрастает следующим образом:

Правило Клечковского: заполнение электронами атомных орбиталей происходит в соответствии с увеличением суммы главного  и побочного
и побочного  квантовых чисел; если
квантовых чисел; если  одинакова, то атомная орбиталь заполняется от больших
одинакова, то атомная орбиталь заполняется от больших  и меньших
и меньших  к меньшим
к меньшим  и большим
и большим  .
.
|
|
| Орбиталь |
1 | 1 | 1s | |
2 | 2 | 2s | |
1 | 3 | 2p | |
3 | 3 | 3s | |
1 | 4 | 3p | |
2 | 5 | 3d | |
4 | 4 | 4s | |
1 | 5 | 4p | |
2 | 6 | 4d | |
3 | 7 | 4f | |
5 | 5 | 5s | |
1 | 6 | 5p | |
2 | 7 | 5d | |
3 | 8 | 5f | |
4 | 9 | 5g | |
6 | 6 | 6s |
Принцип Паули: в атоме не может быть 2 электрона, у которых 4 одинаковых квантовых числа. Следовательно, на 1-ой орбитали могут находиться не более 2-х электронов, отличающихся друг от друга значением спинового квантового числа. Отсюда следует, что максимальное количество электронов на энергетическом уровне 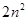 , на энергетическом подуровне
, на энергетическом подуровне  .
.
Пример:

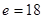

Правило Хунда: электроны располагаются на орбиталях равной энергии таким образом, чтобы их суммарный спин был максимальный. Это означает, что первоначально электроны заполняют все свободные орбитали данного подуровня по 1-му, имея при этом параллельные спины, и только потом происходит заполнение этих орбиталей 2-ми электронами.
Пример:

 Px Py Pz
Px Py Pz
K | L | M | |||||||
| 1 | 2 | 3 | ||||||
| 1 | 1 | 2 | ||||||
| -1 | +1 | -1 | +1 | |||||
| ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ | ↓↑ |
|
|
|
|
|
|
|
|
|
Количество неспаренных электронов на внешнем уровне определяет валентность элемента, т.е. способность образовывать химические связи с другими атомами. В большинстве случаев, но не всегда.
 5
5 
 4
4 
4  3
3 
3  2
2 
2  1
1 
1 
Периодический закон (1869 г): свойства простых тел, а также свойства и формы соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
До появления сведений о сложном строении атома основной характеристикой элемента служил атомный вес (относительная атомная масса). Развитие теории строения атома привело к установлению того факта, что главной характеристикой атома является положительный заряд ядра.
В современной формулировке периодический закон звучит: свойства химических элементов, а также формулы и свойства образуемых ими соединений находятся в периодической зависимости от величины заряда ядер их атомов.
Физической основой структуры периодической системы элементов служит определённая последовательность формирования электронных конфигураций атомов по мере роста порядкового номера элемента.
В зависимости от того, какой энергетический подуровень заполняется электронами последним, различают 4 типа элементов:
 – элементы (последним заполняется
– элементы (последним заполняется  -подуровень внешнего энергетического уровня)
-подуровень внешнего энергетического уровня)
 – элементы (последним заполняется
– элементы (последним заполняется  -подуровень внешнего энергетического уровня)
-подуровень внешнего энергетического уровня)
 – элементы (последним заполняется
– элементы (последним заполняется  -подуровень предпоследнего энергетического уровня)
-подуровень предпоследнего энергетического уровня)
 – элементы (последним заполняется
– элементы (последним заполняется  -подуровень 3-го снаружи энергетического уровня).
-подуровень 3-го снаружи энергетического уровня).
Горизонтально располагаются периоды – последовательный ряд элементов, электронная конфигурация внешнего энергетического уровня которых изменяется от  до
до  . Номер периода совпадает со значением главного квантового числа
. Номер периода совпадает со значением главного квантового числа 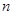 внешнего энергетического уровня.
внешнего энергетического уровня.
Вертикально располагаются группы – элементы имеющие сходное электронное строение. У элементов главной подгруппы последним заполняется  и
и  подуровни внешнего энергетического уровня, у элементов побочной подгруппы происходит заполнение внутренних
подуровни внешнего энергетического уровня, у элементов побочной подгруппы происходит заполнение внутренних  и
и  подуровней. Одинаковый номер группы, как правило, определяет число электронов, которое может участвовать в образовании химических связей.
подуровней. Одинаковый номер группы, как правило, определяет число электронов, которое может участвовать в образовании химических связей.
Квантово-механическая модель атома.
Уравнения де Бройля и Шредингера.
Принцип неопределенности Гейзенберга.
Атомная орбиталь, квантовые числа.
Правила заполнения электронами атомных орбиталей (принцип минимальной энергии, правило Клечковского, правила Паули и Гунда).
Периодический закон Д.И. Менделеева. Периодическая таблица (периоды и группы).
www.ronl.ru