Углерод.
Углерод (Carboneum), С — химический элемент IV группы, побочной подгруппы, 2-го периода периодической системы Д. И. Менделеева, порядковый номер 6. Относительная атомная масса: 12,011. Электроотрицательность: 2,6. Температура плавления: 3370єС (сгорает). Температура кипения: 4200єС. Плотность (графит): 2,27 г/смі. Число собственных минералов углерода — 112; исключительно велико число органических соединений углерода — углеводородов и их производных. Углерод находится в природе как в свободном состоянии (в виде алмаза, графита), так и в виде соединений (содержится в горючих сланцах, буром и каменном углях, торфе и в виде соединений в нефти, природных горючих газах, в карбонатах). Все живые организмы построены из соединений углерода. Углерод широко распространен, но содержание его в земной коре всего 0,19%; также углерод широко распространён в космосе; на Солнце он занимает 4-е место после водорода, гелия и кислорода. По сравнению со средним содержанием в земной коре человечество в исключительно больших количествах извлекает углерод из недр (уголь, нефть, природный газ), так как эти ископаемые — основной источник энергии.
Историческая справка. В 1778 К. Шееле, нагревая графит с селитрой, обнаружил, что при этом, как и при нагревании угля с селитрой, выделяется углекислый газ. Химический состав алмаза был установлен в результате опытов А. Лавуазье (1772) по изучению горения алмаза на воздухе и исследований С. Теннанта (1797), доказавшего, что одинаковые количества алмаза и угля дают при окислении равные количества углекислого газа. Углерод был признан химическим элементом в 1789 Лавуазье. Латинское название «carboneum» углерод получил от «carbo» — уголь. А в 1961 Международные союзы теоретической и прикладной химии (ИЮПАК) и по физике приняли за единицу атомной массы массу изотопа углерода 12C, упразднив существовавшую до того кислородную шкалу атомных масс. Атомная масса углерода в этой системе равна 12,011, так как она является средней для трех природных изотопов углерода с учетом их распространенности в природе.
Углерод известен с древности. Издавна известно, что графитом можно маркировать другой материал, и само название «графит», происходящее от греческого слова, означающего «писать», предложено А.Вернером в 1789. Однако история графита запутана, часто за него принимали вещества, обладающие сходными внешними физическими свойствами, например молибденит (сульфид молибдена), одно время считавшийся графитом. Среди других названий графита известны «черный свинец», «карбидное железо», «серебристый свинец». В 1779 К.Шееле установил, что графит можно окислить воздухом с образованием углекислого газа.
Алмазы впервые нашли применение в Индии, а в Бразилии драгоценные камни приобрели коммерческое значение в 1725; месторождения в Южной Африке были открыты в 1867. В XX веке основными производителями алмазов являются ЮАР, Заир, Ботсвана, Намибия, Ангола, Сьерра-Леоне, Танзания и Россия. Искусственные алмазы, технология которых была создана в 1970, производятся для промышленных целей.
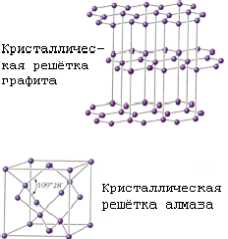
Физические и химические свойства. Известны четыре кристаллические модификации углерода: графит, алмаз, карбин и лонсдейлит. Графит — серо-чёрная, непрозрачная, жирная на ощупь, чешуйчатая, очень мягкая масса с металлическим блеском, обладает электропроводимостью. Атомы расположены параллельными слоями, образуя гексагональную решетку. Внутри слоя атомы связаны сильнее, чем один слой с другим, поэтому графит может расслаиваться. Сгорает при 700єС в рисутствии кислорода. Встречается в природе; получается искусственно. При высокой температуре, давлении и рисутствии катализатора (марганец Mn, хром Cr, платиновые металлы) графит превращается в алмаз. Алмаз — минерал, имеющий желтоватый, белый, серый, зеленоватый, реже голубой и черный цвет. Не проводит электрический ток, плохо проводит тепло. В кристалле атомы углерода образуют непрерывный трехмерный каркас, состоящий из сочлененных тетраэдров, что обеспечивает высокую прочность связей. Алмаз — это самое твердое вещество из всех известных. Температура плавления выше 3500єС. Химически стоек. Сгорает при 870єС в присутствии кислорода. При 1800єС в отсутствие кислорода превращается в графит. Прозрачные кристаллы; после обработки — бриллианты. Добывают из россыпей и коренных месторождений. Синтетический алмаз получают из графита при высоких давлении и температуре. Он чаще полупрозрачный или непрозрачный; имеет кристаллическую структуру и свойства природного алмаза.Жидкий углерод может быть получен при давлениях выше 10,5 Мн/мІ (105 кгс/смІ) и температурах выше 3700єС. Кокс, сажа, древесный уголь (твердый углерод ) имеют то же строение, что и графит.Для твёрдого углерода характерно также состояние с неупорядоченной структурой — так называемый «аморфный» углерод , который не представляет собой самостоятельной модификации; в основе его строения лежит структура мелкокристаллического графита. Нагревание некоторых разновидностей «аморфного» углерода выше 1500-1600єС без доступа воздуха вызывает их превращение в графит. Физические свойства «аморфного» углерода очень сильно зависят от дисперсности частиц и наличия примесей. Плотность, теплоёмкость, теплопроводность и электропроводность «аморфного» углерода всегда выше, чем графита. Карбин получен искусственно. Он представляет собой мелкокристаллический порошок чёрного цвета (плотность = 2 г/смі). Построен из длинных цепочек атомов С, уложенных параллельно друг другу. Лонсдейлит найден в метеоритах и получен искусственно; его структура и свойства окончательно не установлены.

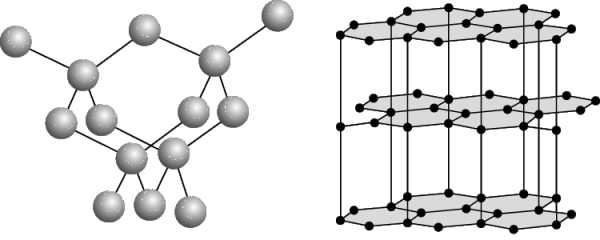
А Б
Структура алмаза (а) и графита (б).
Конфигурация внешней электронной оболочки атома углерода2s І 2p І. Для углерода характерно образование четырёх ковалентных связей, обусловленное возбуждением внешней электронной оболочки до состояния 2sp і. Химическая связь может осуществляться за счет sp 3 -,sp 2 — и sp — гибридных орбиталей, которым соответствуют координационные числа 4, 3 и 2. Число валентных электронов углерода и число валентных орбиталей одинаково; это одна из причин устойчивости связи между атомами углерода.
Строение атома углерода.
Уникальная способность атомов углерода соединяться между собой с образованием прочных и длинных цепей и циклов привела к возникновению громадного числа разнообразных соединений углерода (углеводородов), изучаемых органической химией.
В соединениях углерод проявляет степени окисления -4; +2; +4. Атомный радиус 0,77Б, ковалентные радиусы 0,77Б, 0,67Б, 0,60Б соответственно в одинарной, двойной и тройной связях; ионной радиус
С4- 2,60Б, С4+ 0,20Б. При обычных условиях углерод химически инертен, при высоких температурах он соединяется со многими элементами, проявляя сильные восстановительные свойства. Химическая активность убывает в ряду: «аморфный» углерод, графит, алмаз; взаимодействие с кислородом воздуха (горение) происходит соответственно при температурах выше 300-500єС, 600-700єС и 850-1000єС с образованием двуокиси углерода CO2 и окиси углерода CO.
CO2 растворяется в воде с образованием угольной кислоты. В 1906 О. Дильс получил недоокись углерода C3O2. Все формы углерода устойчивы к щелочам и кислотам и медленно окисляются только очень сильными окислителями (хромовая смесь, смесь концентрированных HNO3 и KClO3 и др.). «Аморфный» углеод реагирует с фтором при комнатной температуре, графит и алмаз — при нагревании. Непосредственное соединение углерода с хлором происходит в электрической дуге; с бромом и иодом углерод не реагирует, поэтому многочисленные галогениды углерода синтезируют косвенным путём. Из оксигалогенидов общей формулы COX2 (где Х — галоген) наиболее известна хлорокись COCl2 (фосген). Водород с алмазом не взаимодействует; с графитом и «аморфным» углеродом реагирует при высоких температурах в присутствии катализаторов (никель Ni, платина Pt): при 600-1000єС образуется в основном метан Ch5, при 1500-2000єС — ацетилен C2h3, в продуктах могут присутствовать также другие углеводороды, например этан C2H6, бензол C6H6. Взаимодействие серы с «аморфным» углеродом и графитом начинается при 700-800єС, с алмазом при 900-1000єС; во всех случаях образуется сероуглерод CS2. Другие соединения углерода, содержащие серу (тиоокись CS, тионедоокись C3S2, сероокись COS и тиофосген CSCl2), получают косвенным путём. При взаимодействии CS2 с сульфидами металлов образуются тиокарбонаты — соли слабой тиоугольной кислоты. Взаимодействие углерода с азотом с получением циана (CN)2 происходит при пропускании электрического разряда между угольными электродами в атмосфере азота. Среди азотсодержащих соединений углерода важное практическое значение имеют цианистый водород HCN и его многочисленные производные: цианиды, гало-генцианы, нитрилы и др. При температурах выше 1000єС углерод взаимодействует со многими металлами, давая карбиды. Все формы углерода при нагревании восстанавливают окислы металлов с образованием свободных металлов (Zn,Cd,Cu,Pb и др.) или карбидов (CaC2, Mo2C, WC, TaC и др.). Углерод реагирует при температурах выше 600-800°С с водяным паром и углекислым газом. Отличительной особенностью графита является способность при умеренном нагревании до 300-400єС взаимодействовать со щелочными металлами и галогенидами с образованием соединений включения типа C8Me, C24Me, C8X (где Х — галоген, Me — металл). Известны соединения включения графита с HNO3, h3SO4, FeCl3 и другие (например, бисульфат графита C24SO4h3). Все формы углерода нерастворимы в обычных неорганических и органических растворителях, но растворяются в некоторых расплавленных металлах (например, железо Fe, никель Ni, кобальт Co).
Изотопы углерода. В природе известно семь изотопов углерода, из которых существенную роль играют три. Два из них — и — являются стабильными, а один — — радиоактивным (в организме человека его содержится около 0,1мккюри ). С использованием изотопов углерода в биологических и медицинских исследованиях связаны многие крупные достижения в изучении обмена веществ и круговорота углерода в природе. Так, с помощью радиоуглеродной метки была доказана возможность фиксации Н14СО3 растениями и тканями животных, установлена последовательность реакции фотосинтеза, изучен обмен аминокислот, прослежены пути биосинтеза многих биологически активных соединений и т. д. Применение 14С способствовало успехам молекулярной биологии в изучении механизмов биосинтеза белка и передачи наследственной информации. Определение удельной активности 14С в углеродсодержащих органических остатках позволяет судить об их возрасте, что используется в палеонтологии и археологии.
Углерод в организме. Углерод — важнейший биогенный элемент, составляющий основу жизни на Земле, структурная единица огромного числа органических соединений, участвующих в построении организмов и обеспечении их жизнедеятельности (биополимеры, а также многочисленные низкомолекулярные биологически активные вещества — витамины, гормоны, медиаторы и др.). Значительная часть необходимой организмам энергии образуется в клетках за счёт окисления углерода. Возникновение жизни на Земле рассматривается в современной науке как сложный процесс эволюции углеродистых соединений.
Содержание углерода в живых организмах в расчёте на сухое вещество составляет: 34,5-40% у водных растений и животных, 45,4-46,5% у наземных растений и животных и 54% у бактерий.
Роль углерода в живой природе. Уникальная роль углерода в живой природе обусловлена его свойствами, которыми в совокупности не обладает ни один другой элемент периодической системы. Между атомами углерода, а также между углеродом и другими элементами образуются прочные химические связи, которые, однако, могут быть разорваны в сравнительно мягких физиологических условиях (эти связи могут быть одинарными, двойными и тройными). Способность углерода образовывать 4 равнозначные валентные связи с другими атомами углерода создаёт возможность для построения углеродных скелетов различных типов — линейных, разветвленных, циклических. Показательно, что всего три элемента — углерод С, кислород О и водород Н — составляют 98% общей массы живых организмов. Этим достигается определённая экономичность в живой природе: при практически безграничном структурном разнообразии углеродистых соединений небольшое число типов химических связей позволяет намного сократить количество ферментов, необходимых для расщепления и синтеза органических веществ. Особенности строения атома углерода лежат в основе различных видов изомерии органических соединений (способность к оптической изомерии оказалась решающей в биохимической эволюции аминокислот, углеводов и некоторых алкалоидов).
Согласно общепринятой гипотезе А. И. Опарина, первые органические соединения на Земле имели абиогенное происхождение. Источниками углерода служили метан (Ch5) и цианистый водород (HCN), содержавшиеся в первичной атмосфере Земли. С возникновением жизни единственным источником неорганического углерода, за счёт которого образуется всё органическое вещество биосферы, является двуокись углерода (CO2), находящаяся в атмосфере, а также растворённая в природных водах в виде HCO-3. Наиболее мощный механизм усвоения (ассимиляции) углерода (в форме CO2) — фотосинтез — осуществляется повсеместно зелёными растениями (ежегодно ассимилируется около 100 млрд. т CО2). На Земле существует и эволюционно более древний способ усвоения CO2 путём хемосинтеза; в этом случае микроорганизмы-хемосинтетики используют не лучистую энергию Солнца, а энергию окисления неорганических соединений. Большинство животных потребляют углерод с пищей в виде уже готовых органических соединений. В зависимости от способа усвоения органических соединений принято различать автотрофные организмы и гетеротрофные организмы. Применение для биосинтеза белка и других питательных веществ микроорганизмов, использующих в качестве единственного источника углерода углеводороды нефти,- одна из важных современных научно-технических проблем.
Помимо основной функции — источника углерода — двуокись углерода CO2, растворённая в природных водах и в биологических жидкостях, участвует в поддержании оптимальной для жизненных процессов кислотности среды. В составе CaCO3 углерод образует наружный скелет многих беспозвоночных (например, раковины моллюсков), а также содержится в кораллах, яичной скорлупе птиц и др. Такие соединения углерода, как HCN, CO, CCl4, преобладавшие в первичной атмосфере Земли в добиологический период, в дальнейшем, в процессе биологической эволюции, превратились в сильные антиметаболиты обмена веществ.
Круговорот углерода. Углерод — основной биогенный элемент; он играет важнейшую роль в образовании живого вещества биосферы. Углекислый газ из атмосферы в процессе фотосинтеза, осуществляемого зелёными растениями, ассимилируется и превращается в разнообразные и многочисленные органические соединения растений. Растительные организмы, особенно низшие микроорганизмы, морской фитопланктон, благодаря исключительной скорости размножения продуцируют в год около 1,5·10№№ т углерода в виде органической массы, что соответствует
5,86·10Іє Дж (1,4·10Ієкал) энергии. Растения частично поедаются животными (при этом образуются более или менее сложные пищевые цепи). В конечном счёте органическое вещество в результате дыхания организмов, разложения их трупов, процессов брожения, гниения и горения превращается в углекислый газ или отлагается в виде сапропеля, гумуса, торфа, которые, в свою очередь, дают начало многим др. каустобиолитам — каменным углям, нефти, горючим газам.

Круговорот углерода.
В процессах распада органических веществ, их минерализации огромную роль играют бактерии (например, гнилостные), а также многие грибы (например, плесневые).
В активном круговороте углерода участвует очень небольшая часть всей его массы. Огромное количество угольной кислоты законсервировано в виде ископаемых известняков и других пород. Между углекислым газом атмосферы и водой океана, в свою очередь, существует подвижное равновесие.
Таблица: Содержание углерода на поверхности Земли и в земной коре (16 км мощности)
В т В г на 1 см І поверхности Земли
Животные 5·109 0,0015
Растения 5·10№№ 0,1
Атмосфера 6,4·10№№ 0,125
Океан 3,8·10№і 7,5
Массивные кристаллические
породы: базальты и др. 1,7·1014 33,0
основные породы
Граниты, гранодиориты 2,9·1015 567
Угли, нефти и другие
каустобиолиты 6,4·1015 663
Кристаллические сланцы 1·1016 2000
Карбонаты 1,3·1016 2500
Всего 3,2·1016 5770
Многие водные организмы поглощают углекислый кальций, создают свои скелеты, а затем из них образуются пласты известняков. Из атмосферы было извлечено и захоронено в десятки тысяч раз больше углекислого газа, чем в ней находится в данный момент. Атмосфера пополняется углекислым газом благодаря процессам разложения органического вещества, карбонатов и др., а также, всё в большей мере, в результате индустриальной деятельности человека. Особенно мощным источником являются вулканы, газы которых состоят главным образом из углекислого газа и паров воды. Некоторая часть углекислого газа и воды, извергаемых вулканами, возрождается из осадочных пород, в частности известняков, при контакте магмы с ними и их ассимиляции магмой. В процессе круговорота углерода происходит неоднократное фракционирование его по изотопному составу (№ІC — №іC), особенно в магматогенном процессе (образование CO2, алмазов, карбонатов), при биогенном образовании органического вещества (угля, нефти, тканей организмов и др.).
Применение углерода. Углерод широко используется в виде простых веществ. Драгоценный алмаз является предметом ювелирных украшений; непрозрачный алмаз — ценный абразив, а так же материал для изготовления резцов и другого инструмента. Древесный уголь и другие аморфные формы углерода применяются для обесцвечивания, очистки, адсорбции газов, в областях техники, где требуются адсорбенты с развитой поверхностью. Графит применяют для изготовления плавильных тиглей, футеровочных плит, электродов, твердых смазочных материалов; в ракетной технике; как замедлитель нейтронов в ядерных реакторах; компонент состава для изготовления стержней для арандашей; для получения алмаза; наполнитель пластмасс. Каменноугольный кокс используется в черной металлургии в качестве топлива и восстановителя в доменных печах и вагранках. Нефтяной и электродный пековый кокс применяется для изготовления угольных и графитированных электродов, реже — как топливо. Сажа (технический углерод) применяется как наполнитель в производстве резины, пластмасс; пигмент в лакокрасочной промышленности; для изготовления электродов и т. п. Карбиды, соединения углерода с металлами, а также с бором и кремнием (например, Al4C3, SiC, B4C) отличаются высокой твердостью и используются для изготовления абразивного и режущего инструмента. Углерод применяется для получения металлов из их оксидов. Углерод входит в состав сталей и сплавов в элементном состоянии и в виде карбидов. Насыщение поверхности стальных отливок углеродом при высокой температуре (цементация) значительно увеличивает поверхностную твердость и износостойкость.
Применение алмаза в ювелирных украшениях,
графита в карандашах.
Список литературы: 1) «Большая школьная энциклопедия», т. 2, изд. «Олма-пресс»
2) Интернет: www.encycl.yandex.ru, www.krugosvet.ru, www.informika.ru.
www.ronl.ru
.
глерод (лат. Carboneum), С - химический элемент IV группы периодической системы Менделеева. Известны два стабильных изотопа12С (98,892 %) и13С (1,108 %).
Углерод известен с глубокой древности. Древесный уголь служил для восстановления металлов из руд, алмаз - как драгоценный камень. Значительно позднее стали применяться графит для изготовления тиглей и карандашей.
В 1778К. Шееле, нагревая графит с селитрой, обнаружил, что при этом, как и при нагревании угля с селитрой, выделяется углекислый газ. Химический состав алмаза был установлен в результате опытовА.Лавуазье(1772) по изучения горения алмаза на воздухе и исследованийС.Теннанта(1797), доказавшего, что одинаковые количества алмаза и угля дают при окислении равные количества углекислого газа. Углерод как химический элемент был признан только в 1789А.Лавуазье.Латинское название сarboneum углерод получил от сarbo — уголь.
Распространение в природе:
Среднее содержание углерода в земной коре 2,3*10-2% по массе (1*10–2в ультраосновных, 1*10–2в основных, 2*10–2в средних, 3*10–2в кислых горных породах). Углерода накапливается в верхней части земной коры (биосфере): в живом веществе 18 % углерода, в древесине 50 %, в каменном угле 80 %, в нефти 85 %, антраците 96 %. Значит часть углерода литосферы сосредоточена в известняках и доломитах.
Число собственных минералов углерода - 112; исключительно велико число органических соединений углерода - углеводородов и их производных.
С накоплением углерода в земной коре связано накопление и многих других элементов, сорбируемых органическим веществом и осаждающихся в виде нерастворимых карбонатов и т.д.
По сравнению со средним содержанием в земной коре человечество в исключительно больших количествах извлекает углерод из недр (уголь, нефть, природный газ), т.к. эти ископаемые — основные источники энергии.
Углерод широко распространён также в космосе; на Солнце он занимает 4-е место после водорода, гелия и кислорода.
Физические и химические свойства:
Известны четыре кристаллические модификации углерода: графит, алмаз, карбин и лонсдейлит. Графит - серо-черная, непрозрачная, жирная на ощупь, чешуйчатая, очень мягкая масса с металлическим блеском. При комнатной температуре и нормальном давлении (0,1Мн/м2, или 1кгс/см2) графит термодинамически стабилен. Алмаз - очень твердое, кристаллическое вещество. Кристаллы имеют кубическую гранецентрированную решетку: а=3,560Á. При комнатной температуре и нормальном давлении алмаз метастабилен. Заметное превращение алмаза в графит наблюдается при температурах выше 1400°С в вакууме или в инертной атмосфере. При атмосферном давлении и температуре около 3700°С графит возгоняется. Жидкий углерод может быть получен при давлении выше 10,5Мн/м2(1051кгс/см2) и температурах выше 3700°С. Для твердого углерода (кокс, сажа, древесный уголь) характерно также состояние с неупорядоченной структурой “аморфный” углерод, который не представляет собой самостоятельной модификации; в основе его строения лежит структура мелкокристаллического графита. Нагревание некоторых разновидностей “аморфного” углерода выше 1500-1600°С без доступа воздуха вызывает их превращение в графит. Физические свойства “аморфный” углерода очень сильно зависят от дисперсности частиц и наличия примесей. Плотность, теплоемкость, теплопроводность и электропроводность “аморфный” углерода всегда выше, чем графита. Карбин получен искусственно. Он представляет собой мелкокристаллический порошок черного цвета (плотность 1,9 - 2г/см3). Построен из длинных цепочек атомов С, уложенных параллельно друг другу. Лонсдейлит найден в метеоритах и получен искусственно; его структура и свойства окончательно не установлены.
Конфигурация внешней оболочки атома углерода 2s22p2. Для углерода характерно образование четырех ковалентных связей, обусловленное возбуждение внешней электронной оболочки до состояния 2sp3. Поэтому углерод способен в равной степени как притягивать, так и отдавать электроны. Химическая связь может осуществляться за счет sp3-, sp2- и sp- гибридных орбиталей, которым соответствуют координационные числа 4,3 и 2. Число валентных электронов углерода и число валентных орбиталей одинаково; это одна из причин устойчивости связи между атомами углерода.
Уникальная способность атомов углерода соединяться между собой с образованием прочных и длинных цепей и циклов привела к возникновению громадного числа разнообразных соединений углерода, изучаемых органической химией.
В соединениях углерод проявляет степени окисления -4; +2; +4. Атомный радиус 0,77Á,ковалентные радиусы 0,77Á, 0,67Á, 0,60Á соответственно в одинарной, двойной и тройной связях; ионной радиус С4-2,60Á, С4+0,20Á. При обычных условиях углерод химически инертен, при высоких температурах он соединяется со многими элементами, проявляя сильные восстановительные свойства.
Все формы углерода устойчивы к щелочам и кислотам и медленно окисляются только очень сильными окислителями (хромовая смесь, смесь концентриров. HNO3и KCIO3и др.). “Аморфный” углерод реагирует с фтором при комнатной температуре, графит и алмаз - при нагревании. Непосредственно соединение углерода с хлором происходит в электрической дуге; с бромом и йодом углерод не реагирует, поэтому многочисленныеуглерода галогенидысинтезируют косвенным путем. Из оксигалогенидов общей формулы COX2(где Х - галоген) наиболее известная хлорокись COCI2(фосген).
При температурах выше 1000°С углерод взаимодействует со многими металлами, даваякарбиды.Все формы углерода при нагревании восстанавливают окислы металлов с образованием свободных металлов (Zn,Cd,Cu,Pb и др.) или карбидов (CaC2, Mo2C, WC, TaC и др.). Углерод реагирует при температурах выше 600 - 800°С с водяным паром и углекислым газом.
Все формы углерода нерастворимы в обычных неорганических и органических растворителях, но растворяются в некоторых расплавленных металлах (например, Fe, Ni, Co).
Народнохозяйственное значение:
Углерод определяется тем, что свыше 90 % всех первичных источников потребляемой в мире энергии приходится на органическоетопливо,главенствующая роль которого сохранится и на ближайшие десятилетия, несмотря на интенсивное развитие ядерной энергетики. Только около 10% добываемого топлива используется в качестве сырья дляосновного органического синтезаинефтехимического синтеза,для полученияпластичных масси др.
Углерод в организме:
Углерод - важнейший биогенный элемент, составляющий основу жизни на Земле, структурная единица огромного числа органических соединений, участвующих в построении организмов и обеспечении их жизнедеятельности (биополимеры, а также многочисленные низкомолекулярные биологически активные вещества - витамины, гормоны, медиаторы и др.). Значительную часть необходимой организмам энергии образуется в клетках за счет окисления углерода. Возникновение жизни на Земле рассматривается в современной науке как сложный процесс эволюции углеродистых соединений.
Уникальная роль углерода в живой природе обусловлена его свойствами, которыми в совокупности не обладает ни один другой элемент периодической системы. Между атомами углерода, а также между углеродом и другими элементами образуются прочные химические связи, которые, однако, могут быть разорваны в сравнительно мягких физиологических условиях (эти связи могут быть одинарными, двойными и тройными). Способность углерода образовывать 4 равнозначные валентные связи с другими атомами. Углерод создает возможность для построения углеродных скелетов различных типов - линейных, разветвленных, циклических. Показательно, что всего три элемента - С, О, Н - составляют 98 % общей массы живых организмов. Этим достигается определенная экономичность в живой природе: при практически безграничном структурном разнообразии углеродистых соединений небольшое число типов химических связей позволяет на много сократить количество ферментов, необходимых для расщепления и синтеза органических веществ. Особенности строения атома углерода лежит в основе различных видовизомерииорганических соединений (способность к оптической изомерии оказалась решающей в биохимической эволюции аминокислот, углеводов и некоторых алкалоидов).
Согласно гипотезе А. И.Опарина, первые органические соединения на Земле имели абиогенное происхождение. Источниками углерода служили (СН4)и цианистый водород (HCN),содержавшиеся в первичной атмосфере Земли. С возникновением жизни единственным источником неорганического углерода, за счет которого образуется всё органическое вещество биосферы, являетсяуглерода двуокись(СО2),находящийся в атмосфере, а также растворенная в природных водах в виде НСО3. Наиболее мощный механизм усвоения (ассимиляция) углерода (в форме СО2) -фотосинтез- осуществляется повсеместно зелеными растениями. На Земле существует и эволюционно более древний способ усвоения СО2путемхемосинтеза;в этом случае микроорганизмы - хемосинтетики используют не лучистую энергию Солнца, а энергию окисления неорганических соединений. Большинство животных потребляют углерод с пищей в виде уже готовых органических соединений. В зависимости от способа усвоения органических соединений принято различатьавтотрофные организмыигетеротрофные организмы.Применение для биосинтеза белка и других питательных веществ микроорганизмов, использующих в качестве единственного источника углерода,углеводородынефти, - одна из важных современных научно - технических проблем.
superbotanik.net
.
глерод (лат. Carboneum), С — химический элемент IV группы периодической системы Менделеева. Известны два стабильных изотопа 12 С (98,892 %) и 13 С (1,108 %).
Углерод известен с глубокой древности. Древесный уголь служил для восстановления металлов из руд, алмаз — как драгоценный камень. Значительно позднее стали применяться графит для изготовления тиглей и карандашей.
В 1778 К. Шееле, нагревая графит с селитрой, обнаружил, что при этом, как и при нагревании угля с селитрой, выделяется углекислый газ. Химический состав алмаза был установлен в результате опытов А.Лавуазье (1772) по изучения горения алмаза на воздухе и исследований С.Теннанта (1797), доказавшего, что одинаковые количества алмаза и угля дают при окислении равные количества углекислого газа. Углерод как химический элемент был признан только в 1789 А.Лавуазье. Латинское название сarboneum углерод получил от сarbo — уголь.
Распространение в природе:
Среднее содержание углерода в земной коре 2,3* 10-2 % по массе (1* 10 –2 в ультраосновных, 1* 10 –2 в основных, 2* 10 –2 в средних, 3* 10 –2 в кислых горных породах). Углерода накапливается в верхней части земной коры (биосфере): в живом веществе 18 % углерода, в древесине 50 %, в каменном угле 80 %, в нефти 85 %, антраците 96 %. Значит часть углерода литосферы сосредоточена в известняках и доломитах.
Число собственных минералов углерода — 112; исключительно велико число органических соединений углерода — углеводородов и их производных.
С накоплением углерода в земной коре связано накопление и многих других элементов, сорбируемых органическим веществом и осаждающихся в виде нерастворимых карбонатов и т.д.
По сравнению со средним содержанием в земной коре человечество в исключительно больших количествах извлекает углерод из недр (уголь, нефть, природный газ), т.к. эти ископаемые — основные источники энергии.
Углерод широко распространён также в космосе; на Солнце он занимает 4-е место после водорода, гелия и кислорода.
Физические и химические свойства:
Известны четыре кристаллические модификации углерода: графит, алмаз, карбин и лонсдейлит. Графит — серо-черная, непрозрачная, жирная на ощупь, чешуйчатая, очень мягкая масса с металлическим блеском. При комнатной температуре и нормальном давлении (0,1 Мн /м2, или 1кгс /см2 ) графит термодинамически стабилен. Алмаз — очень твердое, кристаллическое вещество. Кристаллы имеют кубическую гранецентрированную решетку: а= 3,560Á. При комнатной температуре и нормальном давлении алмаз метастабилен. Заметное превращение алмаза в графит наблюдается при температурах выше 1400° С в вакууме или в инертной атмосфере. При атмосферном давлении и температуре около 3700°С графит возгоняется. Жидкий углерод может быть получен при давлении выше 10,5 Мн /м2 (1051 кгс /см2 ) и температурах выше 3700°С. Для твердого углерода (кокс, сажа, древесный уголь) характерно также состояние с неупорядоченной структурой “аморфный” углерод, который не представляет собой самостоятельной модификации; в основе его строения лежит структура мелкокристаллического графита. Нагревание некоторых разновидностей “аморфного” углерода выше 1500-1600°С без доступа воздуха вызывает их превращение в графит. Физические свойства “аморфный” углерода очень сильно зависят от дисперсности частиц и наличия примесей. Плотность, теплоемкость, теплопроводность и электропроводность “аморфный” углерода всегда выше, чем графита. Карбин получен искусственно. Он представляет собой мелкокристаллический порошок черного цвета (плотность 1,9 — 2г /см3 ). Построен из длинных цепочек атомов С, уложенных параллельно друг другу. Лонсдейлит найден в метеоритах и получен искусственно; его структура и свойства окончательно не установлены.
Конфигурация внешней оболочки атома углерода 2s2 2p2. Для углерода характерно образование четырех ковалентных связей, обусловленное возбуждение внешней электронной оболочки до состояния 2sp3. Поэтому углерод способен в равной степени как притягивать, так и отдавать электроны. Химическая связь может осуществляться за счет sp3 -, sp2 — и sp- гибридных орбиталей, которым соответствуют координационные числа 4,3 и 2. Число валентных электронов углерода и число валентных орбиталей одинаково; это одна из причин устойчивости связи между атомами углерода.
Уникальная способность атомов углерода соединяться между собой с образованием прочных и длинных цепей и циклов привела к возникновению громадного числа разнообразных соединений углерода, изучаемых органической химией.
В соединениях углерод проявляет степени окисления -4; +2; +4. Атомный радиус 0,77Á, ковалентные радиусы 0,77Á, 0,67Á, 0,60Á соответственно в одинарной, двойной и тройной связях; ионной радиус С4- 2,60Á, С4+ 0,20Á. При обычных условиях углерод химически инертен, при высоких температурах он соединяется со многими элементами, проявляя сильные восстановительные свойства.
Все формы углерода устойчивы к щелочам и кислотам и медленно окисляются только очень сильными окислителями (хромовая смесь, смесь концентриров. HNO3 и KCIO3 и др.). “Аморфный” углерод реагирует с фтором при комнатной температуре, графит и алмаз — при нагревании. Непосредственно соединение углерода с хлором происходит в электрической дуге; с бромом и йодом углерод не реагирует, поэтому многочисленные углерода галогениды синтезируют косвенным путем. Из оксигалогенидов общей формулы COX2 (где Х — галоген) наиболее известная хлорокись COCI2 (фосген).
При температурах выше 1000°С углерод взаимодействует со многими металлами, давая карбиды. Все формы углерода при нагревании восстанавливают окислы металлов с образованием свободных металлов (Zn,Cd,Cu,Pb и др.) или карбидов (CaC2, Mo2 C, WC, TaC и др.). Углерод реагирует при температурах выше 600 — 800°С с водяным паром и углекислым газом.
Все формы углерода нерастворимы в обычных неорганических и органических растворителях, но растворяются в некоторых расплавленных металлах (например, Fe, Ni, Co).
Народнохозяйственное значение:
Углерод определяется тем, что свыше 90 % всех первичных источников потребляемой в мире энергии приходится на органическое топливо, главенствующая роль которого сохранится и на ближайшие десятилетия, несмотря на интенсивное развитие ядерной энергетики. Только около 10% добываемого топлива используется в качестве сырья для основного органического синтеза и нефтехимического синтеза, для получения пластичных масс и др.
Углерод в организме:
Углерод — важнейший биогенный элемент, составляющий основу жизни на Земле, структурная единица огромного числа органических соединений, участвующих в построении организмов и обеспечении их жизнедеятельности (биополимеры, а также многочисленные низкомолекулярные биологически активные вещества — витамины, гормоны, медиаторы и др.). Значительную часть необходимой организмам энергии образуется в клетках за счет окисления углерода. Возникновение жизни на Земле рассматривается в современной науке как сложный процесс эволюции углеродистых соединений.
Уникальная роль углерода в живой природе обусловлена его свойствами, которыми в совокупности не обладает ни один другой элемент периодической системы. Между атомами углерода, а также между углеродом и другими элементами образуются прочные химические связи, которые, однако, могут быть разорваны в сравнительно мягких физиологических условиях (эти связи могут быть одинарными, двойными и тройными). Способность углерода образовывать 4 равнозначные валентные связи с другими атомами. Углерод создает возможность для построения углеродных скелетов различных типов — линейных, разветвленных, циклических. Показательно, что всего три элемента — С, О, Н — составляют 98 % общей массы живых организмов. Этим достигается определенная экономичность в живой природе: при практически безграничном структурном разнообразии углеродистых соединений небольшое число типов химических связей позволяет на много сократить количество ферментов, необходимых для расщепления и синтеза органических веществ. Особенности строения атома углерода лежит в основе различных видов изомерии органических соединений (способность к оптической изомерии оказалась решающей в биохимической эволюции аминокислот, углеводов и некоторых алкалоидов).
Согласно гипотезе А. И. Опарина, первые органические соединения на Земле имели абиогенное происхождение. Источниками углерода служили (СН4 )и цианистый водород (HCN), содержавшиеся в первичной атмосфере Земли. С возникновением жизни единственным источником неорганического углерода, за счет которого образуется всё органическое вещество биосферы, является углерода двуокись (СО2 ), находящийся в атмосфере, а также растворенная в природных водах в виде НСО3. Наиболее мощный механизм усвоения (ассимиляция) углерода (в форме СО2 ) — фотосинтез — осуществляется повсеместно зелеными растениями. На Земле существует и эволюционно более древний способ усвоения СО2 путем хемосинтеза; в этом случае микроорганизмы — хемосинтетики используют не лучистую энергию Солнца, а энергию окисления неорганических соединений. Большинство животных потребляют углерод с пищей в виде уже готовых органических соединений. В зависимости от способа усвоения органических соединений принято различать автотрофные организмы и гетеротрофные организмы. Применение для биосинтеза белка и других питательных веществ микроорганизмов, использующих в качестве единственного источника углерода, углеводороды нефти, — одна из важных современных научно — технических проблем.
www.ronl.ru
Углерод.
Углерод (Carboneum), С — химический элемент IV группы, побочной подгруппы, 2-го периодапериодической системы Д. И. Менделеева, порядковый номер 6. Относительнаяатомная масса: 12,011. Электроотрицательность: 2,6. Температура плавления: 3370єС(сгорает). Температура кипения: 4200єС. Плотность (графит): 2,27 г/смі. Число собственных минералов углерода — 112;исключительно велико число органических соединений углерода — углеводородов иих производных. Углерод находится в природе как в свободном состоянии (в видеалмаза, графита), так и в виде соединений (содержится в горючих сланцах, буроми каменном углях, торфе и в виде соединений в нефти, природных горючих газах, вкарбонатах). Все живые организмы построены из соединений углерода. Углеродшироко распространен, но содержание его в земной коре всего 0,19%; такжеуглерод широко распространён в космосе; на Солнце он занимает 4-е место послеводорода, гелия и кислорода. По сравнению со средним содержанием в земной коречеловечество в исключительно больших количествах извлекает углерод из недр(уголь, нефть, природный газ), так как эти ископаемые — основной источникэнергии.
Историческая справка. В 1778 К. Шееле, нагревая графит с селитрой,обнаружил, что при этом, как и при нагревании угля с селитрой, выделяетсяуглекислый газ. Химический состав алмаза был установлен в результате опытов А.Лавуазье (1772) по изучению горения алмаза на воздухе и исследований С.Теннанта (1797), доказавшего, что одинаковые количества алмаза и угля дают приокислении равные количества углекислого газа. Углерод был признан химическимэлементом в 1789 Лавуазье. Латинское название «carboneum» углеродполучил от «carbo» — уголь. А в 1961 Международные союзытеоретической и прикладной химии (ИЮПАК) и по физике приняли за единицу атомноймассы массу изотопа углерода 12C, упразднив существовавшую до того кислороднуюшкалу атомных масс. Атомная масса углерода в этой системе равна 12,011, так какона является средней для трех природных изотопов углерода с учетом ихраспространенности в природе.
Углерод известен с древности.Издавна известно, что графитом можно маркировать другой материал, и самоназвание «графит», происходящее от греческого слова, означающего «писать», предложеноА.Вернером в 1789. Однако история графита запутана, часто за него принималивещества, обладающие сходными внешними физическими свойствами, напримермолибденит (сульфид молибдена), одно время считавшийся графитом. Среди другихназваний графита известны «черный свинец», «карбидное железо», «серебристыйсвинец». В 1779 К.Шееле установил, что графит можно окислить воздухом собразованием углекислого газа.
Алмазы впервые нашлиприменение в Индии, а в Бразилии драгоценные камни приобрели коммерческоезначение в 1725; месторождения в Южной Африке были открыты в 1867. В XX векеосновными производителями алмазов являются ЮАР, Заир, Ботсвана, Намибия,Ангола, Сьерра-Леоне, Танзания и Россия. Искусственные алмазы, технологиякоторых была создана в 1970, производятся для промышленных целей.
Физические и химическиесвойства.Известны четыре кристаллические модификации углерода:графит, алмаз, карбин и лонсдейлит. Графит — серо-чёрная,непрозрачная, жирная на ощупь, чешуйчатая, очень мягкая масса с металлическимблеском, обладает электропроводимостью. Атомы расположены параллельными слоями,образуя гексагональную решетку. Внутри слоя атомы связаны сильнее, чем одинслой с другим, поэтому графит может расслаиваться. Сгорает при 700єС врисутствии кислорода. Встречается в природе; получается искусственно. Привысокой температуре, давлении и рисутствии катализатора (марганец Mn,хром Cr, платиновые металлы) графит превращается в алмаз. Алмаз — минерал, имеющий желтоватый, белый, серый, зеленоватый, реже голубой и черныйцвет. Не проводит электрический ток, плохо проводит тепло. В кристалле атомыуглерода образуют непрерывный трехмерный каркас, состоящий из сочлененныхтетраэдров, что обеспечивает высокую прочность связей. Алмаз — это самоетвердое вещество из всех известных. Температура плавления выше 3500єС.Химически стоек. Сгорает при 870єС в присутствии кислорода. При 1800єС вотсутствие кислорода превращается в графит. Прозрачные кристаллы; послеобработки — бриллианты. Добывают из россыпей и коренных месторождений.Синтетический алмаз получают из графита при высоких давлении и температуре. Ончаще полупрозрачный или непрозрачный; имеет кристаллическую структуру исвойства природного алмаза.Жидкий углерод может быть получен придавлениях выше 10,5 Мн/мІ (105 кгс/смІ) итемпературах выше 3700єС. Кокс, сажа, древесный уголь (твердый углерод)имеют то же строение, что и графит.Для твёрдого углерода характерно такжесостояние с неупорядоченной структурой — так называемый «аморфный»углерод, который не представляет собой самостоятельной модификации; воснове его строения лежит структура мелкокристаллического графита. Нагреваниенекоторых разновидностей «аморфного» углерода выше 1500-1600єС бездоступа воздуха вызывает их превращение в графит. Физические свойства«аморфного» углерода очень сильно зависят от дисперсности частиц иналичия примесей. Плотность, теплоёмкость, теплопроводность иэлектропроводность «аморфного» углерода всегда выше, чем графита. Карбинполучен искусственно. Он представляет собой мелкокристаллический порошокчёрного цвета (плотность = 2 г/смі).Построен из длинных цепочек атомов С, уложенных параллельно друг другу. Лонсдейлитнайден в метеоритах и получен искусственно; его структура и свойстваокончательно не установлены.
/>
/>
А Б
Структура алмаза(а) и графита (б).
Конфигурация внешней электронной оболочки атомауглерода2sІ2pІ.Для углерода характерно образование четырёх ковалентных связей, обусловленноевозбуждением внешней электронной оболочки до состояния 2spі. Химическая связь может осуществляться за счет sp3-, sp2 — и sp — гибридных орбиталей, которым соответствуют координационные числа 4, 3 и 2.Число валентных электронов углерода и число валентных орбиталей одинаково; этоодна из причин устойчивости связи между атомами углерода.
/>
Строение атомауглерода.
Уникальная способность атомовуглерода соединяться между собой с образованием прочных и длинных цепей ициклов привела к возникновению громадного числа разнообразных соединенийуглерода (углеводородов), изучаемых органической химией.
В соединениях углеродпроявляет степени окисления -4; +2; +4. Атомный радиус 0,77Б, ковалентные радиусы 0,77Б, 0,67Б, 0,60Б соответственно в одинарной, двойной и тройной связях;ионной радиус
С4- 2,60Б, С4+ 0,20Б. Приобычных условиях углерод химически инертен, при высоких температурах онсоединяется со многими элементами, проявляя сильные восстановительные свойства.Химическая активность убывает в ряду: «аморфный» углерод, графит,алмаз; взаимодействие с кислородом воздуха (горение) происходит соответственнопри температурах выше 300-500єС, 600-700єС и 850-1000єС с образованием двуокисиуглерода CO2 и окиси углерода CO.
CO2 растворяется вводе с образованием угольной кислоты. В 1906 О. Дильс получил недоокисьуглерода C3O2. Все формы углерода устойчивы к щелочам и кислотам и медленноокисляются только очень сильными окислителями (хромовая смесь, смеськонцентрированных HNO3 и KClO3 и др.). «Аморфный» углеод реагирует с фторомпри комнатной температуре, графит и алмаз — при нагревании. Непосредственноесоединение углерода с хлором происходит в электрической дуге; с бромоми иодом углерод не реагирует, поэтому многочисленные галогениды углеродасинтезируют косвенным путём. Из оксигалогенидов общей формулы COX2 (где Х — галоген) наиболее известна хлорокись COCl2 (фосген). Водород с алмазом невзаимодействует; с графитом и «аморфным» углеродом реагирует привысоких температурах в присутствии катализаторов (никель Ni, платина Pt): при600-1000єС образуется в основном метан Ch5, при 1500-2000єС — ацетилен C2h3, в продуктахмогут присутствовать также другие углеводороды, например этан C2H6, бензол C6H6. Взаимодействиесеры с «аморфным» углеродом и графитом начинается при 700-800єС,с алмазом при 900-1000єС; во всех случаях образуется сероуглерод CS2. Другиесоединения углерода, содержащие серу (тиоокись CS, тионедоокись C3S2, сероокись COSи тиофосген CSCl2), получают косвенным путём. При взаимодействии CS2 с сульфидамиметаллов образуются тиокарбонаты — соли слабой тиоугольной кислоты.Взаимодействие углерода с азотом с получением циана (CN)2 происходит припропускании электрического разряда между угольными электродами в атмосфереазота. Среди азотсодержащих соединений углерода важное практическое значениеимеют цианистый водород HCN и его многочисленные производные: цианиды,гало-генцианы, нитрилы и др. При температурах выше 1000єС углеродвзаимодействует со многими металлами, давая карбиды. Все формы углеродапри нагревании восстанавливают окислы металлов с образованием свободныхметаллов (Zn, Cd, Cu, Pb и др.) или карбидов (CaC2, Mo2C, WC, TaC и др.). Углерод реагирует при температурах выше 600-800°С с водяным паром и углекислым газом. Отличительнойособенностью графита является способность при умеренном нагревании до 300-400єСвзаимодействовать со щелочными металлами и галогенидами с образованиемсоединений включения типа C8Me, C24Me, C8X (где Х — галоген, Me — металл). Известны соединениявключения графита с HNO3, h3SO4, FeCl3 и другие (например, бисульфат графита C24SO4h3). Все формыуглерода нерастворимы в обычных неорганических и органических растворителях,но растворяются в некоторых расплавленных металлах (например, железо Fe, никельNi, кобальт Co).
Изотопы углерода. В природе известно семь изотопов углерода, из которыхсущественную роль играют три. Два из них — /> и /> - являются стабильными, а один — /> - радиоактивным (в организме человека его содержитсяоколо 0,1мккюри). С использованием изотопов углерода в биологических имедицинских исследованиях связаны многие крупные достижения в изучении обменавеществ и круговорота углерода в природе. Так, с помощью радиоуглеродной меткибыла доказана возможность фиксации Н14СО3 растениями и тканями животных,установлена последовательность реакции фотосинтеза, изучен обмен аминокислот,прослежены пути биосинтеза многих биологически активных соединений и т. д.Применение 14С способствовало успехам молекулярной биологии в изучениимеханизмов биосинтеза белка и передачи наследственной информации. Определениеудельной активности 14С в углеродсодержащих органических остатках позволяетсудить об их возрасте, что используется в палеонтологии и археологии.
Углерод в организме. Углерод — важнейший биогенный элемент, составляющийоснову жизни на Земле, структурная единица огромного числа органическихсоединений, участвующих в построении организмов и обеспечении ихжизнедеятельности (биополимеры, а также многочисленные низкомолекулярныебиологически активные вещества — витамины, гормоны, медиаторы и др.).Значительная часть необходимой организмам энергии образуется в клетках за счётокисления углерода. Возникновение жизни на Земле рассматривается в современнойнауке как сложный процесс эволюции углеродистых соединений.
Содержание углерода в живыхорганизмах в расчёте на сухое вещество составляет: 34,5-40% у водных растений иживотных, 45,4-46,5% у наземных растений и животных и 54% у бактерий.
Роль углерода в живойприроде. Уникальная роль углеродав живой природе обусловлена его свойствами, которыми в совокупности не обладаетни один другой элемент периодической системы. Между атомами углерода, а такжемежду углеродом и другими элементами образуются прочные химические связи,которые, однако, могут быть разорваны в сравнительно мягких физиологическихусловиях (эти связи могут быть одинарными, двойными и тройными). Способностьуглерода образовывать 4 равнозначные валентные связи с другими атомами углеродасоздаёт возможность для построения углеродных скелетов различных типов — линейных, разветвленных, циклических. Показательно, что всего три элемента — углерод С, кислород О и водород Н — составляют 98% общей массы живыхорганизмов. Этим достигается определённая экономичность в живой природе: припрактически безграничном структурном разнообразии углеродистых соединенийнебольшое число типов химических связей позволяет намного сократить количествоферментов, необходимых для расщепления и синтеза органических веществ.Особенности строения атома углерода лежат в основе различных видов изомерииорганических соединений (способность к оптической изомерии оказалась решающей вбиохимической эволюции аминокислот, углеводов и некоторых алкалоидов).
Согласно общепринятойгипотезе А. И. Опарина, первые органические соединения на Земле имелиабиогенное происхождение. Источниками углерода служили метан (Ch5) и цианистыйводород (HCN), содержавшиеся в первичной атмосфере Земли. С возникновениемжизни единственным источником неорганического углерода, за счёт которогообразуется всё органическое вещество биосферы, является двуокись углерода (CO2), находящаяся ватмосфере, а также растворённая в природных водах в виде HCO-3. Наиболее мощный механизм усвоения (ассимиляции)углерода (в форме CO2) — фотосинтез — осуществляется повсеместно зелёнымирастениями (ежегодно ассимилируется около 100 млрд. т CО2). На Землесуществует и эволюционно более древний способ усвоения CO2 путёмхемосинтеза; в этом случае микроорганизмы-хемосинтетики используют не лучистуюэнергию Солнца, а энергию окисления неорганических соединений. Большинствоживотных потребляют углерод с пищей в виде уже готовых органических соединений.В зависимости от способа усвоения органических соединений принято различатьавтотрофные организмы и гетеротрофные организмы. Применение для биосинтезабелка и других питательных веществ микроорганизмов, использующих в качествеединственного источника углерода углеводороды нефти,- одна из важныхсовременных научно-технических проблем.
Помимо основной функции — источника углерода — двуокись углерода CO2, растворённая в природных водах и в биологическихжидкостях, участвует в поддержании оптимальной для жизненных процессовкислотности среды. В составе CaCO3 углерод образует наружный скелет многихбеспозвоночных (например, раковины моллюсков), а также содержится в кораллах,яичной скорлупе птиц и др. Такие соединения углерода, как HCN, CO, CCl4, преобладавшиев первичной атмосфере Земли в добиологический период, в дальнейшем, в процессебиологической эволюции, превратились в сильные антиметаболиты обмена веществ.
Круговорот углерода. Углерод — основной биогенный элемент; он играетважнейшую роль в образовании живого вещества биосферы. Углекислый газ изатмосферы в процессе фотосинтеза, осуществляемого зелёными растениями,ассимилируется и превращается в разнообразные и многочисленные органическиесоединения растений. Растительные организмы, особенно низшие микроорганизмы,морской фитопланктон, благодаря исключительной скорости размножения продуцируютв год около 1,5·10№№ т углерода в виде органической массы, чтосоответствует
5,86·10Іє Дж (1,4·10Ієкал) энергии. Растения частично поедаютсяживотными (при этом образуются более или менее сложные пищевые цепи). Вконечном счёте органическое вещество в результате дыхания организмов,разложения их трупов, процессов брожения, гниения и горения превращается вуглекислый газ или отлагается в виде сапропеля, гумуса, торфа, которые, в своюочередь, дают начало многим др. каустобиолитам — каменным углям, нефти, горючимгазам.
/>
Круговоротуглерода.
В процессах распадаорганических веществ, их минерализации огромную роль играют бактерии (например,гнилостные), а также многие грибы (например, плесневые).
В активном круговоротеуглерода участвует очень небольшая часть всей его массы. Огромное количествоугольной кислоты законсервировано в виде ископаемых известняков и других пород.Между углекислым газом атмосферы и водой океана, в свою очередь, существуетподвижное равновесие.
Таблица: Содержаниеуглерода на поверхности Земли и в земной коре (16 км мощности)
Вт В г на 1 смІ поверхности Земли
Животные 5·109 0,0015
Растения 5·10№№ 0,1
Атмосфера 6,4·10№№ 0,125
Океан 3,8·10№і 7,5
Массивные кристаллические
породы: базальты и др. 1,7·1014 33,0
основные породы
Граниты, гранодиориты 2,9·1015 567
Угли, нефти и другие
каустобиолиты 6,4·1015 663
Кристаллические сланцы 1·1016 2000
Карбонаты 1,3·1016 2500
Всего 3,2·1016 5770
Многие водные организмыпоглощают углекислый кальций, создают свои скелеты, а затем из них образуютсяпласты известняков. Из атмосферы было извлечено и захоронено в десятки тысячраз больше углекислого газа, чем в ней находится в данный момент. Атмосферапополняется углекислым газом благодаря процессам разложения органическоговещества, карбонатов и др., а также, всё в большей мере, в результатеиндустриальной деятельности человека. Особенно мощным источником являютсявулканы, газы которых состоят главным образом из углекислого газа и паров воды.Некоторая часть углекислого газа и воды, извергаемых вулканами, возрождается изосадочных пород, в частности известняков, при контакте магмы с ними и ихассимиляции магмой. В процессе круговорота углерода происходит неоднократноефракционирование его по изотопному составу (№ІC — №іC), особенно вмагматогенном процессе (образование CO2, алмазов, карбонатов), при биогенном образованииорганического вещества (угля, нефти, тканей организмов и др.).
Применение углерода. Углерод широко используется в виде простых веществ.Драгоценный алмаз является предметом ювелирных украшений; непрозрачныйалмаз — ценный абразив, а так же материал для изготовления резцов и другогоинструмента. Древесный уголь и другие аморфные формы углеродаприменяются для обесцвечивания, очистки, адсорбции газов, в областях техники,где требуются адсорбенты с развитой поверхностью. Графит применяют дляизготовления плавильных тиглей, футеровочных плит, электродов, твердыхсмазочных материалов; в ракетной технике; как замедлитель нейтронов в ядерныхреакторах; компонент состава для изготовления стержней для арандашей; дляполучения алмаза; наполнитель пластмасс. Каменноугольный коксиспользуется в черной металлургии в качестве топлива и восстановителя вдоменных печах и вагранках. Нефтяной и электродный пековый кокс применяется дляизготовления угольных и графитированных электродов, реже — как топливо. Сажа(технический углерод) применяется как наполнитель в производстве резины,пластмасс; пигмент в лакокрасочной промышленности; для изготовления электродови т. п. Карбиды, соединения углерода с металлами, а также с бором икремнием (например, Al4C3, SiC, B4C) отличаются высокой твердостью и используются дляизготовления абразивного и режущего инструмента. Углерод применяется дляполучения металлов из их оксидов. Углерод входит в состав сталей и сплавов вэлементном состоянии и в виде карбидов. Насыщение поверхности стальных отливокуглеродом при высокой температуре (цементация) значительно увеличиваетповерхностную твердость и износостойкость.
/>
Применение алмазав ювелирных украшениях,
графита вкарандашах.
Список литературы: 1)«Большая школьная энциклопедия», т. 2, изд. «Олма-пресс»
2) Интернет: www.encycl.yandex.ru, www.krugosvet.ru, www.informika.ru.
www.ronl.ru
Распространение в природе:
Среднее содержание углерода в земной коре 2,3*10-2 % по массе (1*10 –2 в ультраосновных, 1*10 –2 в основных, 2*10 –2 в средних, 3*10 –2 в кислых горных породах). Углерода накапливается в верхней части земной коры (биосфере): в живом веществе 18 % углерода, в древесине 50 %, в каменном угле 80 %, в нефти 85 %, антраците 96 %. Значит часть углерода литосферы сосредоточена в известняках и доломитах. Число собственных минералов углерода - 112; исключительно велико число органических соединений углерода - углеводородов и их производных. С накоплением углерода в земной коре связано накопление и многих других элементов, сорбируемых органическим веществом и осаждающихся в виде нерастворимых карбонатов и т.д. По сравнению со средним содержанием в земной коре человечество в исключительно больших количествах извлекает углерод из недр (уголь, нефть, природный газ), т.к. эти ископаемые — основные источники энергии. Углерод широко распространён также в космосе; на Солнце он занимает 4-е место после водорода, гелия и кислорода.
Физические и химические свойства:
Известны четыре кристаллические модификации углерода: графит, алмаз, карбин и лонсдейлит. Графит - серо-черная, непрозрачная, жирная на ощупь, чешуйчатая, очень мягкая масса с металлическим блеском. При комнатной температуре и нормальном давлении (0,1 Мн/м2, или 1кгс/см2) графит термодинамически стабилен. Алмаз - очень твердое, кристаллическое вещество. Кристаллы имеют кубическую гранецентрированную решетку: а=3,560(. При комнатной температуре и нормальном давлении алмаз метастабилен. Заметное превращение алмаза в графит наблюдается при температурах выше 1400(С в вакууме или в инертной атмосфере. При атмосферном давлении и температуре около 3700(С графит возгоняется. Жидкий углерод может быть получен при давлении выше 10,5 Мн/м2 (1051 кгс/см2) и температурах выше 3700(С. Для твердого углерода (кокс, сажа, древесный уголь) характерно также состояние с неупорядоченной структурой “аморфный” углерод, который не представляет собой самостоятельной модификации; в основе его строения лежит структура мелкокристаллического графита. Нагревание некоторых разновидностей “аморфного” углерода выше 1500-1600(С без доступа воздуха вызывает их превращение в графит. Физические свойства “аморфный” углерода очень сильно зависят от дисперсности частиц и наличия примесей. Плотность, теплоемкость, теплопроводность и электропроводность “аморфный” углерода всегда выше, чем графита. Карбин получен искусственно. Он представляет собой мелкокристаллический порошок черного цвета (плотность 1,9 - 2 г/см3). Построен из длинных цепочек атомов С, уложенных параллельно друг другу. Лонсдейлит найден в метеоритах и получен искусственно; его структура и свойства окончательно не установлены. Конфигурация внешней оболочки атома углерода 2s22p2. Для углерода характерно образование четырех ковалентных связей, обусловленное возбуждение внешней электронной оболочки до состояния 2sp3. Поэтому углерод способен в равной степени как притягивать, так и отдавать электроны. Химическая связь может осуществляться за счет sp3-, sp2- и sp- гибридных орбиталей, которым соответствуют координационные числа 4,3 и 2. Число валентных электронов углерода и число валентных орбиталей одинаково; это одна из причин устойчивости связи между атомами углерода. Уникальная способность атомов углерода соединяться между собой с образованием прочных и длинных цепей и циклов привела к возникновению громадного числа разнообразных соединений углерода, изучаемых органической химией. В соединениях углерод проявляет степени окисления -4; +2; +4. Атомный радиус 0,77(,ковалентные радиусы 0,77(, 0,67(, 0,60( соответственно в одинарной, двойной и тройной связях; ионной радиус С4- 2,60(, С4+ 0,20(. При обычных условиях углерод химически инертен, при высоких температурах он соединяется со многими элементами, проявляя сильные восстановительные свойства. Все формы углерода устойчивы к щелочам и кислотам и медленно окисляются только очень сильными окислителями (хромовая смесь, смесь концентриров. HNO3 и KCIO3 и др.). “Аморфный” углерод реагирует с фтором при комнатной температуре, графит и алмаз - при нагревании. Непосредственно соединение углерода с хлором происходит в электрической дуге; с бромом и йодом углерод не реагирует, поэтому многочисленные углерода галогениды синтезируют косвенным путем. Из оксигалогенидов общей формулы COX2 (где Х - галоген) наиболее известная хлорокись COCI2 (фосген). При температурах выше 1000(С углерод взаимодействует со многими металлами, давая карбиды. Все формы углерода при нагревании восстанавливают окислы металлов с образованием свободных металлов (Zn, Cd, Cu, Pb и др.) или карбидов (CaC2, Mo2C, WC, TaC и др.). Углерод реагирует при температурах выше 600 - 800(С с водяным паром и углекислым газом. Все формы углерода нерастворимы в обычных неорганических и органических растворителях, но растворяются в некоторых расплавленных металлах (например, Fe, Ni, Co). Народнохозяйственное значение: Углерод определяется тем, что свыше 90 % всех первичных источников потребляемой в мире энергии приходится на органическое топливо, главенствующая роль которого сохранится и на ближайшие десятилетия, несмотря на интенсивное развитие ядерной энергетики. Только около 10% добываемого топлива используется в качестве сырья для основного органического синтеза и нефтехимического синтеза, для получения пластичных масс и др. Углерод в организме: Углерод - важнейший биогенный элемент, составляющий основу жизни на Земле, структурная единица огромного числа органических соединений, участвующих в построении организмов и обеспечении их жизнедеятельности (биополимеры, а также многочисленные низкомолекулярные биологически активные вещества - витамины, гормоны, медиаторы и др.). Значительную часть необходимой организмам энергии образуется в клетках за счет окисления углерода. Возникновение жизни на Земле рассматривается в современной науке как сложный процесс эволюции углеродистых соединений. Уникальная роль углерода в живой природе обусловлена его свойствами, которыми в совокупности не обладает ни один другой элемент периодической системы. Между атомами углерода, а также между углеродом и другими элементами образуются прочные химические связи, которые, однако, могут быть разорваны в сравнительно мягких физиологических условиях (эти связи могут быть одинарными, двойными и тройными). Способность углерода образовывать 4 равнозначные валентные связи с другими атомами. Углерод создает возможность для построения углеродных скелетов различных типов - линейных, разветвленных, циклических. Показательно, что всего три элемента - С, О, Н - составляют 98 % общей массы живых организмов. Этим достигается определенная экономичность в живой природе: при практически безграничном структурном разнообразии углеродистых соединений небольшое число типов химических связей позволяет на много сократить количество ферментов, необходимых для расщепления и синтеза органических веществ. Особенности строения атома углерода лежит в основе различных видов изомерии органических соединений (способность к оптической изомерии оказалась решающей в биохимической эволюции аминокислот, углеводов и некоторых алкалоидов). Согласно гипотезе А. И. Опарина, первые органические соединения на Земле имели абиогенное происхождение. Источниками углерода служили (СН4)и цианистый водород (HCN),содержавшиеся в первичной атмосфере Земли. С возникновением жизни единственным источником неорганического углерода, за счет которого образуется всё органическое вещество биосферы, является углерода двуокись (СО2),находящийся в атмосфере, а также растворенная в природных водах в виде НСО3. Наиболее мощный механизм усвоения (ассимиляция) углерода (в форме СО2) - фотосинтез - осуществляется повсеместно зелеными растениями. На Земле существует и эволюционно более древний способ усвоения СО2 путем хемосинтеза; в этом случае микроорганизмы - хемосинтетики используют не лучистую энергию Солнца, а энергию окисления неорганических соединений. Большинство животных потребляют углерод с пищей в виде уже готовых органических соединений. В зависимости от способа усвоения органических соединений принято различать автотрофные организмы и гетеротрофные организмы. Применение для биосинтеза белка и других питательных веществ микроорганизмов, использующих в качестве единственного источника углерода, углеводороды нефти, - одна из важных современных научно - технических проблем. Помимо стабильных изотопов углерода, в природе распространен радиоактивный 14С (в организме человека его содержится около 0,1мккюри). С использованием изотопов углерода в биологических и медицинских исследованиях связаны многие крупные достижения в изучении обмена веществ и круговорота углерода в природе. Так, с помощью радиоуглеродной метки была доказана возможность фиксации Н14СО3 растениями и тканями животных, установлена последовательность реакции фотосинтеза, изучен обмен аминокислот, прослежены пути биосинтеза многих биологически активных соединений и т. д. Применение 14С способствовало успехам молекулярной биологии в изучении механизмов биосинтеза белка и передачи наследственной информации. Определение удельной активности 14С в углеродсодержащих органических остатках позволяет судить об их возрасте, что используется в палеонтологии и археологии.
1
www.ronl.ru
Реферат по химии
УГЛЕРОД И ЕГО СОЕДИНЕННИЯ
УГЛЕРОД И ЕГО СОЕДИНЕНИЯ.
Углерод как простое вещество.
В атоме углерода на его внешних четырех АО имеется четыре электрона. Поэтому все четыре АО принимают участие в образовании химических связей. Этим объясняется разнообразие и многочисленность соединений углерода.
Подавляющее большинство соединений углерода относят к так называемым органическим веществам. В этом разделе рассмотрим свойства неорганических веществ, образуемых углеродом, - простых веществ, его оксидов, угольной кислоты и некоторых ее солей.
Углерод образует несколько простых веществ. Среди них пока важнейшими считаются алмаз и графит. Эти аллотропные модификации имеют атомные кристаллические решетки, которые различаются своими структурами. Отсюда отличие их физических и химических свойств.
В алмазе каждый атом углерода связан с четырьмя другими атомами. В пространстве эти атомы располагаются в центре и углах тетраэдров, соединенных своими вершинами. Это очень симметричная и прочная решетка. Алмаз – это самое твердое вещество на Земле.
В графите каждый атом соединен с тремя другими, лежащими в той же плоскости. На образование этих связей затрачивается по три АО с тремя электронами. Четвертая орбиталь 2р-АО с одним электроном располагается перпендикулярно плоскости. Эти оставшиеся атомные орбиталь всей сетки перекрываются между собой, образуя зону молекулярных орбиталей. Эта зона занята не полностью, а наполовину, что обеспечивает металлическую электропроводность графита (в отличие от алмаза).
Помимо электропроводности графит обладает еще тремя практически важными свойствами.
Во-первых, тугоплавкость. Температура плавления графита выше 3500 С – это самое тугоплавкое простое вещество на Земле.
Во-вторых, отсутствие на его поверхности каких-либо продуктов взаимодействия с окружающей средой (на металлах это оксиды), увеличивающих электрическое сопротивление.
В-третьих, способность оказывать смазывающее действие на трущиеся поверхности. В кристалле графита атомы углерода прочно связаны между собой в плоских сетках, а связь между сетками слабая, она имеет межмолекулярную природу, как в веществах с молекулярными решетками. Поэтому уже небольшие механические усилия вызывают смещение сеток относително друг друга, что и обусловливает действие графита как смазки.
Энергия связи между атомами углерода в простых и сложных веществах, в том числе и в алмазе, и в графите. Очень велика. О твердости алмаза уже говорили. Прочна связь между атомами и в графитовой сетке. Так, прочность на разрыв волокна из графита значительно превышает прочность железа и технической стали.
На основе графита изготавливают так называемые композиционные материалы, в частности углепластики, в которых волокна графита находятся на матрице из эпоксидной смолы. Композиционные материалы все шире применяются в авиационной и космической технике (ведь помимо прочности они легкие; сравним плотность графита, р=2,3 г/см3 ,с плотностью «легкого» алюминия, р=2,7г/см3, и тем более железа, р=7,9г/см3), а также в судостроении, где особенно ценна коррозионная стойкость.
| Углерод | Соединения углерода | |
| Оксид углерода (1У) | Угольная кислота | |
получение неполное сжигание метана: СН4+О2=С+2Н2О |
CO2+Ca(OH)2=CaCO3+h4O 5.Реагирует с основными оксидами: CO2+CaO=CaCO3 6.Образуется в реакциях а) горения углерода в кислороде: C+O2=CO2 б) окисления оксида углерода (II): 2CO+O2=2CO2 в) сгорания метана: CH5+O2=CO2+2h4O г) взаимодействие кислот с карбонатами: CaCO3+2HCI=CaCI2+CO2+h4O д) термического разложения карбонатов, гидрокарбонатов: CaCO3=CaO+CO2 2NaHCO3=Na2CO3+CO2+h4O е) окисления биохимических процессов дыхания, гниения. | 1.Непрочная молекула. Слабая двухосновная кислота. В водном растворе существуют равновесия. 2. Взаимодействует с растворами щелочей как раствор углекислого газа в воде с образованием солей- кислых (гидрокарбонатов) и средних (карбонатов): CO2+NaOH=NaHCO3 CO2+2NaOH=Na2CO3+ h4O 3.Вытесняется из солей более сильными кислотами CaCO3+2HCI=CaCI2+CO2+h4O 4.Соли угольной кислоты подвергаются гидролизу |
Углерод химически инертен только при сравнительно низких температурах, а при высоких – это один из сильнейших восстановителей. Главное химическое применение углерода – восстановление металлов, в первую очередь железа, из руд.
Оксиды углерода.
Имея четыре электрона во внешнем энергетическом уровне, углерод в соединениях с кислородом в зависимости от условий проявляет валентности +2 и +4.
При горении углеродосодержащих веществ (дрова, уголь, природный газ метан, спирт и др.) при температуре обычного пламени идет реакция:
С + О2 = СО2
Но если создать условия для повышения температуры (например, уменьшить теплоотвод, что может происходить внутри толстого слоя горящего угля, в том числе в доменной печи), то протекают реакции:
С +О2 = 2СО
СО2 + С = 2СО
Продуктом полного сгорания углерода и содержащих его веществ является оксид углерода (1У) СО2 – углекислый газ. Он же образуется при дыхании живых организмов и гниении их остатков. Одновременно углекислый газ (вместе с водой) является главным веществом, потребляемым растениями в процессе их роста.
При повышении давления уже при комнатной температуре диоксид углерода сжижается. Жидким СО2 заполняют некоторые типы огнетушителей.
При понижении давления жидкий оксид углерода закипает. При этом его температура резко снижается, поскольку на порообразование, как известно из физики, затрачивается большое количество теплоты. В результате СО2 затвердевает. В твердом виде (под названием «сухой лед») он применяется в качестве хладоагента. При атмосферном давлении «сухой лед» не плавится, а подобно иоду, фосфору, углероду возгоняется, только при значительно более низкой температуре (-75 С).
refdb.ru
Углерод Выполнил: Серенков Андрей Ученик 11 «Б» класса Проверил: Комарчева Е.А. Канск 2005План 1. Роль углеродов в живой природе 2.Распространение в природе. 3. Физические и химические свойства. 4. Роль углеводов в живой природе. Углерод (лат. Carboneum), С - химический элемент IV группы периодической системы Менделеева. Известны два стабильных изотопа 12С (98,892 %) и 13С (1,108 %). Углерод известен с глубокой древности. Древесный уголь служил для восстановления металлов из руд, алмаз - как драгоценный камень. Значительно позднее стали применяться графит для изготовления тиглей и карандашей. В 1778 К. Шееле, нагревая графит с селитрой, обнаружил, что при этом, как и при нагревании угля с селитрой, выделяется углекислый газ. Химический состав алмаза был установлен в результате опытов А.Лавуазье (1772) по изучения горения алмаза на воздухе и исследований С.Теннанта (1797), доказавшего, что одинаковые количества алмаза и угля дают при окислении равные количества углекислого газа. Углерод как химический элемент был признан только в 1789 А.Лавуазье. Латинское название сarboneum углерод получил от сarbo — уголь. Среднее содержание углерода в земной коре 2,3*10-2 % по массе (1*10 –2в ультраосновных, 1*10 –2 в основных, 2*10 –2 в средних, 3*10 –2 в кислых горных породах). Углерода накапливается в верхней части земной коры (биосфере): в живом веществе 18 % углерода, в древесине 50 %, в каменном угле 80 %, в нефти 85 %, антраците 96 %. Значит часть углерода литосферы сосредоточена в известняках и доломитах. Число собственных минералов углерода - 112; исключительно велико число органических соединений углерода - углеводородов и их производных. С накоплением углерода в земной коре связано накопление и многих других элементов, сорбируемых органическим веществом и осаждающихся в виде нерастворимых карбонатов и т.д. По сравнению со средним содержанием в земной коре человечество в исключительно больших количествах извлекает углерод из недр (уголь, нефть, природный газ), т.к. эти ископаемые — основные источники энергии. Углерод широко распространён также в космосе; на Солнце он занимает 4-е место после водорода, гелия и кислорода. Известны четыре кристаллические модификации углерода: графит, алмаз, карбин и лонсдейлит. Графит - серо-черная, непрозрачная, жирная на ощупь, чешуйчатая, очень мягкая масса с металлическим блеском. При комнатной температуре и нормальном давлении (0,1 Мн/м2, или 1кгс/см2) графит термодинамически стабилен. Алмаз - очень твердое, кристаллическое вещество. Кристаллы имеют кубическую гранецентрированную решетку: а=3,560Б. При комнатной температуре и нормальном давлении алмаз метастабилен. Заметное превращение алмаза в графит наблюдается при температурах выше 1400°С в вакууме или в инертной атмосфере. При атмосферном давлении и температуре около 3700°С графит возгоняется. Жидкий углерод может быть получен при давлении выше 10,5 Мн/м2 (1051 кгс/см2) и температурах выше 3700°С. Для твердого углерода (кокс, сажа, древесный уголь) характерно также состояние с неупорядоченной структурой “аморфный” углерод, который не представляет собой самостоятельной модификации; в основе его строения лежит структура мелкокристаллического графита. Нагревание некоторых разновидностей “аморфного” углерода выше 1500-1600°С без доступа воздуха вызывает их превращение в графит. Физические свойства “аморфный” углерода очень сильно зависят от дисперсности частиц и наличия примесей. Плотность, теплоемкость, теплопроводность и электропроводность “аморфный” углерода всегда выше, чем графита. Карбин получен искусственно. Он представляет собой мелкокристаллический порошок черного цвета (плотность 1,9 - 2 г/см3). Построен из длинных цепочек атомов С, уложенных параллельно друг другу. Лонсдейлит найден в метеоритах и получен искусственно; его структура и свойства окончательно не установлены. Конфигурация внешней оболочки атома углерода 2s22p2. Для углерода характерно образование четырех ковалентных связей, обусловленное возбуждение внешней электронной оболочки до состояния 2sp3. Поэтому углерод способен в равной степени как притягивать, так и отдавать электроны. Химическая связь может осуществляться за счет sp3-, sp2- и sp- гибридных орбиталей, которым соответствуют координационные числа 4,3 и 2. Число валентных электронов углерода и число валентных орбиталей одинаково; это одна из причин устойчивости связи между атомами углерода. Уникальная способность атомов углерода соединяться между собой с образованием прочных и длинных цепей и циклов привела к возникновению громадного числа разнообразных соединений углерода, изучаемых органической химией. В соединениях углерод проявляет степени окисления -4; +2; +4. Атомный радиус 0,77Б,ковалентные радиусы 0,77Б, 0,67Б, 0,60Б соответственно в одинарной, двойной и тройной связях; ионной радиус С4- 2,60Б, С4+ 0,20Б. При обычных условиях углерод химически инертен, при высоких температурах он соединяется со многими элементами, проявляя сильные восстановительные свойства. Все формы углерода устойчивы к щелочам и кислотам и медленно окисляются только очень сильными окислителями (хромовая смесь, смесь концентриров. HNO3 и KCIO3 и др.). “Аморфный” углерод реагирует с фтором при комнатной температуре, графит и алмаз - при нагревании. Непосредственно соединение углерода с хлором происходит в электрической дуге; с бромом и йодом углерод не реагирует, поэтому многочисленные углерода галогениды синтезируют косвенным путем. Из оксигалогенидов общей формулы COX2 (где Х - галоген) наиболее известная хлорокись COCI2 (фосген). При температурах выше 1000°С углерод взаимодействует со многими металлами, давая карбиды. Все формы углерода при нагревании восстанавливают окислы металлов с образованием свободных металлов (Zn, Cd, Cu, Pb и др.) или карбидов (CaC2, Mo2C, WC, TaC и др.). Углерод реагирует при температурах выше 600 - 800°С с водяным паром и углекислым газом. Все формы углерода нерастворимы в обычных неорганических и органических растворителях, но растворяются в некоторых расплавленных металлах (например, Fe, Ni, Co). Углерод - важнейший биогенный элемент, составляющий основу жизни на Земле, структурная единица огромного числа органических соединений, участвующих в построении организмов и обеспечении их жизнедеятельности (биополимеры, а также многочисленные низкомолекулярные биологически активные вещества - витамины, гормоны, медиаторы и др.). Значительную часть необходимой организмам энергии образуется в клетках за счет окисления углерода. Возникновение жизни на Земле рассматривается в современной науке как сложный процесс эволюции углеродистых соединений. Уникальная роль углерода в живой природе обусловлена его свойствами, которыми в совокупности не обладает ни один другой элемент периодической системы. Между атомами углерода, а также между углеродом и другими элементами образуются прочные химические связи, которые, однако, могут быть разорваны в сравнительно мягких физиологических условиях (эти связи могут быть одинарными, двойными и тройными). Способность углерода образовывать 4 равнозначные валентные связи с другими атомами. Углерод создает возможность для построения углеродных скелетов различных типов - линейных, разветвленных, циклических. Показательно, что всего три элемента - С, О, Н - составляют 98 % общей массы живых организмов. Этим достигается определенная экономичность в живой природе: при практически безграничном структурном разнообразии углеродистых соединений небольшое число типов химических связей позволяет на много сократить количество ферментов, необходимых для расщепления и синтеза органических веществ. Особенности строения атома углерода лежит в основе различных видов изомерии органических соединений (способность к оптической изомерии оказалась решающей в биохимической эволюции аминокислот, углеводов и некоторых алкалоидов). Согласно гипотезе А. И. Опарина, первые органические соединения на Земле имели абиогенное происхождение. Источниками углерода служили (СН4)и цианистый водород (HCN),содержавшиеся в первичной атмосфере Земли. С возникновением жизни единственным источником неорганического углерода, за счет которого образуется всё органическое вещество биосферы, является углерода двуокись (СО2),находящийся в атмосфере, а также растворенная в природных водах в виде НСО3. Наиболее мощный механизм усвоения (ассимиляция) углерода (в форме СО2) - фотосинтез - осуществляется повсеместно зелеными растениями. На Земле существует и эволюционно более древний способ усвоения СО2 путем хемосинтеза; в этом случае микроорганизмы - хемосинтетики используют не лучистую энергию Солнца, а энергию окисления неорганических соединений. Большинство животных потребляют углерод с пищей в виде уже готовых органических соединений. В зависимости от способа усвоения органических соединений принято различать автотрофные организмы и гетеротрофные организмы. Применение для биосинтеза белка и других питательных веществ микроорганизмов, использующих в качестве единственного источника углерода, углеводороды нефти, - одна из важных современных научно - технических проблем. Помимо стабильных изотопов углерода, в природе распространен радиоактивный 14С (в организме человека его содержится около 0,1мккюри). С использованием изотопов углерода в биологических и медицинских исследованиях связаны многие крупные достижения в изучении обмена веществ и круговорота углерода в природе. Так, с помощью радиоуглеродной метки была доказана возможность фиксации Н14СО3 растениями и тканями животных, установлена последовательность реакции фотосинтеза, изучен обмен аминокислот, прослежены пути биосинтеза многих биологически активных соединений и т. д. Применение 14С способствовало успехам молекулярной биологии в изучении механизмов биосинтеза белка и передачи наследственной информации. Определение удельной активности 14С в углеродсодержащих органических остатках позволяет судить об их возрасте, что используется в палеонтологии и археологии.
bukvasha.ru