|
|
|
|
 Far Far |
 WinNavigator WinNavigator |
 Frigate Frigate |
 Norton
Commander Norton
Commander |
 WinNC WinNC |
 Dos
Navigator Dos
Navigator |
 Servant
Salamander Servant
Salamander |
 Turbo
Browser Turbo
Browser |
|
|
 Winamp,
Skins, Plugins Winamp,
Skins, Plugins |
 Необходимые
Утилиты Необходимые
Утилиты |
 Текстовые
редакторы Текстовые
редакторы |
 Юмор Юмор |
|
|
|
File managers and best utilites |
Реферат: Современные методы ультразвуковой диагностики рака предстательной железы. Реферат на тему узи предстательной железы
Реферат Медицина Ультразвуковая диагностика мочевого пузыря и предстательной железы
Реферат
тема: Ультразвуковая диагностика мочевого пузыря и предстательной железы
Курсант: Кузьмич А.И. Москва, 2004 г.Содержание
Ультразвуковая диагностика заболеваний мочевого пузыря. 3 Новообразования мочевого пузыря. 5 Аномалии развития. 8 Камни мочевого пузыря. 9 Воспалительные заболевания мочевого пузаря. 9 Анатомия предстательной железы.. 10 Методика УЗИ.. 11 Эхография предстательной железы в норме. 12 УЗ диагностика заболеваний предстательной железы.. 14 Доброкачественная гиперплазия простаты.. 14 Воспалительные заболевания предстательной железы.. 16 Кисты предстательной железы.. 18 Камни предстательной железы.. 18 Рак предстательной железы.. 19 Список использованой литературы.. 22Ультразвуковая диагностика заболеваний мочевого пузыря.
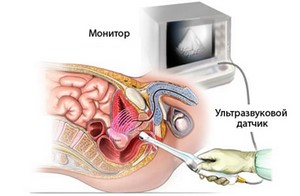
До недавнего времени цистопатия и рентген-методы занимали ведущее место в Исследованиях мочевого пузыря (МП), однако существует ряд противопоказаний проведению данных исследований. УЗИ является доступным, неинвазивным, информативным методом диагностики. УЗ изображение мочевого пузыря впервые было получено J. Donald (1963) во время исследования матки беременной женщины. E. Barnett и P. Marley (1974) представили УЗ картину в норме и при различных заболеваниях. В 1964 году H Takahashi и T. Oncbi предложили использовать для исследования мочевого пузыря и предстательной железы (ПЖ) ректальный датчик и получили поперечное сечение предстательной железы. Позже для диагностики патологических процессов в стенке МП, в частности глубины инвазии опухоли, был предложен уретральный внутриполостной датчик, который даёт возможность исследовать мочевой пузырь в секторе 360° (1974 г.). Показания для исследования мочевого пузыря: поиск аномалий развития, выявление признаков уростаза, его причин и последствий, обнаружение очаговой патологии (камни, опухоли), дизурия, гематурия, рецидивирующий цистит у взрослых и острый воспалительный процесс у детей, образование и боли в малом тазу. При обследовании мочевого пузыря обязательным является обследование почек. Требования к оборудованию: для клинической практики в большинстве случаев достаточно иметь сканер среднего класса, позволяющего проводить исследование в B-режиме и укомплектованного датчиками от 3,5 до 7,5 МГц. Удобным является комбинация из конвексного датчика с частотой 3,5 МГц для общего осмотра и линейного датчика 5-7,5 МГц для детального изучения зоны интереса. УЗИ должно проводиться на высоте клинических проявлений, в экстренной ситуации без специальной подготовки при хорошо заполненном мочевом пузыре, что достигается приемом 3-4 стаканов жидкости за 1 час до исследования. Оптимальным является заполнение мочевого пузыря до 250-300 мл. Исследование мочевого пузыря дополняется скрининговым исследованием органов брюшной полости. Исследование начинают с поперечных срезов от лона до пупка, далее продольное сканирование от одной стороны живота до другой. Для получения оптимальной визуализации боковых стенок и передней стенки. Иногда возникает необходимость повернуть пациента на 30-45. Любой подозрительный участок должен исследоваться полипозиционно. Исследование проводят и после мочеиспускания для определения объема остатков мочи, который вычисляется по формуле V={поперечный размер в см}x{переднезадний размер в см}x{продольный размер в см}x0,52. Остаточный мочи может быть не более 15 мл у взрослых. При исследовании важно определить толщину стенки, контуры мочевого пузыря, симметричность изображения, наличие трабекулярности, кистозных структур в полости мочевого пузыря и рядом с ним, эхогенных структур в полости мочевого пузыря. В норме мочевой пузырь на поперечных сканограммах имеет округлую форму, а на продольных выглядит как овоидное анэхогенное образование, исходящее из малого таза, свободное от внутренних эхоструктур, с ровными четкими контурами. Дальняя стенка визуализируется лучше, чем ближняя к датчику. Толщина стенок мочевого пузыря при адекватном наполнении не более 5 мм. Анатомически в мочевом пузыре различают верхушку, тело, дно, шейку, переднюю, заднюю, боковые поверхности, переходящие друг в друга без четких границ. В мочевом пузыре различают мочепузырный треугольник, образованный межмочеточниковой складкой с устьями мочеточников по бокам и внутренним отверстием уретры. Начальный отдел уретры охвачен предстательной железой. В норме мочевой пузырь симметричен в сагиттальной плоскости. Иногда при УЗИ различима слоистая структура стенки. Внутренний слой (слизистая и подслизистая) и наружный слой (серозный) выглядят как структура повышенной эхогенности, а средний слой (мышечная оболочка) гипоэхогенная. Толщина слизистой около 2 мм. Толщина стенки мочевого пузыря одинакова во всех отделах. Любое локальное уплотнение стенки рассматривается как патологическое. Использование сканеров, работающих в реальном времени иногда, особенно после использования диуретиков, позволяет наблюдать выброс мочи из устьев мочеточников. Сами мочеточниковые отверстия при УЗИ не визуализируются, но расположение определяется по выбросу. Выброс лоцируется в 30-40% случаев, а при форсированном мочеотделении на фоне диуретиков этот феномен наблюдается в 70-80%. При ЦДК выброс обнаруживается практически всегда. Визуализация этого феномена связана с эффектом псевдоконтрастирования турбулентной струи мочи, выбрасываемой в мочевой пузырь, и различной плотности мочеточниковой и пузырной мочи. При выбросе отмечается струя с турбулентным движением под углом 45-60° к задней стенке мочевого пузыря. Чаще наблюдается односторонний выброс. В тех случаях, когда выброс одновременный, в связи с перекрещиванием 2-х потоков, происходит быстрое гашение всего потока или обратной струи. В ряде ситуаций (при беременности, почечной недостаточности, непереносимости контрастных веществ), когда невозможно применить другие методы, данный тест может помочь оценить характер пассажа мочи. Средняя длина выбросов 3-5 см, наблюдается 2-4 выброса в минуту. УЗИ играет важную роль в диагностике ряда заболеваний мочевого пузыря, ‑ это прежде всего новообразований мочевого пузыря, камней мочевого пузыря, воспалительных процессов, ряда аномалий развития (дивертикулы, уретероцеле, киста урахуса), выявление признаков ИВО (инфравезикальной обструкции).Новообразования мочевого пузыря.
Симптоматика опухолей мочевого пузыря определяется следующими симптомами: 1. Гематурия, которая вначале может быть бессимптомной, транзиторной. Гематурия может быть различной степени выраженности, от незначительной, до профузной, вызывающей тампонаду сгустками крови мочевого пузыря. 2. Дизурия, которая, как правило, отсутствует при поверхностных опухолях. 3. Различные формы нарушения уродинамики нижних и верхних мочевых путей. Несмотря на то, что цистоскопия остаётся основным методом диагностики опухолей мочевого пузыря, определённую конкуренцию ей составляет УЗИ. В тех случаях, когда цистоскопия невыполнима или затруднена (гематурия, дизурия, малая емкость мочевого пузыря, стенозы уретры, острые воспалительные процессы урогенитального тракта и т.д.) УЗИ становиться основным методом диагностики. Для диагностики применяют трансабдоминальное УЗИ (ТАУЗИ), трансректальное УЗИ (ТРУЗИ), трансвагинальное УЗИ (ТВУЗИ), трансуретральное УЗИ (ТУУЗИ). Наибольшее распространение получило трансабдоминальное УЗИ, которое позволяет определить наличие опухоли, её локализацию, размеры и структуру, степень инвазии, выявить инфильтрацию устьев мочеточников и нарушение уродинамики. ТАУЗИ затруднено при дизурии, малой ёмкости мочевого пузыря, сопровождающейся большим количеством артефактов, что усложняет интерпретацию полученных данных. Результаты ТАУЗИ находятся в прямой зависимости от размеров и стадии заболевания. Точность ТАУЗИ при опухолях более 5 мм около 82%, при опухолях менее 5 мм около 38%. Сложность возникает при локализации образований на передней стенке, в области шейки мочевого пузыря и мочепузырного треугольника. Наиболее благоприятным для исследования является локализация новообразования на боковых и задней стенках мочевого пузыря. Трудности возникают также при тотальном поражении мочевого пузыря, когда все стенки утолщены на всём протяжении. УЗИ картина может напоминать мочевой пузырь при инфравезикальной обструкции (ИВО) или болезненном цистите. В этом случае необходимо обследовать мочевой пузырь в доплеровском цветном режиме (для опухоли характерна интенсивная бессистемная васкуляризация). Ложноположительные результаты обусловлены трабекулярностью стенки мочевого пузыря, дивертикулами, деформацией и малой ёмкостью мочевого пузыря, послеоперационными изменениями. При получении сомнительных результатов при ТАУЗИ применяют внутриполостные методы. Чаще всего применяют трансректальное УЗИ у мужчин, у женщин трансвагинальное УЗИ. Преимуществом метода является возможность изучения шейки мочевого пузыря, треугольника, окружающей мочевой пузырь клетчатки, предстательной железы, семенных пузырьков, информативность метода 94%. Ошибки в интерпретации данных связаны с кальцификацией опухоли, фиброзными изменениями стенки мочевого пузыря в месте локализации опухоли, воспалительной реакцией, пристеночным сгустком крови, трабекулярностью стенки. Некоторые авторы рекомендуют выполнять сочетанные методы исследования: ТАУЗИ и внутриполостные методы. С 1974 г. в практику введена трансуретральная методика УЗИ (ТУУЗИ). ТУУЗИ наиболее информативное УЗИ для оценки местного распространения опухоли, точным методом определения глубины инвазии, позволяет точно изучить результаты трансуретральной резекции мочевого пузыря, диагностики опухоли в дивертикуле мочевого пузыря. При ТУУЗИ чётко визуализируются все слои стенки мочевого пузыря, возможно детально оценить небольшую опухоль и рак in situ, неопределяемыми другими методами УЗИ и эндоскопически. При УЗИ определяют ёмкость мочевого пузыря, степень его деформации, чёткость контуров мочевого пузыря, тип роста и форму опухоли, структуру её и степень инвазии стенки мочевого пузыря, выход за пределы органа, интенсивность отражения из зоны регионарного метастазирования, где возможно обнаружить увеличение лимфоузлов. Однако увеличение лимфоузлов не всегда является признаком mts в них и нередко является следствием реактивной гиперплазии. Уточняется состояние верхних мочевых путей. При местнораспространённой опухоли с вовлечением паравезикальной клетчатки у 100% нарушается дифференцировка слоёв стенки мочевого пузыря, у 90% деформация МП, у 87% определяется прерывистый наружный контур, у 95% неоднородность паравезикальной клетчатки, у 52% дилятация верхних мочевых путей. В 60-100% снижается ёмкость мочевого пузыря. В начальных стадиях этих симптомов нет. При неинвазивных опухолях мочевой пузырь симметричный, признаков инфильтрации мышц нет. Наиболее часто встречаются папиллярные опухоли. Доброкачественные опухоли, как правило, выглядят как полипоподобные ворсинчатые образования повышенной эхогенности на узком удлинённом образовании. Папиллярный рак имеет широкое основание неоднородной структуры с участками разной эхогенности, неровную поверхность, иногда имеются небольшие кальцинаты. Встречаются признаки солевой инкрустации опухоли. При УЗИ дифференцировать гистоформу и степень злокачественности, особенно при небольших размерах опухоли, затруднено. При солидном или первично инфильтрирующем раке опухоль мало выступает в просвет мочевого пузыря, поражённая стенка утолщается, теряет эластичность, ёмкость мочевого пузыря уменьшается, теряется слоистая структура стенки, эхогенность стенки снижается. Одной из важных проблем лечения новообразований мочевого пузыря является их своевременная диагностика, выявления стадии опухоли, степени инфильтрации стенки мочевого пузыря и окружающих тканей, судить о злокачественности или доброкачественности процесса не всегда возможно. Точность определения стадии рака мочевого пузыря по данным ряда авторов при УЗИ 80%. При оценке результатов УЗИ и КТ, проведенной в онкоцентре РАМН, информативность этих методик примерно одинакова.Аномалии развития.
Дивертикул мочевого пузыря – мешковидное выпячивание слоёв стенки мочевого пузыря, могут быть одиночными и множественными, чаще располагаются на стенке латеральнее мочепузырного треугольника, реже у верхушки дивертикулы. Различаю истинные и ложные дивертикулы. Истинные дивертикулы – результат дизэмбриогенеза и имеет все слои стенки мочевого пузыря. На эхограммах дивертикул отображается как эхонегативное, лишенное внутренних эхоструктур, выпячивание одной из стенок мочевого пузыря. Эхография позволяет получить информацию о величине, форме дивертикула; размерах его шейки, пространственного взаимоотношения с окружающими структурами, что имеет значение в выборе метода оперативного лечения. В дивертикуле могут располагаться камни, опухоли мочевого пузыря, которые тоже могут быть выявлены при УЗИ. Урахус – остаток аллантоиса, соединяющий мочевой пузырь с пуповиной. Сам урахус (пузырнопупочный свищ) при УЗИ не визуализируется. Визуализируется киста урахуса, как кистозное или солидное образование, лежащее над верхушкой мочевого пузыря. Уретероцеле – кистовидное расширение терминального отдела мочеточника следствии его порока развития, пролабирующее в мочевой пузырь. Уретероцеле может быть простым, при нормальном расположении устья мочеточника, или эктопическим, одно- или двухсторонним. Часто уретероцеле бывает в одном из удвоенных мочеточников. Эхографически уретероцеле выглядит как эхонегатиное образование округлой или овальной формы, ближе к задней стенке мочевого пузыря. Размеры уретероцеле изменяются при сокращении или расслаблении нижнего цистоида мочеточника. По величине уретероцеле бывает от 0,5 см до образования, занимающего весь мочевой пузырь. При больших размерах уретероцеле бывают симптомы инфравезикальной обструкции и уростаз верхних мочевых путей.Камни мочевого пузыря.
Это гиперэхогенные образования с дорсальной тенью. При адекватном наполнении визуализируются частицы 1-2 мм в диаметре. Конкремент мочевого пузыря смещается при изменении положения тела, тогда как камни устья мочеточника не смещаются. При длительном стоянии камни в интрамуральном отделе мочеточника отмечается буллезный отёк стенки мочевого пузыря в виде очагового утолщения стенки мочевого пузыря в области мочепузырного треугольника, иногда напоминающего папиллярную опухоль мочевого пузыря на широком основании. При УЗИ визуализируются камни любого состава, размером не более 0,5 см.Воспалительные заболевания мочевого пузаря.
Признаком цистита может служить утолщение стенки мочевого пузыря более 5мм, снижение объёма мочевого пузыря, мелкодисперсная эхогенная взвесь в мочевой пузырь. При хроническом воспалении стенка утолщена и неровная. Утолщение стенки может наблюдаться при инфравезикальной обструкции в следствии гипертрофии, а также при нейрогенной дисфункции мочевого пузыря. При обнаружении локального утолщения стенки мочевого пузыря необходимо повторить УЗИ через 1-2 часа для исключения естественной складчатости мочевого пузыря, вследствие плохого заполнения, а также исключить опухоль мочевого пузыря. Туберкулёзное воспаление мочевого пузыря характеризуется образованием гранулём в стенке мочевого пузыря, что проявляется множественными локальными утолщениями стенки с исходом в микроцистис. При воспалении мочевого пузыря вследствие шистосомоза стенка мочевого пузыря утолщается, эхогенность её повышается с гиперэхогенными включениями за счёт кальцинатов, которые могут быть локальными или множественными, кальцификация затрагивает обычно интрамуральные отделы мочеточников. УЗИ нашло широкое применение в диагностике заболеваний предстательной железы. Особое значение приобрёл метод с развитием современных методик, таких как применение внутриполостных многоплоскостных датчиков, использование высококонтрастного сканирования, цветовое и энергетическое доплеровское картирование, в т.ч. и применение эхоконтрастных препаратов и трехмерной реконструкции изображения. Современные методики позволяют получать очень высококачественное изображение, детализировать структуру железы и окружающих её тканей и органов, проводить биопсию под контролем УЗИ.Анатомия предстательной железы
Предстательная железа располагается в малом тазу, под мочевым пузырем. По форме напоминает плод каштана. В железе различают основание, прилежащее к мочевому пузырю, верхушку, примыкающую к тазовой диафрагме, заднюю поверхность выпуклой формы, прилежащую к передней стенке прямой кишки и переднюю поверхность выпуклой формы, обращенную к лону. На задней поверхности есть борозда, условно разделяющая предстательную железу на доли. Предстательная железа плотно охватывает часть мочеиспускательного канала. В п.в. наиболее распространена зональная анатомия предстательной железы. (McNeal, 1981) Выделяю четыре зоны: 1. центральная в форме конуса с основанием, являющийся основание предстательной железы и верхушкой, обращённой к семенному бугорку на задней стенке простатичного отдела уретры, сбоку эта зона ограничена семявыбрасывающими протоками, проходящими через толщу железы. Эта зона составляет 20% объема железы; 2. периферическая зона занимает 75% объема железы; 3. переходная зона располагается с боков проксимальной уретры и составляет 5% объема предстательной железы; 4. передняя фибромускулярная зона покрывает переднюю часть предстательной железы. Деление предстательной железы на эти хоны обусловлено hgpkbxysv строением железистых элементов и имеет клиническое значение. Предстательная железа состоит из 30-50 желез, выводные протоки которых сливаясь открываются в уретру. В предстательной железе имеются периуретральные железы – вокруг простатического отдела уретры. Помимо желез, предстательная железа содержит большое количеств гладкомышечных волокон и прослоек соединительной ткани, переходящих в капсулу.Методика УЗИ
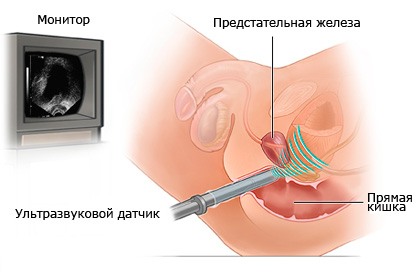
В н. в. существуют четыре методики УЗИ: трансабдоминальные (ТАУЗИ), трансперинеальные, трансректальные (ТРУЗИ), трансуретральные (ТУУЗИ). ТАУЗИ наиболее распространенная методика проводиться через брюшную стенку при умеренном наполнении мочевого пузыря. Его преимущества: простота, легкая переносимость, возможность сочетания с ректальным обследованием, возможность одновременного обследования мочевого пузыря. Недостаток – низкое разрешение, т.к. применяются низкочастотные датчики, исследование проводиться при большом удалении органа от трансдьюсера, необходимость наполнения мочевого пузыря, плохо визуализируется верхушка. Трансперинеальное УЗИ применятся редко, его преимущества: это возможность исследования при пустом мочевом пузыре, возможность визуализации верхушки. Однако применять высокочастотное сканирование невозможно, низкое качество изображения. ТУУЗИ позволяет получить хорошее изображение предстательной железы. Недостатки: инвазивность. ТРУЗИ является основным методом исследования. Основными видами ТРУЗИ являются: продольно линейное, поперечно радиальное или конвексное и двухплоскостное. При ТРУЗИ визуализируется вся железа в т.ч. и капсула при изображении очень хорошего качества, точность измерения, возможно проводить микционную уретрографию. Недостаток: невозможность проведения при заболеваниях прямой кишки и после операций на промежности. Наиболее информативные биплановые датчики с пробольным линейным и поперечным конвексным сканированием частотой 75 МГц, с длиной сканирующей поверхности 50 мм, работающие в режиме импульсного, цветного и энергетического допплера, имеющие адапторы для проведения инструментов. Показателями к УЗИ предстательной железы являются любые анамнестические, клинические, физикальные или лабораторные данные о возможном неблагополучии предстательной железы. Подготовка к исследованию заключается в наполнении мочевого пузыря до позыва (150 мл) на мочеиспускание. При чрезмерном наполнении возникают трудности в визуализации предстательной железы при ТАУЗИ в связи с ее отдаленностью от датчика, а при недостаточном наполнении также трудно визуализировать при ТАУЗИ и ТРУЗИ (трудно дифференцировать контуры предстательной железы от стенки мочевого пузыря). Перед ТРУЗИ выполняется очистительная клизма. Исследование предстательной железы начинают с трансабдоминального сканирования в положении на спине. Для получения поперечного среза датчик устанавливают в горизонтальной плоскости над лоном. При повороте датчика на 90° получается продольное сечение. Данное исследование позволяет оценить форму и размеры предстательной железы, симметричность долей, в определенной степени изучить структуру железы, взаимоотношение с окружающими структурами. ТРУЗИ проводят на урологическом кресле или на кушетке на левом боку с согнутыми и приведенными к животу ногами. Датчик, смазанный гелем вводят на 5-7 см. Ориентир глубины введения – визуализация основания предстательной железы, мочевого пузыря, семенных пузырьков.Эхография предстательной железы в норме
При ТАУЗИ предстательная железа в продольном сечение отображается виде овального образования, вытянутого от основания к верхушке. Хорошо визуализируется шейка мочевого пузыря, верхушка предстательной железы дифференцируется редко. При поперечном сканировании предстательная железа имеет овальную, округлую, треугольную, полукруглую форму. При поперечном сканировании задний контур может нечетко отделяться от прямой кишки. При ТАУЗИ говорить о капсуле можно условно. Чаще определяется границе между железой с более эхогенной парапростатической клетчаткой. Железа имеет четкие и ровные контуры. Дифференцировка на зоны выглядит как гетерогенная, слегка эхогенная область, окруженная более гомогенной слегка гипоэхогенное, в связи с большим количеством мышечных волокон периферической зоны. Размеры предстательной железы: переднезадний 15-25 мм, поперечный 30-45 мм, верхнее-нижний 24-40 мм. Первые два размера измеряются на поперечных срезах, а третий на продольном. Эхогенность предстательной железы мелкозернистая и представлена множеством мелких точечных и линейных эхосигналов, средней эхогенности. Фибромускулярная зона из-за преобладания мышечных структур имеет низкую эхогенность. При продольном ТРУЗИ предстательная железа имеет полукруглую форму или треугольную форму. У лиц до 40 лет, у лиц средней или старшей возрастной группы приобретает овальную форму. Размеры: толщина 1,5 -2,3 см, ширина 2,7-4,3 см, длина 2,4-4,1 см. Объем предстательной железы не должен превышать 200 см3 . Структура железы всегда неоднородная. Визуализируется дугообразная уретра, шейка мочевого пузыря. Вокруг уретры располагается гипоэхогенная зона – периуретральные железы. В месте изгиба дуги уретры определяется гипоэхогенное расширение треугольной формы до 2 мм – семенной бугорок. Визуализируются в предстательной железы семявыбрасывающие протоки, идущие от семенных пузырьков параллельно прямой кишке к среднему отделу уретры. Визуализируются они как тонкие трубчатые гипоэхогенные структуры. Зоны предстательной железы четкой границы не имеют. Структура предстательной железы мелкозернистая, средней эхогенности. Зоны чаще всего определяют на основании анатомических ориентиров: уретра, семявыбрасывающие протоки, семенной бугорок. Капсула предстательной железы определяется тоже как тонкая (1-2 мм) гиперэхогенная полоска, окружающая предстательную железу. Капсула четко дифференцируется от ткани. Наружный контур капсулы прослеживается не всегда четко, т.к. сливается с парапростатической клетчаткой. При ТРУЗИ хорошо визуализируется прямая кишка, парапростатическая клетчатка, шейка мочевого пузыря, вены парапростатического стежения (линейные анэхогенные структуры). Семенные пузырьки лоцируются как извилистые трубчатые или мешотчатые структуры, располагающиеся между стенкой мочевого пузыря и прямой кишкой, краниально и латерально от предстательной железы. Имеют однородную структуру, эхогенность близкую к эхогенности предстательной железы. При поперечном ТРУЗИ форма предстательной железы треугольная или полукруглая. В центре предстательной железы гипоэхогенная зона – гладкомышечные волокна, окружающие уретру. Семявыбрасывающие протоки визуализируются редко, если они видны, то выглядят близкорасположенными овальными гипоэхогенными структурами. Чётко визуализируется капсула. Снаружи гипоэхогенной зоны располагается зона средней эхогенности – совокупность железистых зон. При такой плоскости сканирования иногда удается дифференцировать границы периферической зоны предстательной железы, которая располагается полумесяцем у задней поверхности железы и имеет более высокую эхогенность. Дифференцировать границы центральной и переходной зон в норме обычно не удается. Капсула выглядит также как и при продольном сканировании – гиперэхогенной полосой. Поперечное сканирование имеет преимущество в изучении симметричности внутренней структуры железы и семенных пузырьков, в изучении наружного края предстательной железы. При продольном сканировании лучше визуализируется верхушка предстательной железы, сфинктеры, уретра, семенные пузырьки. Применение допплерографических методик, в т.ч. цветового доплеровского картирования (ЦДК), энергетического допплера, эхо-контрастных веществ и методики "второй гармоники", что в совокупности объединяется термином "цветовой УЗ сканографии", позволяет получать важные дополнительные данные для диагностики и дифференциальной диагностики заболеваний органа. Для изучения сосудистой архитектоники применяют ТРУЗИ. При ЦДК визуализируются капсулярные сосуды, артерии вдоль семявыбрасывающих протоков, уретральные артерии, отдельные артериальные сосуды ткани периферической и центральной зон. Сосуды передней фибропоскулярной зоны не визуализируются. Отчетливо определяются многочисленные вены, сопровождающие крупные артериальные ветви.УЗ диагностика заболеваний предстательной железы
Доброкачественная гиперплазия простаты
Доброкачественная гиперплазия простаты обнаруживается у 40% Лиз в возрасте 50 лет, и у 90% старше 80. Характеризуется доброкачественным увеличением железы с преимущественным ростом либо в прямую кишку, либо концентрацией изменений вокруг внутреннего отверстия уретры с распространением гиперплазированной предстательной железы в мочевой пузырь. Различают железистую форму, железисто-мышечную, фибозно-мышечную формы. Развитие доброкачественной гиперплазии предстательной железы (ДГПЖ) сопровождается увеличением органа. ДГПЖ развивается преимущественно из переходной зоны. Развитие процесса вызывает сдавливание центральной и периферической зоны, вызывая их атрофию и формирование "хирургической потенции" предстательной железы. По мере распространения предстательная железа приобретает шаровидную форму. При преимущественном росте периуретральных желез предстательной железы выбухает в просвет мочевого пузыря и формирует среднюю долю. Существует две эхографические формы ДГПЖ: 1. преимущественно узловая форма в 80%, 2. диффузная форма. При узловой форме внутри предстательной железы выявляется образования, окруженные гипоэхогенной тонкой зоной (при ЦДК оттесненные, расширенные сосуды), в ряде случаев может наблюдаться гиперэхогенная зона (сдавление прилегающих тканей, склеротические процессы). Аденома в боковых долях возникает первоначально в виде небольших округлых гиперэхогенных с четкими ровными контурами образований. Минимальные визуализируемые размеры аденомозных узлов 7-8 мм. В поздних стадиях визуализируется большая двух долевая аденома, занимающая всю предстательную железу. Предстательная железа при этом может становиться ассиметричной, вдаваться в полость мочевого пузыря, сдавливая уретры, нарушая отток мочи из мочевого пузыря. Железа становиться неоднородной эхоструктуры по мере роста аденомозных узлов. По периферии аденомозных узлов наблюдаются частично кальцинаты и ретенционные кисты. Контуры узлов в предстательной железе отчётливо прослеживаютсялишь при ТРУЗИ. При ТАУЗИ контуры узлов прослеживаются при сохранении паренхимы между узлами. Часто двух долевая гиперплазися сочетается с гиперплазией средней зоны. При УЗИ помимо увеличения размеров боковых долей отмечается внутрипузырный узел. Структура узлов может быть разной: гомогенной мелкоточечной (изоэхогенная), гетерогенной с участками различной эхогенности. Особое внимание привлекают случаи с расположением внутри узла гипоэхогенного участка (дифференциальный диагноз с раком предстательной железы). Характер эхографической картины зависит от гистоформы ДГПЖ. Для железистой формы наиболее характерна гипоэхогенность узлов. При диффузной форме гиперплазии наблюдается увеличение предстательной железы без отчетливой визуализации узлов. Характеризуется неоднородность эхоструктуры за счет чередования участков сниженной и повышенной эхогенности. Существенно на характер эхографической картины ДГПЖ влияют сопутствующие наружные процессы, воспалительные, деструктивные, кисто- и камнеобразования. При присоединение воспаления размеры узлов увеличиваются, эхогенность уменьшается. По мере роста узлов нарастают дегенеративные и склеротичесике процессы, железистая ткань замещается фиброзной, изменяется и эхографическая картина. При ЦДК изменяется оптоархитектоника: огибание сосудами узлов, в самой ткани узлы выявляются 1-2 крупных сосуда, другая ткань предстательной железы имеет большую сосудистую плотность.Воспалительные заболевания предстательной железы
Воспалительные заболевания занимают одно из первых мест среди заболеваний мужских половых органов. Считается, что простатитом страдает 30-40% мужчин. При простатите не всегда имеются специфические признаки. Необходимо всегда сопоставлять УЗ и клинические признаки. В типичных случаях при остром простатите предстательная железа увеличивается в размерах, форма становиться шаровидной, отмечается снижение общей эхогенности. Изменяется эхоструктура: теряется дифференцировка железистых и фибромышечных зон, появляется неоднородность структуры (чередование гипо- и гиперэхогенных участков), контур капсулы плохо дифференцируется. Эхографическая картина абсцесса предстательной железы имеет характерные особенности: гипо- или анэхогенное образование неправильной, иногда звездчатой формы, неровной внутренней поверхностью. Абсцессы четко визуализируются при ТРУЗИ. Они возникают на фоне гипоэхогенной отечной ткани предстательной железы. Стенка абсцесса толстая, содержимое неоднородное. УЗИ имеет большое значение для коррекции лечения, принятия решения о хирургичесокм вмешательстве, позволяет проводить диагностический контроль при консервативном лечении. Хронический простатит может быть как исход острого или быть первично хроническим. Хронический простатит имеет разнообразные клинические формы, в связи с этим спецификой УЗ сканеров. Может отмечаться равномерное и неравномерное снижение эхогенности предстательной железы, выраженное в большей степени в центральной зоне, что приводит к повышению дифференцировки зон предстательной железы, анатомические элементы становятся подчеркнутыми. При ТРУЗИ определяется расширение вен перипростатического венозного сплетения. Реже определяется локальное снижение эхогенности, что требует дифференцировки с раком предстательной железы. В других случаях отмечается появление гиперэхогенных структур без акустической тени, за счет инфильтративных и склеротических процессов. Часто отмечается наличие мелких кальцинатов в виде цепочек и полей в боковых долях основания предстательной железы, в периуретральной области. Часто мелкие камни по типу "звездного неба" располагаются диффузно. При застое секрета отмечается расширение желез предстательной железы и железа принимает мелкосотовый вид прежде всего в периферической зоне, появляются кистозные образования. При густом секрете отмечается появление треугольных участков повышенной эхогенности с основанием и капсуле предстательной железы. Эхографическая картина в многом зависит от стадии процесса. В острой стадии отмечается увеличение предстательной железы, снижение эхогенности и дифференцировки структур, мелкосоставный рисунок ткани, расширение перипростатических вен. При переходе воспаления в стадию пролиферации появляются легкие гипоэхогенные включения, отмечается подчёркнутость анатомических структур, размеры железы нормальные. В склеротической стадии размеры предстательной железы уменьшаются, структуры неоднородности с нечетко ограниченными участками повышенной эхогенности, средней звукопроводности, появляются кальцинаты. Туберкулез предстательной железы сочетается обычно с туберкулезном почек, характеризуется появление в паренхиме туберкулем различной величины. При УЗИ выявляются гипоэхогенные зоны с нечеткими, неровными контурами, требующих дифференцировки с раком предстательной железы. При благоприятном течении очаги инкапсулируются и обизвествляются. При неблагоприятном течении образуются некротические полости – каверны, визуализирующиеся как кистозные полости с толстой стенкой, развитие фиброза приводит к неоднородности эхостуктуры железы. Отложения массивные кальция в капсуле затрудняет визуализацию ткани предстательной железы, создается впечатление о наличии большого камня в мочевом пузыре.Кисты предстательной железы
Признаки: анэхогенность или выраженная гипоэхогенность, четкие границы, диагональное усиление, подчеркнутость дальней стенки. Кисты предстательной железы выявляются от 7,9% до 20%. Мелкие кисты (2-5 мм) могут встречаться у практически здоровых мужсин. Они располагаются в боковых долях, имеют тонкие стенки, ровные контуры, однородное содержимое. До 90% кист выявляются на фоне заболеваний предстательной железы. Киста на фоне ДГПЖ располагаются по периферии узлов, овальные, вытянутые, ветеренообразные. Редко кисты располагаются внутри узлов, форма их непрерывная, отмечается многокамерность. Часто кисты располагаются в области основания предстательной железы, в области внутреннего отверстия уретры, они могут пролябировать в мочевой пузырь. Могу кисты образовываться на фоне хронического простатита, злокачественных опухолей. Врожденные кисты составляют 8% всех кист предстательной железы. Для них характерно срединное расположение в основании предстательной железы, каплевидная или веретенообразная форма с тонкой ножкой из паренхимы. Содержимое таких кист анэхогенное однородное, стенка тонкая, размеры от 0,3 до 4 см, а иногда гигантские, занимающие весь таз.Камни предстательной железы
Выявляются часто, располагаются в железах предстательной железы. Развитию камней способствует застой секрета на фоне старения организма, воспалительные изменения предстательной железы, ДГПЖ. У практически здоровых мужчин с неизменной предстательной железой камни встречаются в 5%, при хроническом простатите у 25-100%, раке предстательной железы 2-43%, ДГПЖ: 50-70%. Эхографически - это гиперэхогенные структуры различной величины, единичные или множественные. Иногда при УЗИ трудно дифференцировать камни со склеротическими участками. Камни не всегда дают акустическую тень, а мелкие холестериновые наоборот дают эффект "хвоста кометы". При ДГПЖ камни располагаются по периферии узлов и могут образовывать известковую капсулу, улучшая УЗ визуализацию узлов.Рак предстательной железы
Рак предстательной железы (РПЖ) - наиболее часто встречающаяся злокачественная опухоль у мужчин. Заболеваемость раком предстательной железы растет и за последние 10 лет увеличилась в России в два раза. Для рака предстательной железы в онкоурологической заболеваемости 41%. Эффективность его лечения зависит от своевременности диагностики. Ранняя диагностика в виду особенности клиники заболевания, анатомии органа затруднена и до 50% опухолей выявляется в стадии распространенного процесса. У 12-14% у мужчин в возрасте старше 50 лет имеются воспалений предстательной железы, к 90 годам эти проценты повышаются до 90%. Рак предстательной железы метастазирует лимфогенно в лимфоузлы таза и забрюшинного пространства, гематогенные метастазы обнаруживаются в 65% в почках, в легких в 38%. Важное место в комплексном обследовании пациентов играет УЗИ. Возможности обычного трансабдоминального УЗИ ограничены. Можно определить размеры предстательной железы, симметричность ее, состояние капсулы, объем остаточной мочи в мочевом пузыре. Выявление тонких изменений структуры характерных патологических изменений возможно лишь при трансректальном УЗИ. Специфичность МЗИ при диагностике рака предстательной железы 20-30%, т.к. изменения характерные для рака могут наблюдаться при других заболеваниях предстательной железы. УЗ диагностика лимфогенных метастахов сложна, вероятность ошибок до 50-60%. УЗИ может выявить увеличение лимфоузлов, когда размер их более 2 см. Однако выявление увеличенных лимфоузлов не всегда связано с наличием в них метастазов. Рак предстательной железы чаще развивается в периферической зоне (75%) и переходной зоне (20%), редко в центральной зоне (5%). Рак предстательной железы не имеет специфических эхографических признаков. Характерно появление в паренхиме узлов, чаще всего на периферии у капсулы. Хотя большинство узлов гипоэхогенное (54%), встречаются фокусы различной эхогенности: изоэхогенные (24%) повышенной эхогенности (22%) смешанной эхогенности. Контур узла неровный, нечеткий, структура неоднородная. Нередко узел окружен гиперэхогенным ободком – реакция соединительной ткани. Особенно сложна диагностика рака предстательной железы из переходной и центральной зон, где он развивается не фоне ДГПЖ. Сложная диагностика рака предстательной железы, развивающегося в области верхушки предстательной железы и по передней поверхности, эти зоны труднодоступны для УЗИ. Гипоэхогенные фокусы не дают дополнительных акустических эффектов в отличие от кистозных образований. Изо-, гиперэхогенные, смешанные формы диагностируются при УЗИ в 11% случаев. Рак предстательной железы встречается в виде одиночных или множественных узлов. Не все гипоэхогенные участки являются показателями рака предстательной железы (при биопсии в 21-37% выявляются не раковые изменения предстательной железы). Различают агаповую (в 30%) и диффузную форму (20%) рака предстательной железы. При диффузной форме выделить отдельные фокусы арка невозможно, вся железа или большая ее часть неоднородна. По мере развития опухоли отмечается деформация и асимметрия железы, контуры становятся неровными, теряется непрерывность капсулы при ее пенетрации, нарастает неоднородность структуры паренхимы предстательной железы, характерна беспорядочность отражённых сигналов. Распространение опухоли внутри железы приводит к слиянию отдельных фокусов дин узел и железа может выглядеть однородной гипоэхогенной. На этом фоне могут появляться отдельные очаги ещё более пониженной эхогенности или гиперэхогенные включения. УЗ признаками инвазии капсулы является местная деформация контура предстательной железы, неоднородность перепростатической клетчатки. прерывистость капсулы. Происходят изменения семенных пузырьков при инвазии их опухолью: асимметрия, кистозная дилятация, смещение кпереди, повышение эхогенности, нечеткость контуров. Единственным признаком инвазии стенки мочевого пузыря является ее утолщение. Часто приходиться дифференцировать опухоль мочевого пузыря, прорастающую в предстательную железу, от рака предстательной железы прорастающего в мочевой пузырь. Для лечения лучевыми или гормональными методами характерно заметное уменьшение органа, контуры крупноволнистые, структура может быть однородной гипоэхогенной с гиперэхогенными точечными или линейными структурами, в других случая наблюдается повышение эхогенности железы за счёт фиброза. Ценными методами диагностики являются допплерографические методики. Характерно выявление гипоэхогенных участков с повышенной, в отличие от других отделов предстательной железы, васкуляризацией. Для повышения чувствительности метода применяют исследование с эхоконтрастными препаратами, использование энергии второй гармоники, трехмерные изображения. Данные методы позволяют отчетливо визуализировать патологические сосуды. УЗИ играет важную роль в комплексном обследовании пациентов с раком предстательной железы, повышая достоверность диагностики до 77%. В н.в. стандартом обследования больных с подозрением на рак предстательной железы является пункционная биопсия под контролем УЗ сканеров.Список использованной литературы
1. "Комплексная эхограмма", Р.Я. Абдулаев, С. Левин, Ю.С. Соболь, Харьков, "Факт", 1999 2. Руководство по ультразвуковой диагностике под ред. П.Е.С. Кальмера. Москва, "Медицина", 2000 3. "Ультразвуковое исследование предстательной железы", А.И. Громов, Москва, 1999 4. "Ультразвуковое исследование мочевого пузыря, мочеточников, почек", С.В. Капустин, С.И. Пиманов, Москва, "Медицинская литература", 2001 5. "Дифференциальный диагноз при абдоминальном ультразвуковм обследовании", Р. Биссет, А. Хан, Москва, "Медицинска литература", 2003 6. "Ультразвуковая диагностика в уронефрологии", В.Н. Демидов, Ю.А. Пытель, А.В. Амосов, Москва, "Медицина", 1989 7. "Рак предстательной железы", Б.П. Матвеев, Б.В. Бухаркин, В.Б. Матвеев, Москва, 1999 8. "Рак мочевого пузыря", Б.П. Матвеев, К.М. Фигурин, В.М. Карягин, Москва, 2001 9. "Ультразвуковая диагностика заболеваний предстательной железы", С.А Лаврова, Н.М. Ткаченко, "Новости лучевой диагностики",1999works.tarefer.ru
Ультразвуковая диагностика простаты
Ультрасонография простаты в последние годы приобрела огромное значение, положительно изменив и упростив выявляемость рака простаты. Трансректальная сонография простаты на сегодня является наиболее быстрым информативным методом исследования, который используют урологи в своей клинической практике, решая многие проблемы, связанные с заболеваниями предстательной железы, в том числе и «симптомов нижнего мочевого тракта». Получение информации, как правило, не сопровождается серьезными неудобствами для пациента.

Несмотря на способность трансректальной ультрасонографии распознавания очагов возможного ракового поражения предстательной железы, получаемая информация нередко оказывается недостаточной для оценки экстракапсулярного распространения опухоли. Известно, что особенности кровообращения, выраженность сосудистой плотности, наличие коллатералей определяют интенсивность роста злокачественной опухоли. Исключение не составляет и рак простаты. Уловить и подробно расшифровать подобные изменения с помощью трансректального УЗИ невозможно.
В 1842 г. австрийский физик X.Допплер сделал открытие, названное впоследствии эффектом изменения частоты ультразвукового сигнала в зависимости от направления движения исследуемого объекта. В медицине эффект Допплера ассоциирован со степенью интенсивности кровоснабжения того или иного органа в зависимости от возникшего патологического процесса. Для оценки роста раковой опухоли предстательной железы данный феномен имеет оценочное значение. Допплерографическую оценку степени насыщения или редукции сосудистого русла можно получить как непосредственно, так и в условиях регулируемого кровотока, называемого не иначе как применение провокационных тестов. Цветной Допплер, конструктивно совмещенный с мульти- или биплановыми трансректальными датчиками, позволяет визуализировать ангиографию, что открывает большие возможности в достоверности воссоздания ангиоархитектоники органа. Визуализация последнего с одновременной компьютерной графикой позволяют реконструировать трехмерное ультразвуковое изображение исследуемого органа.
Такая комбинация дает возможность с известной степенью точности измерить объем и вычислить неправильности формы пораженной предстательной железы, измерить в нескольких проекциях размер ракового очага и облегчить прецизионную биопсию или криоаблацию простаты под контролем 3Д-ультразвука.
Абсолютное большинство специалистов отдают предпочтение трансректальному ультразвуковому сканированию, которое действительно дает наиболее полную информацию о наличии тех или иных отклонений в паренхиме предстательной железы. Простота получения информации объясняется возможностью подвести датчики в почти полное соприкосновение с железой, и только слизистая прямой кишки, будучи нежной структурой, служит легким барьером, не способным исказить получаемую информацию. Внедрение в практику ТрУЗИ вначале окрылило специалистов, полагавших, что данный метод позволит избежать многих диагностических затруднении.
К ним относятся:
-
наличие эхонегативного узла в паренхиме, особенно ближе к региону простатической капсулы;
-
диффузные зоны изменений без четких границ и очертании;
-
серповидные протяженные эхонегативные тени, охватывающие периферическую зону предстательной железы;
-
отсутствие симметричных контуров железы;
-
участки смешанной эхогенности, асимметрия железы без очерченного фокуса измененной эхогенности;
-
полная утрата структурной и зональной дифференцировки;
-
изменения нормальной дифференцировки по зонам.

Критериями для внекапсулярного роста являются неравномерность, выпячивания и разрыв непрерывности капсулы, имеющиеся подозрения на инвазию семенных пузырьков при наличии гипер- и гипоэхогенных участков ближе к основанию простаты. К сожалению, специалист, который дает заключение по результатам ТрУЗИ о стадии рака простаты, отнюдь не упрощает для уролога интерпретацию получаемых сведений. Публикуемые результаты ТрУЗИ указывают на экстракапсулярный рост с точностью 58-86%, чувствительностью 50-90% и специфичностью — 46-91%. Диагностика прорастания семенных пузырьков имеет точность 78%, специфичность 78% и чувствительность 22-60%.
Общее положительное предсказательное значение ТрУЗИ при диагностике рака простаты невелико — от 18 до 52%. Данное обстоятельство не позволяет рекомендовать ТрУЗИ в качестве скрининга рака этого органа.
Учитывая это, многие авторы находят данное исследование оправданным лишь для контроля проведения биопсии, что является современным стандартом в установлении первичного диагноза рака простаты.
Ультразвуковое наведение позволяет точно провести биопсийную иглу в определенную область простаты за исключением случаев, когда патологический очаг хорошо пальпируется, но не определяется при сонографии.
В данной ситуации биопсия 6 точек — лучший метод выявления рака простаты, несмотря на нормальные показатели ТрУЗИ. Считается, что эта методика увеличивает выявляемость рака простаты на 20% при неизмененной ультразвуковой структуре периферической зоны предстательной железы и повышенном уровне ПСА.
Однако многие исследователи, изучавшие результаты биопсии, указывают на неточности и ошибки этой методики. К тому же рак простаты мультифокальное и гистологически гетерогенное заболевание, поэтому биопсия не может гарантировать точность локализации и гистологической градации всех очагов болезни.

Оптимизация результатов обычного трансректального исследования в режиме серой шкалы привела к получению ультразвуковых изображений, обработанных компьютером. Данный подход направлен на стандартизацию оценки изображений и улучшение предсказательного значения ТрУЗИ. Компьютер оценивает информацию, недоступную человеческому глазу, и использует алгоритм процессинга изображения в режиме серой шкалы с цветовым кодированием участков, подозрительных на наличие злокачественного процесса. Использование подобных систем автоматического обнаружения рака позволяет увеличить эффективность ТрУЗИ при сравнении с результатами биопсии. При этом точность и чувствительность методики достигают 75%, а специфичность 78%.
Для улучшения диагностики рака простаты с помощью ультрасонографии были созданы и так называемые искусственные невральные сети.
Недавние работы продемонстрировали высокую чувствительность и специфичность данной методики. ANN позволяет повысить положительную предсказательную значимость ТрУЗИ до 82%, а негативную — до 97 %. Неожиданным результатом стало то, что в 97% случаев ANN позволяет диагностировать рак при изоэхогенных признаках опухоли.
3D-ультрасонография
Использование ЗD-методик формирования ультразвукового изображения обладает большими возможностями в изучении объема патологического очага и, собственно, простаты, что потенциально может улучшить результаты биопсии, а также определения стадии рака. Большинство авторов считают, что ЗD-ТрУЗИ имеет лишь дополнительное значение в диагнозе рака простаты и должно сочетаться с допплеровским исследованием и контрастным усилением.
Следующим шагом в усовершенствовании диагностики рака явилось активное использование допплеровских изображений. Рак простаты, как и другие опухолевые процессы, является гиперваскулярным новообразованием, поэтому сравнительный анализ кровоснабжения участков простаты и структуры их сосудов вполне оправдан.
Исследования начала 80-х годов продемонстрировали, что около 85% рака простаты имеет повышенное кровоснабжение, однако более поздние работы свидетельствуют, что только 50% опухолей проявляются асимметричным или аномальным кровотоком. Это связано с тем, что опухоли малого размера существенно не изменяют сосудистую архитектонику железы.
Вместе с тем было обнаружено, что опухолевые модели демонструют определенные параллели между васкуляризацией и размером опухоли. Так, очаги размером менее 2 мм, как правило, аваскулярны, а неизмененная васкуляризация имеет место при очагах объемом до 1 куб. см. Дальнейшее увеличение опухоли приводит к появлению участков некроза, что проявляется неоднородной картиной кровоснабжения. Учитывая, что рак простаты может сопровождаться неоваскуляризацией, считается, что допплеровские методики выявляют небольшие очаги рака более эффективно, чем обычное ТрУЗИ.
Другой ультразвуковой технологией, используемой при детекции рака простаты, является ТрУ3И-сонография. Результаты in vitro в сравнении с сонографией в режиме серой шкалы демонстрируют более высокую чувствительность и точность в выявлении и локализации очагов рака простаты.
Очень важно, что с помощью допплеровских методик стала возможна более точная биопсия простаты. Данный подход позволяет улучшить на 10% эффективность биопсии.
Существует лишь небольшое количество пациентов, у которых ультрасонография неэффективна при биопсии. Это ситуации, когда очаги рака пальпируются при пальцевом ректальном исследовании, но не видны при ультразвуковом сканировании. В большинстве случаев ультрасонография позволяет достаточно точно провести биопсийную иглу в исследуемую область простаты.
Контрастное усиление изображения
Основные ограничения цветной и энергетической ультрасонографии определяются недостаточной визуализацией мелких сосудов или сосудов с низким уровнем кровотока. Этот недостаток в настоящее время с успехом компенсируется использованием ультразвуковых контрастных агентов. При этом используются фактически все варианты формирования ультразвуковых изображений:
-
обычное изображение в режиме серой шкалы;
-
гармоническое изображение в режиме серой ш кал ы;
-
допплеровские изображения;
-
гармонические изображения в режиме энергетического Допплера;
-
фазово-инверсионное изображение;
-
3D-энергетическое или цветное допплеровское сканирование.
Начальные исследования, использовавшие контрастирование при цветном допплеровском сканировании, четко продемонстрировали усиление кровотока в очагах рака. При этом не было зафиксировано каких-либо побочных эффектов.
В настоящее время используются комбинированные технологии, наиболее популярной из которых является ЦДК+ЭД исследование инвазивно, так как:
-
необходим внутривенный катетер для введения контраста в кровяное русло;
-
для исследования необходим сканере цветным или энергетическим Допплером;
-
увеличение времени для исследования и интерпретации полученных данных. Временной показатель зависит от опыта врача.
Все обнаруживаемые изменения в равной степени требуют биопсийного подтверждения их связи с наличием рака. Они важны, поскольку обязывают включить дополнительный диагностический резерв.
Однако, чаще всего это исследование проводят для выяснения состояния простатической капсулы - ее прерывистости, поисков очагов истончения или утолщения, а также обнаружения участков выбухания. Относительно роли обычного ТрУЗИ в определении скрининговой программы и, главное стадии, этот метод считается недостаточно чувствительным.
Ряд специалистов для выявляемости рака простаты усложняют методику ультразвукового исследования путем введения ангиографического компонента. Действительно, целый ряд получаемых изображений, выразительных и убедительных, основываются на известном принципе – чем обильнее васкуляризация, тем ярче выявляются границы опухоли. Однако этот метод, как отмечают и сами авторы, не способен установить стадию опухоли, что является определяющим во всей диагностической проблеме.
В специальных изданиях практически отсутствуют данные о диагностической значимости надлонного сканирования при раке простаты. Это досадное упущение, вероятно, объясняется недостаточным желанием получить максимальную информацию при минимальных издержках у пациентов с распространенным раком простаты. Достаточно убедительные сведения выявляются у пациентов с опухолями в стадии Т3 и Т4.
Наличие жидкости в заполненном мочевом пузыре позволяет получить четкое визуальное представление о следующих параметрах:
-
размерах увеличения предстательной железы;
-
деформации шейки мочевого пузыря;
-
объеме выступающей опухоли в просвет мочевого пузыря.
Так, у отдельных пациентов вся предстательная железа оказывается эхонегативной, имеет овальную, яйцевидную форму. Самым необычным феноменом является сохранение данным опухолевым образованием ложных очертаний и, более того, просматриваемостью хирургической капсулы.
В других наблюдениях опухолевое замещение паренхимы может также быть тотальным, но с выступающими фрагментами за пределы очертаний хирургической капсулы.
Хорошо видны выступающие внутрь просвета мочевого пузыря бугристые, неравномерные образования. О признаках экстрапростатического прорастания свидетельствует и сдавление одного или обоих мочеточников. Их тазовые отделы деформированы и расширены.
Несколько необычно визуализируются расширенные семенные пузырьки. Хотя само их прорастание выявить надлонным ультразвуковым сканированием сложно или вообще невозможно, расширение ампулярных частей определяется с достаточной убедительностью. Причиной дилатации служит сдавление внутри простатических отделов опухолевыми образованиями переходной, либо центральной зоны, относящихся, как известно, к переднему раку предстательной железы. Иногда надлонное сканирование помогает распознать и такое редкое заболевание, как рак семенного пузырька.
У отдельных пациентов при умелом проведении ультразвукового сканирования удается определить пузырные внутрипростатические узлы и даже очертания хирургической капсулы. Следовательно, надлонное ультразвуковое сканирование позволяет с минимальными усилиями и затратами получить ценную информацию о распространенности местно-прогрессирующего рака предстательной железы.
Данный метод исследования относится к категории визуальных, позволяющих получить непосредственное изображение предстательной железы, вместе с окружающими ее органами и тканями. По сравнению с рентгенологическими методами МРТ использует энергию противоположного края электромагнитного спектра и не имеет опасных побочных осложнений.
При этом стала реальной трехмерная объемная реконструкция органов, что весьма актуально для выявления контуров и деформации предстательной железы. Главной отличительной характеристикой МРТ следует признать способность получения специфического тканевого сигнала, основанного на показателях времени релаксации.
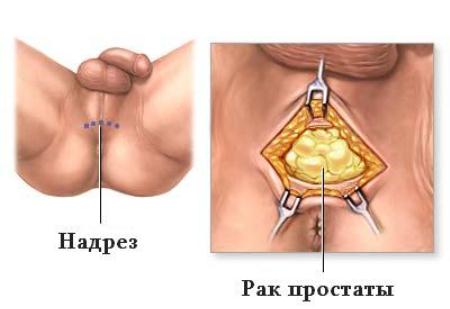
Помимо важности получения характеристик опухоли, МРТ дает возможность рассмотреть некоторые анатомические детали таза, необходимые при проведении радикальной простатэктомии. Выяснено, что длина наружного уретрального сфинктера в среднем составляет 2,1 см. Поэтому для достижения раннего и отдаленного удержания необходимо максимальное сохранение наружного сфинктера, что достигается благодаря селективному пересечению plexus Santorini.
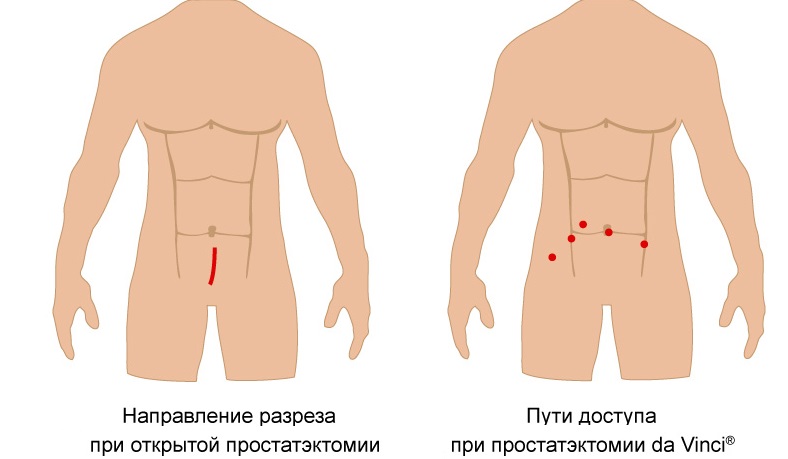
Важнейшим условием адекватного изображения простаты и зональной анатомии ее является, наряду с применением эндоректальных катушек, стандартизация условий исследования. Приступая к получению послойного изображения в коронарной и сагиттальной плоскостях, прежде всего необходимо получить поперечный срез, начиная послойно изучать участки ниже apex и подниматься кверху к семенным пузырькам.
Следует считаться по возможности с осевым планированием слоев, что должно корригироваться изменением угла исследования. Второй плоскостью является получение коронарного изображения, поскольку как краниокаудальное, так и распространение per continuitatum доступно установить. Изображение зональной анатомии простаты возможно за счет получения быстрых тестов с продолжительностью исследования 8 мин для рассмотрения в двух плоскостях.
doctoroff.ru
Реферат - Современные методы ультразвуковой диагностики рака предстательной железы
Рак предстательной железы — одно из наиболее часто встречающихся новообразований у мужчин среднего и пожилого возраста. В настоящее время наблюдается тенденция к лидерству этого заболевания среди мужского населения России. Ранее применявшиеся методы диагностики оказались малоэффективными и при жизни ранние стадии заболевания, как правило, не выявлялись. Учитывая анатомические особенности предстательной железы, специфику клинического течения ее опухолевых заболеваний, современные методы ультразвуковой диагностики существенно улучшают выявляемость этого заболевания. Ультразвуковая томография должна применяться в комплексе с пальцевым ректальным исследованием и иммунологическими методами диагностики. Наиболее информативным методом ультразвуковой диагностики является трансректальное исследование с одновременной секстантной биопсией предстательной железы.
Р ак предстательной железы (РПЖ) — одно из наиболее часто встречающихся новообразований у мужчин среднего и пожилого возраста. В настоящее время наблюдается тенденция к выходу этого заболевания на лидирующее место в структуре онкологической и онкоурологической заболеваемости у мужского населения России и стран СНГ. В некоторых странах мира (США, Швеции, Германии) РПЖ прочно занимает второе место в структуре онкологической заболеваемости у мужчин. По данным американских исследователей, РПЖ в 1992 г. составил 23,4% от всех онкологических заболеваний и 67,9% от онкологических заболеваний мочеполовых органов. В России РПЖ составляет 2,9% всех онкологических и 36% онкоурологических заболеваний. Эти цифры свидетельствуют о том, что, к сожалению, в России мужчины не доживают до РПЖ, так как их средняя продолжительность жизни составляет всего лишь 64,8 лет, по сравнению с 82 годами на Западе. Выявляемость больных при профилактических осмотрах чрезвычайно низка и составляет для РПЖ всего 3,6%. Этот показатель говорит о низкой эффективности наших так называемых профосмотров — среди 1000 больных РПЖ лишь у 36 он выявлен при проведении профессиональных осмотров. Это наряду со спецификой клинической картины РПЖ является одной из причин малого числа вновь выявленных больных с I — II cтадиями заболевания. Формально процент I и II стадий является относительно высоким, но мы все прекрасно знаем, что эта цифра получена у больных, перенесших аденомэктомию или ТУР, и у них случайно выявлен рак. В повседневной же жизни раннии стадии заболевания, как правило, не диагностируются. Летальность на 1-м году жизни после установления диагноза составляет 32%, что свидетельствует о крайне низкой выявляемости начальных стадий заболевания. В связи с особенностями клинического течения и трудностями диагностики около 60% больных на момент начала лечения имеют метастатическое поражение лимфатических узлов или костей. Представленные статистические данные свидетельствуют о том, что вопросы диагностики и лечения РПЖ продолжают оставаться одной из актуальнейших проблем современной онкоурологии. РПЖ значительно отличается от ряда других злокачественных новообразований своим биологическим потенциалом, вариабельностью клинического течения, возможностями использования различных методов лечения. Это объясняется сложностью нейроэндокринной регуляции предстательной железы, нарушение отдельных звеньев которой играет важную роль в патогенезе ее дисгормональных заболеваний — рака и доброкачественной гиперплазии. В последние годы произошел значительный прогресс в развитии методов диагностики РПЖ, направленных по пути выявления первичного очага опухоли и ее распространения в регионарные лимфатические узлы и кости. Возможности диагностики возросли с внедрением в клиническую практику методов определения биохимических маркеров опухолевого роста и развитием методов интроскопии. Тем не менее, проблема РПЖ содержит целый ряд нерешенных вопросов, касающихся диагностики, определения стадии заболевания, гистологической градации, чувствительности к лекарственной и лучевой терапии, показаний к оперативному лечению. Одним из важных клинических вопросов остается ранняя диагностика этого заболевания, так как до сих пор высок процент его позднего выявления (в стадии распространенных метастазов). На сегодняшний момент трансректальное ультразвуковое исследование в сочетании с прицельной биопсией имеет неоспоримые преимущества по сравнению с другими методами интроскопии.
Технология ультразвукового исследования предстательной железы
Трансректальную ультразвуковую томографию нельзя назвать новой методикой исследования. Первые сообщения об использовании ректальных ультразвуковых зондов относятся к 1955 г. Однако получаемые изображения были далеки от совершенства. В начале 70-х годов был разработан ректальный зонд, позволяющий получать двухмерные изображения, но они также были сложны для интерпретации. Только в начале 80-х годов, когда был разработан датчик частотой 5 МГц, удалось получить ультразвуковое изображение предстательной железы удовлетворительного качества. Современные трансректальные датчики, работающие на частоте 7,5 МГц и выше, обеспечивают очень высокое качество изображения и позволяют детально визуализировать структуру простаты и окружающих ее органов и тканей. Трансректальный датчик компактен, имеет длину рабочей части 12 — 15 см и диаметр 15 мм и меньше. По конструктивным особенностям датчики можно разделить на три группы: 1) датчики, работающие в одной плоскости; 2) биплановые датчики, имеющие два трансдьюсера, расположенные тандемом и позволяющие получать изображение железы в поперечной и продольной плоскостях; 3) многоплановые датчики с возможностью плавного изменения плоскости сканирования на 180Ў. Как известно, для получения качественного ультразвукового изображения необходим надежный акустический контакт рабочей поверхности датчика с исследуемой областью. С этой целью на датчик одевают специальный резиновый баллон или обычный презерватив, который плотно фиксируют резиновым кольцом. Через специальный штуцер в баллон вводят небольшое количество жидкости (воды) и через другой штуцер удаляют пузырьки воздуха. Пациент располагается лежа на левом боку с согнутыми в коленях ногами. После введения датчика в прямую кишку можно несколько увеличить объем жидкости в баллоне для более надежного контакта рабочей поверхности датчика со стенкой прямой кишки. Постепенно продвигая датчик, осматривают предстательную железу, перипростатическую клетчатку, обл. семенных пузырьков, шейку и дно мочевого пузыря. На сегодняшний день не утратил актуальности и трансабдоминальный способ исследования простаты. Методика позволяет оценить размер железы и выявить грубые изменения со стороны тазовых органов. Однако большое количество артефактов и ряд объективных причин (например, недержание мочи) не позволяют получить качественное изображение структуры предстательной железы. Тем не менее мы считаем, что начинать исследование простаты необходимо именно трансабдоминальным доступом, чтобы получить общее представление о состоянии органов таза, а затем переходить к трансректальному исследованию.
Нормальная ультразвуковая анатомия предстательной железы
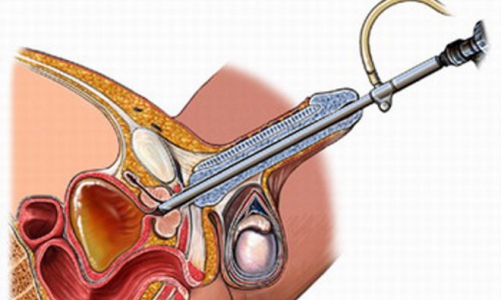
Неизмененная предстательная железа имеет треугольную форму значительно меньшим переднезадним размером по сравнению с поперечным. Основание железы плотно спаяно с шейкой мочевого пузыря. Узкая часть или верхушка обращена к мочеполовой диафрагме. Задняя поверхность железы слегка вогнута и образует так называемую междолевую борозду. В норме поперечный размер железы составляет 40 — 45 мм, переднезадний — 20 — 27 мм и продольный — 35 — 40 мм. На ультразвуковой томограмме можно различить центральную и периферическую зоны простаты. Периферическая зона (занимающая в норме большую часть железы) характеризуется отражениями средней интенсивности и имеет однородную структуру. Центральная зона, расположенная вокруг простатического отдела уретры и представленная периуретральными железами, по эхогенности ниже периферической зоны и имеет ячеистую структуру. В области шейки мочевого пузыря можно выделить гипоэхогенную фибромускулярную строму, не содержащую желез, которая формирует переднюю часть простаты. Следует отметить, что с возрастом при развитии доброкачественной гиперплазии и при воспалительных заболеваниях центральная и периферические зоны железы могут не дифференцироваться. Простатический отдел уретры определяется в виде гипоэхогенного тяжа, проходящего через центральную зону железы. Простата окружена перипростатической жировой клетчаткой и фасцией, которые формируют гиперэхогенный «пограничный слой», описываемый многими исследователями как капсула железы. Истинная капсула железы, если ее удается визуализировать, определяется в виде очень тонкой гипоэхогенной прерывистой линии по поверхности железы. Жировая клетчатка и фасция отграничивают заднюю поверхность железы от прямой кишки. Семенные пузырьки визуализируются в виде симметричных гипоэхогенных тяжей, расположенных между простатой и мочевым пузырем. Размеры семенных пузырьков весьма индивидуальны, в норме длина их может достигать7,5 см, а переднезадний размер — 1,9 — 2,0 см. Одним из наиболее распространенных заболеваний простаты является аденома или, по современной номенклатуре, доброкачественная гиперплазия (ДГП). Признаки ДГП можно выявить у мужчин в возрасте 40-45 лет. В возрасте старше 50 лет около 50% мужчин страдает этим заболеванием. В более старшей возрастной группе частота ДГП возрастает и у мужчин старше 60 лет заболевание встречается в 50 — 75% случаев, а в возрасте старше 80 лет — у 85% мужчин. Ультразвуковая картина ДГП характеризуется диффузным увеличением железы, преимущественно в переднезаднем размере. В связи с этим железа приобретает округлую, шаровидную форму. При значительном увеличении объема железы гиперэхогенный «пограничный слой» истончается и в ряде случаев может не дифференцироваться. В связи с пролиферацией железистых и стромальных элементов периуретральной ткани (или центральной зоны) и появлением узлов гиперплазии, оттесняющих ткань простаты, формируется так называемая хирургическая капсула, которая приобретает вид кортикальной зоны, примыкающей к зоне гиперплазии. Простатический отдел уретры удлиняется, деформируется и сдавливается, что является причиной нарушения мочеиспускания. Несмотря на значительное увеличение размеров железы, сохраняется ее симметрия и относительная однородность, за исключением случаев, связанных с наличием амилоидных телец, кальцификатов, очагового простатита и сочетания ДГП и рака. В некоторых случаях узлы гиперплазии развиваются неравномерно, в результате чего нарушается симметрия железы и ее размеры увеличиваются за счет одной из долей. Однако контур железы остается ровным. Ультразвуковая структура простаты при доброкачественной гиперплазии определяется преобладанием в ней железистых или стромальных элементов. При значительной стромальной пролиферации железистая ткань разделяется большим количеством стромы и коллагеновых волокон, что проявляется в виде множества линейных отражений средней и высокой интенсивности. При преобладании железистой пролиферации эхогенность железы снижается, ткань ее приобретает ячеистую структуру со множеством мелких кистоподобных включений. Амилоидные тельца, представляющие собой желеобразное вещество, выделяемое ацинусами, и кальцификаты определяются в виде гиперэхогенных включений, располагающихся по границе хирургической капсулы или в толще железы. В отличие от кальцификатов амилоидные тельца не дают акустической тени. Несмотря на различие гистологической и ультразвуковой картины, при доброкачественной гиперплазии предстательная железа сохраняет шаровидную форму и гладкий контур. Так же как и доброкачественная гиперплазия, рак простаты является дисгормональным заболеванием. Под влиянием эндокринных сдвигов в предстательной железе возникает прогрессирование частоты атипичной гиперплазии, которая развивается чаще в периферической зоне простаты. Это коррелирует с фактом повышенной чувствительности периферической зоны к развитию в ней рака. Учитывая это, при оценке результатов ультразвуковой томографии может использоваться простой и достаточно надежный дифференциально-диагностический принцип. Структурные изменения, локализующиеся в пределах центральной зоны, с большей вероятностью могут быть отнесены к проявлениям доброкачественного процесса. Изменения, локализующиеся в периферической зоне, чаще соответствуют злокачественной опухоли. Периферическая зона занимает 75% объема простаты и в этой части железы рак возникает в 80% случаев. Большей частью опухоль располагается на глубине 3-4 мм от пограничного слоя. Центральная зона занимает около 20% объема железы. В этой части простаты развивается только 5% злокачественных новообразований. Вокруг простатического отдела уретры располагается тонкий участок железистой ткани — так называемая переходная зона. В норме она практически не дифференцируется от центральной зоны и занимает всего 5% объема простаты. В переходной зоне рак развивается в 20% случаев. Опухоль, локализующаяся в периферической зоне простаты, часто легко пальпируется и хорошо определяется при ультразвуковом исследовании. Так как образование располагается на небольшой глубине от поверхности железы и не вызывает сдавления простатического отдела уретры, заболевание нередко диагностируется на стадии распространения на перипростатические ткани. Наиболее характерными признаками рака простаты, локализующегося в периферической зоне, является наличие одного или нескольких узлов неправильной формы и пониженной эхогенности. Нередко узел окружен гиперэхогенным ободком, что объясняется фиброзной реакцией соединительной ткани предстательной железы, окружающей опухолевый очаг. К характерным особенностям рака простаты относится бугристый контур железы с признаками пенетрации пограничного слоя. Выявление ультразвуковых признаков прорастания пограничного слоя позволяет правильно установить степень локального распространения опухолевого процесса, особенно при инфильтрации переднебоковой поверхности железы, которая не определяется при пальцевом исследовании. Наиболее сложными для диагностики являются опухоли, локализующиеся в центральной и переходной зонах железы. Развиваясь на фоне доброкачественной гиперплазии, опухоль по эхогенности практически не отличается от окружающих тканей, и диагноз часто устанавливается при гистологическом исследовании энуклиированных узлов после трансуретральной резекции по поводу доброкачественной гиперплазии. При массивной опухолевой инфильтрации стромы железы меняется ее ультразвуковая структура. Ткань железы становится неоднородной, с беспорядочными отражениями низкой интенсивности. Как указывалось, ультразвуковая томография позволяет выявить инфильтрацию перипростатических тканей, семенных пузырьков, мочевого пузыря, стенки прямой кишки. В связи с этим ультразвуковое исследование позволяет определить стадию заболевания и увеличить частоту выявления потенциально курабельного рака предстательной железы. При прорастании опухолью пограничного слоя опухолевый инфильтрат распространяется по парапростатической клетчатке к стенкам таза, инфильтрирует семенные пузырьки и дно мочевого пузыря. Характерным ультразвуковым признаком является деформация или отсутствие изображения семенных пузырьков, инфильтрированных опухолью. Клиническое значение ультразвуковой томографии при раке простаты определяется возможностью выявления минимальных изменений в структуре железы. Это позволяет дать оценку локальному распространению так называемой фокальной опухоли, которая не дает клинической симптоматики и пальпаторно не определяется. Конечно, ультразвуковое исследование не является самостоятельным методом диагностики рака простаты. Диагностический комплекс должен включать в себя обязательное пальцевое ректальное исследование, определение уровня простатспецифического антигена (ПСА) в сыворотке крови и трансректальное ультразвуковое исследование. На сегодняшний день ПСА является одним из самых чувствительных биологических маркеров для ранней диагностики РПЖ. В норме уровень ПСА не превышает 2,5-4,0 нг/мл. Повышение уровня ПСА выше этих значений требует дополнительных диагностических манипуляций. Однако следует отметить, что уровень ПСА может повышаться и при неопухолевых заболеваниях простаты, таких как простатит и доброкачественная гиперплазия, но значения его не превышают 10-16 нг/мл. Повышение уровня ПСА, на наш взгляд, даже при отрицательном результате пальцевого и ультразвукового ректального исследования требует биопсии простаты под ультразвуковым наведением. Биопсия простаты может быть выполнена двумя способами — промежностным доступом и трансректально. По нашему мнению, наиболее простым и необременительным для больного является трансректальный доступ. Для этого необходим датчик с биопсийным каналом в его корпусе или специальная насадка для трансректальной биопсии. При биопсии трансректальным доступом не требуется введения большого количества анестетика. Попадающие при этом в ткани микропузырьки воздуха значительно ухудшают изображение. Биопсию промежностным доступом можно проводить без специальных приспособлений, однако эта процедура более травматична и дает худшие результаты по сравнению с трансректальной. В тех случаях, когда показаниями к биопсии является только повышение уровня ПСА и при ультразвуковом исследовании не выявляются очаговые изменения в ткани простаты, биопсию берут из нескольких участков железы, как правило, по три фрагмента ткани из каждой доли (так называемая секстантная биопсия). Подобная методика, включающая в себя ультразвуковую томографию, определение уровня ПСА и биопсию, позволяет существенно повысить уровень ранней диагностики РПЖ. Таким образом, учитывая анатомические особенности предстательной железы и специфику клинического течения ее опухолевых заболеваний, ультразвуковая томография должна применяться в комплексе с пальцевым ректальным исследованием и иммунологическими методами диагностики. При этом наиболее информативным методом является трансректальное ультразвуковое исследование в сочетании с секстантной биопсией простаты.
Литература:
1. Игнашин Н.С. Инвазивные ультразвуковые вмешательства в диагностике и лечении урологических заболеваний: Дис. докт. мед. наук. — М., 1989. 2. Клиническое руководство по ультразвуковой диагностике под ред. В.В. Митькова. М.,1996. — Т. 1. 3. McNeal J.E. Normal and pathologic anatomy of prostate. Urology 1981;17:11-16.
www.ronl.ru
Дипломная работа - Современные методы ультразвуковой диагностики рака предстательной железы
Рак предстательной железы — одно из наиболее часто встречающихся новообразований у мужчин среднего и пожилого возраста. В настоящее время наблюдается тенденция к лидерству этого заболевания среди мужского населения России. Ранее применявшиеся методы диагностики оказались малоэффективными и при жизни ранние стадии заболевания, как правило, не выявлялись. Учитывая анатомические особенности предстательной железы, специфику клинического течения ее опухолевых заболеваний, современные методы ультразвуковой диагностики существенно улучшают выявляемость этого заболевания. Ультразвуковая томография должна применяться в комплексе с пальцевым ректальным исследованием и иммунологическими методами диагностики. Наиболее информативным методом ультразвуковой диагностики является трансректальное исследование с одновременной секстантной биопсией предстательной железы.
Р ак предстательной железы (РПЖ) — одно из наиболее часто встречающихся новообразований у мужчин среднего и пожилого возраста. В настоящее время наблюдается тенденция к выходу этого заболевания на лидирующее место в структуре онкологической и онкоурологической заболеваемости у мужского населения России и стран СНГ. В некоторых странах мира (США, Швеции, Германии) РПЖ прочно занимает второе место в структуре онкологической заболеваемости у мужчин. По данным американских исследователей, РПЖ в 1992 г. составил 23,4% от всех онкологических заболеваний и 67,9% от онкологических заболеваний мочеполовых органов. В России РПЖ составляет 2,9% всех онкологических и 36% онкоурологических заболеваний. Эти цифры свидетельствуют о том, что, к сожалению, в России мужчины не доживают до РПЖ, так как их средняя продолжительность жизни составляет всего лишь 64,8 лет, по сравнению с 82 годами на Западе. Выявляемость больных при профилактических осмотрах чрезвычайно низка и составляет для РПЖ всего 3,6%. Этот показатель говорит о низкой эффективности наших так называемых профосмотров — среди 1000 больных РПЖ лишь у 36 он выявлен при проведении профессиональных осмотров. Это наряду со спецификой клинической картины РПЖ является одной из причин малого числа вновь выявленных больных с I — II cтадиями заболевания. Формально процент I и II стадий является относительно высоким, но мы все прекрасно знаем, что эта цифра получена у больных, перенесших аденомэктомию или ТУР, и у них случайно выявлен рак. В повседневной же жизни раннии стадии заболевания, как правило, не диагностируются. Летальность на 1-м году жизни после установления диагноза составляет 32%, что свидетельствует о крайне низкой выявляемости начальных стадий заболевания. В связи с особенностями клинического течения и трудностями диагностики около 60% больных на момент начала лечения имеют метастатическое поражение лимфатических узлов или костей. Представленные статистические данные свидетельствуют о том, что вопросы диагностики и лечения РПЖ продолжают оставаться одной из актуальнейших проблем современной онкоурологии. РПЖ значительно отличается от ряда других злокачественных новообразований своим биологическим потенциалом, вариабельностью клинического течения, возможностями использования различных методов лечения. Это объясняется сложностью нейроэндокринной регуляции предстательной железы, нарушение отдельных звеньев которой играет важную роль в патогенезе ее дисгормональных заболеваний — рака и доброкачественной гиперплазии. В последние годы произошел значительный прогресс в развитии методов диагностики РПЖ, направленных по пути выявления первичного очага опухоли и ее распространения в регионарные лимфатические узлы и кости. Возможности диагностики возросли с внедрением в клиническую практику методов определения биохимических маркеров опухолевого роста и развитием методов интроскопии. Тем не менее, проблема РПЖ содержит целый ряд нерешенных вопросов, касающихся диагностики, определения стадии заболевания, гистологической градации, чувствительности к лекарственной и лучевой терапии, показаний к оперативному лечению. Одним из важных клинических вопросов остается ранняя диагностика этого заболевания, так как до сих пор высок процент его позднего выявления (в стадии распространенных метастазов). На сегодняшний момент трансректальное ультразвуковое исследование в сочетании с прицельной биопсией имеет неоспоримые преимущества по сравнению с другими методами интроскопии.
Технология ультразвукового исследования предстательной железы
Трансректальную ультразвуковую томографию нельзя назвать новой методикой исследования. Первые сообщения об использовании ректальных ультразвуковых зондов относятся к 1955 г. Однако получаемые изображения были далеки от совершенства. В начале 70-х годов был разработан ректальный зонд, позволяющий получать двухмерные изображения, но они также были сложны для интерпретации. Только в начале 80-х годов, когда был разработан датчик частотой 5 МГц, удалось получить ультразвуковое изображение предстательной железы удовлетворительного качества. Современные трансректальные датчики, работающие на частоте 7,5 МГц и выше, обеспечивают очень высокое качество изображения и позволяют детально визуализировать структуру простаты и окружающих ее органов и тканей. Трансректальный датчик компактен, имеет длину рабочей части 12 — 15 см и диаметр 15 мм и меньше. По конструктивным особенностям датчики можно разделить на три группы: 1) датчики, работающие в одной плоскости; 2) биплановые датчики, имеющие два трансдьюсера, расположенные тандемом и позволяющие получать изображение железы в поперечной и продольной плоскостях; 3) многоплановые датчики с возможностью плавного изменения плоскости сканирования на 180Ў. Как известно, для получения качественного ультразвукового изображения необходим надежный акустический контакт рабочей поверхности датчика с исследуемой областью. С этой целью на датчик одевают специальный резиновый баллон или обычный презерватив, который плотно фиксируют резиновым кольцом. Через специальный штуцер в баллон вводят небольшое количество жидкости (воды) и через другой штуцер удаляют пузырьки воздуха. Пациент располагается лежа на левом боку с согнутыми в коленях ногами. После введения датчика в прямую кишку можно несколько увеличить объем жидкости в баллоне для более надежного контакта рабочей поверхности датчика со стенкой прямой кишки. Постепенно продвигая датчик, осматривают предстательную железу, перипростатическую клетчатку, обл. семенных пузырьков, шейку и дно мочевого пузыря. На сегодняшний день не утратил актуальности и трансабдоминальный способ исследования простаты. Методика позволяет оценить размер железы и выявить грубые изменения со стороны тазовых органов. Однако большое количество артефактов и ряд объективных причин (например, недержание мочи) не позволяют получить качественное изображение структуры предстательной железы. Тем не менее мы считаем, что начинать исследование простаты необходимо именно трансабдоминальным доступом, чтобы получить общее представление о состоянии органов таза, а затем переходить к трансректальному исследованию.
Нормальная ультразвуковая анатомия предстательной железы
Неизмененная предстательная железа имеет треугольную форму значительно меньшим переднезадним размером по сравнению с поперечным. Основание железы плотно спаяно с шейкой мочевого пузыря. Узкая часть или верхушка обращена к мочеполовой диафрагме. Задняя поверхность железы слегка вогнута и образует так называемую междолевую борозду. В норме поперечный размер железы составляет 40 — 45 мм, переднезадний — 20 — 27 мм и продольный — 35 — 40 мм. На ультразвуковой томограмме можно различить центральную и периферическую зоны простаты. Периферическая зона (занимающая в норме большую часть железы) характеризуется отражениями средней интенсивности и имеет однородную структуру. Центральная зона, расположенная вокруг простатического отдела уретры и представленная периуретральными железами, по эхогенности ниже периферической зоны и имеет ячеистую структуру. В области шейки мочевого пузыря можно выделить гипоэхогенную фибромускулярную строму, не содержащую желез, которая формирует переднюю часть простаты. Следует отметить, что с возрастом при развитии доброкачественной гиперплазии и при воспалительных заболеваниях центральная и периферические зоны железы могут не дифференцироваться. Простатический отдел уретры определяется в виде гипоэхогенного тяжа, проходящего через центральную зону железы. Простата окружена перипростатической жировой клетчаткой и фасцией, которые формируют гиперэхогенный «пограничный слой», описываемый многими исследователями как капсула железы. Истинная капсула железы, если ее удается визуализировать, определяется в виде очень тонкой гипоэхогенной прерывистой линии по поверхности железы. Жировая клетчатка и фасция отграничивают заднюю поверхность железы от прямой кишки. Семенные пузырьки визуализируются в виде симметричных гипоэхогенных тяжей, расположенных между простатой и мочевым пузырем. Размеры семенных пузырьков весьма индивидуальны, в норме длина их может достигать7,5 см, а переднезадний размер — 1,9 — 2,0 см. Одним из наиболее распространенных заболеваний простаты является аденома или, по современной номенклатуре, доброкачественная гиперплазия (ДГП). Признаки ДГП можно выявить у мужчин в возрасте 40-45 лет. В возрасте старше 50 лет около 50% мужчин страдает этим заболеванием. В более старшей возрастной группе частота ДГП возрастает и у мужчин старше 60 лет заболевание встречается в 50 — 75% случаев, а в возрасте старше 80 лет — у 85% мужчин. Ультразвуковая картина ДГП характеризуется диффузным увеличением железы, преимущественно в переднезаднем размере. В связи с этим железа приобретает округлую, шаровидную форму. При значительном увеличении объема железы гиперэхогенный «пограничный слой» истончается и в ряде случаев может не дифференцироваться. В связи с пролиферацией железистых и стромальных элементов периуретральной ткани (или центральной зоны) и появлением узлов гиперплазии, оттесняющих ткань простаты, формируется так называемая хирургическая капсула, которая приобретает вид кортикальной зоны, примыкающей к зоне гиперплазии. Простатический отдел уретры удлиняется, деформируется и сдавливается, что является причиной нарушения мочеиспускания. Несмотря на значительное увеличение размеров железы, сохраняется ее симметрия и относительная однородность, за исключением случаев, связанных с наличием амилоидных телец, кальцификатов, очагового простатита и сочетания ДГП и рака. В некоторых случаях узлы гиперплазии развиваются неравномерно, в результате чего нарушается симметрия железы и ее размеры увеличиваются за счет одной из долей. Однако контур железы остается ровным. Ультразвуковая структура простаты при доброкачественной гиперплазии определяется преобладанием в ней железистых или стромальных элементов. При значительной стромальной пролиферации железистая ткань разделяется большим количеством стромы и коллагеновых волокон, что проявляется в виде множества линейных отражений средней и высокой интенсивности. При преобладании железистой пролиферации эхогенность железы снижается, ткань ее приобретает ячеистую структуру со множеством мелких кистоподобных включений. Амилоидные тельца, представляющие собой желеобразное вещество, выделяемое ацинусами, и кальцификаты определяются в виде гиперэхогенных включений, располагающихся по границе хирургической капсулы или в толще железы. В отличие от кальцификатов амилоидные тельца не дают акустической тени. Несмотря на различие гистологической и ультразвуковой картины, при доброкачественной гиперплазии предстательная железа сохраняет шаровидную форму и гладкий контур. Так же как и доброкачественная гиперплазия, рак простаты является дисгормональным заболеванием. Под влиянием эндокринных сдвигов в предстательной железе возникает прогрессирование частоты атипичной гиперплазии, которая развивается чаще в периферической зоне простаты. Это коррелирует с фактом повышенной чувствительности периферической зоны к развитию в ней рака. Учитывая это, при оценке результатов ультразвуковой томографии может использоваться простой и достаточно надежный дифференциально-диагностический принцип. Структурные изменения, локализующиеся в пределах центральной зоны, с большей вероятностью могут быть отнесены к проявлениям доброкачественного процесса. Изменения, локализующиеся в периферической зоне, чаще соответствуют злокачественной опухоли. Периферическая зона занимает 75% объема простаты и в этой части железы рак возникает в 80% случаев. Большей частью опухоль располагается на глубине 3-4 мм от пограничного слоя. Центральная зона занимает около 20% объема железы. В этой части простаты развивается только 5% злокачественных новообразований. Вокруг простатического отдела уретры располагается тонкий участок железистой ткани — так называемая переходная зона. В норме она практически не дифференцируется от центральной зоны и занимает всего 5% объема простаты. В переходной зоне рак развивается в 20% случаев. Опухоль, локализующаяся в периферической зоне простаты, часто легко пальпируется и хорошо определяется при ультразвуковом исследовании. Так как образование располагается на небольшой глубине от поверхности железы и не вызывает сдавления простатического отдела уретры, заболевание нередко диагностируется на стадии распространения на перипростатические ткани. Наиболее характерными признаками рака простаты, локализующегося в периферической зоне, является наличие одного или нескольких узлов неправильной формы и пониженной эхогенности. Нередко узел окружен гиперэхогенным ободком, что объясняется фиброзной реакцией соединительной ткани предстательной железы, окружающей опухолевый очаг. К характерным особенностям рака простаты относится бугристый контур железы с признаками пенетрации пограничного слоя. Выявление ультразвуковых признаков прорастания пограничного слоя позволяет правильно установить степень локального распространения опухолевого процесса, особенно при инфильтрации переднебоковой поверхности железы, которая не определяется при пальцевом исследовании. Наиболее сложными для диагностики являются опухоли, локализующиеся в центральной и переходной зонах железы. Развиваясь на фоне доброкачественной гиперплазии, опухоль по эхогенности практически не отличается от окружающих тканей, и диагноз часто устанавливается при гистологическом исследовании энуклиированных узлов после трансуретральной резекции по поводу доброкачественной гиперплазии. При массивной опухолевой инфильтрации стромы железы меняется ее ультразвуковая структура. Ткань железы становится неоднородной, с беспорядочными отражениями низкой интенсивности. Как указывалось, ультразвуковая томография позволяет выявить инфильтрацию перипростатических тканей, семенных пузырьков, мочевого пузыря, стенки прямой кишки. В связи с этим ультразвуковое исследование позволяет определить стадию заболевания и увеличить частоту выявления потенциально курабельного рака предстательной железы. При прорастании опухолью пограничного слоя опухолевый инфильтрат распространяется по парапростатической клетчатке к стенкам таза, инфильтрирует семенные пузырьки и дно мочевого пузыря. Характерным ультразвуковым признаком является деформация или отсутствие изображения семенных пузырьков, инфильтрированных опухолью. Клиническое значение ультразвуковой томографии при раке простаты определяется возможностью выявления минимальных изменений в структуре железы. Это позволяет дать оценку локальному распространению так называемой фокальной опухоли, которая не дает клинической симптоматики и пальпаторно не определяется. Конечно, ультразвуковое исследование не является самостоятельным методом диагностики рака простаты. Диагностический комплекс должен включать в себя обязательное пальцевое ректальное исследование, определение уровня простатспецифического антигена (ПСА) в сыворотке крови и трансректальное ультразвуковое исследование. На сегодняшний день ПСА является одним из самых чувствительных биологических маркеров для ранней диагностики РПЖ. В норме уровень ПСА не превышает 2,5-4,0 нг/мл. Повышение уровня ПСА выше этих значений требует дополнительных диагностических манипуляций. Однако следует отметить, что уровень ПСА может повышаться и при неопухолевых заболеваниях простаты, таких как простатит и доброкачественная гиперплазия, но значения его не превышают 10-16 нг/мл. Повышение уровня ПСА, на наш взгляд, даже при отрицательном результате пальцевого и ультразвукового ректального исследования требует биопсии простаты под ультразвуковым наведением. Биопсия простаты может быть выполнена двумя способами — промежностным доступом и трансректально. По нашему мнению, наиболее простым и необременительным для больного является трансректальный доступ. Для этого необходим датчик с биопсийным каналом в его корпусе или специальная насадка для трансректальной биопсии. При биопсии трансректальным доступом не требуется введения большого количества анестетика. Попадающие при этом в ткани микропузырьки воздуха значительно ухудшают изображение. Биопсию промежностным доступом можно проводить без специальных приспособлений, однако эта процедура более травматична и дает худшие результаты по сравнению с трансректальной. В тех случаях, когда показаниями к биопсии является только повышение уровня ПСА и при ультразвуковом исследовании не выявляются очаговые изменения в ткани простаты, биопсию берут из нескольких участков железы, как правило, по три фрагмента ткани из каждой доли (так называемая секстантная биопсия). Подобная методика, включающая в себя ультразвуковую томографию, определение уровня ПСА и биопсию, позволяет существенно повысить уровень ранней диагностики РПЖ. Таким образом, учитывая анатомические особенности предстательной железы и специфику клинического течения ее опухолевых заболеваний, ультразвуковая томография должна применяться в комплексе с пальцевым ректальным исследованием и иммунологическими методами диагностики. При этом наиболее информативным методом является трансректальное ультразвуковое исследование в сочетании с секстантной биопсией простаты.
Литература:
1. Игнашин Н.С. Инвазивные ультразвуковые вмешательства в диагностике и лечении урологических заболеваний: Дис. докт. мед. наук. — М., 1989. 2. Клиническое руководство по ультразвуковой диагностике под ред. В.В. Митькова. М.,1996. — Т. 1. 3. McNeal J.E. Normal and pathologic anatomy of prostate. Urology 1981;17:11-16.
www.ronl.ru
Современные методы ультразвуковой диагностики рака предстательной железы
Современные методы ультразвуковой диагностики рака предстательной железы
Рак предстательной железы - одно из наиболее часто встречающихся новообразований у мужчин среднего и пожилого возраста. В настоящее время наблюдается тенденция к лидерству этого заболевания среди мужского населения России. Ранее применявшиеся методы диагностики оказались малоэффективными и при жизни ранние стадии заболевания, как правило, не выявлялись. Учитывая анатомические особенности предстательной железы, специфику клинического течения ее опухолевых заболеваний, современные методы ультразвуковой диагностики существенно улучшают выявляемость этого заболевания. Ультразвуковая томография должна применяться в комплексе с пальцевым ректальным исследованием и иммунологическими методами диагностики. Наиболее информативным методом ультразвуковой диагностики является трансректальное исследование с одновременной секстантной биопсией предстательной железы.
Рак предстательной железы (РПЖ) - одно из наиболее часто встречающихся новообразований у мужчин среднего и пожилого возраста. В настоящее время наблюдается тенденция к выходу этого заболевания на лидирующее место в структуре онкологической и онкоурологической заболеваемости у мужского населения России и стран СНГ. В некоторых странах мира (США, Швеции, Германии) РПЖ прочно занимает второе место в структуре онкологической заболеваемости у мужчин.По данным американских исследователей, РПЖ в 1992 г. составил 23,4% от всех онкологических заболеваний и 67,9% от онкологических заболеваний мочеполовых органов.В России РПЖ составляет 2,9% всех онкологических и 36% онкоурологических заболеваний. Эти цифры свидетельствуют о том, что, к сожалению, в России мужчины не доживают до РПЖ, так как их средняя продолжительность жизни составляет всего лишь 64,8 лет, по сравнению с 82 годами на Западе. Выявляемость больных при профилактических осмотрах чрезвычайно низка и составляет для РПЖ всего 3,6%. Этот показатель говорит о низкой эффективности наших так называемых профосмотров - среди 1000 больных РПЖ лишь у 36 он выявлен при проведении профессиональных осмотров. Это наряду со спецификой клинической картины РПЖ является одной из причин малого числа вновь выявленных больных с I - II cтадиями заболевания. Формально процент I и II стадий является относительно высоким, но мы все прекрасно знаем, что эта цифра получена у больных, перенесших аденомэктомию или ТУР, и у них случайно выявлен рак. В повседневной же жизни раннии стадии заболевания, как правило, не диагностируются. Летальность на 1-м году жизни после установления диагноза составляет 32%, что свидетельствует о крайне низкой выявляемости начальных стадий заболевания. В связи с особенностями клинического течения и трудностями диагностики около 60% больных на момент начала лечения имеют метастатическое поражение лимфатических узлов или костей.Представленные статистические данные свидетельствуют о том, что вопросы диагностики и лечения РПЖ продолжают оставаться одной из актуальнейших проблем современной онкоурологии.РПЖ значительно отличается от ряда других злокачественных новообразований своим биологическим потенциалом, вариабельностью клинического течения, возможностями использования различных методов лечения. Это объясняется сложностью нейроэндокринной регуляции предстательной железы, нарушение отдельных звеньев которой играет важную роль в патогенезе ее дисгормональных заболеваний - рака и доброкачественной гиперплазии.В последние годы произошел значительный прогресс в развитии методов диагностики РПЖ, направленных по пути выявления первичного очага опухоли и ее распространения в регионарные лимфатические узлы и кости. Возможности диагностики возросли с внедрением в клиническую практику методов определения биохимических маркеров опухолевого роста и развитием методов интроскопии. Тем не менее, проблема РПЖ содержит целый ряд нерешенных вопросов, касающихся диагностики, определения стадии заболевания, гистологической градации, чувствительности к лекарственной и лучевой терапии, показаний к оперативному лечению. Одним из важных клинических вопросов остается ранняя диагностика этого заболевания, так как до сих пор высок процент его позднего выявления (в стадии распространенных метастазов).На сегодняшний момент трансректальное ультразвуковое исследование в сочетании с прицельной биопсией имеет неоспоримые преимущества по сравнению с другими методами интроскопии.
Технология ультразвукового исследования предстательной железы
Трансректальную ультразвуковую томографию нельзя назвать новой методикой исследования. Первые сообщения об использовании ректальных ультразвуковых зондов относятся к 1955 г. Однако получаемые изображения были далеки от совершенства. В начале 70-х годов был разработан ректальный зонд, позволяющий получать двухмерные изображения, но они также были сложны для интерпретации. Только в начале 80-х годов, когда был разработан датчик частотой 5 МГц, удалось получить ультразвуковое изображение предстательной железы удовлетворительного качества. Современные трансректальные датчики, работающие на частоте 7,5 МГц и выше, обеспечивают очень высокое качество изображения и позволяют детально визуализировать структуру простаты и окружающих ее органов и тканей. Трансректальный датчик компактен, имеет длину рабочей части 12 - 15 см и диаметр 15 мм и меньше. По конструктивным особенностям датчики можно разделить на три группы: 1) датчики, работающие в одной плоскости; 2) биплановые датчики, имеющие два трансдьюсера, расположенные тандемом и позволяющие получать изображение железы в поперечной и продольной плоскостях; 3) многоплановые датчики с возможностью плавного изменения плоскости сканирования на 180Ў. Как известно, для получения качественного ультразвукового изображения необходим надежный акустический контакт рабочей поверхности датчика с исследуемой областью. С этой целью на датчик одевают специальный резиновый баллон или обычный презерватив, который плотно фиксируют резиновым кольцом. Через специальный штуцер в баллон вводят небольшое количество жидкости (воды) и через другой штуцер удаляют пузырьки воздуха. Пациент располагается лежа на левом боку с согнутыми в коленях ногами. После введения датчика в прямую кишку можно несколько увеличить объем жидкости в баллоне для более надежного контакта рабочей поверхности датчика со стенкой прямой кишки. Постепенно продвигая датчик, осматривают предстательную железу, перипростатическую клетчатку, обл. семенных пузырьков, шейку и дно мочевого пузыря.На сегодняшний день не утратил актуальности и трансабдоминальный способ исследования простаты. Методика позволяет оценить размер железы и выявить грубые изменения со стороны тазовых органов. Однако большое количество артефактов и ряд объективных причин (например, недержание мочи) не позволяют получить качественное изображение структуры предстательной железы. Тем не менее мы считаем, что начинать исследование простаты необходимо именно трансабдоминальным доступом, чтобы получить общее представление о состоянии органов таза, а затем переходить к трансректальному исследованию.
Нормальная ультразвуковая анатомия предстательной железы
Неизмененная предстательная железа имеет треугольную форму значительно меньшим переднезадним размером по сравнению с поперечным. Основание железы плотно спаяно с шейкой мочевого пузыря. Узкая часть или верхушка обращена к мочеполовой диафрагме. Задняя поверхность железы слегка вогнута и образует так называемую междолевую борозду. В норме поперечный размер железы составляет 40 - 45 мм, переднезадний - 20 - 27 мм и продольный - 35 - 40 мм. На ультразвуковой томограмме можно различить центральную и периферическую зоны простаты. Периферическая зона (занимающая в норме большую часть железы) характеризуется отражениями средней интенсивности и имеет однородную структуру. Центральная зона, расположенная вокруг простатического отдела уретры и представленная периуретральными железами, по эхогенности ниже периферической зоны и имеет ячеистую структуру. В области шейки мочевого пузыря можно выделить гипоэхогенную фибромускулярную строму, не содержащую желез, которая формирует переднюю часть простаты. Следует отметить, что с возрастом при развитии доброкачественной гиперплазии и при воспалительных заболеваниях центральная и периферические зоны железы могут не дифференцироваться. Простатический отдел уретры определяется в виде гипоэхогенного тяжа, проходящего через центральную зону железы.Простата окружена перипростатической жировой клетчаткой и фасцией, которые формируют гиперэхогенный "пограничный слой", описываемый многими исследователями как капсула железы. Истинная капсула железы, если ее удается визуализировать, определяется в виде очень тонкой гипоэхогенной прерывистой линии по поверхности железы. Жировая клетчатка и фасция отграничивают заднюю поверхность железы от прямой кишки.Семенные пузырьки визуализируются в виде симметричных гипоэхогенных тяжей, расположенных между простатой и мочевым пузырем. Размеры семенных пузырьков весьма индивидуальны, в норме длина их может достигать7,5 см, а переднезадний размер - 1,9 - 2,0 см. Одним из наиболее распространенных заболеваний простаты является аденома или, по современной номенклатуре, доброкачественная гиперплазия (ДГП). Признаки ДГП можно выявить у мужчин в возрасте 40-45 лет. В возрасте старше 50 лет около 50% мужчин страдает этим заболеванием. В более старшей возрастной группе частота ДГП возрастает и у мужчин старше 60 лет заболевание встречается в 50 - 75% случаев, а в возрасте старше 80 лет - у 85% мужчин. Ультразвуковая картина ДГП характеризуется диффузным увеличением железы, преимущественно в переднезаднем размере. В связи с этим железа приобретает округлую, шаровидную форму. При значительном увеличении объема железы гиперэхогенный "пограничный слой" истончается и в ряде случаев может не дифференцироваться. В связи с пролиферацией железистых и стромальных элементов периуретральной ткани (или центральной зоны) и появлением узлов гиперплазии, оттесняющих ткань простаты, формируется так называемая хирургическая капсула, которая приобретает вид кортикальной зоны, примыкающей к зоне гиперплазии. Простатический отдел уретры удлиняется, деформируется и сдавливается, что является причиной нарушения мочеиспускания.Несмотря на значительное увеличение размеров железы, сохраняется ее симметрия и относительная однородность, за исключением случаев, связанных с наличием амилоидных телец, кальцификатов, очагового простатита и сочетания ДГП и рака. В некоторых случаях узлы гиперплазии развиваются неравномерно, в результате чего нарушается симметрия железы и ее размеры увеличиваются за счет одной из долей. Однако контур железы остается ровным. Ультразвуковая структура простаты при доброкачественной гиперплазии определяется преобладанием в ней железистых или стромальных элементов.При значительной стромальной пролиферации железистая ткань разделяется большим количеством стромы и коллагеновых волокон, что проявляется в виде множества линейных отражений средней и высокой интенсивности. При преобладании железистой пролиферации эхогенность железы снижается, ткань ее приобретает ячеистую структуру со множеством мелких кистоподобных включений. Амилоидные тельца, представляющие собой желеобразное вещество, выделяемое ацинусами, и кальцификаты определяются в виде гиперэхогенных включений, располагающихся по границе хирургической капсулы или в толще железы. В отличие от кальцификатов амилоидные тельца не дают акустической тени. Несмотря на различие гистологической и ультразвуковой картины, при доброкачественной гиперплазии предстательная железа сохраняет шаровидную форму и гладкий контур.Так же как и доброкачественная гиперплазия, рак простаты является дисгормональным заболеванием. Под влиянием эндокринных сдвигов в предстательной железе возникает прогрессирование частоты атипичной гиперплазии, которая развивается чаще в периферической зоне простаты. Это коррелирует с фактом повышенной чувствительности периферической зоны к развитию в ней рака. Учитывая это, при оценке результатов ультразвуковой томографии может использоваться простой и достаточно надежный дифференциально-диагностический принцип. Структурные изменения, локализующиеся в пределах центральной зоны, с большей вероятностью могут быть отнесены к проявлениям доброкачественного процесса. Изменения, локализующиеся в периферической зоне, чаще соответствуют злокачественной опухоли. Периферическая зона занимает 75% объема простаты и в этой части железы рак возникает в 80% случаев. Большей частью опухоль располагается на глубине 3-4 мм от пограничного слоя. Центральная зона занимает около 20% объема железы. В этой части простаты развивается только 5% злокачественных новообразований. Вокруг простатического отдела уретры располагается тонкий участок железистой ткани - так называемая переходная зона. В норме она практически не дифференцируется от центральной зоны и занимает всего 5% объема простаты. В переходной зоне рак развивается в 20% случаев.Опухоль, локализующаяся в периферической зоне простаты, часто легко пальпируется и хорошо определяется при ультразвуковом исследовании. Так как образование располагается на небольшой глубине от поверхности железы и не вызывает сдавления простатического отдела уретры, заболевание нередко диагностируется на стадии распространения на перипростатические ткани. Наиболее характерными признаками рака простаты, локализующегося в периферической зоне, является наличие одного или нескольких узлов неправильной формы и пониженной эхогенности. Нередко узел окружен гиперэхогенным ободком, что объясняется фиброзной реакцией соединительной ткани предстательной железы, окружающей опухолевый очаг. К характерным особенностям рака простаты относится бугристый контур железы с признаками пенетрации пограничного слоя. Выявление ультразвуковых признаков прорастания пограничного слоя позволяет правильно установить степень локального распространения опухолевого процесса, особенно при инфильтрации переднебоковой поверхности железы, которая не определяется при пальцевом исследовании. Наиболее сложными для диагностики являются опухоли, локализующиеся в центральной и переходной зонах железы. Развиваясь на фоне доброкачественной гиперплазии, опухоль по эхогенности практически не отличается от окружающих тканей, и диагноз часто устанавливается при гистологическом исследовании энуклиированных узлов после трансуретральной резекции по поводу доброкачественной гиперплазии.При массивной опухолевой инфильтрации стромы железы меняется ее ультразвуковая структура. Ткань железы становится неоднородной, с беспорядочными отражениями низкой интенсивности. Как указывалось, ультразвуковая томография позволяет выявить инфильтрацию перипростатических тканей, семенных пузырьков, мочевого пузыря, стенки прямой кишки. В связи с этим ультразвуковое исследование позволяет определить стадию заболевания и увеличить частоту выявления потенциально курабельного рака предстательной железы. При прорастании опухолью пограничного слоя опухолевый инфильтрат распространяется по парапростатической клетчатке к стенкам таза, инфильтрирует семенные пузырьки и дно мочевого пузыря. Характерным ультразвуковым признаком является деформация или отсутствие изображения семенных пузырьков, инфильтрированных опухолью.Клиническое значение ультразвуковой томографии при раке простаты определяется возможностью выявления минимальных изменений в структуре железы. Это позволяет дать оценку локальному распространению так называемой фокальной опухоли, которая не дает клинической симптоматики и пальпаторно не определяется.Конечно, ультразвуковое исследование не является самостоятельным методом диагностики рака простаты. Диагностический комплекс должен включать в себя обязательное пальцевое ректальное исследование, определение уровня простатспецифического антигена (ПСА) в сыворотке крови и трансректальное ультразвуковое исследование. На сегодняшний день ПСА является одним из самых чувствительных биологических маркеров для ранней диагностики РПЖ. В норме уровень ПСА не превышает 2,5-4,0 нг/мл. Повышение уровня ПСА выше этих значений требует дополнительных диагностических манипуляций. Однако следует отметить, что уровень ПСА может повышаться и при неопухолевых заболеваниях простаты, таких как простатит и доброкачественная гиперплазия, но значения его не превышают 10-16 нг/мл. Повышение уровня ПСА, на наш взгляд, даже при отрицательном результате пальцевого и ультразвукового ректального исследования требует биопсии простаты под ультразвуковым наведением.Биопсия простаты может быть выполнена двумя способами - промежностным доступом и трансректально. По нашему мнению, наиболее простым и необременительным для больного является трансректальный доступ. Для этого необходим датчик с биопсийным каналом в его корпусе или специальная насадка для трансректальной биопсии. При биопсии трансректальным доступом не требуется введения большого количества анестетика. Попадающие при этом в ткани микропузырьки воздуха значительно ухудшают изображение. Биопсию промежностным доступом можно проводить без специальных приспособлений, однако эта процедура более травматична и дает худшие результаты по сравнению с трансректальной. В тех случаях, когда показаниями к биопсии является только повышение уровня ПСА и при ультразвуковом исследовании не выявляются очаговые изменения в ткани простаты, биопсию берут из нескольких участков железы, как правило, по три фрагмента ткани из каждой доли (так называемая секстантная биопсия). Подобная методика, включающая в себя ультразвуковую томографию, определение уровня ПСА и биопсию, позволяет существенно повысить уровень ранней диагностики РПЖ. Таким образом, учитывая анатомические особенности предстательной железы и специфику клинического течения ее опухолевых заболеваний, ультразвуковая томография должна применяться в комплексе с пальцевым ректальным исследованием и иммунологическими методами диагностики. При этом наиболее информативным методом является трансректальное ультразвуковое исследование в сочетании с секстантной биопсией простаты.
Литература:
1. Игнашин Н.С. Инвазивные ультразвуковые вмешательства в диагностике и лечении урологических заболеваний: Дис. докт. мед. наук. - М., 1989.2. Клиническое руководство по ультразвуковой диагностике под ред. В.В. Митькова. М.,1996. - Т. 1.3. McNeal J.E. Normal and pathologic anatomy of prostate. Urology 1981;17:11-16.
www.neuch.ru
|
|
..:::Счетчики:::.. |
|
|
|
|
|
|
|
|


