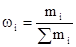 или
или 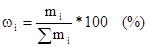
Реферат на тему:
О растворе в строительстве см. строительный раствор
Растворение соли в воде
Раство́р — гомогенная (однородная) смесь, образованная не менее чем двумя компонентами, один из которых называется растворителем, а другой растворимым веществом, это также система переменного состава, находящаяся в состоянии химического равновесия.
Химический раствор — это смесь одной или нескольких кислот с водой.
Раствор — однофазная система переменного состава, состоящая из двух или более компонентов. Растворы — гомогенные (однородные) системы, то есть каждый из компонентов распределён в массе другого в виде молекул, атомов или ионов[1].
Растворитель — компонент, агрегатное состояние которого не изменяется при образовании раствора. В случае же растворов, образующихся при смешении газа с газом, жидкости с жидкостью, твёрдого вещества с твёрдым, растворителем считается компонент, количество которого в растворе преобладает[1].
Образование того или иного типа раствора обусловливается интенсивностью межмолекулярного, межатомного, межионного или другого вида взаимодействия, то есть, теми же силами, которые определяют возникновение того или иного агрегатного состояния. Отличия: образование раствора зависит от характера и интенсивности взаимодействия частиц разных веществ[1].
По сравнению с индивидуальными веществами по структуре растворы сложнее[1].
Растворы бывают газовыми, жидкими и твёрдыми[1].
Чаще под раствором подразумевается жидкое вещество, например раствор соли или спирта в воде (или даже раствор золота в ртути — амальгама).
Существуют также растворы газов в жидкостях, газов в газах и жидкостей в жидкостях, в последнем случае растворителем считается вода, или же компонент, которого больше.
В химической практике обычно под растворами понимают гомогенные системы, растворитель может быть жидким, твёрдым (твёрдый раствор), газообразным. Однако нередко допускается и микрогетерогенность — см. «Золи».
«Раствором» именуют и смесь цемента с водой, песком и так далее. Хотя это и не является раствором в химическом смысле этого слова.
Коллоидные и ионные растворы (изучением коллоидных систем занимается коллоидная химия) отличаются главным образом размерами частиц.
В ионных растворах размер частиц менее 1×10−9 м, частицы в таких растворах невозможно обнаружить оптическими методами; в то время как в коллоидных растворах размер частиц 1×10−9 м — 5×10−7 м, частицы в таких растворах можно обнаружить при помощи ультрамикроскопа (см. эффект Тиндаля).
Растворение — переход молекул вещества из одной фазы в другую (раствор, растворенное состояние). Происходит в результате взаимодействия атомов (молекул) растворителя и растворённого вещества и сопровождается увеличением энтропии при растворении твёрдых веществ и её уменьшением при растворении газов. При растворении межфазная граница исчезает, при этом многие физические свойства раствора (например, плотность, вязкость, иногда — цвет, и другие) меняются.
В случае химического взаимодействия растворителя и растворённого вещества сильно меняются и химические свойства — например, при растворении газа хлороводорода в воде образуется жидкая соляная кислота.
Электролиты при растворении в подходящих растворителях (вода, другие полярные растворители) диссоциируют на ионы. Сильное физико-химическое взаимодействие при растворении приводит к сильному изменению свойств раствора (химическая теория растворов).Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами.
Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами.
К электролитам относятся кислоты, основания и почти все соли, к неэлектролитам — большинство органических соединений, а также вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи.
Растворы высокомолекулярных веществ ВМС — белков, углеводов и др. обладают одновременно многими свойствами истинных и коллоидных растворов. Средняя молекулярная масса растворенного…
В зависимости от цели для описания концентрации растворов используются разные физические величины.
В случаях приготовления растворов сильных кислот согласно правилам техники безопасности кислоту нужно добавлять в воду, но ни в коем случае не наоборот. Для запоминания этого лабораторного приёма существует несколько мнемонических правил:
Сначала вода,Потом кислота,Иначе случитсяБольшая беда
Streitwieser Andrew Introduction to Organic Chemistry. — 4th ed.. — Macmillan Publishing Company, New York, 1992. — ISBN ISBN 0-02-418170-6
wreferat.baza-referat.ru
СПб ГИТМО (ТУ)
Кафедра: Физической химии,
волокнистой и интегральной оптики.
Реферат
Жидкие растворы.
Студент: Тулякова М. 156гр.
Преподаватель: Успенская М.В.
Санкт- Петербург
2002г
Оглавление:
Вступление… 3
I. Определение раствора… 4
II. Процесс растворения… 5
III. Классификации растворов… 7
IV. Способы выражения состава растворов… 8
V. Растворимость. Зависимость растворимости от температуры… 10
VI. Теплоты растворения и разбавления… 12
VII.Давление пара растворов. Состав пара растворов… 13
VIII Неидеальные растворы… 15
IX.Активность и коэффициент активности… 16
X.Кристаллизация растворов… 17
XI Кипение растворов… 18
XII Осмос… 18
Список литературы… 20
Вступление
Растворы находят широкое применение в самых различных областях практики. Категории растворов относятся и природный раствор воды, и такие материалы, как сырая нефть и различные нефтепродукты-бензины, керосин, вазелин, парафин, смазочные масла, жидкие сплавы металлов, расплавленные смеси силикатов смеси органических растворителей, различные водноспиртовые смеси и др.
Во второй половине прошлого века существовало две противоположных точки зрения на процесс растворения. Для первой точки зрения характерно рассмотрение процесса растворения как явления химического, для второго — как физического. В химических теориях предполагалось, что растворенное вещество и растворитель химически взаимодействуют между собой. С физической точки зрения растворенное вещество можно рассматривать, как находящееся в газообразном состоянии и применять к нему законы кинетической теории газов. Каждая из этих теорий была разработана и внесла свой вклад в создание современной теории растворов, в которой принимаются во внимание и химические, и физические факторы.
В развитии учения о растворах выдающаяся роль принадлежит работам Д.И. Менделеева. Он рассматривал растворы как неустойчивые химические соединения постоянного состава, находящиеся в состоянии частичной диссоциации. Этим было положено начало химической теории растворов в противовес физическим теориям, игнорировавшим значение химического взаимодействия.
Общей теории растворов — теории, которая давала бы возможность определять свойства раствора по известным свойствам компонентов в чистом состоянии и известному составу раствора, — в настоящее время еще нет. Только для растворов очень разбавленных (в пределе бесконечно разбавленных) удалось еще в 80-х годах прошлого века создать начала количественной теории, дающей возможность определять некоторые свойства растворов по известной их концентрации. В таких растворах молекулы растворенного вещества разобщены друг от другого большим количеством молекул растворителя. Вследствие этого их взаимодействие не проявляется в заметной степени.
I. Определение раствора.Растворы — однородная многокомпонентная система, состоящая из растворителя, растворённых веществ и продуктов их взаимодействия, относительные количества которых могут изменяться в широких пределах. Этот термин может относиться к любому агрегатному состоянию системы. По агрегатному состоянию растворы могут быть жидкими (морская вода), газообразными (смеси азота с аммиаком) или твёрдыми (многие сплавы металлов).
Газообразные растворы обычно представляют собой смеси газов и реже – растворы жидкостей или твердых тел в газах. Газы способны смешиваться во всех отношениях не при любых условиях. При высоких температурах и давлении наблюдается неполное смешение газов с образованием двух газообразных фаз, находящихся в равновесии.
Твердые растворы образуются кристаллизации жидких расплавов или при растворении газов в твердых веществах. Различают твердые растворы замещения, внедрения и вычитания.
Твердые растворы замещения, которые образуются при сохранении структуры кристаллической решетки растворителя являются наиболее распространенными. При образовании твердых растворов замещения в узлах кристаллической решетки данного вещества атомы, молекулы и ионы замещаются частицами другого вещества. Образование таких растворов возможно, если оба вещества близки по кристаллическим свойствам и размерам частиц. По приближенному правилу В.Юм-Розери твердые растворы замещения образуются в тех случаях, когда размеры двух частиц отличаются не более чем на 14-15%. Устойчивыми являются твердые растворы замещения любого состава.
Твердые растворы внедрения получаются путем внедрения частиц одного вещества в междоузлия кристаллической решетки другого вещества (растворителя). Растворы внедрения образуются в том случае, когда размеры частиц внедряемого вещества меньше размеров частиц растворителя. Такие растворы обычно возникают при растворении растворов неметаллов в металлах. При внедрении новых частиц в промежутки между атомами металла происходит увеличение напряжения в кристаллической решетке, в связи с такие растворы образуются сравнительно редко.
Твердые растворы вычитания встречаются значительно реже. Они получаются при выпадении некоторых атомов из кристаллической ячейки, в связи с чем эти растворы иногда называются твердыми растворами с дефектной решеткой.
Наиболее часто встречаются жидкие растворы. В моем реферате речь пойдет преимущественно о жидких растворах.
Растворы занимают промежуточное место между химическими соединениями и механическими смесями. Однородность растворов делает их схожими с химическими соединениями, так же на химическое взаимодействие между компонентами растворов указывает выделение теплоты при растворении некоторых веществ. Растворы отличаются от химических соединений тем, что состав взаимодействующих веществ может изменяться в широких пределах. В свойствах раствора можно обнаружить многие свойства компонентов его составляющих, что характерно для механических соединений.
II. Процесс растворенияПроцесс растворения кристалла в жидкости происходит так. Когда кристалл соли, например, хлорида натрия попадает в воду, то распложенные на его поверхности ионы притягивают полярные молекулы воды (ион-дипольное взаимодействие). К ионам натрия молекулы притягиваются своими отрицательными полюсами, а к ионам хлора положительными. Но если ионы протягивают к себе молекулы воды, то и молекулы воды притягивают к себе ионы. В то же время притянутые молекулы воды испытывают толчки со стороны непритянутых молекул воды, находящихся в тепловом движении. И этих толчков, а так же тепловых колебаний самих ионов достаточно для того, чтобы ион хлора или натрия отделился от кристалла и перешел в раствор. Вслед за первым слоем ионов в раствор переходит следующий слой и таким образом идет постепенное растворение кристалла. Перешедшие в раствор ионы остаются связанными с молекулами воды и образуют гидраты ионов. Гидратация – основная причина диссоциации. Она отчасти затрудняет их обратное соединение (ассоциацию). Под гидратацией обычно понимают совокупность энергетических процессов и структурных изменений, происходящих в растворе при взаимодействии частиц растворенного вещества с водой. Слой частиц воды, непосредственно присоединенных к центральной частице растворенного вещества образует вокруг нее гдратную оболочку. Наименьшее число молекул растворителя, удерживаемое около частицы растворенного вещества называется координатным числом гидратации. Координатное число определить трудно, оно зависит от природы растворенного вещества и растворителя.
Доказательством того, что компоненты раствора химически взаимодействуют друг с другом, служит тот факт, что многие вещества выделяются из водных растворов в виде кристаллов, содержащих кристаллизованную воду – гидратов; причем на каждую молекулу растворенного вещества приходится определенное число молекул воды. Как правило, гидраты – нестойкие соединения, во многих случаях они разлагаются уже при выпаривании растворов. Но иногда гидраты так прочны, что при выделении растворенного вещества из раствора вода входит в состав его кристаллов. Вещества, в состав которых входят молекулы воды называются кристаллогидратами, а содержащаяся в них вода — кристаллизованной. Прочность связи между гидратами и кристаллизованной водой различна. Многие из них теряют кристаллизованную воду уже при комнатной температуре, для некоторых требуется значительное нагревание, а от кристаллогидрата алюминия, например, не удается удалить воду никакими способами.
Состав кристаллогидратов принято изображать формулами, показывающими, какое количество кристаллизованной воды содержит кристаллогидрат. Например, кристаллогидрат сульфата натрия, содержащий на один моль Na2SO4 10 молей воды выражается формулой Na2SO4.10h3O.
Иначе протекает диссоциация молекул, которые обладают полярной связью. Молекулы воды, притянувшиеся к концам полярной молекулы (диполь-дипольное взаимодействие), вызывают расхождение ее полюсов – поляризуют молекулу. Такая поляризация в сочетании с колебательным движением атомов в самой молекуле, а так же беспорядочное тепловое движение окружающих ее молекул воды приводит к распаду полярной молекулы на ионы. Как и в случае растворения кристалла с ионной связью эти ионы гидрируются.
Гидрированные ионы содержат как постоянное, так и переменное количество молекул воды, это количество зависит от концентрации и других условий. Гидрат постоянного состава образует ион водорода H+, он называется ионом гидроксония. Ион гидроксония благодаря очень маленьким размерам обладает электростатическим полем большой электороотицательности. Он не имеет электронной оболочки и поэтому не испытывает отталкивания от электронных оболочек других атомов. Поэтому в растворах ион гидроксония существует исключительно в виде объединений с молекулами воды. Самый прочный комплекс образуется с одной молекулой воды, который так же окружается гидратной оболочкой из других молекул.
III. Классификации растворов .Существует несколько способов классификации растворов. Так, основываясь на величине электрической проводимости, различают растворы электролитов и неэлектролитов. Можно классифицировать растворы по агрегатному состоянию системы и тех частиц, из которых она состоит.
Возможна классификация раствора по количеству растворенного вещества в нем присутствующего. Если молекулярные или ионные частицы, распределённые в жидком растворе, присутствуют в нём в таком количестве, что при данных условиях не происходит дальнейшего растворения вещества, раствор называется насыщенным. (Например, если поместить 50 г NaCl в 100 г h3 O, то при 20ºC растворится только 36 г соли). Насыщенным называется раствор, который находится в динамическом равновесии с избытком растворённого вещества. Поместив в 100 г воды при 20ºC меньше 36 г NaCl мы получим ненасыщенный раствор. При нагревании смеси соли с водой до 100○ C произойдёт растворение 39,8 г NaCl в 100 г воды. Если теперь удалить из раствора нерастворившуюся соль, а раствор осторожно охладить до 20ºC, избыточное количество соли не всегда выпадает в осадок. В этом случае мы имеем дело с перенасыщенным раствором. Перенасыщенные растворы очень неустойчивы. Помешивание, встряхивание, добавление крупинок соли может вызвать кристаллизацию избытка соли и переход в насыщенное устойчивое состояние.
С точки термодинамики можно различать идеальные растворы и неидеальные (или реальные). В идеальных растворах, к которым реальные могут только приближаться, внутренняя энергия каждого компонента не зависит от концентрации. Компоненты в идеальном растворе смешиваются, как идеальные газы; предполагается, что сил взаимодействия между частицами нет, и вещества смешиваются без выделения или поглощения теплоты.
Растворы, не удовлетворяющие указанным условиям, относят к реальным растворам. Чем меньше концентрация раствора, тем ближе он к идеальному раствору. Растворы изотопов одного элемента в другом почти точно подчиняются законам идеальных растворов. Однородные смеси неполярных веществ (углеводородов) близки к идеальным растворам при всех концентрациях. Растворы полярных веществ, особенно электролитов, обнаруживают заметное отклонение от идеальности уже при концентрациях, отвечающих мольной доле порядка одной миллионной.
IV. Способы выражения состава растворовЛюбой раствор состоит из растворителя и растворенного вещества. В случае растворов газов или твердых веществ в жидкостях растворителем обычно считается жидкость, а растворенным веществом – растворенный газ или твердое вещество, независимо от их относительного количественного содержания. Когда компоненты обладают ограниченной смешиваемостью, то растворителем является тот, прибавление которого к раствору возможно в неограниченном количестве без нарушения гомогенности. Если компоненты обладают неограниченной растворимостью, то можно выделить два случая. При значительном различии содержания компонентов растворителем считается вещество, присутствующее в относительно большем количестве. Понятия растворитель и растворенное вещество теряют смысл, когда речь идет о смесях с примерно равными или близкими концентрациями компонентов. В этом случае состав раствора может выражаться различными способами – как с помощью безразмерных единиц – долей или процентов, так и через размерные величины – концентрации.На практике используют более десятка способов выражения концентрации. Вот некоторые из них:
1. Массовая доля растворенного вещества.
Отношение массы растворенного вещества B к массе растворителя.
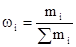 или
или 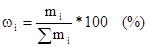
2. Мольная доля растворенного вещества.
Отношение количества растворенного вещества к суммарному количеству всех веществ, составляющих раствор, включая растворитель
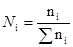 или
или 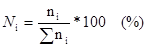
Мольная доля указывает на число молей данного вещества в одном моле раствора. Сумма мольных долей всех составных веществ равна единице: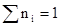
3. Объемная доля растворенного вещества:
Отношение объема растворенного вещества к сумме объемов вещества и растворителя.
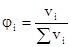 или
или 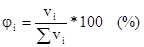
4. Молярная концентрация (или молярность).
Определяется отношением числа молей растворенного вещества к объему раствора, выраженному в литрах. Физический смысл молярной концентрации заключается в том, что она указывает на число молей вещества содержащегося в 1 литре его раствора.
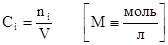
5. Нормальная концентрация (или нормальность).
Определяется отношением числа эквивалентов растворенного вещества B к объему раствора, выраженному в литрах. Физический смысл нормальной концентрации заключается в том, что она указывает на число эквивалентов растворенного вещества, содержащегося в 1 литре раствора.
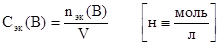
6. Моляльная концентрация (или моляльность).
Определяется отношением числа молей растворенного вещества к массе растворителя. Физический смысл заключается в том, что она показывает, сколько молей вещества растворено в 1 кг (1000г) растворителя.
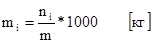
Применение того или иного способа выражения концентрации зависит от решения конкретных практических задач.
V. Растворимость. Зависимость растворимости от температуры.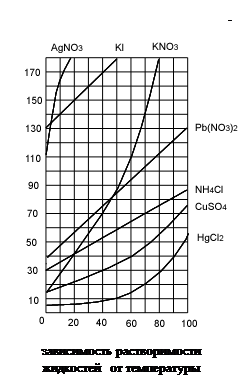 Растворимостью называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества является его содержание в насыщенном растворе. Если в 100 г воды растворяется более 10 г вещества, то такое вещество называют хорошо растворимым. Если растворяется менее 1 г вещества – вещество мало растворимо. Наконец, вещество считают практически нерастворимым, если в раствор переходит менее 0,01 г вещества. Абсолютно нерастворимых веществ не бывает.
Растворимостью называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества является его содержание в насыщенном растворе. Если в 100 г воды растворяется более 10 г вещества, то такое вещество называют хорошо растворимым. Если растворяется менее 1 г вещества – вещество мало растворимо. Наконец, вещество считают практически нерастворимым, если в раствор переходит менее 0,01 г вещества. Абсолютно нерастворимых веществ не бывает.
Растворение большинства твердых веществ в жидкостях сопровождается обычно поглощением энергии. Это объясняется затратой значительного количества энергии на разрушение кристаллической решетки твердого вещества. В этом случае растворимость твердых веществ увеличивается с ростом температуры. Но если растворение сопровождается выделением энергии, то растворимость с ростом температуры понижается. Такое явление наблюдается при растворении в воде щелочей, солей лития, магния, алюминия.
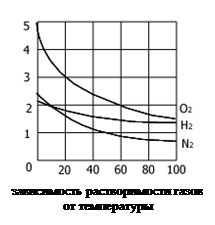 Теоретически пока нельзя вычислить точно величину растворимости данного вещества в определенном растворителе. Сходство в химической природе двух веществ увеличивает их взаимную растворимость. Многие жидкости проявляют способность к неограниченной взаимной растворимости. Так бензол и толуол, вода и этиловый спирт могут смешиваться друг с другом в любых отношениях. Жидкости с ограниченной взаимной растворимостью образуют расслаивающиеся системы. По мере повышения температуры взаимная растворимость увеличивается, и тогда жидкости полностью смешиваются, образуя однородную массу. Температура, при которой наступает смешивание, называется критической температурой смешения. Растворение газов в воде представляет собой экзотермический пресс. Поэтому растворимость газов с повышением температуры уменьшается. Однако растворение газов в органических жидкостях сопровождается поглощением теплоты. Это происходит от того энергия межмолекулярного взаимодействия между молекулами растворителя и растворимого вещества больше, чем энергия притяжения между молекулами газа и растворителя в растворе.
Теоретически пока нельзя вычислить точно величину растворимости данного вещества в определенном растворителе. Сходство в химической природе двух веществ увеличивает их взаимную растворимость. Многие жидкости проявляют способность к неограниченной взаимной растворимости. Так бензол и толуол, вода и этиловый спирт могут смешиваться друг с другом в любых отношениях. Жидкости с ограниченной взаимной растворимостью образуют расслаивающиеся системы. По мере повышения температуры взаимная растворимость увеличивается, и тогда жидкости полностью смешиваются, образуя однородную массу. Температура, при которой наступает смешивание, называется критической температурой смешения. Растворение газов в воде представляет собой экзотермический пресс. Поэтому растворимость газов с повышением температуры уменьшается. Однако растворение газов в органических жидкостях сопровождается поглощением теплоты. Это происходит от того энергия межмолекулярного взаимодействия между молекулами растворителя и растворимого вещества больше, чем энергия притяжения между молекулами газа и растворителя в растворе.
На практике растворимость вещества выражается величиной, называемой коэффициентом растворимости. Коэффициент растворимости показывает массу вещества, насыщаемую при данной температуре 100 граммов растворителя.
Растворимость некоторых веществ в воде представлена в таблице
| Вещество | Растворимость: масса вещества (г) в 100 г воды при температурах | ||||||
| 00C | 100C | 200C | 400C | 600C | 800C | 1000C | |
| SO2 | 22,83 | 16,21 | 11,29 | 5,41 | 3,2 | 2,1 | – |
| Nh4 | 89,7 | 68,3 | 52,9 | 31,6 | 16,8 | 6,5 | |
| CuSO4 | 14,3 | 17,4 | 20,7 | 28,5 | 40,0 | 55,0 | 75,4 |
| K2 SO4 | 7,35 | 9,22 | 11,11 | 14,76 | 18,17 | 21,4 | 24,1 |
| Al2 (SO4 )3 | 31,2 | 33,5 | 36,4 | 45,7 | 59,2 | 73,1 | 89,0 |
| NaCl | 35,7 | 35,8 | 36,0 | 36,6 | 37,3 | 38,4 | 39,8 |
| Nh5 Cl | 29,4 | 33,3 | 37,2 | 45,2 | 55,2 | 65,6 | 77,3 |
| KNO3 | 13,3 | 20,9 | 31,6 | 63,9 | 110,0 | 169 | 243 |
| KNO2 | 278,8 | – | 298,4 | 334,9 | 350 | 376 | 412,9 |
Изменение энтальпии при переходе твердого, жидкого или газообразного вещества в раствор называется теплотой или энтальпией растворения. Эндотермические реакции характеризуются положительным изменением энтальпии, а экзотермические – отрицательным. Энтальпией растворения называют изменение энтальпии при растворении 1 моль вещества в некотором количестве чистого растворителя. Процесс растворения в термохимии обычно выражают термохимическим уравнением, например процесс растворения a моль Pb(NO3 )2 в b моль воды можно представить уравнением:
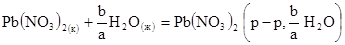
Теплота растворения зависит от концентрации полученного раствора и от температуры.
Особый интерес представляют первая и полная теплоты растворения. Первой теплотой растворения называется изменение энтальпии при растворении 1 моль вещества в бесконечно большом количестве растворителя. В результате этого процесса образуется бесконечно разбавленный раствор. Полной теплотой растворения называется изменение энтальпии при растворении 1 моль вещества в таком количестве чистого растворителя, которой необходимо для образования насыщенного раствора.
Тепловой эффект взаимодействия раствора данной концентрации с чистым растворителем называется энтальпией разведения или разбавления. Если раствор, содержащий 1 моль растворенного вещества, разбавляется от данной концентрации до определенной конечной (не бесконечно малой) концентрации, то тепловой эффект тепловой эффект называется промежуточной теплотой разбавления.
VII. Давление пара растворов. Состав пара растворов .Давление насыщенного пара является весьма важным свойством растворов. С его величиной непосредственно связаны многие свойства растворов. Допустим, что к пару применимы законы идеальных газов. Воспользуемся упрощенной схемой испарения. Растворяя большое количество какого-либо вещества в данном растворителе, мы понижаем концентрацию молекул последнего в единице объема и уменьшаем этим число молекул, вылетающих в единицу времени из жидкой фазы в газообразную. В результате равновесие между жидкостью и паром устанавливается при меньшей концентрации раствора, т.е. при меньшем его давлении. Следовательно, давление насыщенного пара растворителя над раствором, должно быть всегда меньше, чем над чистым растворителем. При этом понижение давления пара будет, тем больше чем больше концентрация растворенного вещества в растворе. Из этого вытекает закон Генри, который можно выразить уравнением:
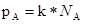 , где
, где
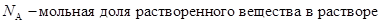
p – парциальное давление
k – константа Генри
Закон Генри звучит так: Парциальное давление пара растворенного вещества пропорционально его концентрации в растворе.
При N A =1 парциальное давление пара pA представляет собой давление насыщенного данного компонента в свободном состоянии 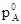 . Следовательно k=
. Следовательно k=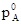 и равенство принимает вид:
и равенство принимает вид:
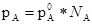
Концентрация растворенного вещества в растворе при выражении ее в мольных долях этого веществаN A связана с концентрацией растворителя как
N A +N B =1. Подставляя это выражение в закон Генри получим:
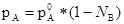 Þ
Þ
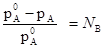
Разность (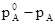 ) называется понижением давления насыщенного пара, а отношение
) называется понижением давления насыщенного пара, а отношение 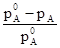 -относительным понижением давления насыщенного пара.
-относительным понижением давления насыщенного пара.
Согласно закону Рауля: Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле вещества в растворе
Если графически изобразить зависимость давления пара каждого вещества двухкомпонентной смеси от его мольной доли, поучиться прямая линия. Пусть даны вещества А и В. Обозначим их мольные доли N A и N B. По закону Рауля имеем:
 pA =
pA = *N A, pB =
*N A, pB = *N В
*N В
 где p0есть давление пара чистого вещества. Это суть уравнения прямых, если на осях отложены давления пара и мольные доли.
где p0есть давление пара чистого вещества. Это суть уравнения прямых, если на осях отложены давления пара и мольные доли.
Для общего давления пара раствора отсюда следует равенство: p= *N A +
*N A + 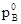 *N В
*N В
Эта линейная зависимость осложняется если между компонентами смеси действуют силы притяжения, и она изображается не прямой, а кривой линией
Если оба компонента раствора вчистом состоянии летучи, то пар будет содержать оба компонента. Однако относительное содержание компонентов в парах в общем случае будет отличаться от относительного содержания их в жидкостях. Для простейших систем легко установить соотношение между составами раствора и пара, равновесного с ним. Только b системе, компоненты которой обладают одинаковым давлением пара в чистом состоянии, состав пара над раствором равен составу раствора. В остальных же случаях состав пара отличен от состава раствора и тем в большей степени, чем больше различаются давления пара над чистыми компонентами. В простейших системах в парах всегда преобладает по сравнению с жидкостью тот из компонентов, который обладает большим давлением пара в чистом состоянии.
В количественной форме соотношения между составом пара и жидкости могут быть выведены следующим путем. Обозначим через NA’ и NB’ мольные доли компонентов в парах, причем NA’ =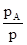 иNB’ =
иNB’ =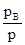
Пользуясь законом Рауля легко получить, что p=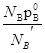 , а пользуясь выражением p=
, а пользуясь выражением p=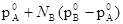 получаем, что
получаем, что 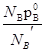 =
=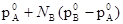
Для систем, в которых зависимость давления пара от состава нелинейная, нет общего выражения, в такой простей форме связывающего составы пара и раствора. Зависимость состава пара от состава раствора и общего давления характеризуется законом, открытым Д.И.Коноваловым и носящими его имя. Закон Коновалова характеризует соотношения между составами равновесных жидкостей и пара и влияние добавления того или иного компонента на общее давление пара. Он формулируется следующим образом:
а) Повышение относительного содержания компонента в жидкой фазе всегда вызывает увеличение относительного содержания его и в парах.
b) В двойной системе пар, по сравнению с находящейся с ним в равновесии жидкостью, относительно более богаче тем из компонентов, прибавление которого к системе повышает общее давление пара, т.е. понижает температуру кипения смеси при данном давлении.
Введем в раствор из двух веществ какое-либо новое вещество. В общем случае это вещество распределится между обоими веществами в растворе, пропорционально своей растворимости в каждом из них. Отсюда втекает закон распределения, согласно которому вещество, способное растворяться в двух несмешивающихся растворителях, распределяется между ними так, что отношение его концентраций в этих растворителях при постоянной температуре остается постоянным, независимо от общего количества растворенного вещества.
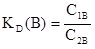
где С1B и С2B — концентрации растворенного вещества в первом и втором растворителях;
KD (B) – константа распределения вещества B между двумя жидкими несмешивающимися фазами.
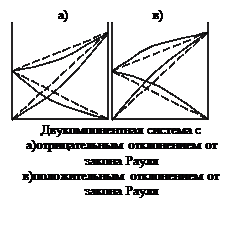
VIII. Неидеальные растворы.Реальные растворы в подавляющем большинстве не подчиняются законам идеальных растворов. Очень многие из них не подчиняются, например, закону Рауля, причем известны как положительные, так и отрицательные отклонения. Если давление пара над реальным раствором больше, чем над идеальным такого же состава, то отклонения от закона Рауля называют положительными, а если меньше, то отрицательными. Знак и величина отклонения зависит от природы растворителя и растворенного вещества.. Если молекулы одного компонента сильнее притягиваются друг к другу, чем к молекулам другого компонента, то парциальные давления пара над смесью будут больше вычисленных. Если же частицы разных компонентов притягиваются друг к другу сильнее, чем частицы одного и того же компонента, то парциальные давления будут меньше вычисленных.
В реальных растворах взаимодействия между однородными и разнородными молекулами различны. Если раствор образуется из частных компонентов А и В, то изменение потенциальной энергии при образовании раствора равно:
 DU=
DU=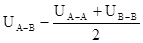 , где
, где
UA-A, UB-B и UA-B — средние потенциальные энергии взаимодействия между однородными и разнородными молекулами соответственно, если DU=0, то раствор идеальный. Идеальные растворы при всех концентрациях и температурах подчиняются закону Рауля.
IX. Активность и коэффициент активности.При рассмотрении термодинамических свойств растворов принято пользоваться отношением
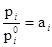
Эта величина называется активностью i в растворе. Согласно уравнению 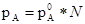 отношение
отношение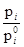 равно мольной концентрации данного компонента в растворе. Активность представляет собой вспомогательную расчетную термодинамическую функцию, которая характеризует степень связанности молекул компонента. При образовании данным компонентом в растворе каких-нибудь соединений его активность становится меньше и, наоборот, активность возрастает при уменьшении степени ассоциации компонента. Активность дает возможность судить об отклонении свойств данного компонента в том или ином растворе от свойств в простейшем растворе при той же мольной концентрации компонента. Активность зависит от вида и концентрации каждого из других компонентов.раствора. Она зависит также от температуры и от давления, но не зависит от способа выражения концентрации. Химический потенциал данного компонента в растворе связывается с активностью соотношением:
равно мольной концентрации данного компонента в растворе. Активность представляет собой вспомогательную расчетную термодинамическую функцию, которая характеризует степень связанности молекул компонента. При образовании данным компонентом в растворе каких-нибудь соединений его активность становится меньше и, наоборот, активность возрастает при уменьшении степени ассоциации компонента. Активность дает возможность судить об отклонении свойств данного компонента в том или ином растворе от свойств в простейшем растворе при той же мольной концентрации компонента. Активность зависит от вида и концентрации каждого из других компонентов.раствора. Она зависит также от температуры и от давления, но не зависит от способа выражения концентрации. Химический потенциал данного компонента в растворе связывается с активностью соотношением:
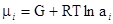
Вместо активности нередко пользуются величиной коэффициента активности, g. Он равен отношению активности к концентрации g=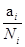 . Коэффициент активности характеризует степень отклонения свойств рассматриваемого компонента в данном растворе от его свойств в соответствующем простейшем растворе. В сильно разбавленном растворе коэффициент активности равен единице. Чем более концентрирован раствор, тем больше отличается активность от концентрации.
. Коэффициент активности характеризует степень отклонения свойств рассматриваемого компонента в данном растворе от его свойств в соответствующем простейшем растворе. В сильно разбавленном растворе коэффициент активности равен единице. Чем более концентрирован раствор, тем больше отличается активность от концентрации.
Раствор, в отличие от чистой жидкости не отвердевает целиком при одной температуре. Кристаллы начинают выделяться при какой-то одной температуре. По мере понижения температуры количество их растет, пока весь раствор не отвердеет. Температурой начала кристаллизации называют температуру, при которой при охлаждении раствора начинается образование кристаллов. Не рассматривая здесь систем, в которых происходит образование твердых растворов, можно сказать, что температурой начала кристаллизации называется температура, при которой кристаллы растворителя находятся в равновесии с раствором данного вещества. Опыт показывает, что разбавленный раствор замерзает при температуре более низкой, чем чистый растворитель. Такое изменение температуры можно рассматривать как общее правило. Для характеристики температуры замерзания раствора введена величина “понижение температуры замерзания” DT3. Она определена как разность между температурами замерзания чистого растворителя и раствора:
DT3 =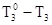 .
.
Понижение температуры замерзания пропорционально концентрации растворенного вещества в растворе.
DT=K*c
Коэффициент K называется молярным понижением температуры замерзания или криоскопической постоянной. К = 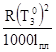 , где
, где
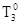 -температура замерзания растворителя
-температура замерзания растворителя
lпл – удельная теплота плавления
XI. Кипение растворов.Если рассматривать растворы нелетучего вещества в летучих растворителях, то температура кипения таких растворов всегда выше температуры кипения чистого растворителя. Повышение температуры кипения будет тем больше, чем выше концентрация раствора. И для разбавленных растворов его можно считать пропорциональным концентрации. Для растворов температуры кипения являются более высокими, чем для чистого растворителя и разность между ними
DТкип = T кип — 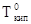
будет тем большей, чем выше концентрация растворов. Повышение температуры кипения пропорционально концентрации раствора.
DT кип = Е*с
Коэффициент пропорциональности Е является постоянной. Он называется молярным повышение температуры кипения или эбуллиоскопической постоянной. Е = 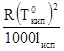 , где
, где 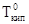 — температура кипения чистого растворителя
— температура кипения чистого растворителя
lисп – удельная теплота его испарения
XII. Осмос.Раствор представляет собой гомогенную систему. Все частицы растворенного
вещества находятся в беспорядочном тепловом движении равномерно распределены по всему объему раствора.
Если поместить в сосуд концентрированный раствор какого-либо вещества, например, сахара, а поверх его осторожно налить слой более разбавленного раствора сахара, то вначале сахар и вода будут распределены в объеме раствора неравномерно. Но через некоторое время молекулы сахара и воды вновь равномерно распределяться по всему объему жидкости. Это происходит потому, что молекулы сахара, беспорядочно двигаясь проникают как из концентрированного раствора в разбавленный, и в обратном направлении, но при этом в течение любого промежутка времени из концентрированного раствора переходит в разбавленный раствор больше молекул, чем из разбавленного в концентрированный. Точно так же ведут себя и молекулы воды. Таким образом возникает направленное движение молекул сахара из концентрированного раствора в разбавленный, а воды – из разбавленного раствора в концентрированный. Такой самопроизвольный процесс перемещения вещества, приводящий к выравниванию его концентрации, называется диффузией. Когда концентрация раствора во всем его объеме выравнивается, диффузия прекращается. В рассмотренном случае частицы растворителя и растворенного вещества диффундируют в противоположных направлениях. Такой процесс называется двусторонней или встречной диффузией. Но возможен и другой случай, когда между веществами поместить перегородку, через которую растворитель проходить может, а растворенное вещество нет. Односторонняя диффузия вещества через такую перегородку называется осмосом.
Возьмем два сосуда, расположенные один в другом. Пусть дно внутреннего сосуда сделано из полунепроницаемого материала. Наружный сосуд наполним водой, а во внутренний поместим водный раствор, например сахара в воде. Рассмотрим процесс, происходящий в приборе, состоящем из этих двух сосудов. Из наружного сосуда вода будет проходить во внутренний и подниматься по трубке, соединенной с внутренним сосудом. При этом повышается гидростатическое давление, под которым находится раствор во внутреннем сосуде. Наконец при некоторой высоте столба жидкости ее подъем прекратиться. Давление, которое отвечает такому равновесию может служить количественной характеристикой осмоса и называется осмотическим давлением. Таким образом осмотическое давление равно тому давлению, которое нужно приложить к раствору, чтобы привести его в равновесие с чистым растворителем, отделенным от него полунепроницаемой перегородкой. Описанный метод дает возможность измерять осмотическое давление. Опытные данные позволяют установить, что в достаточно разбавленных растворах осмотическое давление p прямо пропорционально концентрации растворенного вещества:
p=KС
Сравнение осмотического давления одних и тех же растворов при разных температурах приводит к выводу, что осмотическое давление изменяется прямопропорционально абсолютной температуре.
p=СRT,
где R – универсальная газовая постоянная.
Это уравнение по форме совпадает с уравнением состояния идеального газа, так как связь между концентрацией и объемом выражается, как С=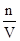 .Таким образом осмотическое давление равно тому газовому давлению, которым обладало растворенное вещество, если бы, находясь в газообразном состоянии при той же температуре, оно занимало бы весь объем, который занимает раствор. Этот закон называется законом Вант-Гоффа
.Таким образом осмотическое давление равно тому газовому давлению, которым обладало растворенное вещество, если бы, находясь в газообразном состоянии при той же температуре, оно занимало бы весь объем, который занимает раствор. Этот закон называется законом Вант-Гоффа
1. В.А. Киреев “Курс физической химии”, М. 1975
2. Н.Л.Глинка “Общая химия”, М. 2000
3. М.К.Дей, Д.Селбин “Теоретическая неорганическая химия”, М. 1971
4. Л.А.Николаев “Общая и неорганическая химия” М. 1974
5. К.С.Краснов “Физическая химия” М. 2001
www.ronl.ru
Раствор — гомогенная (однородная) смесь, образованная не менее чем двумя компонентами, один из которых называется растворителем, а другой растворимым веществом, это также система переменного состава, находящаяся в состоянии химического равновесия. Химический раствор — это смесь одной или нескольких кислот с водой. Раствор — однофазная система переменного состава, состоящая из двух или более компонентов. Растворы — гомогенные (однородные) системы, то есть каждый из компонентов распределён в массе другого в виде молекул, атомов или ионов.
Растворитель — компонент, агрегатное состояние которого не изменяется при образовании раствора. В случае же растворов, образующихся при смешении газа с газом, жидкости с жидкостью, твёрдого вещества с твёрдым, растворителем считается компонент, количество которого в растворе преобладает.
Образование того или иного типа раствора обусловливается интенсивностью межмолекулярного, межатомного, межионного или другого вида взаимодействия, то есть, теми же силами, которые определяют возникновение того или иного агрегатного состояния. Отличия: образование раствора зависит от характера и интенсивности взаимодействия частиц разных веществ.
По сравнению с индивидуальными веществами по структуре растворы сложнее.
Растворы бывают газовыми, жидкими и твёрдыми.
Виды растворов.
Твёрдые, жидкие, газообразные растворы.
Чаще под раствором подразумевается жидкое вещество, например раствор соли или спирта в воде (или даже раствор золота в ртути — амальгама).
Существуют также растворы газов в жидкостях, газов в газах и жидкостей в жидкостях, в последнем случае растворителем считается вода, или же компонент, которого больше.
В химической практике обычно под растворами понимают гомогенные системы, растворитель может быть жидким, твёрдым (твёрдый раствор), газообразным. Однако нередко допускается и микрогетерогенность — см. «Золи».
«Раствором» именуют и смесь цемента с водой, песком и так далее. Хотя это и не является раствором в химическом смысле этого слова.
Истинные и коллоидные растворы.
Коллоидные и истинные растворы (изучением коллоидных систем занимается коллоидная химия) отличаются главным образом размерами частиц.
В истинных растворах размер частиц менее 1×10−9 м, частицы в таких растворах невозможно обнаружить оптическими методами; в то время как в коллоидных растворах размер частиц 1×10−9 м — 5×10−7 м, частицы в таких растворах можно обнаружить при помощи ультрамикроскопа (см. эффект Тиндаля).
Так же, растворы бывают:
Концентрированный раствор — раствор с высоким содержанием растворённого вещества в противоположность разбавленному раствору, содержащему малое количество растворённого вещества. Очевидно, что концентрированные растворы могут образовывать только хорошо растворимые вещества. Деление растворов на концентрированные и разбавленные не связано с делением на насыщенные и ненасыщеные. Так насыщенный 0,0000134М раствор хлорида серебра является очень разбавленным, а 4М раствор бромида калия, будучи очень концентрированным, не является насыщенным.
Разбавленный раствор — раствор с низким содержанием растворённого вещества. Отметим, что не всегда разбавленный раствор является ненасыщенным — например, насыщенный 0,0000134М раствор практически нерастворимого хлорида серебра является очень разбавленным. Граница между разбавленным и концентрированным растворами весьма условна. В физической химии важную роль играет понятие предельно разбавленного раствора, то есть раствора, в котором концентрация растворенного вещества бесконечно мала. В таком растворе растворитель подчиняется законам поведения идеальных растворов, а растворенное вещество — не подчиняется. В частности, к растворенному веществу в предельно разбавленном растворе не применим закон Рауля, а давление его пара над раствором может быть описано законом Генри:
,где p2 — давление пара растворенного вещества, x2 — мольная доля его, K2 — постоянная Генри. Насыщенный раствор — раствор, в котором растворённое вещество при данных условиях достигло максимальной концентрации и больше не растворяется. Осадок данного вещества находится в равновесном состоянии с веществом в растворе.
Ненасыщенный раствор — раствор, в котором концентрация растворенного вещества меньше, чем в насыщенном растворе, и в котором при данных условиях можно растворить еще некоторое его количество.
Пересыщенный раствор — раствор, содержащий при данных условиях больше растворённого вещества, чем в насыщенном растворе, избыток вещества легко выпадает в осадок. Обычно пересыщенный раствор получают охлаждением раствора, насыщенного при более высокой температуре (пересыщение).
Растворы электролитов и неэлектролитов.
Электролиты при растворении в подходящих растворителях (вода, другие полярные растворители) диссоциируют на ионы. Сильное физико-химическое взаимодействие при растворении приводит к сильному изменению свойств раствора (химическая теория растворов). Электролиты при растворении в подходящих растворителях (вода, другие полярные растворители) диссоциируют на ионы. Сильное физико-химическое взаимодействие при растворении приводит к сильному изменению свойств раствора (химическая теория растворов).
Электролитическая диссоциация — процесс распада электролита на ионы при растворении его в воде или при плавлении.
Диссоциация на ионы происходит вследствие взаимодействия растворённого вещества с растворителем; по данным спектроскопических методов, это взаимодействие носит в значительной мере химический характер. Наряду с сольватирующей способностью молекул растворителя определённую роль в электролитической диссоциации играет также макроскопическое свойство растворителя — его диэлектрическая проницаемость (Схема электролитической диссоциации).
Под действием высоких температур ионы кристаллической решётки начинают совершать колебания, кинетическая энергия повышается, и наступит такой момент (при температуре плавления вещества), когда она превысит энергию взаимодействия ионов. Результатом этого является распад вещества на ионы.
Классическая теория электролитической диссоциации
Классическая теория электролитической диссоциации была создана С. Аррениусом и В. Оствальдом в 1887 году. Аррениус придерживался физической теории растворов, не учитывал взаимодействие электролита с водой и считал, что в растворах находятся свободные ионы. Русские химики И. А. Каблуков и В. А. Кистяковский применили для объяснения электролитической диссоциации химическую теорию растворов Д. И. Менделеева и доказали, что при растворении электролита происходит его химическое взаимодействие с водой, в результате которого электролит диссоциирует на ионы.
Классическая теория электролитической диссоциации основана на предположении о неполной диссоциации растворённого вещества, характеризуемой степенью диссоциации α, т. е. долей распавшихся молекул электролита. Динамическое равновесие между недиссоциированными молекулами и ионами описывается законом действующих масс . Например, электролитическая диссоциация бинарного электролита KA выражается уравнением типа:
Константа диссоциации Kd определяется активностями катионов анионов и недиссоциированных молекул следующим образом :
Значение Kd зависит от природы растворённого вещества и растворителя, а также от температуры и может быть определено несколькими экспериментальными методами. Степень диссоциации (α) может быть рассчитана при любой концентрации электролита с помощью соотношения:
где — средний коэффициент активности электролита.
Сильные электролиты
Классическая теория электролитической диссоциации применима лишь к разбавленным растворам слабых электролитов. Сильные электролиты в разбавленных растворах диссоциированы практически полностью, поэтому представления о равновесии между ионами и недиссоциированными молекулами лишено смысла. Согласно представлениям, выдвинутым в 20—30-х гг. 20 в. В. К. Семенченко (СССР), Н. Бьеррумом (Дания), Р. М. Фуоссом (США) и др., в растворах сильных электролитов при средних и высоких концентрациях образуются ионные пары и более сложные агрегаты. Современные спектроскопические данные показывают, что ионная пара состоит из двух ионов противоположного знака, находящихся в контакте («контактная ионная пара») или разделённых одной или несколькими молекулами растворителя («разделённая ионная пара»). Ионные пары электрически нейтральны и не принимают участия в переносе электричества. В сравнительно разбавленных растворах сильных электролитов равновесие между отдельными сольватированными ионами и ионными парами может быть приближённо охарактеризовано, аналогично классической теории электролитической диссоциации, константой диссоциации (или обратной величиной — константой ассоциации). Это позволяет использовать вышеприведённое уравнение для расчёта соответствующей степени диссоциации, исходя из экспериментальных данных. В простейших случаях (большие одноатомные однозарядные ионы) приближённые значения константы диссоциации в разбавленных растворах сильных электролитов можно вычислить теоретически, исходя из представлений о чисто электростатическом взаимодействии между ионами в непрерывной среде — растворителе.
Общие свойства растворов
Качественный и количественный состав растворов
Раствор - это гомогенная система, состоящая из двух или более веществ, содержание которых можно изменять в определенных пределах без нарушения однородности. Состав растворов обычно передаётся содержанием в них растворённого вещества в виде массовой доли или молярной концентрации. Жидкие растворы (в дальнейшем будем называть их просто "растворами") состоят из жидкого растворителя (чаще всего воды) и растворенного вещества, которое до смешения с растворителем могло быть твердым (например KBr), жидким (например h3SO4) или газообразным (например CO2). Состояние веществ в водном растворе обозначается (р), например KBr(р). Состав растворов обычно передается содержанием в нем растворенного вещества в виде массовой доли или молярной концентрации.
Массовая доля и молярная концентрация растворённого вещества
Массовая доля wВ растворенного вещества В - это отношение его массы mB к массе раствора m(р): wВ = mB / m(р), где m(р) = mB + m(Н2О). Единица массовой доли вещества в растворе - доля от единицы или от 100%. Например, если в 100 г раствора находится 1 г KBr, то w(KBr) = 0,01 (1%). Такой раствор называют однопроцентным (1%-ный раствор KBr). Для приготовления 100 г 1%-ного раствора некоторой соли надо взять 1 г этой соли и 99 г воды. Плотность воды при комнатной температуре принимают равной 1 г/мл, поэтому удобнее отмерять 99 мл воды и добавить 1 г соли.
Насыщенные и пересыщенные растворы
При растворении твердого вещества в воде сначала образуется ненасыщенный раствор, в котором возможно растворение следующих порций до тех пор, пока вещество не перестанет переходить в раствор и часть его не останется в виде осадка на дне стакана. При этом образуется насыщенный раствор: между веществом в насыщенном растворе и тем же веществом в осадке устанавливается состояние гетерогенного равновесия. KBr(т) KBr(насыщенный раствор) Частицы растворённого вещества переходят из осадка в раствор и обратно; при этом состав насыщенного раствора остается постоянным при T=const. Иногда приготовление раствора в особых условиях (осторожное охлаждение горячего ненасыщенного раствора) ведет не к насыщенному раствору (с осадком), а к пересыщенному раствору. Такой раствор обычно неустойчив - при введении "затравки" (кристаллика вещества) избыточное количество растворяемого вещества выпадает в осадок, и раствор становится насыщенным.
Растворимость веществ
Содержание вещества в насыщенном растворе при T=constколичественно характеризует растворимость этого вещества. Обычно растворимость выражается массой растворенного вещества, приходящейся на 100 г воды. Эта величина - коэффициент растворимости (например, 65,2 г KBr / 100 г h3O при 20 °С). Следовательно, если 70 г твердого бромида калия внести в 100 г воды при 20 °С, то 65,2 г соли перейдет в раствор (который будет насыщенным), а 4,8 г твердого бромида калия (избыток) останется на дне стакана. Содержание растворённого вещества в насыщенном растворе равно, в ненасыщенном растворе меньше и пересыщенном больше его растворимости при данной температуре. Так, раствор, приготовленный при 20 °С из 100 г воды и сульфата натрия Na2SO4 (растворимость 19,2 г / 100 г h3O), при содержании 12,3 г соли - ненасыщенный, 19,2 г соли - насыщенный, 20,1 г соли - пересыщенный. Растворимость твердых веществ обычно увеличивается с ростом температуры (KBr, NaCl) и лишь для некоторых веществ (CaSO4, Li2CO3) наблюдается обратное. Растворимость газов при повышении температуры падает, а при повышении давления растет, например, при давлении 1 атм растворимость аммиака составляет 52,6 (20 °С) и 15,4 г / 100 г h3O (80 °С), а при 20 °С и 9 атм она равна 93,5 г / 100 г h3O.
turboreferat.ru
 или
или  2. Мольная доля растворенного вещества. Отношение количества растворенного вещества к суммарному количеству всех веществ, составляющих раствор, включая растворитель
2. Мольная доля растворенного вещества. Отношение количества растворенного вещества к суммарному количеству всех веществ, составляющих раствор, включая растворитель  или
или  Мольная доля указывает на число молей данного вещества в одном моле раствора. Сумма мольных долей всех составных веществ равна единице:
Мольная доля указывает на число молей данного вещества в одном моле раствора. Сумма мольных долей всех составных веществ равна единице: 3. Объемная доля растворенного вещества: Отношение объема растворенного вещества к сумме объемов вещества и растворителя.
3. Объемная доля растворенного вещества: Отношение объема растворенного вещества к сумме объемов вещества и растворителя.  или
или  4. Молярная концентрация (или молярность). Определяется отношением числа молей растворенного вещества к объему раствора, выраженному в литрах. Физический смысл молярной концентрации заключается в том, что она указывает на число молей вещества содержащегося в 1 литре его раствора.
4. Молярная концентрация (или молярность). Определяется отношением числа молей растворенного вещества к объему раствора, выраженному в литрах. Физический смысл молярной концентрации заключается в том, что она указывает на число молей вещества содержащегося в 1 литре его раствора.  5. Нормальная концентрация (или нормальность). Определяется отношением числа эквивалентов растворенного вещества B к объему раствора, выраженному в литрах. Физический смысл нормальной концентрации заключается в том, что она указывает на число эквивалентов растворенного вещества, содержащегося в 1 литре раствора.
5. Нормальная концентрация (или нормальность). Определяется отношением числа эквивалентов растворенного вещества B к объему раствора, выраженному в литрах. Физический смысл нормальной концентрации заключается в том, что она указывает на число эквивалентов растворенного вещества, содержащегося в 1 литре раствора.  6. Моляльная концентрация (или моляльность). Определяется отношением числа молей растворенного вещества к массе растворителя. Физический смысл заключается в том, что она показывает, сколько молей вещества растворено в 1 кг (1000г) растворителя.
6. Моляльная концентрация (или моляльность). Определяется отношением числа молей растворенного вещества к массе растворителя. Физический смысл заключается в том, что она показывает, сколько молей вещества растворено в 1 кг (1000г) растворителя.  Применение того или иного способа выражения концентрации зависит от решения конкретных практических задач.
Применение того или иного способа выражения концентрации зависит от решения конкретных практических задач.  Растворимостью называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества является его содержание в насыщенном растворе. Если в 100 г воды растворяется более 10 г вещества, то такое вещество называют хорошо растворимым. Если растворяется менее 1 г вещества – вещество мало растворимо. Наконец, вещество считают практически нерастворимым, если в раствор переходит менее 0,01 г вещества. Абсолютно нерастворимых веществ не бывает. Растворение большинства твердых веществ в жидкостях сопровождается обычно поглощением энергии. Это объясняется затратой значительного количества энергии на разрушение кристаллической решетки твердого вещества. В этом случае растворимость твердых веществ увеличивается с ростом температуры. Но если растворение сопровождается выделением энергии, то растворимость с ростом температуры понижается. Такое явление наблюдается при растворении в воде щелочей, солей лития, магния, алюминия.
Растворимостью называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества является его содержание в насыщенном растворе. Если в 100 г воды растворяется более 10 г вещества, то такое вещество называют хорошо растворимым. Если растворяется менее 1 г вещества – вещество мало растворимо. Наконец, вещество считают практически нерастворимым, если в раствор переходит менее 0,01 г вещества. Абсолютно нерастворимых веществ не бывает. Растворение большинства твердых веществ в жидкостях сопровождается обычно поглощением энергии. Это объясняется затратой значительного количества энергии на разрушение кристаллической решетки твердого вещества. В этом случае растворимость твердых веществ увеличивается с ростом температуры. Но если растворение сопровождается выделением энергии, то растворимость с ростом температуры понижается. Такое явление наблюдается при растворении в воде щелочей, солей лития, магния, алюминия.  Теоретически пока нельзя вычислить точно величину растворимости данного вещества в определенном растворителе. Сходство в химической природе двух веществ увеличивает их взаимную растворимость. Многие жидкости проявляют способность к неограниченной взаимной растворимости. Так бензол и толуол, вода и этиловый спирт могут смешиваться друг с другом в любых отношениях. Жидкости с ограниченной взаимной растворимостью образуют расслаивающиеся системы. По мере повышения температуры взаимная растворимость увеличивается, и тогда жидкости полностью смешиваются, образуя однородную массу. Температура, при которой наступает смешивание, называется критической температурой смешения. Растворение газов в воде представляет собой экзотермический пресс. Поэтому растворимость газов с повышением температуры уменьшается. Однако растворение газов в органических жидкостях сопровождается поглощением теплоты. Это происходит от того энергия межмолекулярного взаимодействия между молекулами растворителя и растворимого вещества больше, чем энергия притяжения между молекулами газа и растворителя в растворе. На практике растворимость вещества выражается величиной, называемой коэффициентом растворимости. Коэффициент растворимости показывает массу вещества, насыщаемую при данной температуре 100 граммов растворителя. Растворимость некоторых веществ в воде представлена в таблице
Теоретически пока нельзя вычислить точно величину растворимости данного вещества в определенном растворителе. Сходство в химической природе двух веществ увеличивает их взаимную растворимость. Многие жидкости проявляют способность к неограниченной взаимной растворимости. Так бензол и толуол, вода и этиловый спирт могут смешиваться друг с другом в любых отношениях. Жидкости с ограниченной взаимной растворимостью образуют расслаивающиеся системы. По мере повышения температуры взаимная растворимость увеличивается, и тогда жидкости полностью смешиваются, образуя однородную массу. Температура, при которой наступает смешивание, называется критической температурой смешения. Растворение газов в воде представляет собой экзотермический пресс. Поэтому растворимость газов с повышением температуры уменьшается. Однако растворение газов в органических жидкостях сопровождается поглощением теплоты. Это происходит от того энергия межмолекулярного взаимодействия между молекулами растворителя и растворимого вещества больше, чем энергия притяжения между молекулами газа и растворителя в растворе. На практике растворимость вещества выражается величиной, называемой коэффициентом растворимости. Коэффициент растворимости показывает массу вещества, насыщаемую при данной температуре 100 граммов растворителя. Растворимость некоторых веществ в воде представлена в таблице | Вещество | Растворимость: масса вещества (г) в 100 г воды при температурах | ||||||
00C | 100C | 200C | 400C | 600C | 800C | 1000C | |
SO2 | 22,83 | 16,21 | 11,29 | 5,41 | 3,2 | 2,1 | – |
Nh4 | 89,7 | 68,3 | 52,9 | 31,6 | 16,8 | 6,5 | 0 |
CuSO4 | 14,3 | 17,4 | 20,7 | 28,5 | 40,0 | 55,0 | 75,4 |
K2SO4 | 7,35 | 9,22 | 11,11 | 14,76 | 18,17 | 21,4 | 24,1 |
Al2(SO4)3 | 31,2 | 33,5 | 36,4 | 45,7 | 59,2 | 73,1 | 89,0 |
| NaCl | 35,7 | 35,8 | 36,0 | 36,6 | 37,3 | 38,4 | 39,8 |
Nh5Cl | 29,4 | 33,3 | 37,2 | 45,2 | 55,2 | 65,6 | 77,3 |
KNO3 | 13,3 | 20,9 | 31,6 | 63,9 | 110,0 | 169 | 243 |
KNO2 | 278,8 | – | 298,4 | 334,9 | 350 | 376 | 412,9 |
 Теплота растворения зависит от концентрации полученного раствора и от температуры. Особый интерес представляют первая и полная теплоты растворения. Первой теплотой растворения называется изменение энтальпии при растворении 1 моль вещества в бесконечно большом количестве растворителя. В результате этого процесса образуется бесконечно разбавленный раствор. Полной теплотой растворения называется изменение энтальпии при растворении 1 моль вещества в таком количестве чистого растворителя, которой необходимо для образования насыщенного раствора. Тепловой эффект взаимодействия раствора данной концентрации с чистым растворителем называется энтальпией разведения или разбавления. Если раствор, содержащий 1 моль растворенного вещества, разбавляется от данной концентрации до определенной конечной (не бесконечно малой) концентрации, то тепловой эффект тепловой эффект называется промежуточной теплотой разбавления.
Теплота растворения зависит от концентрации полученного раствора и от температуры. Особый интерес представляют первая и полная теплоты растворения. Первой теплотой растворения называется изменение энтальпии при растворении 1 моль вещества в бесконечно большом количестве растворителя. В результате этого процесса образуется бесконечно разбавленный раствор. Полной теплотой растворения называется изменение энтальпии при растворении 1 моль вещества в таком количестве чистого растворителя, которой необходимо для образования насыщенного раствора. Тепловой эффект взаимодействия раствора данной концентрации с чистым растворителем называется энтальпией разведения или разбавления. Если раствор, содержащий 1 моль растворенного вещества, разбавляется от данной концентрации до определенной конечной (не бесконечно малой) концентрации, то тепловой эффект тепловой эффект называется промежуточной теплотой разбавления.  , где
, где  p – парциальное давление k – константа Генри Закон Генри звучит так: Парциальное давление пара растворенного вещества пропорционально его концентрации в растворе. При NA=1 парциальное давление пара pA представляет собой давление насыщенного данного компонента в свободном состоянии
p – парциальное давление k – константа Генри Закон Генри звучит так: Парциальное давление пара растворенного вещества пропорционально его концентрации в растворе. При NA=1 парциальное давление пара pA представляет собой давление насыщенного данного компонента в свободном состоянии  . Следовательно k=
. Следовательно k= и равенство принимает вид:
и равенство принимает вид:  Концентрация растворенного вещества в растворе при выражении ее в мольных долях этого вещества NA связана с концентрацией растворителя как NA+ NB =1. Подставляя это выражение в закон Генри получим:
Концентрация растворенного вещества в растворе при выражении ее в мольных долях этого вещества NA связана с концентрацией растворителя как NA+ NB =1. Подставляя это выражение в закон Генри получим:  Þ
Þ  Разность (
Разность ( ) называется понижением давления насыщенного пара, а отношение
) называется понижением давления насыщенного пара, а отношение  -относительным понижением давления насыщенного пара. Согласно закону Рауля: Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле вещества в растворе Если графически изобразить зависимость давления пара каждого вещества двухкомпонентной смеси от его мольной доли, поучиться прямая линия. Пусть даны вещества А и В. Обозначим их мольные доли NA и N B. По закону Рауля имеем:
-относительным понижением давления насыщенного пара. Согласно закону Рауля: Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле вещества в растворе Если графически изобразить зависимость давления пара каждого вещества двухкомпонентной смеси от его мольной доли, поучиться прямая линия. Пусть даны вещества А и В. Обозначим их мольные доли NA и N B. По закону Рауля имеем:  pA=
pA= * NA, pB=
* NA, pB= * NВ
* NВ где p0 есть давление пара чистого вещества. Это суть уравнения прямых, если на осях отложены давления пара и мольные доли. Для общего давления пара раствора отсюда следует равенство: p=
где p0 есть давление пара чистого вещества. Это суть уравнения прямых, если на осях отложены давления пара и мольные доли. Для общего давления пара раствора отсюда следует равенство: p= * NA +
* NA +  * NВ Эта линейная зависимость осложняется если между компонентами смеси действуют силы притяжения, и она изображается не прямой, а кривой линией Если оба компонента раствора в чистом состоянии летучи, то пар будет содержать оба компонента. Однако относительное содержание компонентов в парах в общем случае будет отличаться от относительного содержания их в жидкостях. Для простейших систем легко установить соотношение между составами раствора и пара, равновесного с ним. Только b системе, компоненты которой обладают одинаковым давлением пара в чистом состоянии, состав пара над раствором равен составу раствора. В остальных же случаях состав пара отличен от состава раствора и тем в большей степени, чем больше различаются давления пара над чистыми компонентами. В простейших системах в парах всегда преобладает по сравнению с жидкостью тот из компонентов, который обладает большим давлением пара в чистом состоянии. В количественной форме соотношения между составом пара и жидкости могут быть выведены следующим путем. Обозначим через NA’ и NB ’ мольные доли компонентов в парах, причем NA’=
* NВ Эта линейная зависимость осложняется если между компонентами смеси действуют силы притяжения, и она изображается не прямой, а кривой линией Если оба компонента раствора в чистом состоянии летучи, то пар будет содержать оба компонента. Однако относительное содержание компонентов в парах в общем случае будет отличаться от относительного содержания их в жидкостях. Для простейших систем легко установить соотношение между составами раствора и пара, равновесного с ним. Только b системе, компоненты которой обладают одинаковым давлением пара в чистом состоянии, состав пара над раствором равен составу раствора. В остальных же случаях состав пара отличен от состава раствора и тем в большей степени, чем больше различаются давления пара над чистыми компонентами. В простейших системах в парах всегда преобладает по сравнению с жидкостью тот из компонентов, который обладает большим давлением пара в чистом состоянии. В количественной форме соотношения между составом пара и жидкости могут быть выведены следующим путем. Обозначим через NA’ и NB ’ мольные доли компонентов в парах, причем NA’= и NB’=
и NB’= Пользуясь законом Рауля легко получить, что p=
Пользуясь законом Рауля легко получить, что p= , а пользуясь выражением p=
, а пользуясь выражением p= получаем, что
получаем, что  =
= Для систем, в которых зависимость давления пара от состава нелинейная, нет общего выражения, в такой простей форме связывающего составы пара и раствора. Зависимость состава пара от состава раствора и общего давления характеризуется законом, открытым Д.И.Коноваловым и носящими его имя. Закон Коновалова характеризует соотношения между составами равновесных жидкостей и пара и влияние добавления того или иного компонента на общее давление пара. Он формулируется следующим образом: а) Повышение относительного содержания компонента в жидкой фазе всегда вызывает увеличение относительного содержания его и в парах. b) В двойной системе пар, по сравнению с находящейся с ним в равновесии жидкостью, относительно более богаче тем из компонентов, прибавление которого к системе повышает общее давление пара, т.е. понижает температуру кипения смеси при данном давлении. Введем в раствор из двух веществ какое-либо новое вещество. В общем случае это вещество распределится между обоими веществами в растворе, пропорционально своей растворимости в каждом из них. Отсюда втекает закон распределения, согласно которому вещество, способное растворяться в двух несмешивающихся растворителях, распределяется между ними так, что отношение его концентраций в этих растворителях при постоянной температуре остается постоянным, независимо от общего количества растворенного вещества.
Для систем, в которых зависимость давления пара от состава нелинейная, нет общего выражения, в такой простей форме связывающего составы пара и раствора. Зависимость состава пара от состава раствора и общего давления характеризуется законом, открытым Д.И.Коноваловым и носящими его имя. Закон Коновалова характеризует соотношения между составами равновесных жидкостей и пара и влияние добавления того или иного компонента на общее давление пара. Он формулируется следующим образом: а) Повышение относительного содержания компонента в жидкой фазе всегда вызывает увеличение относительного содержания его и в парах. b) В двойной системе пар, по сравнению с находящейся с ним в равновесии жидкостью, относительно более богаче тем из компонентов, прибавление которого к системе повышает общее давление пара, т.е. понижает температуру кипения смеси при данном давлении. Введем в раствор из двух веществ какое-либо новое вещество. В общем случае это вещество распределится между обоими веществами в растворе, пропорционально своей растворимости в каждом из них. Отсюда втекает закон распределения, согласно которому вещество, способное растворяться в двух несмешивающихся растворителях, распределяется между ними так, что отношение его концентраций в этих растворителях при постоянной температуре остается постоянным, независимо от общего количества растворенного вещества.  где С1B и С2B - концентрации растворенного вещества в первом и втором растворителях; KD(B) – константа распределения вещества B между двумя жидкими несмешивающимися фазами.
где С1B и С2B - концентрации растворенного вещества в первом и втором растворителях; KD(B) – константа распределения вещества B между двумя жидкими несмешивающимися фазами.  DU=
DU= , где UA-A, UB-B и UA-B - средние потенциальные энергии взаимодействия между однородными и разнородными молекулами соответственно, если DU=0, то раствор идеальный. Идеальные растворы при всех концентрациях и температурах подчиняются закону Рауля.
, где UA-A, UB-B и UA-B - средние потенциальные энергии взаимодействия между однородными и разнородными молекулами соответственно, если DU=0, то раствор идеальный. Идеальные растворы при всех концентрациях и температурах подчиняются закону Рауля.  Эта величина называется активностью i в растворе. Согласно уравнению
Эта величина называется активностью i в растворе. Согласно уравнению  отношение
отношение равно мольной концентрации данного компонента в растворе. Активность представляет собой вспомогательную расчетную термодинамическую функцию, которая характеризует степень связанности молекул компонента. При образовании данным компонентом в растворе каких-нибудь соединений его активность становится меньше и, наоборот, активность возрастает при уменьшении степени ассоциации компонента. Активность дает возможность судить об отклонении свойств данного компонента в том или ином растворе от свойств в простейшем растворе при той же мольной концентрации компонента. Активность зависит от вида и концентрации каждого из других компонентов .раствора. Она зависит также от температуры и от давления, но не зависит от способа выражения концентрации. Химический потенциал данного компонента в растворе связывается с активностью соотношением:
равно мольной концентрации данного компонента в растворе. Активность представляет собой вспомогательную расчетную термодинамическую функцию, которая характеризует степень связанности молекул компонента. При образовании данным компонентом в растворе каких-нибудь соединений его активность становится меньше и, наоборот, активность возрастает при уменьшении степени ассоциации компонента. Активность дает возможность судить об отклонении свойств данного компонента в том или ином растворе от свойств в простейшем растворе при той же мольной концентрации компонента. Активность зависит от вида и концентрации каждого из других компонентов .раствора. Она зависит также от температуры и от давления, но не зависит от способа выражения концентрации. Химический потенциал данного компонента в растворе связывается с активностью соотношением:  Вместо активности нередко пользуются величиной коэффициента активности, g. Он равен отношению активности к концентрации g=
Вместо активности нередко пользуются величиной коэффициента активности, g. Он равен отношению активности к концентрации g= . Коэффициент активности характеризует степень отклонения свойств рассматриваемого компонента в данном растворе от его свойств в соответствующем простейшем растворе. В сильно разбавленном растворе коэффициент активности равен единице. Чем более концентрирован раствор, тем больше отличается активность от концентрации.
. Коэффициент активности характеризует степень отклонения свойств рассматриваемого компонента в данном растворе от его свойств в соответствующем простейшем растворе. В сильно разбавленном растворе коэффициент активности равен единице. Чем более концентрирован раствор, тем больше отличается активность от концентрации.  . Понижение температуры замерзания пропорционально концентрации растворенного вещества в растворе. DT=K*c Коэффициент K называется молярным понижением температуры замерзания или криоскопической постоянной. К =
. Понижение температуры замерзания пропорционально концентрации растворенного вещества в растворе. DT=K*c Коэффициент K называется молярным понижением температуры замерзания или криоскопической постоянной. К =  , где
, где  -температура замерзания растворителя lпл – удельная теплота плавления
-температура замерзания растворителя lпл – удельная теплота плавления  будет тем большей, чем выше концентрация растворов. Повышение температуры кипения пропорционально концентрации раствора. DT кип = Е*с Коэффициент пропорциональности Е является постоянной. Он называется молярным повышение температуры кипения или эбуллиоскопической постоянной. Е =
будет тем большей, чем выше концентрация растворов. Повышение температуры кипения пропорционально концентрации раствора. DT кип = Е*с Коэффициент пропорциональности Е является постоянной. Он называется молярным повышение температуры кипения или эбуллиоскопической постоянной. Е =  , где
, где  - температура кипения чистого растворителя lисп – удельная теплота его испарения
- температура кипения чистого растворителя lисп – удельная теплота его испарения  .Таким образом осмотическое давление равно тому газовому давлению, которым обладало растворенное вещество, если бы, находясь в газообразном состоянии при той же температуре, оно занимало бы весь объем, который занимает раствор. Этот закон называется законом Вант-Гоффа
.Таким образом осмотическое давление равно тому газовому давлению, которым обладало растворенное вещество, если бы, находясь в газообразном состоянии при той же температуре, оно занимало бы весь объем, который занимает раствор. Этот закон называется законом Вант-Гоффа works.tarefer.ru
Растворы
Растворами называются термодинамически устойчивые гомогенные системы, состоящие из двух и более веществ, а также продуктов их взаимодействия между собой.
Вещества, образующие раствор, называются иначе его компонентами. Их состав и концентрация в растворе могут изменяться в пределах ограниченных взаимной растворимостью.
Характерной особенностью растворов является то, что составляющие их компоненты присутствуют в них в виде отдельных молекул или ионов, которые равномерно распределяются по всему объему системы. В связи с этим в растворах отсутствует поверхность раздела между веществами и не протекают поверхностные явления, приводящие к значительному увеличению внутренней энергии. Такие растворы называются иначе истинными. Они являются термодинамически устойчивыми, образуются самопроизвольно и могут существовать неограниченно долгое время, если не изменять их количественный состав и условия хранения.
Истинные растворы в зависимости от своего агрегатного состояния подразделяются на газообразные, твердые и жидкие.
Газообразные растворы называются иначе газовыми смесями. Примером такой смеси может служить земная атмосфера, состоящая, главным образом, из азота и кислорода, а также некоторых других веществ, присутствующих в значительно меньших количествах (углекислого газа, водяных паров, благородных газов и т. д.).
Твердыми растворами являются многие сплавы металлов, некоторые неорганические минералы. Образуются твердые растворы при кристаллизации расплавов.
Наибольшее распространение в природе и в хозяйственной деятельности человека получили жидкие растворы. Они, в свою очередь, подразделяются на растворы газов в жидкостях, жидкостей в жидкостях и растворы твердых веществ в жидкостях.
Различают также растворы низкомолекулярных соединений (НМС) и растворы высокомолекулярных соединений (ВМС). Последние по многим свойствам значительно отличаются от растворов НМС и поэтому будут рассмотрены отдельно.
При характеристике составных частей жидких растворов используют понятия растворитель и растворенное вещество. Однако, провести между ними четкую разграничительную линию удается не всегда. Легче всего это сделать, если образующие раствор вещества, в индивидуальном виде находятся в разных агрегатных состояниях. В этом случае растворителем всегда считается то вещество, которое при тех же условиях, что и получившийся раствор, является жидкостью. Твердые и газообразные вещества, входящие в состав такого раствора, называются растворенными веществами.
При образовании раствора из двух смешивающихся жидкостей растворителем чаще всего называют то вещество, которое присутствует в растворе в бульших количествах, или же по взаимной договоренности какое-то конкретное вещество (например, Н2О), независимо от его содержания в системе.
К твердым растворам и газовым смесям понятия растворитель и растворенное вещество не применяют.
Жидкие растворы, в которых в качестве растворителя выступает Н2О, называются водными. Если растворителем является какая-то другая жидкость — неводными.
Для медицины наибольшее значение имеют водные растворы, т.к. Н2О является универсальным растворителем для веществ самой различной природы и составляет основную часть внутренней среды человеческого организма. В зависимости от возраста человека на долю воды в его теле может приходиться от 80 до 50% по массе. При этом важнейшие биологические жидкости (кровь, лимфа, моча, слюна, пот и т. д.) содержат в своем составе различные растворенные вещества: неорганические соли, белки, углеводы, аминокислоты и другие гетеро- и полифункциональные органические соединения. В водной среде в живых организмах протекают многочисленные биохимические реакции. Усваивание пищи связано с переходом питательных веществ в растворенное состояние. Это облегчает их дальнейшую транспортировку биологическими жидкостями к органам и тканям. Выведение из организма метаболитов также осуществляется путем перевода их в растворенное состояние.
Физические свойства Н2О и строение ее молекул
При комнатных условиях чистая вода — жидкость без запаха и вкуса. Температура кипения Н2О (при р=101,325 кПа) равна 100оС, температура замерзания 0оС. В тонком слое вода бесцветна, однако при толщине более двух метров приобретает голубоватый оттенок. Вода является хорошим растворителем для многих веществ, поэтому чистой Н2О в природе нет. Она всегда содержит многочисленные примеси растворенных веществ. Для очистки от них воду доводят до кипения, а образовавшиеся при этом водяные пары путем охлаждения вновь конденсируют в жидкость. Этот процесс называют «перегонкой», а получившуюся Н2О — дистиллированной водой.
Молекулы Н2О состоят из двух атомов водорода Н и одного атома кислорода О, соединенных между собой ковалентными полярными связями. На атоме О, как на более электроотрицательном сосредоточен частичный отрицательный заряд |д-| < 1, а на атомах Н — частичный положительный заряд |д+| < 1. Молекула Н2О имеет угловую форму. Атомы водорода, связанные одинарными д-связями с атомами кислорода, образуют угол, равный 104,5о (рис. 16). Он несколько отличается от тетраэдрического (109о28?), хотя атом О в молекуле Н2О находится в состоянии sp3-гибридизации.
Отклонение угла связи от тетраэдрического связано с взаимным отталкиванием двух неподеленных электронных пар, находящихся на гибридных орбиталях атома кислорода.
Рис. 1 — Схема образования молекулы Н2О
Вследствие своего строения молекула Н2О обладает значительным дипольным моментом (рис. 17) и является сильнополярной. В связи с этим вода имеет большую диэлектрическую проницаемость и в ее среде значительно уменьшаются (приблизительно в 80 раз) кулоновские силы взаимодействия между электрическими зарядами. Это приводит к тому, что прочность связей в ионной кристаллической решетке, а также между полярными молекулами твердых и жидких веществ и между атомами в самих этих молекулах тоже понижается? в 80 раз.
? 0
Рис. 2 — Дипольный момент молекулы Н2О
Благодаря этому свойству вода хорошо растворяет вещества, образованные ионными и ковалентными полярными связями, вызывая при этом электролитическую диссоциацию электролитов и реакции гидролитического разложения веществ.
Вода по сравнению с другими водородными соединениями элементов IVA — VIIA групп (HCl, h3S, Ch5, HF, Nh4) имеет аномально высокие температуры кипения и плавления, обладает высокой теплоемкостью и удельной теплотой испарения.
Эти свойства воды объясняются способностью ее молекул образовывать друг с другом прочные водородные связи. Причем одна молекула Н2О может образовать водородные связи с четырьмя другими молекулами воды. Это создает возможность построения сложной трехмерной пространственной структуры из ассоциированных молекул Н2О, в которой имеется много пустот. Благодаря этому плотность льда меньше плотности жидкой воды, т.к. в последнем случае вследствие теплового движения происходит частичное разрушение водородных связей и образовавшиеся свободные молекулы воды могут заполнять имеющиеся полости, увеличивая тем самым плотность жидкости.
Водородные связи молекулы Н2О могут образовывать не только между собой, но и с полярными функциональными группами органических веществ: спиртов, аминов, карбоновых кислот, различных гетеро- и полифункциональных соединений, способствуя тем самым их растворению.
Таким образом, вода является универсальным растворителем и способна растворять в себе как многочисленные неорганические, так и органические соединения.
Механизм образования растворов
Растворы занимают промежуточное положение между механическими смесями веществ и индивидуальными химическими соединениями, обладая определенными свойствами и тех и других систем и в тоже время значительно отличаясь от каждой из них.
Так по сравнению со смесями растворы являются более однородными и в любой своей части обладают одинаковыми физическими свойствами и химическим составом, как и индивидуальные соединения.
В то же время многие вещества в растворах, как и в механических смесях, сохраняют неизменными часть свойств, присущих им в чистом виде. В отличие от индивидуальных соединений растворы обладают переменным составом и отличаются природой связи между своими структурными единицами. Если для химических веществ характерны ковалентные и ионные связи, то в растворах между их компонентами присутствуют более слабые диполь-дипольные, ион-дипольные или ван-дер-ваальсовые взаимодействия, а в некоторых случаях — водородные связи и донорно-акцепторные взаимодействия.
Таким образом, процесс растворения нельзя рассматривать как простое механическое распределение одного вещества в другом.
Дмитрий Иванович Менделеев (1834-1907)
Поистине великий ученый. Нет, кажется, ни одной области химии, в которую бы он не внес свой вклад. Наиболее известные его работы, кроме периодического закона, это открытие «температуры абсолютного кипения» (критической точки), разработка физико-химической (гидратной) теории растворов, формулировка обобщенного газового закона. Еще одним главным делом своей жизни Д. И. Менделеев считал учебник «Основы химии».
При растворении имеет место физико-химическое взаимодействие растворяемого вещества с молекулами растворителя, в результате которого разрушается его исходная структура и происходит образование новой структуры, свойственной раствору. При этом различают физическую и химическую стадии растворения вещества, которые протекают одновременно.
На физической стадии происходит процесс измельчения (диспергирования) растворяемого вещества до отдельных молекул или ионов и их равномерное распределение во всем объеме раствора. Осуществляется она за счет действия молекул растворителя на вещество и протекания процесса диффузии.
На этой стадии энергия всегда затрачивается, т.к. она необходима для разрыва связей в кристаллической решетке твердого вещества или межмолекулярных связей при растворении жидкости.
Покажем механизм этого процесса на примере растворения в Н2О соли KCl, имеющей ионную кристаллическую решетку (рис. 3).
Диполи растворителя ориентируются соответствующим образом относительно ионов кристаллической решетки на ее поверхности и в результате своего теплового движения и колебательного движения ионов последовательно вырывают их из узлов решетки и переводят в раствор.
Чем прочнее связи в кристаллической решетке, тем большее количество энергии нужно затратить на ее разрушение. Межмолекулярные связи в жидкостях, как правило, слабее чем в твердых веществах, поэтому при их растворении энергии затрачивается гораздо меньше.
Рис. 3 — Механизм растворения ионного соединения (KCl) в воде
В газах молекулы практически не связаны между собой, поэтому на физической стадии их растворения энергия не расходуется.
На химической стадии растворения происходит взаимодействие частиц растворенного вещества (молекул или ионов) с молекулами растворителя и образуются химические соединения: гидраты (если в роли растворителя выступает Н2О) или сольваты (если растворителем выступает любая другая жидкость).
В зависимости от природы растворенного вещества сольваты (гидраты) могут образовываться как в результате физических взаимодействий: ион-дипольного (при растворении веществ с ионной структурой) и диполь-дипольного (при растворении веществ с молекулярной структурой), так и химических.
Химические взаимодействия осуществляются за счет образования донорно-акцепторных связей. При этом ионы растворенного вещества являются акцепторами, а молекулы растворителя (Н2О, Nh4) — донорами электронных пар. Образующиеся таким образом гидраты называются иначе аквакомплексами: [Cu (h3O)6]2+, [Al (Н2О)6]3+. Их образование в растворах часто сопровождается изменением окраски. Так растворение безводного медь (II)-сульфата белого цвета приводит к появлению интенсивной голубой окраски. Гидратные оболочки полярных молекул органических соединений появляются в результате образования водородных связей между их функциональными группами и молекулами воды.
Вследствие образования гидратов (сольватов) при растворении многих веществ имеет место контрактация — сжатие объема системы из-за ее самоуплотнения (особенно в случае концентрированных растворов). При этом объем получившегося раствора будет меньше суммы объемов растворителя и растворяемого вещества (если только последнее не является газом).
Образование гидратных (сольватных) оболочек всегда сопровождается выделением энергии. При гидратации ионов количество выделившейся энергии и число удерживаемых молекул воды зависят от величины их заряда и радиуса.
Чем больше заряд иона и меньше его радиус, тем большее количество энергии выделяется и тем более устойчивой будет образовавшаяся гидратная оболочка (рис. 4).
Рис. 4 — Зависимость размеров гидратных оболочек ионов от величины их радиуса
Если вещество в растворе находится в виде молекул, то количество выделяемой при гидратации энергии пропорционально полярности его молекул.
В ходе теплового движения частицы растворенного вещества в растворе перемещается вместе со своими гидратными (сольватными) оболочками, которые составляют с ними одно целое.
В большинстве случаев образовавшиеся гидратные (сольватные) оболочки являются непрочными и легко разрушаются уже при слабом нагревании или при выпадении веществ из раствора. Но иногда гидратные соединения настолько устойчивы, что выпадают из раствора в виде кристаллов, которые называются иначе кристаллогидратами, а содержащаяся в них Н2О — кристаллизационной.
В химических формулах кристаллогидратов молекулы Н2О пишутся через точку (табл. 1). Из этих формул видно, сколько молекул Н2О окружают одну молекулу вещества.
Таблица 1 — Формулы и тривиальные названия кристаллогидратов
Название кристаллогидрата | Химическая формула | |
Сода кристаллическая | Na2CO3 · 10 Н2О | |
Медный купорос | CuSO4 · 5 Н2О | |
Железный купорос | FeSO4 · 7 Н2О | |
Глауберова соль | Na2SO4 · 10 Н2О | |
Английская соль | MgSO4 · 7 Н2О | |
Гипс | CaSO4 · 2 Н2О | |
Алебастр | CaSO4 · 0,5 Н2О | |
При нагревании (иногда достаточно сильном) кристаллогидраты разрушаются, а кристаллизационная Н2О испаряется.
Физическая и химическая стадии процесса растворения протекают одновременно. Суммарный тепловой эффект при растворении вещества определяется соотношением между двумя этими стадиями.
Если на физической стадии энергии затрачивается больше, чем её выделяется на химической стадии, то при растворении такого вещества температура раствора будет понижаться, а энергия, в целом, затрачиваться. Это наблюдается, например, при растворении NaCl, Nh5NO3.
Если же на физической стадии энергии расходуется меньше, чем выделяется на химической стадии, то при растворении таких веществ температура раствора, наоборот, будет повышаться, а энергия, в целом, выделяться. Особенно хорошо это наблюдается при растворении в воде NaOH, KOH, h3SO4.
Если на физической стадии затрачивается примерно столько же энергии, сколько выделяется на химической, то температура раствора при растворении такого вещества практически не будет меняться.
При растворении газов теплота всегда выделяется, т.к. на физической стадии энергия не расходуется.
Тепловые эффекты растворения большинства веществ незначительны, поэтому заметного разогревания или охлаждения растворов, как правило, не наблюдается. Однако в некоторых случаях, например, при растворении в Н2О гидроксидов щелочных металлов или h3SO4, происходит настолько сильное разогревание раствора, что он может даже закипеть. Поэтому при приготовлении водных растворов кислот и щелочей требуется особая осторожность. В частности, при получении разбавленного раствора h3SO4 нужно приливать небольшими порциями концентрированную кислоту в Н2О, а не наоборот.
При растворении NaCl или Nh5NO3 температура раствора может, понизиться до минусовой.
Теплоту, выделяемую или поглощаемую при растворении 1 моля вещества называют его теплотой растворения (Qраств.).
Растворимость веществ. Факторы, влияющие на растворимость
Одни вещества лучше растворяются в том или ином растворителе, другие хуже. Считается, что абсолютно нерастворимых веществ нет. Каждое вещество способно к растворению, пусть даже в некоторых случаях и в очень незначительных количествах (например, ртуть в воде, бензол в воде).
К сожалению, до настоящего времени, нет теории, с помощью которой можно было бы предсказать и вычислить растворимость любого вещества в соответствующем растворителе. Обусловлено это сложностью и многообразием взаимодействия компонентов раствора между собой и отсутствием общей теории растворов (особенно концентрированных). В связи с этим необходимые данные по растворимости веществ получают, как правило, опытным путем.
Количественно способность вещества к растворению характеризуется чаще всего растворимостью или коэффициентом растворимости (S).
Растворимость (S) показывает сколько граммов вещества может максимально раствориться при данных условиях (температуре, давлении) в 100 г растворителя с образованием насыщенного раствора.
При необходимости коэффициент растворимости определяется и для другого количества растворителя (например, для 1000 г, 100 см³, 1000 см³ и т. д.).
По растворимости все вещества в зависимости от своей природы делятся на 3 группы: 1) хорошо растворимые; 2) мало растворимые; 3) плохо растворимые или нерастворимые.
Коэффициент растворимости для веществ первой группы больше 1 г (на 100 г растворителя), для веществ второй группы лежит в интервале 0,01 — 1,0 г и для веществ третьей группы S < 0,01 г.
На растворимость веществ оказывают влияние многие факторы, главными из которых являются природа растворителя и растворяемого вещества, температура, давление, наличие в растворе других веществ (особенно электролитов).
Влияние природы веществ на растворимость
Установлено опытным путем, что в растворителе, молекулы которого полярны, лучше всего растворяются вещества, образованные ионными или ковалентными полярными связями. А в растворителе, молекулы которого неполярны, лучше растворяются вещества, образованные слабополярными или неполярными ковалентными связями. По другому эту выявленную закономерность можно сформулировать так: «Подобное растворяется в подобном».
Растворимость веществ во многом обуславливается силой и характером их взаимодействия с молекулами растворителя. Чем сильнее выражено это взаимодействие, тем больше растворимость и наоборот.
Известно, что силы, действующие между неполярными и слабополярными молекулами, невелики и неспецифичны, т. е. в количественном выражении существенно не зависят от вида вещества.
Если в неполярную жидкость В ввести однотипные неполярные молекулы А, то энергия взаимодействия частиц, А и В между собой не будет значительно отличаться от энергии взаимодействия между частицами, А и, А или частицами В и В. Поэтому подобно тому как смешиваются любые количества одного и того же вещества, с большой вероятностью будут неограниченно смешиваться друг с другом (т.е. растворяться друг в друге) и различные неполярные жидкости.
По этой же причине и молекулярные кристаллы обычно лучше растворяются в неполярных жидкостях.
Если же энергия взаимодействия молекул, А и, А или В и В больше чем, А и В, то одинаковые молекулы каждого компонента будут предпочтительнее связываться между собой и растворимость их друг в друге понизится (табл. 6).
Полярность любого растворителя часто характеризуют значением его диэлектрической проницаемости (е), которая легко определяется опытным путем. Чем она больше, тем более полярным является вещество.
Таблица 2 — Растворимость KI (мас%) в растворителях различной полярности
Растворитель | Н2О | Ch4OH | н-С4Н9ОН | C6H6 | |
Диэлектрическая проницаемость растворителя, е | 80,4 | 31,2 | 10,72 | 2,3 | |
Растворимость, KI | 59,8 | 14,97 | 0,2 | 0,16 | |
Растворимость веществ значительно повышается если они способны образовывать с растворителем водородные или донорно-акцепторные связи. Примером большой растворимости, обусловленной образованием водородных связей, является раствор этилового спирта в Н2О, а образованием донорно-акцепторных связей — раствор Nh4 в воде. При этом растворимость спирта не ограничена, а Nh4 в Н2О растворяется в объемном соотношении ~ 700: 1.
Влияние давления на растворимость веществ
Влияние давления на растворимость твердых и жидких веществ практически не сказывается, т.к. объем системы при этом изменяется незначительно. Только при очень высоких давлениях изменение растворимости становится заметным. Так, например, растворимость Nh5NO3 снижается почти вдвое при повышении давления до 106 кПа (т.е. приблизительно в 10 000 раз больше атмосферного).
Существенное влияние давление оказывает лишь на растворимость газов. Причем если между газом и растворителем не возникает химического взаимодействия, то согласно закона Генри растворимость газа при постоянной температуре прямо пропорциональна его давлению над раствором
S = kp
где k — коэффициент пропорциональности, зависящий от природы жидкости и газа; p — давление газа над раствором.
Закон Генри справедлив только для разбавленных растворов и в условиях низких давлений.
Если речь идет о растворении не одного газообразного вещества, а смеси, состоящей из нескольких газов, то согласно закона Дальтона растворимость каждого компонента смеси при постоянной температуре пропорциональна его парциальному давлению над жидкостью и не зависит от общего давления смеси и присутствия других газов.
Парциальное давление отдельного газа в смеси (р1) рассчитывается по формуле:
р1 = робщ. · Х1
где робщ. — общее давление газовой смеси; Х1 — мольная доля газа в смеси.
Если газовая смесь состоит из нескольких компонентов, то ее общее давление определяется суммой парциальных давлений всех газов, входящих в смесь:
робщ. = р1 + р2 + р3 + …
Газы, вступающие во взаимодействие с растворителем (например, Nh4, SO2, HCl) при растворении в Н2О закону Генри и Дальтона не подчиняются. Их растворимость также увеличивается с повышением давления, но по более сложной зависимости.
Понижение давления газа над раствором ведет к уменьшению его растворимости и выделению из жидкости в виде пузырьков.
Изменением растворимости газа при резком снижении давления обусловлена так называемая кессонная болезнь, которой могут заболеть водолазы, работающие глубоко под водой. В этих условиях они дышат воздухом, находящимся под большим давлением. При этом растворимость газов в крови сильно увеличивается. Если после окончания работы подниматься на поверхность слишком быстро, то вследствие резкого уменьшения давления избыточные газы, растворенные в крови, начинают бурно выделяться. Образовавшиеся пузырьки закупоривают кровеносные сосуды, что приводит к нарушению кровообращения, многочисленным кровоизлияниям в различных тканях и органах из-за разрыва капилляров.
Поэтому подъем на поверхность с больших глубин должен быть достаточно долгим и медленным, чтобы лишний газ успевал удаляться из кровеносной системы через органы дыхания.
Аналогичная картина может возникнуть и при разгерметизации на большой высоте кабин и салонов самолетов, скафандров военных летчиков.
Влияние температуры на растворимость веществ
Растворимость большинства твердых и жидких веществ при повышении температуры в той или иной степени увеличивается. Для некоторых твердых веществ (особенно если при их растворении теплота выделяется) растворимость, наоборот, может понижаться с повышением температуры.
Зависимость растворимости веществ от температуры часто наглядно показывают при помощи графиков, которые называют кривыми растворимости (рис. 5). Растворимость газов уменьшается с повышением температуры. Длительным кипячением можно почти полностью удалить растворенные газы из жидкости. Насыщение же жидкости газом, наоборот, целесообразнее проводить при низких температурах.
Изменением растворимости с температурой часто пользуются для очистки веществ путем перекристаллизации. При остывании горячего насыщенного раствора какой-либо соли, загрязненной посторонними примесями, значительная ее часть (соли) выделится в виде осадка, а загрязняющие примеси останутся в растворе, так как последний даже на холоде по отношению к ним не будет насыщенным.
Рис. 5 — Кривые растворимости твердых веществ (1) и газов (2) в зависимости от температуры
Подобным образом можно очищать лишь те твердые вещества, растворимость которых сильно зависит от температуры.
Влияние электролитов на растворимость веществ
Если растворитель содержит примеси, то растворимость веществ в нем уменьшается. Особенно сильно это заметно, когда в роли такого постороннего соединения выступает электролит, а растворяемым веществом является газ. Например, в 1 см³ Н2О при 20оС растворяется около 3 см³ газообразного Cl2, а в 1 см³ насыщенного раствора NaCl растворяется всего 0,3 см³ хлора. Русский ученый — физиолог И. М. Сеченов установил количественную зависимость между растворимостью газа и концентрацией электролита в растворе (закон Сеченова):
S = S0e-kC
где S — растворимость газа в растворе электролита; S0 — растворимость газа в растворителе; С — молярная концентрация электролита в растворе; k — константа, зависящая от природы газа, электролита и температуры.
Закон Сеченова позволяет исследовать растворимость газов в крови, которая содержит в своем составе значительное число растворенных веществ, в том числе и электролитов.
Подобно газам при добавлении в раствор электролитов может понижаться растворимость и некоторых жидкостей, твердых веществ.
Это явление называют иначе высаливанием, т.к. в качестве электролита чаще всего используют соли.
Одной из причин уменьшения растворимости веществ в присутствии электролитов может быть образование прочных гидратных (сольватных) оболочек вокруг ионов, на которые распадаются электролиты. В результате этого количество свободных молекул жидкости, а значит и ее растворяющая способность, понижается.
Взаимная растворимость жидкостей
При смешивании жидкостей в зависимости от их природы, характера и силы взаимодействия между молекулами возможны 3 случая: 1) неограниченная растворимость; 2) ограниченная растворимость; 3) практическая нерастворимость.
В первом случае жидкости смешиваются друг с другом в любых соотношениях с образованием однородного раствора (вода и глицерин, вода и этиловый спирт, бензол и толуол).
При ограниченной растворимости обе жидкости растворяются друг в друге достаточно хорошо, но их взаимная растворимость не безгранична и достигает при данных условиях какого-то определенного предела. Примером таких систем являются вода и фенол, вода и анилин, диэтиловый эфир и вода.
При смешивании анилина с водой образуется 2 слоя. В верхнем слое содержится больше воды и меньше анилина, а в нижнем слое — наоборот. Таким образом, верхний слой можно рассматривать как насыщенный раствор анилина в Н2О, а нижний — воды в анилине. При постоянной температуре эти слои будут находиться в состоянии равновесия и концентрация растворенных веществ в них будет оставаться строго определенной. Добавление к этой смеси некоторого количества анилина или воды приведет только к увеличению объема нижнего или верхнего слоя, но концентрации растворенных веществ в них не изменяются.
Повышение температуры обычно вызывает увеличение взаимной растворимости жидкостей. В некоторых случаях это может привести к неограниченной растворимости, и жидкости будут смешиваться друг с другом при данных условиях в любых соотношениях.
Температура, выше которой оба компонента начинают неограниченно растворяться друг в друге, называется критической температурой растворения. Для смеси анилин — вода она равна 168оС, для смеси фенол — вода — 65,9оС.
Примером практически нерастворимых друг в друге жидкостей является вода и бензол, вода и ртуть. При смешивании эти системы разделяются на 2 слоя. Весьма вероятно, что в каждом слое в незначительном количестве будет присутствовать и другая жидкость (т.к. абсолютно нерастворимых веществ нет). Но ее концентрация будет настолько мала, что ею можно пренебречь.
Если в такую двухслойную систему, состоящую из двух практически не смешивающихся жидкостей, внести небольшое количество какого-нибудь третьего вещества, то через некоторое время оно распределится между двумя слоями.
Например, если в систему вода — сероуглерод (CS2) поместить навеску I2 и смесь тщательно перемешать, то йод можно будут обнаружить и в водном и в сероуглеродном слоях. Однако концентрация I2 в СS2 будет значительно выше чем в Н2О. При введении дополнительного количества I2 изменится концентрация его в каждом слое, но отношение концентраций при данной температуре сохраняется постоянным. Оно также не изменится если прибавить к полученной трехкомпонентной системе сероуглерод или воду.
Таким образом при постоянной температуре отношение равновесных концентраций растворенного вещества, распределившегося между двумя несмешивающимися жидкостями, является величиной постоянной, независящей от общего количества компонентов. Эта закономерность называется иначе законом распределения Нернста. Математически он записывается следующим образом:
где С1 и С2 — концентрации растворенного вещества в первом и втором растворителе соответственно; K — коэффициент распределения.
На различной растворимости одного и того же вещества в несмешивающихся жидкостях основан метод его извлечения из разбавленного раствора.
По этому методу к исходному разбавленному раствору добавляют другой растворитель, несмешивающийся с растворителем в первом растворе, но хорошо растворяющий извлекаемое вещество. При этом из первоначального разбавленного раствора растворенное вещество переходит в слой добавленного растворителя и концентрируется в нем. Этот процесс называется экстракцией.
Вальтер Фридрих Нернст
Вальтер Фридрих Нернст (1864−1941) — немецкий ученый. Известен своими работами в области физической химии растворов. В 1898 г. им разработана теория гальванического элемента. Наибольшую известность Нернсту принесли термодинамические исследования веществ при низких температурах, в результате которых было установлено, что при температуре абсолютного нуля энтропия однородного твердого тела стремится к нулю (тепловая теорема Нернста). В 1920 г. В. Нернст был удостоен Нобелевской премии.
Экстракцию из растворов применяют для разделения близкокипящих жидкостей, жидкостей с малой летучестью паров и высокой температурой кипения, веществ, разлагающихся при нагревании, т. е. в тех случаях, когда разделение перегонкой малоэффективно или вообще невозможно. Например, пенициллин и ряд других антибиотиков нельзя концентрировать выпариванием из разбавленных растворов, т.к. эти соединения при нагревании разрушаются. Для получения концентрированных растворов антибиотиков проводят их экстракцию бутил или этилацетатом.
Способы выражения состава растворов
Состав любого раствора может быть выражен как качественно, так и количественно. Обычно, при качественной оценке раствора применяют такие понятия как, насыщенный, ненасыщенный, пересыщенный (или перенасыщенный), концентрированный и разбавленный раствор.
Насыщенным называется раствор, в котором содержится максимально возможное при данных условиях (t, р) количество растворённого вещества. Насыщенный раствор часто находится в состоянии динамического равновесия с избытком растворённого вещества, при котором процесс растворения и процесс кристаллизации (выпадения вещества из раствора) протекают с одинаковой скоростью.
Для приготовления насыщенного раствора растворение вещества необходимо вести до образования осадка, не исчезающего при длительном хранении.
Ненасыщенным называется раствор, который содержит вещества меньше, чем его может раствориться при данных условиях.
Перенасыщенные растворы содержат в себе по массе больше растворённого вещества, чем его может раствориться в данных условиях. Образуются перенасыщенные растворы при быстром охлаждении насыщенных растворов. Они неустойчивы и могут существовать ограниченное время. Очень быстро лишнее растворённое вещество выпадает в осадок, а раствор превращается в насыщенный.
Следует отметить, что при изменении температуры насыщенный и ненасыщенный растворы могут легко обратимо превращаться друг в друга. Процесс выделения твёрдого вещества из насыщенного раствора при понижении температуры называется кристаллизацией. Кристаллизация и растворение играют огромную роль в природе: приводят к образованию минералов, имеют большое значение в атмосферных и почвенных явлениях. На основе кристаллизации в химии распространён метод очистки веществ, который называется перекристаллизацией.
Для приблизительного количественного выражения состава раствора используют понятия концентрированный и разбавленный растворы.
Концентрированным называется раствор, в котором масса растворённого вещества соизмерима с массой растворителя, т. е. не отличается от него более чем в 10 раз.
Если же масса растворённого вещества более чем в десять раз меньше массы растворителя, то такие растворы называются разбавленными.
Однако следует помнить, что деление растворов на концентрированные и разбавленные условно, и чёткой границы между ними нет.
Точный количественный состав растворов выражают при помощи массовой доли растворённого вещества, его молярной концентрации, а также некоторыми другими способами.
Массовая доля растворённого вещества (w) — это безразмерная физическая величина, равная отношению массы растворённого вещества к общей массе раствора, т. е.
Обычно выражается в долях единицы или в процентах. Массовая доля, выраженная в %, называется процентной концентрацией. Она показывает, какая масса вещества растворена в 100 г раствора.
Молярная концентрация © или молярность — это величина, равная отношению количества растворённого вещества к объему раствора (в литрах), т. е.
Молярность измеряется в моль/л и показывает сколько моль вещества растворено в одном литре раствора. Молярность обозначается обычно буквой М. Если в одном литре раствора содержится 1 моль вещества, то такой раствор называется одномолярным (1М), если 0,1 моль вещества — децимолярным (0,1М), если 0,01 моль вещества — сантимолярным (0,01М), если 0,001 моль вещества — миллимолярным (0,001М).
Титром (Т) называется отношение массы вещества в граммах к объёму раствора в мл, т. е.
Титр имеет размерность г/мл, он показывает, сколько грамм вещества растворено в 1 мл раствора.
Моляльная концентрация или моляльность (m) — это величина, равная отношению количества растворённого вещества к массе растворителя, выраженной в кг, т. е.
Моляльность имеет размерность моль/кг и показывает, какое количество вещества растворено в 1 кг растворителя.
Мольная доля (Х) — это величина, равная отношению количества растворённого вещества к общему количеству вещества в растворе:
вода молекула раствор нернст
Мольная доля — это безразмерная величина и измеряется в долях единицы или в %. Молярная концентрация химического эквивалента вещества © или нормальная концентрация — это величина, равная отношению количества химического эквивалента растворённого вещества к объему раствора (в литрах), т. е.
Молярная концентрация химического эквивалента вещества измеряется в моль/л и показывает сколько моль эквивалента вещества растворено в одном литре раствора. Она обозначается обычно буквой н. Если в одном литре раствора содержится 1 моль химического эквивалента вещества, то такой раствор называется однонормальным (1н), если 0,1 моль вещества — децинормальным (0,1н), если 0,01 моль вещества — сантинормальным (0,01н), если 0,001 моль вещества — миллинормальным (0,001н).
Термодинамические аспекты процесса растворения. Идеальные растворы
Согласно второму началу термодинамики в изобарно-изотерических условиях (р, Т = const) вещества могут самопроизвольно растворяться в каком-либо растворителе, если при совершении этого процесса энергия Гиббса системы уменьшается, т. е.
G < 0 или H — TS < 0
При растворении жидких и твердых веществ энтропия системы обычно возрастает (S > 0), т.к. растворяемые вещества из более упорядоченного состояния переходят в менее упорядоченное состояние. Особенно сильно это выражено при растворении твердых веществ. Вклад энтропийного фактора (ТS) при этом становится преобладающим по сравнению с энтальпийным (Н) и приводит к уменьшению энергии Гиббса даже если растворение вещества сопровождается поглощением энергии (Н > 0).
Роль энтропийного фактора еще больше усиливается при повышении температуры, потому что в этом случае множитель Т становится бульшим и произведение ТS существеннее увеличивается. Именно поэтому растворимость твердых и жидких веществ с повышением температуры, как правило, возрастает.
Если при растворении твердого либо жидкого вещества энергия выделяется (Н < 0), то оба фактора (и энтальпийный и энтропийный) действуют в одинаковом направлении и способствуют уменьшению энергии Гиббса.
При растворении газов энтропия системы, как правило, уменьшается (S < 0), т.к. вещество при этом из менее упорядоченного состояния переходит в более упорядоченное. Таким образом уменьшение энергии Гиббса в этом случае возможно только за счет большего вклада энтальпийного фактора. Причем изменение энтальпии должно быть меньше нуля (Н < 0). Именно это (т.е. выделение энергии) и наблюдается при растворении газов, но величина теплового эффекта данного явления обычно не превышает 15−20 кДж/моль, поэтому даже при небольшом увеличении температуры вклад энтропийного фактора начинает преобладать, а растворимость газов в жидкости уменьшается.
Растворы, в процессе образования которых тепловые и объемные эффекты отсутствуют, т. е. Н = 0 и V = 0 (изменение объема) называются идеальными.
Такие растворы получаются при смешивании компонентов, А и В, у которых силы взаимодействия между однородными (А и А, В и В) и разнородными (А и В) молекулами равны.
Образование растворов в данном случае сопровождается лишь хаотическим распределением частиц без изменения характера и величины сил взаимодействия между собой. Поэтому тепловые эффекты отсутствуют.
Свойства идеальных растворов подобно свойствам разреженных газовых смесей не зависят от природы растворенного вещества, а определяются лишь его концентрацией (т.е. количеством) в растворе. При этом единственной причиной образования таких растворов (как и газовых смесей) является увеличение энтропии (S > 0).
В идеальных растворах свойства отдельных компонентов не отличаются от их свойств в чистом индивидуальном виде.
Реальные растворы не обладают свойствами идеальных растворов, но могут в той или иной степени приближаться к ним. Особенно это характерно для разбавленных растворов, в которых можно пренебречь взаимодействием между частицами растворенного вещества, т.к. они в нем достаточно разобщены, т. е. находятся на большом расстоянии друг от друга.
Показать Свернутьreferat.bookap.info
Растворы и растворители. Участие растворителей в кислотно-основном взаимодействии. Протеолитическая теория кислот и оснований. Способы выражения концентрации растворов. Буферные растворы и вычисление их pH
Растворы и растворители
В качестве растворителя в количественном химическом анализе в основном используют воду как наиболее доступный и дешевый растворитель, не требующий специальных условий работы с ним (например, вытяжных шкафов, защитной одежды и т.п.), легко поддающийся очистке дистилляцией. В аналитической практике используют дистиллят или бидистиллят воды (т.е. один раз или дважды продистиллированную воду) в зависимости от требуемой по методике анализа чистоты растворителя.
Анализ нерастворимых в воде веществ (например, органических) проводят в неводных средах с использованием неводных растворов кислот, оснований и т.п.
При классификации растворителей прежде всего выделяют характер их участия в процессе кислотно-основного взаимодействия. По этому признаку выделяют апротонные и протолитические растворители.
Молекулы апротонных растворителей не ионизированы, поэтому в кислотно-основных взаимодействиях они ведут себя как химически инертные вещества, не отдавая и не принимая протон, как безпротонные, что отражено в их названии. К апротонным растворителям относят углеводороды, например гексан, бензол и их галогенопроизводные (хлороформ, тетрахлорид углерода и др.)
К протолитическим относят растворители способные к ионизации и отдаче или присоединению протона. Кислотно-основное равновесие в этих растворителях осуществляется с их участием.
Это участие является основой идеей протолитической (протонной) теории кислот и оснований Бренстеда и Лоури (1927г.). В отличие от теории электролитической диссоциации Аррениуса - Оствальда (1887 г.), в которой растворитель считался инертной средой, с точки зрения протонной теории кислота не выделяет протон самопроизвольно, а участвует в его переносе совместно с основанием, в качестве которого могут быть молекулы растворителя. Согласно протонной теории процесс передачи протона от кислоты к основанию называется протолизом, причем кислотой считают любое вещество, способное отдавать протон, а основанием - его принимать. Ионно-молекулярное равновесие, устанавливающееся после передачи протона, называют протолитическим или кислотно-основным.
Кислотно-основное взаимодействие по этой теории состоит в обратимом переносе протона от кислоты к основанию. В результате такого процесса образуется пара новых частиц, одна из которых опять способна отдавать протон, а другая - его присоединять. Таким образом, кислота оказывается в равновесии с сопряженным основанием, а основание - с сопряженной кислотой:
НА + В НВ+ +А-
Кислотаоснование сопряженная сопряженное
кислота основание
Например, НСN + NaOHh3O + NaCN
или в ионном виде НСN + OH- h3O + CN-
Кислоты и основания, теряющие и приобретающие протоны, называют протолитами. Протолитические растворители, ведущие себя в процессе растворения вещества как кислота, отдавая протон, называют протогенными (от лат. «протонорождающие»). К ним относят жидкие галогеноводороды (HCl, HBr), серную, безводную муравьиную и уксусную кислоты и др. Они увеличивают основные свойства растворенных в них веществ и уменьшают кислотные. Например, слабое основание анилин в среде безводной уксусной кислоты является сильным.
Протофильные (от лат. «протонолюбящие») растворители способны принимать протоны в процессе растворения. Это, например, жидкий аммиак, пиридин, гидразин и др. Они увеличивают кислотность растворенных веществ.
Амфипротонные растворители способны как отдавать, так и принимать протоны (вода, спирты, кетоны, нитрилы и др.). Вещества с такими свойствами называют амфолитами или амфипротонными. С учетом амфипротонных свойств воды кислотно-основное взаимодействие является суммарным результатом следующих процессов передачи протона:
НА + h3O h4O+ + А-
В + h3O НВ+ +OH-
НА+ В НВ+ + А-
Например, взаимодействие циановодородной кислоты со щелочью можно изобразить так:
НСN + h3O h4O+ + CN-
OH-+ h3O h3O + OH-
НСN + OH- h3O + CN-
Для простоты промежуточные уравнения реакции, показывающие участие воды в установлении кислотно-основного равновесия, опускают, изображая кислотно-основную реакцию результирующим уравнением.
Амфипротонные свойства воды позволили объяснить щелочную среду водных растворов солей, образованных сильным основанием и слабой кислотой (Na2CO3, KCN, Na2HPO4 и др.) и кислую среду растворов солей слабых оснований (Nh5Cl) и многоосновных слабых кислот (Nah3PO4, KHSO4 и др.). Их химическое взаимодействие с водой приводит к накоплению в растворе ионов H+ или OH-, определяющих кислотность их среды.
Например КСN + h3O КОH + НCN
или в ионном виде CN- + h3O OH-+ НCN,
откуда видно, что гидролиз этой соли приводит к щелочной среде раствора КСN. Таким образом, реакция гидролиза - частный случай протолиза.
Обладая амфипротонными свойствами молекулы воды могут вступать во взаимодействие друг с другом, как кислота со щелочью, образуя ион гидроксония h4O+ и гидроксид - ион OH-:
h3O + h3O h4O+ + OH-
Этот процесс называется автопротолизом, он свойственен и другим амфипротонным растворителям.
Для простоты автопротолиз h3O записывают в виде диссоциации воды:
h3O Н+ + OH-
По закону действующих масс константа равновесия процесса диссоциации воды равна

Измерениями доказано, что для чистой воды [h3O] =55,85моль/л и [Н+]= [OH-]=10-7 моль/л, следовательно,
КДИС(h3O) [h3O] =[Н+] [OH-] = const .
Произведение равновесных концентраций ионов воды при данной температуре есть величина постоянная, называемое ионное произведение воды КW:
КW = [Н+][OH-] = 10-14 моль/л .
Понятие о рН и рОН среды раствора
Концентрация ионов водорода в водных растворах изменяется приблизительно от 1 моль/л в 1М растворе сильной кислоты (например, HCl) до 10-14 моль/л в 1М растворе сильной щелочи (например, NaOH).
Этот интервал 10-14 < [Н+] < 1 очень широк и неудобен для характеристики кислотности среды, поэтому шведский ученый Сорренсон в 1909 г ввел шкалу кислотности, основанную на отрицательном десятичном логарифме от граничных значений этого интервала:
0 < - ℓg[Н+] <14 .
Обозначив «-ℓg» через «р», а [Н+] через «Н» он получил водородный показатель среды раствора рН. По аналогии рОН = -ℓg[ОН-] - гидроксильный показатель. Таким образом, 0 < рН < 14. Раствор с рН = 0…7 имеет кислую среду, при рН = 7 среда раствора нейтральная, при рН = 7…14 - щелочная.
Возьмем отрицательный десятичный логарифм от КW:
-ℓg КW = -ℓg[Н+] - ℓg[ОН-],
следовательно, 14 = рН + рОН, а рН = 14 - рОН.
Буферные растворы
Большинство аналитических реакций в водных растворах проводят при определенных значениях рН. Для поддержания заданного значения рН используют специальные буферные растворы (БР). БР содержат двойные смеси сопряженных кислот и оснований. Приготовленные БР специально вводят в реакционную систему, но БР могут и сами образовываться в ней за счет химических реакций слабых кислот (слабых оснований) или гидролизующихся солей с сильными основаниями (сильными кислотами). БР обладают способностью не изменять заметно рН при их разбавлении, а также препятствовать изменению рН реакционной системы, в которую введен (или образовался) БР, при добавлении к ней небольших количеств сильной кислоты или оснований. Сущность буферного действия БР заключается в том, что его сопряженная кислота может связывать ОН-- ионы, а сопряженное основаниеН+ - ионы в молекулы слабого электролита (воду, слабую кислоту или слабое основание). рН системы при этом меняется незначительно. Во всех реакциях один компонент БР вступает во взаимодействие, а другой является ее продуктом (табл. 1.4.2).
Таблица 1.4.2
| Буферный раствор и его рН | Химическая реакция | |
| при добавлении кислоты | при добавлении основания | |
|
Ацетатный БР (СН3СООН + СН3СООNa) pH = 4,7 |
СН3СООNa + HCl = СН3СООН + NaCl |
СН3СООН + NaОН = СН3СООNa + h3О |
|
Аммиачный БР (Nh5OH + Nh5Cl) рН = 9,3 |
Nh5OH + HCl = Nh5Cl + h3О |
Nh5Cl + NaОН = Nh5OH + NaCl |
|
Карбонатный БР (Na2CO3 + NaHCO3) рН = 10,3 |
Na2CO3 + HCl = NaHCO3 + NaCl |
NaHCO3 + NaОН = Na2CO3 + h3О |
|
Фосфатный БР (Na2HPO4 + Nah3PO4) рН = 8 |
Na2HPO4 + HCl = Nah3PO4 + NaCl |
Nah3PO4 + NaОН = Na2HPO4 + h3О |
Уравнение для вычисления рН БР, состоящих из слабой кислоты НАn и ее соли МАn, можно вывести следующим образом.
Слабая кислота НАn диссоциирует с образованием сопряженного основания Аn- : НАn Н+ + Аn-
по ЗДМ:
Для слабой кислоты концентрацию недиссоциированных молекул можно принять равной концентрации кислоты, т.е. [НАn] = c (НАn). Содержащаяся в БР соль МАn диссоциирует нацело (полностью), поэтому концентрация сопряженного основания Аn-, образовавшегосявследствие диссоциации соли МА, значительно больше, чем вследствие диссоциации слабой кислоты НАn, поэтому можно считать, что[Аn-] = c (МАn). Подставим полученное в уравнение для К(НАn)

Отсюда ,

следовательно, .
Последняя формула доказывает, что при разбавлении БР его рН не изменяется, так как при этом меняются только значения с(НАn) и с (МАn), а их соотношение сохраняется.
Аналогично для БР, состоящего из слабого основания ВОН и его соли ВА, можно получить

так как то
отсюда
Буферирующая способность БР количественно определяется буферной емкостью.
= с / рН.
Она соответствует количеству эквивалентов сильной кислоты или сильного основания, которое вызывает изменение на единицу рН БР. Максимальную буферную емкость имеют БР с соотношением компонентов 1:1.
В большинстве случаев рассчитывается по упрощенной формуле

где с(БР) - общая концентрация компонентов БР при их соотношении 1:1.
Пример. Рассчитайте, как изменится рН 1 л БР, состоящего из 0,1 н. СН3СООН и 0,1 н. СН3СООNa при добавлении 0,01 моль HCl.
Решение. Общая концентрация БР равна с(БР) = [СН3СООН] + [СН3СООNa] = 0,1 + 0,1 =0,2 моль/л. По справочнику рК(СН3СООН) = 1,75·10-5.
Найдем [H+], pH и исходного БР до добавления кислоты: [H+] = 1,75 · 10-5 · (0,1/0,1) = 1,75 · 10-5 моль/л. рН = -ℓg1,75 · 10-5= = 4,75.

Найдем изменения рН БР после добавления кислоты:
рН = -с/ = - 0,01/0,1151 = - 0,09.
знак «-» взят в формуле, так как при добавлении сильной кислоты рН уменьшается. Таким образом, при добавлении кислоты рН уменьшится и станет равным 4,75 - 0,09 = 4,66.
Реакции, позволяющие получить внешний эффект с определяемым веществом, называют аналитическими, а добавляемое для этого вещество - реагентом. Аналитические реакции, проводимые между твердыми веществами, относят к реакциям «сухим путем», а в растворах - «мокрым путем».
К реакциям «сухим путем» относятся реакции, выполняемые путем растирания твердого исследуемого вещества с твердым реагентом, а также путем получения окрашенных стекол (перлов) при сплавлении некоторых элементов с бурой.
Значительно чаще анализ проводят «мокрым путем», для чего анализируемое вещество переводят в раствор. Реакции с растворами могут выполняться пробирочным, капельным и микрокристалли-ческим методами. При пробирочном полумикроанализе его выполняют в пробирках вместимостью 2-5см3. Для отделения осадков используют центрифугирование, а выпаривание ведут в фарфоровых чашечках или тиглях. Капельный анализ (Н.А. Тананаев, 1920 г.) осуществляют на фарфоровых пластинках или полосках фильтрованной бумаги, получая цветные реакции при добавлении к одной капле раствора вещества одной капли раствора реактива. Микрокристаллический анализ основан на обнаружении компонентов с помощью реакций, в результате которых образуются соединения с характерным цветом и формой кристаллов, наблюдаемых в микроскоп.
Для качественного химического анализа используют все известные типы реакций: кислотно-основные, окислительно-восстановительные, осаждения, комплексообразования и другие.
Качественный анализ растворов неорганических веществ сводится к обнаружению катионов и анионов. Для этого используют общие и частные реакции. Общие реакции дают сходный внешний эффект (АС) со многими ионами (например, образование катионами осадков сульфатов, карбонатов, фосфатов и т.д.), а частные - с 2-5 ионами. Чем меньше число ионов дают сходный АС, тем селективнее (избирательнее) считается реакция. Реакция называется специфической, когда позволяет обнаружить один ион в присутствии всех остальных. Специфической, например, на ион аммония является реакция:
Nh5Cl + KOH Nh4 + KCl + h3O
Аммиак обнаруживают по запаху или по посинению красной лакмусовой бумажки, смоченной в воде и помещенной над пробиркой.
Селективность реакций можно повысить, изменяя их условия (рН) или применяямаскирование. Маскирование заключается в уменьшении концентрации мешающих ионов в растворе меньше предела их обнаружения, например путем их связывания в бесцветные комплексы.
Если состав анализируемого раствора несложен, то его после маскировки анализируют дробным способом. Он заключается в обнаружении в любой последовательности одного иона в присутствии всех остальных с помощью специфических реакций, которые проводят в отдельных порциях анализируемого раствора. Поскольку специфических реакций немного, то при анализе сложной ионной смеси используют систематический способ. Этот способ основан на разделении смеси на группы ионов со сходными химическими свойствами путем перевода их в осадки с помощью групповых реактивов, причем групповыми реактивами воздействуют на одну и ту же порцию анализируемого раствора по определенной системе, в строго определенной последовательности. Осадки отделяют друг от друга (например, центрифугированием), затем растворяют определенным образом и получают серию растворов, позволяющих в каждом обнаружить отдельный ион специфической реакцией на него.
Существует несколько систематических способов анализа, называемых по применяемым групповым реактивам: сероводородный, кислотно-основный, аммиачно-фосфатный и другие. Классический сероводородный способ основан на разделении катионов на 5 групп путем получения их сульфидов или сернистых соединений при воздействии h3S, (Nh5)2S, NaS в различных условиях.
Более широко применяемым, доступным и безопасным является кислотно-основный метод, при котором катионы разделяют на 6 групп (табл. 1.3.1.). Номер группы указывает на последовательность воздействия реактивом.
www.neuch.ru