|
|
|
|
 Far Far |
 WinNavigator WinNavigator |
 Frigate Frigate |
 Norton
Commander Norton
Commander |
 WinNC WinNC |
 Dos
Navigator Dos
Navigator |
 Servant
Salamander Servant
Salamander |
 Turbo
Browser Turbo
Browser |
|
|
 Winamp,
Skins, Plugins Winamp,
Skins, Plugins |
 Необходимые
Утилиты Необходимые
Утилиты |
 Текстовые
редакторы Текстовые
редакторы |
 Юмор Юмор |
|
|
|
File managers and best utilites |
Реферат: Применение радиоактивных изотопов в технике. Реферат изотопы
Реферат Изотопы
скачатьРеферат на тему:
План:
- Введение
- 1 Терминология
- 2 История открытия изотопов
- 3 Изотопы в природе
- 4 Применение изотопов человеком
Введение
Изото́пы (от греч. ισος — «равный», «одинаковый», и τόπος — «место») — разновидности атомов (и ядер) одного химического элемента с разным количеством нейтронов в ядре. Название связано с тем, что изотопы находятся в одном и том же месте (в одной клетке) таблицы Менделеева. Химические свойства атома зависят практически только от строения электронной оболочки, которая, в свою очередь, определяется в основном зарядом ядра Z (то есть количеством протонов в нём) и почти не зависит от его массового числа A (то есть суммарного числа протонов Z и нейтронов N). Все изотопы одного элемента имеют одинаковый заряд ядра, отличаясь лишь числом нейтронов. Обычно изотоп обозначается символом химического элемента, к которому он относится, с добавлением верхнего левого индекса, означающего массовое число (например, 12C, 222Rn). Можно также написать название элемента с добавлением через дефис массового числа (например, углерод-12, радон-222). Некоторые изотопы имеют традиционные собственные названия (например, дейтерий, актинон).
Пример изотопов:
1. Терминология
Основная позиция ИЮПАК состоит в том, что правильным термином в единственном числе для обозначения атомов (или ядер) одного химического элемента с одинаковой атомной массой является нуклид, а термин изотопы допускается применять для обозначения совокупности нуклидов одного элемента. Термин изотопы был предложен и применялся изначально во множественном числе, поскольку для сравнения необходимо минимум две разновидности атомов. В дальнейшем в практику широко вошло также употребление термина в единственном числе — изотоп. Кроме того, термин во множественном числе часто применяется для обозначения любой совокупности нуклидов, а не только одного элемента, что также некорректно. В настоящее время позиции международных научных организаций не приведены к единообразию и термин изотоп продолжает широко применяться, в том числе и в официальных материалах различных подразделений ИЮПАК и ИЮПАП. Это один из примеров того, как смысл термина, изначально в него заложенный, перестаёт соответствовать понятию, для обозначения которого этот термин используется (другой хрестоматийный пример — атом, который, в противоречии с названием, не является неделимым).
2. История открытия изотопов
Первое доказательство того, что вещества, имеющие одинаковое химическое поведение, могут иметь различные физические свойства, было получено при исследовании радиоактивных превращений атомов тяжёлых элементов. В 1906—07 выяснилось, что продукт радиоактивного распада урана — ионий и продукт радиоактивного распада тория — радиоторий, имеют те же химические свойства, что и торий, но отличаются от него атомной массой и характеристиками радиоактивного распада. Было обнаружено позднее, что у всех трёх продуктов одинаковы оптические и рентгеновские спектры. Такие вещества, идентичные по химическим свойствам, но различные по массе атомов и некоторым физическим свойствам, по предложению английского учёного Ф. Содди, стали называть изотопами.
3. Изотопы в природе
Считается, что изотопный состав элементов на Земле одинаков во всех материалах. Некоторые физические процессы в природе приводят к нарушению изотопного состава элементов (природное фракционирование изотопов, характерное для лёгких элементов, а также изотопные сдвиги при распаде природных долгоживущих изотопов). Постепенное накопление в минералах ядер — продуктов распада некоторых долгоживущих нуклидов используется в ядерной геохронологии.
4. Применение изотопов человеком
В технологической деятельности люди научились изменять изотопный состав элементов для получения каких-либо специфических свойств материалов. Например, 235U способен к цепной реакции деления тепловыми нейтронами и может использоваться в качестве топлива для ядерных реакторов или ядерного оружия. Однако в природном уране лишь 0,72 % этого нуклида, тогда как цепная реакция практически осуществима лишь при содержании 235U не менее 3 %. В связи с близостью физико-химических свойств изотопов тяжёлых элементов, процедура изотопного обогащения урана является крайне сложной технологической задачей, которая доступна лишь десятку государств в мире. Во многих отраслях науки и техники (например, в радиоиммунном анализе) используются изотопные метки.
wreferat.baza-referat.ru
Реферат - Применение радиоактивных изотопов в технике
Курсовая работа
На тему: «Радиоактивность.
Применение радиоактивных изотопов в технике»
Содержание
Введение
1.Виды радиоактивных излучений
2.Другие виды радиоактивности
3.Альфа-распад
4.Бета-распад
5.Гамма-распад
6.Закон радиоактивного распада
7.Радиоактивные ряды
8.Действие радиоактивного излучения на человека
9.Применение радиоактивных изотопов
Список использованной литературы
Введение
Радиоактивность – превращение атомных ядер в другие ядра, сопровождающееся испусканием различных частиц и электромагнитного излучения. Отсюда и название явления: на латыни radio – излучаю, activus – действенный. Это слово ввела Мария Кюри. При распаде нестабильного ядра – радионуклида из него вылетают с большой скоростью одна или несколько частиц высокой энергии. Поток этих частиц называют радиоактивным излучением или попросту радиацией.
Лучи Рентгена. Открытие радиоактивности было непосредственно связано с открытием Рентгена. Более того, некоторое время думали, что это один и тот же вид излучения. Конец 19 в. вообще был богат на открытие различного рода не известных до того «излучений». В 1880-е английский физик Джозеф Джон Томсон приступил к изучению элементарных носителей отрицательного заряда, в 1891 ирландский физик Джордж Джонстон Стони (1826–1911) назвал эти частицы электронами. Наконец, в декабре Вильгельм Конрад Рентген сообщил об открытии нового вида лучей, которые он назвал Х-лучами. До сих пор в большинстве стран они так и называются, но в Германии и России принято предложение немецкого биолога Рудольфа Альберта фон Кёлликера (1817–1905) называть лучи рентгеновскими. Эти лучи возникают, когда быстро летящие в вакууме электроны (катодные лучи) сталкиваются с препятствием. Было известно, что при попадании катодных лучей на стекло, оно испускает видимый свет – зеленую люминесценцию. Рентген обнаружил, что одновременно от зеленого пятна на стекле исходят какие-то другие невидимые лучи. Это произошло случайно: то в темной комнате светился находящийся неподалеку экран, покрытый тетрацианоплатинатом бария Ba[Pt(CN)4] (раньше его называли платиносинеродистым барием). Это вещество дает яркую желто-зеленую люминесценцию под действием ультрафиолетовых, а также катодных лучей. Но катодные лучи на экран не попадали, и более того, когда прибор был закрыт черной бумагой, экран продолжал светиться. Вскоре Рентген обнаружил, что излучение проходит через многие непрозрачные вещества, вызывает почернение фотопластинки, завернутой в черную бумагу или даже помещенной в металлический футляр. Лучи проходили через очень толстую книгу, через еловую доску толщиной 3 см, через алюминиевую пластину толщиной 1,5 см… Рентген понял возможности своего открытия: «Если держать руку между разрядной трубкой и экраном, – писал он, – то видны темные тени костей на фоне более светлых очертаний руки». Это было первое в истории рентгеноскопическое исследование.
Открытие Рентгена мгновенно облетело весь мир и поразило не только специалистов. В канун 1896 в книжном магазине одного немецкого города была выставлена фотография кисти руки. На ней были видны кости живого человека, а на одном из пальцев – обручальное кольцо. Это была снятая в рентгеновских лучах фотография кисти жены Рентгена. Первое сообщение Рентгена “О новом роде лучей” было опубликовано в «Отчетах Вюрцбургского физико-медицинского общества» 28 декабря оно было немедленно переведено и опубликовано в разных странах, выходящий в Лондоне самый известный научный журнал «Nature» («Природа») опубликовал статью Рентгена 23 января 1896.
Новые лучи стали исследовать во всем мире, только за один год на эту тему было опубликовано свыше тысячи работ. Несложные по конструкции рентгеновские аппараты появились и в госпиталях: медицинское применение новых лучей было очевидным.
Сейчас рентгеновские лучи широко используются (и не только в медицинских целях) во всем мире.
Лучи Беккереля. Открытие Рентгена вскоре привело к не менее выдающемуся открытию. Его сделал в 1896 французский физик Антуан Анри Беккерель. Он был 20 января 1896 на заседании Академии, на котором физик и философ Анри Пуанкаре рассказал об открытии Рентгена и продемонстрировал сделанные уже во Франции рентгеновские снимки руки человека. Пуанкаре не ограничился рассказом о новых лучах. Он высказал предположение, что эти лучи связаны с люминесценцией и, возможно, всегда возникают одновременно с этим видом свечения, так что, вероятно, можно обойтись и без катодных лучей. Свечение веществ под действием ультрафиолета – флуоресценция или фосфоресценция (в 19 в. не было строгого разграничения этих понятий) было знакомо Беккерелю: ею занимались и его отец Александр Эдмонд Беккерель (1820–1891), и дед Антуан Сезар Беккерель (1788–1878) – оба физики; физиком стал и сын Антуана Анри Беккереля – Жак, который «по наследству» принял кафедру физики при парижском Музее естественной истории, эту кафедру Беккерели возглавляли 110 лет, с 1838 по 1948.
Беккерель решил проверить, связаны ли лучи Рентгена с флуоресценцией. Яркой желто-зеленой флуоресценцией обладают некоторые соли урана, например, уранилнитрат UO2(NO3)2. Такие вещества были в лаборатории Беккереля, где работал. С препаратами урана работал еще его отец, который показал, что после прекращения действия солнечного света их свечение исчезает очень быстро – менее чем за сотую долю секунды. Однако никто не проверял, сопровождается ли это свечение испусканием каких-то других лучей, способных проходить сквозь непрозрачные материалы, как это было у Рентгена. Именно это после доклада Пуанкаре решил проверить Беккерель. 24 февраля 1896 на еженедельном заседании Академии он рассказал, что беря фотопластинку, завернутую в два слоя плотной черной бумаги, кладя на нее кристаллы двойного сульфата калия-уранила K2UO2(SO4)2·2h3O и выставляя все это на несколько часов на солнечный свет, то после проявления фотопластинки на ней можно видеть несколько размытый контур кристаллов. Если между пластинкой и кристаллами поместить монету или вырезанную из жести фигуру, то после проявления на пластинке появляется четкое изображение этих предметов.
Все это могло свидетельствовать о связи флуоресценции и рентгеновского излучения. Недавно открытые Х-лучи можно получать намного проще – без катодных лучей и необходимых для этого вакуумной трубки и высокого напряжения, но надо было проверить, не оказывается ли, что урановая соль, нагреваясь на солнце, выделяет какой-то газ, который проникает под черную бумагу и действует на фотоэмульсию Чтобы исключить эту возможность, Беккерель проложил между урановой солью и фотопластинкой лист стекла – она все равно засветилась. «Отсюда, – заключил свое краткое сообщение Беккерель, – можно сделать вывод о том, что светящаяся соль испускает лучи, которые проникают через не прозрачную для света черную бумагу и восстанавливают серебряные соли в фотопластинке». Как будто Пуанкаре оказался прав и Х-лучи Рентгена можно получить совсем другим способом.
Беккерель начал ставить множество опытов, чтобы лучше понять условия, при которых появляются лучи, засвечивающие фотопластинку, и исследовать свойства этих лучей. Он помещал между кристаллами и фотопластинкой разные вещества – бумагу, стекло, пластинки алюминия, меди, свинца разной толщины. Результаты получались те же, что и у Рентгена, что также могло служить доводом в пользу сходства обоих излучений. Помимо прямого солнечного света Беккерель освещал соль урана светом, отраженным зеркалом или преломленным призмой. Он получил, что результаты всех прежних опытов никак не были связаны с солнцем; имело значение лишь то, как долго урановая соль находилась вблизи фотопластинки. На следующий день Беккерель доложил об этом на заседании Академии, но вывод он, как потом выяснилось, сделал неверный: он решил, что соль урана, хотя бы раз «заряженная» на свету, способна потом сама длительное время испускать невидимые проникающие лучи.
Беккерель до конца года он опубликовал на эту тему девять статей, в одной из них он писал: «Разные соли урана были помещены в толстостенный свинцовый ящик… Защищенные от действия любых известных излучений, эти вещества продолжали испускать лучи, проходящие через стекло и черную бумагу..., через восемь месяцев».
Эти лучи исходили от любых соединений урана, даже от тех, которые не светятся на солнце. Еще более сильным (примерно в 3,5 раза) оказалось излучение металлического урана. Стало очевидным, что излучение хотя и похоже по некоторым проявлениям на рентгеновское, но обладает большей проникающей способностью и как-то связано с ураном, так что Беккерель стал называть его «урановыми лучами».
Беккерель обнаружил также, что «урановые лучи» ионизируют воздух, делая его проводником электричества. Практически одновременно, в ноябре 1896, английские физики Дж. Дж.Томсон и Эрнест Резерфорд(обнаружили ионизацию воздуха и под действием рентгеновских лучей. Для измерения интенсивности излучения Беккерель использовал электроскоп, в котором легчайшие золотые листочки, подвешенные за концы и заряженные электростатически, отталкиваются и их свободные концы расходятся. Если воздух проводит ток, заряд с листочков стекает и они опадают – тем быстрее, чем выше электропроводность воздуха и, следовательно, больше интенсивность излучения.
Оставался вопрос, каким образом вещество испускает непрерывное и не ослабевающее в течение многих месяцев излучение без подвода энергии от внешнего источника Сам Беккерель писал, что не в состоянии понять, откуда уран получает энергию, которую он непрерывно излучает. По этому поводу выдвигались самые разные гипотезы, иногда довольно фантастические. Например, английский химик и физик Уильям Рамзайписал: «… физики недоумевали, откуда мог бы взяться неисчерпаемый запас энергии в солях урана. Лорд Кельвин склонялся к предположению, что уран служит своего рода западней, которая улавливает ничем другим не обнаруживаемую лучистую энергию, доходящую до нас через пространство, и превращает ее в такую форму, в виде которой она делается способной производить химические действия».
Беккерель не мог ни принять эту гипотезу, ни придумать что-то более правдоподобное, ни отказаться от принципа сохранения энергии. Кончилось тем, что он вообще на некоторое время бросил работу с ураном и занялся расщеплением спектральных линий в магнитном поле. Этот эффект был обнаружен почти одновременно с открытием Беккереля молодым голландским физиком Питером Зееманоми объяснен другим голландцем – Хендриком Антоном Лоренцем.
На этом закончился первый этап исследования радиоактивности. Альберт Эйнштейн сравнил открытие радиоактивности с открытием огня, так как считал, что и огонь и радиоактивность – одинаково крупные вехи в истории цивилизации.
1. Виды радиоактивных излучений
--PAGE_BREAK--Когда в руках исследователей появились мощные источники радиации, в миллионы раз более сильные, чем уран (это были препараты радия, полония, актиния), можно было более подробно ознакомиться со свойствами радиоактивного излучения. В первых исследованиях на эту тему самое активное участие приняли Эрнест Резерфорд супруги Мария и Пьер Кюри, А.Беккерель, многие другие. Прежде всего, была изучена проникающая способность лучей, а также действие на излучение магнитного поля. Оказалось, что излучение неоднородно, а представляет собой смесь «лучей». Пьер Кюри обнаружил, что при действии магнитного поля на излучение радия одни лучи отклоняются, а другие нет. Было известно, что магнитное поле отклоняет только заряженные летящие частицы, причем положительные и отрицательные в разные стороны. По направлению отклонения убедились в том, что отклоняемые β-лучи заряжены отрицательно. Дальнейшие опыты показали, что между катодными и β-лучами нет принципиальной разницы, откуда следовало, что они представляют собой поток электронов.
Отклоняющиеся лучи обладали более сильной способностью проникать через различные материалы, тогда как неотклоняющиеся легко поглощались даже тонкой алюминиевой фольгой – так вело себя, например, излучение нового элемента полония – его излучение не проникало даже сквозь картонные стенки коробки, в которой хранился препарат.
При использовании более сильных магнитов оказалось, что α-лучи тоже отклоняются, только значительно слабее, чем β-лучи, причем в другую сторону. Отсюда следовало, что они заряжены положительно и имеют значительно бóльшую массу (как потом выяснили, масса α-частиц в 7740 раз больше массы электрона). Впервые это явление обнаружили в 1899 А.Беккерель и Ф.Гизель. В дальнейшем выяснилось, что α-частицы представляют собой ядра атомов гелия (нуклид 4Не) с зарядом +2 и массой 4 у.е… Когда же в 1900 французский физик Поль Вийар (1860–1934) исследовал более подробно отклонение α- и β-лучей, он обнаружил в излучении радия и третий вид лучей, не отклоняющихся в самых сильных магнитных полях, это открытие вскоре подтвердил и Беккерель. Этот вид излучения, по аналогии с альфа- и бета-лучами, был назван гамма-лучами, обозначение разных излучений первыми буквами греческого алфавита предложил Резерфорд. Гамма-лучи оказались сходными с лучами Рентгена, т.е. они представляют собой электромагнитное излучение, но с более короткими длинами волн и соответственно с большей энергией. Все эти виды радиации описала М.Кюри в своей монографии «Радий и радиоактивность». Вместо магнитного поля для «расщепления» радиации можно использовать электрическое поле, только заряженные частицы в нем будут отклоняться не перпендикулярно силовым линиям, а вдоль них – по направлению к отклоняющим пластинам.
Долгое время было неясно, откуда берутся все эти лучи. В течение нескольких десятилетий трудами многих физиков была выяснена природа радиоактивного излучения и его свойства, были открыты новые типы радиоактивности.γ
Альфа-лучи испускают, главным образом, ядра самых тяжелых и потому менее стабильных атомов (в периодической таблице они расположены после свинца). Эти высокоэнергетичные частицы. Обычно наблюдается несколько групп α -частиц, каждая из которых имеет строго определенную энергию. Так, почти все α -частицы, вылетающие из ядер 226Ra, обладают энергией в 4,78 МэВ (мегаэлектрон-вольт) и небольшая доля α -частиц энергией в 4,60 МэВ. Другой изотоп радия – 221Ra испускает четыре группы α -частиц с энергиями 6,76, 6,67, 6,61 и 6,59 МэВ. Это свидетельствует о наличии в ядрах нескольких энергетических уровней, их разность соответствует энергии излучаемых ядром α -квантов. Известны и «чистые» альфа-излучатели (например, 222Rn).
По формуле E = mu2/2 можно подсчитать скорость α-частиц с определенной энергией. Например, 1 моль α -частиц с Е = 4,78 МэВ имеет энергию (в единицах СИ) Е = 4,78·106 эВ 96500 Дж/(эВ·моль) = 4,61·1011 Дж/моль и массу m = 0,004 кг/моль, откуда uα 15200 км/с, что в десятки тысяч раз больше скорости пистолетной пули. Альфа-частицы обладают самым сильным ионизирующим действием: сталкиваясь с любыми другими атомами в газе, жидкости или твердом теле, они «обдирают» с них электроны, создавая заряженные частицы. При этом α-частицы очень быстро теряют энергию: они задерживаются даже листом бумаги. В воздухе α-излучение радия проходит всего 3,3 см, α -излучение тория – 2,6 см и т.д. В конечном счете потерявшая кинетическую энергию α-частица захватывает два электрона и превращается в атом гелия. Первый потенциал ионизации атома гелия (He – e → He+) составляет 24,6 эВ, второй (He+ – e → He+2) – 54,4 эВ, это намного больше, чем у любых других атомов. При захвате электронов α-частицами выделяется огромная энергия (более 7600 кДж/моль), поэтому ни один атом, кроме атомов самого гелия, не в состоянии удержать свои электроны, если по соседству окажется α -частица.
Очень большая кинетическая энергия α -частиц позволяет «увидеть» их невооруженным глазом (или с помощью обычной лупы), впервые это продемонстрировал в 1903 английский физик и химик Уильям Крукс (1832 – 1919. Он приклеил на кончик иглы еле видимую глазом крупинку радиевой соли и укрепил иглу в широкой стеклянной трубке. На одном конце этой трубки, недалеко от кончика иглы, помещалась пластинка, покрытая слоем люминофора (им служил сульфид цинка), а на другом конце было увеличительное стекло. Если в темноте рассматривать люминофор, то видно: все поле зрения усеяно вспыхивающими и сейчас же гаснущими искрами. Каждая искра – это результат удара одной α -частицы. Крукс назвал этот прибор спинтарископом (от греч. spintharis – искра и skopeo – смотрю, наблюдаю). С помощью этого простого метода подсчета α -частиц был выполнен ряд исследований, например, этим способом можно было довольно точно определить постоянную Авогадро.
В ядре протоны и нейтроны удерживаются вместе ядерными силами, Поэтому было непонятно, каким образом альфа-частица, состоящая из двух протонов и двух нейтронов, может покинуть ядро. Ответ дал в 1928 американский физик (эмигрировавший в 1933 из СССР)Джордж (Георгий Антонович) Гамов). По законам квантовой механики α-частицы, как и любые частицы малой массы, обладают волновой природой и потому у них есть некоторая небольшая вероятность оказаться вне ядра, на небольшом (примерно 6·10–12см) расстоянии от него. Как только это происходит, на частицу начинает действовать с кулоновское отталкивание от очень близко находящегося положительно заряженного ядра.
Альфа-распаду подвержены, в основном, тяжелые ядра – их известно более 200, α-частицы испускаются большинством изотопов элементов, следующих за висмутом. Известны ти более легкие альфа-излучатели, в основном, это атомы редкоземельных элементов. Но почему из ядра вылетают именно альфа-частицы, а не отдельные протоны? Качественно это объясняется энергетическим выигрышем при α-распаде (α-частицы – ядра гелия устойчивы). Количественная же теория α-распада была создана лишь в 1980-х, в ее разработке принимали участие и отечественные физики, в их числе Лев Давидович Ландау, Аркадий Бейнусович Мигдал (1911–1991), заведующий кафедрой ядерной физики Воронежского университета Станислав Георгиевич Кадменский с сотрудниками.
Вылет из ядра α-частицы приводит к ядру другого химического элемента, который смещен в периодической таблице на две клетки влево. В качестве примера можно привести превращения семи изотопов полония (заряд ядра 84) в разные изотопы свинца (заряд ядра 82): 218Po → 214Pb, 214Po → 210Pb, 210Po → 206Pb, 211Po → 207Pb, 215Po →211Pb, 212Po → 208Pb, 216Po → 212Pb. Изотопы свинца 206Pb 207Pb и 208Pb стабильны, остальные радиоактивны.
Бета-распад наблюдается как у тяжелых, так и у легких ядер, например, у трития. Эти легкие частицы (быстрые электроны) обладают более высокой проникающей способностью. Так, в воздухе β-частицы могут пролететь несколько десятков сантиметров, в жидких и твердых веществах – от долей миллиметра до примерно 1 см. В отличие от α-частиц, энергетический спектр β-лучей не дискретный. Энергия вылетающих из ядра электронов может меняться почти от нуля до некоторого максимального значения, характерного для данного радионуклида. Обычно средняя энергия β-частиц намного меньше, чем у α -частиц; например, энергия β-излучения 228Ra составляет 0,04 МэВ. Но бывают и исключения; так β-излучение короткоживущего нуклида 11Ве несет энергию 11,5 МэВ. Долго было неясно, каким образом из одинаковых атомов одного и того же элемента вылетают частицы с разной скоростью. Когда же стало известно понятно строение атома и атомного ядра, появилась новая загадка: откуда вообще берутся вылетающие из ядра β-частицы – ведь в ядре никаких электронов нет. После того как в 1932 английский физик Джеймс Чедвикомоткрыл нейтрон, отечественные физики Дмитрий Дмитриевич Иваненко (1904–1994) и Игорь Евгеньевич Тамми независимо немецкий физик Вернер Гейзенбергпредположили, что атомные ядра состоят из протонов и нейтронов. В таком случае β-частицы должны образоваться в результате внутриядерного процесса превращения нейтрона в протон и электрон: n → p + e. Масса нейтрона немного превышает суммарную массу протона и электрона, избыток массы, в соответствии с формулой Эйнштейна E= mc2, дает кинетическую энергию вылетающего из ядра электрона, поэтому β-распад наблюдается, в основном, у ядер с избыточным числом нейтронов. Например, нуклид 226Ra – α-излучатель, а все более тяжелые изотопы радия (227Ra, 228Ra, 229Ra и 230Ra) – β-излучатели.
продолжение --PAGE_BREAK--Оставалось выяснить, почему β-частицы, в отличие от α-частиц, имеют сплошной спектр энергии, это означало, что одни из них обладают очень малой энергией, а другие – очень большой (и при этом движутся со скоростью, близкую к скорости света). Более того, суммарная энергия всех этих электронов (она была измерена с помощью калориметра) оказалась меньше, чем разность энергии исходного ядра и продукта его распада. Снова физики с толкнулись с «нарушением» закона сохранения энергии: часть энергии исходного ядра непонятно куда исчезала. Незыблемый физический закон «спас» в 1931 швейцарский физик Вольфганг Паули, который предположил, что при β-распаде из ядра вылетают две частицы: электрон и гипотетическая нейтральная частица – нейтрино с почти нулевой массой, которая и уносит избыток энергии. Непрерывный спектр β-излучения объясняется распределением энергии между электронами и этой частицей. Нейтрино (как потом оказалось, при β-распаде образуется так называемое электронное антинейтрино />) очень слабо взаимодействует с веществом (например, легко пронзает по диаметру земной шар и даже огромную звезду) и потому долго не обнаруживалось – экспериментально свободные нейтрино были зарегистрированы только в 1956 г. Таким образом, уточненная схема бета-распада такова: n → p + />. Количественную теорию β-распада на основе представлений Паули о нейтрино разработал в 1933 итальянский физик Энрико Ферми, он же предложил название нейтрино (по-итальянски «нейтрончик»).
Превращение нейтрона в протон при β-распаде практически не изменяет массу нуклида, но увеличивает заряд ядра на единицу. Следовательно, образуется новый элемент, смещенный в периодической таблице на одну клетку вправо, например: />→ />, />→/>, />→ />и т.д. (одновременно из ядра вылетают электрон и антинейтрино).
2. Другие виды радиоактивности
Помимо альфа- и бета-распадов, известны и другие типы самопроизвольных радиоактивных превращений. В 1938 американский физик Луис Уолтер Альваресоткрыл третий тип радиоактивного превращения – электронный захват (К-захват). В этом случае ядро захватывает электрон с ближайшей к нему энергетической оболочки (К-оболочки). При взаимодействии электрона с протоном образуется нейтрон, а из ядра вылетает нейтрино, уносящее избыток энергии. Превращение протона в нейтрон не изменяет массу нуклида, но уменьшает заряд ядра на единицу. Следовательно, образуется новый элемент, находящийся в периодической таблице на одну клетку левее, например, из />получается стабильный нуклид />(именно на этом примере Альварес открыл этот тип радиоактивности).
При К-захвате в электронной оболочке атома на место исчезнувшего электрона «спускается» электрон с более высокого энергетического уровня, излишек энергии либо выделяется в виде рентгеновского излучения, либо расходуется на вылет из атома более слабо связанных одного или нескольких электронов – так называемых оже-электронов, по имени французского физика Пьера Оже (1899–1993), открывшего этот эффект в 1923 (для выбивания внутренних электронов он использовал ионизирующее излучение).
В 1940 Георгий Николаевич Флеров (1913–1990) и Константин Антонович Петржак (1907–1998) на примере урана открыли самопроизвольное (спонтанное) деление, при котором нестабильное ядро распадается на два более легких ядра, массы которых различаются не очень сильно, например: />→ />+ />+ 2n. Этот тип распада наблюдается только у уранаи более тяжелых элементов – всего более чем у 50 нуклидов. В случае урана спонтанное деление происходит очень медленно: среднее время жизни атома 238U составляет 6,5 миллиарда лет. В 1938 немецкий физик и химик Отто Ган, австрийский радиохимик и физик Лизе Мейтнер (в ее честь назван элемент Mt – мейтнерий) и немецкий физикохимик Фриц Штрассман (1902–1980) обнаружили, что при бомбардировке нейтронами ядра урана делятся на осколки, причем вылетевшие из ядер нейтроны способны вызвать деление соседних ядер урана, что приводит к цепной реакции). Этот процесс сопровождается выделением огромной (по сравнению с химическими реакциями) энергии, что привело к созданию ядерного оружия и строительству АЭС.
В 1934 дочь Марии Кюри Ирэн Жолио-Кюрии ее муж Фредерик Жолио-Кюриоткрыли позитронный распад. В этом процессе один из протонов ядра превращается в нейтрон и антиэлектрон (позитрон) – частицу с той же массой, но положительно заряженную; одновременно из ядра вылетает нейтрино: p → n + e++ 238. Масса ядра при этом не изменяется, а смещение происходит, отличие от β–-распада, влево, β+-распад характерен для ядер с избытком протонов (так называемые нейтронодефицитные ядра). Так, тяжелые изотопы кислорода 19О, 20О и 21О β–-активны, а его легкие изотопы 14О и 15О β+ — активны, например: 14O → 14N + e++ 238. Как античастицы, позитроны сразу же уничтожаются (аннигилируют) при встрече с электронами с образованием двух γ-квантов. Позитронный распад часто конкурирует с К-захватом.
В 1982 была открыта протонная радиоактивность: испускание ядром протона (это возможно лишь для некоторых искусственно полученных ядер, обладающих избыточной энергией). В 1960 физико-химик Виталий Иосифович Гольданский (1923–2001) теоретически предсказал двухпротонную радиоактивность: выбрасывание ядром двух протонов со спаренными спинами. Впервые она наблюдалась в 1970. Очень редко наблюдается и двухнейтронная радиоактивность (обнаружена в 1979).
В 1984 была открыта кластерная радиоактивность (от англ. cluster – гроздь, рой). При этом, в отличие от спонтанного деления, ядро распадается на осколки с сильно отличающимися массами, например, из тяжелого ядра вылетают ядра с массами от 14 до 34. Кластерный распад также наблюдается очень редко, и это в течение длительного времени затрудняло его обнаружение.
Некоторые ядра способны распадаться по разным направлениям. Например, 221Rn на 80% распадается с испусканием α-частиц и на 20% – β-частиц, многие изотопы редкоземельных элементов (137Pr, 141Nd, 141Pm, 142Sm и др.) распадаются либо путем электронного захвата, либо с испусканием позитрона. Различные виды радиоактивных излучений часто (но не всегда) сопровождаются γ-излучением. Происходит это потому, что образующееся ядро может обладать избыточной энергией, от которой оно освобождается путем испускания гамма-квантов. Энергия γ-излучения лежит в широких пределах, так, при распаде 226Ra она равна 0,186 МэВ, а при распаде 11Ве достигает 8 МэВ.
Почти 90% из известных 2500 атомных ядер нестабильны. Нестабильное ядро самопроизвольно превращается в другие ядра с испусканием частиц. Это свойство ядер называется радиоактивностью. У больших ядер нестабильность возникает вследствие конкуренции между притяжением нуклонов ядерными силами и кулоновским отталкиванием протонов. Не существует стабильных ядер с зарядовым числом Z > 83 и массовым числом A > 209. Но радиоактивными могут оказаться и ядра атомов с существенно меньшими значениями чисел Zи A. Если ядро содержит значительно больше протонов, чем нейтронов, то нестабильность обуславливается избытком энергии кулоновского взаимодействия. Ядра, которые содержали бы большой избыток нейтронов над числом протонов, оказываются нестабильными вследствие того, что масса нейтрона превышает массу протона. Увеличение массы ядра приводит к увеличению его энергии.
Явление радиоактивности было открыто в 1896 году французским физиком А. Беккерелем, который обнаружил, что соли урана испускают неизвестное излучение, способное проникать через непрозрачные для света преграды и вызывать почернение фотоэмульсии. Через два года французские физики М. и П. Кюри обнаружили радиоактивность тория и открыли два новых радиоактивных элемента – полоний />и радий />
В последующие годы исследованием природы радиоактивных излучений занимались многие физики, в том числе Э. Резерфорд и его ученики. Было выяснено, что радиоактивные ядра могут испускать частицы трех видов: положительно и отрицательно заряженные и нейтральные. Эти три вида излучений были названы α-, β- и γ-излучениями. Эти три вида радиоактивных излучений сильно отличаются друг от друга по способности ионизировать атомы вещества и, следовательно, по проникающей способности. Наименьшей проникающей способностью обладает α-излучение. В воздухе при нормальных условиях α-лучи проходят путь в несколько сантиметров. β-лучи гораздо меньше поглощаются веществом. Они способны пройти через слой алюминия толщиной в несколько миллиметров. Наибольшей проникающей способностью обладают γ-лучи, способные проходить через слой свинца толщиной 5–10 см.
продолжение --PAGE_BREAK--Во втором десятилетии XX века после открытия Э. Резерфордом ядерного строения атомов было твердо установлено, что радиоактивность – это свойство атомных ядер. Исследования показали, что α-лучи представляют поток α-частиц – ядер гелия, β-лучи – это поток электронов, γ-лучи представляют собой коротковолновое электромагнитное излучение с чрезвычайно малой длиной волны λ < 10–10 м и вследствие этого – ярко выраженными корпускулярными свойствами, т.е. является потоком частиц – γ-квантов.
3. Альфа-распад
Альфа-распадом называется самопроизвольное превращение атомного ядра с числом протонов Zи нейтронов Nв другое (дочернее) ядро, содержащее число протонов Z – 2 и нейтронов N – 2. При этом испускается α-частица – ядро атома гелия />. Примером такого процесса может служить α-распад радия: />Альфа-частицы, испускаемые ядрами атомов радия, использовались Резерфордом в опытах по рассеянию на ядрах тяжелых элементов. Скорость α-частиц, испускаемых при α-распаде ядер радия, измеренная по кривизне траектории в магнитном поле, приблизительно равна 1,5·107 м/с, а соответствующая кинетическая энергия около 7,5·10–13 Дж (приблизительно 4,8 МэВ). Эта величина легко может быть определена по известным значениям масс материнского и дочернего ядер и ядра гелия. Хотя скорость вылетающей α-частицы огромна, но она все же составляет только 5% от скорости света, поэтому при расчете можно пользоваться нерелятивистским выражением для кинетической энергии. Исследования показали, что радиоактивное вещество может испускать α-частицы с несколькими дискретными значениями энергий. Это объясняется тем, что ядра могут находиться, подобно атомам, в разных возбужденных состояниях. В одном из таких возбужденных состояний может оказаться дочернее ядро при α-распаде.
При последующем переходе этого ядра в основное состояние испускается γ-квант. Схема α-распада радия с испусканием α-частиц с двумя значениями кинетических энергий приведена на рис.2. Таким образом, α-распад ядер во многих случаях сопровождается γ-излучением.
В теории α-распада предполагается, что внутри ядер могут образовываться группы, состоящие из двух протонов и двух нейтронов, т.е. α-частица. Материнское ядро является для α-частиц потенциальной ямой, которая ограничена потенциальным барьером. Энергия α-частицы в ядре недостаточна для преодоления этого барьера (рис.3). Вылет α-частицы из ядра оказывается возможным только благодаря квантово-механическому явлению, которое называется туннельным эффектом. Согласно квантовой механике, существуют отличная от нуля вероятность прохождения частицы подпотенциальным барьером. Явление туннелирования имеет вероятностный характер.
4. Бета-распад
При бета-распаде из ядра вылетает электрон. Внутри ядер электроны существовать не могут, они возникают при β-распаде в результате превращения нейтрона в протон. Этот процесс может происходить не только внутри ядра, но и со свободными нейтронами. Среднее время жизни свободного нейтрона составляет около 15 минут. При распаде нейтрон />превращается в протон />и электрон />
Измерения показали, что в этом процессе наблюдается кажущееся нарушение закона сохранения энергии, так как суммарная энергия протона и электрона, возникающих при распаде нейтрона, меньше энергии нейтрона. В 1931 году В. Паули высказал предположение, что при распаде нейтрона выделяется еще одна частица с нулевыми значениями массы и заряда, которая уносит с собой часть энергии. Новая частица получила название нейтрино(маленький нейтрон). Из-за отсутствия у нейтрино заряда и массы эта частица очень слабо взаимодействует с атомами вещества, поэтому ее чрезвычайно трудно обнаружить в эксперименте. Ионизирующая способность нейтрино столь мала, что один акт ионизации в воздухе приходится приблизительно на 500 км пути. Эта частица была обнаружена лишь в 1953 г. В настоящее время известно, что существует несколько разновидностей нейтрино. В процессе распада нейтрона возникает частица, которая называется электронным антинейтрино. Она обозначается символом />. Поэтому реакция распада нейтрона записывается в виде
/>
Аналогичный процесс происходит и внутри ядер при β- распаде. Электрон, образующийся в результате распада одного из ядерных нейтронов, немедленно выбрасывается из «родительского дома» (ядра) с огромной скоростью, которая может отличаться от скорости света лишь на доли процента. Так как распределение энергии, выделяющейся при β-распаде, между электроном, нейтрино и дочерним ядром носит случайный характер, β-электроны могут иметь различные скорости в широком интервале.
При β-распаде зарядовое число Zувеличивается на единицу, а массовое число Aостается неизменным. Дочернее ядро оказывается ядром одного из изотопов элемента, порядковый номер которого в таблице Менделеева на единицу превышает порядковый номер исходного ядра. Типичным примером β-распада может служить превращение изотона тория />возникающего при α-распаде урана />в палладий />
/>
Наряду с электронным β-распадом обнаружен так называемый позитронный β+-распад, при котором из ядра вылетают позитрон />и нейтрино />. Позитрон – это частица-двойник электрона, отличающаяся от него только знаком заряда. Существование позитрона было предсказано выдающимся физиком П. Диракомв 1928 г. Через несколько лет позитрон был обнаружен в составе космических лучей. Позитроны возникают в результате реакции превращения протона в нейтрон по следующей схеме:
/>
5. Гамма-распад
продолжение --PAGE_BREAK--В отличие от α- и β-радиоактивности γ-радиоактивность ядер не связана с изменением внутренней структуры ядра и не сопровождается изменением зарядового или массового чисел. Как при α-, так и при β-распаде дочернее ядро может оказаться в некотором возбужденном состоянии и иметь избыток энергии. Переход ядра из возбужденного состояния в основное сопровождается испусканием одного или нескольких γ-квантов, энергия которых может достигать нескольких МэВ.
6. Закон радиоактивного распада
В любом образце радиоактивного вещества содержится огромное число радиоактивных атомов. Так как радиоактивный распад имеет случайный характер и не зависит от внешних условий, то закон убывания количества N(t) нераспавшихся к данному моменту времени tядер может служить важной статистической характеристикой процесса радиоактивного распада.
Пусть за малый промежуток времени Δtколичество нераспавшихся ядер N(t) изменилось на ΔN < 0. Так как вероятность распада каждого ядра неизменна во времени, что число распадов будет пропорционально количеству ядер N(t) и промежутку времени Δt:
ΔN = –λN(t)Δt.
Коэффициент пропорциональности λ – это вероятность распада ядра за время Δt = 1 с. Эта формула означает, что скорость />изменения функции N(t) прямо пропорциональна самой функции.
/>
Подобная зависимость возникает во многих физических задачах (например, при разряде конденсатора через резистор). Решение этого уравнения приводит к экспоненциальному закону:
N(t) = Ne–λt,
где N– начальное число радиоактивных ядер при t = 0. За время τ = 1 / λ количество нераспавшихся ядер уменьшится в e ≈ 2,7 раза. Величину τ называют средним временем жизнирадиоактивного ядра.
Для практического использования закон радиоактивного распада удобно записать в другом виде, используя в качестве основания число 2, а не e:
N(t) = N · 2–t/T.
Величина Tназывается периодом полураспада. За время Tраспадается половина первоначального количества радиоактивных ядер. Величины Tи τ связаны соотношением
/>
Рис. 4. иллюстрирует закон радиоактивного распада.
/>
Рисунок 4.
Закон радиоактивного распада.
Период полураспада – основная величина, характеризующая скорость радиоактивного распада. Чем меньше период полураспада, тем интенсивнее протекает распад. Так, для урана T ≈ 4,5 млрд. лет, а для радия T ≈ 1600 лет. Поэтому активность радия значительно выше, чем урана. Существуют радиоактивные элементы с периодом полураспада в доли секунды.
При α- и β-радиоактивном распаде дочернее ядро также может оказаться нестабильным. Поэтому возможны серии последовательных радиоактивных распадов, которые заканчиваются образованием стабильных ядер. В природе существует несколько таких серий. Наиболее длинной является серия />состоящая из 14 последовательных распадов (8 – альфа-распадов и 6 бета-распадов). Эта серия заканчивается стабильным изотопом свинца />(рис. 5).
/>
Рисунок 5.
Схема распада радиоактивной серии />Указаны периоды полураспада.
В природе существуют еще несколько радиоактивных серий, аналогичных серии />. Известна также серия, которая начинается с нептуния />не обнаруженного в естественных условиях, и заканчивается на висмуте />. Эта серия радиоактивных распадов возникает в ядерных реакторах.
продолжение --PAGE_BREAK--Правило смещения.Правило смещения точно указывает, какие именно превращения претерпевает химический элемент, испуская радиоактивное излучение.
7. Радиоактивные ряды
Правило смещения позволило проследить превращения естественных радиоактивных элементов и выстроить из них три генеалогических дерева, родоначальниками которых являются уран-238, уран-235 и торий-232. Каждое семейство начинается с чрезвычайно долгоживущего радиоактивного элемента. Урановое семейство, например, возглавляет уран с массовым числом 238 и периодом полураспада 4,5·109лет (в табл. 1 в соответствии с первоначальным названием обозначен как уран I).
Таблица 1. Радиоактивное семейство урана
Радиоактивный элемент
Z
Химический элемент
А
Тип излуче-
ния
Период полурас-
пада
Уран I
92
Уран
238
4,5109лет
Уран X1
90
Торий
234
24,1 сут
Уран X2 Уран Z
91
91
Протактиний
Протактиний
234
234
–(99,88%) (0,12%)
1,14 мин
,7 ч
Уран II
92
Уран
234
2,5105лет
Ионий
90
Торий
230
8104лет
Радий
88
Радий
226
1620 лет
Радон
86
Радон
222
3,8 сут
Радий А
84
Полоний
218
3,05 мин
Радий В
82
Свинец
214
26,8 мин
РадийС
Радий С
83 83
Висмут Висмут
214 214
(99,96%)
(0,04%)
19,7 мин
19,7 мин
Радий С
84
Полоний
214
1,610–4с
Радий С
81
Таллий
210
1,3 мин
Радий D
82
Свинец
210
25 лет
Радий Е
83
Висмут
210
4,85 сут
Радий F
84
Полоний
210
138 сут
Радий G
82
Свинец
206
Стабилен
Семейство урана.На элементах семейства урана можно проследить большинство обсуждавшихся выше свойств радиоактивных превращений. Так, например, у третьего члена семейства наблюдается ядерная изомерия. Уран X2, испуская бета-частицы, превращается в уран II (T = 1,14 мин). Это соответствует бета-распаду возбужденного состояния протактиния-234. Однако в 0,12% случаев возбужденный протактиний-234 (уран X2) излучает гамма-квант и переходит в основное состояние (уран Z). Бета-распад урана Z, также приводящий к образованию урана II, происходит за 6,7 ч.
Радий С интересен тем, что может распадаться двумя путями: испуская либо альфа-, либо бета-частицу. Эти процессы конкурируют между собой, но в 99,96% случаев происходит бета-распад с образованием радия С. В 0,04% случаев радий С испускает альфа-частицу и превращается в радий С (RaC). В свою очередь RaC и RaC путем эмиссии альфа- и бета-частиц соответственно превращаются в радий D.
Изотопы.Среди членов уранового семейства встречаются такие, атомы которых имеют одинаковый атомный номер (одинаковый заряд ядер) и разные массовые числа. Они идентичны по химическим свойствам, но различаются по характеру радиоактивности. Например, радий B, радий D и радий G, имеющие одинаковый со свинцом атомный номер 82, подобны свинцу по химическому поведению. Очевидно, что химические свойства не зависят от массового числа; они определяются строением электронных оболочек атома (следовательно, и Z). С другой стороны, массовое число имеет решающее значение для ядерной стабильности радиоактивных свойств атома. Атомы с одинаковым атомным номером и разными массовыми числами называются изотопами. Изотопы радиоактивных элементов были открыты Ф.Содди в 1913, но вскоре Ф.Астон с помощью масс-спектроскопии доказал, что изотопы имеются и у многих стабильных элементов.
продолжение --PAGE_BREAK--8.Действие радиоактивного излучения на человека
Радиоактивное излучение всех видов (альфа, бета, гамма, нейтроны), а также электромагнитная радиация (рентгеновское излучение) оказывают очень сильное биологическое воздействие на живые организмы, которое заключается в процессах возбуждения и ионизации атомов и молекул, входящих в состав живых клеток. Под действием ионизирующей радиации разрушаются сложные молекулы и клеточные структуры, что приводит к лучевому поражению организма. Поэтому при работе с любым источником радиации необходимо принимать все меры по радиационной защите людей, которые могут попасть в зону действия излучения.
Однако человек может подвергаться действию ионизирующей радиации и в бытовых условиях. Серьезную опасность для здоровья человека может представлять инертный, бесцветный, радиоактивный газ радон />Как видно из схемы, изображенной на рис.5, радон является продуктом α-распада радия и имеет период полураспада T = 3,82 сут. Радий в небольших количествах содержится в почве, в камнях, в различных строительных конструкциях. Несмотря на сравнительно небольшое время жизни, концентрация радона непрерывно восполняется за счет новых распадов ядер радия, поэтому радон может накапливаться в закрытых помещениях. Попадая в легкие, радон испускает α-частицы и превращается в полоний />который не является химически инертным веществом. Далее следует цепь радиоактивных превращений серии урана (рис. 5). По данным Американской комиссии радиационной безопасности и контроля, человек в среднем получает 55% ионизирующей радиации за счет радона и только 11% за счет медицинских обслуживаний. Вклад космических лучей составляет примерно 8%. Общая доза облучения, которую получает человек за жизнь, во много раз меньше предельно допустимой дозы(ПДД), которая устанавливается для людей некоторых профессий, подвергающихся дополнительному облучению ионизирующей радиацией.
9. Применение радиоактивных изотопов
Одним из наиболее выдающихся исследований, проведенных с помощью «меченых атомов», явилось исследование обмена веществ в организмах. Было доказано, что за сравнительно небольшое время организм подвергается почти полному обновлению. Слагающие его атомы заменяются новыми. Лишь железо, как показали опыты по изотопному исследованию крови, является исключением из этого правила. Железо входит в состав гемоглобина красных кровяных шариков. При введении в пищу радиоактивных атомов железа было установлено, что свободный кислород, выделяемый при фотосинтезе, первоначально входил в состав воды, а не углекислого газа. Радиоактивные изотопы применяются в медицине как для постановки диагноза, так и для терапевтических целей. Радиоактивный натрий, вводимый в небольших количествах в кровь, используется для исследования кровообращения, йод интенсивно отлагается в щитовидной железе, особенно при базедовой болезни. Наблюдая с помощью счетчика за отложением радиоактивного йода, можно быстро поставить диагноз. Большие дозы радиоактивного йода вызывают частичное разрушение аномально развивающихся тканей, и поэтому радиоактивный йод используют для лечения базедовой болезни. Интенсивное гамма-излучение кобальта используется при лечении раковых заболеваний (кобальтовая пушка).
Не менее обширны применения радиоактивных изотопов в промышленности. Одним из примеров этого может служить следующий способ контроля износа поршневых колец в двигателях внутреннего сгорания. Облучая поршневое кольцо нейтронами, вызывают в нем ядерные реакции и делают его радиоактивным. При работе двигателя частички материала кольца попадают в смазочное масло. Исследуя уровень радиоактивности масла после определенного времени работы двигателя, определяют износ кольца. Радиоактивные изотопы позволяют судить о диффузии металлов, процессах в доменных печах и т. д.
Мощное гамма-излучение радиоактивных препаратов используют для исследования внутренней структуры металлических отливок с целью обнаружения в них дефектов.
Все более широкое применение получают радиоактивные изотопы в сельском хозяйстве. Облучение семян растений (хлопчатника, капусты, редиса и др.) небольшими дозами гамма-лучей от радиоактивных препаратов приводит к заметному увеличению урожайности. Большие дозы 'радиации вызывают мутации у растений и микроорганизмов, что в отдельных случаях приводит к появлению мутантов с новыми ценными свойствами (радиоселекция). Так выведены ценные сорта пшеницы, фасоли и других культур, а также получены высоко продуктивные микроорганизмы, применяемые в производстве антибиотиков. Гамма-излучение радиоактивных изотопов используется также для борьбы с вредными насекомыми и для консервации пищевых продуктов. Широкое применение получили «меченые атомы» в агротехнике. Например, чтобы выяснить, какое из фосфорных удобрений лучше усваивается растением, помечают различные удобрения радиоактивным фосфором 15 32P. Исследуя затем растения на радиоактивность, можно определить количество усвоенного ими фосфора из разных сортов удобрения.
Интересным применением радиоактивности является метод датирования археологических и геологических находок по концентрации радиоактивных изотопов. Наиболее часто используется радиоуглеродный метод датирования. Нестабильный изотоп углерода />возникает в атмосфере вследствие ядерных реакций, вызываемых космическими лучами. Небольшой процент этого изотопа содержится в воздухе наряду с обычным стабильным изотопом />.Растения и другие организмы потребляют углерод из воздуха, и в них накапливаются оба изотопа в той же пропорции, как и в воздухе. После гибели растений они перестают потреблять углерод и нестабильный изотоп в результате β-распада постепенно превращается в азот />с периодом полураспада 5730 лет. Путем точного измерения относительной концентрации радиоактивного углерода />в останках древних организмов можно определить время их гибели.
Список использованной литературы
1. Учение о радиоактивности. История и современность. М. Наука, 1973 2. Ядерные излучения в науке и технике. М. Наука, 1984 Фурман В. И. 3. Альфа-распад и родственные ядерные реакции. М. Наука, 1985
4. Ландсберг Г. С. Элементарный учебник физики. Том III. – М.: Наука, 1986
5. Селезнев Ю. А. Основы элементарной физики. –
М.: Наука, 1964.
6. CD ROM «Большая энциклопедия Кирилла и Мефодия», 1997.
7. Кюри М., Радиоактивность, пер. с франц., 2 изд., М. — Л., 1960
8. Мурин А.Н., Введение в радиоактивность, Л., 1955
9. Давыдов А.С., Теория атомного ядра, М., 1958
10. Гайсинский М.Н., Ядерная химия и ее приложения, пер. с франц., М., 1961
11. Экспериментальная ядерная физика, под ред. Э. Сегре, пер. с англ., т. 3, М., 1961; Средства сети INTERNET
www.ronl.ru
Реферат - Применение радиоактивных изотопов в технике
Курсовая работа
На тему: «Радиоактивность.
Применение радиоактивных изотопов в технике»
Содержание
Введение
1.Виды радиоактивных излучений
2.Другие виды радиоактивности
3.Альфа-распад
4.Бета-распад
5.Гамма-распад
6.Закон радиоактивного распада
7.Радиоактивные ряды
8.Действие радиоактивного излучения на человека
9.Применение радиоактивных изотопов
Список использованной литературы
Введение
Радиоактивность – превращение атомных ядер в другие ядра, сопровождающееся испусканием различных частиц и электромагнитного излучения. Отсюда и название явления: на латыни radio – излучаю, activus – действенный. Это слово ввела Мария Кюри. При распаде нестабильного ядра – радионуклида из него вылетают с большой скоростью одна или несколько частиц высокой энергии. Поток этих частиц называют радиоактивным излучением или попросту радиацией.
Лучи Рентгена. Открытие радиоактивности было непосредственно связано с открытием Рентгена. Более того, некоторое время думали, что это один и тот же вид излучения. Конец 19 в. вообще был богат на открытие различного рода не известных до того «излучений». В 1880-е английский физик Джозеф Джон Томсон приступил к изучению элементарных носителей отрицательного заряда, в 1891 ирландский физик Джордж Джонстон Стони (1826–1911) назвал эти частицы электронами. Наконец, в декабре Вильгельм Конрад Рентген сообщил об открытии нового вида лучей, которые он назвал Х-лучами. До сих пор в большинстве стран они так и называются, но в Германии и России принято предложение немецкого биолога Рудольфа Альберта фон Кёлликера (1817–1905) называть лучи рентгеновскими. Эти лучи возникают, когда быстро летящие в вакууме электроны (катодные лучи) сталкиваются с препятствием. Было известно, что при попадании катодных лучей на стекло, оно испускает видимый свет – зеленую люминесценцию. Рентген обнаружил, что одновременно от зеленого пятна на стекле исходят какие-то другие невидимые лучи. Это произошло случайно: то в темной комнате светился находящийся неподалеку экран, покрытый тетрацианоплатинатом бария Ba[Pt(CN)4 ] (раньше его называли платиносинеродистым барием). Это вещество дает яркую желто-зеленую люминесценцию под действием ультрафиолетовых, а также катодных лучей. Но катодные лучи на экран не попадали, и более того, когда прибор был закрыт черной бумагой, экран продолжал светиться. Вскоре Рентген обнаружил, что излучение проходит через многие непрозрачные вещества, вызывает почернение фотопластинки, завернутой в черную бумагу или даже помещенной в металлический футляр. Лучи проходили через очень толстую книгу, через еловую доску толщиной 3 см, через алюминиевую пластину толщиной 1,5 см… Рентген понял возможности своего открытия: «Если держать руку между разрядной трубкой и экраном, – писал он, – то видны темные тени костей на фоне более светлых очертаний руки». Это было первое в истории рентгеноскопическое исследование.
Открытие Рентгена мгновенно облетело весь мир и поразило не только специалистов. В канун 1896 в книжном магазине одного немецкого города была выставлена фотография кисти руки. На ней были видны кости живого человека, а на одном из пальцев – обручальное кольцо. Это была снятая в рентгеновских лучах фотография кисти жены Рентгена. Первое сообщение Рентгена “О новом роде лучей” было опубликовано в «Отчетах Вюрцбургского физико-медицинского общества» 28 декабря оно было немедленно переведено и опубликовано в разных странах, выходящий в Лондоне самый известный научный журнал «Nature» («Природа») опубликовал статью Рентгена 23 января 1896.
Новые лучи стали исследовать во всем мире, только за один год на эту тему было опубликовано свыше тысячи работ. Несложные по конструкции рентгеновские аппараты появились и в госпиталях: медицинское применение новых лучей было очевидным.
Сейчас рентгеновские лучи широко используются (и не только в медицинских целях) во всем мире.
Лучи Беккереля. Открытие Рентгена вскоре привело к не менее выдающемуся открытию. Его сделал в 1896 французский физик Антуан Анри Беккерель. Он был 20 января 1896 на заседании Академии, на котором физик и философ Анри Пуанкаре рассказал об открытии Рентгена и продемонстрировал сделанные уже во Франции рентгеновские снимки руки человека. Пуанкаре не ограничился рассказом о новых лучах. Он высказал предположение, что эти лучи связаны с люминесценцией и, возможно, всегда возникают одновременно с этим видом свечения, так что, вероятно, можно обойтись и без катодных лучей. Свечение веществ под действием ультрафиолета – флуоресценция или фосфоресценция (в 19 в. не было строгого разграничения этих понятий) было знакомо Беккерелю: ею занимались и его отец Александр Эдмонд Беккерель (1820–1891), и дед Антуан Сезар Беккерель (1788–1878) – оба физики; физиком стал и сын Антуана Анри Беккереля – Жак, который «по наследству» принял кафедру физики при парижском Музее естественной истории, эту кафедру Беккерели возглавляли 110 лет, с 1838 по 1948.
Беккерель решил проверить, связаны ли лучи Рентгена с флуоресценцией. Яркой желто-зеленой флуоресценцией обладают некоторые соли урана, например, уранилнитрат UO2 (NO3 )2. Такие вещества были в лаборатории Беккереля, где работал. С препаратами урана работал еще его отец, который показал, что после прекращения действия солнечного света их свечение исчезает очень быстро – менее чем за сотую долю секунды. Однако никто не проверял, сопровождается ли это свечение испусканием каких-то других лучей, способных проходить сквозь непрозрачные материалы, как это было у Рентгена. Именно это после доклада Пуанкаре решил проверить Беккерель. 24 февраля 1896 на еженедельном заседании Академии он рассказал, что беря фотопластинку, завернутую в два слоя плотной черной бумаги, кладя на нее кристаллы двойного сульфата калия-уранила K2 UO2 (SO4 )2·2h3O и выставляя все это на несколько часов на солнечный свет, то после проявления фотопластинки на ней можно видеть несколько размытый контур кристаллов. Если между пластинкой и кристаллами поместить монету или вырезанную из жести фигуру, то после проявления на пластинке появляется четкое изображение этих предметов.
Все это могло свидетельствовать о связи флуоресценции и рентгеновского излучения. Недавно открытые Х-лучи можно получать намного проще – без катодных лучей и необходимых для этого вакуумной трубки и высокого напряжения, но надо было проверить, не оказывается ли, что урановая соль, нагреваясь на солнце, выделяет какой-то газ, который проникает под черную бумагу и действует на фотоэмульсию Чтобы исключить эту возможность, Беккерель проложил между урановой солью и фотопластинкой лист стекла – она все равно засветилась. «Отсюда, – заключил свое краткое сообщение Беккерель, – можно сделать вывод о том, что светящаяся соль испускает лучи, которые проникают через не прозрачную для света черную бумагу и восстанавливают серебряные соли в фотопластинке». Как будто Пуанкаре оказался прав и Х-лучи Рентгена можно получить совсем другим способом.
Беккерель начал ставить множество опытов, чтобы лучше понять условия, при которых появляются лучи, засвечивающие фотопластинку, и исследовать свойства этих лучей. Он помещал между кристаллами и фотопластинкой разные вещества – бумагу, стекло, пластинки алюминия, меди, свинца разной толщины. Результаты получались те же, что и у Рентгена, что также могло служить доводом в пользу сходства обоих излучений. Помимо прямого солнечного света Беккерель освещал соль урана светом, отраженным зеркалом или преломленным призмой. Он получил, что результаты всех прежних опытов никак не были связаны с солнцем; имело значение лишь то, как долго урановая соль находилась вблизи фотопластинки. На следующий день Беккерель доложил об этом на заседании Академии, но вывод он, как потом выяснилось, сделал неверный: он решил, что соль урана, хотя бы раз «заряженная» на свету, способна потом сама длительное время испускать невидимые проникающие лучи.
Беккерель до конца года он опубликовал на эту тему девять статей, в одной из них он писал: «Разные соли урана были помещены в толстостенный свинцовый ящик… Защищенные от действия любых известных излучений, эти вещества продолжали испускать лучи, проходящие через стекло и черную бумагу..., через восемь месяцев».
Эти лучи исходили от любых соединений урана, даже от тех, которые не светятся на солнце. Еще более сильным (примерно в 3,5 раза) оказалось излучение металлического урана. Стало очевидным, что излучение хотя и похоже по некоторым проявлениям на рентгеновское, но обладает большей проникающей способностью и как-то связано с ураном, так что Беккерель стал называть его «урановыми лучами».
Беккерель обнаружил также, что «урановые лучи» ионизируют воздух, делая его проводником электричества. Практически одновременно, в ноябре 1896, английские физики Дж. Дж.Томсон и Эрнест Резерфорд (обнаружили ионизацию воздуха и под действием рентгеновских лучей. Для измерения интенсивности излучения Беккерель использовал электроскоп, в котором легчайшие золотые листочки, подвешенные за концы и заряженные электростатически, отталкиваются и их свободные концы расходятся. Если воздух проводит ток, заряд с листочков стекает и они опадают – тем быстрее, чем выше электропроводность воздуха и, следовательно, больше интенсивность излучения.
Оставался вопрос, каким образом вещество испускает непрерывное и не ослабевающее в течение многих месяцев излучение без подвода энергии от внешнего источника Сам Беккерель писал, что не в состоянии понять, откуда уран получает энергию, которую он непрерывно излучает. По этому поводу выдвигались самые разные гипотезы, иногда довольно фантастические. Например, английский химик и физик Уильям Рамзай писал: «… физики недоумевали, откуда мог бы взяться неисчерпаемый запас энергии в солях урана. Лорд Кельвин склонялся к предположению, что уран служит своего рода западней, которая улавливает ничем другим не обнаруживаемую лучистую энергию, доходящую до нас через пространство, и превращает ее в такую форму, в виде которой она делается способной производить химические действия».
Беккерель не мог ни принять эту гипотезу, ни придумать что-то более правдоподобное, ни отказаться от принципа сохранения энергии. Кончилось тем, что он вообще на некоторое время бросил работу с ураном и занялся расщеплением спектральных линий в магнитном поле. Этот эффект был обнаружен почти одновременно с открытием Беккереля молодым голландским физиком Питером Зееманом и объяснен другим голландцем – Хендриком Антоном Лоренцем.
На этом закончился первый этап исследования радиоактивности. Альберт Эйнштейн сравнил открытие радиоактивности с открытием огня, так как считал, что и огонь и радиоактивность – одинаково крупные вехи в истории цивилизации.
1. Виды радиоактивных излучений
Когда в руках исследователей появились мощные источники радиации, в миллионы раз более сильные, чем уран (это были препараты радия, полония, актиния), можно было более подробно ознакомиться со свойствами радиоактивного излучения. В первых исследованиях на эту тему самое активное участие приняли Эрнест Резерфорд супруги Мария и Пьер Кюри, А.Беккерель, многие другие. Прежде всего, была изучена проникающая способность лучей, а также действие на излучение магнитного поля. Оказалось, что излучение неоднородно, а представляет собой смесь «лучей». Пьер Кюри обнаружил, что при действии магнитного поля на излучение радия одни лучи отклоняются, а другие нет. Было известно, что магнитное поле отклоняет только заряженные летящие частицы, причем положительные и отрицательные в разные стороны. По направлению отклонения убедились в том, что отклоняемые β-лучи заряжены отрицательно. Дальнейшие опыты показали, что между катодными и β-лучами нет принципиальной разницы, откуда следовало, что они представляют собой поток электронов.
Отклоняющиеся лучи обладали более сильной способностью проникать через различные материалы, тогда как неотклоняющиеся легко поглощались даже тонкой алюминиевой фольгой – так вело себя, например, излучение нового элемента полония – его излучение не проникало даже сквозь картонные стенки коробки, в которой хранился препарат.
При использовании более сильных магнитов оказалось, что α-лучи тоже отклоняются, только значительно слабее, чем β-лучи, причем в другую сторону. Отсюда следовало, что они заряжены положительно и имеют значительно бóльшую массу (как потом выяснили, масса α-частиц в 7740 раз больше массы электрона). Впервые это явление обнаружили в 1899 А.Беккерель и Ф.Гизель. В дальнейшем выяснилось, что α-частицы представляют собой ядра атомов гелия (нуклид 4 Не) с зарядом +2 и массой 4 у.е… Когда же в 1900 французский физик Поль Вийар (1860–1934) исследовал более подробно отклонение α- и β-лучей, он обнаружил в излучении радия и третий вид лучей, не отклоняющихся в самых сильных магнитных полях, это открытие вскоре подтвердил и Беккерель. Этот вид излучения, по аналогии с альфа- и бета-лучами, был назван гамма-лучами, обозначение разных излучений первыми буквами греческого алфавита предложил Резерфорд. Гамма-лучи оказались сходными с лучами Рентгена, т.е. они представляют собой электромагнитное излучение, но с более короткими длинами волн и соответственно с большей энергией. Все эти виды радиации описала М.Кюри в своей монографии «Радий и радиоактивность». Вместо магнитного поля для «расщепления» радиации можно использовать электрическое поле, только заряженные частицы в нем будут отклоняться не перпендикулярно силовым линиям, а вдоль них – по направлению к отклоняющим пластинам.
Долгое время было неясно, откуда берутся все эти лучи. В течение нескольких десятилетий трудами многих физиков была выяснена природа радиоактивного излучения и его свойства, были открыты новые типы радиоактивности.γ
Альфа-лучи испускают, главным образом, ядра самых тяжелых и потому менее стабильных атомов (в периодической таблице они расположены после свинца). Эти высокоэнергетичные частицы. Обычно наблюдается несколько групп α -частиц, каждая из которых имеет строго определенную энергию. Так, почти все α -частицы, вылетающие из ядер 226 Ra, обладают энергией в 4,78 МэВ (мегаэлектрон-вольт) и небольшая доля α -частиц энергией в 4,60 МэВ. Другой изотоп радия – 221 Ra испускает четыре группы α -частиц с энергиями 6,76, 6,67, 6,61 и 6,59 МэВ. Это свидетельствует о наличии в ядрах нескольких энергетических уровней, их разность соответствует энергии излучаемых ядром α -квантов. Известны и «чистые» альфа-излучатели (например, 222 Rn).
По формуле E = mu 2 /2 можно подсчитать скорость α-частиц с определенной энергией. Например, 1 моль α -частиц с Е = 4,78 МэВ имеет энергию (в единицах СИ) Е = 4,78·106 эВ 96500 Дж/(эВ·моль) = 4,61·1011 Дж/моль и массу m = 0,004 кг/моль, откуда u α 15200 км/с, что в десятки тысяч раз больше скорости пистолетной пули. Альфа-частицы обладают самым сильным ионизирующим действием: сталкиваясь с любыми другими атомами в газе, жидкости или твердом теле, они «обдирают» с них электроны, создавая заряженные частицы. При этом α-частицы очень быстро теряют энергию: они задерживаются даже листом бумаги. В воздухе α-излучение радия проходит всего 3,3 см, α -излучение тория – 2,6 см и т.д. В конечном счете потерявшая кинетическую энергию α-частица захватывает два электрона и превращается в атом гелия. Первый потенциал ионизации атома гелия (He – e → He+ ) составляет 24,6 эВ, второй (He+ – e → He+2 ) – 54,4 эВ, это намного больше, чем у любых других атомов. При захвате электронов α-частицами выделяется огромная энергия (более 7600 кДж/моль), поэтому ни один атом, кроме атомов самого гелия, не в состоянии удержать свои электроны, если по соседству окажется α -частица.
Очень большая кинетическая энергия α -частиц позволяет «увидеть» их невооруженным глазом (или с помощью обычной лупы), впервые это продемонстрировал в 1903 английский физик и химик Уильям Крукс (1832 – 1919. Он приклеил на кончик иглы еле видимую глазом крупинку радиевой соли и укрепил иглу в широкой стеклянной трубке. На одном конце этой трубки, недалеко от кончика иглы, помещалась пластинка, покрытая слоем люминофора (им служил сульфид цинка), а на другом конце было увеличительное стекло. Если в темноте рассматривать люминофор, то видно: все поле зрения усеяно вспыхивающими и сейчас же гаснущими искрами. Каждая искра – это результат удара одной α -частицы. Крукс назвал этот прибор спинтарископом (от греч. spintharis – искра и skopeo – смотрю, наблюдаю). С помощью этого простого метода подсчета α -частиц был выполнен ряд исследований, например, этим способом можно было довольно точно определить постоянную Авогадро.
В ядре протоны и нейтроны удерживаются вместе ядерными силами, Поэтому было непонятно, каким образом альфа-частица, состоящая из двух протонов и двух нейтронов, может покинуть ядро. Ответ дал в 1928 американский физик (эмигрировавший в 1933 из СССР)Джордж (Георгий Антонович) Гамов). По законам квантовой механики α -частицы, как и любые частицы малой массы, обладают волновой природой и потому у них есть некоторая небольшая вероятность оказаться вне ядра, на небольшом (примерно 6· 10–12 см) расстоянии от него. Как только это происходит, на частицу начинает действовать с кулоновское отталкивание от очень близко находящегося положительно заряженного ядра.
Альфа-распаду подвержены, в основном, тяжелые ядра – их известно более 200, α-частицы испускаются большинством изотопов элементов, следующих за висмутом. Известны ти более легкие альфа-излучатели, в основном, это атомы редкоземельных элементов. Но почему из ядра вылетают именно альфа-частицы, а не отдельные протоны? Качественно это объясняется энергетическим выигрышем при α-распаде (α-частицы – ядра гелия устойчивы). Количественная же теория α-распада была создана лишь в 1980-х, в ее разработке принимали участие и отечественные физики, в их числе Лев Давидович Ландау, Аркадий Бейнусович Мигдал (1911–1991), заведующий кафедрой ядерной физики Воронежского университета Станислав Георгиевич Кадменский с сотрудниками.
Вылет из ядра α-частицы приводит к ядру другого химического элемента, который смещен в периодической таблице на две клетки влево. В качестве примера можно привести превращения семи изотопов полония (заряд ядра 84) в разные изотопы свинца (заряд ядра 82): 218 Po → 214 Pb, 214 Po → 210 Pb, 210 Po → 206 Pb, 211 Po → 207 Pb, 215 Po →211 Pb, 212 Po → 208 Pb, 216 Po → 212 Pb. Изотопы свинца 206 Pb 207 Pb и 208 Pb стабильны, остальные радиоактивны.
Бета-распад наблюдается как у тяжелых, так и у легких ядер, например, у трития. Эти легкие частицы (быстрые электроны) обладают более высокой проникающей способностью. Так, в воздухе β -частицы могут пролететь несколько десятков сантиметров, в жидких и твердых веществах – от долей миллиметра до примерно 1 см. В отличие от α-частиц, энергетический спектр β -лучей не дискретный. Энергия вылетающих из ядра электронов может меняться почти от нуля до некоторого максимального значения, характерного для данного радионуклида. Обычно средняя энергия β -частиц намного меньше, чем у α -частиц; например, энергия β -излучения 228 Ra составляет 0,04 МэВ. Но бывают и исключения; так β -излучение короткоживущего нуклида 11 Ве несет энергию 11,5 МэВ. Долго было неясно, каким образом из одинаковых атомов одного и того же элемента вылетают частицы с разной скоростью. Когда же стало известно понятно строение атома и атомного ядра, появилась новая загадка: откуда вообще берутся вылетающие из ядра β -частицы – ведь в ядре никаких электронов нет. После того как в 1932 английский физик Джеймс Чедвиком открыл нейтрон, отечественные физики Дмитрий Дмитриевич Иваненко (1904–1994) и Игорь Евгеньевич Тамм и независимо немецкий физик Вернер Гейзенберг предположили, что атомные ядра состоят из протонов и нейтронов. В таком случае β -частицы должны образоваться в результате внутриядерного процесса превращения нейтрона в протон и электрон: n → p + e. Масса нейтрона немного превышает суммарную массу протона и электрона, избыток массы, в соответствии с формулой Эйнштейна E = mc 2, дает кинетическую энергию вылетающего из ядра электрона, поэтому β -распад наблюдается, в основном, у ядер с избыточным числом нейтронов. Например, нуклид 226 Ra – α-излучатель, а все более тяжелые изотопы радия (227 Ra, 228 Ra, 229 Ra и 230 Ra) – β -излучатели.
Оставалось выяснить, почему β-частицы, в отличие от α -частиц, имеют сплошной спектр энергии, это означало, что одни из них обладают очень малой энергией, а другие – очень большой (и при этом движутся со скоростью, близкую к скорости света). Более того, суммарная энергия всех этих электронов (она была измерена с помощью калориметра) оказалась меньше, чем разность энергии исходного ядра и продукта его распада. Снова физики с толкнулись с «нарушением» закона сохранения энергии: часть энергии исходного ядра непонятно куда исчезала. Незыблемый физический закон «спас» в 1931 швейцарский физик Вольфганг Паули, который предположил, что при β-распаде из ядра вылетают две частицы: электрон и гипотетическая нейтральная частица – нейтрино с почти нулевой массой, которая и уносит избыток энергии. Непрерывный спектр β -излучения объясняется распределением энергии между электронами и этой частицей. Нейтрино (как потом оказалось, при β-распаде образуется так называемое электронное антинейтрино ) очень слабо взаимодействует с веществом (например, легко пронзает по диаметру земной шар и даже огромную звезду) и потому долго не обнаруживалось – экспериментально свободные нейтрино были зарегистрированы только в 1956 г. Таким образом, уточненная схема бета-распада такова: n → p + . Количественную теорию β-распада на основе представлений Паули о нейтрино разработал в 1933 итальянский физик Энрико Ферми, он же предложил название нейтрино (по-итальянски «нейтрончик»).
Превращение нейтрона в протон при β-распаде практически не изменяет массу нуклида, но увеличивает заряд ядра на единицу. Следовательно, образуется новый элемент, смещенный в периодической таблице на одну клетку вправо, например: → , →, → и т.д. (одновременно из ядра вылетают электрон и антинейтрино).
2. Другие виды радиоактивности
Помимо альфа- и бета-распадов, известны и другие типы самопроизвольных радиоактивных превращений. В 1938 американский физик Луис Уолтер Альварес открыл третий тип радиоактивного превращения – электронный захват (К-захват). В этом случае ядро захватывает электрон с ближайшей к нему энергетической оболочки (К-оболочки). При взаимодействии электрона с протоном образуется нейтрон, а из ядра вылетает нейтрино, уносящее избыток энергии. Превращение протона в нейтрон не изменяет массу нуклида, но уменьшает заряд ядра на единицу. Следовательно, образуется новый элемент, находящийся в периодической таблице на одну клетку левее, например, из получается стабильный нуклид (именно на этом примере Альварес открыл этот тип радиоактивности).
При К-захвате в электронной оболочке атома на место исчезнувшего электрона «спускается» электрон с более высокого энергетического уровня, излишек энергии либо выделяется в виде рентгеновского излучения, либо расходуется на вылет из атома более слабо связанных одного или нескольких электронов – так называемых оже-электронов, по имени французского физика Пьера Оже (1899–1993), открывшего этот эффект в 1923 (для выбивания внутренних электронов он использовал ионизирующее излучение).
В 1940 Георгий Николаевич Флеров (1913–1990) и Константин Антонович Петржак (1907–1998) на примере урана открыли самопроизвольное (спонтанное) деление, при котором нестабильное ядро распадается на два более легких ядра, массы которых различаются не очень сильно, например: → + + 2n. Этот тип распада наблюдается только у урана и более тяжелых элементов – всего более чем у 50 нуклидов. В случае урана спонтанное деление происходит очень медленно: среднее время жизни атома 238 U составляет 6,5 миллиарда лет. В 1938 немецкий физик и химик Отто Ган, австрийский радиохимик и физик Лизе Мейтнер (в ее честь назван элемент Mt – мейтнерий) и немецкий физикохимик Фриц Штрассман (1902–1980) обнаружили, что при бомбардировке нейтронами ядра урана делятся на осколки, причем вылетевшие из ядер нейтроны способны вызвать деление соседних ядер урана, что приводит к цепной реакции). Этот процесс сопровождается выделением огромной (по сравнению с химическими реакциями) энергии, что привело к созданию ядерного оружия и строительству АЭС.
В 1934 дочь Марии Кюри Ирэн Жолио-Кюри и ее муж Фредерик Жолио-Кюри открыли позитронный распад. В этом процессе один из протонов ядра превращается в нейтрон и антиэлектрон (позитрон) – частицу с той же массой, но положительно заряженную; одновременно из ядра вылетает нейтрино: p → n + e+ + 238. Масса ядра при этом не изменяется, а смещение происходит, отличие от β– -распада, влево, β+-распад характерен для ядер с избытком протонов (так называемые нейтронодефицитные ядра). Так, тяжелые изотопы кислорода 19 О, 20 О и 21 О β– -активны, а его легкие изотопы 14 О и 15 О β+ — активны, например: 14 O → 14 N + e+ + 238. Как античастицы, позитроны сразу же уничтожаются (аннигилируют) при встрече с электронами с образованием двух γ-квантов. Позитронный распад часто конкурирует с К-захватом.
В 1982 была открыта протонная радиоактивность: испускание ядром протона (это возможно лишь для некоторых искусственно полученных ядер, обладающих избыточной энергией). В 1960 физико-химик Виталий Иосифович Гольданский (1923–2001) теоретически предсказал двухпротонную радиоактивность: выбрасывание ядром двух протонов со спаренными спинами. Впервые она наблюдалась в 1970. Очень редко наблюдается и двухнейтронная радиоактивность (обнаружена в 1979).
В 1984 была открыта кластерная радиоактивность (от англ. cluster – гроздь, рой). При этом, в отличие от спонтанного деления, ядро распадается на осколки с сильно отличающимися массами, например, из тяжелого ядра вылетают ядра с массами от 14 до 34. Кластерный распад также наблюдается очень редко, и это в течение длительного времени затрудняло его обнаружение.
Некоторые ядра способны распадаться по разным направлениям. Например, 221 Rn на 80% распадается с испусканием α-частиц и на 20% – β-частиц, многие изотопы редкоземельных элементов (137 Pr, 141 Nd, 141 Pm, 142 Sm и др.) распадаются либо путем электронного захвата, либо с испусканием позитрона. Различные виды радиоактивных излучений часто (но не всегда) сопровождаются γ-излучением. Происходит это потому, что образующееся ядро может обладать избыточной энергией, от которой оно освобождается путем испускания гамма-квантов. Энергия γ-излучения лежит в широких пределах, так, при распаде 226 Ra она равна 0,186 МэВ, а при распаде 11 Ве достигает 8 МэВ.
Почти 90% из известных 2500 атомных ядер нестабильны. Нестабильное ядро самопроизвольно превращается в другие ядра с испусканием частиц. Это свойство ядер называется радиоактивностью. У больших ядер нестабильность возникает вследствие конкуренции между притяжением нуклонов ядерными силами и кулоновским отталкиванием протонов. Не существует стабильных ядер с зарядовым числом Z > 83 и массовым числом A > 209. Но радиоактивными могут оказаться и ядра атомов с существенно меньшими значениями чисел Z и A. Если ядро содержит значительно больше протонов, чем нейтронов, то нестабильность обуславливается избытком энергии кулоновского взаимодействия. Ядра, которые содержали бы большой избыток нейтронов над числом протонов, оказываются нестабильными вследствие того, что масса нейтрона превышает массу протона. Увеличение массы ядра приводит к увеличению его энергии.
Явление радиоактивности было открыто в 1896 году французским физиком А. Беккерелем, который обнаружил, что соли урана испускают неизвестное излучение, способное проникать через непрозрачные для света преграды и вызывать почернение фотоэмульсии. Через два года французские физики М. и П. Кюри обнаружили радиоактивность тория и открыли два новых радиоактивных элемента – полоний и радий
В последующие годы исследованием природы радиоактивных излучений занимались многие физики, в том числе Э. Резерфорд и его ученики. Было выяснено, что радиоактивные ядра могут испускать частицы трех видов: положительно и отрицательно заряженные и нейтральные. Эти три вида излучений были названы α-, β- и γ-излучениями. Эти три вида радиоактивных излучений сильно отличаются друг от друга по способности ионизировать атомы вещества и, следовательно, по проникающей способности. Наименьшей проникающей способностью обладает α-излучение. В воздухе при нормальных условиях α-лучи проходят путь в несколько сантиметров. β-лучи гораздо меньше поглощаются веществом. Они способны пройти через слой алюминия толщиной в несколько миллиметров. Наибольшей проникающей способностью обладают γ-лучи, способные проходить через слой свинца толщиной 5–10 см.
Во втором десятилетии XX века после открытия Э. Резерфордом ядерного строения атомов было твердо установлено, что радиоактивность – это свойство атомных ядер. Исследования показали, что α-лучи представляют поток α-частиц – ядер гелия, β-лучи – это поток электронов, γ-лучи представляют собой коротковолновое электромагнитное излучение с чрезвычайно малой длиной волны λ < 10–10 м и вследствие этого – ярко выраженными корпускулярными свойствами, т.е. является потоком частиц – γ-квантов.
3. Альфа-распад
Альфа-распадом называется самопроизвольное превращение атомного ядра с числом протонов Z и нейтронов N в другое (дочернее) ядро, содержащее число протонов Z – 2 и нейтронов N – 2. При этом испускается α-частица – ядро атома гелия . Примером такого процесса может служить α-распад радия: Альфа-частицы, испускаемые ядрами атомов радия, использовались Резерфордом в опытах по рассеянию на ядрах тяжелых элементов. Скорость α-частиц, испускаемых при α-распаде ядер радия, измеренная по кривизне траектории в магнитном поле, приблизительно равна 1,5·107 м/с, а соответствующая кинетическая энергия около 7,5·10–13 Дж (приблизительно 4,8 МэВ). Эта величина легко может быть определена по известным значениям масс материнского и дочернего ядер и ядра гелия. Хотя скорость вылетающей α-частицы огромна, но она все же составляет только 5% от скорости света, поэтому при расчете можно пользоваться нерелятивистским выражением для кинетической энергии. Исследования показали, что радиоактивное вещество может испускать α-частицы с несколькими дискретными значениями энергий. Это объясняется тем, что ядра могут находиться, подобно атомам, в разных возбужденных состояниях. В одном из таких возбужденных состояний может оказаться дочернее ядро при α-распаде.
При последующем переходе этого ядра в основное состояние испускается γ-квант. Схема α-распада радия с испусканием α-частиц с двумя значениями кинетических энергий приведена на рис.2. Таким образом, α-распад ядер во многих случаях сопровождается γ-излучением.
В теории α-распада предполагается, что внутри ядер могут образовываться группы, состоящие из двух протонов и двух нейтронов, т.е. α-частица. Материнское ядро является для α-частиц потенциальной ямой, которая ограничена потенциальным барьером. Энергия α-частицы в ядре недостаточна для преодоления этого барьера (рис.3). Вылет α-частицы из ядра оказывается возможным только благодаря квантово-механическому явлению, которое называется туннельным эффектом. Согласно квантовой механике, существуют отличная от нуля вероятность прохождения частицы под потенциальным барьером. Явление туннелирования имеет вероятностный характер.
4. Бета-распад
При бета-распаде из ядра вылетает электрон. Внутри ядер электроны существовать не могут, они возникают при β-распаде в результате превращения нейтрона в протон. Этот процесс может происходить не только внутри ядра, но и со свободными нейтронами. Среднее время жизни свободного нейтрона составляет около 15 минут. При распаде нейтрон превращается в протон и электрон
Измерения показали, что в этом процессе наблюдается кажущееся нарушение закона сохранения энергии, так как суммарная энергия протона и электрона, возникающих при распаде нейтрона, меньше энергии нейтрона. В 1931 году В. Паули высказал предположение, что при распаде нейтрона выделяется еще одна частица с нулевыми значениями массы и заряда, которая уносит с собой часть энергии. Новая частица получила название нейтрино (маленький нейтрон). Из-за отсутствия у нейтрино заряда и массы эта частица очень слабо взаимодействует с атомами вещества, поэтому ее чрезвычайно трудно обнаружить в эксперименте. Ионизирующая способность нейтрино столь мала, что один акт ионизации в воздухе приходится приблизительно на 500 км пути. Эта частица была обнаружена лишь в 1953 г. В настоящее время известно, что существует несколько разновидностей нейтрино. В процессе распада нейтрона возникает частица, которая называется электронным антинейтрино. Она обозначается символом . Поэтому реакция распада нейтрона записывается в виде
Аналогичный процесс происходит и внутри ядер при β- распаде. Электрон, образующийся в результате распада одного из ядерных нейтронов, немедленно выбрасывается из «родительского дома» (ядра) с огромной скоростью, которая может отличаться от скорости света лишь на доли процента. Так как распределение энергии, выделяющейся при β-распаде, между электроном, нейтрино и дочерним ядром носит случайный характер, β-электроны могут иметь различные скорости в широком интервале.
При β-распаде зарядовое число Z увеличивается на единицу, а массовое число A остается неизменным. Дочернее ядро оказывается ядром одного из изотопов элемента, порядковый номер которого в таблице Менделеева на единицу превышает порядковый номер исходного ядра. Типичным примером β-распада может служить превращение изотона тория возникающего при α-распаде урана в палладий
Наряду с электронным β-распадом обнаружен так называемый позитронный β+ -распад, при котором из ядра вылетают позитрон и нейтрино . Позитрон – это частица-двойник электрона, отличающаяся от него только знаком заряда. Существование позитрона было предсказано выдающимся физиком П. Дираком в 1928 г. Через несколько лет позитрон был обнаружен в составе космических лучей. Позитроны возникают в результате реакции превращения протона в нейтрон по следующей схеме:
5. Гамма-распад
В отличие от α- и β-радиоактивности γ-радиоактивность ядер не связана с изменением внутренней структуры ядра и не сопровождается изменением зарядового или массового чисел. Как при α-, так и при β-распаде дочернее ядро может оказаться в некотором возбужденном состоянии и иметь избыток энергии. Переход ядра из возбужденного состояния в основное сопровождается испусканием одного или нескольких γ-квантов, энергия которых может достигать нескольких МэВ.
6. Закон радиоактивного распада
В любом образце радиоактивного вещества содержится огромное число радиоактивных атомов. Так как радиоактивный распад имеет случайный характер и не зависит от внешних условий, то закон убывания количества N(t) нераспавшихся к данному моменту времени t ядер может служить важной статистической характеристикой процесса радиоактивного распада.
Пусть за малый промежуток времени Δt количество нераспавшихся ядер N(t) изменилось на ΔN < 0. Так как вероятность распада каждого ядра неизменна во времени, что число распадов будет пропорционально количеству ядер N(t) и промежутку времени Δt:
Коэффициент пропорциональности λ – это вероятность распада ядра за время Δt = 1 с. Эта формула означает, что скорость изменения функции N(t) прямо пропорциональна самой функции.
Подобная зависимость возникает во многих физических задачах (например, при разряде конденсатора через резистор). Решение этого уравнения приводит к экспоненциальному закону:
где N0– начальное число радиоактивных ядер при t = 0. За время τ = 1 / λ количество нераспавшихся ядер уменьшится в e ≈ 2,7 раза. Величину τ называют средним временем жизни радиоактивного ядра.
Для практического использования закон радиоактивного распада удобно записать в другом виде, используя в качестве основания число 2, а не e:
Величина T называется периодом полураспада. За время T распадается половина первоначального количества радиоактивных ядер. Величины T и τ связаны соотношением
Рис. 4. иллюстрирует закон радиоактивного распада.
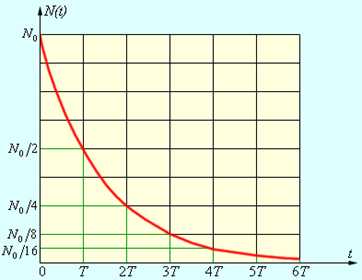 | Рисунок 4. Закон радиоактивного распада. |
Период полураспада – основная величина, характеризующая скорость радиоактивного распада. Чем меньше период полураспада, тем интенсивнее протекает распад. Так, для урана T ≈ 4,5 млрд. лет, а для радия T ≈ 1600 лет. Поэтому активность радия значительно выше, чем урана. Существуют радиоактивные элементы с периодом полураспада в доли секунды.
При α- и β-радиоактивном распаде дочернее ядро также может оказаться нестабильным. Поэтому возможны серии последовательных радиоактивных распадов, которые заканчиваются образованием стабильных ядер. В природе существует несколько таких серий. Наиболее длинной является серия состоящая из 14 последовательных распадов (8 – альфа-распадов и 6 бета-распадов). Эта серия заканчивается стабильным изотопом свинца (рис. 5).
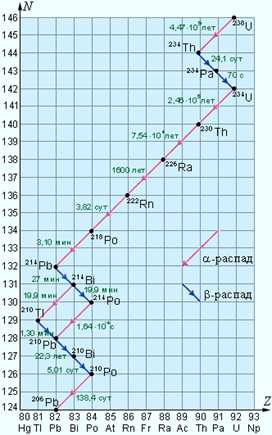 | Рисунок 5. Схема распада радиоактивной серии Указаны периоды полураспада. |
В природе существуют еще несколько радиоактивных серий, аналогичных серии . Известна также серия, которая начинается с нептуния не обнаруженного в естественных условиях, и заканчивается на висмуте . Эта серия радиоактивных распадов возникает в ядерных реакторах.
Правило смещения. Правило смещения точно указывает, какие именно превращения претерпевает химический элемент, испуская радиоактивное излучение.
7. Радиоактивные ряды
Правило смещения позволило проследить превращения естественных радиоактивных элементов и выстроить из них три генеалогических дерева, родоначальниками которых являются уран-238, уран-235 и торий-232. Каждое семейство начинается с чрезвычайно долгоживущего радиоактивного элемента. Урановое семейство, например, возглавляет уран с массовым числом 238 и периодом полураспада 4,5·109 лет (в табл. 1 в соответствии с первоначальным названием обозначен как уран I).
| Таблица 1. Радиоактивное семейство урана | |||||
| Радиоактивный элемент | Z | Химический элемент | А | Тип излуче- ния | Период полурас- пада |
| Уран I | 92 | Уран | 238 | | 4,5109 лет |
| Уран X1 | 90 | Торий | 234 | | 24,1 сут |
| Уран X2 Уран Z | 91 91 | Протактиний Протактиний | 234 234 | – (99,88%) (0,12%) | 1,14 мин ,7 ч |
| Уран II | 92 | Уран | 234 | | 2,5105 лет |
| Ионий | 90 | Торий | 230 | | 8104 лет |
| Радий | 88 | Радий | 226 | | 1620 лет |
| Радон | 86 | Радон | 222 | | 3,8 сут |
| Радий А | 84 | Полоний | 218 | | 3,05 мин |
| Радий В | 82 | Свинец | 214 | | 26,8 мин |
РадийС Радий С | 83 83 | Висмут Висмут | 214 214 | (99,96%) (0,04%) | 19,7 мин 19,7 мин |
| Радий С | 84 | Полоний | 214 | | 1,610–4 с |
| Радий С | 81 | Таллий | 210 | | 1,3 мин |
| Радий D | 82 | Свинец | 210 | | 25 лет |
| Радий Е | 83 | Висмут | 210 | | 4,85 сут |
| Радий F | 84 | Полоний | 210 | | 138 сут |
| Радий G | 82 | Свинец | 206 | Стабилен |
Семейство урана. На элементах семейства урана можно проследить большинство обсуждавшихся выше свойств радиоактивных превращений. Так, например, у третьего члена семейства наблюдается ядерная изомерия. Уран X2, испуская бета-частицы, превращается в уран II (T = 1,14 мин). Это соответствует бета-распаду возбужденного состояния протактиния-234. Однако в 0,12% случаев возбужденный протактиний-234 (уран X2 ) излучает гамма-квант и переходит в основное состояние (уран Z). Бета-распад урана Z, также приводящий к образованию урана II, происходит за 6,7 ч.
Радий С интересен тем, что может распадаться двумя путями: испуская либо альфа-, либо бета-частицу. Эти процессы конкурируют между собой, но в 99,96% случаев происходит бета-распад с образованием радия С. В 0,04% случаев радий С испускает альфа-частицу и превращается в радий С (RaC). В свою очередь RaC и RaC путем эмиссии альфа- и бета-частиц соответственно превращаются в радий D.
Изотопы. Среди членов уранового семейства встречаются такие, атомы которых имеют одинаковый атомный номер (одинаковый заряд ядер) и разные массовые числа. Они идентичны по химическим свойствам, но различаются по характеру радиоактивности. Например, радий B, радий D и радий G, имеющие одинаковый со свинцом атомный номер 82, подобны свинцу по химическому поведению. Очевидно, что химические свойства не зависят от массового числа; они определяются строением электронных оболочек атома (следовательно, и Z ). С другой стороны, массовое число имеет решающее значение для ядерной стабильности радиоактивных свойств атома. Атомы с одинаковым атомным номером и разными массовыми числами называются изотопами. Изотопы радиоактивных элементов были открыты Ф.Содди в 1913, но вскоре Ф.Астон с помощью масс-спектроскопии доказал, что изотопы имеются и у многих стабильных элементов.
8.Действие радиоактивного излучения на человека
Радиоактивное излучение всех видов (альфа, бета, гамма, нейтроны), а также электромагнитная радиация (рентгеновское излучение) оказывают очень сильное биологическое воздействие на живые организмы, которое заключается в процессах возбуждения и ионизации атомов и молекул, входящих в состав живых клеток. Под действием ионизирующей радиации разрушаются сложные молекулы и клеточные структуры, что приводит к лучевому поражению организма. Поэтому при работе с любым источником радиации необходимо принимать все меры по радиационной защите людей, которые могут попасть в зону действия излучения.
Однако человек может подвергаться действию ионизирующей радиации и в бытовых условиях. Серьезную опасность для здоровья человека может представлять инертный, бесцветный, радиоактивный газ радон Как видно из схемы, изображенной на рис.5, радон является продуктом α-распада радия и имеет период полураспада T = 3,82 сут. Радий в небольших количествах содержится в почве, в камнях, в различных строительных конструкциях. Несмотря на сравнительно небольшое время жизни, концентрация радона непрерывно восполняется за счет новых распадов ядер радия, поэтому радон может накапливаться в закрытых помещениях. Попадая в легкие, радон испускает α-частицы и превращается в полоний который не является химически инертным веществом. Далее следует цепь радиоактивных превращений серии урана (рис. 5). По данным Американской комиссии радиационной безопасности и контроля, человек в среднем получает 55% ионизирующей радиации за счет радона и только 11% за счет медицинских обслуживаний. Вклад космических лучей составляет примерно 8%. Общая доза облучения, которую получает человек за жизнь, во много раз меньше предельно допустимой дозы (ПДД), которая устанавливается для людей некоторых профессий, подвергающихся дополнительному облучению ионизирующей радиацией.
9. Применение радиоактивных изотопов
Одним из наиболее выдающихся исследований, проведенных с помощью «меченых атомов», явилось исследование обмена веществ в организмах. Было доказано, что за сравнительно небольшое время организм подвергается почти полному обновлению. Слагающие его атомы заменяются новыми. Лишь железо, как показали опыты по изотопному исследованию крови, является исключением из этого правила. Железо входит в состав гемоглобина красных кровяных шариков. При введении в пищу радиоактивных атомов железа было установлено, что свободный кислород, выделяемый при фотосинтезе, первоначально входил в состав воды, а не углекислого газа. Радиоактивные изотопы применяются в медицине как для постановки диагноза, так и для терапевтических целей. Радиоактивный натрий, вводимый в небольших количествах в кровь, используется для исследования кровообращения, йод интенсивно отлагается в щитовидной железе, особенно при базедовой болезни. Наблюдая с помощью счетчика за отложением радиоактивного йода, можно быстро поставить диагноз. Большие дозы радиоактивного йода вызывают частичное разрушение аномально развивающихся тканей, и поэтому радиоактивный йод используют для лечения базедовой болезни. Интенсивное гамма-излучение кобальта используется при лечении раковых заболеваний (кобальтовая пушка).
Не менее обширны применения радиоактивных изотопов в промышленности. Одним из примеров этого может служить следующий способ контроля износа поршневых колец в двигателях внутреннего сгорания. Облучая поршневое кольцо нейтронами, вызывают в нем ядерные реакции и делают его радиоактивным. При работе двигателя частички материала кольца попадают в смазочное масло. Исследуя уровень радиоактивности масла после определенного времени работы двигателя, определяют износ кольца. Радиоактивные изотопы позволяют судить о диффузии металлов, процессах в доменных печах и т. д.
Мощное гамма-излучение радиоактивных препаратов используют для исследования внутренней структуры металлических отливок с целью обнаружения в них дефектов.
Все более широкое применение получают радиоактивные изотопы в сельском хозяйстве. Облучение семян растений (хлопчатника, капусты, редиса и др.) небольшими дозами гамма-лучей от радиоактивных препаратов приводит к заметному увеличению урожайности. Большие дозы 'радиации вызывают мутации у растений и микроорганизмов, что в отдельных случаях приводит к появлению мутантов с новыми ценными свойствами (радиоселекция). Так выведены ценные сорта пшеницы, фасоли и других культур, а также получены высоко продуктивные микроорганизмы, применяемые в производстве антибиотиков. Гамма-излучение радиоактивных изотопов используется также для борьбы с вредными насекомыми и для консервации пищевых продуктов. Широкое применение получили «меченые атомы» в агротехнике. Например, чтобы выяснить, какое из фосфорных удобрений лучше усваивается растением, помечают различные удобрения радиоактивным фосфором 15 32P. Исследуя затем растения на радиоактивность, можно определить количество усвоенного ими фосфора из разных сортов удобрения.
Интересным применением радиоактивности является метод датирования археологических и геологических находок по концентрации радиоактивных изотопов. Наиболее часто используется радиоуглеродный метод датирования. Нестабильный изотоп углерода возникает в атмосфере вследствие ядерных реакций, вызываемых космическими лучами. Небольшой процент этого изотопа содержится в воздухе наряду с обычным стабильным изотопом .Растения и другие организмы потребляют углерод из воздуха, и в них накапливаются оба изотопа в той же пропорции, как и в воздухе. После гибели растений они перестают потреблять углерод и нестабильный изотоп в результате β-распада постепенно превращается в азот с периодом полураспада 5730 лет. Путем точного измерения относительной концентрации радиоактивного углерода в останках древних организмов можно определить время их гибели.
Список использованной литературы
1. Учение о радиоактивности. История и современность. М. Наука, 1973 2. Ядерные излучения в науке и технике. М. Наука, 1984 Фурман В. И. 3. Альфа-распад и родственные ядерные реакции. М. Наука, 1985
4. Ландсберг Г. С. Элементарный учебник физики. Том III. – М.: Наука, 19865. Селезнев Ю. А. Основы элементарной физики. –М.: Наука, 1964.6. CD ROM «Большая энциклопедия Кирилла и Мефодия», 1997.7. Кюри М., Радиоактивность, пер. с франц., 2 изд., М. — Л., 1960
8. Мурин А.Н., Введение в радиоактивность, Л., 1955
9. Давыдов А.С., Теория атомного ядра, М., 1958
10. Гайсинский М.Н., Ядерная химия и ее приложения, пер. с франц., М., 1961
11. Экспериментальная ядерная физика, под ред. Э. Сегре, пер. с англ., т. 3, М., 1961; Средства сети INTERNET
www.ronl.ru
Доклад - Применение радиоактивных изотопов в технике
Курсовая работа
На тему: «Радиоактивность.
Применение радиоактивных изотопов в технике»
Содержание
Введение
1.Виды радиоактивных излучений
2.Другие виды радиоактивности
3.Альфа-распад
4.Бета-распад
5.Гамма-распад
6.Закон радиоактивного распада
7.Радиоактивные ряды
8.Действие радиоактивного излучения на человека
9.Применение радиоактивных изотопов
Список использованной литературы
Введение
Радиоактивность – превращение атомных ядер в другие ядра, сопровождающееся испусканием различных частиц и электромагнитного излучения. Отсюда и название явления: на латыни radio – излучаю, activus – действенный. Это слово ввела Мария Кюри. При распаде нестабильного ядра – радионуклида из него вылетают с большой скоростью одна или несколько частиц высокой энергии. Поток этих частиц называют радиоактивным излучением или попросту радиацией.
Лучи Рентгена. Открытие радиоактивности было непосредственно связано с открытием Рентгена. Более того, некоторое время думали, что это один и тот же вид излучения. Конец 19 в. вообще был богат на открытие различного рода не известных до того «излучений». В 1880-е английский физик Джозеф Джон Томсон приступил к изучению элементарных носителей отрицательного заряда, в 1891 ирландский физик Джордж Джонстон Стони (1826–1911) назвал эти частицы электронами. Наконец, в декабре Вильгельм Конрад Рентген сообщил об открытии нового вида лучей, которые он назвал Х-лучами. До сих пор в большинстве стран они так и называются, но в Германии и России принято предложение немецкого биолога Рудольфа Альберта фон Кёлликера (1817–1905) называть лучи рентгеновскими. Эти лучи возникают, когда быстро летящие в вакууме электроны (катодные лучи) сталкиваются с препятствием. Было известно, что при попадании катодных лучей на стекло, оно испускает видимый свет – зеленую люминесценцию. Рентген обнаружил, что одновременно от зеленого пятна на стекле исходят какие-то другие невидимые лучи. Это произошло случайно: то в темной комнате светился находящийся неподалеку экран, покрытый тетрацианоплатинатом бария Ba[Pt(CN)4] (раньше его называли платиносинеродистым барием). Это вещество дает яркую желто-зеленую люминесценцию под действием ультрафиолетовых, а также катодных лучей. Но катодные лучи на экран не попадали, и более того, когда прибор был закрыт черной бумагой, экран продолжал светиться. Вскоре Рентген обнаружил, что излучение проходит через многие непрозрачные вещества, вызывает почернение фотопластинки, завернутой в черную бумагу или даже помещенной в металлический футляр. Лучи проходили через очень толстую книгу, через еловую доску толщиной 3 см, через алюминиевую пластину толщиной 1,5 см… Рентген понял возможности своего открытия: «Если держать руку между разрядной трубкой и экраном, – писал он, – то видны темные тени костей на фоне более светлых очертаний руки». Это было первое в истории рентгеноскопическое исследование.
Открытие Рентгена мгновенно облетело весь мир и поразило не только специалистов. В канун 1896 в книжном магазине одного немецкого города была выставлена фотография кисти руки. На ней были видны кости живого человека, а на одном из пальцев – обручальное кольцо. Это была снятая в рентгеновских лучах фотография кисти жены Рентгена. Первое сообщение Рентгена “О новом роде лучей” было опубликовано в «Отчетах Вюрцбургского физико-медицинского общества» 28 декабря оно было немедленно переведено и опубликовано в разных странах, выходящий в Лондоне самый известный научный журнал «Nature» («Природа») опубликовал статью Рентгена 23 января 1896.
Новые лучи стали исследовать во всем мире, только за один год на эту тему было опубликовано свыше тысячи работ. Несложные по конструкции рентгеновские аппараты появились и в госпиталях: медицинское применение новых лучей было очевидным.
Сейчас рентгеновские лучи широко используются (и не только в медицинских целях) во всем мире.
Лучи Беккереля. Открытие Рентгена вскоре привело к не менее выдающемуся открытию. Его сделал в 1896 французский физик Антуан Анри Беккерель. Он был 20 января 1896 на заседании Академии, на котором физик и философ Анри Пуанкаре рассказал об открытии Рентгена и продемонстрировал сделанные уже во Франции рентгеновские снимки руки человека. Пуанкаре не ограничился рассказом о новых лучах. Он высказал предположение, что эти лучи связаны с люминесценцией и, возможно, всегда возникают одновременно с этим видом свечения, так что, вероятно, можно обойтись и без катодных лучей. Свечение веществ под действием ультрафиолета – флуоресценция или фосфоресценция (в 19 в. не было строгого разграничения этих понятий) было знакомо Беккерелю: ею занимались и его отец Александр Эдмонд Беккерель (1820–1891), и дед Антуан Сезар Беккерель (1788–1878) – оба физики; физиком стал и сын Антуана Анри Беккереля – Жак, который «по наследству» принял кафедру физики при парижском Музее естественной истории, эту кафедру Беккерели возглавляли 110 лет, с 1838 по 1948.
Беккерель решил проверить, связаны ли лучи Рентгена с флуоресценцией. Яркой желто-зеленой флуоресценцией обладают некоторые соли урана, например, уранилнитрат UO2(NO3)2. Такие вещества были в лаборатории Беккереля, где работал. С препаратами урана работал еще его отец, который показал, что после прекращения действия солнечного света их свечение исчезает очень быстро – менее чем за сотую долю секунды. Однако никто не проверял, сопровождается ли это свечение испусканием каких-то других лучей, способных проходить сквозь непрозрачные материалы, как это было у Рентгена. Именно это после доклада Пуанкаре решил проверить Беккерель. 24 февраля 1896 на еженедельном заседании Академии он рассказал, что беря фотопластинку, завернутую в два слоя плотной черной бумаги, кладя на нее кристаллы двойного сульфата калия-уранила K2UO2(SO4)2·2h3O и выставляя все это на несколько часов на солнечный свет, то после проявления фотопластинки на ней можно видеть несколько размытый контур кристаллов. Если между пластинкой и кристаллами поместить монету или вырезанную из жести фигуру, то после проявления на пластинке появляется четкое изображение этих предметов.
Все это могло свидетельствовать о связи флуоресценции и рентгеновского излучения. Недавно открытые Х-лучи можно получать намного проще – без катодных лучей и необходимых для этого вакуумной трубки и высокого напряжения, но надо было проверить, не оказывается ли, что урановая соль, нагреваясь на солнце, выделяет какой-то газ, который проникает под черную бумагу и действует на фотоэмульсию Чтобы исключить эту возможность, Беккерель проложил между урановой солью и фотопластинкой лист стекла – она все равно засветилась. «Отсюда, – заключил свое краткое сообщение Беккерель, – можно сделать вывод о том, что светящаяся соль испускает лучи, которые проникают через не прозрачную для света черную бумагу и восстанавливают серебряные соли в фотопластинке». Как будто Пуанкаре оказался прав и Х-лучи Рентгена можно получить совсем другим способом.
Беккерель начал ставить множество опытов, чтобы лучше понять условия, при которых появляются лучи, засвечивающие фотопластинку, и исследовать свойства этих лучей. Он помещал между кристаллами и фотопластинкой разные вещества – бумагу, стекло, пластинки алюминия, меди, свинца разной толщины. Результаты получались те же, что и у Рентгена, что также могло служить доводом в пользу сходства обоих излучений. Помимо прямого солнечного света Беккерель освещал соль урана светом, отраженным зеркалом или преломленным призмой. Он получил, что результаты всех прежних опытов никак не были связаны с солнцем; имело значение лишь то, как долго урановая соль находилась вблизи фотопластинки. На следующий день Беккерель доложил об этом на заседании Академии, но вывод он, как потом выяснилось, сделал неверный: он решил, что соль урана, хотя бы раз «заряженная» на свету, способна потом сама длительное время испускать невидимые проникающие лучи.
Беккерель до конца года он опубликовал на эту тему девять статей, в одной из них он писал: «Разные соли урана были помещены в толстостенный свинцовый ящик… Защищенные от действия любых известных излучений, эти вещества продолжали испускать лучи, проходящие через стекло и черную бумагу..., через восемь месяцев».
Эти лучи исходили от любых соединений урана, даже от тех, которые не светятся на солнце. Еще более сильным (примерно в 3,5 раза) оказалось излучение металлического урана. Стало очевидным, что излучение хотя и похоже по некоторым проявлениям на рентгеновское, но обладает большей проникающей способностью и как-то связано с ураном, так что Беккерель стал называть его «урановыми лучами».
Беккерель обнаружил также, что «урановые лучи» ионизируют воздух, делая его проводником электричества. Практически одновременно, в ноябре 1896, английские физики Дж. Дж.Томсон и Эрнест Резерфорд(обнаружили ионизацию воздуха и под действием рентгеновских лучей. Для измерения интенсивности излучения Беккерель использовал электроскоп, в котором легчайшие золотые листочки, подвешенные за концы и заряженные электростатически, отталкиваются и их свободные концы расходятся. Если воздух проводит ток, заряд с листочков стекает и они опадают – тем быстрее, чем выше электропроводность воздуха и, следовательно, больше интенсивность излучения.
Оставался вопрос, каким образом вещество испускает непрерывное и не ослабевающее в течение многих месяцев излучение без подвода энергии от внешнего источника Сам Беккерель писал, что не в состоянии понять, откуда уран получает энергию, которую он непрерывно излучает. По этому поводу выдвигались самые разные гипотезы, иногда довольно фантастические. Например, английский химик и физик Уильям Рамзайписал: «… физики недоумевали, откуда мог бы взяться неисчерпаемый запас энергии в солях урана. Лорд Кельвин склонялся к предположению, что уран служит своего рода западней, которая улавливает ничем другим не обнаруживаемую лучистую энергию, доходящую до нас через пространство, и превращает ее в такую форму, в виде которой она делается способной производить химические действия».
Беккерель не мог ни принять эту гипотезу, ни придумать что-то более правдоподобное, ни отказаться от принципа сохранения энергии. Кончилось тем, что он вообще на некоторое время бросил работу с ураном и занялся расщеплением спектральных линий в магнитном поле. Этот эффект был обнаружен почти одновременно с открытием Беккереля молодым голландским физиком Питером Зееманоми объяснен другим голландцем – Хендриком Антоном Лоренцем.
На этом закончился первый этап исследования радиоактивности. Альберт Эйнштейн сравнил открытие радиоактивности с открытием огня, так как считал, что и огонь и радиоактивность – одинаково крупные вехи в истории цивилизации.
1. Виды радиоактивных излучений
--PAGE_BREAK--Когда в руках исследователей появились мощные источники радиации, в миллионы раз более сильные, чем уран (это были препараты радия, полония, актиния), можно было более подробно ознакомиться со свойствами радиоактивного излучения. В первых исследованиях на эту тему самое активное участие приняли Эрнест Резерфорд супруги Мария и Пьер Кюри, А.Беккерель, многие другие. Прежде всего, была изучена проникающая способность лучей, а также действие на излучение магнитного поля. Оказалось, что излучение неоднородно, а представляет собой смесь «лучей». Пьер Кюри обнаружил, что при действии магнитного поля на излучение радия одни лучи отклоняются, а другие нет. Было известно, что магнитное поле отклоняет только заряженные летящие частицы, причем положительные и отрицательные в разные стороны. По направлению отклонения убедились в том, что отклоняемые β-лучи заряжены отрицательно. Дальнейшие опыты показали, что между катодными и β-лучами нет принципиальной разницы, откуда следовало, что они представляют собой поток электронов.
Отклоняющиеся лучи обладали более сильной способностью проникать через различные материалы, тогда как неотклоняющиеся легко поглощались даже тонкой алюминиевой фольгой – так вело себя, например, излучение нового элемента полония – его излучение не проникало даже сквозь картонные стенки коробки, в которой хранился препарат.
При использовании более сильных магнитов оказалось, что α-лучи тоже отклоняются, только значительно слабее, чем β-лучи, причем в другую сторону. Отсюда следовало, что они заряжены положительно и имеют значительно бóльшую массу (как потом выяснили, масса α-частиц в 7740 раз больше массы электрона). Впервые это явление обнаружили в 1899 А.Беккерель и Ф.Гизель. В дальнейшем выяснилось, что α-частицы представляют собой ядра атомов гелия (нуклид 4Не) с зарядом +2 и массой 4 у.е… Когда же в 1900 французский физик Поль Вийар (1860–1934) исследовал более подробно отклонение α- и β-лучей, он обнаружил в излучении радия и третий вид лучей, не отклоняющихся в самых сильных магнитных полях, это открытие вскоре подтвердил и Беккерель. Этот вид излучения, по аналогии с альфа- и бета-лучами, был назван гамма-лучами, обозначение разных излучений первыми буквами греческого алфавита предложил Резерфорд. Гамма-лучи оказались сходными с лучами Рентгена, т.е. они представляют собой электромагнитное излучение, но с более короткими длинами волн и соответственно с большей энергией. Все эти виды радиации описала М.Кюри в своей монографии «Радий и радиоактивность». Вместо магнитного поля для «расщепления» радиации можно использовать электрическое поле, только заряженные частицы в нем будут отклоняться не перпендикулярно силовым линиям, а вдоль них – по направлению к отклоняющим пластинам.
Долгое время было неясно, откуда берутся все эти лучи. В течение нескольких десятилетий трудами многих физиков была выяснена природа радиоактивного излучения и его свойства, были открыты новые типы радиоактивности.γ
Альфа-лучи испускают, главным образом, ядра самых тяжелых и потому менее стабильных атомов (в периодической таблице они расположены после свинца). Эти высокоэнергетичные частицы. Обычно наблюдается несколько групп α -частиц, каждая из которых имеет строго определенную энергию. Так, почти все α -частицы, вылетающие из ядер 226Ra, обладают энергией в 4,78 МэВ (мегаэлектрон-вольт) и небольшая доля α -частиц энергией в 4,60 МэВ. Другой изотоп радия – 221Ra испускает четыре группы α -частиц с энергиями 6,76, 6,67, 6,61 и 6,59 МэВ. Это свидетельствует о наличии в ядрах нескольких энергетических уровней, их разность соответствует энергии излучаемых ядром α -квантов. Известны и «чистые» альфа-излучатели (например, 222Rn).
По формуле E = mu2/2 можно подсчитать скорость α-частиц с определенной энергией. Например, 1 моль α -частиц с Е = 4,78 МэВ имеет энергию (в единицах СИ) Е = 4,78·106 эВ 96500 Дж/(эВ·моль) = 4,61·1011 Дж/моль и массу m = 0,004 кг/моль, откуда uα 15200 км/с, что в десятки тысяч раз больше скорости пистолетной пули. Альфа-частицы обладают самым сильным ионизирующим действием: сталкиваясь с любыми другими атомами в газе, жидкости или твердом теле, они «обдирают» с них электроны, создавая заряженные частицы. При этом α-частицы очень быстро теряют энергию: они задерживаются даже листом бумаги. В воздухе α-излучение радия проходит всего 3,3 см, α -излучение тория – 2,6 см и т.д. В конечном счете потерявшая кинетическую энергию α-частица захватывает два электрона и превращается в атом гелия. Первый потенциал ионизации атома гелия (He – e → He+) составляет 24,6 эВ, второй (He+ – e → He+2) – 54,4 эВ, это намного больше, чем у любых других атомов. При захвате электронов α-частицами выделяется огромная энергия (более 7600 кДж/моль), поэтому ни один атом, кроме атомов самого гелия, не в состоянии удержать свои электроны, если по соседству окажется α -частица.
Очень большая кинетическая энергия α -частиц позволяет «увидеть» их невооруженным глазом (или с помощью обычной лупы), впервые это продемонстрировал в 1903 английский физик и химик Уильям Крукс (1832 – 1919. Он приклеил на кончик иглы еле видимую глазом крупинку радиевой соли и укрепил иглу в широкой стеклянной трубке. На одном конце этой трубки, недалеко от кончика иглы, помещалась пластинка, покрытая слоем люминофора (им служил сульфид цинка), а на другом конце было увеличительное стекло. Если в темноте рассматривать люминофор, то видно: все поле зрения усеяно вспыхивающими и сейчас же гаснущими искрами. Каждая искра – это результат удара одной α -частицы. Крукс назвал этот прибор спинтарископом (от греч. spintharis – искра и skopeo – смотрю, наблюдаю). С помощью этого простого метода подсчета α -частиц был выполнен ряд исследований, например, этим способом можно было довольно точно определить постоянную Авогадро.
В ядре протоны и нейтроны удерживаются вместе ядерными силами, Поэтому было непонятно, каким образом альфа-частица, состоящая из двух протонов и двух нейтронов, может покинуть ядро. Ответ дал в 1928 американский физик (эмигрировавший в 1933 из СССР)Джордж (Георгий Антонович) Гамов). По законам квантовой механики α-частицы, как и любые частицы малой массы, обладают волновой природой и потому у них есть некоторая небольшая вероятность оказаться вне ядра, на небольшом (примерно 6·10–12см) расстоянии от него. Как только это происходит, на частицу начинает действовать с кулоновское отталкивание от очень близко находящегося положительно заряженного ядра.
Альфа-распаду подвержены, в основном, тяжелые ядра – их известно более 200, α-частицы испускаются большинством изотопов элементов, следующих за висмутом. Известны ти более легкие альфа-излучатели, в основном, это атомы редкоземельных элементов. Но почему из ядра вылетают именно альфа-частицы, а не отдельные протоны? Качественно это объясняется энергетическим выигрышем при α-распаде (α-частицы – ядра гелия устойчивы). Количественная же теория α-распада была создана лишь в 1980-х, в ее разработке принимали участие и отечественные физики, в их числе Лев Давидович Ландау, Аркадий Бейнусович Мигдал (1911–1991), заведующий кафедрой ядерной физики Воронежского университета Станислав Георгиевич Кадменский с сотрудниками.
Вылет из ядра α-частицы приводит к ядру другого химического элемента, который смещен в периодической таблице на две клетки влево. В качестве примера можно привести превращения семи изотопов полония (заряд ядра 84) в разные изотопы свинца (заряд ядра 82): 218Po → 214Pb, 214Po → 210Pb, 210Po → 206Pb, 211Po → 207Pb, 215Po →211Pb, 212Po → 208Pb, 216Po → 212Pb. Изотопы свинца 206Pb 207Pb и 208Pb стабильны, остальные радиоактивны.
Бета-распад наблюдается как у тяжелых, так и у легких ядер, например, у трития. Эти легкие частицы (быстрые электроны) обладают более высокой проникающей способностью. Так, в воздухе β-частицы могут пролететь несколько десятков сантиметров, в жидких и твердых веществах – от долей миллиметра до примерно 1 см. В отличие от α-частиц, энергетический спектр β-лучей не дискретный. Энергия вылетающих из ядра электронов может меняться почти от нуля до некоторого максимального значения, характерного для данного радионуклида. Обычно средняя энергия β-частиц намного меньше, чем у α -частиц; например, энергия β-излучения 228Ra составляет 0,04 МэВ. Но бывают и исключения; так β-излучение короткоживущего нуклида 11Ве несет энергию 11,5 МэВ. Долго было неясно, каким образом из одинаковых атомов одного и того же элемента вылетают частицы с разной скоростью. Когда же стало известно понятно строение атома и атомного ядра, появилась новая загадка: откуда вообще берутся вылетающие из ядра β-частицы – ведь в ядре никаких электронов нет. После того как в 1932 английский физик Джеймс Чедвикомоткрыл нейтрон, отечественные физики Дмитрий Дмитриевич Иваненко (1904–1994) и Игорь Евгеньевич Тамми независимо немецкий физик Вернер Гейзенбергпредположили, что атомные ядра состоят из протонов и нейтронов. В таком случае β-частицы должны образоваться в результате внутриядерного процесса превращения нейтрона в протон и электрон: n → p + e. Масса нейтрона немного превышает суммарную массу протона и электрона, избыток массы, в соответствии с формулой Эйнштейна E= mc2, дает кинетическую энергию вылетающего из ядра электрона, поэтому β-распад наблюдается, в основном, у ядер с избыточным числом нейтронов. Например, нуклид 226Ra – α-излучатель, а все более тяжелые изотопы радия (227Ra, 228Ra, 229Ra и 230Ra) – β-излучатели.
продолжение --PAGE_BREAK--Оставалось выяснить, почему β-частицы, в отличие от α-частиц, имеют сплошной спектр энергии, это означало, что одни из них обладают очень малой энергией, а другие – очень большой (и при этом движутся со скоростью, близкую к скорости света). Более того, суммарная энергия всех этих электронов (она была измерена с помощью калориметра) оказалась меньше, чем разность энергии исходного ядра и продукта его распада. Снова физики с толкнулись с «нарушением» закона сохранения энергии: часть энергии исходного ядра непонятно куда исчезала. Незыблемый физический закон «спас» в 1931 швейцарский физик Вольфганг Паули, который предположил, что при β-распаде из ядра вылетают две частицы: электрон и гипотетическая нейтральная частица – нейтрино с почти нулевой массой, которая и уносит избыток энергии. Непрерывный спектр β-излучения объясняется распределением энергии между электронами и этой частицей. Нейтрино (как потом оказалось, при β-распаде образуется так называемое электронное антинейтрино />) очень слабо взаимодействует с веществом (например, легко пронзает по диаметру земной шар и даже огромную звезду) и потому долго не обнаруживалось – экспериментально свободные нейтрино были зарегистрированы только в 1956 г. Таким образом, уточненная схема бета-распада такова: n → p + />. Количественную теорию β-распада на основе представлений Паули о нейтрино разработал в 1933 итальянский физик Энрико Ферми, он же предложил название нейтрино (по-итальянски «нейтрончик»).
Превращение нейтрона в протон при β-распаде практически не изменяет массу нуклида, но увеличивает заряд ядра на единицу. Следовательно, образуется новый элемент, смещенный в периодической таблице на одну клетку вправо, например: />→ />, />→/>, />→ />и т.д. (одновременно из ядра вылетают электрон и антинейтрино).
2. Другие виды радиоактивности
Помимо альфа- и бета-распадов, известны и другие типы самопроизвольных радиоактивных превращений. В 1938 американский физик Луис Уолтер Альваресоткрыл третий тип радиоактивного превращения – электронный захват (К-захват). В этом случае ядро захватывает электрон с ближайшей к нему энергетической оболочки (К-оболочки). При взаимодействии электрона с протоном образуется нейтрон, а из ядра вылетает нейтрино, уносящее избыток энергии. Превращение протона в нейтрон не изменяет массу нуклида, но уменьшает заряд ядра на единицу. Следовательно, образуется новый элемент, находящийся в периодической таблице на одну клетку левее, например, из />получается стабильный нуклид />(именно на этом примере Альварес открыл этот тип радиоактивности).
При К-захвате в электронной оболочке атома на место исчезнувшего электрона «спускается» электрон с более высокого энергетического уровня, излишек энергии либо выделяется в виде рентгеновского излучения, либо расходуется на вылет из атома более слабо связанных одного или нескольких электронов – так называемых оже-электронов, по имени французского физика Пьера Оже (1899–1993), открывшего этот эффект в 1923 (для выбивания внутренних электронов он использовал ионизирующее излучение).
В 1940 Георгий Николаевич Флеров (1913–1990) и Константин Антонович Петржак (1907–1998) на примере урана открыли самопроизвольное (спонтанное) деление, при котором нестабильное ядро распадается на два более легких ядра, массы которых различаются не очень сильно, например: />→ />+ />+ 2n. Этот тип распада наблюдается только у уранаи более тяжелых элементов – всего более чем у 50 нуклидов. В случае урана спонтанное деление происходит очень медленно: среднее время жизни атома 238U составляет 6,5 миллиарда лет. В 1938 немецкий физик и химик Отто Ган, австрийский радиохимик и физик Лизе Мейтнер (в ее честь назван элемент Mt – мейтнерий) и немецкий физикохимик Фриц Штрассман (1902–1980) обнаружили, что при бомбардировке нейтронами ядра урана делятся на осколки, причем вылетевшие из ядер нейтроны способны вызвать деление соседних ядер урана, что приводит к цепной реакции). Этот процесс сопровождается выделением огромной (по сравнению с химическими реакциями) энергии, что привело к созданию ядерного оружия и строительству АЭС.
В 1934 дочь Марии Кюри Ирэн Жолио-Кюрии ее муж Фредерик Жолио-Кюриоткрыли позитронный распад. В этом процессе один из протонов ядра превращается в нейтрон и антиэлектрон (позитрон) – частицу с той же массой, но положительно заряженную; одновременно из ядра вылетает нейтрино: p → n + e++ 238. Масса ядра при этом не изменяется, а смещение происходит, отличие от β–-распада, влево, β+-распад характерен для ядер с избытком протонов (так называемые нейтронодефицитные ядра). Так, тяжелые изотопы кислорода 19О, 20О и 21О β–-активны, а его легкие изотопы 14О и 15О β+ — активны, например: 14O → 14N + e++ 238. Как античастицы, позитроны сразу же уничтожаются (аннигилируют) при встрече с электронами с образованием двух γ-квантов. Позитронный распад часто конкурирует с К-захватом.
В 1982 была открыта протонная радиоактивность: испускание ядром протона (это возможно лишь для некоторых искусственно полученных ядер, обладающих избыточной энергией). В 1960 физико-химик Виталий Иосифович Гольданский (1923–2001) теоретически предсказал двухпротонную радиоактивность: выбрасывание ядром двух протонов со спаренными спинами. Впервые она наблюдалась в 1970. Очень редко наблюдается и двухнейтронная радиоактивность (обнаружена в 1979).
В 1984 была открыта кластерная радиоактивность (от англ. cluster – гроздь, рой). При этом, в отличие от спонтанного деления, ядро распадается на осколки с сильно отличающимися массами, например, из тяжелого ядра вылетают ядра с массами от 14 до 34. Кластерный распад также наблюдается очень редко, и это в течение длительного времени затрудняло его обнаружение.
Некоторые ядра способны распадаться по разным направлениям. Например, 221Rn на 80% распадается с испусканием α-частиц и на 20% – β-частиц, многие изотопы редкоземельных элементов (137Pr, 141Nd, 141Pm, 142Sm и др.) распадаются либо путем электронного захвата, либо с испусканием позитрона. Различные виды радиоактивных излучений часто (но не всегда) сопровождаются γ-излучением. Происходит это потому, что образующееся ядро может обладать избыточной энергией, от которой оно освобождается путем испускания гамма-квантов. Энергия γ-излучения лежит в широких пределах, так, при распаде 226Ra она равна 0,186 МэВ, а при распаде 11Ве достигает 8 МэВ.
Почти 90% из известных 2500 атомных ядер нестабильны. Нестабильное ядро самопроизвольно превращается в другие ядра с испусканием частиц. Это свойство ядер называется радиоактивностью. У больших ядер нестабильность возникает вследствие конкуренции между притяжением нуклонов ядерными силами и кулоновским отталкиванием протонов. Не существует стабильных ядер с зарядовым числом Z > 83 и массовым числом A > 209. Но радиоактивными могут оказаться и ядра атомов с существенно меньшими значениями чисел Zи A. Если ядро содержит значительно больше протонов, чем нейтронов, то нестабильность обуславливается избытком энергии кулоновского взаимодействия. Ядра, которые содержали бы большой избыток нейтронов над числом протонов, оказываются нестабильными вследствие того, что масса нейтрона превышает массу протона. Увеличение массы ядра приводит к увеличению его энергии.
Явление радиоактивности было открыто в 1896 году французским физиком А. Беккерелем, который обнаружил, что соли урана испускают неизвестное излучение, способное проникать через непрозрачные для света преграды и вызывать почернение фотоэмульсии. Через два года французские физики М. и П. Кюри обнаружили радиоактивность тория и открыли два новых радиоактивных элемента – полоний />и радий />
В последующие годы исследованием природы радиоактивных излучений занимались многие физики, в том числе Э. Резерфорд и его ученики. Было выяснено, что радиоактивные ядра могут испускать частицы трех видов: положительно и отрицательно заряженные и нейтральные. Эти три вида излучений были названы α-, β- и γ-излучениями. Эти три вида радиоактивных излучений сильно отличаются друг от друга по способности ионизировать атомы вещества и, следовательно, по проникающей способности. Наименьшей проникающей способностью обладает α-излучение. В воздухе при нормальных условиях α-лучи проходят путь в несколько сантиметров. β-лучи гораздо меньше поглощаются веществом. Они способны пройти через слой алюминия толщиной в несколько миллиметров. Наибольшей проникающей способностью обладают γ-лучи, способные проходить через слой свинца толщиной 5–10 см.
продолжение --PAGE_BREAK--Во втором десятилетии XX века после открытия Э. Резерфордом ядерного строения атомов было твердо установлено, что радиоактивность – это свойство атомных ядер. Исследования показали, что α-лучи представляют поток α-частиц – ядер гелия, β-лучи – это поток электронов, γ-лучи представляют собой коротковолновое электромагнитное излучение с чрезвычайно малой длиной волны λ < 10–10 м и вследствие этого – ярко выраженными корпускулярными свойствами, т.е. является потоком частиц – γ-квантов.
3. Альфа-распад
Альфа-распадом называется самопроизвольное превращение атомного ядра с числом протонов Zи нейтронов Nв другое (дочернее) ядро, содержащее число протонов Z – 2 и нейтронов N – 2. При этом испускается α-частица – ядро атома гелия />. Примером такого процесса может служить α-распад радия: />Альфа-частицы, испускаемые ядрами атомов радия, использовались Резерфордом в опытах по рассеянию на ядрах тяжелых элементов. Скорость α-частиц, испускаемых при α-распаде ядер радия, измеренная по кривизне траектории в магнитном поле, приблизительно равна 1,5·107 м/с, а соответствующая кинетическая энергия около 7,5·10–13 Дж (приблизительно 4,8 МэВ). Эта величина легко может быть определена по известным значениям масс материнского и дочернего ядер и ядра гелия. Хотя скорость вылетающей α-частицы огромна, но она все же составляет только 5% от скорости света, поэтому при расчете можно пользоваться нерелятивистским выражением для кинетической энергии. Исследования показали, что радиоактивное вещество может испускать α-частицы с несколькими дискретными значениями энергий. Это объясняется тем, что ядра могут находиться, подобно атомам, в разных возбужденных состояниях. В одном из таких возбужденных состояний может оказаться дочернее ядро при α-распаде.
При последующем переходе этого ядра в основное состояние испускается γ-квант. Схема α-распада радия с испусканием α-частиц с двумя значениями кинетических энергий приведена на рис.2. Таким образом, α-распад ядер во многих случаях сопровождается γ-излучением.
В теории α-распада предполагается, что внутри ядер могут образовываться группы, состоящие из двух протонов и двух нейтронов, т.е. α-частица. Материнское ядро является для α-частиц потенциальной ямой, которая ограничена потенциальным барьером. Энергия α-частицы в ядре недостаточна для преодоления этого барьера (рис.3). Вылет α-частицы из ядра оказывается возможным только благодаря квантово-механическому явлению, которое называется туннельным эффектом. Согласно квантовой механике, существуют отличная от нуля вероятность прохождения частицы подпотенциальным барьером. Явление туннелирования имеет вероятностный характер.
4. Бета-распад
При бета-распаде из ядра вылетает электрон. Внутри ядер электроны существовать не могут, они возникают при β-распаде в результате превращения нейтрона в протон. Этот процесс может происходить не только внутри ядра, но и со свободными нейтронами. Среднее время жизни свободного нейтрона составляет около 15 минут. При распаде нейтрон />превращается в протон />и электрон />
Измерения показали, что в этом процессе наблюдается кажущееся нарушение закона сохранения энергии, так как суммарная энергия протона и электрона, возникающих при распаде нейтрона, меньше энергии нейтрона. В 1931 году В. Паули высказал предположение, что при распаде нейтрона выделяется еще одна частица с нулевыми значениями массы и заряда, которая уносит с собой часть энергии. Новая частица получила название нейтрино(маленький нейтрон). Из-за отсутствия у нейтрино заряда и массы эта частица очень слабо взаимодействует с атомами вещества, поэтому ее чрезвычайно трудно обнаружить в эксперименте. Ионизирующая способность нейтрино столь мала, что один акт ионизации в воздухе приходится приблизительно на 500 км пути. Эта частица была обнаружена лишь в 1953 г. В настоящее время известно, что существует несколько разновидностей нейтрино. В процессе распада нейтрона возникает частица, которая называется электронным антинейтрино. Она обозначается символом />. Поэтому реакция распада нейтрона записывается в виде
/>
Аналогичный процесс происходит и внутри ядер при β- распаде. Электрон, образующийся в результате распада одного из ядерных нейтронов, немедленно выбрасывается из «родительского дома» (ядра) с огромной скоростью, которая может отличаться от скорости света лишь на доли процента. Так как распределение энергии, выделяющейся при β-распаде, между электроном, нейтрино и дочерним ядром носит случайный характер, β-электроны могут иметь различные скорости в широком интервале.
При β-распаде зарядовое число Zувеличивается на единицу, а массовое число Aостается неизменным. Дочернее ядро оказывается ядром одного из изотопов элемента, порядковый номер которого в таблице Менделеева на единицу превышает порядковый номер исходного ядра. Типичным примером β-распада может служить превращение изотона тория />возникающего при α-распаде урана />в палладий />
/>
Наряду с электронным β-распадом обнаружен так называемый позитронный β+-распад, при котором из ядра вылетают позитрон />и нейтрино />. Позитрон – это частица-двойник электрона, отличающаяся от него только знаком заряда. Существование позитрона было предсказано выдающимся физиком П. Диракомв 1928 г. Через несколько лет позитрон был обнаружен в составе космических лучей. Позитроны возникают в результате реакции превращения протона в нейтрон по следующей схеме:
/>
5. Гамма-распад
продолжение --PAGE_BREAK--В отличие от α- и β-радиоактивности γ-радиоактивность ядер не связана с изменением внутренней структуры ядра и не сопровождается изменением зарядового или массового чисел. Как при α-, так и при β-распаде дочернее ядро может оказаться в некотором возбужденном состоянии и иметь избыток энергии. Переход ядра из возбужденного состояния в основное сопровождается испусканием одного или нескольких γ-квантов, энергия которых может достигать нескольких МэВ.
6. Закон радиоактивного распада
В любом образце радиоактивного вещества содержится огромное число радиоактивных атомов. Так как радиоактивный распад имеет случайный характер и не зависит от внешних условий, то закон убывания количества N(t) нераспавшихся к данному моменту времени tядер может служить важной статистической характеристикой процесса радиоактивного распада.
Пусть за малый промежуток времени Δtколичество нераспавшихся ядер N(t) изменилось на ΔN < 0. Так как вероятность распада каждого ядра неизменна во времени, что число распадов будет пропорционально количеству ядер N(t) и промежутку времени Δt:
ΔN = –λN(t)Δt.
Коэффициент пропорциональности λ – это вероятность распада ядра за время Δt = 1 с. Эта формула означает, что скорость />изменения функции N(t) прямо пропорциональна самой функции.
/>
Подобная зависимость возникает во многих физических задачах (например, при разряде конденсатора через резистор). Решение этого уравнения приводит к экспоненциальному закону:
N(t) = Ne–λt,
где N– начальное число радиоактивных ядер при t = 0. За время τ = 1 / λ количество нераспавшихся ядер уменьшится в e ≈ 2,7 раза. Величину τ называют средним временем жизнирадиоактивного ядра.
Для практического использования закон радиоактивного распада удобно записать в другом виде, используя в качестве основания число 2, а не e:
N(t) = N · 2–t/T.
Величина Tназывается периодом полураспада. За время Tраспадается половина первоначального количества радиоактивных ядер. Величины Tи τ связаны соотношением
/>
Рис. 4. иллюстрирует закон радиоактивного распада.
/>
Рисунок 4.
Закон радиоактивного распада.
Период полураспада – основная величина, характеризующая скорость радиоактивного распада. Чем меньше период полураспада, тем интенсивнее протекает распад. Так, для урана T ≈ 4,5 млрд. лет, а для радия T ≈ 1600 лет. Поэтому активность радия значительно выше, чем урана. Существуют радиоактивные элементы с периодом полураспада в доли секунды.
При α- и β-радиоактивном распаде дочернее ядро также может оказаться нестабильным. Поэтому возможны серии последовательных радиоактивных распадов, которые заканчиваются образованием стабильных ядер. В природе существует несколько таких серий. Наиболее длинной является серия />состоящая из 14 последовательных распадов (8 – альфа-распадов и 6 бета-распадов). Эта серия заканчивается стабильным изотопом свинца />(рис. 5).
/>
Рисунок 5.
Схема распада радиоактивной серии />Указаны периоды полураспада.
В природе существуют еще несколько радиоактивных серий, аналогичных серии />. Известна также серия, которая начинается с нептуния />не обнаруженного в естественных условиях, и заканчивается на висмуте />. Эта серия радиоактивных распадов возникает в ядерных реакторах.
продолжение --PAGE_BREAK--Правило смещения.Правило смещения точно указывает, какие именно превращения претерпевает химический элемент, испуская радиоактивное излучение.
7. Радиоактивные ряды
Правило смещения позволило проследить превращения естественных радиоактивных элементов и выстроить из них три генеалогических дерева, родоначальниками которых являются уран-238, уран-235 и торий-232. Каждое семейство начинается с чрезвычайно долгоживущего радиоактивного элемента. Урановое семейство, например, возглавляет уран с массовым числом 238 и периодом полураспада 4,5·109лет (в табл. 1 в соответствии с первоначальным названием обозначен как уран I).
Таблица 1. Радиоактивное семейство урана
Радиоактивный элемент
Z
Химический элемент
А
Тип излуче-
ния
Период полурас-
пада
Уран I
92
Уран
238
4,5109лет
Уран X1
90
Торий
234
24,1 сут
Уран X2 Уран Z
91
91
Протактиний
Протактиний
234
234
–(99,88%) (0,12%)
1,14 мин
,7 ч
Уран II
92
Уран
234
2,5105лет
Ионий
90
Торий
230
8104лет
Радий
88
Радий
226
1620 лет
Радон
86
Радон
222
3,8 сут
Радий А
84
Полоний
218
3,05 мин
Радий В
82
Свинец
214
26,8 мин
РадийС
Радий С
83 83
Висмут Висмут
214 214
(99,96%)
(0,04%)
19,7 мин
19,7 мин
Радий С
84
Полоний
214
1,610–4с
Радий С
81
Таллий
210
1,3 мин
Радий D
82
Свинец
210
25 лет
Радий Е
83
Висмут
210
4,85 сут
Радий F
84
Полоний
210
138 сут
Радий G
82
Свинец
206
Стабилен
Семейство урана.На элементах семейства урана можно проследить большинство обсуждавшихся выше свойств радиоактивных превращений. Так, например, у третьего члена семейства наблюдается ядерная изомерия. Уран X2, испуская бета-частицы, превращается в уран II (T = 1,14 мин). Это соответствует бета-распаду возбужденного состояния протактиния-234. Однако в 0,12% случаев возбужденный протактиний-234 (уран X2) излучает гамма-квант и переходит в основное состояние (уран Z). Бета-распад урана Z, также приводящий к образованию урана II, происходит за 6,7 ч.
Радий С интересен тем, что может распадаться двумя путями: испуская либо альфа-, либо бета-частицу. Эти процессы конкурируют между собой, но в 99,96% случаев происходит бета-распад с образованием радия С. В 0,04% случаев радий С испускает альфа-частицу и превращается в радий С (RaC). В свою очередь RaC и RaC путем эмиссии альфа- и бета-частиц соответственно превращаются в радий D.
Изотопы.Среди членов уранового семейства встречаются такие, атомы которых имеют одинаковый атомный номер (одинаковый заряд ядер) и разные массовые числа. Они идентичны по химическим свойствам, но различаются по характеру радиоактивности. Например, радий B, радий D и радий G, имеющие одинаковый со свинцом атомный номер 82, подобны свинцу по химическому поведению. Очевидно, что химические свойства не зависят от массового числа; они определяются строением электронных оболочек атома (следовательно, и Z). С другой стороны, массовое число имеет решающее значение для ядерной стабильности радиоактивных свойств атома. Атомы с одинаковым атомным номером и разными массовыми числами называются изотопами. Изотопы радиоактивных элементов были открыты Ф.Содди в 1913, но вскоре Ф.Астон с помощью масс-спектроскопии доказал, что изотопы имеются и у многих стабильных элементов.
продолжение --PAGE_BREAK--8.Действие радиоактивного излучения на человека
Радиоактивное излучение всех видов (альфа, бета, гамма, нейтроны), а также электромагнитная радиация (рентгеновское излучение) оказывают очень сильное биологическое воздействие на живые организмы, которое заключается в процессах возбуждения и ионизации атомов и молекул, входящих в состав живых клеток. Под действием ионизирующей радиации разрушаются сложные молекулы и клеточные структуры, что приводит к лучевому поражению организма. Поэтому при работе с любым источником радиации необходимо принимать все меры по радиационной защите людей, которые могут попасть в зону действия излучения.
Однако человек может подвергаться действию ионизирующей радиации и в бытовых условиях. Серьезную опасность для здоровья человека может представлять инертный, бесцветный, радиоактивный газ радон />Как видно из схемы, изображенной на рис.5, радон является продуктом α-распада радия и имеет период полураспада T = 3,82 сут. Радий в небольших количествах содержится в почве, в камнях, в различных строительных конструкциях. Несмотря на сравнительно небольшое время жизни, концентрация радона непрерывно восполняется за счет новых распадов ядер радия, поэтому радон может накапливаться в закрытых помещениях. Попадая в легкие, радон испускает α-частицы и превращается в полоний />который не является химически инертным веществом. Далее следует цепь радиоактивных превращений серии урана (рис. 5). По данным Американской комиссии радиационной безопасности и контроля, человек в среднем получает 55% ионизирующей радиации за счет радона и только 11% за счет медицинских обслуживаний. Вклад космических лучей составляет примерно 8%. Общая доза облучения, которую получает человек за жизнь, во много раз меньше предельно допустимой дозы(ПДД), которая устанавливается для людей некоторых профессий, подвергающихся дополнительному облучению ионизирующей радиацией.
9. Применение радиоактивных изотопов
Одним из наиболее выдающихся исследований, проведенных с помощью «меченых атомов», явилось исследование обмена веществ в организмах. Было доказано, что за сравнительно небольшое время организм подвергается почти полному обновлению. Слагающие его атомы заменяются новыми. Лишь железо, как показали опыты по изотопному исследованию крови, является исключением из этого правила. Железо входит в состав гемоглобина красных кровяных шариков. При введении в пищу радиоактивных атомов железа было установлено, что свободный кислород, выделяемый при фотосинтезе, первоначально входил в состав воды, а не углекислого газа. Радиоактивные изотопы применяются в медицине как для постановки диагноза, так и для терапевтических целей. Радиоактивный натрий, вводимый в небольших количествах в кровь, используется для исследования кровообращения, йод интенсивно отлагается в щитовидной железе, особенно при базедовой болезни. Наблюдая с помощью счетчика за отложением радиоактивного йода, можно быстро поставить диагноз. Большие дозы радиоактивного йода вызывают частичное разрушение аномально развивающихся тканей, и поэтому радиоактивный йод используют для лечения базедовой болезни. Интенсивное гамма-излучение кобальта используется при лечении раковых заболеваний (кобальтовая пушка).
Не менее обширны применения радиоактивных изотопов в промышленности. Одним из примеров этого может служить следующий способ контроля износа поршневых колец в двигателях внутреннего сгорания. Облучая поршневое кольцо нейтронами, вызывают в нем ядерные реакции и делают его радиоактивным. При работе двигателя частички материала кольца попадают в смазочное масло. Исследуя уровень радиоактивности масла после определенного времени работы двигателя, определяют износ кольца. Радиоактивные изотопы позволяют судить о диффузии металлов, процессах в доменных печах и т. д.
Мощное гамма-излучение радиоактивных препаратов используют для исследования внутренней структуры металлических отливок с целью обнаружения в них дефектов.
Все более широкое применение получают радиоактивные изотопы в сельском хозяйстве. Облучение семян растений (хлопчатника, капусты, редиса и др.) небольшими дозами гамма-лучей от радиоактивных препаратов приводит к заметному увеличению урожайности. Большие дозы 'радиации вызывают мутации у растений и микроорганизмов, что в отдельных случаях приводит к появлению мутантов с новыми ценными свойствами (радиоселекция). Так выведены ценные сорта пшеницы, фасоли и других культур, а также получены высоко продуктивные микроорганизмы, применяемые в производстве антибиотиков. Гамма-излучение радиоактивных изотопов используется также для борьбы с вредными насекомыми и для консервации пищевых продуктов. Широкое применение получили «меченые атомы» в агротехнике. Например, чтобы выяснить, какое из фосфорных удобрений лучше усваивается растением, помечают различные удобрения радиоактивным фосфором 15 32P. Исследуя затем растения на радиоактивность, можно определить количество усвоенного ими фосфора из разных сортов удобрения.
Интересным применением радиоактивности является метод датирования археологических и геологических находок по концентрации радиоактивных изотопов. Наиболее часто используется радиоуглеродный метод датирования. Нестабильный изотоп углерода />возникает в атмосфере вследствие ядерных реакций, вызываемых космическими лучами. Небольшой процент этого изотопа содержится в воздухе наряду с обычным стабильным изотопом />.Растения и другие организмы потребляют углерод из воздуха, и в них накапливаются оба изотопа в той же пропорции, как и в воздухе. После гибели растений они перестают потреблять углерод и нестабильный изотоп в результате β-распада постепенно превращается в азот />с периодом полураспада 5730 лет. Путем точного измерения относительной концентрации радиоактивного углерода />в останках древних организмов можно определить время их гибели.
Список использованной литературы
1. Учение о радиоактивности. История и современность. М. Наука, 1973 2. Ядерные излучения в науке и технике. М. Наука, 1984 Фурман В. И. 3. Альфа-распад и родственные ядерные реакции. М. Наука, 1985
4. Ландсберг Г. С. Элементарный учебник физики. Том III. – М.: Наука, 1986
5. Селезнев Ю. А. Основы элементарной физики. –
М.: Наука, 1964.
6. CD ROM «Большая энциклопедия Кирилла и Мефодия», 1997.
7. Кюри М., Радиоактивность, пер. с франц., 2 изд., М. — Л., 1960
8. Мурин А.Н., Введение в радиоактивность, Л., 1955
9. Давыдов А.С., Теория атомного ядра, М., 1958
10. Гайсинский М.Н., Ядерная химия и ее приложения, пер. с франц., М., 1961
11. Экспериментальная ядерная физика, под ред. Э. Сегре, пер. с англ., т. 3, М., 1961; Средства сети INTERNET
www.ronl.ru
Изотопы — реферат
Изото́пы (от греч. ισος — «равный», «одинаковый», и τόπος — «место») — разновидности атомов (и ядер) одного химического элемента с разным количеством нейтронов в ядре. Название связано с тем, что изотопы находятся в одном и том же месте (в одной клетке) таблицы Менделеева. Химические свойства атома зависят практически только от строения электронной оболочки, которая, в свою очередь, определяется в основном зарядом ядра Z (то есть количеством протонов в нём) и почти не зависит от его массового числа A (то есть суммарного числа протонов Z и нейтронов N). Все изотопы одного элемента имеют одинаковый заряд ядра, отличаясь лишь числом нейтронов. Обычно изотоп обозначается символом химического элемента, к которому он относится, с добавлением верхнего левого индекса, означающего массовое число (например, 12C, 222Rn). Можно также написать название элемента с добавлением через дефис массового числа (например, углерод-12, радон-222). Некоторые изотопы имеют традиционные собственные названия (например, дейтерий, актинон).
Терминология
Основная позиция ИЮПАК состоит в том, что правильным термином в единственном числе для обозначения атомов (или ядер) одного химического элемента с одинаковой атомной массой является нуклид, а термин изотопы допускается применять для обозначения совокупности нуклидов одного элемента. Термин изотопы был предложен и применялся изначально во множественном числе, поскольку для сравнения необходимо минимум две разновидности атомов. В дальнейшем в практику широко вошло также употребление термина в единственном числе — изотоп. Кроме того, термин во множественном числе часто применяется для обозначения любой совокупности нуклидов, а не только одного элемента, что также некорректно. В настоящее время позиции международных научных организаций не приведены к единообразию и термин изотоп продолжает широко применяться, в том числе и в официальных материалах различных подразделений ИЮПАК и ИЮПАП. Это один из примеров того, как смысл термина, изначально в него заложенный, перестаёт соответствовать понятию, для обозначения которого этот термин используется (другой хрестоматийный пример — атом, который, в противоречии с названием, не является неделимым).
История открытия изотопов
Первое доказательство того, что вещества, имеющие одинаковое химическое поведение, могут иметь различные физические свойства, было получено при исследовании радиоактивных превращений атомов тяжёлых элементов. В 1906—07 выяснилось, что продукт радиоактивного распада урана — ионий и продукт радиоактивного распада тория — радиоторий, имеют те же химические свойства, что и торий, но отличаются от него атомной массой и характеристиками радиоактивного распада. Было обнаружено позднее, что у всех трёх продуктов одинаковы оптические и рентгеновские спектры. Такие вещества, идентичные по химическим свойствам, но различные по массе атомов и некоторым физическим свойствам, по предложению английского учёного Ф. Содди, стали называть изотопами.
Изотопы в природе
Считается, что изотопный состав элементов на Земле одинаков во всех материалах. Некоторые физические процессы в природе приводят к нарушению изотопного состава элементов (природное фракционирование изотопов, характерное для лёгких элементов, а также изотопные сдвиги при распаде природных долгоживущих изотопов). Постепенное накопление в минералах ядер — продуктов распада некоторых долгоживущих нуклидов используется в ядерной геохронологии.
Применение изотопов человеком
В технологической деятельности люди научились изменять изотопный состав элементов для получения каких-либо специфических свойств материалов. Например, 235U способен к цепной реакции деления тепловыми нейтронами и может использоваться в качестве топлива для ядерных реакторов или ядерного оружия. Однако в природном уране лишь 0,72 % этого нуклида, тогда как цепная реакция практически осуществима лишь при содержании 235U не менее 3 %. В связи с близостью физико-химических свойств изотопов тяжёлых элементов, процедура изотопного обогащения урана является крайне сложной технологической задачей, которая доступна лишь десятку государств в мире. Во многих отраслях науки и техники (например, в радиоиммунном анализе) используются изотопные метки.
Источники природной радиоактивности
Природная радиоактивность обусловлена радиоактивными изотопами естественного происхождения, присутствующими во всех оболочках земли — литосфере, гидросфере, атмосфере и биосфере. Сохранившиеся на нашей планете радиоактивные элементы условно могут быть разделены на три группы.
1. Радиоактивные изотопы, входящие в состав радиоактивных семейств, родоначальниками которых являются уран (U238), торий (Th332) и актиний–уран (AcU235).
2. Генетически не связанные с ними радиоактивные элементы: калий (К40), кальций (Ca48), рубидий (Rb87) и др.
3. Радиоактивные изотопы, непрерывно возникающие на земле в результате ядерных реакций, под воздействием космических лучей. Наиболее важные из них — углерод (С14) и тритий (Н3).
Естественные радиоактивные вещества широко распространены во внешней среде. Это в основном долгоживущие изотопы с периодом полураспада 108–1016 лет. В процессе распада они испускают a- и b-частицы, а также g-лучи.
Главным источником поступающих во внешнюю среду естественных радиоактивных веществ, к настоящему времени широко распространенных во всех оболочках земли, являются горные породы, происхождение которых неразрывно связано с включением в их состав всех радиоактивных элементов, возникших в период формирования и развития планеты. Благодаря деструктивным процессам метеорологического, гидрологического, геохимического и вулканического характера, происходящих непрерывно, радиоактивные вещества подверглись широкому рассеиванию.
Естественная радиоактивность растений и пищевых продуктов обусловлена поглощением ими радиоактивных веществ из окружающей среды. Из естественных радиоактивных веществ наибольшую удельную активность в растениях составляет К40, особенно в бобовых растениях. Многие наземные растения, особенно водоросли, обладают способностью концентрировать в своих тканях радий из почв и воды, некоторые накапливают уран. Анализы различных продуктов питания показали, что радий постоянно присутствует в хлебе, овощах, мясе, рыбе и других продуктах питания.
Сельскохозяйственные животные за свою жизнь поедают растительные корма с больших площадей. Вместе с кормом в их организм поступают радиоактивные продукты деления, которые в небольших количествах не приводят к регистрируемым поражениям организма. В животных организмах К40 обычно содержится меньше, чем в растениях. U238, Th332 и С14 по сравнению с К40 встречаются в биологических объектах в очень незначительных концентрациях.
Источники искусственной радиоактивности
Кроме естественных радиоактивных изотопов, существующих в природной смеси элементов, известно много искусственных, полученных в результате различных ядерных реакций (облучение устойчивых химических элементов потоками нейтронов в ядерных реакторах или бомбардировка их тяжелыми частицами — протонами, a-частицами и др.) или же образующихся в результате ядерных взрывов. При ядерном взрыве образуется большое количество радиоактивных веществ как в результате процессов деления, так и при реакции синтеза легких ядер.
Из радиоактивных продуктов деления наибольшую опасность представляют Sr90 и Cs137. Они имеют относительную высокую энергию излучения и большой период полураспада, исключительную способность включаться в биологический круговорот веществ, а также долго задерживаться в организме животных и человека.
freepapers.ru
Реферат на тему Радиоактивные изотопы и соединения
Радиоактивные изотопы и соединения, меченные радиоактивными изотопами, широко применяются в самых разных областях человеческой деятельности. Промышленность и технологический контроль, сельское хозяйство и медицина, средства связи и научные исследования — охватить весь спектр применения радиоактивных изотопов практически невозможно, хотя все они возникли чуть более, чем за 100 лет. Представленный ниже материал посвящён использованию радиоактивных изотопов в различных молекулярно-биологических исследованиях и является учебно-методическим пособием, а не строгой научной публикацией. К сожалению, значительная часть начинающих молодых ученых, работающих в области life science, представляет себе специфику работ с радиоактивными веществами поверхностно и фрагментарно. Это неудивительно, так как в России образование на медицинских и биологических факультетах не дает ни основных теоретических представлений о радиоактивности, ни практических навыков в этой области. У химиков ситуация лучше, потому что некоторые основные понятия о природе радиоактивности входят в учебную программу.Хотя представленный материал рассчитан на малоподготовленного читателя, надеюсь, что он может оказаться полезным и для профессионалов.1. Основные понятия и терминологияРадиоактивность (radioactivity) — это обозначение удивительного явления природы, открытого Беккерелем в конце XIX века, суть которого заключается в самопроизвольном спонтанном превращении атомных ядер некоторых элементов в другие, которое сопровождается выделением трёх видов "лучей". Природу лучей установили быстро: α-лучи — это двукратно ионизированные атомы гелия, β-лучи — это электроны, γ-лучи — это жесткое коротковолновое электромагнитное излучение. Элементы, способные к таким превращениям стали называться радиоактивными, т.е. способными к этому превращению. В зависимости от типа излучения, радиоактивные атомы стали определять соответственно как α, β или γ излучатели или источники. Правда, вскоре было установлено, что некоторые радиоактивные атомы излучают сразу два (а возможно, и три) вида лучей, поэтому такая классификация дополняется пояснениями — это "чистый" α-излучатель или имеется сопутствующее γ-излучение. К первоначальным трём типам ядерных превращений (α, β и γ — радиоактивный распад) добавились новые, однако, общие закономерности для всех остались неизменными. В конце ХХ века было рекомендовано термин "изотоп" заменить на "нуклид" и, соответственно, "радиоактивный изотоп" на "радионуклид". Особенно широкого распространения это нововведение не получило, и оба термина используются в научной литературе как синонимы.Количественная характеристика радиоактивности получила у физиков название "активность" (activity). Так как физикам никто не давал монопольного права на термин "активность", то со временем выяснилось, что в разных областях науки под "активностью" понимают совсем разные понятия. Сравните: активность радиоактивного изотопа, химическая активность элемента или соединения, энзимологическая активность фермента, биологическая (например, антивирусная) активность препарата — всё это совершенно различные понятия. Сближение различных научных дисциплин ещё больше запутывает положение. Попробуйте охарактеризовать фермент, меченный радиоактивным изотопом углерода-14. Активность такого фермента — это его энзимологическая характеристика или радиоактивная? Поэтому в современной научной литературе (особенно биологической) все чаще термин "активность" для радиоактивных веществ заменяется термином "радиоактивность".За единицу активности (радиоактивности) радиоактивного вещества в Международной системе СИ принята скорость радиоактивного распада, равная 1 распаду в секунду, которая получила название беккерель — Бк (в английской версии Bq). Устаревшая, но по-прежнему используемая единица активности кюри — Ки (в английской версии Ci) — это активность препарата, эквивалентная активности 1 г металлического радия-226 и равная 3,7х1010 распадов в секунду, т.е. 3,7х1010 Бк.Строго говоря, радиоактивный распад — это превращение ядра атома радиоактивного элемента, которое сопровождается выделением продуктов такого превращения. Например, электронный захват представляет собой поглощение электрона ядром с выделением γ-кванта, и такой тип "радиоактивного распада" более точно следует называть "ядерным превращением". Впрочем, оба термина используются в литературе на равных, несмотря на предпочтительность "ядерного превращения".Основной закон радиоактивного распада описывается замечательной формулой:Nt = N0e-λtгде: Nt — количество распавшихся радиоактивных атомов; N0 — начальное количество радиоактивных атомов; е — основание натурального логарифма; λ — константа скорости радиоактивного распада; t — время.На практике для работы ею никто не пользуется, однако, из этой формулы следует сразу несколько довольно простых, но очень важных выводов и следствий, которые надо знать всем работающим с радиоактивными изотопами:1. Количество радиоактивных атомов, распавшихся за некоторое время наблюдения, зависит только от их исходного количества и времени наблюдения (распада). Никакие другие параметры: астрономические, физические, химические, парапсихологические и "волшебные" на радиоактивный распад не влияют. Константа скорости радиоактивного распада [ λ ] (иногда ее называют константой распада) определяется только природой изотопа и для каждого изотопа имеет свою величину. Все попытки замедлить радиоактивный распад охлаждением (даже в жидком азоте) или ускорить распад нагреванием абсолютно бессмысленны. Вы можете влиять на стабильность химического соединения, меняя температуру его хранения, но количество радиоактивных атомов в препарате при этом не изменится.2. Скорость радиоактивного распада меняется по экспоненте (т.е. нелинейно), и рассчитывать количество радиоактивного материала в вашем препарате надо с учетом этого факта, пользуясь либо вышеприведенной формулой, либо соответствующими таблицами распада (что обычно и делают на практике).3. Представьте себе, что в формуле радиоактивного распада Nt = 1/2 N0 , т.е. распалась ровно половина радиоактивных атомов, содержащихся в препарате. Время этого процесса — константа Т1\2 — называется периодом полураспада. Физический смысл — время, за которое распадается половина радиоактивных атомов данного изотопа. Эта величина весьма полезна для работающих с радиоактивностью, т.к. позволяет быстро оценить "потери на распад" препарата.4. Физический смысл константы скорости радиоактивного распада [ λ ] — это активность 1 моля (или ммоля) 100% радиоактивного изотопа и соответственно размерность этой константы — Бк/моль (Bq/mol) или Ки/ммоль (Ci/mmol). То есть, это теоретически достижимая молярная активность (активность одного моля радиоактивного вещества), знание которой позволяет оценить чувствительность метода и качество радиоактивного препарата. Ниже об этом будет сказано подробнее.2. Детекция и количественные измерения радионуклидовДетектирование радиоактивного распада основано на его различных физических свойствах: 5. способность взаимодействовать с кристаллами бромистого серебра, засвечивая светочувствительные материалы, — авторадиография,6. способность вызывать "свечение" при столкновении продуктов распада с некоторыми веществами — сцинтилляция,7. способность ионизировать молекулы окружающей среды продуктами радиоактивного распада — ионизация,8. способность вызывать дефекты в кристаллических решетках,9. способность осуществлять (или катализировать) некоторые химические реакции.Все эти способности были задействованы при создании различных измерительных приборов и индикаторов различного назначения. Однако, для измерения активности, т.е. количества ядерных превращений в единицу времени, наиболее широкое распространение получили приборы, основанные на использовании сцинтилляции или ионизации. При этом в life science используют, как правило, сцинтилляционные приборы и авторадиографию, а для физических, инженерных и медицинских работ — приборы, измеряющие ионизацию среды. Впрочем, такое разделение весьма условно, так как разнообразных приборов и средств измерений было создано за 100 лет очень много.Следует особо выделить приборы для измерения ионизирующей способности излучения. Это важнейшая составляющая контроля за облучением персонала, работающего с источниками ионизирующего излучения (в том числе и с радиоактивными веществами). Контроль за радиационной обстановкой осуществляется по особым правилам, и краткая информация о нормах радиационной опасности и единицах, в которых эти нормы установлены. Пока следует подчеркнуть, что активность радиоактивного препарата и радиационная обстановка возле этого препарата — это совершенно разные характеристики, например, как масса вещества и его твердость. Единицы активности (Бк или Ки) говорят о количестве ядерных превращений в единицу времени. Наиболее популярная единица экспозиционной дозы для γ- (рентгеновского) излучения — рентген (Р) — говорит о величине потока ионизирующего излучения (потока энергии), проходящего через слой сухого воздуха и вызывающего ионизацию определенного числа молекул воздуха. Поэтому никакой прямой связи между этими величинами нет. Большая часть радионуклидов, которые используются в life science (об этом ниже), вообще никак не может быть охарактеризована термином экспозиционная доза, который введен для γ- (рентгеновского) излучения.2.1. АвторадиографияЭто исторически самый первый и, по-прежнему, весьма популярный метод детекции различных радионуклидов. Главное преимущество авторадиографии — простота и доступность. Выдержите (проэкспонируйте) образец с рентгеновской пленкой, затем проявите пленку в стандартных условиях — и получите картину распределения радионуклида по поверхности образца: геля, тонкослойной хроматограммы и т.д.Если полученная "картинка" вас не устраивает — можно повторить экспозицию с новой пленкой, увеличивая (или уменьшая) время по своему желанию. Обычно время экспозиции меняют в 2ч3 раза, так как изменение времени экспозиции на 20ч30% существенных изменений в картину не вносит.Весь сиквенс ДНК и РНК с радиоактивным фосфором использовал исключительно авторадиографию. Флюоресцентная метка практически полностью вытеснила радиоактивные изотопы из секвенирования, однако авторадиография остается широко применяемым методом детекции.Главный недостаток авторадиографии — сложности с количественной оценкой. При визуальном определении даже интуитивно ясно, что интенсивность "почернения" пленки пропорциональна количеству радиоактивных атомов в этом месте. Но вопрос об этой "пропорциональности" нуждается в пояснении. Существует несколько типов сканеров, позволяющих довольно точно определять интенсивность "зачернения" пленки и, следовательно, сравнивать пятна инструментально, а не "на глаз". Оказалось, что диапазон активности препарата, в котором интенсивность "зачернения" пленки прямо пропорциональна количеству радиоактивных атомов, очень невелик и зависит от времени экспозиции образца с пленкой, типа пленки, природы радионуклида (тип распада и энергия излучения) и даже от режима обработки пленки. Например, для фосфора-32 за ночь экспозиции линейная зависимость "зачернения" пленки от активности образца находится в диапазоне 0,5ч25 Бк на мм2 (примерно 30ч1500 имп/мин). Дальнейшее увеличение активности образца, например, до 100 Бк на мм2 не приводит к большей интенсивности "зачернения" — всё уже "зашкалило".Поэтому, простой совет для начинающих работать с количественной авторадиографией. Сделайте несколько калибровок — нанесите ряд пятен диаметром 1ч1,5 мм с активностью 1 · 3 · 10 · 30 · 100 · 300 Бк, проэкспонируйте их с рентгеновской пленкой различное время и после обработки пленки просканируйте её на своем приборе. Вы сразу определите диапазон, в котором ваши последующие количественные измерения радиоавтографов будут корректными. Для разных радионуклидов такой диапазон различается очень существенно, но учитывать его надо в любом случае.Для увеличения чувствительности авторадиографии (точнее, для уменьшения времени экспозиции) можно воспользоваться усиливающими экранами. Это весьма эффективно для фосфора-32 или йода-125, однако практически бесполезно для мягких (слабоэнергетических) β-излучателей. Использование экрана для фосфора-32 позволяет снизить время экспозиции в 2ч3 раза, но за это приходится "платить" ухудшением разрешения, которое происходит за счет "размывания зон".2.2. Сцинтилляционные счетчикиЭффект сцинтилляции для количественного определения радионуклидов начинали использовать еще во времена Резерфорда, который визуально считал сцинтилляционные вспышки под микроскопом. За сто лет принципиальных изменений не произошло. Рядом с источником излучения помещают сцинтиллятор и ФЭУ (фотоэлектронный умножитель), который считает вспышки. Сцинтиллятор может быть твердым, а может быть и жидким (чаще, растворенным в жидкости). Во флакон (vial) с жидким сцинтиллятором добавляют тестируемый образец, и в этом случае можно эффективно измерять даже самое "слабое", низкоэнергетическое излучение.При измерении активности (радиоактивности) любых образцов и для любых средств измерения необходимо помнить несколько простых, но важных правил: 10. Радиоактивный распад является классическим примером случайного, вероятностного природного процесса и, рассматривая измерение активности как регистрацию случайных событий, мы получаем математическую ошибку измерения активности:n1/2/n x 100%где n — число "событий" (в нашем случае распадов) Например, для 400 зарегистрированных импульсов на любом приборе независимо от времени измерения (наблюдения) 4001/2 / 400 х 100% = 5%, т.е. ошибка 5%. Это означает, что чем больше число измерений (собственно счет), тем меньше математическая ошибка измерения. Более того, вопреки устоявшейся традиции, для снижения математической ошибки измерения надо считать не число зарегистрированных прибором распадов (импульсов) за единицу времени, а время, необходимое для "накопления нужного" числа импульсов — например, 10000 имп. Тем не менее, во всем мире активность с помощью счетчиков измеряют как количество импульсов за единицу времени (обычно по 1 минуте).11. Все счетчики имеют верхний предел измерения, после которого их точность падает, так как счетчик не успевает регистрировать — "захлебывается". Для сцинтилляционных счетчиков — это активность на уровне 106ч107 расп./мин. Некоторые типы счетчиков имеют встроенную блокировку и отказываются считать образцы, активность которых превышает установленную для данной модели. Оптимальная активность образца для точного измерения 104ч106 расп./мин.
12. Проводя количественные измерения, например, определяя концентрацию радионуклида в растворе, всегда делайте хотя бы 2, а лучше 3 измерения независимых аликвот и активность определяйте как среднюю из 2 — 3 измерений. Затраты времени на "лишние" процедуры будут с лихвой компенсированы отсечением случайных "выбросов". Разброс в измерениях, особенно у начинающих исследователей, может достигать 200% и более, хотя в норме не должен превышать обычную ошибку рутинного отбора аликвот. 13. Ни один измерительный прибор не регистрирует 100% всех "распадов" (decompositions) в измеряемом образце. Эффективность счета — это коэффициент, который связывает зарегистрированные прибором импульсы (counts) и реальные распады (decompositions). Поэтому для любого измерения распады/мин. (dpm — decompositions per min.) больше импульсов/мин. (cpm — counts per min.). Правда, для большинства радионуклидов, применяемых в life science, эффективность жидкостного сцинтилляционного счета составляет более 90%. Однако, тритий удается измерять с эффективность не более 50ч60%. Обычно эффективность счета для каждого радионуклида указывается в технической документации к прибору, и долгое время негласное соревнование между фирмами за более высокую эффективность счета трития было чуть ли не главным двигателем технического прогресса в этой области. 14. Все измерительные приборы имеют собственный "фон" — регистрируют какое-то количество импульсов без источника ионизирующего излучения (радиоактивного препарата). Природа фона различна: космическое излучение, электронный шум, содержание природных радионуклидов в помещении, где установлена измерительная аппаратура и т.д. Поэтому минимально достоверная величина активности, измеряемая прибором, увязывается с фоном и обычно принимается равной трехкратному превышению фона данного прибора. Если в вашем "эпохальном" эксперименте активность "главного" образца едва-едва превышает фон, попытайтесь увеличить время измерения (можно до 20 мин.) — тогда достоверность измерения возрастёт. 15. В большинстве случаев в life science абсолютные измерения активности не нужны, и гораздо важнее получить информацию об относительной активности образцов: распределение активности по гелю, хроматографической пластинке или по элюированным с колонки продуктам; доля субстрата, превратившегося в продукт под действием фермента; доля лиганда, связанного с рецептором; детекция продуктов метаболизма соединения, меченного радионуклидом, и другие аналогичные задачи. Поэтому очень важно, чтобы условия приготовления и измерения образцов в конкретном эксперименте были одинаковыми, тогда абсолютные погрешности в измерениях не окажут существенного влияния на биологические результаты. Наиболее ярко эту относительность измерений иллюстрирует широкое использование минимониторов — приборов, предназначенных для определения загрязнения поверхностей рабочих столов, одежды и т.д. Небольшие карманные приборы, имеющие ионизационный счетчик (обычно это ионизационная камера или счетчик Гейгера), оказались очень удобными для детекции меченного фосфором-32 фрагмента ДНК в агарозном геле или меченного йодом-125 белка в ПААГ и т.п. Некоторые ухитряются по показаниям такого прибора оценивать включение меченых предшественников биосинтеза в биополимеры после разделения продуктов реакции, используют мониторы для измерения активности образцов на фильтрах, кусках фильтровальной или хроматографической бумаги и даже в пробирках. Это удобно и полезно для качественных и полуколичественных оценок, но следует помнить , что приборные ошибки в таких измерениях могут быть очень значительными и достигать 200—300%. Жидкостные сцинтилляционные счетчики уже многие годы остаются главным инструментом для количественного измерения радионуклидов в life science. Несмотря на разнообразие конструкций, с точки зрения пользователя, все они измеряют активность образцов, помещенных в специальный стеклянный или пластиковый флакон и заполненный жидким сцинтиллятором. Поскольку измерение активности сводится к подсчету вспышек света, жидкость во флаконе должна быть прозрачная для счета и гомогенная по составу. Все отклонения от этого требования снижают эффективность счета, причем иногда существенно. Образование осадка или двухфазной несмешивающейся жидкой системы, наличие образцов биологических тканей или фильтровальных материалов — все эти факторы снижают эффективность счета. То же самое касается добавок многих химических веществ: кислот, щелочей, концентрированных растворов сахаров, солей, мочевины и многое другое. Особенно это касается измерений трития, где разница в эффективности счета для гомогенного, почти идеального, образца и образца, нанесенного на хроматографический сорбент, может быть в 10ч30 раз и даже больше. Это необходимо учитывать, если при составлении баланса по активности вдруг куда-то исчезнет часть радиоактивного материала или откуда-то внезапно появится "лишнее". Составы сцинтилляторов весьма разнообразны и фирмы, производящие сцинтилляционные коктейли, часто не раскрывают их состав. Классический (едва ли не самым первый) жидкий сцинтиллятор — это толуольный раствор 2,5-дифенилоксазола (РРО) с добавкой 1,4-ди-[2-фенил-(5-окзазолил)]-бензола (РОРОР). Состав: 4 г РРО и 0,2 г РОРОР на 1 л толуола. Не вдаваясь в подробности, следует подчеркнуть, что это — неводная система, а водные растворы считать в таком сцинтилляторе не принято. Для измерения водных проб к такому сцинтиллятору добавляют тритон Х-100 до 30% по объему. Другим вариантом "водолюбивого" сцинтиллятора является диоксановый: 60 г нафталина, 4 г РРО, 0,2 г РОРОР, 200 мл спирта и до 1 л диоксан марки "сцинтиляционный". Впрочем, большинство исследователей сегодня успешно пользуются готовыми фирменными коктейлями, справедливо не задумываясь над их составом. Важными источниками ошибок для жидкостного сцинтилляционного счета являются "засветка" сцинтилляционной жидкости и электризация счетных флаконов. Оба эффекта легко нейтрализуются во времени (не спешите сразу считать, дайте пробам постоять в темном пространстве прибора несколько минут), кроме того, электризация почему-то чаще проявляется на стеклянных флаконах, и реже — на одноразовых пластиковых. Внедрение в технологию биоскрининга радиометрических методов анализа подвигло разработчиков на создание высокопроизводительных сцинтилляционных счетчиков для измерения активности в планшетах. Для радиоактивных изотопов фосфора прибор используется в модификации с внешним твердым сцинтиллятором, который и является детектором. Для трития твердый сцинтиллятор добавляют прямо в лунку планшета в виде специальных бусинок и, так как эти бусинки являются одновременно компонентом биохимической реакции, то связанный с "бусами" меченый тритием лиганд считается сцинтиллятором, а не связанный, находящийся в растворе, — не считается. С радиохимической точки зрения эффективность счета в таких измерениях очень низкая, но для биоскрининга важно относительное распределение меченых соединений в системе "связанный-несвязанный", а высокая производительность и простота операций оправдывают колоссальные затраты на реализацию таких методов. 2.3. Иммиджеры Очень полезной и эффективной оказалась "электронная авторадиография", возникшая сравнительно недавно, как результат развития микроэлектроники и компьютерной техники. Фосфоимиджер — прибор для "электронной авторадиографии" фосфора-32. Кассета с многократно используемым экраном экспонируется с плоским образцом: гелем, хроматографической пластинкой и т.п. Затем экран помещается в прибор, в котором с помощью лазерного сканирования определяется местоположение и активность радиоактивного материала, экспонировавшегося с экраном. Другая вариация на эту тему — это использование газопроточных счетчиков для "электронной авторадиографии". Представьте себе щетку для одежды, каждый волосок которой диаметром 0,2 мм является индивидуальным газопроточным счетчиком. Если вы совместите такую "щетку" общим размером 18 х 24 см с исследуемым плоским образцом, то на экране компьютера в реальном времени вы сможете наблюдать количественную картинку распределения "радиоактивных веществ" на плоскости вашего образца. Разные модификации такого прибора позволяют работать практически со всеми радионуклидами, которые применяются в life science. Эффективность счета в этих приборах, конечно, не может быть высокой, однако для практической работы в life science этот недостаток с лихвой компенсируется быстротой и удобством "электронной авторадиографии", а также возможностью получения результата сразу в электронном виде. 3. Классификация и номенклатура Все радиоактивные источники с технологической точки зрения делятся на закрытые и открытые. Закрытые источники — это радиоактивные препараты, помещенные в специальную защитную герметичную упаковку (как правило стальную), — предназначены для работ без вскрытия защитной оболочки. В молекулярно-биологических и биохимических исследованиях используют открытые источники — твердые, жидкие или газообразные радиоактивные вещества или их растворы. Практически все радиоактивные препараты, применяемые в life science — это растворы соединений, меченных радиоактивными изотопами. Для обозначения конкретного изотопа (в том числе и радиоактивного), согласно правилам номенклатуры, перед химическим символом элемента ставится надстрочечное число, обозначающее массу изотопа. Например, 14С — изотоп углерода с массой 14. В литературе допускается полное написание химического элемента и его массы через дефис, например, углерод-14. Обратите внимание, что пишется 14С, а произносится обычно С-14, т.е. для любого изотопа при написании первым всегда указывается массовое число изотопа над строкой, а затем символ химического элемента, а произносят наоборот: сначала элемент, затем масса изотопа. Соединения, меченные радиоактивными изотопами, делят на две группы веществ. Во-первых, это конкретные химические соединения, у которых один атом (или несколько) заменён на атом радиоактивного изотопа того же элемента, т.е. химически такое соединение идентично "немеченому". Во-вторых, это молекулы соединений, модифицированные с помощью радиоактивного фрагмента (или дополнительного радиоактивного атома), которые отличаются от исходного немеченого соединения. К последнему случаю относятся всевозможные конъюгаты и модификации биологических макромолекул с неопределенным местоположением радиоактивного атома, например, молекула иммуноглобулина с введенным изотопом радиоактивного йода-125. Более подробно об этом ниже. Для обозначения меченых соединений первой группы принято в обычное химическое наименование молекулы вставлять в квадратных скобках наименование изотопа, которым мечено соединение, и его место в молекуле перед названием части молекулы, содержащей меченый атом. В качестве примера ниже приведены наименования тимидин-5'-трифосфата, меченного различными радионуклидами и в разных положениях: 16. [6-3H] тимидин-5' трифосфат 17. [метил-3H] тимидин-5' трифосфат 18. [U-3H] тимидин-5' трифосфат 19. [5'-3H] тимидин-5' трифосфат 20. [6,2',3'-3H] тимидин-5' трифосфат 21. [2-14С] тимидин-5' трифосфат 22. [U-14С] тимидин-5' трифосфат 23. тимидин -5' [α-32P] трифосфат 24. тимидин -5' [γ-32P] трифосфат В примерах 3 и 7 место радиоактивного атома в молекуле обозначено U — это означает, что точное место радиоактивного атома неизвестно и, возможно, речь идет о равномерно меченой молекуле. Обычно такое бывает, если способ получения соединения заключался в выращивании микроорганизма на среде, обогащённой целевым изотопом, с последующим выделением нужного соединения из клеточного лизата. Подробнее методы получения меченых соединений обсуждаются в других разделах. В примерах 8 и 9 α и γ — это не тип радиоактивного распада, а местоположение радиоактивных атомов фосфора-32 в трифосфатной группе. Для наименования второй группы соединений обозначение радионуклида в квадратных скобках выносят перед наименованием молекулы: [125I]-альбумин — альбумин, меченный йодом-125 или [метил -3H]-альбумин — альбумин, меченный тритием за счет метилирования молекулы [3H]-метильной группой йодистого метила. 4. Основные радионуклиды в life science Список радиоактивных изотопов, которые используются в life science, вообще крайне ограничен самой природой. В состав органических соединений входят водород, углерод, кислород, азот, а также гораздо реже фосфор и сера. Следовательно, для получения немодифицированных меченых соединений круг возможных радионуклидов ограничен этими биогенными элементами. Их характеристики приведены в таблице 1.
| ||||||||||||||||||||||||||||||||||||||||||||
Схема распада углерода-14: 14C —> 14N + e. Хотя с детекцией 14C особых проблем не возникает, применение 14C-соединений в life science крайне ограничено. Это связано с очень низкой молярной активностью 14C-соединений, и даже кратно меченые молекулы не меняют ситуацию радикально. Обычно молярная активность 14C-соединений не превышает 20ч50 мКи/ммоль, (у соединений трития почти в 1000 раз выше, а у фосфора-32 или 33 еще в 100 раз выше) и, следовательно, по чувствительности методы с использованием 14C-соединений значительно уступают методам, в которых используют 3Н-соединения. На сегодняшний день 14C-соединения прочно удерживают за собой только одну "нишу" в life science — это изучение метаболизма новых лекарственных (или косметических) препаратов. Для изучения деградации, накопления в органах, скорости и путей выведения, биодоступности и прочих аспектов метаболизма равномерно меченые 14C-соединения остаются востребованными, несмотря на очень высокую стоимость и трудоемкость синтеза.8. Радионуклиды 32P и 33PРадионуклиды 32P и 33P — очень удобны для life science, но их применение ограничено природой, т.к. фосфор в природных органических соединениях присутствует гораздо реже, чем водород, углерод или кислород.Получение радиоактивных изотопов фосфора (32Р и 33Р) с технической точки зрения одинаково: облучение элементарной серы особой чистоты в ядерном реакторе.Однако, с экономической точки зрения разница колоссальная. Дело в том, что 32Р получают по реакции 32S + 0n —> 32P + 1p в виде 32P-ортофосфата. Стартовый материал мишени — природная элементарная сера, содержащая более 92% стабильного изотопа 32S. Изотоп 33Р получают по реакции 33S + 0n —> 33P + 1p также в виде 33P-ортофосфата. Но мишенью для этой реакции служит изотоп 33S, содержание которого в природе составляет доли процента. Для получения 33Р высокого качества необходимо использовать для облучения только 33S с обогащением не ниже 98,5ч99,0%. Это сразу существенно увеличивает стоимость продукта, т.к. стоимость обогащенной серы-33 больше природной серы примерно на 6 порядков (в миллион раз). Поэтому соединения фосфора-33 всегда будут дороже аналогичных соединений, меченных фосфором-32.Схемы распада радионуклидов фосфора : 32P —> 32S + e и 33P —> 33S + e Исходным радиоактивным сырьем для получения соединений, меченных радиоактивными изотопами фосфора, всегда является ортофосфорная кислота (32Р или 33Р соответственно). Так как химия и биохимия 32Р и 33Р абсолютно одинаковы, в дальнейшем речь пойдет о фосфоре-32, с учетом того, что все это распространяется и на фосфор-33. В особых случаях, когда необходимо, будут отмечаться различия. Собственно сама 32Р-орто-фосфорная кислота в life science используется редко. Обычно это выращивание микроорганизмов (бактерий или дрожжей) или культуры клеток в среде, содержащей 32Р-ортофосфат. Полученную меченую биомассу отделяют от культуральной жидкости, а затем исследуют. Несколько замечаний по этому процессу.36. Исходная 32Р-ортофосфорная кислота без носителя (этот термин означает, что в препарат не добавляли специально нерадиоактивную ортофосфорную кислоту) имеет молярную активность не менее 5000 Ки/ммоль, и, соответственно, концентрация собственно фосфата в среде только за счет радиоактивного фосфора будет не выше 10-8 М. Для биологических (микробиологических) работ такая концентрация фосфата в среде слишком низкая — клетки будут "считать", что фосфора нет вообще. Поэтому в культуральную среду обязательно добавляется "холодный" фосфат в концентрации, необходимой для усваивания. Обычно это не ниже 10-4 М. Не пытайтесь "включить" радиоактивный фосфат в культуру клеток без "холодного" носителя. Часть радиоактивного фосфата просто сорбируется на поверхности посуды или клеток, а включения в клеточный обмен не произойдет.37. Оптимальная концентрация фосфата для таких экспериментов подбирается индивидуально для разных задач и видов клеток. "Переносить" данные по оптимальной концентрации с одного вида экспериментов (или клеток) на другой надо осторожно.Основными соединениями фосфора-32, применяемыми в life science, являются нуклеозид-5'-трифосфаты, меченные в альфа или гамма положении. В конце 60-х — начале 80-х годов ХХ века было разработано несколько способов синтеза этих соединений, но после работы Джонсона и Валсеса, предложенный ими ферментативный способ стал рутиной как для лабораторного синтеза, так и для масштабного производства. Химические методы синтеза меченных фосфором-32 соединений используются, когда нет ферментативного пути, например для синтеза синтетических аналогов нуклеотидов.Измерение активности радионуклидов 32Р и 33Р — операция достаточно простая — любой жидкостной сцинтилляционный β-счетчик считает 32Р и 33Р с эффективностью не ниже 90%. Для фосфора-32 использование сцинтиллятора совсем не обязательно. Обычно измерение фосфора-32 проводят за счет "свечения Черенкова" — эффекта, обусловленного взаимодействием высокоэнергетических электронов с окружающей средой. Не вдаваясь в физические аспекты Черенковского свечения, следует знать, что сцинтилляционные счетчики "считают" фосфор-32 без всякого сцинтиллятора с эффективностью около 30%. Черенковское свечение фосфора-32 можно легко увидеть. Нанесите на подложку (пластинку ТСХ или фильтровальную бумагу) 1 мкл раствора 32Р-ортофосфорной кислоты (или любого другого соединения фосфора-32) с активностью 50 мкКи (около 2МБк) и поместите подложку между плоскостями двух кусков обычного стекла, толщиной 4ч5 мм. В темноте (только без "красного" света) через 3ч5 мин. адаптации глаза будет хорошо видно зеленовато-голубое свечение пятна, соответствующего точке нанесения раствора на подложку. Не подносите такой источник близко к глазам — все прекрасно видно с расстояния 40ч60 см.Весьма полезным для работы является возможность измерения фосфора-32 прямо в пластиковых пробирках, помещенных в стандартный сцинтилляционный флакон. На практике это означает, что вы можете измерять активность своего образца, например, вырезанный кусок из агарозного геля или пробирку с фракцией элюата хроматографического разделения, а затем использовать образец для дальнейшей работы. Такая особенность фосфора-32 является его важнейшим преимуществом перед другими β-радионуклидами, применяемыми в life science. Все остальные β-радионуклиды, приведенные выше в таблице 1, включая фосфор-33, требуют для измерения в сцинтилляционном счетчике прямого контакта с сцинтилляционной жидкостью, т.е. добавления образца прямо во флакон, содержащий сцинтиллятор. Естественно, после этого образец для дальнейшей работы теряется.Среди радионуклидов, применяемых в life science, фосфор-32 является "рекордсменом" по чувствительности методик с его использованием. Однако, простой расчет чувствительности метода (поделите обычный предел обнаружения фосфора-32, т.е. около 3ч4 Бк, на максимальную молярную активность используемого соединения, т.е. около 2х1017 Бк/моль) показывает величину около 10-17 моля. К сожалению, это неправильно. Причина этого в высоком "биологическом" фоне. Например, при постановке ДНК-полимеразной реакции контрольная проба, в которую добавляют все компоненты реакции кроме фермента, также показывает некоторое "включение" радиоактивного фосфора в ДНК, на самом деле обусловленное просто неспецифической сорбцией радиоактивного предшественника биосинтеза. Такая неспецифическая сорбция есть всегда в любом биохимическом эксперименте и фактически чувствительность метода будет определяться величиной этого "биологического" фона. Например, в реакцию добавлено 0,1 МБк [α-32P] dNТР (это примерно 2х106 срм по Черенкову), ферментативое включение в ДНК около 30%, а неспецифическая сорбция — фон — составляет около 0,1%, т.е. 2х103 срм. Граница достоверности определяемой величины будет определяться именно неспецифической сорбцией (в этом примере 2х103 срм), которая обычно гораздо выше фона измерительной аппаратуры. В этом примере фон 2000 срм, и, следовательно, достоверная величина измеряемого эффекта должна быть не ниже 6000 срм, что в 30 раз снижает чувствительность по сравнению с "идеальной" расчетной.Использование фофора-32, а позднее и фосфора-33, начиналось еще в 50-х годах ХХ века, однако после разработки методов секвенирования ДНК с помощью фосфора-32 спрос на соединения, меченные фосфором-32, достиг просто огромных величин. В "пике" потребления нуклеотиды, меченные фосфором-32, производились в мире в объеме несколько десятков кюри ежемесячно (это десятки тысяч фасовок каждый месяц), и только флюоресцентные методы секвенирования спустили потребление радиоактивного фосфора с заоблачных высот к нынешнему состоянию.Традиционно меченые фосфором нуклеотиды используются по нескольким направлениям:38. Введение в ДНК (РНК) за счет нуклеозид-5' — [α-32Р]-трифосфатов и изучение соответствующих ферментов.39. Введение в олигонуклеотиды 32Р фосфорилированием 5'-конца с помощью [γ-32P] ATP и полинуклеотидкиназы.40. Фосфорилирование белков протеинкиназами с помощью [γ-32P] ATP.Наиболее востребованным меченым соединением фосфора-32 является аденозин-5'-[γ-32P] трифосфат, который обычно сокращенно обозначают [γ-32P] АТР. Это вполне объяснимо, т.к. кроме широко известной методики введения 32Р-метки на 5'-конец олигонуклеотида с помощью Т4 полинуклеотидкиназы, [γ-32P] АТР используют для изучения различных фосфотрансфераз (киназ), в том числе и для биоскрининга химических библиотек протеин-киназными тестами. Нуклеозид-5'трифосфаты, меченные фосфором-32 в α-положении, сокращенно обозначают [α-32Р] NТР или [α-32Р] dNТР (рибо- или 2'-дезоксирибонуклеотиды соответственно) и используют, в основном, для введения "метки" в нуклеиновые кислоты с помощью РНК- или ДНК-полимераз. Естественно, сюда же примыкают исследования биосинтеза нуклеиновых кислот и их ферментативного аппарата. Технология введения 32Р-метки в нуклеиновые кислоты подробно изложена в "классике методов" ( Маниатис Т. Фрич Э. Самбрук Дж. "Молекулярное клонирование" М. "Мир" 1984 г.). Поэтому я отмечу только некоторые характерные для начинающих ошибки.Вполне естественное стремление каждого исследователя получить меченый препарат ДНК (например ДНК-зонд для гибридизации) с максимальной удельной активностью имеет свои ограничения. Считается, что препарат ДНК, имеющий удельную активность не менее 108 срм на мкг ДНК, "пометился" хорошо и может дать при гибридизации чувствительность, близкую к максимальной. Если удельная активность препарата 107ч108 срм на мкг ДНК, то результат получится весьма посредственный, а если синтезированный вами препарат имеет удельную 106 срм на мкг ДНК, то вы что-то сделали неправильно — такой препарат к работе мало пригоден.Еще одна характерная ошибка начинающих исследователей — попытка синтеза высокомеченного ДНК-зонда с помощью замены нерадиоактивных dNTP на [α-32Р] dNТР. К сожалению, попытки использовать для синтеза меченой ДНК 2ч3, а иногда и всех 4-х меченых [α-32Р] dNТР вместо одного, заранее обречены. В лучшем случае использование двух меченых [α-32Р] dNТР даст почти такой же результат (как правило, все-таки немного ниже) как использование одного [α-32Р] dNТР. В остальных вариантах, независимо от конкретных нуклеотидов, удельная активность такой 32Р-ДНК будет существенно ниже. Это обусловлено двумя причинами. Во-первых, оптимальная концентрация dNTP для синтеза меченой ДНК не ниже 10 мкМ (часто делают ещё выше), а молярная концентрация меченого [α-32Р] dNТР в реакции — примерно 0,2ч0,4 мкМ. Замена "холодного" dNTP на [α-32Р] dNТР снижает концентрацию в 20ч40 раз. Следовательно, замена всех dNTP на радиоактивные [α-32Р] dNТР снижает концентрацию всех предшественников биосинтеза до величин ниже Км (константы Михаэлиса) для каждого dNТР, что в данном случае почти останавливает реакцию. Во-вторых, химическая чистота "холодных" dNTP, как правило, выше [α-32Р] dNТР и, соответственно, количество примесей, способных ингибировать ДНК-полимеразу, возрастает, если заменять все dNTP на соответствующие [α-32Р] dNТР.Аналогичная ситуация наблюдается и при использовании [α-32Р] NТР в синтезе РНК. Так как величина Км большинства РНК-полимераз находится в интервале 10ч100 мкМ, то использовать [α-32Р] NТР без добавления в реакцию "холодного" трифосфата до приемлемой концентрации бессмысленно — реакция не идет. Более того, РНК-полимеразы более "капризны", чем ДНК-полимеразы, и требования к химической чистоте всех ингредиентов, в том числе и меченых предшественников биосинтеза РНК, еще более жесткие.Все фирмы-производители нуклеозид-5'трифосфатов, меченых фосфором-32 (или 33), поставляют эти соединения с добавками, снижающими химическую деструкцию веществ, обусловленную воздействием ионизирующего излучения, и в криостатах с сухим льдом (при -70°С). Такие добавки, "продлевающие" жизнь меченым соединениям, получили название радиопротекторов — по аналогии с веществами, снижающими вредное воздействие ионизирующего излучения на живые организмы. Каждый производитель использует свои, как правило, запатентованные радиопротекторы, продлевающие сроки использования меченых препаратов. Часто такие радиопротекторы (или их комбинации) окрашены в яркие цвета, что создает определенное удобство для работы — хорошо видно даже минимальный объем окрашенного меченого соединения. Естественно, что важнейшее требование к радиопротектору для меченых соединений в life science — это нетоксичность или "безвредность" самого радиопротектора и продуктов его радиолиза для тех биологических и ферментативных систем, в которых используется данный меченый препарат. Иными словами, радиопротектор не должен участвовать в биологическом процессе, который вы собираетесь изучать с помощью меченого соединения, содержащего радиопротектор. Соединения, меченные фосфором-32 или фосфором-33, которые производили и производят в России, окрашены за счет радиопротектора в ярко-красный цвет. При длительном хранении цвет будет "желтеть". Пожелтевший препарат лучше выбросить сразу — весь радиопротектор в таком препарате уже разрушился, и ничего хорошего от его радиоактивных остатков ждать не следует.Вообще, саморадиолиз соединений, меченных фосфором-32 или фосфором-33, очень неудобное для работы явление, и его надо учитывать. Без радиопротекторов меченные фосфором-32 соединения в концентрированном растворе (более 15 мКи/мл) могут храниться очень недолго, а в сухом виде оставлять их дольше нескольких часов не следует, т.к. скорость химических превращений, под действием ионизирующего излучения в этом случае очень высокая.Основное отличие фосфора-33 от фосфора-32 заключается в энергии β-излучения этих радионуклидов, т.к. различие в периоде полураспада менее чем в 2 раза несущественно. При этом преимущество более слабого излучения фосфора-33 (кроме психологического комфорта) проявляется только при необходимости авторадиографии с высоким разрешением близко расположенных меченых продуктов, например, автограф геля после электрофоретического разделения меченых фрагментов нуклеиовых кислот. Действительно, эффективность "ручного радиоактивного" сиквенса определялась разрешающей способностью электрофоретического разделения продуктов реакции терминации синтеза ДНК (в методе Сэнгера) или фрагментов химического расщепления [5'-32P]-одноцепочечной ДНК (по Максаму-Гилберту). Для 32Р-меченых фрагментов с одного геля квалифицированный специалист мог "прочитать" 350ч400 нуклеотидов. "Зубры" секвенирования ДНК в Москве и Новосибирске довели эту величину до 700 нуклеотидов. Однажды, автору этого обзора в новосибирском Академгородке с гордостью продемонстрировали автограф геля, с которого удалось "прочитать" почти 750 нуклеотидов. В научном фольклоре встречались даже более высокие величины (вплоть до 1000), однако, таких задокументированных результатов я не встречал. Переход на фосфор-33 только за счет более мягкого β-излучения сразу увеличивал разрешение в 1,5ч2 раза и, следовательно, повышал производительность труда при сиквенировании ДНК. Впрочем, автоматические секвенаторы ДНК, использующие флюоресцентную метку, полностью прекратили эту гонку за производительностью "ручного сиквенса" с использованием радиоактивных изотопов.9. Радионуклид 35SНаработка радионуклида серы-35 проводится в ректоре облучением KCl или NaCl по реакции 35Cl + 0n —> 35S + 1p в виде 35S-сульфата. Некоторые специфические методики приготовления образцов KCl для облучения позволяют получать 35S в виде элементарной серы. Схема распада серы-35: 35S —> 35Cl + e . Удобный период полураспада и вполне приемлемая энергия β-излучения делают серу-35 очень популярным радионуклидом в своей "нише", вызывая досаду малой распространённостью соединений серы в живых организмах.В life science сера-35 используется, в основном, для введения "метки" в белок за счет 35S-метионина или (реже) 35S-цистеина. Аминокислоты, меченные серой-35, получают биосинтезом, выращивая бактериальную биомассу на среде, содержащей 35S-сульфат. После кислотного гидролиза 35S-биомассы из белкового гидролизата выделяют аминокислоты. Иногда фирмы-производители вместо индивидуальных 35S-аминокислот предлагают просто 35S-белковый гидролизат, который может быть использован для выращивания культуры клеток в 35S питательной среде.В 80-х годах ХХ-века на пике бума секвенирования ДНК с помощью радиоактивных изотопов фирма Амершам предложила использовать вместо нуклеозид-5'-трифосфатов, меченных фосфором-32 (или 33), нуклеозид-5'-трифосфаты, меченные серой-35 по фосфатной группе, т.е. 35S- тиофосфаты. Однако, несмотря на широкую рекламу, большого распространения этот вариант секвенирования ДНК так и не получил. Во-первых, работа с радиоизотопами фосфора была привычней, а при массовой работе и регулярных поставках "свежей метки" надежней. Во-вторых, появившиеся вскоре флюоресцентные автоматические секвенаторы сделали это направление просто ненужным. Тем не менее, в арсенале life science остались нуклеозид-5' - [γ-35S] тиотрифосфаты и нуклеозид-5' - [α-35S] тиотрифосфаты для решения специальных задач, например, энзимологии протеинкиназ или энзимологии биосинтеза (деградации, коррекции) нуклеиновых кислот.Главным недостатком соединений, меченных серой-35, которые используются в life science, является их низкая химическая стабильность. При том, что процессы радиолиза для этих соединений менее критичны, чем для трития или фосфора-32, 35S аминокислоты и тиотрифосфаты легко окисляются, поэтому их важно хранить при -20°С (лучше -70°С) и контролировать чистоту перед использованием.10. Радионуклид 125IСреди радиоактивных изотопов йода самым популярным для исследовательских работ в life science является 125I. Это реакторный изотоп, получающийся из стабильного изотопа ксенон-124. Среди радионуклидов в таблице, приведенной в разделе 4, йод-125 единственный γ-излучатель, хотя тип распада (точнее ядерного превращения) — электронный захват, в результате которого йод превращается в теллур с выделением γ-кванта. Йод-125 — очень удобный для детекции радионуклид. Во-первых, его можно измерять сцинтилляционным γ-счетчиком (не путайте с жидкостным сцинтилляционным β-счетчиком), и весь радиоиммуноанализ в пробирочном варианте был построен на этих измерениях. Во-вторых, йод-125 прекрасно детектируется авторадиографически на рентгеновской пленке или "электронной авторадиографией" с помощью имиджера. Наконец, йод-125 можно измерять на жидкостном сцинтилляционном β-счетчике во флаконе с сцинтиллятором, как тритиевый образец, за счет электронов Оже.Несмотря на широкое применение йода-125 в life science, собственно 125I-меченные соединения почти не используются. Правильнее говорить об использовании йода-125 для "мечения" биологических макромолекул, т.е. получения меченых соединений второй группы — модифицированных соединений (см. раздел 3). Поэтому самым востребованным соединением йода-125 в life science является раствор йодистого калия — K125I — исходный материал для введения радионуклида в нужную молекулу.Основным "потребителем" йода-125 являются исследования белков и пептидов. Традиционно йодирование белков проводят в нейтральной или слабокислой среде в присутствии окислителя, который окисляет йодид, обеспечивая его реакцию с аминокислотными остатками белка. Легче всего йод присоединяется по остаткам тирозина и гораздо хуже — по остаткам фенилаланина, триптофана или гистидина. Йодированный тирозиновый остаток практически не меняет физико-химические и иммунологические свойства белка, что очень важно для дальнейшего использования меченого препарата. В качестве окислителя использовались самые различные агенты: хлорамин Т, "йодоген", перекись водорода с лактопероксидазой и даже катод полярографа (при электрохимическом окислении). Каждый метод имеет свои особенности, но общий недостаток для всех — это окисление, которое для многих белков приводит к потере (или изменениям) ими своих свойств и функций. Даже кратковременное воздействие окислителя (реакция с хлорамином Т длится обычно 30ч40 сек.) для многих белков недопустимо. Поэтому был предложен реагент Болтона-Хантера — реагент, ацилирующий свободные аминогруппы белков. Такая модификация белка проходит без окисления, однако ацилирование аминогруппы меняет физико-химические характеристики исходного белка и может значительно изменить его иммунологические свойства. Особенно это касается небольших молекул, например, пептидов, где количество антигенных детерминант ограничено размерами самой молекулы.Тем не менее, йодирование белков и пептидов йодом-125 широко используется для различных исследований, особенно иммунологических, рецепторных, гормональных и др. Такие 125I-меченные пептиды также используются для исследований, связанных с распределением пептидов по органам и тканям экспериментальных животных и их фармакокинетике.Были предприняты попытки использовать 125I для исследований нуклеиновых кислот. Действительно, можно "пройодировать" ДНК, используя хлорид таллия и K125I, для введения "метки" по остаткам цитидина (образуется 5-йодцитидин). Можно вводить 125I в ДНК за счет ферментативного синтеза, используя ДНК-полимеразу и [5-125I] цитидин-5' трифосфат - 125I-аналог dCTP. Тем не менее, широкого распространения эти методики не получили, так как особых преимуществ у 125I перед 32Р нет. Кроме того, высокомеченная 125I ДНК гораздо быстрее деградирует под действием продуктов радиолиза и электронов Оже, чем ДНК, меченная фосфором-32 или фосфором-33.11. Основы радиационной безопасностиВсем, кто работает с источниками ионизирующего излучения, в том числе с радиоактивными веществами, приходится получать допуск к работе: проходить медкомиссию и сдавать экзамен по знанию норм и правил радиационной безопасности. Возможно, самым ярким примером тесного переплетения фундаментальных академических исследований и утилитарно-прикладных разработок являются правила работы с источниками ионизирующего излучения. Вся информация для проведения работ с радиоактивными веществами изложена в двух основных документах: "Нормы радиационной безопасности" (НРБ) и "Основные санитарные правила" (ОСП). Эти скучные строгие документы существуют уже более 30-ти лет. Регулярно (примерно раз в 10 лет) информация в этих документах обновляется в соответствии с развитием радиобиологических и биофизических исследований, вносятся изменения, иногда весьма серьезные, но общая структура документов не меняется. НРБ устанавливает нормативы по всем параметрам, связанным с радиоактивностью: дозы и уровни облучения, содержание различных радионуклидов в воде, воздухе и т.д., уровни загрязнения радионуклидами и пр. Следует подчеркнуть, что это не военно-технический или медико-терапевтический документ, а общие нормы, установленные для всех организаций и лиц, постоянно работающих с источниками ионизирующего излучения, в том числе с радиоактивными веществами.Хотя в НРБ и ОСП даны кратко определения основных терминов и понятий, ниже я попытаюсь упрощенно систематизировать эту информацию для начинающих работать с радиоактивными веществами.Экспозиционная доза — энергетическая характеристика γ- и рентгеновского излучения, которая оценивается по эффекту ионизации сухого атмосферного воздуха. Единица экспозиционной дозы рентген - поток γ- или рентгеновского излучения, который в 1 см3 сухого воздуха образует 2х109 пар ионов. Эта самая популярная единица измерения в дозиметрии, хотя и является устаревшей и внесистемной.Поглощенная доза — собственно это и является характеристикой опасности излучения, так как определяется как отношение поглощенной энергии ионизирующего излучения к массе облученного вещества. Единицы поглощенной дозы — рад и грей. Рад — это внесистемная (но популярная) единица — rad (radiation absorbed dose) — равна 100 эрг/г. Грей — единица в системе СИ, равная 1 дж/кг. Значит, 1 Гр (грей) равен 100 рад.Эквивалентная доза — произведение поглощенной дозы излучения на некий коэффициент качества излучения, учитывающий неблагоприятные биологические последствия. Единицы измерения — бэр и зиверт. Бэр - биологический эквивалент рентгена (иногда говорят рада) — доза любого вида ионизирующего излучения, производящая такое же воздействие на биологические объекты как доза γ- или рентгеновского излучения в 1 Р (рентген). В системе СИ принят зиверт — эквивалентная доза, соответствующая поглощенной доза в 1 Гр (грей) с коэффициентом качества 1.Эффективная доза — величина, используемая для оценки меры риска возникновения отдаленных последствий облучения всего тела человека и его отдельных органов и тканей с учетом их радиочувствительности.Вся эта "голубая муть" на дозовую тему для нормальной работы, конечно, не нужна. Тем более для работы в life science. Дозиметрические приборы (точнее, приборы радиометрического контроля) меряют или мощность экспозиционной дозы γ- или рентгеновского излучения (в миллирентгенах в час), или поток β-частиц с поверхности (количество частиц в сек. на 1 см2). Собственно поглощенная работником доза обычно измеряется специальными индивидуальными дозиметрами разных систем: ионизационными — типа ДП-22В, фотокасетными (количественная авторадиография) и даже современными термолюминисцентными. Однако, все замеры всеми типами дозиметров всегда показывали, что для работающих в life science, поглощенные дозы бесконечно малы и не могут быть достоверно измеряны существующими приборами.Порядок работы с радиоактивными веществами определен в ОСП. Последняя редакция этого документа называется "Основные санитарные правила обеспечения радиационной безопасности" (ОСПОРБ-99), и название полностью соответствует содержанию. В ОСПОРБ-99 не только подробно изложен порядок работы с любыми радионуклидами, но и порядок их получения (передачи) от других организации, порядок списания источников и сдачи радиоактивных отходов и многое другое. Согласно классификации работ с радиоактивными веществами в этом документе в зависимости от уровня опасности, все исследования с радиоактивными изотопами в life science относятся к третьему (самому низкому) классу радиационной опасности. Эта "классность" работ определяется, во-первых, количеством радионуклида на рабочем месте, а во-вторых, "радиотоксичностью" радионуклида и характером работ по его использованию. Радиотоксичность — понятие, введенное для оценки вреда, который может нанести радионуклид человеку, и зависит от типа распада, энергии излучения, периода полураспада и способности радионуклида усваиваться организмом. Все радионуклиды разбиты на четыре группы радиотоксичности: А (самая опасная), Б, В, и Г (наименее опасная). Из радионуклидов, указанных в таблице 1, самым "вредным" является фосфор-32 — группа Б.Опасность радионуклида при внешнем облучении определяется характером и энергией излучения. Для всех "мягких" β-излучателей (для life science радионуклидов из таблицы 1: тритий, углеров-14, фосфор-33, и сера-35) опасность минимальна. Электронный поток задерживается листом плотной бумаги, резиновыми хирургическими перчатками и т.д. Сложнее с фосфором-32. Кроме излучения высоко энергетических электронов для фосфора-32 характерно "тормозное излучение" — вторичное электромагнитное излучение, возникающее при торможении электрона в плотной среде. По своей природе такое тормозное излучение одинаково с рентгеновским и его проникающая способность очень высокая. Именно по этой причине для защиты от излучения фосфора-32 применяются дополнительны средства защиты: защитные экраны со свинцовыми стеклами и свинцовые контейнеры для препаратов. Аналогичная защита требуется и для работы с йодом-125. Гамма-излучение 125I экранировать легкой защитой из оргстекла не удается.Существуют три защитных фактора от воздействия ионизирующего излучения на организм.41. Расстояние. Чем дальше вы от источника излучения, тем лучше. Это не только вывод народной мудрости — "держаться подальше", но и научно обоснованная реальность, т.к. интенсивность излучения убывает пропорционально квадрату расстояния. Поэтому старайтесь не брать радиоактивные препараты руками (даже в перчатках), а пользуйтесь пинцетами, захватами и прочими дистанционными приспособлениями, если такая возможность есть. 42. Время. Чем меньше время контакта с радиоактивным веществом, тем меньше вред воздействия. Поэтому готовьте заранее все реактивы, приборы, расчеты и продумывайте свои действия, чтобы сократить время непосредственного контакта с радиоактивным веществом до минимального.43. Защитная среда (экранирование). Собственно защита с помощью различных контейнеров, стенок, экранов, защитной спецодежды, очков и т.д. Почему-то этому фактору уделяют самое большое внимание, хотя первый и второй гораздо важнее и проще.Несколько сложнее ситуация с внутренним облучением. Понятно, что внутреннее облучение возможно только при попадании радионуклида вовнутрь вместе с пищей, водой или при вдохе. Так как такое попадание обычно не планируется, то и оценить количество радиоактивного материала и, соответственно, дозу внутреннего облучения очень сложно. Особенно это проблематично для слабых β-излучателей трития или углерода-14. Поэтому главным способом снижения внутреннего облучения персонала, работающего с радионуклидами, является аккуратность в работе с открытыми источниками и соблюдение санитарных и гигиенических норм и правил.Вообще, вопреки разным слухам, количество радиоактивного материала, которое используется для life science, не может нанести серьезного ущерба для здоровья человека, работающего непосредственно с препаратом, и тем более для его будущих детей. Даже если в полном безумии кто-то проглотит 1ч2 полных фасовки [γ-32P] ATP (40 МБк), то ущерб будет выражаться, как материальные потери от нецелевого использования препарата, но не от физического вреда здоровью проглотившего. За многолетнюю работу многочисленных научных сотрудников в биологических НИИ в СССР, а затем в России, не зафиксировано ни одного случая отрицательного воздействия радиоактивных препаратов на здоровье работающего сотрудника. Слишком маленькие количества радиоактивных препаратов применяют для работы по III-му классу работ с радиоактивными веществами. Однако, это не относится к работам на предприятиях, производящих радионуклиды, и к другим организациям, где работают с радионуклидами по I или II классу работ.
bukvasha.ru
|
|
..:::Счетчики:::.. |
|
|
|
|
|
|
|
|