|
|
|
|
 Far Far |
 WinNavigator WinNavigator |
 Frigate Frigate |
 Norton
Commander Norton
Commander |
 WinNC WinNC |
 Dos
Navigator Dos
Navigator |
 Servant
Salamander Servant
Salamander |
 Turbo
Browser Turbo
Browser |
|
|
 Winamp,
Skins, Plugins Winamp,
Skins, Plugins |
 Необходимые
Утилиты Необходимые
Утилиты |
 Текстовые
редакторы Текстовые
редакторы |
 Юмор Юмор |
|
|
|
File managers and best utilites |
Реферат: Генная терапия – новая эра новой эры:. Реферат генная терапия
Реферат - Генная терапия – новая эра новой эры
Кордюм Виталий Арнольдович, член-корреспондент НАН и АМН Украины
Чем проще идея, тем труднее она для практической реализации. Сколько спорят, есть ли жизнь на Марсе! Идея решения удивительно проста – полететь туда и посмотреть на месте. К таким “простым” идеям до недавнего времени относилась проблема радикального лечения болезней. Поскольку болезнь возникает вследствие того, что в организме “что-то не так”, то сделать чтобы было “так” и болезни не станет. К сожалению, как при всех простых идеях, уже со следующего шага, сразу после их изложения начинались неразрешимые проблемы. В данном случае таким первым последующим шагом было выяснение что же это такое, “что-то”, что такое “так” и что такое “не так”, которое надо вернуть в “так”.
Сегодня известно, что первоосновой, информационной базой всего организма являются гены. Изменение их структуры или активности является первопричиной изменений в организме. А болезнь причинно-следственно связана с дефектом одного из них (или некоторой их части), т. е. ген и есть то самое “что-то”. Тогда следует заменить дефектные гены на полноценные и “не так” вернется в “так” – больной выздоровеет радикально.
Попробуем сформулировать что для этого надо. Надо знать, какой же конкретно ген отвечает своим дефектом за данную патологию. Этот ген надо получить. Получив – ввести обратно в клетку. Сделать так, чтобы после введения было обеспечено его требуемое функционирование. В свою очередь каждое из этих “надо” состоит из блока сложнейших проблем, любая из которых требует для своего решения выполнения многих задач “ну очень” высокой степени трудности. Если же все это соотнести в виде реальных технологий к человеку, то еще недавно казалось, что спокойно можно прогнозировать реализацию этой “простой” идеи на какое-нибудь пятое или, еще лучше, шестое тысячелетие. Скорее всего, так было бы действительно лучше. Но реальность оказалась иной.
Предтечей грядущего стали очень странные на то время работы Грифитса, который в 1928 г. обнаружил, что непатогенный пневмококк можно превратить в патогенный посредством какого-то вещества, которое содержится в клетках и которое можно из клеток извлечь. Естественно, это не могло восприниматься иначе чем курьез. Но он как заноза требовал решения. Ведь вещество вызывало не просто изменения, а совершенно (и всегда!) конкретные. И даже не мелкие изменения, а появление патогенности. Ну, ладно, еще бы утрату, а то ведь появление! Решение курьезу было найдено через 15 лет. В то время, когда на планете бушевала вторая мировая война и на полях ее сражений решались судьбы человеческой цивилизации, в тиши лабораторий Эвери и Мак Карти решали судьбу самого человечества. Естественно, они об этом даже не подозревали. Но именно ими тогда было показано, что полимерными молекулами дезоксирибонуклеиновой кислоты, т. е. химически очищенным веществом, впервые полученным еще в конце прошлого столетия Мишером, можно передавать наследственные признаки. Вещество является материальным носителем наследственности!!!
Тогда это было сделано на микроорганизмах. Но иллюзий, что такое возможно только для них, уже не питал никто. И когда Уотсон и Крик выбрали для расшифровки пространственной структуры именно ДНК – они знали что делали. Предложенная ими в 1953 г. модель строения вещества наследственности показала ту основу, с которой можно работать. Работать как с любой молекулой, делая искусственно наследственность. Технически тогда еще это было невозможно. Но все прекрасно понимали, что это дело только времени.
Осознавая случившееся, в своем грустном прогнозе Чаргаф предупреждал, что овладение техникой производства наследственности в пробирке и реализация ее в живое “нечто”, приведет к последствиям, по сравнению с которыми атомные бомбы, стершие с лица земли Хиросиму и Нагасаки, будут воспринимать как пасхальные яйца. Но джин уже был выпущен из бутылки. Стремительно развивалась база знаний, развертывался гиганский фронт работ, создавалось то, что позже получило название “молекулярная генетика” и “молекулярная биология”.
Несколько раз казалось, что решающий шаг уже сделан, но это были только зарницы. Гром грянул в 1972 г. Бергом была впервые получена, а Бойером создана универсальная технология получения генов и объединения их в любых комбинациях – техника рекомбинантных молекул. Практически стало возможным создание любых генетических конструкций. Но на первых порах молекулярный арсенал новой технологии был ограничен, а фантазия исследователей жестко зашорена. Поэтому начали с реализации новых возможностей на старой основе. Например, гормон роста видоспецифичен. Для того чтобы его использовать как лекарство, из умершего человека извлекали гипофиз, из гипофиза выделяли гормон роста, очищали, разливали по ампулам и в таком виде поставляли пациентам. Очевидно, что источник подобного препарата был, мягко говоря, ограничен. Но иного-то не было.
Техника рекомбинантных молекул позволяла выделить ген человека, сделать требуемую конструкцию, ввести в клетки (прокариатические или эукаротические) и из них, уже в неограниченном количестве, получать человеческие белки и пептиды. Оставался последний логический шаг. Зачем ген вводить в бактерии (или иные объекты), получать из них человеческий продукт, чистить, фасовать, а затем опять вводить человеку? Ведь тот же ген можно прямо ввести человеку в его клетки, и пусть они себе синтезируют что требуется. Этот последний шаг переводил генные технологии на уровень непосредственно человека. Человек должен был стать прямым и непосредственным объектом генетических манипуляций – манипуляций, меняющих его генетический аппарат. Сначала на уровне соматических клеток, а далее, как ясно было всем – и зародышевых.
По аналогии с имеющимися, такую технологию тогда называли своим истинным именем – генная инженерия человека. И первый опыт генной инженерии на людях (вначале по самой примитивной, в прямом смысле этого термина, методике) был поставлен в середине 70-х годов. Возмущению мировой общественности не было пределов. Все понимали, что, начав за здравие, кончат обязательно иначе. Почти 15 лет общественное мнение держало оборону. Но законы человеческого разума неумолимы – все что возможно технически, на что нет непреодолимых принципиальных запретов, обязательно будет воплощено в жизнь. Возможности исправления генетических дефектов, радикального избавления от любых болезней, имели столь очевидное для каждого значения (личное, для близких, для детей), что возражения падали одно за другим. Для того чтобы окончательно успокоить сомневающихся, изменили терминологию. Теперь это стало называться “генная терапия”. Ну есть лечение травами, микроэлементами, витаминами, антибиотиками и т. д. Добавим еще лечение генами. И в конце 80-х годов, сначала в США, а затем и в ряде других стран сугубо демократически, с всеобщего согласия начались санкционированные испытания на людях, теперь уже под названием “генной терапии”.
Сегодня на различных стадиях разработки находится более двухсот клинических протоколов генной терапии. Как это реализуется практически? В генной терапии достаточно четко можно выделить три принципиальных подхода: лечение классических наследственных болезней, “хирургическая” генная терапия и лечение массовых патологий. Они различаются особенностями участия в них наследственного аппарата человека.
Классические наследственные болезни (в основном моногенные) характеризуются дефектом гена, который имеется во всех клетках организма. Этот дефект и ведет к патологии. Одна (но конкретная) нуклеотидная замена в гене глобина приводит к серповидноклеточной анемии; выпадение фрагмента гена глобина – к талассемии и т. д. Нарушен только один ген. Все остальное в организме не нарушено. И, теоретически, если ввести в клетки полноценный ген, то он обеспечит синтез полноценного продукта, наступит радикальное излечение. Конечно, здесь имеется очень много особенностей. Но в случаях наиболее простых (и наиболее распространенных) наследственных дефектов – это так. По своим функциям гены делятся на общеклеточные (они работают во всех клетках, поддерживая их существование) и тканеспецифические. Так, гемоглобин нужен и, соответственно, вырабатывается только в эритроидных клетках. Во всех остальных он не функционирует, и для клетки не имеет значения дефектен он или нет. Поэтому достаточно полноценный ген глобина ввести только в клетки эритроидного ряда. Поскольку же они, в свою очередь, образуются из стволовых, то достаточно ввести полноценный ген (конечно, в составе адекватной молекулярной конструкции) в относительно небольшое и, главное, доступное для такой процедуры количество стволовых клеток. Через некоторое время “не то”, станет “тем”.
“Хирургическая” генная терапия используется при таких болезнях, которые характеризуются тем, что и гены и их регуляция в организме полноценные. Но возникла патология в генетическом аппарате локальной группы (или групп) клеток. Например, при злокачественных опухолях. Убрать бы эти клетки из организма, все до единой, и болезнь бы ушла. Для достижения такой цели в генной терапии используют своеобразный временно-локальный подход. В случае онкологических болезней из биопсийного материала отделяют и переводят в культуру опухольпроникающие лимфоциты. Их размножают, вводят в них ген, кодирующий соответствующий иммунноактивный продукт (интерлейкин 2, фактор некроза опухоли и т. д.), и возвращают в организм больного. Такие генетически трансформированные лимфоциты уничтожают опухолевые клетки. Но время жизни лимфоцитов – примерно месяц. Если за это время они уничтожают все опухолевые клетки – задача выполнена, и сами измененные лимфоциты исчезают. Если опухоль разрушена за это время только частично, процедуру повторяют. Вводимые гены можно раз от раза варьировать. И так – до победы. Гены приводящие к гибели опухоли можно вводить и в сами опухолевые клетки. Но общим принципом здесь является то, что после излечения (полного) в организме не остается и тех генетически измененных клеток, которые такое излечение обеспечили.
При массовых патологиях сами гены не нарушены. Но в результате каких-то, в разных случаях разных, многоуровневых и множественных событий нарушена регуляция функционирования одного или нескольких генов. Простое введение в клетки еще одного (или нескольких) таких же генов ничего не дает. Ведь и собственный ген не нарушен. А регуляция на то и регуляция, чтобы держать активность на заданном уровне. Начни все гены функционировать по максимуму своих возможностей – организм мгновенно пойдет в разнос. До такой жуткой патологии даже природа не додумалась. Тут и болезни никакой дополнительной не надо. Именно поэтому большинство генов у человека ткане- и стадиоспецифические. Они функционируют на определенной стадии индивидуального развития и только в определенных тканях, часто вообще в ограниченном числе клеток.
Например, диабет. Повреждения гена инсулина, приводящие к диабету, описаны как уникальные наследственные болезни. А при остальных (практически всех) случаях этой болезни ген инсулина не нарушен. Но функционирует он только в -клетках поджелудочной железы (и весьма ограниченно – в некоторых клетках центральной нервной системы). А во всех остальных – выключен множественной, для надежности, регуляцией. Человек может умирать от нехватки инсулина, но регуляция не позволит включиться ни одному гену инсулина ни в одной другой клетке. Поэтому при генной терапии массовых патологий, в силу указанных особенностей, создают такие молекулярные конструкции, в которых клеточная регуляция не может выключить вводимый ген, хотя на собственный, резидентный, она действует. Достигается это тем, что у гена убираются все “свои” регуляторные участки и ставятся другие. Возникает молекулярная химера – структурный ген (кодирующий белок) остается исходным (таким же как в клетках), а регуляторные последовательности берутся от иных генов (часто вообще не клеточных). Теперь клетка не может выключить своей регуляцией вводимый извне ген. И он будет функционировать на заданном уровне, уйдя от нарушенной в организме регуляции.
Остается последняя задача – ввести созданную молекулярную конструкцию в клетки организма. Принципиально это можно осуществить двумя путями. Первый путь предусматривает извлечение из организма клеток (стволовых или вообще способных к размножению), обработку их созданным генетическим материалом (если надо – с последующим отбором и подращиванием) и возвращение в организм. По второму пути молекулярная конструкция вводится непосредственно в организм – в кровь или прямой инъекцией в ткань.
Для того, чтобы конструкция вошла в клетки, ее одевают в вирусный капсид, соединяют с лигандом к соответствующему рецептору, помещают в липосому и т. д.
История состояния на сегодня и прогноз развития на обозримую перспективу генных технологий в медицине.
| Рекомбинантные белки | Генная диагностика | Последовательность генома | Генная вакцинация | Генная терапия | Искусственные органы | Внутриклеточная иммунизация | Белковая инженерия | Генная инженерия человека | |
| 1972 | Сформировано представление об общности молекулярных основ живого | Создание техники рекомбинантных ДНК | |||||||
| | | | |||||||
| 1980 | Первый генно-инженерный синтез пептида человека (соматостатин) в бактериях Первый, санкционированный к применению, пептид человека (инсулин), полученный в бактериях по генно-инженерной технологии | Первые несанкционированные опыты на людях по генной терапии (аргининемия), называемой тогда “генной инженерией человека” Вторая группа несанкционированных опытов на людях по генной терапии, все еще называемой “генной инженерией человека” | Разработка на животных технологий изменения в поколениях методами генной инженерии | ||||||
| | | | | | | | | | |
| 1990 | Широкое получение рекомбинантных белков и пептидов для лечения, иммунизации и диагностики | Закладываются основы генной диагностики Быстрое совершенствование и расширение возможностей генной диагностики | Создан и начал функционировать проект “Геном человека” | Работы по генной вакцинации с использованием «параллельных» вакцин | Первые санкционированные опыты на людях по отработке технологии генной терапии Первые санкционированные опыты на людях по генной терапии с целью лечения | Закладываются основы технологий уничтожения заданных клеток в организме. Создание технологий получения кожи человека | Формирование первых представлений о внутриклеточной вакцинации | Разработка общих теоретических представлений белковой инженерии | Получение первых моделей наследственных болезней на животных и стремительно набирающая темпы разработка технологии изменения в поколениях модельных животных методами генной инженерии |
| | | | | | | | | | |
| 1997 | Массовая индустрия, применение, испытания и получение новых рекомбинантных белков и пептидов человека для лечения, иммунизации и диагностики. Здесь уже фактически нет ограничений | Перенос генной диагностики в клиники, расширение ее спектра, нарастающие темпы разработки практически приемлемых технологий генной диагностики зигот | Стремительно развивается проект “Геном человека”, определена первичная последовательность более 10% всех структурных генов человека | Быстро набирающие темпы исследования по генной вакцинации | Набирающая темпы и расширяющаяся по номенклатуре генная терапия человека с массовой развивающейся базой и подготовкой новых возможностей | Создание и разработка различных технологий уничтожения любых заданных клеток на животных моделях. Разработка технологий получения искусственных биологических органов и разных тканей | Первые санкционированные опыты на людях по внутриклеточной иммунизации, лавинообразный рост исследований | Медленно и очень тяжело, но неуклонно набирают темпы исследования по белковой инженерии | Массовое получение моделей наследственных болезней человека на животных и продолжение совершенствования технологии широких изменений в поколениях |
| | | | | | | | | | |
| 2000 | Массовое применение рекомбинантных белков в медицине становится рутинным | Генная диагностика становится рутинным клиническим анализом. Начало практического перехода к диагностике дефектов одновременно нескольких генов, а так же патологий, при которых влияние генов выражено «слабо» | Определение четверти всех структурных генов человека и быстрое дальнейшее продвижение программы “Геном человека” | Первые санкционированные опыты на людях по генной вакцинации | Начало клинического масштабирования генной терапии. Первые опыты на людях по генной терапии возрастной патологии | Разработка технологий уничтожения любых клеток, их сообществ, тканей и органов. Первые опыты на людях по подсадке искусственно созданных биологических органов и разных тканей | Подготовка к масштабированию внутриклеточной иммунизации | Ускорение работ по белковой инженерии, основанных на прорыве в области теории расчета строения и функции белка на основе данных о его первичной структуре | Методическая готовность для генной терапии на уровне зародышевых клеток человека |
| | | | | | | | | | |
| 2010 | Рекомбинантные белки и пептиды человека как основные терапевтические и профилактические средства для употребления «извне», (инъекции, мази и т.д.) | Генная диагностика множественных нарушений в геномах – «слабых мутаций» – становится рутинным клиническим исследованием | Окончание определения полной последовательности всего генома человека. Переход на масштабные определения геномов у индивидуумов | Практическое применение технологии генной вакцинации. Обеспечение требуемого функционирования любых введенных на постнатальном уровне генов | Устранение отдельных генетических дефектов как рутинная клиническая процедура. Клиническое масштабирование генной терапии возрастной патологии | Начало масштабированных замен тканей и органов искусственно созданными аналогами из модифицированных и выращенных вне организма клеток данного индивидуума | Лечение и профилактика вирусных и опухолевых болезней на основе внутриклеточной иммунизации как рутинная клиническая процедура | Первые санкционированные опыты на людях по белковой инженерии. Опыты по белковой инженерии на животных | Начало санкционированных опытов по преобразованию человека в поколениях (генная инженерия на зародышевых клетках) |
| Начало санкционированных работ по полномасштабной реконструкции человека на постнатальном уровне и в поколениях |
Вероятно, читающий это описание, уже понял, что за всей легкостью изложения типа “создание соответствующих молекулярных конструкций”, “ген начал функционировать несмотря на регуляцию, выключающую свой, такой же, но клеточный ген” и т. д. стоят технические и технологические трудности почти фантастической сложности. Задача же состоит в том, чтобы генная терапия из рекордов виртуозов превратилась в рутинную медицинскую процедуру. Поэтому сегодня уже создан и стремительно расширяется фронт работ по решению такой задачи. Сегодня на людях испытывают технологии генной терапии гемофилии, муковисцидоза, синдрома врожденного иммунодефицита, опухолевой болезни и некоторых других. Лечение более чем десятка патологий уже апробировано генной терапией на животных и проходит путь формального санкционирования для перехода на людей. Для лечения еще нескольких десятков болезней технологии оттачиваются на животных. Для этого создаются специальные их линии с генетическими дефектами, аналогичными таковым при генетически детерминированных болезнях человека.
Поскольку критический этап, связанный с решением принципиальных вопросов, пройден, в генную терапию начали устремляться могущественные фирмы с практически неограниченными материальными и финансовыми возможностями. Это, безусловно, не просто ускорит работы по доведению генной терапии до клиник, но и расширит сферу ее применения. Уже сегодня полномасштабно ставится вопрос о генной вакцинации, о внутриклеточной иммунизации, пересадке генетически адаптированных тканей и органов и т. д. Но реальностью становится и то, что казалось принципиально неразрешимым – генная терапия разных видов возрастной патологии. Нами, совместно с группой исследователей под руководством академика В.В.Фролькиса, показано, что могут быть созданы молекулярные конструкции, способные оказывать терапевтический эффект у старых животных более интенсивно, чем у молодых. Продемонстрировано это на примере нарушений, связанных с сосудами, что само по себе более чем актуально. Но это значит также, что можно создать системы генных воздействий и на иные виды возрастной патологии.
Если теперь все это свести воедино, то пугавший когда-то термин “генная терапия человека” окажется безнадежно устаревшим в силу своей ограниченности. Сегодня полноразмерным является комплекс “генных технологий человека”, уже начинающий плавно перерастать в еще более широкомасштабный комплекс ближайшего будущего – технологии “биологической реконструкции человека”. Для тех, кто не работает в данной области, такие понятия звучат как нечто за гранью фантастики. А специалисты развитых стран прогнозируют начало рутинного применения в клиниках первых технологий генной терапии рубежом оканчивающегося века, т. е. всего-то через каких-нибудь 3 года. С последующим крутым нарастанием. И для того, чтобы представить себе очень недалекое будущее на поддающуюся прогнозу глубину, можно посмотреть на приведенную слева схему.
www.ronl.ru
Генная терапия – новая эра новой эры
Кордюм Виталий Арнольдович, член-корреспондент НАН и АМН Украины
Чем проще идея, тем труднее она для практической реализации. Сколько спорят, есть ли жизнь на Марсе! Идея решения удивительно проста – полететь туда и посмотреть на месте. К таким “простым” идеям до недавнего времени относилась проблема радикального лечения болезней. Поскольку болезнь возникает вследствие того, что в организме “что-то не так”, то сделать чтобы было “так” и болезни не станет. К сожалению, как при всех простых идеях, уже со следующего шага, сразу после их изложения начинались неразрешимые проблемы. В данном случае таким первым последующим шагом было выяснение что же это такое, “что-то”, что такое “так” и что такое “не так”, которое надо вернуть в “так”.
Сегодня известно, что первоосновой, информационной базой всего организма являются гены. Изменение их структуры или активности является первопричиной изменений в организме. А болезнь причинно-следственно связана с дефектом одного из них (или некоторой их части), т. е. ген и есть то самое “что-то”. Тогда следует заменить дефектные гены на полноценные и “не так” вернется в “так” – больной выздоровеет радикально.
Попробуем сформулировать что для этого надо. Надо знать, какой же конкретно ген отвечает своим дефектом за данную патологию. Этот ген надо получить. Получив – ввести обратно в клетку. Сделать так, чтобы после введения было обеспечено его требуемое функционирование. В свою очередь каждое из этих “надо” состоит из блока сложнейших проблем, любая из которых требует для своего решения выполнения многих задач “ну очень” высокой степени трудности. Если же все это соотнести в виде реальных технологий к человеку, то еще недавно казалось, что спокойно можно прогнозировать реализацию этой “простой” идеи на какое-нибудь пятое или, еще лучше, шестое тысячелетие. Скорее всего, так было бы действительно лучше. Но реальность оказалась иной.
Предтечей грядущего стали очень странные на то время работы Грифитса, который в 1928 г. обнаружил, что непатогенный пневмококк можно превратить в патогенный посредством какого-то вещества, которое содержится в клетках и которое можно из клеток извлечь. Естественно, это не могло восприниматься иначе чем курьез. Но он как заноза требовал решения. Ведь вещество вызывало не просто изменения, а совершенно (и всегда!) конкретные. И даже не мелкие изменения, а появление патогенности. Ну, ладно, еще бы утрату, а то ведь появление! Решение курьезу было найдено через 15 лет. В то время, когда на планете бушевала вторая мировая война и на полях ее сражений решались судьбы человеческой цивилизации, в тиши лабораторий Эвери и Мак Карти решали судьбу самого человечества. Естественно, они об этом даже не подозревали. Но именно ими тогда было показано, что полимерными молекулами дезоксирибонуклеиновой кислоты, т. е. химически очищенным веществом, впервые полученным еще в конце прошлого столетия Мишером, можно передавать наследственные признаки. Вещество является материальным носителем наследственности!!!
Тогда это было сделано на микроорганизмах. Но иллюзий, что такое возможно только для них, уже не питал никто. И когда Уотсон и Крик выбрали для расшифровки пространственной структуры именно ДНК – они знали что делали. Предложенная ими в 1953 г. модель строения вещества наследственности показала ту основу, с которой можно работать. Работать как с любой молекулой, делая искусственно наследственность. Технически тогда еще это было невозможно. Но все прекрасно понимали, что это дело только времени.
Осознавая случившееся, в своем грустном прогнозе Чаргаф предупреждал, что овладение техникой производства наследственности в пробирке и реализация ее в живое “нечто”, приведет к последствиям, по сравнению с которыми атомные бомбы, стершие с лица земли Хиросиму и Нагасаки, будут воспринимать как пасхальные яйца. Но джин уже был выпущен из бутылки. Стремительно развивалась база знаний, развертывался гиганский фронт работ, создавалось то, что позже получило название “молекулярная генетика” и “молекулярная биология”.
Несколько раз казалось, что решающий шаг уже сделан, но это были только зарницы. Гром грянул в 1972 г. Бергом была впервые получена, а Бойером создана универсальная технология получения генов и объединения их в любых комбинациях – техника рекомбинантных молекул. Практически стало возможным создание любых генетических конструкций. Но на первых порах молекулярный арсенал новой технологии был ограничен, а фантазия исследователей жестко зашорена. Поэтому начали с реализации новых возможностей на старой основе. Например, гормон роста видоспецифичен. Для того чтобы его использовать как лекарство, из умершего человека извлекали гипофиз, из гипофиза выделяли гормон роста, очищали, разливали по ампулам и в таком виде поставляли пациентам. Очевидно, что источник подобного препарата был, мягко говоря, ограничен. Но иного-то не было.
Техника рекомбинантных молекул позволяла выделить ген человека, сделать требуемую конструкцию, ввести в клетки (прокариатические или эукаротические) и из них, уже в неограниченном количестве, получать человеческие белки и пептиды. Оставался последний логический шаг. Зачем ген вводить в бактерии (или иные объекты), получать из них человеческий продукт, чистить, фасовать, а затем опять вводить человеку? Ведь тот же ген можно прямо ввести человеку в его клетки, и пусть они себе синтезируют что требуется. Этот последний шаг переводил генные технологии на уровень непосредственно человека. Человек должен был стать прямым и непосредственным объектом генетических манипуляций – манипуляций, меняющих его генетический аппарат. Сначала на уровне соматических клеток, а далее, как ясно было всем – и зародышевых.
По аналогии с имеющимися, такую технологию тогда называли своим истинным именем – генная инженерия человека. И первый опыт генной инженерии на людях (вначале по самой примитивной, в прямом смысле этого термина, методике) был поставлен в середине 70-х годов. Возмущению мировой общественности не было пределов. Все понимали, что, начав за здравие, кончат обязательно иначе. Почти 15 лет общественное мнение держало оборону. Но законы человеческого разума неумолимы – все что возможно технически, на что нет непреодолимых принципиальных запретов, обязательно будет воплощено в жизнь. Возможности исправления генетических дефектов, радикального избавления от любых болезней, имели столь очевидное для каждого значения (личное, для близких, для детей), что возражения падали одно за другим. Для того чтобы окончательно успокоить сомневающихся, изменили терминологию. Теперь это стало называться “генная терапия”. Ну есть лечение травами, микроэлементами, витаминами, антибиотиками и т. д. Добавим еще лечение генами. И в конце 80-х годов, сначала в США, а затем и в ряде других стран сугубо демократически, с всеобщего согласия начались санкционированные испытания на людях, теперь уже под названием “генной терапии”.
Сегодня на различных стадиях разработки находится более двухсот клинических протоколов генной терапии. Как это реализуется практически? В генной терапии достаточно четко можно выделить три принципиальных подхода: лечение классических наследственных болезней, “хирургическая” генная терапия и лечение массовых патологий. Они различаются особенностями участия в них наследственного аппарата человека.
Классические наследственные болезни (в основном моногенные) характеризуются дефектом гена, который имеется во всех клетках организма. Этот дефект и ведет к патологии. Одна (но конкретная) нуклеотидная замена в гене глобина приводит к серповидноклеточной анемии; выпадение фрагмента гена глобина – к талассемии и т. д. Нарушен только один ген. Все остальное в организме не нарушено. И, теоретически, если ввести в клетки полноценный ген, то он обеспечит синтез полноценного продукта, наступит радикальное излечение. Конечно, здесь имеется очень много особенностей. Но в случаях наиболее простых (и наиболее распространенных) наследственных дефектов – это так. По своим функциям гены делятся на общеклеточные (они работают во всех клетках, поддерживая их существование) и тканеспецифические. Так, гемоглобин нужен и, соответственно, вырабатывается только в эритроидных клетках. Во всех остальных он не функционирует, и для клетки не имеет значения дефектен он или нет. Поэтому достаточно полноценный ген глобина ввести только в клетки эритроидного ряда. Поскольку же они, в свою очередь, образуются из стволовых, то достаточно ввести полноценный ген (конечно, в составе адекватной молекулярной конструкции) в относительно небольшое и, главное, доступное для такой процедуры количество стволовых клеток. Через некоторое время “не то”, станет “тем”.
“Хирургическая” генная терапия используется при таких болезнях, которые характеризуются тем, что и гены и их регуляция в организме полноценные. Но возникла патология в генетическом аппарате локальной группы (или групп) клеток. Например, при злокачественных опухолях. Убрать бы эти клетки из организма, все до единой, и болезнь бы ушла. Для достижения такой цели в генной терапии используют своеобразный временно-локальный подход. В случае онкологических болезней из биопсийного материала отделяют и переводят в культуру опухольпроникающие лимфоциты. Их размножают, вводят в них ген, кодирующий соответствующий иммунноактивный продукт (интерлейкин 2, фактор некроза опухоли и т. д.), и возвращают в организм больного. Такие генетически трансформированные лимфоциты уничтожают опухолевые клетки. Но время жизни лимфоцитов – примерно месяц. Если за это время они уничтожают все опухолевые клетки – задача выполнена, и сами измененные лимфоциты исчезают. Если опухоль разрушена за это время только частично, процедуру повторяют. Вводимые гены можно раз от раза варьировать. И так – до победы. Гены приводящие к гибели опухоли можно вводить и в сами опухолевые клетки. Но общим принципом здесь является то, что после излечения (полного) в организме не остается и тех генетически измененных клеток, которые такое излечение обеспечили.
При массовых патологиях сами гены не нарушены. Но в результате каких-то, в разных случаях разных, многоуровневых и множественных событий нарушена регуляция функционирования одного или нескольких генов. Простое введение в клетки еще одного (или нескольких) таких же генов ничего не дает. Ведь и собственный ген не нарушен. А регуляция на то и регуляция, чтобы держать активность на заданном уровне. Начни все гены функционировать по максимуму своих возможностей – организм мгновенно пойдет в разнос. До такой жуткой патологии даже природа не додумалась. Тут и болезни никакой дополнительной не надо. Именно поэтому большинство генов у человека ткане- и стадиоспецифические. Они функционируют на определенной стадии индивидуального развития и только в определенных тканях, часто вообще в ограниченном числе клеток.
Например, диабет. Повреждения гена инсулина, приводящие к диабету, описаны как уникальные наследственные болезни. А при остальных (практически всех) случаях этой болезни ген инсулина не нарушен. Но функционирует он только в -клетках поджелудочной железы (и весьма ограниченно – в некоторых клетках центральной нервной системы). А во всех остальных – выключен множественной, для надежности, регуляцией. Человек может умирать от нехватки инсулина, но регуляция не позволит включиться ни одному гену инсулина ни в одной другой клетке. Поэтому при генной терапии массовых патологий, в силу указанных особенностей, создают такие молекулярные конструкции, в которых клеточная регуляция не может выключить вводимый ген, хотя на собственный, резидентный, она действует. Достигается это тем, что у гена убираются все “свои” регуляторные участки и ставятся другие. Возникает молекулярная химера – структурный ген (кодирующий белок) остается исходным (таким же как в клетках), а регуляторные последовательности берутся от иных генов (часто вообще не клеточных). Теперь клетка не может выключить своей регуляцией вводимый извне ген. И он будет функционировать на заданном уровне, уйдя от нарушенной в организме регуляции.
Остается последняя задача – ввести созданную молекулярную конструкцию в клетки организма. Принципиально это можно осуществить двумя путями. Первый путь предусматривает извлечение из организма клеток (стволовых или вообще способных к размножению), обработку их созданным генетическим материалом (если надо – с последующим отбором и подращиванием) и возвращение в организм. По второму пути молекулярная конструкция вводится непосредственно в организм – в кровь или прямой инъекцией в ткань.
Для того, чтобы конструкция вошла в клетки, ее одевают в вирусный капсид, соединяют с лигандом к соответствующему рецептору, помещают в липосому и т. д.
История состояния на сегодня и прогноз развития на обозримую перспективу генных технологий в медицине.
| Рекомбинантные белки | Генная диагностика | Последовательность генома | Генная вакцинация | Генная терапия | Искусственные органы | Внутриклеточная иммунизация | Белковая инженерия | Генная инженерия человека | |
| 1972 | Сформировано представление об общности молекулярных основ живого | Создание техники рекомбинантных ДНК | |||||||
| | | | |||||||
| 1980 | Первый генно-инженерный синтез пептида человека (соматостатин) в бактериях Первый, санкционированный к применению, пептид человека (инсулин), полученный в бактериях по генно-инженерной технологии | Первые несанкционированные опыты на людях по генной терапии (аргининемия), называемой тогда “генной инженерией человека” Вторая группа несанкционированных опытов на людях по генной терапии, все еще называемой “генной инженерией человека” | Разработка на животных технологий изменения в поколениях методами генной инженерии | ||||||
| | | | | | | | | | |
| 1990 | Широкое получение рекомбинантных белков и пептидов для лечения, иммунизации и диагностики | Закладываются основы генной диагностики Быстрое совершенствование и расширение возможностей генной диагностики | Создан и начал функционировать проект “Геном человека” | Работы по генной вакцинации с использованием "параллельных" вакцин | Первые санкционированные опыты на людях по отработке технологии генной терапии Первые санкционированные опыты на людях по генной терапии с целью лечения | Закладываются основы технологий уничтожения заданных клеток в организме. Создание технологий получения кожи человека | Формирование первых представлений о внутриклеточной вакцинации | Разработка общих теоретических представлений белковой инженерии | Получение первых моделей наследственных болезней на животных и стремительно набирающая темпы разработка технологии изменения в поколениях модельных животных методами генной инженерии |
| | | | | | | | | | |
| 1997 | Массовая индустрия, применение, испытания и получение новых рекомбинантных белков и пептидов человека для лечения, иммунизации и диагностики. Здесь уже фактически нет ограничений | Перенос генной диагностики в клиники, расширение ее спектра, нарастающие темпы разработки практически приемлемых технологий генной диагностики зигот | Стремительно развивается проект “Геном человека”, определена первичная последовательность более 10% всех структурных генов человека | Быстро набирающие темпы исследования по генной вакцинации | Набирающая темпы и расширяющаяся по номенклатуре генная терапия человека с массовой развивающейся базой и подготовкой новых возможностей | Создание и разработка различных технологий уничтожения любых заданных клеток на животных моделях. Разработка технологий получения искусственных биологических органов и разных тканей | Первые санкционированные опыты на людях по внутриклеточной иммунизации, лавинообразный рост исследований | Медленно и очень тяжело, но неуклонно набирают темпы исследования по белковой инженерии | Массовое получение моделей наследственных болезней человека на животных и продолжение совершенствования технологии широких изменений в поколениях |
| | | | | | | | | | |
| 2000 | Массовое применение рекомбинантных белков в медицине становится рутинным | Генная диагностика становится рутинным клиническим анализом. Начало практического перехода к диагностике дефектов одновременно нескольких генов, а так же патологий, при которых влияние генов выражено "слабо" | Определение четверти всех структурных генов человека и быстрое дальнейшее продвижение программы “Геном человека” | Первые санкционированные опыты на людях по генной вакцинации | Начало клинического масштабирования генной терапии. Первые опыты на людях по генной терапии возрастной патологии | Разработка технологий уничтожения любых клеток, их сообществ, тканей и органов. Первые опыты на людях по подсадке искусственно созданных биологических органов и разных тканей | Подготовка к масштабированию внутриклеточной иммунизации | Ускорение работ по белковой инженерии, основанных на прорыве в области теории расчета строения и функции белка на основе данных о его первичной структуре | Методическая готовность для генной терапии на уровне зародышевых клеток человека |
| | | | | | | | | | |
| 2010 | Рекомбинантные белки и пептиды человека как основные терапевтические и профилактические средства для употребления "извне", (инъекции, мази и т.д.) | Генная диагностика множественных нарушений в геномах – "слабых мутаций" – становится рутинным клиническим исследованием | Окончание определения полной последовательности всего генома человека. Переход на масштабные определения геномов у индивидуумов | Практическое применение технологии генной вакцинации. Обеспечение требуемого функционирования любых введенных на постнатальном уровне генов | Устранение отдельных генетических дефектов как рутинная клиническая процедура. Клиническое масштабирование генной терапии возрастной патологии | Начало масштабированных замен тканей и органов искусственно созданными аналогами из модифицированных и выращенных вне организма клеток данного индивидуума | Лечение и профилактика вирусных и опухолевых болезней на основе внутриклеточной иммунизации как рутинная клиническая процедура | Первые санкционированные опыты на людях по белковой инженерии. Опыты по белковой инженерии на животных | Начало санкционированных опытов по преобразованию человека в поколениях (генная инженерия на зародышевых клетках) |
| Начало санкционированных работ по полномасштабной реконструкции человека на постнатальном уровне и в поколениях | |||||||||
Вероятно, читающий это описание, уже понял, что за всей легкостью изложения типа “создание соответствующих молекулярных конструкций”, “ген начал функционировать несмотря на регуляцию, выключающую свой, такой же, но клеточный ген” и т. д. стоят технические и технологические трудности почти фантастической сложности. Задача же состоит в том, чтобы генная терапия из рекордов виртуозов превратилась в рутинную медицинскую процедуру. Поэтому сегодня уже создан и стремительно расширяется фронт работ по решению такой задачи. Сегодня на людях испытывают технологии генной терапии гемофилии, муковисцидоза, синдрома врожденного иммунодефицита, опухолевой болезни и некоторых других. Лечение более чем десятка патологий уже апробировано генной терапией на животных и проходит путь формального санкционирования для перехода на людей. Для лечения еще нескольких десятков болезней технологии оттачиваются на животных. Для этого создаются специальные их линии с генетическими дефектами, аналогичными таковым при генетически детерминированных болезнях человека.
Поскольку критический этап, связанный с решением принципиальных вопросов, пройден, в генную терапию начали устремляться могущественные фирмы с практически неограниченными материальными и финансовыми возможностями. Это, безусловно, не просто ускорит работы по доведению генной терапии до клиник, но и расширит сферу ее применения. Уже сегодня полномасштабно ставится вопрос о генной вакцинации, о внутриклеточной иммунизации, пересадке генетически адаптированных тканей и органов и т. д. Но реальностью становится и то, что казалось принципиально неразрешимым – генная терапия разных видов возрастной патологии. Нами, совместно с группой исследователей под руководством академика В.В.Фролькиса, показано, что могут быть созданы молекулярные конструкции, способные оказывать терапевтический эффект у старых животных более интенсивно, чем у молодых. Продемонстрировано это на примере нарушений, связанных с сосудами, что само по себе более чем актуально. Но это значит также, что можно создать системы генных воздействий и на иные виды возрастной патологии.
Если теперь все это свести воедино, то пугавший когда-то термин “генная терапия человека” окажется безнадежно устаревшим в силу своей ограниченности. Сегодня полноразмерным является комплекс “генных технологий человека”, уже начинающий плавно перерастать в еще более широкомасштабный комплекс ближайшего будущего – технологии “биологической реконструкции человека”. Для тех, кто не работает в данной области, такие понятия звучат как нечто за гранью фантастики. А специалисты развитых стран прогнозируют начало рутинного применения в клиниках первых технологий генной терапии рубежом оканчивающегося века, т. е. всего-то через каких-нибудь 3 года. С последующим крутым нарастанием. И для того, чтобы представить себе очень недалекое будущее на поддающуюся прогнозу глубину, можно посмотреть на приведенную слева схему.
superbotanik.net
Гены и генная терапия - реферат
Сергей Львович Киселев, д.б.н., проф., зав. лаб. молекулярной генетики рака Ин-та биологии гена РАН.
Несколько лет назад на уровне глав государств, как великое достижение человечества, было всемирно заявлено о прочтении первичной последовательности генома человека, включающей предположительно порядка 30-40 тыс. генов. Что же такое ген, для чего он нужен в организме и почему его можно использовать как терапевтическое средство?
Существование единицы наследственности, т.е. некой условной единицы, которая определяет передачу того или иного признака от родителей к детям, предсказал еще в позапрошлом веке Грегор Мендель. Скрупулезно наблюдая за горохом в ряду поколений, он вывел свои знаменитые законы. В первой половине прошлого, XX в., эти законы развил Томас Морган. Для целого поколения российских ученых менделизм-морганизм означал клеймо, за которое либо ссылали, либо просто заставляли отречься от своих убеждений. Ко второй половине XX в. стало более или менее понятно, что представляет собой единица наследственной информации. Ее материальный носитель, ДНК (дезоксирибонуклеиновая кислота), находящаяся в ядре клетки, служит некой матрицей, позволяющей благодаря заложенной в ней программе существовать всему живому, от вирусов до человека. Эта возможность реализуется через два универсальных механизма, заложенных в структуре и коде ДНК: репликации и транскрипции. Репликация - процесс воспроизводства: цепи двуцепочечной молекулы комплементарны, благодаря чему она сама достраивает себя и таким образом обеспечивается идентичность. В ходе транскрипции с одной цепи синтезируется рибонуклеиновая кислота (РНК), с которой уже считываются функциональные белки, из которых построено все живое.
Зачем такой сложный механизм? Поскольку уникальная последовательность всех нуклеотидов - кирпичиков ДНК - невероятно большая (несколько миллиардов нуклеотидов), копирование такого количества невозможно без неких ошибок. Одни устраняются в ходе синтеза ДНК (репарация), другие на этапе синтеза РНК, третьи при синтезе белков. Однако система не совершенна, и случаются ошибки, которые дают начало мутациям. Одни из них - вредные, могут приводить к преждевременной гибели организма, другие - положительные, дают ему некие преимущества, а третьи - безразличны в пределах некого периода времени.
Известно, что почти все заболевания так или иначе связаны с нарушением работы генов, т.е. с негативными мутациями. И генная терапия как один из подходов молекулярной медицины направлена на то, чтобы так или иначе восстановить контроль за работой и функцией гена. В одних случаях, когда больные клетки потеряли функцию какого-либо гена, ее необходимо восстановить. Осуществляется это путем физического переноса гена в организм и далее в клетку. В других случаях, когда болезнь вызывается избыточной функцией, не свойственной нормальной клетке (например, при раке или инфекционных заболеваниях), работу гена надо подавить.
Принципиальное отличие генной терапии от любой другой в том, что она направлена на устранение не симптомов заболевания, а его первопричины. В недалеком будущем благодаря созданию генетической карты каждого отдельного человека можно будет предсказать, а, значит, и предотвратить вероятную предрасположенность к заболеваниям. Некоторые из них уже сегодня могут служить объектом генной терапии (табл.1).
Составляющие генной терапии
Прошло 15 лет с того момента, когда начались испытания генного воздействия на детей с дефектом гена фермента аденозиндезаминазы (ADA). В организм вводили аденовирус, который кодировал недостающий фермент. Вирус проникал в клетки, и тогда генетически модифицированные клетки синтезировали аденозиндезаминазу. Такая терапия позволила почти втрое сократить лекарственное лечение, стоимость которого составляла 60 тыс. долл. в год.
В настоящее время в мире проводится множество клинических испытаний по генной терапии тех или иных заболеваний (рис.1). За прошедшие годы генная терапия испытала целый ряд подъемов и падений, которые были вызваны широко разрекламированными, но не оправдавшимися ожиданиями. Это связано в первую очередь с тем, что коммерциализация и применение технологий стали опережать процесс познания законов природы. Развитие генной терапии можно сравнить с эволюцией биотехнологии, которая в начале 80-х находилась в глубочайшем кризисе, а теперь занимает ведущее положение наравне с информатикой.
Рис.1. Диаграммы количественного распределения пациентов по типам заболеваний (вверху) и по типу использования векторов.
Сегодня существует два типа генно-терапевтического воздействия: ex vivo и in vivo, но в любом случае это воздействие оказывается на соматические клетки, а не на клетки зародышевого пути. В случае eх vivo подход индивидуализирован: генно-инженерные манипуляции сначала проводят с клетками пациента in vitro, потом уже эти генетически обработанные клетки попадают обратно в организм. В случае in vivo ген вводят в организм пациента в составе векторной молекулы.
До настоящего времени все клинические исследования сфокусированы на внесении дополнительных генов, а не на коррекции существующих или на их замещении, что значительно сложнее. Но в любом случае ген необходимо доставить во все, в любые или в какие-либо определенные типы клеток и тканей. Отсюда следует два важных вывода. Во-первых, неотъемлемость генной терапии от Т-клеток и, как следствие, отсутствие генной терапии как таковой, а реальное существование генно-клеточной терапии. Оба эти термина мы в дальнейшем будем отождествлять. Во-вторых, как и для любого вида лекарственной терапии, основной проблемой остается доставка действующего начала (в нашем случае гена) в нужное место и с высокой эффективностью. Транспорт и проявление нужного гена в клетке обеспечивает вектор, к которому “прикрепляются” гены или их фрагменты. Вектор - широкое понятие: это общее название “транспортного средства” для целенаправленной доставки того или иного вещества, и не только гена, а любых, даже таких традиционных лекарств, как анальгина или аспирина. Лекарственный препарат, попадающий в организм, как правило, традиционным путем, действует почти на все клетки, а надо подействовать или на определенную группу клеток, или даже на участок генома, специфичный для определенной группы клеток. С другой стороны, транспортируемое вещество необходимо “защитить” от повреждений. Сегодня самая большая проблема медицины, которую пытаются решить десятки биотехнологических компаний, - направленная, т.е. векторная доставка и ее эффективность.
Для генной терапии векторы бывают либо синтетическими (основаны на полимерных материалах, например липосомах), либо “натуральными”, т.е. природного происхождения (чаще всего это вирусы или плазмиды). Вирусы, применяемые здесь в качестве векторов, лишены своих вредоносных свойств и практически безопасны для человека. Но, к сожалению, реально возможна недоработка в технологии. Тому есть примеры, ставшие одной из основных причин временного спада интереса к этому направлению медицины. Так, в конце 90-х была зафиксирована смерть от генной терапии, когда вектором служил аденовирус. На самом деле смерть вызвал не вектор, а превышение дозы, определенной протоколом исследования, а также недоработка технологии, в результате чего произошла интоксикация организма пациента из-за его повышенной чувствительности. Но здесь скорее виноват человеческий фактор, потому что индивидуальные реакции организма часто непредсказуемы. Известно, что в мире от предоперационного наркоза ежегодно гибнут или остаются полными инвалидами примерно 40 тыс. человек. И с этим пока ничего сделать нельзя.
В 2002 г. проявились осложнения в ходе другого клинического исследования. Речь идет о так называемой ОКИН (острой комбинированной иммунной недостаточности) - тяжелой врожденной патологии, при которой новорожденного ребенка немедленно помещают в специальную стерильную камеру, поскольку любой микроорганизм для него смертельно опасен. Такие дети редко доживают до своего первого дня рождения, а стоимость поддержания их жизни очень высока. Во Франции проводятся клинические испытания метода генной терапии при лечении ОКИН. После коррекции гена удавалось практически полностью восстановить иммунную систему. Но сначала у одного ребенка, а потом еще у одного началась лейкемия. Это случилось из-за того, что ретровирус, примененный в качестве вектора, встроился в определенное место клеточного генома и нарушил работу других генов. Исследования хотели прекратить, но по требованию родителей их продолжили. Почему? Ответ простой: для таких больных нет других методов лечения. Даже в барокамере их продолжительность жизни - несколько лет. Подобная терапия дает им возможность жить намного дольше и полноценно, а лейкемия, особенно в детском возрасте, хорошо поддается химиотерапевтическому лечению. Грубо говоря, из двух зол выбирают наименьшее. Кроме этого, необходимо помнить слова Парацельса: “Яд - это всего лишь вопрос дозы”. Завышенная доза ретровирусного вектора нарушает работу других генов. А подбор эффективной терапевтической дозы, не имеющей негативных последствий, и есть одна из важнейших задач как доклинического исследования, так и клинических испытаний.
Другие векторные молекулы проникают в клетки организма с меньшей эффективностью, но одновременно и более безопасны. Совсем недавно в сотрудничестве с Научно-исследовательским центром сердечно-сосудистой хирургии им.Бакулева нашей лабораторией была продемонстрирована эффективность использования нативной, или так называемой “голой” плазмидной ДНК, кодирующей стимулятор роста сосудов - васкулярный фактор роста эндотелия (VEGF). Испытания проводились на пациентах с периферической ишемией, у которых нарушено кровоснабжение тканей. Если стимулировать рост сосудов, ишемия отступит, восстановится нормальная ткань и кровоснабжение. Полученные результаты оказались замечательными: у всех пациентов, включая тех, кому грозила ампутация, наблюдался долговременный и сильный эффект. Применение подобной терапии у пациентов с ишемией сердца на настоящий момент подтверждает эффективность метода.
Терапия опухолей
Не секрет, что, несмотря на существенное улучшение методов борьбы с опухолями, онкологические заболевания продолжают оставаться одной из основных причин смертности. По данным Национального ракового института США, за последнее десятилетие смертность от рака снизилась на 15-17%, но одновременно с этим встречаемость заболевания увеличилась на 50%. Похоже, что эффективность традиционных методов лечения рака достигла своего максимума. Необходимо искать принципиально новые подходы к терапии опухолей. Достижения современной молекулярной биологии и генетики позволяют надеяться, что такие средства будут найдены.
В настоящее время молекулярно-генетические принципы возникновения опухолей в основном понятны. Открыта и охарактеризована большая группа онкогенов, мутации в которых приводят к их повышенной экспрессии и, как следствие, к злокачественной трансформации клеток. Другая группа генов, обозначаемых как гены-супрессоры опухолей, кодируют белки, подавляющие клеточный рост. Инактивация таких генов также способствует превращению нормальной клетки в опухолевую. Наконец, выявлено большое число генов, изменения в которых всегда ведут к перерождению первичной, относительно доброкачественной опухоли. Ее клетки становятся злокачественными, способными к инвазивному, деструктивному росту и метастазированию, т.е. переносу и росту в новых местах. Более того, трансформированные клетки могут атаковать и уничтожать нормальные клетки организма.
Хотя мы узнали очень много о механизмах возникновения рака, это не привело к немедленному решению проблемы рака, т.е. к разработке методов его лечения. Одна из причин - разнообразие генетических изменений, вызывающих рак. Более того, в одной опухоли могут присутствовать клетки с разными генетическими портретами, которые выражаются в виде опухолевых антигенов. Другая причина - невозможность вызвать генетические изменения абсолютно во всех опухолевых клетках так, чтобы подавить их рост. Наконец, третья причина - это высокая пластичность опухолевых клеток, их способность накапливать мутации, сохраняя жизнеспособность. В результате некоторым клеткам удается избежать гибели, и они снова дают рост опухоли.
Таким образом, современные подходы к генной терапии опухолей основаны, во-первых, на нормализации работы мутировавшего гена (онкогена или гена-супрессора) и, во-вторых, на обучении иммунной системы организма распознавать опухолевые антигены и активировать противоопухолевый иммунный ответ.
К первому относятся попытки подавить работу наиболее часто активируемых онкогенов, например, онкогена ras, или, наоборот, вызвать образование нормального продукта гена-супрессора опухолей, например, белка р53. В частности, заражение опухолей вирусами, синтезирующими нормальный белок р53, останавливает развитие опухоли, хотя и не приводит к полному излечению.
Здесь мы подходим к основополагающей проблеме любой неинвазивной терапии. Ведь если мы инфицируем вирусным вектором целый организм, то и нормальные клетки заражаются вирусом, который будет всегда либо синтезировать нормальный белок р53, либо инактивировать экспрессию гена ras. И то и другое может иметь негативные последствия для нормальной клетки. Значит, повысить эффективность воздействия и снизить негативные эффекты может только направленная или адресная доставка терапевтического средства. Работы в данном направлении интенсивно ведутся, но каких-либо существенных достижений пока не опубликовано.
Второй подход основан на мобилизации иммунной системы организма против опухоли. В рамках теории иммунного надзора, трансформированные клетки должны удаляться с помощью клеток иммунной системы. Однако наличие опухолей указывает на низкую эффективность этого надзора, а может быть, и на его полное отсутствие. Одновременно с этим имеется целый ряд документированных фактов, подтверждающих принципиальную возможность существования противоопухолевого иммунитета. Это и случаи спонтанной регрессии опухоли; и обнаружение в организме пациентов клеток иммунной системы, распознающих опухолевые клетки; и многочисленные эксперименты на животных, в которых достигался терапевтический эффект. Эти факты не могли не привести к идее противоопухолевой вакцинации, тем более что противопатогенные вакцины уже доказали свою эффективность. Но в данном случае речь идет не о профилактической вакцинации, а о вакцинации уже инфицированного организма, т.е. о терапевтической вакцинации, что весьма непросто, если нужно вызвать специфический иммунный ответ. “Иммунизировать против рака будет так же сложно, как организму отторгнуть правое ухо, оставив незатронутым левое”, - писал В.Вуглум в журнале “Раковые исследования” (США) в начале XX в.
За последнее десятилетие за рубежом проведено большое количество клинических испытаний по противоопухолевой вакцинации. Так, в США за один только год (2003) прошло более 100 клинических исследований по вакцинотерапии опухолей. В основном их можно разделить на три группы. К первой относят клинические исследования, в которых в качестве иммуногенов используются известные опухолевые антигены в виде синтетических пептидов. Для этого определяется наличие этих антигенов в опухоли пациента и проводится иммунизация соответствующими пептидами. При подобном подходе частичный регресс опухоли достигался только в 2-3% случаев. С точки зрения клинической медицины применение стандартизованных химических пептидов имеет неоспоримое преимущество. Однако, во-первых, эффективность такой вакцинации незначительна, во-вторых, количество известных опухолевых антигенов еще очень ограничено. Кроме того, в организме пациентов уже сформировалась толерантность к опухолевым антигенам, используемым для вакцинации. Значит, необходимо каким-то образом либо преодолеть эту толерантность, либо применять те опухолевые антигены, на которые она еще не сформировалась.
Эти задачи пытаются решить в исследованиях, относящихся ко второй группе. Здесь источником опухолевых антигенов служат сами инактивированные опухолевые клетки, которые для преодоления толерантности генетически модифицируются, чтобы секретировать различные цитокины, такие как интерлейкин-2, -4, -7, интерферон, фактор, стимулирующий рост колоний, и целый ряд других. Все перечисленные цитокины принимают участие в формировании приобретенного иммунного ответа. Большинство опухолевых клеток, модифицированных для продукции определенных цитокинов, in vitro не замедляют свой рост. Однако in vivo рост опухоли значительно замедляется, что говорит об активации иммунного ответа организма благодаря цитокинам. Механизмы данного процесса до конца не ясны и могут отличаться для различных цитокинов. Тем не менее использование инактивированных цитокин-продуцирующих опухолевых клеток для иммунизации пациентов применяется в клинике, однако его эффективность составляет 3-4%.
К третьей группе относятся вакцины на основе дендритных клеток пациента, которые нагружаются вне организма (ex vivo) опухолевыми антигенами в виде пептидов или клеточных лизатов. Эффективность такой вакцинации, а именно случаи частичного регресса опухоли, составляет 7-7.5%.
Как видно из приведенных клинических данных, эффективность терапевтических вакцин достаточно низкая. Как это объяснить и как повысить их эффективность?
Для того чтобы разобраться со сложным процессом возможного противоопухолевого ответа, совершим небольшой экскурс в теорию иммунного ответа. В упрощенном виде иммунная система атакует то, что имеет признак “чужого” или/и не имеет признака “своего”. Эволюционируя, иммунная система должна была противостоять, в первую очередь, наружной инфекции, которая не имеет признаков “своего”, но несет признак “чужого”. Но трансформация собственных клеток организма и, как следствие, отсутствие признака “чужой”, а в то же время присутствие признака “свой”, приводит к возникновению толерантности в отношении переродившихся клеток. В данном случае мы даже не рассматриваем те опухоли, которые сами “научились” распознавать и атаковать клетки иммунной системы, например, через Fas лигандзависимый лизис. Таким образом, чтобы обеспечить эффективное распознавание опухолевых клеток, мы должны пометить их маркером “чужой”, а чтобы удалить их - активировать цитотоксический ответ.
Антиген-презентирующие клетки (АПК), к которым относятся дендритные клетки, макрофаги и некоторые другие, взаимодействуют с патогеном. Поглощенный патоген индуцирует синтез антигенных пептидов, которые представляются в комплексе с антигенами главного комплекса гистосовместимости (major histocomplatibility complex - MHC), формируя первый сигнальный каскад. Одновременно с этим АПК распознает “чужого”, запускает цитокиновый каскад и синтезирует костимуляторную (кооперативно действующую) молекулу В7, обеспечивая второй сигнальный каскад. Таким образом наивная Т-клетка превращается в обученную клетку-помощника. Через сложный каскад цитокинов и взаимодействий такая клетка инициирует антительный и/или цитотоксический Т-лимфоцитарный ответ (рис.2). Для надежности природой придуманы два сигнала, помогающие избежать ответа на “свои” антигены, который может привести к аутоиммунным заболеваниям. В случае злокачественной трансформации клеток организма именно отсутствие второго сигнала блокирует противоопухолевый ответ иммунной системы. Распознавание “чужого” происходит с помощью врожденной системы защиты организма.
Рис.2. Схема взаимодействия антиген-презентирующей клетки (АПК) с Т-лимфоцитом, который еще никогда не встречался с патогенами. Для того, чтобы Т-лимфоциты научились распознавать патоген, необходимо образование Т-хелперов - лимфоцитов-помощников (Тh2, Th3). Это происходит лишь в случае получения двух сигналов: одного - через Т-клеточный рецептор (TCR) от главного комплекса гистосовместимости второго типа (МНСII), второго - благодаря взаимодействию костимуляторных молекул CD28 и В7. Первый сигнал обусловливает последующую направленность Т-лимфоцита на определенный антиген, а второй подтверждает чужеродность антигена. Т-лимфоциты узнают этот антиген на поверхности любой другой клетки организма, которую нужно уничтожить. Антиген-презентирующая клетка обеспечивает Т-лимфоцит обоими сигналами. Для синтеза В7 АПК должна посредством патоген-распознающих молекул узнать “чужое”. Одновременно с этим патоген поглощается антиген-презентирующей клеткой, а его антигенные пептиды транспортируются на поверхность АПК с молекулой MHCII. Весь этот контактный процесс дополнительно сопровождается секрецией определенных цитокинов.
Еще не так давно врожденная система защиты рассматривалась как некая примитивная система, обеспечивающая первичную защиту организма от инфекций. Теперь стало ясно, что она не столь примитивна, а должна сложным образом отличить “свое” от “чужого” и, более того, без ее правильного функционирования нет адекватного адаптивного ответа организма. В систему врожденного распознавания “чужого” и адекватного реагирования вовлечен целый ряд распознающих и сигнальных молекул. Наиболее хорошо изучено семейство TLR (Toll like receptors) млекопитающих.
Совсем недавно в нашей лаборатории, а позднее и зарубежными исследователями обнаружено новое семейство сигнальных и распознающих молекул. Мы назвали новое семейство Tag7 - по первому обнаруженному члену семейства, а зарубежные авторы - PGRP; они работали на стандартном объекте генетиков - плодовой мушке дрозофиле, а мы изучали функции представителей этого семейства у млекопитающих. Перечислять все выявленные функции этих молекул в рамках одной статьи не имеет смысла. Остановимся на найденных и оказавшихся существенными для дальнейшей работы по созданию противоопухолевой вакцины. Первое замечательное свойство секретируемого белка Tag7/PGRP состоит в том, что он привлекает к месту секреции (т.е. к клеткам, выделяющим белок в окружающую среду) клетки иммунной системы, в том числе и профессиональные антиген-презентирующие клетки. Второе его свойство, которое решили использовать при создании вакцины, - способность активировать созревание дендритных клеток, т.е. стимулировать экспрессию сигнальной молекулы В7, которая и обеспечивает последующее созревание наивного Т-лимфоцита.
Насколько эффективен тот или иной подход, какой механизм вовлечен в формирование противоопухолевого ответа, изучается на экспериментальных моделях, на животных. Мы использовали линии клеток мышиной меланомы, которые могут расти как в культуре (вне организма), так и после их введения животным. В культуре клетки наращивались до определенного количества, затем их генетически модифицировали вектором, содержащим ген tag7/PGRP. После этого опухолевые клетки начинали секретировать белок Tag7/PGRP, количество которого измерялось. Далее клетки облучали для подавления их деления, т.е. инактивировали, и вводили животным в качестве вакцины. Через 10 дней, после формирования иммунного ответа, в противоположную ногу животным вводили исходные (неинактивированные и немодифицированные) опухолевые клетки и в дальнейшем наблюдали за ними. Оказалось, что на иммунизированных таким образом животных опухоли практически не формировались или, появившись, вскоре исчезали, все животные при этом выживали. В контрольных группах животных опухоли развивались, и мыши погибали.
В других экспериментах мы использовали так называемых “голых” мышей - у них отсутствуют Т-лимфоциты. Считается, что именно эти клетки играют одну из основных ролей в элиминации опухолей. Животным, полностью лишенным Т-клеток, вакцинация не помогала, что говорило о том, что и в нашем случае Т-клетки чрезвычайно важны для противоопухолевого ответа. Последующие опыты показали, что в наблюдаемом нами противоопухолевом ответе организма определенное участие принимают и натуральные киллеры, и В-лимфоциты. Никаких побочных негативных явлений, вызванных вакцинацией, не отмечалось. Более трех лет в нашей лаборатории шли опыты на животных, а результаты публиковались в престижных международных журналах. В терапевтической схеме, т.е. когда сначала вводили опухолевые клетки и лишь потом вакцину, эффективность была меньше, но тем не менее большое количество животных выживало.
После успешных экспериментов на животных в 2000 г. решили начать клинические испытания. В этом нам очень помогли руководство и сотрудники РОНЦ им.Н.Н.Блохина РАМН в Москве и НИИ онкологии им.Н.Н.Петрова в Санкт-Петербурге. Составили Протокол проведения клинических испытаний. По действующим жестким правилам первые испытания новых способов лечения проводятся на пациентах, которым уже никакая другая терапия помочь не в состоянии; в данном случае на больных меланомой (одним из самых страшных видов рака), для которых методы лечения были исчерпаны.
Схема индивидуального приготовления вакцины выглядит следующим образом: из удаленной во время хирургической операции опухоли отбирается первичный опухолевый материал, и из него в лабораторных условиях получают первичную опухолевую клеточную линию. Далее эти клетки размножают и подбирают условия для их генетической модификации. После проведения самой генетической модификации, инактивации опухолевых клеток радиацией и определения уровня экспрессии гена вакцина готова. В 2001 г. вакцинировали первого пациента. К настоящему времени начальную фазу испытаний можно считать успешно завершенной. По результатам проведенных исследований написана и опубликована статья в международном журнале.
Каков краткий итог проведенных исследований? Нашим коллегам-клиницистам удалось добиться стабилизации заболевания в 25% случаев, а частичного регресса опухоли - в 7% случаев. Конечно, эти цифры не впечатляют, но если сравнить с выше приведенными данными, где эффективность похожего подхода составляла всего 3%, то использование активаторов врожденного компонента иммунной защиты (белка Tag7/PGRP) повысило положительную динамику в два раза. В то же время надо понимать, что с помощью вакцины практически нельзя удалить большую опухоль, тем более если пациент уже прошел курс химиотерапии и его иммунная система подавлена не только прогрессирующей опухолью, но и проводимой терапией. Какова же область применения аутологичной вакцины? Несомненно, она нужна после хирургического вмешательства, чтобы избежать рецидивов заболевания. Когда удален крупный опухолевый узел, возможный источник метастазов, эта вакцина способна уничтожить невидимые глазу врача единичные опухолевые клетки.
Зарубежные лаборатории и клиники уже накопили большой опыт подобных работ. В России же - это первое и пока единственное клиническое испытание вакцинотерапии опухолей с помощью аутологичных генетически модифицированных клеток. За это время нам пришлось преодолеть массу трудностей. Эффективность получения клеточной линии из опухолевого материала весьма низкая, порядка 10-15%. Реально приготовление вакцины занимает 3-5 мес и требует участия квалифицированных специалистов, которых в нашей стране практически не осталось. Кроме этого, для работы необходимы высококачественные импортные клеточные реагенты, специальное оборудование, абсолютная стерильность, а это существенно влияет на стоимость исследований. Клиническое исследование, проведенное нами, оказалось возможным только благодаря поддержке, получаемой от мэра г.Москвы Ю.М.Лужкова.
Несомненно, предложенный нами подход показал свою эффективность, но его можно и нужно улучшать. Во-первых, необходимо в будущей вакцине совместить активацию врожденного компонента и приобретенного иммунитета. В настоящее время в нашей лаборатории такие исследования проводятся. Во-вторых, сделать клиническое применение вакцины более удобным и менее дорогостоящим. Для этого имеются все предпосылки, поскольку в ходе клинических исследований сформировался банк опухолевых клеточных линий, охарактеризованных по многим параметрам. В настоящее время мы подбираем наиболее эффективные с точки зрения представленности опухолевых антигенов клеточные линии для приготовления аллогенной (не персональной) генетически модифицированной вакцины. Такой стандартный препарат, готовый к использованию, сократит и время от момента операции до начала его применения.
В заключение хочется подчеркнуть два важных момента. Для лечения онкологических заболеваний нельзя найти одно универсальное лекарство - слишком многообразны трансформированные (злокачественные) клетки. Именно поэтому мы разработали целый ряд генно-терапевтических подходов по блокированию кровеснабжения опухоли. Лишенная питания и кислорода опухолевая ткань должна погибнуть. Но даже и комбинация двух методов не станет панацеей. Необходимы дальнейшие исследования и испытания методов. При этом всегда надо помнить, что чудес не бывает.
2dip.su
Реферат - Допинги и генная терапия
Николай Дмитриевич Дурманов, Генеральный секретарь Российского антидопингового агентства (RADA)
В период крупных международных соревнований, каковыми, несомненно, являются Олимпийские игры, активизируются разговоры о допинговых скандалах и предположения о наличии новых суперсовременных фармацевтических возможностей, разрабатываемых для спортивного бизнеса. Что здесь правда, а что досужие выдумки? Мы предоставляем слово генеральному секретарю Российского антидопингового агентства (RADA) Николаю Дмитриевичу ДУРМАНОВУ.
Мировая политика в области спорта и подготовки спортсменов широко известна: все борются с допингами – и Международный олимпийский комитет (МОК), и Совет по спорту при Президенте США, другие международные организации. Однако по ряду признаков можно уже говорить о том, что в мире, особенно на Западе, предпринимаются попытки воспользоваться иными возможностями для улучшения спортивных показателей, в частности — генной терапией.
Попробуем разобраться. В этическом плане существует запрет на использование зародышевых клеток в медицинских и научных целях, но можно воспользоваться соматическими клетками человека. На сегодняшний день более всего подобных протоколов с использованием генетического материала утверждено и используется при лечении тяжелых смертельных болезней, и, конечно, такие случаи не вызывают этических сомнений ни у ученых, ни у общества.
Какова же техника использования генного материала? В вирус вводится целевой ген, затем материал “подсаживается” пациенту по двум возможным схемам: замена имеющегося гена; коррекция имеющегося гена.
При современной научной базе для этих целей могут быть использованы клетки печени, спинного мозга. Если клетку возвратить пациенту с новым генным набором, то можно, к примеру, “отключить” у человека ощущение боли. Ясно, зачем такая операция нужна онкологическому больному, но этой же методикой можно резко изменить возможности спортсмена – выносливость, действия в условиях нехватки кислорода, снижение утомляемости. И сегодня практически нет препятствий для развития этого направления спортивной медицины.
Опытным путем установлено, что дополнительное введение рипокси-гена позволяет поддерживать у спортсмена уровень гемоглобина в крови на отметке 190 единиц в течение 3 недель!
В опытах на мышах с использованием этих методик за 3 недели масса тела животного увеличивалась на 20%, то есть выращивалась “мышь-Шварцнеггер”. Доказано, что переносчиками нужного гена могут быть вирусы, и эффективность результата может зависеть от выбора гена и типа вируса.
Подобные методики разрабатываются изначально с благими целями, например, для лечения нервных болезней, болезни Альцгеймера, но протоколы по генной терапии уже пришли в большой спорт. Используя их, можно компенсировать ряд состояний и свойств человека – усталость, ощущение боли, устойчивость к гипоксии и т.д. Такая подготовка спортсменов может давать результаты на порядок выше использования психотропных препаратов. Остается вопрос, где кончается медицина и начинается допинг? Ясно, что при лечении травм мышц, связок использование данных методик будут многократно эффективнее любых известных препаратов по заживлению. Под благовидным предлогом данные протоколы могут быть использованы как допинг, т.к. до 150 генов человека связаны с получением спортивных показателей. По ним уже сегодня можно определить: может ли спортсмен быть стайером или спринтером, подсчитать его уровень утомляемости, рассчитать методику подготовки. По генам можно выяснить, будет ли спортсмен гением выносливости и каков его индивидуальный порог.
Сегодня зафиксирован интерес спортсменов к разработкам, ведущимся в ряде западных лабораторий. Введение новых генов не “ловится”, как фармакологические препараты, по параметрам крови, ген поступает в ткани, маркеров проведенных процедур просто нет. Данные разработки делают перспективы допинг-контроля весьма туманными, а возможность использования генной терапии — достаточно вероятной. В этой ситуации спортивные состязания могут превратиться в соревнования лабораторий по совершенствованию методик генной терапии. И если мы не будем обращать внимание на эти вопросы, не наладим подобные работы, то и в области неизлечимых болезней, и в спорте окажемся аутсайдерами.
Проблему комментирует академик РАН, директор Института биоорганической химии и медицины СО РАН Валентин Викторович Власов
Генотерапия — это введение в геном клетки новых генетических программ. Делается это либо для восполнения дефекта, когда собственный клеточный ген не работает, либо для того, чтобы в клетке мог нарабатываться некий новый продукт, генетической программы для которого в клетке нет. Однако до сих пор эффективных и безопасных методов создать не удалось. Если это делать, просто вводя в кровь или ткани генетические конструкции, в клетки проникает лишь ничтожная часть материала. Есть способ, позволяющий очень эффективно вводить генетический материал в клетки — с помощью вирусов, которые в ходе эволюции приобрели способность эффективно встраивать свои гены в геном человека. Но вирусы вызывают иммунный ответ, а главное — они могут “встраивать” ген в любые участки человеческого генома и потенциально несут угрозу нарушения регуляции клеточных генов и превращения нормальных клеток в злокачественные. Таким образом, сегодня классические подходы генотерапии не готовы для применения, даже для решения простейших задач.
Однако в последнее время появились реальные надежды на скорое внедрение генотерапии в практику — путем комбинации ее методов с техникой стволовых клеток. Стволовые клетки могут делиться и размножаться неограниченное количество раз, т.е. они практически бессмертны. Во-вторых, они — клетки-предшественники, изначально не имеющие специализации, но способные в процессе деления дать специализированных потомков — клетки определенных видов. Таким образом, из первоначально неспециализированных стволовых клеток можно растить клетки любых органов, причем вне организма, в биореакторах, в больших количествах. Получены обещающие результаты при попытках применения стволовых клеток для лечения инфаркта миокарда. Введенные в кровь пациента стволовые клетки накапливаются в области повреждения и начинают размножаться в поврежденной ткани, дифференцируясь в необходимые для заживления клетки. Широки потенциальные возможности применения терапии стволовыми клетками в спортивной медицине — ведь спортсмены часто травмируются, а времени на долгое лечение у них нет. Очевидны потенциальные возможности восстановления с помощью стволовых клеток хрящевых, нервных тканей, ускорение лечения травм и переломов.
Сейчас опыты по использованию стволовых клеток ведутся во всем мире, в том числе и в России. Серьезных систематических исследований их применения в практической медицине пока нет, а уже развернута огромная рекламная кампания и десятки организаций предлагают услуги по излечению стволовыми клетками любых болезней — от облысения и импотенции до раковых заболеваний и старости. Никаких разрешений у них, понятно, нет, и никаких гарантий они, естественно, дать не могут.
Возвращаясь к генотерапии: техника работы со стволовыми клетками позволяет снять проблему доставки генов. Можно взять стволовые клетки у пациента, провести с ними необходимые манипуляции и ввести в них нужные гены вне организма — пусть с низкой эффективностью, зато безопасно. А дальше — отобрать и размножить полученные клетки с нужными свойствами в необходимом количестве, а затем ввести их пациенту. Перед этим можно заранее запрограммировать их на превращение в клетки требуемой ткани.
А теперь о допинге, о введении спортсменам генов, продуцирующих “внутренние” биологически активные вещества, которые могут повысить возможности спортсменов. Возможно ли использовать технологии генотерапии с такими целями? Конечно, да, особенно если не задумываться о том, что будет впоследствии со спортсменами. Работающий в клетках организма ген – это надолго или навсегда. Повышенная продукция даже безобидного, “родного” биологически активного вещества в организме неминуемо затронет регуляторные системы, следящие за балансом биологически активных веществ в крови. Предсказать долговременные последствия таких вмешательств — трудная задача.
Можно ли “спрятать” такие генетические модификации организма? Пока о них совсем ничего неизвестно и их не умеют обнаруживать — они помогут нечестно занимать призовые места. Но как только станет известно, что появился новый допинг, проводится детальная аналитическая работа, идентифицируется вещество и разрабатывается нужный метод детекции. Точно так же и с генами: методы генодиагностики позволят обнаружить гены — продуценты допинга очень легко: функционирующий ген не спрячешь. Можно, конечно, сделать так, что будет совершенно нормальный ген, как бы свой, но производящий очень много продукта, нужного спортсмену для достижения успеха. Но ведь не скроешь повышенное содержание продукта гена в крови. Его легко аналитически определить, и если такие технологии попытаются использовать, наверняка будет введен контроль и установлены пределы содержания естественных биологически активных веществ в крови. Если у спортсменов эти пределы превышены — последует детальное разбирательство, углубленный анализ их геномов, и генные модификации будут обнаружены.
Процессы изобретения допингов и средств контроля за их использованием, как и соревнование снаряда и защищающей от него брони — процессы бесконечные.
www.ronl.ru
Реферат: Гены и генная терапия
Сергей Львович Киселев, д.б.н., проф., зав. лаб. молекулярной генетики рака Ин-та биологии гена РАН.
Несколько лет назад на уровне глав государств, как великое достижение человечества, было всемирно заявлено о прочтении первичной последовательности генома человека, включающей предположительно порядка 30-40 тыс. генов. Что же такое ген, для чего он нужен в организме и почему его можно использовать как терапевтическое средство?
Существование единицы наследственности, т.е. некой условной единицы, которая определяет передачу того или иного признака от родителей к детям, предсказал еще в позапрошлом веке Грегор Мендель. Скрупулезно наблюдая за горохом в ряду поколений, он вывел свои знаменитые законы. В первой половине прошлого, XX в., эти законы развил Томас Морган. Для целого поколения российских ученых менделизм-морганизм означал клеймо, за которое либо ссылали, либо просто заставляли отречься от своих убеждений. Ко второй половине XX в. стало более или менее понятно, что представляет собой единица наследственной информации. Ее материальный носитель, ДНК (дезоксирибонуклеиновая кислота), находящаяся в ядре клетки, служит некой матрицей, позволяющей благодаря заложенной в ней программе существовать всему живому, от вирусов до человека. Эта возможность реализуется через два универсальных механизма, заложенных в структуре и коде ДНК: репликации и транскрипции. Репликация - процесс воспроизводства: цепи двуцепочечной молекулы комплементарны, благодаря чему она сама достраивает себя и таким образом обеспечивается идентичность. В ходе транскрипции с одной цепи синтезируется рибонуклеиновая кислота (РНК), с которой уже считываются функциональные белки, из которых построено все живое.
Зачем такой сложный механизм? Поскольку уникальная последовательность всех нуклеотидов - кирпичиков ДНК - невероятно большая (несколько миллиардов нуклеотидов), копирование такого количества невозможно без неких ошибок. Одни устраняются в ходе синтеза ДНК (репарация), другие на этапе синтеза РНК, третьи при синтезе белков. Однако система не совершенна, и случаются ошибки, которые дают начало мутациям. Одни из них - вредные, могут приводить к преждевременной гибели организма, другие - положительные, дают ему некие преимущества, а третьи - безразличны в пределах некого периода времени.
Известно, что почти все заболевания так или иначе связаны с нарушением работы генов, т.е. с негативными мутациями. И генная терапия как один из подходов молекулярной медицины направлена на то, чтобы так или иначе восстановить контроль за работой и функцией гена. В одних случаях, когда больные клетки потеряли функцию какого-либо гена, ее необходимо восстановить. Осуществляется это путем физического переноса гена в организм и далее в клетку. В других случаях, когда болезнь вызывается избыточной функцией, не свойственной нормальной клетке (например, при раке или инфекционных заболеваниях), работу гена надо подавить.
Принципиальное отличие генной терапии от любой другой в том, что она направлена на устранение не симптомов заболевания, а его первопричины. В недалеком будущем благодаря созданию генетической карты каждого отдельного человека можно будет предсказать, а, значит, и предотвратить вероятную предрасположенность к заболеваниям. Некоторые из них уже сегодня могут служить объектом генной терапии (табл.1).

Составляющие генной терапии
Прошло 15 лет с того момента, когда начались испытания генного воздействия на детей с дефектом гена фермента аденозиндезаминазы (ADA). В организм вводили аденовирус, который кодировал недостающий фермент. Вирус проникал в клетки, и тогда генетически модифицированные клетки синтезировали аденозиндезаминазу. Такая терапия позволила почти втрое сократить лекарственное лечение, стоимость которого составляла 60 тыс. долл. в год.
В настоящее время в мире проводится множество клинических испытаний по генной терапии тех или иных заболеваний (рис.1). За прошедшие годы генная терапия испытала целый ряд подъемов и падений, которые были вызваны широко разрекламированными, но не оправдавшимися ожиданиями. Это связано в первую очередь с тем, что коммерциализация и применение технологий стали опережать процесс познания законов природы. Развитие генной терапии можно сравнить с эволюцией биотехнологии, которая в начале 80-х находилась в глубочайшем кризисе, а теперь занимает ведущее положение наравне с информатикой.

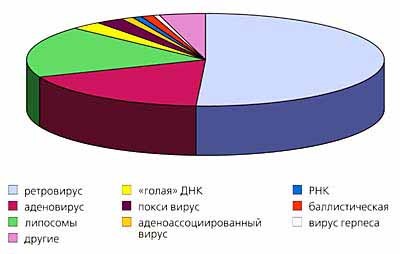
Рис.1. Диаграммы количественного распределения пациентов по типам заболеваний (вверху) и по типу использования векторов.
Сегодня существует два типа генно-терапевтического воздействия: ex vivo и in vivo, но в любом случае это воздействие оказывается на соматические клетки, а не на клетки зародышевого пути. В случае eх vivo подход индивидуализирован: генно-инженерные манипуляции сначала проводят с клетками пациента in vitro, потом уже эти генетически обработанные клетки попадают обратно в организм. В случае in vivo ген вводят в организм пациента в составе векторной молекулы.
До настоящего времени все клинические исследования сфокусированы на внесении дополнительных генов, а не на коррекции существующих или на их замещении, что значительно сложнее. Но в любом случае ген необходимо доставить во все, в любые или в какие-либо определенные типы клеток и тканей. Отсюда следует два важных вывода. Во-первых, неотъемлемость генной терапии от Т-клеток и, как следствие, отсутствие генной терапии как таковой, а реальное существование генно-клеточной терапии. Оба эти термина мы в дальнейшем будем отождествлять. Во-вторых, как и для любого вида лекарственной терапии, основной проблемой остается доставка действующего начала (в нашем случае гена) в нужное место и с высокой эффективностью. Транспорт и проявление нужного гена в клетке обеспечивает вектор, к которому “прикрепляются” гены или их фрагменты. Вектор - широкое понятие: это общее название “транспортного средства” для целенаправленной доставки того или иного вещества, и не только гена, а любых, даже таких традиционных лекарств, как анальгина или аспирина. Лекарственный препарат, попадающий в организм, как правило, традиционным путем, действует почти на все клетки, а надо подействовать или на определенную группу клеток, или даже на участок генома, специфичный для определенной группы клеток. С другой стороны, транспортируемое вещество необходимо “защитить” от повреждений. Сегодня самая большая проблема медицины, которую пытаются решить десятки биотехнологических компаний, - направленная, т.е. векторная доставка и ее эффективность.
Для генной терапии векторы бывают либо синтетическими (основаны на полимерных материалах, например липосомах), либо “натуральными”, т.е. природного происхождения (чаще всего это вирусы или плазмиды). Вирусы, применяемые здесь в качестве векторов, лишены своих вредоносных свойств и практически безопасны для человека. Но, к сожалению, реально возможна недоработка в технологии. Тому есть примеры, ставшие одной из основных причин временного спада интереса к этому направлению медицины. Так, в конце 90-х была зафиксирована смерть от генной терапии, когда вектором служил аденовирус. На самом деле смерть вызвал не вектор, а превышение дозы, определенной протоколом исследования, а также недоработка технологии, в результате чего произошла интоксикация организма пациента из-за его повышенной чувствительности. Но здесь скорее виноват человеческий фактор, потому что индивидуальные реакции организма часто непредсказуемы. Известно, что в мире от предоперационного наркоза ежегодно гибнут или остаются полными инвалидами примерно 40 тыс. человек. И с этим пока ничего сделать нельзя.
В 2002 г. проявились осложнения в ходе другого клинического исследования. Речь идет о так называемой ОКИН (острой комбинированной иммунной недостаточности) - тяжелой врожденной патологии, при которой новорожденного ребенка немедленно помещают в специальную стерильную камеру, поскольку любой микроорганизм для него смертельно опасен. Такие дети редко доживают до своего первого дня рождения, а стоимость поддержания их жизни очень высока. Во Франции проводятся клинические испытания метода генной терапии при лечении ОКИН. После коррекции гена удавалось практически полностью восстановить иммунную систему. Но сначала у одного ребенка, а потом еще у одного началась лейкемия. Это случилось из-за того, что ретровирус, примененный в качестве вектора, встроился в определенное место клеточного генома и нарушил работу других генов. Исследования хотели прекратить, но по требованию родителей их продолжили. Почему? Ответ простой: для таких больных нет других методов лечения. Даже в барокамере их продолжительность жизни - несколько лет. Подобная терапия дает им возможность жить намного дольше и полноценно, а лейкемия, особенно в детском возрасте, хорошо поддается химиотерапевтическому лечению. Грубо говоря, из двух зол выбирают наименьшее. Кроме этого, необходимо помнить слова Парацельса: “Яд - это всего лишь вопрос дозы”. Завышенная доза ретровирусного вектора нарушает работу других генов. А подбор эффективной терапевтической дозы, не имеющей негативных последствий, и есть одна из важнейших задач как доклинического исследования, так и клинических испытаний.
Другие векторные молекулы проникают в клетки организма с меньшей эффективностью, но одновременно и более безопасны. Совсем недавно в сотрудничестве с Научно-исследовательским центром сердечно-сосудистой хирургии им.Бакулева нашей лабораторией была продемонстрирована эффективность использования нативной, или так называемой “голой” плазмидной ДНК, кодирующей стимулятор роста сосудов - васкулярный фактор роста эндотелия (VEGF). Испытания проводились на пациентах с периферической ишемией, у которых нарушено кровоснабжение тканей. Если стимулировать рост сосудов, ишемия отступит, восстановится нормальная ткань и кровоснабжение. Полученные результаты оказались замечательными: у всех пациентов, включая тех, кому грозила ампутация, наблюдался долговременный и сильный эффект. Применение подобной терапии у пациентов с ишемией сердца на настоящий момент подтверждает эффективность метода.
Терапия опухолей
Не секрет, что, несмотря на существенное улучшение методов борьбы с опухолями, онкологические заболевания продолжают оставаться одной из основных причин смертности. По данным Национального ракового института США, за последнее десятилетие смертность от рака снизилась на 15-17%, но одновременно с этим встречаемость заболевания увеличилась на 50%. Похоже, что эффективность традиционных методов лечения рака достигла своего максимума. Необходимо искать принципиально новые подходы к терапии опухолей. Достижения современной молекулярной биологии и генетики позволяют надеяться, что такие средства будут найдены.
В настоящее время молекулярно-генетические принципы возникновения опухолей в основном понятны. Открыта и охарактеризована большая группа онкогенов, мутации в которых приводят к их повышенной экспрессии и, как следствие, к злокачественной трансформации клеток. Другая группа генов, обозначаемых как гены-супрессоры опухолей, кодируют белки, подавляющие клеточный рост. Инактивация таких генов также способствует превращению нормальной клетки в опухолевую. Наконец, выявлено большое число генов, изменения в которых всегда ведут к перерождению первичной, относительно доброкачественной опухоли. Ее клетки становятся злокачественными, способными к инвазивному, деструктивному росту и метастазированию, т.е. переносу и росту в новых местах. Более того, трансформированные клетки могут атаковать и уничтожать нормальные клетки организма.
Хотя мы узнали очень много о механизмах возникновения рака, это не привело к немедленному решению проблемы рака, т.е. к разработке методов его лечения. Одна из причин - разнообразие генетических изменений, вызывающих рак. Более того, в одной опухоли могут присутствовать клетки с разными генетическими портретами, которые выражаются в виде опухолевых антигенов. Другая причина - невозможность вызвать генетические изменения абсолютно во всех опухолевых клетках так, чтобы подавить их рост. Наконец, третья причина - это высокая пластичность опухолевых клеток, их способность накапливать мутации, сохраняя жизнеспособность. В результате некоторым клеткам удается избежать гибели, и они снова дают рост опухоли.
Таким образом, современные подходы к генной терапии опухолей основаны, во-первых, на нормализации работы мутировавшего гена (онкогена или гена-супрессора) и, во-вторых, на обучении иммунной системы организма распознавать опухолевые антигены и активировать противоопухолевый иммунный ответ.
К первому относятся попытки подавить работу наиболее часто активируемых онкогенов, например, онкогена ras, или, наоборот, вызвать образование нормального продукта гена-супрессора опухолей, например, белка р53. В частности, заражение опухолей вирусами, синтезирующими нормальный белок р53, останавливает развитие опухоли, хотя и не приводит к полному излечению.
Здесь мы подходим к основополагающей проблеме любой неинвазивной терапии. Ведь если мы инфицируем вирусным вектором целый организм, то и нормальные клетки заражаются вирусом, который будет всегда либо синтезировать нормальный белок р53, либо инактивировать экспрессию гена ras. И то и другое может иметь негативные последствия для нормальной клетки. Значит, повысить эффективность воздействия и снизить негативные эффекты может только направленная или адресная доставка терапевтического средства. Работы в данном направлении интенсивно ведутся, но каких-либо существенных достижений пока не опубликовано.
Второй подход основан на мобилизации иммунной системы организма против опухоли. В рамках теории иммунного надзора, трансформированные клетки должны удаляться с помощью клеток иммунной системы. Однако наличие опухолей указывает на низкую эффективность этого надзора, а может быть, и на его полное отсутствие. Одновременно с этим имеется целый ряд документированных фактов, подтверждающих принципиальную возможность существования противоопухолевого иммунитета. Это и случаи спонтанной регрессии опухоли; и обнаружение в организме пациентов клеток иммунной системы, распознающих опухолевые клетки; и многочисленные эксперименты на животных, в которых достигался терапевтический эффект. Эти факты не могли не привести к идее противоопухолевой вакцинации, тем более что противопатогенные вакцины уже доказали свою эффективность. Но в данном случае речь идет не о профилактической вакцинации, а о вакцинации уже инфицированного организма, т.е. о терапевтической вакцинации, что весьма непросто, если нужно вызвать специфический иммунный ответ. “Иммунизировать против рака будет так же сложно, как организму отторгнуть правое ухо, оставив незатронутым левое”, - писал В.Вуглум в журнале “Раковые исследования” (США) в начале XX в.
За последнее десятилетие за рубежом проведено большое количество клинических испытаний по противоопухолевой вакцинации. Так, в США за один только год (2003) прошло более 100 клинических исследований по вакцинотерапии опухолей. В основном их можно разделить на три группы. К первой относят клинические исследования, в которых в качестве иммуногенов используются известные опухолевые антигены в виде синтетических пептидов. Для этого определяется наличие этих антигенов в опухоли пациента и проводится иммунизация соответствующими пептидами. При подобном подходе частичный регресс опухоли достигался только в 2-3% случаев. С точки зрения клинической медицины применение стандартизованных химических пептидов имеет неоспоримое преимущество. Однако, во-первых, эффективность такой вакцинации незначительна, во-вторых, количество известных опухолевых антигенов еще очень ограничено. Кроме того, в организме пациентов уже сформировалась толерантность к опухолевым антигенам, используемым для вакцинации. Значит, необходимо каким-то образом либо преодолеть эту толерантность, либо применять те опухолевые антигены, на которые она еще не сформировалась.
Эти задачи пытаются решить в исследованиях, относящихся ко второй группе. Здесь источником опухолевых антигенов служат сами инактивированные опухолевые клетки, которые для преодоления толерантности генетически модифицируются, чтобы секретировать различные цитокины, такие как интерлейкин-2, -4, -7, интерферон, фактор, стимулирующий рост колоний, и целый ряд других. Все перечисленные цитокины принимают участие в формировании приобретенного иммунного ответа. Большинство опухолевых клеток, модифицированных для продукции определенных цитокинов, in vitro не замедляют свой рост. Однако in vivo рост опухоли значительно замедляется, что говорит об активации иммунного ответа организма благодаря цитокинам. Механизмы данного процесса до конца не ясны и могут отличаться для различных цитокинов. Тем не менее использование инактивированных цитокин-продуцирующих опухолевых клеток для иммунизации пациентов применяется в клинике, однако его эффективность составляет 3-4%.
К третьей группе относятся вакцины на основе дендритных клеток пациента, которые нагружаются вне организма (ex vivo) опухолевыми антигенами в виде пептидов или клеточных лизатов. Эффективность такой вакцинации, а именно случаи частичного регресса опухоли, составляет 7-7.5%.
Как видно из приведенных клинических данных, эффективность терапевтических вакцин достаточно низкая. Как это объяснить и как повысить их эффективность?
Для того чтобы разобраться со сложным процессом возможного противоопухолевого ответа, совершим небольшой экскурс в теорию иммунного ответа. В упрощенном виде иммунная система атакует то, что имеет признак “чужого” или/и не имеет признака “своего”. Эволюционируя, иммунная система должна была противостоять, в первую очередь, наружной инфекции, которая не имеет признаков “своего”, но несет признак “чужого”. Но трансформация собственных клеток организма и, как следствие, отсутствие признака “чужой”, а в то же время присутствие признака “свой”, приводит к возникновению толерантности в отношении переродившихся клеток. В данном случае мы даже не рассматриваем те опухоли, которые сами “научились” распознавать и атаковать клетки иммунной системы, например, через Fas лигандзависимый лизис. Таким образом, чтобы обеспечить эффективное распознавание опухолевых клеток, мы должны пометить их маркером “чужой”, а чтобы удалить их - активировать цитотоксический ответ.
Антиген-презентирующие клетки (АПК), к которым относятся дендритные клетки, макрофаги и некоторые другие, взаимодействуют с патогеном. Поглощенный патоген индуцирует синтез антигенных пептидов, которые представляются в комплексе с антигенами главного комплекса гистосовместимости (major histocomplatibility complex - MHC), формируя первый сигнальный каскад. Одновременно с этим АПК распознает “чужого”, запускает цитокиновый каскад и синтезирует костимуляторную (кооперативно действующую) молекулу В7, обеспечивая второй сигнальный каскад. Таким образом наивная Т-клетка превращается в обученную клетку-помощника. Через сложный каскад цитокинов и взаимодействий такая клетка инициирует антительный и/или цитотоксический Т-лимфоцитарный ответ (рис.2). Для надежности природой придуманы два сигнала, помогающие избежать ответа на “свои” антигены, который может привести к аутоиммунным заболеваниям. В случае злокачественной трансформации клеток организма именно отсутствие второго сигнала блокирует противоопухолевый ответ иммунной системы. Распознавание “чужого” происходит с помощью врожденной системы защиты организма.
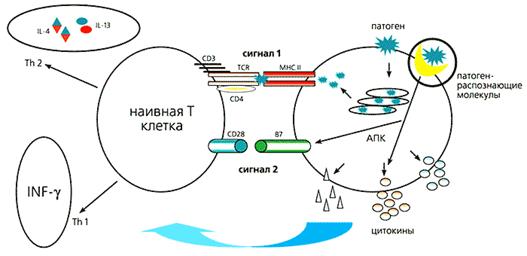
Рис.2. Схема взаимодействия антиген-презентирующей клетки (АПК) с Т-лимфоцитом, который еще никогда не встречался с патогенами. Для того, чтобы Т-лимфоциты научились распознавать патоген, необходимо образование Т-хелперов - лимфоцитов-помощников (Тh2, Th3). Это происходит лишь в случае получения двух сигналов: одного - через Т-клеточный рецептор (TCR) от главного комплекса гистосовместимости второго типа (МНСII), второго - благодаря взаимодействию костимуляторных молекул CD28 и В7. Первый сигнал обусловливает последующую направленность Т-лимфоцита на определенный антиген, а второй подтверждает чужеродность антигена. Т-лимфоциты узнают этот антиген на поверхности любой другой клетки организма, которую нужно уничтожить. Антиген-презентирующая клетка обеспечивает Т-лимфоцит обоими сигналами. Для синтеза В7 АПК должна посредством патоген-распознающих молекул узнать “чужое”. Одновременно с этим патоген поглощается антиген-презентирующей клеткой, а его антигенные пептиды транспортируются на поверхность АПК с молекулой MHCII. Весь этот контактный процесс дополнительно сопровождается секрецией определенных цитокинов.
Еще не так давно врожденная система защиты рассматривалась как некая примитивная система, обеспечивающая первичную защиту организма от инфекций. Теперь стало ясно, что она не столь примитивна, а должна сложным образом отличить “свое” от “чужого” и, более того, без ее правильного функционирования нет адекватного адаптивного ответа организма. В систему врожденного распознавания “чужого” и адекватного реагирования вовлечен целый ряд распознающих и сигнальных молекул. Наиболее хорошо изучено семейство TLR (Toll like receptors) млекопитающих.
Совсем недавно в нашей лаборатории, а позднее и зарубежными исследователями обнаружено новое семейство сигнальных и распознающих молекул. Мы назвали новое семейство Tag7 - по первому обнаруженному члену семейства, а зарубежные авторы - PGRP; они работали на стандартном объекте генетиков - плодовой мушке дрозофиле, а мы изучали функции представителей этого семейства у млекопитающих. Перечислять все выявленные функции этих молекул в рамках одной статьи не имеет смысла. Остановимся на найденных и оказавшихся существенными для дальнейшей работы по созданию противоопухолевой вакцины. Первое замечательное свойство секретируемого белка Tag7/PGRP состоит в том, что он привлекает к месту секреции (т.е. к клеткам, выделяющим белок в окружающую среду) клетки иммунной системы, в том числе и профессиональные антиген-презентирующие клетки. Второе его свойство, которое решили использовать при создании вакцины, - способность активировать созревание дендритных клеток, т.е. стимулировать экспрессию сигнальной молекулы В7, которая и обеспечивает последующее созревание наивного Т-лимфоцита.
Насколько эффективен тот или иной подход, какой механизм вовлечен в формирование противоопухолевого ответа, изучается на экспериментальных моделях, на животных. Мы использовали линии клеток мышиной меланомы, которые могут расти как в культуре (вне организма), так и после их введения животным. В культуре клетки наращивались до определенного количества, затем их генетически модифицировали вектором, содержащим ген tag7/PGRP. После этого опухолевые клетки начинали секретировать белок Tag7/PGRP, количество которого измерялось. Далее клетки облучали для подавления их деления, т.е. инактивировали, и вводили животным в качестве вакцины. Через 10 дней, после формирования иммунного ответа, в противоположную ногу животным вводили исходные (неинактивированные и немодифицированные) опухолевые клетки и в дальнейшем наблюдали за ними. Оказалось, что на иммунизированных таким образом животных опухоли практически не формировались или, появившись, вскоре исчезали, все животные при этом выживали. В контрольных группах животных опухоли развивались, и мыши погибали.
В других экспериментах мы использовали так называемых “голых” мышей - у них отсутствуют Т-лимфоциты. Считается, что именно эти клетки играют одну из основных ролей в элиминации опухолей. Животным, полностью лишенным Т-клеток, вакцинация не помогала, что говорило о том, что и в нашем случае Т-клетки чрезвычайно важны для противоопухолевого ответа. Последующие опыты показали, что в наблюдаемом нами противоопухолевом ответе организма определенное участие принимают и натуральные киллеры, и В-лимфоциты. Никаких побочных негативных явлений, вызванных вакцинацией, не отмечалось. Более трех лет в нашей лаборатории шли опыты на животных, а результаты публиковались в престижных международных журналах. В терапевтической схеме, т.е. когда сначала вводили опухолевые клетки и лишь потом вакцину, эффективность была меньше, но тем не менее большое количество животных выживало.
После успешных экспериментов на животных в 2000 г. решили начать клинические испытания. В этом нам очень помогли руководство и сотрудники РОНЦ им.Н.Н.Блохина РАМН в Москве и НИИ онкологии им.Н.Н.Петрова в Санкт-Петербурге. Составили Протокол проведения клинических испытаний. По действующим жестким правилам первые испытания новых способов лечения проводятся на пациентах, которым уже никакая другая терапия помочь не в состоянии; в данном случае на больных меланомой (одним из самых страшных видов рака), для которых методы лечения были исчерпаны.
Схема индивидуального приготовления вакцины выглядит следующим образом: из удаленной во время хирургической операции опухоли отбирается первичный опухолевый материал, и из него в лабораторных условиях получают первичную опухолевую клеточную линию. Далее эти клетки размножают и подбирают условия для их генетической модификации. После проведения самой генетической модификации, инактивации опухолевых клеток радиацией и определения уровня экспрессии гена вакцина готова. В 2001 г. вакцинировали первого пациента. К настоящему времени начальную фазу испытаний можно считать успешно завершенной. По результатам проведенных исследований написана и опубликована статья в международном журнале.
Каков краткий итог проведенных исследований? Нашим коллегам-клиницистам удалось добиться стабилизации заболевания в 25% случаев, а частичного регресса опухоли - в 7% случаев. Конечно, эти цифры не впечатляют, но если сравнить с выше приведенными данными, где эффективность похожего подхода составляла всего 3%, то использование активаторов врожденного компонента иммунной защиты (белка Tag7/PGRP) повысило положительную динамику в два раза. В то же время надо понимать, что с помощью вакцины практически нельзя удалить большую опухоль, тем более если пациент уже прошел курс химиотерапии и его иммунная система подавлена не только прогрессирующей опухолью, но и проводимой терапией. Какова же область применения аутологичной вакцины? Несомненно, она нужна после хирургического вмешательства, чтобы избежать рецидивов заболевания. Когда удален крупный опухолевый узел, возможный источник метастазов, эта вакцина способна уничтожить невидимые глазу врача единичные опухолевые клетки.
Зарубежные лаборатории и клиники уже накопили большой опыт подобных работ. В России же - это первое и пока единственное клиническое испытание вакцинотерапии опухолей с помощью аутологичных генетически модифицированных клеток. За это время нам пришлось преодолеть массу трудностей. Эффективность получения клеточной линии из опухолевого материала весьма низкая, порядка 10-15%. Реально приготовление вакцины занимает 3-5 мес и требует участия квалифицированных специалистов, которых в нашей стране практически не осталось. Кроме этого, для работы необходимы высококачественные импортные клеточные реагенты, специальное оборудование, абсолютная стерильность, а это существенно влияет на стоимость исследований. Клиническое исследование, проведенное нами, оказалось возможным только благодаря поддержке, получаемой от мэра г.Москвы Ю.М.Лужкова.
Несомненно, предложенный нами подход показал свою эффективность, но его можно и нужно улучшать. Во-первых, необходимо в будущей вакцине совместить активацию врожденного компонента и приобретенного иммунитета. В настоящее время в нашей лаборатории такие исследования проводятся. Во-вторых, сделать клиническое применение вакцины более удобным и менее дорогостоящим. Для этого имеются все предпосылки, поскольку в ходе клинических исследований сформировался банк опухолевых клеточных линий, охарактеризованных по многим параметрам. В настоящее время мы подбираем наиболее эффективные с точки зрения представленности опухолевых антигенов клеточные линии для приготовления аллогенной (не персональной) генетически модифицированной вакцины. Такой стандартный препарат, готовый к использованию, сократит и время от момента операции до начала его применения.
В заключение хочется подчеркнуть два важных момента. Для лечения онкологических заболеваний нельзя найти одно универсальное лекарство - слишком многообразны трансформированные (злокачественные) клетки. Именно поэтому мы разработали целый ряд генно-терапевтических подходов по блокированию кровеснабжения опухоли. Лишенная питания и кислорода опухолевая ткань должна погибнуть. Но даже и комбинация двух методов не станет панацеей. Необходимы дальнейшие исследования и испытания методов. При этом всегда надо помнить, что чудес не бывает.
superbotanik.net
Генная терапия – новая эра новой эры
Чем проще идея, тем труднее она для практической реализации. Сколько спорят, есть ли жизнь на Марсе! Идея решения удивительно проста – полететь туда и посмотреть на месте. К таким “простым” идеям до недавнего времени относилась проблема радикального лечения болезней. Поскольку болезнь возникает вследствие того, что в организме “что-то не так”, то сделать чтобы было “так” и болезни не станет. К сожалению, как при всех простых идеях, уже со следующего шага, сразу после их изложения начинались неразрешимые проблемы. В данном случае таким первым последующим шагом было выяснение что же это такое, “что-то”, что такое “так” и что такое “не так”, которое надо вернуть в “так”.
Сегодня известно, что первоосновой, информационной базой всего организма являются гены. Изменение их структуры или активности является первопричиной изменений в организме. А болезнь причинно-следственно связана с дефектом одного из них (или некоторой их части), т. е. ген и есть то самое “что-то”. Тогда следует заменить дефектные гены на полноценные и “не так” вернется в “так” – больной выздоровеет радикально.
Попробуем сформулировать что для этого надо. Надо знать, какой же конкретно ген отвечает своим дефектом за данную патологию. Этот ген надо получить. Получив – ввести обратно в клетку. Сделать так, чтобы после введения было обеспечено его требуемое функционирование. В свою очередь каждое из этих “надо” состоит из блока сложнейших проблем, любая из которых требует для своего решения выполнения многих задач “ну очень” высокой степени трудности. Если же все это соотнести в виде реальных технологий к человеку, то еще недавно казалось, что спокойно можно прогнозировать реализацию этой “простой” идеи на какое-нибудь пятое или, еще лучше, шестое тысячелетие. Скорее всего, так было бы действительно лучше. Но реальность оказалась иной.
Предтечей грядущего стали очень странные на то время работы Грифитса, который в 1928 г. обнаружил, что непатогенный пневмококк можно превратить в патогенный посредством какого-то вещества, которое содержится в клетках и которое можно из клеток извлечь. Естественно, это не могло восприниматься иначе чем курьез. Но он как заноза требовал решения. Ведь вещество вызывало не просто изменения, а совершенно (и всегда!) конкретные. И даже не мелкие изменения, а появление патогенности. Ну, ладно, еще бы утрату, а то ведь появление! Решение курьезу было найдено через 15 лет. В то время, когда на планете бушевала вторая мировая война и на полях ее сражений решались судьбы человеческой цивилизации, в тиши лабораторий Эвери и Мак Карти решали судьбу самого человечества. Естественно, они об этом даже не подозревали. Но именно ими тогда было показано, что полимерными молекулами дезоксирибонуклеиновой кислоты, т. е. химически очищенным веществом, впервые полученным еще в конце прошлого столетия Мишером, можно передавать наследственные признаки. Вещество является материальным носителем наследственности!!!
Тогда это было сделано на микроорганизмах. Но иллюзий, что такое возможно только для них, уже не питал никто. И когда Уотсон и Крик выбрали для расшифровки пространственной структуры именно ДНК – они знали что делали. Предложенная ими в 1953 г. модель строения вещества наследственности показала ту основу, с которой можно работать. Работать как с любой молекулой, делая искусственно наследственность. Технически тогда еще это было невозможно. Но все прекрасно понимали, что это дело только времени.
Возможно вы искали - Реферат: Вода - энергоноситель, способный заменить нефть.
Осознавая случившееся, в своем грустном прогнозе Чаргаф предупреждал, что овладение техникой производства наследственности в пробирке и реализация ее в живое “нечто”, приведет к последствиям, по сравнению с которыми атомные бомбы, стершие с лица земли Хиросиму и Нагасаки, будут воспринимать как пасхальные яйца. Но джин уже был выпущен из бутылки. Стремительно развивалась база знаний, развертывался гиганский фронт работ, создавалось то, что позже получило название “молекулярная генетика” и “молекулярная биология”.
Несколько раз казалось, что решающий шаг уже сделан, но это были только зарницы. Гром грянул в 1972 г. Бергом была впервые получена, а Бойером создана универсальная технология получения генов и объединения их в любых комбинациях – техника рекомбинантных молекул. Практически стало возможным создание любых генетических конструкций. Но на первых порах молекулярный арсенал новой технологии был ограничен, а фантазия исследователей жестко зашорена. Поэтому начали с реализации новых возможностей на старой основе. Например, гормон роста видоспецифичен. Для того чтобы его использовать как лекарство, из умершего человека извлекали гипофиз, из гипофиза выделяли гормон роста, очищали, разливали по ампулам и в таком виде поставляли пациентам. Очевидно, что источник подобного препарата был, мягко говоря, ограничен. Но иного-то не было.
Техника рекомбинантных молекул позволяла выделить ген человека, сделать требуемую конструкцию, ввести в клетки (прокариатические или эукаротические) и из них, уже в неограниченном количестве, получать человеческие белки и пептиды. Оставался последний логический шаг. Зачем ген вводить в бактерии (или иные объекты), получать из них человеческий продукт, чистить, фасовать, а затем опять вводить человеку? Ведь тот же ген можно прямо ввести человеку в его клетки, и пусть они себе синтезируют что требуется. Этот последний шаг переводил генные технологии на уровень непосредственно человека. Человек должен был стать прямым и непосредственным объектом генетических манипуляций – манипуляций, меняющих его генетический аппарат. Сначала на уровне соматических клеток, а далее, как ясно было всем – и зародышевых.
По аналогии с имеющимися, такую технологию тогда называли своим истинным именем – генная инженерия человека. И первый опыт генной инженерии на людях (вначале по самой примитивной, в прямом смысле этого термина, методике) был поставлен в середине 70-х годов. Возмущению мировой общественности не было пределов. Все понимали, что, начав за здравие, кончат обязательно иначе. Почти 15 лет общественное мнение держало оборону. Но законы человеческого разума неумолимы – все что возможно технически, на что нет непреодолимых принципиальных запретов, обязательно будет воплощено в жизнь. Возможности исправления генетических дефектов, радикального избавления от любых болезней, имели столь очевидное для каждого значения (личное, для близких, для детей), что возражения падали одно за другим. Для того чтобы окончательно успокоить сомневающихся, изменили терминологию. Теперь это стало называться “генная терапия”. Ну есть лечение травами, микроэлементами, витаминами, антибиотиками и т. д. Добавим еще лечение генами. И в конце 80-х годов, сначала в США, а затем и в ряде других стран сугубо демократически, с всеобщего согласия начались санкционированные испытания на людях, теперь уже под названием “генной терапии”.
Сегодня на различных стадиях разработки находится более двухсот клинических протоколов генной терапии. Как это реализуется практически? В генной терапии достаточно четко можно выделить три принципиальных подхода: лечение классических наследственных болезней, “хирургическая” генная терапия и лечение массовых патологий. Они различаются особенностями участия в них наследственного аппарата человека.
Похожий материал - Реферат: Современный миф
Классические наследственные болезни (в основном моногенные) характеризуются дефектом гена, который имеется во всех клетках организма. Этот дефект и ведет к патологии. Одна (но конкретная) нуклеотидная замена в гене глобина приводит к серповидноклеточной анемии; выпадение фрагмента гена глобина – к талассемии и т. д. Нарушен только один ген. Все остальное в организме не нарушено. И, теоретически, если ввести в клетки полноценный ген, то он обеспечит синтез полноценного продукта, наступит радикальное излечение. Конечно, здесь имеется очень много особенностей. Но в случаях наиболее простых (и наиболее распространенных) наследственных дефектов – это так. По своим функциям гены делятся на общеклеточные (они работают во всех клетках, поддерживая их существование) и тканеспецифические. Так, гемоглобин нужен и, соответственно, вырабатывается только в эритроидных клетках. Во всех остальных он не функционирует, и для клетки не имеет значения дефектен он или нет. Поэтому достаточно полноценный ген глобина ввести только в клетки эритроидного ряда. Поскольку же они, в свою очередь, образуются из стволовых, то достаточно ввести полноценный ген (конечно, в составе адекватной молекулярной конструкции) в относительно небольшое и, главное, доступное для такой процедуры количество стволовых клеток. Через некоторое время “не то”, станет “тем”.
“Хирургическая” генная терапия используется при таких болезнях, которые характеризуются тем, что и гены и их регуляция в организме полноценные. Но возникла патология в генетическом аппарате локальной группы (или групп) клеток. Например, при злокачественных опухолях. Убрать бы эти клетки из организма, все до единой, и болезнь бы ушла. Для достижения такой цели в генной терапии используют своеобразный временно-локальный подход. В случае онкологических болезней из биопсийного материала отделяют и переводят в культуру опухольпроникающие лимфоциты. Их размножают, вводят в них ген, кодирующий соответствующий иммунноактивный продукт (интерлейкин 2, фактор некроза опухоли и т. д.), и возвращают в организм больного. Такие генетически трансформированные лимфоциты уничтожают опухолевые клетки. Но время жизни лимфоцитов – примерно месяц. Если за это время они уничтожают все опухолевые клетки – задача выполнена, и сами измененные лимфоциты исчезают. Если опухоль разрушена за это время только частично, процедуру повторяют. Вводимые гены можно раз от раза варьировать. И так – до победы. Гены приводящие к гибели опухоли можно вводить и в сами опухолевые клетки. Но общим принципом здесь является то, что после излечения (полного) в организме не остается и тех генетически измененных клеток, которые такое излечение обеспечили.
При массовых патологиях сами гены не нарушены. Но в результате каких-то, в разных случаях разных, многоуровневых и множественных событий нарушена регуляция функционирования одного или нескольких генов. Простое введение в клетки еще одного (или нескольких) таких же генов ничего не дает. Ведь и собственный ген не нарушен. А регуляция на то и регуляция, чтобы держать активность на заданном уровне. Начни все гены функционировать по максимуму своих возможностей – организм мгновенно пойдет в разнос. До такой жуткой патологии даже природа не додумалась. Тут и болезни никакой дополнительной не надо. Именно поэтому большинство генов у человека ткане- и стадиоспецифические. Они функционируют на определенной стадии индивидуального развития и только в определенных тканях, часто вообще в ограниченном числе клеток.
Например, диабет. Повреждения гена инсулина, приводящие к диабету, описаны как уникальные наследственные болезни. А при остальных (практически всех) случаях этой болезни ген инсулина не нарушен. Но функционирует он только в -клетках поджелудочной железы (и весьма ограниченно – в некоторых клетках центральной нервной системы). А во всех остальных – выключен множественной, для надежности, регуляцией. Человек может умирать от нехватки инсулина, но регуляция не позволит включиться ни одному гену инсулина ни в одной другой клетке. Поэтому при генной терапии массовых патологий, в силу указанных особенностей, создают такие молекулярные конструкции, в которых клеточная регуляция не может выключить вводимый ген, хотя на собственный, резидентный, она действует. Достигается это тем, что у гена убираются все “свои” регуляторные участки и ставятся другие. Возникает молекулярная химера – структурный ген (кодирующий белок) остается исходным (таким же как в клетках), а регуляторные последовательности берутся от иных генов (часто вообще не клеточных). Теперь клетка не может выключить своей регуляцией вводимый извне ген. И он будет функционировать на заданном уровне, уйдя от нарушенной в организме регуляции.
Остается последняя задача – ввести созданную молекулярную конструкцию в клетки организма. Принципиально это можно осуществить двумя путями. Первый путь предусматривает извлечение из организма клеток (стволовых или вообще способных к размножению), обработку их созданным генетическим материалом (если надо – с последующим отбором и подращиванием) и возвращение в организм. По второму пути молекулярная конструкция вводится непосредственно в организм – в кровь или прямой инъекцией в ткань.
Очень интересно - Реферат: Эффект Махариши: медитация и процесс смерти
Для того, чтобы конструкция вошла в клетки, ее одевают в вирусный капсид, соединяют с лигандом к соответствующему рецептору, помещают в липосому и т. д.
История состояния на сегодня и прогноз развития на обозримую перспективу генных технологий в медицине.
cwetochki.ru
Курсовая работа - Генная терапия – новая эра новой эры
Кордюм Виталий Арнольдович, член-корреспондент НАН и АМН Украины
Чем проще идея, тем труднее она для практической реализации. Сколько спорят, есть ли жизнь на Марсе! Идея решения удивительно проста – полететь туда и посмотреть на месте. К таким “простым” идеям до недавнего времени относилась проблема радикального лечения болезней. Поскольку болезнь возникает вследствие того, что в организме “что-то не так”, то сделать чтобы было “так” и болезни не станет. К сожалению, как при всех простых идеях, уже со следующего шага, сразу после их изложения начинались неразрешимые проблемы. В данном случае таким первым последующим шагом было выяснение что же это такое, “что-то”, что такое “так” и что такое “не так”, которое надо вернуть в “так”.
Сегодня известно, что первоосновой, информационной базой всего организма являются гены. Изменение их структуры или активности является первопричиной изменений в организме. А болезнь причинно-следственно связана с дефектом одного из них (или некоторой их части), т. е. ген и есть то самое “что-то”. Тогда следует заменить дефектные гены на полноценные и “не так” вернется в “так” – больной выздоровеет радикально.
Попробуем сформулировать что для этого надо. Надо знать, какой же конкретно ген отвечает своим дефектом за данную патологию. Этот ген надо получить. Получив – ввести обратно в клетку. Сделать так, чтобы после введения было обеспечено его требуемое функционирование. В свою очередь каждое из этих “надо” состоит из блока сложнейших проблем, любая из которых требует для своего решения выполнения многих задач “ну очень” высокой степени трудности. Если же все это соотнести в виде реальных технологий к человеку, то еще недавно казалось, что спокойно можно прогнозировать реализацию этой “простой” идеи на какое-нибудь пятое или, еще лучше, шестое тысячелетие. Скорее всего, так было бы действительно лучше. Но реальность оказалась иной.
Предтечей грядущего стали очень странные на то время работы Грифитса, который в 1928 г. обнаружил, что непатогенный пневмококк можно превратить в патогенный посредством какого-то вещества, которое содержится в клетках и которое можно из клеток извлечь. Естественно, это не могло восприниматься иначе чем курьез. Но он как заноза требовал решения. Ведь вещество вызывало не просто изменения, а совершенно (и всегда!) конкретные. И даже не мелкие изменения, а появление патогенности. Ну, ладно, еще бы утрату, а то ведь появление! Решение курьезу было найдено через 15 лет. В то время, когда на планете бушевала вторая мировая война и на полях ее сражений решались судьбы человеческой цивилизации, в тиши лабораторий Эвери и Мак Карти решали судьбу самого человечества. Естественно, они об этом даже не подозревали. Но именно ими тогда было показано, что полимерными молекулами дезоксирибонуклеиновой кислоты, т. е. химически очищенным веществом, впервые полученным еще в конце прошлого столетия Мишером, можно передавать наследственные признаки. Вещество является материальным носителем наследственности!!!
Тогда это было сделано на микроорганизмах. Но иллюзий, что такое возможно только для них, уже не питал никто. И когда Уотсон и Крик выбрали для расшифровки пространственной структуры именно ДНК – они знали что делали. Предложенная ими в 1953 г. модель строения вещества наследственности показала ту основу, с которой можно работать. Работать как с любой молекулой, делая искусственно наследственность. Технически тогда еще это было невозможно. Но все прекрасно понимали, что это дело только времени.
Осознавая случившееся, в своем грустном прогнозе Чаргаф предупреждал, что овладение техникой производства наследственности в пробирке и реализация ее в живое “нечто”, приведет к последствиям, по сравнению с которыми атомные бомбы, стершие с лица земли Хиросиму и Нагасаки, будут воспринимать как пасхальные яйца. Но джин уже был выпущен из бутылки. Стремительно развивалась база знаний, развертывался гиганский фронт работ, создавалось то, что позже получило название “молекулярная генетика” и “молекулярная биология”.
Несколько раз казалось, что решающий шаг уже сделан, но это были только зарницы. Гром грянул в 1972 г. Бергом была впервые получена, а Бойером создана универсальная технология получения генов и объединения их в любых комбинациях – техника рекомбинантных молекул. Практически стало возможным создание любых генетических конструкций. Но на первых порах молекулярный арсенал новой технологии был ограничен, а фантазия исследователей жестко зашорена. Поэтому начали с реализации новых возможностей на старой основе. Например, гормон роста видоспецифичен. Для того чтобы его использовать как лекарство, из умершего человека извлекали гипофиз, из гипофиза выделяли гормон роста, очищали, разливали по ампулам и в таком виде поставляли пациентам. Очевидно, что источник подобного препарата был, мягко говоря, ограничен. Но иного-то не было.
Техника рекомбинантных молекул позволяла выделить ген человека, сделать требуемую конструкцию, ввести в клетки (прокариатические или эукаротические) и из них, уже в неограниченном количестве, получать человеческие белки и пептиды. Оставался последний логический шаг. Зачем ген вводить в бактерии (или иные объекты), получать из них человеческий продукт, чистить, фасовать, а затем опять вводить человеку? Ведь тот же ген можно прямо ввести человеку в его клетки, и пусть они себе синтезируют что требуется. Этот последний шаг переводил генные технологии на уровень непосредственно человека. Человек должен был стать прямым и непосредственным объектом генетических манипуляций – манипуляций, меняющих его генетический аппарат. Сначала на уровне соматических клеток, а далее, как ясно было всем – и зародышевых.
По аналогии с имеющимися, такую технологию тогда называли своим истинным именем – генная инженерия человека. И первый опыт генной инженерии на людях (вначале по самой примитивной, в прямом смысле этого термина, методике) был поставлен в середине 70-х годов. Возмущению мировой общественности не было пределов. Все понимали, что, начав за здравие, кончат обязательно иначе. Почти 15 лет общественное мнение держало оборону. Но законы человеческого разума неумолимы – все что возможно технически, на что нет непреодолимых принципиальных запретов, обязательно будет воплощено в жизнь. Возможности исправления генетических дефектов, радикального избавления от любых болезней, имели столь очевидное для каждого значения (личное, для близких, для детей), что возражения падали одно за другим. Для того чтобы окончательно успокоить сомневающихся, изменили терминологию. Теперь это стало называться “генная терапия”. Ну есть лечение травами, микроэлементами, витаминами, антибиотиками и т. д. Добавим еще лечение генами. И в конце 80-х годов, сначала в США, а затем и в ряде других стран сугубо демократически, с всеобщего согласия начались санкционированные испытания на людях, теперь уже под названием “генной терапии”.
Сегодня на различных стадиях разработки находится более двухсот клинических протоколов генной терапии. Как это реализуется практически? В генной терапии достаточно четко можно выделить три принципиальных подхода: лечение классических наследственных болезней, “хирургическая” генная терапия и лечение массовых патологий. Они различаются особенностями участия в них наследственного аппарата человека.
Классические наследственные болезни (в основном моногенные) характеризуются дефектом гена, который имеется во всех клетках организма. Этот дефект и ведет к патологии. Одна (но конкретная) нуклеотидная замена в гене глобина приводит к серповидноклеточной анемии; выпадение фрагмента гена глобина – к талассемии и т. д. Нарушен только один ген. Все остальное в организме не нарушено. И, теоретически, если ввести в клетки полноценный ген, то он обеспечит синтез полноценного продукта, наступит радикальное излечение. Конечно, здесь имеется очень много особенностей. Но в случаях наиболее простых (и наиболее распространенных) наследственных дефектов – это так. По своим функциям гены делятся на общеклеточные (они работают во всех клетках, поддерживая их существование) и тканеспецифические. Так, гемоглобин нужен и, соответственно, вырабатывается только в эритроидных клетках. Во всех остальных он не функционирует, и для клетки не имеет значения дефектен он или нет. Поэтому достаточно полноценный ген глобина ввести только в клетки эритроидного ряда. Поскольку же они, в свою очередь, образуются из стволовых, то достаточно ввести полноценный ген (конечно, в составе адекватной молекулярной конструкции) в относительно небольшое и, главное, доступное для такой процедуры количество стволовых клеток. Через некоторое время “не то”, станет “тем”.
“Хирургическая” генная терапия используется при таких болезнях, которые характеризуются тем, что и гены и их регуляция в организме полноценные. Но возникла патология в генетическом аппарате локальной группы (или групп) клеток. Например, при злокачественных опухолях. Убрать бы эти клетки из организма, все до единой, и болезнь бы ушла. Для достижения такой цели в генной терапии используют своеобразный временно-локальный подход. В случае онкологических болезней из биопсийного материала отделяют и переводят в культуру опухольпроникающие лимфоциты. Их размножают, вводят в них ген, кодирующий соответствующий иммунноактивный продукт (интерлейкин 2, фактор некроза опухоли и т. д.), и возвращают в организм больного. Такие генетически трансформированные лимфоциты уничтожают опухолевые клетки. Но время жизни лимфоцитов – примерно месяц. Если за это время они уничтожают все опухолевые клетки – задача выполнена, и сами измененные лимфоциты исчезают. Если опухоль разрушена за это время только частично, процедуру повторяют. Вводимые гены можно раз от раза варьировать. И так – до победы. Гены приводящие к гибели опухоли можно вводить и в сами опухолевые клетки. Но общим принципом здесь является то, что после излечения (полного) в организме не остается и тех генетически измененных клеток, которые такое излечение обеспечили.
При массовых патологиях сами гены не нарушены. Но в результате каких-то, в разных случаях разных, многоуровневых и множественных событий нарушена регуляция функционирования одного или нескольких генов. Простое введение в клетки еще одного (или нескольких) таких же генов ничего не дает. Ведь и собственный ген не нарушен. А регуляция на то и регуляция, чтобы держать активность на заданном уровне. Начни все гены функционировать по максимуму своих возможностей – организм мгновенно пойдет в разнос. До такой жуткой патологии даже природа не додумалась. Тут и болезни никакой дополнительной не надо. Именно поэтому большинство генов у человека ткане- и стадиоспецифические. Они функционируют на определенной стадии индивидуального развития и только в определенных тканях, часто вообще в ограниченном числе клеток.
Например, диабет. Повреждения гена инсулина, приводящие к диабету, описаны как уникальные наследственные болезни. А при остальных (практически всех) случаях этой болезни ген инсулина не нарушен. Но функционирует он только в -клетках поджелудочной железы (и весьма ограниченно – в некоторых клетках центральной нервной системы). А во всех остальных – выключен множественной, для надежности, регуляцией. Человек может умирать от нехватки инсулина, но регуляция не позволит включиться ни одному гену инсулина ни в одной другой клетке. Поэтому при генной терапии массовых патологий, в силу указанных особенностей, создают такие молекулярные конструкции, в которых клеточная регуляция не может выключить вводимый ген, хотя на собственный, резидентный, она действует. Достигается это тем, что у гена убираются все “свои” регуляторные участки и ставятся другие. Возникает молекулярная химера – структурный ген (кодирующий белок) остается исходным (таким же как в клетках), а регуляторные последовательности берутся от иных генов (часто вообще не клеточных). Теперь клетка не может выключить своей регуляцией вводимый извне ген. И он будет функционировать на заданном уровне, уйдя от нарушенной в организме регуляции.
Остается последняя задача – ввести созданную молекулярную конструкцию в клетки организма. Принципиально это можно осуществить двумя путями. Первый путь предусматривает извлечение из организма клеток (стволовых или вообще способных к размножению), обработку их созданным генетическим материалом (если надо – с последующим отбором и подращиванием) и возвращение в организм. По второму пути молекулярная конструкция вводится непосредственно в организм – в кровь или прямой инъекцией в ткань.
Для того, чтобы конструкция вошла в клетки, ее одевают в вирусный капсид, соединяют с лигандом к соответствующему рецептору, помещают в липосому и т. д.
История состояния на сегодня и прогноз развития на обозримую перспективу генных технологий в медицине.
| Рекомбинантные белки | Генная диагностика | Последовательность генома | Генная вакцинация | Генная терапия | Искусственные органы | Внутриклеточная иммунизация | Белковая инженерия | Генная инженерия человека | |
| 1972 | Сформировано представление об общности молекулярных основ живого | Создание техники рекомбинантных ДНК | |||||||
| | | | |||||||
| 1980 | Первый генно-инженерный синтез пептида человека (соматостатин) в бактериях Первый, санкционированный к применению, пептид человека (инсулин), полученный в бактериях по генно-инженерной технологии | Первые несанкционированные опыты на людях по генной терапии (аргининемия), называемой тогда “генной инженерией человека” Вторая группа несанкционированных опытов на людях по генной терапии, все еще называемой “генной инженерией человека” | Разработка на животных технологий изменения в поколениях методами генной инженерии | ||||||
| | | | | | | | | | |
| 1990 | Широкое получение рекомбинантных белков и пептидов для лечения, иммунизации и диагностики | Закладываются основы генной диагностики Быстрое совершенствование и расширение возможностей генной диагностики | Создан и начал функционировать проект “Геном человека” | Работы по генной вакцинации с использованием «параллельных» вакцин | Первые санкционированные опыты на людях по отработке технологии генной терапии Первые санкционированные опыты на людях по генной терапии с целью лечения | Закладываются основы технологий уничтожения заданных клеток в организме. Создание технологий получения кожи человека | Формирование первых представлений о внутриклеточной вакцинации | Разработка общих теоретических представлений белковой инженерии | Получение первых моделей наследственных болезней на животных и стремительно набирающая темпы разработка технологии изменения в поколениях модельных животных методами генной инженерии |
| | | | | | | | | | |
| 1997 | Массовая индустрия, применение, испытания и получение новых рекомбинантных белков и пептидов человека для лечения, иммунизации и диагностики. Здесь уже фактически нет ограничений | Перенос генной диагностики в клиники, расширение ее спектра, нарастающие темпы разработки практически приемлемых технологий генной диагностики зигот | Стремительно развивается проект “Геном человека”, определена первичная последовательность более 10% всех структурных генов человека | Быстро набирающие темпы исследования по генной вакцинации | Набирающая темпы и расширяющаяся по номенклатуре генная терапия человека с массовой развивающейся базой и подготовкой новых возможностей | Создание и разработка различных технологий уничтожения любых заданных клеток на животных моделях. Разработка технологий получения искусственных биологических органов и разных тканей | Первые санкционированные опыты на людях по внутриклеточной иммунизации, лавинообразный рост исследований | Медленно и очень тяжело, но неуклонно набирают темпы исследования по белковой инженерии | Массовое получение моделей наследственных болезней человека на животных и продолжение совершенствования технологии широких изменений в поколениях |
| | | | | | | | | | |
| 2000 | Массовое применение рекомбинантных белков в медицине становится рутинным | Генная диагностика становится рутинным клиническим анализом. Начало практического перехода к диагностике дефектов одновременно нескольких генов, а так же патологий, при которых влияние генов выражено «слабо» | Определение четверти всех структурных генов человека и быстрое дальнейшее продвижение программы “Геном человека” | Первые санкционированные опыты на людях по генной вакцинации | Начало клинического масштабирования генной терапии. Первые опыты на людях по генной терапии возрастной патологии | Разработка технологий уничтожения любых клеток, их сообществ, тканей и органов. Первые опыты на людях по подсадке искусственно созданных биологических органов и разных тканей | Подготовка к масштабированию внутриклеточной иммунизации | Ускорение работ по белковой инженерии, основанных на прорыве в области теории расчета строения и функции белка на основе данных о его первичной структуре | Методическая готовность для генной терапии на уровне зародышевых клеток человека |
| | | | | | | | | | |
| 2010 | Рекомбинантные белки и пептиды человека как основные терапевтические и профилактические средства для употребления «извне», (инъекции, мази и т.д.) | Генная диагностика множественных нарушений в геномах – «слабых мутаций» – становится рутинным клиническим исследованием | Окончание определения полной последовательности всего генома человека. Переход на масштабные определения геномов у индивидуумов | Практическое применение технологии генной вакцинации. Обеспечение требуемого функционирования любых введенных на постнатальном уровне генов | Устранение отдельных генетических дефектов как рутинная клиническая процедура. Клиническое масштабирование генной терапии возрастной патологии | Начало масштабированных замен тканей и органов искусственно созданными аналогами из модифицированных и выращенных вне организма клеток данного индивидуума | Лечение и профилактика вирусных и опухолевых болезней на основе внутриклеточной иммунизации как рутинная клиническая процедура | Первые санкционированные опыты на людях по белковой инженерии. Опыты по белковой инженерии на животных | Начало санкционированных опытов по преобразованию человека в поколениях (генная инженерия на зародышевых клетках) |
| Начало санкционированных работ по полномасштабной реконструкции человека на постнатальном уровне и в поколениях |
Вероятно, читающий это описание, уже понял, что за всей легкостью изложения типа “создание соответствующих молекулярных конструкций”, “ген начал функционировать несмотря на регуляцию, выключающую свой, такой же, но клеточный ген” и т. д. стоят технические и технологические трудности почти фантастической сложности. Задача же состоит в том, чтобы генная терапия из рекордов виртуозов превратилась в рутинную медицинскую процедуру. Поэтому сегодня уже создан и стремительно расширяется фронт работ по решению такой задачи. Сегодня на людях испытывают технологии генной терапии гемофилии, муковисцидоза, синдрома врожденного иммунодефицита, опухолевой болезни и некоторых других. Лечение более чем десятка патологий уже апробировано генной терапией на животных и проходит путь формального санкционирования для перехода на людей. Для лечения еще нескольких десятков болезней технологии оттачиваются на животных. Для этого создаются специальные их линии с генетическими дефектами, аналогичными таковым при генетически детерминированных болезнях человека.
Поскольку критический этап, связанный с решением принципиальных вопросов, пройден, в генную терапию начали устремляться могущественные фирмы с практически неограниченными материальными и финансовыми возможностями. Это, безусловно, не просто ускорит работы по доведению генной терапии до клиник, но и расширит сферу ее применения. Уже сегодня полномасштабно ставится вопрос о генной вакцинации, о внутриклеточной иммунизации, пересадке генетически адаптированных тканей и органов и т. д. Но реальностью становится и то, что казалось принципиально неразрешимым – генная терапия разных видов возрастной патологии. Нами, совместно с группой исследователей под руководством академика В.В.Фролькиса, показано, что могут быть созданы молекулярные конструкции, способные оказывать терапевтический эффект у старых животных более интенсивно, чем у молодых. Продемонстрировано это на примере нарушений, связанных с сосудами, что само по себе более чем актуально. Но это значит также, что можно создать системы генных воздействий и на иные виды возрастной патологии.
Если теперь все это свести воедино, то пугавший когда-то термин “генная терапия человека” окажется безнадежно устаревшим в силу своей ограниченности. Сегодня полноразмерным является комплекс “генных технологий человека”, уже начинающий плавно перерастать в еще более широкомасштабный комплекс ближайшего будущего – технологии “биологической реконструкции человека”. Для тех, кто не работает в данной области, такие понятия звучат как нечто за гранью фантастики. А специалисты развитых стран прогнозируют начало рутинного применения в клиниках первых технологий генной терапии рубежом оканчивающегося века, т. е. всего-то через каких-нибудь 3 года. С последующим крутым нарастанием. И для того, чтобы представить себе очень недалекое будущее на поддающуюся прогнозу глубину, можно посмотреть на приведенную слева схему.
www.ronl.ru
|
|
..:::Счетчики:::.. |
|
|
|
|
|
|
|
|


