
Поскольку, до завершения энергетического уровня галогенам не хватает всего 1-го электрона, в ОВР они чаще всего проявляют свойства окислителей. Степени окисления галогенов: от «-1» до «+7». Единственный элемент группы галогенов – фтор – проявляет только одну степень окисления «-1» и является самым электроотрицательным элементом.
Галогены можно получить при электролизе растворов или расплавов галогенидов:
MgCl2 = Mg + Cl2 (расплав)
Наиболее часто галогены получают по реакции окисления галогенводородных кислот:
MnO2 + 4HCl = MnCl2 + Cl2↑ +2h3O
K2Cr2O7 + 14HCl = 3Cl2↑ + 2KCl +2CrCl3 +7h3O
2KMnO4 +16HCl = 2MnCl2 +5Cl2↑ +8h3O +2KCl
HF и HCl получают взаимодействием их твердых солей с концентрированной серной кислотой при нагревании:
CaCl2 + h3SO4 = CaSO4 + 2HCl↑
HBr и HI получить таким способом нельзя, поскольку эти вещества – сильные восстановители и окисляются серной кислотой:
2KBr + 2h3SO4 = K2SO4 + Br2 + 2h3O + SO2
8KI + 5h3SO4 = 4K2SO4 +4I2 +4h3O + h3S
Поэтому HBr и HI получают гидролизом соответствующих галогенидов фосфора:
PBr3 +3h3O = 3HBr + h4PO3
Среди кислородсодержащих соединений галогенов наибольшее значение имеют кислородсодержащие кислоты и их соли. Так, HClO – одна из кислородсодержащих кислот хлора — хлорноватистая кислота получается в водных растворах хлора как продукт гидролиза:
Cl2+ h3O ↔ HClO + HCl
Соли хлорноватистой кислоты – гипохлориты образуются при пропускании хлора через холодные растворы щелочей, например:
Cl2 + 2KOH = KClO + KCl + h3O
Хлорноватую кислоту (HClO3) получают ее при действии на соли (хлораты) кислоты концентрированной серной кислотой:
Ba(ClO3)2 + h3SO4 = BaSO4 +2HClO3
Соли хлорноватистой кислоты – хлораты получают, пропуская Cl2 в горячий раствор щелочи:
3Cl2 + 6KOH = 5 KCl + KClO3 + 3h3O
HClO4 — хлорная кислота, которую можно получить, действуя на перхлорат калия концентрированной серной кислотой:
2 KClO4 + h3SO4 = K2SO4 +2 HClO4
Растворы бромноватистой (HOBr) и йодноватистой (HOI) кислот могут быть получены, подобно HClO, взаимодействием соответствующих галогенов с водой.
Br2 + h3O = HBr + HOBr
I2 + h3O = HI + HOI
Бромноватую (HBrO3) и йодноватую (HIO3) кислоты можно получить путем окисления бромной или йодной воды хлором:
Br2+ 5Cl2 + 6h3O = 2HBrO3 + 10 HCl
Хлор — один важнейших элементов, входящих в состав живых организмов. В организме он содержится в виде соли – хлорида натрия. Хлор стимулирует обмен веществ, рост волос, придает бодрость и силу. Больше всего NаСl содержится в плазме крови.
HCl, входящая в состав желудочного сока, контролирует процессы пищеварения. В отсутствие 0,2%-ной НСl процесс переваривания пищи практически прекращается.
Водоросли, а также некоторые другие растения активно накапливают бром. Морская вода содержит самое большое количество брома, который способен переходить в воздух, поэтому его содержание в воздухе приморских районов всегда больше, чем в районах, далеких от моря.
Йод, как и хлор — один важнейших элементов, входящих в состав живых организмов. Недостаток йода в воде и пище снижает выработку гормона щитовидной железы и приводит к заболеванию эндемическим зобом. Йод попадает в организм вместе с пищей: хлебом, яйцами, молоком, водой, морской капустой и с воздухом (особенно морским) при дыхании.
Галогены нашли широкое применение в промышленности. Так, фтор используют для получения смазочных веществ, выдерживающих высокую температуру, тефлона, фреонов и т.д. Хлор используют в производстве соляной кислоты, хлорной извести, гипохлоритов и хлоратов, для отбеливания тканей и целлюлозы, идущей на изготовление бумаги, для стерилизации питьевой воды и обеззараживания сточных вод и т.д.
Бром необходим для выработки различных лекарственных веществ, некоторых красителей, а также бромида серебра, использующегося в производстве фотоматериалов.
Йод применяют в медицине в виде 10%-го раствора в этаноле в качестве антисептического и кровоостанавливающего средства. Йод входит в состав ряда фармацевтических препаратов.
Плавиковую кислоту (HF) используют для получения фторидов, травления стекла, удаления песка с металлических отливок, при анализах минералов.
Соляная кислота (HCl) нашла широкое применение в химической практике, также, как и её соли. Например, хлорид натрия (поваренная соль) служит сырьем для получения хлора, соляной кислоты, едкого натра, используется в красильном деле, в мыловарении и других отраслях производства.
ru.solverbook.com
Тема: Галогены. Медико-биологическая роль
Содержание
Введение
1. Общая характеристика фтора
1.1 Медико-биологическая роль фтора
2. Общая характеристика хлора
2. 1Медико-биологическая роль соединений хлора
3. Общая характеристика брома
3. 1Медико-биологическая роль брома
4. Общая характеристика йода
4. 1Медико-биологическая роль йода
Заключение
Список литературы
Введение
Галогены (от греч. halos — соль и genes — рождающий, рождённый) находятся в главной подгруппе VII группы периодической системы химических элементов.
К галогенам относят фтор, хлор, бром, иод и астат.
Хим. знак | Распределение электронов | |||
по энергетическим уровням | по энергетическим уровням и подуровням | по орбиталям | ||
F | +9 °F 2з, 7з | +9 °F 1s22s22p5 | 1s2 2s2 2p5 +9F | |
Cl | +17Cl 2з, 8з, 7з | +17Cl 1s22s22p63s23p53d0 | 3s2 3p5 3d0 +17Cl … | |
Br | +35Br 2з, 8з, 18з, 7з | +35Br …3d0? 4s24p54d0 | 4s2 4p5 4d0 +35Br … | |
I | +53I 2з, 8з, 18з, 18з, 7з | +53I …4d0? 5s25p55d0 | 5s2 5p5 5d0 +53I … | |
На наружном энергетическом уровне атомов галогенов находятся семь электронов:
До восьми электронов (октета) на наружном энергетическом уровне, т. е. до устойчивого состояния атомов, характерного для благородных газов, атомам галогенов недостаёт по одному электрону. К тому же атомы галогенов по сравнению с атомами металлов того же периода обладают бьльшим зарядом ядра, меньшим атомным радиусом и имеют по одному неспаренному электрону. Поэтому атомы всех галогенов энергично присоединяют недостающий электрон. Например,
Cl0 + з > Cl-.
Фтор в химических реакциях проявляет только окислительные свойства, и для него характерна степень окисления -1. Остальные галогены могут проявлять и восстановительные свойства при взаимодействии с более электроотрицательными элементами — фтором, кислородом, азотом, при этом степени их окисления могут принимать значения +1, +3, +5, +7. Восстановительные свойства галогенов усиливаются от хлора к йоду, что связано с ростом радиусов их атомов: атомы хлора примерно вдвое меньше, чем у йода.
1. Общая характеристика фтора
Фтор -- (от др. -греч. циьспт «разрушение, порча, вред», далее от циеЯсщ «уничтожать, истреблять, губить») -- элемент 17-й группы периодической таблицы химических элементов (по короткой форме периодической системы -- элемент главной подгруппы VII группы), второго периода, с атомным номером 9[5]. Обозначается символом F (лат. Fluorum). Фтор -- чрезвычайно химически активный неметалл и самый сильный окислитель, является самым лёгким элементом из группы галогенов. Простое вещество фтор (CAS-номер: 7782−41−4) при нормальных условиях -- двухатомный газ (формула F2) бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор
1.1 Медико-биологическая роль фтора
Фтор является жизненно необходимым для организма элементом. В организме человека фтор, в основном, содержится в эмали зубов в составе фторапатита -- Ca5F (PO4)3. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариес и флюороз (крапчатость эмали) и остеосаркома, соответственно[13]. Малое содержание фтора разрушает эмаль за счёт вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фторидов (натрия и/или олова) или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1−2% раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30−50%[14].
Предельно допустимая концентрация связанного фтора[15] в воздухе промышленных помещениях равна 0,0005 мг/литр воздуха.
Итак, фтор в человеческом теле выполняет следующие функции:
* поддерживает твёрдость и прочность костной ткани, в том числе и зубов;
* позволяет правильно формироваться всем костям скелета, ускоряет срастание костей при переломах;
* совместно с фосфором и кальцием предохраняет зубы от разрушения вследствие кариеса, устраняет в них микротрещины;
* принимает участие в процессе кроветворения;
* предотвращает ломкость волос и ногтей;
* укрепляет иммунитет и поддерживает его на должном уровне;
* улучшает состояние человека при остеопорозе;
* ускоряет всасывание железа;
* выводит из организма вредные вещества вроде радионуклидов и солей тяжелых металлов.
2. Общая характеристика хлора
Хлор (от греч. члщсьт --«зелёный») -- элемент 17-й группы периодической таблицы химических элементов (по устаревшей классификации -- элемент главной подгруппы VII группы), третьего периода, с атомным номером 17[3]. Обозначается символом Cl (лат. Chlorum). Химически активный неметалл. Входит в группу галогенов (первоначально название «галоген» использовал немецкий химик Швейгер для хлора -- дословно «галоген» переводится как солерод -- но оно не прижилось и впоследствии стало общим для 17-й (VIIA) группы элементов, в которую входит и хлор[4]).
Простое вещество хлор (CAS-номер: 7782−50−5) при нормальных условиях -- ядовитый газ желтовато-зелёного цвета, тяжелее воздуха, с резкимзапахом. Молекула хлора двухатомная (формула Cl2)
Ионы хлора жизненно необходимы растениям. Хлор участвует в энергетическом обмене у растений, активируя окислительное фосфорилирование. Он необходим для образования кислорода в процессе фотосинтеза изолированными хлоропластами, стимулирует вспомогательные процессы фотосинтеза, прежде всего те из них, которые связаны с аккумулированием энергии. Xлор положительно влияет на поглощение корнями кислорода, соединений калия, кальция, магния. Чрезмерная концентрация ионов хлора в растениях может иметь и отрицательную сторону, например, снижать содержание хлорофилла, уменьшать активность фотосинтеза, задерживать рост и развитие растений.
Учитывая связь хлора и натрия, следует отметить, что поступление в организм этих элементов тесно взаимосвязано. У животных и человека, ионы хлора участвуют в поддержании осмотического равновесия, хлорид-ион имеет оптимальный радиус для проникновения через мембрану клеток. Именно этим объясняется его совместное участие с ионами натрия и калия в создании постоянного осмотического давления и регуляции водно-солевого обмена.
Под воздействием ГАМК (нейромедиатор) ионы хлора оказывают тормозящий эффект на нейроны путем снижения потенциала действия. В желудке ионы хлора создают благоприятную среду для действия протеолитических ферментов желудочного сока. Хлорные каналы представлены во многих типах клеток, митохондриальных мембранах и скелетных мышцах. Эти каналы выполняют важные функции в регуляции объема жидкости, трансэпителиальном транспорте ионов и стабилизации мембранных потенциалов, участвуют в поддержании рН клеток.
В настоящее время участие хлора в возникновении отдельных заболеваний у человека изучено недостаточно хорошо, главным образом из-за малого количества исследований.
2.1 Медико-биологическая роль соединений хлора
Соединения хлора используются в приготовлении пищи (NaCl), для обеззараживания питьевой воды (хлорирование), дезинфекции, отбеливании тканей, в качестве реагента для многих химических процессов (HCl, HClO4), а также широко используются в химической и целлюлозно-бумажной промышленности при производстве органических растворителей и полимеров.
Хлор применяется для производства гербицидов, пестицидов и инсектицидов.
Хлор элемент входит в состав желудочного сока, препаратов для лечения ряда желудочно-кишечных заболеваний. В медицине широко используются бактерицидные свойства хлорсодержащих препаратов.
3. Общая характеристика брома
Бром (от др. -греч. вс? мпт «вонючка», «вонючий») -- элемент 17-й группы периодической таблицы химических элементов (поустаревшей классификации -- элемент главной подгруппы VII группы), четвёртого периода, с атомным номером 35[3]. Обозначается символом Br (лат. Bromum). Химически активный неметалл, относится к группе галогенов. Простое вещество бром (CAS-номер: 7726−95−6) при нормальных условиях -- тяжёлая едкая жидкость красно-бурого цвета с сильным неприятным запахом. Молекула брома двухатомна (формула Br2)
3.1 Медико-биологическая роль брома
Многие аспекты биологической роли брома в настоящее время еще не выяснены. Бром является незаменимым микроэлементом, который оказывает благоприятное воздействие на здоровье человека. Благодаря брому начинает лучше функционировать центральная нервная система, щитовидная железа, а также регулируется половая сфера.
В человеческом организме бром очень широко распространен. Он содержится в гипофизе, почках, щитовидной железе, в мышечной и костной ткани, а также в крови. В общей сложности в органах и тканях человека содержится приблизительно 200−300 миллиграммов брома. Выводится данный микроэлемент из организма естественным путем — вместе с потом и мочой.
В человеческом организме бром выполняет множество полезных функций — они принимает участие в активации пепсина, способствует активизации липазов, амилазов, а также некоторых других ферментов; улучшает деятельность щитовидной железы и предотвращает возникновение эндемического зоба, а также принимает активное участие в регуляции деятельности центральной нервной системы. Кроме того, на основе брома изготавливают медицинские препараты, которые применяются с целью подавления полового влечения.
Следует иметь в виду, что бром не совместим с йодом, алюминием, хлором и фтором.
В медицине бромид натрия и бромид калия применяют как успокаивающие средства.
Бром концентрируется в железах внутренней секреции, и его недостаток в организме человека ведет к нарушению нормального соотношения между процессами возбуждения и торможения.
Органические соединения брома применяют для ингаляционного наркоза (галотан — 1,1,1-трифтор-2-хлор-2-бромэтан, CF3CHBrCl), в качестве обезболивающих, успокоительных, антигистаминных и антибактериальных препаратов, при лечении язвенных болезней, эпилепсии, сердечно-сосудистых заболеваний. Изотоп брома с атомной массой 82 находит применение в медицине при лечении опухолей и при изучении поведения бромсодержащих препаратов в организме.
4. Общая характеристика йода
Иомд (тривиальное (общеупотребительное) название -- йод; от др. -греч. ?юдзт -- «фиалковый (фиолетовый)») -- элемент17-й группы периодической таблицы химических элементов (по устаревшей классификации -- элемент главной подгруппы VII группы), пятого периода, с атомным номером 53. Обозначается символом I (лат. Iodum). Химически активный неметалл, относится к группе галогенов.
Простое вещество иод (CAS-номер: 7553−56−2) при нормальных условиях -- кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары, обладающие резким запахом. Молекула вещества двухатомна (формула I2).
4.1 Медико-биологическая роль йода
Основная биологическая функция йода состоит в поддержании функции щитовидной железы и построении ею гормона — тироксина. Йод пока является единственным известным микроэлементом, участвующим в образовании гормона. Физиологическая роль тироксина, основой образования которого является йод, очень велика: контроль за интенсивностью основного обмена, влияние на водно-солевой, жировой и углеводный обмены. Как гормон, тироксин находится в постоянной связи с другими железами внутренней секреции, особенно с гипофизом и половыми железами. Он активно воздействует на физическое и психическое развитие человека, участвует в регуляции деятельности центральной нервной системы, влияет на эмоциональный тонус человека, на деятельность сердечно-сосудистой системы и печени. В обычных условиях в организме человека содержится 20−50 мг йода. Наибольшая концентрация йода (8 мг из общего количества) содержится в щитовидной железе. Суточная потребность взрослого человека — 50−200 мкг йода (0,05−0,2 мг). галоген фтор йод хлор
Она полностью обеспечивается при нормальном сбалансированном питании (40−200 мкг) за счет продуктов растительного и животного происхождения. Лишь небольшая часть йода (около 5−10%) поступает с водой.
Наиболее высокое содержание йода в морских водорослях:
в сухой ламинарии — 160−800 мг на 100 г продукта,
в сухой морской капусте — 200−220 мг на 100 г продукта.
В морской рыбе и продуктах моря содержание йода достигает 300−3000 мкг на 100 г продукта.
Также источником йода для человека являются: мясо, яйца, молоко, овощи.
При длительном хранении продуктов и кулинарной обработке может теряться до 65% йода.
Недостаточность йода широко распространена и носит эндемический характер. Основной причиной является недостаточное содержание йода в окружающей среде, а следовательно и в продуктах питания. Проявляется недостаточность йода увеличением щитовидной железы (эндемический зоб). В ряде случаев может развиваться гипотиреоз (недостаточность функции щитовидной железы), проявляющийся резким снижением физической и умственной работоспособности, сухостью кожи, выпадением волос, снижением температуры тела, отечностью лица и другими симптомами.
Для профилактики развития зоба в эндемических зонах население использует в питание йодированную соль (25 г йодида калия на 1 тонну соли), что обеспечивает ежедневное поступление в организм человека до 200 мкг йода.
Заключение
Галогены -- элементы седьмой группы системы Менделеева. К ним относятся: хлор, фтор, йод, астат, бром. Роль галогенов в организме человека заключается в их уникальном свойстве поддерживать важные химико-биологические обменные процессы (все процессы жизнедеятельности человека). Фтор содержится во всех человеческих органах и играет важную роль в строении костей, зубов. Бром содержится в почках, печени, крови, мозге. Йод важен для функционирования щитовидной железы. Хлор помогает поддерживать в организме осмотическое давление лимфы и крови, сохраняет баланс воды.
Список литературы
Редкол. :Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. -- Москва: Советская энциклопедия, 1988. -- Т. 1. -- С. 211. -- 623 с. -- 100 000 экз.
Стасиневич Д. С. Иод // Краткая химическая энциклопедия / Отв. ред. И. Л. Кнунянц. -- М.: Советская Энциклопедия, 1963. -- Т. 2. Ж--Малоновый эфир.
Ходаков Ю. В., Эпштейн Д. А., Глориозов П. А. § 84. Фтор, бром, иод // Неорганическая химия: Учебник для 7--8 классов средней школы. -- 18-е изд. -- М.: Просвещение, 1987. -- С. 197--199. -- 240 с. --1 630 000 экз.
Показать Свернутьreferat.bookap.info
"Рождающие соли" – так переводится название элементов, о свойствах которых пойдет речь в нашей статье. Находясь в VII А группе периодической системы химических элементов, они представляют собой наиболее активные неметаллы. Особенности строения атомов обуславливают как физические свойства галогенов, так и их способность к реакциям с металлами, водородом и другими неметаллическими элементами. Рассмотрим их подробнее.
Отличительной чертой галогенов является их ярко выраженная электроотрицательность – способность забирать единичные отрицательно заряженные частицы у атомов менее активных элементов.

В этом случае электронные оболочки фтора, хлора, брома и йода заполняются электронами до октета и становятся устойчивыми анионами: F-, CI- и т. д. Атомы металлов при взаимодействии с элементами VII A группы отдают свои частицы, превращаясь в положительно заряженные катионы, а в молекулах образовавшихся солей, например хлорида натрия, фторида магния или йодида кальция, возникает прочная ионная связь. Простое вещество – галоген - представляет собой двухатомную молекулу, например CI2 или F2, содержащую между атомами ковалентную неполярную связь.
С увеличением заряда ядра и раздуванием атома за счет добавления новых энергетических слоев, электроотрицательность у галогенов уменьшается. Действительно, фтор является самым активным неметаллом и всегда имеет отрицательный заряд иона, т. е. он при взаимодействии с атомами других элементов забирает их электроны. Хлор в реакциях с веществами также электроотрицателен, за исключением оксидов, где его атом имеет положительную степень окисления. Физические свойства галогенов и их агрегатное состояние также изменяются с увеличением заряда ядра. Остановимся на этом вопросе подробнее.

Простые вещества фтор и хлор представляют собой сильно токсичные газы. В малых концентрациях они вызывают раздражение слизистых оболочек глаз и верхних дыхательных путей. Длительное вдыхание паров галогенов приводит к параличу дыхательных мышц и удушью с летальным исходом. Именно поэтому немецкая армия в Первой мировой войне использовала хлор в качестве химического оружия.
С увеличением заряда ядра атома агрегатное состояние веществ изменяется, и бром уже представляет собой тяжелую жидкость красно-бурого цвета с резким запахом. Она может вызывать ожоги на коже, и особенно опасна при попадании в глаза.
Продолжим далее характеристику галогенов и остановимся на йоде и астате. Йод представлен в виде серо-фиолетовых кристаллов, плотность их - 4,94 г/см3. Вещество имеет низкую температуру плавления – 113,5° и при нагревании сразу же превращается в газ, минуя жидкую фазу. Такое явление в химии получило название сублимации.
Астат является радиоактивным элементом, по внешнему виду похожим на йод и так же, как он, способным к возгонке. В лаборатории его получают облучением атомов висмута ядрами атома гелия. Астат является наиболее редко встречающимся элементом в природе.

Рассмотрев физические свойства галогенов, остановимся на их способности реагировать с другими веществами. Интересным в этом отношении является фтор. Это первый элемент, который оказался способным образовывать соединения с инертными газами, в частности с ксеноном. Были получены несколько веществ – фторидов ксенона с различными степенями окисления инертного элемента: XeF2, XeF4, XeF6. С этого момента началось активное развитие химии благородных газов.
Другой галоген, формула которого CI2, - хлор - является вторым по активности элементом после фтора. Он взаимодействует с кислородом и образует несколько оксидов, в которых имеет такие степени окисления: +3, +5, +7. Как и все неметаллы, хлор реагирует с металлами, образуя соли – хлориды. Соединения хлора достаточно распространены в природе и входят в состав многих горных пород и минералов.
Галогены в природе встречаются достаточно часто. В периоды вулканической активности большое количество газообразных соединений хлора, фтора и йода попадают в атмосферу Земли. Кроме того, как мы говорили ранее, хлориды представлены в виде рудообразующих соединений: сильвинита ( двойная соль KCI × NaCI), карналлита и поваренной соли. Отметим также, что хлор составляет примерно 0,05 % массы земной коры. Все элементы этого ряда, за исключением астата, не только входят в состав неживой природы, но и являются обязательными компонентами клеток растений, животных и человека.

Биохимия – это наука, определяющая роль химических веществ в метаболических процессах, проходящих в живой клетке. Она подтверждает важное биологическое значение галогенов. Как оказалось, наибольшее распространение у прокариотов и эукариотов имеет хлор. Он является необходимым макроэлементом в цитоплазме и в межклеточной жидкости. Так, ионы хлора входят в состав плазмы крови, участвуют в транспорте веществ через клеточную мембрану, они также задействованы в процессах прохождения импульсов по нервному волокну. Атомарный фтор является компонентом эмали зубов, обеспечивая ее твердость и устойчивость к кариесу. Рассматривая физические свойства галогенов, выясним их значение в клеточном метаболизме.
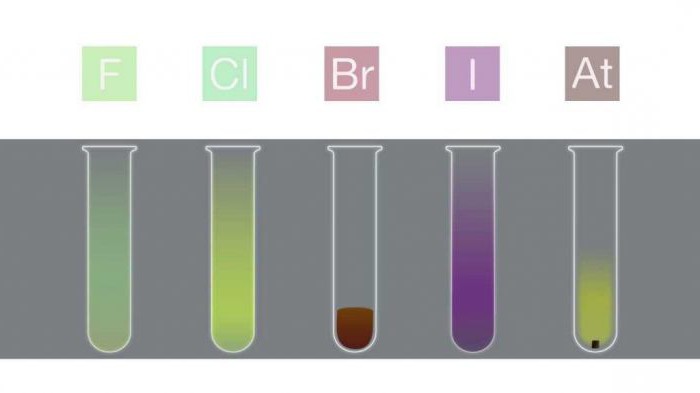
Бром и йод входят в комплексы биологически активных соединений: ферментов и гормонов. Например, трийодтиронин и тироксин, вырабатываемые тканями щитовидной железы и содержащие ионы йода, регулируют важнейшие процессы обмена веществ в организме человека. Их недостаточная секреция может вызвать такие тяжелые эндокринные патологии, как эндемический зоб или базедова болезнь. Основные источники поступления брома и йода в организм – это пищевая соль (хлорид натрия), морские водоросли, например такие, как ламинария (она содержит йод и бром), морепродукты.
Классическим примером, известным еще из школьного курса химии, является лабораторный опыт выделения свободного хлора из соляной кислоты действием на нее диоксида марганца при нагревании. Реакция обязательно проводится в вытяжном шкафу вследствие высокой токсичности газообразного хлора. Если в качестве окислителя использовать перманганат калия, то процесс можно проводить без нагревания реагентов. Фтор, хлор, бром и йод имеют широкое применение в химии органического синтеза, в фармакологии и медицине, поэтому получение галогенов проводится в промышленных масштабах методом электролиза. Чтобы выделить молекулы CI2 , используют электолизеры с концентрированным раствором хлорида натрия.

Хлор восстанавливается на аноде, его собирают, а затем сжижают под давлением до 6 атмосфер и при комнатной температуре. Для транспортировки полученного продукта используют стальные баллоны. Фтор, бром и йод также получают методом электролиза. Но при этом используют не растворы, а расплавы их солей.
Как простые вещества, так и соединения хлора, фтора, брома и йода имеют большое значение в жизни человека. Например, применение галогенов в медицине обусловлено бактерицидными свойствами спиртового раствора йода и хлорной извести. Последнее вещество можно использовать в проведении карантинных мероприятий, при очистке воды и дегазации зараженной территории. Высокие окислительные свойства хлора позволяют применять его в качестве отбеливателя ткани и бумаги.

Простое вещество также используют в промышленном производстве соляной кислоты. Фтор – незаменимый компонент в синтезе фторопластов, вследствие высокой химической активности им окисляют ракетное топливо. Бром входит в состав многих лекарственных средств, применяемых в неврологии для купирования судорожных состояний, при нервном истощении и бессоннице. Все выше приведенные примеры являются наглядным подтверждением того, какое важное значение для человека имеет применение галогенов в промышленности и быту.
fb.ru