 Фотография, сделанная с помощью электронного микроскопа, показывает процесс закрепления бактериофагов (колифагов T1) на поверхности бактерии E. coli.
Фотография, сделанная с помощью электронного микроскопа, показывает процесс закрепления бактериофагов (колифагов T1) на поверхности бактерии E. coli.Константин Мирошников, «Популярная механика» № 10-2013
У всех существ, обитающих на земле, есть микроскопические паразиты – вирусы. Есть свои вирусы и у бактерий. Цикл размножения бактериальных вирусов неизбежно заканчивается гибелью микроба. Чтобы подчеркнуть такую особенность, один из первооткрывателей этого эффекта, Феликс Д’Эрель, придумал специальное название – «бактериофаги», в переводе с греческого – «пожиратели бактерий».
 Фотография, сделанная с помощью электронного микроскопа, показывает процесс закрепления бактериофагов (колифагов T1) на поверхности бактерии E. coli.
Фотография, сделанная с помощью электронного микроскопа, показывает процесс закрепления бактериофагов (колифагов T1) на поверхности бактерии E. coli.
В конце ХХ века стало ясно, что бактерии безусловно доминируют в биосфере Земли, составляя более 90% ее биомассы. У каждого вида имеется множество специализированных типов вирусов. По предварительным оценкам, число видов бактериофагов составляет около 1015. Чтобы понять масштаб этой цифры, можно сказать, что если каждый человек на Земле будет каждый день открывать по одному новому бактериофагу, то на описание всех их понадобится 30 лет.
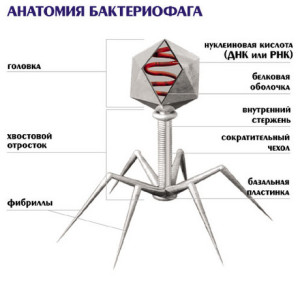
Таким образом, бактериофаги – самые малоизученные существа в нашей биосфере. Большинство известных сегодня бактериофагов принадлежит к отряду Caudovirales – хвостатые вирусы. Их частицы имеют размер от 50 до 200 нм. Хвост разной длины и формы обеспечивает присоединение вируса к поверхности бактерии-хозяина, головка (капсид) служит хранилищем для генома. Геномная ДНК кодирует структурные белки, формирующие «тело» бактериофага, и белки, которые обеспечивают размножение фага внутри клетки в процессе инфекции.
Можно сказать, что бактериофаг – это природный высокотехнологичный нанообъект. Например, хвосты фагов представляют собой «молекулярный шприц», который протыкает стенку бактерии и, сокращаясь, впрыскивает свою ДНК внутрь клетки. С этого момента начинается инфекционный цикл. Его дальнейшие этапы состоят из переключения механизмов жизнедеятельности бактерии на обслуживание бактериофага, размножение его генома, построение множества копий вирусных оболочек, упаковки в них ДНК вируса и, наконец, разрушение (лизис) хозяйской клетки.
 Бактериофаг – это не живое существо, а молекулярный наномеханизм, созданный природой. Хвост бактериофага – шприц, который протыкает стенку бактерии и впрыскивает вирусную ДНК, которая хранится в головке (капсиде), внутрь клетки.
Бактериофаг – это не живое существо, а молекулярный наномеханизм, созданный природой. Хвост бактериофага – шприц, который протыкает стенку бактерии и впрыскивает вирусную ДНК, которая хранится в головке (капсиде), внутрь клетки.
У каждого этапа существует множество нюансов, имеющих глубокий эволюционный и экологический смысл. Ведь бактерии и их вирусные паразиты сосуществуют сотни миллионов, если не миллиарды лет. И эта борьба за выживание не закончилась ни тотальным уничтожением одноклеточных, ни приобретением тотальной устойчивости к фагам и бесконтрольным размножением бактерий.
Помимо постоянного эволюционного соревнования механизмов защиты у бактерий и нападения у вирусов, причиной сложившегося равновесия можно считать и то, что бактериофаги специализировались по своему инфекционному действию. Если имеется крупная колония бактерий, где своих жертв найдут и следующие поколения фагов, то уничтожение бактерий литическими (убивающими, дословно – растворяющими) фагами идет быстро и непрерывно.
Если потенциальных жертв маловато или внешние условия не слишком подходят для эффективного размножения фагов, то преимущество получают фаги с лизогенным циклом развития. В этом случае после внедрения внутрь бактерии ДНК фага не сразу запускает механизм инфекции, а до поры до времени существует внутри клетки в пассивном состоянии, зачастую внедряясь в бактериальный геном.
В таком состоянии профага вирус может существовать долго, проходя вместе с хромосомой бактерии циклы деления клетки. И лишь когда бактерия попадает в благоприятную для размножения среду, активируется литический цикл инфекции. При этом, когда ДНК фага освобождается из бактериальной хромосомы, часто захватываются и соседние участки бактериального генома, а их содержимое в дальнейшем может перенестись в следующую бактерию, которую заразит бактериофаг. Этот процесс (трансдукция генов) считается важнейшим средством переноса информации между прокариотами – организмами без клеточных ядер.
 Как действует бактериофаг
Как действует бактериофаг
Все эти молекулярные тонкости не были известны во втором десятилетии ХХ века, когда были открыты «невидимые инфекционные агенты, уничтожающие бактерий». Но и без электронного микроскопа, с помощью которого в конце 1940-х впервые удалось получить изображения бактериофагов, было понятно, что они способны уничтожать бактерии, в том числе и болезнетворные. Это свойство было незамедлительно востребовано медициной.
Первые попытки лечения фагами дизентерии, раневых инфекций, холеры, тифа и даже чумы были проведены достаточно аккуратно, и успех выглядел вполне убедительно. Но после начала массового выпуска и использования фаговых препаратов эйфория сменилась разочарованием. О том, что такое бактериофаги, как производить, очищать и применять их лекарственные формы, было известно еще очень мало. Достаточно сказать, что по результатам предпринятой в США в конце 1920-х годов проверки во многих промышленных фагопрепаратах собственно бактериофагов вообще не оказалось.
Проблема с антибиотиками
Вторую половину ХХ века в медицине можно назвать «эрой антибиотиков». Однако еще первооткрыватель пенициллина Александр Флеминг в своей нобелевской лекции предупреждал, что устойчивость микробов к пенициллину возникает довольно быстро. До поры до времени антибиотикоустойчивость компенсировалась разработкой новых типов противомикробных лекарств. Но с 1990-х годов стало ясно, что человечество проигрывает «гонку вооружений» против микробов.
Виновато прежде всего бесконтрольное применение антибиотиков не только в лечебных, но и в профилактических целях, причем не только в медицине, но и в сельском хозяйстве, пищевой промышленности и быту. В результате устойчивость к этим препаратам начала вырабатываться не только у болезнетворных бактерий, но и у самых обычных микроорганизмов, живущих в почве и воде, делая из них «условных патогенов».
Такие бактерии комфортно существуют в медицинских учреждениях, заселяя сантехнику, мебель, медицинскую аппаратуру, порой даже дезинфицирующие растворы. У людей с ослабленным иммунитетом, каких в больницах большинство, они вызывают тяжелейшие осложнения.
Неудивительно, что медицинское сообщество бьет тревогу. В прошедшем, 2012 году гендиректор ВОЗ Маргарет Чен выступила с заявлением, предсказывающим конец эры антибиотиков и беззащитность человечества перед инфекционными заболеваниями. Впрочем, практические возможности комбинаторной химии – основы фармакологической науки – далеко не исчерпаны. Другое дело, что разработка противомикробных средств – очень дорогой процесс, не приносящий таких прибылей, как многие другие лекарства. Так что страшилки о «супербактериях» – это скорее предостережение, побуждающее людей к поискам альтернативных решений.
Бактериофаги и иммунитет
Поскольку бактериофагов в природе несметное количество и они постоянно попадают в организм человека с водой, воздухом и пищей, то иммунитет их просто игнорирует. Существует даже гипотеза о симбиозе бактериофагов в кишечнике, регулирующем кишечную микрофлору. Добиться какой-то иммунной реакции можно лишь при длительном введении в организм больших доз фагов.
Но таким образом можно добиться аллергии на почти любые вещества. И наконец, очень важно, что бактериофаги недороги. Разработка и производство препарата, состоящего из точно подобранных бактериофагов с полностью расшифрованными геномами, культивированных по современным биотехнологическим стандартам на определенных штаммах бактерий в химически чистых средах и прошедших высокую очистку, на порядки дешевле, чем современных сложных антибиотиков.
Это позволяет быстро приспосабливать фаготерапевтические препараты к меняющимся наборам патогенных бактерий и применять бактериофаги в ветеринарии, где дорогие лекарства экономически не оправданы.
На медицинской службе
Вполне логичным выглядит возрождение интереса к использованию бактериофагов – естественных врагов бактерий – для лечения инфекций. Действительно, за десятилетия «эры антибиотиков» бактериофаги активно служили науке, но не медицине, а фундаментальной молекулярной биологии. Достаточно упомянуть расшифровку «триплетов» генетического кода и процесса рекомбинации ДНК. Сейчас о бактериофагах известно достаточно, чтобы обоснованно выбирать фаги, подходящие для терапевтических целей.
Достоинств у бактериофагов как потенциальных лекарств множество. Прежде всего – это их несметное количество. Хотя изменять генетический аппарат бактериофага тоже намного проще, чем у бактерии, и тем более – у высших организмов, в этом нет необходимости. Всегда можно подобрать что-то подходящее в природе. Речь идет скорее о селекции, закреплении востребованных свойств и размножении нужных бактериофагов.
Это можно сравнить с выведением пород собак – ездовых, сторожевых, охотничьих, гончих, бойцовых, декоративных… Все они при этом остаются собаками, но оптимизированы под определенный вид действий, нужных человеку. Во-вторых, бактериофаги строго специфичны, то есть они уничтожают только определенный вид микробов, не угнетая при этом нормальную микрофлору человека.
В-третьих, когда бактериофаг находит бактерию, которую должен уничтожить, он в процессе своего жизненного цикла начинает размножаться. Таким образом, не столь острым становится вопрос дозировки. В-четвертых, бактериофаги не вызывают побочных эффектов. Все случаи аллергических реакций при использовании терапевтических бактериофагов были вызваны либо примесями, от которых препарат был недостаточно очищен, либо токсинами, выделяющимися при массовой гибели бактерий. Последнее явление, «эффект Герксхаймера», нередко наблюдается и при применении антибиотиков.
Две стороны медали
К сожалению, недостатков у медицинских бактериофагов тоже немало. Самая главная проблема проистекает из достоинства – высокой специфичности фагов. Каждый бактериофаг инфицирует строго определенный тип бактерий, даже не таксономический вид, а ряд более узких разновидностей, штаммов. Условно говоря, как если бы сторожевая собака начинала лаять только на одетых в черные плащи громил двухметрового роста, а на лезущего в дом подростка в шортах никак не реагировала.
Поэтому для нынешних фаговых препаратов нередки случаи неэффективного применения. Препарат, сделанный против определенного набора штаммов и прекрасно лечащий стрептококковую ангину в Смоленске, может оказаться бессильным против по всем признакам такой же ангины в Кемерове. Болезнь та же, вызывается тем же микробом, а штаммы стрептококка в разных регионах оказываются различными.
Для максимально эффективного применения бактериофага необходима точная диагностика патогенного микроба, вплоть до штамма. Самый распространенный сейчас метод диагностики – культуральный посев – занимает много времени и требуемой точности не дает. Быстрые методы – типирование с помощью полимеразной цепной реакции или масс-спектрометрии – внедряются медленно из-за дороговизны аппаратуры и более высоких требований к квалификации лаборантов. В идеале подбор фагов-компонентов лекарственного препарата можно было бы делать против инфекции каждого конкретного пациента, но это дорого и на практике неприемлемо.
Другой важный недостаток фагов – их биологическая природа. Кроме того, что бактериофаги для поддержания инфекционности требуют особых условий хранения и транспортировки, такой метод лечения открывает простор для множества спекуляций на тему «посторонней ДНК в человеке». И хотя известно, что бактериофаг в принципе не может заразить человеческую клетку и внедрить в нее свою ДНК, поменять общественное мнение непросто.
Из биологической природы и довольно большого, по сравнению с низкомолекулярными лекарствами (теми же антибиотиками), размера вытекает третье ограничение – проблема доставки бактериофага в организм. Если микробная инфекция развивается там, куда бактериофаг можно приложить напрямую в виде капель, спрея или клизмы, – на коже, открытых ранах, ожогах, слизистых оболочках носоглотки, ушей, глаз, толстого кишечника – то проблем не возникает.
Но если заражение происходит во внутренних органах, ситуация сложнее. Случаи успешного излечения инфекций почек или селезенки при обычном пероральном приеме препарата бактериофага известны. Но сам механизм проникновения относительно крупных (100 нм) фаговых частиц из желудка в кровоток и во внутренние органы изучен плохо и сильно разнится от пациента к пациенту. Бактериофаги бессильны и против тех микробов, которые развиваются внутри клеток, например возбудителей туберкулеза и проказы. Через стенку человеческой клетки бактериофаг пробраться не может.
Нужно отметить, что противопоставлять применение бактериофагов и антибиотиков в медицинских целях не следует. При совместном их действии наблюдается взаимное усиление противобактериального эффекта. Это позволяет, например, снизить дозы антибиотиков до значений, не вызывающих выраженных побочных эффектов. Соответственно, и механизм выработки у бактерий устойчивости к обоим компонентам комбинированного лекарства почти невозможен.
Расширение арсенала противомикробных препаратов дает больше степеней свободы в выборе методики лечения. Таким образом, научно обоснованное развитие концепции применения бактериофагов в противомикробной терапии – перспективное направление. Бактериофаги служат не столько альтернативой, сколько дополнением и усилением в борьбе с инфекциями.
Автор – и.о. зав.лаб. молекулярной биоинженерии Института биоорганической химии им. Шемякина и Овчинникова РАН
Портал «Вечная молодость» http://vechnayamolodost.ru01.11.2013
www.vechnayamolodost.ru
 Бактериофа́ги (фаги) (от φᾰγω — «пожираю») — вирусы, избирательно поражающие бактериальные клетки. Чаще всего бактериофаги размножаются внутри бактерий и вызывают их лизис. Бактериофаг состоит из белковой оболочки и генетического материала нуклеиновой кислоты. Бактериофаги представляют собой наиболее многочисленную, широко распространенную в биосфере и, предположительно, наиболее эволюционно древнюю группу вирусов. В природных условиях фаги встречаются в тех местах, где есть чувствительные к ним бактерии. Чем богаче тот или иной субстрат (почва, выделения человека и животных, вода и т. д.) микроорганизмами, тем в большем количестве в нём встречаются соответствующие фаги. Бактериофаги выполняют важную роль в контроле численности микробных популяций, в автолизе стареющих клеток, в переносе бактериальных генов. Бактериофаги представляют собой один из основных подвижных генетических элементов. Посредством трансдукции они привносят в бактериальный геном новые гены. Было подсчитано, что за 1 секунду могут быть инфицированы 1024 бактерий. Это означает, что постоянный перенос генетического материала распределяется между бактериями, обитающими в сходных условиях.
Бактериофа́ги (фаги) (от φᾰγω — «пожираю») — вирусы, избирательно поражающие бактериальные клетки. Чаще всего бактериофаги размножаются внутри бактерий и вызывают их лизис. Бактериофаг состоит из белковой оболочки и генетического материала нуклеиновой кислоты. Бактериофаги представляют собой наиболее многочисленную, широко распространенную в биосфере и, предположительно, наиболее эволюционно древнюю группу вирусов. В природных условиях фаги встречаются в тех местах, где есть чувствительные к ним бактерии. Чем богаче тот или иной субстрат (почва, выделения человека и животных, вода и т. д.) микроорганизмами, тем в большем количестве в нём встречаются соответствующие фаги. Бактериофаги выполняют важную роль в контроле численности микробных популяций, в автолизе стареющих клеток, в переносе бактериальных генов. Бактериофаги представляют собой один из основных подвижных генетических элементов. Посредством трансдукции они привносят в бактериальный геном новые гены. Было подсчитано, что за 1 секунду могут быть инфицированы 1024 бактерий. Это означает, что постоянный перенос генетического материала распределяется между бактериями, обитающими в сходных условиях.
Бактериофаги различаются по химической структуре, типу нуклеиновой кислоты, морфологии и характеру взаимодействия с бактериями. По размеру бактериальные вирусы в сотни и тысячи раз меньше микробных клеток. Типичная фаговая частица состоит из головки и хвоста. Длина хвоста обычно в 2 — 4 раза больше диаметра головки. Фаги, как и все вирусы, являются абсолютными внутриклеточными паразитами. Хотя они переносят всю информацию для запуска собственной репродукции в соответствующем хозяине, у них отсутствуют механизмы для выработки энергии и рибосомы для синтеза белка.
Первоначально бактериофаги прикрепляются к фагоспецифическим рецепторам на поверхности бактериальной клетки. Хвост фага с помощью ферментов, находящихся на его конце, локально растворяет оболочку клетки, сокращается и содержащаяся в головке ДНК инъецируется в клетку, при этом белковая оболочка бактериофага остается снаружи. Продолжительность этого процесса может составлять от нескольких минут до нескольких часов. Затем происходит лизис клетки, и освобождаются новые зрелые бактериофаги. Иногда фаг инициирует лизирующий цикл, что приводит к лизису клетки и освобождению новых фагов. Таким образом, вирусный геном реплицируется синхронно с ДНК хозяина и делением клетки, а подобное состояние фага называется профагом. Бактерия, содержащая профаг, становится лизогенной до тех пор, пока при определенных условиях или спонтанно профаг не будет стимулирован на осуществление лизирующего цикла репликации.
Одной из областей использования бактериофагов является антибактериальная терапия, альтернативная приёму антибиотиков. Например, применяются бактериофаги: стрептококковый, стафилококковый, клебсиеллёзный, дизентерийный поливалентный, пиобактериофаг, коли, протейный и колипротейный и другие. Бактериофаги применяются также в генной инженерии в качестве векторов, переносящих участки ДНК, возможна также естественная передача генов между бактериями посредством некоторых фагов (трансдукция). Фаговые векторы обычно создают на базе умеренного бактериофага λ, содержащего ДНК. Размножение бактериофага возможно только в живых клетках. Бактериофаги могут быть использованы для определения жизнеспособности бактерий. Данное направление имеет большие перспективы, поскольку, одним из основных вопросов при разных биотехнологических процессах является определение жизнеспособности используемых культур. С помощью метода электрооптического анализа клеточных суспензий была показана возможность изучения этапов взаимодействия бактериофагов и микроорганизмов.
В компании НПЦ «МикроМир» разработан комбинированный фаговый препарат «Фагодерм»(подробнее о препаратах), предназначенный для профилактики и лечения гнойно-воспалительных осложнений в хирургии и раневых инфекций, вызванных патогеными штаммами.
Препарат выпускается в гелевой и лиофильно-высушенной формах. Гелевый препарат применяется в виде аппликаций на пораженный участок кожи, слизистой, подкожной клетчатки 1-2 раза в день до выздоровления. Можно наносить препарат на перевязочный материал. Не желательно применять препарат совместно с мазевыми препаратами.
Лиофильно-высушенный препарат готовится непосредственно перед употреблением: во флакон с лиофильно-высушенным препаратом вносится 1 мл стерильного физиологического раствора, содержимое флакона тщательно взбалтывается; приготовленный прозрачный раствор добавляют в 50 мл стерильного физиологического раствора, который используют для промываний, дренажей и аппликаций.
Препарат не имеет противопоказаний и побочных эффектов. Хранить при температуре +4ºС.
Препарат с бактериофагами устраняет зуд кожи. При обработке подмышечных областей и ног препарат устраняет неприятный запах на длительное время. «Фагодерм» является эффективным профилактическим средством в личной гигиене (обработка рук, мочеполовых органов, ректальной области при геморрое).
stemcellbank.spb.ru
Бактериофаги – уникальные микроорганизмы, на основе которых создана особая по своим свойствам и характеристикам группа лечебно-профилактических препаратов. Лежащие в основе их действия природные физиологические механизмы взаимодействия фагов и бактерий позволяют прогнозировать бесконечное разнообразие как самих бактериофагов, так и возможных способов их применения. По мере расширения коллекций бактериофагов, несомненно, будут появляться новые целевые патогены, будет расширяться спектр заболеваний, при которых фаги могут применяться как в режиме монотерапии, так и в составе комплексных схем лечения.
 Современная медицина располагает огромным арсеналом терапевтических средств влияния на микроорганизмы. Однако так было далеко не всегда. Еще в конце XIX в. ученые знали о существовании микроорганизмов, но не располагали научно обоснованной теорией воздействия на них. Одним из основоположников современной концепции этиотропной терапии с полным правом мы считаем Дмитрия Леонидовича Романовского, который еще в 1890 г. писал, что «…истинная специфичность действия на самую сущность болезни, на производящего ее паразита…» заключается «…в разрушительном действии на паразита…» и для каждой инфекции должно быть найдено «…вещество, которое при введении в заболевший организм окажет наименьший вред последнему вызовет наибольшее деструктивное действие в патогенном агенте…» [1]. Дальнейшее развитие этой концепции мы находим в трудах Пауля Эрлиха, приложившего немало усилий для поиска средства против бледной спирохеты. Анализ литературных сведений, собственный опыт и эксперимента позволили Эрлиху сформулировать концепцию «волшебной пули» (die Zauberkugel), т. е. вещества с минимальной органотропностью и максимальной паразитотропностью. Как мы знаем, ни одни из имеющихся лекарственных препаратов, основанных на химическом взаимодействии органических и неорганических молекул, не смогли достичь заявленной Паулем Эрлихом избирательности действия и заданного уровня безопасности. Из всех известных современной медицине лекарственных препаратов, пожалуй, наивысшей таргентной активностью обладают бактериофаги, в истории открытия которых также нашлось место отечественным ученым. Если первую гипотезу об уничтожении бактерий некой неизвестной субстанцией высказал в 1896 г. английский бактериолог Эрнест Ханкин, то первым явление разрушения палочки сибирской язвы в 1898 г. наблюдал русский микробиолог Н.Ф. Гамалея. И лишь в 1917 г. Феликс Д’Эрель сообщил, что нашел «невидимого микроба», поражающего дизентерийную палочку. Он же дал название «бактериофаг» («пожиратель бактерий») новому микроорганизму. Стремительное внедрение в повседневную практику антибиотиков в середине XX в. на Западе и в США сместило акценты в антимикробной терапии в пользу антибиотиков. И лишь в XXI в. зарубежные исследователи вновь обратили свое внимание на возможности фаготерапии. Признавая несомненные заслуги и опыт советских ученых, подчеркивают, что «…обилие клинических доказательств имеется в советской литературе, но во многом они технически несовершенны. Более реалистическая оценка клинического значения фагов может быть получена в результате исследований на животных, проводящихся на Западе [2]. Перечень бактерий, на которые мы можем воздействовать антибиотиком, в десятки раз шире, чем аналогичный перечень для бактериофагов. Однако мы должны отчетливо понимать, что эти ограничения применимы не к бактериофагам как таковым, а именно к группе зарегистрированных лекарственных препаратов. Число известных бактериофагов существенно больше. Кроме того, высокая специфичность бактериофагов как обоюдоострый меч позволяет эффективно их применять как для диагностических, так и лечебных целей. Если приказ Минздрава России от 21.02.2000 №64 «Об утверждении номенклатуры клинических лабораторных исследований» предлагает в целях диагностики фаготипировать Сorynebacterium diphtheriae, Salmonella, Staphilococcus aureus и Yersinia pestis, то производители лекарственных препаратов на основе бактериофагов предлагают существенно больший перечень «целевых» микроорганизмов как для диагностического, так и лечебно-профилактического применения – Shigella, Salmonella serogroups A, B, C, D, E, Salmonella typhi, Stapylococcus aureus и ряд других видов коагулазоотрицательных стафилококков, Streptococcus, Enterococcus, Proteus vulgaris и P. mirabilis, патогенные Escherichia coli, Pseudomonas aeruginosa, Klebsiella rhinoscleromatis, Klebsiella pneumoniae, Klebsiella ozaenae. Есть опыт применения бактериофагов против C. difficile [3, 4], Listeria monocytogenes [5], Acinetobacter [6], H. pylori [7], хламидий [8].
Современная медицина располагает огромным арсеналом терапевтических средств влияния на микроорганизмы. Однако так было далеко не всегда. Еще в конце XIX в. ученые знали о существовании микроорганизмов, но не располагали научно обоснованной теорией воздействия на них. Одним из основоположников современной концепции этиотропной терапии с полным правом мы считаем Дмитрия Леонидовича Романовского, который еще в 1890 г. писал, что «…истинная специфичность действия на самую сущность болезни, на производящего ее паразита…» заключается «…в разрушительном действии на паразита…» и для каждой инфекции должно быть найдено «…вещество, которое при введении в заболевший организм окажет наименьший вред последнему вызовет наибольшее деструктивное действие в патогенном агенте…» [1]. Дальнейшее развитие этой концепции мы находим в трудах Пауля Эрлиха, приложившего немало усилий для поиска средства против бледной спирохеты. Анализ литературных сведений, собственный опыт и эксперимента позволили Эрлиху сформулировать концепцию «волшебной пули» (die Zauberkugel), т. е. вещества с минимальной органотропностью и максимальной паразитотропностью. Как мы знаем, ни одни из имеющихся лекарственных препаратов, основанных на химическом взаимодействии органических и неорганических молекул, не смогли достичь заявленной Паулем Эрлихом избирательности действия и заданного уровня безопасности. Из всех известных современной медицине лекарственных препаратов, пожалуй, наивысшей таргентной активностью обладают бактериофаги, в истории открытия которых также нашлось место отечественным ученым. Если первую гипотезу об уничтожении бактерий некой неизвестной субстанцией высказал в 1896 г. английский бактериолог Эрнест Ханкин, то первым явление разрушения палочки сибирской язвы в 1898 г. наблюдал русский микробиолог Н.Ф. Гамалея. И лишь в 1917 г. Феликс Д’Эрель сообщил, что нашел «невидимого микроба», поражающего дизентерийную палочку. Он же дал название «бактериофаг» («пожиратель бактерий») новому микроорганизму. Стремительное внедрение в повседневную практику антибиотиков в середине XX в. на Западе и в США сместило акценты в антимикробной терапии в пользу антибиотиков. И лишь в XXI в. зарубежные исследователи вновь обратили свое внимание на возможности фаготерапии. Признавая несомненные заслуги и опыт советских ученых, подчеркивают, что «…обилие клинических доказательств имеется в советской литературе, но во многом они технически несовершенны. Более реалистическая оценка клинического значения фагов может быть получена в результате исследований на животных, проводящихся на Западе [2]. Перечень бактерий, на которые мы можем воздействовать антибиотиком, в десятки раз шире, чем аналогичный перечень для бактериофагов. Однако мы должны отчетливо понимать, что эти ограничения применимы не к бактериофагам как таковым, а именно к группе зарегистрированных лекарственных препаратов. Число известных бактериофагов существенно больше. Кроме того, высокая специфичность бактериофагов как обоюдоострый меч позволяет эффективно их применять как для диагностических, так и лечебных целей. Если приказ Минздрава России от 21.02.2000 №64 «Об утверждении номенклатуры клинических лабораторных исследований» предлагает в целях диагностики фаготипировать Сorynebacterium diphtheriae, Salmonella, Staphilococcus aureus и Yersinia pestis, то производители лекарственных препаратов на основе бактериофагов предлагают существенно больший перечень «целевых» микроорганизмов как для диагностического, так и лечебно-профилактического применения – Shigella, Salmonella serogroups A, B, C, D, E, Salmonella typhi, Stapylococcus aureus и ряд других видов коагулазоотрицательных стафилококков, Streptococcus, Enterococcus, Proteus vulgaris и P. mirabilis, патогенные Escherichia coli, Pseudomonas aeruginosa, Klebsiella rhinoscleromatis, Klebsiella pneumoniae, Klebsiella ozaenae. Есть опыт применения бактериофагов против C. difficile [3, 4], Listeria monocytogenes [5], Acinetobacter [6], H. pylori [7], хламидий [8]. 
Так, использование поливалентного пиобактериофага Секстафаг при лечении инфицированного панкреонекроза (Пермская государственная медицинская академия им. академика Е.А. Вагнера) позволило быстрее восстанавливать у больных основные параметры гомеостаза и функции органов и систем. Также значительно снизилось количество послеоперационных осложнений и летальных исходов: в группе больных, получавших стандартную терапию, летальность составила 100%, в то время как в труппе, получавшей БФ, — 16,6% [22].
Вследствие безвредности и ареактогенности препаратов БФ возможно их применение в педиатрической практике, в т. ч. и у новорожденных детей. Интересен опыт Нижегородской детской областной клинической больницы, где в период осложнения эпидемиологической ситуации наряду с обычными противоэпидемическими мероприятиями были использованы и БФ — Интести-бактериофаг и БФ Pseucfomonas aeruginosa. Снижение заболеваемости внутибольничной инфекцией синегнойной этиологии в 11 раз показало высокую эффективность применения БФ [20]. Препараты БФ могут назначаться как для лечения дисбактериоза и расстройств пищеварительной системы, так и для предотвращения колонизации слизистых оболочек желудочно-кишечного тракта условно-патогенными бактериями. Поликомпонентные препараты БФ идеальны для немедленного купирования первых признаков расстройства желудочно-кишечного тракта.
На сегодняшний день на предприятии намечен целый ряд приоритетных направлений разработки и производства лечебно-профилактических бактериофагов, которые коррелируют с вновь зарождающимися общемировыми тенденциями. Создаются и внедряются новые препараты: разработаны БФ против серраций и энтеробактерий, ведутся работы по созданию фагового препарата против Helicobacter pylori.
Лишь один производитель этих препаратов – НПО «Микроген», по докладу замглавы управления науки и инновационного развития Аллы Лобастовой, выпускает более 2 млн упаковок ежегодно [9]. К сожалению, представления многих врачей о бактериофагах далеки от объективности. Не многие знают, что бактериофаги, активные в отношении одного и того же возбудителя, могут относиться к разным семействам, обладать различным жизненным циклом и т. п. Так, например, бактериофаги P. aeruginosa относятся к семействам Myoviridae, Podoviridae, Siphoviridae, имеют литический жизненный цикл или умеренный. Разные штаммы одного и того же патогена могут обладать различной чувствительностью к бактериофагам. Большинство специалистов знают (слышали, кто-то применял) о существовании жидкой и таблетированной лекарственной формы лечебно-профилактических препаратов бактериофагов. Однако их спектр существенно шире, что может быть отнесено к безусловным преимуществам, особенно в сочетании с многообразием путей введения (прием внутрь, введение в клизмах, аппликации, орошение ран и слизистых оболочек, введение в раневые полости и т. п.) [10]. К очевидным преимуществам бактериофагов традиционно относят специфическое воздействие на достаточно ограниченную популяцию бактерий, ограниченное во времени существование (пока не исчезнет целевая популяция микроорганизмов), отсутствие таких побочных эффектов, как токсические и аллергические реакции, дисбиотические реакции и др. Эти препараты могут применяться в самых разных возрастных группах и при беременности [11, 12]. Сами бактериофаги не являются значимыми аллергенами. Случаи непереносимости препаратов бактериофагов связаны в своем большинстве с реакцией на компоненты питательной среды. Все крупные производители этой группы препаратов стремятся к максимальному качеству используемых компонентов, что уменьшает вероятность таких реакций. В условиях роста антибиотикорезистентности некоторые авторы [13] предлагают рассматривать бактериофаги как наилучшую альтернативу антибиотикам. Лечебно-профилактические препараты бактериофагов представляют собой коктейль из специально подобранных комбинаций (комплекс поликлональных высоковирулентных бактериальных вирусов, специально подобранных против наиболее часто встречающихся групп возбудителей бактериальных инфекций) на основе коллекций фагов производителя [14]. Филиалы ФГУП «НПО «Микроген» в Уфе, Перми и Нижнем Новгороде – современные центры производства таких препаратов. Возможность создания адаптированных к конкретным патогенным микроорганизмам лечебно-профилактических препаратов бактериофагов – еще одно важнейшее преимущество этой группы препаратов. Рост устойчивости бактерий к антимикробным препаратам и часто встречающаяся полиэтиологичность современных инфекционных заболеваний требуют проведения комбинированной антибиотикотерапии (двух, трех, а иногда и более антимикробных препаратов). Для выбора эффективной схемы терапии антибиотиками, помимо собственно чувствительности бактерии к препарату, необходимо учесть достаточно большое число факторов. Фаготерапия в этом отношении также имеет определенные преимущества. С одной стороны, применение комбинации бактериофагов не сопровождается их взаимодействием между собой и не ведет к изменению схем их применения. В рамках имеющегося набора лечебных бактериофагов существуют ряд хорошо себя зарекомендовавших комбинаций – бактериофаг колипротейный, пиобактериофаг поливалентный, интести-бактериофаг. С другой стороны, бактерии не имеют общих механизмов устойчивости к антибиотикам и фагам, следовательно, могут они применяться как при устойчивости патогена к одному из препаратов, так и в комбинации «антибиотик + бактериофаг». Особенно эффективна такая комбинация для разрушения микробных биопленок. В эксперименте убедительно показано, что комбинированное применение антагонистов железа и бактериофага способно нарушать формирование биопленок Klebsiella pneumoniae [15]. При этом отмечается как достоверное уменьшение численности микробной популяции, так и уменьшение числа «молодых» клеток. Еще одной важной особенностью действия бактериофагов является такой феномен, как индукция апоптоза. Некоторые штаммы E. coli имеют гены, вызывающие гибель клетки после внедрения в нее бактериофага Т4 [16]. Так, в ответ на экспрессию поздних генов фага Т4 ген lit (кодирует протеазу, разрушающую необходимый для синтеза белков фактор элонгации EF-Tu [17]) блокирует синтез всех клеточных белков. Ген prrC кодирует нуклеазу, расщепляющую лизиновую тРНК. Нуклеаза активируется продуктом гена stp фага Т4. У инфицированных фагом Т4 клеток гены rex (относятся к геному фага и экспрессируются в лизогенных клетках) вызывают формирование ионных каналов, ведущих к потере клетками жизненно важных ионов и впоследствии к гибели. Предотвратить гибель клетки может сам фаг Т4, закрывая каналы своими белками, продуктами генов rII [18]. В случае формирования устойчивости бактерий к антибиотику приходится искать новые варианты модификации активной молекулы или принципиально новые вещества. К сожалению, за последние годы темпы внедрения новых антибиотиков существенно замедлились. Ситуация с бактериофагами принципиально иная. Коллекции крупных производителей насчитывают десятки готовых штаммов бактериофагов и постоянно пополняются новыми активными фагами [19]. Благодаря постоянно проводимому мониторингу чувствительности выделяемых патогенов к бактериофагам производители корректируют поставляемые в регионы фаговые композиции [20]. Благодаря адаптированным бактериофагам удается ликвидировать вспышки внутригоспитальных инфекций, вызываемых резистентными к антибиотикам штаммами [21].
При пероральном приеме бактериофаги быстро достигают очагов локализации инфекции: при пероральном приеме больными с гнойно-воспалительными заболеваниями уже через час фаги попадают в кровь, через 1–1,5 ч выявляются из бронхолегочного экссудата и с поверхности ожоговых ран, через 2 ч – из мочи, а также из ликвора больных с черепно-мозговыми травмами [14].
Таким образом, бактериофаги – уникальные микроорганизмы, на основе которых создана особая по своим свойствам и характеристикам группа лечебно-профилактических препаратов. Лежащие в основе их действия природные физиологические механизмы взаимодействия фагов и бактерий позволяют прогнозировать бесконечное разнообразие как самих бактериофагов, так и возможных способов их применения. По мере расширения коллекций бактериофагов, несомненно, будут появляться новые целевые патогены, будет расширяться спектр заболеваний, при которых фаги могут применяться как в режиме монотерапии, так и в составе комплексных схем лечения. Современный взгляд на дальнейшую судьбу фаготерапии должен быть основан как на высокой специфичности их действия, так и на необходимости строго соблюдения всех правил фаготерапии. Противопоставление бактериофагов любым средствам этиотропной терапии является ошибочным. Источник : http://www.remedium.ru/drugs/detail.php?ID=64539pharmedu.ru
ФГОУ ВПО САНКТ-ПЕТЕРБУРГСКАЯ
ГОСУДАРСТВЕННАЯ АКАДЕМИЯ
ВЕТЕРИНАРНОЙ МЕДИЦИНЫ
Кафедра микробиологии, вирусологии и иммунологии
РЕФЕРАТ
на тему: Природа, морфология и основные свойства бактериофагов. Механизм действия их на бактериальную клетку. Применение их в диагностике, лечении и профилактике болезней
Студентки 2-го курса 21-й группы
Генрих Елены Валерьевны
Проверил преподаватель:
Приходько Елена Игнатьевна
Санкт-Петербург
2008 год
ВВЕДЕНИЕ
Бактерии, резистентные к большинству или ко всем из всех известных антибиотиков, вызывают всё более серьезные проблемы. Это увеличивает риск возврата человечества к проблемам того периода, когда антибиотики были неизвестны, когда были широко распространены неизлечимые инфекции и эпидемии. Несмотря на интенсивную работу фармацевтических компаний, за последние 30 лет не было найдено новых классов антибиотиков. Есть надежда, что вновь обнаруженная возможность полностью секвенировать микробные геномы и определять молекулярные основы патогенности откроет новые пути лечения инфекционных заболеваний, но с всё большим рвением идет поиск других подходов к этой проблеме. Одним из результатов такого поиска является вновь возникший интерес к возможностям терапевтического использования бактериофагов (от бактерии и греч. phagos -- пожиратель; буквально -- пожиратели бактерий) - специфических вирусов, которые атакуют только бактерии и убивают патогенные микроорганизмы. Для обозначения фагов вызывающих лизис актиномицетов, применяется термин актинофаг, микобактерий-- микофаг, кишечной палочки -- колифаг, водорослей -- цианофаг и т.д.
Фаговая терапия была впервые разработана в начале этого века и казалась многообещающей, хотя и вызвала много споров. Вначале много внимания уделялось изучению фагов, активных против патогенных бактерий: дизентерийной, брюшнотифозной, дифтерийной палочек, стафилококков с целью выяснения возможности использования их для лечения и профилактики инфекционных заболеваний. Одновременно много внимания уделялось изучению природы фагов. С начала эры антибиотиков в 40-х гг. в западных странах ее использовали мало. При этом в Восточной Европе за последние 50 лет были проведены широкие клинические исследования в отношении фаговой терапии. Результаты этой работы хорошо дополняют ограниченные изыскания последних лет, проведенные на животных на Западе. В последние годы проблема бактериофагии фактически превратилась в самостоятельную область биологии со своими специфическими разделами. Это придает оптимизм в том отношении, что фаги могут, в самом деле, играть важную роль в борьбе с инфекциями, вызываемых микробами, резистентность которых к лекарственным средствам растет.
Фаги оказались весьма удобной моделью для разрешения ряда важнейших теоретических и практических вопросов общей биологии, генетики, молекулярной биологии, биохимии, а также медицины, ветеринарии и вирусологии.
В результате большого теоретического и практического значения проблемы бактериофагии за последние 10--20 лет фаги изучались весьма интенсивно и всесторонне.
История бактериофагов
1896: Эрнест Ханкин сообщил, что воды рек Ганга и Джамна в Индии обладают значительной антибактериальной активностью, которая сохранялась после прохождения через фарфоровый фильтр с порами очень малого размера, но устранялась при кипячении. Наиболее подробно изучал он действие неизвестной субстанции на Vibrio cholerae и предположил, что она ответственна за предупреждение распространения эпидемий холеры, вызванных употреблением воды из этих рек. При этом, в последующем, он не объяснил этот феномен.
1898: Впервые перевиваемый лизис бактерий (сибиреязвенной палочки) наблюдал русский микробиолог Н.Ф. Гамалея.
1915: Английский учёный Ф. Туорт описал это же явление у гнойного стафилококка и открыл первый «вирус, пожирающий бактерии» , когда он наблюдал любопытное дегенеративное изменение - лизис в культурах стафилококков из лимфы теленка. С его именем связано название «феномен Туорта».
1917: Феликс д'Эрель делает аналогичное открытие, Именно Феликс д'Эрель канадский сотрудник Института Пастера в Париже, дал им название “бактериофаги” - используя суффикс “фаг” не в его прямом смысле “есть”, а в смысле развития за счет чего-то (д'Эрель, 1922, р. 21), они стали главной частью работы всей его жизни.
Д'Эрель, микробиолог, преимущественно самоучка, провел 10 лет в Гватемале, Мексике и Аргентине. Там он имел дело с эпидемиями дизентерии, желтой лихорадки и грибков кофейных деревьев, для контроля чумы саранчи он выделил из умирающей саранчи бактерию, а также исследовал несколько интересных загадок брожения. Всё это было хорошей подготовкой к его более поздней работе с фагами и интересно изложено в Summers (1999). В Институте Пастера он проводил кропотливое исследование метода приготовления вакцины с помощью модельной системы - “B. typhimurium” на её природном хозяине мыши, поскольку был твердо убежден в том, что значимые данные об иммунитете и патогенности можно получить только при использовании природных хозяев. В свободное время он также продолжал обследовать дизентерийных больных - частую проблему в воевавшей Франции. Из фекалий нескольких из этих больных он выделил анти-шигелловый “микроорганизм”, который был размножен путем многочисленных серий пассажей на бактерии-хозяине и мог образовывать небольшие чистые круги на газоне этих же бацилл шигеллы ('Эрель, 1917).
Д'Эрель продолжал тщательно характеризовать бактериофаги как вирусы, которые размножаются в бактериях и разрабатывать подробности инфекции различными фагами разнообразных бактерий-хозяев в разных условиях окружающей среды, всегда объединяя в своей работе природные феномены и лабораторные данные, для лучшего понимания иммунитета и естественного (самопроизвольного) излечения от инфекционных заболеваний (Summers, 1999). На Девятнадцатом ежегодном заседании Британской Медицинской Ассоциации в Глазго прошла очень интересная дискуссия между д'Эрель, Twort и несколькими другими выдающимися учеными того времени о природе и свойствах бактериофагов (d'Herelle et al, 1922). Главный её вопрос: является ли причинной основой лизиса бактерий, вырабатываемый ими фермент или это особая форма мельчайшего вируса с некоторым родом собственной жизни, как заявлял д'Эрель. Этот спор продолжался много лет, разделяя людей, работающих с фагами, которых становилось все больше и больше.
Д'Эрель суммировал начальный этап работы с фагами в 300-страничной книге “Бактериофаг” (1922). Он провел классические описания образования бляшек и состава, инфекционных центров, литических процессов, специфической адсорбции на бактерии-хозяина и размножения, зависимости продукции фагов от конкретного состояния бактерии-хозяина, выделения фагов из источников инфекционных бактерий и факторов, регулирующих стабильность внеклеточного фага. Он быстро увлекся очевидной ролью фагов в природном контроле микробных инфекций. Он, например, отметил частое выявление у выздоравливающих больных фагов, специфичных в отношении микроорганизмов, вызвавших заболевание и довольно быстрое по времени изменения популяций этих фагов. Всю свою жизнь он посвятил, разработке возможности применения фагов, полученных путем надлежащей селекции, как средства для лечения заболеваний, наиболее подрывавших здоровье людей в те годы. Вначале, однако, он сосредоточился на простом понимании биологии фагов. По этому первое известное сообщение об успешной фаговой терапии поступило не от д'Эрель, а от Bruynoghe и Маisin (1921), которые использовали фаг для лечения стафилококковых инфекций кожи.
Через год, будучи в институте Пастера в Сайгоне, д'Эрель оказался в тяжелом материальном положении, находясь в конфликте и имея интеллектуальные разногласия с коллективом института Пастера в Париже. Вскоре он принял предложение переехать в Нидерланды, где ему были обеспечены лучшие условия для работы по лечению инфекционных заболеваний и исследованию свойств бактериофагов. Там он опубликовал свою первую книгу и ряд статей, получил степень доктора медицинских наук .В 1925 г. он стал инспектором службы здравоохранения Лиги Наций, (Александрия, Египет), особо уполномоченным за борьбу с инфекционными заболеваниями на кораблях, проходящих по Суэцкому каналу и во время некоторых крупных мусульманских паломничеств. Фаговая терапия и санитарные мероприятия были главными средствами в его арсенале борьбы с крупными вспышками инфекционных заболеваний на Среднем Востоке и в Индии. В течение всего этого периода он продолжал публикации о своем исследовании и клинических испытаниях, оказывал помощь и давал консультации желающим изучать фаги, часто предпринимая длительные путешествия за свой счет. Одно из наиболее обширных исследований фаговой терапии, проведенное с его помощью, было Исследование Бактериофагов в 1927-1936 гг. (Summers, 1993), закончившееся тем, “что результаты, подтвержденные августейшей комиссией, кажутся убедительными” и хотя все еще остается много скептиков в отношении фаговой терапии, эти исследования заслуживают тщательного изучения.
В 1928 г. д'Эрель был приглашен в Стэнфорд, чтобы прочитать престижные лекции - Lane Lectures; его дискуссия “Бактериофаг и его клинические применения” была опубликована в виде монографии (d' Herelle and Smith, 1930). Во время поездок по стране он прочел множество лекций в медицинских институтах и обществах. Затем он отправился в Йель, чтобы занять постоянную должность на факультете, организованную при поддержке George Smith, который перевел первые две его книги на английский язык. Он продолжал проводить летний период в Париже, работая в организованной им фаговой компании, которой руководил его зять. Компания была создана в ответ на большие потребности в высококачественных фаговых препаратах; этот период особенно хорошо описан Summers (1999). В 1933 г. д'Эрель возвратился в Европу на постоянное жительство, проводя много времени в следующие два года в Тифлисе (Тбилиси), Грузия, помогая в организации Международного Института Бактериофагов.
С самого начала, одним из главных направлений практического применения фагов была идентификация бактерий путем процесса, называемого фаготипирование - идентификации штаммов микробов с помощью определения спектра чувствительности к специфическому набору фагов. Эта методика обладает преимуществом в виду высокой специфичности многих фагов в отношении их хозяев и по-прежнему широко используется во всем мире. Высокоспецифичная способность фагов уничтожать свои бактерии-хозяева может также оказать негативный коммерческое эффект: случайное заражение фагом может быть катастрофическим для различных бродильных производств, использующих микробные технологии, таких, как производство сыра и ферментативный синтез химических веществ и вызывать финансовые бедствия
Фаговая терапия испытывалась широко, были сообщения о многочисленных успехах ее при ряде заболеваний включая дизентерию, брюшной тиф и напоминающую брюшной тиф лихорадку, холеру, пиогенные инфекции и инфекции мочевых путей. Фаги непосредственно наносили на место поражения, давали внутрь либо применяли в виде аэрозолей или клизм. Их также вводили в виде инъекций внутрикожно, в сосуды, внутримышечно, интрадуоденально, внутрибрюшинно даже внутрь легких, в сонную артерию и перикард. Сильный интерес к фаговой терапии на раннем этапе нашел отражение в том, что на эту тему опубликовано около 800 статей с 1917 по 1956 г; результаты были довольно разнообразными и подробно освещены Ackerman и Dubow (1987). Многие врачи и предприниматели очень заинтересовались возможным клиническим применением фагов и перескочили к использованию, имея как слабое представление о них самих и о микробиологии, так и дефицит базовых научных знаний вообще. Таким образом, многие из этих исследований были плохо контролируемыми или вовсе анекдотичными, многие неудачи были предсказуемыми, а в описании некоторых успехов не доставало научного смысла. Часто фаги с неизвестными свойствами, в неизвестных концентрациях давались больным без специфичного бактериологического диагноза, при всём этом не было никакого упоминания о катамнезе, контроле или плацебо.
На раннем этапе работы с фагами игнорировалось многое из того, что удалось понять д'Эрель часто использовались неправильные методы приготовления, “консервирования” и хранения. В одном случае д'Эрель описал испытание 20 препаратов изготовленных различными компаниями, в ходе которого выяснилось, что ни один из них не содержал активные бактериофаги (Summers, 1999).
В другом случае препарат рекламировался как содержащий ряд различных фагов, но, как оказалось, ответственный технолог решил, что легче выращивать их в виде одной большой партии, чем отдельно. Неудивительно, что проверка продукта выявила подавление одним фагом всех остальных, и препарат фактически не был поливалентным. Так был получен фаг Т7, РНК-полимераза которого сейчас играет большую роль в биотехнологии (личное сообщение William Summers). В целом, исключая несколько исследовательских центров, контроль качества не производился. Крупные клинические исследования были редкостью, и результаты этих немногих работ были большей частью недоступны за пределами Восточной Европы.
В 1931 г. Советом по Фармации и Химии Американской Медицинской Ассоциации был подготовлен обширный обзор по фаговой терапии (Eaton and Bayne-Jones, 1931). Его целью было: “(а) представить резюме и обсуждения (1) экспериментально установленных фактов, связанных с феноменом бактериофагов, (2) лабораторных и клинических данных "за" и "против" терапевтической применимости бактериофагов и (3) выявить имеет ли отношение так называемый антивирус к материалам, содержащим бактериофаги и (б) служить основой для изучения свойств некоторых коммерческих препаратов”. Этот отчет, имевший 150 ссылок, был крупнейшей попыткой обзора, по крайней мере, тех статей и обзоров, которые рассматривались как наиболее значимые. Оценивая этот отчет, важно понять, насколько мало было известно тогда о бактериофагах. Фактически первым заключением было: “Экспериментальные исследования литического агента, названного “бактериофагом”, не раскрыли его природы. Теория д'Эрель о том, что этот материал является живым вирусом, паразитирующим в бактериях, не доказана. Напротив, факты указывают на то, что этот материал неживой, возможно является ферментом”. В ретроспективе доказательство того, что фаги являются вирусами, выглядит веско, и трудно понять‚ как можно было придти к такому заключению, явно повлиявшему на все остальные. Они включали в себя следующее:
1) Поскольку окончательно не показано, что бактериофаг является живым организмом, не обосновано объяснять его действия на культуры бактерий или его возможное терапевтическое действие свойствами живого вещества. 2) В то время как в [бактериальной] культуре бактериофаг растворяет чувствительные бактерии и вызывает многочисленные модификации микроорганизмов, его литическое действие в организме ингибируется или сильно затрудняется кровью и другими жидкостями тела. 3) Материал, называемый бактериофагом, обычно является фильтратом лизированных микроорганизмов, содержащим, в дополнение к литическому началу, антигенные бактериальные вещества, продукты бактериального роста и составляющие культуральной среды. Эффект всех этих компонентов необходимо принимать во внимание всякий раз, когда испытывается терапевтическое действие. 4) Обзор литературы об использовании бактериофагов в лечении инфекций выявил, что обоснование терапевтической значимости литических фильтратов является большей частью спорным. Только при лечении местных стрептококковых инфекций и, возможно, цистита, представлены вполне убедительные данные”.
Эта оценка явно оказала сильное влияние на инвестирование серьезных исследований фаговой терапии медицинской общественностью, по крайней мере, в Соединенных Штатах. Поднятые вопросы, по-прежнему требуют рассмотрения, как, в отношений многих описанных здесь исследований на животных или на людей, которые, казалось, были малоуспешными или безуспешными, так и в отношении таких возможно неправильных объяснений успехов, как сильная стимуляция естественных иммунных механизмов продуктами распада бактерий, содержащимися в используемых лизатах. Далее в 40-х гг. стали широкодоступны новые “чудесные” антибиотики, такие как пенициллин, и Западный мир большей частью отказался от фаговой терапии.
Специфическе проблемы ранних работ по фаговой терапии
Сегодня многие полагают, что в первой половине этого века была показана неэффективность фаговой терапии. При этом получилось так, что она просто не исследована в полной мере и должным образом, так что иная ее оценка вполне оправдана. По этому важно рассмотреть во всех деталях как возможные причины проблем раннего периода, так и вопросы касающиеся эффективности, а именно:
1) Недостаточность понимания гетерогенности и экологии как фагов, так и вовлеченных бактерий.
2) Неудача в селекции фагов, высоко вирулентных против бактерий-мишеней, до их использования у больных.
3) Использование моно фагов при инфекциях, вызываемых несколькими различными бактериями.
4) Появление резистентных штаммов бактерий. Они могут возникнуть путем селекции резистентных мутантов (это часто происходит, при использовании только одного штамма фага против конкретной бактерии) или путем лизогенизации (если используются умеренные фаги, как обсуждается ниже).
5) Неправильная классификация фагов или ошибки в отношении титра препаратов, некоторые из которых были полностью неактивны.
6) Неудача в нейтрализации низких значений желудочного рН при использовании пероральных препаратов.
7) Инактивация бактериофагов специфическими и неспецифическими факторами в жидкостях организма.
8) Высвобождение эндотоксинов вследствие массивного лизиса бактерий внутри организма (что именуется врачами реакцией Herxheimer). Это может привести к токсическому шоку и является потенциальной проблемой также и для химических антибиотиков.
9) Недостаточная готовность и надежность бактериологических лабораторий для тщательной идентификации причинных патогенов, необходимой ввиду специфичности фаговой терапии. Природа фаговНесмотря на то, что явление бактериофагии интенсивно изучается более пятидесяти лет, на природу фагов нет единой точки зрения, и этот вопрос до сих пор остается спорным. В нашей стране и за рубежом в специальной печати и на конференциях неоднократно возникали горячие дискуссии на эту тему. И это не случайно. Вопрос о происхождении фагов, как и других вирусов, имеет большое значение, так как с ним тесно связано решение многих актуальнейших задач современной биологии: происхождение жизни, возможные формы существования живого; существование живых существ, не имеющих клеточной структуры; происхождение клеточных форм жизни; развитие, изменчивость и видообразование у микроорганизмов и др.
До настоящего времени все еще существуют диаметрально противоположные точки зрения на природу вирусов, в том числе и фагов. По мнению одних ученых, фаги относятся к живым организмам; другие рассматривают их как особые вещества типа ферментов.
Важно отметить, что те исследователи, которые относят фаги к живым организмам, различно трактуют вопрос об их происхождении. Одни исследователи считают, что фаги, как и вирусы человека, животных и растений, произошли от древнейших доклеточных форм, которые в процессе эволюции приспособились к паразитированию в первичных одноклеточных организмах и в дальнейшем эволюционировали вместе со своими хозяевами. Таким путем, как думают эти ученые, возникли фаги микроорганизмов, которые по своему отношению к клетке-хозяину являются паразитами экзогенного, т.е. внешнего, происхождения. Другие же считают, что происхождение фагов связано тем или иным образом с клеткой своего теперешнего хозяина (эндогенное происхождение).
По мнению ученых, рассматривающих фаг как фермент эндогенного происхождения, фаговая частица является продуктом жизнедеятельности микробной клетки. При попадании в клетку фаги вызывают каталитически протекающие процессы образования активного фага, способного разрушать микробную клетку. А размножение фага в клетке происходит приблизительно так же, как образование активного фермента из его неактивного предшественника -- профермента.
Какая же из изложенных точек зрения на природу фага является наиболее приемлемой, исходя из современных знаний о свойствах фага и его взаимоотношений с клеткой-хозяином? Является ли фаг живым существом или это -- вещество подобное ферменту? За последние годы благодаря применению новейших современных методов исследования (электронная микроскопия, меченые атомы) знания о структуре фагов, их химическом составе, особенностях размножения значительно расширились. Фаговая частица оказалась довольно сложно организованной. Она содержит основные химические соединения, свойственные живому организму,-- нуклеиновые кислоты и белок. Подобно другим живым существам, фаги способны изменять все свои свойства. Поэтому рассматривать их как ферменты нет никаких оснований. Верно, они не обладают собственным обменом веществ. Они являются абсолютными паразитами, живущими полностью за счет клетки-хозяина.
Следовательно, фаги логично рассматривать как особые формы живых существ. При этом вопрос о происхождении фагов пока еще нельзя считать окончательно решенным.
Распространение фагов
В настоящее время найдены, фаги, лизирующие клетки микроорганизмов, принадлежащих ко всем систематическим группам, как патогенных для человека, животных и растений, так и сапрофитных (непатогенных).
До недавнего времени не было ясно, существуют ли фаги против плесневых грибов и дрожжей. В последние годы найдены фаги, активные против грибов родов пенициллов, аспергил-лов и других, а также против некоторых дрожжей. Интересно отметить, что вирус удалось выявить и у тех видов пенициллов, которые применяются в промышленности для получения пенициллина. Не выявлены вирусы, активные против простейших животных, а также истинных спирохет.
В природных условиях фаги встречаются в тех местах, где есть чувствительные к ним бактерии. Чем богаче тот или иной субстрат (почва, вода, выделения человека и животных и т. д.) микроорганизмами, тем в большем количестве в нем встречаются соответствующие фаги. Так, фаги, лизирующие клетки всех видов почвенных микроорганизмов, находятся в почвах. Особенно богаты фагами черноземы и почвы, в которые вносились органические удобрения. Фаги, активные против разных видов кишечной, дизентерийной, тифозной и паратифозной палочек, часто встречаются в содержимом кишечника человека и животных, сточных водах и загрязненных водоемах. Фаги фитопатогенных микроорганизмов успешнее всего выделяются из остатков растений, пораженных этими микробами
Итак, те субстраты, на которых развиваются определенные формы микроорганизмов, также благоприятны для существования соответствующих фагов.
Иллюстрация 1: Escherichia coli атакуемая фагами
Морфология фаговПрименение современных электронных микроскопов, а также усовершенствование методов приготовления препаратов для электронной микроскопии позволили более детально изучить тонкую структуру фагов. Оказалось, что она весьма разнообразна и у многих фагов более сложна, чем структура вирусов растений и ряда вирусов человека и животных.
Иллюстрация 2: Морфологические типы фагов
Разные фаги отличаются друг от друга не только по форме, величине и сложности своей организации, но и по химическому составу. Оказалось, что фаги, лизирующие микроорганизмы различных групп, могут быть вполне идентичными по своей морфологии. В то же время фаги, активные против одной и той же культуры, могут резко различаться по своей структуре. Так, например, среди фагов, способных лизировать разные штаммы кишечной палочки, выявлены все известные морфологические типы фагов.
Иллюстрация 3: Палочковидные, или нитевидные, фаги. Увел. X 400 000.
Частицы (или вирионы) большинства известных фагов имеют форму сперматозоида. Они состоят из головки (или капсида) и отростка. Наряду с этим есть фаги, которые состоят из одной головки, без отростка, и фаги, имеющие форму палочки (палочковидные или нитевидные фаги).
По форме частиц фаги делятся на шесть основных морфологических типов (групп): (рис.2) палочковидные или нитевидные фаги; фаги, состоящие из одной головки, без отростка; фаги, состоящие из головки, на которой имеется несколько небольших выступов; фаги, состоящие из головки и весьма короткого отростка; фаги, имеющие головку и длинный отросток, чехол которого не может сокращаться; фаги, имеющие головку и длинный отросток, чехол которого может сокращаться.
Иллюстрация 4: Фаги 2 морфологического типа, частица состоит из одной головки. Увел. X 600 000
Размеры фагов принято обозначать в милли-микрометрах (1 миллимикрометр -- миллионная часть миллиметра) или в ангстремах (10 А = 1 миллимикрометр).
Фаги первого морфологического типа -- палочковидные или нитевидные -- выявлены у кишечной, синегнойной, чудесной палочек и других бактерий. Средние размеры их: длина -- от 7000 до 8500 А, ширина -- от 50 до 80 А (рис. 3). Эти фаги отличаются от всех остальных не только большой специфичностью, но и рядом других важных свойств.
Фаги второго морфологического типа. Частица их состоит из одной головки гексагональной (шестигранной) формы на плоскости. Частицы очень мелкие, средний размер их 230--300 А в диаметре (рис. 4).
У фагов третьего морфологического типа форма и размеры головки такие же, как у фагов второго типа, но у их головок имеются обычно несколько очень коротких выступов (рис. 5). Возможно, эти выступы являются аналогами отростков.
Иллюстрация 5: Фаги третьего морфологического типа от головки отходят небольшие выступы
Иллюстрация 6: Фаг 4 морф. типа. Частица состоит из головки и короткого отростка Увел. х500 000
Фаги 2-го и 3-го морфологических типов отличаются постоянством формы и размеров, независимо от того, против каких микроорганизмов они активны. Эти фаги относятся к мелким формам.
Фаги 4-го морфологического типа. Частица состоит из головки, размеры которой варьирую от 400 до 640 А в диаметре, и очень короткого отростка (рис. 6).Длина и ширина отростка от 70 до 200 А.
Фаги пятого морфологического типа наиболее широко распространены. Головка у частиц гексагональной, формы различных размеров -- от 500 до 4250 А в диаметре. Размеры отростка: длина -- от 1700 до 5000 А, ширина -- от 70 до 120 А (рис. 7). Чехол отростка не способен сокращаться.
Фаги шестого морфологического типа также широко распространены. Головка частицы различной формы и размеров -- от 600 до 1500 А в диаметре, гексагональная. Размеры отростка: длина -- от 800 до 2890 А, ширина -- от 140 до 370 А. Важной особенностью фагов этой группы является то, что чехол, окружающий отросток, способен сокращаться, в результате чего становится видимым внутренний стержень отростка (рис.8).
Головки всех фагов состоят из внутреннего содержимого -- нуклеиновой кислоты - и окружены белковой оболочкой. Отросток фагов весьма сложен. Он обычно состоит из следующих структур: наружного чехла (или оболочки), внутреннего стержня с канальцем, базальной пластинки, оканчивающейся выступами (типа шипов) и нитевидными структурами. Чехол отростка состоит из субъединиц белковой природы, собранных в спираль. В результате этого он приобретает вид гофрированной трубки. В верхней части отростка многих фагов имеется образование, которое называется воротничком. На рисунке 9 схематически изображена тонкая структура фаговой частицы.
Химический состав фаговИзучение химического состава фагов стало возможно лишь тогда, когда были усовершенствованы методы получения в больших количествах очищенных препаратов фага. В настоящее время изучен химический состав фагов, принадлежащих к разным морфологическим типам и поражающих микроорганизмы почти всех систематических групп.
Иллюстрация 7: Разные фаги пятого морфологического типа, частица состоит из головки и длинного отростка, чехол которого не способен сокращаться. 1,2- увел. X 225 000, 3 - увел. X250 000
Основными компонентами фагов являются белки и нуклеиновые кислоты. Важно отметить, что фаги, как и другие вирусы, содержат только один тип нуклеиновой кислоты -- дезоксирибонуклеиновую (ДНК) или рибонуклеиновую (РНК). Этим свойством вирусы отличаются от микроорганизмов, содержащих в клетках оба типа нуклеиновых кислот.
Нуклеиновая кислота находится в головке. Внутри головки фагов обнаружено также небольшое количество белка (около 3%).
Таким образом, по химическому составу фаги являются нуклеопротеидами. В зависимости от типа своей нуклеиновой кислоты фаги делятся на ДНК-овые и РНК-овые. Количество белка и нуклеиновой кислоты у разных фагов разное. У некоторых фагов содержание их почти одинаковое и каждый из этих компонентов составляет около 50%. У других фагов соотношение между этими основными компонентами может быть различно.
Иллюстрация 8: Фаг шестого морфологического типа, частица состоит из головки и длинного отростка, чехол которого способен к сокращению. Увел, около 400 000.
Кроме указанных основных компонентов, фаги содержат в небольших количествах углеводы и некоторые преимущественно нейтральные жиры.
Иллюстрация 9: Схема строения фаговой частицы.
Все известные фаги второго морфологического типа РНК-овые. Среди фагов третьего морфологического типа встречаются как РНК-овые, так и ДНК-овые формы. Фаги остальных морфологических типов -- ДНК-овые.
Антигенные свойства фаговИзвестно, что при введении в организм животного подкожно или внутривенно белка, бактериальных клеток, некоторых продуктов жизнедеятельности микроорганизмов и других веществ в крови животного вырабатываются вещества, названные антителами. Вещества, способные вызывать образование антител, называются антигенами.
Антитела очень специфичны и способны вступать в реакции только с теми антигенами, которые вызвали их образование. Они или связывают соответствующие антигены, или нейтрализуют их, или осаждают, или растворяют.
Оказалось, что все фаги обладают антигенными свойствами. При введении фага в организм животного в сыворотке крови образуются специфические антитела, способные действовать только против данного фага. Такие сыворотки называются антифаговыми. Когда фаг смешивается со специфической антифаговой сывороткой, происходит инактивация фага -- фаг теряет способность вызывать лизис чувствительных к нему микробов.
Так как каждая антифаговая сыворотка специфична, ее можно успешно применять для идентификации и классификации фагов и очистки микробной культуры от фага. При помощи сыворотки удалось доказать, что белок оболочки фага отличается от белка оболочки отростка и от белка базальной пластинки и ее нитевидных образований, что говорит о сложности структуры фаговой частицы. По антигенным свойствам фаг резко отличается от чувствительных к нему микробов.
Механизм воздействия бактериофагов на бактериальную клетку Размножение фаговВзаимоотношения между фагом и чувствительной к нему клеткой очень сложны и не всегда завершаются лизисом клетки и размножением в ней фага. Одни бактериофаги весьма специфичны и способны лизировать клетки только одного какого-либо вида микроорганизмов (монофаги), другие -- клетки разных видов (полифаги). Рассмотрим такую инфекцию клетки, которая заканчивается гибелью клетки и размножением в ней фага. Такая инфекция называется продуктивной.
Важнейшей особенностью размножения фага является то, что оно может происходить только в живых клетках, находящихся в стадии роста.
В мертвых клетках, а также продуктах клеточного обмена размножение фага не происходит.. По характеру взаимодействия с микробной клеткой различают вирулентные и умеренные Б. Процесс взаимодействия вирулентного Б. с клеткой весьма сложный и состоит из следующих последовательно протекающих этапов (рис. 10): 1) адсорбция фаговой частицы на поверхности микробной клетки; 2) проникновение содержимого головки фаговой частицы (нуклеиновой кислоты) в микробную клетку; 3) внутриклеточное развитие фага, заканчивающееся образованием новых фаговых частиц; 4) лизис клетки и выход из нее новых фагов.
Время с момента инфицирования клетки фагом до лизиса клетки называется латентным или скрытым периодом. Продолжительность этого периода различна для разных типов фага, зависит от окружающей температуры, состава среды и других факторов. Латентный период фагов, специфичных для одних бактерий, 15--40 мин, для других -- 5 ч и более. У фагов актиномицетов латентный период может быть еще продолжительнее. При низкой температуре латентный период значительно увеличивается.
Иллюстрация 10: Схема размножения фага.
Иллюстрация 11: Адсорбция фага на клетке
Из всех этапов размножения фага наиболее изучен первый -- адсорбция.
Адсорбция фага на клетке -- реакция весьма специфичная. В клеточной стенке бактерий имеются особые структуры (рецепторы), к которым могут прикрепиться фаги. Адсорбируются на рецепторах только те фаги, к которым чувствительна клетка.
Фаги, имеющие отростки, прикрепляются к микробной стенке свободным концом отростка. Нитевидные фаги, а также фаги, не имеющие отростков, адсорбируются не на микробной стенке, а на нитевидных структурах, окружающих стенку, -- фимбриях. Описаны фаги, которые прикрепляются отростком к бактериальным жгутикам. У некоторых фагов процесс адсорбции может осуществляться лишь в том случае, когда в среде имеются определенные вещества -- кофакторы: аминокислоты (триптофан, тирозин и др.) или соли (кальциевые, магниевые).
На конце фагового отростка имеется особый фермент типа лизоцима. После адсорбции фага под влиянием этого фермента происходит растворение стенки микробной клетки и содержимое головки фага -- нуклеиновая кислота -- перекачивается в микробную клетку. Этим завершается второй этап процесса размножения фага.
Остальные структуры фаговой частицы -- оболочка головки, отросток и его субструктуры -- внутрь инфицированной фагом клетки не попадают. Их роль заключается в обеспечении сохранности фаговой частицы, находящейся вне клетки, и содействии проникновению фаговой нуклеиновой кислоты в клетку при инфекции.
Иллюстрация 12: Мелкие (едва видимые) негативные колонии актинофага. Увел. 6:10
У нитевидных фагов, в отличие от других видов фагов, внутрь клетки проникает весь белок или его часть. После проникновения нуклеиновой кислоты фага в клетку начинается сложный процесс внутриклеточного размножения фага. Под влиянием нуклеиновой кислоты фага резко изменяется весь обмен микробной клетки. Основные процессы, протекающие в инфицированной клетке, направлены на образование новых фаговых частиц. Инъецированная ДНК подавляет синтезирующие механизмы клетки, заставляя ее синтезировать ДНК и белки бактериофага. Из образовавшихся в разных частях клетки в разное время фаговой нуклеиновой кислоты и белка формируются новые фаговые частицы (сборка Б.). Вначале формируются отдельно головки и отростки, которые затем объединяются в зрелые фаговые частицы. К этому времени внутри клетки образуется особый литический фермент, который вызывает лизис клетки изнутри. Клетка распадается, и новые зрелые частицы фага выходят наружу.
Иллюстрация 13: Мелкие негативные колонии актинофага Увел. 8 : 9.
Количество новых фаговых частиц, образуемых одной клеткой при фаговой инфекции, называют выходом фага или его урожайностью. Выход фага зависит от свойств данного фага и не зависит от клетки-хозяина и ее размеров. Одни фаги отличаются очень низким выходом (5--50 частиц на клетку), у других выход значительно выше (от 1000 до 2500). Особенно высоким выходом отличаются мелкие РНК-овые фаги (свыше 20 000 частиц на клетку). Если большое количество бактериальных клеток смешать с небольшим количеством фаговых частиц, то процесс размножения фагов проходит несколько циклов. В начале инфицируется часть клеток. Первое потомство фага инфицирует оставшиеся клетки -- происходит второй цикл, за ним может следовать третий и т.д., пока не будут лизированы все чувствительные к данному фагу клетки. Среди фагов встречаются такие, размножение которых возможно лишь при наличии в среде определенных кофакторов. Одни из этих веществ, как уже указывалось, необходимы для адсорбции фага; другие -- для внутриклеточного размножения фага.
Иллюстрация 14: Негативные колонии бактериофага средней величины. Увел. 1:1
Является ли процесс размножения фага всегда смертельным для инфицированной им клетки? Несомненно, абсолютное большинство фагов вызывают при размножении лизис клетки и ее гибель. Лишь в последнее время было установлено, что при инфицировании клетки нитевидными фагами возможно размножение их без гибели клетки.
Если произвести рассев по поверхности агаризованной питательной среды в чашках Петри смеси фага и чувствительных к нему микробов и чашки выдержать в термостате, то происходит лизис клеток в результате размножения фага. Если взять большое количество частиц фага, то лизируется большая часть или весь выросший газон культуры. Если количество фаговых частиц таково, что они распределяются только на отдельных участках газона, лизируя в этих местах культуру, то возникает колония фага.
Эти колонии фага получили название бляшек, стерильных пятен. Правильнее их называть негативными колониями. Каждая негативная колония состоит из десятков и сотен миллионов фаговых частиц. Размер негативных колоний и их форма зависят в первую очередь от свойств фага, а также от состава среды и культуры микробов. У одних фагов негативные колонии очень мелкие и еле видимы невооруженным глазом, другие достигают 10 мм в диаметре и более. Колонии бывают светлые и четкие, когда лизировалась вся культура, или мутноватые, когда лизировались не все клетки. Вокруг негативных колоний некоторых фагов могут возникнуть различной формы и величины ореолы. На рисунках 12-- 16 показаны негативные колонии разных фагов.
Морфология негативных колоний служит одним из признаков, которым пользуются при дифференциации фагов.
Иллюстрация 15: Крупные негативные колонии актинофага. Увел. 1:1.
Иллюстрация 16: Негативные колонии актинофага, окруженные ореолом угнетенного роста тест-культуры. Увел. 10:8.
Лизогения и её биологическое значение
При изучении явления бактериофагии исследователи обратили внимание на то, что иногда встречаются культуры микроорганизмов, которые содержат фаги, хотя на эти культуры фагами и не воздействовали. Явление фагоносительства получило название лизогении.
Оно было описано одним из основоположников учения о бактериофагах -- Д'Эреллем, который считал, что такие культуры загрязняются фагом извне. Подобные культуры были названы ложнолизогенными.
Ложнолизогенные культуры состоят из смеси устойчивых и чувствительных к определенному фагу клеток.
Такие культуры могут быть легко освобождены от содержащихся в них фагов или путем нескольких рассевов, или с помощью специфической антифаговой сыворотки, или воздействием антифаговыми веществами.
Кроме ложнолизогенных, встречаются такие содержащие фаги культуры, у которых лизо-генное состояние, т. е. способность выделять фаги, стойко сохраняется даже после многочисленных пересевов в среде с антифаговой сывороткой и многократных воздействий антифаговыми веществами. Такие культуры названы истиннолизогенными. Мы расскажем только об этих культурах, которые будем называть лизогенными.
Лизогенными культурами являются такие культуры, которые обладают способностью продуцировать зрелые частицы фага без воздействия на них фагом извне. Это свойство стойко передается по наследству. В лизогенной культуре фаг находится внутри клетки. Для понимания сущности лизогении особо важное значение имел вопрос: в каком состоянии фаг находится внутри лизогенной клетки?
Опыты с искусственным разрывом клеток лизогенных культур под влиянием разнообразных физических и химических факторов (ультразвука, антибиотиков, литических ферментов и т. д.) не выявили наличия в клетках зрелых частиц фага.
Важное значение для понимания истинной природы лизогении имели работы А. Львова и А. Гутмана (1950). Оригинальные опыты этих исследователей убедительно показали, что в лизогенной клетке фаг находится не в виде зрелых частиц, а в какой-то другой, неинфекционной для клетки форме. Такую форму назвали профагом. Именно умеренные фаги могут находиться в лизогенных клетках в виде профага.
Клетку можно экспериментально сделать лизогенной. Такой эксперимент помог выяснить механизмы процесса, благодаря которому клетка становится лизогенной. Оказалось, что при воздействии на клетку умеренным фагом часть популяции клеток лизируется, а другая часть становится лизогенной. При этом фаг адсорбируется клеткой и его нуклеиновая кислота проникает внутрь клетки. При этом, в отличие от продуктивной инфекции, вызываемой вирулентным фагом, при лизогенизадии нуклеиновая кислота фага связывается с ядерным аппаратом клетки (хромосомой) и остается в ней в виде профага.
Вопросы локализации профага в клетке и формы его связи с клеткой являются важнейшими проблемами лизогении. По данным ряда исследователей, каждый профаг занимает определенное место на хромосоме лизогенной клетки. При делении клетки профаг воспроизводится со скоростью, равной скорости воспроизводства генетического материала клетки, что способствует передаче лизогенного состояния потомству.
Следовательно, в лизогенной клетке профаг ведет себя как ее нормальный компонент. При лизогенизации происходит объединение генетического материала клетки с генетическим материалом фага на молекулярном уровне. Известны пока единичные случаи, когда профаг не связан с хромосомой, а расположен на мембранах клеточной цитоплазмы.
Итак, в лизогенной клетке фаг является дополнительным генетическим фактором, который может неопределенно длительное время находиться внутри клетки и, как всякий генетический фактор, определять свойственные ему признаки.
Лизогенные культуры устойчивы (или иммунны) к тому фагу, который они содержат, а также к близкородственным ему фагам. При размножении лизогенной культуры какая-то часть клеток популяции лизируется и освобождает зрелые частицы специфичного для этой популяции умеренного фага.
Образование лизогенными культурами зрелых частиц фага получило название спонтанной индукции. Количество лизируемых клеток и количество образовавшихся зрелых частиц фага зависят от особенностей данной культуры и условий выращивания. В то же время количество клеток, освобождающих фаги, может быть резко увеличено при воздействии на лизогенную культуру некоторыми физическими и химическими факторами, получившими название индуцирующих. При индукции некоторых лизогенных культур удавалось вызывать образование зрелых частиц фага почти у всех клеток. К индуцирующим агентам относятся ультрафиолетовые (УФ), рентгеновские и гамма-излучения, перекиси, азотистый иприт и его гомологи, этиленимин, урацил, многие антибиотики. Наиболее эффективные и широко применяемые индуцирующие факторы -- УФ-лучи и антибиотик митомицин С.
Как отмечалось, важным свойством лизогенной культуры является ее устойчивость к содержащемуся в ней фагу. В связи с этим выделение и изучение умеренных фагов лизогенной культуры возможно лишь в том случае, когда имеется другая культура того же вида, которая чувствительна к умеренному фагу данной лизогенной культуры. Такие культуры получили название индикаторных. К лизогенным культурам, особенно широко распространенным в природе, сравнительно легко можно подобрать индикаторные культуры среди других разновидностей этого же вида.
В отдельных случаях умеренный фаг лизогенной культуры может спонтанно (без внешних воздействий) или под влиянием различных факторов измениться и стать вирулентным. Тогда фаг приобретает способность лизировать все клетки данной культуры. У некоторых лизогенных культур превращение умеренного фага в вирулентный происходит сравнительно легко. Имеется ряд культур, у которых экспериментально не удавалось превратить умеренный фаг в вирулентный.
Возможность возникновения вирулентных мутантов умеренных фагов имеет большое теоретическое и практическое значение. Не редки случаи, когда единственным доказательством лизогенности культуры является возникновение вирулентных мутантов ее умеренного фага.
Лизогения широко распространена среди всех систематических групп микроорганизмов. Это явление детально изучено у сальмонелл -- возбудителей брюшного тифа и паратифа, у дифтерийной палочки; все культуры этих видов патогенных бактерий оказались лизогенными. Лизогения широко распространена среди стрептококков, споровых форм бактерий, клубеньковых бактерий, актиномицетов, микобактерий и др.; она выявлена и у некоторых мицелиальных грибов (пенициллов) и дрожжей. Есть все основания утверждать, что абсолютное большинство микроорганизмов являются лизогенными. Ни про одну культуру нельзя с уверенностью сказать, что она не лизогенная.
За последнее время накапливается все больше данных о том, что многие лизогенные культуры содержат 2, 3, 4 и более умеренных фагов, т. е. являются полилизогенными. Например, многие актиномицеты, проактиномицеты, клубеньковые бактерии и некоторые спороносные бактерии содержат 4 и более фагов. Содержащиеся в полилизогенных культурах фаги часто резко различаются между собой по форме частиц, антигенным свойствам и спектру литического действия. Полилизогенные культуры можно экспериментально получить с помощью воздействия на них одновременно или последовательно различными умеренными фагами. Полученные таким способом культуры не отличаются от выделенных из природных источников.
Как уже отмечалось, профаг лизогенной культуры способен превратиться спонтанно или при индукции в зрелую полноценную фаговую частицу. При этом в ряде случаев под влиянием различных факторов у профага возникают стойкие наследуемые изменения (мутации), в результате которых он при индукции не способен превращаться в полноценную частицу. Поэтому у таких культур возникают частицы, состоящие только из головки или только из одного отростка. Возможны и другие нарушения в структуре фаговой частицы. При индукции таких культур лизогенная клетка лизируется, но образовавшиеся частицы как неполноценные не способны к размножению на индикаторной культуре.
Наиболее детально изучены дефектные фаги, у которых образуются одни лишь отростки. Такие фаги способны адсорбироваться на клетке, убить ее, но не могут размножаться. В последнее время такие дефектные фаги привлекли к себе внимание исследователей, так как было установлено, что многие описанные в литературе бактериоцины (вещества, убивающие бактерии) представляют собой дефектные фаговые частицы.
Существуют два принципиально различных типа бактериоцинов. Одни из них отличаются низким молекулярным весом, не осаждаются при центрифугировании, чувствительны к ферменту трипсину, термолабильны и в электронном микроскопе не видны. Бактериоцины другого типа обладают высоким молекулярным весом, осаждаются при центрифугировании, термостабильны и в электронном микроскопе видны в виде фагоподобных частиц или отдельных компонентов фаговой частицы (преимущественно в виде отростков).
О происхождении бактериоцинов первого типа и о возможной связи их с лизогенным состоянием культуры-продуцента никаких данных нет. В то же время многими исследователями показано, что образование бактериоцинов второго типа тесно связано с дефектной лизогенией продуцента.
Наиболее убедительное доказательство дефектной лизогении -- выявление дефектных фаговых частиц, количество которых значительно увеличивается при индукции.
Имеются все основания утверждать, что дефектная лизогения довольно широко распространена. Она выявлена у очень многих культур, например у актиномицета, продуцирующего антибиотик стрептомицин, клубеньковых бактерий, спороносных бактерий, применяемых для борьбы с вредными насекомыми. Выявлены дефектные фаговые частицы, обнаруженные у кишечной палочки и названные колицином. Кроме того, были выявлены и описаны полилизогенные культуры актиномицетов, которые одновременно содержали нормальные и дефектные фаговые частицы.
Как уже отмечалось, профаг в лизогенной культуре связан с ядерным аппаратом клетки и является дополнительным генетическим фактором. Профаг в лизогенной клетке ведет себя как ген, хотя между ними имеются принципиальные различия. За последние годы достигнуты большие успехи не только в изучении сущности лизогении, но и в выяснении роли профагов как дополнительных генетических факторов. Изменения, вызываемые профагом в лизогенной клетке, получили название лизогенных конверсии.
Лизогения, несомненно, одно из самых интересных явлений в биологии микроорганизмов, теоретическое и практическое значение которого далеко выходит за пределы микробиологии. Изучение этого явления сыграло большую роль в формировании представлений о фагах, их происхождении, о взаимоотношениях фагов с клеткой-хозяином.
Не исключено, что лизогенизация является одним из механизмов защиты микробной клетки от фаговой инфекции, выработанным клеткой в процессе длительной эволюции. Лизогенизация в известной степени биологически выгодна и клетке, и фагу. Клетка при лизогенизации становится устойчивой не только к данному фагу, но и к родственным ему фагам и, кроме того, приобретает дополнительные свойства.
Фаг же приобретает устойчивость к разнообразным внешним воздействиям и в то же время сохраняет потенциальную возможность перейти в вегетативное состояние и в состояние зрелой инфекционной частицы. Широкое распространение лизогении дает основание рассматривать это явление не как исключительное, а как нормальное на данном этапе эволюции микробов.
Изменчивость фагов и изменчивость микроорганизмов под
влиянием фагов
Фаги, как и микроорганизмы, способны изменять все свои свойства: форму и размеры негативных колоний, спектр литического действия, способность к адсорбции на микробной клетке, устойчивость к внешним воздействиям, антигенные свойства. Особенно часто наблюдаются изменения морфологии негативных колоний, спектра литического действия и превращение умеренных фагов в вирулентные.
Большие изменения могут наблюдаться в тонкой структуре фаговой частицы -- возникают дефектные частицы, лишенные головки, отростка, нитевидных образований или других субструктур.
Изменения фагов могут быть наследственными (мутации) и не наследственными (феноти-пические). Фенотипические изменения зависят от условий, в которых образуются фаговые частицы. Важное значение имеют изменения, вызываемые клеткой-хозяином, т.е. той культурой, на которой фаг размножается. Эти изменения большей частью носят фенотипический характер и касаются преимущественно формы негативных колоний, спектра литического действия и вирулентности. Под влиянием клетки-хозяина возможны и стойкие изменения типа мутаций. С помощью разных мутагенных факторов (лучистой энергии, химических агентов) могут быть получены разнообразные мутанты.
Особый интерес представляют изменения, происходящие при одновременном размножении на одной и той же культуре двух родственных по антигенным свойствам фагов. При этом в потомстве возникают частицы каждого из этих фагов и, кроме того, формы, которые приобрели свойства обоих родителей (гибридные формы).
Под влиянием фагов могут существенно изменяться все свойства микроорганизмов -- морфология клеток, строение колоний, токсичность, подвижность и т.д. Изменения, вызываемые фагом, могут быть наследственными и ненаследственными. Механизмы, приводящие к изменению клеток под влиянием фагов, различные. В отдельных случаях фаг играет лишь роль отбирающего фактора: под его влиянием лизируются все чувствительные к нему клетки данной популяции и остаются лишь те клетки, которые еще до воздействия фагом были по разным причинам устойчивы к нему.
При выращивании микроорганизмов в жидкой среде совместно с активным против них фагом обычно наблюдается следующее. Сначала среда мутнеет, а затем просветляется в результате лизиса клеток. В ряде случаев через некоторое время (разное для разных микробов и фагов) культуральная жидкость снова мутнеет. Помутнение среды происходит вследствие возобновления роста культуры. На агаризованных средах при нанесении фага на газон чувствительной к нему культуры можно наблюдать вначале лизис культуры в местах нанесения фага, а через некоторое время на лизированных участках появляется рост культуры, обычно в виде отдельных колоний (рис. 218).
Вырастающие после лизиса микроорганизмы получили название культур вторичного роста. Анализ культур вторичного роста показывает, что в одних случаях они состоят из вариантов, ставших стабильно устойчивыми к данному фагу, в других -- из нестойких форм. Культуры, ставшие устойчивыми к фагу, могут одновременно приобрести и ряд новых свойств. Этим обычно пользуются при получении фагоустойчивых культур для промышленных целей.
В последние годы были выявлены два принципиально различных механизма изменчивости клеток под влиянием фагов -- трансдукция и лизогенные конверсии.
Трансдукция (перенос)
При размножении определенных умеренных фагов на чувствительних к ним культурах фаговая частица захватывает какой-нибудь фрагмент генетического материала данной клетки. При воздействии этим же фагом на другую чувствительную к нему культуру он передает новой культуре захваченный фрагмент. Культура, от которой фаг переносит генетический материал, получила название донора (дающая), а культура, приобретающая генетический материал, -- реципиента (получающая).
При трансдукции фаг играет роль механического переносчика; лизогенизация клетки не обязательна. Один и тот же фаг может переносить разные свойства. Трансдукция происходит довольно редко: из одного и более миллионов фаговых частиц только одна способна осуществлять трансдукцию. При помощи трансдукции удавалось перенести от клеток-доноров клеткам-реципиентам различные свойства: токсичность, устойчивость к антибиотикам, способность продуцировать определенные ферменты, антигенные и другие свойства.
Лизогенные конверсии (превращения)
Как уже отмечалось, при лизогенизации клетка-хозяин приобретает устойчивость к данному фагу, а также способность продуцировать зрелые частицы этого фага. При этом этим не ограничиваются изменения, вызванные фагом при лизогенизации. Многочисленными опытами на микроорганизмах самых различных систематических групп было показано, что при лизогенизации клетка приобретает новые, точно определенные свойства, характер которых зависит от особенностей данного фага.
В отличие от трансдукции, при которой фаг выступает в роли механического переносчика генетического материала, при лизогенизации сам фаг (вернее, его нуклеиновая кислота) является тем генетическим материалом, который в виде профага придается генетическому материалу клетки. Поэтому при лизогенизации не имеет значения культура, на которой размножался данный умеренный фаг.
Наиболее детально лизогенные конверсии изучены у некоторых патогенных бактерий, преимущественно у дифтерийной палочки и сальмонелл.
Дифтерийная палочка содержит три разных фага. Оказалось, что только один из них (фаг бета) влияет на образование этой культурой токсина. При отсутствии в клетке фага бета культура не продуцирует токсина. Если нетоксичную дифтерийную культуру лизогенизировать фагом бета, то она приобретает способность образовывать токсин.
Иллюстрация 17: Появление колоний вторичного роста после лизиса актинофагом. Культура Act. oriental's продуцирует антибиотик ванкомицин
Опытами на сальмонеллах было показано, что токсичность, антигенный свойства, подвижность и другие признаки связаны с наличием в этих культурах строго определенных фагов. Среди споровых бактерий группы клостридий имеются виды, образующие ботулинический токсин, вызывающий опасные пищевые отравления. Недавно удалось выяснить, что эти культуры полилизогенные и один из содержащихся в них фагов вызывает образование токсина. Для ряда культур показано, что способность продуцировать определенные ферменты, антигенные и другие их свойства связаны с лизогенизацией определенными фагами. Была выявлена одна полилизогенная культура акти-номицета, которая содержала 4 разных фага. Из них один определял способность культуры продуцировать антибиотик. После удаления его культура теряла способность продуцировать антибиотик. При лизогенизации неактивной культуры этим фагом она вновь приобретала способность образовывать антибиотик.
К сожалению, еще у очень многих лизогенных культур микроорганизмов не установлено, какие свойства их связаны с фагами. Выяснение этого вопроса -- одна из важнейших задач микробиологов и генетиков.
Практическое использование фагов
Первыми были выделены фаги, активные против патогенных микроорганизмов (дизентерийной палочки). Вполне естественно, что у исследователей многих стран возник вопрос об использовании фагов для лечения и профилактики инфекционных заболеваний, вызываемых бактериями (дизентерия, брюшной тиф, паратифы, холера и др.). Многочисленные исследования в этой области были проведены и в нашей стране. Результаты этих работ весьма разноречивы. Имеются данные, показывающие несомненную эффективность фагов при лечении дизентерии и холеры. Во время Великой Отечественной войны некоторые хирурги успешно применяли фаги для борьбы с нагноением ран. «Сталинский антибиотик»-Старое лекарство из красноармейского вещмешка может вернуться во врачебную практику.
В 30-х годах туберкулез и воспаление легких стали излечимыми, а гангрена перестала непременно заканчиваться ампутацией. Но врачи и фармацевты жарко спорили о том, какое антибактериальное средство эффективнее -- антибиотики или бактериофаги.
Главным преимуществом пенициллина и его производных была возможность изготавливать их синтетическим путем. Изобретение Александра Флеминга тогда одержало победу. Массовая эйфория по поводу бактериофагов сменилась забвением.
Везде, кроме Советского Союза, где на родине Сталина, в Грузии, специальный медицинский институт продолжал соответствующие исследования. В результате родились противовоспалительные препараты, который широко использовались при самых разных диагнозах -- от заражения крови до простуды.
Больше всего их применяли в Красной Армии, но они использовались и в гражданской медицине, как в СССР, так и в некоторых странах Восточной Европы.
До недавних пор использование бактериофагов считалось местной спецификой, если не признаком отсталости. При этом роман мировой медицины с антибиотиками начал подходить к концу по мере того, как микробы стали приобретать к ним устойчивость.
Чтобы создать новый сильнодействующий антибиотик, фармацевтические компании сегодня должны в среднем потратить 10 лет и 800 млн. долларов.
Начались лихорадочные поиски принципиально новых методов лечения. Похоже, возвращение бактериофагов не за горами.
Привлекательность антибиотиков, помимо всего прочего, состоит и в том, что одно и то же лекарство способно уничтожать разные бактерии. В случае с бактериофагами надо вывести отдельный вирус для каждого инфекционного заболевания.
Правда, бактерии могут приобрести устойчивость к отдельным фагам, как они уже научились сопротивляться антибиотикам. В этом случае придется создавать новые разновидности вирусов. Скорее всего, чтобы повысить эффективность лечения, будут использоваться «коктейли» из нескольких фагов.
Лечение бактериофагами не дает побочных эффектов. Правда, известно, что в 30-е и 40-е годы оно довольно часто не давало вовсе никакого эффекта, и пациенты умирали.
--При этом современные энтузиасты «нового старого» метода терапии убеждены, что дело не в его недостатках как такового, а в несовершенстве технологий более чем полувековой давности и неправильных диагнозах.
Рассмотрим роль бактериофагов в сохранении микробиоценоза человека и теплокровных животных.
На представленной схеме можно увидеть наличие на коже, в полости рта или в кишечнике различных видов микроорганизмов и их количественное соотношение. Здесь изображен один из вариантов правильного микробиоценоза, где присутствуют все представители микроорганизмов и каждый занимает свою определенную нишу.
Самый большой сектор - это бактерии нормофлоры, которые создают с организмом взаимовыгодное сосуществование. Человек для них является средой обитания, а бактерии участвуют во многих жизненно важных для организма процессах, связанных в первую очередь с обменом веществ.
Следующий по величине сектор - медиаторы - вещества, которые выделяют сами клетки кожи и все виды микроорганизмов. Это могут быть сигнальные белковые молекулы, лизоцим, витамины, молочная кислота, другие органические кислоты и т.д. Медиаторы являются одним из самых важных звеньев в существовании микробиоценоза и регулируют многие связи в организме.
Еще пять небольших секторов занимают грибы, вирусы, бактериофаги, простейшие и болезнетворные бактерии, типа стрептококков и стафилококков. При изменении этого соотношения или при исчезновении одного из "секторов" под воздействием неблагоприятных факторов возникают воспалительные процессы.
Уже с первых минут жизни человек или животное вступает в контакт с миром микроорганизмов и сосуществует с ним всю жизнь. Это взаимодействие бывает разным: полезное, взаимовыгодное сожительство называется симбиозом. В случае, когда наносится вред одному из "контактеров" - это паразитизм. Взаимодействие с некоторыми бактериями является крайне опасным (например, с палочкой чумного микроба, хотя летальный исход может наступить и от заражения крови обыкновенным стрептококком). В то же время без присутствия лактобактерий или бифидобактерий нарушаются многие функции слизистых оболочек и возникают заболевания. Эти бактерии находятся в симбиозе с организмом, а бактерии чумы - являются паразитами. Биологический термин "паразит" означает, что один живой организм живет и размножается за счет другого. Вид, используемый в качестве "добычи", называется, хозяином. Очень часто в природе такое взаимодействие заканчивается гибелью хозяина и увеличением численности паразита. Численность паразита в свою очередь ограничивает другой вид, для которого паразит является хозяином. Таким образом, паразит - биологический ограничитель. Именно существование биологических ограничителей обеспечивает гармонию в живой природе и сохранение всех биологических видов.
Биологическими ограничителями бактерий являются бактериофаги, в свою очередь,биологическими ограничителями фагов являются медиаторы выделяемые клетками кожи ,бактериями и грибами. Так замыкается круг.
Фаги, бактерии, грибы, простейшие, даже мелкие насекомые, типа клещей, могут быть легко обнаружены и уничтожены целой системой клеток кожи, тем не менее, этого не происходит. В здоровом состоянии все находится в гармонии, "все уживаются" друг с другом, а вот при нарушении этих взаимоотношений возникают проблемы, и приходится восстанавливать утраченное.
Таким образом, исчезновение бактериофагов из этой цепочки создаст условия для размножения болезнетворных бактерий, следовательно можно рассматривать фаги как один из методов, созданных самой природой для поддержания микробиоценоза организма человека или животных.
Бактериофаги - альтернатива антибиотикам
Сравниваемые особенности | Антибиотики | Бактериофаги | |
Частота развития вторичной резистентности | От незначительной до очень высокой | Не характерно | |
Профилактическое использование | Неэффективно, противопоказано | Широко используется | |
Длительность создания нового препарата | От нескольких лет до десятилетий | От нескольких дней до нескольких месяцев | |
Сравниваемые особенности | Антибиотики | Бактериофаги | |
Концентрация в инфекционном очаге | Отличается для разных препаратов, зависит от локализации процесса, скорость снижения различна | Нарастает путем саморазмножения, снижается после ликвидации инфекции | |
Влияние на ферментные системы организма | Характерно для всех препаратов | Не описано | |
Наличие побочных эффектов и осложнений | Аллергические, токсические, конкурентные (в отношении прочих медикаментов), дизбиотичесике изменения различных органов, в том числе - тяжелые (псевдомембранозный колит, ассоциированный с Clostidium difficile)) | Не характерно. Редко - аллергические реакции. Могут вызывать реакцию высвобождения при массивном разрушении микробов. Дизбиотических нарушений не вызывают, но используются для их коррекции. | |
Рациональная комбинация с другими антибактериальными препаратами | Зависит от класса антибактериальных средств и может быть по типу суммации, потенцирования и т.д., в зависимости от точек приложения воздействия препарата на бактериальную клетку. | Всегда по типу взаимного потенцирования, по предварительным данным - вне зависимости от класса препарата. | |
Совместимость с другими медикаментами | Различная, (конкуренцией за ферментные системы, связывание с тканями, усиление токсических эффектов и пр.) | Полная, в том числе и с антибиотиками. | |
Активность в отношении патогенных микробов | Различная. Подавляюта облигатную флору организма, вызывая дисбиотические нарушения. Число чувствительных штаммов составляет 60-90%. | Число чувствительных штаммов составляет 70-90%. Не влияют на облигатную флору организма, не вызывают дизбиоз.. |
Применение препаратов бактериофагов при лечении
урологических заболеваний
Несмотря на многообразие препаратов, предлагаемых для химиотерапии бактериальных заболеваний (свыше 600 наименований, из них более 100 антибиотиков), инфекции мочевых путей до настоящего времени занимают первое место среди всех госпитальных инфекций.
Трудности лечения урологической инфекции обусловлены многими факторами. Внедрение эндоскопических вмешательств (как лечебного, так и диагностического характера) и высоких технологий в урологическую практику, кроме положительных сторон, внесло ряд проблем: открылись новые входные ворота инфекции, увеличилось количество оперируемых больных пожилого и старческого возраста с ослабленным иммунитетом. Постоянные дренажи, камни и остаточная моча служат объектами для колонизации и местами размножения госпитальной микрофлоры. Преобладание роли условно-патогенных микроорганизмов в развитии госпитальной урологической инфекции привело к снижению эффективности лечения и создало трудности в подборе лечебных препаратов, особенно для больных, страдающих хроническими воспалительными заболеваниями почек и мочевыводящих путей.
Первоначальная, природная, резистентность к старым антибиотикам не исчезает, и бактерии постепенно совершенствуют механизмы устойчивости и вырабатывают факторы защиты от новых групп антибиотиков таких, как цефалоспорины 3-го поколения или фторхинолоны. Антибиотики создают селективный фон для постепенного распространения устойчивых к ним штаммов микроорганизмов и широкого распространения в природе механизмов обмена информацией.
Антибактериальное лечение может явиться причиной развития дисбактериозов. В случае же применения антибиотиков на фоне развившегося дисбактериоза кишечного тракта антибактериальная терапия может усиливать степень его выраженности. Кроме того, антибиотики снижают колонизационную невосприимчивость кишечника, увеличивают проницаемость кишечной стенки, способствуя проникновению условно-патогенных микроорганизмов в кровяное русло, внутренние органы и развитию вторичного очага инфекции. Хорошие перспективы в качестве антибактериальной терапии имеют препараты бактериофагов.
Лечебно-профилактические бактериофаги содержат поликлональные вирулентные бактериофаги широкого диапазона действия, активные в том числе и в отношении бактерий, устойчивых к антибиотикам. Фаготерапия может успешно сочетаться с назначением антибиотиков.
В настоящее время в России выпускают препараты бактериофагов против основных возбудителей госпитальной инфекции, такие как стафилококковый, стрептококковый, клебсиелезный, протейный, синегнойный, колифаг (НПО "Иммунопрепарат", г. Уфа; предприятие по производству бактерийных препаратов, г. Нижний Новгород; МП "Биофон", г. Саратов). Препараты Б. выпускают в виде таблеток с кислотоупорной оболочкой, мазей, аэрозолей, свечей, в жидком виде. Употребляют их для орошения, смазывания раневых поверхностей, вводят перорально, иногда внутривенно и т.д. Достоинство этих препаратов заключается в строгой специфичности действия, поскольку они вызывают гибель только своего конкретного вида бактерий, не влияя в отличие от антибиотиков на нормальную микрофлору кишечника больного. Использование бактериофагов показало хорошие результаты при лечении дисбактериозов, хирургических, урогенитальных, ЛОР-инфекций.
Отечественными неонатологами показана высокая эффективность фаготерапии гнойно-септических инфекций у детей раннего возраста. Помимо литического действия на микробы отмечают их значение в механизме антитоксического, клеточного и гуморального иммунитета.
В НИИ урологии МЗМП РФ совместно с НИИ стандартизации и контроля медицинских и биологических препаратов им. Л.А. Тарасовича и НПО "Иммунопрепарат" в течение 1993-1994 гг. проведено изучение клинической эффективности препаратов бактериофагов в лечении больных с воспалительными урологическими заболеваниями.
Фаготерапию применяли в основном при лечении хронических инфекционно-воспалительных урологических заболеваний: хронического цистита, хронического пиелонефрита, хронического простатита, уретрита, нагноения ран, в ряде случаев при острых гнойно-септических состояниях больных - всего 46 человек. Для лечения использовали жидкие бактериофаги: синегнойный, протейный, колифаг, стафилококковый и комбинированный пиобактериофаг, содержащий перечисленные фаги. Применяли фаги как местно: через дренажи в мочевой пузырь (по 50 мл 1-2 раза в сутки), в рану (10-20 мл), в лоханку почки (5-7 мл), так и внутрь (суточная доза 100 мл в день за 30 минут до еды). Курс лечения - 7-10 дней.
Удовлетворительные клинические анализы были получены уже на 2-4 день лечения бактериофагами: уменьшение симптомов общей интоксикации, дизурии, снижение температуры тела, улучшение работы кишечника (особенно у детей).
Общая бактериологическая эффективность была свыше 84%, клиническая - свыше 92%. Клиническая эффективность фаготерапии почти сопоставима с активностью в контрольной группе больных, которых лечили современными антибиотиками - фторхинолонами.
Таким образом, бактериофаготерапия инфекций мочевых путей является эффективным самостоятельным видом лечения или может использоваться в комбинации с антибактериальной химиотерапией.
Являясь безвредным биологическим методом лечения, бактериофаготерапия может применяться у детей раннего возраста. Для получения положительных результатов использования бактериофагов необходимо предварительное исследование чувствительности к ним микроорганизмов. При использовании бактериофагов в крупных клиниках целесообразно включать в состав производственных штаммов, на которых готовятся коммерческие препараты, госпитальные штаммы возбудителей гнойно-воспалительных заболеваний, характерных для данного стационара. Отечественные препараты бактериофагов относительно дешевы, что имеет немаловажное экономическое значение в лечении больных с урологическими инфекциями.
В настоящее время для лечения больных сальмонеллезом и санации реконвалесцентов применяется сальмонеллезный бактериофаг групп АВСДЕ. Препарат выпускается в жидком виде для ректального введения и в виде таблеток для перорального применения. В ряде случаев эффективен жидкий стафилококковый интравенозный фаг, который используется у детей и взрослых при локализованных и генерализованных формах стафилококковой инфекции, включая стафилококковый сепсис. Препарат вводится внутривенно струйно и капельно в течение 5--10 сут. в дозе 0,5--1 мл/кг у взрослых, а у детей -- до 1,5 мл/кг в сутки. При местных гнойно-воспалительных процессах применяют в виде орошений и примочек, при энтероколитах -- внутрь, для санации носителей в носовые ходы вводят ватные тампоны, смоченные фагом, на 10 мин ежедневно в течение 5 сут.
Потенциальные преимущества фаговой терапии
l Размножаясь, они самостоятельно регулируют свою численность (увеличивая или уменьшая ее), поскольку размножаются только до тех пор, пока имеются чувствительные бактерии, а затем постепенно элиминируются из организма и окружающей среды.
l Они гораздо более специфичны, чем большинство антибиотиков; будучи нацелены на конкретные проблемные бактерии, вызывают гораздо меньшее повреждение нормального микробного баланса организма. Бактериальный дисбаланс или “дисбиоз”, вызванный лечением многими антибиотиками, может привести к серьезным вторичным инфекциям с участием достаточно резистентных бактерий, увеличивающим затраты на лечение и летальность. Специфические проблемы, возникающие в результате, включают инфекции, вызванные псевдомонадами, трудно поддающиеся лечению, и Clostridium difficile, причину серьезной диареи и псевдомембранозного колита.
l Фаги имеют возможность использовать в качестве мишеней рецепторы на бактериальной поверхности, участвующие в патогенезе, а это означает, что вирулентность любых резистентных к ним мутантов ослаблена.
l В отношении фаговой терапии описано мало побочных эффектов.
l Фаговая терапия была бы особенно применима для лиц с аллергией к антибиотикам.
l Должным образом селекционированные фаги можно легко использовать профилактически, способствуя предотвращению бактериальных заболеваний у людей или животных при контакте с микробами, либо для санации больниц и борьбы с госпитальными инфекциями.
l Фаги, особенно для наружного применения, можно изготавливать достаточно недорого и локально, способствуя их потенциальному применению населением соответствующей местности.
l Фаг можно использовать либо независимо, либо в сочетании с другими антибиотиками, с целью уменьшения вероятности развитие резистентности бактерий.
l При местном использовании фаги имеют особое преимущество в том, что они продолжают размножаться и проникать глубже до тех пор, пока присутствует инфекция, в противоположность им концентрация антибиотиков быстро снижается по мере удаления от поверхности.
Вместе с этим накопились многочисленные данные об отсутствии лечебного эффекта при применении фагов. Одна из основных причин низкой эффективности или полного отсутствия лечебного эффекта заключается в неумелом подборе фагов для лечебных целей. Одна и та же болезнь, например дизентерия, может вызываться различными видами дизентерийных бактерий. Фаги, активные против одних дизентерийных бактерий, совершенно не влияют на другие. Это не всегда учитывалось в должной мере при приготовлении фаговых препаратов для лечения определенных заболеваний.
В последние годы фаги для лечебных целей почти не применяются. Определенное влияние на отрицательное отношение к использованию фагов в лечебных целях сыграло не только непостоянство результатов, но и появление многочисленных антибиотиков, а также разных хемотерапевтических препаратов.
Профилактическое использование
Фагопрофилактика -- специфическая профилактика бактериальных инфекционных болезней в эпидемических очагах путем применения бактериофагов лицам с высоким риском заражения.
Убедительно показано, что при появлении в детских садах, яслях, школах дизентерийной инфекции использование препаратов фага предотвращает заболевание детей, имевших контакт с заболевшими. В настоящее время готовят сухие препараты фагов в виде драже.
Есть специальные коллекции типовых фагов, активных против патогенных микроорганизмов. Эти фаги помогли выяснить источники многих заболеваний. Одним из методов внутривидовой идентификации бактерий, имеющих значение для выявления эпидемической цепочки заболевания, является фаготипирование. На чашку с питательной средой, засеянную чистой культурой возбудителя, наносят по капле различные диагностические бактериофаги. Если бактерии чувствительны к данному бактериофагу, наблюдается образование бляшек. Возбудитель может быть чувствительным к одному или нескольким фагам, в последнем случае определяют его фагограмму. Спектр чувствительности возбудителя к фагам называют фаготипом, или фаговаром. Определяют фаготип выделенной из исследуемого материала культуры возбудителя при брюшном тифе, паратифе В, стафилококковой инфекции с помощью специальных диагностических наборов. При брюшном тифе используют Vi-брюшнотифозные бактериофаги, лизирующие сальмонеллы, содержащие Vi-антиген. С целью дифференциации биотипов (биоваров) холерного вибриона (cholerae и eltor) наряду с другими признаками изучают их отношение к фагам С и eltor. При помощи специфических фагов можно установить наличие определенных патогенных и непатогенных форм микробов в воде и в выделениях кишечника, а также наличие фитопатогенных бактерий внутри семян растений.
Из лизогенных культур актиномицетов выделен ряд актинофагов, которые можно использовать при классификации актиномицетов. По чувствительности культуры актиномицета к определенному фагу можно было судить, какой она продуцирует антибиотик.
В последние годы было установлено, что способностью индуцировать лизогенные культуры обладают многие вещества с противоопухолевым действием. Поэтому лизогенные культуры стали успешно применяться в поисках антираковых веществ.
Что дальше?
Ученые из Бостонского университета создали синтетические бактериофаги, которые предлагают использовать в сочетании с антибиотиками для борьбы с инфекционными бактериями. Эти бактериофаги, специально “настроенные” для атаки кишечной палочки, могут найти широкое применение в пищевой промышленности, чтобы не допустить попадания инфекции, допустим, при обработке мяса или рыбы.
Созданные учеными бактериофаги могут существенно увеличить обеззараживающие свойства антибиотиков. При одновременном применении бактериофаги и генетически модифицированные вирусы смогут убить в 30 тыс. раз больше бактерий, чем антибиотики отдельно. Один из созданных бактериофагов в ходе экспериментов продемонстрировал удивительную эффективность обеззараживания - 99,997% - против биопленок - особых скоплений бактерий, которые покрывают медицинские инструменты.
Необычный метод борьбы с опасными инфекционными заболеваниями, типа листериоза, предложили американские учёные. Метод одобрен Американским управлением по контролю над пищевыми продуктами и медикаментами (FDA).
Листериозом, в том числе -- через заражённую пищу, в США ежегодно заболевают тысячи людей, и примерно 500 из них -- гибнет. Выход предложила биотехнологическая компания Intralytix. Она придумала "коктейль" из шести вирусов, смертельных для бактерии Listeria monocytogenes.
Вирусы предложено распылять в массовом порядке на мясных продуктах, готовых к употреблению: нарезанной ветчине, хот-догах, сосисках, колбасах, а также различных продуктах из домашней птицы.
Этот специально подготовленный и очищенный коктейль прошёл все необходимые испытания -- никаких побочных эффектов и никакого видимого изменения в обработанной еде не происходило.
В большинстве фармацевтических компаний к бактериофагам относятся осторожно. Компания Novolytics , к примеру, сейчас работает над мазью для борьбы с инфекцией, известной под аббревиатурой MRSA (устойчивая к метициллину разновидность бактерии Staphylococcus aureus).
Известная с 1961 года, она почему-то распространяется в основном в больницах и вызывает воспаления дыхательных путей, мочеполовой системы, открытых ран и мест введения венозных катетеров, осложняя лечение основного заболевания. В обиходе врачи и пациенты называет ее «супержучок» (superbug). Предполагается, что мазь будет вводиться в ноздри для эффективной профилактики.
Бактериофаги -- удобная модель для расшифровки генетического кода, изучения тонкой структуры гена, молекулярных механизмов мутагенеза, влияния ионизирующего излучения и других факторов на наследственные структуры организма. Система фаг -- бактериальная клетка является идеальным объектом для изучения взаимоотношений вируса и клетки, в частности процессов онкогенеза. Бактериофаги используют в генетической инженерии, для диагностики и лечения различных инфекционных болезней.
Проблема фагии в различных производствах
За последние 30--40 лет значительно увеличилось количество производств, основанных на использовании продуктов жизнедеятельности микроорганизмов. При помощи микроорганизмов получают разнообразные антибиотики, ферменты, витамины, аминокислоты, ацетон и бутиловый спирт, молочную, уксусную, лимонную и другие кислоты, различные бактериальные препараты -- удобрения, инсектициды и многие другие.
Вследствие концентрации на указанных производствах больших масс микроорганизмов, находящихся в стадии интенсивного роста, создаются благоприятные условия для размножения соответствующих фагов, часто вызывающих лизис производственных культур. Впервые с этим явлением столкнулись в сыродельном производстве, для которого борьба с фаголизисом -- одна из актуальнейших проблем.
Микробиологические производства, которые сталкиваются с проблемой фагии, можно разбить на две группы. К первой группе относятся те производства, в которых основное применяемое сырье может содержать (и большей частью фактически содержит) фаги. Это предприятия молочной промышленности. Одно из древнейших производств -- молочное (сыроделие, получение молочнокислых продуктов и др.) -- основано на применении молочнокислых стрептококков и бактерий.
Ко второй группе производств относятся те, в которых выращивание микроорганизмов производится на питательных средах, не содержащих фагов. Это фактически все остальные микробиологические производства.
Из производств первой группы рассмотрим сыроделие как наиболее типичное и в то же время лучше изученное с точки зрения фагии.
Молочнокислые микробы очень широко распространены в природе: в почве, в навозе, на корнях, листьях и семенах растений, в кишечнике животных. Широкому распространению фагов молочнокислых бактерий способствует то, что они являются лизогенными, т. е. содержат внутри клеток фаги. В результате этого в молоке сразу же после доения уже есть фаги. Молоко, поступающее на молочные заводы, часто содержит фаги в значительном количестве (1 млн. и более частиц в 1 мл молока). Следует отметить, что все фаги, даже активные против патогенных микробов, совершенно безвредны для людей и животных.
Современное производство сыра основано на применении пастеризованного молока. При этом пастеризация не убивает всех имеющихся в молоке фагов. Охлажденное после пастеризации молоко разливают в специальные ванны, в которые вносится закваска, состоящая из чистых культур молочнокислых стрептококков. Стрептококки вызывают сквашивание молока. Получаемый сгусток молока подвергается дальнейшей переработке.
Работники сыродельных заводов давно обратили внимание на то, что в ряде случаев активность молочнокислых микробов закваски резко снижается, что приводит к плохому сбраживанию молока. Это явление может быть вызвано разными причинами. Но чаще всего оно вызывается фагами, которые лизируют полностью или частично культуры заквасок. В результате этого процесс молочнокислого брожения полностью останавливается или интенсивность его резко снижается.
На сыродельных заводах, как правило, применяют закваски, состоящие не из одной культуры, а из смеси различных культур молочнокислых стрептококков. Стрептококков очень много в природе, поэтому для производства можно отобрать культуры, отличающиеся по своей чувствительности к фагам. При применении смешанной закваски под влиянием фага лизируется одна или две культуры, другие же продолжают процесс молочнокислого брожения.
Одну и ту же закваску используют только определенное время, после чего ее заменяют другой. Длительно применять одну и ту же закваску нельзя, так как это способствует накоплению на заводе фагов, активных против культур данной закваски.
Правильный выбор культур для заквасок, смена их на основании изучения появившихся на заводе фагов дают значительный эффект. В ряде зарубежных стран на сыродельных заводах применяют закваски, содержащие только одну культуру. В этих случаях одну и ту же закваску используют лишь один раз.
Успешность борьбы с фаголизисом требует проведения и ряда других мероприятий. Особое значение имеет борьба с распространением фагов в заводских помещениях.
Значительные трудности в связи с лизисом под влиянием фагов производственных культур испытывала у нас и за рубежом антибиотическая промышленность.
Большой ущерб наносят фаги заводам ацетонобутиловым, а также изготавливающим бактериальные удобрительные препараты и препараты, применяемые для борьбы с вредными насекомыми.
Возникает вопрос: как фаги попадают на эти заводы? Есть два источника. Первый и, по-видимому, основной для антибиотической промышленности -- это сами культуры, применяемые для получения антибиотиков. Все эти культуры лизогенные и содержат внутри своих клеток умеренные фаги. Сами умеренные фаги не опасны. Но в ряде случаев они могут измениться и стать вирулентными, т.е. способными лидировать культуру хозяина. Вирулентные фаги, накапливаясь на заводах, вызывают массовый лизис производственных культур.
Другим источником попадания фагов на производства является почва, которая содержит много фагов. Вместе с пылью фаги могут заноситься в заводские помещения и заражать производственную культуру.
В борьбе с фаголизисом, в особенности при производстве антибиотиков, большое значение имело экспериментальное получение активных фагоустойчивых культур. Такие культуры сегодня успешно применяются.
Заключение
Ясно, что настало время для более внимательного рассмотрения потенциала фаготерапии, как через поддержку новых исследований, так и через тщательное изучение уже доступных данных. Фаготерапия может быть очень эффективна, и в определенных условиях имеет некоторые уникальные преимущества перед антибиотиками. Противовесом росту частоты антибиотико-резистентных бактерий и дефициту созданию новых классов антибиотиков является необходимость исследования применения фага при ряде инфекционных болезней.(Barrow и Soothill).Лечение вслепую явно не приносит пользы; фаги должны тестироваться так же, как антибиотики, показания должны быть правильными, но этого придерживаются в медицине повсюду. При этом фаготерапия требует создания банков фагов и тесного сотрудничества между клиницистом и лабораторией. Фаги имеют, по крайней мере, одно преимущество… В то время как концентрация антибиотика с момента его применения уменьшается, число фагов должно увеличиваться. Другое преимущество состоит в том, что фаги способны распространяться и, таким образом, предотвращать болезнь. Тем не менее, предстоит сделать много исследований…по стабильности терапевтических препаратов; клиренсу тканей и крови от фагов; их размножению в человеческом организме; инактивации антителами, сывороткой или гноем и выделению бактериальных токсинов при лизисе… Кроме того, терапевтические бактериофаги должны быть охарактеризованы, по крайней мере, с помощью электронной микроскопии. В то время как внедрение инъекционных форм фагов на Западе кажется преждевременным без широких дальнейших исследований, их правильное применение в некоторых сельскохозяйственных целях и для наружного использования может потенциально способствовать уменьшению появления антибиотико-резистентных штаммов. Более того, аккуратное использование соответствующих фагов, кажется оправданным в случаях, когда бактерии, устойчивые ко всем доступным антибиотикам, угрожают жизни больного. Они особенно полезны в случаях упорных госпитальных инфекций, когда большое количество особо уязвимых людей инфицируются одним и тем же штаммом бактерии в условиях закрытого стационара. (Ackermann (1987)
Существенную роль в росте популярности возможностей фаготерапии и связанных с ней возможных научных и этических дилемм (Summers, 1991), сыграл классический роман Синклера Льюиса (Sinclair Lewis) Arrowsmith, за который автор получил Нобелевскую премию по литературе. Сегодня рост научного, общественного и коммерческого интереса к фаготерапии находит отражение и стимулируется несколькими путями. Например, “ВВС” недавно выпустила документальный фильм Horizon The Virus that Cures (“Вирус, который лечит”) о фаговой терапии, основанный на Исследовательской статье Радецкого о Возвращении Хорошего Вируса. Компании начали исследовательскую работу по фаготерапии. Хочется верить, что такое внимание приведет к росту поддержки крайне необходимых в этой области исследований и быстрому прогрессу в развитии соответствующего их применения, обеспечив, по крайней мере, одну альтернативу растущей проблеме полирезистентных бактерий.
Список литературы и использованных источников
1. Стейниер P., Эдельберг Э. и Ингрэм Дж. Мир микробов, пер. с англ., т. 2, с. 165, М., 1979;
2. Стент Г. Молекулярная биология вирусов бактерий, пер. с англ., М., 1965;
3. Хейс У. Генетика бактерий и бактериофагов, пер. с англ., М., 1965;
4. Шлегель Г. Общая микробиология, пер. с нем., с. 142, М., 1987.
5. Руководство по инфекционным болезням, под ред. В.И. Покровского и К.М. Лобана, М., 1986;
6. Сепсисология с основами инфекционной патологии, под ред. В.Г. Бочоришвили, Тбилиси, 1988.
7. Справочник по применению бактерийных и вирусных препаратов, под ред. С.Г. Дзагурова и Ф.Ф. Резепова, М., 1975.
8. Бриан Л.Е. Бактериальная резистентность и чувствительность к химиопрепаратам, пер. с англ., М., 1984;
9. Ланчини Д. и Паренти Ф. Антибиотики, пер. с англ., с. 89. М., 1985;
10. Навашин С.М. и Фомина И.П. Рациональная антибиотикотерапия, с. 25, М., 1982;
11. Франклин Т. и Сноу Дж. Биохимия антимикробного действия, пер с англ., с. 197, М., 1984.
12. Козлов Ю.А. Питательные среды в медицинской микробиологии, М., 1950, библиогр.;
13. Лабораторные методы исследования в клинике, под ред. В.В. Меньшикова, с. 315, 343, М., 1987;
14. Мейнелл Дж. и Мейнелл Э. Экспериментальная микробиология, пер. с англ., с. 46, М.,1967;
15. Микробиологические методы исследования при инфекционных заболеваниях, под ред. Г.Я. Синая и О.Г. Биргера, с. 64, М., 1949;
16. Энтеробактерии, под ред. В.И. Покровского, с. 258, М., 1985.
17. Стейниер P., Эдельберг Э. и Ингрэм Дж. Мир микробов, пер. с англ., т. 2, с. 165, М., 1979;
18. Стент Г. Молекулярная биология вирусов бактерий, пер. с англ., М., 1965;
19. Хейс У. Генетика бактерий и бактериофагов, пер. с англ., М., 1965;
20. Шлегель Г. Общая микробиология, пер. с нем., с. 142, М., 1987
21. Элизабет Кюттер Фаговая терапия: бактериофаги как анибиотики (PHAGE THERAPY: BACTERIOPHAGES AS ANTIBIOTICS Elizabeth Kutter, Evergreen State College, Olympia, WA 98505 -- Nov. 15, 1997 )
22. http://www.nedug.ru/library
23. www.popularmechanics.ru
24. www.k2kapital.com
25. http://www.3planet.ru
referatwork.ru
Практическое применение фагов.Бактериофаги используют в лабораторной диагностике инфекций при внутривидовой идентификации бактерий, т. е. определении фаговара (фаготипа). Для этого применяют метод фаготипирования, основанный на строгой специфичности действия фагов: на чашку с плотной питательной средой, засеянной «газоном» чистой культурой возбудителя, наносят капли различных диагностических типоспецифических фагов. Фаговар бактерии определяется тем типом фага, который вызвал ее лизис (образование стерильного пятна, «бляшки», или «негативной колонии», фага). Методику фаготипирования используют для выявления источника и путей распространения инфекции (эпидемиологическое маркирование). Выделение бактерий одного фаговара от разных больных указывает на общий источник их заражения.
По содержанию бактериофагов в объектах окружающей среды (например, в воде) можно судить о присутствии в них соответствующих патогенных бактерий. Подобные исследования проводят … при эпидемиологическом анализе вспышек инфекционных болезней.
Фаги применяют также для лечения и профилактики ряда бактериальных инфекций. Производят брюшнотифозный, сальмонеллезный, дизентерийный, синегнойный, стафилококковый, стрептококковый фаги и комбинированные препараты (колипротейный, пиобактериофаги и др). Бактериофаги назначают по показаниям перорально, парентерально или местно в виде жидких, таблети-рованных форм, свечей или аэрозолей.
Бактериофаги широко применяют в генной инженерии и биотехнологии в качестве векторов для получения рекомбинантных ДНК.
Возбудители эшерихиозов. Таксономия и характеристика. Роль кишечной палочки в норме и патологии. Микробиологическая диагностика энтеральных эшерихиозов. Принципы лечения и профилактики.
Эшерихиозы— инфекционные болезни, возбудителем которых является Escherichia coli.
Различают энтеральные (кишечные) и парентеральные эшерихиозы. Энтеральные эшерихиозы — острые инфекционные болезни, характеризующиеся преимущественным поражением ЖКТ. Они протекают в виде вспышек, возбудителями являются диареегенные штаммы E.coli. Парентеральные эшерихиозы — болезни, вызываемые условно-патогенными штаммами E.coli — представителями нормальной микрофлоры толстой кишки. При этих болезнях возможно поражение любых органов.
Таксономическое положение. Возбудитель — кишечная палочка — основной представитель рода Escherichia, семейства Enterobacteriaceae, относящегося к отделу Gracilicutes.
Морфологические и тинкториальные свойства. E.coli — это мелкие грамотрицательные палочки с закругленными концами. В мазках они располагаются беспорядочно, не образуют спор, перитрихи. Некоторые штаммы имеют микрокапсулу, пили.
Культуральные свойства. Кишечная палочка — факультативный анаэроб, оптим. темп. для роста — 37С. E.coli не требовательна к питательным средам и хорошо растет на простых средах, давая диффузное помутнение на жидких и образуя колонии на плотных средах. Для диагностики эшерихиозов используют дифференциально-диагностические среды с лактозой — Эндо, Левина.
Ферментативная активность. E.coli обладает большим набором различных ферментов. Наиболее отличительным признаком E.coli является ее способность ферментировать лактозу.
Антигенная структура. Кишечная палочка обладает соматическим О-, жгутиковым Н и поверхностным К -антигенами. О-антиген имеет более 170 вариантов, К-антиген — более 100, Н-антиген — более 50. Строение О-антигена определяет принадлежность к серогруппе. Штаммы E.coli, имеющие присущий им набор антигенов (антигенную формулу), называются серологическими вариантами (серовары).
По антигенным, токсигенным, свойствам различают два биологических варианта E.coli:
1) условно-патогенные кишечные палочки;
2) «безусловно» патогенные, диареегенные.
Факторы патогенности. Образует эндотоксин, обладающий энтеротропным, нейротропным и пирогенным действием. Диареегенные эшерихии продуцируют экзотоксин вызывающий значительное нарушение водно-солевого обмена. Кроме того, у некоторых штаммов, как и возбудителей дизентерии, обнаруживается инвазивный фактор, способствующий проникновению бактерий внутрь клеток. Патогенность диареегенных эшерихии — в возникновении геморрагии, в нефро-токсическом действии. К факторам патогенности всех штаммов E.coli относятся пили и белки наружной мембраны, способствующие адгезии, а также микрокапсула, препятствующая фагоцитозу.
Резистентность. E.coli отличается более высокой устойчивостью к действию различных факторов внешней среды; она чувствительна к дезинфектантам, быстро погибает при кипячении.
Роль E.coli. Кишечная палочка — представитель нормальной микрофлоры толстой кишки. Она является антагонистом патогенных кишечных бактерий, гнилостных бактерий и грибов рода Candida. Кроме того, она участвует в синтезе витаминов группы В, Е и К, частично расщепляет клетчатку.
загрузка…
Штаммы, обитающие в толстой кишке и являющиеся условно-патогенными, могут попасть за пределы ЖКТ и при снижении иммунитета и их накоплении стать причиной различных неспецифических гнойно-воспалительных болезней (циститов, холециститов) — парентеральных эшерихиозов.
Эпидемиология. Источник энтеральных эшерихиозов — больные люди. Механизм заражения — фекально-оральный, пути передачи—алиментарный, контактно-бытовой.
Патогенез. Полость рта.Попадает в тонкую кишку, адсорбируется в клетках эпителия с помощью пилей и белков наружной мембраны. Бактерии размножаются, погибают, освобождая эндотоксин, который усиливает перистальтику кишечника, вызывает диарею, повышение температуры тела и другие симптомы общей интоксикации. Выделяет экзотоксин — тяжелая диарея, рвоту и значительное нарушение водно-солевого обмена.
Клиника. Инкубационный период составляет 4 дн. Болезнь начинается остро, с повышения температуры тела, болей в животе, поноса, рвоты. Отмечаются нарушение сна и аппетита, головная боль. При геморрагической форме в кале обнаруживают кровь.
Иммунитет. После перенесенной болезни иммунитет непрочный и непродолжительный.
Микробиологическая диагностика. Основной метод — бактериологический. Определяют вид чистой культуры (грамотрицательные палочки, оксидазоотрицательные, ферментирующие глюкозу и лактозу до кислоты и газа, образующие индол, не образующие сероводород) и принадлежность к серогруппе, что позволяет, отличить условно-патогенные кишечные палочки от диареегенных. Внутривидовая идентификация, имеющая эпидемиологическое значение, заключается в определении серовара с помощью диагностических адсорбированных иммунных сывороток.
83. Структура и функции иммунной системы.
refac.ru