|
|
|
|
 Far Far |
 WinNavigator WinNavigator |
 Frigate Frigate |
 Norton
Commander Norton
Commander |
 WinNC WinNC |
 Dos
Navigator Dos
Navigator |
 Servant
Salamander Servant
Salamander |
 Turbo
Browser Turbo
Browser |
|
|
 Winamp,
Skins, Plugins Winamp,
Skins, Plugins |
 Необходимые
Утилиты Необходимые
Утилиты |
 Текстовые
редакторы Текстовые
редакторы |
 Юмор Юмор |
|
|
|
File managers and best utilites |
Доклад: Карбоновые кислоты - свойства, получение и производные. Карбоновые кислоты реферат
Реферат - Карбоновые кислоты и их производные
РЕФЕРАТ
Карбоновые кислоты и их производные
Карбоновыми кислотами называют органические соединения, содержащие в своем составе карбоксильную группу. По международной заместительной номенклатуре карбоновым кислотам соответствует окончание -овая кислота в названии.
 |
кислот (см. тему «Жиры»), приняты тривиальные названия (уксусная, стеариновая).
По числу карбоксильных групп делятся на монокарбоновые (одноосновные) и дикарбоновые (двухосновные), в зависимости от строения углеводородного скелета — на алифатические (уксусная, щавелевая) и ароматические (бензойная).
Предельные одноосновные карбоновые кислоты, содержащие от одного до одиннадцати атомов углерода — жидкости, хорошо смешивающиеся с водой. В твердом и жидком состояниях, а также в водных растворах молекулы кислот димеризуются в результате образования между ними водородных связей.
Одноосновные карбоновые кислоты
Общие способы получения
 |
 |
Оксосинтез (см. тему «Химические свойства алкенов»).
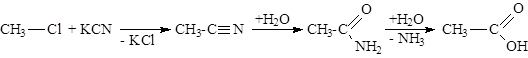 |
 |
Гидролиз сложных эфиров — см. тему «Химические свойства одноатомных спиртов».
Химические свойства
Взаимное влияние составляющих карбоксильную группу карбонила и гидроксила с одной стороны уменьшает поляризацию связей С=O карбонила, с другой стороны ослабляет связь О-Н гидроксила, что приводит к отсутствию реакций нуклеофильного присоединения AN и увеличению подвижности водорода гидроксила (кислотные свойства).
Кислотные свойства.
 Карбоновые кислоты — слабые кислоты. С увеличением углеводородного радикала степень диссоциации уменьшается. Предельные монокарбоновые кислбты обладают всеми свойствами обычных кислот:
Карбоновые кислоты — слабые кислоты. С увеличением углеводородного радикала степень диссоциации уменьшается. Предельные монокарбоновые кислбты обладают всеми свойствами обычных кислот:
a) 2RCOOH + Mg ¾® (RCOO)2Mg + Н2;
б) 2RCOOH + СаО ¾® (RCOO)2Ca + Н2О ;
в) RCOOH + КОН ¾® RCOOK + Н2О;
г) 2RCOOH + Na2CO3 ¾® 2RCOONa + СO2 + Н2О.
 |
 |
 |
 |
 |
Непредельные карбоновые кислоты
Способы получения
 |
 |
Нитрильный синтез:
 |
 |
 |
Двухосновные кислоты
Химические свойства
 |
 |
Двухосновные непредельные кислоты
 |
 |
 |
Способы получения
 |
Нитрильный синтез:
 |
Химические свойства
 |
 |
 |
Оптическая изомерия гидроксикислот
 Зеркальные изомеры называются оптическими антиподами (энантиомерами). Они вращают плоскость поляризации в разные стороны. Стереоизомеры, не являющиеся антиподами, называются диастереомерами. Общее количество оптических изомеров N вычисляется по формуле: N = 2 n, где n – количество асимметрических атомов углерода в молекуле.
Зеркальные изомеры называются оптическими антиподами (энантиомерами). Они вращают плоскость поляризации в разные стороны. Стереоизомеры, не являющиеся антиподами, называются диастереомерами. Общее количество оптических изомеров N вычисляется по формуле: N = 2 n, где n – количество асимметрических атомов углерода в молекуле.
Для идентификации оптических изомеров гидроксилслдержащих веществ применяют D-L-номенклатуру. Оптические изомеры винной кислоты представлены на рисунке.
 |
Композиция, состоящая из равных количеств энантиомеров, называется рацематом.
Альдегидо- и кетокислоты
Способы получения
 |
 |
 |
 |
Химические свойства
 |
Кето-енольная таутомерия ацетоуксусного эфира.
 |
Сложные эфиры
 Сложные эфиры — производные органических или кислородсодержащих неорганических кислот, у которых атом водорода замещен на углеводородный радикал. Названия образуются из названий кислот (кислотных остатков) и названий алкильных радикалов, входящих в состав спиртов.
Сложные эфиры — производные органических или кислородсодержащих неорганических кислот, у которых атом водорода замещен на углеводородный радикал. Названия образуются из названий кислот (кислотных остатков) и названий алкильных радикалов, входящих в состав спиртов.
 |
Способы получения
Реакция этерификации (см. тему «Химические свойства одноосновных карбоновых кислот»).
 |
Изоамилацетат – запах груши.
 |
Этилформиат – запах рома.
 |
Этилбутират – запах ананаса.
Химические свойства
 |
 |
 |
Жиры
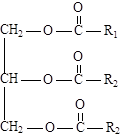 Жиры (триглицериды) — сложные эфиры глицерина и высших карбоновых (жирных) кислот. Наиболее часто в состав жиров входят предельные (пальмитиновая С15Н31СООН, стеариновая С17Н35СООН) и непредельные кислоты (олеиновая С17Н33СООН, линолевая С17Н31СООН, линоленовая С17Н29СООН). Природные жиры представляют собой смесь различных триглицеридов.
Жиры (триглицериды) — сложные эфиры глицерина и высших карбоновых (жирных) кислот. Наиболее часто в состав жиров входят предельные (пальмитиновая С15Н31СООН, стеариновая С17Н35СООН) и непредельные кислоты (олеиновая С17Н33СООН, линолевая С17Н31СООН, линоленовая С17Н29СООН). Природные жиры представляют собой смесь различных триглицеридов.
Жиры — вязкие жидкости или твердые вещества, легче воды, в воде не растворяются, но растворяются в органических растворителях.
Жиры, образованные предельными кислотами — твердые вещества, а непредельными — жидкие (они называются маслами). Чем больше в жирах содержание непредельных кислот, тем ниже их температура плавления.
Получение
 |
Реакция этерификации глицерина:
Химические свойства
I) Гидролиз (омыление).
В зависимости от условий гидролиз бывает: водный (без катализатора, при высоких температуре и давлении), кислотный (в присутствии кислоты в качестве катализатора), щелочной (под действием щелочей) и ферментативный (в живых организмах).
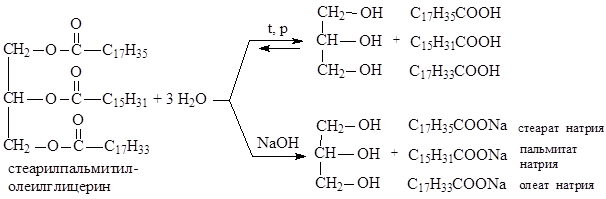 Мылами называют соли высших жирных кислот. Натриевые соли образуют твердые мыла, калиевые — жидкие.
Мылами называют соли высших жирных кислот. Натриевые соли образуют твердые мыла, калиевые — жидкие.
Реакции присоединения: гидрирование или гидрогенизация — получение твердых жиров из жидких. Характерна для жидких жиров, содержащих кратные связи.
 |
www.ronl.ru
Реферат: "Карбоновые кислоты"
Выдержка из работы
МГЭУ им. А.Д. Сахарова
Реферат
на тему: Карбоновые кислоты
Минск, 2008 г.
Содержание
1. Карбоновые кислоты
2. Предельные одноосновные карбоновые кислоты
3. Способы получения
4. Физические и химические свойства
5. Непредельные карбоновые кислоты
6. Химические свойства
Список литературы
Карбоновые кислоты
Функциональная группа карбоновых кислот слагается из двух составляющих — карбонильной и гидроксильной, формирующих качественно новую функцию — карбоксильную:
В зависимости от радикала, связанного с карбоксильной группой, кислоты могут быть как предельными и непредельными, относиться ациклическому, циклическому, ароматическому или гетероциклическому ряду.
Число карбоксильных групп в молекуле определяет основность кислоты. Различают кислоты одноосновные, двухосновные, многоосновные. Карбоновые кислоты могут включать и другие функциональные группы: --ОН (оксикислоты),--Nh3 (аминокислоты) и т. д.
Значение карбоновых кислот в химии не исчерпывается способностью служить донорами протона, т. е. действовать в качестве кислоты. Карбоновые кислоты образуют разнообразные производные (сложные эфиры, ангидриды, амиды и др.), которые участвуют во многих реакциях.
Общая формула производных карбоновых кислот:
где ацильный радикал может быть связан с остатками (Z) спирта, аммиака, карбоновой кислоты и других соединение, образуя соответствующие производные:
химический карбоновый кислота катализатор
Таблица
Производное карбоновой кислоты | Остаток Z | ||||
OR | Hal | Nh3 | |||
Соединение | Сложный эфир | Галогенандрид | Амид | Ангидрид | |
Формула | 2 | ||||
В карбоновых кислотах следует различать кислотный радикал и кислотный остаток:
Кислотные радикалы | Кислотные остатки | |
Ацил… | Ацилат… | |
Формил (метаноил) | Формиат (метаноат) … | |
Предельные одноосновные карбоновые кислоты
Изомерия, номенклатура
Общая формула одноосновных карбоновых кислот предельного ряда:
Сnh3n+1COOH, или Сnh3nO2.
Простейшая карбоновая кислота — муравьиная, не содержит радикала.
Тривиальные названия карбоновых кислот часто указывают на источник их обнаружения или выделения.
Систематическое название карбоновой кислоты строится обычным образом6 за основу выбирают самую длинную цепь, содержащую карбоксильную группу, и к названию соответствующего углеводорода добавляют окончание -овая и слово кислота. Карбоксильный углерод получает первый номер.
Формула | Номенклатура | ||
тривиальная | систематическая | ||
H-COOH | Муравьиная кислота | Метановая кислота | |
Ch4-COOH | Уксусная | Этановая | |
Ch4Ch3-COOH | Пропионовая | Пропановая | |
Ch4Ch3Ch3-COOH | Масляная | Бутановая | |
Ch4(Ch3)3-COOH | Валериановая | Пентановая | |
Ch4(Ch3)4-COOH | Капроновая | Гексановая | |
Ch4(Ch3)14-COOH | Пальмитиновая | Гексадекановая | |
Ch4(Ch3)16-COOH | стеариновая | Октадекановая | |
В рациональной номенклатуре атомы цепи обозначают буквами греческого алфавита (б, в, г и т. д.), начиная с ближайшего к карбоксильному углероду атома цепи:
5 4 3 2 1
C-C-C-C-COOH
Д в д б
В рациональной номенклатуре простейшие карбоновые кислоты называют как замещённые уксусной кислоты. Общеприняты названия изомасляной кислоты — диметилуксусная, 2,2-диметилпропановой — триметилуксусной и т. д.
Структурная изомерия в ряду предельных карбоновых кислот представлена лишь изомерией цепи:
Ch4Ch3Ch3-COOH (масляная кислота — этилуксусная, бутановая)
Ch4-CH-COOH (изомасляная кислота — диметилуксусная,
СН3 2- метилпропановая)
Способы получения
Ранее можно было убедится в том, что карбоновые кислоты получаются при окислении различных углеводородов и их кислородсодержащих производных. Так, алканы под воздействием кислорода воздуха в присутствии марганцевых катализаторов при средних температурах 140−160 °С образуют смесь карбоновых кислот с различной длиной цепи, так как реакция сопровождается крекингом алкана.
Алкены и алканы под действием энергичных окислителей (перманганат калия в кислой среде, хромовая смесь) претерпевают разрыв по кратной связи и превращаются в карбоновые кислоты, если у алкенов при двойной связи отсутствует разветвление.
Первичные спирты и альдегиды достаточно легко окисляются до карбоновых кислот без изменения размера и строения цепи.
Раньше для получения карбоновых кислот достаточно широко применяли гидролиз сложных эфиров (в частности природных жиров):
Известен ряд способов, использующих галогеналканы в качестве исходных веществ в синтезе карбоновых кислот. При этом происходит наращивание углеводородной цепи на один углеродный атом.
Физические свойства
Низшие предельные одноосновные карбоновые кислоты — подвижные жидкости с резким, острым запахом, хорошо растворимые в воде, а также в менее полярных органических растворителях (эфире, спирте, бензоле и др.). Кислоты С4-С9 — маслянистые жидкости с довольно неприятным запахом. Твёрдые высшие карбоновые кислоты почти не пахнут и нерастворимы в воде.
Карбоновые кислоты имеют температуры кипения ещё более высокие, чем спирты с тем же числом углеродных атомов. Это обусловлено как более высокой молекулярной массой, так и водородными связями.
В случае простейших кислот водородные связи могут объединять молекулы попарно в довольно прочные димеры.
Энергия водородных связей составляет примерно 7 ккал/моль. В отличие от спиртов димеры кислот могут, не разрушаясь, существовать в паровой фазе.
Растворимость в воде низших карбоновых кислот также связана с возможностью образования водородных связей с молекулами воды:
Химические свойства
Кислотные свойства. Карбоновые кислоты значительно уступают по своим кислотным свойствам таким сильным неорганическим кислотам, как серная, соляная, и т. п. (ка?10-5-10-7). Из неорганических кислот лишь угольная слабее органических кислот предельного ряда и может вытесняться ими из её солей — карбонатов. Достаточно вспомнить процесс «гашения» уксусом питьевой соды, сопровождающийся выделением пузырьков газа — диоксида углерода:
Водород гидроксила у карбоновых кислот значительно подвижнее нежели в спиртах. Этому способствует эффект с, р-сопряжения, значительно увеличивающий поляризацию связи О-Н. Данный эффект в значительной степени стабилизирует образующийся после отрыва протона карбоксилат-ион, в котором сопряжение обеспечивает эффективную делокализацию отрицательного заряда по обоим кислородным атомам. Из предельных структур аниона и его мезоформулы видно, что электронная плотность распределена равномерно по связям С — О (длина обеих связей одинакова и составила 0,124 нм.)
Устойчивость карбоксилат-иона облегчает его образование:
Предельные структуры карбоксилат-иона Мезоформула
Поэтому карбоновые кислоты в отличие от одноатомных спиртов способны образовывать соли не только при взаимодействии с достаточно активными металлами, ни и с гидроксидами, и с оксидами металлов. Так, не только щелочные металлы, но и цинк или магний могут вытеснять водород из уксусной кислоты. Хорошо реакции идут с MgO и NaOH:
Уксусная кислота Ацетат цинка
Ацетат магния
Ацетат натрия
Поскольку карбоновые кислоты слабее неорганических, их соли частично гидролизируются в водных растворах:
СН3(СН2)16СОО-Na+ + HOH — СН3(СН2)16СООH + NaOH
Стеарат натрия (мыло) Стеариновая кислота
Этим объясняется, в частности, щелочная реакция мыльного раствора.
Разные карбоновые кислоты отличаются своими кислотными свойствами благодаря индуктивному влиянию радикала, связанного с карбоксильной группой. Это влияние изменяет величину частичного положительного заряда на карбоксильном углероде. Заместитель, увеличивающий заряд на атоме углерода карбоксильной группы (электроноакцептор), будет способствовать увеличению кислотных свойств, так как увеличение заряда приводит к усилению эффекта сопряжения и поляризации связи О — Н. Напротив, электронодонорный заместитель, уменьшающий величину д+ на карбоксильном углероде, противодействует мезомерному эффекту p, р-сопряжения и понижает кислотные свойства.
В гомологическом ряду карбоновых кислот кислотные свойства уменьшаются от муравьиной кислоты к высшим карбоновым кислотам. Положительный индукционный эффект радикала тем больше, чем длиннее цепь, или чем более она разветвлена. В молекуле карбоновой кислоты такой радикал частично гасит д+ на атоме углерода карбоксильной группы в соответствии с силой своего влияния. Это уменьшает поляризацию связи О — Н из-за снижения эффекта сопряжения и, как результат, понижает кислотные свойства.
Реакции замещения группы -ОН (разрыв связи С — О). Ещё одно важное свойство карбоновых кислот состоит в способности к замещению гидроксила карбоксильной группы под действием реагентов нуклеофильного характера. Нуклеофильные реагенты способны атаковать молекулу карбоновой кислоты по электронодефицитному карбоксильному атому углерода, несущему частичный положительный заряд, и в этом взаимодействии они способствуют разрыву связи С — ОН с образованием производных карбоновых кислот с общей формулой
(Z- остаток нуклеофила).
В этих реакциях карбоновые кислоты взаимодействуют подобно карбонильным взаимодействиям. Однако в отличие от последних кислоты образуют продукты не присоединения, а замещения.
Общая схема механизма SN в присутствии катализатора (Н+):
В присутствии сильной минеральной кислоты слабая органическая кислота ведет себя как основание и пронируется. При этом положительный заряд на карбоксильном углероде увеличивается, и взаимодействие с нуклеофильном облегчается. Таким образом, роль кислотного катализатора состоит в усилении электрофильности карбоновой кислоты.
Реакция нуклеофильного замещения в ряду производных карбоновых кислот. Для производных карбоновых кислот характерны те же реакции SN, что и для самих кислот. В этих реакциях остаток -Z замещается на остаток нуклеофила с образованием другого производного или самой карбоновой кислоты (гидролиз).
Общая схема механизма реакции практически не отличается от таковой в ряду самих карбоновых кислот:
Однако производные карбоновых кислот отличаются по своей реакционной способности. В реакциях SN общая закономерность состоит в том, что чем выше д+ на карбоксильном углероде, атакуемом нуклеофилом, тем быстрее идет реакция. В молекуле любого производного величину д+ определяет, как и в карбоновых кислотах, влияние окружающих групп, слагаемое из мезомерного эффекта с, р-сопряжения и отрицательного индукционного эффекта группы Z.
+ М (с, р)
Фактически реакции идут тем легче, чем сильнее выражено электронно-акцепторное действие заместителя Z (-I), так как при этом увеличивается д+ карбонильного атома углерода. Мезомерный эффект (+М) уменьшает д+ на карбонильном атоме углерода и замедляет реакции нуклеофильного характера. Реакционная способность будет зависеть от соотношения -I и +М.
Подобное сопоставление помогает понять, почему наибольшую актив-ность в реакциях SN проявляют галогенангидриды карбоновых кислот, а последнее место среди производных занимают амиды:
?
-I > +M -I > +M -I < +M
Хлорангидрид Ангидрид Кислота
?
-I < < +M +I; +M
Сложный эфир Амид Карбоксилат-ион
Практически не способен к взаимодействию с нуклеофилами карбоксилат-ион.
Нуклеофильными реагентами в реакциях производных карбоновых кислот могут служить вода (гидролиз), спирты (алкоголиз), аммиак и амины (аммонолиз), карбоновые кислоты, обычно в виде солей (ацидолиз).
В результате этих реакций в молекулу нуклеофила вводится ацильная группа поэтому их называют также реакциями ацuлирования, а производные кислот — ацилирующими агентами.
Приведем ряд примеров реакций ацилирования.
Ацuлирование спиртов (алкоголиз). Способ синтеза сложных эфиров с помощью хлорангидридов или ангидридов карбоновых кислот имеет широкое применение в органическом синтезе. Эти реакции протекают легче, чем реакции этерификации, и являются необратимыми.
Механизм реакции ацилирования спиртов хлоангидридами кислот:
Механизм ацилирования спиртов ангидридами аналогичен приведенному выше для хлорангидридов: образование на промежуточной стадии неустойчивого продукта присоединения к карбонильному атому углерода и последующая стабилизация продукта, сопровождающаяся отрывом карбоксилат-иона.
Ацuлирование аммиака (аммонолиз). С аммиаком способны взаимодей-ствовать с образованием амидов не только галогенангидриды и ангидриды кислот, но и сложные эфиры:
Гидролиз. В присутствии кислот или оснований производные карбоновых кислот подвергаются гидролизу с образованием свободных карбоновых кислот. Особенно легко гидролизуются галогенангидриды:
Внимания заслуживает гидролиз сложных эфиров. Раньше гидролиз природных жиров служил источником промышленно важных продуктов — глицерина и высших жирных кислот или их солей (мыла). Сложные эфиры подвергаются гидролизу при нагревании с кислотами или щелочами. В кислой среде реакция обратима и представляет собой реакцию, обратную этерификации. Нуклеофилом в ней выступает молекула воды.
При нагревании со щелочью сложные эфиры гидролизуются необратимо с образованием исходной карбоновой кислоты (в виде соли) и молекулы спирта:
Кислота при этом превращается в карбоксилат-анион, который не способен к присоединению нуклеофила, поэтому реакция необратима.
Реакции по б-углеродному атому. Круг этих реакций достаточно ограничен в ряду карбоновых кислот. Подобно альдегидам и кетонам карбоновые кислоты вступают в реакцию с хлором, образуя хлорзамещенные продукты:
Непредельные карбоновые кислоты
Номенклатура и изомерия
Ненасыщенные кислоты содержат кратные связи в составе радикала:
Пропеновая кислота Проионовая кислота
(акриловая) (пропаргиловая)
Рассмотрим одноосновные непредельные карбоновые кислоты этиленового ряда. Среди них особое место благодаря некоторым специфическим особенностям химического поведения занимают б, в-не насыщенные кислоты. Этим они отличаются от непредельных карбоновых кислот с двойной связью, удаленной от карбоксильной группы на одно или более метиленовых звеньев, которые проявляют классические свойства алкенов и карбоновых кислот.
Простейшей б, в -ненасыщенной монокарбоновой кислотой, содержащей двойную связь, является акриловая кислота.
Номенклатура и физико-химические свойства ненасыщенных карбоновых кислот
Формула | Номенклатура | Т плав | Т кип | ||
тривиальная | систематическая | ||||
Сh3=CH-COOH | Акриловая | Пропеновая | 12 | 142 | |
Сh3=C-COOH Ch4 | Метакриловая, б-метилакриловая | 2-Метилпропеновая | 16 | 162 | |
Кротоновая | транс-2-Буте новая | 72 | 185 | ||
Изокротоновая | цис-2- Бутеновая | 16 | 169 | ||
Винилуксусная | 3 — Бутеновая | 39 | 71 | ||
Ее гомологи (кротоновая и метакриловая кислоты) также относятся к этой группе. Винилуксусная кислота — структурный изомер кротоновой кислоты по положению двойной связи — представляет собой уже в, г-ненасыщенную кислоту с изолированной двойной связью. Структурные изомеры в ряду ненасыщенных карбоновых кислот могут также отличаться строением цепи (кроновая и метакриловая кислоты).
Как и в ряду алкенов, ненасыщенные карбоновые кислоты могут образовывать цис-, транс- изомеры. Так, кротоновая кислота — это транс-изомер 2-бутеновой кислоты, цuс-изомер называют изокротоновой кислотой.
Изокротоновая кислота Кротоновая кислота
В природе в составе липидов широко распространены высшие ненасыщенные одноосновные кислоты С16— С20, включающие одну и более двойных связей:
СН3(СН2)7СН=СН (СН2)7СООН (С17Н33СООН)
Олеиновая (9- октадеценовая)
СН3(СН2)4СН=СН-СН2-СН=СН (СН2)7СООН (С17Н31СООН)
Линолевая (9,12-октадекадиеновая)
СН3(СН2-СН=Сн)3(СН2)7СООН (С17Н33СООН)
Линоленовая (9,12,15-октадекатриеновая)
Более 30% карбоновых кислот в липидном составе биологических мембран включают непредельные кислоты С20-С22. В живых организмах высшие ненасыщенные карбоновые слоты существуют исключительно в виде цuс-изомеров. Так, жидкая олеиновая кислота представляет собой цисизомер и широко распространена вопреки энергетически более устойчивому трансизомеру — элаидиновой кислоте.
Способы получения непредельных карбоновых кислот по большей части основаны на уже известных методах введения в молекулу карбоксильной группы или образования двойной связи в карбоновой кислоте. Так, можно получать соединения этого типа дегидрогалогенированием б-галогенокислот или дегидратацией оксикислот, а также оксинитрилов с последующим гидролизом нитрила до карбоновой кислоты и т. п.
Химические свойства
Ненасыщенные кислоты содержат кратную связь и карбоксильную группу, поэтому в ряду этих соединений сохраняются все свойства, как карбоновых кислот, так и непредельных соединений, а также проявляется специфика, вызванная присутствием обеих функций в одной молекуле и их взаимным влиянием.
Кислотные свойства
У ненасыщенных карбоновых кислот кислотные свойства несколько повышены по сравнению с насыщенными. Особенно это касается б, в-ненасыщенных кислот.
Причина повышения кислотных свойств ненасыщенных кислот состоит в присутствии слабого отрицательного индукционного эффекта ненасыщенного радикала. Этот эффект связан с повышенной электроотрицательностью атомов углерода кратных связей, которые находятся в состоянии Sp2— или sp- гибридизации. В связи с этим возникает момент отрицательного индуктивного влияния, приводящий к увеличению частичного положительного заряда на карбоксильном атоме углерода. Это, в свою очередь, усиливает мезомерный эффект p, р-сопряжения в карбоксильной группе, увеличивает полярность связи О-Н и облегчает отщепление протона.
Sp2Sp2
-ICH=CH- +IR IH=0
Ka*10-5. 56
То, что повышение кислотных свойств не насыщенных кислот — результат индуктивного влияния, показывает быстрое уменьшение констант ионизации по мере удаления винильного радикала от карбоксильной группы (индукционный эффект быстро затухает по цепи простых связей). Уже на расстоянии в два метиленовых звена кислотные свойства оказываются близки к таковым уксусной кислоты (значение Ка для 4-пентеновой кислоты близко к уксусной — 2,11). Однако тот факт, что непредельная акриловая кислота оказывается заметно слабее муравьиной кислоты, показывает, что это влияние неабсолютное. Повышенная Э О атома углерода в состоянии Sp2-гибридизации, очевидно, лишь уменьшает общеизвестные электроно-донорные свойства углеводородных радикалов:
R-CH=CH-COOH
-Iвинил
+Iалкильный радикал
Непредельные карбоновые кислоты, подобно насыщенным, способны образовывать различные производные (галогенангидриды, ангидриды, амиды, сложные эфиры) в реакциях нуклеофильного замещения или другими непрямыми методами синтеза. Среди производных заслуживают внимания сложные эфиры б, в-ненасыщенных кислот, которые служат мономерами в реакциях полимеризации. В частности, метиловый спирт метакриловой кислоты (метилметакрилат) полимеризуется, образуя плексиглас. Этот полимерный продукт широко применяется в консервировании биопрепаратов, изготовлении покрытий, органических стекол, бытовых и промышленных изделий.
Реакции ненасыщенных кислот как непредельных соединений.
Подобно соединениям этиленового ряда, ненасыщенные кислоты склонны к реакциям присоединения, окисления и полимеризации.
Реакции присоединения. В реакциях электрофильного присоединения (присоединение галогенов, галогеноводородов, воды), реакционная способность непредельных кислот, особенно б, в-насыщенных, понижена из-за электроноакцепторноro действия карбоксильной группы (отрицательный индукционный эффект, вызванный дефицитом электронов на карбоксильном углероде). Оттягивая электронную плотность на себя, карбоксильная групп обедняет электронами двойную связь, препятствуя тем самым взаимодействию р-электронного облака с электрофильным реагентом.
Действительно, реакция бромирования, например, идет медленнее с акриловой кислотой, чем с этиленом:
Акриловая кислота б, в- Бромпропионовая кислота
При этом у б, в-ненасыщенных кислот карбоксильная групп влияет на направление присоединения. Общая тенденция в реакциях присоединения такова, что в случаях взаимодействия с несимметричным реагентом водород присоединяется к б-углероду, а другой остаток реагента — к в-углеродному атому. Другими словами, присоединение галогеноводородов, воды и некоторых других соединений протекает против правила Марковникова.
в- Бромпропионовая кислота
Н2 SO4, 100 С
в- Оксиропионовая кислота
Причина подобного направления реакции состоит в действии эффекта р, р-сопряжения в молекулах б, вненасыщенных кислот (I). При этом электронная плотность в общем электронном облаке смещена к карбонильному кислороду. В результате протон, первым атакующий молекулу непредельной кислоты, присоединяется к карбонильному кислороду. При этом образуется резонансно-стабилизированный катион (П), в котором положительный заряд оказывается на крайнем атоме углерода. Туда на последней стадии и направляется оставшийся нуклеофил (анион). Другими словами, б, в-ненасыщенная кислота представляет собой сопряженную диеновую систему, особенностью которой, как известно, является возможность присоединения по краям сопряженной системы, и в 1,4-положении (III).
Мезоформула катиона (II)
(III)
Образующийся при таком присоединении продукт (III) неустойчив и пере-группировывается с перемещением протона к б-углеродному атому, при этом вновь образуется карбонильная группа.
б, в-Ненасыщенные кислоты в отличие от соединений с изолированной двойной связью способны присоединять водород в момент выделения. Гидрирование двойной связи при этом также является результатом 1,4-присоединения.
Реакции окисления. Они протекают аналогично алкенам. При обработке непредельной кислоты мягким окислителем — перманганатом калия в щелочной среде (реакция Вагнера) или пероксидом водорода в муравьиной кислоте — осуществляется гидроксилирование:
СН3(СН2)7СН=СН (СН2)7СООН
Олеиновая кислота
СН3 — (СН2)7 — СН — СН — (СН2)7 — СООН
| |
OH OH
9,10 — Дигидроксиоктадекановая кислота
Под действием жесткого окислителя двойная связь рвется с образованием из осколков молекулы кислот и/или кетонов:
СН3(СН2)7СН=СН (СН2)7СООН
Олеиновая кислота
СН3(СН2)7СООН + НООС (СН2)7СООН
Пеларгоновая кислотаАзелаиновая кислота
Список литературы
1- В. Иванов, В. Горденко «Органическая химия»
2- Д. Березин «Курс современной органической химии»
3- Дж. Робертс «Основы органической химии»
Показать Свернутьreferat.bookap.info
Курсовая работа - Карбоновые кислоты и их производные
РЕФЕРАТ
Карбоновые кислоты и их производные
Карбоновыми кислотами называют органические соединения, содержащие в своем составе карбоксильную группу. По международной заместительной номенклатуре карбоновым кислотам соответствует окончание -овая кислота в названии.
 |
кислот (см. тему «Жиры»), приняты тривиальные названия (уксусная, стеариновая).
По числу карбоксильных групп делятся на монокарбоновые (одноосновные) и дикарбоновые (двухосновные), в зависимости от строения углеводородного скелета — на алифатические (уксусная, щавелевая) и ароматические (бензойная).
Предельные одноосновные карбоновые кислоты, содержащие от одного до одиннадцати атомов углерода — жидкости, хорошо смешивающиеся с водой. В твердом и жидком состояниях, а также в водных растворах молекулы кислот димеризуются в результате образования между ними водородных связей.
Одноосновные карбоновые кислоты
Общие способы получения
 |
 |
Оксосинтез (см. тему «Химические свойства алкенов»).
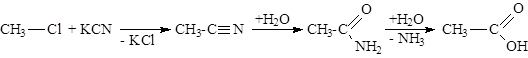 |
 |
Гидролиз сложных эфиров — см. тему «Химические свойства одноатомных спиртов».
Химические свойства
Взаимное влияние составляющих карбоксильную группу карбонила и гидроксила с одной стороны уменьшает поляризацию связей С=O карбонила, с другой стороны ослабляет связь О-Н гидроксила, что приводит к отсутствию реакций нуклеофильного присоединения AN и увеличению подвижности водорода гидроксила (кислотные свойства).
Кислотные свойства.
 Карбоновые кислоты — слабые кислоты. С увеличением углеводородного радикала степень диссоциации уменьшается. Предельные монокарбоновые кислбты обладают всеми свойствами обычных кислот:
Карбоновые кислоты — слабые кислоты. С увеличением углеводородного радикала степень диссоциации уменьшается. Предельные монокарбоновые кислбты обладают всеми свойствами обычных кислот:
a) 2RCOOH + Mg ¾® (RCOO)2Mg + Н2;
б) 2RCOOH + СаО ¾® (RCOO)2Ca + Н2О ;
в) RCOOH + КОН ¾® RCOOK + Н2О;
г) 2RCOOH + Na2CO3 ¾® 2RCOONa + СO2 + Н2О.
 |
 |
 |
 |
 |
Непредельные карбоновые кислоты
Способы получения
 |
 |
Нитрильный синтез:
 |
 |
 |
Двухосновные кислоты
Химические свойства
 |
 |
Двухосновные непредельные кислоты
 |
 |
 |
Способы получения
 |
Нитрильный синтез:
 |
Химические свойства
 |
 |
 |
Оптическая изомерия гидроксикислот
 Зеркальные изомеры называются оптическими антиподами (энантиомерами). Они вращают плоскость поляризации в разные стороны. Стереоизомеры, не являющиеся антиподами, называются диастереомерами. Общее количество оптических изомеров N вычисляется по формуле: N = 2 n, где n – количество асимметрических атомов углерода в молекуле.
Зеркальные изомеры называются оптическими антиподами (энантиомерами). Они вращают плоскость поляризации в разные стороны. Стереоизомеры, не являющиеся антиподами, называются диастереомерами. Общее количество оптических изомеров N вычисляется по формуле: N = 2 n, где n – количество асимметрических атомов углерода в молекуле.
Для идентификации оптических изомеров гидроксилслдержащих веществ применяют D-L-номенклатуру. Оптические изомеры винной кислоты представлены на рисунке.
 |
Композиция, состоящая из равных количеств энантиомеров, называется рацематом.
Альдегидо- и кетокислоты
Способы получения
 |
 |
 |
 |
Химические свойства
 |
Кето-енольная таутомерия ацетоуксусного эфира.
 |
Сложные эфиры
 Сложные эфиры — производные органических или кислородсодержащих неорганических кислот, у которых атом водорода замещен на углеводородный радикал. Названия образуются из названий кислот (кислотных остатков) и названий алкильных радикалов, входящих в состав спиртов.
Сложные эфиры — производные органических или кислородсодержащих неорганических кислот, у которых атом водорода замещен на углеводородный радикал. Названия образуются из названий кислот (кислотных остатков) и названий алкильных радикалов, входящих в состав спиртов.
 |
Способы получения
Реакция этерификации (см. тему «Химические свойства одноосновных карбоновых кислот»).
 |
Изоамилацетат – запах груши.
 |
Этилформиат – запах рома.
 |
Этилбутират – запах ананаса.
Химические свойства
 |
 |
 |
Жиры
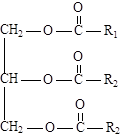 Жиры (триглицериды) — сложные эфиры глицерина и высших карбоновых (жирных) кислот. Наиболее часто в состав жиров входят предельные (пальмитиновая С15Н31СООН, стеариновая С17Н35СООН) и непредельные кислоты (олеиновая С17Н33СООН, линолевая С17Н31СООН, линоленовая С17Н29СООН). Природные жиры представляют собой смесь различных триглицеридов.
Жиры (триглицериды) — сложные эфиры глицерина и высших карбоновых (жирных) кислот. Наиболее часто в состав жиров входят предельные (пальмитиновая С15Н31СООН, стеариновая С17Н35СООН) и непредельные кислоты (олеиновая С17Н33СООН, линолевая С17Н31СООН, линоленовая С17Н29СООН). Природные жиры представляют собой смесь различных триглицеридов.
Жиры — вязкие жидкости или твердые вещества, легче воды, в воде не растворяются, но растворяются в органических растворителях.
Жиры, образованные предельными кислотами — твердые вещества, а непредельными — жидкие (они называются маслами). Чем больше в жирах содержание непредельных кислот, тем ниже их температура плавления.
Получение
 |
Реакция этерификации глицерина:
Химические свойства
I) Гидролиз (омыление).
В зависимости от условий гидролиз бывает: водный (без катализатора, при высоких температуре и давлении), кислотный (в присутствии кислоты в качестве катализатора), щелочной (под действием щелочей) и ферментативный (в живых организмах).
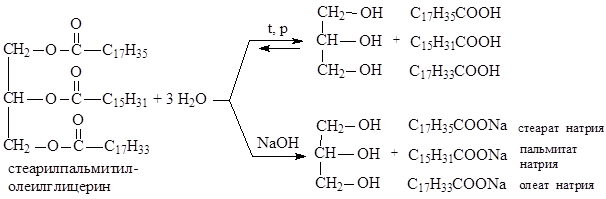 Мылами называют соли высших жирных кислот. Натриевые соли образуют твердые мыла, калиевые — жидкие.
Мылами называют соли высших жирных кислот. Натриевые соли образуют твердые мыла, калиевые — жидкие.
Реакции присоединения: гидрирование или гидрогенизация — получение твердых жиров из жидких. Характерна для жидких жиров, содержащих кратные связи.
 |
www.ronl.ru
Реферат - Карбоновые кислоты и их производные
РЕФЕРАТ
Карбоновые кислоты и их производные
Карбоновыми кислотами называют органические соединения, содержащие в своем составе карбоксильную группу. По международной заместительной номенклатуре карбоновым кислотам соответствует окончание -овая кислота в названии.
/>Для простейших представителей класса, а также высших жирных
кислот (см. тему «Жиры»), приняты тривиальные названия (уксусная, стеариновая).
По числу карбоксильных групп делятся на монокарбоновые (одноосновные) и дикарбоновые (двухосновные), в зависимости от строения углеводородного скелета — на алифатические (уксусная, щавелевая) и ароматические (бензойная).
Предельные одноосновные карбоновые кислоты, содержащие от одного до одиннадцати атомов углерода — жидкости, хорошо смешивающиеся с водой. В твердом и жидком состояниях, а также в водных растворах молекулы кислот димеризуются в результате образования между ними водородных связей.
Одноосновные карбоновые кислоты
Общие способы получения
/>Окисление углеводородов:
/>Окисление первичных спиртов и альдегидов КMпО4 или К2Сr2О7:
Оксосинтез (см. тему «Химические свойства алкенов»).
/>Нитрильный синтез:
/>Магнийорганический синтез:
Гидролиз сложных эфиров — см. тему «Химические свойства одноатомных спиртов».
Химические свойства
Взаимное влияние составляющих карбоксильную группу карбонила и гидроксила с одной стороны уменьшает поляризацию связей С=O карбонила, с другой стороны ослабляет связь О-Н гидроксила, что приводит к отсутствию реакций нуклеофильного присоединения AN и увеличению подвижности водорода гидроксила (кислотные свойства).
Кислотные свойства.
/>Карбоновые кислоты — слабые кислоты. С увеличением углеводородного радикала степень диссоциации уменьшается. Предельные монокарбоновые кислбты обладают всеми свойствами обычных кислот:
a) 2RCOOH + Mg ¾®(RCOO)2Mg + Н2;
б) 2RCOOH + СаО ¾®(RCOO)2Ca + Н2О ;
в) RCOOH + КОН ¾®RCOOK + Н2О;
г) 2RCOOH + Na2CO3 ¾®2RCOONa + СO2+ Н2О.
/>Сравнение силы кислот:
/>Взаимодействие со спиртами (реакция этерификации).
/>Образование галогенангидридов:
/>Образование ангидридов (действием водоотнимаюших средств):
/>Взаимодействие с аммиаком с образованием амидов и нитрилов:
Непредельные карбоновые кислоты
Способы получения
/>Гидролиз галогенопроизводных:
/>Дегидратация гидроксикислот:
Нитрильный синтез:
/>Химические свойства
/>Гидрогалогенирование:
/>Гидратация:
Двухосновные кислоты
Химические свойства
/>Пиролиз щавелевой и малоновой кислот:
/>Синтез с малоновым эфиром:
Двухосновные непредельные кислоты
/>Способ получения
/>Химические свойства
/>Оксикислоты
Способы получения
/>Гидролиз галогенпроизводных:
Нитрильный синтез:
/>/>Реакция Реформатского (получение b-оксикислот):
Химические свойства
/>Дегидратация a-гидроксикислот:
/>Дегидратация b-гидроксикислот:
/>Дегидратация c-гидроксикислот:
Оптическая изомерия гидроксикислот
/>Зеркальные изомеры называются оптическими антиподами (энантиомерами). Они вращают плоскость поляризации в разные стороны. Стереоизомеры, не являющиеся антиподами, называются диастереомерами. Общее количество оптических изомеров N вычисляется по формуле: N = 2 n, где n – количество асимметрических атомов углерода в молекуле.
Для идентификации оптических изомеров гидроксилслдержащих веществ применяют D-L-номенклатуру. Оптические изомеры винной кислоты представлены на рисунке.
/>
Композиция, состоящая из равных количеств энантиомеров, называется рацематом.
Альдегидо- и кетокислоты
Способы получения
/>Окисление двухатомных спиртов с одной концевой группировкой:
/>Окисление оксикислот:
/>Гидролиз вицинальных дигалогенопроизводных карбоновах кислот:
/>Пиролиз винной кислоты:
Химические свойства
/>Пиролиз:
Кето-енольная таутомерия ацетоуксусного эфира.
/>Таутомерия – динамическая изомерия: с повышением температуры увеличивается содержание енольной формы:
Сложные эфиры
/>Сложные эфиры — производные органических или кислородсодержащих неорганических кислот, у которых атом водорода замещен на углеводородный радикал. Названия образуются из названий кислот (кислотных остатков) и названий алкильных радикалов, входящих в состав спиртов.
/>Простейшие по составу сложные эфиры — бесцветные легкокипящие жидкости с фруктовым запахом; высшие сложные эфиры — воскообразные вещества. Все сложные эфиры в воде растворяются плохо.
Способы получения
Реакция этерификации (см. тему «Химические свойства одноосновных карбоновых кислот»).
/>Взаимодействие хлорангидридов кислот и алкоголятов щелочных металлов:
Изоамилацетат – запах груши.
/>Взаимодействие солей карбоновых кислот и галогензамещенных углеводородов:
Этилформиат – запах рома.
/>Реакция ангидридов карбоновых кислот со спиртами:
Этилбутират – запах ананаса.
Химические свойства
/>Гидролиз (омыление):
/>Реакция переэтерификации:
/>3) Образование амидов кислот под действием аммиака:
Жиры
/>Жиры (триглицериды) — сложные эфиры глицерина и высших карбоновых (жирных) кислот. Наиболее часто в состав жиров входят предельные (пальмитиновая С15Н31СООН, стеариновая С17Н35СООН) и непредельные кислоты (олеиновая С17Н33СООН, линолевая С17Н31СООН, линоленовая С17Н29СООН). Природные жиры представляют собой смесь различных триглицеридов.
Жиры — вязкие жидкости или твердые вещества, легче воды, в воде не растворяются, но растворяются в органических растворителях.
Жиры, образованные предельными кислотами — твердые вещества, а непредельными — жидкие (они называются маслами). Чем больше в жирах содержание непредельных кислот, тем ниже их температура плавления.
Получение
/>Из природных источников.
Реакция этерификации глицерина:
Химические свойства
I) Гидролиз (омыление).
В зависимости от условий гидролиз бывает: водный (без катализатора, при высоких температуре и давлении), кислотный (в присутствии кислоты в качестве катализатора), щелочной (под действием щелочей) и ферментативный (в живых организмах).
/>Мылами называют соли высших жирных кислот. Натриевые соли образуют твердые мыла, калиевые — жидкие.
Реакции присоединения: гидрирование или гидрогенизация — получение твердых жиров из жидких. Характерна для жидких жиров, содержащих кратные связи.
/>
www.ronl.ru
Доклад - Карбоновые кислоты - свойства, получение и производные
ВВЕДЕНИЕ
Органические карбоновые кислоты характеризуются наличием карбоксильной группы -COOH или -СO2 H. Все производные карбоновых кислот содержат ацильную группу R-CO-. По этой причине их часто называют также ацильными соединениями .
К основным производным карбоновых кислот (ацильным соединениям) относятся:





хлорангидриды кислот ангидриды сложные эфиры амиды нитрилы
Карбоксильная группа формально состоит из карбонильной и гидроксильной групп, однако, взаимодействие между ними до такой степени изменяет поведение каждой из них, что в единстве они уже представляют собой новую функциональную группу, обладающую своими собственными свойствами.
По числу карбоксильных групп различают одно-, двух-, трех- и вообще многоосновные кислоты. Карбоновые кислоты могут быть предельными (насыщенными) — карбоксил связан с алкилом, — непредельными (ненасыщенными) — карбоксил связан с непредельным радикалом и ароматическими — карбоксил связан с ароматическим радикалом.
Для карбоновых кислот чаще всего используются традиционные названия. По систематической номенклатуре кислоты называют по соответствующим углеводородам с добавлением окончания -овая и слова кислота, причем счет атомов цепи начинается от карбоксильной группы.
Упр.1. Напишите формулы кислот: (а) пропионовой, (б) масляной, (в) изомас-ляной, (г) триметилуксусной, (д) валериановой, (е) пальмитиновой, (ж) стеариновой. Назовите их по номенклатуре IUPAC.
Упр.2. Напишите формулы следующих кислот: (а) бензойной, (б) метилбензой-ных (толуиловых), (в) фталевых, (г) фенилуксусной, (д) коричной.
Гидроксильная группа в карбоновых кислотах образует водородные связи, причем более прочные, чем в спиртах. Кроме того, в карбоновых кислотах в образовании водородной связи может участвовать карбонильная группа. В твердом и жидком состоянии кислоты существуют в основном в виде димеров:

Такие димерные структуры сохраняются даже в газообразном состоянии и в растворах в воде. Способность карбоновых кислот образовывать водородные связи с водой обусловливает растворимость низжих кислот в воде. По мере увеличения длины углеродной цепи растворимость кислот в воде быстро уменьшается.
1. Свойства кислот
Свойства кислот обусловлены наличием в них карбоксильной группы, состоящей из гидроксильной и карбонильной групп.
1.1. Кислотность
В водных растворах карбоновые кислоты существуют в равновесии с карбоксильным ионом:
 (7)
(7)






pKa 4,76 2,86 1,48 0,7 4,19
Степень диссоциации карбоновых кислот в воде относительно не велика. Тем не менее карбоновые кислоты на много порядков сильнее, чем спирты.
Упр.6. Укажите, какая из пары кислот сильнее: (а) бензойная или п -нитробензойная, (б) 2-гидроксипропановая (молочная) или пропановая (пропионовая), (в) 2-оксопропановая (пировиноградная) или пропановая (пропионовая).
Ответ: (а) п -нитробензойная из-за –I-эффекта нитрогруппы, (б) молочная из-за –I-эффекта гидроксильной группы, (в)…
Электролизом солей карбоновых кислот получают алканы. При нагревании серебряных или ртутных солей карбоновых кислот с бромом образуются алкилбромиды.
 (8)
(8)
стеариновая кислота 1-бромгептадекан
 (9)
(9)
Эта реакция открыта русским химиком и композитором А.П. Бородиным (1861). Она протекает по радикальному иеханизму. Многие функциональные группы не мешают протеканию реакции.
Упр.7. Завершите реакции:
(а)  (б)
(б) 
(в)  (г)
(г) 
1.2. Нуклеофильное замещение ацильных соединений
Основной реакцией карбонильных соединений является реакция нуклеофильного присоединения, протекающая по механизму:
 (15 М 3)
(15 М 3)
Ацильная группа включает карбонильную группу. Реакции ацильных соединений проходят по механизму нуклеофильного присоединения — элиминирования:
 (м 2)
(м 2)
Реакционная способность ацильных соединений зависит от основности уходящей группы. По реакционной способности их можно расположить в следующий ряд:

Приведенный порядок реакционной способности ацильных соединений позволяет судить о том, какие из них могут быть получены из данного ацильного соединения, а какие нет. Менее реакционноспособные ацильные соединения могут быть получены из более реакционноспособных, обратные же реакции или затруднены или требуют особых условий.
2. Способы получение
Большинство из многочисленных методов получения кислот нами уже были рассмотрены в предыдущих главах.
А. Муравьиную кислоту получают в промышленности взаимодействием окиси углерода с водным раствором гидроксида натрия при высокой температуре и давлении:
 (1)
(1)
Формиат натрия муравьинаякислота
Б. Карбонилирование метанола. Разработан способ получения уксусной кислоты из метанола и окиси углероа в присутствии небольшого количества родия (III), HI и h3 O.
 (2)
(2)
Реакция проходит по следующему механизму:
 (М 1)
(М 1)

метил-родийкарбонильный комплекс

ацетил-родийкарбонильный комплекс

В. Алкены реагируют с окисью углерода и водяным паром в присутствии тетракарбонила никеля и других катализаторов при нагревании под давлением с образованием карбоновых кислот:
 (3)
(3)
Аналогичная реакция с ацетиленом приводит к образованию акриловой кислоты.
 (4)
(4)
акриловая кислота
Г. Окисление углеводородов кислородом воздуха является основным источником дешевых карбоновых кислот. Окислением толуола воздухом в присутствии марганцевого катализатора в промышленности получают бензойную кислоту.
В лабораторных условиях в качестве окислителя используется перманганат калия:
 (5)
(5)
Д. Металлоорганические соединения легко реагируют с диоксидом углерода, давая соли, которые далее разлагают сильной кислотой:
 (6)
(6)
Упр.3. Напишите реакцию получения пропионовой кислоты (а) по реакции Гриньяра и (б) методом оксосинтеза.
Упр.4. Напишите реакции получения бензойной кислоты из (а) толуола, (б) этил-бензола, (в) стирола, (г) бромбензола, (д) бензилового спирта, (е) бензальдегида.
Упр.5. При окислении циклогексана кислородом воздуха (100о С, 5-6 атм ) образуется смесь циклогексанола и циклогексанона. При дальнейшем окислении этой смеси азотной кислотой получают адипиновую кислоту, необходимую для синтеза найлона. Напишите уравнения реакций, приводящих к адипиновой кислоте.
3. Ангидриды карбоновых кислот
Ангидриды карбоновых кислот представляют собой продукты отщепления молекулы воды от двух молекул кислоты.
3.1. Способы получения ангидридов карбоновых кислот
Ангидриды карбоновых кислот, как мы только что видели (3.1), могут быть получены из хлорангидридов и солей карбоновых кислот. Кроме того они могут быть получены из ацилхлоридов и карбоновых кислот в присутствии пиридина:

ацилхлоорид кислота пиридин ангидрид пиридинийхлорид
Ангидриды многих карбоновых кислот образуются при нагревании соответствующих карбоновых кислот, причем при этом часто используются водоотнимающие средства. Так, уксусный ангидрид получают нагреванием уксусной кислоты с концентрированной серной кислотой:
 (28)
(28)
уксусный ангидрид
 (29)
(29)
В качестве дегидратирующего агента иногда используют дешевый уксусный ангидрид:
 (30)
(30)
Упр.19. Ангидрид бензойной кислоты может быть получен добавлением одного мольэквивалента воды к двум мольэквивалентам бензоилхлорида. Напишите эту реакцию.
Циклические ангидриды дикарбоновых кислот часто образуются при простом их нагревании:
 (31)
(31)
янтарная кислота янтарный ангидрид
Промышленным методом получения малеинового ангидрида служит окисление бензола или 2-бутена воздухом:
 (32)
(32)
Фталевый ангидрид получают в промышленности окислением нафталина или о -ксилола:
 (33)
(33)
Уксусный ангидрид в промышленности получают окислением уксусного альдегида
кислородом воздуха в присутствии медно-кобальтового катализатора:
 (34)
(34)
Упр.20. Малеиновая кислота превращается в малеиновый ангидрид при 200о С. Для получения малеинового ангидрида из фумаровой кислоты требуется значительно более высокая температура. Чем это объясняется? Напишите сооветствующие реакции.
Упр.21. Напишите реакции пропионового ангидрида с (а) водой, (б) этанолом, (в) аммиаком, (г) этиламином и опишите их механизм.
Упр.22. Каковы техничесие методы получения уксусного ангидрида? Каково его промышленное применение?
Упр.23. Завершите реакции



3.2. Реакции ангидридов карбоновых кислот
Ангидриды карбоновых кислот вступают в те же реакции, что и хлорангидриды:
 (35)
(35)
 (36)
(36)
метилацетат
 (М 6)
(М 6)
 (37)
(37)
ацетамид
Соединения, содержащие ацетильные группы, чаще всего получают из уксусного ангидрида: он дешев, легко доступен, не очень летуч и не выделяет коррозионного HCl.
 (38)
(38)
уксусный ангидрид нилин ацетанилид

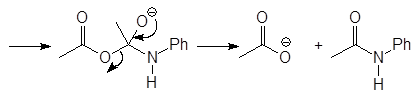 (М 7)
(М 7)
Упр.24. Напишите реакции ацетангидрида (а) с анилином и (б) салициловой кислотой и опишите их механизм.
www.ronl.ru
Карбоновые кислоты и их производные
Похожие работы: Карбоновые кислоты - свойства, получение и производные
Карбоновые кислоты - свойства, получение и производные 3.02.2009/реферат
Ацильные соединения - производные карбоновых кислот, содержащие ацильную группу. Свойства кислот обусловлены наличием в них карбоксильной группы, состоящей из гидроксильной и карбонильной групп. Способы получения и реакции ангидридов карбоновых кислот.
 Карбоновые кислоты. Уксусная кислота
Карбоновые кислоты. Уксусная кислота 16.12.2007/реферат
Карбоновые кислоты-органические соединения, содержащие карбоксильную группу (карбоксил). Номенклатура и изомерия. Физические свойства. Химические свойства. Уксусная (метанкарбоновая, этановая) кислота СН3-СООН. Применение кислот в прмышленности.
 Гидроксикарбонильные соединения. Дикарбоновые кислоты
Гидроксикарбонильные соединения. Дикарбоновые кислоты 3.02.2009/лекция
Получение и отличительные черты гидроксикарбонильных соединений. Химические свойства диальдегидов, дикетонов и кетоальдегидов. Отношение различных дикарбоновых кислот к нагреванию. Галогенирование и механизм стадии расщепления галоформной реакции.
 Одноосновные насыщенные карбоновые кислоты
Одноосновные насыщенные карбоновые кислоты 21.02.2009/реферат
Промышленные способы получения карбоновых кислот. Синтезы на основе оксида углерода. Гидролиз нитрилов. Синтез Гриньяра. Гидролиз жиров. Образование галогенангидридов. Декарбоксилирование. Гидратация ацетилена и окисление получаемого ацетальдегида.
 Синтез диэтилового эфира малоновой кислоты. Свойства и основные методы получения сложных эфиров
Синтез диэтилового эфира малоновой кислоты. Свойства и основные методы получения сложных эфиров 17.01.2009/курсовая работа
Свойства диэтилового эфира малеиновой кислоты. Практическое применение диэтилмалеата - использование в качестве органического растворителя. Методика синтеза. Дикарбоновые кислоты. Реакция этерификации. Механизм этерификации. Метод "меченых атомов".
 Синтез нитробензойной кислоты
Синтез нитробензойной кислоты 5.12.2008/курсовая работа
Понятие термина ароматические карбоновые кислоты. Серная кислота: химические показатели, правила использования. Влияние температуры на реакцию нитрования и ее лабораторные соединения. Способы получения одноосновных карбоновых кислот ароматического ряда.
 Синтез нитрокарбоновой кислоты адамантана
Синтез нитрокарбоновой кислоты адамантана 9.11.2008/курсовая работа
Каркасные соединения. Пространственные изомеры. Химические свойства адамантана. Синтез алифатических, ароматических и адамантанкарбоновых кислот. Исходные вещества. Дикарбоновые кислоты. Окисление углеводородов. Гидролиз нитрилов, жиров и спиртов.
 ГДЗ по химии 10 - 11 класс Цветкова
ГДЗ по химии 10 - 11 класс Цветкова 24.02.2012/шпаргалка
Домашняя работа по химии заДомашняя работа по химии за 10-11 классы к учебнику
Л.Л. Цветкова «Органическая химия: учеб. для учащихся 10-11 кл. общеобразоваг. учеб. заведений»: учебно-мeroдическое пособие / О.Ю. Сергеева. - 3-е ИЗД., стереотип. - М.: Издательство "Экзамен", 2008. Химия – предмет не лёгкий, особенно в старших классах. Не все школьники справляются с этим предметом, а домашня работа превращается в пытку, отнимая массу времени и существенно подрывая иницативу ученика к постижению данной науки. Именно поэтому гдз по химии для 10 -11 классов окажется крайне полезным как для старшекласснков, так и для их родителей. В пособии решены и в большинстве случаев подробно разобраны задачи и упражнения из учебника «Органическая химия: учебник для учащихея 10-11 кл. общеобразоват. учеб. заведений / Л.Л. Цветков. - М.: Гуманитар. Изд. центр ВЛАДОС, 2006».
![]()
Это гдз Вы можете скачать совершенно бесплатно, без смс и без регистрации только на нашем сайте!
Данное гдз по химии поможет родителям, которые смогут проконтролировать правильность решения, а в случае необходимости помочь детям в выполнении домашней работы по химии. 1. Теории химического строении органических соединений. Электронная природа химических свизей § 1. Предпосылки теории строения § 2. Теория химического строения § 3. Изометрия § 4. Электронное строение атомов элеменrов малых периодов. Химическая связь 1. Предельные углеводороды § 5. Метан, его строение § 6. Строение и номешслатура углеводородов ряда метана § 7. Химические свойства предельных углеводородов § 8. Получение и применение предельных углеводородов 3. Непредельные углеводороды § 10. Этилен, его строение § 11. Строение и номенклатура углеводородов рода этилена § 12. Химические свойства углеводородов ряда этилена § 13. Применение и получение этиленовых углеводородов § 14. Диеновые углеводороды § 15. Каучук § 16. Ацетилен и его гомологи 4. Ароматические углеводороды § 17. Бензол § 18. Гомологи бензола § 19. Многообразие углеводородов. Взаимосвязь гомологических рядов Природиые источники углеводородов § 20. Природный и попугный нефтяной газы § 21. Нефть. Нефтепродукты § 22. Переработканефти § 23: Коксохимическое производство 6. Спирты и фенолы § 24. Строение предельных одноатомных спиртов § 25. Химические свойства и применение предельных одноатомных спиртов § 26. Спирты как производные углеводородов. Промышленный синтез метанола § 27. Многоатомные спирты § 28. Фенолы 7. Альдегиды и карбоновые кислоты § 29. Альдегиды § 30. Одноосновные карбоновые кислоты § 31. Представители одноосновных карбоновых кислот § 32. Связь между углеводородами, спиртами, альдегидами и кислотами 8. Сложные эфиры. Жиры § 33. Сложные эфиры § 34. Жиры 9. Углеводы § 35. Глюкоза § 36. Рибоза и дезоксирибоза § 37. Сахароза § 38 Крахмал § 39. Целлюлоза 10. Амины. Аминокислоты. Азотсодержащие гетероциклические соединения § 40. Амины § 41. АмиНокислоты § 42. Азотсодержащие гетероциклические соединения § 43. Примидиновые и пуриновые основания 11. Белки. Нуклеиновые кислоты § 44. Белки § 45. Нуклеиновые кислоты 12. Синтетические высокомолекулярные вещества и полимерные материалы на их основе § 46. Общая характеристика синтетических высокомолекулярных веществ § 47. Пластмассы § 48. Пластмассы (продолжение) § 49. Сmrrетические волокна § 50. Синтетические каучуки Лабораторные опыты Практические работы .. 88
Данное гдз ищут по следующим запросам:
- гдз химия 11 класс бесплатно
- химия гдз 11 класс онлайн
- химия 10 11 клас гдз.
пособии решены и в большинстве случаев подробно разобра'ны
задачи и упражнения из учебника «Органическая химия: учеб. для
учащихея 10-11 кл. общеобразоват. учеб. заведений / Л.Л. Нветков.
- М.: Гуманитар. Изд. центр ВЛАДОС, 2006».
Пособие адресовано родителям, которые CMOryт проконтролировать
правИльность решения, а в случае необходимости помочь детям
в выполнении домашней работы по химии.пособии решены и в большинстве случаев подробно разобра'ны
задачи и упражнения из учебника «Органическая химия: учеб. для
учащихея 10-11 кл. общеобразоват. учеб. заведений / Л.Л. Нветков.
- М.: Гуманитар. Изд. центр ВЛАДОС, 2006».
Пособие адресовано родителям, которые CMOryт проконтролировать
правИльность решения, а в случае необходимости помочь детям
в выполнении домашней работы по химии.
пособии решены и в большинстве случаев подробно разобра'ны
задачи и упражнения из учебника «Органическая химия: учеб. для
учащихея 10-11 кл. общеобразоват. учеб. заведений / Л.Л. Нветков.
- М.: Гуманитар. Изд. центр ВЛАДОС, 2006».
Пособие адресовано родителям, которые CMOryт проконтролировать
правИльность решения, а в случае необходимости помочь детям
в выполнении домашней работы по химии.
пособии решены и в большинстве случаев подробно разобра'ны
задачи и упражнения из учебника «Органическая химия: учеб. для
учащихея 10-11 кл. общеобразоват. учеб. заведений / Л.Л. Нветков.
- М.: Гуманитар. Изд. центр ВЛАДОС, 2006».
Пособие адресовано родителям, которые CMOryт проконтролировать
правИльность решения, а в случае необходимости помочь детям
в выполнении домашней работы по химии.
», 2008. 93, [3] с. (Серия <<Решебнию» 10-11 классы к учебнику
Л.Л. Цветкова «Органическая химия: учеб. для учащихся 10-11 кл.
общеобразоваг. учеб. заведений»: учебно-мeroдическое пособие /
О.Ю. Сергеева. - 3-е ИЗД., стереотип. - М.: Издательство «Экзамен
», 2008. 93, [3] с. (Серия <<Решебнию»
 ГДЗ химия 9 класс Габриелян, 2011
ГДЗ химия 9 класс Габриелян, 2011 24.08.2012/шпаргалка
ГДЗ химия 9 класс Габриелян 2011.
Данная книга представляет ответы на все вопросы и задания учебника Химия 9 класс Габриеляна. Это гдз поможет при самостоятельном выполнении заданий учебника и контроле правильности их выполнения; как дома так и на уроке, а также при выполнении разнообразных химических практикумов.
Пособие предназначено для учеников средней школы, их родителей и учителей, работающим по учебнику О. С. Габриеляна «Химия. 9 класс».
![]()
ОГЛАВЛЕНИЕ
Введение. Общая характеристика химических элементов.
§ 1. Характеристика химического элемента на основании его положения в периодической системе Д. И. Менделеева.
§ 2. Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений
§ 3. Периодический закон и Периодическая система химических элементов Д. И. Менделеева 19
Глава первая. Металлы.
§ 4. Век медный, бронзовый, железный
§ 5. Положение металлов в Периодической системе Д. И. Менделеева
§ 6. Физические свойства металлов ... 26
§ 7. Сплавы 27
§ 8. Химические свойства металлов ... 29
§ 9. Получение металлов 32
§ 10. Коррозия металлов 35
§ 11. Щелочные металлы 37
§ 12. Бериллий, магний и щелочноземельные металлы 39
§ 13. Алюминий 42
§ 14. Железо 46
Глава вторая. Свойства металлов и их соединений (химический практикум) 52
Практическая работа №1. Осуществление цепочки химических превращений 52
Практическая работа №2. Получение и свойства соединений металлов . . 55
Практическая работа №3. Экспериментальные задачи по распознаванию и получению веществ 59
Глава третья. Неметаллы 65
§ 15. Неметаллы: атомы и простые вещества. Кислород, озон, воздух . 65
§ 16. Химические элементы в клетках живых организмов 69
§ 17. Водород 71
§ 18. Галогены 74
§ 19. Соединения галогенов 77
§ 20. Получение галогенов. Биологическое значение и применение галогенов и их соединений 79
§ 21. Кислород 84
§ 22. Сера 88
§ 23. Соединения серы 90
§ 24. Азот 97
§ 25. Аммиак 100
§ 26. Соли аммония 104
§ 27. Кислородные соединения азота . . 106
§ 28. Фосфор и его соединения 111
§ 29. Углерод 116
§ 30. Кислородные соединения углерода 120
§ 31. Кремний и его соединения 125
Глава четвертая. Свойства неметаллов и их соединений (химический практикум) 130
Практическая работа №4. Экспериментальные задачи по теме «Подгруппа кислорода» 130
Практическая работа №5. Экспериментальные задачи по теме «Подгруппа азота и углерода» 135
Практическая работа №6. Получение, собирание и распознавание газов . 140
Глава пятая. Органическая химия 144
32. Предмет органической химии . . . 144
33. Предельные углеводороды 148
34. Непредельные углеводороды. Этан 150
35. Спирты 151
36. Предельные одноосновные карбоновые кислоты. Сложные эфиры . . 155
37. Жиры 158
38. Аминокислоты и белки 161
39. Углеводы 164
40. Полимеры 168
Приложение 173
1. Общая классификация удобрений ... 173
2. Химическая мелиорация почв 177
3. Азотные, калийные и фосфорные удобрения 178
 ГДЗ химия 10 класс базовый уровень Габриелян, 2011
ГДЗ химия 10 класс базовый уровень Габриелян, 2011 24.08.2012/шпаргалка
ГДЗ химия 10 класс Габриелян базовый уровень - 2011
В данном гдз разобраны решеня задачь и упражнений, а также выполнены практические работы из учебника по химии за 10 класс (Базовый уровень): учебник для общеобразовательных учреждений / О.С. Габриелян. - 6-е изд., стереотип. - М.: Дрофа, 2010". Данная книга предназначена родителям, которые смогут проверить правильность решения, а в случае необходимости- помочь своим детям в выполнении домашней работы по химии.§ 1. Предмет органической химии
§ 2. Теория строения органических соединений
§ 3. Природный газ. Алканы
§ 4. Алкены. Этилен
§ 5. Алкадиены. Каучуки
§ 6. Алкины. Ацетилен
§ 7. Арены. Бензол
§ 8. Нефть и способы ее переработки
§ 9. Единство химической организации живых организмов на Земле. Спирты.
§ 10. Фенол 32
§ 11. Альдегиды и кетоны 34
§ 12. Карбоновые кислоты 39
§ 13. Сложные эфиры. Жиры. Мыла 43
§ 14. Углеводы. Моносахариды
§ 15. Дисахариды и полисахариды
§ 16. Амины. Анилин
§ 17. Аминокислоты. Белки
§ 18. Нуклеиновые кислоты
§ 19. Ферменты
§ 20. Витамины. Гормоны. Лекарства
§ 21. Искусственные полимеры
§ 22. Синтетические органические соединения 82
Лабораторные опыты.
1. Определение элементного состава органических соединений 84
4. Получение и свойства ацетилена 84
6. Свойства этилового спирта 85
7. Свойства глицерина
8. Свойства формальдегида
9. Свойства уксусной кислоты
10. Свойства жиров
11. Сравнение свойств растворов мыла и стирального порошка
12. Свойства глюкозы
13. Свойства крахмала
14. Свойства белков
Практическая работа
Идентификация органических соединений 91Данное ГДЗ химия 10 класс Габриеляна можно скачать бесплатно с этого сайта.
 Перейти в список рефератов, курсовых, контрольных и дипломов по дисциплине Химия
Перейти в список рефератов, курсовых, контрольных и дипломов по дисциплине Химия
referatwork.ru
Реферат - Карбоновые кислоты - свойства, получение и производные
ВВЕДЕНИЕ
Органические карбоновые кислоты характеризуются наличием карбоксильной группы -COOH или -СO2 H. Все производные карбоновых кислот содержат ацильную группу R-CO-. По этой причине их часто называют также ацильными соединениями .
К основным производным карбоновых кислот (ацильным соединениям) относятся:





хлорангидриды кислот ангидриды сложные эфиры амиды нитрилы
Карбоксильная группа формально состоит из карбонильной и гидроксильной групп, однако, взаимодействие между ними до такой степени изменяет поведение каждой из них, что в единстве они уже представляют собой новую функциональную группу, обладающую своими собственными свойствами.
По числу карбоксильных групп различают одно-, двух-, трех- и вообще многоосновные кислоты. Карбоновые кислоты могут быть предельными (насыщенными) — карбоксил связан с алкилом, — непредельными (ненасыщенными) — карбоксил связан с непредельным радикалом и ароматическими — карбоксил связан с ароматическим радикалом.
Для карбоновых кислот чаще всего используются традиционные названия. По систематической номенклатуре кислоты называют по соответствующим углеводородам с добавлением окончания -овая и слова кислота, причем счет атомов цепи начинается от карбоксильной группы.
Упр.1. Напишите формулы кислот: (а) пропионовой, (б) масляной, (в) изомас-ляной, (г) триметилуксусной, (д) валериановой, (е) пальмитиновой, (ж) стеариновой. Назовите их по номенклатуре IUPAC.
Упр.2. Напишите формулы следующих кислот: (а) бензойной, (б) метилбензой-ных (толуиловых), (в) фталевых, (г) фенилуксусной, (д) коричной.
Гидроксильная группа в карбоновых кислотах образует водородные связи, причем более прочные, чем в спиртах. Кроме того, в карбоновых кислотах в образовании водородной связи может участвовать карбонильная группа. В твердом и жидком состоянии кислоты существуют в основном в виде димеров:

Такие димерные структуры сохраняются даже в газообразном состоянии и в растворах в воде. Способность карбоновых кислот образовывать водородные связи с водой обусловливает растворимость низжих кислот в воде. По мере увеличения длины углеродной цепи растворимость кислот в воде быстро уменьшается.
1. Свойства кислот
Свойства кислот обусловлены наличием в них карбоксильной группы, состоящей из гидроксильной и карбонильной групп.
1.1. Кислотность
В водных растворах карбоновые кислоты существуют в равновесии с карбоксильным ионом:
 (7)
(7)






pKa 4,76 2,86 1,48 0,7 4,19
Степень диссоциации карбоновых кислот в воде относительно не велика. Тем не менее карбоновые кислоты на много порядков сильнее, чем спирты.
Упр.6. Укажите, какая из пары кислот сильнее: (а) бензойная или п -нитробензойная, (б) 2-гидроксипропановая (молочная) или пропановая (пропионовая), (в) 2-оксопропановая (пировиноградная) или пропановая (пропионовая).
Ответ: (а) п -нитробензойная из-за –I-эффекта нитрогруппы, (б) молочная из-за –I-эффекта гидроксильной группы, (в)…
Электролизом солей карбоновых кислот получают алканы. При нагревании серебряных или ртутных солей карбоновых кислот с бромом образуются алкилбромиды.
 (8)
(8)
стеариновая кислота 1-бромгептадекан
 (9)
(9)
Эта реакция открыта русским химиком и композитором А.П. Бородиным (1861). Она протекает по радикальному иеханизму. Многие функциональные группы не мешают протеканию реакции.
Упр.7. Завершите реакции:
(а)  (б)
(б) 
(в)  (г)
(г) 
1.2. Нуклеофильное замещение ацильных соединений
Основной реакцией карбонильных соединений является реакция нуклеофильного присоединения, протекающая по механизму:
 (15 М 3)
(15 М 3)
Ацильная группа включает карбонильную группу. Реакции ацильных соединений проходят по механизму нуклеофильного присоединения — элиминирования:
 (м 2)
(м 2)
Реакционная способность ацильных соединений зависит от основности уходящей группы. По реакционной способности их можно расположить в следующий ряд:

Приведенный порядок реакционной способности ацильных соединений позволяет судить о том, какие из них могут быть получены из данного ацильного соединения, а какие нет. Менее реакционноспособные ацильные соединения могут быть получены из более реакционноспособных, обратные же реакции или затруднены или требуют особых условий.
2. Способы получение
Большинство из многочисленных методов получения кислот нами уже были рассмотрены в предыдущих главах.
А. Муравьиную кислоту получают в промышленности взаимодействием окиси углерода с водным раствором гидроксида натрия при высокой температуре и давлении:
 (1)
(1)
Формиат натрия муравьинаякислота
Б. Карбонилирование метанола. Разработан способ получения уксусной кислоты из метанола и окиси углероа в присутствии небольшого количества родия (III), HI и h3 O.
 (2)
(2)
Реакция проходит по следующему механизму:
 (М 1)
(М 1)

метил-родийкарбонильный комплекс

ацетил-родийкарбонильный комплекс

В. Алкены реагируют с окисью углерода и водяным паром в присутствии тетракарбонила никеля и других катализаторов при нагревании под давлением с образованием карбоновых кислот:
 (3)
(3)
Аналогичная реакция с ацетиленом приводит к образованию акриловой кислоты.
 (4)
(4)
акриловая кислота
Г. Окисление углеводородов кислородом воздуха является основным источником дешевых карбоновых кислот. Окислением толуола воздухом в присутствии марганцевого катализатора в промышленности получают бензойную кислоту.
В лабораторных условиях в качестве окислителя используется перманганат калия:
 (5)
(5)
Д. Металлоорганические соединения легко реагируют с диоксидом углерода, давая соли, которые далее разлагают сильной кислотой:
 (6)
(6)
Упр.3. Напишите реакцию получения пропионовой кислоты (а) по реакции Гриньяра и (б) методом оксосинтеза.
Упр.4. Напишите реакции получения бензойной кислоты из (а) толуола, (б) этил-бензола, (в) стирола, (г) бромбензола, (д) бензилового спирта, (е) бензальдегида.
Упр.5. При окислении циклогексана кислородом воздуха (100о С, 5-6 атм ) образуется смесь циклогексанола и циклогексанона. При дальнейшем окислении этой смеси азотной кислотой получают адипиновую кислоту, необходимую для синтеза найлона. Напишите уравнения реакций, приводящих к адипиновой кислоте.
3. Ангидриды карбоновых кислот
Ангидриды карбоновых кислот представляют собой продукты отщепления молекулы воды от двух молекул кислоты.
3.1. Способы получения ангидридов карбоновых кислот
Ангидриды карбоновых кислот, как мы только что видели (3.1), могут быть получены из хлорангидридов и солей карбоновых кислот. Кроме того они могут быть получены из ацилхлоридов и карбоновых кислот в присутствии пиридина:

ацилхлоорид кислота пиридин ангидрид пиридинийхлорид
Ангидриды многих карбоновых кислот образуются при нагревании соответствующих карбоновых кислот, причем при этом часто используются водоотнимающие средства. Так, уксусный ангидрид получают нагреванием уксусной кислоты с концентрированной серной кислотой:
 (28)
(28)
уксусный ангидрид
 (29)
(29)
В качестве дегидратирующего агента иногда используют дешевый уксусный ангидрид:
 (30)
(30)
Упр.19. Ангидрид бензойной кислоты может быть получен добавлением одного мольэквивалента воды к двум мольэквивалентам бензоилхлорида. Напишите эту реакцию.
Циклические ангидриды дикарбоновых кислот часто образуются при простом их нагревании:
 (31)
(31)
янтарная кислота янтарный ангидрид
Промышленным методом получения малеинового ангидрида служит окисление бензола или 2-бутена воздухом:
 (32)
(32)
Фталевый ангидрид получают в промышленности окислением нафталина или о -ксилола:
 (33)
(33)
Уксусный ангидрид в промышленности получают окислением уксусного альдегида
кислородом воздуха в присутствии медно-кобальтового катализатора:
 (34)
(34)
Упр.20. Малеиновая кислота превращается в малеиновый ангидрид при 200о С. Для получения малеинового ангидрида из фумаровой кислоты требуется значительно более высокая температура. Чем это объясняется? Напишите сооветствующие реакции.
Упр.21. Напишите реакции пропионового ангидрида с (а) водой, (б) этанолом, (в) аммиаком, (г) этиламином и опишите их механизм.
Упр.22. Каковы техничесие методы получения уксусного ангидрида? Каково его промышленное применение?
Упр.23. Завершите реакции



3.2. Реакции ангидридов карбоновых кислот
Ангидриды карбоновых кислот вступают в те же реакции, что и хлорангидриды:
 (35)
(35)
 (36)
(36)
метилацетат
 (М 6)
(М 6)
 (37)
(37)
ацетамид
Соединения, содержащие ацетильные группы, чаще всего получают из уксусного ангидрида: он дешев, легко доступен, не очень летуч и не выделяет коррозионного HCl.
 (38)
(38)
уксусный ангидрид нилин ацетанилид

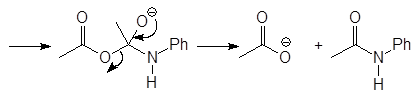 (М 7)
(М 7)
Упр.24. Напишите реакции ацетангидрида (а) с анилином и (б) салициловой кислотой и опишите их механизм.
www.ronl.ru
|
|
..:::Счетчики:::.. |
|
|
|
|
|
|
|
|


