 – протий;
– протий;Водород образует три изотопа с массовыми числами 1, 2, 3:
 – протий;
– протий;
 (
( ) – дейтерий;
) – дейтерий;
 (
( ) – тритий.
) – тритий.
В природе водород находится в виде протия  (99,98%). 0,0156% природного водорода приходится на долю «тяжелого» водорода – дейтерия, масса которого вдвое больше массы протия. Протий и дейтерий не являются радиоактивными.
(99,98%). 0,0156% природного водорода приходится на долю «тяжелого» водорода – дейтерия, масса которого вдвое больше массы протия. Протий и дейтерий не являются радиоактивными.
Впервые дейтерий был получен в виде тяжелой воды D2O путем электролиза природной воды.
Тяжелая вода D2O – вода, образованная атомами дейтерия. По своим физико-химическим свойствам отличается от Н2О:
| … Н2О | D2O | |
 °С °С | 3,83 | |
 °С °С | 101,42 | |
 | 1 (при 20 ºС) | 1,1053 (при 20 ºС) |
В настоящее время дейтерий получают из природной смеси путем изотопного обмена между водой и сероводородом:  . Для получения 1 л тяжелой воды требуется 41 т воды и 135 т сероводорода.
. Для получения 1 л тяжелой воды требуется 41 т воды и 135 т сероводорода.
Химические реакции в тяжелой воде протекают медленнее, по сравнению с обычной водой, водородные связи с участием дейтерия несколько сильнее обычных. Тяжёлая вода токсична. Тяжелая вода оказывает губительное действие на животных и человека. Например, замена 1/3 Н2О на D2O приводит к бесплодию, нарушению углеводного баланса и анемии.
Однако некоторые микроорганизмы способны жить в 70%-ной тяжёлой воде (простейшие) и даже в чистой тяжёлой воде (бактерии). Человек может без видимого вреда для здоровья выпить стакан тяжёлой воды, весь дейтерий будет выведен из организма через несколько дней. В этом отношении тяжёлая вода менее токсична, чем, например, поваренная соль.
Тяжелая вода является промышленным продуктом и доступна в больших количествах. Производство тяжёлой воды очень энергоёмко, поэтому её стоимость довольно высока (ориентировочно 200 – 250 долларов за кг).
Ядра дейтерия имеют спин ядра равный 1, с этим связано использование тяжелой воды и других дейтерированных растворителей (дейтерохлороформ CDCl3) в спектроскопии ядерного магнитного резонанса. Тяжелая вода находит применение в ядерной технике в качестве замедлителя быстрых нейтронов, поскольку она быстро понижет энергию нейтронов ядерного деления, а также вследствие того, что дейтерий имеет низкое сечение захвата нейтронов (не поглощает нейтроны), чем водород, и, следовательно, заметно уменьшает нейтронный поток.
Дейтерий широко применяют при изучении механизмов реакции и при кинетических исследованиях.
От других изотопов тритий отличается тем, что он радиоактивен. В природе тритий встречается в очень малых количествах. Естественное содержание трития – 1 атом на 1018 атомов водорода, это результат ядерных реакций, протекающих вод действием космических лучей в верхних слоях атмосферы:



После испытаний термоядерного оружия (1954 г.) концентрация трития увеличилась в сотни раз, но в настоящее время она упала в результате запрета на испытания ядерного оружия в атмосфере. Низкое содержание трития в земной коре объясняется и его радиоактивностью с периодом полураспада 12,35 года  . В последние годы основным источником техногенного трития в окружающей среде стали атомные электростанции, которые ежегодно выделяют несколько десятков килограммов трития.
. В последние годы основным источником техногенного трития в окружающей среде стали атомные электростанции, которые ежегодно выделяют несколько десятков килограммов трития.
В настоящее время тритий получают в ядерных реакторах при облучении лития нейтронами: 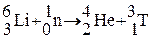 . Литий используют в виде сплава с магнием или алюминием, который удерживает в себе много трития, который освобождается при растворении облученного сплава в кислоте.
. Литий используют в виде сплава с магнием или алюминием, который удерживает в себе много трития, который освобождается при растворении облученного сплава в кислоте.
Прим. Наиболее удобный способ хранения трития состоит в превращении его в UT3 по реакции с мелко раздробленным ураном. Из данного соединения тритий легко освобождается при нагревании выше 400 ºС.
Тяжелая вода на основе трития T2O обладает сильной радиоактивностью. Поэтому обычно используют разбавленные растворы, содержащие 1% тритиевой воды. Тритий является чистым β-излучателем без примеси γ-компоненты, поэтому он относительно безопасен, так как β-частицы обладают низкой проникающей способностью, поэтому задерживаются листом бумаги или слоем воздуха в 3 мм. Тритий – один из наименее токсичных радиоизотопов.
Тритий может служить радиоактивной меткой для изучения различных природных процессов. Анализ атмосферного трития дает ценную информацию о космических лучах. А тритий в осадочных породах может свидетельствовать о перемещениях воздуха и влаги на Земле.
Наиболее богатые природные источники трития – дождь и снег, поскольку почти весь тритий, образующийся под действием космических лучей в атмосфере, переходит в воду. Интенсивность космической радиации изменяется с широтой, поэтому осадки, например, в средней полосе России несут в несколько раз больше трития, чем тропические ливни. И совсем мало трития в дождях, которые идут над океаном, поскольку их источник – в основном та же океаническая вода, а ней трития немного. Понятно, что глубинный лед Гренландии или Антарктиды совсем не содержит трития – он там давно успел полностью распасться. Зная скорость образования трития в атмосфере, можно рассчитать, как долго влага находится в воздухе – с момента ее испарения с поверхности до выпадения в виде дождя или снега. Оказалось, что, например, в воздухе над океаном этот срок составляет в среднем 9 дней.
Чаще всего тритий применяют как метку при изучении механизмов реакций и их кинетики.
Синтезированный тритий сравнительно дешев и находит применение в научных исследованиях и в промышленности. Широкое применение нашли тритиевые светящиеся краски, которые наносят на шкалы приборов. Эти светосоставы с точки зрения радиации менее опасны, чем традиционные радиевые. Такие светосоставы постоянного действия используют для изготовления указателей, шкал приборов и т.п. На их производство ежегодно расходуют сотни граммов трития.
Тритий присутствует и в человеческом организме. Он поступает в него с пищей, с вдыхаемым воздухом и через кожу. Интересно, что газообразный Т2 в 500 раз менее токсичен, чем тритиевая вода Т2О. Это объясняется тем, что молекулярный тритий, попадая с воздухом в легкие, затем быстро (примерно за 3 мин) выделяется из организма, тогда как тритий в составе воды задерживается в нем на 10 суток и успевает за это время передать ему значительную дозу радиации.
Тритий имеет важное значение в реакциях термоядерного синтеза:  , протекающих при взрыве водородной бомбы.
, протекающих при взрыве водородной бомбы.
refac.ru
Количество просмотров публикации Изотопы водорода - 1816
Водород образует три изотопа с массовыми числами 1, 2, 3:
– протий;
(
) – дейтерий;
(
) – тритий.
В природе водород находится в виде протия (99,98%). 0,0156% природного водорода приходится на долю ʼʼтяжелогоʼʼ водорода – дейтерия, масса которого вдвое больше массы протия. Протий и дейтерий не являются радиоактивными.
Впервые дейтерий был получен в виде тяжелой воды D2O путем электролиза природной воды.
Тяжелая вода D2O – вода, образованная атомами дейтерия. Необходимо отметить, что по своим физико-химическим свойствам отличается от Н2О:
| Н2О | D2O | |
| | 3,83 | |
| | 101,42 | |
| | 1 (при 20 ºС) | 1,1053 (при 20 ºС) |
Сегодня дейтерий получают из природной смеси путем изотопного обмена между водой и сероводородом: . Для получения 1 л тяжелой воды требуется 41 т воды и 135 т сероводорода.
Химические реакции в тяжелой воде протекают медленнее, по сравнению с обычной водой, водородные связи с участием дейтерия несколько сильнее обычных. Тяжёлая вода токсична. Тяжелая вода оказывает губительное действие на животных и человека. К примеру, замена 1/3 Н2О на D2O приводит к бесплодию, нарушению углеводного баланса и анемии.
При этом некоторые микроорганизмы способны жить в 70%-ной тяжёлой воде (простейшие) и даже в чистой тяжёлой воде (бактерии). Человек может без видимого вреда для здоровья выпить стакан тяжёлой воды, весь дейтерий будет выведен из организма через несколько дней. В этом отношении тяжёлая вода менее токсична, чем, к примеру, поваренная соль.
Тяжелая вода является промышленным продуктом и доступна в больших количествах. Производство тяжёлой воды очень энергоёмко, в связи с этим её стоимость довольно высока (ориентировочно 200 – 250 долларов за кг).
Ядра дейтерия имеют спин ядра равный 1, с этим связано использование тяжелой воды и других дейтерированных растворителей (дейтерохлороформ CDCl3) в спектроскопии ядерного магнитного резонанса. Тяжелая вода находит применение в ядерной технике в качестве замедлителя быстрых нейтронов, поскольку она быстро понижет энергию нейтронов ядерного деления, а также вследствие того, что дейтерий имеет низкое сечение захвата нейтронов (не поглощает нейтроны), чем водород, и, следовательно, заметно уменьшает нейтронный поток.
Дейтерий широко применяют при изучении механизмов реакции и при кинетических исследованиях.
От других изотопов тритий отличается тем, что он радиоактивен. В природе тритий встречается в очень малых количествах. Естественное содержание трития – 1 атом на 1018 атомов водорода, это результат ядерных реакций, протекающих вод действием космических лучей в верхних слоях атмосферы:
После испытаний термоядерного оружия (1954 ᴦ.) концентрация трития увеличилась в сотни раз, но в настоящее время она упала в результате запрета на испытания ядерного оружия в атмосфере. Низкое содержание трития в земной коре объясняется и его радиоактивностью с периодом полураспада 12,35 года . В последние годы основным источником техногенного трития в окружающей среде стали атомные электростанции, которые ежегодно выделяют несколько десятков килограммов трития.
Сегодня тритий получают в ядерных реакторах при облучении лития нейтронами: . Литий используют в виде сплава с магнием или алюминием, который удерживает в себе много трития, который освобождается при растворении облученного сплава в кислоте.
Прим. Наиболее удобный способ хранения трития состоит в превращении его в UT3 по реакции с мелко раздробленным ураном. Из данного соединения тритий легко освобождается при нагревании выше 400 ºС.
Тяжелая вода на базе трития T2O обладает сильной радиоактивностью. По этой причине обычно используют разбавленные растворы, содержащие 1% тритиевой воды. Тритий является чистым β-излучателем без примеси γ-компоненты, в связи с этим он относительно безопасен, так как β-частицы обладают низкой проникающей способностью, в связи с этим задерживаются листом бумаги или слоем воздуха в 3 мм. Тритий – один из наименее токсичных радиоизотопов.
Тритий может служить радиоактивной меткой для изучения различных природных процессов. Анализ атмосферного трития дает ценную информацию о космических лучах. А тритий в осадочных породах может свидетельствовать о перемещениях воздуха и влаги на Земле.
Наиболее богатые природные источники трития – дождь и снег, поскольку почти весь тритий, образующийся под действием космических лучей в атмосфере, переходит в воду. Интенсивность космической радиации изменяется с широтой, в связи с этим осадки, к примеру, в средней полосе России несут в несколько раз больше трития, чем тропические ливни. И совсем мало трития в дождях, которые идут над океаном, поскольку их источник – в основном та же океаническая вода, а ней трития немного. Понятно, что глубинный лед Гренландии или Антарктиды совсем не содержит трития – он там давно успел полностью распасться. Зная скорость образования трития в атмосфере, можно рассчитать, как долго влага находится в воздухе – с момента ее испарения с поверхности до выпадения в виде дождя или снега. Оказалось, что, к примеру, в воздухе над океаном данный срок составляет в среднем 9 дней.
Чаще всего тритий применяют как метку при изучении механизмов реакций и их кинетики.
Синтезированный тритий сравнительно дешев и находит применение в научных исследованиях и в промышленности. Широкое применение нашли тритиевые светящиеся краски, которые наносят на шкалы приборов. Эти светосоставы с точки зрения радиации менее опасны, чем традиционные радиевые. Такие светосоставы постоянного действия используют для изготовления указателей, шкал приборов и т.п. На их производство ежегодно расходуют сотни граммов трития.
Тритий присутствует и в человеческом организме. Он поступает в него с пищей, с вдыхаемым воздухом и через кожу. Интересно, что газообразный Т2 в 500 раз менее токсичен, чем тритиевая вода Т2О. Это объясняется тем, что молекулярный тритий, попадая с воздухом в легкие, затем быстро (примерно за 3 мин) выделяется из организма, тогда как тритий в составе воды задерживается в нем на 10 суток и успевает за это время передать ему значительную дозу радиации.
Тритий имеет важное значение в реакциях термоядерного синтеза: , протекающих при взрыве водородной бомбы.
referatwork.ru
Атом, молекула, ядерные свойства.
Строение атома.
В центре атома находится положительное заряженное ядро. Вокруг вращается отрицательно заряженный электрон.
Электронная формула: 1s1
m прот. = 1,00783 (а.е.м.)
m нейтр.= 1,00866 (а.е.м.)
m протона = m электрона
Изотопы.
Изотоп: 3Н (тритий — лат. Tritium, от греч. tritos — третий), T.
Краткая характеристика: сверхтяжелый радиоактивный изотоп водорода с массовым числом 3. Период полураспада 12,35 года. Открыт английскими учеными Э. Резерфордом, М. Л. Олифантом и П. Хартеком в 1934. Входит в состав термоядерного заряда. Распространение в природе.
Число протонов в ядре — 1. Число нейтронов в ядре — 2. Число нуклонов — 3.Е связи = 931,5(1*m пр.+2*m нейтр-М(Н3)) = 23,43 (МЭВ)Е удельн. = Е связи/N нуклонов = 7,81 (МЭВ/нукл.)
Альфа-распад невозможенБета-распад: H(Z=1,M=3)-->He(Z=2,M=3)+e(Z=-1,M=0)-0,47(МЭВ)Позитронный распад невозможенЭлектронный захват невозможен
Изотоп: 2H (дейтерий — лат. deuterium, от греч. deuteros — второй), D.
Краткая характеристика: тяжелый водород, стабильный изотоп водорода с массовым числом 2. Ядро атома (дейтрон) состоит из протона и нейтрона. С кислородом образует тяжелую воду. Открыт Г. Юри в 1932.
Изотоп: 1H (протий — лат. Protium от греч. protos — первый).
Краткая характеристика: стабильный и наиболее распространенный (99,98%) изотоп водорода с массовым числом 1. Ядро атома протия — протон.
Химические свойства водорода.
Атом водорода имеет всего один электрон, поэтому при образовании химических соединений может легко отдавать его, либо образовывать одну общую электронную пару, либо присоединять еще один электрон, образуя двухэлектронную внешнюю оболочку, как у благородного газа гелия. Из-за малого заряда ядра атом водорода сравнительно слабо притягивает электроны и может присоединять их только в том случае, когда другой элемент легко их отдает. Такими элементами являются щелочные и щелочноземельные металлы, которые при нагревавши в атмосфере водорода образуют солеобразные соединения — гидриды:
2 К+ Н2 = 2 КН (гидрид калия)Са + Н2 = СаН2 (гидрид кальция) Для водорода более характерны соединения, в которых он проявляет положительную степень окисления. Он взаимодействует со многими неметаллами. В зависимости от активности неметаллов реакция может протекать с различной скоростью. Так, со фтором водород взаимодействует всегда со взрывом:F2 + h3 = 2 НF {фтороводород) Хлор взаимодействует с водородом значительно спокойнее: в темноте и без нагревания реакция протекает довольно медленно, на свету — значительно быстрее, а при наличии инициатора (искра, нагревание) — моментально и со взрывом. Поэтому смесь хлора и водорода является гремучей и требует чрезвычайной осторожности в обращении. Водород хорошо горит в атмосфере хлора. Во всех случаях реакция водорода с хлором протекает по уравнениюН2 + Сl2 = 2 НСl (хлороводород) С бромом и иодом водород реагирует очень медленно.
С другими неметаллами водород реагирует либо при высокой температуре, либо при высоких. температуре и давлении. Например, с серой водород реагирует только при нагревании, а с азотом — при нагревании и высоком давлении: Н2 + S = Н2S (сероводород)3 h3 + N2 = 2 NН3 (аммиак) Водород может отнимать кислород или галогены от многих металлов и неметаллов. В этом случае он выступает как восстановитель:
СuСl2 + Н2 = Сu + 2 НСl Эти реакции используются в металлургии для получения свободных металлов. Они, как правило, протекают при высоких температурах. Чем активнее металл, тем более высокая температура требуется для его восстановления. Водород не поддерживает горение обычных горючих веществ (являющихся соединениями углерода). Так, зажжённая свеча гаснет в нём. Однако, например, кислород горит в атмосфере водорода. Отсюда видна относительность понятия «поддерживает» или «не поддерживает» горения. Обычно его относят именно к горению соединений углерода.
Сам водород горит и в чистом кислороде, и на воздухе, причём продуктом сгорания является вода. При поджигании смеси обоих газов («гремучего газа») взаимодействие протекает со взрывом. Если вместо поджигания привести эту смесь в соприкосновение с очень малым количеством мелко раздробленной платины (играющей роль катализатора), то реакция протекает быстро, но спокойно.
Реакция образования воды из водорода и кислорода сильно экзотермична:
2 Н2 + О2 = 2 Н2О + 573 кДж Помимо прямого соединения с кислородом водород способен отнимать его от оксидов многих элементов: Cu, Pb, Hg и др. В результате из оксида получается свободный элемент, например:
СuO + h3 = h3O + Cu + 130 кДж.
Однако эти реакции, в которых водород выступает как восстановитель, протекают лишь при нагревании. При высоких давлениях водород вытесняет некоторые металлы также из растворов их солей.
Опыт показывает, что химическая активность водорода иногда сильно повышается. Это наблюдается тогда, когда реагирующие с ним вещества находятся в непосредственном контакте с выделяющимся водородом. Повышенную активность такого водорода «в момент выделения» («in statu nascendi») объясняется тем, что реагируют не молекулы Н2, а атомы. Действительно, при реакциях получения водорода (например, действием цинка на кислоту) первоначально выделяются именно отдельные атомы. Если же у места их выделения имеется вещество, способное с ними реагировать, то такая реакция может происходить без предварительного образования молекул Н2.
Это представление было косвенно подтверждено, когда удалось получить атомарный водород в газообразном состоянии и изучить его реакционную способность. Оказалось, что он значительно активнее молекулярного. Так, атомарный водород уже при обычных условиях соединяется с серой, фосфором, мышьяком и т. д., восстанавливает оксиды многих металлов, вытесняет некоторые металлы (Cu, Pb, Ag и др.) из их солей и вступает в другие химические реакции, на которые при тех же условиях не способен обычный молекулярный водород.
При химических взаимодействиях с участием обычного водорода молекула его должна распадаться на атомы. Но сама реакция такого распада (диссоциация на атомы) сильно эндотермична:
Н2 + 435 кДж = Н + Н.
Очевидно, что затрачиваемая на эту реакцию энергия (энергия диссоциации) должна быть восполнена энергией, выделяющуюся при взаимодействии атомов водорода с введённым в реакцию веществом. Следовательно, можно ожидать, что реакция водорода, при которых выделяется менее 435 кДж/моль, не будет протекать самопроизвольно. В случае взаимодействия веществ с атомарным водородом такой затраты энергии на диссоциацию уже не требуется. Поэтому здесь и возможен значительно более широкий круг реакций.
Атомарный водород удобно получать действием на обычный водород тихого электрического разряда. При этом часть молекул распадается на атомы, которые под уменьшенным давлением соединяются в молекулы не моментально, благодаря чему и могут быть изучены химические свойства атомарного водорода. Аналогично водороду может быть получен в атомарном состоянии и кислород. Его химическая активность при переходе в атомарное состояние тоже резко возрастает.
Большое количество энергии, выделяющейся при образовании молекулы водорода, объясняет её устойчивость при обычных условиях. Вместе с тем оно же наводит на мысль о возможности термической диссоциации (разложения при нагревании) молекулы Н2, если сообщить ей достаточное количество тепла. Опыт показывает, что заметная термическая диссоциация водорода начинается примерно с 2000 °С и происходит тем в большей степени, чем выше температура. Наоборот, при понижении температуры отдельные атомы вновь соединяются в молекулы.
Термическая диссоциация водорода (под обычным давлением) характеризуется следующими данными:
| Абсолютная температура, К | 2000 | 2500 | 3000 | 3500 | 4000 | 5000 |
| Диссоциированная часть, % | 0,088 | 1,31 | 8,34 | 29,6 | 63,9 | 95,8 |
Переход водорода в атомарное состояние может вызываться также излучением с длинами волн менее 85 нм. Этим и обусловлено резкое преобладание атомарного водорода над молекулярным в космическом пространстве.
Соединение атомов водорода в молекулы протекает значительно быстрее на поверхности металлов, чем в самом газе. При этом металл воспринимает ту энергию, которая выделяется при образовании молекул и нагревании до очень высоких температур. Последнее создаёт возможность технического использования атомарного водорода для атомно-водородной сварки металлов: между двумя вольфрамовыми стержнями создаётся электрическая дуга, сквозь которую по облегающим стержни трубкам пропускается ток водорода. При этом часть молекул Н2 распадается на атомы, которые затем вновь соединяются на металлической поверхности, помещенной недалеко от дуги. Таким путём металл может быть нагрет выше 3500 °С. В этих условиях происходит быстрая и прочная сварка отдельных его кусков. Большим достоинством атомно-водородной сварки является равномерность нагрева, позволяющая сваривать даже тонкие металлические детали.
Соединение атомов водорода осуществляется гораздо легче на твёрдой поверхности. При реакции по схеме Н + Н = Н2 молекула водорода заключает в себе и кинетическую энергию обоих соединяющихся атомов, и энергию их взаимодействия. В сумме это даёт запас энергии, с избытком превышающий энергию диссоциации молекулы Н2 на атомы. Такая диссоциация не происходит только в том случае, если молекула быстро освобождается от избытка энергии, передавая его какой-либо другой частице. В самом газе это может осуществляться лишь путём тройного столкновения по схеме Н + Н + Х = Н2 + Х, где Х — частица, принимающая избыток энергии. Но вероятность тройного столкновения несравненно меньше вероятности двойного, и поэтому в газе рекомбинация (обратное соединение) атомов Н идёт сравнительно медленно. Напротив, у твёрдой поверхности к образованию молекулы может вести каждое двойное столкновение атомов Н, так как воспринимающая избыток энергии частица (в виде атома или молекулы вещества самой поверхности) всегда имеется.
Если в колбу электрической лампы ввести водород (вместо аргона), то около раскалённой вольфрамовой нити будут происходить частичная диссоциация молекул Н2 на атомы. Энергия рекомбинации последних на покрытой специальным составом (люминофором) внутренней поверхности колбы вызывает её интенсивное свечение. Было показано, что от таких ламп при равной мощности можно получить значительно больше света, чем от обычных.
Нахождение водорода в природе.
Водород является одним из наиболее распространённых элементов — его доля составляет 0,88% от массы всех трёх оболочек земной коры (атмосферы, гидросферы и литосферы), что при пересчёте на атомные проценты даёт цифру 15,5.
Основное количество этого элемента находится в связанном состоянии. Так, вода содержит его около 11 вес. %, глина — около 1,5% и т. д. В виде соединений с углеродом водород входит в состав нефти, горючих природных газов и всех организмов.
Свободный водород состоит из молекул Н2. Он часто содержится в вулканических газах. Частично он образуется также при разложении некоторых органических остатков. Небольшие его количества выделяются зелёными растениями. Атмосфера содержит около 10-5 объёмн. % водорода.
В природе водород образуется главным образом при разложении органических веществ, например целлюлозы или белков, некоторыми видами бактерий. Большие его количества освобождаются при коксовании угля; поэтому светильный и коксовый газы в среднем состоят на 50 объёмн. % из свободного водорода. В последнее время коксовый газ стали технически перерабатывать на водород, сжижая его и выделяя водород как трудно конденсирующийся газ.
www.ronl.ru
 На тему
На темуСредней школы № 64
Серазетдинова Диана -
Под руководством учителя химии
Захаровой Л.С.
Казань 2001г.
План:
1. Введение.
2. Водород. Положение элемента в периодической системе Д.И. Менделеева.
3. Водород в природе.
4. Получение водорода.
5. Так кто же виноват в нашей смерти?
6. Водород и Вселенная.
7. Список использованной литературы.
1.Введение.
Водород (Hudrogenium) был открыт в первой половине XVI века немецким врачом и естествоиспытателем Парацельсом. В 1776 г. Кавендиш (Англия) установил его свойства и указал отличия от других газов. Водород имеет три изотопа: протий ¹Н, дейтерий ²Н или D, тритий ³Н или Т. Их массовые числа равны 1, 2 и 3. Протий и дейтерий стабильны, тритий – радиоактивен (период полураспада 12,5 лет). В природных соединениях дейтерий и протий в среднем содержатся в отношении 1:6800 (по числу атомов). Тритий в природе находится в ничтожно малых количествах.
Ядро атома водорода ¹Н содержит один протон. Ядро дейтерия и трития включают не только протон, но и один, два нейтрона. Молекула водорода состоит из двух атомов. Приведем некоторые свойства, характеризующие атом и молекулу водорода:
Энергия ионизации атома, эВ 13,60
Сродство атома к электрону, эВ 0,75
Относительная электроотрицательность 2,1
Радиус атома, нм 0,046
Межъядерное расстояние в молекуле, нм 0,0741
Стандартная энтальпия диссоциации молекул при 25ºС436,1
2. Водород. Положение водорода в периодической таблице Д.И. Менделеева.
В самом конце XVIII и в начале XIХ века химия вступила в период установления количественных закономерностей: в 1803 году был сформулирован закон кратных отношений (вещества реагируют между собой в весовых отношениях, кратных химическим эквивалентам), а в 1814 году опубликована первая в истории химической науки таблица относительных атомных весов элементов. В этой таблице на первом месте оказался водород, а атомные массы других элементов выражались числами, близкими к целым.
Особое положение, которое с самого начала занял водород, не могло не привлечь внимания ученых, и в 1841 году химики смогли ознакомиться с теорией Уильяма Праута, развившего теорию Древнегреческих философов о единстве мира и предположившего, что все элементы образованы из водорода как из самого легкого элемента. Прауту возражал Й.Я. Берцелиус, как раз занимавшийся уточнением атомных весов: из его опытов следовало, что атомные веса элементов не находятся в целочисленных отношениях к атомному весу водорода. Но, возражали сторонники Праута, атомные веса определены еще недостаточно точно и в качестве примера ссылались на эксперименты Жана Стаса, который в 1840 году исправил атомный вес углерода с 11,26 (эта величина была установлена Берцелиусом) на 12,0.
И все же привлекательную гипотезу Праута пришлось на время оставить: вскоре тот же Стас тщательными и не подлежащими сомнению исследованиями установил, что, например, атомный вес хлора равен 35,45, т. е. никак не может быть выражен числом, кратным атомному весу водорода...
Но вот в 1869 году Дмитрий Иванович Менделеев создал свою периодическую классификацию элементов, положив в ее основу атомные веса элементов как их наиболее фундаментальную характеристику. И на первом месте в системе элементов, естественно, оказался водород.
С открытием периодического закона стадо ясно, что химические элементы образуют единый ряд, построение которого подчиняется какой-то внутренней закономерности. И это не могло вновь не вызвать к жизни гипотезу Праута, — правда, в несколько измененной форме: в 1888 году Уильям Крукс предположил, что все элементы, в том числе и водород, образованы путем уплотнения некоторой первичной материи, названной им протилом. А так как протил, рассуждал Крукс, по-видимому, имеет очень малый атомный вес, то отсюда понятно и возникновение дробных атомных весов.
Но вот что любопытно. Самого Менделеева необычайно занимал вопрос: а почему периодическая система должна начинаться именно с водорода? Что мешает существованию элементов с атомным весом, меньше единицы? И в качестве такого элемента в 1905 годуМенделеев называет… «мировой эфир». Более того, он помещает его в нулевую группу над гелием и рассчитывает его атомный вес — 0,000001! Инертный газ со столь малым атомным весом должен быть по мнению Менделеева, всепроникающим, а его упругие колебания могли бы объяснить световые явления...
Увы, атому предвидению великого ученого не было суждено сбыться. Но Менделеев был прав в том отношении, что элементы не построены из тождественных частиц: мы знаем теперь, что они построены из протонов, нейтронов и электронов.
Но позвольте, воскликнете вы, ведь протон — это ядро атома водорода. Значит Праут был все-таки прав? Да, он действительно был по-своему прав. Но это была, если можно так выразиться, преждевременная правота, потому что в то время ее нельзя было ни по-настоящему подтвердить, ни по-настоящему опровергнуть...
Впрочем, сам водород сыграл в истории развития научной мысли еще немалую роль. В 1913 году Нильс Бор сформулировал свои знаменитые постулаты, объяснившие на основе квантовой механики особенности строения атома и внутреннюю сущность закона периодичности. И теория Бора была признана потому, что рассчитанный на ее основе спектр водорода полностью совпал с наблюдаемым.
3. Водород в природе.
Водород встречается в свободном состоянии на Земле лишь в незначительных количествах. Иногда он выделяется вместе с другими газами при вулканических извержениях, а также из буровых скважин при добычи нефти. Но в виде соединений водород весьма распространен. Это видно уже из того, что он составляет девятую часть массы воды. Водород входит в состав всех животных и растительных организмов, нефти, каменного и бурого углей, природных газов и ряда минералов. На долю водорода из всей массы земной коры, считая воду и воздух, приходится около 1%. Однако при пересчете на проценты от общего числа атомов содержание водорода в земной коре 17%.
Водород самый распространенный элемент космоса. На его долю приходится около половины массы Солнца и большинства других звезд. Он содержится в газовых туманностях, в межзвездном газе, входит в состав звезд. В недрах звезд происходит превращение ядер атомов водорода в ядра атомов гелия. Этот процесс протекает с выделением энергии; для многих звезд, в том числе для Солнца, он служит главным источником энергии. Скорость процесса, т. е. количество ядер водорода, превращающихся в ядра гелия в одном кубическом метре за одну секунду, мала. Поэтому и количество энергии, выделяющейся за единицу времени в единице объема, мало. Однако, вследствие огромности массы Солнца, общее количество энергии, генерируемой и излучаемой Солнцем, очень велико. Оно соответствует уменьшению массы Солнца приблизительно на 4 млн. т в секунду.
4. Получение водорода.
Наиболее старый способ получения водорода — электролиз воды, при котором, пропуская постоянный ток, на катоде накапливают водород, а на аноде — кислород. Такая технология делает его слишком дорогим энергоносителем. Поэтому пока водород используется только для запуска космических аппаратов с водородно-кислородными двигателями. Чаще для получения водорода используют технологию горячей переработки водяного пара при температуре 700-900 °С с участием легкого бензина и тяжелого жидкого топлива, отбирающего кислород. Это тоже дорогой способ. Существует несколько проектов дешевого получения водорода. Например, предлагается построить в Гренландии несколько грандиозных электростанций, которые будут использовать талую воду ледников для производства электроэнергии, а энергия будет на месте затрачиваться на электролиз для получения водорода, его сжижения и транспортировку по трубопроводам и в танкерах в Европу и Америку. Другие проекты — использование энергии атомных и специальных солнечных электростанций для получения водорода путем электролиза воды.
Однако сама природа дает рецепт для получения водорода без огромных затрат энергии. На поверхности частиц взвесей в воде существуют адсорбированные и закрепленные на поверхности ферменты с высокой специфичностью каталитического действия. Они способны расщеплять одну-единственную связь в одном из веществ при очень высокой активности в обычных условиях. Иммобилизованные ферменты могут быть использованы для получения водорода. Представьте себе горсть порошка с иммобилизованным на частицах ферментом. Порошок засыпают в банку с водой, стоящую на солнце, и в ней начинается активное выделение водорода. Уже делаются попытки создания такого
«магического порошка».
Возможен также микробиологический способ получения водорода. В почве существует ряд микроорганизмов, которые выделяют водород в виде побочного продукта. В случае решения задачи дешевого получения водородного топлива и разработки технологии его накопления, хранения и транспортировки человечество получит неиссякаемый источник экологически чистого энергоносителя, встроенного в естественную систему круговорота воды. Наиболее старый способ получения водорода — электролиз воды, при котором, пропуская постоянный ток, на катоде накапливают водород, а на аноде — кислород. Такая технология делает его слишком дорогим энергоносителем. Поэтому пока водород используется только для запуска космических аппаратов с водородно-кислородными двигателями. Чаще для получения водорода используют технологию горячей переработки водяного пара при температуре 700-900 °С с участием легкого бензина и тяжелого жидкого топлива, отбирающего кислород. Это тоже дорогой способ. Существует несколько проектов дешевого получения водорода. Например, предлагается построить в Гренландии несколько грандиозных электростанций, которые будут использовать талую воду ледников для производства электроэнергии, а энергия будет на месте затрачиваться на электролиз для получения водорода, его сжижения и транспортировку по трубопроводам и в танкерах в Европу и Америку. Другие проекты — использование энергии атомных и специальных солнечных электростанций для получения водорода путем электролиза воды.
Однако сама природа дает рецепт для получения водорода без огромных затрат энергии. На поверхности частиц взвесей в воде существуют адсорбированные и закрепленные на поверхности ферменты с высокой специфичностью каталитического действия. Они способны расщеплять одну-единственную связь в одном из веществ при очень высокой активности в обычных условиях. Иммобилизованные ферменты могут быть использованы для получения водорода. Представьте себе горсть порошка с иммобилизованным на частицах ферментом. Порошок засыпают в банку с водой, стоящую на солнце, и в ней начинается активное выделение водорода. Уже делаются попытки создания такого «магического порошка».
Возможен также микробиологический способ получения водорода. В почве существует ряд микроорганизмов, которые выделяют водород в виде побочного продукта. В случае решения задачи дешевого получения водородного топлива и разработки технологии его накопления, хранения и транспортировки человечество получит неиссякаемый источник экологически чистого энергоносителя, встроенного в естественную систему круговорота воды.
5. Так кто же виноват в нашей смерти?
К смерти нас приводит дефицит протонов. Старение и его многочисленные лица, болезни, также являются результатом водородного дефицита. Организм без ионов водорода (протонов) не способен снять зеленый экран смерти и мы покидаем этот мир. Возникновение зеленого экрана зависит от дыхания кислородом воздуха, который сжигает розовый гем, превращая его в зеленый биливердин. Кислород — сильнейший окислитель. Но убирает зеленый экран водород (протон). Водород — сильнейший восстановитель. И если кислород — сжигатель, то водород — гаситель. Окисление и восстановление суть два противоположных процесса. Но эти процессы едины: одно не бывает без другого. Более того, там, где есть одно проявляется и прямо противоположное другое. Это хорошо видно на примере нашего дыхания. Биохимия называет дыхание биологическим окислением. Но та же биохимия дала дыханию и другое, более точное наименование. По-другому, дыхание — это отщепление водорода (протонов) от субстратов с помощью кислорода (дегидрирование субстратов). То есть согласно этому определению, кислород служит для того, чтобы получать ионы водорода. А мы уже знаем, для чего они нужны. Протоны нам дают возможность жить! Итак, кислород дыхания служит для получения протонов. Но значит, вполне справедливо и должно иметь место прямо противоположное явление, восстановление с помощью водорода, в результате чего мы должны повышать потребление кислорода. Но именно так это и происходит! Судите сами. Протон, убирая зеленый экран смерти, восстанавливает железо, увеличивает синтез гемоглобина и дыхательных ферментов. А это значит, что он позволяет увеличить объемы потребления кислорода воздуха, ибо есть, чем этот кислород принять! И главный признак старения организма, кислородный дефицит (гипоксия) исчезает. Таков фундаментальный закон Природы. Закон единства и борьбы противоположностей. (О нем — в последней главе). Без кислорода нет водорода, но и без водорода не бывать кислороду. С открытием Биочасов открылась дорога не только в долголетие, но и в «мечту всех мечт мечтее», в бессмертие! Но в чем же тогда дело? Почему мы все-таки умираем, несмотря на то, что между кислородом и водородом стоит причинно-следственный знак равенства? Секрет смерти в одной маленькой детали, можно сказать, в мелочи. Между кислородом и водородом можно было бы спокойно поставить знак равенства в том случае, если бы время нашей жизни в Биочасах Земли шло строго по кругу. А этого не происходит. Время идет по спирали, где каждый последующий годовой виток никогда не бывает точной копией витка предыдущего. Поэтому потраченная на производство протонов клеточная вода никогда не может быть полностью восполнена в годовом цикле окисления и восстановления. Мешает действие реликтового излучения Вселенной. Свою лепту в нашу смерть вносит и 11-летний цикл солнечной активности, связанный с вращением Солнца вокруг своей оси. Расстояние между годовыми витками спирали времени называется шагом. Шаг спирали жизни никогда не бывает постоянным. Шаг, учитываемый после прекращения периода роста, равен годовому дефициту протона. Получается, что при самом общем рассмотрении вопроса жизни и смерти человека, причиной смерти можно назвать дыхание кислородом воздуха. При ближайшем рассмотрении проблемы причиной смерти можно назвать водородный дефицит организма. При более пристальном взгляде на вещи, причиной смерти является спиральный ход времени в Биочасах относительно реликтового излучения Вселенной. Ну а при расследовании с пристрастием причиной смерти является реликтовое излучение Вселенной и периодическая активность Солнца в его 11-летнем цикле. Именно они не позволяют воспроизводить на Земле одно и то же время из года в год, а посему мы умираем. Но кто есть кто в этой фундаментальной причине? Ответ прост. Реликтовое излучение является радиоволнами, а Солнце сводит нас в могилу оранжевыми лучами своего спектра. Именно радиоволны и оранжевые лучи останавливают колебания весов Жизни в Биочасах, блокируя нашу печень, почку, толстую кишку, кору головного мозга, сердечную сумку, костный мозг и кости, желудок, мочевой пузырь. Но… Именно оранжевые лучи и радиоволны помогают снять нам зеленый экран смерти. Так почему же мы умираем? Что причина нашей смерти? Ответ все тот же: дефицит ионов водорода (протонов) суть причина смерти человека и всего живого на планете Земля. Да, никто не может погасить радиоволны реликтового излучения Вселенной, никто не может остановить движение и вращение Солнца, но никто не может запретить каждому из нас восполнить водородный дефицит и замкнуть спираль времени в кольцо времени. А в песне поется, что «у кольца начала нет и нет конца».
6. Водород и Вселенная.
Слова «дейтерий» и «тритий» напоминают нам о том, что сегодня человек располагает мощнейшим источником энергии, высвобождающейся при реакции
21 Н + 31 Н 42 He + n0 + 17,6 Мэв.
Эта реакция начинается при десяти миллионах градусов и протекает за ничтожные доли секунды при взрыве термоядерной бомбы, причем выделяется гигантское' по масштабам Земли количество энергии.
Водородные бомбы иногда сравнивают с Солнцем. Однако мы уже видели, что на Солнце идут медленные и стабильные термоядерные процессы. Солнце дарует нам жизнь, а водородная бомба — сулит смерть...
Но когда-нибудь настанет время,— и это время не за горами,—когда мерилом ценности станет не золото, а энергия. И тогда изотопы водорода спасут человечество от надвигающегося энергетического голода: в управляемых термоядерных процессах каждый литр природной воды будет давать столько же энергии, сколько ее дают сейчас триста литров бензина. И человечество будет с недоумением вспоминать, что было время, когда люди угрожали друг другу животворным источником тепла и света...
Список использованной литературы:
1. Большой энциклопедический словарь
2. «Основы общей химии» Г.И. Новиков — Москва, 1988г. «Высшая школа»
3. Справочник по химии 8-11 кл.
4. Учебное пособие для химико-технологических специальных ВУЗов
5. «Вариации на тему одной планеты», Франц Шебек Москва, 1977г.
6. «Семь чудес и другие», В.З. Черняк — Москва, 1990г.
www.ronl.ru
Атом, молекула, ядерные свойства.
Строение атома.
В центре атома находится положительное заряженное ядро. Вокруг вращается отрицательно заряженный электрон.
Электронная формула: 1s1
m прот. = 1,00783 (а.е.м.)
m нейтр.= 1,00866 (а.е.м.)
m протона = m электрона
Изотопы.
Изотоп: 3Н (тритий - лат. Tritium, от греч. tritos — третий), T.
Краткая характеристика: сверхтяжелый радиоактивный изотоп водорода с массовым числом 3. Период полураспада 12,35 года. Открыт английскими учеными Э. Резерфордом, М. Л. Олифантом и П. Хартеком в 1934. Входит в состав термоядерного заряда. Распространение в природе.
Число протонов в ядре - 1. Число нейтронов в ядре - 2. Число нуклонов - 3.Е связи = 931,5(1*m пр.+2*m нейтр-М(Н3)) = 23,43 (МЭВ)Е удельн. = Е связи/N нуклонов = 7,81 (МЭВ/нукл.)
Альфа-распад невозможенБета-распад: H(Z=1,M=3)-->He(Z=2,M=3)+e(Z=-1,M=0)-0,47(МЭВ)Позитронный распад невозможенЭлектронный захват невозможен
Изотоп: 2H (дейтерий - лат. deuterium, от греч. deuteros — второй), D.
Краткая характеристика: тяжелый водород, стабильный изотоп водорода с массовым числом 2. Ядро атома (дейтрон) состоит из протона и нейтрона. С кислородом образует тяжелую воду. Открыт Г. Юри в 1932.
Изотоп: 1H (протий - лат. Protium от греч. protos — первый).
Краткая характеристика: стабильный и наиболее распространенный (99,98%) изотоп водорода с массовым числом 1. Ядро атома протия — протон.
Химические свойства водорода.
Атом водорода имеет всего один электрон, поэтому при образовании химических соединений может легко отдавать его, либо образовывать одну общую электронную пару, либо присоединять еще один электрон, образуя двухэлектронную внешнюю оболочку, как у благородного газа гелия. Из-за малого заряда ядра атом водорода сравнительно слабо притягивает электроны и может присоединять их только в том случае, когда другой элемент легко их отдает. Такими элементами являются щелочные и щелочноземельные металлы, которые при нагревавши в атмосфере водорода образуют солеобразные соединения - гидриды:
2 К+ Н2 = 2 КН (гидрид калия)Са + Н2 = СаН2 (гидрид кальция) Для водорода более характерны соединения, в которых он проявляет положительную степень окисления. Он взаимодействует со многими неметаллами. В зависимости от активности неметаллов реакция может протекать с различной скоростью. Так, со фтором водород взаимодействует всегда со взрывом:F2 + h3 = 2 НF {фтороводород) Хлор взаимодействует с водородом значительно спокойнее: в темноте и без нагревания реакция протекает довольно медленно, на свету - значительно быстрее, а при наличии инициатора (искра, нагревание) - моментально и со взрывом. Поэтому смесь хлора и водорода является гремучей и требует чрезвычайной осторожности в обращении. Водород хорошо горит в атмосфере хлора. Во всех случаях реакция водорода с хлором протекает по уравнениюН2 + Сl2 = 2 НСl (хлороводород) С бромом и иодом водород реагирует очень медленно.
С другими неметаллами водород реагирует либо при высокой температуре, либо при высоких. температуре и давлении. Например, с серой водород реагирует только при нагревании, а с азотом - при нагревании и высоком давлении:Н2 + S = Н2S (сероводород)3 h3 + N2 = 2 NН3 (аммиак) Водород может отнимать кислород или галогены от многих металлов и неметаллов. В этом случае он выступает как восстановитель:
СuСl2 + Н2 = Сu + 2 НСl Эти реакции используются в металлургии для получения свободных металлов. Они, как правило, протекают при высоких температурах. Чем активнее металл, тем более высокая температура требуется для его восстановления. Водород не поддерживает горение обычных горючих веществ (являющихся соединениями углерода). Так, зажжённая свеча гаснет в нём. Однако, например, кислород горит в атмосфере водорода. Отсюда видна относительность понятия "поддерживает" или "не поддерживает" горения. Обычно его относят именно к горению соединений углерода.
Сам водород горит и в чистом кислороде, и на воздухе, причём продуктом сгорания является вода. При поджигании смеси обоих газов ("гремучего газа") взаимодействие протекает со взрывом. Если вместо поджигания привести эту смесь в соприкосновение с очень малым количеством мелко раздробленной платины (играющей роль катализатора), то реакция протекает быстро, но спокойно.
Реакция образования воды из водорода и кислорода сильно экзотермична:
2 Н2 + О2 = 2 Н2О + 573 кДж Помимо прямого соединения с кислородом водород способен отнимать его от оксидов многих элементов: Cu, Pb, Hg и др. В результате из оксида получается свободный элемент, например:
СuO + h3 = h3O + Cu + 130 кДж.
Однако эти реакции, в которых водород выступает как восстановитель, протекают лишь при нагревании. При высоких давлениях водород вытесняет некоторые металлы также из растворов их солей.
Опыт показывает, что химическая активность водорода иногда сильно повышается. Это наблюдается тогда, когда реагирующие с ним вещества находятся в непосредственном контакте с выделяющимся водородом. Повышенную активность такого водорода "в момент выделения" ("in statu nascendi") объясняется тем, что реагируют не молекулы Н2, а атомы. Действительно, при реакциях получения водорода (например, действием цинка на кислоту) первоначально выделяются именно отдельные атомы. Если же у места их выделения имеется вещество, способное с ними реагировать, то такая реакция может происходить без предварительного образования молекул Н2.
Это представление было косвенно подтверждено, когда удалось получить атомарный водород в газообразном состоянии и изучить его реакционную способность. Оказалось, что он значительно активнее молекулярного. Так, атомарный водород уже при обычных условиях соединяется с серой, фосфором, мышьяком и т. д., восстанавливает оксиды многих металлов, вытесняет некоторые металлы (Cu, Pb, Ag и др.) из их солей и вступает в другие химические реакции, на которые при тех же условиях не способен обычный молекулярный водород.
При химических взаимодействиях с участием обычного водорода молекула его должна распадаться на атомы. Но сама реакция такого распада (диссоциация на атомы) сильно эндотермична:
Н2 + 435 кДж = Н + Н.
Очевидно, что затрачиваемая на эту реакцию энергия (энергия диссоциации) должна быть восполнена энергией, выделяющуюся при взаимодействии атомов водорода с введённым в реакцию веществом. Следовательно, можно ожидать, что реакция водорода, при которых выделяется менее 435 кДж/моль, не будет протекать самопроизвольно. В случае взаимодействия веществ с атомарным водородом такой затраты энергии на диссоциацию уже не требуется. Поэтому здесь и возможен значительно более широкий круг реакций.
Атомарный водород удобно получать действием на обычный водород тихого электрического разряда. При этом часть молекул распадается на атомы, которые под уменьшенным давлением соединяются в молекулы не моментально, благодаря чему и могут быть изучены химические свойства атомарного водорода. Аналогично водороду может быть получен в атомарном состоянии и кислород. Его химическая активность при переходе в атомарное состояние тоже резко возрастает.
Большое количество энергии, выделяющейся при образовании молекулы водорода, объясняет её устойчивость при обычных условиях. Вместе с тем оно же наводит на мысль о возможности термической диссоциации (разложения при нагревании) молекулы Н2, если сообщить ей достаточное количество тепла. Опыт показывает, что заметная термическая диссоциация водорода начинается примерно с 2000 °С и происходит тем в большей степени, чем выше температура. Наоборот, при понижении температуры отдельные атомы вновь соединяются в молекулы.
Термическая диссоциация водорода (под обычным давлением) характеризуется следующими данными:
| Абсолютная температура, К | 2000 | 2500 | 3000 | 3500 | 4000 | 5000 |
| Диссоциированная часть, % | 0,088 | 1,31 | 8,34 | 29,6 | 63,9 | 95,8 |
Переход водорода в атомарное состояние может вызываться также излучением с длинами волн менее 85 нм. Этим и обусловлено резкое преобладание атомарного водорода над молекулярным в космическом пространстве.
Соединение атомов водорода в молекулы протекает значительно быстрее на поверхности металлов, чем в самом газе. При этом металл воспринимает ту энергию, которая выделяется при образовании молекул и нагревании до очень высоких температур. Последнее создаёт возможность технического использования атомарного водорода для атомно-водородной сварки металлов: между двумя вольфрамовыми стержнями создаётся электрическая дуга, сквозь которую по облегающим стержни трубкам пропускается ток водорода. При этом часть молекул Н2 распадается на атомы, которые затем вновь соединяются на металлической поверхности, помещенной недалеко от дуги. Таким путём металл может быть нагрет выше 3500 °С. В этих условиях происходит быстрая и прочная сварка отдельных его кусков. Большим достоинством атомно-водородной сварки является равномерность нагрева, позволяющая сваривать даже тонкие металлические детали.
Соединение атомов водорода осуществляется гораздо легче на твёрдой поверхности. При реакции по схеме Н + Н = Н2 молекула водорода заключает в себе и кинетическую энергию обоих соединяющихся атомов, и энергию их взаимодействия. В сумме это даёт запас энергии, с избытком превышающий энергию диссоциации молекулы Н2 на атомы. Такая диссоциация не происходит только в том случае, если молекула быстро освобождается от избытка энергии, передавая его какой-либо другой частице. В самом газе это может осуществляться лишь путём тройного столкновения по схеме Н + Н + Х = Н2 + Х, где Х - частица, принимающая избыток энергии. Но вероятность тройного столкновения несравненно меньше вероятности двойного, и поэтому в газе рекомбинация (обратное соединение) атомов Н идёт сравнительно медленно. Напротив, у твёрдой поверхности к образованию молекулы может вести каждое двойное столкновение атомов Н, так как воспринимающая избыток энергии частица (в виде атома или молекулы вещества самой поверхности) всегда имеется.
Если в колбу электрической лампы ввести водород (вместо аргона), то около раскалённой вольфрамовой нити будут происходить частичная диссоциация молекул Н2 на атомы. Энергия рекомбинации последних на покрытой специальным составом (люминофором) внутренней поверхности колбы вызывает её интенсивное свечение. Было показано, что от таких ламп при равной мощности можно получить значительно больше света, чем от обычных.
Нахождение водорода в природе.
Водород является одним из наиболее распространённых элементов - его доля составляет 0,88% от массы всех трёх оболочек земной коры (атмосферы, гидросферы и литосферы), что при пересчёте на атомные проценты даёт цифру 15,5.
Основное количество этого элемента находится в связанном состоянии. Так, вода содержит его около 11 вес. %, глина - около 1,5% и т. д. В виде соединений с углеродом водород входит в состав нефти, горючих природных газов и всех организмов.
Свободный водород состоит из молекул Н2. Он часто содержится в вулканических газах. Частично он образуется также при разложении некоторых органических остатков. Небольшие его количества выделяются зелёными растениями. Атмосфера содержит около 10-5 объёмн. % водорода.
В природе водород образуется главным образом при разложении органических веществ, например целлюлозы или белков, некоторыми видами бактерий. Большие его количества освобождаются при коксовании угля; поэтому светильный и коксовый газы в среднем состоят на 50 объёмн. % из свободного водорода. В последнее время коксовый газ стали технически перерабатывать на водород, сжижая его и выделяя водород как трудно конденсирующийся газ.
www.yurii.ru
Изотопы водорода - раздел Химия, ОСНОВЫ НЕОРГАНИЧЕСКОЙ ХИМИИ
Атомная масса элемента, указанная в периодической системе, определяется как средняя величина из масс всех его изотопов, взятых в процентном отношении, отвечающем их распространенности в природе. Поэтому атомные массы имеют дробные значения. Атомы разных элементов, имеющие разный заряд ядра, но одинаковую атомную массу, называются изобарами. Например, атом 4018Ar и 4019K являются изобарами, атомы 3918Ar и 3919K также являются изобарами.
Электроны в атоме располагаются по электронным слоям, или энергетическим уровнями. Максимальное число электронов на данном энергетическом уровне определяется формулой N=2n2, где n-номер уровня (считая от ядра).
Согласно этой формуле, в первом электронном слое может разместиться не более 2 электронов, во втором – не более 8, в третьем – не более 18, в четвертом – не более 32 и т.д.
| n=1 | N=2n2=2 |
| n=2 | N=2n2=8 |
| n=3 | N=2n2=18 |
| n=4 | N=2n2=32 |
(Более детальное заполнение электронных слоев 2, 8, 18-ю и т.д. электронами рассматривается на основе квантовых чисел.)
Заряд ядра атома (порядковый номер элемента в периодической системе элементов) определяет общее число электронов в атоме и, как следствие его, число внешних электронов. Например, элемент №9 – фтор, имеет 9 электронов, которые распределяются в соответствии с законами построения электронных оболочек следующим образом: 2, 7.
Элемент №10, неон, имеет 10 электронов, закономерно распределяющихся по слоям: 2, 8. У элемента №11, натрия, распределение электронов соответственно 2, 8, 1. Все три элемента имеют различное строение внешнего электронного слоя.
Электроны внешних слоев называются валентными и определяют химические свойства атома. При этом все химические элементы можно разделить на три основные группы. Элементы, атомы которых имеют 1-3 внешних электрона, являются металлами и легко отдают эти электроны при химических реакциях. Элементы, атомы которых имеют 4-7 внешних электронов, относятся к неметаллам и склонны принимать электроны от других атомов до завершения внешнего электронного слоя (до устойчивого октета). Атомы, имеющие завершенный внешний электронный слой (2 или 8 электронов), не склонны вступать в химические реакции и являются химически инертными.
В приведенном примере (9F, 10N, 11Na) даже небольшое изменение величины заряда ядра приводит к значительному изменению в химических свойствах элементов, что еще раз подчеркивает фундаментальное значение такой характеристики атома, как заряд ядра.
Современная формулировка периодического закона гласит:свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от зарядов их ядер (порядковых номеров элементов в периодической системе).
Периодическая система содержит 7 периодов (3 малых и 4 больших) и 8 групп, что соответствует максимальному числу электронов во внешних подоболочках. Группы делятся на главные (основные) и побочные подгруппы.
Подгруппой называется вертикальный ряд элементов, имеющих сходное строение внешнего электронного слоя и близкие химические свойства. Главные подгруппы содержат элементы малых и больших периодов. Побочные подгруппы содержат элементы только больших периодов.
Группа объединяет элементы, имеющие одинаковую высшую валентность (валентность по кислороду). Высшая валентность равна номеру группы (исключения: O, F; Cu, Ag, Au; Fe, Co, Ni и некоторые другие элементы). Подгруппы включают в себя элементы с аналогичными электронными структурами (элементы - аналоги). К главным подгруппам (подгруппам А) относятся подгруппы элементов второго периода: Li, Be, B, C, N, O, F и подгруппа благородных газов. К побочным подгруппам (подгруппам В) принадлежат d- и f- элементы. Первые шесть d- элементов от (Se до Fe) начинают соответствующие подгруппы от подгруппы III (Se) до подгруппы VIII (Fe). В подгруппу VIII также включаются все элементы семейства железа (Fe, Co, Ni) и их аналоги – платиновые металлы. Медь и ее аналоги, имеющие во внешней s- подоболочке по одному электрону, образуют первую побочную подгруппу. Лантоноиды и актиноиды (f- элементы) находятся в III подгруппе в соответствие с особенностями их электронных конфигураций.
Периодом называется горизонтальный ряд элементов, начинающийся щелочным металлом и заканчивающийся инертным газом. Исключение из этого правила представляет самый короткий I период, начинающийся водородом. Период это последовательный ряд элементов, размещенных в порядке возрастания заряда ядра атомов, электронная конфигурация которых изменяется от ns1 до ns2 np6 (или до ns2 у первого периода). Периоды начинаются с s- элемента и заканчиваются p- элементом (у первого периода s- элементом). Малые периоды содержат 2 и 8 элементов, большие периоды – 18 и 32 элемента, седьмой период остается незавершенным.
В периодической системе строго соблюдается ряд закономерностей, связанных со строением электронных оболочек атомов. Эти закономерности таковы:
-Число электронных слоев в атоме элемента равно номеру периода, в котором данный элемент находится. Например, у атома H и He всего один электронный слой, у атома C – два электронных слоя, у атома Cl – три, у атома Fr – семь и т.д.
-Для элементов главных подгрупп число электронов во внешнем электронном слое атома равно номеру группы, в которой находится данный элемент. Например, атом натрия находится в I группе и имеет 1 электрон в наружном слое, атом кремния находится в IV группе и имеет 4 электрона в наружном слое, атомы инертных газов расположены в VIII группе и имеют 8 внешних электронов.
Электроны (1-7) незавершенного внешнего слоя участвуют в образовании химических связей и являются валентными.
В побочных подгруппах распределение валентных электронов более сложное, чем в главных подгруппах. Общее число подвижных валентных электронов также равно номеру группы, но только 2 (реже 1) из них находятся во внешнем слое, а остальные помещаются в предпоследний слой. Например, в атоме марганца (элемент 7-й группы периодической системы) электроны распределены следующим образом:

-В периодической системе сверху вниз по группе увеличивается металлическая активность элементов, т.е. способность отдавать электроны (поскольку с ростом порядкового номера растет число электронных слоев и ослабевает связь внешних электронов с ядром).
-В периодической системе слева направо по периоду увеличивается неметаллическая активность, т.е. способность принимать электроны (поскольку с ростом порядкового номера увеличивается число электронов во внешнем электронном слое, отдавать их становится все труднее, более выгодной будет тенденция дополнить внешний слой до устойчивой восьми электронной оболочки).В соответствии с вышеприведенными закономерностями самым активным металлом является франций, самым активным неметаллом является фтор. Вблизи диагонали, разделяющей эти два полюса, расположены элементы переходного и амфотерного характера: бор, алюминий, германий, мышьяк, теллур, астат и др. Необходимо уметь свободно ориентироваться в закономерностях периодической системы; по месту нахождения элемента в таблице рассказать о его свойствах, характерных валентных состояниях, важнейших соединениях.
– Конец работы –
Эта тема принадлежит разделу:
ОСНОВЫ... НЕОРГАНИЧЕСКОЙ ХИМИИ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Изотопы водорода
Основные законы и понятия химии Раздел химии, рассматривающий количественный состав веществ и количественные соотношения (массовые, объем
Химическая символика Современные символы химических элементов были введены в 1813 г. Берцелиусом. Элементы обозначаются начальны
Латинские корни некоторых элементов Порядковый номер в таблице периодической системы Символ Русское название
Групповые названия элементов Название группы элементов Элементы группы Благородные газы He, N
Названия наиболее часто употребляемых кислот и кислотных остатков Формулы кислоты Название кислоты Формула кислотного остатка Название кисл
Получение кислот 1 . Взаимодействие кислотных оксидов (большинства) с водой: SO3 + Н2О=h3SO4;
Номенклатура неорганических соединений (по правилам ИЮПАК) ИЮПАК – международный союз теоретической и прикладной химии. Правила ИЮПАК 1970 г. являются международной мо
Первые модели атома В 1897 г. Дж. Томсон (Англия) открыл электрон, а в 1909г. Р. Малликен определил его заряд, который равен 1,6 · 10-19
Атомные спектры При нагреве вещество испускает лучи (излучение). Если излучение имеет одну длину волны, то оно назы
Кванты и модель Бора В 1900 г. М. Планк (Германия) высказал предположение, что вещества поглощают и испускают энергию дискретными п
Двойственная природа электрона В 1905 г. А. Эйнштейн предсказал, что любое излучение представляет собой поток квантов энергии, называемых фот
Энергетические подуровни Орбитальное квантовое число l Форма электронного облака в подуровне Изменен
Значения квантовых чисел и максимальное число электронов на квантовых уровнях и подуровнях Квантовый Магнитное квантовое число ml Число кванто-вых состояний (орбитале
Периодическая система элементов Д.И. Менделеева и электронная структура атомов Рассмотрим связь между положением элемента в периодической системе и электронным строением его атомов. У к
Электронные конфигурации элементов первых двух периодов Атом-ный номер Элемент Электрон-ные кон-фигурации Атом-ный номер Элеме
Электронные конфигурации элементов Пе-риод Поряд-ковый номер Эле-мент Элект-ронная конфи-гурация Пе-риод
Периодические свойства элементов Так как электронное строение элементов изменяется периодически, то соответственно периодически изменяют
Электроотрицательность элементов по Полингу Н 2,1
Степени окисления мышьяка, селена, брома Элемент Степень окисления Соединения высшая &n
Сокращенные и полные уравнения ядерных реакций Сокращенные уравнения Полные уравнения 27Al(p,
Определение химической связи Свойства веществ зависят от их состава, строения, от типа химической связи между атомами в веществе. Х
Ионная связь При образовании любой молекулы, атомы этой молекулы «связываются» друг с другом. Причина образования молек
Ковалентная связь Химическая связь, осуществляемая за счет перекрывания электронных облаков взаимодействующих атомов, на
Метод валентных связей (МВС, ВС) Для глубокого понимания сущности ковалентной связи, характера распределения электронной плотности в моле
Метод молекулярных орбиталей (ММО, МО) Хронологически метод МО появился позже метода ВС, поскольку оставались в теории ковалентной связи вопрос
Основные положения ММО, МО. 1. В молекуле все электроны являются общими. Сама молекула — это единое целое, совокупность ядер и электроно
Гибридизация орбиталей и пространственная конфигурация молекул Тип молекулы Исходные орбитали атома А Тип гибридизации Число
Металлическая связь Само название говорит, что речь пойдет о внутренней структуре металлов. Атомы большинства металлов на внеш
Водородная связь Водородная связь — это своеобразная химическая связь. Она возникает между молекулами, в состав которых вхо
Взаимодействия между молекулами При сближении молекул появляется притяжение, что обусловливает возникновение конденсированного состоян
Вклад отдельных составляющих в энергию межмолекулярного взаимодействия Ве-щест-во Элект-ричес-кий момент диполя, D Поля-ризуе-мость, м3∙1030
Общие понятия При протекании химических реакций изменяется энергетическое состояние системы, в которой идет эта реакци
Внутренняя энергия. Первый закон термодинамики При химических реакциях происходят глубокие качественные изменения в системе, рвутся связи в исходных вещ
Энтальпия системы. Тепловые эффекты химических реакций Теплота Q и работа A функциями состояния не являются, ибо они служат формами передачи энергии и связаны с про
Термохимические расчеты Термохимические расчеты основаны на законе Гесса, позволяющее рассчитать энтальпию химической реакции:
Стандартные теплоты (энтальпии) образования некоторых веществ Вещ
Химическое сродство. Энтропия химических реакций. Энергия Гиббса Самопроизвольно могут протекать реакции, сопровождающиеся не только выделением, но и поглощением теплоты
Второй и третий законы термодинамики Для систем, которые не обмениваются с окружающей средой ни энергией, ни веществом (изолированные системы), в
Понятие о скорости химических реакций Скоростью химической реакции называется число элементарных актов реакции, происходящих в единицу времен
Зависимость скорости реакции от концентрации реагентов Чтобы атом и молекулы смогли вступить в реакцию, необходимо их столкновение друг с другом, так как силы хими
Влияние температуры на скорость реакции Зависимость скорости реакции от температуры определя-ется правилом Вант-Гоффа, согласно которому при пов
Энергия активации Быстрое изменение скорости реакции с изменением температуры объясняет теория активации. Почему нагревани
Понятие о катализе и катализаторах Катализом называется изменение скорости химических реакций в присутствии веществ – катализаторов. Ка
Химическое равновесие. Принцип Ле Шателье Реакции, которые протекают в одном направлении и идут до конца, называются необратимыми. Их не так много
Способы выражения концентрации растворов Концентрацией раствора называется содержание растворенного вещества в определенной массе или известном
Коллигативные свойства растворов Коллигативными являются свойства растворов, которые зависят от концентрации и практически не зав
Растворы электролитов Примерами растворов электролитов могут служить растворы щелочей, солей и неорганических кислот в воде, рас
В растворах при 298 К Концентрация, моль/1000г Н2О Коэффициент активности для электролитов NaCl
Гидролиз солей Химическое обменное взаимодействие ионов растворен-ной соли с водой, приводящее к образованию слабодисcоц
Константы и степени диссоциации некоторых слабых электролитов Электролиты Формула Численные значе-ния констант диссоциации Степень диссо-ц
Процессы Окислительно-восстановительными называют реакции, сопровождающиеся изменением степени окисления атомов,
Валентности и степени окисления атомов в некоторых соединениях Моле-кула Ион-ность связи, % Атом Кова-лент-ность Электро-валент-ность
Окислительно-восстановительные реакции Рассмотрим основные положения теории окислительно-восстановительных реакций. 1. Окислением назыв
Важнейшие восстановители и окислители Восстановители Окислители Металлы, водород, уголь Оксид углерода (II) СО Серов
Составление уравнений окислительно-восстановительных реакций Для составления уравнений окислительно-восстанови-тельных реакций и определения коэффициентов применяют
Определение комплексных соединений Такие соединения, как оксиды, кислоты, основания, соли образованы из атомов в результате возникнов
Лиганды К числу лигандов относятся простые анионы, такие как F-, СI-, Вr-, I-, S2-, сложные а
Номенклатура комплексных соединений Название комплексного катиона записывается одним словом, начинающимся с названия отрицательного лиганда
Диссоциация комплексных соединений Комплексные соединения — неэлектролиты в водных растворах диссоциации не подвергаются. У них отсутствует
Константы устойчивости комплексов Для характеристики устойчивости (прочности) комплексного иона применяют также величину, обратную
Роль комплексных соединений Комплексные соединения широко распространены в природе. В состав многих растений и живых организмов вход
allrefers.ru
Реферат на тему:
Водоро́д (калька с латинского: лат. Hydrogenium — hydro = «вода», gen = «порождающий»; hydrogenium — «порождающий воду»; обозначается символом H) — первый элемент периодической системы элементов. Широко распространён в природе. Катион (и ядро) самого распространённого изотопа водорода 1H — протон. Свойства ядра 1H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
Три изотопа водорода имеют собственные названия: 1H — протий (Н), 2H — дейтерий (D) и 3H — тритий (радиоактивен) (T).
Простое вещество водород — h3 — лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен[2]. Растворим в этаноле и ряде металлов: железе, никеле, палладии, платине.
Выделение горючего газа при взаимодействии кислот и металлов наблюдали в XVI и XVII веках на заре становления химии как науки. Прямо указывал на выделение его и Михаил Васильевич Ломоносов, но уже определённо сознавая, что это не флогистон. Английский физик и химик Генри Кавендиш в 1766 году исследовал этот газ и назвал его «горючим воздухом». При сжигании «горючий воздух» давал воду, но приверженность Кавендиша теории флогистона помешала ему сделать правильные выводы. Французский химик Антуан Лавуазье совместно с инженером Ж. Менье, используя специальные газометры, в 1783 г. осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом. Таким образом он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
Лавуазье дал водороду название hydrogène (от др.-греч. ὕδωρ — вода и γεννάω — рождаю) — «рождающий воду». Русское наименование «водород» предложил химик М. Ф. Соловьев в 1824 году — по аналогии с «кислородом» М. В. Ломоносова .
Водород — самый распространённый элемент во Вселенной. На его долю приходится около 92 % всех атомов (8 % составляют атомы гелия, доля всех остальных вместе взятых элементов — менее 0,1 %). Таким образом, водород — основная составная часть звёзд и межзвёздного газа. В условиях звёздных температур (например, температура поверхности Солнца ~ 6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17 % (второе место после кислорода, доля атомов которого равна ~ 52 %). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода. В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005 % по объёму).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках. В живых клетках по числу атомов на водород приходится почти 50 %.
Промышленные способы получения простых веществ зависят от того, в каком виде соответствующий элемент находится в природе, то есть что может быть сырьём для его получения. Так, кислород, имеющийся в свободном состоянии, получают физическим способом — выделением из жидкого воздуха. Водород же практически весь находится в виде соединений, поэтому для его получения применяют химические методы. В частности, могут быть использованы реакции разложения. Одним из способов получения водорода служит реакция разложения воды электрическим током.
Основной промышленный способ получения водорода — реакция с водой метана, который входит в состав природного газа. Она проводится при высокой температуре:
СН4 + 2Н2O = CO2↑ + 4Н2 −165 кДж
Один из лабораторных способов получения водорода, который иногда применяется и в промышленности, — разложение воды электротоком.
Обычно в лаборатории водород получают взаимодействием цинка с соляной кислотой.
1.Электролиз водных растворов солей:
2NaCl + 2h3O → h3↑ + 2NaOH + Cl22.Пропускание паров воды над раскаленным коксом при температуре около 1000 °C:
h3O + C ⇄ h3 + CO3.Из природного газа.
Конверсия с водяным паром: Ch5 + h3O ⇄ CO + 3h3 (1000 °C) Каталитическое окисление кислородом: 2Ch5 + O2 ⇄ 2CO + 4h34. Крекинг и риформинг углеводородов в процессе переработки нефти.
1.Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную соляную кислоту:
Zn + 2HCl → ZnCl2 + h3↑2.Взаимодействие кальция с водой:
Ca + 2h3O → Ca(OH)2 + h3↑3.Гидролиз гидридов:
NaH + h3O → NaOH + h3↑4.Действие щелочей на цинк или алюминий:
2Al + 2NaOH + 6h3O → 2Na[Al(OH)4] + 3h3↑ Zn + 2KOH + 2h3O → K2[Zn(OH)4] + h3↑5.С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
2h4O+ + 2e− → h3↑ + 2h3OСпектр излучения водорода
Эмиссионный спектр водорода
Водород — самый лёгкий газ, он легче воздуха в 14,5 раз. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях — это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н.у.), температура кипения −252,76 °C, удельная теплота сгорания 120.9×106 Дж/кг, малорастворим в воде — 18,8 мл/л. Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов на 1 объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.
Фазовая диаграмма водорода
Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см³) и текучая (вязкость при −253 °C 13,8 спуаз). Критические параметры водорода очень низкие: температура −240,2 °C и давление 12,8 атм. Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79 % пара-Н2, 0,21 % орто-Н2.
Твердый водород, температура плавления −259,2 °C, плотность 0,0807 г/см³ (при −262 °C) — снегоподобная масса, кристаллы гексогональной сингонии, пространственная группа P6/mmc, параметры ячейки a=3,75 c=6,12. При высоком давлении водород переходит в металлическое состояние.
Молекулярный водород существует в двух спиновых формах (модификациях) — в виде орто- и параводорода. В молекуле ортоводорода o-h3 (т. пл. −259,10 °C, т. кип. −252,56 °C) ядерные спины направлены одинаково (параллельны), а у параводорода p-h3 (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны). Равновесная смесь o-h3 и p-h3 при заданной температуре называется равновесный водород e-h3.
Равновесная мольная концентрация пара-водорода
Разделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону последнего. При 80 К соотношение форм приблизительно 1:1. Десорбированный параводород при нагревании превращается в ортоводород вплоть до образования равновесной при комнатной температуре смеси (орто-пара: 75:25). Без катализатора превращение происходит медленно (в условиях межзвёздной среды — с характерными временами вплоть до космологических), что даёт возможность изучить свойства отдельных модификаций.
Водород встречается в виде трёх изотопов, которые имеют индивидуальные названия: 1H — протий (Н), 2Н — дейтерий (D), 3Н — тритий (радиоактивный) (T).
Протий и дейтерий являются стабильными изотопами с массовыми числами 1 и 2. Содержание их в природе соответственно составляет 99,9885 ± 0,0070 % и 0,0115 ± 0,0070 %[3]. Это соотношение может незначительно меняться в зависимости от источника и способа получения водорода.
Изотоп водорода 3Н (тритий) нестабилен. Его период полураспада составляет 12,32[3] лет. Тритий содержится в природе в очень малых количествах.
В литературе[3] также приводятся данные об изотопах водорода с массовыми числами 4 — 7 и периодами полураспада 10−22 — 10−23 с.
Природный водород состоит из молекул h3 и HD (дейтероводород) в соотношении 3200:1. Содержание чистого дейтерийного водорода D2 ещё меньше. Отношение концентраций HD и D2, примерно, 6400:1.
Из всех изотопов химических элементов физические и химические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов[4].
| 13.96 | 20,39 | 13,96 / 7,3 | 32,98 / 1,31 | 70,811 / 1,316 |
| 16,65 | 22,13 | 16,60 / 12,8 | 35,91 / 1,48 | 114,80 / 1,802 |
| 22,92 | 17,63 / 17,7 | 37,13 / 1,57 | 158,62 / 2,310 | |
| 18,65 | 23,67 | 18,73 / 17,1 | 38,35 / 1,67 | 162,50 / 2,230 |
| 24.38 | 19,71 / 19,4 | 39,42 / 1,77 | 211,54 / 2,694 | |
| 20,63 | 25,04 | 20,62 / 21,6 | 40,44 / 1,85 | 260,17 / 3,136 |
Дейтерий и тритий также имеют орто- и пара- модификации: p-D2, o-D2, p-T2, o-T2. Гетероизотопный водород (HD, HT, DT) не имеют орто- и пара- модификаций.
Источники информации[5][3]:
| 1H | 1 | 0 | 1,007 825 032 07(10) | Стабилен | 1⁄2+ | 99,9885(70)% | ||
| 2H | 1 | 1 | 2,014 101 777 8(4) | Стабилен | 1+ | 0,0115(70)% | ||
| 3H | 1 | 2 | 3,016 049 277 7(25) | 12,32(2) года | 1⁄2+ | β− | 18,591(1) кэВ | |
| 4H | 1 | 3 | 4,027 81(11) | 1,39(10)×10−22 с | 2− | -n | 23,48(10) МэВ | |
| 5H | 1 | 4 | 5.035 31(11) | >9,1×10−22 с | (1⁄2+) | -nn | 21,51(11) МэВ | |
| 6H | 1 | 5 | 6,044 94(28) | 2,90(70)×10−22 с | 2− | −3n | 24,27(26) МэВ | |
| 7H | 1 | 6 | 7,052 75(108) | 2,3(6)×10−23 с | 1⁄2+ | -nn | 23,03(101) МэВ | |
В круглых скобках приведено среднеквадратическое отклонение значения в единицах последнего разряда соответствующего числа.
Доля диссоциировавших молекул водорода
Молекулы водорода Н2 довольно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
Н2 = 2Н − 432 кДжПоэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:
Ca + Н2 = СаН2и с единственным неметаллом — фтором, образуя фтороводород:
F2 + h3 = 2HFС большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении:
О2 + 2Н2 = 2Н2ООн может «отнимать» кислород от некоторых оксидов, например:
CuO + Н2 = Cu + Н2OЗаписанное уравнение отражает восстановительные свойства водорода.
N2 + 3h3 → 2Nh4С галогенами образует галогеноводороды:
F2 + h3 → 2HF, реакция протекает со взрывом в темноте и при любой температуре, Cl2 + h3 → 2HCl, реакция протекает со взрывом, только на свету.С сажей взаимодействует при сильном нагревании:
C + 2h3 → Ch5При взаимодействии с активными металлами водород образует гидриды:
2Na + h3 → 2NaH Ca + h3 → Cah3 Mg + h3 → Mgh3Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:
Cah3 + 2h3O → Ca(OH)2 + 2h3↑Оксиды восстанавливаются до металлов:
CuO + h3 → Cu + h3O Fe2O3 + 3h3 → 2Fe + 3h3O WO3 + 3h3 → W + 3h3OМолекулярный водород широко применяется в органическом синтезе для восстановления органических соединений. Эти процессы называют реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр. Катализатор Уилкинсона), так и гетерогенным (напр. никель Ренея, палладий на угле).
Так, в частности, при каталитическом гидрировании ненасыщенных соединений, таких как алкены и алкины, образуются насыщенные соединения — алканы.
На Земле содержание водорода понижено по сравнению с Солнцем, планетами-гигантами и первичными метеоритами, из чего следует, что во время образования Земля была значительно дегазирована и водород вместе с другими летучими элементами покинул планету во время аккреции или вскоре после неё.
Свободный водород h3 относительно редко встречается в земных газах, но в виде воды он принимает исключительно важное участие в геохимических процессах.
В состав минералов водород может входить в виде иона аммония, гидроксил-иона и кристаллической воды.
В атмосфере водород непрерывно образуется в результате разложения воды солнечным излучением[6]. Имея малую массу, молекулы водорода обладают высокой скоростью диффузионного движения (она близка ко второй космической скорости) и, попадая в верхние слои атмосферы, могут улететь в космическое пространство.
Водород при смеси с воздухом образует взрывоопасную смесь — так называемый гремучий газ. Наибольшую взрывоопасность этот газ имеет при объёмном отношении водорода и кислорода 2:1, или водорода и воздуха приближённо 2:5, так как в воздухе кислорода содержится примерно 21 %. Также водород пожароопасен. Жидкий водород при попадании на кожу может вызвать сильное обморожение.
Взрывоопасные концентрации водорода с кислородом возникают от 4 % до 96 % объёмных. При смеси с воздухом от 4 % до 75 (74) % объёмных.
Стоимость водорода при крупнооптовых поставках колеблется в диапазоне 2-5$ за кг[7].
Атомарный водород используется для атомно-водородной сварки.
Водород очень лёгок и в воздухе всегда поднимается вверх. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XX в. произошло несколько катастроф, в ходе которых дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием, несмотря на его существенно более высокую стоимость.
Водород используют в качестве ракетного топлива.
Ведутся исследования по применению водорода как топлива для легковых и грузовых автомобилей. Водородные двигатели не загрязняют окружающую среду и выделяют только водяной пар.
В водородно-кислородных топливных элементах используется водород для непосредственного преобразования энергии химической реакции в электрическую.
wreferat.baza-referat.ru