|
|
|
|
 Far Far |
 WinNavigator WinNavigator |
 Frigate Frigate |
 Norton
Commander Norton
Commander |
 WinNC WinNC |
 Dos
Navigator Dos
Navigator |
 Servant
Salamander Servant
Salamander |
 Turbo
Browser Turbo
Browser |
|
|
 Winamp,
Skins, Plugins Winamp,
Skins, Plugins |
 Необходимые
Утилиты Необходимые
Утилиты |
 Текстовые
редакторы Текстовые
редакторы |
 Юмор Юмор |
|
|
|
File managers and best utilites |
Предпосылки создания теории электролитической диссоциации. Изотонический коэффициент. Изотонический коэффициент реферат
Реферат Изотонический коэффициент
скачатьРеферат на тему:
План:
- Введение
- 1 Значение понятия
- 2 Изотонический коэффициент в растворах сильных электролитов
- 3 Влияние внешних факторов Литература
Введение
Изотонический коэффициент (также фактор Вант-Гоффа; обозначается i) — безразмерный параметр, характеризующий поведение вещества в растворе. Он численно равен отношению значения некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства неэлектролита той же концентрации при неизменных прочих параметрах системы:
1. Значение понятия
Смысл параметра ясен из определения каждого из коллигативных параметров: они зависят от концентрации в растворе частиц растворённого вещества. Неэлектролиты в растворе не диссоциируют, стало быть, каждая молекула неэлектролита образует в растворе лишь одну частицу. В свою очередь, электролиты в растворе под влиянием сольватации частично или полностью распадаются на ионы, образуя при этом несколько частиц на одну диссоциировавшую молекулу. Соответственно, и коллигативные свойства данного раствора (аддитивные величины) зависят от содержания в нём частиц (ионов) каждого типа из тех, которым принадлежат частицы, образовавшиеся в растворе в результате диссоциации исходной молекулы, — раствор представляется как бы смесью растворов каждого из типов частиц. Например, раствор хлорной извести содержит три типа частиц — катионы кальция, хлорид-анионы и гипохлорит-анионы. Итак, изотонический коэффициент показывает, насколько в растворе электролита больше частиц по сравнению с раствором неэлектролита аналогичной концентрации, и связан со способностью вещества распадаться в растворе на ионы, то есть, со степенью диссоциации. Если формульная единица или молекула содержит n ионов (или атомов при полярных связях, в растворе превращающихся в ионы), количество исходных молекул равно N, а степень диссоциации соединения — α, то количество диссоциировавших молекул равно N·α (при этом образуются N·α·n ионов), а общее количество частиц в растворе равно ((N — N·α) + N·α·n).
Изотонический же коэффициент равен отношению:
2. Изотонический коэффициент в растворах сильных электролитов
Поскольку сильные электролиты диссоциируют практически полностью, можно было бы ожидать для них изотонический коэффициент, равный количеству ионов (или поляризованных атомов) в формульной единице (молекуле). Однако в действительности этот коэффициент всегда меньше определённого по формуле. Например, изотонический коэффициент для 0,05-моляльного раствора NaCl равен 1,9 вместо 2,0 (для раствора сульфата магния той же концентрации и вовсе i = 1,3). Это объясняет теория сильных электролитов, разработанная в 1923 году П. Дебаем и Э. Хюккелем: передвижение ионов в растворе затруднено образовавшейся оболочкой сольватации. К тому же, ионы взаимодействуют и между собой: разноимённо заряженные притягиваются, а одноимённо заряженные — отталкиваются; силы взаимного притяжения приводят к образованию групп ионов, перемещающихся по раствору совместно. Такие группы называют ионными ассоциатами или ионными па́рами. Соответственно, раствор ведёт себя так, будто содержит меньше частиц, чем на самом деле, ведь свобода их перемещения ограничена. Наиболее очевиден пример, касающийся электропроводности растворов λ, которая возрастает с разбавлением раствора. Через отношение реальной электропроводности к таковой при бесконечном разбавлении определяют мнимую степень диссоциации сильных электролитов, также обозначаемую через α:
3. Влияние внешних факторов
Очевидно, что взаимодействие ионов уменьшается с повышением температуры (вследствие возросшего теплового движения частичек), а также с уменьшением их концентрации, то есть, разбавлением раствора, ведь тогда уменьшается вероятность встречи двух частичек. Экстраполируя разбавление в сторону бесконечности, коэффициент i стремится к своему максимальному значению, определяемому по формуле растворённого соединения. Степень диссоциации α, в соответствии с вышеупомянутой формулой зависимости между i и α, одновременно возрастает, приближаясь к единице (1).
Изотонический коэффициент был введён в последней четверти XIX века Я. Х. Вант-Гоффом. В 1901 году он первым получил Нобелевскую премию по химии — за свои заслуги в изучении растворов.
Литература
- Еремин В. В., Каргов С. И., Успенская И. А., Кузьменко Н. Е., Лунин В. В. Основы физической химии. Теория и задачи: учеб. пособие для вузов. — М.: Издательство «Экзамен», 2005. — 480 с. — (Серия «Классический университетский учебник»). — ISBN 5-472-00834-4
- Kokars, V. Vispārīgā ķīmija (1. daļa). Rīga: RTU izdevniecība, 2009. 286 lpp. (латыш.)
wreferat.baza-referat.ru
Реферат Изотонический коэффициент
скачатьРеферат на тему:
План:
- Введение
- 1 Значение понятия
- 2 Изотонический коэффициент в растворах сильных электролитов
- 3 Влияние внешних факторов Литература
Введение
Изотонический коэффициент (также фактор Вант-Гоффа; обозначается i) — безразмерный параметр, характеризующий поведение вещества в растворе. Он численно равен отношению значения некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства неэлектролита той же концентрации при неизменных прочих параметрах системы:
1. Значение понятия
Смысл параметра ясен из определения каждого из коллигативных параметров: они зависят от концентрации в растворе частиц растворённого вещества. Неэлектролиты в растворе не диссоциируют, стало быть, каждая молекула неэлектролита образует в растворе лишь одну частицу. В свою очередь, электролиты в растворе под влиянием сольватации частично или полностью распадаются на ионы, образуя при этом несколько частиц на одну диссоциировавшую молекулу. Соответственно, и коллигативные свойства данного раствора (аддитивные величины) зависят от содержания в нём частиц (ионов) каждого типа из тех, которым принадлежат частицы, образовавшиеся в растворе в результате диссоциации исходной молекулы, — раствор представляется как бы смесью растворов каждого из типов частиц. Например, раствор хлорной извести содержит три типа частиц — катионы кальция, хлорид-анионы и гипохлорит-анионы. Итак, изотонический коэффициент показывает, насколько в растворе электролита больше частиц по сравнению с раствором неэлектролита аналогичной концентрации, и связан со способностью вещества распадаться в растворе на ионы, то есть, со степенью диссоциации. Если формульная единица или молекула содержит n ионов (или атомов при полярных связях, в растворе превращающихся в ионы), количество исходных молекул равно N, а степень диссоциации соединения — α, то количество диссоциировавших молекул равно N·α (при этом образуются N·α·n ионов), а общее количество частиц в растворе равно ((N — N·α) + N·α·n).
Изотонический же коэффициент равен отношению:
2. Изотонический коэффициент в растворах сильных электролитов
Поскольку сильные электролиты диссоциируют практически полностью, можно было бы ожидать для них изотонический коэффициент, равный количеству ионов (или поляризованных атомов) в формульной единице (молекуле). Однако в действительности этот коэффициент всегда меньше определённого по формуле. Например, изотонический коэффициент для 0,05-моляльного раствора NaCl равен 1,9 вместо 2,0 (для раствора сульфата магния той же концентрации и вовсе i = 1,3). Это объясняет теория сильных электролитов, разработанная в 1923 году П. Дебаем и Э. Хюккелем: передвижение ионов в растворе затруднено образовавшейся оболочкой сольватации. К тому же, ионы взаимодействуют и между собой: разноимённо заряженные притягиваются, а одноимённо заряженные — отталкиваются; силы взаимного притяжения приводят к образованию групп ионов, перемещающихся по раствору совместно. Такие группы называют ионными ассоциатами или ионными па́рами. Соответственно, раствор ведёт себя так, будто содержит меньше частиц, чем на самом деле, ведь свобода их перемещения ограничена. Наиболее очевиден пример, касающийся электропроводности растворов λ, которая возрастает с разбавлением раствора. Через отношение реальной электропроводности к таковой при бесконечном разбавлении определяют мнимую степень диссоциации сильных электролитов, также обозначаемую через α:
3. Влияние внешних факторов
Очевидно, что взаимодействие ионов уменьшается с повышением температуры (вследствие возросшего теплового движения частичек), а также с уменьшением их концентрации, то есть, разбавлением раствора, ведь тогда уменьшается вероятность встречи двух частичек. Экстраполируя разбавление в сторону бесконечности, коэффициент i стремится к своему максимальному значению, определяемому по формуле растворённого соединения. Степень диссоциации α, в соответствии с вышеупомянутой формулой зависимости между i и α, одновременно возрастает, приближаясь к единице (1).
Изотонический коэффициент был введён в последней четверти XIX века Я. Х. Вант-Гоффом. В 1901 году он первым получил Нобелевскую премию по химии — за свои заслуги в изучении растворов.
Литература
- Еремин В. В., Каргов С. И., Успенская И. А., Кузьменко Н. Е., Лунин В. В. Основы физической химии. Теория и задачи: учеб. пособие для вузов. — М.: Издательство «Экзамен», 2005. — 480 с. — (Серия «Классический университетский учебник»). — ISBN 5-472-00834-4
- Kokars, V. Vispārīgā ķīmija (1. daļa). Rīga: RTU izdevniecība, 2009. 286 lpp. (латыш.)
www.wreferat.baza-referat.ru
Коллигативные свойства растворов электролитов. Изотонический коэффициент Вант-Гоффа
Коллигативные свойства растворов электролитов. Изотонический коэффициент Вант-Гоффа - раздел Химия, ОБЩАЯ ХИМИЯ
Все темы данного раздела:
Термодинамические параметры Физические величины, характеризующие какое-либо свойство системы, называются термодинамическими па
Внутренняя энергия системы Важнейшей характеристикой термодинамической системы является величина ее внутренней энергии.
В самом общем виде можно определить внутреннюю энергию системы как сумму потенциальной и кинетической энергии всех составляющих ее частиц. Это определение не позволяет, однако, дать однозначный ответ на вопрос о том, чему равна энергия конкретной
Форма обмена энергии с окружающей средой При протекании термодинамических процессов внутренняя энергия системы может увеличиваться или уменьшать
Изобарный и изохорный процессы. Энтальпия. Тепловые эффекты химических реакций Существуют такие процессы, в ходе протекания которых остаются неизменными только один или несколько парам
В изохорных процессах вся теплота, сообщенная системе или выделенная ею, определяется изменением внутренней энергии системы U2 – U1 = ΔU, где U1 – внутренняя энергия начального состояния системы; U2
Данные условия называются иначе стандартными условиями. Определенные таким образом энтальпии образования веществ называются стандартными энтальпиями образовани
Влияние температуры и давления на тепловой эффект реакции Используя справочные данные теплот образования или теплот сгорания химических веществ, можно теоретическ
Использование закона Гесса в биохимических исследованиях Закон Гесса справедлив не только для чисто химических реакций, но и для сложных биохимических процессов. Та
Энтропия На основании первого начала термодинамики невозможно установить, в каком направлении и до какого предела б
Принцип энергетического сопряжения Самопроизвольно протекающие при данных условиях реакции называются экзергоническими; реакции, к
Химическое равновесие Обратимые и необратимые реакции. Константа равновесия В ходе самопроизвольного процесса
Данное выражение называется иначе уравнением изотермы химической реакции 2) ∆ х.р. = - RTln (С учетом того, что в условиях химического равновесия ∆Gх.р. = 0). В этом случае K
К твердым растворам и газовым смесям понятия растворитель и растворенное вещество не применяют. Жидкие растворы, в которых в качестве растворителя выступает Н2О, называются водными. Если р
Механизм образования растворов Растворы занимают промежуточное положение между механическими смесями веществ и индивидуальными химичес
Влияние природы веществ на растворимость Установлено опытным путем, что в растворителе, молекулы которого полярны, лучше всего растворяются веществ
Влияние давления на растворимость веществ Влияние давления на растворимость твердых и жидких веществ практически не сказывается, т.к. объем системы п
Влияние электролитов на растворимость веществ Если растворитель содержит примеси, то растворимость веществ в нем уменьшается. Особенно сильно это заметн
Взаимная растворимость жидкостей При смешивании жидкостей в зависимости от их природы, характера и силы взаимодействия между молекулам
На различной растворимости одного и того же вещества в несмешивающихся жидкостях основан метод его извлечения из разбавленного раствора. По этому методу к исходному разбавленному раствору добавляют другой растворитель, не смешивающийся с раст
Способы выражения состава растворов Состав любого раствора может быть выражен как качественно, так и количественно. Обычно при качественной оц
Термодинамические аспекты процесса растворения. Идеальные растворы Согласно второму началу термодинамики, в изобарно-изотерических условиях (р, Т = const) вещества могут самопро
Коллигативные свойства разбавленных растворов Растворы обладают рядом свойств, называемых иначе коллигативными (коллективными).
Диффузия и осмос в растворах В растворах частицы растворителя и растворенного вещества равномерно распределяются по всему объему
Роль осмоса в биологических процессах Осмос имеет большое значение в жизнедеятельности человека, животных и растительных организмов. Как извест
Растворы замерзают при более низкой температуре, чем чистый растворитель. Рассмотрим их более подробно. Кипение является физическим процессом перехода жидкости в газообразное
Электролитическая диссоциация Электролиты и неэлектролиты. Теория электролитической диссоциации Все вещества делятся н
Общая характеристика электролитов Одни электролиты в растворах полностью распадаются на ионы. Они называются сильными.
Слабые электролиты Для слабых электролитов степень диссоциации очень мала (α<<1). Так, для воды при 20оС α ≈ 1 ∙ 1
Сильные электролиты Согласно теории электролитической диссоциации С. Аррениуса, сильные электролиты в растворах должны полнос
Под активностью ионов подразумевают ту их эффективную (условную) концентрацию, соответственно которой они количественно проявляют себя в растворе. Активность иона а равна его молярной концентрации С, умноженной на коэффициент активности γ
Диссоциация воды. Водородный показатель Чистая вода плохо проводит электрический ток, но всё же обладает измеримой электропроводностью, которая об
Теория кислот и оснований Содержание понятий «кислота» и «основание» в процессе развития химической науки существенно менялось, ост
Чем меньше значение , тем более сильным является основание. Для кислоты и сопряженного ей основания в разбавленном водном растворе справедливо равенство:
Таким образом, любая кислотно-основная буферная система является равновесной смесью, состоящей из донора и акцептора протонов. В такой системе, содержащей в своем составе слабую кислоту, различают общую, активную и потенциальную к
Механизм действия буферных систем Сущность буферного действия смеси слабой кислоты с ее солью можно рассмотреть на примере ацетатного буфер
Величина буферной емкости зависит от концентраций компонентов буферной системы и от их соотношения. Чем более концентрированным является буферный раствор, тем выше его буферная емкость, т.к. в этом случае доб
Буферные системы человеческого организма В организме человека в результате протекания различных метаболических процессов постоянно образуются бол
Кинетика химических реакций Учение о химических процессах состоит из двух частей: 1) химической термодинамики; 2) химиче
Порядок и молекулярность простых химических реакций В главном кинетическом уравнении химической реакции аA + bВ + … → u = k · · · … а, b, … – эт
К тримолекулярным относятся простые реакции, в элементарном акте которых сталкиваются и претерпевают изменения три частицы. В зависимости от природы этих частиц (т.е. одинаковые они или разные) кинетическое уравнение такой реакции м
Понятие о сложных химических реакциях Следует подчеркнуть, что и простые моно-, и бимолекулярные реакции в самостоятельном или «чистом» виде
Т.е., при которых одни и те же исходные вещества, одновременно реагируя между собой, образуют разные продукты. Примером подобного типа реакций является реакция разложения бертолетовой соли KClO3, способная протек
Химические методы основаны на непосредственном определении количества вещества или его концентрации в реакционном сосуде. Чаще всего для этих целей используют такие виды количественного анализа, как титриметрия и гравиметрия. Ес
Константаскорости вычисляется по формуле k = ( – ) и измеряется в л∙с-1∙моль-1, т.е. ее численное значение зависит от т
Влияние температуры на скорость химической реакции Скорость химических реакций зависит от многих факторов, главными из которых являются концентрация и п
Множитель А отражает долю эффективных соударений между молекулами исходных веществ в общем их числе. Очевидно, что его значения должны находиться в интервале от 0 до 1. При А = 1 все соударения оказываются эффект
Общие положения и закономерности катализа Скорость химической реакции может регулироваться с помощью катализаторов. Ими называют вещ
Механизм гомогенного и гетерогенного катализа Механизм гомогенного катализа обычно объясняют с помощью теории промежуточных соединений. Согла
Особенности каталитической активности ферментов Ферментами называются природные катализаторы, ускоряющие протекание биохимических реакций в жив
Другим важным отличием ферментов от катализаторов небелковой природы является их высокая специфичность, т.е. избирательность действия. Различают субстратную и групповуюспецифичность. В случае субстратной специф
Определение дисперсных систем Системы, в которых одно вещество, находящееся в диспергированном (измельченном или раздробленном) сост
Степень дисперсности есть величина, показывающая, какое число частиц можно вплотную уложить на отрезке длиной в 1 м. Понятие поперечный размер имеет четко выраженный смысл для сферических частиц (а равно диаметру dэтих ч
В коллоидно-дисперсных системах частицы дисперсной фазы состоят из множества соединенных между собой атомов, молекул либо ионов. Количество данных структурных единиц в одной частице может колебаться в самых широких пределах в зави
Для диспергирования твердых тел используют механические, ультразвуковые, химические методы, взрывы. Эти процессы широко применяют в народном хозяйстве: при производстве цементов, для помола зерна и других пр
Диспергирование жидкостей Для диспергирования жидкостей и получения мелких капель в аэрозолях и эмульсиях используют преимуществен
Диспергирование газов Для получения газовых пузырьков в жидкости применяют несколько вариантов диспергирования: 1) барб
Конденсационные методы Эти методы позволяют получить дисперсные частицы с любыми размерами, в том числе и 10–8 – 10–9 м.
Методы физической конденсации Конденсацией паров различных веществ в газовой среде получают аэрозоли. В природных условиях т
Методы химической конденсации В этих методах новая фаза образуется при протекании гомогенных химических реакций, приводящих к образ
Очистка золей Полученные тем или иным способом коллоидные растворы (особенно с помощью метода химической конденсации) пр
Компенсационный диализ и вивидиализ Для очистки биологических жидкостей, представляющих собой коллоидные системы, применяют компенсацион
МОЛЕКУЛЯРНО-кинетические свойства золей На начальном этапе развития коллоидной химии утверждалось, что дисперсным системам, в отличие от истинных
Броуновское движение Важнейшим фактором, влияющим на молекулярно-кинетические свойства золей, является броуновское движен
Диффузия Под влиянием теплового и броуновского движения происходит самопроизвольный процесс выравнивания концент
Седиментация в золях Коллоидные частицы в золе постоянно находятся под влиянием двух противоположно направленных сил: силы тяж
Осмотическое давление в золях Коллоидные растворы, как и истинные, обладают осмотическим давлением, хотя у золей оно имеет гораздо меньшу
Ультрамикроскоп Коллоидные частицы по своим размерам меньше, чем длина полуволны видимого света, и поэтому их нельзя увидет
Рассмотрим сперва механизм образования ДЭС коллоидной частицы адсорбционным путем. В качестве примера возьмем золь, полученный с помощью метода химической агрегации в результате смешивания
Электрокинетические свойства золей Доказательство того, что коллоидные частицы в золях состоят из двух разноименно заряженных частей, способн
Виды устойчивости золей Как было показано ранее, гидрофобные коллоидно-дисперсные системы, по сравнению с истинными растворами, от
Теория коагуляции Дерягина-Ландау-Фервея-Овербека При изучении коагуляции золей возникло много теорий, с помощью которых пытались на качественном и количест
Влияние электролитов на устойчивость золей. Порог коагуляции. Правило Шульца-Гарди Фактором, вызывающим коагуляцию, может быть любое внешнее воздействие, нарушающее агрегативную устойчивос
Чередование зон коагуляции При добавлении к коллоидным растворам электролитов, содержащих в своем составе ионы с повышенной коагулир
Коагуляции золей смесями электролитов Коагулирующее действие смеси электролитов проявляется по-разному, в зависимости от природы ионов, вызываю
Скорость коагуляции Процесс коагуляции количественно характеризуется скоростью коагуляции. Скорость коагуляции, подобно скор
Коллоидная защита Нередко наблюдают повышение устойчивости лиофобных золей к коагулирующему действию электролитов при доба
Роль процессов коагуляции в промышленности, медицине, биологии Коагуляционные процессы часто происходят в природе, например, в местах впадения рек в моря. В речной воде вс
Растворы высокомолекулярных соединений Кроме так называемых лиофобных золей (подробно рассмотренных нами выше), коллоидная химия изучает и другие
Частичками дисперсной фазы в них являются не мицеллы (как в лиофобных золях), а отдельные макромолекулы (по своим размерам сравнимые с мицеллами). В связи с этим для разбавленных растворов ВМС термин «лиофильный золь» является принципиально неправильны
Общая характеристика высокомолекулярных соединений Высокомолекулярными соединениями (ВМС) или полимерами называются сложные вещества, молекулы которых
Набухание и растворение ВМС Растворение высокомолекулярных соединений представляет собой сложный процесс, отличающийся от растворен
Термодинамические аспекты процесса набухания Термодинамически самопроизвольное набухание или растворение высокомолекулярных соединений всегда сопро
Давление набухания Если при набухании образца полимера каким-либо способом препятствовать увеличению его размеров, то в нем в
Осмотическое давление растворов ВМС Как любые высокодисперсные системы, частицы которых подвержены тепловому движению, растворы ВМС обладают
Онкотическое давление крови Осмотическое давление в биологических жидкостях: крови, лимфе, внутри- и межклеточной жидкости – обусловле
Вязкость растворов полимеров По вязкости растворы высокомолекулярных соединений резко отличаются от растворов низкомолекулярных веще
Свободная и связанная вода в растворах В растворах полимеров какая-то часть растворителя оказывается прочно связанной с макромолекулами вследст
Полиэлектролиты Многие природные и синтетические полимеры содержат в составе элементарных звеньев своих макромолекул
Факторы, влияющие на устойчивость растворов полимеров. Высаливание Истинные растворы полимеров, как и растворы низкомолекулярных соединений, являются агрегативно устойчивы
Растворы электролитов как проводники второго рода. электропроводность растворов электролитов В зависимости от способности проводить электрический ток все вещества делятся на 3 основных типа: пров
Эквивалентная электропроводность растворов Эквивалентной электропроводностьюназывается электрическая проводимость раствора электролита толщ
Данное равенство называется законом независимого движения ионов или законом Кольрауша. Величины λк и λа называются иначе подвижностями катионов и анионов. Они, соответс
Практическое применение электропроводности Зная эквивалентную электропроводность раствора можно рассчитать степень (a) и константу диссоциации (K) рас
Металлический электрод При опускании металлической пластинки в воду на её поверхности возникает отрицательный электрический зар
Измерение электродных потенциалов Абсолютное значение электродного потенциала непосредственно определить нельзя. Можно измерить лишь разно
Окислительно-восстановительные электроды Существуют растворы, содержащие в своем составе два вещества, в которых атомы одного и того же элемента
Диффузионный и мембранный потенциалы Диффузионные потенциалы возникают на границе соприкосновения двух растворов. Причем это могут бы
Среди ионо-селективных электродов большое распространение получил стеклянный электрод, который применяют для определения рН растворов. Центральной частью стеклянного электрода (рис. 91) является шарик, изготовленный из специального токопровод
Химические источники электрического тока. Гальванические элементы Химические источники электрического тока или гальванические элементы преобразуют энергию, выд
Потенциометрия Потенциометриейназывают группу методов количественного анализа, основанных на использовании завис
Различают прямую и косвенную потенциометрию или потенциометрическое титрование. Прямая потенциометрия (ионометрия) – это потенциометрический метод, в котором индикаторным эле
allrefers.ru
Коллигативные свойства растворов. О смотическое и онкотическое давление. Изотонический коэффициент
Государственный медицинский университет г.Семей.
Кафедра: Биохимии и Химии.
Дисциплина: Химия.
Зав.кафедры: Тапбергенов С.О.
СРС.
Тема: Коллигативные свойства растворов.
О смотическое и онкотическое давление.
Изотонический коэффициент.
Подготовила: Жумалинова Ботагоз
103 группа ОМФ
Проверила: Абулысбекова С.М.
Семей 2013г.
Введенин.
План.
1.1. Коллигативные свойства растворов — это те свойства, которые при данных условиях оказываются равными и независимыми от химической природы растворённого вещества; свойства растворов, которые зависят лишь от количества кинетических единиц и от их теплового движения. К коллигативным свойствам растворов относят: 1) понижение давления насыщенного пара растворителя над раствором, 2) понижение температуры замерзания и повышение температуры кипения растворов по сравнению с температурами замерзания и кипения чистых растворителей. 3) осмотическое давление.
Первый закон Рауля
Пар, находящийся в равновесии с жидкостью, называют насыщенным. Давление такого пара над чистым растворителем (p0) называют давлением или упругостью насыщенного пара чистого растворителя.
В 1886 (1887) году Франсуа Мари Рауль сформулировал закон:
Давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе:
p = p0 · χр-ль , где
p — давление пара над раствором, ПА;
p0 — давление пара над чистым растворителем;
χр-ль —— мольная доля растворителя.
Для растворов электролитов используют несколько другую форму уравнения, позволяющую добавить в неё изотонический коэффициент:
Δp = i · p0 · χв-ва , где
Δp — собственно изменение давления по сравнению с чистым растворителем;
χв-ва — мольная доля вещества в растворе.
Второй закон Рауля
Также Рауль экспериментально доказал, что повышение температуры кипения раствора по сравнению с температурой кипения растворителя, а равно и понижение температуры замерзания раствора по сравнению с аналогичным характеризующей величиной для растворителя прямо пропорциональна моляльности раствора, то есть,
ΔTкип/зам= Kэб/кр · mв-ва , где
Kэб/кр — соответственно эбулиоскопическая (от лат. ebullire — «кипеть» и др.-греч. σκοπέω — «наблюдаю») и криоскопическая (относится к замерзанию) константы, характерные для данного растворителя;
mв-ва — моляльность вещества в растворе.
1.2. Осмотическое и онкотическое давление.
1) Осмотическое давление (обозначается π) — избыточное гидростатическое давление на раствор, отделённый от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану. Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворённого вещества и растворителя.
Величина осмотического давления, создаваемая раствором, зависит от количества, а не от химической природы растворенных в нём веществ, следовательно, осмотическое давление является коллигативным свойством раствора. Чем больше концентрация вещества в растворе, тем больше создаваемое им осмотическое давление. Это правило, выражается формулой:
π =I C·R·T
Где I — изотонический коэффициент раствора;
C — молярная концентрация раствора, выраженная в моль/м3;
R — универсальная газовая постоянная;
T — термодинамическая температура раствора.
Осмотическое давление может быть весьма значительным. В дереве, например, под действием осмотического давления растительный сок (вода с растворёнными в ней минеральными веществами) поднимается по ксилеме от корней до самой верхушки. Одни только капиллярные явления не способны создать достаточную подъёмную силу — например, секвойям требуется доставлять раствор на высоту до 100 метров. При этом в дереве движение концентрированного раствора, каким является растительный сок, ничем не ограничено.
Взаимодействие эритроцитов с растворами в зависимости от их осмотического давления.
Если же подобный раствор находится в замкнутом пространстве, например, в клетке крови, то осмотическое давление может привести к разрыву клеточной мембраны. Именно по этой причине лекарства, предназначенные для введения в кровь, растворяют в изотоническом растворе, содержащем столько хлорида натрия (поваренной соли), сколько нужно, чтобы уравновесить создаваемое клеточной жидкостью осмотическое давление.
Диффу́зия (лат. diffusio — распространение, растекание, рассеивание, взаимодействие) — процесс взаимного проникновения молекул или атомов одного вещества между молекулами или атомами другого, приводящий к самопроизвольному выравниванию их концентраций по всему занимаемому объёму.
О́смос (от греч. ὄσμος — толчок, давление) — процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону большей концентрации растворённого вещества (меньшей концентрации растворителя).
Мера градиента осмотического давления, то есть различия водного потенциала двух растворов, разделённых полупроницаемой мембраной, называется тоничностью. Различают три варианта тоничности: один раствор по отношению к другому может быть изотоническим, гипертоническим и гипотоничнеским.
- Изотонический раствор - раствор, имеющий осмотическое давление, равное внутриклеточному.
Например: Клетка, погружённая в изотонический раствор, находится в равновесном состоянии —молекулы воды диффундируют через клеточную мембрану в равном количестве внутрь и наружу, не накапливаясь и не теряясь клеткой.
- Раствор, имеющий более высокое осмотическое давление по сравнению с другим раствором, называется гипертоническим. Например: Если ввести в кровь слишком концентрированный раствор хлорида натрия (3-5-10 % ), то вода из клеток будет выходить наружу, и они сожмутся.
- Раствор, имеющий более низкое осмотическое давление по сравнению с другим раствором - гипотоническим.
Например: Если бы вводимые лекарственные препараты были изготовлены на воде или в очень сильно разбавленном растворе, осмотическое давление, заставляя воду проникать в клетки крови, приводило бы к их разрыву.
2) Онкотическое давление (от др.-греч. — объем, масса) — коллоидно-осмотическое давление, доля осмотического давления, создаваемая высокомолекулярными компонентами раствора. В плазме крови человека составляет лишь около 0,5 % осмотического давления (3—4 кн/м², или 0,03—0,04 ат). Тем не менее онкотическое давление играет важнейшую роль в образовании межклеточной жидкости, первичной мочи и др.
1.3. Изотонический коэффициент (также фактор Вант-Гоффа; обозначается i) — безразмерный параметр, характеризующий поведение вещества в растворе. Он численно равен отношению значения некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства неэлектролита той же концентрации при неизменных прочих параметрах систем:
где Р(э) - данный раствор,
Р - раствор неэлектролита той же концентрации,
tкип - температура кипения, а tзам - температура плавления (замерзания).
Литература.
Детлаф А. А., Яворский Б. М. Курс физики: Учебное пособие для втузов — Москва: Высшая школа, 1989. — с. 113
Еремин В. В., Каргов С. И., Успенская И. А., Кузьменко Н. Е., Лунин В. В. Основы физической химии. Теория и задачи: учеб. пособие для вузов. — М.: Издательство «Экзамен», 2005. — 480 с. — (Серия «Классический университетский учебник»).
referat911.ru
Предпосылки создания теории электролитической диссоциации. Изотонический коэффициент.
Табл. 1. Значение коэффициента i для 0,2 н. растворов некоторых солей
| Соль | Формула | Понижение температуры замерзания | 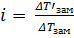 | |
| Наблюдаемое (ΔТ’зам) | Вычисленное по формуле Рауля (ΔТзам) | |||
| Хлорид калия | KCl | 0,673 | 0,372 | 1,81 |
| Нитрат калия | KNO3 | 0,664 | 0,372 | 1,78 |
| Хлорид магния | MgCl2 | 0,519 | 0,186 | 2,79 |
| Нитрат кальция | Ca(NO3)2 | 0,461 | 0,186 | 2,48 |
Когда для указанного раствора KCLизмерили повышение температуры кипения , эта величина также оказалась больше вычисленной по формуле  в такое же число раз.
в такое же число раз.
Во столько же число раз и осмотическое давление этого раствора оказалось больше теоретической величины.
Как Вы уже знаете, величина осмотического давления для разбавленных растворов подчиняется закону Вант-Гоффа:  . Чтобы распространить этот закон на растворы с «ненормальным» осмотическим давлением, Вант-Гофф ввел в уравнение поправочный коэффициент, показывающий, во сколько раз осмотическое давление данного раствора больше нормального. Этот коэффициент был назван изотоническим и обозначался буквой i. Коэффициент i определялся для каждого раствора экспериментальным путем – например, по понижению давления пара, или по понижению температуры замерзания, или по повышению температуры кипения.
. Чтобы распространить этот закон на растворы с «ненормальным» осмотическим давлением, Вант-Гофф ввел в уравнение поправочный коэффициент, показывающий, во сколько раз осмотическое давление данного раствора больше нормального. Этот коэффициент был назван изотоническим и обозначался буквой i. Коэффициент i определялся для каждого раствора экспериментальным путем – например, по понижению давления пара, или по понижению температуры замерзания, или по повышению температуры кипения.
Оказалось, что для растворов солей наблюдаемые понижения давления пара, изменение температур кипения и замерзания, осмотическое давление всегда больше вычисленных по формулам в i раз:
 .
.
Δtкип = i  E
E  ,
,
Δtзам = i  K
K  ,
,
i – изотонический коэффициент или коэффициент Вант-Гоффа
Практически i определяют, сравнивая реально наблюдаемые и вычисленные по формулам значения Δtзам : i =  .
.
Вернемся к нашей таблице. В ней приведены значения изотонических коэффициентов, найденные Вант-Гоффом для двудецинормальных растворов некоторых солей. Из таблицы мы видим, что изотонический коэффициент i больше единицы и для разных солей имеет различные значения:
для  i
i  для
для 
Итак, соли, кислоты, основания, растворяясь в воде, дают «увеличенные» по сравнению с теоретическими значения рассмотренных величин. Как это объяснить? Мы видим, что во все наши формулы входит произведение постоянных величин и обязательно входит концентрация раствора. А концентрация раствора, будь то молярная концентрация (как в формуле  ), или моляльность (как в формуле Δtзам = i
), или моляльность (как в формуле Δtзам = i  K
K  ) обязательно зависит от числа частиц растворенного вещества в растворе. Поэтому естественно предположить, что в наших «ненормальных» растворах молекулы растворенных веществ распадаются на какие-то более мелкие частицы так, что общее число частиц в растворе возрастает. Впервые это предположение высказал шведский химик Сванте Аррениус в 1887 году.
) обязательно зависит от числа частиц растворенного вещества в растворе. Поэтому естественно предположить, что в наших «ненормальных» растворах молекулы растворенных веществ распадаются на какие-то более мелкие частицы так, что общее число частиц в растворе возрастает. Впервые это предположение высказал шведский химик Сванте Аррениус в 1887 году.
Так как и  зависят от концентрации растворов, шведский химик Аррениус в 1887 году предположил, что молекулы солей, оснований и кислот при растворении распадаются на ионы, и общее число частиц в растворе увеличивается.
зависят от концентрации растворов, шведский химик Аррениус в 1887 году предположил, что молекулы солей, оснований и кислот при растворении распадаются на ионы, и общее число частиц в растворе увеличивается.
Следующий вопрос, который возникает при этом: на какие частицы распадаются соли, основания и кислоты? Когда Аррениус искал ответ на этот вопрос, уже было известно, что водные растворы солей, оснований и кислот обладают еще одной особенностью: они проводят электрический ток. При этом сухие соли, основания и кислоты тока не проводят, чистая вода сама по себе также обладает очень плохой проводимостью.
Как вы уже знаете из школьного курса, вещества, растворы или расплавы которых проводят электрический ток, называются электролитами. Электролиты – проводники II рода, электрический ток в них переносится ионами. Эти сведения были известны еще до Аррениуса, но считалось, что электролиты распадаются на ионы только под действием электрического тока. Аррениус же впервые обратил внимание на тесную связь между способностью растворов солей кислот и оснований проводить электрический ток и отклонениями свойств этих растворов от законов Рауля и Вант-Гоффа. Им была выдвинута гипотеза о том, что молекулы электролитов распадаются на ионы уже при растворении, еще до пропускания электрического тока.
Эти предположения в дальнейшем были развиты в стройную теорию, получившую название теории электролитической диссоциации (ТЭД).
Электролитическая диссоциация – это процесс распада электролита на ионы под действием полярных молекул растворителя.
Первое положение ТЭД
При растворении в воде электролиты распадаются на положительно заряженные ионы – катионы и отрицательно заряженные ионы – анионы.
Например, диссоциацию KCl и MgCl2 можно выразить уравнениями:
KCl =  i
i  2;
2;
1 частица 2 иона
MgCl2 =  i
i  3;
3;
1 частица 3 иона
Вот теперь мы можем объяснить отклонения от законов Рауля и Вант-Гоффа. В качестве примера мы рассматривали понижение температуры замерзания для хлорида калия. Это понижение было в 1,81 раза больше рассчитанного по формуле Δtзам = K 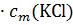 . Но теперь мы видим, что из одной условной молекулы
. Но теперь мы видим, что из одной условной молекулы  образуется вдвое большее число частиц, то есть концентрация частиц повышается вдвое. Поэтому и понижение температуры замерзания в растворе
образуется вдвое большее число частиц, то есть концентрация частиц повышается вдвое. Поэтому и понижение температуры замерзания в растворе  должно быть вдвое больше, чем в растворе неэлектролитов той же концентрации.
должно быть вдвое больше, чем в растворе неэлектролитов той же концентрации.
Точно также в разбавленном растворе хлорида магния понижение температуры замерзания оказывается в 2,79 раз больше, чем вычисленное по формуле Δtзам = K 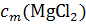 , так как число частиц в растворе
, так как число частиц в растворе  в три раза больше, чем если бы хлорид магния находился в растворе в виде условных молекул.
в три раза больше, чем если бы хлорид магния находился в растворе в виде условных молекул.
Рассмотренные примеры позволяют выяснить физический смысл изотонического коэффициента. Изотонический коэффициент i – это отношение всех частиц, находящихся в растворе, к числу частиц, введенных в раствор.
Однако, теория Аррениуса не сразу получила широкое признание. Особое недоумение вызывало у современников Аррениуса его предположение о диссоциации в растворе некоторых солей, например, хлорида натрия. Если хлорид натрия распадается в воде на натрий и хлор – говорили они – значит, раствор поваренной соли должен пахнуть хлором, а образовавшийся хлорид натрия должен бурно реагировать с водой. Почему этого не происходит? Ответом на этот вопрос служит второе положение теории электролитической диссоциации.
Второе положение ТЭД
Ионы по своим свойствам отличаются от атомов и молекул.
Однако, теория Аррениуса не учитывала всей сложности явлений в растворах. В частности, она рассматривала ионы как свободные, независимые от молекул растворителя частицы. Теории Аррениуса противостояла химическая или гидратная теория растворов Менделеева. Как вы помните, в основе этой теории лежит представление о взаимодействии растворенного вещества с растворителем. В преодолении кажущегося противоречия обеих теорий большая заслуга принадлежит русскому ученому И.А. Каблукову. Он впервые высказал предположение о гидратации ионов. Развитие этой идеи привело к дальнейшему объединению теории Аррениуса и Менделеева.
| | | следующая страница ==> | |
| Тема № 4. Растворы. Дисперсные системы | | | Механизм диссоциации веществ с ионной связью |
Дата добавления: 2014-05-03; просмотров: 4.
Поделиться с ДРУЗЬЯМИ:refac.ru
Изотонический коэффициент в растворах электролитов и неэлектролитов :: SYL.ru
В данной статье будет рассмотрено понятие изотонического коэффициента Вант-Гоффа, его значение в неорганичекой химии. Будет названа его формула и перечислены различные составные данной величины, определяющей принципы действий каких-либо веществ при смешивании друг с другом и добавлении в растворы. А также упомянуты будут значение физического характера и воздействия факторов внешних условий на значение этой коэффициента.
Знакомство с понятием
Изотонический коэффициент, иногда называемый фактором Вант-Гоффа, является параметром безразмерной величины, который дает исчерпывающую характеристику поведения любых веществ в растворе. В численном выражении он равен значению некоторой составной свойства коллигативного раствора конкретного исследуемого соединения к явлению такой же коллигативной характеристики неэлектролитического раствора, имеющего ту же концентрацию и неизменные системные или иные параметры.
Такое понятие, как изотонический коэффициент, ввел в XIX веке Якоб Вант-Гофф, за что позже был удостоен Нобелевской премии по химии. Также этим ученым было введено в науку правило, названное его именем.

Суть коэффициента
Оба коллигативных параметра дают четкую характеристику данного параметра и четко определяют его смысл и суть. Зависят же эти характеристики от концентрации частичек вещества, которое было растворено, в самом растворе. Молекулы неэлектролитов, все по отдельности, образуют только по одной частичке в созданном растворе, а объясняется это тем, что процесс диссоциации неэлектролитов в растворе не происходит.
В тоже время влияние сольватации принуждает электролиты в р-ре целиком или частично распадаться на катионы и анионы, создавая в ходе этого процесса несколько частичек на единичную молекулу, подвергшуюся диссоциации. Из этого следует, что аддитивная величина или, иными словами, свойства коллигативного характера исследуемого р-ра, будут зависеть от количества содержащихся ионов всех типов в нем. Такие ионы будут частицами, что образовались в р-ре в результате протекания диссоциации изначально содержащихся молекул. Данный р-р представляется в виде смеси р-ров, составленных из каждого, отдельного типа частичек.
Примером тому служит р-р извести хлорной, содержащий 3 вида частиц – гипохлориты анионов, хлоридные анионы и катионы кальция. В общем понимании изотонический коэффициент Вант Гоффа позволяет нам узнать, на сколько же частичек находящихся в р-ре электролита, больше, чем в растворе неэлектролита, имеющего аналогичные показатели концентрации. Связан этот к-т со свойством вещества, распадающегося в р-ре, образовывать различного рода катионы и анионы, то есть он показывает степень происходящей диссоциации.
В случае, когда молекула или формульная единица заключает в себе n ионов либо атомов в р-рах с полярным типом связи, количество изначально взятых молекул будет равно N, в свою очередь α будет указывать уровень проявления диссоциации в соединении, и из этого понятно, что N·α. Таким образом, суммарная величина частичек в р-ре вычисляется по формуле – ((N – N·α) + N·α·n).
Нахождение в сильных электролитических растворах
Сильные электролиты в результате диссоциации распадаются практически на 100%, и из-за этого можно решить что, изотонический к-т будет равняться ионному количеству на одну формульную единицу или молекулу, но это не так. В реальности показатель будет меньше того, что был определен по формуле. Данное явление объясняется теорией сильных электролитов, созданной П. Дебаем совместно с Э. Хюккелем в 1923 году. Из этой теории следует, что движение ионов в р-ре будет затрудняться вследствие образования оболочки сольватации. К этому добавляем фактор взаимодействия ионов друг с другом, ведь разноименные частицы будут притягиваться, а одноименные – отталкиваться. Таким образом, взаимное притяжение создаст группы ионов, которые будут передвигаться в толще р-ра друг с другом. Группы таких ионов называются ассоциативными, или парными. В результате такого явления р-р начинает себя вести, словно он содержит меньшее количество частичек, чем есть на самом деле, что объясняется ограничением свободы их перемещения.

Физическая роль коэффициента
К-т Вант-Гоффа кроет в себе значение не только для химии. Физический смысл изотонического коэффициента заключен в учете увеличения количества частичек в р-ре электролитического характера по сравнению с р-ром неэлектролитической природы и аналогичного уровня концентрации.

Внешнее влияние на значение коэффициента
Изотонический коэффициент может изменяться под влиянием факторов различной природы внешнего характера. Например, ионное взаимодействие будет уменьшаться, если температуру раствора повысить (связано с возрастанием теплового движения частиц), или уменьшить концентрацию заряженных частиц путем разбавления р-ра (вследствие уменьшения шанса встречи пары частиц). Если мы будем экстраполировать уровень разбавления, приближая его к бесконечности, то увидим что к-т i пытается набрать свое максимальное значение, которое определяется при помощи формулы растворенных соединений.

Заключение
Итак, мы видим что данная безразмерная величина, представленная в виде изотонического к-та, является характеристикой растворов, а именно: объясняет суть того или иного поведения вещества в растворе, позволяет определять степень диссоциации растворов электролитической и неэлектролитической природы и делать расчет соотношения частичек (ионов) в подобных растворах в сравнении друг с другом.
www.syl.ru
ИЗОТОНИЧЕСКИЙ КОЭФФИЦИЕНТ ФОРМУЛА - Растворы электролитов
 В результате в растворе оказалось Л иох — недиссоциированных молекул и ионов электролита. То есть, изотонический коэффициент показывает, разницу содержания частиц в растворе электролита по сравнению с раствором неэлектролита такой же концентрации. В растворах электролитов химические реакции протекают между ионами. Чем выше концентрация раствора, тем сильнее взаимодействие ионов, тем меньше и кажущаяся степень диссоциации сильного электролита.
В результате в растворе оказалось Л иох — недиссоциированных молекул и ионов электролита. То есть, изотонический коэффициент показывает, разницу содержания частиц в растворе электролита по сравнению с раствором неэлектролита такой же концентрации. В растворах электролитов химические реакции протекают между ионами. Чем выше концентрация раствора, тем сильнее взаимодействие ионов, тем меньше и кажущаяся степень диссоциации сильного электролита.
Смысл параметра ясен из определения каждого из коллигативных параметров: они зависят от концентрации в растворе частиц растворённого вещества. В свою очередь, электролиты в растворе под влиянием сольватации частично или полностью распадаются на ионы, образуя при этом несколько частиц на одну диссоциировавшую молекулу.

Однако в действительности этот коэффициент всегда меньше определённого по формуле. Экстраполируя разбавление в сторону бесконечности, коэффициент i стремится к своему максимальному значению, определяемому по формуле растворённого соединения.

В 0,1 М растворе сильного электролита HCI суммарная концентрация частиц будет складываться из концентрации молекулярной и ионной форм кислоты. Свойства растворов являются коллигативными, т.е. зависят от числа частиц растворенного вещества. Врастворах электролитов эти свойства проявляются в большей степени, чем в равных по концентрации растворах неэлектролитов.

При этом следует иметь в виду, что в случае сильных электролитов найденное таким способом значение aдис выражает лишь «кажущуюся» степень диссоциации. Пример 1. Раствор, содержащий 0,85 г хлорида цинка в 125 г воды кристаллизуется при -0,23°С.
Коллигативные свойства растворов
Рассчитайте температуру кипения этого раствора при условии: 1) НА -электролит; 2) НА — неэлектролит. Сделайте вывод о применимости закона Рауля к растворам этого вещества. Сокращенноеионное уравнение отражает суть химических превращений в растворе. У меня возникли сложности с таким вопросом: Раствор KCl, моляльность которого равна 1 моль/кг, замерзает при -3,36 С. Определите изотонический коэффициент и степень диссоциации (%)….
Покажем как рассчитать этот коэффициент из степени диссоциации и количества ионов: (так как в растворе n0*(1-α) недиссоцировавших молекул, а те n0*α, которые диссоциировали распались на k ионов). Теперь несложно получить формулу i = 1+α(k-1).А нормальность раствора на самом деле входит в эту формулу. Изотонический коэффициентпоказывает, во сколько раз возрастает концентрация ионов за счет диссоциации электролита.
Законы Рауля и принцип Вант-Гоффа не выполняются для растворов (даже бесконечно разбавленных), которые проводят электрический ток – растворов электролитов. 3. Силы взаимодействия ионов с молекулами растворителя и друг с другом малы (т.е. растворы являются идеальными).
Величина степени диссоциации зависит от природы растворителя и растворенного вещества, концентрации раствора и температуры. Т.о., степень диссоциации слабого электролита обратно пропорциональна концентрации и прямо пропорциональна разбавлению раствора; выражение (III.24) называют законом разбавления Оствальда.
Дебаем и Хюккелем был разработан метод расчета среднего коэффициента активности сильного электролита. Для более концентрированных растворов сильных электролитов количественной теории не существует.
Свойства реальных растворов описываются уравнениями, в которых вместо концентраций вводится активность. Любому раствору характерны те или иные физические свойства, к которым относятся и коллигативные свойства растворов. В 1887 г. Ф.М. Рауль описал количественные закономерности коллигативных свойств растворов.
Осмотическое давление раствора
T — абсолютная температура раствора. Задача 5Каким электролитом (сильным или слабым) является иодид натрия в этаноле, если раствор, содержащий 0.506 г NaI в 32.5г С2H5OH кипит при 77.40°C. Это следствие закона Рауля: повышение температуры кипения раствора пропорционально числу частиц растворенного вещества.

Указанные законы справедливы для разбавленных растворов неэлектролитов. Пример 2. Вычислите температуру замерзания раствора, если он содержит 18,06×1022 молекул неэлектролита и 1000 мл воды. Криоскопическая константа воды равна 1,86 (кг×°С)/моль.

Первый закон Рауля
Пример 3. Вычислите массовую долю нафталина С10Н8 в бензольном растворе, если он кипит при температуре 81,45°С. Решение. Допустим, что в растворе содержится 100 г растворителя (бензола). У растворов разных по своей природе веществ, но содержащих одно и то же число кинетически активных частиц растворенного вещества данные свойства будут одинаковые.

В растворах частицы растворителя и растворенного вещества равномерно распределяются по всему объему системы вследствие своего беспорядочного теплового движения.
Например, раствор хлорной извести содержит три типа частиц — катионыкальция, хлорид-анионы и гипохлорит-анионы. Соответственно, раствор ведёт себя так, будто содержит меньше частиц, чем на самом деле, ведь свобода их перемещения ограничена. Наиболее очевиден пример, касающийся электропроводности растворов λ, которая возрастает с разбавлением раствора.
Если же диссоциируют не все молекулы, а только определенная их доля а (0число частиц в растворе будет больше, чем N в i раз, где i — изотонический коэффициент, или коэффициент Вант-Гоффа. Степень диссоциации слабого электролита можно связать с изотоническим коэффициентом. Изотонический коэффициент для растворов электролитов всегда больше единицы, причем с разбавлением раствора i возрастает до некоторого целочисленного значения.
Также интересно:
Пирожок
proslogogu.ru
|
|
..:::Счетчики:::.. |
|
|
|
|
|
|
|
|


