|
|
|
|
 Far Far |
 WinNavigator WinNavigator |
 Frigate Frigate |
 Norton
Commander Norton
Commander |
 WinNC WinNC |
 Dos
Navigator Dos
Navigator |
 Servant
Salamander Servant
Salamander |
 Turbo
Browser Turbo
Browser |
|
|
 Winamp,
Skins, Plugins Winamp,
Skins, Plugins |
 Необходимые
Утилиты Необходимые
Утилиты |
 Текстовые
редакторы Текстовые
редакторы |
 Юмор Юмор |
|
|
|
File managers and best utilites |
Реферат по теории растворов. "теории растворов". Физическая теория растворов реферат
1. Вступление
Федеральное агентство по образованию
Государственное образовательное учреждение высшего
профессионального образования
«Ярославский государственный технический университет»
Кафедра «Общей и физической химии»
Реферат принят
с оценкой
Преподаватель,
Е. А. Смирнова
19.11.12
Реферат на тему
“ТЕОРИИ РАСТВОРОВ”
Реферат выполнила
студентка гр. ХТХ-19
Н. А. Горголь
19.11.12
2012
Содержание
1. Введение
2. Основная часть
2.1. Гидратная теория растворов Д. И. Менделеева
2.2. Электролитическая теория растворов
3. Заключение
4. Список источников
Растворы играют ключевую роль в природе, науке и технике. Вода – основа жизни, всегда содержит растворенные вещества. Пресная вода рек и озер содержит мало растворенных веществ, в то время как морская вода содержит около 3,5% растворенных солей.
Первичный океан по предположениям, содержал всего 1% растворенных солей. «Именно в этой среде впервые развивались живые организмы, из этого раствора они черпали ионы и молекулы, которые необходимы для их дальнейшего роста и развития… Со временем живые организмы развивались и преображались, поэтому они смогли оставить водную среду и перебраться на сушу и затем подняться в воздух. Они получили эти способности, сохранив в своих организмах водный раствор в виде жидкостей, которые содержат жизненно важный запас ионов и молекул» – именно такими словами описывает роль растворов в природе знаменитый американский химик, лауреат Нобелевской премии Лайнус Полинг. Внутри каждого из нас, в каждой клетке нашего организма – содержатся воспоминания о первичном океане, месте в котором зародилась жизнь, - водном растворе, обеспечивающем саму жизнь.
В любом живом организме постоянно течет по сосудам – артериям, венам и капиллярам – необычный раствор, который составляет основу крови, массовая доля солей в нем такая же, как в первичном океане, – 0,9%. Сложные физико-химические процессы, протекающие в организме человека и животного, также взаимодействуют в растворах. Процесс усвоения пищи связан с переводом высокопитательных веществ в раствор. Природные водные растворы напрямую связаны с процессами почвообразования, снабжением растений питательными веществами. Такие технологические процессы в химической и многих других отраслях промышленности, например производство удобрений, металлов, кислот, бумаги, происходят в растворах. Современная наука занимается изучением свойств растворов. Растворы отличаются от других смесей тем, что частицы составных частей располагаются в них равномерно, и в любом микрообъеме подобной смеси состав будет одинаков.
Именно поэтому под растворами понимали однородные смеси, которые состоят из двух или более однородных частей. Такое представление исходило из физической теории растворов.
Приверженцы физической теории растворов, которой занимались Вант-Гофф, Аррениус и Оствальд, считали, что процесс растворения является результатом диффузии.
Д. И. Менделеев и сторонники химической теории считали, что растворение является результатом химического взаимодействия растворенного вещества с молекулами воды. Химическое взаимодействие обычно сопровождается тепловыми явлениями. К примеру, растворение серной кислоты в воде проходит с выделением такого колоссального количества тепла, что раствор может закипеть, именно поэтому кислоту льют в воду, а не наоборот. Растворение таких веществ как хлорид натрия, нитрат аммония, сопровождается поглощением тепла.
М. В. Ломоносов доказал, что растворы превращаются в лед при более низкой температуре, чем растворитель.[1]
2.1. ГИДРАТНАЯ ТЕОРИЯ РАСТВОРОВ Д. И. МЕНДЕЛЕЕВА
В 1905 году Д. И. Менделеев скажет: «Всего четыре предмета составили моё имя, периодический закон, исследование упругости газов, понимание растворов как ассоциации и „Основы химии“. Тут моё богатство. Оно не отнято у кого-нибудь, а произведено мною…».
На протяжении всей своей научной жизни у Д. И. Менделеева не ослабевал интерес к «растворной» тематике. Наиболее значительные его исследования в этой области относятся к середине 1860-х, а важнейшие — к 1880-м годам.
Работы Д.И.Менделеева по теории растворов далеко не так известны, как открытый им Периодический закон. А ведь именно этими трудами он заложил основы такой современной науки, как физическая химия растворов.
В 1864 году Д.И.Менделеев защитил диссертацию «Рассуждение о соединении спирта с водою». В этом исследовании он отмечал сжатие раствора при смешивании спирта с водой, которое максимально проявлялось при 0оС для 46% раствора спирта. Это была его первая серьезная работа по растворам, и именно она явилась основой для создания гидратной теории растворов. В гидратной теории растворы рассматривались как системы, в которых происходит взаимодействие растворенного вещества с молекулами растворителя.
7 мая 1887 года в Русском физико-химическом обществе Д. И. Менделеев сделал доклад, посвященный вопросу о существовании гидратов определенного состава в растворе спирта в воде. В этом докладе, основываясь на своих данных и результатах, полученных рядом исследователей, он утверждал, что в растворе образуются три гидрата спирта, а именно: одна молекула спирта с двенадцатью, тремя и одной молекулой воды. В дальнейшем в своих работах по растворам Менделеев сформулировал теорию, согласно которой в растворе происходит не механическое распределение частиц, а химическое взаимодействие, в результате которого образуются соединения неопределенного состава – гидраты. Для окончательного доказательства наличия гидратов в растворах Менделеев провел новое обширное исследование. В 1887 году из печати вышла его монография «Исследование водных растворов по удельному весу», в которой с большой тщательностью исследованы все факторы, влияющие на плотность водно-спиртовых растворов – содержание спирта, температура, сжатие при смешивании спирта с водой.
«Гидратная» теория Менделеева, по существу явилась историческим предшественником теории электролитической диссоциации С.Аррениуса, а в дальнейшем – переросла в более общую теорию, в соответствии с которой первоначальная гидратация ионов является непременным условием диссоциации.[2]
Менделеев действительно использовал в своей работе водно-спиртовые смеси, но не как прообраз современной водки, а как идеальные «модели», с помощью которых можно было изучать многие физико-химические явления, связанные с процессами растворения. [3]
studfiles.net
Теория растворов | Бесплатные курсовые, рефераты и дипломные работы
Факты, которые не могла объяснить физическая теория растворов:
1) Тепловые эффекты растворения.
Пример. Растворение  – процесс экзотермический; растворение
– процесс экзотермический; растворение  – эндотермический.
– эндотермический.
2) Изменение (чаще – уменьшение) объема жидкости при растворении. Это явление называется контракция.
Пример. При смешивании 50 мл  и 50 мл
и 50 мл  образуется 98 мл раствора
образуется 98 мл раствора
3) Изменение окраски некоторых веществ при растворении и некоторых растворов при выпаривании.
Примеры. Безводный сульфат меди(II) – белый порошок – при поглощении воды синеет.
Розовый раствор хлорида кобальта(II) при высыхании окраску не изменяет, а при последующем выпаривании – синеет.
…
1),2),3) — признаки химических реакций.
Д. И. Менделеев считал, что рассмотренные явления, безусловно, указывают на какие-то взаимодействия между растворенным веществом и растворителем. Он последовательно развивал мысль о химическом взаимодействии между частицами растворенного вещества и молекулами растворителя. Учение Менделеева было развито и дополнено русскими учеными И. А. Каблуковым и В. А. Кистяковским. На основе этих представлений произошло объединение физической и химической точки зрения на растворы.
Основные положения современной физико-химической теории растворов сводятся к следующему.
1) Растворитель и растворенное вещество химически взаимодействуют между собой.
2) В результате взаимодействия образуются непрочные соединения, называемые сольватами, а сам процесс называется сольватацией. В частном случае, когда растворителем является вода, эти соединения называются гидратами, а процесс – гидратацией.
Сами растворы, а также большинство гидратов (сольватов), которые образуются при растворении, имеют переменный состав. Этим они отличаются от химических соединений.
Физико-химическая теория растворов позволила объяснить многие непонятные до этого факты:
1) Изменение окраски некоторых веществ при растворении и некоторых растворов при выпаривании.
2) Тепловые эффекты при растворении.
Явление гидратации иногда можно наблюдать, не пользуясь специальными приборами. Например, безводный сульфат меди (II) CuSO4 – белое вещество. При его растворении в воде образуется голубой раствор. Окраска раствора обусловливается гидратированными ионами меди. Гидратированные частички иногда настолько прочны, что при выделении растворенного вещества из раствора в твердую фазу молекулы воды входят в состав кристаллов. Так, при выпаривании водного раствора сульфата меди в твердую фазу выделяется соль CuSO4∙5h3O.
Кристаллические вещества, в состав которых входят молекулы воды, называются кристаллогидратами, а содержащаяся в них вода — кристаллизационной
Аналогично объясняется изменение окраски раствора хлорида кобальта(II) при выпаривании. Гидратированные ионы кобальта в растворе — розового цвета, такой же розовый цвет имеет и кристаллогидрат кобальта (II) CoCl2∙6h3O. Но при прокаливании на воздухе кристаллогидрат кобальта теряет кристаллизационную воду и превращается в безводный хлорид кобальта(II) синего цвета.
Образованием кристаллогидратов объясняются и тепловые эффекты при растворении. Тепловой эффект растворения складывается из энергии, затраченной на разрушение кристаллической решетки и отделение частиц растворенного вещества друг от друга, а также энергии, которая выделяется при гидратации.
Какой вклад энергии преобладает, такой тепловой эффект в итоге мы и получаем.
Изменение других термодинамических параметров при растворении.
 так как, в целом, при растворении беспорядок в системе увеличивается.
так как, в целом, при растворении беспорядок в системе увеличивается.
 так как растворение – процесс самопроизвольный.
так как растворение – процесс самопроизвольный.
| | | следующая страница ==> | |
| Способы выражения концентраций раствора | | | Диффузия. Осмос. Осмотическое давление |
Дата добавления: 2014-05-03; просмотров: 6.
Поделиться с ДРУЗЬЯМИ:refac.ru
Реферат - Теория растворов - Химия
Растворимость газов в жидкостях
Зависит от природы жидкости, газа, температуры, давления газа и присутствия называется в жидкости др. растворённых веществ. Процесс растворения газа в жидкости называется адсорбцией. Строгих закономерностей описания зависимости растворимости газа в жидкости от их природы не имеется. Газы, имеющие полярную молекулу, лучше растворяются в полярных растворителях. Неполярные в неполярных. Если сравнивать растворимость различных неполярных газов в неполярных растворителях, то газы легко сжимаемые в чистом состоянии, обладающие более высокой критической температурой является более растворимыми. Зависимость от давления при постоянной Т определяется законом Генри по которому />. />– давление над жидкостью, />– коэффициент пропорциональности, константа Генри. Закон Генри записывается />. Закон Генри может быть легко получен из условий гетерогенного равновесия
/>. />,
/>,/>
Правая часть зависит только от температуры и при постоянной температуре остается постоянной />, при Т=const => />, />. В каждом виде закона Генри справедлив для разбавленных растворов при небольших значениях давления. В случае большого давления газа над жидкостью закон Генри сохраняется по форме, но вместо давления нужно подставлять фугитивность />. Если над жидкостью находится смесь газов, то каждый компонент растворяется в зависимости от его парциального давления. Поскольку константа Генри для каждого компонента различна, то отношение концентраций в растворе всегда отлично от отношений концентраций в газовой фазе. Закон Генри справедлив если растворённый газ в растворе не диссоциирует и ассоциирует. При растворении газа в жидких Ме происходит диссоциация молекул газа и тогда количество растворённого в расплаве Ме газа пропорционально корню квадратному из его давления над жидким Ме. Закон Сивертса. Зависимость растворённого газа в жидкости от температуры выражается через зависимость константы Генри от температуры />. Растворимость газов в обычных жидкостях сопровождается выделением теплоты, т.е. />, />т.е. с увеличением температуры константа Генри будет уменьшаться, и будет уменьшаться растворимость при постоянном давлении. При растворимости газов в жидких Ме наблюдается поглощение теплоты />, />т.е. с ростом температуры константа Генри растёт и увеличивается растворимость. Растворимость зависит от присутствия в жидкость др. растворённых веществ.
Растворимость тв. тел в жидкостях
Так как образование насыщенного раствора приводит к состоянию равновесия, то для качественного выяснения влияния температуры и давления на растворимость можно применять правило Леашателье. В соответствии с этим принципом при повышении температуры в равновесных системах идут эндотермические процессы. Если растворение сопровождается поглощением теплоты, то растворимость увеличивается с повышением температуры. Для большинства твёрдых веществ растворимость сопровождается поглощением теплоты, так как расход тепла на разрушение кристаллической решётки больше чем его выделение в результате сольватации — образования молекул или ионов. Для некоторых твёрдых веществ растворимость уменьшается с повышением Т (Ca(OH)2) или не зависит от неё (NaCl). Растворимость различных полиморфных модификаций твёрдого вещества существенно различаются и поэтому при Т полиморфных превращений наблюдаются изломы на кривой зависимости растворимости от Т. Количественно зависимость растворимости от Т для идеальных растворов (для растворов малорастворимых веществ) выражается Ур Шредера />/>– молярная доля растворённого вещества в насыщенном растворе, />– молярная теплота растворённого вещества в насыщенном растворе (парциальное и молярная теплота раствора). Влияние внешнего Р на растворимость определяется так же по принципу лешателье. С увеличением Р в равновесной системе должен идти процесс, сопровождающийся уменьшением Р или V. Растворимость тв тел вызывает очень не большое изменение Р, по этому их растворимость практически не зависит от внешнего Р.
Коллигативные свойства разбавленных растворов неэлектролитов
Коллигативными называются свойства, величина которых зависит только от количества частиц растворённого вещества. Измеряя одно из этих свойств можно вычислить все остальные. К количественным свойствам относятся: 1) понижение Р пара растворителя над раствором 2) повышение Т кипения разбавленного раствора по сравнению с температурой кипения чистого растворителя 3) понижение Т замерзания раствора по сравнению с Т замерзания чистого растворителя 4) осмотическое Р при постоянной Т давления насыщенного пара растворителя над раствором всегда ниже чем давление насыщенного пара над чистым растворителем />, />– молярная доля растворителя в растворе />. Относительное понижение давление пара растворителя над раствором равно молярной доле растворённого вещества. З. Рауля можно вывести используя Ур Дюгема – Маргулиса. Запишем закон Генри выражение концентрации растворённого вещества в молярных долях />, />;
продифференцировав по />при постоянстве Р и Т />(1).
В соотв. Ур Д – М.
/>, />(2), />, />, />, то />
/>
Растворы кипят при Т более высокой чем чистый растворитель. Любая жидкость начинает кипеть при такой температуре, при которой давление её насыщенного пара становится равным внешнему давлению. В соответствии с з Рауля давление пара над раствором ниже, чем над чистым растворителем при той же температуре. Равенство давлений внешнего и пара над раствором достигается при более высокой Т.
/>, />, />— моляльность, Е – эбуллиоскопическая константа, ОА – зависимость Р от Т для чистого растворителя, O’B– для раствора. Эбуллиоскопическая константа = повышению температуры кипения раствора в котором концентрация растворённого вещества = 1 моль/кг растворителя. При условии, что раствор сохраняет свойства разбавленного. Эбулеоскопической константой называется молярное повышение Т кипения. Е как и К зависит только от природы растворителя />, />– удельная теплота испарения растворителя. Измеренным />можно вычислить молекулярную массу растворено го вещества />, />– масса растворённого вещества, />– масса растворителя />. />как правило < чем. точность определения молекулярной массы в значительной степени зависит от точного определения />, то криоскопический метод является более предпочтительным.
/>
Любая жидкость начинает замерзать при такой Т при которой Р её насыщенного пара становится = давлению пара над твёрдым веществом. Т кристаллизации растворителя из раствора всегда ниже, чем Т кристаллизации чистого растворителя. />– зависимость Р над тв веществом, />– Р пара над жидкостью. />Установлено, что />, />— моляльная концентрация растворённого вещества, />— коэффициент пропорциональности. Это соотношение получается следующим образом. Запишем Ур Клауз-Клап для растворителя в тв и ж сост./>(1), />, />, />численно равно понижению Т замерзания раствора 1 моляльной концентрации. Измеренной />раствора определённой концентрации можно вычислить молекулярную массу растворённого вещества />.
Если раствор привести в контакт с чистым растворителем, через полупроницаемую мембрану способную пропускать только молекулы растворителя, то наблюдается самопроизвольный переход растворителя в раствор, это явление называется осмосом. Давление, с которым растворитель стремится перейти в раствор называется осмотическим давлением. По величине это давление = тому давлению, которое нужно приложить к раствору, что бы прекратить переход растворителя в раствор (чтобы привести его в равновесие). Для разбавленных растворов неэлектролитов Ванд Гофф нашел />. Осмотическое давление может иметь большие величины />. Это давление, которое производили бы молекулы находящиеся в состоянии идеального газа и занимая при той же температуре V=V раствора. Осмотическое давление учитывается в технологических процессах переработки растительного и животного сырья.
Коллигативные свойства разбавленных растворов в случае диссоциации
Величина свойства зависит от количества частиц растворённого вещества в растворе, то это приводит к увеличению числа частиц этого вещества в растворе и к увеличению числа частиц этого вещества в растворе и к увеличению величины свойства. Для вычисления свойств растворов рассмотренных нами формулами />, />, />, />вводят поправочный множитель, называемый изотоническим коэффициентом i. Несколько меньше, что объясняется взаимным притяжением частиц образованных при диссоциации. Для вычисления коллигативных свойств растворов в случае диссоциации растворов вещества используют />/>– степень диссоциации, />– число образовавшихся при диссоциации молекул.
--PAGE_BREAK--Закон распределения:
если в системе, состоящей из 2-ух несмешиваемых растворителей ввести 3-ее вещество которое способно растворить в обоих растворителях, то оно распределится м/у этими растворителями, т.о. чтобы отношение его концентрации в этих растворителях при постоянной температуре оставалось величиной постоянной независящей от количества введённого 3 –го компонента. />– коэффициент распределения, />справедлив если растворы 3-го вещества в 1-ом и 2-ом растворителях можно считать разбавленными. Если растворы 3-го вещества в равновесных фазах нельзя считать идеальными, то константа распределения определяется как отношение активности 3-го вещества. З распределения легко получить из условий гетерогенного равновесия />/>/>. Если распределяемое вещество при растворении в 1-ом и 2-ом растворителях диссоциирует или ассоциирует, то з. распределения />. Экстрагирование – метод извлечения растворённого вещества из раствора с помощью другого растворителя, который не смешивается и химически не реагирует с раствором, но растворять извлекаемое вещество в большем количестве чем первый растворитель. Экстракция широко используется.
Используя закон распределения, можно рассчитать процесс экстрагирования. Пусть вещество подлежащее извлечению находится в растворе объёмом V в количестве, и пусть для извлечения его из раствора используют подходящий растворитель объёмом. Если к раствору объёмом V добавить растворитель />и смесь хорошо перемешать до наступления равновесия, то часть растворённого вещества из раствора перейдёт в растворитель. Обозначим количество извлечённого вещества оставшегося в растворе, тогда его концентрация в этом растворе />. Его концентрация в />/>. Коэффициент распределения />. />Количество извлечённого вещества />. Если отделить раствор с помощью делительной воронки, к оставшемуся раствору в котором извлечённого вещества добавить свежеприготовленного растворителя />, то обозначим через количество растворённого вещества в растворе после второго экстрагирования. Будем иметь />;/>; />. Если экстрагировать n- раз />, где />— количество извлекаемого вещества которое осталось в растворе V n-го после экстрагирования. Количество извлечённого вещества при этом определяется />. если экстрагировать 1 раз, но V />, то количество экстрагированного вещества определяется />. Эффективнее экстрагировать />раз обьёмом V чем один раз — />.
Совершенные растворы
Образуются в том случае, если компоненты весьма близки по своим физикохим. свойствам (растворы оптических изомеров, расплавы близких по свойствам природных веществ (Fe и Ni). Совершенные растворы, образованные без изменения V и без теплового эффекта. По этой причине V и Н бинарного совершенного раствора выражается уравнением: />/>, здесь и — молярный V 1-ого и 2-ого компонентов, а и — молярные энтальпии этих компонентов в чистом виде />; />. Парциальный молярный V равен просто молярному V />; />т.к. />то />, это означает, что тенденция к образованию такого раствора определяется увеличением энтропии />. В отличии от величин Н и V величины G и S преобр. совершенного раствора не аддитивны. Энтропия S определяется отношением: />; />— энтропии чистых компонентов относящихся к 1 молю, а – изменение энтропии при смешении компонентов. Изменение энтропии при смешении 1 и 2 компонента определяется: />. Изменение энтропии при образовании 1 моля раствора />. Изменение G при образовании 1 моля раствора />. Т к />/>и />, то />, то есть совершенный раствор образуется самопроизвольно при любых концентрациях, при любых соотношениях компонентов. Для любого компонента совершенного раствора хим. потенциал определяется />:. Для обоих компонентов бинарного совершенного раствора при любых его концентрациях соблюдается закон Рауля />и />. Давление пара над раствором />; />. Как парциальное давление каждого компонента так и общее давление пара над раствором является линейной функцией состава.
/>
Чтобы построить диаграмму давление-состав для совершенного раствора, достаточно знать лишь давление насыщенного пара каждого из компонентов в чистом состоянии при данной температуре. В случае совершенного раствора легко определить состав пара над раствором. В общем случае составы равновесных жидкости и пара не совпадают. Обозначим и – молярные доли 1 и 2 компонента в насыщенном паре над раствором. По закону Рауля />и />. По закону Дальтона />и />, где –P общее давление пара над раствором />а />. и />/>Соответственно />по этим формулам можно подсчитать молярные доли компонентов в равновесной паре над совершенным раствором, если известен состав раствора. Сопоставив закон Рауля и Дальтона можно написать />. Составы пара и жидкости будут одинаковы только тогда, когда будут равны давлению насыщенного пара компонентов в чистом состоянии, что бывает очень редко. Если />, то есть компонент первый при данной температуре более летуч, то пар будет обогащен по сравнению с жидкостью именно этим компонентом, то есть />. В случае совершенных растворов пар всегда обогащен по сравнению с жидкостью компонентом, давление насыщенного пара которого выше, то есть более летучим компонентом.
Реальные растворы
Образ реального сопровождается обычно тепловыми эффектами и изменением V т.е. />, />реальные растворы обнаруживают отклонение от з. Рауюля. Если взаимод. м/у разнородными молекулами бинарного раствора (А и В) сильнее, чем взаимодействие м/у однородными молекулами, то образование раствора при смешении компонентов сопровождается уменьшением V системы и выделение теплоты. Такие растворы обнаруживают отрицательное отклонение от з Рауля (эфир-хлороформ). Диаграмма давление-состав в таких случаях:
/>
в системе с отрицательным отклонением хим. потенциала компонента меньше чем они были бы в случае совершенного раствора того же состава. Если взаимодействие А В слабее чем взаимодействие А-А и В-В, то образование раствора при смешении компонентов сопровождается увеличением V и поглощение теплоты т.е />, />. такие растворы обнаруживают положительное отклонение от з. Рауля.
/>
В системе с положительным отклонением от з Рауля хим. потенциал компонентов больше чем они были бы в случае совершенного раствора того же состава. Как положительное, так и отрицательное отклонение. Взаимодействие разнородных молекул А и В и однородных является процессом конкур. В зависимости от состояния раствора может преобладать как положительное, так и отрицательное отклонения. В качестве примера системы пиридин-вода. Отсутствие отклонения от закона Рауля или равенство нулю теплоты смешения при образовании раствора одного какого-либо состояния является признаком того, что данный компонент при смешении образует идеальный раствор.
www.ronl.ru
Реферат по теории растворов - "теории растворов"
Федеральное агентство по образованиюГосударственное образовательное учреждение высшего
профессионального образования
«Ярославский государственный технический университет»
Кафедра «Общей и физической химии»
Реферат принят
с оценкой
Преподаватель,
Е. А. Смирнова
19.11.12
Реферат на тему
“ТЕОРИИ РАСТВОРОВ”
Реферат выполнила
студентка гр. ХТХ-19
Н. А. Горголь
19.11.12
2012
Содержание
1. Введение
2. Основная часть
2.1. Гидратная теория растворов Д. И. Менделеева
2.2. Электролитическая теория растворов
3. Заключение
4. Список источников
1. ВСТУПЛЕНИЕ
Растворы играют ключевую роль в природе, науке и технике. Вода – основа жизни, всегда содержит растворенные вещества. Пресная вода рек и озер содержит мало растворенных веществ, в то время как морская вода содержит около 3,5% растворенных солей.
Первичный океан по предположениям, содержал всего 1% растворенных солей. «Именно в этой среде впервые развивались живые организмы, из этого раствора они черпали ионы и молекулы, которые необходимы для их дальнейшего роста и развития… Со временем живые организмы развивались и преображались, поэтому они смогли оставить водную среду и перебраться на сушу и затем подняться в воздух. Они получили эти способности, сохранив в своих организмах водный раствор в виде жидкостей, которые содержат жизненно важный запас ионов и молекул» – именно такими словами описывает роль растворов в природе знаменитый американский химик, лауреат Нобелевской премии Лайнус Полинг. Внутри каждого из нас, в каждой клетке нашего организма – содержатся воспоминания о первичном океане, месте в котором зародилась жизнь, - водном растворе, обеспечивающем саму жизнь.
В любом живом организме постоянно течет по сосудам – артериям, венам и капиллярам – необычный раствор, который составляет основу крови, массовая доля солей в нем такая же, как в первичном океане, – 0,9%. Сложные физико-химические процессы, протекающие в организме человека и животного, также взаимодействуют в растворах. Процесс усвоения пищи связан с переводом высокопитательных веществ в раствор. Природные водные растворы напрямую связаны с процессами почвообразования, снабжением растений питательными веществами. Такие технологические процессы в химической и многих других отраслях промышленности, например производство удобрений, металлов, кислот, бумаги, происходят в растворах. Современная наука занимается изучением свойств растворов. Растворы отличаются от других смесей тем, что частицы составных частей располагаются в них равномерно, и в любом микрообъеме подобной смеси состав будет одинаков.
Именно поэтому под растворами понимали однородные смеси, которые состоят из двух или более однородных частей. Такое представление исходило из физической теории растворов.
Приверженцы физической теории растворов, которой занимались Вант-Гофф, Аррениус и Оствальд, считали, что процесс растворения является результатом диффузии.
Д. И. Менделеев и сторонники химической теории считали, что растворение является результатом химического взаимодействия растворенного вещества с молекулами воды. Химическое взаимодействие обычно сопровождается тепловыми явлениями. К примеру, растворение серной кислоты в воде проходит с выделением такого колоссального количества тепла, что раствор может закипеть, именно поэтому кислоту льют в воду, а не наоборот. Растворение таких веществ как хлорид натрия, нитрат аммония, сопровождается поглощением тепла.
М. В. Ломоносов доказал, что растворы превращаются в лед при более низкой температуре, чем растворитель.[1]
2.1. ГИДРАТНАЯ ТЕОРИЯ РАСТВОРОВ Д. И. МЕНДЕЛЕЕВА
В 1905 году Д. И. Менделеев скажет: «Всего четыре предмета составили моё имя, периодический закон, исследование упругости газов, понимание растворов как ассоциации и „Основы химии“. Тут моё богатство. Оно не отнято у кого-нибудь, а произведено мною…».
На протяжении всей своей научной жизни у Д. И. Менделеева не ослабевал интерес к «растворной» тематике. Наиболее значительные его исследования в этой области относятся к середине 1860-х, а важнейшие — к 1880-м годам.
Работы Д.И.Менделеева по теории растворов далеко не так известны, как открытый им Периодический закон. А ведь именно этими трудами он заложил основы такой современной науки, как физическая химия растворов.
В 1864 году Д.И.Менделеев защитил диссертацию «Рассуждение о соединении спирта с водою». В этом исследовании он отмечал сжатие раствора при смешивании спирта с водой, которое максимально проявлялось при 0оС для 46% раствора спирта. Это была его первая серьезная работа по растворам, и именно она явилась основой для создания гидратной теории растворов. В гидратной теории растворы рассматривались как системы, в которых происходит взаимодействие растворенного вещества с молекулами растворителя.
7 мая 1887 года в Русском физико-химическом обществе Д. И. Менделеев сделал доклад, посвященный вопросу о существовании гидратов определенного состава в растворе спирта в воде. В этом докладе, основываясь на своих данных и результатах, полученных рядом исследователей, он утверждал, что в растворе образуются три гидрата спирта, а именно: одна молекула спирта с двенадцатью, тремя и одной молекулой воды. В дальнейшем в своих работах по растворам Менделеев сформулировал теорию, согласно которой в растворе происходит не механическое распределение частиц, а химическое взаимодействие, в результате которого образуются соединения неопределенного состава – гидраты. Для окончательного доказательства наличия гидратов в растворах Менделеев провел новое обширное исследование. В 1887 году из печати вышла его монография «Исследование водных растворов по удельному весу», в которой с большой тщательностью исследованы все факторы, влияющие на плотность водно-спиртовых растворов – содержание спирта, температура, сжатие при смешивании спирта с водой.
«Гидратная» теория Менделеева, по существу явилась историческим предшественником теории электролитической диссоциации С.Аррениуса, а в дальнейшем – переросла в более общую теорию, в соответствии с которой первоначальная гидратация ионов является непременным условием диссоциации.[2]
Менделеев действительно использовал в своей работе водно-спиртовые смеси, но не как прообраз современной водки, а как идеальные «модели», с помощью которых можно было изучать многие физико-химические явления, связанные с процессами растворения. [3]
2.2. ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
После установления законов электролиза М. Фарадея стала медленно укрепляться идея, что многие вещества в растворе диссоциированы на ионы. Различные гипотезы о существовании ионов высказывали Гротгус (1806 г.), Клаузиус (1857 г.), И. В. Гитторф (1866–1869 гг.) и другие ученые. Однако все они не дали настоящего решения этой проблемы, ограничившись лишь качественной стороной. Заслуга правильной постановки проблемы происхождения и поведения ионов в растворах электролитов принадлежит С. Аррениусу. Он высказал предположение, что электролитическая диссоциация вызывается растворителем, например водой, в момент растворения соли или кислоты. При этом частицы растворенного вещества распадаются не на обычные атомы, а на атомы, несущие электрический заряд. Таким образом ионы Фарадея – это атомы (или группы атомов), несущие положительный или отрицательный электрический заряд. Идеи С. Аррениуса на родине были встречены очень холодно, а диссертацию ученого едва не отклонили. Однако за пределами Швеции его работа была встречена с живым интересом. Особенно хорошее впечатление его труды произвели на В. Оствальда, и он предложил шведскому ученому место в своей лаборатории в Риге. Необходимо отметить, что на протяжении многих лет В. Оствальд поддерживал Аррениуса и стимулировал его активность в плане продолжения работ в области физической химии.
В 1887 г. С. Аррениус познакомился с работой Вант-Гоффа «Химическое равновесие в системах газов и разведенных растворов», которая оказала огромное влияние на формирование окончательной редакции учения об электролитической диссоциации (ионизации). Основное положения этой теории, а именно признание существования в растворах «свободных ионов», несущих определенные электрические заряды, Аррениус разработал только после прочтения статьи голландского ученого. С. Аррениус осознал, что аномальное возрастание осмотического давления в растворах электролитов вызвано распадом их частиц на ионы. При этом каждый из образовавшихся ионов оказывает с точки зрения осмотического давления точно такое же действие, что и недиссоциированная частица.
Принятие этой гипотезы позволило Аррениусу дать окончательную формулировку теории электролитической диссоциации (ионизации) :
1. При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации — процесс распада электролита на ионы при растворении его в полярном растворителе или при плавлении.).
2. Под действием электрического тока катионы (+) двигаются к катоду (-), а анионы (-) – к аноду (+).
3. Электролитическая диссоциация - процесс обратимый (обратная реакция называется моляризацией).
4. Степень электролитической диссоциации (a) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся на ионы (n) к общему числу молекул, введенных в раствор (N).
Сразу же после опубликования теории электролитической диссоциации возникла острая и продолжительная полемика. К числу противников теории прежде всего принадлежала группа российских ученых, в которую входили Д. И. Менделеев, Д. П. Коновалов, Н. Н. Бекетов и другие. С. Аррениус решительно защищал свою точку зрения, особенно энергично возражая против утверждения Менделеева о существовании в растворах промежуточных соединений (сольватов или гидратов). Такие не всегда обоснованные действия шведского ученого, отчасти можно объяснить тем, что с самого начала своей научной деятельности он приобрел влиятельных сторонников, к числу которых следует отнести Вант-Гоффа и В. Оствальда.
Необходимо признать, что не все российские ученые высказывались критически в отношении теории электролитической диссоциации. Среди активных сторонников и защитников этой теории в России следует назвать прежде всего В. А. Кистяковского и И. А. Каблукова. Практически одновременно В. А. Кистяковский и И. А. Каблуков высказали идею о гидратации ионов в растворах электролитов. В этом можно увидеть стремление русских ученых объединить представления гидратной теории растворов Д. И. Менделеева с учением об электролитической диссоциации (ионизации).[4]
Каблуков и Кистяковский доказали, что процесс растворения является физико-химическим, что дало возможность объяснить поведение растворенных веществ в растворе и их свойства.
В отличие от гипотезы ионизации С. Аррениуса, не учитывающей взаимодействие растворенного вещества с растворителем, в их теории к объяснению электролитической диссоциации привлекается химическая теория растворов Д.И. Менделеева.[5]
Основные научные работы И. А. Каблукова относятся к электрохимии неводных растворов. В 1889-1891 гг., изучая электрическую проводимость электролитов в органических растворителях, он установил аномальную проводимость неводных растворов электролитов и увеличение ее при добавлении воды к спиртовым растворам. На основании этих наблюдениях высказал предположение о наличии химического взаимодействия между растворителем и растворяемым веществом. В 1889-1891 гг., независимо от В. А. Кистяковского ввел представление о сольватации ионов. Указанные работы составили предмет докторской диссертации И.А.Каблукова - "Современные теории растворов (Вант-Гоффа и Аррениуса) в связи с учениями о химическом равновесии", которую он защитил в 1891 г. Эти работы положили начало сближению физической и химической теорий растворов.[6]
3. ЗАКЛЮЧЕНИЕ
Растворы имеют важное значение в жизни и практической деятельности человека. Так, процессы усвоения пищи человеком и животными связаны с переводом питательных веществ в раствор. Растворами являются все важнейшие физиологические жидкости (кровь, лимфа и т.д.). Производства, в основе которых лежат химические процессы, обычно связаны с использованием растворов.[7]
4. ИСТОЧНИКИ ЛИТЕРАТУРЫ
- http://www.tutoronline.ru/blog/mar_2012/rastvorenie-rastvorimost-vewest v-v-vode.aspx
- Летопись жизни и деятельности Д. И. Менделеева / Ответственный редактор А. В. Сторонкин. — Л.: Наука, 1984.
- Слетов П. В., «Менделеев», 1933. — 184 с. (Жизнь замечательных людей)
- http://ru.wikipedia.org/wiki/Аррениус,_Сванте_Август
- http://ru.wikipedia.org/wiki/Электролитическая_диссоциация
- Соловьев Ю. И., Каблукова М. И., Колесников Е. В. «Иван Алексеевич Каблуков: Сто лет со дня рождения. 1857—1957». М., Изд-во АН СССР, 1957, 211 с.
- Учебник: Общая химия, учебник для ВУЗов; Н. Л. Глинка, 1985 ,- 731 с
newrefs.ru
Физическая и химическая теории растворов. — КиберПедия
Физическая и химическая теории растворов.
Растворы являются сложными системами, в которых имеют место различные виды взаимодействия между частицами (Ван-дер-Ваальсовы, электростатические и т.д.).
Существуют две точки зрения на природу растворения и растворов. Согласно физической точке зрения, растворение является чисто физическим процессом (разрушение кристаллической решетки при растворении твердых тел). Растворы при этом рассматриваются как молекулярные смеси нескольких веществ, не взаимодействующих химически. Противоположные представления были развиты Д. И. Менделеевым, который считал растворение химическим процессом, а растворы рассматривал как непрочные соединения компонентов раствора, находящихся в состоянии частичной диссоциации и отличающихся от обычных соединений переменным составом.
В настоящее время используются представления обеих теорий и доминирующая роль физической или химической компонент, в процессе растворения, определяется свойствами растворителя и растворенного вещества (системы).
Закон электронейтральности
При диссоциации молекул, число положительных и отрицательных ионов определяется стехиометрическими индексами в формуле молекулы. Электролиты, в которых ионы обладают одинаковым зарядом катиона и аниона, например, 1-1-электролит KCl  или 2-2-электролит
или 2-2-электролит  , распадаются на два иона - называются симметричные или симметричными. Электролиты, в которых ионы обладают неодинаковым зарядом катиона и аниона, например, 1-2-электролит
, распадаются на два иона - называются симметричные или симметричными. Электролиты, в которых ионы обладают неодинаковым зарядом катиона и аниона, например, 1-2-электролит 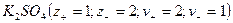 или 3-1–электролит
или 3-1–электролит  , называются несимметричными. Для любого типа электролита в элементарном объеме сумма зарядов анионов и катионов всегда одинакова (закон электронейтральности) :
, называются несимметричными. Для любого типа электролита в элементарном объеме сумма зарядов анионов и катионов всегда одинакова (закон электронейтральности) :
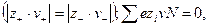 (32.1)
(32.1)
Где 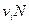 число частиц в растворе.
число частиц в растворе.
Степень диссоциации, изотонический коэффициент
Количественно диссоциация характеризуется степенью диссоциации 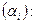
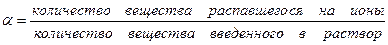 . (32.2)
. (32.2)
Величина  может изменяться от нуля (диссоциация отсутствует) до единицы (в растворе присутствуют только ионы). У сильных
может изменяться от нуля (диссоциация отсутствует) до единицы (в растворе присутствуют только ионы). У сильных  электролитов
электролитов  , у слабых -
, у слабых -  у неэлектролитов
у неэлектролитов 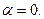
Изотонический коэффициент Вант-Гоффа i характеризует во сколько раз изменилось общее число частиц в растворе в результате диссоциации:

где числитель - общее число вещества в растворе: распавшихся на ионы 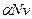 и оставшихся непродиссоциированными
и оставшихся непродиссоциированными 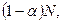 а знаменатель - число молекул, введенных в раствор.
а знаменатель - число молекул, введенных в раствор.
Для сильных электролитов изотонический коэффициент теоретически должен быть равен числу ионов, на которые распадается молекула при диссоциации: при  (например, для
(например, для 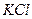 и
и 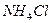 v=2, для
v=2, для  и
и 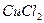 v=3, для
v=3, для 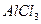 v=4 и т.д.). Однако обычно экспериментальные величины i<v. Причиной этого является электростатическое взаимодействие между ионами, величина которого характеризуется осмотическим коэффициентом
v=4 и т.д.). Однако обычно экспериментальные величины i<v. Причиной этого является электростатическое взаимодействие между ионами, величина которого характеризуется осмотическим коэффициентом
g I(g<1): i=vg. Для неэлектролитов 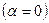 i=1.
i=1.
Закон разбавления Оствальда
Степень диссоциации  зависит от концентрации слабого электролита в
зависит от концентрации слабого электролита в
растворе.
Рассмотрим в качестве примера реакцию:

Если исходная концентрация уксусной кислоты была равна c, то концентрация образовавшихся в результате диссоциации ионов
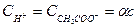 ,
,
а концентрация непродиссоциировавшей уксусной кислоты 
Тогда, с учетом уравнения (32.2):
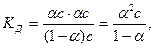 (32.3)
(32.3)
а если 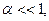 то
то 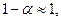 и,
и,
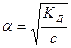 . (32.4)
. (32.4)
Выражение (32.3) носит название закона разбавления Оствальда. Как видно из этого уравнения, при разведении степень диссоциации возрастает, достигая в области бесконечных разбавлений значения, близкого к единице, т. е уменьшается вероятность ассоциации ионов в молекулу из-за уменьшения степени вероятности их столкновения.
Константа гидролиза
Если растворитель диссоциирует на ионы, то их взаимодействие с ионами растворенного вещества приводит к возникновению новых ионных равновесий. Обменные реакции между растворенным веществом и растворителем называется сольволизом (для водных растворов - гидролизом).
Гидролизу подвергаются все вещества, образованные с участием слабых электролитов. Например, при гидролизе соли слабой кислоты и сильного основания устанавливается равновесие:
 (щелочная реакция)
(щелочная реакция)
 (кислая реакция)
(кислая реакция)
Наиболее сильно подвержены гидролизу соли, образованные слабой кислотой и слабым основанием
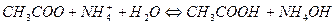
Равновесие реакции гидролиза может быть количественно охарактеризовано константой гидролиза  . Например, константа равновесия реакции гидролиза ацетата натрия имеет вид:
. Например, константа равновесия реакции гидролиза ацетата натрия имеет вид:
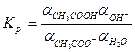
Поскольку  то и
то и  Это произведение носит название константы гидролиза
Это произведение носит название константы гидролиза  . Умножая числитель и знаменатель дроби на активность ионов водорода и произведя перестановки, получим
. Умножая числитель и знаменатель дроби на активность ионов водорода и произведя перестановки, получим
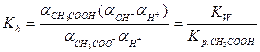
Как следует из приведенного выражения, константа гидролиза обратно пропорциональна константе диссоциации слабого электролита, участвующего в образовании соли (если в образовании соли участвуют два слабых электролита, то  обратно пропорциональна произведению их констант диссоциации).
обратно пропорциональна произведению их констант диссоциации).
Степень гидролиза является величиной аналогичной степени диссоциации.

Уравнение, связывающую константу гидролиза со степенью гидролиза, по форме аналогично уравнению (32.3):

где h - число частиц введенных в раствор.
При повышении температуры степень диссоциации воды сильно увеличивается, тогда как у большинства других электролитов она изменяется незначительно. Вследствие этого степень гидролиза водных растворов при повышении температуры увеличивается.
Буферные растворы
В природе и практической деятельности многие реакции протекают при определенном значении pH, которое должно быть постоянным и не зависеть от разведения, изменения состава раствора, добавления кислоты или щелочи и т.д. Такими свойствами обладают буферные растворы, содержащие слабую кислоту и соль, образованную этой кислотой и сильным основанием (например, ацетатный буфер  ), или слабое основание и соль, образованную сильной кислотой и этим основанием (например, аммиачный буфер
), или слабое основание и соль, образованную сильной кислотой и этим основанием (например, аммиачный буфер  ). Эти растворы обладают определенными свойствами, которые проиллюстрируем на примере ацетатного буфера.
). Эти растворы обладают определенными свойствами, которые проиллюстрируем на примере ацетатного буфера.
Присутствие ацетата натрия (сильного электролита), который полностью диссоциирован, настолько увеличивает концентрацию ионов CH 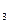 COO
COO 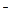 , что, в соответствии с принципом Ле-Шателье, диссоциация уксусной кислоты полностью подавляется:
, что, в соответствии с принципом Ле-Шателье, диссоциация уксусной кислоты полностью подавляется:
В результате можно считать, что в буферном растворе активность анионов равна активности анионов соли  , а активность кислоты равна ее концентрации
, а активность кислоты равна ее концентрации 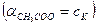 . Подставляя эти величины в выражение константы диссоциации, логарифмируя и вводя обозначение
. Подставляя эти величины в выражение константы диссоциации, логарифмируя и вводя обозначение 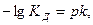 получимследующие формулы:
получимследующие формулы:
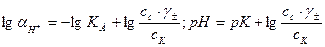 (32.9)
(32.9)
Эти формулы показывают, что pH буферного раствора зависит от константы диссоциации кислоты и соотношения аналитических концентраций соли и кислоты. При разбавлении буферного раствора это соотношение не меняется, а незначительное повышение pH обусловлено изменением коэффициента активности соли. Добавление сильной кислоты тоже сравнительно слабо отражается на изменении pH. При добавлении сильной кислоты к буферному раствору идет реакция с образованием недиссоциированной уксусной кислоты:
 а при добавлении сильного основания- реакция нейтрализации:
а при добавлении сильного основания- реакция нейтрализации:
 .
.
Ионы 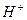 в первом случае, и ионы
в первом случае, и ионы 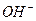 во втором, связываются в малодиссоциированные молекулы (
во втором, связываются в малодиссоциированные молекулы ( 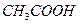 и
и 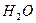 ), в результате чего в pH раствора практически не изменяется.
), в результате чего в pH раствора практически не изменяется.
Способность буферных растворов противостоять изменению pH количественно выражается величиной, называемой буферной емкостью. Буферная емкость - это количество кислоты или щелочи которое нужно добавить к раствору, чтобы изменить его pH на единицу.
Числа переноса
Каждый вид ионов переносит определенное количество электричества, зависящее от заряда и концентрации ионов, а также скорости их движения в электрическом поле. Отношение количества электричества  перенесенного ионами
перенесенного ионами  вида, к общему количеству электричества
вида, к общему количеству электричества 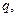 перенесенному всеми ионами, находящимися в растворе, называют числом переноса ионов:
перенесенному всеми ионами, находящимися в растворе, называют числом переноса ионов:
 (32.42)
(32.42)
В соответствии с этим определением сумма чисел переноса всех видов ионов в растворе равна единице.
Для симметричного электролита KA, диссоциирующего на два вида ионов  и
и 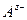 , количество электричества, перенесенное катионами и анионами, составит соответственно:
, количество электричества, перенесенное катионами и анионами, составит соответственно:

 (32.43)
(32.43)
где 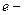 элементарный заряд;
элементарный заряд;  заряд катиона и аниона;
заряд катиона и аниона; 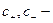 молярная концентрация катионов и анионов
молярная концентрация катионов и анионов 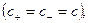
 абсолютные скорости ионов. Отношение чисел переноса катионов
абсолютные скорости ионов. Отношение чисел переноса катионов  и анионов
и анионов 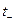 равно отношению их абсолютных скоростей или подвижностей:
равно отношению их абсолютных скоростей или подвижностей:
 ,
,
а поскольку 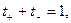 то
то
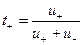 и
и  (32.44)
(32.44)
Из уравнений видно, что число переноса данного вида иона зависит от абсолютной скорости и подвижности обоих видов ионов, т. е. в растворах разных электролитах числа переноса одного и того же иона различны.
На степень гидратации ионов, величины их абсолютной скорости и числа переноса влияют концентрация раствора и температура. С ростом концентрации примерно до 0,1 моль/л для большинства электролитов числа переноса ионов изменяются незначительно; в области более высоких концентраций это изменение заметнее. При повышении температуры размеры гидратных оболочек слабо гидратированных ионов уменьшаются менее резко, чем сильно гидрати-рованных (а иногда даже увеличиваются). В результате величины абсолютной подвижности катионов и анионов сближаются, и их числа переноса стремятся к 0,5.
[1] Диэлектрическая проницаемость - величина, показывающая, во сколько раз сила взаимодействия двух зарядов в изучаемой среде меньше, чем в вакууме.
[2] Зарядом иона z называют отношение заряда иона, выраженного в кулонах, к заряду электрона Кл; заряд иона, в кулонах, соответственно, равен произведению ez.
[3] Далее во всех случаях, где это особо не оговаривается, с целью упрощения мы будем говорить о коэффициенте активности и активности электролитов, понимая, что речь идет о среднем коэффициенте активности и средней активности. В дальнейшем пренебрегается и различием между тремя способами выражения активности (коэффициента активности), что вполне допустимо для разбавленных растворов.
[4] Используют также определение – радиус (толщина) ионной атмосферы, дебаевский радиус.
[5] Обозначение единицы электрической проводимости сименс, как и всех других единиц, происходящих от имен собственных, пишется с прописной буквы (См). Это обозначение нельзя путать с обозначением единицы измерения длины – сантиметр (см).
Физическая и химическая теории растворов.
Растворы являются сложными системами, в которых имеют место различные виды взаимодействия между частицами (Ван-дер-Ваальсовы, электростатические и т.д.).
Существуют две точки зрения на природу растворения и растворов. Согласно физической точке зрения, растворение является чисто физическим процессом (разрушение кристаллической решетки при растворении твердых тел). Растворы при этом рассматриваются как молекулярные смеси нескольких веществ, не взаимодействующих химически. Противоположные представления были развиты Д. И. Менделеевым, который считал растворение химическим процессом, а растворы рассматривал как непрочные соединения компонентов раствора, находящихся в состоянии частичной диссоциации и отличающихся от обычных соединений переменным составом.
В настоящее время используются представления обеих теорий и доминирующая роль физической или химической компонент, в процессе растворения, определяется свойствами растворителя и растворенного вещества (системы).
cyberpedia.su
2. Химическая теория растворов.
Химическая, или сольватная, теория растворов была предложена в 1887 г. Д.И. Менделеевым, который установил, что в реальном растворе присутствуют не только индивидуальные компоненты, но и продукты их взаимодействия. Исследования водных растворов серной кислоты и этилового спирта, проведенные Д.И. Менделеевым, легли в основу теории, суть которой заключается в том, что между частицами растворенного вещества и молекулами растворителя происходят взаимодействия, в результате которых образуются нестойкие соединения переменного состава, называемые сольватами или гидратами, если растворителем является вода. Главную роль в образовании сольватов играют непрочные межмолекулярные силы, в частности, водородная связь.
В этой связи следует принять следующую трактовку понятия «раствор»:
Раствором называется гомогенная система переменного состава, состоящая из двух и более компонентов и продуктов их взаимодействия.
Из данного определения следует, что растворы занимают промежуточное положение между химическими соединениями и смесями. С одной стороны, растворы однородны, что позволяет рассматривать их как химические соединения. С другой стороны, в растворах нет строгого стехиометрического соотношения между компонентами. Кроме того, растворы можно разделить на составные части (например, при упаривании раствора NaCl можно выделить соль в индивидуальном виде).
Основные способы выражения концентрации растворов
Количественный состав раствора чаще всего оценивают при помощи понятия концентрации, под которым понимают содержание растворенного вещества (в определенных единицах) в единице массы (объема) раствора (растворителя). Основными способами выражения концентрации растворов являются следующие:
1. Массовая доля вещества (x) это отношение массы данного компонента x, содержащегося в системе, к общей массе этой системы:
| | (1) |
Выражается в долях единицы или в %. Массовая доля компонента в % показывает, сколько г данного компонента содержится в 100 г раствора. Например, раствор NaCl с массовой долей 0,9% содержит 0,9 г NaCl в 100 г раствора.
2. Молярная концентрация раствора С(х) это отношение количества вещества компонента n(х) к объему раствора Vр-ра:
| | (2) |
Единицей количества вещества является моль, т. е. то количество вещества, которое содержит столько реальных или условных частиц, сколько атомов содержится в 0,012 кг изотопа С12. При использовании моля как единицы количества вещества следует знать, какие частицы имеются в виду: молекулы, атомы, электроны или другие. Молярная масса М(х) это отношение массы к количеству вещества (г/моль):

3. Молярная концентрация эквивалента С( x) это отношение количества эквивалента вещества n(
x) это отношение количества эквивалента вещества n( x) к объему раствора Vр-ра:
x) к объему раствора Vр-ра:
|
| (3) |
Химический эквивалент – это реальная или условная частица вещества, которая может замещать, присоединять или высвобождать 1 ион водорода в кислотно-основных или ионообменных реакциях.
Так же, как молекула, атом или ион, эквивалент безразмерен.
Масса моля эквивалентов называется молярной массой эквивалента М( x). Величина
x). Величина  называется фактором эквивалентности. Она показывает, какая доля реальной частицы вещества соответствует эквиваленту. Для правильного определения эквивалента вещества надо исходить из конкретной реакции, в которой это вещество участвует, например, в реакции взаимодействия Н3РО4 с NaOH может происходить замещение одного, двух или трех протонов:
называется фактором эквивалентности. Она показывает, какая доля реальной частицы вещества соответствует эквиваленту. Для правильного определения эквивалента вещества надо исходить из конкретной реакции, в которой это вещество участвует, например, в реакции взаимодействия Н3РО4 с NaOH может происходить замещение одного, двух или трех протонов:
1. h4PO4 + NaOH Nah3PO4 + h3O;
2. h4PO4 + 2NaOH Na2HPO4 + 2h3O;
3. h4PO4 + 3NaOH Na3PO4 + 3h3O.
В соответствии с определением эквивалента, в 1-й реакции замещается один протон, следовательно, молярная масса эквивалента вещества равна молярной массе, т. е. z l и  . В данном случае:
. В данном случае:
 .
.
Во 2-й реакции происходит замещение двух протонов, следовательно, молярная масса эквивалента составит половину молярной массы Н3РО4, т. e. z 2, а  . Здесь:
. Здесь:
 .
.
В 3-й реакции происходит замещение трех протонов и молярная масса эквивалента составит третью часть молярной массы Н3РО4, т.е. z 3, a  . Соответственно:
. Соответственно:
 .
.
В реакциях обмена, где непосредственно не участвуют протоны, эквиваленты могут быть определены косвенным путем, введением вспомогательных реакций, анализ результатов которых позволяет вывести правило, что z для всех реакций равен суммарному заряду обменивающихся ионов в молекуле вещества, участвующего в конкретной химической реакции.
Примеры:
1. AlCl3 + 3AgNO3 = Al(NO3)3 + 3AgCl.
Для AlCl3 обменивается 1 ион Al3+ с зарядом +3, следовательно, z = 13 = 3. Таким образом:

Можно также сказать, что обмениваются 3 иона хлора с зарядом 1. Тогда z = 31 = 3 и 
Для AgNO3 z = 11 = 1 (обменивается 1 ион Ag+ с зарядом +1 или обменивается 1 ион NO3 с зарядом 1).
2. Al2(SO4)3 + 3BaCl2 = 3BaSO4 + 2AlCl3.
Для Al2(SO4)3 z = 23 = 6 (обменивается 2 иона Al3+ с зарядом +3 или 3 иона SO42 с зарядом 2). Следовательно,

Итак, запись С( h3SO4) = 0,02 моль/л означает, что имеется раствор, в 1 л которого содержится 0,02 моль эквивалента h3SO4, а молярная масса эквивалента h3SO4 составляет при этом
h3SO4) = 0,02 моль/л означает, что имеется раствор, в 1 л которого содержится 0,02 моль эквивалента h3SO4, а молярная масса эквивалента h3SO4 составляет при этом  молярной массыh3SO4, т. е. 1 л раствора содержит
молярной массыh3SO4, т. е. 1 л раствора содержит  h3SO4.
h3SO4.
При факторе эквивалентности  молярная концентрация эквивалента равна молярной концентрации раствора.
молярная концентрация эквивалента равна молярной концентрации раствора.
4. Титр Т(x) – это отношение массы вещества к объему раствора (в мл):
| | (4) |
5. Моляльная концентрация (моляльность) b(х) – это отношение количества растворенного вещества (в молях) к массе m растворителя:
| | (5) |
6. Мольная доля N(x) – это отношение количества вещества данного компонента, содержащегося в системе, к общему количеству веществ системы:
| | (6) |
Выражается в долях единицы или в %.
7. Коэффициентом растворимости вещества Р(x) называют максимальную массу вещества, выраженную в г, которая может раствориться в 100 г растворителя.
studfiles.net
Активность – концентрация для реальных систем
Активность – термодинамический параметр, используемый вместо концентраций во всех уравнениях, описывающих поведение реальных растоворов.
Активность была предложена в 1907 году Льюисомкак новая переменная, применение которой вместо концентрации позволяет использовать для описания свойств реальных растворов относительно простые уравнения, полученные для идеальных систем. Альтернативой этому пути является использование более сложных уравнений, учитывающих взаимодействие между частицами.
Активность (обозначается a) пропорциональна концентрациираствораa = γс. Отношение активности ( ) к концентрации вещества в растворе называется коэффициентом активности:
) к концентрации вещества в растворе называется коэффициентом активности:
γ =a/с (7.4.6)
Коэффициент активности не является постоянной величиной для одного вида раствора и зависит от концентрации. При сильном разбавлении раствора γ 1, и a с.
Коэффициент активности служит мерой отклонения поведения раствора(или компонента раствора) отидеального. Отклонения от идеальности могут быть обусловлены различными химическими и физическими причинами — дипольные взаимодействия, поляризация, образованиеводородных связей, ассоциация,диссоциация, сольватация и др.
Теория растворов
Современная теория растворов сформировалась в начале 20 века, хотя первые обьяснения свойств растворов появились на сто лет раньше. В конце 19 столетия Д.И. Менделеев создал первую теорию растворов учитывающую образование химических связей в жидких растворах.
Эта теория получила название «химической» и стала дополнением к физической теория растворов.
Физическая теория
Физическая теория растворов была предложена Якобом Г. Вант-Гоффом (1885 г.) и Сванте А. Аррениусом (1883 г.).
Растворение соли в воде

Согласно этой теории, растворитель рассматривается как химически индифферентная среда, в которой равномерно распределены частицы (молекулы, ионы) растворенного вещества.
При этом предполагается отсутствие межмолекулярного взаимодействия как между частицами растворенного вещества, так и между молекулами растворителя и частицами растворенного вещества. Частицы растворителя и растворенного вещества вследствие процессов диффузии перемешиваются и равномерно распределяются по всему объему раствора.
Как выяснилось впоследствии, физическая теория удовлетворительно описывает поведение лишь идеальных растворов, в которых частицы растворителя и частицы растворенного вещества действительно практически не взаимодействуют между собой. Примерами идеальных растворов являются многие газовые растворы.
Не реагирующие между собой газы смешиваются друг с другом в неограниченных соотношениях.
Химическая теория
Химическая или сольватная теория растворов предложена Д.И. Менделеевым (1887 г.). Менделеев, посвятивший исследованиям растворов более сорока лет, первым указал, что в реальном растворе могут существовать не только частицы растворенного вещества и растворителя (примерами таких растворов являются растворы Н2, О2, N2 в воде или в жидких углеводородах), но часто может происходить химическое или физическое взаимодействие частиц растворяемого вещества с растворителем. Это легло в основу разработанной им теории растворов.
Суть этой теории состоит в том, что между частицами растворенного вещества и молекулами растворителя происходит взаимодействие, в результате которого образуются нестойкие соединения переменного состава называемые сольватами или гидратами, если растворителем является вода.
Главную роль в образовании сольватов играет водородная связь. Рассмотрим механизм растворения вещества на примере растворения NaCI в воде.

Из этого рис. видно, что положительные и отрицательные ионы, имеющиеся в кристаллической решетке, могут по законам электрического взаимодействия притягивать или отталкивать полярные молекулы растворителя. Например, положительно заряженные ионы Na+ могут быть окружены одним или несколькими слоями полярных молекул воды (гидратация ионов), отрицательно заряженные ионы Cl- также могут взаимодействовать с молекулами полярного растворителя , но ориентация диполей воды вокруг ионов Cl- будет отличаться от ориентации вокруг ионов Na+
Исследование растворов различными методами показало, что в водных растворах образуются соединения частиц растворенного вещества с молекулами воды — гидраты. В случае сульфата меди присутствие гидратов легко обнаружить по изменению цвета: безводная соль белого цвета, растворяясь в воде, образует раствор синего цвета.
Иногда гидратная вода настолько прочно связана с растворенным веществом, что при выделении его из раствора входит в состав его кристаллов.
Кристаллические вещества, содержащие в своем составе воду, называются кристаллогидратами, а вода, входящая в структуру таких кристаллов, называется кристаллизационной.
Таким образом, растворы занимают промежуточное положение между химическими соединениями и смесями. С одной стороны растворы, как и химические соединения, однородны. Образование растворов сопровождается, как правило, тепловым эффектом, что свидетельствует о взаимодействии растворенного вещества с молекулами растворителя. С другой стороны, в растворах нет строгого соотношения между растворенным веществом и растворителем, т.е. растворы не подчиняются закону постоянства состава, кроме того, они могут быть разделены на составные части (например, при упаривании раствора хлорида натрия можно выделить из раствора NaCI).
studfiles.net
|
|
..:::Счетчики:::.. |
|
|
|
|
|
|
|
|








