Содержание.
1. Классификация аминокислот.
2. Синтезы , , — аминокислот.
3. Свойства аминокислот: амфотерность, реакция по аминогруппе и карбоксилу.
4. — аминокислоты, их роль в природе.
5. Синтез пептидов.
Белковые вещества:
1. Классификация.
2. Строение. Первичная структура, понятие о вторичной, третичной и четвертичной структурах.
3. Понятие о ферментах.
Аминокислотами называются органические кислоты, содержащие одну или несколько аминогрупп. В зависимости от природы кислотной функции аминокислоты подразделяют на аминокарбоновые, например h3 N(Ch3 )5 COOH, аминосульфоновые, например h3 N(Ch3 )2 SO3 H, аминофосфоновые, h3 NCH[P(O)(OH)2 ]2, аминоарсиновые, например, h3 NC6 h5 AsO3 h3 .
Согласно правилам ИЮПАК название аминокислот производят от названия соответствующей кислоты; взаимное расположение в углеродной цепи карбоксильной и аминной групп обозначают обычно цифрами, в некоторых случаях — греческими буквами. Однако, как правило, пользуются тривиальными названиями аминокислот. ( см. таблицу 1.).
В зависимости от положения аминогруппы по отношению к карбоксилу различают , и — аминокислоты:
|
|
|
Все — аминокислоты, кроме аминоуксусной (глицина), имеют асимметрический — углеродный атом и существуют в виде двух энантиомеров. За редким исключением, природные - аминокислоты относятся к L- ряду (S-конфигурация) и имеют следующее пространственное строение:
По физическим и ряду химических свойств аминокислоты резко отличаются от соответствующих кислот и оснований. Они лучше растворяются в воде, чем в органических растворителях; хорошо кристаллизуются; имеют высокую плотность и исключительно высокие температуры плавления. Эти свойства указывают на взаимодействие аминных и кислотных групп, вследствие чего аминокислоты в твёрдом состоянии и в растворе (в широком интервале pH) находятся в цвиттер-ионной форме (т.е. как внутренние соли). Взаимное влияние групп особенно ярко проявляется у - аминокислот, где обе группы находятся в непосредственной близости.
Цвиттер-ионная структура аминокислот подтверждается их большим дипольным моментом (не менее 50×10-30 Кл × м), а также полосой поглощения в ИК- спектре твердой аминокислоты или её раствора.
| Тривиальное название | Сокр.название ос- татка ами нок-ты | Формула | Температура плавления, 0С. | Растворимость в воде при 250С, г/100г. |
| Моноаминомонокарбоновые кислоты | ||||
| Гликокол или глицин | Gly | h3 NCh3 COOH | 262 | 25 |
| Аланин | Ala | h3 NCH(Ch4 ) COOH | 297 | 16,6 |
| Валин | Val | h3 NCHCOOH ï CH(Ch4 )2 | 315 | 8,85 |
| Лейцин | Leu | h3 NCHCOOH ï Ch3 CH(Ch4 )2 | 337 | 2,2 |
| Изолейцин | He | h3 NCHCOOH ï Ch4 ─ CH ─ C2 H5 | 284 | 4,12 |
| Фенилаланин | Phe | h3 NCHCOOH ï Ch3 C6 H5 | 283 (разл.) | ― |
| Моноаминодикарбоновые кислоты и их амиды | ||||
| Аспарагиновая кислота | Asp(D) | h3 NCHCOOH ï Ch3 COOH | 270 | 0,5 |
| Аспарагин | Asn(N) | h3 NCHCOOH ï Ch3 CONh3 | 236 | 2,5 |
| Глутаминовая кислота | Glu(E) | h3 NCHCOOH ï Ch3 Ch3 COOH | 249 | 0,84 |
| Глутамин | Gln(Q) | h3 NCHCOOH ï Ch3 Ch3 CONh3 | 185 | 4,2 |
| Диаминомонокарбоновые кислоты | ||||
| Орнитин(+) | Orn | h3 NCHCOOH ï Ch3 Ch3 Ch3 Nh3 | 140 | ― |
| Лизин | Lys(K) | h3 NCHCOOH ï Ch3 Ch3 Ch3 Ch3 Nh3 | 224 | Хорошо растворим |
| Аминокислоты | ||||
| Аргинин | Arg® | h3 NCHCOOH ï Ch3 ï Ch3 Ch3 NH ─ C ─ Nh3 ║ NH | 238 | 15 |
| Гидроксиаминокислоты | ||||
| Серин | Ser(S) | h3 NCHCOOH ï Ch3 OH | 228 | 5 |
| Треонин | Tre(T) | h3 NCHCOOH ï Ch3 (OH)Ch4 | 253 | 20,5 |
| Тирозин | Tyr(Y) | h3 NCHCOOH ï Ch3 C6 h5 OH-n | 344 | ― |
| Тиоаминокислоты | ||||
| Метионин | Met(M) | h3 NCHCOOH ï Ch3 Ch3 SCh4 | 283 | 3,5 |
| Цистин | (Cys)2 | 2 | 260 | 0,011 |
| Цистеин | Cys© | h3 NCHCOOH ï Ch3 SH | 178 | Хорошо растворим |
| Гетероциклические аминокислоты | ||||
| Триптофан | Try(W) | h3 NCHCOOH ï h3 C NH | 382 | 1,14 |
| Пролин | Pro(P) | h3 C Ch3 ïï h3 C CHCOOH NH | 299 | 16,2 |
| Оксипролин | Opr | HOHC Ch3 ïï h3 C CHCOOH NH | 270 | 36,1 |
| Гистидин | His(H) | Nh3 CHCOOH ï h3 C ―C ―― CH ïï N NH CH | 277 | 4,3 |
- аминокислоты получают галогенированием карбоновых кислот или эфиров в -положение с последующей заменой галогена на аминогруппу при обработке амином, аммиаком или фталимидом калия (по Габриэлю).
|
По Штрекеру – Зелинскому - аминокислоты получают из альдегидов:
|
|
В этой реакции вместо альдегидов могут быть использованы кетоны, а вместо диалкилфосфитов- диалкилтиофосфиты, кислые эфиры алкилфосфонистых кислот RP(OH)OR и диарилфосфиноксиды Ar2 HPO.
Альдегиды и кетоны или их более активные производные – кетали служат для синтеза — аминокислот с увеличением числа углеродных атомов на две единицы. Для этого их конденсируют с циклическими производными аминоуксусной кислоты – азалактонами, гидантоинами, тиогидантоинами, 2,5-пиперазиндионами или с её медными или кобальтовыми хелатами, например:
Удобные предшественники - аминокислот — аминомалоновый эфир и нитроуксусный эфир. К их - углеродным атомам можно предварительно ввести желаемые радикалы методами алкилирования или конденсации. - кетокислоты превращают в - аминокислоты гидрированием в присутствии Nh4 или гидрированием их оксимов, гидразонов и фенилгидразонов.
 |
Можно получать - аминокислоты также непосредственно из - кетонокислот, действуя на них аммиаком и водородом над никелевым катализатором:
Некоторые L-- аминокислоты ввиду сложности синтеза и разделения оптических изомеров получают микробиологическим способом (лизин, триптофан, треонин) или выделяют из гидролизатов природных белковых продуктов (пролин, цистин, аргинин, гистидин).
— аминосульфоновые кислоты получают при обработке аммиаком продуктов присоединения NaHSO3 к альдегидам:
RCHO + NaHSO3 ® RCH(OH)SO3 Na ® RCH(Nh3 )SO3 Na
|
В.М.Родионов предложил метод, в котором совмещаются в одной операции получение , -непредельной кислоты конденсацией альдегида с малоновой кислотой и присоединение аммиака:
-аминокислоты получают гидролизом соответствующих лактамов, которые образуются в результате перегруппировки Бекмана из оксимов циклических кетонов под действием h3 SO4. -аминоэтановую и -аминоундекановую кислоты синтезируют из ,,,-тетрахлоралканов путем их гидролиза конц. h3 SO4 до -хлоралкановых кислот с последующим аммонолизом:
Cℓ(Ch3 Ch3 )n CCℓ3 → Cℓ(Ch3 Ch3 )n COOH → h3 N(Ch3 Ch3 )n COOH
Исходные тетрахлоралканы получают теломеризацией этилена с CCℓ4.
Бекмановская перегруппировка оксимов циклических кетонов. Наибольшей практический интерес представляет перегруппировка оксима циклогексанона:

Получаемый этим путем капролактам полимеризуют в высокомолекулярный поликапромид
из которого изготовляют капроновое волокно.
Свойства аминокислот: амфотерность, реакция по аминогруппе и карбоксилу.
1. Большинство аминокислот – бесцветные кристаллические вещества, обычно хорошо растворимы в воде, часто сладковаты на вкус.
2. В молекулах аминокислот содержатся две группы с прямо противоположными свойствами: карбоксильная группа-кислотная, и аминогруппа с основными свойствами. Поэтому они обладают одновременно и кислотными и основными свойствами. Как кислоты, аминокислоты образуют со спиртами сложные эфиры, а с металлами и основаниями-соли:
Для аминокислот особенно характерно образование медных солей, обладающих специфической синей окраской. Эти вещества являются внутренними комплексными солями; в них атом меди связан не только с атомами кислорода, но и с атомами азота аминогрупп:
|
Связь между атомом меди и азота осуществляется дополнительными валентностями( за счет свободной пары электронов азота аминогруппы). Как видно, при этом возникают кольчатые структуры, состоящие из пятичленных циклов. На легкость образования подобных пяти- и шестичленных циклов обратил внимание в 1906г. Л.А. Чугаев и отметил их значительную устойчивость. Медь(и другие металлы) в таких внутрикомплексных соединениях не имеют ионного характера. Водные растворы подобных соединений не проводят в заметной степени электрический ток.
При действии едких щелочей на медные соли аминокислот не происходит выпадания гидрата окиси меди. Однако при действии сероводорода происходит разрушение внутрикомплексного соединения и выпадает труднорастворимая в воде сернистая медью
3. Кислотные свойства в моноаминокислотах выражены весьма слобо-аминокислоты почти не изменяют окраски лакмуса. Таким образом, кислотные свойства карбоксила в них значительно ослаблены.
4. Как амины, аминокислоты образуют соли с кислотами, например:
HCℓ∙Nh3 Ch3 COOH
Но эти соли весьма непрочны и легко разлагаются. Таким образом, основные свойтва аминогруппы в аминокислотах также значительно ослаблены.
5. При действии азотистой кислоты на аминокислоты образуются оксикислоты:
Nh3 Ch3 COOH + NHO2 HOCh3 COOH + N2 + h3 O
Эта реакция совершенно аналогична реакции образования спиртов при действии азотистой кислоты на первичные амины.
6. С галоидангидритами кислот аминокислоты образуют вещества, которые одновременно являются и аминоксилотами и амидами кислот. Так, при действии хлористого ацетила на аминоуксусную кислоту образуется ацетиламиноуксусная килослота:
Ch4 COСℓ + Nh3 Ch3 COOH Сh3 CONHСh3 COOH + HCℓ
ацетиламиноуксусная килослота
Ацетиламиноуксусную кислоту можно рассматривать и как производное аминоуксусной кислоты, в молекуле которой атом водорода аминогруппы замещен ацетилом Ch4 CO- и как ацетамид, в молекуле которого атом водорода аминогруппы замещен остатком уксусной кислоты -Ch3 COOH.
7. - Аминокислоты принагревании легко отщепляют воду,
причем из двух молекул аминокислоты выделяются две молекулы воды и образуются дикетопиперазины:
|
Дикетопиперазины-циклические соединения, кольцо которых образовано четырьмя атомами углерода и двумя атомами азота. Дикетопиперазины — твердые, хорошо кристаллизующиеся вещества.
|
— Аминокслоты легко отщепляют воду, образуя лактамы:
|
Лактамы можно рассматривать как внутренние амиды.
8. Аминокислоты образуют сложные эфиры при действии хлористого водорода на них спиртовые растворы. При этом, разумеется, образуется солянокислые соли эфиров, из которых свободные эфиры можно получить, удаляя хлористый водород окисью серебра, окисью свинца или триэтиламином:
+ +
Nh4 —Ch3 —C—O– + C2 H5 OH + HCℓ Nh4 —Ch3 —C—OC2 H5 Cℓ–
║ ║
O O
+
2 Nh4 —Ch3 —C—OC2 H5 Cℓ– + Ag2 O Nh3 —Ch3 —C—OC2 H5 + 2AgCℓ– + h3 O
║ ║
OO
Эфиры обычных аминокислот — жидкости, перегоняющиеся в вакууме. Именно этерификацией суммы аминокислот, получающихся в результате гидролиза белка, разгонкой в вакууме и последующим гидролизом Э.Фишер выделил индивидуальные аминокислоты и дал способ установления аминокислотного состава белков.
9. При действии пятихлористого фосфора на аминокислоты образуются солянокислые соли хлорангидридов аминокислот, довольно неустойчивые соединения, при отщеплении HCℓ образующие совсем неустойчивые свободные хлорангидриды:
+ +
Nh4 —Ch3 —C—O– + PCℓ5 Nh4 —Ch3 —C—Cℓ Cℓ– + POCℓ3
║ ║
OO
10. Аминокислоты ацилируются по аминогруппе:
+
Nh3 —Ch3 —C—O– + Ch3 —C O Ch4 —C—NH—Ch3 —C—OH + Ch4 —C—OH
║ ║ ║ ║ ║
O O 2 O O O
ацетилгликокол
+
Nh3 —Ch3 —C—O– + C6 H5 —C—Сℓ C6 H5 —C—NH—Ch3 —C—OH + HСℓ
║ ║ ║ ║
O O O O
бензоилгликокол
(гиппуровая кислота)
Образующаяся в последней из написанных реакций гиппуровая кислота – вещество, в виде которого травоядные животные выделяют с мочой небезвредную бензойную кислоту, попадающую в организм с пищей.
11. Аминокислоты можно алкилировать по аминогруппе. Алкилированием глицина получается метиламиноуксосная кислота-саркозин
+ +
Nh4 —Ch3 —C—O– + Ch3 I Ch4 Nh3 —Ch3 —C—O– + HI
║ ║
OO
саркозин
которая в связанном виде содержится в некоторых белках
При избытке иодистого метила образуется замещенная на четвертичноаммониевую группировку уксусная кислота
+ +
Nh4 —Ch3 —C—O– + 3Ch4 I (Ch4 )3 N—Ch3 —C—OH I– + 2HI
║ ║
OO
от которой можно отщепить HI и получить бетаин, лучше синтезируемый из триметиламина и хлоруксусной кислоты:
+
(Сh4 )3 N + CℓCh3 —C—ONa (Ch4 )3 N—Ch3 —C—O– + NaCℓ
║ ║
OO
бетаин
Бетаин, получивший свое название от свеклы(Betavulgaris), в соке которой он находится, дал название и всему классу внутренних солей, в которых анион и катион связаны внутри одной молекулы. В этом смысле говорят о бетаинобразной структуре самих аминокислот:
+ +
h4 N—Ch3 —C—O– (Ch4 )3 N—Ch3 —C—O–
║ ║
OO
Бетаины обладают большим дипольным моментом и солеобразны (тверды, нелетучи, водорастворимы).
— аминокислоты, их роль в природе.
В молекулах большинства - аминокислот содержится асимметрический атом углерода; природные аминокислоты существуют в виде оптических антиподов. Те из антиподов, конфигурация которых аналогична конфигурации правовращающего глицеринового альдегида, обозначаются буквой D; буквой L обозначаются антиподы, конфигурация которых соответствует конфигурации левовращающего глицеринового альдегида:
|
Конфигурация - асимметрического атома углерода у всех природных -аминокислот одинаковая, все они относятся к L-ряду.
Наибольший интерес представляют 20 - аминокислот, входящих в состав белковых молекул.
Принадлежность природных аминокислот к - аминокислотам легко устанавливается по их способности образовывать дикетопиперазины и характерные внутрикомплексные медные соли. Азотистая кислота превращает их в - оксикислоты, из которых многие известные уже со второй половины XVIII столетия. Если при этом получается неизвестная оксикислота, то аминогруппу можно заменить на хлор действием хлористого нитролиза
RR
+ │ │
Nh4 —CH—C—O– + NOCℓ Cℓ—CH—C—OH + N2 + h3 O
║ ║
OO
а затем, заменив действием цинка в кислой среде хлор на водород, получить известную карбоновую кислоту(в случае аминодикарбоновых кислот-двухосновную). Таким путем, например, из валина образуется изовалериановая кислота, из лейцина – изокапроновая, из глутаминовой – глутаровая, которые легко идентифицировать по каким-либо твердым производным (например по анилидам).
Синтез пептидов.
Дипептидами называются - амино-N-ациламинокислоты
R—CH—C—NH—CH—C—O–
│+║ │ ║
Nh4 O R’ O
Полипептиды построены по тому же амидному принципу из нескольких одинаковых или разных аминокислот. Они называются по числу участвующих остатков аминокислот ди-, три- и т.д. полипептидами.
Дипетиды с одинаковыми - аминокислотными остатками можно получить гидролитическим размыканием дикетопиперазинов. Дипетиды с любыми - аминокислотными остатками были получены Э. Фишером путем ацилирования аминокислоты по аминогруппе хлорангидритом - галоидзамещенной кислоты и последующей заменой - галоида на аминогруппу действием аммиака:
Сℓ—CH—C—Сℓ h3 N—CH—C—OH Сℓ—CH—C—NH—CH—C—OH + HСℓ
│║ │ ║│║ │ ║
ROR’ OROR’ O
Сℓ—CH—C—NH—CH—C—OH + 2Nh4 h3 N—CH—C—NH—CH—C—O– + Nh5 Сℓ
│║ │ ║ │║ │ ║
R O R’ O R O R’ O
Подобная же последовательность реакций, примененная к полученному дипетиту, приведет к трипетиду и т.д. Э. Фишер получил таким путем октадекапептид, состоящий из 18 остатков аминокислот.
В более новых методах синтеза полипептидов исходят из хлорангидридов аминокислот(или из иных функциональных производных аминокислот с резко выраженной ацилирующей способностью) с защищенной аминогруппой. Такая защита необходима, чтобы хлорангидрид первой аминокислоты не проацилировал себе подобную молекулу, а осуществил связь со второй аминокислотой. Защита аминогруппы ацетилированием мало удобна, так как условия удаления ацетильной группы гидролизом таковы, что сам ди или полипептид будет гидролизоваться, распадаясь на аминокислоты. Поэтому аминогруппу кислоты, предназначенной в качестве ацилирующего агента и превращаемой для этого в хлорангидрид, защищают, в водя в аминогруппу такую группировку, которую можно удалить из дипептида гидролизом в очень мягких условиях или каким-либо другим методом. Например группу CF3 CO- можно удалить обработкой слабой щелочью или гидрогенолизом; группу C6 H5 Ch3 OCO- легко удалить гидрированием над палладиевым катализатором, восстановлением раствора натрия в жидком аммиаке или действием гидрозина; фталильная группа под действием гидразина отщепляется в виде
CO
NH
C6 h5 │
NH
CO
Что касается того, в форме какого функционального производного должен находится карбоксил защищенной описанным способом аминокислоты, то чаще чем хлорангидриды, применяют легко ацитилирующие эфиры или смешанные ангидриды, например:
HN—CH—C—O— —NO2 или HN—CH—C— —O—C—OR’
│ │ ║ │ │ ║ ║
X R O X R O O
где X- защищающий аминогруппу заместитель, R’- остаток пространственно затрудненного алифатического спирта, например (Ch4 )2 CH—Ch3 OH, что обеспечивает разрыв ацилирующей молекулы по линии, намеченной пунктиром.
Совершенно иное дело-получение полипептидов, даже с высоким молекулярным весом, из остатков одной кислоты. Для этой цели выработан следующий метод(Лейхс), рассмотренный на примере глицина (R=H):
R
│
C6 H5 Ch3 —O—C—Cℓ + h3 N—CH—C—OH
║ ║
O O
R
│
C6 H5 Ch3 —O—C—NH—CH—C—OH
║ ║
O O O
R R—CH—C
│ нагревание
C6 H5 Ch3 —O—C—NH—CH—C—Cℓ O
║ ║
O O HN — C
O
Такие циклические внутренние смешанные ангидриды при нагревании распадаются с выделением CO2 и образованием высокомолекулярных полипетидов:
O
R—CH—C R R
│ │
n O nCO2 + —HN—CH—C—(HN—CH—C—)n-1
║ ║
HN — C O O
O
В химии белков и полипептидов для сокращения принято писать формулы, обозначая остатки аминокислот буквами. Например, Glu- обозначение глутаминовой кислоты, Cys- цистеина, Gly- глицина и т.д. Сокращенная формула глутатиона будет в таком изображении
Gly—Cys—Gly
Белковые вещества. Классификация.
Белки ― высокомолекулярные природные полимеры, построенные из остатков аминокислот, соединенных амидной (пептидной) связью ―CO―NH―.
Каждый Б. характеризуется специфической аминокислотной последовательностью и индивидуальной пространственной структурой (конформацией). На долю белков приходится не менее 50% сухой массы органических соединений животной клетки. Функционирование белка лежит в основе важнейших процессов жизнедеятельности организма. Обмен веществ (пищеварение, дыхание и др.), мышечное сокращение, нервная проводимость и жизнь клетки в целом неразрывно связаны с активностью ферментов — высокоспецифичных катализаторов биохимических реакций, являющихся белками. Основу костной и соединительной тканей, шерсти, роговых образований составляют структурные белки. Они же формируют остов клеточных органелл (митохондрий, мембран и др.). Расхождение хромосом при делении клетки, движение жгутиков, работа мышц животных и человека осуществляются по единому механизму при посредстве белка сократительной системы (напр., Актин, Миозин). Важную группу составляют регуляторные белки, контролирующие биосинтез белка и нуклеиновых кислот. К регуляторным белкам относятся также пептидно-белковые гормоны, которые секретируются эндокринными железами. Информация о состоянии внешней среды, различные регуляторные сигналы (в т. ч. гормональные) воспринимаются клеткой с помощью спец. рецепторных белков, располагающихся на наружной поверхности плазматической мембраны. Эти белки играют важную роль в передаче нервного возбуждения и в ориентированном движении клетки (хемотаксисе). В активном транспорте ионов, липидов, сахаров и аминокислот через биологические мембраны участвуют транспортные белки, или белки-переносчики. К последним относятся также гемоглобин и миоглобин, осуществляющие перенос кислорода. Преобразование и утилизация энергии, поступающей в организм с питанием, а также энергии солнечного излучения происходят при участии белков биоэнергетической системы (напр., родопсин, цитохромы). Большое значение имеют пищевые и запасные белки ( напр., Казеин, Проламины), играющие важную роль в развитии и функционировании организмов. Защитные системы высших организмов формируются защитными белками, к которым относятся иммуноглобулины (ответственны за иммунитет), белки комплемента (ответственны за лизис чужеродных клеток и активацию иммунологической функции), белки системы свертывания крови ( напр. Тромбин, Фибрин) и противовирусный белок интерферон.
По составу белки делят на простые, состоящие только из аминокислотных остатков (протеины), и сложные (протеиды). Сложные могут включать ионы металла (металлопротеиды) или пигмент (хромопротеиды), образовывать прочные комплексы с липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеиды), а также ковалентно связывать остаток фосфорной кислоты (фосфопротеиды), углевода (гликопротеины) или нуклеиновой кислоты (геномы некоторых вирусов).
По ряду характерных свойств протеины можно разделить на несколько подгрупп:
Альбумины. Они растворимы в воде, свёртываются при нагревании, нейтральны, сравнительно трудно осаждаются растворами солей. Примерами их могут служить: альбумин белка куриного яйца, альбумин кровяной сыворотки, альбумин мускульной ткани, молочный альбумин.
Глобулины. Они нерастворимы в воде, но растворяются в очень слабых растворах солей. Более концентрированными растворами солей они вновь осаждаются; осаждение происходит при меньшей концентрации, чем та, которая необходима для осаждения альбуминов. Эти белки являются очень слабыми кислотами. Примерами глобулинов могут служить: фибриноген, глобулин кровяной сыворотки, глобулин мускульной ткани, глобулин белка куриного яйца.
Гистоны. Белки основного характера. Находятся в виде нуклеопротеидов в лейкоцитах и красных кровяных шариках.
Протамины. Не содержат серы, обладают сравнительно сильными основными свойствами, дают кристаллические соли; содержатся (в виде нуклеопротеинов) в сперматозоидах рыб.
Проламины. Находятся в зернах различных хлебных злаков. Замечательной их особенностью является растворимость в 80% -ном спирте. Представителем этих белков может служить глиадин, составляющий главную часть клейковины.
Склеропротеины. Нерастворимые белки, которые составляют наружный покров тела животного и находятся в скелете и в соединительной ткани. К ним относятся кератин, коллагены, эластин, фиброин.
Керотин является главной составной частью волос, рогов, копыт, ногтей, перьев и верхнего слоя кожи. Скорлупа куриного яйца состоит из извести и кератина. Если растворить известь скорлупы яйца в кислоте, то останется мягкая кожа, состоящая из кератина; из кератина состоит кожица, которая следует за скорлупой яйца. По химическому составу кератин богат серой.
Коллагены. Чрезвычайно распространены в живых организмах. Из коллагенов состоит соединительная ткань; они находятся в хрящах. Кости позвоночных животных состоят из неорганических веществ (фосфорнокислого и углекислого кальция), жира и коллагенов.
При кипячении с водой или при действии перегретого водяного пара коллагены образуют клей. Если из костей извлечь жир и потом, обработав их кислотой, растворить фосфорнокислый кальций, то останется белковое вещество-оссеин. При обработке оссеина перегретым водяным паром он переходит в клей. Чистый костяной клей называется желатиной. Особенно чистая желатина получается из рыбьего пузыря кипячением с водой.
Эластин входит в состав жил и других эластичных веществ соединительной ткани.
Нити сырого шелка состоят из белкового вещества-фиброина, покрытого другим белковым веществом, играющим роль шелкового клея,-серицином. При кипячении с водой шелк освобождается от клея который при этом переходит в раствор.
Протеиды также можно разделить на несколько групп: фосфоропротеиды содержат в своем составе фосфор. Они, в противоположность протаминам, обладающим, как указано выше, основными свойствами, имеют определенно выраженный кислотный характер.
Главнейшим представителем фосфоропротеидов является казеин молока. Он обладает настолько ясно выраженным кислотным характером, что разлагает углекислые соли с выделением углекислого газа. Казеин растворяется в слабых растворах щелочей, образуя с ними соли. Соли казеина называются казеинатами.
При нагревании казеин не свертывается. При действии кислот на соли казеина он выделяется в свободном виде. Этим объясняется свертывание молока при прокисании.
Казеин применяется для изготовления твердой, напоминающей рог пластмассы-галалита).Для получения галалита казеин смешивают с водой, красками и наполнителями, прессуют под давлением, и полученные пластины обрабатывают формалином. Казеин содержит фосфор в виде сложного эфира фосфорной кислоты.
Из других фосфоропротеинов следует отметить вителлин, который находится в желтке куриного яйца.
Нуклеопротеиды находятся в клеточных ядрах. При осторожном гидролизе они расщепляются на белок и нуклеиновую кислоту.
Нуклеиновые кислоты являются весьма сложными веществами, расщепляющимися при гидролизе на фосфорную кислоту, углеводы и азотосодержащие органические вещества группы пиримидина и группы пурина.
Хромопротеиды. Под этим названием известны протеиды, которые представляют собой сочетание белков с окрашенными веществами. Из хромопротеидов наиболее изучен гемоглобин красящее вещество красных кровяных шариков. Гемоглобин, соединяясь с кислородом,
превращается в оксигемоглобин, который, отдавая свой кислород другим веществам, снова превращается в гемоглобин. Значение гемоглобина в жизни человека и животных очень велико. Он играет роль переносчика кислорода от легких к тканям. Образовавшийся в легких оксигемоглабин кровью разносится по телу и, отдавая свой кислород, способствует протекание в организме окислительных процессов. Кроме того, гемоглобин вместе с плазмой крови осуществляет регуляцию величины pH крови и перенос углекислоты в организме.
Характерной особенностью гемоглобина является его способность соединятся с окисью углерода, после чего он теряет способность соединяться с кислородом. Этим объясняется ядовитое действии окиси углерода.
Гемоглобин представляет собой соединение белка глобина с красящим началом гемохромогеном. Вне организма гемоглобин, при действии воздуха, превращается в метгемоглобин, который отличается от оксигемоглобына прочностью связи с кислородом. При обработке ледяной уксусной кислотой метгемоглобин расщепляется с образованием глобина и гематина C34 h42 O4 N4 Fe(OH). Обработкой метгемоглобина тем же реактивом, но в присутствии NaCℓ, получается хлористая соль гематина, называемая гемином, C34 h42 O4 N4 FeCℓ. Гемин образует характерные красно-коричневые таблички, которые дают возможность открыть присутствие крови в пятнах даже через несколько лет. Гематин очень близок к гемохромогену, но все же от него отличается.
Глюкопротеиды. Некоторые белки этой группы встречаются в слизистых соединениях животных организмов и обусловливаются свойства этих выделений тянуться в нити даже при сравнительно большом разбавлении. Эти белки образуются в подчелюстной железе(подчелюстная железа-одна из слюнных желез), печени, железах желудка и кишечника. Другие глюкопротеиды находятся в хрящах, яичном белке, стекловидном теле глаза и т.д. Исследованныепредставители глюкопротеидов являются сочетанием белков с веществами, содержащими остатки некоторых производных углеводов, серной и уксусной кислот.
Строение белковых молекул.
Практически все белки построены из 20 -аминокислот, принадлежащих, за исключением глицина, к L-ряду. Аминокислоты соединены между собой пептидными связями, образованными карбоксильной и -аминогруппами соседних аминокислотных остатков Белковая молекула может состоять из одной или нескольких цепей, содержащих от 50 до нескольких сотен (иногда –более тысячи) аминокислотных остатков. Молекулы, содержащие менее 50 остатков часто относят к пептидам. В состав многих молекул входят остатки цистина, дисульфидные связи которых ковалентно связывают участки одной или нескольких цепей. В нативном состоянии макромолекулы белка обладают специфичной конформацией. Характерная для данного белка конформация определяется последовательностью аминокислотных остатков и стабилизируется водородными связями между пептидными и боковыми группами аминокислотных остатков, а также гидрофобными и электростатическими взаимодействиями.
Различают четыре уровня организации белковых молекул.
Первичной структурой называют последовательность аминокислотных остатков в полипептидной цепи. Все белки различаются по первичной структуре, потенциально их возможное число практически неограничено.
Вторичная структура белка – это -спираль, которая образуется в результате скручивания полипептидной цепи за счет водородных связей между группами: ―C― и ―N―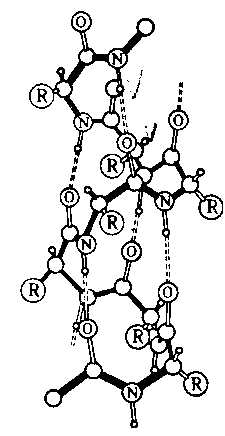 .
.
║ ║
OH
В одном витке спирали обычно содержится 3,6 аминокислотных остатка, шаг спирали – 0,544 нм.
Под третичной структурой белка понимают расположение его полипептидной цепи в пространстве. Существенное влияние на формирование третичной структуры оказывают размер, форма и полярность аминокислотных остатков. Третичная структура многих белков составляется из нескольких компактных глобул, называемых доменами. Между собой домены обычно бывают связаны тонкими перемычками – вытянутыми полипептидными цепями.
Термин четвертичная структура относится к макромолекулам, в состав которых входит несколько полипептидных цепей (субъединиц), не связанных между собой ковалентно. Между собой эти субъединицы соединяются водородными, ионными, гидрофобными и другими связями. Примером может служить макромолекула гемоглобина.
Понятие о ферментах.
Катализ многочисленных биохимических реакций, протекающих в растительных и животных организмах и их клетках, так же как и в одноклеточных микроорганизмах, совершается ферментами (энзимами).
Ферменты представляют, собой вещества или чисто белковые структуры, или протеиды-белки, связанные с небелковой простетической группой. Число уже известных ферментов очень велико. Считают, что одна клетка бактерии использует до 1000 разных ферментов. Однако лишь для не многих установлено строение. Примерами чисто белковых ферментов могут служить протеолитические ферменты пищеварения, такие как пепсин и трипсин. Известны случаи, когда один и тот же белок несет в организме и структурную и ферментную функцию. Примером служит белок мышц миозин, каталитически разлагающий аденозинтрифосфат – реакция, в данном случае дающая энергию сокращения мышцы.
Витамины – группы веществ обычно довольно сложной структуры, часто очень далеких химически друг от друга и объединяемых только по биологическому признаку. Это – требуемые в микроколичествах, но совершенно необходимые составные части пищи, недостаток которых вызывает болезнь, а отсутствие – гибель организма. Используя витамины(но не только их), организм человека и животных и строит свои ферменты. Одно и тоже вещество, служащее для организмов одного вида витамином, для других организмов может и не быть витамином по двум причинам: либо он может его синтезировать сам. Так аскорбиновая кислота – витамин для человека, но для крысы она не является витамином, так как организм крысы создает ее из глюкозы. Некоторые витамины имеют весьма универсальный характер и необходимы всем организмам – от одноклеточных(дрожжей и бактерий) до человека. Зеленые растения способны производить все свои вещества из минеральных исходных веществ и CO2 и, следовательно, не нуждаются в витаминах.
Для действия ряда белковых ферментов в организме необходимо присутствие микроколичеств ионов некоторых металлов-активаторов (Mg, Zn, Mo, Mn, Cu), которые витаминами не считаются. В состав некоторых коферментов и соответствующих витаминов входят металлы (железо, кобальт). Очень существенна роль микроколичеств металлов (микроэлементов) для развития растений; по-видимому, эти микроэлементы используются для постороения ферментов и служат как бы «витаминами растений».
Ферменты являются катализатороми, но отличаются от обычных катализаторов. Так им свойственны:
1. Гораздо большая специфичность по отношению к структуре катализируемого объекта и по отношению к реакции.
2. Полная стереохимическая специфичность.
3. Гораздо большая скорость протекания ферментных реакций по сравнению с теми же реакциями, катализируемыми обычнами катализаторами.
4. Невысокие оптимумы температуры их действия(обычно активность ферментов резко падает к 50О С и в интервале 50-100О С действие их полностью прекращается).
5. Денатурируемость- необратимая потеря каталитической активности при нагревании до 50-100О С. Существуют, однако, ферменты (трипсин, рибонуклеаза), активность которых восстанавливается по охлаждении даже после кипячения.
6. Существование оптимума кислотной среды для действия каждого фермента.
Высокая скорость ферментативных реакций объясняется, с одной стороны, как всегда при катализе, сильным снижением энергии активации реакции. Так, при катализе, сильным снижением энергии активации реакции. Так, при гидролизе казеина кислотой энергии активации 20,6 ккал/моль, а при гидролизе трипсином-только 12 ккал/моль. Гидролиз сахарозы кислотой требует энергии активации 25,5 ккал/моль, а ферментативный (сахарозой)-лишь 12-13 ккал/моль. С другой стороны, в ферментативных реакциях не меньшую роль играет предэкспоненциальный множитель уравнения Арреннуса, так как величина этого множителя, как правило, на много порядков выше, чем в реакциях обычного типа. Есть доказательство того, что ферменты содержат центры(«карманы»), фиксирующие субстрат на поверхности их молекул, и вторые центры, осуществляющие реакцию. Фермент может быть активен в том смысле, что он подтягивает активный центр к месту действия, несколько изменяя свою вторичную или третичную структуру.
Список используемой литературы:
1. А.Н.Несмеянов, Н.А.Несмеянов «Начала органической химии», т.1, 2.
2. Б.А.Павлов, А.П.Терентьев «Курс органической химии».
3. Химическая энциклопедия, т. 1.
4. Дж.Робертс, М.Касерио «Основы органической химии».
5. Шабаров Ю.С. «Органическая химия»
Саратовский Государственный Университет им. Н.Г.Чернышевского.
Тема: Аминокислоты. Белки.
гр. 212.
1999г.
www.ronl.ru
Содержание:
Введение
Классификация аминокислот
Виды изомерии аминокислот
Двухосновные моноаминокислоты
Одноосновные диаминокислоты
Оксиаминокислоты
Серосодержащие аминокислоты
Гетероциклические аминокислоты
Способы получения аминокислот
Химические свойства аминокислот:
А) Свойства аминокислот, зависящие от наличия карбоксила.
Б) Свойства аминокислот, зависящие от наличия аминогруппы.
В) Свойства аминокислот, зависящие от совместного наличия карбоксильной и аминогруппы
Окислительно-восстановительные процессы, протекающие с участием аминокислот.
Связывание минерального азота аминокислотами.
Список использованной литературы
Введение
Аминокислоты — такие кислоты, которые помимо карбоксильной группы содержат аминогруппу Nh3 .
Классификация аминокислот
1) по углеводородному радикалу (предельные, непредельные, ароматические, циклические, гетероциклические.)
2) по числу карбоксильных групп (одноосновные, двухосновные и тд.)
3) по числу аминогрупп (моноамино, диамино и тд.)
4) по наличию других функциональных групп (оксиаминокислоты, серосодержащие аминокислоты)
Виды изомерии аминокислот
1) изомерия углеродного скелета
2) изомерия положения аминогруппы: 2,β, γ и α
В природных условиях, как правило, встречаются α-аминокислоты. Они образуют мономерные звенья белковых молекул, то есть входят в состав белка.
3) оптическая изомерия. Аминокислоты, которые встречаются в природе L-ряда. Рассмотрим оптическую изомерию на примере α-аминопропионовой кислоты.
Сh4 – * CH – C = O α-аминопропионовая кислота, или аланин.
Nh3 OH
Оптические изомеры:
ОН OH
С = О C = O
Н – С – Nh3 h3 N – C – H
Ch4 Ch4
D-изомер(-) L- изомер (+)
L – изомеры отличаются от D – изомеров вкусом. D-изомеры сладкие, а L- изомеры горькие или безвкусные. Природные аминокислоты это L- изомеры. В биологическом отношении аминокислоты очень важные соединения, так как из их остатков строятся белковые молекулы. В состав белков входят 20-25 аминокислот. Это следующие:
1) Сh3 – C = O аминоуксусная кислота, или глицин
Nh3 OH
2)Ch4 – CH – C = O α- аминопропионовая кислота, аланин
Nh3 OH
3) Сh4 – CH – CH – C = O валин
Ch4 Nh3 OH
4) Ch4 – CH – Ch3 – CH – C = O лейцин
Ch4 Nh3 OH
5) Ch4 – Ch3 – CH – CH – C = O изолейцин
Ch4 Nh3 OH
6) C6 H5 – Ch3 – CH – C = O фенилаланин
Nh3 OH
Двухосновные моноаминокислоты
1) O = C – CH – Ch3 – C = O аспарагиновая кислота
HO Nh3 OH
Амид этой кислоты называется аспарагин. Причем на аминогруппу замещается гидроксил наиболее удаленный от аминогруппы:
O = C – CH – Ch3 – C = O — аспарагин
HO Nh3 Nh3
2) O = C – CH – Ch3 – Ch3 – C = O — глутаминовая кислота
HO Nh3 OH
O = C – CH – Ch3 – Ch3 – C = O – глутамин (амид глутаминовой кислоты)
HO Nh3 Nh3
Одноосновные диаминокислоты
1) Ch3 – Ch3 – Ch3 – CH – C = O — орнитин
Nh3 Nh3 OH
2) Ch3 – Ch3 – Ch3 – Ch3 – CH – C = O — лизин
Nh3 Nh3 OH
3) NH = C – NH – Ch3 – Ch3 — Ch3 – CH – C = O -аргинин, в процессе обмена преобразуется в к-ту цитруллин
Nh3 Nh3 OH
4) Nh3 – C – NH – Ch3 – Ch3 – Ch3 – CH – C = O -цитруллин
O Nh3 OH
Оксиаминокислоты
1) Сh3 – CH – C = O — серин
OH Nh3 OH
2) Ch4 – CH – CH – C = O — треонин
OH Nh3 OH
3) HO –C6 h5 – Ch3 – CH – C = O – оксифенилаланин или тирозин
Nh3 OH
Серосодержащие аминокислоты
1) Ch3 – CH – C = O — цистеин
SH Nh3 OH
2) Ch3 – CH – C = O — цистин
S Nh3 OH
S
Ch3 – CH – C = O
Nh3 OH
3) Ch4 – S – Ch3 – Ch3 –CH – C = O метионин
Nh3 OH
Гетероциклические аминокислоты
1) h3C Ch3 2) OH – HC Ch3
OH
h3 C CH – C = O h3 C CH – C =O
NH OH NH
пролин оксипролин
3) N C – Ch3 – CH – C = O 4) CH Nh3 OH
Nh3 OH HC C C – Ch3 – CH – C = O
HC CH HC C CH
NH CH NH
гистидин триптофан
Среди всех аминокислот 9 являются незаменимыми, то есть они в тканях синтезироваться не могут и должны поступать с пищей. Это кислоты:
1) Валин;
2) Лейцин;
3) Изолейцин;
4) Фенилаланин;
5) Лизин;
6) Треонин;
7) Метионин;
8) Гистидин;
9) Триптофан.
Способы получения аминокислот
1.Аминокислоты получаются при гидролизе белка, который протекает при нагревании белковых веществ при температуре равной 1000С, в присутствии серной кислоты в течении 24-48 часов. Этот способ применяется при количественном и качественном определении аминокислот в белке, как правило, методом хроматографии.
2.Действие аммиака на галогенкислоты :
Ch3 – C = O + Nh4 HCL + Ch3 – C = O
CL OH Nh3 OH
хлоруксусная глицин
кислота
3. Присоединение аммиака к непредельным кислотам (таким способом получают β-аминокислоты).
Ch3 = CH – C = O + HNh3 Ch3 – Ch3 – C = O
OH Nh3 OH
акриловая к-та β – оксипропионовая к-та
Присоединение водорода идет против правила Марковникова, так как сопряженные двойные связи.
4.Восстановительное аминирование. Протекает в растительных и животных организмах. Это способ связан с введением аминогруппы в кетокислоту. Протекает в два этапа:
ОН OH ОН
С = О +Nh4 C = O +2H. С = O
С = О -h3O C = NH СH – Nh3
СН3 Ch4 Ch4
пировино- иминокислота аланин
градная к-та
Химические свойства аминокислот:
Они зависят от наличия:
1)карбоксильной группы
2)аминогруппы
3)от совместного наличия двух этих групп.
А) Свойства аминокислот, зависящие от наличия карбоксила.
Аминокислоты, как и любые кислоты, способны образовывать: а)соли; б)галогенангидриды; в)сложные эфиры; г)амиды; д)ангидриды; е)подвергаются декарбоксилированию.
R – CH – C = O + h3 O — соль
Nh3 ONa Nh3 CL
R – CH – C = O –хлорангидрид
R – CH – C = O R – CH – C = O + h3 O
Nh3 OH Nh3 O – Ch4 – сложный эфир
R – CH – C = O + h3 O
Nh3 Nh3 – амид
R – Ch3 — амин
Nh3
Реакция декарбоксилирования аминокислот протекает в присутствии ферментов декарбоксилаз, а также при разложении белковых соединений, в результате таких реакций образуются амины (низшие амины содержатся в кишечных газах и имеют неприятный запах).
Nh3 – Ch3 – Ch3 – Ch3 – Ch3 – CH – C = O -CO2 Nh3 – (Ch3 )5 – Nh3
лизин Nh3 OH диамин пептаметилендиамин (кадаверин)
Б) Свойства аминокислот, зависящие от наличия аминогруппы.
1) Реакции ацилирования (ацил- радикал кислоты). По этой реакции один водород аминогруппы замещается на радикал кислоты – ацил. Примером может служить реакция обезвреживания бензойной кислоты в организме животных:
C6 H5 – C = O + HNh3 – Ch3 – C = O C6 H5 – C = O OH
OH OH NH – Ch3 – C = O
бензойная к-та глицин гиппуровая к-та
2) Реакция аминирования (амин- углеводородный радикал). По этой реакции один водород аминогруппы замещается на углеводородный радикал – амин (такие реакции проводятся в лаборатории, когда надо протитровать аминокислоту, то есть количественно определить аминокислоту).
OH
Ch4 – CH – C = O + Ch4 – I HI + Ch4 – CH – C = O
Nh3 OH NH – Ch4
аланин пористый
метил
По этой реакции аминогруппа как бы зажимается в тиски, блокируется и становится нереакционноспособной. Реакционноспособной становится только карбоксильная группа.
3) Реакции дезаминирования. Дезаминирование- это отщепление аминогруппы в виде аммиака. Такие реакции протекают в обменных процессах, а часто и при нарушении обмена. Они ведут к распаду аминокислот. Различают четыре вида дезаминирования:
а) окислительное дезаминирование.
OH OH OH
C = O +O C = O +h3O C = O + Nh4
CH – Nh3 ОКИСЛЕНИЕ C = NH C = O
Ch4 Ch4 Ch4
аланин иминокислота кетокислота (пировиноградная)
Окислительное дезаминирование – процесс, обратный восстановительному аминированию.
б) восстановительное дезаминирование. Протекает под действием водорода:
OH OH
C = O +2H C = O + Nh4
CH – Nh3 Ch3
Ch4 Ch4
аланин пропионовая(предельная) к-та
в) гидролитическое дезаминирование. Протекает под действием воды. При этом из аминокислоты образуются оксикислоты:
OH OH
C = O +HOH C = O + Nh4
CH – Nh3 CH – OH
Ch4 Ch4
аланин оксикислота (молочная)
г) внутримолекулярное дезаминирование :
R R
Ch3 CH
CH – Nh3ПРОТЕКАЕТ В ОСНОВНОМ В МИКРООРГАНИЗМАХ CH + Nh4
C = O C = O
OH OH
непредельная к-та
Основной путь дезаминирования – это окислительное дезаминирование. Этот вид дезаминирования преобладает у животных, растений и большинства микроорганизмов. Происходит под действием ферментов дегидрогеназ. Однако, активность дегидрогеназы тканей животных для большинства аминокислот очень низкая. Активна только дегидрогеназа глутаминовой кислоты. Поэтому большинство аминокислот в организме животных дезаминируются непрямым путем. Непрямое окислительное дезаминирование характеризуется предварительным переаминированием аминокислот с α- кетоглутаровой кислотой:
COOH COOH
R Ch3 R Ch3
CH – Nh3 + Ch3 C = O + Ch3
COOH C = O COOH CH – Nh3
COOH COOH
амино- α-кетоглутаровая кетокис- глутаминовая
кислота к-та лота кислота
Образующаяся при этом глутаминовая кислота затем дезаминируется под действием глутаматдегидрогеназы до α-кетоглутаровой кислоты, которая может снова участвовать в непрямом дезаминировании других аминокислот.
COOH COOH COOH
Ch3 Ch3 Ch3
Ch3-2H Ch3+h3O Ch3 + Nh4
CH – Nh3 C = NH C = O
COOH COOH COOH
глутаминовая иминокислота α-кетоглутаовая к-та
к-та
В) Свойства аминокислот, зависящие от совместного наличия карбоксильной и аминогруппы
1)Амфотерные свойства одноосновных моноаминокислот. Реакция водных растворов таких аминокислот на лакмус нейтральна. Это объясняется тем, что карбоксильная группа обладает кислотными свойствами, а аминогруппа – основными. Эти группы взаимодействуют с образованием, так называемых внутренних солей. Внутренние соли – это соли, образующиеся в результате взаимодействия кислотных и основных групп, находящихся в пределах одной и той же молекулы. При образовании внутренних солей аминокислот ион водорода отщепляется от карбоксильной группы и присоединяется к аминогруппе, которая превращается как бы в ион замещенного аммония. Например, для аланина:
Ch4 – CH – C = O Ch4 – CH – C = O -
Nh3 OH + Nh4 O
внутренняя соль (имеет два полюса + и -).
ОН
Такие аминокислоты ( с одной – С = О и одной Nh3 ) обладают амфотерными свойствами, они могут реагировать как с кислотами, так и с основаниями, образуя при этом комплексные соли. Взаимодействие аминокислоты с кислотой:
Ch4 – CH – C = O + H+ CL- Ch4 – CH – C = O +
+ Nh4 O- Nh4 OH CL-
комплексная соль, где аминокислота является катионом
Взаимодействие со щелочью:
Ch4 – CH – C = O + NaOH Ch4 – CH – C = O –
+ Nh4 O- Nh3 O- Na+ + h3 O
комплексная соль, где аминокислота является анионом
2) Образование ди- три и полипептидов. Эта реакция протекает в организме под действием ферментов пептидаз. Она ведет к образованию первичной структуры белка. При образовании дипептида две аминокислоты связываются пептидной связью. При этом одна аминокислота реагирует карбоксильной группой, а другая – аминогруппой.
Ch4 – CH – C = O + HNH – Ch3 – C = O -h3O Ch4 – CH – C – NH – Ch3 – C = O
Nh3 OH OH Nh3 O OH
аланин глицин дипептидаланинглицин
– С = О -пептидная связь
NH
Та аминокислота, от которой уходит гидроксил карбоксильной группы, то есть остается кислотный радикал – ацил, меняет окончание «ин» на «ил».
3) Особое поведение аминокислот при нагревании, в присутствии водоотнимающих веществ.
а) α- аминокислоты при нагревании образуют циклические амиды – дикетопиперазины. взаимодействуют две молекулы :
h4 C h4 C
CH – C = O CH – C = O
h3 N OH -2h3O NH NH
HO Nh3 O = C – HC
O = C – CH Ch4
Ch4 дикетопиперазин (2, 5 –диметил – 3, 6 дикетопиперазин)
Для разных кислот радикалы при группе – СН могут быть разными, а ядро дикетопиперазина одно и то же. По мнению русских ученых Землинского, Садикова дикетопиперазины содержатся в полипептидных цепях. Они связывают остатки аминокислот также, как и пептидные связи.
б) β-аминокислоты при нагревании теряют молекулу аммиака и превращаются в непредельные кислоты.
Ch4 – CH – Ch3 – C = O -Nh4 Ch4 – CH = CH – C = O
Nh3 OH OH
Β-аминомасляная к-та кротоновая к-та
в) γ-аминокислоты при нагревании, выделяя воду, образуют внутримолекулярные циклические амиды, так называемые лактамы:
Ch3 – Ch3 – Ch3 – C = O h3 C – Ch3
Nh3 OH h3 C C = O — лактам γ-аминомасляной к-ты
γ-аминомасляная к-та NH
Лактам капроновой кислоты при полимеризации образует волокно-капрон.
Окислительно-восстановительные процессы, протекающие с участием аминокислот .
Эти процессы протекают в организмах растений и животных. Имеются такие соединения, которые способны либо выделять водород, либо поглощать его (присоединять). При биологическом окислении идет отщепление двух атомов водорода, а при биологическом восстановлении – присоединение двух томов водорода. Рассмотрим это на примере цистеина и цистина.
Ch3 – CH – C = O Ch3 – CH – C = O
HS Nh3 OH -2H S Nh3 OH
HS Nh3 OH +2H S Nh3 OH
Ch3 – CH – C = O Ch3 – CH – C = O
цистеин цистин
восстановленная форма окисленная форма
Две молекулы цистина, теряя два атома водорода, образуют окисленную форму – цистеин. Этот процесс обратимый, при присоединении двух атомов водорода к цистину образуется цистеин — восстановленная форма. Аналогично протекает процесс окислительно- восстановительный на примере трипептида – глутатиона, который состоит из трех аминокислот: глутаминовой, глицина и цистеина.
цистеин
O = C – NH – CH – Ch3 – SH O = C – NH – CH – Ch3 – S – S –Ch3 – CH – NH – C = O
Ch3 C = O -2Н Ch3 C = O C = O Ch3
Ch3 NH +2Н Ch3 NH NH Ch3
CH – Nh3 Ch3 глицин CH – Nh3 Ch3 Ch3 CH – Nh3
C = O C = O C = O C = O C = O C = O
OH OH OH OH OH OH
(2 молекулы)
трипептид восстановленная форма гексапептид – окисленная форма
При окислении отщепляется 2 атома водорода и соединяются две молекулы глутатиона и трипептид превращается в гексапептид, то есть окисляется.
Связывание минерального азота аминокислотами .
У растений при избытке азота в почве аминокислоты (аспарагиновая и глутаминовая) способны связывать его в виде аммиака с образованием амидов – глутамина и аспарагина.
OH Nh3
C = O C = O
Ch3 Ch3
Ch3 + Nh4 Ch3
CH – Nh3 CH – Nh3
C = O C = O
OH OH
глутаминовая к-та глутамин
Аналогично идет образование аспарагина. В организмах животных также образуются амиды аспарагиновой и глутаминовой кислот, которые являются резервом (депо) азота.
Аммиак, который образуется при дезамиировании аминокислот, может связываться аспарагиновой и глутаминовой кислотами. При этом образуются амиды аспарагин и глутамин.
Список использованной литературы:
1) Овчинников Ю.А. Биоорганическая химия / Ю.А. Овчинников. – М.: Просвещение, 1987.
2) Яковишин Л.А. Избранные главы биоорганической химии / Л.А. Яковишин. – Севастополь: Стрижак-пресс, 2006.
3) Филиппович Ю.В. Основы биохимии. — М., 2007
4) Нейланд О.Я. Органическая химия.- М., 1990
www.ronl.ru
|
|
|
Тривиальное название | Сокр.название ос- татка ами нок-ты | Формула | Температура плавления, 0С. | Растворимость в воде при 250С, г/100г. |
Моноаминомонокарбоновые кислоты | ||||
| Гликокол или глицин | Gly | h3NCh3COOH | 262 | 25 |
| Аланин | Ala | h3NCH(Ch4) COOH | 297 | 16,6 |
| Валин | Val | h3NCHCOOH ï CH(Ch4)2 | 315 | 8,85 |
| Лейцин | Leu | h3NCHCOOH ï Ch3CH(Ch4)2 | 337 | 2,2 |
| Изолейцин | He | h3NCHCOOH ï Ch4 ─ CH ─ C2H5 | 284 | 4,12 |
| Фенилаланин | Phe | h3NCHCOOH ï Ch3C6H5 | 283 (разл.) | ― |
Моноаминодикарбоновые кислоты и их амиды | ||||
| Аспарагиновая кислота | Asp(D) | h3NCHCOOH ï Ch3COOH | 270 | 0,5 |
| Аспарагин | Asn(N) | h3NCHCOOH ï Ch3CONh3 | 236 | 2,5 |
| Глутаминовая кислота | Glu(E) | h3NCHCOOH ï Ch3Ch3COOH | 249 | 0,84 |
| Глутамин | Gln(Q) | h3NCHCOOH ï Ch3Ch3CONh3 | 185 | 4,2 |
Диаминомонокарбоновые кислоты | ||||
| Орнитин(+) | Orn | h3NCHCOOH ï Ch3Ch3Ch3 Nh3 | 140 | ― |
| Лизин | Lys(K) | h3NCHCOOH ï Ch3Ch3Ch3 Ch3Nh3 | 224 | Хорошо растворим |
Аминокислоты | ||||
| Аргинин | Arg® | h3NCHCOOH ï Ch3 ï Ch3Ch3 NH ─ C ─ Nh3 ║ NH | 238 | 15 |
Гидроксиаминокислоты | ||||
| Серин | Ser(S) | h3NCHCOOH ï Ch3OH | 228 | 5 |
| Треонин | Tre(T) | h3NCHCOOH ï Ch3 (OH)Ch4 | 253 | 20,5 |
| Тирозин | Tyr(Y) | h3NCHCOOH ï Ch3C6h5OH-n | 344 | ― |
Тиоаминокислоты | ||||
| Метионин | Met(M) | h3NCHCOOH ï Ch3Ch3SCh4 | 283 | 3,5 |
Цистин | (Cys)2 | 2 | 260 | 0,011 |
| Цистеин | Cys© | h3NCHCOOH ï Ch3SH | 178 | Хорошо растворим |
Гетероциклические аминокислоты | ||||
Триптофан | Try(W) | h3NCHCOOH ï h3C NH | 382 | 1,14 |
Пролин | Pro(P) | h3C Ch3 ï ï h3C CHCOOH NH | 299 | 16,2 |
Оксипролин | Opr | HOHC Ch3 ï ï h3C CHCOOH NH | 270 | 36,1 |
Гистидин | His(H) | Nh3CHCOOH ï h3C ―C ―― CH ï ï N NH CH | 277 | 4,3 |
|
|
|
|
|
|
|
|
|
works.tarefer.ru