Входные контрольные работы по химии, 9-11 классы
Рассмотрено Согласовано Утверждаю
На заседании ШМО Заместителем директора по УВР Директор МОУ Дмитриево
Протокол от _______2017 МОУ Дмитриево Помряскинская СШ Помряскинская СШ
№__________ _________________Витман Д.А. ______________Дубровская Ю.А.
Протокол МС от ________2017 №_____ Приказ от ______2017 №_______
Входной контроль по химии 9 класс
Вариант 1
Задание 1. Дайте полную характеристику элементу с порядковым номером 15.
Задание 2. Допишите реакции, назовите сложные вещества, укажите тип реакции:
а) AI + O2
б) Mg + h3SO4
в) CaCO3
г) HCI + Na2CO3
Задание 3. Допишите реакции и напишите их в ионных формах? Дайте названия веществам:
а) BaCI2 + h4PO4
б) НСI + AgNO3
Задание 4. Составьте реакции, расставьте коэффициенты, укажите тип реакций:
а) фосфор + кислород оксид фосфора (V)
б) цинк + азотная кислота нитрат цинка + водород
в) хлорид бария + серная кислота
Задание 5. Рассчитайте объём углекислого газа (при н.у.), если он выделился при взаимодействии 250 г мела, содержащего 10 % примесей с серной кислотой.
Рассчитайте объём углекислого газа (при н.у.), если он выделился при взаимодействии 250 г мела, содержащего 10 % примесей с серной кислотой.
Рассмотрено Согласовано Утверждаю
На заседании ШМО Заместителем директора по УВР Директор МОУ Дмитриево
Протокол от _______2017 МОУ Дмитриево Помряскинская СШ Помряскинская СШ
№__________ _________________Витман Д.А. ______________Дубровская Ю.А.
Протокол МС от ________2017 №_____ Приказ от ______2017 №_______
Входной контроль по химии 9 класс
Вариант 2
Задание 1. Дайте полную характеристику элементу с порядковым номером 19.
Задание 2 Допишите реакции, назовите сложные вещества, укажите тип реакции:
а) Zn + O2
б) Mg + HCI
в) h3O
г) h3SO4 + K2CO3
Задание 3. Допишите реакции и напишите их в ионных формах? Дайте названия веществам:
а) Ba(NO3)2 + h4PO4
б) NaСI + AgNO3
Задание 4. Составьте реакции, расставьте коэффициенты, укажите тип реакций:
Составьте реакции, расставьте коэффициенты, укажите тип реакций:
а) фосфор + кислород оксид фосфора (III)
б) цинк + соляная кислота хлорид цинка + водород
в) хлорид меди + гидроксид натрия
Задание 5. Рассчитайте объём углекислого газа (при н.у.), если он выделился при взаимодействии 230 г раствора содержащего 10 % карбоната натрия с азотной кислотой.
Спецификация тестовой контрольной работы
(входной контроль) по химии 9 класс
Назначение работы – контроль уровня подготовки учащихся по химии за курс 8 класса.
Время проведения – 40 минут (1 урок).
Общая характеристика содержания и структуры работы:
Работа состоит из одной части, содержащей 5 заданий требующих решений.
С помощью заданий, направленных на проверку базового уровня подготовки по химии, проверяется знание и понимание важных элементов содержания (понятий, их свойств, приемов решения заданий и пр. ), владение основными алгоритмами, умение применить знания при решении химических задач. При выполнении этих заданий учащиеся также должны продемонстрировать определенную системность знаний и широту представлений, умение переходить с одного химического языка на другой.
), владение основными алгоритмами, умение применить знания при решении химических задач. При выполнении этих заданий учащиеся также должны продемонстрировать определенную системность знаний и широту представлений, умение переходить с одного химического языка на другой.
Проверке подлежит материал основных химических блоков, на которые распределено содержание школьного курса химии: «Строение атома химического элемента», «Полная характеристика химического элемента» «Номенклатура неорганических веществ», «Типы химических реакций», «Реакции ионного обмена», «Составление химических реакций по схеме», «Решение химических задач с использованием понятия примеси», «Решение химических задач на растворы».
№ задания | Проверяемые элементы содержания | Уровень сложности | Тип задания |
1 | Строение атома химического элемента | Базовый | Выполнение действий (решение) |
1 | Полная характеристика химического элемента | Базовый | Выполнение действий (решение) |
2 | Номенклатура неорганических веществ | Базовый | Выполнение действий (решение) |
2,4 | Типы химических реакций | Базовый | Выполнение действий (решение) |
3 | Реакции ионного обмена | Базовый | Выполнение действий (решение) |
4 | Составление химических реакций по схеме | Базовый | Выполнение действий (решение) |
5 | Решение химических задач с использованием понятия примеси | Базовый | Выполнение действий (решение) |
5 | Решение химических задач на растворы | Базовый | Выполнение действий (решение) |
Критерии оценивания – первое и пятое задания оцениваются до 5 баллов, каждый верный ответ 2-4 задания (под каждой буквой) оценивается в 1 балл. За неверный ответ или отсутствие ответа выставляется 0 баллов. Максимальное количество баллов в работе – 19. Рекомендуемая шкала перевода баллов в оценку:
За неверный ответ или отсутствие ответа выставляется 0 баллов. Максимальное количество баллов в работе – 19. Рекомендуемая шкала перевода баллов в оценку:
Баллы | 0 – 7 | 8 – 13 | 14 – 16 | 17 – 19 |
Оценка | 2 | 3 | 4 | 5 |
Ответы к заданиям. Вариант 1
Задание 1.
1. Р –сера, неметалл
2. Расположен в пятой группе ПС, главной подгруппы, в 3 периоде.
3. 15 Р р+ 15 n016 1S2 2S22P6 3 S2 3P5 3 d0
e-15
4. Неметаллические свойства в периоде слева на право увеличиваются.
Неметаллические свойства в периоде слева на право увеличиваются.
5. Неметаллические свойства в группах сверху вниз уменьшаются
6. Р2О5- формула высшего оксида, проявляет окислительные свойства
7. РН3 – формула водородного летучего соединения, фосфин.
Задание 2.
а)4 AI + 3O2 2 AI2O3- оксид алюминия, реакция соединения
б) Mg + h3SO4(серная кислота) Mg SO4 (сульфат магния)+ h3- реакция замещения
в) CaCO3(карбонат кальция) CaО (оксид кальция) + CO2 (оксид углерода(IV))- реакция разложения
г) 2HCI + Na2CO3 2Na CI + h3О + CO2 (оксид углерода(IV)) — реакция обмена
соляная кислота карбонат натрия хлорид натрия оксид водорода
Задание 3.
а) 3BaCI2 + 2h4PO4 Ba3 (PO4)2+ 6HCI
хлорид бария фосфорная кислота фосфат бария соляная кислота
3Ва2+ + 6CI- + 6Н+ + 2 PO43- Ba3 (PO4)2+ 6H+ + 6CI-
3Ва2++ 2 PO43- Ba3 (PO4)2
б) НСI + AgNO3 Ag СI +Н NO3
соляная кислота нитрат серебра хлорид серебра азотная кислота
Н+ + СI- + Ag+ + NO3- Ag СI +Н+ + NO3-
Ag+ + СI- Ag СI
Задание 4.
а) фосфор + кислород оксид фосфора (V)
4Р + 5О2 2Р2О5 – реакция соединения
б) цинк + азотная кислота нитрат цинка + вода + оксид азота (IV)
Zn +4 Н NO3 Zn(NO3)2 + 2h3O + 2 NO2 — реакция замещения
в) хлорид бария + серная кислота сульфат бария + соляная кислота
BaCI2+ h3SO4 2 НСI + BaSO4 — реакция обмена
Задание 5.
Дано: Решение:
m(CaCO3) = 250 г. 1. Найдём массу чистого карбоната натрия.
wпр= 10 % 100 г. с примесями — 90 г. чистого вещества
Vм = 22,4 л/моль 250 г. с примесями – X г. – чистого вещества
V(CO2) — ? m(CaCO3) = 250* 90/100 = 225 г.
2. Найдём объём углекислого газа.
225 г. v л. – по условию задачи
CaCO3 + h3SO4 Ca SO4 + h3О + CO2
100 г. 22,4 л. – по уравнению реакции
V(CO2) = 225*22,4/100=50,4 л.
Ответ: V(CO2) =50,4 л.
Ответы к заданиям. Вариант 2
Задание 1.
1. К – калий, металл.
К – калий, металл.
2. Расположен в ПС в первой группе, главной подгруппы, в четвёртом периоде.
3. 19 К р+ 19 n020 1S2 2S22P6 3 S2 3P6 3 d04S1
e-19
4. Металлические свойства в периоде слева на право ослабевают.
5. Металлические свойства в группах сверху вниз усиливаются
6. К2О- формула высшего оксида, проявляет основные свойства
7. Формула водородного летучего соединения — отсутствует
Задание 2.
а)2 Zn + O2 2 ZnО – оксид цинка, реакция соединения
б) Mg + 2HCI (соляная кислота) Mg CI2 (хлорид магния)+ h3 -реакция замещения
в) 2h3O (окисид водорода) 2h3 + О2 — реакция разложения
г) h3SO4 + K2CO3 K2 SO4 + h3О + CO2 (оксид углерода(IV)) — реакция обмена
Задание 3.
а)3 Ba(NO3)2 + 2h4PO4 Ba3 (PO4)2+ 6HNO3
нитрат бария фосфорная кислота фосфат бария азотная кислота
3Ba2+ + 6NO3- + 6H+ + 2PO43- Ba3 (PO4)2+ 6H + 6 NO3-
3Ва2++ 2 PO43- Ba3 (PO4)2
б) NaСI + AgNO3 Na NO3 + Ag СI
хлорид натрия нитрат серебра нитрат натрия хлорид серебра
Na+ + СI- + Ag+ + NO3- Na+ + NO3- + Ag СI
Ag+ + СI- Ag СI
Задание 4.
а) фосфор + кислород оксид фосфора (III)
4Р + 3О2 2Р2О3 – реакция соединения
б) цинк + соляная кислота хлорид цинка + водород
Zn + 2HCI ZnCI2 + h3 – реакция замещения
в) хлорид меди (II) + гидроксид натрия гидроксид меди(II) + хлорид натрия
CuCI2 +2 NaOH Cu(OH)2 + 2NaCI – реакция обмена
Задание 5.
Дано: Решение:
m(Na2 CO3) = 230 г. 1. Найдём массу чистого карбоната натрия.
wпр= 10 % 100 г. с примесями — 90 г. чистого вещества
Vм = 22,4 л/моль 230 г. с примесями – X г. – чистого вещества
V(CO2) — ? m(CaCO3) = 230* 90/100 = 207 г.
2. Найдём объём углекислого газа.
207 г. v л. – по условию задачи
Na2 CO3 +2 HNO3 2 Na NO3 + h3О + CO2
106 г. 22,4 л. – по уравнению реакции
V(CO2) = 207*22,4/106= 43,7л.
Ответ: V(CO2) =43, 67 л.
Рассмотрено Согласовано Утверждаю
На заседании ШМО Заместителем директора по УВР Директор МОУ Дмитриево
Протокол от _______2017 МОУ Дмитриево Помряскинская СШ Помряскинская СШ
№__________ _________________Витман Д. А. ______________Дубровская Ю.А.
А. ______________Дубровская Ю.А.
Протокол МС от ________2017 №_____ Приказ от ______2017 №_______
Входной контроль по химии 10 класс
Вариант 1
Задание 1. Дайте полную характеристику элементу с порядковым номером 25.
Задание 2. Уравняйте реакцию методом электронного баланса:
Н2О2 + КMnO4 + h3SO4 O2 + MnSO4 + K2SO4 + h3O
Задание 3. Допишите реакцию и напишите её в ионной форме:
BaCI2 + h4PO4
Задание 4. Напишите гидролиз соли, в том числе в ионных формах:
Na2S
Задание 5. Рассчитайте объём углекислого газа (при н.у.), если он выделился при взаимодействии 250 г мела, содержащего 10 % примесей с серной кислотой.
Рассмотрено Согласовано Утверждаю
На заседании ШМО Заместителем директора по УВР Директор МОУ Дмитриево
Протокол от _______2017 МОУ Дмитриево Помряскинская СШ Помряскинская СШ
№__________ _________________Витман Д.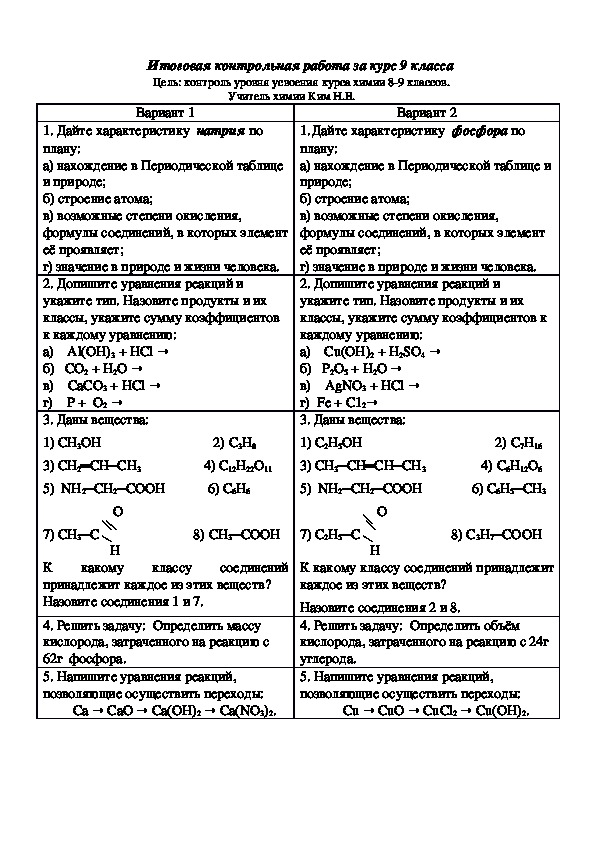 А. ______________Дубровская Ю.А.
А. ______________Дубровская Ю.А.
Протокол МС от ________2017 №_____ Приказ от ______2017 №_______
Входной контроль по химии 10 класс
Вариант 2
Задание 1. Дайте полную характеристику элементу с порядковым номером 30.
Задание 2. Уравняйте реакцию методом электронного баланса:
Na2 SО3 + КMnO4 + h3O Na2SO4 + MnO2 + KOH
Задание 3. Допишите реакцию и напишите её в ионной форме:
AICI3 + AgNO3
Задание 4. Напишите гидролиз соли, в том числе в ионных формах:
FeCI3
Задание 5. Рассчитайте объём водорода (при н.у.), если он выделился при взаимодействии 240 г магния, содержащего 12 % примесей с соляной кислотой.
Спецификация тестовой контрольной работы
(входной контроль) по химии 10 класс
Назначение работы – контроль уровня подготовки учащихся по химии за курс 9 класса.
Время проведения – 40 минут (1 урок).
Общая характеристика содержания и структуры работы:
Работа состоит из одной части, содержащей 5 заданий требующих решений.
С помощью заданий, направленных на проверку базового уровня подготовки по химии, проверяется знание и понимание важных элементов содержания (понятий, их свойств, приемов решения заданий и пр.), владение основными алгоритмами, умение применить знания при решении химических задач. При выполнении этих заданий учащиеся также должны продемонстрировать определенную системность знаний и широту представлений, умение переходить с одного химического языка на другой.
Проверке подлежит материал основных химических блоков, на которые распределено содержание школьного курса химии: «Строение атома химического элемента», «Полная характеристика химического элемента» «Номенклатура неорганических веществ», «Окислительно-восстановительные реакции», «Реакции ионного обмена», «Гидролиз веществ», «Решение химических задач с использованием понятия примеси».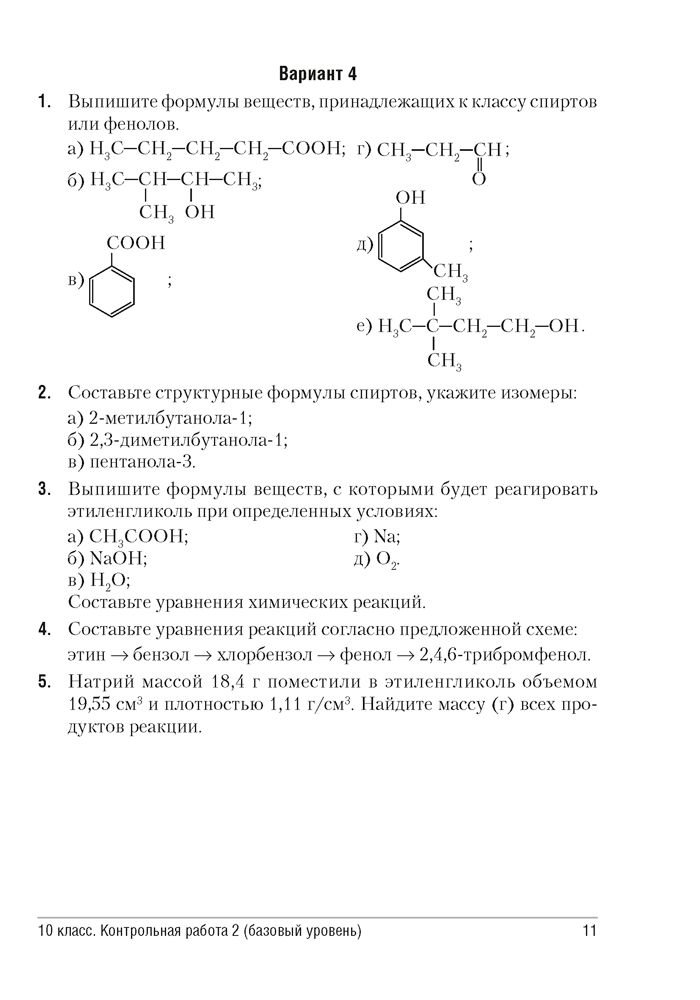
№ задания | Проверяемые элементы содержания | Уровень сложности | Тип задания |
1 | Строение атома химического элемента | Базовый | Выполнение действий (решение) |
1 | Полная характеристика химического элемента | Базовый | Выполнение действий (решение) |
2,3 | Номенклатура неорганических веществ | Базовый | Выполнение действий (решение) |
2 | Окислительно-восстановительные реакции | Базовый | Выполнение действий (решение) |
3 | Реакции ионного обмена | Базовый | Выполнение действий (решение) |
4 | Гидролиз веществ | Базовый | Выполнение действий (решение) |
5 | Решение химических задач с использованием понятия примеси | Базовый | Выполнение действий (решение) |
Критерии оценивания – первое и пятое задания оцениваются до 5 баллов, каждый верный ответ 2-4 задания оценивается в 2 балла. За неверный ответ или отсутствие ответа выставляется 0 баллов. Максимальное количество баллов в работе – 16. Рекомендуемая шкала перевода баллов в оценку:
За неверный ответ или отсутствие ответа выставляется 0 баллов. Максимальное количество баллов в работе – 16. Рекомендуемая шкала перевода баллов в оценку:
Баллы | 0 – 7 | 8 – 11 | 12 – 14 | 15 – 16 |
Оценка | 2 | 3 | 4 | 5 |
Ответы к заданиям. Вариант 1
Задание 1.
1. Мn – марганец, переходный металл.
2. Расположен в ПС в седьмой группе, побочной подгруппы, в четвёртом периоде.
3. 25 Мn р+ 25 n0 30 1S2 2S22P6 3 S2 3P6 3 d 54S2
e- 25
4. Металлические свойства в периоде слева на право ослабевают.
Металлические свойства в периоде слева на право ослабевают.
5. Металлические свойства в группах сверху вниз усиливаютс
Диагностические работы по химии(стартовый контроль 8-11 класс)
1 вариант.
Часть А. (вопросы с единичным выбором ответа)
1. В приведённом перечне вещество – это
1) алюминий 3) железный гвоздь
2) алюминиевая ложка 4) капля воды
2. В приведённом перечне физическое тело – это
1) жидкая вода 3) лёд
2) водяной пар
4) капля воды
3. Индивидуальным веществом является
1) морская вода 3) поваренная соль
2) сладкий чай 4) воздух
4. Для разделения смеси поваренной соли и речного песка следует проделать следующие операции:
1) фильтрование, выпаривание
2) растворение в воде, фильтрование, выпаривание
3) растворение в воде, выпаривание
4) растворение в воде, отделение раствора при помощи делительной воронки, выпаривание
5.



Входная контрольная работа по химии 11 класс ФГОС Школа России — 23 Января 2016
1. Вискозное волокно получают химической модификацией целлюлозы. Это волокно является1) натуральным 2) искусственным 3) синтетическим 4) природным
2. Вещества, не являющиеся природными полимерами…
1) белки 2) жиры 3) полисахариды 4) нуклеиновые кислоты
3. Среди продуктов полного гидролиза ДНК нельзя обнаружить
1) урацил 2) фосфорную кислоту 3) цитозин 4) дезоксирибозу
4. Комплементарной парой азотистых оснований в молекулах ДНК является
1) аденин-гуанин 2) гуанин-цитозин 3) аденин-цитозин 4) гуанин-тимин
5. Денатурацией называется
1) связывание белками молекул воды
2) частичное или полное разрушение пространственной структуры белков
3) расщепление полипептидной цепи под действием ферментов
4) потеря белковой молекулой электрич. заряда при определенной кислотности среды
6. Высокомолекулярное вещество, практически не изменяющееся при небольшом нагревании, а при сильном нагревании подвергающееся разложению, называется
1) термореактивным полимером 2) смолой 3) термопластичным полимером 4) саломасом
7. Полипропилен получают из вещества, формула которого
1) СН2 = СН2 2) СН ≡ СН 3) СН2 = СН – СН3 4) СН2 = С – СН3
СН3
8. Получение капрона ( — NH — (Ch3)5 – CO — ) n относится к реакции
1) изомеризации 2) полимеризации 3) поликонденсации 4) дегидратации
9. Многократно повторяется в молекуле полимера
1) степень полимеризации 2) мономер 3) молекула 4) структурное звено
10. Глобулярное строение полипептидной цепи – это структура белка
1) первичная 2) вторичная 3) третичная 4) четвертичная
11. Биополимер, построенный из остатков β — глюкозы– это
1) белок 2) крахмал 3) ДНК 4) целлюлоза
12. К термореактивным полимерам относится
1) полиэтилен 2) фенолформальдегидная смола 3) поливинилхлорид 4) полистирол
13. Верны ли утверждения: А. Все полимеры термопластичны
Б. У всех полимеров высокая молекулярная масса
1)верно только А 2) верно только Б 3) верны оба утверждения 4) неверно ни одно из утверждений
14. Установите соответствие между названием полимера и его формулой
ФОРМУЛА НАЗВАНИЕ ПОЛИМЕРА
(- СН — СН2 — )n
⎟
СН3
( — NH — (Ch3)6 – CO — ) n
(- СН2 — СН2 — ) n
(- СН — СН2 — )n
⎟
С6Н5
( — CН2 – СН = СН – СН2 — ) n
А. полистирол
Б. энант
В бутадиеновый каучук
Г. полиэтилен
Д. поливинилхлорид
Е. полипропилен
Ж. тефлон
15. Какой объем пропена потребуется для получения 1 кг полипропилена?
16. Решите цепочку CaC2 C2h3 C2h4Cl (- CH(Cl) – Ch3-)n
Азот и его соединения 11 класс по химии | Растворы
Аммиак Аммиак Аммиак Аммиак Аммиак
1. При каких условиях азот соединяется с водородом с образованием аммиака?
Ответ. Когда азот соединяется с водородом в объемном соотношении 1: 3 при низкой температуре и высоком давлении с железом в качестве катализатора и молибденом в качестве промотора, он образует аммиак.
N 2 + 3H 2 ↔ 2NH 3 + 92.6 кДжмоль -1
2. Что происходит, когда газообразный аммиак пропускается через нагретый CuO?
Ans — Когда газообразный аммиак проходит через нагретый CuO, он превращается в газообразный азот.
3CuO + 2NH 3 → 3Cu + N 2 + 3H 2 O
3. Чем ион аммония отличается от аммиака?
Ans- Ион аммония отличается от аммиака как;
Ион аммония | Аммиак |
Это положительный ион. | Это нейтральный газ. |
В водном растворе ион аммония действует как кислота. | В водном растворе аммиак действует как основание. |
4. Покажите, что азотная кислота содержит водород.
Ans-Металлы, которые являются более электроположительными, чем водород, и располагаются над ним в электрохимической последовательности, реагируют с HNO 3 с образованием образующегося водорода.
Zn + HNO 3 → Zn (NO 3 ) 2 + 2 [H]
Когда такие металлы, как магний и марганец, реагируют с очень разбавленной азотной кислотой, они выделяют газообразный водород, который показывает, что азотная кислота содержит водород
Mg + 2HNO 3 → Mg (NO 3 ) 2 + H 2
Это показывает, что азотная кислота состоит из водорода.
5. Изобразите структуру Льюиса N 2 O 5 .
Ans — структура Льюиса N 2 O 5 :
6. Объясните, почему газ NH 3 нельзя осушать с помощью обычного обезвоживающего агента, такого как конц. H 2 SO 4 , P 2 O 5 и CaCl 2 .
Ans — газообразный аммиак, являющийся основанием Льюиса, реагирует с H 2 SO 4 , P 2 O 5 и CaCl 2 с образованием сульфата аммония, фосфата аммония и хлорида аммония.
2NH 3 + H 2 SO 4 → (NH 4 ) 2 SO4
6NH 3 + P 2 O 5 + 3H 2 O $ \ to $ 2 (NH 4 ) 2 PO 4
2NH 3 + CaCl 2 → 2NH 3 Cl + 2Ca
Итак, газ NH 3 нельзя осушить с помощью обычного дегидратирующего агента, такого как конц. H 2 SO 4 , P 2 O 5 и CaCl 2
7.Что такое лабораторный тест на азотную кислоту?
Ans-лабораторный тест азотной кислоты объяснен ниже;
Свежеприготовленный раствор сульфата двухвалентного железа добавляют к разбавленной азотной кислоте или водному раствору нитратной соли и осторожно наливают концентрированную серную кислоту вдоль стенки пробирки. На стыке двух слоев образуется темно-коричневое кольцо.
Для нитратной соли реакция будет
NO 3 — + H 2 SO 4 → HNO 3 + HSO 4 — ] * 2
2HNO 3 → 2NO + H 2 O + 3 [O]
H 2 SO 4 + 2FeSO 4 + [O] → Fe 2 (SO 4 ) 3 + H 2 O] * 3
6FeSO 4 + 5 H 2 SO 4 + NO 3 — → 3 Fe 2 (SO 4 ) 3 + 2 HSO 4 — + 4H 2 O
FeSO 4 + NO → FeSO 4 .НЕТ
Закись азота сульфат железа (коричневое кольцо)
8. Почему азотную кислоту обычно хранят в коричневых бутылях?
Ans — Азотная кислота в присутствии солнечного света приобретает желтый цвет и разлагается на оксиды, такие как газ NO 2 и газ O 2 . Чтобы избежать этого, азотную кислоту обычно хранят в темно-коричневых бутылках.
4HNO 3 → 4NO 2 ↑ + 2H 2 O + O 2 ↑
9. Как превратить газообразный аммиак в мочевину? Напишите подходящую химическую реакцию.
Ans-Когда аммиак реагирует с CO 2 при давлении около 220 атм и температуре в диапазоне 130-150 ° C, он дает мочевину.
CO 2 + 2NH 3 → NH 2 CO NH 2 + H 2 O
Мочевина
10. Напишите 2–2 использования i) NH 3 ii) азотной кислоты
Ответ: аммиак используется двумя способами;
i) Аммиак из-за большой теплоты испарения используется в холодильном оборудовании.
ii) Используется для изготовления искусственного шелка.
Азотная кислота используется для двух целей:
i) Азотная кислота используется для нитрования различных соединений, таких как бензол, с получением нитробензола.
ii) Используется в производстве удобрений, таких как нитрат аммония, основная нитрат кальция и т. Д.
11. Газ получают действием концентрированной азотной кислоты на медь. Ответить на следующие вопросы;
i) Бесцветный ли газ?
ii) Является ли газ кислым или основным?
Ans- Газ, полученный при воздействии концентрированной азотной кислоты на медь, NO 2 .2HNO 3 → H 2 O + 2NO 2 + 3 [O]
[Cu + [O] → CuO] * 3
CuO + 2HNO 3 → Cu (NO 3 ) 2 + H 2 O
3Cu + 4HNO 3 → Cu (NO 3 ) 2 + 2NO 2 + 2H 2 O
i) Газ, то есть диоксид азота, имеет красновато-коричневый цвет при высокой и бесцветный при низкой температуре.
ii) NO 2 является основным газом, поскольку он имеет тенденцию растворяться в воде и выделять азотную кислоту и азотистую кислоту.
2НО 2 + H 2 O → HNO 3 + HNO 2
12) Комментарий к инертному поведению молекулы азота.
Ans-Nitrogen имеет 3 или 5 валентных электронов. Чтобы быть октетом, требуется как минимум 3 электрона, поэтому требуется тройная связь. Тройные узы очень сложно разорвать. Азот имеет очень высокий потенциал ионизации 1043 кДжмоль -1 . Таким образом, азот сохраняет полную валентную оболочку вместо того, чтобы вступать в реакцию с другими соединениями.Это называется инертным поведением азота.
13) Азот не может образовывать пентагалогениды, но фосфор образует. Объясни.
Ans — Азот не состоит из d-орбитали, поэтому он может образовывать только тригалогенид азота, но в случае фосфора d-орбиталь пуста, а s-орбиталь хорошо защищена d- и f-орбиталями. Итак, фосфор образует нестабильные пентагалогениды.
14) Что происходит, когда аммиак пропускается через раскаленный CuO?
Ответ — Когда газообразный аммиак пропускают через раскаленный CuO, он превращается в газообразный азот.
3CuO + 2NH 3 → 3Cu + N 2 ↑ + 3H 2 O
15) Почему газообразный диоксид азота имеет красновато-коричневый цвет при высокой температуре и бесцветный при низкой температуре?
Ans- При низкой температуре NO 2 димеризуется в N 2 O 4 . N 2 O 4 диамагнетик, поэтому он бесцветен. Но NO 2 парамагнитен и выглядит коричневым при высокой температуре.Таким образом, газообразный диоксид азота имеет красновато-коричневый цвет при высокой температуре и бесцветный при низкой температуре.
16) Нарисуйте структуру Льюиса
i) азотная кислота
Анс — структура Льюиса HNO 3
ii) азотистая кислота.
Ans-
17) Укажите условие оптимального выхода аммиака.
Ans — Аммиак образуется в результате обратимой экзотермической реакции, в которой количество молей реагентов превышает количество молей продукта. Итак, условия для оптимального выхода аммиака:
-Низкая температура
-Высокое давление
-Наличие катализатора
-Высокая концентрация реагентов.
18) Запишите ангидриды кислот i) HNO 3 ii) HNO 2
Ans- Кислотный ангидрид HNO 3 и HNO 2 — это N 2 O 5 и N 2 O 3 .
19) Что происходит, когда NH 3 переходит в (i) раствор FeSO 4 (ii) Ртуть-нитратную бумагу?
Ans — Когда аммиак пропускают через раствор FeSO 4 , Fe 3+ выпадает в осадок, приобретая грязно-зеленый цвет.
NH 3 + H 2 O → NH 4 OH
FeSO 4 + 2NH 4 OH → Fe (OH) 2 + (NH 4 ) 2 SO 4
Из-за образования аммиачной азотнокислой ртути и мелкодисперсной ртути при прохождении через нее аммиак становится черной.
Hg (NO 3 ) 2 + 2NH 3 → Hg + Hg (NH 2 ) N 3 + NH 4 NO 3
Черный ppt
Короткие ответы на вопросы:
1) Опишите экспериментально, аммиак хорошо растворяется в воде.
Ответ — Растворимость аммиака в воде очень высока i.е. при 273К 1 объем воды может растворить 1300 объемов аммиака. Высокая растворимость аммиака в воде может быть продемонстрирована экспериментом с фонтаном, который объясняется ниже;
Аммиак наливают в сухую колбу и фиксируют через пробку, в которую очень плотно вставляют капельницу, полную воды, и трубку, заканчивающуюся струей. Как показано на рисунке, колба закрепляется на подставке, а трубка опускается в воду. Вода в стеклянной трубке торопится в виде фонтана, если из капельницы внутри колбы вытечет несколько капель воды.Поскольку газообразный аммиак является щелочным по природе, фенолфталеин окрашивает воду в розовый цвет, если он находится в воде в желобе.
NH 3 + H 2 O → NH 4 OH
NH 4 OH ↔ NH 4 + + OH —
По мере растворения аммиака в воде, как только несколько капель воды попадают внутрь колбы, вода устремляется вверх из-за снижения давления внутри колбы.Этот эксперимент показывает, что аммиак хорошо растворяется в воде.
2) Что происходит, когда:
и. хлорид аммония нагревают с нитратом натрия.
Ans — При нагревании хлорида аммония с нитратом натрия образуются нитрат и соль аммония. Реакция представлена в химическом уравнении как;
NH 4 Cl + Na (NO 3 ) 2 → NH 4 (NO 3 ) 2 + NaCl
ii.аммиачный газ обрабатывают раствором нитрата ртути.
Ответ — Из-за образования аммиачной азотной кислоты и мелкодисперсной ртути, аммиак при прохождении через него превращает раствор нитрата ртути в черный цвет.
Hg (NO 3 ) 2 + 2NH 3 → Hg + Hg (NH 2 ) N 3 + NH 4 NO 3
Черный ppt
iii.газообразный аммиак реагирует с нагретым натрием?
Ans — Когда газообразный аммиак реагирует с нагретым натрием при температуре около 300 ° C, образуется газообразный натрий и водород.
Na + 2NH 3 2NaNH 2 + H 2 ↑
3) Объясните следующее:
и. исключительно высокие температуры плавления и кипения аммиака по сравнению с фосфином (PH 3 ).
Ans-Точки кипения и плавления аммиака очень высоки.Это потому, что NH 3 помимо дисперсионных сил демонстрирует водородные связи. Водородная связь увеличивает межмолекулярную силу притяжения и повышает как MP, так и BP. Поскольку PH 3 не имеет водородной связи, межмолекулярные силы, удерживающие PH 3 , являются только дисперсионными силами. Вот почему аммиак имеет исключительно высокие значения MP и BP по сравнению с газообразным фосфином.
ii. Белая часть твердого хлорида серебра, растворимого в растворе аммиака.
Ans — Хлорид серебра растворяется в растворе аммиака с образованием сложного растворимого соединения, называемого хлорид диамминсеребря (I).В этой реакции наблюдается белый осадок твердого AgCl в растворе аммиака.
AgCl + 2NH 4 OH → [Ag (NH 3 ) 2 ] Cl + 2H 2 O
хлорид диамминсеребра (I)
iii. аммиак хорошо растворяется в воде.
Ответ — Растворимость вещества в воде зависит от полярной природы. Поскольку вода является полярной молекулой, она легко растворяет другие полярные молекулы. Как мы говорим, «подобное растворяется в подобном», полярные соединения растворяют полярные молекулы.Растворимость газа в воде также зависит от температуры и давления газа. Газы растворяются в воде при высоком давлении и низкой температуре. Аммиак — это газ, растворимый в воде. Плюс наличие водородной связи увеличивает растворимость аммиака в воде. Таким образом, аммиак хорошо растворяется в воде.
4) Запишите действие азота с (а) карбидом кальция (б) горящей лентой Mg.
Ans — Когда азот реагирует с карбидом кальция при высокой температуре, он образует циамид кальция, который используется в качестве азотного удобрения.
CaC 2 + N 2 + тепло → CaCN 2 + C
Циамид кальция
При реакции аммиака с горящей лентой магния образуется нитрит магния.
3Mg + N 2 → Mg 3 N 2
5) Почему газообразный аммиак нельзя собирать над водой?
Ans- Газообразный аммиак хорошо растворяется в воде. При 273К 1 объем воды может растворить 1300 объемов аммиака.Таким образом, его нельзя собрать над водой, и, поскольку он легче воздуха, он собирается путем вытеснения воздуха вниз или собирается над ртутью.
6) Запишите химическую реакцию, когда
i) аммиак и оксид меди (II)
Ans-Когда аммиак реагирует с оксидом меди (II), образуется медь и газообразный азот.
3CuO + 2NH 3 → 3Cu + 3H 2 O + N 2 ↑
ii) аммиак и хлор.
Ответ: Когда избыток аммиака реагирует с хлором, образуется хлорид аммония и газообразный азот, а когда аммиак реагирует с избытком хлора, образуется трихлорид азота и хлорид аммония.
8NH 3 + 3Cl 2 → 6NH 4 Cl + N 2 ↑
избыток хлорида аммония
4NH 3 + 3Cl 2 → NCl 3 + 3NH 4 Cl
избыток трихлорида азота
7) Обсудите положение азота в таблице Менделеева.
Ans — Азот — элемент, наиболее распространенный в атмосфере Земли. Он находится в свободном состоянии в количестве около 75% по весу и 78% по объему в атмосфере. Атомный номер азота 7, а его атомный вес 14. Он помещен в качестве первого члена группы VA в периодической таблице и находится во 2-м периоде. Группа VA также называется семейством пникогенов, а их соединения называются пниктидами. Другими элементами семейства пникогенов являются фосфор (P), мышьяк (As), сурьма (Sb) и висмут (Bi).
Азот демонстрирует аномальное поведение по сравнению с другими элементами той же группы. Азот — единственный газ в группе VA периодической таблицы. Только азот и висмут из группы VA не являются четырехатомными. Оба они двухатомные. Азот образует водородную связь, а другие элементы — нет. Азот относительно инертен и показывает широкий диапазон O.S. от -3 до +5. Он имеет меньший размер и наибольшее значение электроотрицательности в группе. Но азот сохраняется в группе VA, потому что:
i) Он имеет конфигурацию валентной оболочки ns 2 , np 3 , как и все остальные элементы группы.
ii) Он имеет аллотропную форму, как и все другие элементы группы, кроме висмута.
iii) P-орбитали наполовину заполнены и обладают повышенной стабильностью.
Вопросы с длинным ответом:
1) Опишите производство газообразного аммиака по методу Габера с указанием принципа, условий реакции и хорошо обозначенной диаграммы. Как он реагирует с: а) хлором б) реактивом Несслера?
Ans-
В больших масштабах аммиак получают по способу Габера, цианамидному процессу или процессу Серпека.{450 {\ rm {C \: Fe}} \ & Mo \: 200 — 900 \: atm} $ 2Nh4 (г) + 22 ккал
Процесс Хабера
Это экзотермическая обратимая реакция, которая происходит при уменьшении объема. Принцип Ле Шателье предсказывает следующие благоприятные условия реакции:
Низкая температура — Поскольку мы знаем, что эта реакция является экзотермической реакцией, низкая температура благоприятна для образования аммиака. Но если температура ниже 450 ° C, N 2 и H 2 будут реагировать слишком медленно.Итак, для лучшей работы растений необходимо поддерживать температуру около 450-500 ° C.
Высокое давление — По мере того, как реакция протекает с уменьшением объема продукта, высокая температура 200-900 атм. способствует образованию аммиака.
Высокая концентрация — Реакция протекает по прямой реакции с уменьшением объема. Следовательно, избыточное количество одного или обоих реагентов дает высокий выход аммиака.
Катализатор- Наличие мелкодисперсного железа, содержащего молибден или оксид алюминия, ускоряет скорость реакции.Итак, железо используется в качестве катализатора, а молибден или оксид алюминия — в качестве промотора.
Чистота реагентов — Если чистота используемых азота и водорода меньше, каталитическая активность снижается, поскольку катализатор отравлен. Итак, газообразный азот и водород должны быть очень чистыми.
Аммиак реагирует с хлором следующим образом:
Когда избыток аммиака реагирует с хлором, образуется хлорид аммония и газообразный азот, а когда аммиак реагирует с избытком хлора, образуется трихлорид азота и хлорид аммония.
8NH 3 + 3Cl 2 → 6NH 4 Cl + N 2 ↑
избыток хлорида аммония
4NH 3 + 3Cl 2 → NCl 3 + 3NH 4 Cl
избыток трихлорида азота
Аммиак реагирует с реактивом Несслера следующим образом:
Аммиак образует красновато-коричневую часть миллионного основания, когда он вступает в реакцию с реактивом Несслера i.е. К 2 HgI 4
K 2 HgI 4 + 2NH 3 → NH 4 I + 2KI + Hg (NH 2 ) I
2Hg (NH 2 ) I + H 2 O → NH 2 .HgO.Hg ↓ + NH 4 I
млн по базе
2) Как аммиак готовится в чистом и сухом состоянии в лаборатории? Объясните, почему H 2 SO 4 , P 2 O 5 и плавленый CaCl 2 нельзя использовать для осушки газа.\ Delta $ CaCl 2 + 2NH 3 ↑ + 2H 2 O
Процедура — Хлорид аммония и гашеная известь в соотношении 1: 3 помещают в колбу RB или в твердую стеклянную трубку, как показано на рисунке. Колба RB или трубка должны иметь наклон вниз, чтобы избежать риска поломки из-за потока воды. Аппарат также должен быть герметичным. Затем выделяющийся газообразный аммиак сушат, пропуская через насадочную башню из негашеной извести. Поскольку мы знаем, что аммиак легче воздуха, а также растворим в воде, он собирается над ртутью или путем вытеснения воздуха вниз.
Сушка аммиака — Сушка аммиака осуществляется путем пропускания его через негашеную известь. Газообразный аммиак, являющийся основанием Льюиса, реагирует с H 2 SO 4 , P 2 O 5 и CaCl 2 с образованием сульфата аммония, фосфата аммония и хлорида аммония.
2NH 3 + H 2 SO 4 → (NH 4 ) 2 SO4
6NH 3 + P 2 O 5 + 3H 2 O → 2 (NH 4 ) 2 PO 4
2NH 3 + CaCl 2 → 2NH 3 Cl + 2Ca
H 2 SO 4 , P 2 O 5 и плавленый CaCl 2 нельзя использовать для осушки газа, поскольку газообразный аммиак является основанием Льюиса и реагирует с H 2 SO 4 , P 2 O 5 и плавленый CaCl 2 с образованием сульфата аммония, фосфата аммония и хлорида аммония.
2NH 3 + H 2 SO 4 → (NH 4 ) 2 SO4
6NH 3 + P 2 O 5 + 3H 2 O → 2 (NH 4 ) 2 PO 4
2NH 3 + CaCl 2 → 2NH 3 Cl + 2Ca
С парами конц. HCl — С парами конц. HCl, аммиак реагирует с образованием соли хлорида аммония аммония.
NH 3 + HCl → NH 4 Cl (хлорид аммония)
С раствором хлорида цинка —
В растворе хлорида цинка аммиак дает хлорид аммония и гидроксид цинка.
NH 3 + ZnCl 2 + H 2 O → NH 4 Cl + Zn (OH) 2
3) Изобразите структуру Льюиса пяти различных оксидов азота.
Ответ — Структура Льюиса пяти различных оксидов азота составляет
Закись азота
Пентаоксид динитрогена
4) Опишите производство азотной кислоты каталитическим окислением аммиака. {90 {\ rm {\% \: Pt}} + {\ rm {\:}} 10 {\ rm {\% \: Rb \:}} 800 {\ rm {C \:}}} $ ↑ 6H 2 O + 4NO + 90 кДжмоль -1
1 том 8 том
2НО + O 2 → 2НО 2
4НО 2 + 2H 2 O + O 2 → 4HNO 3
Процесс производства аммиака по Габеру
Производство аммиака по методу Оствальда состоит из трех основных этапов:
i) Окисление аммиака
Аммиак, полученный по технологии Габера, смешивается с чистым и сухим свободным воздухом в соотношении 1: 8 по объему.{90 {\ rm {\% \: Pt}} + {\ rm {\:}} 10 {\ rm {\% \: Rb \:}} 800 {\ rm {C}}} $ 6H 2 O + 4NO + 90 кДжмоль -1
Поскольку эта реакция является экзотермической, конвертер сначала нагревают, и это тепло выделяется в реакции для поддержания температуры.
ii) Окисление оксида азота
Оксид азота, полученный описанным выше способом, охлаждается примерно до 100 ° C, проходя через охладитель. Охлажденный газ поступает в камеру окисления, где воздух окисляет его до диоксида азота.Низкая температура способствует этому окислению.
2НО + O 2 → 2НО 2
iii) Поглощение диоксида азота
Двуокись азота из камеры окисления прошла через абсорбционную башню, заполненную кислотостойким камнем или кварцем. NO 2 затем вступает в контакт с воздухом с образованием азотной кислоты.
4НО 2 + 2H 2 O + O 2 → 4HNO 3
Разбавленная азотная кислота собирается в приемнике в нижней части колонны, который затем концентрируется путем распыления ее сверху колонны вместо воды.Техническая азотная кислота 68%. Перегонка при пониженном давлении применяется для его дальнейшего концентрирования до 98% в присутствии H 2 SO 4 в качестве агента дегидратации. Безводный HNO 3 может быть получен перегонкой водного HNO 3 с P 2 O 5 или P 4 O 10 .
5) Опишите производство азотной кислоты по методу Оствальда, представив четкую схему. Как определяют азотную кислоту в лаборатории?
Ans- Процесс производства аммиака Оствальдом
Процесс Оствальда включает каталитическое окисление аммиака с получением азотной кислоты, которая при дальнейшем окислении дает диоксид азота.{90 {\ rm {\% \: Pt}} + {\ rm {\:}} 10 {\ rm {\% \: Rb \:}} 800 {\ rm {C}}} $ 6H 2 O + 4NO + 90 кДжмоль -1 ↑
1 том 8 том
2НО + O 2 → 2НО 2
4НО 2 + 2H 2 O + O 2 → 4HNO 3
Процесс производства аммиака по Габеру
Производство аммиака по методу Оствальда состоит из трех основных этапов:
i) Окисление аммиака
Аммиак, полученный по технологии Габера, смешивается с чистым и сухим свободным воздухом в соотношении 1: 8 по объему.{90 {\ rm {\% \: Pt}} + {\ rm {\:}} 10 {\ rm {\% \: Rb \:}} 800 {\ rm {C}}} $ 6H 2 O + 4NO + 90 кДжмоль -1 ↑
Поскольку эта реакция является экзотермической, конвертер сначала нагревают, и это тепло выделяется в реакции для поддержания температуры.
ii) Окисление оксида азота
Оксид азота, полученный описанным выше способом, охлаждается примерно до 100 ° C, проходя через охладитель. Охлажденный газ поступает в камеру окисления, где воздух окисляет его до диоксида азота.Низкая температура способствует этому окислению.
2НО + O 2 → 2НО 2
iii) Поглощение диоксида азота
Двуокись азота из камеры окисления прошла через абсорбционную башню, заполненную кислотостойким камнем или кварцем. NO 2 затем вступает в контакт с воздухом с образованием азотной кислоты.
4НО 2 + 2H 2 O + O 2 → 4HNO 3
Разбавленная азотная кислота собирается в приемнике в нижней части колонны, который затем концентрируется путем распыления ее сверху колонны вместо воды.Техническая азотная кислота 68%. Перегонка при пониженном давлении применяется для его дальнейшего концентрирования до 98% в присутствии H 2 SO 4 в качестве агента дегидратации. Безводный HNO 3 может быть получен перегонкой водного HNO 3 с P 2 O 5 или P 4 O 10 .
Азотная кислота обнаруживается в лаборатории с помощью теста с коричневым кольцом, описание которого приводится ниже:
Лабораторные испытания азотной кислоты описаны ниже;
Свежеприготовленный раствор сульфата двухвалентного железа добавляют к разбавленной азотной кислоте или водному раствору нитратной соли и осторожно наливают концентрированную серную кислоту вдоль стенки пробирки.На стыке двух слоев образуется темно-коричневое кольцо.
Для нитратной соли реакция будет
NO3- + h3SO4 → HNO3 + HSO4-] * 2
2HNO3 → 2NO + h3O + 3 [O]
h3SO4 + 2FeSO4 + [O] → Fe2 (SO4) 3 + h3O] * 3
6FeSO4 + 5 h3SO4 + NO3- → 3 Fe2 (SO4) 3 + 2 HSO4- + 4h3O
FeSO4 + NO → FeSO4. №
Закись азота сульфат железа (коричневое кольцо)
6) Что происходит, когда:
а) Раствор FeSO 4 добавляют к хорошо охлажденной смеси разбавленной азотной кислоты и концентрированной H 2 SO 4 ?
Ответ — Когда FeSO 4 добавляется в хорошо охлажденную смесь разбавленной HNO 3 и конц.H 2 SO 4 , дает коричневое кольцо из азотистого сульфата железа. Это испытание азотной кислотой.
KNO3- + h3SO4 → HNO3 + HSO4-] * 2
2HNO3 → 2NO + h3O + 3 [O]
h3SO4 + 2FeSO4 + [O] → Fe2 (SO4) 3 + h3O] * 3
6FeSO4 + 5 h3SO4 + 2KNO3- → 3 Fe2 (SO4) 3 + 2 HSO4- + 4h3O
FeSO4 + NO → FeSO4. №
азотистый сульфат железа (коричневое кольцо)
б) Фосфор обрабатывают HNO 3 ?
Ответ: Когда фосфор обрабатывают концентрированной азотной кислотой, образуется фосфорная кислота.
2HNO3 → 2NO2 + h3O + [O] * 10
P4 + 10 [O] → 2P2O5
P2O5 + 3h3O → 2h4PO4] * 2
P4 + 20HNO3 → 4h4PO4 + 20NO2 + 4h3O
c) Металлический цинк обрабатывают азотной кислотой (1: 1)?
Ответ — Когда металлический цинк обрабатывают умеренно конц. т.е. азотная кислота 1: 1, она окисляется до нитрата цинка
Zn + 2HNO3 → Zn (NO3) 2 + 2 [H] * 3
HNO3 + 3H → 2h3O + NO] * 2
3Zn + 8HNO3 → 3Zn (NO3) 2 + 2NO + 4h3O
г) Йод обрабатывают конц.HNO 3 ?
Ans- Conc. HNO 3 окисляет йод до йодной кислоты
2HNO3 → 2NO2 + h3O + [O] * 5
I + 5 [O] → I2O5
I2O5 + h3O → 2HIO3
I2 + 10HNO3 → 2HIO3 + 10NO2 + 4h3O
йодная кислота
д) Чистая азотная кислота подвергается воздействию света?
Ans — Когда чистая азотная кислота подвергается воздействию света, она дает диоксид азота, воду и азот.
4HNO3hv → 4NO2 + O2 + 2h3O
f) Газ, полученный при нагревании нашатырного спирта с каустической содой, пропускают над раствором сульфата меди.
Ans — саламмиаковая кислота реагирует с содой с образованием аммиака
Nh5Cl + NaOH → NaCl + Nh4 + h3O
Когда газообразный аммиак пропускают через раствор сульфата меди, сначала он образует голубовато-белую часть Cu (OH) 2, которая при избыточной подаче Nh4 растворяется и растворяется темно-синий раствор сложного тетраамина сульфата меди (II).
CuSO4 + 2Nh5OH $ \ to $ Cu (OH) 2 + (Nh5) 2SO4
(Nh5) 2SO4 + Cu (OH) 2 + 2Nh5OH $ \ to $ Cu (Nh4) 4SO4 + 4h3O
сульфат тетраамина меди (II)
11 лучших научных экзаменов, которые вы ДОЛЖНЫ сдать после бакалавриата
По мере того, как выпускная степень достигает последнего года обучения, студенты уже бегают от полюса к столбу, чтобы выбрать свое дальнейшее образование или возможности трудоустройства. Ознакомьтесь с популярными деталями вступительных экзаменов, чтобы поступить в самые лучшие институты STEM в Индии.
Ежегодно около 11,52 лакха B.Sc. выпускники находятся на развилке карьерного пути. У них есть множество вариантов, помимо обычных аспектов. Лучшие исследователи получают степень магистра и доктора философии. Следующим шагом будет сертификация PG и диплом в области чистых наук. Другие переходят на MBA или учатся за границей, чтобы сменить профессию.
Чтобы помочь юным читателям принять осознанное решение о карьере, мы предлагаем вам 11 вступительных экзаменов по естествознанию студентов могут выбрать после B.Sc. Читайте дальше …
Эти вступительные тесты охватывают более 89 различных областей, от астрофизики до биоинформатики, почти во всех областях науки.
IIT JAM:
Если вы хотите начать вторую возможность в ИИТ, то нет лучшего экзамена, чем совместный вступительный тест для получения степени магистра . Чтобы осуществить мечту IIT после бакалавриата, вы можете сдать этот экзамен и получить допуск к MSc в IISc, IITs, IISER, NITs и других CFTI.
Цель: Допуск к получению степени магистра или доктора философии или магистра наук с докторской степенью на профессиональные курсы с двумя дипломами, предлагаемые IIT и IISc. NIT, IISER и другие известные колледжи также принимают баллы IIT JAM для поступления в магистратуру.
Право на участие: Проверьте Обновленные критерии соответствия требованиям JAM 2019 здесь. В этом году были обновлены критерии отбора выпускников технических специальностей.
Даты экзаменов: 10 th февраля 2018 (проводящий орган — ИИТ Харагпур)
Порядок подачи заявки: Вы можете подать заявку на IIT JAM 2019 в онлайн-режиме с сентября.
Веб-сайт: http://jam.iitkgp.ac.in/
JEST:
JEST признан Советом по научным и инженерным исследованиям (SERB) национальным квалификационным тестом. Популярность Совместного вступительного скринингового теста настолько велика, что его также называют как паспорт для научных исследований .
Цель: Это квалификационный тест для поступления на программы доктора философии по физике в более чем 20 ведущих индийских исследовательских институтов, а также программу доктора философии в области теоретической информатики в Институте математических наук.
Право на участие: Ознакомьтесь с критериями соответствия JEST здесь. Минимальный уровень образования — B.Sc. для большинства курсов. B.Tech./B.E./M.E./M.Tech./4 год B.S./M.C.A. также может быть рассмотрен для программ магистратуры и доктора философии (интегрированных и обычных) в некоторых институтах.
Даты экзаменов: В прошлом году прием заявок начался примерно в декабре, а экзамен проводился в феврале. Даты экзаменов еще не объявлены организатором.
Процедура подачи заявки: Процесс онлайн-регистрации на экзамен начнется в декабре.
Веб-сайт: https://www.jest.org.in
TIFR GS:
TIFR GS — это общенациональный вступительный экзамен, проводимый Институтом фундаментальных исследований Тата для приема кандидатов на курсы последипломного образования, предлагаемые им.
Цель: Институт реализует программу для выпускников, по результатам которой присуждаются докторские, интегрированные и докторские степени, а также степень магистра по определенным предметам.
Право на участие : Студенты получат степень через предметные советы аспирантуры TIFR. Таким образом, они должны соответствовать требованиям соответствующей комиссии. Право на участие в программе приведено на официальном сайте для различных предлагаемых курсов.
Тематический совет по физике:
PhD : MSc (Physics) / B.Tech. & B.E. (Инженерная физика) / Б. / B.Tech/ M.Tech. или эквивалентная научная / инженерная / медицинская степень, требующая четырех или более лет университетского образования.
Интегрированный MSc-PhD: B.Sc / B.E./ B.Tech / B.Pharm или эквивалентная наука / инженерия / медицинская степень / MSc (кроме физики) / M.Tech / M.Pharm / MBBS или эквивалентная научная / инженерная / медицинская степень.
Тематический химический совет:
PhD : MSc (Chemistry) / M.Tech. (Химические науки) / магистр фармацевтики или эквивалентная степень в области науки / техники / медицины.
Интегрированный MSc-PhD : бакалавр наук / бакалавриат / бакалавр технических наук / бакалавриат фармацевтических наук или эквивалентная степень в области науки / техники / медицины.
Даты экзаменов: Экзамен будет проведен в декабре 2018 года.
Процедура подачи заявки: Студенты могут подавать заявки как онлайн, так и офлайн. Студенты из отдаленных районов, у которых нет доступа к Интернету, могут подать заявку вручную. Они могут отправить запрос на форму заявки (без DD) вместе с конвертом с адресом и маркой (20 рупий / -) (размер 25 x 17 см) с надписью «GS-2018 (Subject)» по следующим адресам:
По биологии:
Приемная комиссия
Национальный центр биологических наук
Кампус УАС-ГКВК, Беллари-роуд,
Бангалор 560065.
Для других предметов, кроме естественнонаучного образования:
University Cell, Институт фундаментальных исследований Тата, Homi Bhabha Road, Colaba, Mumbai 400005.
Веб-сайт: http://univ.tifr.res.in/
JNUEE:
JNU — известный университет в Индии, о котором всегда говорят в новостях по хорошим или плохим причинам.Тем не менее, про JNU говорят, что это не просто университет — это образ жизни.
Будучи политически сознательным университетским городком, который считает, что «JNU думает сегодня, Индия думает завтра», университет был институтом мечты для многих. JNUEE — один из экзаменов, проводимых для поступления в этот институт.
Цель: Вступительный экзамен в университет Джавахарлала Неру проводится для поступления на программы бакалавриата и магистратуры в рамках JRF.Квалифицированные студенты могут поступить в следующие школы JNU:
| Школа международных исследований (SIS) | Школа наук о жизни (SLS) |
| Школа наук об окружающей среде (SES) | Школа социальных наук (SSS) |
| Школа физических наук (SPS) | Школа компьютерных и системных наук (SC&SS) |
| Школа языков, литературы и культуры (SL) | Школа вычислительных и интегративных наук (SC&IS) |
| Школа искусств и эстетики (SAA) | Школа биотехнологии (SBT) |
| Центр изучения санскрита (CSS) | Центр молекулярной медицины (CMM) |
| Центр изучения права и управления (CLG) | Центр нано-наук (CNS) |
Право на участие: JNU проводит общий экзамен для различных M.Программы Phil / MA / MSc. Требования к участникам разные для каждого курса. Поскольку мы говорим о выпускниках бакалавриата, мы будем обсуждать критерии отбора только на курсы MSc.
Магистр наук о жизни:
Кандидаты должны иметь степень бакалавра или бакалавра наук. /B.Tech или эквивалент в области биологических / физических / сельскохозяйственных наук или биотехнологии из любого государственного или центрального признанного института / университета.
Кандидаты должны получить не менее 55 процентов баллов по совокупности всех предметов.
Магистр физики:
Кандидаты должны иметь степень бакалавра по физике в качестве одного из предметов по любой дисциплине в рамках схемы образования 10 + 2 + 3, что в сумме дает не менее 55 процентов баллов.
Кандидатов, имеющих квалификацию бакалавра по физике, химии и математике вместе, или по физике с отличием, или со степенью B.Техника в области электроники / электротехники / механики / компьютера также имеет право.
Магистр наук об окружающей среде:
Кандидаты должны иметь степень бакалавра в любой отрасли фундаментальных или прикладных наук по схеме образования 10 + 2 + 3, полученной в школе / институте / университете, как это признано на государственном или национальном уровне.
Кандидаты должны иметь не менее 55 процентов баллов по совокупности предметов экзамена на получение квалификационной степени.
Даты экзаменов: 27 чт до 30 чт декабря 2018
Процедура подачи заявки: Университет выдаст форму заявки JNU 2018 только через онлайн-режим . Окно для внесения исправлений в форму также откроется позже. Формы ожидаются в октябре 2018 года.
Веб-сайт : https: // admissions.jnu.ac.in/
NEST (Национальный отборочный экзамен):
Национальный вступительный экзамен Тест ( NEST ) — обязательный тест для студентов, поступающих в Национальный институт научного образования и исследований (NISER), Бхубанешвар и Университет Мумбаи — Центр передового опыта в области фундаментальных наук Департамента атомной энергии для 5-летняя интегрированная программа MSc .
Цель : Допуск к прохождению интегрированного курса PG для проведения передовых научных исследований и внесения вклада в научные программы Министерства атомной энергии и других учреждений прикладной науки в стране.
Право на участие: Кандидаты должны соответствовать всем четырем критериям отбора, перечисленным ниже:
1. Возрастное ограничение для экзамена NEST : Кандидаты в категории General и OBC должны родиться 1 августа 1999 года или позднее.Возрастное ограничение для кандидатов SC / ST / с ограниченными физическими возможностями (PD) снижено на 5 лет.
2. Требования к образованию : Квалификационный экзамен по классу XII должен быть сдан в 2017 или 2018 году. Кандидаты, появившиеся в 2019 году, также имеют право. (Если Правлением выставляется только буквенная оценка, потребуется сертификат Совета с указанием эквивалентных процентных оценок. В случае отсутствия такого сертификата решение соответствующих Приемных комиссий будет окончательным.)
3. Требование в процентах : По крайней мере 60% оценок в совокупной (или эквивалентной) оценке на экзамене Класса XII (или эквивалентном) от любого признанного Совета в Индии. Для кандидатов в зарегистрированные касты (SC), зарегистрированные племена (ST) и для лиц с ограниченными возможностями (PD) минимальное требование составляет 55%.
4. Кандидат должен занять место в списке заслуг NEST.
Даты экзаменов: Экзамен состоится в первую субботу июня 2019 г. i.е. 1 st июнь 2019
Процедура подачи заявки: Онлайн-процесс подачи заявки на участие в NEST 2019 начнется в первый понедельник января, т. Е. 7 th января 2019 года.
Веб-сайт: https://www.nestexam.in/
Примечание: Следующее уведомление будет выпущено 26 th декабря 2018, кандидатам рекомендуется посетить веб-сайт после этого.
ICAR AIEEA PG Вступительный экзамен:
История сельского хозяйства в Индии восходит к эпохе цивилизации долины Инда и даже раньше.Экономический вклад сельского хозяйства в ВВП Индии составляет 13,7%. Индия как страна в такой степени полагается на сельское хозяйство, что аспиранты по сельскому хозяйству являются одними из самых востребованных специалистов в индийских банках и департаментах центрального правительства.
Индийский совет сельскохозяйственных исследований (ICAR) — это автономный орган, отвечающий за координацию сельскохозяйственного образования и исследований в Индии.
Цель : AIEEA — это вступительный экзамен для поступления в учреждение ICAR.Это крупнейшая в мире сеть сельскохозяйственных научно-исследовательских и образовательных институтов. Большое количество обладателей степени магистра сельскохозяйственных наук получают высшее образование в индийских университетах и за рубежом. В 2017 году на экзамен ICAR PG Exam было допущено 43% кандидатов-женщин, что свидетельствует о повышенном интересе женщин к этой сфере.
ИКАР имеет следующие учреждения:
6 признанных университетов (2 новых НААРМ, Хайдарабад и НИАСМ, Мелегаон, Махараштра)
64 учреждения ИКАР
15 национальных исследовательских центров
6 Национальных бюро
25 дирекций / проектных дирекций (модернизированные NRCs-12)
Право на участие:
Возрастное ограничение — Кандидат должен быть не моложе 19 лет.
Квалификационный экзамен — Кандидат должен иметь степень бакалавра признанного университета в соответствующей области.
Правила получения права на отдых по различным дисциплинам можно проверить здесь .
Даты экзаменов : Экзамен проводился недавно 18 августа года. Даты экзаменов для предстоящей сессии будут объявлены в ближайшее время.
Порядок подачи документов: Регистрация на экзамен осуществляется онлайн на официальном сайте.
Веб-сайт: https://icarexam.net
AIIMS Вступительный экзамен на магистратуру:
Если вы интересуетесь человеческим телом и наукой, хотите изменить жизнь людей к лучшему, то медицинская школа станет для вас идеальным местом.
Если вы упустили свой шанс поступить на курс AIIMS для подготовки к медицине, то магистратура может быть вашим вторым шансом осуществить мечту.
AIIMS проводит собственные медицинские вступительные экзамены для студентов, желающих продолжить обучение в магистратуре, в своем родительском институте и других 7 кампусах.
Цель: Прием в магистратуру (различные дисциплины), MBI и курсы сестринского дела в AIIMS. В рамках этого вступительного экзамена в AIIMS предлагаются следующие курсы PG:
Магистр анатомии
Магистр биохимии
Магистр биофизики
Магистр сердечно-сосудистой визуализации и эндоваскулярных технологий
Магистр физиологии
Магистр фармакологии
MSc Perfusion Technology
Магистр репродуктивной биологии и клинической эмбриологии
Магистр технологий ядерной медицины
Право на участие : Критерии приемлемости указаны в электронном проспекте, загруженном на официальный сайт AIIMS.
Даты экзаменов : Экзамен будет проводиться только в онлайн-режиме. Даты экзаменов — июнь 2019 года.
Порядок подачи заявок : Заявки приглашаются в режиме онлайн, и он начинается в марте каждого года.
Веб-сайт: https://www.aiimsexams.org
Национальная сертификация биоинформатики (BINC):
Биоинформатика — это наука о сборе и анализе сложных биологических данных, таких как генетические коды.Эта область объединяет информатику, биологию, химию, математику, генетику и инженерию.
Сегодня почти все биологи нуждаются в дополнительных ресурсах в области биоинформатики. Мировой рынок биоинформатики растет быстрыми темпами, и даже индийский рынок биоинформатики, как ожидается, вырастет на 19,8% к 2022 году . В ближайшие 5 лет будет большой спрос на квалифицированных и подготовленных профессионалов в области биоинформатики.
BINC — это программа сертификации для аспирантов и аспирантов с целью признания их исключительных знаний и навыков в области биоинформатики и улучшения их возможностей трудоустройства.
Цель: Растет потребность в квалифицированных кадрах в области биоинформатики. В настоящее время различные университеты и учреждения, как государственные, так и частные, предоставляют образование в области биоинформатики в Индии. BINC — это пожизненный сертификат, который помогает отраслям и потенциальным работодателям нанимать профессионалов в области биоинформатики, обладающих исключительно хорошими навыками в области биоинформатики.
Квалифицированные кандидаты получат стипендию рупий.25000 / — в месяц (в течение первого и второго года) и рупий. 28000 / — в месяц (в течение третьего и последующих лет).
Право на участие:
Степень бакалавра / магистра наук о жизни, физических наук, химических наук, математических наук, сельского хозяйства, ветеринарии, медицины, фармации, инженерии и технологий.
Никакого формального обучения, диплома или сертификата по биоинформатике не требуется.
Кандидаты на последний год обучения на степень бакалавра / магистра также имеют право подать заявку.
Даты экзаменов : Период регистрации для BINC — май-июнь каждого года.
Процедура подачи заявки : Кандидаты могут подать онлайн-заявку на экзамен BINC.
Веб-сайт : https://cdn.digialm.com//EForms/configuredHtml/1065/55901//index.html
Приемные экзамены в Индийский статистический институт:
Статистик — самая крутая работа, о которой вы никогда не слышали.Не верьте нам на слово; убедитесь сами, что вы можете сделать, сделав карьеру в статистике.
ISI Kolkata — уникальное учреждение, занимающееся исследованиями, преподаванием и применением статистики, естественных и социальных наук. Агентство также стремится развивать строгость статистики среди индийской молодежи.
Выдает степени и дипломы по математике, количественной экономике, информатике и другим предметам, связанным со статистикой.
Если у вас есть склонность к статистике, то «Знания в статистике» предоставят вам способ разумно извлекать информацию из множества доступных повсюду данных.
Цель : Поступление на магистерские курсы в ISI Kolkata осуществляется через вступительные испытания. Вступительные испытания проводятся в ряде центров Индии. Общая оценка оценивается на основании результатов как на тестах, так и на собеседовании. Иногда также учитываются прошлые академические рекорды.Доступны следующие курсы PG:
M Стат.
M математика
Магистр количественной экономики
Магистр наук в области управления качеством
Магистр библиотечных и информационных наук
Магистр компьютерных наук (дополнительное требование карта GATE Score)
Магистр технологий в области криптологии и безопасности (дополнительное требование GATE Score card)
Магистр технологий в области качества, надежности и операционных исследований
Диплом о высшем образовании в области статистических методов и аналитики
Диплом о высшем образовании в области компьютерных приложений
Диплом о высшем образовании в области бизнес-аналитики
Право на участие: Чтобы иметь право на допуск к программе PG, заявитель должен иметь:
трехлетняя степень бакалавра или техническая степень BE / B со статистикой / математикой в качестве предмета, или степень B Math / B Stat от ISI, или диплом последипломного образования в области статистических методов и аналитики от ISI
Подробный критерий приемлемости для вступительного экзамена ISI Kolkata Admission Test приведен здесь.
Даты экзаменов : Экзамен проводится в мае каждого года.
Процедура подачи заявки : Процесс подачи онлайн-заявки начинается в феврале месяце.
Веб-сайт: https://www.isical.ac.in/
INAT:
Космос, последний рубеж.Мы все еще очень мало знаем об огромной Вселенной, в которой живем. INAT может стать важной вехой, чтобы сделать шаг вперед на пути к вашей карьере в астрофизике и астрономии.
Цель: Найти увлеченных студентов для исследований в области астрофизики и астрономии в кампусе IUCAA-NCRA в Пуне.
Право на участие: Согласно официальному сайту INAT , любой выпускник науки или технологии может подать заявку на этот экзамен.
Мы ищем высокомотивированных студентов с неизменно хорошей успеваемостью. Хотя мы настоятельно рекомендуем студентам с инженерным образованием подавать заявки на INAT-2018, мы подчеркиваем, что мы ищем студентов, которые заинтересованы в проведении докторских исследований в области физики или астрономии и астрофизики. Следовательно, мы ожидаем, что потенциальные кандидаты будут хорошо разбираться в основах физики.
Даты экзаменов: Экзамен будет проводиться в декабре.
Процедура подачи заявки: Онлайн-заявка немного отличается от других экзаменов. Подача онлайн-заявок начнется в сентябре 2018 года.
В процедуре подачи заявки есть Три шагов.
1. Кандидаты должны сначала зарегистрироваться, указав свое имя и действующий адрес электронной почты в соответствующих полях регистрации ниже. Пароль приложения будет автоматически отправлен на адрес электронной почты кандидатов; адрес электронной почты и пароль должны быть введены для заполнения онлайн-формы заявки.
2. В форме заявки также требуются имена и адреса электронной почты двух рецензентов.
3. Когда форма будет отправлена, двум рецензентам будут автоматически отправлены электронные письма с просьбой заполнить и отправить онлайн-форму конфиденциальной оценки. Кандидаты должны проинформировать своих рефери о форме оценки.
Веб-сайт: http: //inat.ncra.tifr.res.in/INAT2016/candidate/Guidelines.ncra
GATE Science:
Поступление в ИИТ считается «началом» роста и процветания в профессиональной жизни. Следовательно, лихорадка ИИТ всегда соблазняет ученых. GATE в основном предназначен для поступления в M.Tech. курсы, но есть загвоздка для бакалавриата ученики.
GATE Science проводится по следующим предметам:
Физика
Химия
Математика
Биотехнологии
Науки о жизни
Технические науки
Геология и геофизика
Статистика
Цель: Соответствие требованиям GATE является обязательным для подачи заявки или финансовой помощи по адресу:
1. Программы магистратуры или прямого доктора наук в области инженерии / технологий / архитектуры.
2. Докторантура по соответствующим экзаменам по естествознанию в MHRD / Govt. поддерживаемые институты.
3. Набор в некоторые ПЕВ. Право на участие: Те, у кого нет инженерного образования, задают много вопросов, касающихся их права на экзамен GATE. К сожалению, B.Sc. Студенты BCA и BCS (трехлетняя степень) не имеют права на экзамен GATE.
Но, B.Sc. (Tech), четыре года обучения, студенты последнего курса имеют право на GATE Science. Также, B.Sc. (Исследования) / B.S./ Integrated B.S. — РС. имеют право на экзамен.
Даты экзаменов: GATE Exam 2019 состоится 2 -е февраля, 3 -е , 9 -е и 10 -е февраля 2019.
Процедура подачи заявки: Индийский технологический институт (IIT) в Мадрасе опубликовал официальную информацию о экзамене Graduate Aptitude Test in Engineering (GATE) 2019.
Кандидаты могут зарегистрироваться на экзамен онлайн в период с 1 сентября по 21 сентября 2018 года на официальном сайте GATE
Сайт: http://gate.iitm.ac.in/
Это сообщение от команды Eduncle. Как упоминалось выше, доступно большое количество курсов. Убедитесь, что вы не торопитесь и думаете, прежде чем выбирать курс. Еще одна вещь, о которой следует помнить, — подходит ли курс способностям студента или нет!
Все гении.Но если судить о рыбе по ее способности залезть на дерево, она проживет всю жизнь, полагая, что это глупо.
бакалавриата может быть или не стать вашим выбором карьеры, поскольку в подростковом возрасте легко попасть под давление родителей и общества. Но теперь вы выросли, чтобы сделать осознанный шаг, и мы надеемся, что наша статья в какой-то мере вам помогла.
Если у вас все еще есть сомнения, спросите команду Eduncle, оставив комментарий ниже.Мы с нетерпением ждем ваших комментариев и ответим на них, чтобы заполнить пробелы в ваших знаниях.
Химия класса 11 Примечания к главам решений NCERT и последние образцы документов
Studiestoday Найти репетитора Поиск репетиторов Регистрация репетитора Вход для репетитора- Курсы
- CBSE
- JEE
- NEET
- NTSE
- BITSAT
- CTET
675 675 - 675
- 675 675 Класс 10
- Класс 9
- Класс 8
- Класс 7
- Класс 6
- Класс 5
- Класс 4
- Класс 3
- Класс 2
- Класс 1
- Решения Класс 12
- 926 71 Решения NCERT
- Решения NCERT
- TS Grewal Solutions
- Решения DK Goel
- Решения HC Verma
- RS Aggar1 9267 Решения
- Класс 12
- Класс 11
- Класс 10
- Класс 9
- Класс 8
- Класс 7
- Класс 6
- Класс 5
- Класс 4
- Класс 3
- Класс 92 2
- Кла ss 1
- Дошкольное учреждение
- Классы с 1 по 12
- NEET
- JEE
- BITSAT
- NTSE
Chapter Wise Online Test для класса химии 12
Этот онлайн-тест по химии оформлен в виде общих вопросов.Представленный здесь онлайн-тест по химии был запрошен на различных конкурсных экзаменах. Этот онлайн-тест по химии принимают самые разные ученики класса.
Почему входной онлайн-тест по химии
Академическая группа приёмов загрузила все главы по химии 12 класса. Каждая глава состоит из одного или нескольких онлайн-тестов по химии 12 класса. Эти онлайн-тестовые листы имеют отрицательные оценки за каждый правильный вопрос, вы получите +4 балла и за каждый неправильный вопрос. вы получите -1 балл.Сразу после того, как тест проанализирует вашу оценочную карточку, найдите подробные решения неправильных ответов и попытайтесь выяснить ошибку, которую вы сделали в вопросах.
Думает сделать перед онлайн-тестом для 12 класса химии
Онлайн-тест по химии 12 класса не только поможет вам подготовиться к доске CBSE, но и будет очень полезен для вступительных экзаменов, таких как JEE и NEET. Перед тестом необходимо пересмотреть главу, прочитать учебник NCERT, решить вопросы, получить помощь от Entry NCERT, решения для класс 12.Вам нужна дополнительная теория, чтобы иметь более глубокую концепцию, поэтому прочитайте заметки по химии для класса 12 и запишите важные моменты и формулы химии.
Правильные стратегии для онлайн-теста для 12 класса химии
Онлайн-тест по химии был запланирован в соответствии с последней учебной программой CBSE. Студенты могут свободно решать самый главный вопрос, при этом предоставляются ответы. Вопросы в этом онлайн-тесте по химии составлены в соответствии с вопросами общей осведомленности, задаваемыми на экзаменах, таких как JEE и NEET.Студентам необходимо решить онлайн-тест по химии, чтобы хорошо владеть предметом химии. Решение онлайн-теста по химии не только расширит ваши знания, но и поможет выделиться среди остальных. Онлайн-тест по химии лучше всего подходит для студентов, готовящихся к некоторым экзаменам.
Единственная цель проведения этого онлайн-теста по химии от Entrancei — помочь студенту ответить на новые вопросы. Студенты могут рассчитывать на новые вопросы, соответствующие экзаменам.Все, что вам нужно сделать, это регулярно проходить онлайн-тест по химии. На сайте размещен полный комплект онлайн-теста по химии. Студенты могут найти все последние вопросы экзаменов. Онлайн-тест по химии — полезный источник, чтобы познакомиться с последними моделями экзаменов национального уровня. Онлайн-тест по химии помогает студентам развеять сомнения. Онлайн-тест по химии включает в себя некоторые популярные вопросы. Онлайн-тест по химии можно практиковать прямо из дома.
Все ответы на вопросы указаны в финале онлайн-теста по химии, чтобы студент мог проверить свои ответы. Вопросы, упомянутые в онлайн-тесте по химии, созданы, чтобы ответить на все жизненно важные вопросы. Вопрос в онлайн-тесте по химии предоставляет все важные вопросы в сильно обособленном формате. Онлайн-тест по химии очень увлекательно помогает студентам подготовиться к конкурсным экзаменам. Студентам необходимо пройти онлайн-тест по химии для углубленных знаний.
Вопрос, включенный в онлайн-тест по химии, был представлен после очень интенсивных исследований. Если студенты ищут веб-портал с целостным подходом, чтобы развеять сомнения студентов, то вам можно доверять Entrancei. Мы предоставляем онлайн-тесты по химии уже много лет. Студенты могут полностью пройти онлайн-тест по химии прямо перед экзаменом, чтобы эксперты разрешили свои сомнения. Предлагаемый нами онлайн-тест по химии дает комплексный подход к вашей подготовке к экзаменам.Студенты могут слепо доверять онлайн-тесту по химии от наших специалистов.
FAQ Для онлайн-теста для 12 класса химии
Q-1. Какой лучший веб-сайт для онлайн-теста по химии 12 th ?
Ответ: Ну, мы просто собираемся сказать, что качество говорит о многом, и здесь, в Entrancei, мы предоставляем заметки по химии, подготовленные нашими закаленными и опытными учителями в соответствии с последней программой химии NCERT для 12 класса. В случае сомнений просьба изложить свои сомнения в разделе «Сомнения», и наши специалисты решат ваши вопросы в кратчайшие сроки.
Q-2. Как мне подготовиться к онлайн-тестам 12 th ?
Ответ-1. Учитесь ежедневно.
2. Обучайте понятиям, а не цените их.
3. Избавьтесь от сомнений, как можно скорее избавившись от них у учителей.
4. Тщательно подготовьтесь, составив анкеты и образцы бумаги за предыдущий год.
Q-3. Каковы преимущества использования решений NCERT для онлайн-теста по химии 12 класса?
Ans-Преимущества приведены ниже —
1.Все решения, представленные на этой странице, были разработаны преподавателями и экспертами мирового уровня в соответствии с рекомендациями CBSE NCERT.
2. С этими растворами обращаются в соответствии со схемой маркировки CBSE.
3. С помощью этих решений был рассмотрен каждый вопрос из книги NCERT для 12-го класса.
4. Эти решения помогают студентам подготовиться к конкурсным вступительным экзаменам, таким как JEE Main, NEET и т. Д.
5. Эти решения можно легко скачать.
Вопрос-4. Как онлайн-тест по химии 12 класса может помочь вам с подготовкой?
Ответ 1. Помогите вам понять схему экзамена — эти тесты помогут вам определить свои слабые места, которые вам необходимо исправить быстро и точно.
2.Помощь с пересмотром — важные темы CBSE требуют прохождения онлайн-теста для своевременной подготовки к экзамену.
3. Правильное управление временем — с каждым онлайн-тестом вы увидите значительное увеличение скорости и точности, и вы узнаете, какие конкретные темы требуют большего внимания с вашей стороны, что поможет вам правильно и эффективно ответить на вопросы.
Q-5. Каковы преимущества онлайн-теста на Entrancei?
Ответ: Все эти тесты доступны онлайн по главам.
1. Вы можете попробовать их где угодно и когда угодно, если у вас есть работающее устройство и стабильное интернет-соединение.
2. В конце вы получите подробный анализ своей работы.
3. Для каждого вопроса также предоставляются решения.
Q-6. Сколько онлайн-тестов по химии 12 th я должен сдать?
Ответ. Пройдите несколько практических онлайн-тестов в Интернете и посмотрите, насколько вы правильны.Если вы получили низкий балл, исправьте образцы бумаги, создайте тестовые листы и попробуйте упражнения по химии NCERT Grade 12 для практики и повторите тест. Пройдите как можно больше онлайн-тестов. Чем больше вы практикуетесь, тем яснее становятся ваши сомнения. Однако исправьте свои самые слабые места с помощью соответствующего теста.
Карточки и викторины по химии 12 класс
Знание Генома TM
Сертифицировано Brainscape
Просмотрите более 1 миллиона курсов, созданных лучшими студентами, профессорами, издателями и экспертами, которые охватывают весь мир «усваиваемых» знаний.
Вступительные экзамены
Экзамены уровня A
Экзамены AP
Экзамены GCSE
Вступительные экзамены в магистратуру
Экзамены IGCSE
Международный Бакалавриат
5 национальных экзаменов
Вступительные экзамены в университет
Профессиональные сертификаты
Бар экзамен
Водитель Эд
Финансовые экзамены
Сертификаты управления
Медицинские и сестринские сертификаты
Военные экзамены
MPRE
Другие сертификаты
Сертификаты технологий
TOEFL
Иностранные языки
арабский
китайский язык
французкий язык
Немецкий
иврит
Итальянский
Японский
корейский язык
Лингвистика
Другие иностранные языки
португальский
русский
испанский
TOEFL
Наука
Анатомия
Астрономия
Биохимия
Биология
Клеточная биология
Химия
науки о Земле
Наука об окружающей среде
Генетика
Геология
Наука о жизни
Морская биология
Метеорология
Микробиология
Молекулярная биология
Естественные науки
Океанография
Органическая химия
Периодическая таблица
Физическая наука
Физика
Физиология
Растениеводство
Класс науки
Зоология
Английский
Американская литература
Британская литература
Классические романы
Писательское творчество
английский
Английская грамматика
Фантастика
Высший английский
Литература
Средневековая литература
Акустика
Поэзия
Пословицы и идиомы
Шекспир
Орфография
Vocab Builder
Гуманитарные и социальные исследования
Антропология
Гражданство
Гражданское
Классика
Связь
Консультации
Уголовное правосудие
География
История
Философия
Политическая наука
Психология
Религия и Библия
Социальные исследования
Социальная работа
Социология
Математика
Алгебра
Алгебра II
Арифметика
Исчисление
Геометрия
Линейная алгебра
Математика
Таблицы умножения
Precalculus
Вероятность
Статистические методы
Статистика
Тригонометрия
Медицина и уход
Анатомия
Системы тела
Стоматология
Медицинские курсы и предметные области
Медицинские осмотры
Медицинские специальности
Медицинская терминология
Разные темы здравоохранения
Курсы медсестер и предметные области
Медсестринские специальности
Другие области здравоохранения
Фармакология
Физиология
Радиология и диагностическая визуализация
Ветеринарная
Профессия
ASVAB
Автомобильная промышленность
Авиация
Парикмахерская
Катание на лодках
Косметология
Бриллианты
Электрические
Электрик
Пожаротушение
Садоводство
Домашняя экономика
Садоводство
HVAC
Дизайн интерьера
Ландшафтная архитектура
Массажная терапия
Металлургия
Военные
Борьба с вредителями
Сантехника
Полицейская
Сточные Воды
Сварка
Закон
Закон Австралии
Банкротство
Бар экзамен
Предпринимательское право
Экзамен в адвокатуру Калифорнии
Экзамен CIPP
Гражданский процесс
Конституционное право
Договорное право
Корпоративное право
Уголовное право
Доказательства
Семейное право
Экзамен в адвокатуру Флориды
Страховое право
Интеллектуальная собственность
Международный закон
Закон
Закон и этика
Правовые исследования
Судебные разбирательства
MBE
MPRE
Закон о аптеках
Право собственности
Закон о недвижимости
Экзамен в адвокатуре Техаса
Проступки
Трасты и имения
Здоровье и фитнес
Нетрадиционная медицина
Класс здоровья и фитнеса
Здоровье и человеческое развитие
Урок здоровья
Наука о здоровье
Человеческое развитие
Человеческий рост и развитие
Душевное здоровье
Здравоохранение
Спорт и кинезиология
Йога
Бизнес и финансы
Бухгалтерский учет
Бизнес
Экономика
Финансы
Управление
Маркетинг
Недвижимость
Технологии и машиностроение
Архитектура
Биотехнологии
Компьютерное программирование
Информационные технологии
Инженерное дело
Графический дизайн
Информационной безопасности
Информационные технологии
Информационные системы управления
Еда и напитки
Бармен
Готовка
Кулинарное искусство
Гостеприимство
Питание
Вино
Изобразительное искусство
Изобразительное искусство
История искусства
Танец
Музыка
Другое изобразительное искусство
Случайное знание
Астрология
Блэк Джек
Культурная грамотность
Знание реабилитации
Мифология
Национальные столицы
Люди, которых вы должны знать
Покер
Чаша для викторины
Спортивные викторины
Карты Таро
| Тест / Экзамен | График онлайн-регистрации | Цель Срок, учебный год |
| Старший
Средняя школа 11 класс | С 1 по 31 декабря 2019 г. | 2020-2021 |
| Лабораторный вступительный экзамен в старшую школу (PUP LHSEE) 7 класс (неполная средняя школа) | 14 октября 2019 г. — 7 февраля 2020 г. | 2020-2021 |
Вход в колледж
Тест (PUPCET)
| Различные графики | Первый семестр 2020-2021 гг. |
Вход в аспирантуру
Экзамен (PUPGSEE)
| С 22 сентября по 9 октября 2020 г. (тел.Только D. Psych) | Первый семестр 2020-2021 гг. |
Выпускник
Вход на учебу
Экзамен для колледжа делового администрирования (PUPCBA-GSEE)
| 29 июня по 24 июля 2020 г. | Первый семестр 2020-2021 гг. |
Выпускник
Вход на учебу
Экзамен для Педагогического колледжа (PUPCOED-GSEE)
| 22 июня по 22 июля 2020 | Первый семестр 2020-2021 гг. |
Открыть
Университетская система (PUPOUSEE)
| 12 июня по 23 сентября 2020 г. | Первый семестр 2020-2021 гг. |
Открытый университет
Система (PUPCET-OUS)
| С 12 июня по 23 июля 2020 г. Leave a Reply
|
