Контрольная работа по теме «Электролитическая диссоциация. ОВР» для 9 класса по курсу Г.Е. Рудзитиса, Ф.Г. Фельдмана.
Котрольная работа №1. Вариант 1.
Часть А.
Процесс распада электролита на ионы называют:
А) ассоциацией Б) гидратацией В) диссоциацией Г) нейтрализацией
2. Лампочка прибора для проверки электропроводимости загорится в растворе:
А) сахара Б) этилового спирта В) кислорода Г) поваренной соли
3. Вещество, при диссоциации которого образуются катионы водорода и анионы кислотного остатка: А) соль Б) кислота В) вода Г) щелочь
4. Катионы металла и гидроксид-анионы образуются при диссоциации:
А) хлорида натрия Б) соляной кислоты В) гидроксида кальция Г) глюкозы
5. Если степень диссоциации α равна 1, то в растворе вещество существует:
А) в виде молекул Б) в виде ионов В) в виде ионов и молекул Г) в основном в виде молекул
6. Сильным электролитом является: А) NaOH Б) Cu(OH)
Сильным электролитом является: А) NaOH Б) Cu(OH)
7. На третьей ступени диссоциации фосфорной кислоты образуются:
А) H+ и H2PO4 — Б) 2H+ и HPO4 2- В) 3H+ и PO4 3- Г) H+ и PO4 3-
8. К выпадению осадка приводит взаимодействие пары ионов:
А) Na+ и S2- Б) Al3+ и Cl— В) Sn2+ и OH— Г) Cr3+ и F—
9. Пять ионов образуются при диссоциации: А) Na2CO3 Б) H2SO4 В) Ca(OH)2 Г) Al2(SO
10. Необратимо протекает реакция ионного обмена между растворами:
А) NaCl и Zn(NO3)2 Б) H2SO4 и BaCl2 В) K2SO4 и NaOH Г) KNO3 и FeSO4
11. Сокращенному ионному уравнению Н+ + ОН— → Н2О соответствует взаимодействие между:
Сокращенному ионному уравнению Н+ + ОН— → Н2О соответствует взаимодействие между:
А) HCl и Cu(OH)2 Б) HBr и NaOH В) H2SiO3 и NaOH Г) NH3 и H2O
12. Лакмус в растворе карбоната натрия становится: А)красным Б)фиолетовым В)cиним Г)бесцветным
13. Степень окисления +1 хлор проявляет в соединении:
А) Сl2O Б) ClO3 В) AlCl3 Г) HCl
14. Окислителем в реакции Zn + H2SO4 → ZnSO4 + H2 является:А)водород Б)кислород В)цинк Г)сера
Часть Б.
1. Составьте уравнение реакции в молекулярном, полном ионном, сокращенном ионном виде между гидроксидом бария и сульфатом натрия.
Определите среду в растворе нитрата калия, аргументируйте ответ.
Расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель:
PH3 + O2 → P
4. Определите формулу соли, если известно, что при взаимодействии раствора этой соли с раствором щелочи выпадает синий осадок, а при взаимодействии с раствором нитрата серебра – белый осадок.
Определите формулу соли, если известно, что при взаимодействии раствора этой соли с раствором щелочи выпадает синий осадок, а при взаимодействии с раствором нитрата серебра – белый осадок.
Котрольная работа №1. Вариант 2.
Часть А.
1.Вещество, водный раствор или расплав которого не проводит электрический ток называется:
А) электролитом Б) неэлектролитом В) окислителем Г) восстановителем
2. Лампочка прибора для проверки электропроводимости не загорится в растворе:
А) соляной кислоты Б) гидроксида натрия В) глюкозы Г) поваренной соли
3. Вещество, при диссоциации которого образуются катионы металла и анионы кислотного остатка: А) соль Б) кислота В) вода Г) щелочь
4. Катионы водорода и анионы кислотного остатка образуются при диссоциации:
А) хлорной кислоты Б) фторида калия В) сульфата кальция Г) этанола
5. Если степень диссоциации α равна 0, то в растворе вещество существует:
А) в виде молекул Б) в виде ионов В) в виде ионов и молекул Г) в основном в виде молекул
6. Слабым электролитом является: А) H2SO3 Б) H2SO4 В) Na2CO3 Г) Al
Слабым электролитом является: А) H2SO3 Б) H2SO4 В) Na2CO3 Г) Al
7. На второй ступени диссоциации серной кислоты образуются:
А) H+ и HSO4 — Б) 2H+ и HSO4 2- В) 2H+ и SO4 2- Г) H+ и SO4 2-
8. К выпадению осадка не приводит взаимодействие пары ионов:
А) Вa2+ и SО42- Б) Al3+ и ОН— В) Mg2+ и SО32- Г) Cr3+ и F—
9. Три иона образуются при диссоциации: А) AlCl3 Б) HBr В) CaCl2 Г) Na3PO4
10. Необратимо протекает реакция ионного обмена между растворами:
А) Fe2(SO4)3 и KNO3 Б) H2S и NaBr В) Ba(OH)2 и NaCl Г) Na2CO3 и HNO3
11. Сокращенному ионному уравнению Ag+ + Cl— → AgCl↓ соответствует взаимодействие между:
Сокращенному ионному уравнению Ag+ + Cl— → AgCl↓ соответствует взаимодействие между:
А) AgCl и H2O Б) AgNO3 и KCl В) Ag2O и HCl Г) Ag и Cl2
12. Лакмус в растворе сульфата меди становится: А)красным Б)фиолетовым В)cиним Г)бесцветным
13. Степень окисления -3 азот проявляет в соединении:
А) HNO
14. Восстановителем в реакции Al + HCl → AlCL3+ H2 является:
А)водород Б)кислород В)алюминий Г)хлор
Часть Б. 1. Составьте уравнение реакции в молекулярном, полном ионном, сокращенном ионном виде между хлоридом кальция и нитратом свинца.
2.Определите среду в растворе иодида алюминия, аргументируйте ответ.
3.Расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель:
KClO3 + S → KCl + SO2
Определите формулу соли, если известно, что при взаимодействии раствора этой соли с раствором щелочи выделяется газ с резким запахом аммиака, а при взаимодействии с раствором соляной кислоты – газ без запаха, вызывающий помутнение известковой воды.

Котрольная работа №1. Вариант 3.
Часть А.
1.Присоединение воды к молекулам, атомам или ионам называется:
А) константой диссоциации Б) степенью диссоциации В) концентрацией Г) долей диссоциации
2. Лампочка прибора для проверки электропроводимости слабо загорится в растворе:
А) уксусной кислоты Б) гидроксида натрия В) сахара Г) поваренной соли
3. Вещество, при диссоциации которого образуются катионы металла и гидроксид-анионы:
А) соль Б) кислота В) вода Г) щелочь
4. Катионы металла и анионы кислотного остатка образуются при диссоциации:
А) соляной кислоты Б) гидроксида бария В) карбоната кальция Г) нитрата алюминия
5. Если степень диссоциации α близка к 0, то в растворе вещество существует:
А) в виде молекул Б) в виде ионов В) в основном в виде ионов Г) в основном в виде молекул
6. Сильным электролитом является: А) H2СO3 Б) KMnO4 В) Ag2S Г) Al(OH)3
7. На первой ступени диссоциации гидроксида бария образуются:
На первой ступени диссоциации гидроксида бария образуются:
А) Ba2+ и OH— Б) Ba2+ и 2OH— В) BaOH+ и OH— Г) BaOH+ и 2OH—
8. К выпадению осадка приводит взаимодействие ионов:
А) Fe3+ и F— Б) Zn2+ и PO43— В) Hg2+ и NO3 — Г) NH4+ и I—
9. Четыре иона образуются при диссоциации: А) AlBr3 Б) AgNO3 В) BaCl2 Г) Na2SO4
10. Необратимо протекает реакция ионного обмена между растворами:
А) Н2S и Ba(OH)
11. Сокращенному ионному уравнению Cu2+ + 2OH— → Cu(OH)2↓соответствует взаимодействие между:
А) CuCl2 и H2O Б) Cu(NO3)2 и NaOH В) CuO и NaOH Г) Cu и H2O
12. Лакмус в растворе cульфида бария становится: А)красным Б)фиолетовым В)cиним Г)бесцветным
Лакмус в растворе cульфида бария становится: А)красным Б)фиолетовым В)cиним Г)бесцветным
13. Наименьшую степень окисления сера прявляет в соединении:
14. Восстановителем в реакции Fe + H3PO4 → Fe PO4+ H2 является:
А) водород Б) кислород В) железо Г) фосфор
Часть Б.
1. Составьте уравнение реакции в молекулярном, полном ионном, сокращенном ионном виде между бромида железа(II) и гидроксида калия.
2.Определите среду в растворе хлората натрия, аргументируйте ответ.
3.Расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель:
Fe2O3 + C → Fe + CO2
4. Определите формулу соли, если известно, что при взаимодействии раствора этой соли с раствором щелочи выпадает осадок бурового цвета, а при взаимодействии с раствором нитрата серебра – желтый осадок.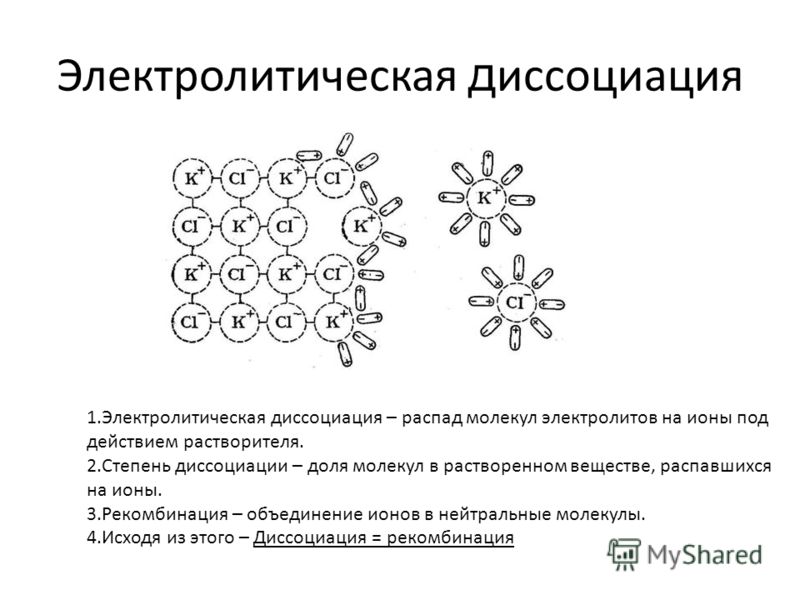
Котрольная работа №1. Вариант 4.
Часть А.
1.Отношение числа распавшихся на ионы молекул к общему числу молекул называется:
А) ассоциацией Б) гидратацией В) диссоциацией Г) нейтрализацией
2. Лампочка прибора для проверки электропроводимости загорится в растворе:
А) глюкозы Б) сульфата натрия В) спирта Г) ледяной уксусной кислоты
3. Вещества, при диссоциации которых всегда образуются катионы водорода:
А) любой электролит Б) соль В) основание Г) кислота
4. Катионы металла и гидроксид-анионы образуются при диссоциации:
А) гидроксида железа (II) Б) гидроксида калия
В) серной кислоты Г) воды
5. Если степень диссоциации α близка к 1, то в растворе вещество существует:
А) в виде молекул Б) в виде ионов
В) в основном в виде ионов Г) в основном в виде молекул
6. Слабым электролитом является: А) H2S Б) KMnO4 В) HClO4 Г) Ba(OH)2
7. На первой ступени диссоциации гидроксида кальция образуются:
На первой ступени диссоциации гидроксида кальция образуются:
А) Сa2+ и OH— Б) Сa2+ и 2OH— В) СaOH+ и OH— Г) СaOH+ и 2OH—
8. К выпадению осадка не приводит взаимодействие ионов:
А) Al3+ и OH— Б) NH4+ и PO43— В) Ag+ и Cl— Г) Hg2+ и I—
9. Наибольшее количество ионов образуются при диссоциации:
А) FeBr3 Б) Al(NO3) 3 В) Fe2(SO4)3 Г) Na2S
10. Необратимо протекает реакция ионного обмена между растворами:
А) FeSO4 и Ba(OH)2 Б) Сa(NO3)2 и K2SO4 В) K2CO3 и Na2SO3 Г) K2CO3 и NH4NO3
11. Сокращенному ионному уравнению Cr2+ + 2OH— → Cr(OH)2↓соответствует взаимодействие между:
Сокращенному ионному уравнению Cr2+ + 2OH— → Cr(OH)2↓соответствует взаимодействие между:
А) CrCl2 и H2O Б) CrCl2 и NaOH В) CrO и KOH Г) Cr и H2O
12. Лакмус в растворе cульфата натрия становится: А)красным Б)фиолетовым В)cиним Г)бесцветным
13. Набольшую степень окисления азот прявляет в соединении:
А) NO2 Б) N2O3 В) NH3 Г) NH4Cl
14. Окислителем в реакции Аl + FePO4 → AlPO4+ Feявляется:
А) алюминий Б) кислород В) железо Г) фосфор
Часть Б.
1. Составьте уравнение реакции в молекулярном, полном ионном, сокращенном ионном виде между ортофосфорной кислотой и гидроксидом натрия.
2.Определите среду в растворе хлората железа(II), аргументируйте ответ.
3.Расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель:
HNO3 + S → H2SO4 + NO
4. Определите формулу соли, если известно, что при взаимодействии раствора этой соли с раствором щелочи выпадает осадок зеленоватого цвета, а при взаимодействии с раствором нитрата серебра – белый осадок.
Базовый вариант. Котрольная работа №1. Вариант 1.
Часть А.
Процесс распада электролита на ионы называют:
А) ассоциацией Б) гидратацией В) диссоциацией Г) нейтрализацией
2. Лампочка прибора для проверки электропроводимости загорится в растворе:
А) сахара Б) этилового спирта В) кислорода Г) поваренной соли
3. Вещество, при диссоциации которого образуются катионы водорода и анионы кислотного остатка: А) соль Б) кислота В) вода Г) щелочь
4. Если степень диссоциации α равна 1, то в растворе вещество существует:
А) в виде молекул Б) в виде ионов В) в виде ионов и молекул Г) в основном в виде молекул
5. Сильным электролитом является: А) NaOH Б) Cu(OH)2 В) Fe(OH)3 Г) Zn(OH)2
6. На третьей ступени диссоциации фосфорной кислоты образуются:
А) H+ и H2PO4 — Б) 2H+ и HPO4 2- В) 3H+ и PO4 3- Г) H+ и PO4 3-
7. К выпадению осадка приводит взаимодействие пары ионов:
А) Na+ и S2- Б) Al3+ и Cl— В) Sn2+ и OH— Г) Cr3+ и F—
8. Пять ионов образуются при диссоциации: А) Na2CO3 Б) H2SO4 В) Ca(OH)2 Г) Al2(SO4)3
9. Сокращенному ионному уравнению Н+ + ОН— → Н2О соответствует взаимодействие между:
А) HCl и Cu(OH)2 Б) HBr и NaOH В) H2SiO3 и NaOH Г) NH3 и H2O
10. Лакмус в растворе соляной кислоты становится: А)красным Б)фиолетовым В)cиним Г)бесцветным
11. Степень окисления +1 хлор проявляет в соединении:
А) Сl2O Б) ClO3 В) AlCl3 Г) HCl
12. Окислителем в реакции Zn + H2SO4 → ZnSO4 + H2 является:А)водород Б)кислород В)цинк Г)сера
Часть Б.
1. Составьте уравнение реакции в молекулярном, полном ионном, сокращенном ионном виде между гидроксидом бария и сульфатом натрия.
Расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель:
PH3 + O2 → P2O5 + H2O
Базовый вариант. Котрольная работа №1. Вариант 2.
Часть А.
1.Вещество, водный раствор или расплав которого не проводит электрический ток называется:
А) электролитом Б) неэлектролитом В) окислителем Г) восстановителем
2. Лампочка прибора для проверки электропроводимости не загорится в растворе:
А) соляной кислоты Б) гидроксида натрия В) глюкозы Г) поваренной соли
3. Вещество, при диссоциации которого образуются катионы металла и анионы кислотного остатка: А) соль Б) кислота В) вода Г) щелочь
4. Если степень диссоциации α равна 0, то в растворе вещество существует:
А) в виде молекул Б) в виде ионов В) в виде ионов и молекул Г) в основном в виде молекул
5. Слабым электролитом является: А) H2SO3 Б) H2SO4 В) Na2CO3 Г) Al2(SO4)3
6. На второй ступени диссоциации серной кислоты образуются:
А) H+ и HSO4 — Б) 2H+ и HSO4 2- В) 2H+ и SO4 2- Г) H+ и SO4 2-
7. К выпадению осадка не приводит взаимодействие пары ионов:
А) Вa2+ и SО42- Б) Al3+ и ОН— В) Mg2+ и SО32- Г) Cr3+ и F—
8. Три иона образуются при диссоциации: А) AlCl3 Б) HBr В) CaCl2 Г) Na3PO4
9. Сокращенному ионному уравнению Ag+ + Cl— → AgCl↓ соответствует взаимодействие между:
А) AgCl и H2O Б) AgNO3 и KCl В) Ag2O и HCl Г) Ag и Cl2
10. Лакмус в растворе гидроксида натрия становится: А)красным Б)фиолетовым В)cиним Г)бесцветным
11. Степень окисления -3 азот проявляет в соединении:
А) HNO2 Б) K3N В) N2O3 Г) HNO3
12. Восстановителем в реакции Al + HCl → AlCL3+ H2 является:
А)водород Б)кислород В)алюминий Г)хлор
Часть Б. 1. Составьте уравнение реакции в молекулярном, полном ионном, сокращенном ионном виде между хлоридом кальция и нитратом свинца.
2.Расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель:
KClO3 + S → KCl + SO2
Контрольная работа №2 «Электролитическая диссоциация»
1 вариант
Задание №1 Напишите уравнения электролитической диссоциации следующих веществ:
1. Гидроксид натрия
2. Азотная кислота
3. Хлорид магния
4. Карбонат калия
5. Нитрат железа (III)
Задание №2 Составьте молекулярные и полные ионные уравнения химических реакций:
1. Fe(OH)3 +3H1+ = Fe3+ +3H2O
2. NH41+ + OH1- = NH3 + H2O
3. CO32- +2H1+ = H2O + CO2
Задание №3 Расставьте коэффициенты в ОВР методом электронного баланса. Укажите окислитель и восстановитель:
KClO3 + Fe2O3 + KOH = K2FeO4 + KCl + H2O
Задание №4 Какие из перечисленных солей подвергаются гидролизу:
1. Нитрат калия
2. Сульфид натрия
3. Хлорид железа
Напишите уравнения гидролиза. Определите среду.
Задание №5 К 60г 10% раствора хлорида бария прилили избыток раствора сульфата цинка. Рассчитайте массу образовавшегося осадка.
Задание №5 (профиль)
Определите массу осадка, который образуется при сливании 15г 5% раствора хлорида бария и 10г 8% раствора сульфата натрия.
2 вариант
Задание №1 Напишите уравнения электролитической диссоциации следующих веществ:
1. Борная кислота
2. Гидроксид бария
3. Хлорид алюминия
4. Нитрат меди(II)
5. Сульфат железа(II)
Задание №2 Составьте молекулярные и полные ионные уравнения химических реакций:
1. СаО +2H1+ = Са2+ +H2O
2. Al3+ + 3OH1- = Al(OH)3
3. Cu2+ +S2- = CuS
Задание №3 Расставьте коэффициенты в ОВР методом электронного баланса. Укажите окислитель и восстановитель:
KNO2 + Na2S + H2SO4 = K2SO4 + NO + Na2SO4 + S + H2O
Задание №4 Какие из перечисленных солей подвергаются гидролизу:
1. Фосфат натрия
2. Сульфат натрия
3. Хлорид алюминия
Напишите уравнения гидролиза. Определите среду.
Задание №5 К 80г 15% раствора хлорида меди(II) прилили избыток раствора гидроксида калия. Рассчитайте массу образовавшегося осадка.
Задание №5 (профиль):
Какой объем газа выделится, если к раствору, содержащему 53г карбоната натрия, прилить 400г 20% азотной кислоты.
Тест Электролитическая диссоциация (9 класс) с ответами по теории темы
Сложность: знаток.Последний раз тест пройден более 24 часов назад.
Вопрос 1 из 10
Cоединения с ионной связью…..
- Правильный ответ
- Неправильный ответ
- Вы ответили лучше 57% участников
- 43% ответили правильно на этот вопрос
В вопросе ошибка?
Следующий вопросОтветитьВопрос 2 из 10
Неэлектролит — это
- Правильный ответ
- Неправильный ответ
- Вы и еще 71% ответили правильно
- 71% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 3 из 10
Не проводит электрический ток раствор
- Правильный ответ
- Неправильный ответ
- Вы и еще 71% ответили правильно
- 71% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 4 из 10
Вещество, имеющее ионную кристаллическую решетку,
- Правильный ответ
- Неправильный ответ
- Вы и еще 51% ответили правильно
- 51% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 5 из 10
Причина электролитической диссоциации
- Правильный ответ
- Неправильный ответ
- Вы ответили лучше 67% участников
- 33% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 6 из 10
Если электролит полностью диссоциирует на ионы и является сильным электролитом, то его степень диссоциации равна
- Правильный ответ
- Неправильный ответ
- Вы и еще 54% ответили правильно
- 54% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 7 из 10
В растворе находятся 20 молекул вещества, полностью распавшиеся на ионы, и 60 недиссоциированных молекул этого же вещества. Определите степень диссоциации этого электролита.
- Правильный ответ
- Неправильный ответ
- Вы ответили лучше 67% участников
- 33% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 8 из 10
Укажите сильный электролит
- Правильный ответ
- Неправильный ответ
- Вы и еще 65% ответили правильно
- 65% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 9 из 10
Осадок образуется при взаимодействии раствора гидроксида бария с раствором …
- Правильный ответ
- Неправильный ответ
- Вы и еще 51% ответили правильно
- 51% ответили правильно на этот вопрос
В вопросе ошибка?
ОтветитьВопрос 10 из 10
Раствор любой кислоты не взаимодействует с раствором …
- Правильный ответ
- Неправильный ответ
- Вы ответили лучше 70% участников
- 30% ответили правильно на этот вопрос
В вопросе ошибка?
Ответить
Доска почёта
Чтобы попасть сюда — пройдите тест.
-
Naryto Naryto
10/10
Макс Волк
2/10
Контрольная работа «Электролитическая диссоциация» 8 Класс
Рубаник Анна Иосифовна
учитель биологии и химии
МБОУ «СОШ№14»,г. Нижневартовск
Дифференцированный подход в обучении химии
Одной из перспективных и эффективных педагогических технологий обучения является дифференцированный подход обучения школьников, основанный на личностно-ориентированном характере образования. Цель дифференциации — обучение каждого на уровне его возможностей, способностей, адаптации обучения к особенностям различных групп учащихся.
Задания уровня «А» зафиксированы как базовый стандарт – минимальный, или репродуктивный. Здесь особенностью обучения является многократность повторения, умение выделять смысловые группы. Задание уровня «А» должен уметь выполнить каждый, прежде чем приступить к заданиям «В», «С». Уровень «В» – аналитико-синтетический уровень, руководствуется приемами умственной деятельности, которые необходимы для решения задач на применение. Здесь, кроме конкретных знаний вводятся дополнительные сведения, расширяющие материал уровня «А». Уровень «С» – творческий уровень, выводящий учащихся на уровень осознанного, творческого применения знаний, предусмотрены сведения, углубляющие материал, требующие логического обоснования. Этот уровень позволяет учащимся проявлять способность к дополнительной самостоятельной работе.
Опыт использования дифференциального подхода к контролю знаний учащихся покажу на примерах: разноуровневые контрольные работы по химии в 9 классе. Дифференцированные контрольные работы представлены в нескольких вариантах. Задания работы сгруппированы в три уровня: «А», «В», «С». В уровень «А» включены задания, проверяющие усвоение необходимого минимума конкретных знаний по химии. Выполнение ее требует от учащихся репродуктивной деятельности, оцениваю ее выполнение на «3». При выполнении уровня «В» учащиеся должны уметь раскрыть причинно-следственные связи, применять теоретические знания для объяснения конкретных явлений. Выполнение уровней «А» и «В» оцениваю на «4». Уровень «С» содержит задания, требующие целостного восприятия материала, самостоятельно проводить обобщение и сравнение. Выполнение этого уровня оцениваю на «5».
Источники материалов:
Царева Т.В., Реализация дифференцированного подхода в обучении химии как одно из направлений современных педагогических технологий. http://sarschool76.narod.ru/Tv_pab_ctv.pdf
Зуева М. В., Гара Н. Н. Контрольные и проверочные работы по химии. 8-9 кл.: методическое пособие. М.: Дрофа, 2002.
Иванова Р. Г. Вопросы, упражнения и задания по химии: пособие для учащихся 8-9 кл. М.: Просвещение, 2002.
Радецкий А. М. Проверочные работы по химии в 8-11 классах: пособие для учителя. М.: Просвещение, 2001.
Контрольная работа № 1
Электролитическая диссоциация
1 вариант
Уровень А
1.Какие из перечисленных веществ являются электролитами: сахар, H2, KCl, H3PO4, CuO, Ba(OH)2 , Fe(NO3)3, бензин?
2.Напишите уравнения диссоциации следующих электролитов:
H2SO3 → BaCl2 →
NaOH → Fe2(SO4)3 →
3.Приведите формулы 2-3 веществ, при растворении которых в водном растворе образуются ионы железа Fe3+.
Уровень В
4.Допишите уравнения реакций, составьте полные и сокращенные ионные уравнения:
А) HCl + KOH →
Б)* MgCl2 + NaOH →
Уровень С
5.* Допишите уравнение реакции. Составьте ионные уравнения в полной и сокращенной форме:
K2CO3 + … → … + H2O + CO2
6.** Составьте в молекулярной форме уравнение реакции, которому соответствует следующее ионное уравнение:
2H+ + SiO32- =H2SiO3
Контрольная работа № 1
Электролитическая диссоциация
2 вариант
Уровень А
1.Какие из перечисленных веществ являются неэлектролитами: сахар, H2, NaCl, H2SO4, MgO, KOH , Ba(NO3)2, спирт?
2.Напишите уравнения диссоциации следующих электролитов:
HNO3 → ZnCl2 →
Ca(OH)2 → Na3PO4 →
3.Напишите химические формулы электролитов, если известно, как они диссоциируют:
А) ? ↔ Mg2+ + 2NO3— Б) ? ↔ 2К+ + SO42-
Уровень В
4.Допишите уравнения реакций, составьте полные и сокращенные ионные уравнения:
А) KCl + AgNO3 →
Б)* Ba(NO3)2 + Na2SO4 →
Уровень С
5.* Допишите уравнение реакции. Составьте ионные уравнения в полной и сокращенной форме:
Cu(NO3)2 + … → Cu(OH)2 +
6.** Составьте в молекулярной форме уравнение реакции, которому соответствует следующее ионное уравнение:
3Ca2+ + 2PO43- = Ca3(PO4)2
Контрольная работа № 1
Электролитическая диссоциация
3 вариант
Уровень А
1.Какие из перечисленных веществ являются неэлектролитами: сахар, O2, MgCl2, H2SO4, FeO, KOH , Zn(NO3)2, спирт?
2.Напишите уравнения диссоциации следующих электролитов:
KNO3 → AlCl3 →
Ba(OH)2 → Na2SO4 →
3.Напишите химические формулы электролитов, если известно, как они диссоциируют:
А) ? ↔ Fe2+ + 2NO3 — Б) ? ↔ 3Na+ + PO43-
Уровень В
4.Допишите уравнения реакций, составьте полные и сокращенные ионные уравнения:
А) NaBr + AgNO3 →
Б)* BaCl2 + CuSO4 →
Уровень С
5.* Допишите уравнения реакций. Составьте ионные уравнения в полной и сокращенной форме:
CuCl2 + … → Cu(OH)2 + …
6.** Составьте в молекулярной форме уравнение реакции, которому соответствует следующее ионное уравнение:
3Zn2+ + 2PO43- = Zn3(PO4)2
Контрольная работа № 1
Электролитическая диссоциация
4 вариант
Уровень А
1.Какие из перечисленных веществ являются электролитами: сахар, N2, BaCl2, HNO3, CO, Ca(OH)2 , FeSO4, бензин?
2.Напишите уравнения диссоциации следующих электролитов:
Na2SO3 → MgCl2 →
KOH → Al2(SO4)3 →
3.Приведите формулы 2-3 веществ, при растворении которых в водном растворе образуются карбонат-ионы СО32-.
Уровень В
4.Допишите уравнения реакций, составьте полные и сокращенные ионные уравнения:
А) HNO3 + NaOH →
Б)* ZnCl2 + KOH →
Уровень С
5.* Допишите уравнения реакций. Составьте ионные уравнения в полной и сокращенной форме:
FeCl3 + … → AgCl + …
6.** Составьте в молекулярной форме уравнение реакции, которому соответствует следующее ионное уравнение:
Ba2+ + SiO32- =BaSiO3
Контрольная работа по теме “Неметаллы»
1 вариант
Уровень А
Выберите один правильный ответ.
Какой заряд ядра атома кремния:
+14
+28
+3
+4
Количество валентных электронов углерода:
2
4
6
12
Возможная валентность серы:
II
II, IV
II, IV, VI
II, IV, VI, VIII
контрольная_работа_№1_ТЭД_9_класс — Дать расшифровку понятиям неэлектролит
Вариант 1
Задание 1. Дать расшифровку понятиям:
неэлектролит
кислоты
степень электролитической диссоциации
растворение
Задание 2. Составить реакции ионного обмена, написать молекулярные, полные и сокращенные ионные уравнения:
а) Ca (NO3)2 + K2CO3 =
б) HNO3 +Ba (OH)2 =
в) Cu (OH)2 + HNO3=
Задание 3. Какие из веществ при диссоциации образуют ион ОН–? Запишите уравнения их диссоциации.
а) Bа(ОН)2; б) Zn(OH)2; в) НClO; г) KOН
Вариант 2
Задание 1. Дать расшифровку понятиям:
электролит
электролитическая диссоциация
гидролиз солей
основания
Задание 2. Составить реакции ионного обмена, написать молекулярные, полные и сокращенные ионные уравнения:
а) Ba(NO3)2 +K2SO4=
б) Na2CO3 + H2SO4 =
в) Fe(OH)2 + HNO3=
Задание 3. Какие из веществ при диссоциации образуют ион Н+? Запишите уравнения их диссоциации.
а) Са(ОН)2; б) Н2SO4; в) Н2SiO3; г) НNО3.
Вариант 3
Задание 1. Дать расшифровку понятиям:
электролит
кислоты
растворение
гидролиз солей
Задание 2. Составить реакции ионного обмена, написать молекулярные, полные и сокращенные ионные уравнения:
а) KOH + H2SO4 =
б) Na2CO3 + HNO3 =
в) CuCI2 + NaOH =
Задание 3. Какие из веществ при диссоциации образуют ион Н+? Запишите уравнения их диссоциации.
а) Са(ОН)2; б) Н2SO4; в) Н2SiO3; г) НNО3.
Вариант 4
Задание 1. Дать расшифровку понятиям:
неэлектролит
электролитическая диссоциация
степень электролитической диссоциации
основания
Задание 2. Составить реакции ионного обмена, написать молекулярные, полные и сокращенные ионные уравнения:
а) NaOH + H3PO4 =
б) K2CO3 + HCI =
в) FeCI2 + NaOH =
Задание 3. Какие из веществ при диссоциации образуют ион ОН–? Запишите уравнения их диссоциации.
а) Bа(ОН)2; б) Zn(OH)2; в) НClO; г) KOН
Вариант 5
Задание 1. Дать расшифровку понятиям:
неэлектролит
кислоты
степень электролитической диссоциации
растворение
Задание 2. Составить реакции ионного обмена, написать молекулярные, полные и сокращенные ионные уравнения, указать названия продуктов реакции:
а) FeCl3+AgNO3=
б) NaOH+Fe(NO3)3=
в) CaCl2+Na2CO3=
Задание 3. Какие из веществ при диссоциации образуют ион Н+? Запишите уравнения их диссоциации.
а) Са(ОН)2; б) Н2SO4; в) Н2SiO3; г) НNО3.
Вариант 6
Задание 1. Дать расшифровку понятиям:
электролит
электролитическая диссоциация
гидролиз солей
основания
Задание 2. Составить реакции ионного обмена, написать молекулярные, полные и сокращенные ионные уравнения, указать названия продуктов реакции:
а) Al(OH)3+H2SO4=
б) AgNO3+NaCl=
в) Na2SO4+BaCl2=
Задание 3. Какие из веществ при диссоциации образуют ион ОН–? Запишите уравнения их диссоциации.
а) Bа(ОН)2; б) Zn(OH)2; в) НClO; г) KOН
Степень диссоциации — Учебный материал для IIT JEE
Степень диссоциации ()
Степень диссоциации вещества определяется как доля его молекул, диссоциирующих в данный момент времени.
Рассмотрим реакцию,
2NH 3 (г) N 2 (г) + 3H 2 (г)
Пусть начальные моли NH 3 (g) будут «а». Пусть x молей NH 3 диссоциируют при равновесии.
Степень диссоциации (а) NH 3 определяется как число молей диссоциированного Nh4 на моль Nh4.
, если x моль диссоциирует от «a» моль NH 3 , то степень диссоциации Nh4 будет x / a.
Мы также можем посмотреть на реакцию следующим образом.
Таким образом вы должны вычислить основное уравнение. Итак, мой вам совет: при решении проблемы следуйте приведенному ниже методу:
Напишите сбалансированную химическую реакцию (в основном она будет дана)
Под каждым компонентом напишите начальный номер. родинок.
Сделайте то же самое для состояния равновесия.
Затем выведите выражение.
Зависимость степени диссоциации от измерений плотности
? Плотность пара и степень диссоциации см. В следующем видео
Ниже приводится метод расчета степени диссоциации газа с использованием плотности пара. Этот метод действителен только для реакций, в которых существует K P , т.е.е. реакции, в которых присутствует, по крайней мере, один газ, но нет раствора.
С
pV = nRT
pV = nRT
С
P = NRT / V
Для реакции при равновесии V — константа, а ρ — константа. Плотность пара α 1 / n
(молекулярная масса = 2 × V.D)
Здесь M = исходная молекулярная масса
m = молекулярная масса в состоянии равновесия
Возьмем реакцию
PCl 5 PCl 3 + Cl 2
Начальные моль C 0 0
По ур.С (1-α) Cα Cα
∴ = C (1 + α) / C = D / d; 1 + α = D / d = M / м
Зная D и d, можно вычислить α, а также M и m.
Термодинамика химического равновесия
Пусть ΔG 0 будет разностью свободной энергии реакции, когда все реагенты и продукты находятся в стандартном состоянии, а K c или K p будет константой термодинамического равновесия реакции.Оба связаны друг с другом при температуре T следующим соотношением.
ΔG 0 = — 2.303 RT logK c и ΔG 0 = — 2.303 RT log K p (в случае идеальных газов)
Теперь мы знаем, что термодинамически
ΔG 0 = ΔH 0 — TDS 0
здесь ΔH 0 — стандартная энтальпия реакции, а ΔS 0 — стандартное изменение энтропии
(i) Когда ΔG 0 = 0, тогда K c = 1
(ii) Когда ΔG 0 > 0, т.е.е. + ve, тогда K c <1, в этом случае возможна обратная реакция, демонстрируя тем самым меньшую концентрацию продуктов при равновесной скорости.
(iii) Когда ΔG 0 <0, то есть -ve, тогда K c > 1; В этом случае возможна прямая реакция, показывая тем самым большие концентрации продукта в равновесном состоянии.
В состоянии равновесия,
Пример 1 . При нагревании PCl 5 диссоциирует на PCl 3 и Cl 2 .Плотность газовой смеси при 200 o C и 250 o C составляет 70,2 и 57,9 соответственно. Найдите степень диссоциации при 200 o C и 250 o C.
Раствор: PCl 5 (г) → PCl 3 (г) + Cl 2 (г)
Нам даны плотности пара в состоянии равновесия при 200 ° ° C и 250 ° ° C.
Начальная плотность пара будет такой же при обеих температурах, как
это будет M PCl5 /2.
∴ Начальная плотность пара = (31 + 5 × 35,5) / 2 = 104,25
Плотность пара в состоянии равновесия при 200 ° C o C = 70,2
∴ Общее количество молей в состоянии равновесия / Общее количество молей в исходном состоянии = 1 + α = Исходная плотность пара / Плотность пара в состоянии равновесия = 104,25 / 70,2 = 1,485
∴ а = 0,485
При 250 o C, 1 + α = 104,25 / 57,9 = 1,8
∴ а = 0,8
Пример проблемы.
Степень диссоциации PCl 5 составляет 60%, затем узнайте наблюдаемую молярную массу смеси.
Раствор: PCl 5 (г) PCl 3 (г) + Cl 2 (г)
Первоначально родинки 1 0 0
В экв. 1 — α α α
Где α = степень диссоциации = 0,6
Общее количество молей в состоянии равновесия = 1 + a = наблюдаемое количество молей
1 + a = 206,5 / наблюдаемая молекулярная масса
Наблюдаемая молекулярная масса= 206.5/1 + а = 206,5 / 1,6 = 129,06
Пример 2. Система находится в равновесии как PCl 5 + Heat -> PCl 3 + Cl 2
Почему температура системы снижается, когда PCl 3 удаляются из равновесной смеси при постоянном объеме?
Решение: При удалении PCl 3 из системы реакция сместилась вправо. Это потребляемое тепло и, следовательно, температура снижается.
Пример. NO и Br 2 при начальных парциальных давлениях 98,4 и 41,3 торр, соответственно, реагировали при 300 К. В состоянии равновесия полное давление составляло 110,5 торр. Рассчитайте значение константы равновесия и стандартное изменение свободной энергии при 300 К для реакции 2NO (г) + Br 2 (г) 2NOBr (г).
Решение:
2НО (г) + Br 2 (г) → 2НОБР (г)
Начальное давление 98.4 41,3 0
В eqlbm. 98,4-х 41,3 — х / 2 х
Полное давление в состоянии равновесия 110,5 торр.
98,4-х + 41,3- х / 2 + х = 110,5
x = 58,4 торр
Сейчас, 1 атм = 760,4 торр,
x = 7,68 × 10 -2 атм.
п НОБР = 7,68 × 10 -2 атм; p NO = 98,4-x = 40 торр = 5,26 × 10 -2 атм.
п Br2 = 41.3 — x / 2 = 12,1 торр = 1,59 × 10 -2 атм.
ΔG o = -2,303 RT log K = -2,303 (1,99) (300) (log 134)
= -2,92 ккал = -12,2 кДж.
[Если R используется как 1,99 кал / моль К, тогда ΔG o будет в кал. Если использовать R как 8,314 Дж / моль К, тогда ΔG o будет в Джоулях. Но K P всегда должен быть в (атм) Δ n .]
Связанные ресурсы
Программа обучения химии JEE
Справочники по химии
Чтобы узнать больше, купите учебные материалы по «Химическому равновесию», включая заметки для изучения, заметки о пересмотре, видеолекции, решенные вопросы за предыдущий год и т.Также просмотрите дополнительные учебные материалы по химии здесь.
Особенности курса
- 731 Видео-лекции
- Примечания к редакции
- Документы за предыдущий год
- Интеллектуальная карта
- Планировщик исследования
- Решения NCERT
- Обсуждение Форум
- Контрольная бумага с видео-решением
Теория электролитической диссоциации Аррениуса
(1- α) + 2α = (1+ α) = I, где I — фактор Вант-Гоффа.
Мерой степени диссоциации (α) является коэффициент проводимости Аррениуса, который представляет собой отношение эквивалентной проводимости при любой данной концентрации t при бесконечном разбавлении. Эта теория оказалась успешной и сторонниками Аррениуса — Вант Хоффом и Освальдом, впоследствии известными как «ионисты».
Модификации и применимость теории пытались распространить на концентрированные растворы, и были разработаны допущение и идея свободной воды.Но в конечном итоге теория межионного взаимодействия полной диссоциации Дебая-Хюккеля объяснила концентрационную зависимость коэффициентов активности для разбавленных растворов, а затем распространила ее на более концентрированные электролиты. Это привело к сложным уравнениям с неизвестными параметрами и без объяснения неидеализма во всем диапазоне концентраций.
Постепенно по прошествии нескольких лет было подтверждено, что числа степени диссоциации и гидратации оцениваются по данным давления пара, а не по коэффициенту проводимости.Это объяснило и доказало неидеальные свойства электролитов в большом диапазоне концентраций. Далее было обнаружено, что модальности и количество гидратации свободной воды были разными на поверхности и в объеме раствора. Это привело к применению теории электролитов во всем диапазоне концентраций от нуля до насыщения на основе идеи частичной диссоциации и свободной воды.
Постулат утверждает, что; «В водном растворе молекулы электролита подвергаются самопроизвольной диссоциации с образованием положительных и отрицательных ионов.”Лучшим примером является NaCl, диссоциирующий на Na + и Cl-
NaCl (водн.) → Na + (водн.) + Cl– (водн.)
h3SO4 (водн.) → 2 H + (водн.) + SO42- (водн.)
Определение электролитической диссоциации:
Диссоциация просто означает разрушение соединения на более простые составляющие, которые могут снова рекомбинировать в других условиях. При ионной или электролитической диссоциации добавление электролита или растворителя заставляет молекулы соединения распадаться на ионы (электрически заряженные частицы).Свойство диссоциации используется для объяснения электропроводности электролита и соединения.
Обзор:
В соответствии с современной теорией предполагается, что твердые электролиты состоят из двух типов заряженных частиц — положительных и отрицательных, которые удерживаются вместе за счет электростатической силы притяжения. Когда эти твердые электролиты растворяются в подходящем растворителе, электростатическая сила между заряженными частицами ослабевает, что приводит к разделению или диссоциации на одно заряженное вещество.Это известно как электролитическая диссоциация или ионная сольватация. В зависимости от свойств электролитов их типы следующие:
1) Сильные электролиты — те электролиты, которые полностью диссоциируют на соответствующие ионы, даже в умеренных условиях, называются сильными электролитами. Их степень диссоциации высока, и одновременно высока их константа диссоциации. Электролиты этого типа обладают высокой проводимостью. Закон массового действия неприменим, поскольку диссоциация необратима.
Пример: сильные кислоты — h3SO4, HCl, HNO3
Сильные основания — NaOH, KOH
Соли — NaCI, KCl
2) Слабые электролиты — те электролиты, которые диссоциируют в ограниченной степени, называются слабыми электролитами . Эти электролиты имеют низкую степень ионизации и меньшее значение константы диссоциации. У них низкая электропроводность. Диссоциация обратима; следовательно, применим закон массового действия. Пример: уксусная кислота, муравьиная кислота, слабое основание, такое как гидроксид аммония, и соли, такие как ацетат аммония и ацетат серебра.
Характеристики электролитической диссоциации:
1. Диссоциация — это процесс разделения заряженных частиц, которые уже существуют в соединении.
2. В диссоциации участвуют ионные соединения.
3. В результате диссоциации образуются заряженные или электрически нейтральные частицы.
4. Диссоциация обратима.
5. Диссоциация возможна только при наличии ионных связей в соединении.
Разница между концепциями ионизации и диссоциации:
Основное различие между ними заключается в типе используемых соединений.
Ионизация — процесс образования ионов из соединений, которые не являются ионными по своей природе. В нем участвуют ковалентные соединения. Это необратимо по своей природе. Для запуска процесса ионизации требуется соответствующий растворитель, который также называется ионной сольватацией.
Пример: В случае молекулы HCl атомы H и Cl связаны ковалентно.Однако при растворении в воде он образует два иона, а именно ионы H + и Cl–.
HCl (водный) → H + (водный) + Cl– (водный)
Диссоциация — это процесс самопроизвольного расщепления вещества на составляющие заряженные частицы. Требуемое соединение должно быть ионным по природе. По своей природе они обратимы.
Пример: В случае молекулы хлорида натрия (NaCl)
NaCl (водный) → Na + (водный) + Cl– (водный)
Эффект асимметрии:
Прохождение тока через раствор электролита вызывает асимметрия в ионной атмосфере.Центральный ион движется к электроду и молекуле растворителя в противоположном направлении. Из-за большого количества любого из зарядов плотность заряда увеличивается на одном конце. Это вызывает снижение проводимости, однако симметрия достигается через короткое время. Эффект представлен:
B = 8,2×105Λ0 / (DT) 3/2
D — диэлектрическая проницаемость, η — вязкость в пуазах, T — абсолютная температура
Электрофоретический эффект:
A одиночный ион окружен молекулой растворителя и другими ионами, поэтому ионная атмосфера центрального иона задействует силы обоих.Движение центрального иона в направлении, противоположном направлению ионной атмосферы, вызывает силу отвода со стороны молекулы растворителя на движение центрального иона. Эта новая сила, замедляющая действие центрального иона из-за трения между ионом и растворителем, известна как электрофоретический эффект. Это вызывает уменьшение эквивалентной существующей проводимости. Электрофоретическая сила может быть математически представлена в следующем уравнении:
A = 82,4 / (DT) 1 / 2η
D — диэлектрическая постоянная, η — вязкость в пуазах, T — абсолютная температура.
Степень диссоциации:
Доля от общего числа молей слабого электролита, который ионизируется в соответствующие ионы в водном растворе в равновесном состоянии, называется степенью диссоциации. Обозначается он «α». Его можно представить в виде уравнения:
Обнаружено, что степень диссоциации и ее значение зависят от следующих факторов:
a) Природа растворенного вещества: если ионизируемая часть молекулы связана ковалентными связями, меньше ионов производится.А если ионизируемая часть молекулы удерживается электроковалентной связью, образуется больше ионов.
б) Природа растворителя: Растворитель несет полную ответственность за уменьшение силы электростатического притяжения между двумя заряженными частицами (ионами). Из закона Кулона хорошо известно, что силы между двумя заряженными частицами обратно пропорциональны диэлектрической проницаемости среды между ними. Таким образом, чем больше диэлектрическая проницаемость, тем больше способность растворителя разделять ионы.Вода имеет самую высокую диэлектрическую проницаемость, поэтому является лучшим растворителем для диссоциации заряженных частиц.
c) Концентрация раствора: согласно закону разбавления Оствальда «Степень ионизации любого слабого электролита обратно пропорциональна квадратному корню из концентрации и прямо пропорциональна квадратному корню из разбавления». Таким образом, это означает, что если разбавление конкретного вещества увеличивается, логически это означает большее добавление растворителя (концентрация уменьшается).Степень ионизации увеличивается, поскольку большее количество молекул растворителя вызывает большее образование ионов.
d) Температура: Температура прямо пропорциональна степени диссоциации. По мере увеличения температуры кинетическая энергия молекул увеличивается, что приводит к уменьшению силы притяжения между частицами и приводит к обычной диссоциации ионов.
Доказательства в поддержку теории Аррениуса:
• Исследования дифракции рентгеновских лучей показывают присутствие ионов в электролитах.Это также показывает, что они проводят электричество в плавленом состоянии.
• Электролитические растворы подчиняются закону Ома. Это возможно, особенно если ионы уже присутствуют в растворе.
• Некоторые реакции возможны из-за присутствия ионов и ионных соединений:
• Na + (водн.) + Ag + (водн.) + NO3– (водн.) + Cl– (водн.) → AgCl (водн.) + NaNO3 (водн.)
• Согласно теории Аррениуса, в некоторой системе получается недиссоциированная вода, что приводит к изменению энтальпии системы.Это явление известно как энтальпия нейтрализации.
• Цвет электролита обусловлен наличием иона.
• Эта теория лежит в основе продукта растворимости, гидролиза, эффекта обычных ионов, электролиза, электропроводности, электрофореза и т. Д.
• Ионная теория может объяснить аномальные и непредсказуемые коллигативные свойства. Когда электолит растворяется в воде, количество частиц в растворе всегда увеличивается, чем общее количество молекул, растворенных за счет ионизации.
Ограничения теории Аррениуса:
• Теория Аррениуса применима к водным растворам, а не к неводным растворам и газообразным растворам, поскольку она определяет электролит как водный раствор, а не как вещество.
• Растворитель не влияет на определение силы электролита. Пример: HCl — сильная кислота в присутствии воды, но слабая кислота в присутствии бензола.
• Органические растворители не исследовались так широко, как неорганические растворители.
• Теории, основанные (закон разбавления Оствальда) на теории диссоциации Аррениуса, оказались эффективными только для слабых электролитов.
• Доказано и замечено, что и в отсутствие воды сильный электролит проводит электричество. Это оказывается противоречащим теории Аррениуса.
• Факторы, влияющие на степень диссоциации, не очень хорошо объяснены.
Теория диссоциации
Экспериментально установлено, что растворы некоторых веществ в воде могут проводить электрический ток (например, раствор поваренной соли в воде), а раствор сахара — нет. Первая группа веществ получила название электролитов, вторая — неэлектролитов.
Чтобы понять уникальные свойства растворов электролитов, мы кратко рассмотрим теорию Сванте Аррениуса (1859-1927).Его работы составляют основу современной теории ионов в водных растворах, в которых вода является растворителем. Аррениус считал ионы электрически заряженными. В целом раствор содержит равное количество положительных и отрицательных зарядов. Он пришел к выводу, что ионы образуются в результате ионизации молекул в водном растворе.
Вода — растворитель в водном растворе — не инертный компонент. Полярность молекул воды играет важную роль в образовании растворов ионных соединений в воде.Молекула H 2 O представляет собой полярную частицу, называемую дублетом:
H + ─ OH — _
Заряженные концы молекул воды притягивают ионы в ионных соединениях и переводят их в раствор. Энергия, выделяемая при притяжении иона к молекуле воды, также влияет на теплоту растворения ионного соединения в воде.
Процесс растворения ионных соединений. Предположим, мы бросаем несколько кристаллов хлорида натрия в стакан с водой.На поверхности кристалла молекулы воды контактируют с ионами Na + и Cl — . Положительные концы молекул воды притягиваются к ионам Cl — ; отрицательные концы притягиваются к ионам Na + . Притяжение между молекулами воды и ионами достаточно сильное, чтобы увести ионы от поверхности кристалла в раствор, как показано на рис. 15.
Рисунок 15.Поваренная соль (хлорид натрия) растворяется в воде с образованием гидратированных ионов натрия и хлорида
Этот процесс растворения с водой в качестве растворителя называется гидратацией. Говорят, что ионы гидратированы. Притяжение между ионами и молекулами воды достаточно сильное, чтобы каждый ион в растворе оставался окруженным молекулами воды.
Разделение ионов, которое происходит при растворении ионного соединения, называется диссоциацией (означает распад, распад, разложение).Уравнения, описывающие диссоциацию хлорида натрия в воде:
NaCl (с) Na + (водн.) + Cl — (водн.)
где (s) — твердая фаза;
(водн.) — водный раствор
или в упрощенном виде
NaCl Na + + Cl — .
4. Степень диссоциации
Степень диссоциации (α) электролита — это соотношение:
α =.
α измеряет в процентах (0100%) или на единицу (01). Степень диссоциации зависит от:
Ø природа химических связей в растворенном веществе и растворителе;
Ø концентрация растворенного вещества;
Ø температуры раствора.
Основные направления этих взаимозависимостей:
- Степень диссоциации увеличивается с уменьшением концентрации электролита;
- Степень диссоциации увеличивается с повышением температуры.
В зависимости от степени диссоциации все электролиты подразделяются на три типа: сильные, средние и слабые. Однако это подразделение относительное.
Степень диссоциации сильных электролитов более 30%, средних — от 3% до 30%, слабых — не более 3%. В Приложении 9 представлено разделение основных классов неорганических веществ на электролиты.
Дата: 12.01.2015; просмотр: 835
8.10.9C: Слабые и сильные электролиты
Серьезное изучение растворов электролитов началось во второй половине 19 века, в основном в Германии, и до того, как были хорошо изучены детали диссоциации и ионизации. Эти исследования показали, что все эквивалентные электропроводности электролитов уменьшаются с концентрацией (или, точнее, с квадратным корнем из концентрации), но они делают это несколькими различными способами, которые отличаются своим поведением при очень малых концентрациях.Это привело к классификации электролитов на слабые, промежуточные и сильные.
Вы заметите, что графики зависимости проводимости от √ c начинаются с c = 0. Конечно, невозможно измерить проводимость электролита при исчезающе малых концентрациях (не говоря уже о нуле!), Но для сильных и промежуточных электролитов можно экстраполировать ряд наблюдений до нуля. Результирующие значения известны как , ограничивающие эквивалентные проводимости или иногда как «эквивалентные проводимости при бесконечном разбавлении», обозначаемые Λ °.
- Сильные электролиты
- Эти системы с хорошим поведением включают множество простых солей, таких как NaCl, а также все сильные кислоты.
График Λ против √c точно соответствует линейной зависимости - Λ = Λ ° — б √ в
- Промежуточные электролиты
- Эти «не очень сильные» соли не могут полностью соответствовать приведенному выше линейному уравнению, но их электропроводность может быть экстраполирована на бесконечное разбавление.
- Слабые электролиты
- «Меньше значит больше» для этих странностей, обладающих замечательной способностью демонстрировать бесконечную эквивалентную проводимость при бесконечном разбавлении.Хотя Λ ° не может быть оценено экстраполяцией, есть хитрый обходной путь.
Электропроводность уменьшается с увеличением концентрации
Поскольку ионы являются носителями заряда, можно ожидать, что проводимость раствора прямо пропорциональна их концентрациям в растворе. Таким образом, если электролит полностью диссоциирован, проводимость должна быть прямо пропорциональна концентрации электролита. Но это идеальное поведение никогда не наблюдается; вместо этого проводимость электролитов всех видов уменьшается с увеличением концентрации.
Неидеальность электролитических растворов также отражается в их коллигативных свойствах, особенно в понижении точки замерзания и осмотическом давлении. Основная причина этого — присутствие ионной атмосферы, которая была введена выше. В той степени, в которой ионы, имеющие противоположные знаки заряда, с большей вероятностью будут находиться ближе друг к другу, мы ожидаем, что их заряды частично аннулируются, уменьшая их тенденцию к миграции в ответ на приложенный градиент потенциала.
Вторичный эффект возникает из-за того, что когда ион мигрирует через раствор, его противоионное облако не успевает за ним. Вместо этого новые противоионы постоянно собираются на переднем фронте движения, а уже существующие остаются на противоположной стороне. Для рассеивания потерянных противоионов требуется некоторое время, поэтому на заднем фронте всегда больше противоионов. Возникающая в результате асимметрия поля противоиона оказывает тормозящее влияние на центральный ион, снижая скорость его миграции и, таким образом, его вклад в проводимость раствора.
Количественная обработка этих эффектов была впервые разработана П. Дебаем и У. Хюккелем в начале 1920-х годов и улучшена Оствальдом несколько лет спустя. –_ {(aq)} \]
сместится влево по мере увеличения концентрации «свободных» ионов.В более разбавленных растворах фактическая концентрация этих ионов меньше, но их относительное содержание по отношению к недиссоциированной форме больше. Когда концентрация раствора приближается к нулю, практически весь \ (MX _ {(aq)} \) диссоциирует, и проводимость достигает своего предельного значения.
Слабые электролиты диссоциируют только при очень высоком разбавлении
| плавиковая кислота | HF | K a = 10 –3.2 |
| уксусная кислота | CH 3 COOH | K a = 10 –6,3 |
| бикарбонат-ион | HCO 3 — | K a = 10 –10,3 |
| аммиак | NH 3 | K b = 10 –4.7 |
Диссоциация, конечно, зависит от степени. Константы равновесия диссоциации промежуточной электролитной соли MX обычно находятся в диапазоне 1-200. Это контрастирует с большим количеством слабых кислот (а также слабых оснований), константы диссоциации которых обычно находятся в диапазоне от 10 –3 до менее 10 –10 .
Эти слабые электролиты, как и промежуточные, будут полностью диссоциировать на пределе нулевой концентрации; если бы масштаб графика слабого электролита (синий), показанный выше, был бы увеличен на много порядков, кривая была бы похожа на кривую для промежуточного электролита над ним, и значение для Λ ° можно было бы найти путем экстраполяции.Но при таком большом разбавлении проводимость была бы настолько незначительной, что она была бы замаскирована проводимостью самой воды (то есть ионами H + и OH — , находящимися в равновесии с массивным 55,6 ML -1 концентрация воды), что делает значения Λ в этой области практически неизмеримыми.
