Заказать контрольную по химии в Москве
Если вы не можете самостоятельно решить задания из контрольной работы по химии, закажите услуги опытных исполнителей на сайте YouDo. Грамотные специалисты индивидуально подходят к написанию контрольной работы, и заранее оговаривают сроки ее выполнения, а также стоимость.
Преимущества покупки контрольной работы по химии
Химия является достаточно сложной учебной дисциплиной, поэтому решение контрольной работы может занять достаточно большое количество времени. Закажите контрольную по химии на сайте youdo.com, и опытные специалисты срочно выполнят работу на высоком профессиональном уровне.
Для выполнения контрольной работы по химии исполнителями Юду необходимо:
- предоставить задания
- указать особенности оформления
- сообщить критерии проверки, установленные вашим преподавателем
- подготовить методические материалы, по которым должна быть выполнена работа
- указать (если есть) список рекомендуемой педагогом литературы
- установить сроки выполнения работы
Ознакомившись с вашими требованиями, квалифицированные специалисты предложат вам качественные услуги и цены, которые будут невысоки.
От чего зависит стоимость работы по химии
Чтобы недорого купить контрольную по химии, оформите заявку на сайте Юду. Квалифицированные специалисты предложат вам наиболее выгодные условия и доступные цены за написание уникальной работы. Точную стоимость контрольной по химии исполнители Юду рассчитывают индивидуально.
При расчете стоимости написания контрольной работы по химии учитываются такие факторы:
- сложность и количество заданий в контрольной работе
- уровень требований к написанию работы по химии
- особенности оформления
- сроки выполнения контрольной работы по химии
Чтобы узнать примерную цену контрольных по химии, посмотрите прайс-листы исполнителей YouDo. Выбирая специалиста для решения контрольной по химии, обратите внимание не только на стоимость услуг, но и на рейтинг исполнителя, а также на отзывы о качестве и оперативности выполнения подобных работ.
Решение задач по химии. Контрольные работы по химии для студентов.

«Что самое важное при изучении химии? Никогда не облизывать ложечки!»
Для решения задач по химии , будь то органическая, аналитическая или любая другая , кроме знаний, необходимо время. Если Вы не можете, не хотите или не успеваете сами решить Вашу задачу или контрольную работу по химии, обращайтесь к нам. Будем рады помочь. Наши специалисты в кратчайшие сроки и за умеренную цену выполнят Ваши задания. Доработка при необходимости и сопровождение до защиты.
Оказываем помощь на экзамене, зачете по химии онлайн!
Химия – древнейшая наука, но она всегда, еще с тех времен, когда именовалась алхимией, была уделом избранных. Большинство людей со школьных времен не понимают и не любят этот предмет. В тоже время он присутствует в большинстве учебных программ технических и технологических вузов. Вы можете обучаться на архитектора, инженера-механика или инженера-метролога, и скорее всего за всю свою производственную деятельность никогда не увидеть ни одной химической формулы — но в вузе Вас упорно и настойчиво будут учить решать задачи по химии.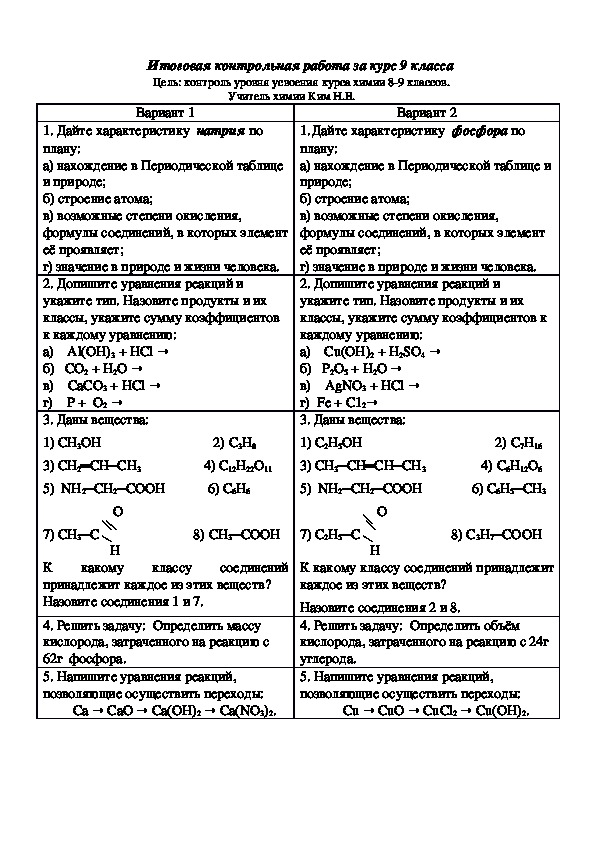 Если же Вам не дается это легко, и слова “диссоциация “, “гидратация “ и “4 сульфо-3-хлорбензойный альдегид “ не встречают у Вас радостного понимания — наш сайт придет Вам на помощь.
Если же Вам не дается это легко, и слова “диссоциация “, “гидратация “ и “4 сульфо-3-хлорбензойный альдегид “ не встречают у Вас радостного понимания — наш сайт придет Вам на помощь.
При необходимости поможем сдать тест по химии онлайн .
Ниже вы можете ознакомиться с примерами решенных нами экзаменационных билетов. Поскольку время на экзамене обычно ограничено и требуется оставить время на переписывание, пояснения к задачам — минимальные, в отличие от подробных пояснений в контрольных работах. Советуем учитывать этот факт, если собираетесь воспользоваться услугой «онлайн помощи» и Ваш преподаватель на экзамене имеет привычку задавать дополнительные вопросы. В таком случае Вам необходимо будет минимально подготовиться — так, чтобы хотя бы понимать ход мыслей в решении.
Стоимость решения задач по химии — от 100р за задачу , в зависимости от сложности и сроков. Онлайн помощь — от 1200р за билет.
Примеры решенных билетов с экзаменов:
-
Показать/скрыть условия билета 1
- Растворяется ли серебро в деаэрированной воде? Если растворяется – напишите уравнение соответствующей реакции.
 Если нет – объясните почему.
Если нет – объясните почему. - Будет ли железо взаимодействовать с хлороводородной кислотой? Если да, то напишите уравнение соответствующей реакции, составьте схему электронного баланса и расставьте коэффициенты. Если нет – объясните почему.
- Будет ли цинк растворяться в разбавленном растворе гидроксида калия? Если да, то напишите уравнение реакции(можно без коэффициентов). Если нет – объясните почему
- Будет ли медь постепенно растворяться в растворе сульфата меди? Ответ мотивируйте.
- Напишите уравнение реакций(можно без коэффициентов). Mg +H2SO4 =>X1+NaOH => X2+HCl =>X3
- Напишите уравнение реакций(можно без коэффициентов). FeCl2 + NaOH =>X1+O2+H2O =>X2 (t0) =>X3
- Что представляет собой накипь в чайнике? Как ее удалить? Напишите уравнение соответствующей реакции.

- Какую массу гидроксида кальция надо добавить к 400 мл воды, чтобы устранить временную жесткость, равную равную 4ммоль-экв/л? Напишите уравнение соответствующей реакции в ионно-молекулярной виде.
- Составьте схемы двух гальванических элементов, в одном из которых цинк был бы анодом, в другом – катодом. При каких условиях для подсчета ЭДС этих гальванических элементов можно пользоваться таблицей стандартных электродных потенциалов?
- Рассчитайте φ Me в некоторой среде по отношению к НВП, если его потенциал по отношению к медносульфатному электроду(МСЭ) равен равен -0,034 В. Φ
- Вычислить ЭДС гальванического элемента, составленных из одинаковых металлических электродов, опущенных в растворы соли этого металла с активной концентрацией ионов металла 1М и 10-3М.
- Продуктами, выделяющимися на инертных электродах при электролизе водного раствора йодида алюминия являются — 1. Al+I2 2.
 H2+I2 3. H2+O2 4. Al + H2
H2+I2 3. H2+O2 4. Al + H2 - Для получения каких металлов применяют электролиз расплавов их оксидов или солей? Почему? 1.Ba 2.Sb 3. Na 4. Mo 5. Ti
- Какие процессы могут протекать на катодных участках поверхности металла? От чего это зависит?
- Цинк имеет медное покрытие. Это покрытие (анодное?катодное?), так как….Напишите уравнения процессов, происходящих на анодных и катодных участках при разрушении этого покрытия на воздухе.
- Какие неметаллические покрытия применяются для защиты магистральных трубопроводов от коррозии?
- Растворяется ли серебро в деаэрированной воде? Если растворяется – напишите уравнение соответствующей реакции.
-
Показать/скрыть условия билета 2
- Какие углеводороды входят в состав бензиновой фракции, керосиновой, газойлевой и мазут?
- Какие вещества образуются при действии металлического натрия на бромисты пропил.
- Как меняется растворимость углеводородов различных рядов в анилине.

- Что такое “кислотное число” и как оно определяется.
-
Показать/скрыть условия билета 3
- Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа и уравнение Аренниуса. При 20ºC некоторая реакция заканчивается за 10 с. При какой температуре эта реакция закончится за 4,5 мин? Температурный коэффициент скорости реакции равен 3.
- У каких двух элементов периодической системы невозбужденные атомы имеют по 5 электронов на подуровне 4d? Составьте для них электронные и электронно-графические формулы.
- В чем состоят отличия коллоидных растворов от истинных? Причины и условия образования коллоидных растворов. Предложите способ получения и составьте общую формулу мицелл золя фторида алюминия с положительным зарядом граней.
- В воде содержаться соли: MgCl2, KCl, Ka(HCO3)2. Будет ли такая вода жесткой? Можно ли добавлением гашеной извести к этой воде полностью устранить ее жесткость и почему? Приведите возможные реакции в молекулярной и молекулярно-ионной формах.

- Уравняйте данную окислительно-восстановительную реакцию методами электронного или электронно-ионного баланса. Какое из реагирующих веществ является окислителем и какое – восстановителем? KMnO4+FeSO4+H2SO4 =>MnSO4+Fe(SO4)3+K2SO4+H2O
- Гипсовые вяжущие вещества. Получение, особенности процессов твердения. Сколько строительного гипса можно получить при обжиге природного гипсового камня массой 10т, в котором содержится 10% посторонних примесей?(предполагается, что примеси при нагревании не изменяются).
-
Показать/скрыть условия билета 4
- Назовите по систематической и рациональной номенклатуре следующие соединения.

- Напишите реакции а) пентена-2 с концентрированным раствором KMnO4 б) пентена -2 с разбавленным раствором KMnO4 в) пропина с HOH в присутствии HgSO4 г) нагревание н-гексана при 5000С
- Получите бутен-1 из а) 1-хлорбутана б)реакцией крекинга
- Назовите по систематической и рациональной номенклатуре следующие соединения.
-
Показать/скрыть условия билета 5
Теоретическая часть
- Какие из соединений MnCl2 , KMnO4, MnO2, K2MnO4 проявляет только окислительные свойства? Ответ надо обосновать(приведите электронное строение соответствующего иона)
- Какие металлы растворяются в воде? Приведите уравнения реакций.
- Запишите строение электронной оболочки атома S в основном и возбужденном состоянии, начиная с начала периода, в котором находится элемент. Определите максимальное число неспаренных электронов.
- Составьте формулу высшего оксида элемента(задание 3) и определите его кислотно-основные свойства.
 Подтвердите уравнениями в молекулярном и ионно-молекулярном виде.
Подтвердите уравнениями в молекулярном и ионно-молекулярном виде.
Практическая часть
- Масса меди, выделившаяся на катоде при пропускании тока силой 17,9 А в течении 45 минут через раствор сульфата меди (II) с выходом по току 100% составляет ___г.
- Сколько граммов гидроксида кальция необходимо прибавить в 1000л воды, чтобы удалить временную жесткость, равную 2,86 ммоль/л? Напишите уравнение соответствующей реакции в ионно-молекулярном виде.
- Рассчитайте Жврем воды, если на титрование 75мл этой воды понадобилось 4 мл 0,1 раствора соляной кислоты.
- Запишите электронно-графическую формулу иона Sn2+ (начиная с начала V периода) и объясните, почему этот ион способен образовать комплексные соединения. Закончите уравнение и назовите полученное соединение: SnCl2+NaOH(изб) =>
- Какое вещество выпадет в осадок при сливании водных растворов хлорида хрома и сульфида калия? Ответ подтвердите молекулярным уравнением процесса.

- Какие продукты образуются при горении магния на воздухе? Написать уравнения реакций их взаимодействия с водой. Определите степень окисления атомов элемента, составьте уравнения электронного баланса, укажите окислитель и восстановитель, процессы окисления и восстановления и расставьте коэффициенты. Назовите полученное соединение.
- Будет ли железо взаимодействовать с бромоводородной кислотой? Если да, напишите уравнение соответствующей реакции, составьте схему электронного баланса и расставьте коэффициенты. Если нет – объясните почему.
- Будет ли медь растворяться в разбавленном растворе гидроксида натрия? Если да – напишите уравнение реакции. Если нет – объясните почему.
-
Показать/скрыть условия билета 6
- Рассчитайте, какое значение pH имеют растворы соляной HCl и ортофосфорной H3PO4 кислот с одинаковой молярной концентрацией, равной 0,2 моль/л.
 Степень диссоциации HСl составляет составляет 100%, а степень диссоциации H3PO4 по первой ступени – 45%(диссоциацией ортофосфорной кислоты по другим ступеням пренебречь).
Степень диссоциации HСl составляет составляет 100%, а степень диссоциации H3PO4 по первой ступени – 45%(диссоциацией ортофосфорной кислоты по другим ступеням пренебречь). - Напишите уравнения гидролиза NH4Cl в молекулярной и сокращенной ионной формах. Укажите характер среды (pH) в растворе этой соли.
- Гальванический элемент состоит из цинка (Zn) в растворе соли ZnCl2 с концентрацией 1 моль/л и меди (Cu) в растворе CuSO4 с концентрацией 0,1 моль/л. Как изменится ЭДС этого элемента, если раствор CuSO4 разбавить в 100 раз.
- Какие из металлов сплава Zn-Cu будет ли наиболее активно подвергаться коррозии в кислой среде(например, в растворе h3SO4)? Составьте схему работы гальванического элемента, образующегося при этом, и рассчитайте его ЭДС.
- Вычислите удельную поверхность катализатора, 0,5г которого адсорбирует 50 мл N2 (при нормальных условиях). Площадь поперечного сечения адсорбированной молекулы N2 равна 16 А2 .

- Вычислите порог коагуляции золя раствором K2SO4 , если добавление 0,002л раствора K2SO4 с концентрацией 0,15 моль –экв/л вызывает коагуляцию 0,02 л золя.
- Рассчитайте, какое значение pH имеют растворы соляной HCl и ортофосфорной H3PO4 кислот с одинаковой молярной концентрацией, равной 0,2 моль/л.
-
Показать/скрыть условия билета 7
- Напишите электроннографическую формулу Cr+6 и объясните, какие свойства в окислительно-восстановительных реакциях может проявлять этот ион.
- Исходя из степени окисления подчеркнутых элементов, определите, какие из перечисленных элементов могут быть и окислителями, и восстановителями: KNO3, H2S, K2SO3. Ответ обоснуйте.
- Определите а)степени окисления атомов элемента б)составьте электронный баланс, укажите окислитель и восстановитель в) процессы окисления и восстановления г) расставьте коэффициенты д) определите тип окислительно-восстановительной реакции: K2SO3 + H2O => S+K2SO4+KOH е)дайте определение реакции данного типа
- Используя уравнение задания 3, определите, какую массу серы моно получить из 60 моль сульфита калия
- Определите, возможна ли реакция (при ст.
 у.), используя стандартные потенциалы полуреакций. Ответ обоснуйте. Au(NO3)3+3NO2+3H2O = >Au+6HNO3 . φ0(Au3+/Au)=1,50В, φ0(NO—3 +2H+/NO2+H2O)=0,78В.
у.), используя стандартные потенциалы полуреакций. Ответ обоснуйте. Au(NO3)3+3NO2+3H2O = >Au+6HNO3 . φ0(Au3+/Au)=1,50В, φ0(NO—3 +2H+/NO2+H2O)=0,78В. - От чего зависит электродный потенциал любого металла.
- Рассчитайте φ Me в некоторой среде по отношению к НВП, если его потенциал по отношению к каломельному электроду равен -0,516 В. Φкалом/НВЭ=+0,241В.
- Составьте схему гальванического элемента, составленного из хромовых электродов, опущенных в растворы соли хрома с активной концентрацией ионов хрома 10-4М и 10-1М. Укажите, какие процессы проходят на аноде и катоде, и рассчитайте ЭДС этого элемента.
- ЭДС гальванического элемента, состоящего из медного и серебрянного электродов, погруженных в 0,1М растворы их нитратов, увеличится, если 1) уменьшить концентрацию нитрата меди 2) увеличить концентрацию нитрата меди 3) увеличить концентрацию нитрата серебра 4) уменьшить концентрацию нитрата серебра .
 Укажите не менее двух вариантов ответа.
Укажите не менее двух вариантов ответа. - Продуктами, выделяющимися на инертных электродах при электролизе водного раствора хлорида натрия, являются 1.Na+Cl2 2. H2+Cl2 3. Na+H2 4. H2+O2 . Приведите уравнения процессов, происходящих на аноде и катоде. Объясните, почему протекают именно эти процессы.
- Для получения каких металлов применяют электролиз расплавов их оксидов или солей? Почему? 1. Cd 2. Ca 3. Co 4. Mg 5. Sn
- Дайте определение понятию химическая коррозия. При каких температурах возможно ее протекание? Приведите уравнение реакции, соответствующее коррозии стали во влажном воздухе.
- Сталь имеет цинковое покрытие. Это покрытие 1) анодное или 2) катодное? Ответ обоснуйте, используя значения стандартных электродных потенциалов металлов. Напишите уравнения процессов, проходящих на анодных и катодных участках при разрушении этого покрытия на воздухе.
- В чем заключается механизм действия пассивационных ингибиторов? Приведите пример такого ингибитора.

-
Показать/скрыть условия билета 8
- Рассчитайте энтальпию, энергию Гиббса химической реакции. Сделайте выводы. CH4(r)+2H2O(r) =>CO2(r) + 4H2(r)
- Рассчитайте ph раствора электролита HNO2 , c=0.02 моль/л
- Подберите анод для данного катода Cu. Напишите уравнения анодного и катодного процессов. Рассчитайте ЭДС.
Примеры контрольных работ:
Вы можете связаться с нами, уточнить стоимость и сроки, заказать услуги через наши контакты либо заполнив данную форму.
?Заказать решение контрольных работ по химии
Выучить наизусть таблицу Менделеева, разложить какой-то элемент на молекулы это же колоссальный труд! А зачем, какой смысл в этом, зачем так напрягаться? Чтобы была в дипломе хорошая оценка? И что дальше с того? Чаще всего дальше ничего, с годами все это быстро забывается и мы переключаемся на что-то иное. А что если уже сейчас заказать контрольную по химии? Сэкономить себе кучу времени. И вложить это время в нужное направление, развить навык, который уже сейчас будет работать на ваше будущее.
А что если уже сейчас заказать контрольную по химии? Сэкономить себе кучу времени. И вложить это время в нужное направление, развить навык, который уже сейчас будет работать на ваше будущее.
Химия – одна из сложнейших современных наук, включающая в себя много важных и сложных разделов. Она бывает общая, органическая, неорганическая, биологическая, пищевая, и так далее. Сложность предмета состоит в том, что его невозможно просто выучить, как, допустим историю или литературу — ее важно понимать. Она тесно переплетается с математикой, физикой и биологией, для ее изучения нужно очень много времени и сил.
Обучиться химии устно практически невозможно. Необходимо постоянно работать и письменно: составлять графические и молекулярные формулы, писать уравнения реакций, решать задачи и т. п. В процессе обучения вам придется запоминать очень много различной справочной информации, чтобы впоследствии без проблем выполнять решение задач и контрольных работ. А потому этот предмет нередко вызывает трудности у студентов.
Средняя оценка:
4,9
Выполненных работ:
более 2,5 млн.
Авторов онлайн:
более 4 тыс.
Студенчество, с одной стороны, веселая и приятная пора, а с другой – очень сложное время, когда нужно получать, перерабатывать и усваивать много полезной информации. При этом, изучая, к примеру, химию, студент должен уделять немало внимания и другим, сопутствующим дисциплинам. Это иностранный язык, философия, история, бухгалтерский учет и много других предметов, с которыми, согласно программе, должен быть ознакомлен учащийся. Лекции, семинары, практические работы, изучение литературы, написание рефератов, курсовых – все это очень загружает студентов так, что они едва успевают выполнить все, что от них требуется.
Где заказать контрольную по химии недорого?
Для тех учащихся, которые по тем или иным причинам не могут самостоятельно выполнить решение контрольных работ по химии, есть отличный вариант – заказ работы у специалистов. Студент экономит свое время, силы и нервы, посвящая их чему-то другому, а в результате получает идеально выполненную контрольную, гарантирующую отличную оценку. Специалисты подходят к решению грамотно, серьезно и профессионально, качественно выполняя контрольные задания в нужный срок. И за свою работу берут совсем недорого.
Студент экономит свое время, силы и нервы, посвящая их чему-то другому, а в результате получает идеально выполненную контрольную, гарантирующую отличную оценку. Специалисты подходят к решению грамотно, серьезно и профессионально, качественно выполняя контрольные задания в нужный срок. И за свою работу берут совсем недорого.
Доступность интернета дает массу преимуществ – учащемуся необходимо лишь оформить заказ, заполнив специальную онлайн-форму на сайте, указать, в какие сроки ему необходимо получить выполненные задания. После этого нужно будет дождаться, когда менеджер сообщит ему цену. При этом требуется внести предоплату в размере 25% от общей стоимости заказа. Примечательно, что система предусматривает для своих клиентов накопительные скидки. Таким образом, можно предложить подобную услугу своим однокурсникам и набрать несколько человек, желающих заказать решение своей контрольной работы по химии или любому другому предмету. Оформив несколько заявок, студенты получат возможность сэкономить свои средства.
Материалы по теме:
Поделиться с друзьями:
Загрузка…Решение контрольных работ по химии 👇 на заказ
Не получается решить контрольную работу по химии? Сроки горят, а задачам не видно конца и края? Химические реакции, валентности, катализаторы и эфиры взрывают мозг и разъедают настроение?
Мы Вам поможем! Выполнение контрольных работ по химии для наших авторов — не проблема! Наши специалисты, среди которых преподаватели, аспиранты, кандидаты наук — будут рады взять на себя Ваши заботы. За их плечами множество публикаций, собственные разработки и даже диссертации. Описание самых разных реакций, грамотный подбор компонентов, составление формул сложных веществ — всё это будет выполнено качественно и в кратчайшие сроки.
Мы понимаем, что у студента — каждая копейка на счету. Поэтому не содержим дорогостоящий офис и выполняем все работы удалённо.
Вы платите только за качественное выполнение контрольной работы!
С нами у Вас не только появится свободное время, но и останутся деньги, чтобы провести его действительно приятно!
Контрольная работа по химии на заказ — это разумный способ сэкономить силы для дел, действительно для Вас важных.
Вам осталось лишь заполнить форму заказа. Ваш запрос будет обработан в предельно сжатые сроки, и на контактную почту будет отправлена информация о цене и сроках выполнения заказа.
Для Вашего удобства, решение контрольной работы по химии предоставляется в электронном виде: в формат *.doc или *.pdf. Такой подход избавит Вас от необходимости разбираться в непонятном почерке специалиста. Контрольную работу останется только распечатать! По особому требованию Вы можете получить отсканированную версию решения — в случае острой необходимости это ускорит процесс выполнения Вашего заказа.
Сотрудничая с нами, Вы получите не только свободу от выполнения ненавистных домашних заданий, но и возможность быть «на хорошем счету» у преподавателей, вызывать уважение сокурсников.
Контрольная работа по химии на «отлично» — это просто!
Также наши специалисты готовы помочь Вам в решении контрольных работ по информатике и многим другим предметам.
Контрольные по химии
Гарантии:1. Webmoney BL~200 Webmoney BL~200 2. Опыт >10 лет 3. Множество положительных отзывов 4. Оплачивать можно частями 5. Исправления/доработки бесплатны |
Что можно заказать:1. Онлайн помощь на экзаменах2. Контрольные работы 3.Лабораторные работы 4. Курсовые работы 5. Диплом/Диссертацию |
Контрольные по химии. Оцените наше качество.
Почта: [email protected] ICQ: 591810759
Задачи и контрольных работы по химии на заказ теперь доступны каждому студенту. Если Вам срочно нужно выполнить контрольную работу или у Вас трудности с задачами и нет времени или знаний для того чтоб все сделать самостоятельно – Вы можете обратиться за помощью к нам. Наши решения контрольных по химии каждый часто вызывают похвалу у наших клиентов. Мы работаем для студентов каждый день без перерывов и выходных. У нас Вы можете кроме ответов на тесты получить подробные разборы самых трудных задач. Часто ИДЗ по органике, общей химии, физколлоидной химии бывают очень сложными и не каждый ученик может их грамотно выполнить.
У нас Вы можете кроме ответов на тесты получить подробные разборы самых трудных задач. Часто ИДЗ по органике, общей химии, физколлоидной химии бывают очень сложными и не каждый ученик может их грамотно выполнить.
Если по какой-то причине Вам не пришло ответное письмо от нас на почту – обращайтесь к нам в ICQ, наши консультанты сразу же оценят стоимость Вашей контрольной работы, предложат способы оплаты и сроки выполнения.
Бывает, что Вы сталкиваетесь с вопросом делать или не делать самостоятельно, но можно на это посмотреть с другой стороны. Нередко замечено, что преподаватели ставят автоматом оценки на экзамене тем, у кого по контрольным работам нет троек. Это значит, что если Вы закажете выполнение контрольных по химии у нас – у Вас будут высокие баллы, и Вас будет ждать оценка автоматом в конце семестра, что очень и очень важно для каждого студента!
Кроме того, вы можете получить помощь прямо на контрольных онлайн – это быстрое выполнение Ваших задач непосредственно во время пары или экзамене. Эта услуга очень популярна и очень эффективна. Для жителей Москвы и московской области существуют отдельные условия для заказа решения химии в Москве.
Эта услуга очень популярна и очень эффективна. Для жителей Москвы и московской области существуют отдельные условия для заказа решения химии в Москве.
Основная направленность нашей деятельности – качественная и пунктуальная целенаправленная работа для абитуриентов и студентов по перегрызанию грантиных столбов науки. Но мы не зациклены только на заработке, у нас Вы получить спектр объяснений по гидравлике или теплотехнике. Если Вам нужно заказать решение математики – Вы тоже можете обратиться к нам.
Тем студентам, которые ищут репетитора по для решение контрольных – это нерационально и может быть очень накладно. Репетиторы очень ценят свой труд, это ведь работа с людьми и у них решение может стоить на порядок дороже чем у нас. Оформление решения у репетиторов может хромать, т.к. мы занимаемся профессионально и у наших исполнителей уже набита рука на Ваших задачах. Если Вы готовитесь к олимпиаде или очень сложным КР – то Вы тоже можете получить очень существенное облегчение, попросив решить сложные задачи у нас и посмотрев как нужно правильно их выполнять, а потом просто примените полученные знания на Ваших олимпиадах и других мероприятиях. Саму подготовку к олимпиадам и КР мы не проводим, т.к. не ведем репетиционной деятельности (просто нет такой возможности у нас). Если Вам не нужно решать химию — вы можете заказать решение ТОЭ. Очень часто студентам задачют РГР по ТОЭ.
Саму подготовку к олимпиадам и КР мы не проводим, т.к. не ведем репетиционной деятельности (просто нет такой возможности у нас). Если Вам не нужно решать химию — вы можете заказать решение ТОЭ. Очень часто студентам задачют РГР по ТОЭ.
Нередко задают нам вопрос о гарантийном и постгарантийном обслуживании наших работ. Ответ прост: на ЛЮБОЕ решение мы даем гарантию, это значит, что при заказе у нас контрольной Вы получаете полную гарантию. Гарантией является качество исполнения, т.е. если Вы сдали свою контрольную на проверку и там обнаружились неточности или ошибки – пишите нам и мы в кратчайшие сроки эти ошибки устраняем. Как правильно сделать запрос на онлайн помощь? Полный ответ на этот вопрос постараемся дать ниже. Чтобы Ваши задачи быстро оценили, не переоценили сложность и быстро их оформили к сдаче — Вам нужно придерживаться следующих принципов:
1. Присылать задачки в читаемом виде, это может быть как рукопись, так и электронный документ, можете нарисовать Ваши задания даже в Paint, лиж бы они были читаемыми.
2. Указать вид оформления, это может быть рукопись или вариант машинописной работы, могут быть особые требования или условия, все это влияет на сроки и стоимость.
3. Подробность решения контрольных. Если про подробность Вы ничего не указываете в Вашей работе – по умолчанию она будет выполнена в стандартном виде.
4. Очень важным моментом составлени запроса на помощь — является прикрепление методических материалов. Это может помочь как в скорости исполнения, так и оформлении, а иногда даже в его подробности. А еще Вы можете Заказать решение электротехники или Физику РГР и курсовые.
5. Нам может помочь даже список рекомендуемой литературы, иногда встречаются контрольные работы, решение которых просто невозможно выполнить без рекомендуемого списка литературы, т.к. там очень специфические задания.
6. Последним важным пунктом является грамотное указание сроков выполнения. Экспресс выполнение работ и задач более сложное мероприятие, ведь при таком виде выполнения смазывается время суток. А это значит, что мы работаем даже ночью и в праздничные дни, следовательно, эта работа удорожается. Не срочная помощь – это помощь, обычно, в пределах 2-5 дней. Несрочными являются все заказы, если об этом Вы не сообщили отдельно.
Экспресс выполнение работ и задач более сложное мероприятие, ведь при таком виде выполнения смазывается время суток. А это значит, что мы работаем даже ночью и в праздничные дни, следовательно, эта работа удорожается. Не срочная помощь – это помощь, обычно, в пределах 2-5 дней. Несрочными являются все заказы, если об этом Вы не сообщили отдельно.
Иногда возникают потребности у студентов медицинских ВУЗов такие как написать уравнение реакции, провети анали полученного вещества. И эти трудности могут быть и по химии и биологии. В этом случае мы готовы прийти Вам на помощь. Мы выполняем как контрольные по био-, так и по фармацевтической химии.
Решение контрольных работ по химии на заказ в санкт-Петербурге (Спб).
Принимаем к оплатеВыполним на заказ
Решение контрольных работ по химии на заказ
Если вам требуется быстрое и качественное решение контрольных по химии или нужно выполнить задания, пройти тесты, но времени и возможности нет или же просто не можете разобраться со сложной темой самостоятельно наши сотрудники рады вам помочь. В нашем коллективе большой и разнообразный штат сотрудников, которые справляются с самыми сложными заданиями технических и гуманитарных вузов. У нас есть учителя и преподаватели химии, которые оказывают качественную и оперативную помощь в любом возникшем вопросе.
В нашем коллективе большой и разнообразный штат сотрудников, которые справляются с самыми сложными заданиями технических и гуманитарных вузов. У нас есть учителя и преподаватели химии, которые оказывают качественную и оперативную помощь в любом возникшем вопросе.
Решение контрольных работ по химии на заказ – сегодня реальная услуга для нашей компании. Мы несем ответственность за выполнение и отменное оформление в компьютерном редакторе текстов. Наши специалисты постараются найти подход к каждому клиенту.
Студент или школьник имеет возможность заказать контрольную работу по химии с полным решением заданий, или же частичную помощь в сложных вопросах. Вот наши гарантии, которые мы обещаем предоставить:
 Наши сотрудники обсудят с вами все интересующие вас вопросы;
Наши сотрудники обсудят с вами все интересующие вас вопросы;В итоге у Нас:
- Низкая стоимость услуг.
- Короткие сроки выполнения.
- Антиплагиат — 100% Уникальность.
- Проверка Ваших работ.
Закажите звонок
Заказать контрольную работу по химии, доступные цены
Как решить задания контрольной работы по предмету Химия
При выполнении контрольных работ по химическим связям, реакциям и на другие подобные темы, внимательно записывайте формулы, не допуская фактических ошибок и опечаток. Соблюдайте требования, указанные в методических пособиях, касательно оформления, чтобы учитель увидел не только ваши знания, но и старательность. При написании, желательно использовать конспект, который вы вели на лекциях, и литературу, рекомендованную преподавателем.
Соблюдайте требования, указанные в методических пособиях, касательно оформления, чтобы учитель увидел не только ваши знания, но и старательность. При написании, желательно использовать конспект, который вы вели на лекциях, и литературу, рекомендованную преподавателем.
Помощь в контрольных работах по химии для студентов вуза
Чтобы самостоятельно сделать контрольную работу по химии по темам, которые охватывают вопросы строения вещества, химических систем, закономерностей протекания химических процессов, студенту предстоит:
- внимательно изучать содержание учебников и методических пособий;
- регулярно посещать лекции по дисциплине;
- записывать все важные тезисы, высказанные преподавателем;
- использовать правила русского языка, не допуская грамматических ошибок.
Если вам не достаточно времени на подготовку или есть какие-либо другие сложности, обращайтесь к специалистам компании «Заочник». Мы будем рады предоставить свою помощь, и вы получите за контрольную долгожданный зачёт.
Мы будем рады предоставить свою помощь, и вы получите за контрольную долгожданный зачёт.
Как купить контрольную работу по курсу «Общая и неорганическая химия»
Мы работаем строго по индивидуальным заказам наших клиентов. Каждая контрольная работа от «Заочника» является:
- уникальной;
- содержательной;
- структурированной;
- грамотной.
Заказать контрольную работу по дисциплине «Химия» базового или профильного уровня вы можете, не выходя из дома. Мы предоставляем услуги в режиме онлайн и принимаем заявки круглосуточно.
Сколько стоит решить контрольную по химии
Мы выбираем исполнителей, в зависимости от уровня сложности задач и вопросов. С некоторыми работами могут справиться студенты старших курсов профильных вузов. Но при повышенной сложности приходится привлекать преподавателей и представителей научного сообщества, которые требуют высоких гонораров.
Второй важный фактор – срок. Если написать контрольную нужно срочно, это будет стоить дороже. Имеет значение и объем работы, которую предстоит выполнить. В каждом случае мы стараемся минимизировать цены, чтобы студентам наши услуги обходились недорого. Для уточнения информации и оформления заказа в любое время обращайтесь к нашим менеджерам.
Если написать контрольную нужно срочно, это будет стоить дороже. Имеет значение и объем работы, которую предстоит выполнить. В каждом случае мы стараемся минимизировать цены, чтобы студентам наши услуги обходились недорого. Для уточнения информации и оформления заказа в любое время обращайтесь к нашим менеджерам.
Меры контроля при оценке опасности
Инженерный контроль
Хотя устранение и замена являются отдельными средствами контроля в иерархии мер контроля, они также считаются инженерными средствами контроля, поскольку предназначены для удаления опасного источника до того, как работник вступит в контакт. Другие формы инженерного контроля включают:
- Изоляция
Уменьшите или устраните опасности путем разделения во времени или пространстве.(Может быть особенно полезно в общем лабораторном пространстве, где используются разные типы химикатов.) - Корпус
Поместите материал или процесс в закрытую систему.
- Транспорт
Перемещайте опасные материалы в места, где меньше рабочих. - Защита и защита
Установите ограждения для защиты от движущихся частей или электрических соединений.
Экранирование обеспечивает защиту от возможных взрывов - Вентиляция
Используйте вытяжные шкафы, вентиляторы, воздуховоды и воздушные фильтры.
Административный контроль
В то время как технический контроль направлен на устранение опасностей, административный контроль направлен на минимизацию воздействия на лабораторного работника. Административный контроль — это существующие правила безопасности и протоколы, которым должны следовать сотрудники лаборатории. Ниже приведены примеры административного контроля:
Средства индивидуальной защиты (СИЗ)
Даже несмотря на то, что иерархия мер контроля указывает на то, что СИЗ являются наименее эффективными из мер контроля, их следует обязательно использовать в случае неудачи других мер контроля. Успех СИЗ частично зависит от того, действительно ли сотрудники лаборатории используют их.
Успех СИЗ частично зависит от того, действительно ли сотрудники лаборатории используют их.
Очки для глаз, средства защиты органов слуха и защитная одежда (например, лабораторные халаты и перчатки) являются наиболее узнаваемыми и наиболее часто используемыми СИЗ в лаборатории.
СИЗ всегда необходимы и особенно важны в следующих обстоятельствах:
- Когда технический контроль невозможен или не устраняет опасность полностью;
- В качестве временного контроля при разработке технических средств контроля;
- В экстренных ситуациях.
4.5: Концентрация растворов — Химия LibreTexts
Многие люди имеют качественное представление о том, что подразумевается под концентрацией . Любой, кто варил растворимый кофе или лимонад, знает, что слишком много порошка дает сильно ароматный и высококонцентрированный напиток, а слишком маленькое — разбавленный раствор, который трудно отличить от воды. В химии концентрация раствора — это количество растворенного вещества , которое содержится в определенном количестве растворителя или раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для реакций в растворе. Химики используют множество различных методов для определения концентраций, некоторые из которых описаны в этом разделе.
Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для реакций в растворе. Химики используют множество различных методов для определения концентраций, некоторые из которых описаны в этом разделе.
Молярность
Наиболее распространенной единицей концентрации является молярность , что также является наиболее полезным для расчетов, включающих стехиометрию реакций в растворе. Молярность (M) определяется как количество молей растворенного вещества, присутствующего ровно в 1 л раствора.Это эквивалентно количеству миллимолей растворенного вещества, присутствующего точно в 1 мл раствора:
\ [молярность = \ dfrac {моль \: of \: solute} {литры \: of \: solution} = \ dfrac {ммоль \: of \: solute} {миллилитры \: of \: solution} \ label {4.5 .1} \]
Таким образом, единицами молярности являются моль на литр раствора (моль / л), сокращенно \ (М \). Водный раствор, содержащий 1 моль (342 г) сахарозы в достаточном количестве воды, чтобы получить конечный объем 1,00 л, имеет концентрацию сахарозы 1.00 моль / л или 1,00 М. В химической записи квадратные скобки вокруг названия или формулы растворенного вещества представляют молярную концентрацию растворенного вещества. Следовательно,
\ [[\ rm {сахароза}] = 1,00 \: M \]
читается как «концентрация сахарозы 1,00 молярная». Отношения между объемом, молярностью и молями могут быть выражены как
\ [V_L M_ {mol / L} = \ cancel {L} \ left (\ dfrac {mol} {\ cancel {L}} \ right) = моль \ label {4.5.2} \]
или
\ [V_ {mL} M_ {ммоль / мл} = \ cancel {mL} \ left (\ dfrac {mmol} {\ cancel {mL}} \ right) = ммоль \ label {4.5.3} \]
На рисунке \ (\ PageIndex {1} \) показано использование формул \ (\ ref {4.5.2} \) и \ (\ ref {4.5.3} \).
Рисунок \ (\ PageIndex {1} \): Приготовление раствора известной концентрации с использованием твердого раствораПример \ (\ PageIndex {1} \): расчет молей по концентрации NaOH
Рассчитайте количество молей гидроксида натрия (NaOH) в 2,50 л 0,100 M NaOH.
Дано: идентичность растворенного вещества, а также объем и молярность раствора
Запрошено: количество растворенного вещества в молях
Стратегия:
Используйте уравнение \ ref {4.5.2} или Equation \ ref {4.5.3}, в зависимости от единиц, указанных в задаче.
Решение:
Поскольку нам задают объем раствора в литрах и спрашивают количество молей вещества, уравнение \ ref {4.5.2} более полезно:
\ (моль \: NaOH = V_L M_ {моль / л} = (2,50 \: \ cancel {L}) \ left (\ dfrac {0.100 \: mol} {\ cancel {L}} \ right) = 0,250 \: моль \: NaOH \)
Упражнение \ (\ PageIndex {1} \): вычисление молей по концентрации аланина
Вычислите количество миллимолей аланина, биологически важной молекулы, в 27.2 мл 1,53 М аланина.
- Ответ
41,6 ммоль
Концентрации также часто указываются в зависимости от массы к массе (м / м) или по отношению к массе к объему (м / об), особенно в клинических лабораториях и инженерных приложениях. Концентрация, выраженная на основе м / м, равна количеству граммов растворенного вещества на грамм раствора; Концентрация на основе м / об — это количество граммов растворенного вещества на миллилитр раствора.Каждое измерение можно выразить в процентах, умножив соотношение на 100; результат выражается в процентах по массе или в процентах по массе. Концентрации очень разбавленных растворов часто выражаются в частей на миллион ( частей на миллион ), что составляет граммы растворенного вещества на 10 6 г раствора, или в частей на миллиард ( частей на миллиард ), что составляет граммов растворенного вещества на 10 9 г раствора. Для водных растворов при 20 ° C 1 ppm соответствует 1 мкг на миллилитр, а 1 ppb соответствует 1 нг на миллилитр.Эти концентрации и их единицы приведены в Таблице \ (\ PageIndex {1} \).
| Концентрация | Шт. |
|---|---|
| м / м | г растворенного вещества / г раствора |
| м / об | г растворенного вещества / мл раствора |
| частей на миллион | г растворенного вещества / 10 6 г раствора |
| мкг / мл | |
| частей на миллиард | г растворенного вещества / 10 9 г раствора |
| нг / мл |
Приготовление растворов
Чтобы приготовить раствор, содержащий определенную концентрацию вещества, необходимо растворить желаемое количество молей растворенного вещества в достаточном количестве растворителя, чтобы получить желаемый конечный объем раствора.Рисунок \ (\ PageIndex {1} \) иллюстрирует эту процедуру для раствора дигидрата хлорида кобальта (II) в этаноле. Обратите внимание, что объем растворителя не указан. Поскольку растворенное вещество занимает пространство в растворе, необходимый объем растворителя почти всегда на меньше , чем желаемый объем раствора. Например, если желаемый объем составлял 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, потому что это привело бы к получению более 1,00 л раствора.Как показано на рисунке \ (\ PageIndex {2} \), для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
Рисунок \ (\ PageIndex {2} \): Приготовление 250 мл раствора (NH 4 ) 2 Cr 2 O 7 в воде. Растворенное вещество занимает пространство в растворе, поэтому для приготовления 250 мл раствора требуется менее 250 мл воды.Пример \ (\ PageIndex {2} \)
Раствор содержит 10,0 г дигидрата хлорида кобальта (II), CoCl 2 • 2H 2 O, в этаноле, достаточном для приготовления ровно 500 мл раствора.Какова молярная концентрация \ (\ ce {CoCl2 • 2h3O} \)?
Дано: Масса растворенного вещества и объем раствора
Запрошено: концентрация (M)
Стратегия:
Чтобы найти количество молей \ (\ ce {CoCl2 • 2h3O} \), разделите массу соединения на его молярную массу. Рассчитайте молярность раствора, разделив количество молей растворенного вещества на объем раствора в литрах.
Решение:
Молярная масса CoCl 2 • 2H 2 O составляет 165.87 г / моль. Следовательно,
\ [молей \: CoCl_2 \ cdot 2H_2O = \ left (\ dfrac {10.0 \: \ cancel {g}} {165 .87 \: \ cancel {g} / mol} \ right) = 0 .0603 \: mol \ nonumber \]
Объем раствора в литрах
\ [volume = 500 \: \ cancel {mL} \ left (\ dfrac {1 \: L} {1000 \: \ cancel {mL}} \ right) = 0 .500 \: L \ nonumber \]
Молярность — это количество молей растворенного вещества на литр раствора, поэтому молярность раствора равна
.\ [молярность = \ dfrac {0,0603 \: моль} {0.500 \: L} = 0,121 \: M = CoCl_2 \ cdot H_2O \ nonumber \]
Упражнение \ (\ PageIndex {2} \)
Раствор, показанный на рисунке \ (\ PageIndex {2} \), содержит 90,0 г (NH 4 ) 2 Cr 2 O 7 в достаточном количестве воды, чтобы получить конечный объем ровно 250 мл. Какова молярная концентрация дихромата аммония?
- Ответ
\ [(NH_4) _2Cr_2O_7 = 1,43 \: M \ nonumber \]
Чтобы приготовить конкретный объем раствора, который содержит указанную концентрацию растворенного вещества, нам сначала нужно вычислить количество молей растворенного вещества в желаемом объеме раствора, используя соотношение, показанное в уравнении \ (\ ref {4.5.2} \). Затем мы переводим количество молей растворенного вещества в соответствующую массу необходимого растворенного вещества. Эта процедура проиллюстрирована в примере \ (\ PageIndex {3} \).
Пример \ (\ PageIndex {3} \): D5W Решение
Так называемый раствор D5W, используемый для внутривенного замещения биологических жидкостей, содержит 0,310 М глюкозы. (D5W представляет собой примерно 5% раствор декстрозы [медицинское название глюкозы] в воде.) Рассчитайте массу глюкозы, необходимую для приготовления пакета D5W объемом 500 мл. Глюкоза имеет молярную массу 180.16 г / моль.
Дано: молярность, объем и молярная масса растворенного вещества
Запрошено: Масса растворенного вещества
Стратегия:
- Рассчитайте количество молей глюкозы в указанном объеме раствора, умножив объем раствора на его молярность.
- Получите необходимую массу глюкозы, умножив количество молей соединения на его молярную массу.
Решение:
A Сначала мы должны вычислить количество молей глюкозы, содержащихся в 500 мл 0.310 M раствор:
\ (V_L M_ {моль / л} = моль \)
\ (500 \: \ cancel {mL} \ left (\ dfrac {1 \: \ cancel {L}} {1000 \: \ cancel {mL}} \ right) \ left (\ dfrac {0 .310 \: моль \: глюкоза} {1 \: \ cancel {L}} \ right) = 0,155 \: моль \: глюкоза \)
B Затем мы переводим количество молей глюкозы в требуемую массу глюкозы:
\ (масса \: of \: глюкоза = 0,155 \: \ cancel {моль \: глюкоза} \ left (\ dfrac {180.16 \: g \: глюкоза} {1 \: \ cancel {моль \: глюкоза}} \ справа) = 27.9 \: г \: глюкоза \)
Упражнение \ (\ PageIndex {3} \)
Другой раствор, обычно используемый для внутривенных инъекций, — это физиологический раствор, 0,16 М раствор хлорида натрия в воде. Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
- Ответ
2,3 г NaCl
Раствор желаемой концентрации также можно приготовить путем разбавления небольшого объема более концентрированного раствора дополнительным растворителем.Базовый раствор — это коммерчески приготовленный раствор известной концентрации, который часто используется для этой цели. Разбавление основного раствора является предпочтительным, поскольку альтернативный метод взвешивания крошечных количеств растворенного вещества трудно осуществить с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из исходного раствора показана на рисунке \ (\ PageIndex {3} \).Это требует расчета желаемого количества молей растворенного вещества в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, который содержит это количество растворенного вещества. Помните, что разбавление данного количества исходного раствора растворителем не приводит к изменению числа , а не количества молей присутствующего растворенного вещества. Таким образом, соотношение между объемом и концентрацией основного раствора и объемом и концентрацией желаемого разбавленного раствора составляет
.\ [(V_s) (M_s) = моли \: of \: solute = (V_d) (M_d) \ label {4.5.4} \]
, где нижние индексы s и d обозначают исходный и разбавленный растворы, соответственно. Пример \ (\ PageIndex {4} \) демонстрирует вычисления, связанные с разбавлением концентрированного исходного раствора.
Рисунок \ (\ PageIndex {3} \): Приготовление раствора известной концентрации путем разбавления исходного раствора. (a) Объем ( V s ), содержащий желаемые моли растворенного вещества (M s ), измеряют для исходного раствора известной концентрации.(b) Отмеренный объем исходного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляется растворителем до объемной метки [( V s ) (M s ) = ( V d ) (M d ). ].Пример \ (\ PageIndex {4} \)
Какой объем 3,00 М исходного раствора глюкозы необходим для приготовления 2500 мл раствора D5W в Примере \ (\ PageIndex {3} \)?
Дано: Объем и молярность разбавленного раствора
Запрошено: объем основного раствора
Стратегия:
- Рассчитайте количество молей глюкозы в указанном объеме разбавленного раствора, умножив объем раствора на его молярность.
- Чтобы определить необходимый объем маточного раствора, разделите количество молей глюкозы на молярность исходного раствора.
Решение:
A Раствор D5W в Примере 4.5.3 содержал 0,310 М глюкозы. Начнем с использования уравнения 4.5.4 для расчета количества молей глюкозы, содержащихся в 2500 мл раствора:
\ [моль \: глюкоза = 2500 \: \ cancel {mL} \ left (\ dfrac {1 \: \ cancel {L}} {1000 \: \ cancel {mL}} \ right) \ left (\ dfrac { 0.310 \: моль \: глюкоза} {1 \: \ cancel {L}} \ right) = 0,775 \: моль \: глюкоза \]
B Теперь мы должны определить объем исходного раствора 3,00 M, который содержит это количество глюкозы:
\ [объем \: of \: stock \: soln = 0,775 \: \ cancel {mol \: gluosis} \ left (\ dfrac {1 \: L} {3 .00 \: \ cancel {mol \: глюкоза}} \ right) = 0,258 \: L \: или \: 258 \: mL \]
При определении необходимого объема исходного раствора мы должны были разделить желаемое количество молей глюкозы на концентрацию исходного раствора, чтобы получить соответствующие единицы.Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление основного раствора примерно в 10 раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это происходит (3,00 M → 0,310 M).
Мы также могли бы решить эту проблему за один шаг, решив уравнение 4.5.4 для В с и подставив соответствующие значения:
\ [V_s = \ dfrac {(V_d) (M_d)} {M_s} = \ dfrac {(2 .500 \: L) (0,310 \: \ cancel {M})} {3 .00 \: \ отменить {M}} = 0 .258 \: L \]
Как мы уже отмечали, часто существует несколько правильных способов решения проблемы.
Упражнение \ (\ PageIndex {4} \)
Какой объем 5,0 М маточного раствора NaCl необходим для приготовления 500 мл физиологического раствора (0,16 М NaCl)?
- Ответ
16 мл
Концентрации ионов в растворе
В примере \ (\ PageIndex {2} \) — концентрация раствора, содержащего 90.Было рассчитано, что 00 г дихромата аммония в конечном объеме 250 мл составляет 1,43 М. Давайте более подробно рассмотрим, что это означает. Дихромат аммония — это ионное соединение, которое содержит два иона NH 4 + и один ион Cr 2 O 7 2- на формульную единицу. {2-} (водн.) \ Label {4.5.5} \]
Таким образом, 1 моль единиц формулы дихромата аммония растворяется в воде с образованием 1 моль анионов Cr 2 O 7 2- и 2 моль катионов NH 4 + (см. Рисунок \ (\ PageIndex { 4} \)).
Рисунок \ (\ PageIndex {4} \): Растворение 1 моля ионного соединения. В этом случае растворение 1 моля (NH 4 ) 2 Cr 2 O 7 дает раствор, содержащий 1 моль Cr 2 O 7 2- иона и 2 моль NH 4 + иона.(Молекулы воды для ясности не показаны с точки зрения молекул.)При проведении химической реакции с использованием раствора соли, такого как дихромат аммония, важно знать концентрацию каждого иона, присутствующего в растворе. Если раствор содержит 1,43 M (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2- также должна быть 1,43 M, потому что существует один Cr 2 O 7 2- ионов на формульную единицу.Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 M = 2,86 М. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 образует трех ионов при растворении в воде (2NH 4 + + 1Cr 2 O 7 2-), общая концентрация ионов в решение 3 × 1,43 M = 4,29 M.
Пример \ (\ PageIndex {5} \)
Каковы концентрации всех веществ, полученных из растворенных веществ, в этих водных растворах?
- 0.21 М NaOH
- 3,7 M (CH 3 ) 2 CHOH
- 0,032 M дюйм (NO 3 ) 3
Дано: молярность
Запрошено: концентраций
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или как неэлектролит.
B Если соединение неэлектролит, его концентрация такая же, как молярность раствора.- (водн.) \)
B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH — , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0,21 M и [ OH — ] = 0,21 M.
B Таким образом, единственными растворенными веществами в растворе являются (CH 3 ) 2 молекулы CHOH, поэтому [(CH 3 ) 2 CHOH] = 3,7 M.
\ (In (NO _3) _3 (s) \ xrightarrow {H_ 2 O (l)} In ^ {3+} (aq) + 3NO _3 ^ — (aq) \)
B Одна формульная единица In (NO 3 ) 3 производит один ион In 3 + и три NO 3 — иона, поэтому 0.032 M In (NO 3 ) 3 раствор содержит 0,032 M In 3 + и 3 × 0,032 M = 0,096 M NO 3 — , то есть [In 3 + ] = 0,032 M и [NO 3 — ] = 0,096 M.
Упражнение \ (\ PageIndex {5} \)
Каковы концентрации всех веществ, полученных из растворенных веществ, в этих водных растворах?
- 0,0012 M Ba (OH) 2
- 0.{2-}] = 0,17 \: M \)
- Ответ c
\ ([(CH_3) _2CO] = 0,50 \: M \)
Использование химических веществ для борьбы с микроорганизмами
Цели обучения
- Понимать и сравнивать различные химические вещества, используемые для контроля роста микробов, включая их применение, преимущества и недостатки, химическую структуру и способ действия
В дополнение к физическим методам борьбы с микробами, химические вещества также используются для контроля роста микробов.В качестве дезинфицирующих или антисептических средств можно использовать самые разные химические вещества. При выборе того, что использовать, важно учитывать тип целевого микроба; насколько чистым должен быть предмет; влияние дезинфицирующего средства на целостность изделия; его безопасность для животных, людей и окружающей среды; его расход; и простота использования. В этом разделе описывается множество химических веществ, используемых в качестве дезинфицирующих и антисептических средств, в том числе их механизмы действия и общие способы использования.
Фенолы
В 1800-х годах ученые начали экспериментировать с различными химическими веществами для дезинфекции.В 1860-х годах британский хирург Джозеф Листер (1827–1912) начал использовать карболовую кислоту, известную как фенол , в качестве дезинфицирующего средства для лечения хирургических ран (см. «Основы современной клеточной теории»). В 1879 году работа Листера вдохновила американского химика Джозефа Лоуренса (1836–1909) на разработку листерина, смеси нескольких родственных соединений на спиртовой основе, которая до сих пор используется в качестве перорального антисептика. Сегодня карболовая кислота больше не используется в качестве хирургического дезинфицирующего средства, поскольку она раздражает кожу, но химические соединения, содержащиеся в антисептических жидкостях для полоскания рта и пастилках для горла, называются фенольными соединениями .
Химически фенол состоит из бензольного кольца с группой –ОН, а фенольные соединения — это соединения, которые имеют эту группу как часть своей химической структуры. Фенолы, такие как тимол и эвкалиптол , встречаются в растениях в естественных условиях. Другие фенольные соединения могут быть получены из креозота, компонента каменноугольной смолы. Фенольные смолы, как правило, стабильны, устойчивы на поверхности и менее токсичны, чем фенол. Они подавляют рост микробов, денатурируя белки и разрушая мембраны.
Рисунок 1.Фенол и фенольные соединения использовались для контроля роста микробов. (а) Химическая структура фенола, также известного как карболовая кислота. (b) о-фенилфенол, тип фенола, использовался в качестве дезинфицирующего средства, а также для контроля роста бактерий и грибков на собранных цитрусовых. (c) Гексахлорофен, другой фенол, известный как бисфенол (два кольца), является активным ингредиентом pHisoHex.
Со времен Листера несколько фенольных соединений использовались для контроля роста микробов.Фенольные соединения, такие как крезолы (метилированные фенолы) и о-фенилфенол , были активными ингредиентами в различных составах лизола с момента его изобретения в 1889 году. О-фенилфенол также широко использовался в сельском хозяйстве для контроля роста бактерий и грибков на собранных культурах, особенно цитрусовых. фрукты, но его использование в Соединенных Штатах сейчас гораздо более ограничено. Дезинфицирующее средство бисфенол гексахлорофен является активным ингредиентом pHisoHex, моющего средства для местного применения, широко используемого для мытья рук в больницах.pHisoHex особенно эффективен против грамположительных бактерий, в том числе вызывающих стафилококковые и стрептококковые инфекции кожи. pHisoHex раньше использовался для купания младенцев, но эта практика была прекращена, поскольку было показано, что воздействие гексахлорофена может привести к неврологическим проблемам.
Триклозан — еще одно соединение бисфенола, которое за последние несколько десятилетий широко использовалось в антибактериальных продуктах. Первоначально используемый в зубных пастах, триклозан теперь широко используется в мыле для рук и часто пропитывается широким спектром других продуктов, включая разделочные доски, ножи, занавески для душа, одежду и бетон, чтобы сделать их противомикробными.Он особенно эффективен против грамположительных бактерий на коже, а также некоторых грамотрицательных бактерий и дрожжей.
Триклозан: антибактериальный избыток?
Мыло для рук и другие чистящие средства часто продаются как «антибактериальные», предполагая, что они обеспечивают более высокий уровень чистоты, чем обычное мыло и моющие средства. Но действительно ли антибактериальные ингредиенты в этих продуктах безопасны и эффективны?
Около 75% жидкого антибактериального мыла для рук и 30% мыла для мыла содержат химический триклозан, фенол.Триклозан блокирует фермент в пути биосинтеза жирных кислот бактерий, который не встречается в сопоставимых путях у человека. Хотя использование триклозана в домашних условиях резко возросло в течение 1990-х годов, более чем 40-летние исследования, проведенные FDA, не дали убедительных доказательств того, что мытье с помощью продуктов, содержащих триклозан, обеспечивает большую пользу для здоровья по сравнению с мытьем с традиционным мылом. Хотя некоторые исследования показывают, что после мытья с мылом на основе триклозана на руках может оставаться меньше бактерий, по сравнению с традиционным мылом, нет доказательств, указывающих на снижение передачи бактерий, вызывающих респираторные и желудочно-кишечные заболевания.Короче говоря, мыло с триклозаном может удалить или убить еще несколько микробов, но этого недостаточно для уменьшения распространения болезни.
Возможно, более тревожным является то, что выявлены некоторые явные риски, связанные с мылом на основе триклозана. Широкое использование триклозана привело к увеличению числа устойчивых к триклозану штаммов бактерий, в том числе имеющих клиническое значение, таких как Salmonella enterica ; эта устойчивость может сделать триклозан бесполезным в качестве антибактериального средства в долгосрочной перспективе. Бактерии могут легко приобрести устойчивость к триклозану за счет изменения одного гена, кодирующего целевой фермент в пути синтеза жирных кислот бактериями.Другие дезинфицирующие средства с менее специфическим механизмом действия гораздо менее склонны к возникновению резистентности, потому что для этого потребуется гораздо больше, чем одно генетическое изменение.
Использование триклозана в течение последних нескольких десятилетий также привело к накоплению этого химического вещества в окружающей среде. Триклозан в мыле для рук напрямую попадает в канализационные и канализационные системы в результате мытья рук. Там его антибактериальные свойства могут подавлять или уничтожать бактерии, ответственные за разложение сточных вод, вызывая засорение и резервное копирование септических систем.В конце концов, триклозан из сточных вод попадает в поверхностные воды, ручьи, озера, отложения и почвы, разрушая естественные популяции бактерий, которые выполняют важные экологические функции, такие как подавление роста водорослей. Триклозан также проникает в тела земноводных и рыб, где он может действовать как эндокринный разрушитель. Обнаруживаемые уровни триклозана также были обнаружены в различных жидкостях организма человека, включая грудное молоко, плазму и мочу. Фактически, исследование, проведенное CDC, обнаружило определяемые уровни триклозана в моче у 75% из 2 517 человек, прошедших тестирование в 2003–2004 годах.Это открытие вызывает еще большее беспокойство, учитывая доказательства того, что триклозан может влиять на иммунную функцию человека.
В декабре 2013 года FDA дало производителям мыла срок до 2016 года, чтобы доказать, что антибактериальное мыло имеет значительные преимущества по сравнению с традиционным мылом; если это не удастся, производители будут вынуждены удалить эти продукты с рынка.
Рис. 2. Триклозан является обычным ингредиентом антибактериального мыла, несмотря на доказательства того, что он представляет опасность для окружающей среды и здоровья и не приносит значительной пользы для здоровья по сравнению с обычным мылом.(кредит b, c: модификация работы FDA)
Подумай об этом
- Почему триклозан больше похож на антибиотик, чем на традиционное дезинфицирующее средство?
Тяжелые металлы
Одним из первых химических дезинфицирующих средств и антисептиков, которые были использованы, были тяжелых металлов . Тяжелые металлы убивают микробы, связываясь с белками, тем самым подавляя ферментативную активность. Тяжелые металлы олигодинамичны, что означает, что очень небольшие концентрации проявляют значительную антимикробную активность.Ионы тяжелых металлов прочно связываются с серосодержащими аминокислотами и биоаккумулируются в клетках, позволяя этим металлам достигать высоких локальных концентраций. Это приводит к денатурированию белков.
Тяжелые металлы не являются избирательно токсичными для микробных клеток. Они также могут биоаккумулироваться в клетках человека или животных, а чрезмерные концентрации могут оказывать токсическое воздействие на людей. Если, например, в организме накапливается слишком много серебра, это может привести к состоянию, называемому argyria , при котором кожа становится необратимо серо-голубой.Один из способов снизить потенциальную токсичность тяжелых металлов — это тщательно контролировать продолжительность воздействия и концентрацию тяжелых металлов.
Рис. 3. Тяжелые металлы денатурируют белки, нарушая функцию клеток и, таким образом, придавая им сильные антимикробные свойства. (а) Медь в светильниках, подобных этой дверной ручке, убивает микробы, которые в противном случае могли бы скапливаться на часто затрагиваемых поверхностях. (б) Столовая посуда содержит небольшое количество серебра для подавления роста микробов. (c) Инкубаторы обычно проходят через медные линии, чтобы минимизировать загрязнение клеточных культур, хранящихся внутри.(d) Антисептические жидкости для полоскания рта обычно содержат хлорид цинка. (e) Этот пациент страдает аргирией, необратимым заболеванием, вызванным биоаккумуляцией серебра в организме. (Фото b: модификация работы «Shoshanah» / Flickr; кредит e: модификация работы Герберта Л. Фреда и Хендрика А. ван Дейка)
Меркурий
Ртуть — это пример тяжелого металла, который в течение многих лет использовался для контроля роста микробов. Его использовали на протяжении многих веков для лечения сифилиса. Соединения ртути, такие как хлорид ртути , в основном бактериостатические и обладают очень широким спектром активности.Различные формы ртути связываются с серосодержащими аминокислотами в белках, подавляя их функции.
В последние десятилетия использование таких соединений сократилось из-за токсичности ртути. Он токсичен для центральной нервной, пищеварительной и почечной систем в высоких концентрациях и оказывает негативное воздействие на окружающую среду, включая биоаккумуляцию в рыбе. Когда-то широко использовались местные антисептики, такие как меркурохром , который содержит ртуть в низких концентрациях, и мертиолат , настойка (раствор ртути, растворенной в спирте).Однако из-за опасений по поводу использования соединений ртути эти антисептики больше не продаются в США.
Серебро
Серебро издавна использовалось как антисептик. В древности питьевая вода хранилась в серебряных кувшинах. Крем сильваден обычно используется для лечения местных ран и особенно полезен для предотвращения инфицирования ожоговых ран. Когда-то капли нитрата серебра обычно наносили на глаза новорожденных для защиты от ophthalmia neonatorum , глазных инфекций, которые могут возникнуть из-за воздействия патогенов в родовых путях, но сейчас чаще используются кремы с антибиотиками.Серебро часто сочетается с антибиотиками, что делает их в тысячи раз более эффективными. Серебро также обычно вводят в катетеры и повязки, делая их противомикробными; однако есть свидетельства того, что тяжелые металлы могут также усиливать селекцию по устойчивости к антибиотикам.
Медь, никель и цинк
Некоторые другие тяжелые металлы также обладают антимикробной активностью. Сульфат меди — это распространенный альгицид , используемый для контроля роста водорослей в плавательных бассейнах и аквариумах.Использование металлической меди , меди для минимизации роста микробов также становится все более распространенным. Медные футеровки в инкубаторах помогают снизить загрязнение клеточных культур. Использование медных горшков для хранения воды в слаборазвитых странах исследуется как способ борьбы с диарейными заболеваниями. Медные покрытия также становятся популярными для часто используемых предметов, таких как дверные ручки, фурнитура для шкафов и другие приспособления в медицинских учреждениях, в попытке уменьшить распространение микробов.
Покрытия из никеля и цинка теперь используются аналогичным образом. Другие формы цинка, включая хлорид цинка и оксид цинка , также используются в коммерческих целях. Хлорид цинка довольно безопасен для человека и обычно содержится в жидкостях для полоскания рта, что значительно увеличивает срок их действия. Оксид цинка содержится в различных продуктах, включая антисептические кремы для местного применения, такие как лосьон с каламином, мази для подгузников, детская присыпка и шампуни от перхоти.
Подумай об этом
- Почему многие тяжелые металлы являются противомикробными и токсичными для человека?
Галогены
Другими химическими веществами, обычно используемыми для дезинфекции, являются галогены йод , хлор и фтор .Йод действует путем окисления клеточных компонентов, в том числе серосодержащих аминокислот, нуклеотидов и жирных кислот, и дестабилизации макромолекул, содержащих эти молекулы. Его часто используют в качестве настойки для местного применения, но он может вызвать окрашивание или раздражение кожи. Йодофор представляет собой соединение йода в комплексе с органической молекулой, что увеличивает стабильность йода и, в свою очередь, его эффективность. Один из распространенных йодофоров — это повидон-йод , который включает увлажняющий агент, который относительно медленно выделяет йод.Бетадин — это марка повидон-йода, обычно используемая медицинским персоналом в качестве скраба для рук перед операцией и для местной антисептики кожи пациента перед разрезом.
Рис. 4. (а) Бетадин представляет собой раствор йодофорного повидон-йода. (б) Он обычно используется в качестве местного антисептика на коже пациента перед разрезом во время операции. (кредит b: модификация работы Эндрю Ратто)
Хлор — еще один галоген, обычно используемый для дезинфекции. Когда газообразный хлор смешивается с водой, образуется сильный окислитель, называемый хлорноватистой кислотой, которая не заряжается и легко проникает в клетки.Газообразный хлор обычно используется в городских очистных сооружениях питьевой воды и сточных вод, в результате чего образующаяся хлорноватистая кислота оказывает фактическое противомикробное действие. Лица, работающие на водоочистных сооружениях, должны проявлять большую осторожность, чтобы свести к минимуму воздействие газообразного хлора. Гипохлорит натрия является химическим компонентом обычного бытового отбеливателя , а также используется для самых разных целей дезинфекции. Соли гипохлорита, в том числе гипохлориты натрия и кальция, используются для дезинфекции бассейнов.Газообразный хлор, гипохлорит натрия и гипохлорит кальция также широко используются в качестве дезинфицирующих средств в пищевой и ресторанной промышленности для снижения распространения болезней пищевого происхождения. Работники этих отраслей также должны заботиться о правильном использовании этих продуктов, чтобы обеспечить свою безопасность, а также безопасность потребителей. В недавнем совместном заявлении, опубликованном Продовольственной и сельскохозяйственной организацией Объединенных Наций (ФАО) ООН и ВОЗ, указано, что ни одно из многих полезных применений хлористых продуктов в пищевой промышленности для сокращения распространения болезней пищевого происхождения не представляет риска для потребителей.
Другой класс хлорированных соединений, называемых хлораминами , широко используется в качестве дезинфицирующих средств. Хлорамины относительно стабильны, выделяя хлор в течение длительного времени. Хлорамины представляют собой производные аммиака путем замещения одного, двух или всех трех атомов водорода атомами хлора.
Рис. 5. Монохлорамин, один из хлораминов, получают из аммиака путем замены одного атома водорода на атом хлора.
Хлорамины и другие соединения холора могут использоваться для дезинфекции питьевой воды, и таблетки хлорамина часто используются военными для этой цели.После стихийного бедствия или другого события, которое ставит под угрозу коммунальное водоснабжение, CDC рекомендует дезинфицировать водопроводную воду, добавляя небольшое количество обычного бытового отбеливателя. Недавние исследования показывают, что дихлоризоцианурат натрия (NaDCC) также может быть хорошей альтернативой для дезинфекции питьевой воды. В настоящее время таблетки NaDCC доступны для общего использования и для использования военными, отдыхающими или людьми, нуждающимися в неотложной помощи; для этих целей NaDCC предпочтительнее таблеток хлорамина. Двуокись хлора, газообразный агент, используемый для фумигации и стерилизации закрытых помещений, также обычно используется для дезинфекции воды.
Хотя хлорированные соединения являются относительно эффективными дезинфицирующими средствами, у них есть свои недостатки. Некоторые из них могут вызвать раздражение кожи, носа или глаз у некоторых людей, и они не могут полностью устранить некоторые выносливые организмы из загрязненной питьевой воды. Например, гриб Cryptosporidium имеет защитную внешнюю оболочку, которая делает его устойчивым к хлорированным дезинфицирующим средствам. Таким образом, в экстренных случаях рекомендуется кипячение питьевой воды, когда это возможно.
Галоген фтор, как известно, обладает антимикробными свойствами, которые способствуют предотвращению кариеса зубов (кариес). Фтор — это основной активный ингредиент зубной пасты, который также обычно добавляют в водопроводную воду, чтобы помочь общинам поддерживать здоровье полости рта. Химически фторид может включаться в гидроксиапатит зубной эмали, делая его более устойчивым к коррозионным кислотам, образующимся при ферментации микробов полости рта. Фторид также увеличивает поглощение ионов кальция и фосфата зубной эмалью, способствуя реминерализации.Помимо укрепления эмали, фторид также обладает бактериостатическим действием. Он накапливается в бактериях, образующих зубной налет, нарушая их метаболизм и снижая выработку кислот, способствующих разрушению зубов.
Подумай об этом
- В чем преимущество хлорамина перед гипохлоритом при дезинфекции?
Спирты
Спирты составляют еще одну группу химикатов, обычно используемых в качестве дезинфицирующих и антисептических средств. Они работают за счет быстрой денатурирования белков, что препятствует клеточному метаболизму, и за счет разрушения мембран, что приводит к лизису клеток.После денатурирования белки могут потенциально повторно укладываться, если в растворе присутствует достаточно воды. Спирты обычно используются при концентрации около 70% водного раствора и, фактически, лучше работают в водных растворах, чем 100% спиртовые растворы. Это потому, что спирты коагулируют белки. При более высоких концентрациях спирта быстрая коагуляция поверхностных белков препятствует эффективному проникновению в клетки. Наиболее часто используемые спирты для дезинфекции — это этиловый спирт (этанол) и изопропиловый спирт (изопропанол, медицинский спирт).
Спирты, как правило, обладают бактерицидным и фунгицидным действием, но также могут быть вирусными только в отношении вирусов в оболочке. Хотя спирты не обладают спороцидным действием, они подавляют процессы споруляции и прорастания. Спирты летучие и быстро сохнут, но они также могут вызывать раздражение кожи, поскольку обезвоживают кожу в месте нанесения. Одно из распространенных клинических применений спиртов — это мазок с кожи для удаления зародышей перед иглой. Спирты также являются активными ингредиентами дезинфицирующих средств для рук быстрого приготовления , которые приобрели популярность в последние годы.Спирт в этих дезинфицирующих средствах для рук действует как денатурируя белки, так и разрушая мембрану микробных клеток, но не будет работать эффективно в присутствии видимой грязи.
Наконец, спирты используются для приготовления настоек с другими антисептиками, такими как настойки йода, обсуждавшиеся ранее в этой главе. В целом спирты недороги и достаточно эффективны для дезинфекции широкого спектра вегетативных микробов. Однако одним из недостатков спиртов является их высокая летучесть, ограничивающая их эффективность сразу после нанесения.
Рис. 6. (a) Этиловый спирт, опьяняющий ингредиент алкогольных напитков, также широко используется в качестве дезинфицирующего средства. (б) Изопропиловый спирт, также называемый медицинским спиртом, имеет родственную молекулярную структуру и является еще одним широко используемым дезинфицирующим средством. (кредит фото: модификация работы Д. Кутзи; кредит b фото: модификация работы Крейга Спурриера)
Подумай об этом
- Назовите хотя бы три преимущества спиртов как дезинфицирующих средств.
- Опишите несколько конкретных применений спиртов, используемых в дезинфицирующих средствах.
ПАВ
Поверхностно-активные вещества или поверхностно-активные вещества — это группа химических соединений, снижающих поверхностное натяжение воды. Поверхностно-активные вещества являются основными ингредиентами мыла и детергента . Мыла представляют собой соли длинноцепочечных жирных кислот и имеют как полярные, так и неполярные области, что позволяет им взаимодействовать с полярными и неполярными областями в других молекулах. Они могут взаимодействовать с неполярными маслами и жирами, создавая эмульсии в воде, разрыхляя и удаляя грязь и микробы с поверхностей и кожи.Мыло не убивает и не подавляет рост микробов, поэтому не считается антисептиком или дезинфицирующим средством. Однако правильное использование мыла механически уносит микроорганизмы, эффективно очищая поверхность. Некоторые мыла содержат добавленные бактериостатические агенты, такие как триклокарбан или клофлукарбан , соединения, структурно родственные триклозану, которые придают мыло антисептическое или дезинфицирующее свойства.
Рис. 7. Мыла представляют собой соли (натриевая соль на иллюстрации) жирных кислот и обладают способностью эмульгировать липиды, жиры и масла, взаимодействуя с водой через их гидрофильные головки и с липидами на их гидрофобных хвостах.
Однако мыло часто образует пленки, которые трудно смыть, особенно в жесткой воде, содержащей высокие концентрации минеральных солей кальция и магния. Моющие средства содержат молекулы синтетических поверхностно-активных веществ как с полярными, так и с неполярными областями, которые обладают сильной очищающей активностью, но более растворимы даже в жесткой воде и, следовательно, не оставляют мыльных отложений. Анионные моющие средства , такие как те, которые используются для стирки, имеют отрицательно заряженный анион на одном конце, прикрепленный к длинной гидрофобной цепи, тогда как катионные моющие средства вместо этого имеют положительно заряженный катион.Катионные моющие средства включают важный класс дезинфицирующих и антисептических средств, называемых солями четвертичного аммония (кватерны) , названными в честь характерного четвертичного атома азота, который придает положительный заряд. В целом четвертичные соединения обладают свойствами, аналогичными фосфолипидам, имея гидрофильные и гидрофобные концы. Таким образом, четвертичные соединения обладают способностью вставляться в бактериальный фосфолипидный бислой и нарушать целостность мембраны. Катионный заряд четвертичных, по-видимому, придает их антимикробные свойства, которые уменьшаются при нейтрализации.Кваты обладают рядом полезных свойств. Они стабильны, нетоксичны, недороги, не имеют цвета, запаха и вкуса. Они обладают бактерицидным действием, разрушая мембраны. Они также активны против грибов, простейших и вирусов в оболочке, но эндоспоры не затронуты. В клинических условиях они могут использоваться в качестве антисептиков или для дезинфекции поверхностей. Смеси четвертичных также часто встречаются в бытовых чистящих и дезинфицирующих средствах, в том числе во многих современных составах продуктов марки Lysol, которые содержат хлоридов бензалкония в качестве активных ингредиентов.Хлориды бензалкония, наряду с хлоридом цетилпиримидина quat , также содержатся в таких продуктах, как антисептики для кожи, полоскания для полости рта и жидкости для полоскания рта.
Рис. 8. (a) Двумя общими четвертичными соединениями являются хлорид бензилалкония и хлорид цетилпиримидина. Обратите внимание на гидрофобную неполярную углеродную цепь на одном конце и азотсодержащий катионный компонент на другом конце. (b) Quats способны проникать в фосфолипидные плазматические мембраны бактериальных клеток и нарушать их целостность, что приводит к гибели клетки.
Подумай об этом
- Почему мыло не считается дезинфицирующим средством?
Правильное мытье рук
Мытье рук имеет решающее значение для общественного здравоохранения, и ему следует уделять особое внимание в клинических условиях. Для широкой публики CDC рекомендует для мытья рук до, во время и после работы с пищевыми продуктами; до еды; до и после общения с больным; до и после обработки раны; после посещения туалета или смены подгузников; после кашля, чихания или сморкания; после обработки мусора; и после взаимодействия с животным, его кормом или отходами.На рис. 9 показаны пять этапов правильного мытья рук, рекомендованных CDC.
Мытье рук еще более важно для медицинских работников, которым следует тщательно мыть руки между каждым контактом с пациентом, после снятия перчаток, после контакта с биологическими жидкостями и потенциально инфекционными фомитами, а также до и после оказания хирургу помощи при проведении инвазивных процедур. Даже при использовании надлежащей хирургической одежды, в том числе перчаток, чистка во время операции требует больше усилий, чем обычное мытье рук.Целью хирургической очистки является уменьшение нормальной микробиоты на поверхности кожи, чтобы предотвратить попадание этих микробов в хирургические раны пациента.
Не существует единого общепринятого протокола хирургической чистки. Протоколы продолжительности чистки могут зависеть от применяемого противомикробного препарата; медицинские работники всегда должны проверять рекомендации производителя. По данным Ассоциации хирургических технологов (AST), хирургические скрабы могут выполняться с использованием щеток или без них.
Рис. 9. (a) CDC рекомендует пять этапов обычного мытья рук для населения. (b) Хирургическая чистка более обширна и требует очистки, начиная с кончиков пальцев, до кистей и предплечий, а затем до локтей, как показано здесь. (кредит а: модификация работы Всемирной организации здравоохранения)
Чтобы узнать больше о правильном мытье рук, посетите веб-сайт CDC.Бисбигуаниды
Бисбигуаниды были впервые синтезированы в 20 веке и представляют собой катионные (положительно заряженные) молекулы, известные своими антисептическими свойствами.Одним из важных антисептиков бисбигуанид является хлоргексидин . Он обладает активностью широкого спектра действия против дрожжей, грамположительных и грамотрицательных бактерий, за исключением Pseudomonas aeruginosa , у которых может развиться устойчивость при многократном воздействии. Хлоргексидин разрушает клеточные мембраны и обладает бактериостатическим действием при более низких концентрациях или бактерицидным при более высоких концентрациях, при которых он фактически вызывает застывание цитоплазматического содержимого клеток.Он также действует против вирусов в оболочке. Однако хлоргексидин малоэффективен против Mycobacterium tuberculosis и вирусов без оболочки, а также не является спороцидным. Хлоргексидин обычно используется в клинических условиях в качестве хирургического скраба и для других целей мытья рук для медицинского персонала, а также для местного антисептического действия у пациентов перед операцией или инъекцией иглы. Он более стойкий, чем йодофоры, обеспечивая длительное противомикробное действие.Растворы хлоргексидина также можно использовать в качестве ополаскивателей для полости рта после пероральных процедур или для лечения гингивита. Другой бисбигуанид, алексидин , набирает популярность в качестве хирургического скраба и средства для полоскания полости рта, поскольку действует быстрее, чем хлоргексидин.
Рис. 10. Бисбигуаниды хлоргексадин и алексидин — катионные антисептические соединения, обычно используемые в качестве хирургических скрабов.
Подумай об этом
- Какие два эффекта хлоргексидин оказывает на бактериальные клетки?
Алкилирующие агенты
Алкилирующие агенты представляют собой группу сильнодействующих дезинфицирующих химикатов, которые действуют путем замены атома водорода в молекуле на алкильную группу (C n H 2n + 1 ), тем самым инактивируя ферменты и нуклеиновые кислоты.Алкилирующий агент формальдегид (CH 2 OH) обычно используется в растворе с концентрацией 37% (известный как формалин ) или как газообразное дезинфицирующее средство и биоцид. Это сильнодействующее дезинфицирующее средство и биоцид широкого спектра действия, способное убивать бактерии, вирусы, грибки и эндоспоры, что приводит к стерилизации при низких температурах, что иногда является удобной альтернативой более трудоемким методам тепловой стерилизации. Он также связывает белки и широко используется в качестве химического фиксатора.Из-за этого он используется для хранения образцов тканей и в качестве жидкости для бальзамирования. Он также использовался для инактивации инфекционных агентов при приготовлении вакцины. Формальдегид очень раздражает живые ткани, а также является канцерогенным; поэтому он не используется в качестве антисептика.
Глутаральдегид структурно похож на формальдегид, но имеет две реакционноспособные альдегидные группы, что позволяет ему действовать быстрее, чем формальдегид. Он обычно используется в виде 2% раствора для стерилизации и продается под торговой маркой Cidex.Он используется для дезинфекции различных поверхностей, хирургического и медицинского оборудования. Однако, как и формальдегид, глутаральдегид раздражает кожу и не используется в качестве антисептика.
Новый тип дезинфицирующего средства, набирающий популярность для дезинфекции медицинского оборудования, — это о-фталевый альдегид (OPA), который содержится в некоторых новых составах Cidex и аналогичных продуктов, заменяя глутаральдегид. о-Фталальдегид также имеет две реакционноспособные альдегидные группы, но они связаны ароматическим мостиком.Считается, что о-фталальдегид действует аналогично глютаральдегиду и формальдегиду, но гораздо менее раздражает кожу и носовые ходы, имеет минимальный запах, не требует обработки перед использованием и более эффективен против микобактерий.
Оксид этилена — это тип алкилирующего агента, который используется для газовой стерилизации. Он обладает высокой проникающей способностью и может стерилизовать предметы в пластиковых пакетах, такие как катетеры, одноразовые предметы в лабораториях и клинических учреждениях (например, упакованные чашки Петри) и другое оборудование.Воздействие оксида этилена — это форма холодной стерилизации, что делает его полезным для стерилизации термочувствительных предметов. Однако следует соблюдать осторожность при использовании окиси этилена; он канцерогенный, как и другие алкилирующие агенты, а также очень взрывоопасен. При осторожном использовании и надлежащей аэрации продуктов после обработки оксид этилена очень эффективен, и стерилизаторы оксида этилена обычно используются в медицинских учреждениях для стерилизации упакованных материалов.
β-Пропионолактон представляет собой алкилирующий агент с химической структурой, отличной от других уже рассмотренных.Как и другие алкилирующие агенты, β-пропионолактон связывается с ДНК, тем самым инактивируя ее. Это прозрачная жидкость с сильным запахом, которая убивает эндоспоры. Как таковой, он использовался либо в жидкой форме, либо в виде пара для стерилизации медицинских инструментов и тканевых трансплантатов, и он является обычным компонентом вакцин, используемых для поддержания их стерильности. Он также использовался для стерилизации питательного бульона, а также плазмы крови, молока и воды. Он быстро метаболизируется животными и людьми до молочной кислоты.Однако он также является раздражителем и может привести к необратимому повреждению глаз, почек или печени. Кроме того, было показано, что он канцерогенный для животных; таким образом, необходимы меры предосторожности, чтобы свести к минимуму воздействие β-пропионолактона на человека.
Рис. 11. (a) Алкилирующие агенты заменяют атомы водорода алкильными группами. Здесь гуанин алкилируется, в результате чего образуется водородная связь с тимином, а не с цитозином. (б) Химические структуры нескольких алкилирующих агентов.
Подумай об этом
- В какой химической реакции участвуют алкилирующие агенты?
- Почему алкилирующие агенты не используются в качестве антисептиков?
Дихард Прионы
Прионы, бесклеточные неправильно свернутые белки, ответственные за неизлечимые и смертельные заболевания, такие как куру и болезнь Крейтцфельдта-Якоба (см. Вироиды, вирусоиды и прионы), как известно, трудно уничтожить.Прионы чрезвычайно устойчивы к нагреванию, химическим веществам и радиации. Они также чрезвычайно заразны и смертельно опасны; таким образом, обращение с предметами, инфицированными прионами, и их утилизация требуют обширного обучения и особой осторожности.
Типичные методы дезинфекции могут снизить, но не устранить инфекционность прионов. Автоклавирование не является полностью эффективным, равно как и химические вещества, такие как фенол, спирты, формалин и β-пропиолактон. Даже при фиксации в формалине пораженные ткани головного и спинного мозга остаются заразными.
Персонал, который работает с зараженными образцами или оборудованием или работает с инфицированными пациентами, должен носить защитное пальто, защиту лица и перчатки, устойчивые к порезам. Любой контакт с кожей необходимо немедленно промыть теплой водой с моющим средством, не используя скребок. Затем кожу следует промыть 1 N NaOH или разбавлением 1:10 отбеливателем в течение 1 минуты. Загрязненные отходы необходимо сжигать или автоклавировать в сильном щелочном растворе, а инструменты необходимо очистить и пропитать сильным щелочным раствором.
Для получения дополнительной информации об обращении с животными и материалами, загрязненными прионами, посетите руководящие принципы, опубликованные на веб-сайтах CDC и ВОЗ.Пероксигены
Пероксигены — сильные окислители, которые можно использовать в качестве дезинфицирующих или антисептических средств. Наиболее широко используемым пероксидом является перекись водорода (H 2 O 2 ), которая часто используется в растворах для дезинфекции поверхностей, а также может использоваться в качестве газообразного агента. Растворы перекиси водорода — недорогие кожные антисептики, которые распадаются на воду и кислород, оба из которых являются экологически безопасными.Это разложение ускоряется в присутствии света, поэтому растворы перекиси водорода обычно продаются в коричневых или непрозрачных бутылках. Одним из недостатков использования перекиси водорода в качестве антисептика является то, что она также вызывает повреждение кожи, которое может замедлить заживление или привести к образованию рубцов. Очистители контактных линз часто содержат перекись водорода в качестве дезинфицирующего средства.
Перекись водорода производит свободные радикалы, которые повреждают клеточные макромолекулы. Перекись водорода имеет широкий спектр действия, действуя против грамположительных и грамотрицательных бактерий (с немного большей эффективностью против грамположительных бактерий), грибов, вирусов и эндоспор.Однако бактерии, вырабатывающие кислород-детоксицирующие ферменты , каталазу или пероксидазу , могут иметь внутреннюю толерантность к низким концентрациям перекиси водорода. Чтобы убить эндоспоры, необходимо увеличить продолжительность воздействия или концентрацию растворов перекиси водорода. Газообразная перекись водорода имеет большую эффективность и может использоваться в качестве стерилизатора для помещений или оборудования.
Рис. 12. Каталаза ферментативно превращает перекись водорода с высокой реакционной способностью (H 2 O 2 ) в воду и кислород.Перекись водорода можно использовать для очистки ран. Перекись водорода используется для стерилизации таких предметов, как контактные линзы. (кредитные фотографии: модификация работы Керри Чешик)
Плазма, горячий ионизированный газ, описываемый как четвертое состояние вещества, полезен для стерилизации оборудования, поскольку проникает через поверхности и убивает вегетативные клетки и эндоспоры. Перекись водорода и надуксусная кислота , другой обычно используемый пероксид кислорода, могут вводиться в виде плазмы. Перуксусную кислоту можно использовать в качестве стерилизатора жидкости или плазмы, поскольку она легко убивает эндоспоры, более эффективна, чем перекись водорода даже при довольно низких концентрациях, и невосприимчива к инактивации каталазами и пероксидазами.Он также распадается на экологически безвредные соединения; в данном случае уксусная кислота и кислород.
Другие примеры пероксигенов включают пероксид бензоила и пероксид карбамида . Пероксид бензоила — это пероксид, который используется в растворах для лечения акне. Он убивает бактерии Propionibacterium acnes , которые связаны с акне. Пероксид карбамида, ингредиент, используемый в зубной пасте, представляет собой пероксид, который борется с биопленками полости рта, вызывающими обесцвечивание зубов и неприятный запах изо рта (неприятный запах изо рта).Наконец, газ озон представляет собой перекисный кислород с дезинфицирующими свойствами и используется для очистки воздуха или воды. В целом пероксигены высокоэффективны и широко используются, не опасаясь окружающей среды.
Подумай об этом
- Как перекиси убивают клетки?
Сверхкритические жидкости
В течение последних 15 лет использование сверхкритических жидкостей , особенно сверхкритического диоксида углерода (scCO 2 ), стало популярным в некоторых случаях стерилизации.Когда углекислый газ доводится до давления, примерно в 10 раз превышающего атмосферное, он достигает сверхкритического состояния, которое имеет физические свойства между жидкостями и газами. Материалы, помещенные в камеру, в которой таким образом создается давление диоксида углерода, можно стерилизовать из-за способности scCO 2 проникать через поверхности.
Сверхкритический диоксид углерода проникает в клетки и образует угольную кислоту , тем самым значительно снижая pH клетки. Этот метод эффективен против вегетативных клеток, а также используется в сочетании с перуксусной кислотой для уничтожения эндоспор.Его эффективность также может быть усилена повышением температуры или быстрыми циклами повышения и сброса давления, которые с большей вероятностью вызывают лизис клеток.
Преимущества scCO 2 включают инертные, нетоксичные и негорючие свойства диоксида углерода, и этот протокол эффективен при низких температурах. В отличие от других методов, таких как нагревание и облучение, которые могут разрушить стерилизуемый объект, использование scCO 2 сохраняет целостность объекта и обычно используется для обработки пищевых продуктов (включая специи и соки) и медицинских устройств, таких как эндоскопы.Он также набирает популярность для дезинфекции таких тканей, как кожа, кости, сухожилия и связки, перед трансплантацией. scCO 2 также может использоваться для борьбы с вредителями, поскольку он может убивать яйца и личинки насекомых в продуктах.
Подумай об этом
- Почему использование сверхкритического диоксида углерода становится все более популярным в коммерческих и медицинских целях?
Химические консерванты для пищевых продуктов
Chemical консерванты используются для подавления роста микробов и минимизации порчи некоторых пищевых продуктов.Обычно используемые химические консерванты включают сорбиновую кислоту , бензойную кислоту и пропионовую кислоту , а также их более растворимые соли сорбат калия , бензоат натрия и пропионат кальция , все из которых используются для контроля рост плесени в кислой пище. Каждый из этих консервантов нетоксичен и легко метаболизируется человеком. Они также не имеют вкуса, поэтому не влияют на вкус сохраняемых продуктов.
Сорбиновая и бензойная кислоты проявляют повышенную эффективность при снижении pH. Считается, что сорбиновая кислота действует путем ингибирования различных клеточных ферментов, включая ферменты цикла лимонной кислоты, а также каталазы и пероксидазы . Он добавляется в качестве консерванта в самые разные продукты, включая молочные продукты, хлеб, фрукты и овощи. Бензойная кислота естественным образом содержится во многих фруктах и ягодах, специях и ферментированных продуктах. Считается, что он работает путем снижения внутриклеточного pH, препятствуя таким механизмам, как окислительное фосфорилирование , и поглощение молекул, таких как аминокислоты, клетками.Продукты, консервированные бензойной кислотой или бензоатом натрия, включают фруктовые соки, джемы, мороженое, выпечку, безалкогольные напитки, жевательную резинку и соленые огурцы.
Считается, чтопропионовая кислота ингибирует ферменты и снижает внутриклеточный pH, действуя аналогично бензойной кислоте. Однако пропионовая кислота является более эффективным консервантом при более высоком pH, чем сорбиновая кислота или бензойная кислота. Пропионовая кислота естественным образом вырабатывается некоторыми сырами во время их созревания и добавляется в другие виды сыра и выпечку для предотвращения заражения плесенью.Его также добавляют в сырое тесто, чтобы предотвратить заражение бактериями Bacillus mesentericus , из-за которых хлеб становится вязким.
Другие широко используемые химические консерванты включают диоксид серы и нитриты . Диоксид серы предотвращает потемнение продуктов и используется для консервирования сухофруктов; его использовали в виноделии с давних времен. Газообразный диоксид серы легко растворяется в воде с образованием сульфитов .Хотя сульфиты могут метаболизироваться в организме, у некоторых людей есть аллергия на сульфиты, включая астматические реакции. Кроме того, сульфиты разлагают тиамин, важный нутриент в некоторых продуктах питания. Механизм действия сульфитов не совсем ясен, но они могут препятствовать образованию дисульфидной связи в белках, подавляя ферментативную активность. Альтернативно, они могут снижать внутриклеточный pH клетки, вмешиваясь в механизмы, управляемые протонной движущей силой.
нитритов добавляют в переработанное мясо для сохранения цвета и остановки прорастания эндоспор Clostridium botulinum .Нитриты восстанавливаются до оксида азота , который реагирует с гемовыми группами и железо-серными группами. Когда оксид азота вступает в реакцию с гемовой группой миоглобина мяса, образуется красный продукт, придающий мясу красный цвет. Альтернативно, считается, что когда азотная кислота реагирует с ферментом железо-сера , ферредоксином в бактериях, этот переносчик электронной транспортной цепи разрушается, предотвращая синтез АТФ. Однако нитрозамины являются канцерогенными и могут вырабатываться при воздействии консервированного нитритом мяса (например,г., хот-доги, мясо для обеда, колбаса для завтрака, бекон, мясо в консервированных супах) для разогрева во время приготовления.
Природные химические консерванты для пищевых продуктов
Открытие природных антимикробных веществ, продуцируемых другими микробами, расширило арсенал консервантов, используемых в пищевых продуктах. Низин представляет собой антимикробный пептид, продуцируемый бактерией Lactococcus lactis , и особенно эффективен против грамположительных организмов. Низин действует, нарушая производство клеточной стенки, делая клетки более склонными к лизису.Его используют для консервирования сыров, мяса и напитков.
Натамицин — противогрибковый макролидный антибиотик, продуцируемый бактерией Streptomyces natalensis . Он был одобрен FDA в 1982 году и используется для предотвращения роста грибков в различных типах молочных продуктов, включая творог, нарезанный сыр и тертый сыр. Натамицин также используется для консервирования мяса за пределами США.
Подумай об этом
- Каковы преимущества и недостатки использования сульфитов и нитритов в качестве пищевых консервантов?
Ключевые концепции и резюме
- Тяжелые металлы , включая ртуть, серебро, медь и цинк, давно используются для дезинфекции и консервации, хотя некоторые из них связаны с токсичностью и экологическими рисками.
- Галогены , включая хлор, фтор и йод, также обычно используются для дезинфекции. Для дезинфекции воды обычно используются соединения хлора, включая гипохлорит натрия , хлорамины и диоксид хлора . Йод в виде настойки и йодофор является эффективным антисептиком.
- Спирты , включая этиловый спирт и изопропиловый спирт, являются обычно используемыми антисептиками, которые действуют, денатурируя белки и разрушая мембраны.
- Фенольные смолы — стабильные дезинфицирующие средства длительного действия, которые денатурируют белки и разрушают мембраны. Они обычно входят в состав бытовых чистящих средств, жидкостей для полоскания рта и дезинфицирующих средств в больницах, а также используются для консервирования собранного урожая.
- Фенольное соединение триклозан , обнаруженное в антибактериальном мыле, пластмассах и текстильных изделиях, технически является антибиотиком из-за его специфического механизма действия, подавляющего синтез жирных кислот бактериями.
- Поверхностно-активные вещества , включая мыло и детергенты, снижают поверхностное натяжение воды для создания эмульсий, которые механически уносят микробы.Мыло — это длинноцепочечные жирные кислоты, а моющие средства — синтетические поверхностно-активные вещества.
- Соединения четвертичного аммония ( четвертичные ) являются катионными детергентами, разрушающими мембраны. Они используются в бытовых чистящих средствах, дезинфицирующих средствах для кожи, полосканиях для рта и полосканиях для рта.
- Бисбигуаниды разрушают клеточные мембраны, в результате чего содержимое клеток превращается в гель. Хлоргексидин и алексидин обычно используются для хирургических скрабов, для мытья рук в клинических условиях и в рецептурных полосканиях для полости рта.
- Алкилирующие агенты эффективно стерилизуют материалы при низких температурах, но являются канцерогенными и могут также вызывать раздражение тканей. Глутаральдегид и о-фталальдегид используются в качестве дезинфицирующих средств в больницах, но не в качестве антисептиков. Формальдегид используется для хранения образцов тканей, как жидкость для бальзамирования, а также при приготовлении вакцин для инактивации инфекционных агентов. Оксид этилена — это газовый стерилизатор, который может проникать в термочувствительные упаковочные материалы, но он также является взрывоопасным и канцерогенным.
- Пероксигены , включая перекись водорода , перуксусную кислоту , перекись бензоила и газ озон, являются сильными окислителями, которые производят свободные радикалы в клетках, повреждая их макромолекулы. Они экологически безопасны и являются высокоэффективными дезинфицирующими и антисептическими средствами.
- Углекислый газ под давлением в форме сверхкритической жидкости легко проникает в упакованные материалы и клетки, образуя угольную кислоту и снижая внутриклеточный pH.Сверхкритический диоксид углерода неактивен, нетоксичен, негорючий и эффективен при низких температурах для стерилизации медицинских устройств, имплантатов и трансплантированных тканей.
- Химические консерванты добавляются в различные пищевые продукты. Сорбиновая кислота , бензойная кислота , пропионовая кислота и их более растворимые соли ингибируют ферменты или снижают внутриклеточный pH.
- Сульфиты используются в виноделии и пищевой промышленности для предотвращения потемнения продуктов.
- Нитриты используются для сохранения мяса и поддержания цвета, но приготовление мяса с консервированным нитритом может производить канцерогенные нитрозамины.
- Низин и натамицин — консерванты естественного происхождения, используемые в сырах и мясе. Низин эффективен против грамположительных бактерий, а натамицин — против грибков.
Множественный выбор
Что из перечисленного относится к дезинфицирующему химическому веществу, растворенному в спирте?
- йодофор
- настойка
- фенольный
- пероксид
г.Настойка относится к дезинфицирующему химическому веществу, растворенному в спирте.
Какой из следующих пероксигенов широко используется в качестве дезинфицирующего средства в домашних условиях, стоит недорого и распадается на воду и газообразный кислород?
- перекись водорода
- перуксусная кислота
- пероксид бензоила
- озон
а. Перекись водорода широко используется в качестве дезинфицирующего средства в домашних условиях, стоит недорого и распадается на воду и газообразный кислород.
Какие из следующих химических пищевых консервантов используются в винодельческой промышленности, но могут вызывать астматические реакции у некоторых людей?
- нитриты
- сульфитов
- пропионовая кислота
- бензойная кислота
г.Сульфиты используются в винной промышленности, но у некоторых людей могут вызывать астматические реакции.
Отбеливатель — пример какой группы химикатов используется для дезинфекции?
- тяжелые металлы
- галогены
- кв.
- бисбигуанидов
г. Отбеливатель — это пример галогенов.
Какой химический дезинфектант действует путем метилирования ферментов и нуклеиновых кислот и известен своей токсичностью и канцерогенностью?
- кислота сорбиновая
- триклозан
- формальдегид
- гексаклорофен
г.Формальдегид действует путем метилирования ферментов и нуклеиновых кислот и известен своей токсичностью и канцерогенностью.
Заполните бланк
Дверные ручки и другие поверхности в клинических условиях часто покрываются ________, ________ или ________ для предотвращения передачи микробов.
Покажи ответДверные ручки и другие поверхности в клинических условиях часто покрываются медью , никелем и цинком для предотвращения передачи микробов.
Верно / Неверно
Мыло классифицируется как дезинфицирующее средство.
Соединения на основе ртути перестали использоваться в качестве консервантов и антисептиков.
Подумай об этом
- Какой раствор этилового спирта более эффективен для подавления роста микробов: 70% раствор или 100% раствор? Почему?
- Когда можно использовать обработку газа для контроля роста микробов вместо автоклавирования? Какие есть примеры?
- В чем преимущество йодофора перед йодом или йодной настойкой?
- Глядя на рисунок 11, у какого алкилирующего агента отсутствует альдегидная группа?
- Считаете ли вы, что произведенные естественным путем противомикробные продукты, такие как низин и натамицин, должны заменить сорбиновую кислоту для консервирования пищевых продуктов? Почему или почему нет?
- Почему для хирургической чистки необходимо использовать дезинфицирующие составы для кожи, а не для повседневного мытья рук?
Что такое буфер и как он работает? Вестлаб
Буфер — это водный раствор, который может противостоять значительным изменениям уровня pH при добавлении небольшого количества кислоты или щелочи.Каждый буфер характеризуется установленной «емкостью», которая определяется как количество сильной кислоты или основания, которое необходимо добавить, чтобы изменить pH одного литра раствора на одну единицу pH. Другими словами, буферная емкость — это количество кислоты или основания, которое может быть добавлено до того, как pH начнет значительно изменяться.
Диапазон буфера — это конкретный диапазон pH, в котором буфер эффективно нейтрализует добавленную кислоту или основание, сохраняя при этом почти постоянный pH. Емкость и диапазон конкретного буфера гарантирует, что добавленное небольшое количество кислоты / основания нейтрализуется и химическая реакция продолжается, не давая неверного результата для эксперимента / процесса.Проще говоря, буфер — это смесь слабой кислоты и ее сопряженного основания или слабого основания и сопряженной кислоты.
Есть два типа буферных растворов…
Кислотный буфер
Кислотные буферные растворы имеют pH менее 7. Обычно он состоит из слабой кислоты и одной из ее солей (часто называемых конъюгатом *). Обычно используемые кислотные буферные растворы представляют собой смесь этановой кислоты и этаноата натрия в растворе, который имеет pH 4,76 при смешивании в равных молярных концентрациях.Вы можете изменить pH буферного раствора, изменив соотношение кислоты к соли или выбрав другую кислоту и одну из ее солей.
Щелочной буфер
Щелочные буферные растворы имеют pH более 7 и состоят из слабого основания и одной из его солей. Очень часто используемый пример щелочного буферного раствора представляет собой смесь аммиака и раствора хлорида аммония. Если бы они были смешаны в равных молярных пропорциях, раствор имел бы pH 9.25.
Как работают буферы?
Буферыработают путем нейтрализации любой добавленной кислоты (ионы H +) или основания (ионы OH-) для поддержания умеренного pH, делая их более слабой кислотой или основанием. Рассмотрим пример буфера, состоящего из слабого основного аммиака Nh4 и его сопряженной кислоты Nh5 +. Когда HCl (сильная кислота) добавляется к этой буферной системе, дополнительные ионы H +, добавленные в систему, потребляются Nh4 с образованием Nh5 +. Теперь, поскольку все лишние ионы H + заблокированы и образовали более слабую кислоту, Nh5 +, pH системы существенно не изменится.Точно так же, когда к этой буферной системе добавляется NaOH (сильное основание), ион аммония отдает протон основанию, превращаясь в аммиак и воду, таким образом нейтрализуя основание без какого-либо значительного изменения pH.
Существует термин, который мы называем «разрушение буферного раствора», который возникает, когда все основание и сопряженная с ним кислота (в приведенном выше случае Nh4 и Nh5 +) расходуются для нейтрализации добавленной кислоты или основания. Дальнейшее добавление кислоты или основания в буфер быстро изменит его pH.Таким образом, разрушение буфера — это его емкость, или, другими словами, это количество кислоты или основания, которое буфер может поглотить до того, как нарушит свою емкость. Следует отметить, что раствор со слабым основанием имеет более высокую буферную емкость для добавления сильной кислоты, а раствор слабой кислоты имеет более высокую буферную емкость для добавления сильного основания.
* Конъюгированная кислота — это разновидность, образованная за счет усиления протона основанием, в то время как, наоборот, конъюгированная кислота представляет собой разновидность, образованную отщеплением протона от кислоты.
Мы можем понять это с помощью следующего уравнения:
Кислота + Основание ⇌ Конъюгат Основание + Конъюгат Кислота
h3O (ж) + Nh4 (г) → OH- (водн.) + Nh5 + (водн.)
В этом уравнении h3O представляет собой конъюгированную кислоту, а соответствующее основание конъюгата представляет собой ОН-, в то время как Nh4 и Nh5 + представляют собой основание и пару сопряженных с ним кислот. Здесь следует отметить, что чем сильнее кислота или основание, тем слабее конъюгат и чем слабее кислота или основание, тем сильнее конъюгат.
% PDF-1.2 % 786 0 объект > эндобдж xref 786 92 0000000016 00000 н. 0000002191 00000 п. 0000002370 00000 н. 0000002401 00000 п. 0000002458 00000 н. 0000003208 00000 н. 0000003390 00000 н. 0000003457 00000 н. 0000003618 00000 н. 0000003719 00000 н. 0000003827 00000 н. 0000003993 00000 п. 0000004178 00000 н. 0000004277 00000 н. 0000004456 00000 н. 0000004621 00000 н. 0000004766 00000 н. 0000004948 00000 н. 0000005048 00000 н. 0000005212 00000 н. 0000005324 00000 н. 0000005437 00000 н. 0000005559 00000 н. 0000005719 00000 н. 0000005810 00000 н. 0000005915 00000 н. 0000006016 00000 н. 0000006143 00000 н. 0000006265 00000 н. 0000006382 00000 п. 0000006495 00000 н. 0000006612 00000 н. 0000006719 00000 н. 0000006871 00000 н. 0000007000 00000 н. 0000007143 00000 н. 0000007244 00000 н. 0000007378 00000 н. 0000007512 00000 н. 0000007619 00000 п. 0000007767 00000 н. 0000007928 00000 п. 0000008048 00000 н. 0000008158 00000 п. 0000008298 00000 н. 0000008393 00000 п. 0000008490 00000 н. 0000008585 00000 н. 0000008678 00000 н. 0000008771 00000 п. 0000008865 00000 н. 0000008959 00000 н. 0000009053 00000 п. 0000009147 00000 н. 0000009241 00000 н. 0000009335 00000 п. 0000009429 00000 н. 0000009523 00000 н. 0000009617 00000 н. 0000009711 00000 н. 0000009805 00000 н. 0000009899 00000 н. 0000009993 00000 н. 0000010087 00000 п. 0000010181 00000 п. 0000010275 00000 п. 0000010370 00000 п. 0000010465 00000 п. 0000010560 00000 п. 0000010655 00000 п. 0000010750 00000 п. 0000010845 00000 п. 0000010940 00000 п. 0000011035 00000 п. 0000011130 00000 п. 0000011225 00000 п. 0000011320 00000 п. 0000011415 00000 п. 0000011510 00000 п. 0000011605 00000 п. 0000011700 00000 п. 0000011795 00000 п. 0000011890 00000 п. 0000011985 00000 п. 0000012080 00000 п. 0000012175 00000 п. 0000012293 00000 п. 0000012403 00000 п. 0000012893 00000 п. 0000012998 00000 н. 0000002499 00000 н. 0000003186 00000 п. трейлер ] >> startxref 0 %% EOF 787 0 объект > эндобдж 788 0 объект [ 789 0 руб. ] эндобдж 789 0 объект > / F 831 0 R >> эндобдж 790 0 объект > эндобдж 876 0 объект > поток Hb«f` , К L š
Основы зеленой химии | Зеленая химия
На этой странице:
Определение зеленой химии
Зеленая химия — это разработка химических продуктов и процессов, которые сокращают или исключают использование или образование опасных веществ.Зеленая химия применяется на протяжении всего жизненного цикла химического продукта, включая его проектирование, производство, использование и окончательную утилизацию. Зеленая химия также известна как устойчивая химия.
Зеленая химия:
- Предотвращает загрязнение на молекулярном уровне
- Это философия, которая применима ко всем областям химии, а не к какой-либо одной дисциплине химии
- Применяет инновационные научные решения к реальным экологическим проблемам
- Приводит к сокращению количества источников, поскольку предотвращает загрязнение.
- Снижает негативное воздействие химических продуктов и процессов на здоровье человека и окружающую среду
- Уменьшает, а иногда и устраняет опасность от существующих продуктов и процессов
- Разрабатывает химические продукты и процессы для снижения внутренней опасности
Начало страницы
Чем зеленая химия отличается от очистки загрязнений
Зеленая химия снижает загрязнение в его источнике за счет минимизации или устранения опасностей, связанных с химическим сырьем, реагентами, растворителями и продуктами.
Это не похоже на очистку от загрязнения (также называемую восстановлением), которая включает в себя очистку потоков отходов (обработка на конце трубы) или очистку от разливов в окружающей среде и других выбросов. Восстановление может включать отделение опасных химикатов от других материалов, затем их обработку, чтобы они больше не представляли опасности, или их концентрацию для безопасной утилизации. Большинство мероприятий по восстановлению не связаны с зеленой химией. Рекультивация удаляет опасные материалы из окружающей среды; с другой стороны, зеленая химия в первую очередь предотвращает попадание опасных материалов в окружающую среду.
Если технология уменьшает или устраняет опасные химические вещества, используемые для очистки загрязнителей окружающей среды, эта технология будет квалифицироваться как технология зеленой химии. Одним из примеров является замена опасного сорбента [химического вещества], используемого для улавливания ртути из воздуха для безопасного удаления, на эффективный, но неопасный сорбент. Использование неопасного сорбента означает, что опасный сорбент никогда не производится, и поэтому технология восстановления соответствует определению зеленой химии.
Начало страницы
12 принципов зеленой химии
Эти принципы демонстрируют широту концепции зеленой химии:
1. Предотвращение образования отходов : Разработайте химический синтез для предотвращения образования отходов. Не оставляйте отходы для обработки или очистки.
2. Максимизируйте атомную экономию : Спроектируйте синтезы так, чтобы конечный продукт содержал максимальную долю исходных материалов. Выбросьте мало атомов или совсем не потеряйте их.
3. Разработать менее опасные химические синтезы. : Спроектировать синтез для использования и производства веществ с небольшой или нулевой токсичностью для человека или окружающей среды.
4. Создавайте более безопасные химические вещества и продукты. : Создавайте химические продукты, которые будут полностью эффективными, но при этом имеют небольшую токсичность или не имеют ее.
5. Используйте более безопасные растворители и условия реакции. : Избегайте использования растворителей, разделительных агентов или других вспомогательных химикатов. Если вам необходимо использовать эти химические вещества, используйте более безопасные.
6. Повышение энергоэффективности. : По возможности проводите химические реакции при комнатной температуре и давлении.
7.Используйте возобновляемое сырье. : Используйте возобновляемые, а не истощаемые исходные материалы (также известные как сырье). Источником возобновляемого сырья часто являются сельскохозяйственные продукты или отходы других процессов; Источником истощаемого сырья часто является ископаемое топливо (нефть, природный газ или уголь) или добыча полезных ископаемых.
8. Избегайте химических производных. : Избегайте использования блокирующих или защитных групп или любых временных модификаций, если это возможно. Производные используют дополнительные реагенты и образуют отходы.
9. Используйте катализаторы, а не стехиометрические реагенты. : Минимизируйте количество отходов, используя каталитические реакции. Катализаторы эффективны в небольших количествах и могут проводить одну реакцию много раз. Они предпочтительнее стехиометрических реагентов, которые используются в избытке и проводят реакцию только один раз.
10. Создавайте химикаты и продукты для разложения после использования. : Создавайте химические продукты так, чтобы они после использования разлагались на безвредные вещества, чтобы они не накапливались в окружающей среде.
11. Анализируйте в реальном времени, чтобы предотвратить загрязнение. : Включите внутрипроцессный мониторинг и контроль в реальном времени во время синтеза, чтобы минимизировать или исключить образование побочных продуктов.
12. Свести к минимуму вероятность аварий. : Разработайте химические вещества и их физические формы (твердые, жидкие или газообразные), чтобы минимизировать вероятность химических аварий, включая взрывы, пожары и выбросы в окружающую среду.
Начало страницы
Двенадцать принципов зеленой химии закладкиЗагрузите одностороннюю или двустороннюю закладку, показывающую двенадцать принципов зеленой химии.
Начало страницы
Корни зеленой химии в Законе о предотвращении загрязнения 1990 года
Прекращение загрязнения окружающей среды стало официальной политикой Америки в 1990 году, когда был принят Федеральный закон о предотвращении загрязнения.
Закон определяет сокращение источника как любую практику, которая:
- Снижает количество любого опасного вещества, загрязнителя или загрязняющего вещества, попадающего в поток отходов или иным образом выбрасываемого в окружающую среду (включая неконтролируемые выбросы) перед переработкой, обработкой или удалением.
- Снижает опасность для здоровья населения и окружающей среды, связанную с выбросом таких веществ, загрязнителей или загрязняющих веществ.
Термин «сокращение источника» включает:
- Модификации оборудования или технологий
- Изменения в процессе или процедурах
- Модификации, переформулировка или переработка продукции
- Замена сырья
- Улучшения в ведении домашнего хозяйства, техобслуживании, обучении или управлении запасами
Раздел 2 Закона о предотвращении загрязнения устанавливает иерархию предотвращения загрязнения, говоря:
- Конгресс настоящим заявляет, что национальной политикой Соединенных Штатов является предотвращение или уменьшение загрязнения у источника, когда это возможно;
- Загрязнение, которое невозможно предотвратить, по возможности следует перерабатывать экологически безопасным способом;
- Загрязнение, которое невозможно предотвратить или переработать, следует обрабатывать экологически безопасным способом, когда это возможно;
- Удаление или другие выбросы в окружающую среду должны использоваться только в крайнем случае и должны осуществляться экологически безопасным способом.
Зеленая химия направлена на разработку и производство конкурентоспособных по стоимости химических продуктов и процессов, которые достигают самого высокого уровня иерархии предотвращения загрязнения за счет снижения загрязнения в его источнике.
Для тех, кто создает и использует зеленую химию, иерархия выглядит так:
- Снижение источников и предотвращение химических опасностей
- Разработка химических продуктов, снижающих опасность для здоровья человека и окружающей среды *
- Производство химических продуктов из сырья, реагентов и растворителей, которые менее опасны для здоровья человека и окружающей среды *
- Разработка синтезов и других процессов с уменьшением или даже без химических отходов
- Разработка синтеза и других процессов, использующих меньше энергии или меньше воды
- Использование сырья, полученного из ежегодно возобновляемых ресурсов или из обильных отходов
- Разработка химических продуктов для повторного использования или переработки
- Повторное использование или переработка химикатов
- Обработка химикатов для снижения их опасности перед утилизацией
- Безопасная утилизация необработанных химикатов и только в том случае, если другие варианты невозможны
* Менее опасные для здоровья человека и окружающей среды химические вещества:
- Менее токсичен для организмов
- Меньше вреда для экосистем
- Не является стойким или биоаккумулирующимся в организмах или окружающей среде
- По своей природе более безопасны в обращении и использовании, поскольку они негорючие или взрывоопасные
Начало страницы
Как контролировать химические опасности на рабочем месте
Опасные химические вещества представляют ряд рисков для людей на рабочем месте.Чтобы снизить эти риски, необходимо профессионально контролировать риски, связанные с опасными веществами.
Контроль риска, связанного с опасными химическими веществами, является одной из четырех фаз методологии, которая используется для управления рисками, связанными с опасными химическими веществами на рабочем месте.
Методология управления рисками STOREMASTA
Риском опасных химических веществ можно управлять, следуя методологии STOREMASTA. Эта методология состоит из четырех этапов.Эти четыре фазы: Определить — Оценить — Контролировать — Поддержать.
Способ использования этой методологии для управления опасными химическими веществами на рабочем месте заключается в том, что вы должны сначала определить и оценить их потенциальные риски. Это необходимо сделать до внедрения каких-либо мер контроля для снижения рисков, связанных с опасными химическими веществами.
Выявление риска — это процесс, который включает выявление ситуаций, связанных с опасными химическими веществами, которые потенциально могут нанести вред людям.
После выявления потенциальных рисков, связанных с опасными химическими веществами, необходимо оценить риск. Оценка риска позволяет оценить, что произошло бы, если бы кто-то подвергся воздействию опасных химикатов. Оценка риска позволит вам рассчитать величину риска, определив серьезность и вероятность возникновения инцидента.
После того, как вы определили и оценили серьезность рисков, у вас будут ценные данные, которые позволят вам определить наилучшие методы, которые следует использовать для управления риском.
После внедрения средств контроля вы должны проверить их эффективность и настроить проактивную систему для поддержания их эффективности. Эта проактивная система обычно состоит из ряда периодически планируемых оценок рисков.
Теперь мы более подробно рассмотрим, как контролировать риск, связанный с опасными химическими веществами. Контроль рисков, связанных с опасными химическими веществами, должен осуществляться в соответствии с иерархией средств контроля.
Как контролировать риск, связанный с опасными химическими веществами
Как указано выше, управление рисками, связанными с опасными химическими веществами, состоит из четырех отдельных этапов.Третья фаза этого процесса — внедрение средств контроля для снижения рисков, связанных с опасными химическими веществами. Когда вы обдумываете, какие средства контроля использовать для снижения риска, связанного с опасными химическими веществами, вы должны следовать иерархии средств контроля.
Иерархия средств контроля — это система, описывающая хронологический порядок, в котором вы должны внедрять средства контроля для снижения химической опасности. Иерархия средств контроля ранжирует эффективность различных методов контроля риска: от тех, которые обеспечивают наивысший уровень защиты и надежности, до тех, которые обеспечивают наименьшую степень надежности и защиты.Эта иерархия элементов управления представлена ниже:
Ликвидация
Мера контроля риска, имеющая наибольший уровень эффективности, — устранение. Прежде чем рассматривать какие-либо другие меры контроля, сначала необходимо провести ликвидацию. Устранение — это метод полного устранения опасности или опасной практики с рабочего места. Вот некоторые примеры отказа от использования опасных химических веществ на рабочем месте:
- Устранение использования химического клея за счет использования таких крепежных элементов, как шурупы или гвозди.
- Исключение использования горючего газа для вилочных погрузчиков за счет использования вилочных погрузчиков с электроприводом вместо вилочных погрузчиков, работающих на сжиженном нефтяном газе.
Замена
Если вы не можете полностью отказаться от использования опасного химического вещества, вы должны попытаться заменить его. Замена — это когда вы заменяете использование опасного химического вещества другим химическим веществом, которое менее опасно и представляет меньший уровень риска.
Иногда бывает трудно добиться замены, потому что опасные свойства опасных химикатов часто делают их очень эффективными в производственных и химических процессах.Например, при окраске автомобилей распылением очень важно, чтобы разбавитель, используемый для разбавления краски, очень легко испарялся. Однако чем легче испаряется разбавитель для краски, тем более летучим он будет. Чем более летучим является вещество, тем ниже его температура воспламенения и тем легче оно воспламеняется в присутствии источника воспламенения.
Изоляция
Если невозможно заменить опасное химическое вещество другим, менее опасным, необходимо изолировать опасное химическое вещество от людей и других несовместимых веществ.Это можно сделать несколькими способами. Например; Если одна из частей производственного процесса связана с использованием опасного химического вещества, вы можете построить вентилируемый корпус над этой частью производственного процесса. Это ограждение не позволит переносимым по воздуху загрязнителям из этой области проникнуть в другие области производственного предприятия, где присутствуют люди. Загрязняющие вещества, переносимые по воздуху, которые образуются внутри этого корпуса, должны выводиться в атмосферу в безопасном месте, где люди не собираются.
Если на рабочем месте хранится большое количество опасных химикатов, вы можете изолировать эти опасные химические вещества от людей, храня их на открытом воздухе в соответствующем контейнере для хранения химикатов. Изоляция опасных химикатов от людей путем их хранения на открытом воздухе снижает риск причинения вреда людям в случае пожара на рабочем месте или разлива химикатов.
Опасные вещества также должны быть изолированы от других несовместимых веществ. Смешивание несовместимых веществ может привести к бурным химическим реакциям, которые могут нанести вред людям и имуществу.Несовместимые опасные вещества можно изолировать, храня их в отдельных шкафах для хранения химикатов и контейнерах для хранения опасных грузов.
Инженерный контроль
Если изоляция не может быть достигнута, вы можете реализовать ряд технических средств контроля, чтобы снизить риск, связанный с опасными химическими веществами. Технические средства контроля носят физический характер и представляют собой устройства или процессы, устраняющие воздействие опасных химических веществ. Технический контроль может быть использован для:
- Сведение к минимуму образования опасных химикатов
- Подавлять или содержать химические вещества
- Ограничить зону загрязнения в случае разлива
Технические средства контроля могут включать такие устройства, как системы механической вентиляции, соответствующие контейнеры для хранения химикатов или автоматизацию процессов, связанных с использованием опасных химикатов.
Административный контроль
Если риск все еще остается после внедрения средств контроля более высокого порядка, он должен быть уменьшен путем внедрения административного контроля. Административный контроль не так эффективен, потому что он не контролирует опасность в ее источнике. Административный контроль полагается на поведение и контроль человека.
Административный контроль — это письменные правила и процедуры, в которых изложены передовые методы работы для минимизации воздействия опасных химикатов.Эти политики могут включать такие вещи, как:
- Снижение количества людей, подвергающихся воздействию опасных химических веществ
- Сокращение продолжительности и частоты воздействия опасных химических веществ
- Уменьшение количества опасных химикатов, хранящихся на объекте, с помощью методов сокращения запасов, таких как как раз вовремя. поставка.
Средства индивидуальной защиты
Не следует полагаться на средства индивидуальной защиты (СИЗ) для контроля риска.СИЗ следует использовать только в крайнем случае, когда были применены другие более эффективные меры контроля и риск не был полностью устранен. СИЗ также можно использовать в качестве временной защиты до тех пор, пока не будут полностью внедрены средства контроля более высокого уровня. СИЗ также являются полезным способом дополнить средства контроля более высокого уровня при выполнении работ с высоким риском, таких как окраска распылением и абразивоструйная очистка. Некоторые примеры СИЗ могут включать; химически стойкие очки, защитные маски, химически стойкие перчатки и респираторное оборудование.
Следующие шаги
Опасные химические вещества создают множество рисков для людей на рабочем месте. Чтобы свести к минимуму негативные последствия этих опасностей, очень важно сначала внедрить наиболее эффективные меры контроля. Самый эффективный контроль в иерархии — исключение. Если исключение не может быть достигнуто, необходимо использовать следующие наиболее эффективные меры контроля, которые включают: замещение, изоляция и инженерный контроль. Средства контроля более низкого порядка, такие как административный контроль и СИЗ, не должны использоваться в качестве основного метода контроля риска, а должны дополнять средства контроля более высокого порядка.Если вам нужна дополнительная информация о том, как управлять рисками, связанными с опасными химическими веществами, загрузите нашу БЕСПЛАТНУЮ электронную книгу, щелкнув изображение ниже.
