Контрольная работа «Металлы» — химия, разное
Контрольная работа №1 по теме: «Металлы».
Вариант 1
ЧАСТЬ A. Тестовые задания c выбором ответа
1 (1 балл) Распределение электронов по энергетическим уровням в атоме магния:
A. 2е, 2е. Б. 2е, 4е B.2е, 3е. Г. 2е, 8е, 2е.
2 (1 балл) Число электронов на внешнем электронном слое y атомов щелочных металлов:
А.1. Б.2. В.3. Г.4.
3 (1балл). Тип химической связи в простом веществе литии:
A. Ионная. Б. Ковалентная полярная.
B. Ковалентная неполярная. Г. Металлическая.
4 (1 балл). Простое вещество c наиболее ярко выраженными металлическими свойствами:
A. Бериллий. B. Магний.
Б. Кальций. Г. Стронций.
5 (1 балл). Радиус атомов элементов 3-го периода c увеличением заряда ядра от щелочного металла к галогену:
A. Изменяется периодически. Б. Не изменяется.
B. Увеличивается. Г. Уменьшается.
6 (1 балл). Атом алюминия отличается от иона алюминия:
А. 3арядом ядра. В. Числом протонов.
Б. Радиусом частицы. Г. Числом нейтронов.
А. Калий Б. Кальций В. Скандий Г. Магний.
8 (1балл). С разбавленной серной кислотой не взаимодействует:
А. Железо Б. Никель В. Платина Г. Цинк
Железо Б. Никель В. Платина Г. Цинк
9 (1 балл). Гидроксид алюминия взаимодействует с веществом, формула которого:
А. КОН (р-р). В. КNОз (р-р).
Б. NaC1 (Р—
10 (1балл). Ряд, в котором все вещества реагируют с железом:
А. HC1, О2 , H2SO4. В. КОН, HgO, Н3РО4.
Б. СаО, НСl, НNОз. Г. Н2, О2, СО2.
ЧАСТЬ Б. 3адания со свободным ответом
11 (6 баллов). Составьте уравнения химических реакций, необходимых для осуществления превращений. В первой реакции укажите окислитель и восстановитель, для третьей составьте полное и сокращенное ионное уравнение.
Al→ Al2О3 → AlCl3 → Al(ОН)3 → Al(NОз)3
12 (3балла).Задача на примеси. Определите массу алюминия, который выделится при взаимодействии водорода с 200г оксида алюминия, содержащего 49% примесей.
Критерии оценивания работы.
Максимальное количество баллов-19(100%)
Выразим в процентном отношении:5(82-100%), 4(55-81%), 3(27-54%), 2(менее27%)
Критерии оценивания данной контрольной работы:
На «5»-от 16до19баллов
«4»-от 12до 15баллов
«3»-от 8до 11баллов
«2»-менее 8баллов
Контрольная работа№1 по теме «Металлы»
Вариант 2
ЧАСТЬ А. Тестовые задания с выбором ответа
Тестовые задания с выбором ответа
1 (1 балл). Распределение электронов по энергетическим уровням в атоме лития:
А. 2е, 3е. В. 2е, 4е.
Б. 2е, 1е. Г. 2е, 8е, 1е.
2 (1 балл). Число электронов на внешнем электронном слое у атомов щелочно-земельных металлов: А.1 Б.2. В.3. Г.4.
3 (1 балл). Простое вещество с наиболее ярко выраженными металлическими свойствами:
А. Алюминий. Б. Бор. В. Галлий. Г. Индий.
4 (1 балл). Вид химической связи в простом веществе железе:
А. Ионная. Б. Ковалентная полярная.
В. Ковалентная неполярная. Г. Металлическая.
5 (1 балл). Радиус атомов элементов главной подгруппы с увеличением заряда ядра:
А. Изменяется периодически. Б. Не изменяется.
В. Увеличивается. Г. Уменьшается.
6 (1 балл). Атом кальция отличается от иона кальция:
А. 3арядом ядра. Б. Числом электронов на внешнем энергетическом уровне.
В. Числом протонов. Г. Числом нейтронов.
7 (1 балл). Наиболее энергично реагирует с водой:
А. Барий. В. Магний.
Б. Кальций. Г. Стронций.
8 (1 балл). С соляной кислотой не взаимодействует:
А. Алюминий. В. Серебро.
Б. Магний. Г. Цинк.
9 (1балл). Гидроксид натрия взаимодействует с веществом, формула которого:
А. BaO. В. КСl
BaO. В. КСl
Б. Р2O5. Г. NaNO3
10 (1 балл). Ряд, в котором все вещества реагируют с железом:
А. НС1, СО2, СО.
Б. С12, СuС12, НС1.
В. Н2, O2, СаO.
Г. SO2, HC1, S.
ЧАСТЬ Б. 3адания со свободным ответом
11 (6 баллов). Составьте уравнения химических реакций, необходимых для осуществления превращений. В первой реакции укажите окислитель и восстановитель, для второй составьте полное и сокращенное ионное уравнение.
Fe → FeCl
12 (3балла). Задача на примеси. Определите массу железа, которое образуется при взаимодействии водорода с 200г оксида железа(+3), содержащего 20% примесей.
Критерии оценивания работы.
Максимальное количество баллов-19(100%)
Выразим в процентном отношении:5(82-100%) 4(55-81%), 3(27-54%), 2(менее27%)
Критерии оценивания данной контрольной работы:
На «5»-от 16до19баллов
«4»-от 12до 15баллов
«3»-от 8до 11баллов
«2»-менее 8баллов
Контрольная работа №1 по теме: «Металлы».
Вариант 3
ЧАСТЬ A. Тестовые задания c выбором ответа
1 (1 балл). Распределение электронов по энергетическим уровням в атоме алюминия:
Распределение электронов по энергетическим уровням в атоме алюминия:
A. 2е, 1е. Б. 2е, 4е B.2е, 3е. Г. 2е, 8е, 3е.
2 (1 балл). Степень окисления в соединениях у атомов щелочных металлов:
А. +1 Б. +2 В. +3 Г. +4
3 (1 балл). Тип химической связи в простом веществе кальция:
A.. Ковалентная полярная Б. Металлическая
B. Ковалентная неполярная Г. Ионная.
4 (1 балл). Простое вещество c наиболее ярко выраженными металлическими свойствами:
A. Натрий Б. Литий В. Калий Г. Франций
5 (1 балл). Число валентных электронов у элементов 3-го периода слева направо:
A. Изменяется периодически Б. Не изменяется B. Увеличивается Г. Уменьшается
6 (1 балл). Атом натрия отличается от иона натрия:
А. 3арядом ядра Б. Числом протонов
В. Числом электронов Г. Числом нейтронов
7 (1балл). Наиболее энергично реагирует с водой:
А. Алюминий Б. Кальций В. Барий Г. Магний
8 (1 балл). С разбавленной соляной кислотой взаимодействует:
А. Железо Б. Золото В. Серебро Г. Ртуть
9 (1 балл). Гидроксид натрия взаимодействует с веществом, формула которого:
А. КОН (р-р). В. КNОз (р-р).
Б. NaC1 (Р—Р). Г. Аl2(SO4)3.
10 (1балл). Ряд, в котором все вещества реагируют с кальцием:
А.. Н2, О2, СО2 В. КОН, HgO, Н3РО4.
Б. СаО, НСl, НNОз Г. h3О, О2, Cl2
ЧАСТЬ Б. 3адания со свободным ответом
11 (6 баллов). Составьте уравнения химических реакций, необходимых для осуществления превращений. В первой реакции укажите окислитель и восстановитель, для второй составьте полное и сокращенное ионное уравнение.
Zn→ ZnO→ ZnCl2 → Zn(OH)2 →ZnO
12 (3балла). Задача на примеси. Определите массу цинка, который образуется при взаимодействии водорода с 100г оксида цинка, содержащего 19% примесей.
Критерии оценивания работы.
Максимальное количество баллов-19(100%)
Выразим в процентном отношении:5(82-100%), 4(55-81%), 3(27-54%), 2(менее27%)
Критерии оценивания данной контрольной работы:
На «5»-от 16до19баллов
«4»-от 12до 15баллов
«3»-от 8до 11баллов
«2»-менее 8баллов
Контрольная работа№1 по теме «Металлы»
Вариант 4
ЧАСТЬ А. Тестовые задания с выбором ответа
1 (1балл). Распределение электронов по энергетическим уровням в атоме калия:
А. 2е, 8е, 8е, 1е В. . 2е, 8е, 18е, 8е, 1е
2е, 8е, 8е, 1е В. . 2е, 8е, 18е, 8е, 1е
Б. 2е, 1е Г. 2е, 8е, 1е
2 (1 балл). Число электронов на внешнем электронном слое у атома алюминия:
А. 1 Б. 2 В. 3 Г.4
3 (1 балл). Простое вещество с наиболее ярко выраженными металлическими свойствами:
А. Кальций Б. Барий В. Стронций Г. Радий
4 (1 балл). Вид химической связи в простом веществе алюминия:
А. Ионная Б. Ковалентная полярная
В. Металлическая Г. Ковалентная неполярная
5 (1балл). Число энергетических уровней у элементов одной подгруппы сверху вниз:
А. Изменяется периодически. Б. Не изменяется.
В. Увеличивается. Г. Уменьшается.
6 (1балл). Атом лития отличается от иона лития:
А. 3арядом ядра. Б. Числом электронов на внешнем энергетическом уровне.
В. Числом протонов. Г. Числом нейтронов.
7 (1 балл). Наименее энергично реагирует с водой:
А. Барий. В. Магний.
Б. Кальций. Г. Стронций
8 (1 балл). С раствором серной кислоты не взаимодействует:
А. Алюминий. В. Натрий
Б. Магний. Г. Медь
9 (1 балл). Гидроксид калия не взаимодействует с веществом, формула которого:
А. Na2O В. АlСl3
Б. Р2O5 Г. Zn(NO3)2
10 (1 балл). Ряд, в котором все вещества реагируют с железом:
Ряд, в котором все вещества реагируют с железом:
А. НС1, СО2, СО
Б. CO2, HC1, S
В. Н2, O2, СаO
Г. O2, СuSO4, Н2SO4
ЧАСТЬ Б. 3адания со свободным ответом
11 (6 баллов). Составьте уравнения химических реакций, необходимых для осуществления превращений. В первой реакции укажите окислитель и восстановитель, для третьей составьте полное и сокращенное ионное уравнение.
Ca→ CaO→ Ca(OH)2 → CaCl2 →CaCO3
12 (3балла). Задача на примеси. Определите массу оксида кальция, который образуется при разложении 250 г мрамора, содержащего 20% примесей
Критерии оценивания работы.
Максимальное количество баллов-19(100%)
Выразим в процентном отношении:5(82-100%),4(55-81%),3(27-54%),2(менее27%)
Критерии оценивания данной контрольной работы:
На «5»-от 16до19баллов
«4»-от 12до 15баллов
«3»-от 8до 11баллов
«2»-менее 8 баллов
Ответы
Вариант1
Часть 1
|
вопрос |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
ответ |
г |
а |
г |
г |
г |
б |
а |
в |
а |
а |
Часть 2
11. За каждую реакцию-1балл,окислитель,восстановитель-1балл;ионное уравнение-1балл.
За каждую реакцию-1балл,окислитель,восстановитель-1балл;ионное уравнение-1балл.
1) 4Al+O2=2AL2O3(AL- восстановитель ; O2-окислитель)-
2)AL2O3+6HCL=2ALCL3+3h3O
3)ALCL3+3NaOH=AL(OH)3+3NaCL(составлено ионное уравнение)
4)2AL(OH)3+3h3SO4=AL2(SO4)3+6h3O
12.Правильное оформление:условие задачи-1б,уравнение-1б,ответ-1балл.
|
Дано: |
Решение: |
|
m(AL2O3)=200 W(примесей)=49% M(AL2O3)=102г/моль М(Al)=27г/моль
|
1)уравнение AL2O3+3h3=2AL+3h3O
2)расчеты: 200*51/100=102 102*54/102=54г Ответ:54г |
|
Найти: M(AL)
|
Вариант2
Часть 1
|
вопрос |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
ответ |
б |
б |
г |
г |
в |
б |
а |
в |
б |
б |
Часть 2
11. За каждую реакцию-1балл,окислитель,восстановитель-1балл;ионное уравнение-1балл.
За каждую реакцию-1балл,окислитель,восстановитель-1балл;ионное уравнение-1балл.
1) 2Fe+3CL2=2FeCL3(Fe- восстановитель ; Cl2-окислитель)-
2) FeCL3+3NaOH=Fe(OH)3+3NaCL(составлено ионное уравнение)
3) 2Fe(OH)3=Fe2O3+3h3O
4) Fe2O3+3h3=2Fe+3h3O
12.Правильное оформление:условие задачи-1б,уравнение-1б,ответ-1балл.
|
Дано: |
Решение: |
|
m(Fe2O3)=200 W(примесей)=20% M(Fe2O3)=160г/моль М(Fe)=27г/моль Найти: M(Fe) |
1)уравнение Fe2O3+3h3=2Fe+3h3O 2)расчеты: 200*80/100=160 160*112/160=112г ответ112г |
Вариант3
Часть 1
|
вопрос |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
ответ |
г |
а |
б |
г |
в |
в |
в |
а |
г |
г |
Часть 2
11. За каждую реакцию-1балл,окислитель,восстановитель-1балл;ионное уравнение-1балл.
За каждую реакцию-1балл,окислитель,восстановитель-1балл;ионное уравнение-1балл.
1) 2Zn+O2=2ZnO(Zn- восстановитель ; O2-окислитель)-
2) ZnO +2HCL=ZnCL2+h3O
3) ZnCL2 +2NaOH=Zn(OH)2+2NaCL(составлено ионное уравнение)
4) Zn(OH)2=ZnO+h3O
12.Правильное оформление:условие задачи-1б,уравнение-1б,ответ-1балл.
|
Дано: |
Решение: |
|
m(ZnO)=100 W(примесей)=19% M(ZnO)=81г/моль М(Zn)=65г/моль Найти: M(Zn) |
1)уравнение ZnO+h3=Zn+h3O 2)расчеты: 100*81/100=81 81*65/81=65г ответ 65г |
Вариант4
Часть 1
|
вопрос |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
ответ |
а |
в |
г |
в |
в |
б |
в |
г |
а |
г |
Часть 2
11. За каждую реакцию-1балл,окислитель,восстановитель-1балл;ионное уравнение-1балл.
За каждую реакцию-1балл,окислитель,восстановитель-1балл;ионное уравнение-1балл.
1) 2Ca+O2=2CaO(Ca- восстановитель ; O2-окислитель)-
2) CaO +2h3O=Ca(OH)2
3) Ca(OH)2+2HCL=CaCL2+2h3O(составлено ионное уравнение)
4) CaCL2+h3CO3=CaCO3+2HCL
12.Правильное оформление:условие задачи-1б,уравнение-1б,ответ-1балл.
|
Дано: |
Решение: |
|
m(CaCO3)=250 W(примесей)=20% M(CaO)=56г/моль М(CaCO3)=65г/моль Найти: M(CaO) |
1)уравнение CaCO3=CaO+CO2 2)расчеты: 250*80/100=200 200*56/100=56г ответ 112г |
Контрольная работа по химии на тему: «Металлы» (9 класс) | Тест по химии (9 класс):
Контрольная работа по теме «Металлы»
9 класс
На выполнение контрольной работы по теме «Металлы» отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий.
Часть А включает 6 заданий базового уровня (А1 – А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За каждый правильный ответ дается 1 балл. Максимальный балл за часть А – 6 баллов.
Часть В состоит из 2 заданий повышенного уровня (В1 – В2), на которые надо дать краткий ответ в виде формулы и современного названия вещества, либо последовательности цифр. За каждый правильный ответ в задании В1 дается по 2 балла (1 балл за формулу вещества и 1 балл за его химическое название). Максимальный балл за задание В1 – 8 баллов. За каждый правильный ответ в задании В2 дается по 1 баллу. Максимальный балл за задание В2 – 4 балла.
Часть С содержит два наиболее сложных, объемных заданий. Задание С1 требует полного ответа, а именно записи уравнений химических реакций согласно генетическому ряду соединений металлов. За каждое правильно составленное уравнение реакции можно получить по 1 баллу. Максимальный балл за задание С1 – 4 балла. Задание С2 требует представления полного решения задачи. За правильное решение расчетной задачи С2 (содержит 4 проверяемых элемента содержания) можно получить 4 балла.
1 вариант
Часть А. Выполните тестовые задания.
А 1. Электронная формула атома магния:
1) 1s2 2s2 2) 1s2 2s2 2p1 3) 1s2 2s3 4) 1s2 2s2 2p6 3 s2
А 2. Простое вещество с наиболее ярко выраженными металлическими свойствами:
1) литий 2) кальций 3) калий 4) алюминий
А 3. Наиболее энергично взаимодействует с водой металл:
1) натрий 2) кальций 3) литий 4) калий
А 4. С разбавленной серной кислотой не взаимодействует:
1) железо 2) медь 3) магний 4) цинк
А 5. Тип химической связи в простом веществе натрии:
1) ионная 2) металлическая 3) ковалентная полярная 4) ковалентная неполярная
А 6. Верны ли следующие суждения о щелочных металлах?
А. Во всех соединениях щелочные металлы имеют степень окисления + 1.
Б. Щелочные металлы хранят под слоем керосина, либо вазелина
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения не верны
Часть В.
В1. Заполните таблицу:
Техническое название вещества | Химическая формула вещества | Химическое название вещества |
1) Едкий натр | ||
2) Негашенная известь | ||
3) Жжённая магнезия | ||
4) Кристаллическая сода |
В2. Установите соответствие между исходными веществами и продуктами реакции
Исходные вещества Продукты реакции
А) Ca(OH)2 + SO3 1) BaSO4 +NaCl
Б) CaO + SO3 2) NaOH + h3
В) Na2SO4 + BaCl2 3) CaSO4 + h3O
Г) Na + h3O 4) Na2O + h3
5) CaSO4
Ответ:
Часть С. Дайте развернутый ответ на вопрос.
С1. Осуществите цепочку превращений и назовите продукты реакций:
1 2 3 4
Вa(OH)2 ← Вa → ВaO → Вa (OH)2 → ВaSO4
С2. Решите задачу.
Какой объём водорода может быть получен при растворении в воде 80 граммов кальция, если выход газа составил 60% от теоретически возможного?
2 вариант
Часть А. Выполните тестовые задания.
А 1. Электронная формула атома алюминия:
1) 1s2 2s2 2) 1s2 2s2 2p1 3) 1s2 2s2 2p6 3s1 4) 1s2 2s2 2p6 3s2 3p1
А 2.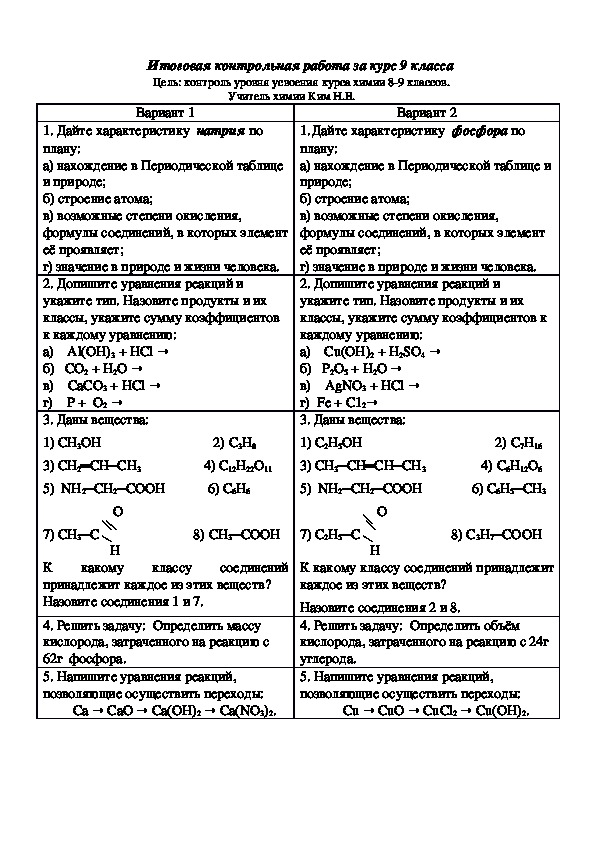 Простое вещество с наиболее ярко выраженными металлическими свойствами:
Простое вещество с наиболее ярко выраженными металлическими свойствами:
1) железо 2) литий 3) калий 4) алюминий
А 3. Наиболее прочная оксидная пленка образуется у металла:
1) натрия 2) железа 3) алюминия 4) магния
А 4. С концентрированной серной кислотой не взаимодействует металл (то есть пассивируется):
1) медь 2) железо 3) магний 4) цинк
А 5. При взаимодействии щелочных металлов с неметаллами 7 группы (А) образуются вещества с типом химической связи:
1) ионной 2) металлической 3) ковалентной полярной 4) ковалентной неполярной
А 6. Верны ли следующие суждения об алюминии?
А. Во всех соединениях алюминий имеет степень окисления + 2.
Б. Оксид и гидроксид алюминия проявляют амфотерные свойства.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения не верны
Часть В.
В1. Заполните таблицу:
Техническое название вещества | Химическая формула вещества | Химическое название вещества |
1) Едкое кали | ||
2) Гашенная известь | ||
3) «Баритовая каша» | ||
4) Горькая (английская) соль |
В2. Установите соответствие между исходными веществами и продуктами реакции
Исходные вещества Продукты реакции
А) NaOH + CO2 1) Na [Al (OH)4 ]
Б) BaO + SO3 2) KOH + h3
В) Al(OH)3 + NaOH 3) BaSO4 + h3O
Г) K + h3O 4) Na2CO3 + h3O
5) BaSO4
Ответ:
Часть С. Дайте развернутый ответ на вопрос.
Дайте развернутый ответ на вопрос.
C1. Осуществите цепочку превращений и назовите продукты реакций:
1 2 3 4
К→ К2O2 → К2O → КOН → К2SO4
С2. Решите задачу.
Какой объём водорода может быть получен при взаимодействии 48 граммов магния с соляной кислотой, если выход газа составил 80% от теоретически возможного?
9 класс Контрольная работа по теме: «МЕталлы»
Контрольная работа по теме: «Металлы».
1 вариант
Часть 1
При выполнении заданий этой части работы обведите кружочком тот вариант ответа, который вы выбрали как правильный.
О железе как о простом веществе говорится в предложении
железо входит в состав гемоглобина
яблоки содержат железо
алюминий вытесняет железо из растворов его солей
железо входит в состав железной окалины
Количество электронов на внешнем уровне атома алюминия равно
1) 1 2) 2 3) 3 4) 4
Ион, в составе которого 20 протонов и 18 электронов имеет заряд
1) 2- 2) 4+ 3) 3+ 4) 2+
Металлическую кристаллическую решетку имеет
1) йод 2) медь
3) поваренная соль 4) кремний
Реакция взаимодействия цинка с соляной кислотой относится к реакциям
окислительно-восстановительным, обмена
обратимым, замещения
окислительно-восстановительным, замещения
необратимым, обмена
6. Ионы серебра Аg+ можно обнаружить в растворе с помощью
1) нитрата серебра 2) соляной кислоты 3) гидроксида натрия 4) лакмуса
Алюминий вступает во взаимодействие с
нитратом бария
сульфатом меди (II)
хлоридом калия
сульфатом кальция
Схеме превращений веществ
металл→ основный оксид→ соль→ металл
соответствуют левые части уравнений химических реакций под номерами
а) СuО + НСl→ б) Сu + О2 → в) CuO + H2→ г) CuCl2 + Fe →
1) а, б, в 2) б, в, г 3) а, в, г 4) б, а, г
Часть 2
Металлические свойства ярче выражены у
1) калия 2) бериллия 3) бария 4) кальция
При выполнении задания 10 запишите в алфавитном порядке буквы, соответствующие выбранному вами ответу.
В системе Fe2O3(T) + 3CO(Г) ↔ 2Fe(T) + 3CO2(Г)+ Q на смещение химического равновесия в сторону продуктов реакции не влияет
А) понижение температуры
Б) уменьшение концентрации CO2
В) повышение давления
Г) увеличение концентрации CO2
Д) катализатор
При взаимодействии цинка массой 13 г с кислородом образовалось________ г оксида. (запишите в ответе число с точностью до целых).
Часть 3
Смесь медных и алюминиевых стружек массой 5 г обработали разбавленной серной кислотой, взятой в избытке. При этом выделилось 3 л (н.у.) водорода. Какова массовая доля металлов в исходной смеси?
Контрольная работа по теме: «Металлы».
2 вариант
Часть 1
При выполнении заданий этой части работы обведите кружочком тот вариант ответа, который вы выбрали как правильный.
К сложным веществам относится каждое из веществ группы
серная кислота, хлорид натрия, спирт, озон
кремний, фосфор, сера, железная окалина
соляная кислота, гидроксид натрия, оксид фосфора, мел
вода, алмаз, железо, графит
Щелочью является гидроксид элемента, который в ПСХЭ находится
1) в 3-м периоде, IIIА группе 2) в 4-м периоде, IА группе
3) во 2-м периоде, IIА группе 4) в 3-м периоде IIА группе
В атоме брома число электронных слоев и число электронов внешнего слоя соответственно равны
1) 4, 5 2) 3, 7 3) 4, 7 4) 4, 6
Самым пластичным является вещество, у которого кристаллическая решетка
1) молекулярная 2) ионная
3) атомная 4) металлическая
К окислительно-восстановительным не относится реакция, уравнение которой
CuCl2 + Fe = FeCl2 + Cu
CuO + H2SO4 = CuSO4 + H2O
2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
2Na + 2H2O = 2NaOH + H2↑
Реактивом на катион Ва2+ является раствор
1) гидроксида натрия 2) соляной кислоты 3) нитрата серебра 4) серной кислоты
Гидроксид цинка взаимодействует с каждым из двух веществ:
с нитратом бария и соляной кислотой
с соляной кислотой и гидроксидом натрия
хлоридом калия и гидроксидом калия
с магнием и азотной кислотой
С помощью соляной кислоты можно осуществить превращение
1) Сu → CuCl2 2) Fe → FeCl3 в) Na2SO4 → NaСl г) Fe → FeCl2
Часть 2
Металлические свойства усиливаются в ряду элементов
1) B → Be → Li 2) O → N → C 3) As → P → N 4) Se → S → O
При выполнении задания 10 запишите в алфавитном порядке буквы, соответствующие выбранному вами ответу.
Необратимые химические реакции возможны между веществами
А) хлорид железа(II) и нитрат кальция
Б) цинк и серная кислота
В) оксид меди (II) и азотная кислота
Г) гидроксид бария и хлорид калия
Д) медь и сульфат железа (II)
При восстановлении 0,5 моль оксида меди (II) водородом образуется ________ г меди и вода. (в ответе число с точностью до целых).
Часть 3
Какой объем водорода выделится при взаимодействии 30 г технического кальция, содержащего 10% примесей и воды
Контрольная работа по химии на тему: «Металлы» (9 класс)
Контрольная работа №1. «Периодический закон и строение вещества».
Назначение контрольной работы: оценить уровень освоения каждым обучающимся класса содержания учебного материала по темам: Строение атома, строение электронных оболочек атомов первых20 элементов Периодической системы Д.И. Менделеева. Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов Д.И. Менделеева, Атомы и молекулы. Химический элемент. Простые и сложные вещества. Химическая реакция. Условия и признаки протекания химических реакций, химические свойства веществ.
Спецификация КИМ для проведения контрольной работы
Каждый вариант контрольной работы содержит 11 заданий. Задания 1-8 оцениваются 1 баллом. Задания 9-10 оцениваются максимально 2 баллами. Задание 13 – максимальный балл 3.На выполнение контрольной работы отводится 45 минут.
Распределение заданий по уровням сложности, проверяемым элементам, уровню подготовки, типам заданий и времени выполнения представлено в таблице.
1 вариант
1. Шесть электронов находятся во внешнем электронном слое атома
Шесть электронов находятся во внешнем электронном слое атома
1) бора 2) углерода 3) фосфора 4) серы
2. В каком ряду химических элементов усиливаются металлические свойства соответствующих им простых веществ?
1) калий → натрий → литий
2) сурьма → мышьяк → фосфор
3) углерод → кремний → германий
4) алюминий → кремний → углерод
3. Какой вид химической связи в оксиде натрия?
1) ковалентная неполярная
2) металлическая
3) ковалентная полярная
4) ионная
4. Низшие степени окисления азота и серы соответственно равны
1) −З и −2 2) +1 и +2
3) +3 и + 2 4) −1 и −2
5. Названия только простых веществ записаны в ряду:
1) оксид магния, оксид серы(IV)
2) углекислый газ, угарный газ
3) железо, аммиак
4) цинк, графит
6. Как определяется место химического элемента в периодической системе Д.И. Менделеева?
1) количеством электронов на внешнем уровне
2) количеством нейтронов в ядре
3) зарядом ядра атома
4) атомной массой
7. Чем отличаются атомы изотопов одного элемента?
1) числом протонов
2) числом нейтронов
3) числом электронов
4) зарядом ядра
8.Какой элемент возглавляет главную подгруппу пятой группы?
1) ванадий 2) азот 3) фосфор 4) мышьяк
9. При выполнении задания из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны.
В ряду химических элементов алюминий-магний натрий происходит уменьшение (ослабление)
1) числа электронов на внешнем энергетическом уровне
2) числа электронных слоев в атомах
3) металлических свойств
4) степени окисления в высших оксидах
5) основного характера свойств высших гидроксидов
10. При выполнении задания из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны.
Среди химических элементов C,N,O
1) наименьший радиус имеет атом углерода
2) наибольшую электроотрицательность имеет кислород
3) только у углерода высшая степень окисления равна номеру группы
4) отрицательную степень окисления может иметь только кислород
5) углерод и азот образуют высшие оксиды с кислотными свойствами
11. Установите соответствие между названием вещества и типом химической связи.
Название вещества Тип химической связи
А) хлорид натрия 1) ионная
Б) кислород 2) ковалентная полярная
В) алюминий 3) ковалентная неполярная
4) металлическая
Ответы:
1)4
2)2
3)2
4)1
5)4
6)3
7)2
8)2
9) 14
10) 25
11) 134
Перевод баллов к 5-бальной отметке представлен в таблице
БаллыОтметка
14-15 баллов
«5»
11-13 баллов
«4»
8-12 баллов
«3»
0 – 7 баллов
«2»
Контрольная работа №2. «Металлы».
Предмет: химия
Класс: 9
Вид контроля: текущий
Назначение контрольной работы: оценить уровень освоения каждым обучающимся класса содержания учебного материала по темам: Положение металлов в Периодической системе Д.И.Менделеева и строение их атомов. Физические свойства металлов. Сплавы. Химические свойства металлов. Получение металлов. Щелочные металлы. Бериллий, магний и щелочноземельные металлы. Алюминий. Железо.
Спецификация КИМ для проведения контрольной работы
Каждый вариант контрольной работы состоит из 3 частей (А,B,C). Часть А содержит 6 тестовых заданий, которые оцениваются 1 баллами. Часть B имеет одно задание на соответвие, которое оценивается 2 баллами. Часть С содержит 2 задания (цепочка, задача) и оценивается 5 и 3 баллами соответственно. На выполнение контрольной работы отводится 45 минут.
Распределение заданий по уровням сложности, проверяемым элементам, уровню подготовки, типам заданий и времени выполнения представлено в таблице.
Часть А1
Базовый
1
3 мин
2
Базовый
1
3 мин
3
Базовый
1
3 мин
4
Базовый
1
3 мин
5
Базовый
1
3 мин
6
Базовый
1
3 мин
Часть В
1
Базовый
2
5 мин
Часть С
1
Повышенный
5
11 мин
2
Повышенный
3
11 мин
1 вариант
Часть А.
Электронная формула атома кремния:1)1s22s2 2) 1s22s2 2p63s2 3) 1s22s2 2p63s1 4) 1s22s2 2p63s23p2
А2
В каком ряду химические элементы расположены в порядке ослабления металлических свойств?
1) Li, K, Rb 2) Al, Mg, K
3) Ca, Mg, Li 4) K, Ca, Be
А3
Металл, обладающий самой высокой электропроводностью, — это
1) железо 2) медь 3) серебро 4) алюминий
А4
Не взаимодействует с раствором серной кислоты
1) цинк 2) серебро
3) никель 4) железо
А5
Гидроксид цинка взаимодействует с каждым из двух веществ:
1) HCl и CO2 2) NaOH и H2SO4 3) SiO2 и KOH 4) NaNO3 и H2SO4
А6
Методы переработки руд, основанные на восстановлении металлов из оксидов при высоких температурах, называются: 1) гидрометаллургия 2) пирометаллургия 3) электрометаллургия 4) гальваностегия
Часть В.
Задание части В на установление соответствия. Запишите в таблицуцифры выбранных вами ответов.
В1.
Установите соответствие между веществами, вступающими в реакцию
и продуктами их взаимодействия
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) СаO + CO2 1) Ca(OH)2
Б) Ca(OH)2+ SO2 2) CaCO3+ H2O
В) Ca + H2O 3) CaSO4+ H2O
Г) Ca (HCO3)2 + Ca(OH)2 4) Ca(OH)2 + H2
5) CaSO3 + H2O
6) CaCO3
Часть С.
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
FeFeCl3Fe(OH)3Fe2O3FeFeCl2.
C2. При взаимодействии 12 г технического магния, содержащего 5% примесей, с избытком соляной кислоты, выделилось 10 л водорода (н.у.). Вычислите объемную долю выхода продукта реакции.
Ответы:
Часть А
1)4
2) 4
3) 3
4) 2
5) 2
6) 2
Часть В
6542
Часть С
1)Элементы ответа:
2Fe + 3Cl2 → 2FeCl3
FeCl3 + 3КОН → Fe(OH)3 + 3КCl
2Fe(OH)3 →Fe2O3 + 3Н2О
Fe2O3 + 3Н2 →2Fe + 3Н2О
Fe + 2НCl = FeCl2 + Н2
2. Mg +2HCl = MgCl2 + H2
m(Mg)= 12г * 0,95 = 11,4г
(Н2) = (Mg) = 11,4 /24 = 0,475моль
V(H2)= 0,475 моль*22,4 л/моль = 10,64л теория
w (выхода) = 10л/10,64л = 0,94 или 94%
Перевод баллов к 5-бальной отметке представлен в таблице
Итоговая контрольная работа по теме «Металлы»
Двухвариантная контрольная работа по теме «Металлы» носит обобщающий характер: строение вещества, физические и химические свойства металлов, способы их получения.
Просмотр содержимого документа
«Итоговая контрольная работа по теме «Металлы»»
КОНТРОЛЬНАЯ РАБОТА ПО ТЕМЕ «МЕТАЛЛЫ»
Вариант 1
Охарактеризуйте алюминий, исходя из его положения в ПСХЭ Д.И. Менделеева
Сравните металлические свойства элементов с порядковыми номерами 19 и 20. Укажите причины.
Предложите 3 способа получения хлорида железа (II)
Допишите химические реакции:
Любое уравнение реакции разберите как ОВР
Na + O2 →
Fe + Cl2 →
Ba + HOH →
Mg + серная кислота →
Осуществите цепочку превращений:
Mg → MgCl2 → Mg(OH)2 → MgO → MgSO4
AgCl → Ag
КОНТРОЛЬНАЯ РАБОТА ПО ТЕМЕ «МЕТАЛЛЫ»
Вариант 2
Охарактеризуйте магний, исходя из его положения в ПСХЭ Д.И. Менделеева
Сравните металлические свойства элементов с порядковыми номерами 11 и 19. Укажите причины.
Предложите 3 способа получения хлорида железа (III)
Допишите химические реакции:
Любое уравнение реакции разберите как ОВР
Na + HOH →
Ca + азотная кислота →
Fe + HCl →
Fe + O2 →
Осуществите цепочку превращений:
Na → Na2O2 → Na2O → Na2SO4→ BaSO4
NaOH + Al(OH)3 →
КОНТРОЛЬНАЯ РАБОТА ПО ТЕМЕ «МЕТАЛЛЫ»
Вариант 1
Охарактеризуйте алюминий, исходя из его положения в ПСХЭ Д.И. Менделеева
Сравните металлические свойства элементов с порядковыми номерами 19 и 20. Укажите причины.
Предложите 3 способа получения хлорида железа (II)
Допишите химические реакции:
Любое уравнение реакции разберите как ОВР
Na + O2 →
Fe + Cl2 →
Ba + HOH →
Mg + серная кислота →
Осуществите цепочку превращений:
Mg → MgCl2 → Mg(OH)2 → MgO → MgSO4
AgCl → Ag
КОНТРОЛЬНАЯ РАБОТА ПО ТЕМЕ «МЕТАЛЛЫ»
Вариант 2
Охарактеризуйте магний, исходя из его положения в ПСХЭ Д.И. Менделеева
Сравните металлические свойства элементов с порядковыми номерами 11 и 19. Укажите причины.
Предложите 3 способа получения хлорида железа (III)
Допишите химические реакции:
Любое уравнение реакции разберите как ОВР
Na + HOH →
Ca + азотная кислота →
Fe + HCl →
Fe + O2 →
Осуществите цепочку превращений:
Na → Na2O2 → Na2O → Na2SO4→ BaSO4
NaOH + Al(OH)3 →
Контрольная работа по теме «Металлы» 9 класс
9класс.
Контрольная работа №2 по теме «Металлы».
Вариант 1.
Часть А.
При выполнении заданий выберите номер одного правильного ответа.
1.Наиболее сильные восстановительные свойства проявляет
а) K б) Mg в) Li г) Na
2.Ряд, в котором элементы расположены в порядке возрастания их атомного радиуса:
а) B→Be→Li в) K→Na→Li
б) Mg→Ca→Be г) Na→Mg→Al
3.Электронная конфигурация внешнего электронного слоя….2s22p1 соответствует атому
а) алюминия б) бора в) скандия г) калия
4.Реактивом на катион Al3+ является
а) Сl— б) Na+ в) OH— г) CO32-
5.Наиболее активно с водой при комнатной температуре будут взаимодействовать оба металла из пары
а) Na и Cu б) Li и Na в) K и Mg г) Cu и Hg
6.С растворами кислот будут взаимодействовать оба металла
а) Li и Ag б) Na и Hg в) K и Mg г) Cu и Hg
7. При взаимодействии железа с водой при нагревании образуется
а) соль и вода в) оксид металла и водород
б) основание и водород г) реакция не протекает
8. С водой с образованием основания и водорода будет взаимодействовать
а) Са б) Сu в) Zn г) Ag
9. Амфотерный оксид образуется при взаимодействии кислорода и
а) натрия б) меди в) магния г) бериллия
10. Для вытеснения меди из раствора ее соли можно использовать
а) натрий б) серебро в) кальций г) железо
Часть В.
В1.Установите соответствие между правой и левой частями уравнений
1) Сu+HNO3конц.→ | А) FeCl3+H2↑ |
2) Fe+HСl→ | Б) FeCl2+H2↑ |
3) Fe+Cl2→ | B) FeCl2 |
4) Cu+HNO3разб.→ | Г) FeCl3 |
Д) Cu(NO3)2 +NO↑+H2O Е) Cu(NO3)2 +NO2↑+H2O |
В2. Напишите уравнения реакций, соответствующих превращениям, укажите типы и условия их протекания:
Al→Al2O3→AlCl3→Al(OH)3→Al2(SO4)3→Al(NO3)3
↓
NaAlO2
В3. Рассчитайте объем, количество вещества и массу водорода, полученного при взаимодействии 80г кальция с водой?
9класс.
Контрольная работа №2 по теме «Металлы».
Вариант 2.
Часть А.
При выполнении заданий выберите номер одного правильного ответа.
1. Наиболее сильные восстановительные свойства проявляет
а) К б) Al в) Na г) Zn
2.Ряд, в котором элементы расположены в порядке уменьшения их атомного радиуса:
а) Al→Mg→Na в) Li→Na→K
б) Ca→Ba→Be г) Ca→ Mg→Be
3.Электронная конфигурация внешнего электронного слоя….3s23p1 соответствует атому
а) алюминия б) бора в) скандия г) калия
4.Реактивом на ион Ca2+ является ион
а) Сl— б) Na+ в) OH— г) CO32-
5. Наиболее активно с водой при комнатной температуре будут взаимодействовать оба металла из пары
а) K и Cu б) Na и K в) Na и Zn г) Cu и Hg
6.С растворами кислот будут взаимодействовать оба металла
а) K и Cu б) Na и Hg в) K и Zn г) Cu и Hg
7. При взаимодействии цинка с водой при нагревании образуется
а) соль и вода в) оксид металла и водород
б) основание и водород г) реакция не протекает
8. С водой с образованием оксида металла и водорода при нагревании будет взаимодействовать
а) Na б) Fe в) Cu г) Ag
9. Амфотерный оксид образуется при взаимодействии кислорода и
а) натрия б) алюминия в) магния г) бария
10. Для вытеснения меди из раствора её соли можно использовать
а) калий б) литий в) цинк г) натрий
Часть В.
В1. Установите соответствие между правой и левой частями уравнений
1) Сu +H2SO4разб.→ | А) Al(OH)3+H2↑ |
2) Сu +H2SO4конц.→ | Б) не взаимодействует |
3)Al+H2O→ | B) СuSO 4 + SO2↑ + H2O |
4)Al2O3+HCl→ | Г) AlCl3+H2O |
Д) AlCl3+H2↑ Е) СuSO4 + H 2S↑ + H2O |
В2. Напишите уравнения реакций, соответствующих превращениям, укажите условия их протекания:
Na→Na2O2 →Na2O→NaOH→Na3PO4→NaNO3. Укажите типы реакции.
Na2CO3
В3. Рассчитайте объем, количество вещества и массу газа, полученного при взаимодействии 3,5 г лития с водой.
Ответы к тесту:
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |
В-1 | в | а | б | в | б | в | в | а | г | г |
В-2 | а | г | а | г | б | в | в | б | б | в |
В1. Вариант 1 В2. Вариант 2
В2. Вариант 1
1. 4Al+3O2 = 2 Al2O3
2. Al2O3 +6 HC l = 2 AlCl3+3H2O
3. AlCl3 + 3NaOH = Al(OH)3 +3NaCl
4. 2Al(OH)3 + 3 H2SO4 = Al2(SO4)3 + 6 H2O
5. Al2(SO4)3 +3Ba (NO3)2 = 3Ba SO4 + 2 Al(NO3)3
6. Al(OH)3 +NaOH = NaAlO2 + 2 H2O (сплавление)
В3. Вариант 1 Ответ: 44.8 л , 2моль и 4г водорода
В2 Вариант2
2Na + О2= Na2O2
Na2O2 + 2Na = 2Na2O
Na2O + H2O = 2 NaOH
3 NaOH + Н3PO4 = Na3PO4 + 3 H2O
Na3PO4 +3AgNO3 = Ag3PO4 + 3NaNO3
2NaOH + CO2 = Na2CO3 + H2O
В3 Вариант 2 5,6л, 0,25 моль, 0.5г водорода
Контрольная работа по теме Металлы
9 класс
Контрольная работа № 1
по теме: «Металлы»
Вариант I
ЧАСТЬ А. Тестовые задания с выбором ответа
1 (2 балла). Электронная формула атома магния:
А. ) В. ) )
22 3
Б. ) )Г.) ) )
2 22 8 2
2 (2 балла). На внешнем энергетическом уровне атомов элементов главной подгруппы II группы Периодической системы электронов:
А. 1. В. 3.
Б. 2. Г. 4.
3 (2 балла). Тип химической связи в простом веществе литии:
А. Ионная.
Б. Ковалентная полярная.
В. Ковалентная неполярная.
Г. Металлическая.
4 (2 балла). Простое вещество с наиболее ярко выраженными металлическими свойствами:
А. Бериллий. В. Магний.
Б. Кальций. Г. Стронций.
5 (2 балла). Радиус атомов элементов 3-го периода с увеличением заряда ядра от щелочного металла к галогену:
А. Изменяется периодически.
Б. Не изменяется.
В. Увеличивается.
Г. Уменьшается.
6 (2 балла). Атом алюминия отличается от иона алюминия:
А. Зарядом ядра. В. Числом протонов.
Б. Радиусом частицы. Г. Числом нейтронов.
7 (2 балла). Наиболее энергично реагирует с водой:
А. Калий. Б. Кальций. В. Скандий. Г. Магний.
8 (2 балла). С разбавленной серной кислотой не взаимодействует:
А. Железо. Б. Никель. В. Платина. Г. Цинк.
9 (2 балла). Гидроксид бериллия взаимодействует с веществом, формула которого:
А. KOH. В. KNO3 (р-р).
Б. NaCl (р-р). Г. ВаSO4.
10 (2 балла). Ряд, в котором все вещества реагируют с цинком:
А. HCl, NаОН, Н2SO4. В. КОН, НgO, Н3Р04.
Б. СаО, НСI, HNO3. Г. Н2, O2, СО2.
ЧАСТЬ Б. Задания со свободным ответом
11 (9 баллов). Предложите три способа получения гидроксида калия. Ответ подтвердите уравнениями реакций.
12 (6 баллов). Определите вещества Х, Y,Z, запишите их химические формулы.
t + H2SO4 + NaOH + HNO3
Сu(ОН)2 X Y ZCu(NO3)2
13 (6 баллов). Как, используя любые реактивы (вещества) и барий, получить оксид, основание, соль? Составьте уравнения реакций в молекулярном виде.
14 (4 балла). Расположите металлы: железо, олово, вольфрам, свинец в порядке увеличения относительной твердости (рис. 1).
Рис. 1. Относительная твердость металлов
15 (5 баллов). Рассчитайте массу металла, который можно получить из 144 г оксида железа (II).
9 класс
Контрольная работа № 1
по теме: «Металлы»
Вариант II
ЧАСТЬ А. Тестовые задания с выбором ответа
1 (2 балла). Электронная формула атома лития:
А. ) ) В. ) )
2 22 3
Б. ) )Г. ) ) )
2 12 8 1
2 (2 балла). На внешнем энергетическом уровне атомов щелочных металлов электронов:
А. 1. В. 3.
Б. 2. Г. 4.
3 (2 балла). Вид химической связи в простом веществе натрии:
А. Ионная.
Б. Ковалентная полярная.
В. Ковалентная неполярная.
Г. Металлическая.
4 (2 балла). Простое вещество с наиболее ярко выраженными металлическими свойствами:
А. Алюминий. Б. Бор.В. Галлий. Г. Индий.
5 (2 балла). Радиус атомов элементов главной подгруппы с увеличением заряда ядра:
А. Изменяется периодически.
Б. Не изменяется.
В. Увеличивается.
Г. Уменьшается.
6 (2 балла). Атом кальция отличается от иона кальция:
А. Зарядом ядра.
Б. Числом электронов на внешнем энергетическом уровне.
В. Числом протонов.
Г. Числом нейтронов.
7 (2 балла). Наиболее энергично реагирует с водой:
А. Барий. Б. Кальций. В. Магний. Г. Стронций.
8 (2 балла). С соляной кислотой не взаимодействует:
А. Алюминий. Б. Магний. В. Серебро. Г. Цинк.
9 (2 балла). Гидроксид алюминия взаимодействует с веществом, формула которого:
А. ВаSO4. В. КСI(p-p).
Б. NаОН. Г. NaNO3(p-p).
10 (2 балла). Ряд, в котором все вещества реагируют с железом:
А. НСI, СО2, СО.
Б. Сl2, СuСl2, НСl.
В. Н2, O2, СаО.
Г. SiO2, НСl, S.
ЧАСТЬ Б. Задания со свободным ответом
11 (9 баллов). Предложите три способа получения гидроксида кальция. Ответ подтвердите уравнениями реакций.
12 (6 баллов). Определите вещества Х, Y,Z, запишите их химические формулы.
+ O2 + HCl + NaOH t
Zn X Y ZZnO
13 (6 баллов).Как, используя любые реактивы (вещества) и литий, получить оксид, основание, соль? Составьте уравнения реакций в молекулярном виде.
14 (4 балла). Расположите металлы: алюминий, свинец, золото, медь в порядке увеличения относительной электропроводности (рис. 2).
Рис. 2. Относительная электропроводность металлов
15 (5 баллов). Рассчитайте массу металла, который можно получить из 80 г оксида железа (III).
9 класс
Контрольная работа № 1
по теме: «Металлы»
Вариант III
ЧАСТЬ А. Тестовые задания с выбором ответа
1 (2 балла). Электронная формула атома натрия:
А. ) ) ) В. ) )
2 8 42 3
Б. ) ) )Г. ) )
2 8 12 7
2 (2 балла). На внешнем энергетическом уровне атомов элементов главной подгруппыIII группы Периодической системы электронов:
А. 1. В. 3.
Б. 2. Г. 4.
3 (2 балла). Вид химической связи в простом веществе кальции:
А. Ионная.
Б. Ковалентная полярная.
В. Ковалентная неполярная.
Г. Металлическая.
4 (2 балла). Простое вещество с наиболее ярко выраженными металлическими свойствами:
А. Алюминий. В. Магний.
Б. Кремний. Г. Натрий.
5 (2 балла). Радиус атомов элементов 2-го периода с увеличением заряда ядра от щелочного металла к галогену:
А. Изменяется периодически.
Б. Не изменяется.
В. Увеличивается.
Г. Уменьшается.
6 (2 балла). Атом магния отличается от иона магния:
А. Зарядом ядра.
Б. Зарядом частицы.
В. Числом протонов.
Г. Числом нейтронов.
7 (2 балла). Наиболее энергично реагирует с водой:
А. Калий. Б. Литий. В. Натрий. Г. Рубидий.
8 (2 балла). С разбавленной серной кислотой не взаимодействует:
А. Алюминий. Б. Барий.В. Железо. Г. Ртуть.
9 (2 балла). Гидроксид бериллия не взаимодействует с веществом, формула которого:
А. NаОН(p-p). Б. NaСl (p-p). В. НСl. Г. Н2SO4.
10 (2 балла). Ряд, в котором все вещества реагируют с кальцием:
А. СО2, Н2, НСl. В. NаОН, Н2O, НCl.
Б. Сl2, Н2O, Н2SO4. Г. S, Н2SO4, SО3.
ЧАСТЬ Б. Задания со свободным ответом
11 (9 баллов). Предложите три способа получения сульфата железа (II). Ответ подтвердите уравнениями реакций.
12 (6 баллов). Определите вещества Х, Y,Z, запишите их химические формулы.
t + HCl + NaOH t
Fe(ОН)3 X Y ZFe2O3
13 (6 баллов).Как, используя любые реактивы (вещества) и алюминий, получить оксид, основание, соль? Составьте уравнения реакций в молекулярном виде.
14 (4 балла). Расположите металлы: медь, золото, алюминий, свинец в порядке увеличения плотности (рис. 3).
Рис. 3. Плотность металлов, г/см3
15 (5 баллов). Рассчитайте массу металла, полученного из 160 г оксида меди (II).
9 класс
Контрольная работа № 1
по теме: «Металлы»
Вариант IV
ЧАСТЬ А. Тестовые задания с выбором ответа
1 (2 балла). Электронная формула атома алюминия:
А. ) ) ) В. ) ) )
2 8 32 8 4
Б. ) ) )Г. ) )
2 8 12 8
2 (2 балла). На внешнем энергетическом уровне атомов щелочноземельных металлов электронов:
А. 1. В. 3.
Б. 2. Г. 4.
3 (2 балла). Вид химической связи в простом веществе магнии:
А. Ионная.
Б. Ковалентная полярная.
В. Ковалентная неполярная.
Г. Металлическая.
4 (2 балла). Простое вещество с наиболее ярко выраженными металлическими свойствами:
А. Калий. Б. Литий. В. Натрий. Г. Рубидий.
5 (2 балла). Радиус атомов элементов главной подгруппы с увеличением заряда ядра:
А. Изменяется периодически.
Б. Не изменяется.
В. Увеличивается.
Г. Уменьшается.
6 (2 балла). Атом и ион натрия отличаются:
А. Зарядом ядра.
Б. Радиусом частицы.
В. Числом протонов.
Г. Числом нейтронов.
7 (2 балла). Наиболее энергично реагирует с водой:
А. Аl. Б. К. В. Са. Г. Мg.
8 (2 балла). С соляной кислотой не взаимодействует:
А. Железо. Б. Кальций. В. Медь. Г. Цинк.
9 (2 балла). Гидроксид алюминия не взаимодействует с веществом, формула которого:
А. НС1(p-p). Б. КОН. В. КNО3(р-p) Г. Сu(ОН)2.
10 (2 балла). Ряд, в котором все вещества реагируют с магнием:
А. S, Н2O,NаOН. В. Li, Н2SO4, СО2.
Б. С12, O2, НСI. Г. СuО, Сu(ОН)2, Н3РO4.
ЧАСТЬ Б. Задания со свободным ответом
11 (9 баллов). Предложите три способа получения оксида алюминия. Ответ подтвердите уравнениями реакций.
12 (6 баллов). Определите вещества Х, Y,Z, запишите их химические формулы.
+ O2 + H2O + CO2 t
Ca X Y ZCaO
13 (6 баллов).Как, используя любые реактивы (вещества), получить из цинка оксид, основание, соль? Составьте уравнения реакций в молекулярном виде.
14 (4 балла). Расположите металлы: алюминий, вольфрам, олово, ртуть в порядке уменьшения температуры плавления (рис. 4).
Рис. 4. Температура плавления металлов, °С
15(5 баллов). Рассчитайте массу металла, который можно получить алюминотермией из 34 г оксида хрома(II).
Адрес публикации: https://www.prodlenka.org/metodicheskie-razrabotki/43813-kontrolnaja-rabota-po-teme-metally
металлов | Примечания, видео, контроль качества и тесты | 9 класс> Наука> Металлы
Металлы
На основании определенных основных свойств все элементы были разделены на два класса: металлы и неметаллы. 80% всех элементов (известных до сих пор) — это металлы. Металлы хорошо проводят тепло и электричество, они пластичны и пластичны. Большинство металлов находится в комбинированном состоянии. Металлы прочны и используются для изготовления инструментов, зданий, мостов и других конструкций, где важна прочность.Самый распространенный металл на Земле — это железо. Самые высокие отдельно стоящие конструкции в мире сделаны из металлов, в первую очередь из легированной стали. Среди них небоскреб Бурдж-Калифа в Дубае, токийская телебашня Skytree и небоскреб Шанхайской башни. Некоторыми примерами металлов являются медь, золото, железо, алюминий и т. Д.
Свойства металлов
Физические свойства
- Состояние: Большинство металлов являются твердыми при обычной температуре, за исключением ртути.
- Твердость: Большинство металлов по своей природе твердые.
- Блеск: Металлы приобретают металлический блеск в свежей огранке.
- Плотность: Металлы имеют относительно высокую плотность, за исключением лития, натрия и калия.
- Ковкость: Металлы можно превратить в тонкую пластину, такое свойство называется пластичностью.
- Пластичность: свойство металла, превращающегося в проволоку, называется пластичностью, а металл — пластичностью.
- Электропроводность: Металлы обычно хорошо проводят тепло и электричество.
- Температура плавления и кипения металла: Температура плавления и кипения металлов обычно высока из-за их высокой плотности и твердости.
- Электрический заряд: Металлы — это электроположительные элементы, которые при ионизации выделяют катионы. В водных растворах соли металлов ионизируются и образуют ионы металлов.
Химические свойства
- Реакция с кислородом: Когда металл обрабатывают кислородом при нагревании, они реагируют вместе с образованием основных оксидов.
4Na + O 2 → 2Na 2 O - Реакция с водородом: такие металлы, как натрий, калий и кальций, горят в водороде и образуют соответствующие галогениды.
2Na + H 2 → 2NaH (гидрид натрия)
2K + H 2 → 2KH (гидрид калия) - Реакция с кислотами: большинство химически активных металлов, таких как натрий, калий и кальций, реагируют с разбавленной кислотой с образованием солей и газообразный водород.
Zn + 2HCl → ZnCl 2 + H 2
Извините! — Страница не найдена
Пока мы разбираемся, возможно, вам поможет одна из ссылок ниже.
Дома Назад- Аудитория
- Онлайн-тесты
- Ускоренный онлайн-курс JEE
- Двухлетний курс для JEE 2021
- Аудитория
- Онлайн-курс NEET
- Серия онлайн-тестов
- CA Foundation
- CA Средний
- CA Финал
- Программа CS
- Аудитория
- Серия испытаний
- Книги и материалы
- Тренажерный зал
- Умный взломщик BBA
- Обучение в классе
- Онлайн-коучинг
- Серия испытаний
- Умный взломщик IPM
- Книги и материалы
- GD-PI
- CBSE, класс 8
- CBSE класс 9
- CBSE, класс 10
- CBSE, класс 11
- CBSE, класс 12
- Обучение в классе
- Онлайн-классы CAT
- CAT серии испытаний
- MBA Жилой
- Умный взломщик CAT
- Книги и материалы
- Онлайн-классы без CAT
- Серия испытаний без CAT
- Тренажерный зал
- GD-PI
- Обучение в классе
- Серия испытаний
- Civils Интервью
- Аудитория
- Онлайн-классы
- Серия испытаний SSC
- Переписка
- Практические тесты
- SSC электронные книги
- SSC JE Study Package
- Аудитория
- RBI класс B
- Банковский тест серии
- Переписка
- Банковские электронные книги
- Банк PDP
- Онлайн-коучинг
- Обучение в классе
- Серия испытаний
- Книги и материалы
- Аудитория
- Программа моста GRE
- GMAT Онлайн-коучинг
- Консультации при приеме
- GMAT Обучение в классе
- Стажировка
- Корпоративные программы
- Студенты колледжа
- Рабочие специалисты
- Колледжи
- школ
вопросов MCQ для класса 10 по науке о металлах и неметаллах с ответами
Бесплатная загрузка PDF-файла CBSE, класс 10 по науке, глава 2, Металлы и неметаллы Вопросы с несколькими вариантами ответов с ответами.Вопросы MCQ для класса 10 по естествознанию с ответами были подготовлены на основе последней схемы экзамена. Студенты могут решать вопросы с несколькими вариантами ответов по науке о металлах и неметаллах NCERT Class 10 с ответами, чтобы узнать свой уровень подготовки.
MCQ по науке, класс 10 Глава 3 Металлы и неметаллы
1. Из алюминия делают кухонную утварь. Какие из следующих свойств алюминия ответственны за это?
(i) Хорошая теплопроводность
(ii) Хорошая электропроводность
(iii) Пластичность
(iv) Высокая температура плавления
(a) (i) и (ii)
(b) (i) и (iii)
( c) (ii) и (iii)
(d) (i) и (iv)
Ответ: d
2.Самый распространенный металл в земной коре —
(а) Железо
(б) Алюминий
(в) Кальций
(г) Натрий
Ответ: b
3. Самым плохим проводником тепла среди металлов является
(a) Свинец
(b) Ртуть
(c) Кальций
(d) Натрий
Ответ:
4. Какие свойства металлов используются для изготовления колокольчиков и струн таких музыкальных инструментов, как ситар и скрипка?
(а) Звукопроницаемость
(б) Пластичность
(в) Пластичность
(г) Электропроводность
Ответ:
5.Al 2 O 3 + 2NaOH → …… + H 2 O
(а) Al (OH) 3
(б) Na 2 O
(в) NaAlO 2
(г ) AlNaO 2
Ответ: c
6. Что из следующего является правильным расположением данных металлов в порядке возрастания их реакционной способности?
Цинк, железо, магний, натрий
(a) Цинк> Железо> Магний> Натрий
(b) Натрий> Магний> Железо> Цинк
(c) Натрий> Цинк> Магний> Железо
(d) Натрий> Магний> Цинк > Утюг
Ответ: d
7.Какая из следующих пар вызовет реакцию смещения?
(а) раствор FeSO 4 и металлическая медь
(б) раствор AgNO 3 и металлическая медь
(в) раствор CuSO 4 и металлическое серебро
(г) раствор NaCl и металлическая медь
Ответ: b
8. Неметаллы образуют ковалентные хлориды, потому что
(a) они могут отдавать электроны хлору
(b) они могут делиться электронами с хлором
(c) они могут отдавать электроны атомам хлора с образованием ионов хлора
(d) они не могут делиться электронами с атомами хлора
Ответ: b
9.Какой из следующих оксидов железа получится при длительной реакции железа с паром?
(а) FeO
(б) Fe 2 O 3
(в) Fe 3 O 4
(г) Fe 2 O 3 и Fe 2 O 4
Ответ: c
Объяснение: Причина: 3Fe (s) + 4H 2 O (g) → Fe 3 O 4 (s) + 4H 2 (g)
10. Какие из следующих шин не являются ионными соединениями?
(i) KCl
(ii) HCl
(iii) CCl 4
(iv) NaCl
(a) (i) и (ii)
(b) (ii) и (iii)
(c) ( iii) и (iv)
(d) (i) и (iii)
Ответ: b
11.Электронная конфигурация трех элементов X, Y и Z следующая:
X = 2, 4, Y = 2, 7, Z = 2,1 Какие два элемента будут объединяться, чтобы сформировать ионное соединение и написать правильную формулу,
(а) X 2 Y
(б) YZ
(в) XZ 3 (г) Y 2 Z
Ответ: b
12. Металлы с высокой реакционной способностью, такие как натрий, калий, магний и т. Д., Извлекаются путем электролиза
(a) их расплавленного хлорида
(b) электролиза их расплавленных оксидов
(c) восстановления алюминием
( г) восстановление углеродом
Ответ:
13.Какой из следующих неметаллов блестящий?
(а) Сера
(б) Кислород
(в) Азот
(г) Йод
Ответ: d
14. Пример амфотерного оксида:
(a) Na 2 O
(b) K 2 O
(C) Al 2 O 3
(d) MgO
Ответ: c
15. Какой из перечисленных ниже оксидов является кислым?
(а) Na 2 O
(б) CO
(в) CO 2
(г) Al 2 O 3
Ответ: c
16.Атомный номер элемента «X» равен 12. Какой инертный газ ближе всего к X?
(а) He
(б) Ar
(в) Ne
(г) Kr
Ответ: c
Объяснение: Причина: «X» — это магний, а аргон (Ar) с атомным номером 12 — ближайший к нему инертный газ.
17, Процесс, при котором карбонатная руда сильно нагревается в отсутствие воздуха для превращения ее в оксид металла, называется
(a) Обжиг
(b) Восстановление
(c) Прокаливание
(d) Выплавка
Ответ: c
18.Оксиды умеренно реактивных металлов, таких как цинк, железо, никель, олово, медь и т. Д., Восстанавливаются при использовании
(a) алюминия в качестве восстановителя
(b) натрия в качестве восстановителя
(c) углерода в качестве восстановителя
(d) кальция в качестве восстановителя
Ответ: c
19. При термитной сварке смесь …… и …… воспламеняется горящей магниевой лентой, которая образует расплавленное железо при выделении большого количества тепла.
(а) оксид железа (III) и порошок алюминия
(б) оксид железа (II) и порошок алюминия
(в) хлорид железа (III) и порошок алюминия
(г) сульфат железа (III) и порошок алюминия
Ответ:
20.Гальванизация — это метод защиты железа от ржавчины путем покрытия тонким слоем
(a) Галий
(b) Алюминий
(c) Цинк
(d) Серебро
Ответ: c
21. Элемент X мягкий, его можно разрезать ножом. Он очень реактивен на воздух и не может оставаться открытым на воздухе. Активно реагирует с водой. Определите элемент из следующих
(a) Mg
(b) Na
(c) P
(d) Ca
Ответ: b
22.Взаимодействие между X и Y образует соединение Z. X теряет электрон, а Y получает электрон. Какое из следующих свойств не отображается Z?
(a) Имеет высокую температуру плавления
(b) Имеет низкую температуру плавления
(c) Проводит электричество в расплавленном состоянии
(d) Имеет твердую форму
Ответ: c
Объяснение: Причина: Z — ионное соединение. Имеет высокую температуру плавления.
23. Электронные конфигурации трех элементов X, Y и Z: X — 2, 8; Y — 2, 8, 7 и Z — 2, 8, 2.Что из следующего верно?
(a) X — металл
(b) Y — металл
(c) Z — неметалл
(d) Y — неметалл, а Z — металл
Ответ: c
Объяснение: Причина: Согласно электронной конфигурации Y — хлор, а Z — магний.
24. Амальгама — это сплав
(a) Медь и олово
(b) Ртуть
(c) Свинец и олово
(d) Медь и цинк
Ответ: b
25.Медные изделия теряют свой блеск и образуют зеленое покрытие из
(a) Оксид меди
(b) Гидроксид меди и оксид меди
(c) Основной карбонат меди
(d) Карбонат меди
Ответ: c
Заполните пропуски
1. Элементы можно разделить на ……… и ……. .
2. Два примера металлов, плохо проводящих тепло: ………, ……….
3. Два металла, плавящиеся при хранении на ладони, это ………, ……….
4. Неметалл, который является хорошим проводником электричества, — это ……….
5. Металлы могут образовывать положительные ионы ……….
6. Блестящий неметалл ……….
7. Металл, который горит на воздухе ослепительно белым пламенем, это ……….
8. Металлы выше водорода в ряду активности могут вытеснять ……… из разбавленных кислот.
9. Извлечение металлов из руд с последующим их рафинированием для использования известно как ……….
10. ……… представляет собой аллотроф углерода и является самым твердым природным веществом.
11. Металлы, которые настолько мягкие, что их можно разрезать ножом, это ………, ………
12.Оксиды металлов ……… и ……… растворяются в воде с образованием щелочей.
ответов
1. металлы, неметаллы
2. Свинец, ртуть
3. Галлий, цезий
4. Графит
5. теряющие электроны
6. Йод
7. Магний
8. Водород
9. Металлургия
10. Алмаз
11. Натрий, калий
12. Оксид натрия и оксид калия
Мы надеемся, что данные вопросы MCQ для класса 10 по науке о металлах и неметаллах с ответами помогут вам. Если у вас есть какие-либо вопросы, касающиеся вопросов с множественным выбором металлов и неметаллов по главе 3 CBSE Class 10 Science, оставьте комментарий ниже, и мы свяжемся с вами в ближайшее время.
Science 9 Рабочий лист итогового теста 1-го квартала B
Расширенный поискСодержание:
Язык: AfarAbkhazAvestanAfrikaansAkanAmharicAragoneseArabicAssameseAsturianuAvaricAymaraAzerbaijaniBashkirBelarusianBulgarianBihariBislamaBambaraBengali, BanglaTibetan стандарт, тибетский, CentralBretonBosnianCatalanChechenChamorroCorsicanCreeCzechOld церковнославянский, церковнославянский, Старый BulgarianChuvashWelshDanishGermanDivehi, Мальдивский, MaldivianDzongkhaEweGreek (современный) EnglishEsperantoSpanishEstonianBasquePersian (фарси) Фуле, фулах, пулар, PularFinnishFijianFaroeseFrenchWestern FrisianIrishScottish гэльский, GaelicGalicianGuaraníGujaratiManxHausaHebrew (современный) HindiHiri MotuCroatianHaitian, гаитянский CreoleHungarianArmenianHereroInterlinguaIndonesianInterlingueIgboNuosuInupiaqIdoIcelandicItalianInuktitutJapaneseJavaneseGeorgianKongoKikuyu, GikuyuKwanyama, KuanyamaKazakhKalaallisut , Гренландский, кхмерский, каннада, корейский, канури, кашмирский, курдский, коми, корнийский, киргизский, латинский, люксембургский, летцебургский, ганда, лимбургский, лимбургский, лимбургский, лингала, литовский, люба-катанга, латышский, малагасийский, маршалльский, маори, македонский, mMongolianMarathi (маратхи) MalayMalteseBurmeseNauruanNorwegian BokmålNorthern NdebeleNepaliNdongaDutchNorwegian NynorskNorwegianSouthern NdebeleNavajo, NavahoChichewa, Chewa, NyanjaOccitanOjibwe, OjibwaOromoOriyaOssetian, OsseticEastern пенджаби, Восточная PanjabiPāliPolishPashto, PushtoPortugueseQuechuaRomanshKirundiRomanianRussianKinyarwandaSanskrit (санскрит) SardinianSindhiNorthern SamiSangoSinhalese, SinhalaSlovakSloveneSamoanShonaSomaliAlbanianSerbianSwatiSouthern SothoSundaneseSwedishSwahiliTamilTeluguTajikThaiTigrinyaTurkmenTagalogTswanaTonga (Остров Тонга) TurkishTsongaTatarTwiTahitianUyghurUkrainianUrduUzbekValencianVendaVietnameseVolapükWalloonWolofXhosaYiddishYorubaZhuang, ChuangChineseZulu Предмет:
Оценка / уровень: Возраст: 3456789101112131415161718+
Поиск: Все рабочие листы Только мои подписанные пользователи Только мои любимые рабочие листы Только мои собственные рабочие листы
Тяжелые металлы — понимание теста и ваших результатов
Источники, использованные в текущем обзоре
2020 обзор выполнен Пенном Мулунгви, доктором философии, NRCC, SC (ASCP).
(24 октября 2018 г.) Образец, Дженнифер А. Отравление свинцом в детстве: Управление. Своевременно. Доступно на сайте https://www.uptodate.com/contents/childhood-lead-poisoning-management. Дата обращения 06.04.2020.
(17 марта 2020 г.) Гольдман, Роуз Х и Ху, Ховард. Воздействие свинца и отравление у взрослых. Своевременно. Доступно в Интернете по адресу https://www.uptodate.com/contents/lead-exposure-and-poisoning-in-adults. Дата обращения 06.04.2020.
(7 января 2019 г.) Гольдман, Роуз Х. Воздействие мышьяка и отравление.Своевременно. Доступно на https://www.uptodate.com/contents/arsenic-exposure-and-poisoning. Дата обращения 06.04.2020.
(© 2020) Лаборатории клиники Мэйо. Экран для тяжелых металлов с рефлексом, 24-часовая моча. Доступно на сайте https://www.mayocliniclabs.com/test-catalog/Overview/48538. Дата обращения 03.04.2020.
(30 августа 2019 г.) Национальная медицинская библиотека. Закон, правила и политика по ртути. Доступно в Интернете по адресу https://www.nlm.nih.gov/enviro/mercury-and-human-health.html. Дата обращения 03.04.2020.
(18 июня 2018 г.) Центры по контролю и профилактике заболеваний. Ведущее обучение и медицинские рекомендации. Доступно в Интернете по адресу https://www.cdc.gov/niosh/topics/lead/medical.html. Дата обращения 30.03.2020.
Источники, использованные в предыдущих обзорах
(обновлено 7 августа 2008 г.). Управление по охране труда и гигиене труда Министерства труда США, Токсичные металлы. Токсичные металлы [Он-лайн информация]. Доступно в Интернете по адресу http://www.osha.gov/SLTC/metalsheavy/index.html.Дата обращения 25.01.09.
Согоян С. и Синерт Р. (18 июля 2008 г.). Токсичность, тяжелые металлы. eMedicine [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/814960-overview. Проверено 18.01.09.
(14 апреля 1999 г.). Токсичные металлы, регулируемые OSHA. Темы по безопасности и охране здоровья Министерства труда США [Информация в Интернете]. Доступно в Интернете по адресу http://www.osha.gov/SLTC/metalsheavy/regulated.html. Дата обращения 25.01.09.
(сентябрь 2006 г.). Алюминий.ATSDR ToxFAQ [Он-лайн информация]. PDF-файл доступен для загрузки по адресу http://www.atsdr.cdc.gov/tfacts22.pdf. Дата обращения 25.01.09.
(сентябрь 1995 г.). Сурьма. ATSDR ToxFAQ [Он-лайн информация]. PDDF доступен для загрузки по адресу http://www.atsdr.cdc.gov/tfacts23.pdf. Дата обращения 25.01.09.
(август 2007 г.). Мышьяк. ATSDR ToxFAQ [Он-лайн информация]. PDF-файл доступен для загрузки по адресу http://www.atsdr.cdc.gov/tfacts2.pdf. Дата обращения 25.01.09.
(сентябрь 2002 г.). Бериллиум. ATSDR ToxFAQ [Он-лайн информация].PDF-файл доступен для загрузки по адресу http://www.atsdr.cdc.gov/tfacts4.pdf. Дата обращения 25.01.09.
(сентябрь 2008 г.). Кадмий. ATSDR ToxFAQ [Он-лайн информация]. PDF-файл доступен для загрузки по адресу http://www.atsdr.cdc.gov/tfacts5.pdf. Дата обращения 25.01.09.
(сентябрь 2008 г.). Хром. ATSDR ToxFAQ [Он-лайн информация]. PDF-файл доступен для загрузки по адресу http://www.atsdr.cdc.gov/tfacts7.pdf. Дата обращения 25.01.09.
(23 мая 2008 г.). Шестивалентный хром. Темы OSHA по безопасности и охране здоровья [Он-лайн информация].Доступно в Интернете по адресу http://www.osha.gov/SLTC/hexavalentchromium/index.html. Дата обращения 25.01.09.
(апрель 2004 г.). Кобальт. ATSDR ToxFAQ [Он-лайн информация]. PDF-файл доступен для загрузки по адресу http://www.atsdr.cdc.gov/tfacts33.pdf. Дата обращения 25.01.09.
(сентябрь 2004 г.). Медь. ATSDR ToxFAQ [Он-лайн информация]. PDF-файл доступен для загрузки по адресу http://www.atsdr.cdc.gov/tfacts132.pdf. Дата обращения 25.01.09.
(август 2007 г.). Вести. ATSDR ToxFAQ [Он-лайн информация]. PDF-файл доступен для скачивания по адресу http: // www.atsdr.cdc.gov/tfacts13.pdf. Дата обращения 25.01.09.
(сентябрь 2008 г.). Марганец. ATSDR ToxFAQ [Он-лайн информация]. PDF-файл доступен для загрузки по адресу http://www.atsdr.cdc.gov/tfacts151.pdf. Дата обращения 25.01.09.
(апрель 1999 г.). Меркурий. ATSDR ToxFAQ [Он-лайн информация]. PDF-файл доступен для загрузки по адресу http://www.atsdr.cdc.gov/tfacts46.pdf. Дата обращения 25.01.09.
(август 2005 г.). Никель. ATSDR ToxFAQ [Он-лайн информация]. PDF-файл доступен для загрузки по адресу http: //www.atsdr.cdc.gov / tfacts15.pdf. Дата обращения 25.01.09.
(сентябрь 2003 г.). Селен. ATSDR ToxFAQ [Он-лайн информация]. PDF-файл доступен для загрузки по адресу http://www.atsdr.cdc.gov/tfacts92.pdf. Дата обращения 25.01.09.
(июль 1999 г.). Серебро. ATSDR ToxFAQ [Он-лайн информация]. PDF-файл доступен для загрузки по адресу http://www.atsdr.cdc.gov/tfacts146.pdf. Дата обращения 25.01.09.
(сентябрь 1995 г.). Таллий. ATSDR ToxFAQ [Он-лайн информация]. PDF-файл доступен для загрузки по адресу http://www.atsdr.cdc.gov/tfacts54.pdf. Дата обращения 25.01.09.
(август 2005 г.). Олово и соединения олова. ATSDR ToxFAQ [Он-лайн информация]. PDF-файл доступен для загрузки по адресу http://www.atsdr.cdc.gov/tfacts55.pdf. Дата обращения 25.01.09.
(сентябрь 1995 г.). Ванадий. ATSDR ToxFAQ [Он-лайн информация]. PDF-файл доступен для загрузки по адресу http://www.atsdr.cdc.gov/tfacts58.pdf. Дата обращения 25.01.09.
(август 2005 г.). Цинк. ATSDR ToxFAQ [Он-лайн информация]. PDF-файл доступен для загрузки по адресу http://www.atsdr.cdc.gov/tfacts60.pdf. Дата обращения 25.01.09.
Подсики, К. (ноябрь 2008 г.). Таблица тяжелых металлов, их солей и других соединений. Американский институт сохранения исторических и художественных произведений [Он-лайн информация]. PDF-файл доступен для загрузки по адресу http://aic.stanford.edu/health/guides/heavy_metals_table_11_08.pdf. Доступно 25.01.09.
Рот, Э. и Куиг, Д. (май 2008 г.). Токсичные металлы, почему анализ волос заслуживает особого внимания. Новости клинической лаборатории v 34, (5) [Он-лайн информация].Доступно в Интернете по адресу http://www.aacc.org/publications/cln/2008/may/Pages/series_0508.aspx. Доступно 25.01.09.
Кларк В. и Дюфур Д. Р., редакторы (© 2006). Современная практика клинической химии: AACC Press, Вашингтон, округ Колумбия. С. 474.
Учебник Тиц по клинической химии и молекулярной диагностике. Burtis CA, Ashwood ER и Bruns DE, ред. 4-е изд. Сент-Луис, Миссури: Эльзевьер Сондерс; 2006, стр. 1371-1374.
Принципы внутренней медицины Харрисона.16-е изд. Каспер Д., Браунвальд Э., Фаучи А., Хаузер С., Лонго Д., Джеймсон Дж. Л., ред. Макгроу-Хилл, 2005, стр. 2577-2580.
Отравление метилртутью. (Обновлено 22 марта 2013 г.). Медицинская энциклопедия MedlinePlus. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/001651.htm. Доступно 21.05.13.
Согоян С. и Синерт Р. (Обновлено 6 мая 2011 г.). Токсичность тяжелых металлов. Справочник по eMedicine Medscape. Доступно в Интернете по адресу http://emedicine.medscape.com/article/814960-overview#a0199.Доступ 14.05.13.
Мартин, К. Дж., Вернц К. Л. и Дукатман А. М. (декабрь 2004 г.). Интерпретация изменений протопорфирина цинка при отравлении свинцом: описание случая и обзор литературы. Национальный центр биотехнологической информации PubMed. Доступно в Интернете по адресу http://www.ncbi.nlm.nih.gov/pubmed/15576877. Доступ 14.05.13.
Центры по контролю и профилактике заболеваний. Советы по профилактике свинца. (Обновлено 25 июня 2012 г.). Доступно в Интернете по адресу http://www.cdc.gov/nceh/lead/tips.htm. Доступно 21.05.13.
Китай рассмотрит отчет о содержании кадмия в детских украшениях. Джереми Маркес, деловой писатель AP, 12.01.2010. Доступно в Интернете по адресу http://www.manufacturing.net/news/2010/01/china-to-review-report-of-cadmium-in-kids-jewelry. По состоянию на май 2013 г.
«Треть китайских игрушек содержат тяжелые металлы». Малкольм Мур, Шанхай и Джеймс Холл, 8 декабря 2011 г. Телеграф . Доступно в Интернете по адресу http://www.telegraph.co.uk/news/worldnews/asia/china/8944028/One-third-of-Chinese-toys-contain-heavy-metals.html. По состоянию на май 2013 г.
2016 обзор выполнен Маноджем Тяги, доктором наук, NRCC CC, директором медицинской лаборатории Captiva Lab.
(14 октября 2010 г.) Управление по санитарному надзору за качеством пищевых продуктов и медикаментов. FDA предупреждает продавцов о неразрешенных «хелатных» продуктах. Доступно в Интернете по адресу http://www.fda.gov/newsevents/newsroom/pressannouncements/ucm229320.htmwww.epa.gov/mercury/. По состоянию на февраль 2016 г.
(январь 2016 г.) Агентство по охране окружающей среды. Вести. Доступно в Интернете по адресу http://www.epa.gov/lead/.По состоянию на февраль 2016 г.
Санберн, Джош. Кризис воды Флинта, объясненный в 3-х гифках (24 января 2016 г.). Журнал Time . Доступно в Интернете по адресу http://time.com/4191864/flint-water-crisis-lead-contaminated-michigan/. По состоянию на 9 февраля 2016 г.
(23 июля 2013 г.) Центры по контролю и профилактике заболеваний. Национальная программа биомониторинга, Ртуть. Доступно в Интернете по адресу http://www.cdc.gov/biomonitoring/Mercury_FactSheet.html. По состоянию на 9 февраля 2016 г.
Управление охраны труда.Токсичные металлы. Доступно на сайте https://www.osha.gov/SLTC/metalsheavy/. По состоянию на февраль 2016 г.
(24 марта 2015 г.) Адал А. Токсичность тяжелых металлов. Ссылка на Medscape. Доступно в Интернете по адресу http://emedicine.medscape.com/article/814960-overview. По состоянию на март 2016 г.
(© 2016) Mayo Medical Laboratories. Экран для тяжелых металлов, 24 часа, моча. Доступно в Интернете по адресу http://www.mayomedicallaboratories.com/test-catalog/Overview/8633. По состоянию на март 2016 г.
(© 2016) Солоуэй Р.Контроль отравлений, Национальный центр по борьбе с отравлениями: хелатная терапия. Доступно в Интернете по адресу http://www.poison.org/articles/2011-mar/chelation-therapy. По состоянию на март 2016 г.
Прочтите вопросы и ответы по химии 9 класса с выбором ответов (MCQ): викторины и практические тесты с ключом ответа (краткое руководство по химии для 9 класса и обзор курса) онлайн, Аршад Икбал
Вопросы и ответы по химии 9 класса с несколькими вариантами ответов (MCQs )Тесты и практические тесты с ключом ответа
Автор: Аршад Икбал
Содержание
Глава 1: Химическая реактивность MCQs
Electro
Глава 3: Основы химии MCQ
Глава 4: Периодическая таблица и MCQ периодичности
Глава 5: MCQ физических состояний вещества
Глава 6: Решения MCQ
Структура 9000 MCQ атомовГлава 8: Структура MCQ молекул 900 05
Ответные ключи
Глава 1 Химическая реакционная способность MCQMCQ 1 : Металл, который трудно окисляется, называется
A.слабые металлы
B. сильные металлы
C. благородные металлы
D. ионные металлы
MCQ 2 : При контакте с кислородом образуется рубидий
A. нормальный оксид
B. пероксид
C. супероксид
D. триоксид
MCQ 3 : Самый металлический из следующих —
A. Na
B. K
C. Al
D. B
MCQ 4 : As we перемещать по периоду электроотрицательность
А.уменьшается
B. увеличивается
C. остается прежним
D. становится равным нулю
MCQ 5 : При перемещении по периоду слева направо реакционная способность металлов с кислородом
A. уменьшается
B . увеличивается
C. остается прежним
D. нулевым
MCQ 6 : металлический натрий мягкий из-за
A. слабая металлическая связь
B. сильная металлическая связь
C. большой размер
D .малый размер
MCQ 7 : элементы, которые обладают свойствами металлов и неметаллов, являются
A. аморфными
B. кристаллическими
C. металлоидами
D. металлами
MCQ 8 : как размер атома увеличивается вниз по группе, электроположительность
A. увеличивается
B. уменьшается
C. остается прежней
D. ни один из указанных выше
MCQ 9 : Бром — неметалл в
А.твердое состояние
B. жидкое состояние
C. газообразное состояние
D. состояние плазмы
MCQ 10 : по сравнению с бериллием магний составляет
A. большой
Периодическая таблица науки
Периодическая таблица
Из (http://www.immr.tu-clausthal.de/geoch/pse/pse.shtml)
Примечания к периодической таблице (http: // www.kidzworld.com/site/p2065.htm)
Атомный номер — элемент определяется количеством протонов, которые он имеет.Атомы углерода имеют шесть протонов, атомы водорода имеют один протон, а атомы кислорода имеют восемь протонов. Число протонов в атоме называется атомным номером. Химическое поведение элемента зависит от количества протонов в атоме.
Атомарный символ — это почти всегда одна или две буквы, обозначающие элемент. Они используются во всем мире и обычно связаны с названием элемента или латинским именем элемента. Примером этого является «O» для кислорода и «Ca» для кальция.
Атомная масса — Средняя масса элемента в атомных единицах массы (а.е.м.). Масса атома настолько мала, что мы используем а.е.м. Это примерно масса одного протона или нейтрона. Атомная масса — это десятичное число в Периодической таблице, потому что это среднее значение различных изотопов (одного или нескольких атомов с одинаковым атомным номером, но разными массовыми числами) элемента. Чтобы найти среднее количество нейтронов для элемента, просто вычтите количество протонов (атомный номер) из этой атомной массы.
Задолго до того, как кто-либо узнал какие-либо подробности об атомах или каких-либо периодических свойствах, элементы были разделены на две широкие категории —> металлы и неметаллы.
Щелочные металлы — Это первая группа в периодической таблице. Они не встречаются в природе свободно и мягче, чем большинство металлов. Как и все металлы, они отлично проводят тепло и даже могут взорваться под воздействием воды.
Щелочноземельные металлы — Это вторая группа в периодической таблице.Поскольку они чрезвычайно реактивны, они не встречаются в природе. Примером щелочноземельного металла является радий.
Переходные металлы — 38 элементов в группах с третьей по 12 называются переходными металлами. Три интересных элемента в этой группе — железо, кобальт и никель. Это единственные известные элементы, которые создают магнитное поле.
Другие металлы — семь элементов считаются «другими металлами» в группах с 13 по 15. Все эти элементы твердые с высокой плотностью.Примерами их являются олово, алюминий и свинец.
Металлиоды — Эти элементы обладают как металлическими, так и неметаллическими свойствами. Некоторые из них являются полупроводниками, что означает, что они могут нести электрический заряд при определенных условиях. Металлоиды отлично подходят для компьютеров и калькуляторов.
Неметаллы — Они попадают в группы с 14 по 16 в периодической таблице. Они не могут хорошо проводить тепло или электричество и очень хрупкие. Из них также нельзя делать проволоку или листы.При комнатной температуре неметаллы превращаются в газы и твердые вещества.
Галогены — Все пять галогенов являются неметаллическими элементами. «Галоген» означает «солеобразователь», поэтому соединения, содержащие галоген, называются «солями». При комнатной температуре они находятся в трех состояниях вещества: твердом, жидком и газообразном.
