Материал по химии (11 класс) на тему: Контрольная работа №1 Тема «Строение атома» 11 класс
КОНТРОЛЬНАЯ РАБОТА №1 Тема «Строение атома» 11 класс
Вариант 1
1.Номер периода в Периодической системе определяется:
А. Зарядом ядра атома
Б. Числом электронов в наружном слое атома.
В. Числом электронных слоев в атоме
Г. Числом электронов в атоме.
2. Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней :
А. S и Cl Б.Be и B В. Kr и Xe Г. Mo и Se
3. р – Элементом является:
А. Скандий.
Б. Барий.
В. Мышьяк
Г. Гелий
4. Электронная конфигурация . . .3d104s2 соответствует элементу:
А. Кальцию.
Б. Криптону.
В.Кадмию.
Г. Цинку.
5. Амфотерным гидроксидом является вещество, формула которого:
A. Zn(OH)2
Б. Mg(OH)2
В. Ca(OH)2
Г. Cr(OH)2
6. Ряд элементов, расположенных в порядке усиления металлических свойств:
А. Mg – Ca – Zn.
Mg – Ca – Zn.
Б.Al – Mg – Ca.
В.Sr – Rb – K.
Г.Ge — Si – Sb.
7.Элемент Э с электронной формулой 1s22s22p63s23p63d104s24p1 образуется высший оксид, соответствующий формуле:
А.Э2О
Б.Э2О3
В.ЭО2
Г.ЭО3
8. Изотоп кальция, в ядре которого содержится 22 нейтрона, обозначают:
А.2040Са
Б.2042СаВ.2044Са
Г.2048Са
9. Установите соответствие:
Элемент:
- Алюминий. II. Калий. III. Селен. IV. Магний.
Электронная формула:
А.1s22s22p63s23p1
Б.1s22s22p63s2
В.1s22s22p63s23p63d104s24p4
Г.1s22s23s23p64s1
Формула высшего оксида:
- Э2О 2.Э2О3 3.ЭО 4.ЭО3
Формула высшего гидроксида:
а. ЭОН. б. Э(ОН)2. в. Э(ОН)3 г. Н2ЭО4
ЧАСТЬ Б. Задания со свободным ответом
10. На основании положения в Периодической системе расположите элементы: германий, мышьяк, сера, фосфор – в порядке убывания окислительных свойств. Объясните ответ.
Объясните ответ.
11. Как и почему в Периодической системе изменяются металлические свойства?
А. В пределах периода.
Б. В пределах главной подгруппы.
12. Составьте электронную формулу элемента с порядковым номером 30 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
13. Какие химические свойства характерны для высшего оксида элемента 3-го периода, главной подгруппы VI группы Периодической системы? Ответ подтвердите, написав уравнения реакций.
Контрольная работа №1 Тема «Строение атома» 11 класс
Вариант 2
- Номер группы (для элементов главных подгрупп) в Периодической системе определяет:
А.Число протонов в атоме.
Б.Число электронов в наружном слое атома.
В.Число электронных слоев в атоме.
Г.Число нейтронов в атоме.
2. Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней :
А. Ba и K В.Ti и Ge
Ba и K В.Ti и Ge
Б.Sb и Bi Г.Kr и Fe
3. р – Элементом является:
А.Калий
Б. Кремний
В.Аргон
Г.Медь
4. Электронная конфигурация . . .3d54s2 соответствует элементу:
А. Брому
Б. Кальцию
В. Марганцу
Г. Хлору
5. Амфотерным оксидом является вещество, формула которого:
А. CrO Б.Сr2О3 В. СrО3 Г.FeO
6. Ряд элементов, расположенных в порядке усиления металлических свойств:
А. Al – Ga – Ge.
Б. Ca – Sr –Ba.
В. K –Na –Li.
Г. Mg — Ca – Zn.
7.Элемент Э с электронной формулой 1s22s22p63s23p63d104s24p3 образуется высший оксид, соответствующий формуле:
А.ЭО
Б.Э2О3
В.Э2О5
Г.ЭО3
8. Изотоп железа, в ядре которого содержится 30 нейтронов, обозначают:
А.2654Fe
Б.2656Fe
В.2657Fe
Г.2658Fe
9. Установите соответствие:
Элемент:
- Бор. II. Бром. III.
 Фосфор. IV. Литий.
Фосфор. IV. Литий.
Электронная формула:
А.1s22s22p1
Б.1s22s1
В. 1s22s22p63s2 3p3
Г. 1s22s22p63s23p63d104s24p5
Формула высшего оксида:
- Э2О 2.Э2О3 3.Э 2О5 4.Э 2О7
Формула высшего гидроксида:
а. ЭОН. б. НЭО3. в. Н3ЭО3 г. НЭО4
ЧАСТЬ Б. Задания со свободным ответом
10. На основании положения в Периодической системе расположите элементы: алюминий, калий, кальций, магний – в порядке возрастания восстановительных свойств. Объясните ответ.
11. Почему заряды ядер атомов элементов, расположенных в порядке возрастания порядковых номеров в Периодической системе, изменяются монотонно, а свойства элементов — периодически?
12. Составьте электронную формулу элемента с порядковым номером 38 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
13. Какие химические свойства характерны для гидроксидов металлов? Ответ подтвердите, написав уравнения реакций.
Вариант 3
1.Общее число электронов в атоме элемента определяют, используя Периодическую систему, по номеру:
А. Группы.
Б. Периода.
В. Ряда.
Г. Порядковому.
2. Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней :
А. Sn и Si Б.As и Se В. Zn и Ca Г. Mo и Te
3. f – Элементом является:
А. Германий.
Б. Калий.
В. Селен.
Г. Уран.
4. Электронная конфигурация . . .4s24p6 соответствует элементу:
А. Брому.
Б. Железу.
В.Неону.
Г. Криптону.
5. Амфотерным гидроксидом является вещество, формула которого:
A. Ga(OH)3.
Б. Mg(OH)2.
В. LiOH.
Г. Sc(OH)2
6. Ряд элементов, расположенных в порядке усиления металлических свойств:
А. K – Rb – Sr.
Б.Al – Mg – Ca.
В. Be –– Li — Cs.
Be –– Li — Cs.
Г.Ge — Sn – Sb.
7.Элемент Э с электронной формулой 1s22s22p63s1 образуется высший оксид, соответствующий формуле:
А.Э2О
Б.Э2О3
В.ЭО2
Г.ЭО3
8. Изотоп кальция, в ядре которого содержится 24 нейтрона, обозначают:
А.2040Са
Б.2042Са
В.2044Са
Г.2048Са
9. Установите соответствие:
Элемент:
- Азот. II. Кальций. III. Кремний. IV. Сера.
Электронная формула:
А.1s22s22p3
Б.1s22s22p63s23p4
В.1s22s22p63s23p2
Г.1s22s23s23p64s2
Формула высшего оксида:
- ЭО 2.ЭО2 3.Э 2О5 4.ЭО3
Формула высшего гидроксида:
а. Н 2ОЭ4. б. Э(ОН)2. в. Н2ЭО3 г. НЭО3
ЧАСТЬ Б. Задания со свободным ответом
10. На основании положения в Периодической системе расположите элементы: кислород, мышьяк, сера, фосфор – в порядке убывания окислительных свойств. Объясните ответ.
Объясните ответ.
11. Перечислите основные правила(законы), в соответствии с которыми происходит заполнение электронами уровней, подуровней и орбиталей в электронной оболочке атомов элементов.
12. Составьте электронную формулу элемента с порядковым номером 34 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
13. Какие химические свойства характерны для гидроксидов неметаллов? Ответ подтвердите, написав уравнения реакций.
КОНТРОЛЬНАЯ РАБОТА №1 по темам «Строение атома и периодический закон», «Строение вещества» I вариант 1. (2 балла). h3, O2, N2 – данные вещества образованы: а) ковалентной полярной б) ионной в) металлической г) ковалентной неполярной 2. а) Ba(OH)2 б) Nh5NO3 в) h3SO4 г) Li2CO3 3. (2 балла). Полярная ковалентная связь наблюдается в следующем веществе: а) углекислый газ б) алмаз в) сера г) фосфор 4. (2 балла). Найдите вещество, имеющее металлический тип связи: а) мышьяк б) галлий в) фосфор г) иод 5. (2 балла). Укажите название вещества, молекулы которого способны к образованию водородных связей: а) водород б) гидрид натрия в) муравьиная кислота г) метан 6. (2 балла). Вещество, образованное элементами с порядковыми номерами 1 и 9, имеет кристаллическую решетку: а) атомную б) молекулярную в) ионную г) металлическую 7. (2 балла). Воск имеет строение: а) твердое кристаллическое б) жидкое в) газообразное г) твердое аморфное 8. Состав атома: Положение элемента в Периодической системе:
9. (4 балла). Установите соответствие между типом элемента и химическим элементом. Тип элемента: Химический элемент:
Г) цинк. 10. (3 балла). Установите соответствие между дисперсной системой и агрегатным состоянием дисперсной фазы и дисперсионной среды. Дисперсная система: Агрегатное состояние дисперсной фазы / дисперсионной среды:
2) снежный наст; Б) газ / твердое вещество; 3)нержавеющая сталь. твердое вещество. 11.(4 балла). Вычислите массовые доли элементов в этанале СН3СНО. 12. (4 балла). Какова массовая доля поваренной соли в растворе, полученном при разбавлении 100 г 20% -го раствора 100 г воды. 13. (4 балла). Найти объем азота в 250л воздуха, если содержание его в воздухе составляет 78%. 14. (4 балла). Найти массу цинка в 50 г технического цинка, содержащего 25% примесей. КОНТРОЛЬНАЯ РАБОТА №1 по темам «Строение атома и периодический закон», «Строение вещества» III вариант 1. (2 балла). Между атомами каких элементов химическая связь будет иметь ионный характер : а) К и О б) Si и Cl в) S и O г) P и Br 2. (2 балла). Только ковалентная связь наблюдается в соединении с формулой: а) h3SO3 б) Nh5NO3 в) Fe(OH)2 г) Li2SiO3 3. (2 балла). Полярная ковалентная связь наблюдается в следующем веществе: а) водород б) алмаз в) аммиак г) хлор 4. (2 балла). Найдите вещество, имеющее металлический тип связи: а) кремний б) висмут в) фосфор г) иод 5. (2 балла). Укажите название вещества, молекулы которого способны к образованию водородных связей: а) водород б) гидрид калия в) муравьиная кислота г) бутан 6. (2 балла). Вещество, образованное элементами с порядковыми номерами 3 и 1, имеет кристаллическую решетку: а) атомную б) молекулярную в) ионную г) металлическую 7. (2 балла). Полиэтилен имеет строение: а) твердое кристаллическое б) жидкое в) газообразное г) твердое аморфное 8. (4 балла). Установите соответствие между составом атома и положением элемента в Периодической системе. Состав атома: Положение элемента в Периодической системе: 1)55р, 78п, 55ē; А) 6-й период IБ группы; 2) 83 р, 126п, 83ē; Б) 6-й период VA группы; 3)73р, 108n, 73ē; В) 6-й период VБ группы; 4)79 р, 118п, 79ē. Г) 6-й период IА группы. 9. (4 балла). Установите соответствие между типом элемента и химическим элементом. Тип элемента: Химический элемент: 1)s; А) германий; 2)р; Б) кобальт; 3)d. В) криптон; Г) стронций. 10. (3 балла). Установите соответствие между дисперсной системой и агрегатным состоянием дисперсной фазы и дисперсионной среды. Дисперсная система: Агрегатное состояние дисперсной фазы / дисперсионной среды: 1)смог; А) твёрдое вещество/ газ; 2) пенобетон; Б) газ / твердое вещество; 3)гранит. В) твердое вещество / твердое вещество. 11.(4 балла). Вычислите массовые доли элементов в муравьиной кислоте НСООН. 12. (4 балла). В 200 г воды растворили. Вычислите массовую долю сахара в полученном растворе. 13. (4 балла). Найти объем азота в 40л воздуха, если содержание его в воздухе составляет 78%. 14. (4 балла). Найти массу железа в 50 г технического железа, содержащего 10% примесей. | КОНТРОЛЬНАЯ РАБОТА №1 по темам «Строение атома и периодический закон», «Строение вещества» II вариант 1. (2 балла). Между атомами каких элементов химическая связь будет иметь ионный характер : а) Li и F б) C и O в) S и CI г) Si и H 2. (2 балла). Только ковалентная связь наблюдается в соединении с формулой: а) Mg(OH)2 б) Nh5NO3 в) K2SO4 г) h3CO3 3. (2 балла). Только ионные связи наблюдается в веществе: а) оксид натрия б) сульфат меди в) гидроксид кальция г) сероводород 4. (2 балла). Найдите вещество, имеющее металлический тип связи: а) ртуть б) хлор в) сера г) кремний 5. (2 балла). Укажите название вещества, молекулы которого способны к образованию водородных связей: а) водород б) гидрид кальция в) уксусная кислота г) пропан 6. (2 балла). Вещество, образованное элементами с порядковыми номерами 35 и 12, имеет кристаллическую решетку: а) атомную б) молекулярную в) ионную г) металлическую 7. (2 балла). Метан имеет строение: а) твердое кристаллическое б) жидкое в) газообразное г) твердое аморфное 8. (4 балла). Установите соответствие между составом атома и положением элемента в Периодической системе. Состав атома: Положение элемента в Периодической системе: 1)38р, 50п, 38ē; А) 5-й период IIБ группы;
3)42р, 54n, 42ē; В) 5-й период IIA группы; 4)52 р, 76п, 72ē. Г) 5-й период VIБ группы. 9. (4 балла). Установите соответствие между типом элемента и химическим элементом. Тип элемента: Химический элемент: 1)s; А) кальций; 2)р; Б) ванадий; 3)d. В) теллур; Г) молибден. 10. (3 балла). Установите соответствие между дисперсной системой и агрегатным состоянием дисперсной фазы и дисперсионной среды. Дисперсная система: Агрегатное состояние дисперсной фазы / дисперсионной среды: 1)чугун; А) твёрдое вещество / газ; 2) смог; Б) газ / твердое вещество; 3)пористый шоколад . В) твердое вещество / твердое вещество. 11.(4 балла). Вычислите массовые доли элементов в этаноле С2Н5ОН. 12. (4 балла). В 300 г морской воды содержится 15 г солей. Вычислите массовую долю солей в этом образце морской воды. 13. (4 балла). Найти объем кислорода в 50л воздуха, если содержание его в воздухе составляет 21%. 14. (4 балла). Найти массу магния в 14 г технического магния, содержащего 2% примесей. КОНТРОЛЬНАЯ РАБОТА №1 по темам «Строение атома и периодический закон», «Строение вещества» IV вариант 1. (2 балла). Na2O, K2O, Ca3N2 – данные вещества образованы: а) ковалентной полярной б) ионной в) металлической г) ковалентной неполярной 2. (2 балла). Только ковалентная связь наблюдается в соединении с формулой: а) NaOH б) Nh5NO3 в) h4PO4 г) CaSO3 3. (2 балла). Полярная ковалентная связь наблюдается в следующем веществе: а) кислород б) алмаз в) сероводород г) бром 4. (2 балла). Найдите вещество, имеющее металлический тип связи: а) хром б) азот в) неон г) углерод 5. (2 балла). Укажите название вещества, молекулы которого способны к образованию водородных связей: а) водород б) гидрид натрия в) салициловая кислота г) этан 6. (2 балла). Вещество, образованное элементами с порядковыми номерами 1 и 17, имеет кристаллическую решетку: а) атомную б) молекулярную в) ионную г) металлическую 7. (2 балла). Янтарь имеет строение: а) твердое кристаллическое б) жидкое в) газообразное г) твердое аморфное 8. (4 балла). Установите соответствие между составом атома и положением элемента в Периодической системе. Состав атома: Положение элемента в Периодической системе: 1)53р, 73п, 53ē; А) 5-й период IIА группы; 2)30р, 35п, 30ē; Б) 5-й период VIIA группы; 3)38р, 50n, 38ē; В) 5-й период IIБ группы; 4)43 р, 56п, 43ē. Г) 5-й период VIIБ группы. 9. (4 балла). Установите соответствие между типом элемента и химическим элементом. Тип элемента: Химический элемент: 1)s; А) рубидий; 2)р; Б) бром; 3)d. В) серебро; Г) никель. 10. (3 балла). Установите соответствие между дисперсной системой и агрегатным состоянием дисперсной фазы и дисперсионной среды. Дисперсная система: Агрегатное состояние дисперсной фазы / дисперсионной среды: 1)дым; А) газ / твёрдое вещество; 2) цветное стекло; Б) твёрдое вещество / газ; 3)кирпич В) твердое вещество / твердое вещество. 11.(4 балла). Вычислите массовые доли элементов в анилине С6Н5Nh3. 12. (4 балла). Какова массовая доля поваренной соли в растворе, полученном при упаривании 200 г 10% -го раствора до 100 г воды. 13. (4 балла). Найти объем кислорода в 55л воздуха, если содержание его в воздухе составляет 21%. 14. (4 балла). Найти массу цинка в 24 г технического цинка, содержащего 15% примесей. |
Материал по химии (11 класс) по теме: Контрольная работа №1 по темам «Строение атома. Периодический закон Д.И.Менделеева»
Контрольная работа №1
по темам «Строение атома. Периодический закон Д.И.Менделеева».
Вариант 1.
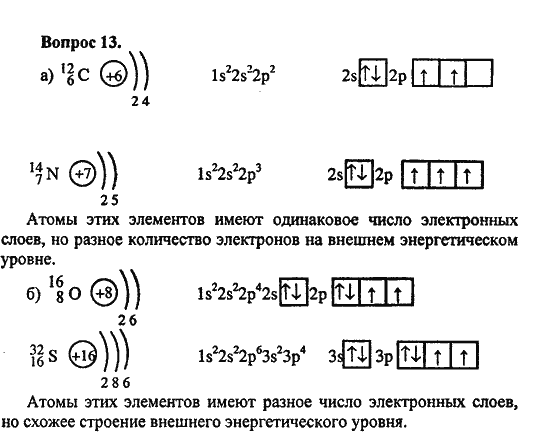
I. Сколько электронов находится на внешнем энергетическом уровне в атоме серы:
А)3 Б) 4 В)6 Г)16.
2. В одном периоде находятся элементы: А) с одинаковыми химическими свойствами; Б) с одинаковым радиусом атомов; Б) с одинаковым числом валентных электронов; В) с зарядом ядра, последовательно возрастающим на 1.
3. В ряду химических элементов Li-Na-K-Rb металлические свойства: А) усиливаются Б) не изменяются В) ослабевают Г) изменяются периодически.
4. К S-элементам относится: А) магний Б) сера В) хлор Г) медь.
5. Электронная конфигурация … 4s 2 соответствует элементу: А) кальций Б) криптон В) кадмий Г)цинк.
6. Сравните атомы, поставив знаки <, > или = вместо * :
а) заряд ядра: Al * Si; О * S.
б) число электронных слоев: Al * Si; О * S.
в) число электронов на внешнем слое: С * N; Mg * Са.
г) радиус атома: А1 * Si; О * S.
д) металлические свойства: Al * Si; О * S.
е) неметаллические свойства: Al * Si; О * S.
7. Общее число электронов у атома родия: А)25 Б)34 В)45 Г)81
Контрольная работа №1
по темам «Строение атома. Периодический закон Д.И.Менделеева».
Вариант 2.
I. Сколько электронов находится на внешнем энергетическом уровне в атоме алюминия:
А)3 Б) 4 В)6 . Г)16.
2. В одной группе находятся элементы
- с одинаковым числом протонов; Б) с одинаковым радиусом атомов;
- с одинаковым числом валентных электронов;
Г) с зарядом ядра, последовательно возрастающим на 1.
3.В ряду химических элементов Na-Mg-Al-Si металлические свойства А) усиливаются Б) не изменяются В) ослабевают Г) изменяются периодически
4. Электронная конфигурация …3s Зр соответствует элементу
А) кальций Б) алюминий В) кадмий Г) цинк.
5. К S-элементам относится
А) хлор Б) сера В) водород Г) медь
6.Сравните атомы, поставив знаки <, > или = вместо * :
а) заряд ядра: С * N; Mg * Са.
б) число электронных слоев: С * N; Mg * Са.
в) число электронов на внешнем слое: С * N; Mg * Са.
г) радиус атома: С * N; Mg * Са.
д) металлические свойства: С * N; Mg * Са.
е)неметаллические свойства: С * N; Mg * Са.
7. Общее число электронов у атома марганца : А)25 Б)34 В)45 Г)81
Контрольная работа по теме «Строение атома» химия 11 класс
Контрольная работа №1 «Строение атома» 11 класс
Вариант 1
1. Число подуровней на втором уровне равно
1) 1 2) 2 3) 3 4) 4
2. Число ориталей на s-подуровне равно:
1) 1 2) 3 3) 5 4) 7
3. Число энергетических уровней в атоме золота равно:
1) 8 2) 5 3) 6 4) 7
4. Максимальное число электронов на четвертом уровне равно:
1) 2 2) 8 3) 18 4) 32
5. Гантелеобразную форму имеет
1) s -орбиталь 2) f –орбиталь 3) р -орбиталь 4) d –орбиталь
6. Максимальное число электронов на d-подуровне равно :
1) 2 2) 6 3) 10 4) 14
7. Подуровень, расположенный дальше от ядра, — это
1) 1s 2) 4s 3) 3s 4) 2s
8. Какие модели строения атома вам известны?
9. Как называются; что характеризуют; какие значения могут принимать данные квантовые числа:
а) n
б) m
а) определите количество электронов, протонов, нейтронов и заряд ядра атома;
б) установите в какой группе и в каком периоде он находится;
в) составьте схему электронного строения, электронную формулу и электронно-графическую формулу данного атома.
Контрольная работа № 1 «Строение атома» 11 класс
Вариант 2
1. Число подуровней на третьем уровне равно
1) 1 2) 2 3) 3 4) 4
2. Число орбиталей на p-подуровне равно:
1) 1 2) 3 3) 5 4) 7
3. Число энергетических уровней в атоме серебра равно:
1) 8 2) 5 3) 6 4) 7
4. Максимальное число электронов на третьем уровне равно:
1) 2 2) 8 3) 18 4) 32
5. Сферическую форму имеет
1) s -орбиталь 2) f –орбиталь 3) р -орбиталь 4) d -орбиталь
6. Максимальное число электронов на p-подуровне равно :
1) 2 2) 6 3) 10 4) 14
7. Подуровень, расположенный ближе к ядру, — это
1) 1s 2) 4s 3) 3s 4) 2s
8. Какова современная модель строения атома? Что такое атом?
9. Как называются; что характеризуют; какие значения могут принимать данные квантовые числа:
а) l
б) s
10. Химический элемент Ниобий опишите строение его атома и положение в ПС Д.И.Менделеева:
а) определите количество электронов, протонов, нейтронов и заряд ядра атома;
б) установите в какой группе и в каком периоде он находится;
в) составьте схему электронного строения, электронную формулу и электронно-графическую формулу данного атома.
Урок в 11 классе по теме «Контрольная работа по теме «Строение атома»»
Контрольная работа № 1 по теме: «Строение атома».
I вариант.
1 Укажите заряд ядра атома фосфора
1) + 31 2) +16 3) +15 4) +30
2 Число нейтронов в ядре изотопа
1) 10 2) 11 3) 20 4) 9.
3 Число электронов в ионе алюминия AL 3+ равно
1) 10 2) 13 3) 14 4) 16
4 Число электронов в атоме аргона равно числу электронов в ионе
1) S2- 2) AL3+ 3)Na+ 4)F—
5 Восьмиэлектронную внешнюю оболочку имеет ион
|
1) Р |
3) S 2- |
|
2) Fe 2+ |
4) CI 5+ |
6 Среди элементов VIА группы максимальный радиус атома имеет
|
1) кислород |
3) теллур |
|
2) сера |
4) полоний |
7 В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
|
1) Na, Mg, AI, Si |
3) P,S, CI, Ar |
|
2) Li, Be, B,C |
4) F, O,N,C |
8 В каком ряду химические элементы расположены в порядке усиления металлических свойств?
|
1) Na, Mg, Al |
3) Cа, Mg, Be |
|
2) Al, Mg, Na |
Mg, Be, Cа |
9 В ряду химических элементов Si P S CI неметаллические свойства
|
1) ослабевают |
3) не изменяются |
|
2) усиливаются |
4) изменяются периодически |
10 Наименьшей электроотрицательностью обладает элемент
11 В ряду Li Na K Rb способность металлов отдавать электроны
|
1) возрастает |
3) не изменяются |
2) ослабевает |
4) изменяются периодически |
12 Формула высшего оксида хлора
|
1) Cl2O |
3) Cl2O6 |
|
2) ClO2 |
4) Cl2O7 |
13 Какие из приведенных утверждений верны?
А. Основным оксидам соответствуют основания.
Б. Основные оксиды образуют только металлы.
|
1) верно только А |
3) верны оба утверждения |
|
2) верно только Б |
4) оба утверждения неверны. |
14 В ряду оксидов SiO2 P2 O 5 SO3
|
1) кислотные свойства возрастают |
3) основные свойства возрастают |
|
2) кислотные свойства ослабевают |
4) свойства не изменяются |
15 В ряду химических элементов бор – углерод – азот возрастает
1) способность атома отдавать электроны 3) высшая степень окисления
|
В задании № 16 на установление соответствия запишите в таблицу цифры выбранных вами ответов. (Цифры в ответе могут повторяться.) |
16. Установите соответствие между элементом, частицей и электронной формулой.
|
Элемент, частица |
Электронная формула |
|
1) Ca |
1) 1s22s2 2p6 3s23p6 |
|
2) Сu |
2) 1s22s2 2p6 3s23p6 4s2 |
|
3) S 2- |
3) 1s22s2 2p6 3s23p6 4s13d10 |
|
4) S 4+ |
4) 1s22s2 2p6 3s23p6 4s23d9 |
|
|
5) 1s22s2 2p6 3s2 |
|
|
6) 1s22s2 2p6 3s23p2 |
17 Для атома химического элемента с порядковыми номером 34 опишите состав атома (число протонов, нейтронов, протонов), нарисуйте схему строения атома, составьте электронную формулу и электронно-графическую схему. Укажите семейство. Напишите число валентных электронов в основном и возбужденном состоянии атома, высшую и низшую степень окисления. Запишите тип элемента (металл, неметалл, переходный элемент), формулу высшего оксида и гидроксида (кислота, основание, амфотерный гидроксид), укажите их характер. Формулу водородного соединения (его характер).
18. Атом химического элемента имеет на семь электронов меньше, чем ион хлора. Назовите элемент, составьте электронную формулу его атома и иона.
19. Составьте электронные формулы атомов кремний и титана. Отметьте черты сходства и различия в строении этих химических элементов. Определите высшую и низшую возможные для этих атомов степени окисления. Напишите формулы высших оксидов этих элементов и соответствующих им гидроксидов. Укажите их характер.
Объясните, почему кремний и титан находятся: а) в IV группе Периодической системы химических элементов Д.И. Менделеева; б) в разных подгруппах этой группы.
20. Одинаковые ли валентные возможности азота и фосфора? Поясните ответ, составив графические схемы строения атомов этих элементов, указав валентности.
21. Составьте химические формулы высших оксидов, гидроксидов для следующих химических элементов:
Сa, Sr, Ba. Укажите их характер. Расположите в порядке возрастания их свойств.
22. Составьте химические формулы высших оксидов, гидроксидов для следующих химических элементов:
P, S, CL. Укажите их характер. Расположите в порядке уменьшения их свойств.
23. Напишите формулы соединений с водородом следующих химических элементов: O, I, F, CL, Na, Br. Выберите формулы соединений, обладающих кислотными свойствами, и расположите их в ряд в порядке убывания кислотных свойств.
24. На основании положения в Периодической системе расположите элементы: О, F, CL, S — в порядке возрастания окислительных свойств. Объясните ответ.
25. Составьте электронные формулы ионов: Na+,As3-,Fe3+.
26. Составьте электронную формулу и энергетическую диаграмму для Cr0 .Составьте электронные формулы : Cr0,Cr2+,Cr3+,Cr 6+
Контрольная работа № 1 по теме: «Строение атома».
II вариант.
1Укажите заряд ядра атома калия
1) + 19 2) +20 3) +39 4) +32
2 Число нейтронов в ядре изотопа 17О равно …
1) 3 2) 7 3) 9 4) 14.
3 Число электронов в ионе цинка Zn2+ равно
4 Число электронов в атоме неона равно числу электронов в ионе
|
1) S2- |
3) CL— |
|
2) K+ |
4) Na+ |
5 Какую электронную конфигурацию имеет атом наиболее активного металла
|
1) 1s22s2 2p6 3s2 |
3) 1s22s2 2p1 |
|
2) 1s22s2 2p6 3s1 |
4) 1s22s1 |
6 Среди элементов VII А группы максимальный радиус атома имеет
|
1) фтор |
3) бром |
|
2) хлор |
4) йод |
7 В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
|
1) Be, B, C,N |
3) O, S, Se, Te |
|
2) Rb, K, Na, Li |
4) Mg, AI, Si, P |
8 В каком ряду химические элементы расположены в порядке усиления неметаллических свойств?
|
1) F,O,N |
3) O,S,Se |
|
2) As, P, N |
4) CI, S, P |
9 В ряду химических элементов Li Na K металлические свойства
|
1) возрастают |
3) не изменяются |
|
2) ослабевают |
4) периодически повторяются |
10 Наибольшей электроотрицательностью обладает элемент?
11 В ряду Na Mg AI способность металлов отдавать электроны
|
1) возрастает |
3) не изменяются |
|
2) ослабевает |
4) изменяются периодически |
12 К кислотным оксидам относится
|
1) BeO |
3) Na2O |
|
2) CaO |
4) СО2 |
13 Какие из приведенных утверждений верны?
А. В периоде слева направо радиус атомов уменьшается.
Б. В периоде слева направо металлические свойства усиливаются.
|
1) верно только А |
3) верны оба утверждения |
|
2) верно только Б |
4) оба утверждения неверны. |
14 В ряду оксидов Li2O Na2O K2O
|
1) кислотные свойства возрастают |
3) основные свойства ослабевают |
|
2) основные свойства возрастают |
4) свойства не изменяются. |
15 В ряду элементов: азот кислород фтор увеличивается
|
1) атомный радиус |
3) число s- электронов в атоме |
|
2) число неспаренных электронов в атоме |
4) электроотрицательность |
|
В задании № 16 на установление соответствия запишите в таблицу цифры выбранных вами ответов. (Цифры в ответе могут повторяться.) |
В1 Установите соответствие между элементом, частицей и электронной формулой.
|
Элемент, частица |
Электронная формула |
|
1) K |
1) 1s22s2 2p6 3s23p6 |
|
2) Сr |
2) 1s22s2 2p6 3s23p6 4s1 |
|
3) P3- |
3) 1s22s2 2p6 3s23p6 4s13d5 |
|
4) P 5+ |
4) 1s22s2 2p6 3s23p6 4s23d4 |
|
|
5) 1s22s2 2p6 3s2 |
|
|
6) 1s22s2 2p6 |
18. Для атома химического элемента с порядковым номером 31 опишите состав атома (число протонов, нейтронов, протонов), нарисуйте схему строения атома, составьте электронную формулу и электронно-графическую схему. Укажите семейство. Напишите число валентных электронов в основном и возбужденном состоянии атома, высшую и низшую степень окисления. Запишите тип элемента (металл, неметалл, переходный элемент), формулу высшего оксида и гидроксида (кислота, основание, амфотерный гидроксид), укажите их характер. Формулу водородного соединения (его характер).
18. Атом химического элемента имеет на шесть электронов больше, чем ион магния. Назовите элемент, составьте электронную формулу его атома и иона.
19. Составьте электронные формулы атомов ванадия и фосфора. Отметьте черты сходства и различия в строении этих химических элементов. Определите высшую и низшую возможные для этих атомов степени окисления. Напишите формулы высших оксидов этих элементов и соответствующих им гидроксидов. Укажите их характер.
Объясните, почему ванадий и фосфор находятся: а) в V группе Периодической системы химических элементов Д.И. Менделеева; б) в разных подгруппах этой группы.
20. Одинаковые ли валентные возможности кислорода и серы? П
Тест по темам «Строение атома» и «Строение вещества», ФГОС
Тестовая работа по химии 11 класс (УМК О.Габриеляна базовый уровень)
по темам «Строение атома», «Строение вещества».
Проверяемые элементы содержания.
Часть А содержит 16 заданий с кратким ответом (базовый уровень сложности).
А1 – Модели строение атомов. Периодический закон Д. И. Менделеева, его формулировки.
А2 – Физический смысл структурных элементов Периодической системы в свете учения о строении атома.
А3 – Строение энергетических уровней и подуровней
А4 – Классификация химических элементов (s, p, d, f)
А5 – Электронные конфигурации атомов
А6 – Классификация химических соединений (оксидов и гидроксидов)
А7 – Изменение свойств химических элементов в периоде и группе
А8 — Взаимосвязь между строением атома и формулой образуемых им химических соединений.
А9 — Изотопы, состав их атомов
А10 — Типы химической связи
А11 — Типы химической связи
А12 — Характеристики химической связи
А13 — Характеристики химической связи
А14 — Типы кристаллических решеток
А15 — Классификация дисперсных систем
А16 — Коллоидные системы
Часть Б содержит 3 задания с развернутым ответом (повышенный уровень сложности).
Б17 – Взаимосвязь между строением атома и составом и свойствами образуемых им химических соединений.
Б18 – Взаимосвязь между составом химического соединения и типами связи и кристаллической решетки в нём.
Б19 — Расчет массовой доли растворенного вещества в растворе
Вариант 1
Часть А (ответом к заданиям 1-16 является одна цифра)
1) Модель атома «пудинг с изюмом» была предложена
А). Н.Бором Б). Э.Резерфордом В). Дж. Томсоном Г). Д.Чедвигом.
2) Порядковый номер элемента в периодической системе определяет:
А). Заряд ядра атома.
Б). Число электронов в наружном слое атома.
В). Число электронных слоёв в атоме.
Г). Число нейтронов в атоме.
3) Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней:
А). B и Si. Б). S и Sе. В). K и Са. Г). Mn и Fe.
4) s-элементом является:
А). Барий. Б). Америций. В). Галлий. Г). Ванадий.
5) Электронная конфигурация …3d64s2 соответствует элементу:
A). Аргону. Б). Железу. В). Криптону. Г). Рутению
6) Амфотерным гидроксидом является вещество, формула которого:
А). Be(OH)2. Б). h3SiO3. В). Mg(OH)2 . Г). Ba(OH)2.
7) Ряд элементов, расположенных в порядке усиления металлических свойств:
А). Sr-Rb-K. Б). Na-K-Ca. В). Na-K-Cs. Г). Al-Mg-Be.
8) Элемент Э с электронной формулой 1s22s22p63s23p3 образует высший оксид, соответствующий формуле:
А). Э2О. Б). Э2О3. В). ЭО2. Г). Э2О5.
9) Изотоп железа, в ядре которого содержится 28 нейтронов, обозначают:
А). 54/26Fe. Б). 56/26Fe. В). 57/26Fe. Г). 58/26Fe.
10). Формула вещества с ковалентной полярной связью:
А) Cl2. Б). KCl. В). Nh4. Г). O2.
11) Вещество, между молекулами которого существует водородная связь, -это:
А). Этанол. Б). Метан. В). Водород. Г). Бензол.
12). Число общих электронных пар в молекуле водорода:
А). Одна. Б). Две. В). Три. Г). Четыре
13) Полярность химической связи увеличивается в ряду соединений, формулы которых:
А). Nh4, HI, O2. Б). Ch5, h3O, HF. В). Ph4, h3S, h3. Г). HCl, Ch5, Cl2.
14) Кристаллическая решетка хлорида магния:
А). Атомная. Б). Металлическая. В). Ионная. Г). Молекулярная.
15) Молоко — это:
А). Суспензия. Б). Эмульсия. В). Золь. Г). Гель.
16) Самопроизвольное уменьшение объема геля, сопровождаемое отделением жидкости, называется
А). Коагуляция. Б). Седиментация. В). Синерезис. Г). Эффект Тиндаля.
Часть Б(к заданиям 17-19 требуется привести подробное решение)
17). Составьте электронную формулу элемента с порядковым номером 32 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
18) Составьте схемы образования соединений (электронную и структурную формулы), состоящих из химических элементов А). Кремния и хлора. Б). Натрия и азота. Укажите тип химической связи и тип кристаллической решетки в каждом соединении.
19) В 280 г 15% раствора хлорида цинка растворили 12 г этой же соли. Какова масса хлорида цинка в полученном растворе?
Вариант 2
Часть А (ответом к заданиям 1-16 является одна буква)
1) Планетарная модель атома была предложена
А). Д.Менделеевым. В). Дж. Томсоном.
Б). Э.Резерфордом. Г). Д.Чедвигом.
2) Номер периода в Периодической системе определяет:
А). Заряд ядра атома.
Б). Число электронов в наружном слое атома.
В). Число электронных слоёв в атоме.
Г). Число электронов в атоме.
3) Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней:
А). S и Cl. Б). Be и B. В). Kr и Xe. Г). Mo и Se.
4) p-Элементом является:
А). Скандий. Б). Барий. В). Мышьяк. Г). Гелий.
5) Электронная конфигурация …3d104s2 соответствует элементу:
A). Кальцию. Б). Криптону. В). Кадмию. Г). Цинку.
6) Амфотерным гидроксидом является вещество, формула которого:
А). Zn(OH)2. Б). Mg(OH)2. В). Ca(OH)2 . Г). Cr(OH)2.
7) Ряд элементов, расположенных в порядке усиления металлических свойств:
А). Mg-Ca-Zn. Б). Al-Mg-Ca. В). Sr-Rb-K. Г).Ge-Si-Sb.
8) Элемент Э с электронной формулой 1s22s22p63s23p63d104s24p1 образует высший оксид, соответствующий формуле:
А). Э2О. Б). Э2О3. В). ЭО2. Г). ЭО3.
9) Изотоп кальция, в ядре которого содержится 22 нейтрона, обозначают:
А). 40/20Ca. Б). 42/20Ca. В). 44/20Ca. Г). 48/20Ca.
10) Формула вещества с ионной связью:
А). HCl. Б). KBr. В). P4. Г). Ch4OH.
11).Вещество с металлической связью:
А). Оксид калия. Б). Медь. В). Кремний. Г). Гидроксид магния.
12). Число общих электронных пар в молекуле азота:
А). Одна. Б). Две. В). Три. Г). Четыре
13). Полярность химической связи уменьшается в ряду соединений, формулы которых:
А). Cl2, h3S, CO2. Б). Nh4, Ph4, SO2. В). HCl, HBr, HI. Г). Bh4, Nh4, HF.
14).Кристаллическая решетка оксида кремния (IV):
А). Атомная. Б). Металлическая. В). Ионная. Г). Молекулярная.
15). Эмалевая краска — это:
А). Суспензия. Б). Эмульсия. В). Золь. Г). Гель.
16). Слипание коллоидных частиц – это
А). Коагуляция. Б). Седиментация. В). Синерезис. Г). Эффект Тиндаля.
Часть Б(к заданиям 17-19 требуется привести подробное решение)
17). Составьте электронную формулу элемента с порядковым номером 30 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
18). Составьте схему образования соединений (электронную
Атомная структура | Примечания, видео, контроль качества и тесты | 11 класс> Химия> Атомная структура
Атомная структура
Атомная структура
Термин «атом» происходит от греческого слова «atomos», означающего «неделимый», и был введен Демокритом примерно в 450 г. до н.э. Атом — фундаментальная единица материи. В 1808 году английский химик Джон Дальтон предложил фундаментальную концепцию структуры материи через атомную теорию Дальтона.Основные постулаты атомной теории Дальтона:
i) Каждая материя состоит из мельчайших частиц, называемых атомами.
ii) Атом — неделимая и недеструктивная единица.
iii. Атом рассматривается как сферическая частица, которую нельзя ни создать, ни разрушить.
iv) Атомы одних и тех же элементов идентичны во всех отношениях.
v) Атомы подвергаются химическому соединению с образованием составного атома (молекулы) в простом целочисленном соотношении.
Атомная теория Дальтона была хорошо принята до 19 века.В дальнейшем было замечено множество недостатков. Итак, эта теория была переработана, уточнена и развита новыми исследователями. Главное, на что следует обратить внимание, — это то, является ли атом делимым или нет.
Открытие элемента (эксперимент с разрядной трубкой)
Электрон был впервые обнаружен Дж. Дж. Томпсоном в 1879 году с помощью эксперимента с разрядной трубкой. В этом эксперименте он наполнял газом специально разработанную стеклянную трубку (разрядную трубку), снабженную металлическими электронами.
Разряд осуществляется при высоком электрическом напряжении (10 000 В) и низком давлении (10 -3 мм рт. Ст.).
В этом состоянии луч начинает перемещаться от катода к аноду; эти лучи были названы катодными лучами. Были исследованы следующие свойства катодных лучей:
i) Катодные лучи отбрасывают тень от объекта на своем пути.
ii) Они движутся по прямой.
iii. Катодные лучи отклоняются к аноду в присутствии электрического поля, указывая на то, что они несут отрицательный заряд.
iv) Они вызывают нагревание змеевика.
v) Катодные лучи могут вызывать флуоресценцию экрана из сульфида цинка.
После исследования свойств катодных лучей он пришел к выводу, что катодные лучи несут отрицательный заряд с определенной массой. Позже эти лучи Стони назвал электронными. Он обозначается как e — или просто e.
Открытие анодных лучей или открытие протона
Протон был открыт после открытия электрона с предположением, что должна существовать положительно заряженная частица наряду с отрицательно заряженной частицей, поскольку атом электрически нейтрален.
Протон был открыт Э. Гольдштейном в 1886 году с помощью эксперимента с разрядной трубкой с перфорированным катодом.
В своем эксперименте он пропустил высокое электрическое напряжение (10000 В) в стеклянную трубку, заполненную газообразным водородом и снабженную перфорированным катодом. Разряд осуществляется при низком давлении (10 -3 мм рт. Ст.)
В этих условиях два типа лучей движутся в двух противоположных направлениях. Те лучи, которые движутся к катоду, были названы анодными лучами.Были исследованы следующие свойства:
i) Анодные лучи отбрасывают тень объекта на своем пути.
ii) Они движутся по прямой.
iii.) Анодные лучи отклоняются к катоду в присутствии электрического поля, указывая на то, что они несут положительный заряд.
iv) Они вызывают нагревание змеевика.
v) Анод может вращать небольшую лопасть, помещенную на их пути.
После исследования свойств анодных лучей он пришел к выводу, что анодные лучи несут положительный заряд с определенной массой.Эти лучи получили название протон. Он обозначается как p + или просто p.
Открытие нейтрона
Нейтрон был открыт сэром Джеймсом Чедвиком в 1932 году. В своем эксперименте он бомбардировал α-частицу (эквивалентную атому гелия) на Be-мишень. Возникла другая частица, не имеющая заряда и массы, почти равной протону.
Выброшенная частица была названа Чедвиком нейтроном. Он обозначается как 1 0 n или просто «n».
Субатомная частица
Более мелкие частицы, присутствующие внутри атома, называются субатомными частицами. Было обнаружено более 36 субатомных частиц, таких как электрон, протон, нейтрон, мезон, лептон, нейтрино и т. Д. Из более чем 36 субатомных частиц электрон, протон и нейтрон называют фундаментальными субатомными частицами.
Вопрос: Каковы фундаментальные субатомные частицы? Почему их так называют?
Ответ:
Электроны, протоны и нейтроны являются фундаментальными субатомными частицами.
Они называются так по следующим причинам. Элемент обычно известен по его атомному номеру. Например, атомный номер 14 представляет кремний. Источником атомного номера элемента является количество протонов или количество электронов, присутствующих в атоме элемента. Помимо этого, масса атома представлена его атомной массой. Например, натрий состоит из 11 протонов и 12 нейтронов. Таким образом, его атомная масса или массовое число равно (11 + 12), т.е. 23. Происходящие химические реакции включают потерю или получение или долю электронов, которые могут быть получены соединением или молекулой.Например: в химической реакции 2Na + Cl 2 → 2NaCl , Na теряет электрон, а хлор приобретает электрон.
Сравнительное исследование электрона, протона и нейтрона
1) Электрон (e — или e)
Открытие: Дж. Дж. Томпсон (1879)
— Нобелевская премия 1906 г.
Заряд: -1,602 x 10 -19 C (-1)
Масса (масса покоя): 9,11 x 10 -28 г ИЛИ 0,00055 а.е.м.
Античастица: позитрон (e + )
2) Протон (стр. + или p)
Открытие: E.Гольдштейн (1886)
Заряд: +1,602 x 10 -19 C (+1)
Масса: 1,673 x 10 -24 г или 1,0072 а.е.м.
Античастица: Антипротон
3) Нейтрон
Открытие: сэр Джеймс Чедвик (1932)
— Нобелевская премия: 1935
Заряд: Без заряда
Масса: 1,673 x 10 -24 г ИЛИ 1,0086amu (почти равна массе атома водорода)
Античастица: Антинейтрон ()
Атомная модель
Эксперимент по рассеянию лучей Резерфорда α
Эрнест Резерфорд и его ученики в 1911 году провели эксперимент по определению местоположения электронов протоны внутри атома.Этот эксперимент известен как эксперимент с золотой фольгой или эксперимент Резерфорда по рассеянию α-лучей.
В его эксперименте кусок радиоактивного вещества (полония) был помещен внутрь свинцовой полости в качестве источника α-частиц (эквивалентно дважды ионизированному ядру гелия, He 2+ ).
Узкий пучок α-частиц направлялся через щели и направлялся на тонкую золотую фольгу. Рассеяние α-частиц контролировали с помощью подвижного экрана из сульфида цинка вместе с микроскопом, как показано на рисунке, поскольку экран из сульфида цинка дает вспышку, когда α-частицы попадают в него.
Наблюдение
i) Большая часть α-частиц (около 99%) прошла через золотую фольгу без какого-либо отклонения.
ii) Некоторые из α-частиц отклоняются на небольшой угол.
iii) Лишь несколько α-частиц (1 из 10 000) отклоняются на большой угол, а некоторые из них (1 из 20 000) отражаются назад, испытывая угол отклонения 180 0 .
Заключение
i) Большая часть α-частиц проходит через золотую фольгу без отклонения. Из этого следует, что большая часть пространства внутри атома — это вакуум.
ii) Поскольку α-частица заряжена положительно, отклонение α-частицы приводит к выводу, что внутри атома должно быть наличие тяжелого положительно заряженного тела, поскольку одинаковые заряды отталкиваются друг от друга. Тяжелое положительно заряженное тело внутри атома Резерфорд назвал ядром.
iii. Отклонение через большое и обратное рассеяние всего нескольких α-частиц приводит к выводу, что ядро занимает очень малый объем по сравнению с общим объемом атома.
Модель атома Резерфорда или модель ядра или модель планеты
Принимая во внимание экспериментальное наблюдение и заключение, Резерфорд предложил модель атома, известную как модель ядра или модель планеты.Согласно этой модели, положительно заряженное ядро окружено системой электронов. Электроны движутся вокруг ядра с высокой скоростью, как движение планет в солнечной системе. Положительно заряженное ядро связано с наличием протонов. Электроны и протоны удерживаются вместе электростатической силой. Эффективный объем ядра очень мал по сравнению с общим объемом атома.
После открытия нейтрона в 1932 году положение нейтрона было дано внутри ядра атома, так как масса нейтрона почти равна массе протона, а большая часть массы атома сосредоточена. в центре атома.
Ограничения или недостатки модели атома Резерфорда
а) Стабильность атома: Отрицательно заряженный протон вращается вокруг ядра, как предполагает Резерфорд, но согласно классической теории электродинамики, любая ускоренная заряженная частица испускает излучение и теряет энергию. Электрон также является заряженной частицей и при движении теряет энергию в виде излучения. С постепенной потерей энергии электрон приближается к ядру и в конечном итоге падает на него, вызывая коллапс атома, но этого никогда не происходит с атомом, поскольку атом — очень стабильная частица.Резерфорд не мог объяснить стабильность атома.
b) Объяснение происхождения атомных спектров: Когда электрон атома набирает или теряет энергию, он производит разноцветную линию на спектре, которая называется атомным спектром. Атомные спектры — очень важная характеристика атома. Атомные спектры разрывного типа. Резерфорд не мог объяснить происхождение атомных спектров даже для простого атома водорода.
Модель атома Бора или модель квантованной оболочки
Чтобы преодолеть ограничение атомной модели Резерфорда, в 1913 году Нил Бор предложил модель квантованной оболочки.Основными постулатами атомной модели Бора являются:
i) Центр атома содержит протон в очень маленьком объеме, и электрон вращается вокруг ядра по определенной круговой траектории, называемой орбитой или энергетической оболочкой.
ii) Орбита атома связана с фиксированной энергией и удерживающей способностью электронов. Он обозначается буквами K, L, M и т. Д. Или цифрами как n = 1, n = 2, n = 3 и т. Д. В направлении наружу от центра.
iii) Максимальное количество электронов, которое может вместить орбита, определяется правилом 2n 2 .
iv) Энергия орбиты продолжает увеличиваться наружу от центра, то есть E 1
v) В основном состоянии электрон не теряет и не набирает энергию. Это объясняет стабильность атома.
vi) Поглощение или испускание энергии электроном переводит его на более высокий энергетический уровень или понижает его на более низкий энергетический уровень во время прыжка, соответственно.Степень скачка зависит от количества энергии, поглощенной или высвобождаемой электроном.
vii) Поглощение или испускание энергии всегда происходит в полном количестве квантов. Итак, электрон не может находиться между двумя орбитами. Это объясняет происхождение атомных спектров.
viii) Разрешена только энергетическая оболочка, в которой угловой момент электрона является целым кратным \ (\ frac {h} {2Π} \).
то есть mvr = n \ (\ frac {h} {2Π} \)
Это известно как квантование углового момента электрона на орбите.2} \)
Z = Атомный номер
K e = Колумбическая постоянная
e = заряд электрона
Объяснение линейчатых спектров водорода на основе атомной модели Бора
Атом состоит из бесконечной количество орбит. Каждая орбита связана с фиксированным количеством энергии и удерживающей способностью электронов. При подаче энергии электрон продвигается на более высокий энергетический уровень, а после отвода энергии электрон возвращается на более низкий энергетический уровень в зависимости от количества поглощенной или высвобожденной энергии.Во время этого процесса поглощения и излучения разрешаются атомные спектры.
В случае водорода молекулярный водород подвергается воздействию разрядной трубки (при высоком напряжении и низком давлении). Сначала молекулярный водород диссоциирует на атомарный водород, а позже дополнительная энергия используется для продвижения электрона на более высокий энергетический уровень. Поскольку возбужденное состояние нестабильно, электроны возвращаются на более низкий энергетический уровень излучающим светом с характерной длиной волны. Таким образом, возникают линейчатые спектры водорода.2}) \)
λ = длина волны излучения
R d = постоянная Ридберга (1,09 x 10 -7 м -1 )
n L = более низкий уровень энергии
n H = более высокий уровень энергии
Пример: Найдите длину волны излучения, когда электрон проходит с орбиты 5 на орбиту 7 .
Здесь
n L = 5
n H = 7
R d = постоянная Ридберга (1.3} \)
или, λ = 4,6 x 10 -4 см
Недостатки атомной модели Бора
i) Атомная модель Бора не может объяснить спектры и энергию атома, содержащего более 1 электрона.
ii) Эта модель не может учитывать относительную яркость спектральной линии, в то время как некоторые линии кажутся яркими или тусклыми.
iii) Спектральная линия состоит из ряда мелких линий (тонкая структура). Атомная модель Бора не может объяснить происхождение тонкой структуры.
iv) Эта модель не может объяснить причину, по которой атомы подвергаются химическому соединению с образованием соединения или почему соединения более стабильны, чем составляющие их атомы.
v) Согласно атомной модели Бора предполагается, что электрон вращается по фиксированной круговой траектории с фиксированной скоростью, но современные исследования показывают, что концепция Бора о фиксированной круговой траектории больше не имеет значения.
Волновое уравнение де-Бройля (двойственная природа частицы)
В 1924 году де-Бройль предположил, что электрон при движении ведет себя как частица, а также как волна.Он назвал его волной материи, которая отличается от механической волны, такой как свет, звук, электромагнитное излучение.
Согласно соотношению масса — энергия Эйнштейна
E = mc 2 ————— (i)
где m — масса частицы, а c — скорость света и согласно уравнению энергии фотона Планка
E = hν ————— (ii)
где h — постоянная Планка (значение = 6,6 x 10 -34 Джс) и v (ню) — частота излучения.
Объединение (i) и (ii)
mc 2 = hν
или, mc 2 = h \ (\ frac {c} {λ} \) [Поскольку c = νλ]
или, λ = \ (\ frac {h} {mc} \) ———- (iii)
Если скорость электрона равна v, то это уравнение принимает вид
или λ = \ ( \ frac {h} {mv} \) ———- (iv)
Это называется волновым уравнением де Бройля. Длина волны электрона очень мала. Таким образом, его стоимость не может быть определена точно.
Принцип неопределенности Гейзенберга
В 1927 году Вернер Гейзенберг выдвинул принцип неопределенности.Согласно этому принципу, и положение, и импульс или скорость меньшей частицы, такой как электрон, не могут быть определены точно одновременно, то есть чем точнее определяется положение, тем менее точным становится импульс, и наоборот.
Пусть Δx и Δp — неопределенности положения и импульса соответственно, тогда согласно этому принципу
Δx.Δp ≥ \ (\ frac {h} {4Π} \)
Отсюда ясно, что увеличение в неопределенности положения уменьшает неопределенность импульса и наоборот.
Итак,
Δp = m Δv
, где Δv = неопределенность скорости
, т.е. м Δv. Δx ≥ \ (\ frac {h} {4Π} \)
то есть Δv. Δx ≥ \ (\ frac {h} {4Πm} \)
Следовательно, неопределенность более выражена для более мелких частиц.
Орбитальная или субоболочка
Орбиталь — это трехмерное пространство вокруг ядра, где вероятность нахождения электрона максимальна. Есть четыре типа орбиталей. Это:
i) S — атомная орбиталь (сферическая)
ii) p — атомная орбиталь (основная)
iii) d — атомная орбиталь (диффузная)
iv) f — атомная орбитальная (основная)
Каждая атомная орбиталь может содержать максимум 2 электрона.Эти электроны движутся в двух противоположных направлениях: один движется по часовой стрелке, а другой — против часовой стрелки.
i) s-атомная орбиталь
Вся атомная орбиталь имеет s-атомную орбиталь. Вероятность нахождения электрона на s-атомной орбитали одинакова во всех направлениях на поверхности сферы, поскольку она имеет сферическую геометрию. Коэффициент орбитали указывает орбиту, к которой он принадлежит. Например: «1s» означает, что s-атомная орбиталь принадлежит 1-й орбите (K) и так далее.Каждая s-атомная орбиталь может содержать максимум 2 электрона. Энергия различных s-атомных орбиталей продолжает увеличиваться кнаружи от центра и следует следующему порядку
1s <2s <3s и так далее
ii) p — атомная орбиталь
Все p-атомные орбитали имеют форму гантели. и стартует с орбиты 2 . p-атомная орбиталь имеет три ориентации Px, P y и P z вдоль оси x, оси y и оси z соответственно.
Каждая ориентация состоит из двух лепестков на двух противоположных концах.Вероятность нахождения электрона максимальна в лепестках и минимальна в узловых плоскостях. p — атомная орбиталь может содержать максимум 6 электронов. Энергии p-атомной орбитали равны, т.е. E Px = Epy = E Pz , p-атомная орбиталь проявляет свойства направленности.
iii) d и f атомные орбитали
d и f атомные орбитали имеют очень сложную форму и начинаются с 3-й и 4-й орбит соответственно. d-атомная орбиталь имеет высокую ориентацию, и максимальное количество электронов, которое она может достичь, равно 10.Точно так же f атомные орбитали имеют 7 ориентаций, и максимальное количество электронов, которое они могут получить, равно 14.
Квантовое число
Квантовое число — это набор из 4 чисел, который описывает энергию электрона (основной уровень энергии, форма орбитали, ориентация орбитали в пространстве и вращение электрона вокруг собственной оси). Есть 4 квантовых числа. И они равны
i) Главное квантовое число (n)
ii) Квантовое число азимутального / углового момента (l)
iii) Магнитное квантовое число (m)
iv) Спиновое квантовое число (а)
i) Главное квантовое число (n)
Квантовое число, которое описывает энергию электрона на основном энергетическом уровне, на котором присутствует электрон, известно как главный квант число.2} \) (ev)
т.е. E 3 > E 2 > E 1
ii) Азимутальное квантовое число
Квантовое число, которое описывает форму орбитали, на которой находится электрон, известно. как.
азимутальное квантовое число. Обозначается буквой «l».
Может иметь только + ve целочисленное значение от 0 до (n — 1), где n — главное квантовое число.
Табл. 1: Обозначение субкорпуса
| Значение l | Обозначение субкорпуса | Спектроскопический термин | |||
| 0 | s | острый 1 | 9055 основной | ||
| 2 | d | диффузный | |||
| 3 | f | основной |
Номер таблицы 2: Соотношение n и l
| Значение l (от 0 до n-1) | Номер подоболочки | Обозначение | ||
| 1 | 0 (с) | 1 | 1s | |
| 2 | 2s и 2p | |||
| 3 | 0,1,2 (s, p, d) | 3 | 3s и 3p | |
| 4 | 0,1,2,3 (s, p, d, f) | 4 | 4s, 4p, 4d и 4f |
iii) Магнитное квантовое число
Квантовое число, которое описывает ориентацию орбитали в пространстве, называется магнитным квантовым числом.Он представлен буквой «м». Он может иметь любое целочисленное значение от -l до + l до 0, где l — азимутальное квантовое число. Для данного значения l будет (2l + 1) значений m.
Таблица № 3: Соотношение между l и m
| Значение l | Количество значений m (2l + 1) | Значения m (от -l до + l через0) | Обозначение |
| 0 (s) | 1 | 0 | s |
| 1 (p) | 3 | -1, 0, +1 | ,, P y P z|
| 2 (d) | 5 | -2, -1,0, + 1, + 2 | d xy , d xz , dyz, d x 2 — y 2 , d z 2 |
| 3 (f) | 7 | -3, -2, -1,0, + 1, + 2, +3 | — |
iv) Спиновое квантовое число
Квантовое число, которое описывает вращение электрона вокруг собственной оси, называется быть квантовым числом спина.Он обозначается буквой «s» или «M s ». Он может иметь только два значения \ (\ frac {-1} {2} \) и \ (\ frac {+1} {2} \)
Пример. Найдите значение n, l, m и s для 3-я орбита
Решение, для 3-й орбиты
n = 3
Для n = 3, l = от 0 до (3-1) = от 0 до 2 = 0, 1, 2, т.е. s, p, d
Для l = 0, m = 0 (от -l до + l до 0)
Для l = 1, m = -1, 0, + 1 (от -l до + l до 0)
Для l = 2, m = -2, -1, 0, + 1, + 2 (от -l до + l до 0)
s = \ (\ frac {-1} {2} \) или \ (\ frac {+1} {2 } \)
Пример «Определите положение электрона, имеющего следующее квантовое число
n = 4, l = 1, m = -1 и s = \ (\ frac {+1} {2} \)
Решение:
n = 4 (4 tth орбита)
l = 1 (p -орбитальная)
m = -1 (P x )
s = \ (\ frac {+1} {2} \) (по часовой стрелке)
i.е. требуемая позиция = 4P x 1
Электрон находится на орбите P x 4-й орбиты со вращением по часовой стрелке.
Пример: присвоить все четыре квантовых числа электронам атома Mg.
Раствор
12 Мг = 1с 2 2с 2 2п 6 3с 2
| 9055 | 9055 9055 9055м | м с | ||
| 1 с 2 | 1 1 | 0 0 | ||
| 2s 2 | 2 2 | 0 0 | 0 0 | + \ (\ frac {1} {2} \) — \ (\ frac {1} {2} \) |
| 2p 6 | 2 2 2 2 2 2 | 1 1 1 1 1 1 | -1 0000004000+1 +1 | + \ (\ frac {1} {2} \) — \ (\ frac {1} {2} \) + \ (\ frac {1} {2} \) — \ (\ frac {1} {2} \) + \ (\ frac {1} {2} \) — \ (\ frac {1} {2} \) |
3s 2 | 3 3 | 0 0 | 0 0 | \ 9000} {2000} {2000} {2000} ) — \ (\ frac {1} {2} \) |
Принцип Ауфбау (Правило заполнения электронами на диффузной орбите) или (n + l) правило
Принцип Ауфбау утверждает, что электроны заполнены на разных орбиталях в зависимости от их возрастающей энергии.Согласно этому принципу, сначала заполняется орбиталь с более низкой энергией, а затем орбиталь с более высокой энергией. Энергия орбитали зависит от главного квантового числа (n) и азимутального квантового числа (l). Таким образом, это можно обобщить как правило (n + l).
Правила:
1. Орбиталь с меньшим значением (n + l) заполняется первой. Например: 3s заполняется перед 3p, потому что.
для 3s, n + l = 3 + 0 = 3
для 3p, n + l = 3 + 1 = 4
2.Если присутствует более одной орбитали с одинаковым значением (n + l), первой заполняется орбиталь с меньшим значением ‘n’.
Например, 2p заполняется до 3s.
Исключения
Электронная конфигурация некоторых элементов не соответствует принципу Ауфбау в виде наполовину заполненной и полностью заполненной орбиты. Это связано с дополнительной стабильностью, достигнутой наполовину заполненными и полностью заполненными орбиталями.
24 Cr = 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 4 (Ожидаемая электронная конфигурация)
= 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5 (Фактическая электронная конфигурация, наполовину заполнена)
29 Cu = 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 9 (Ожидаемая электронная конфигурация)
= 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 (Фактическая электронная конфигурация, полностью заполнена)
Принцип исключения Паули
Вольфганг Паули выдвинул принцип заполнения электронами орбитали.Согласно принципу, никакие два электрона атома не могут иметь одинаковое значение всех четырех квантовых чисел.
Иллюстрация: В случае Neon
10 Ne = 1s 2 2s 2 2p 6
| Электроны | л | м | м с | |
| 1 с 2 | 1 1 | 0 | 0 07 | |
| 2s 2 | 2 2 | 0 0 | 0 0 | + \ (\ frac {1} {2} \) — \ (\ frac {1} {2} \) |
| 2 пол 6 | 2 9000 7 2 2 2 2 2 | 1 1 1 1 1 1 | 0004 9000 0 +1 +1 | + \ (\ frac {1} {2} \) — \ (\ frac {1} {2} \) + \ (\ frac {1 } {2} \) — \ (\ frac {1} {2} \) + \ (\ frac {1} {2} \) — \ (\ frac {1} {2} \ ) |
Заключение
i) Каждая орбиталь может содержать максимум 2 электрона с противоположным спином.
2) Максимальное количество электронов, присутствующих на орбите, равно удвоенному квадрату числа орбиталей, присутствующих на этой орбите. (2n 2 )
Вырожденные орбитали
В отсутствие внешнего магнитного поля все орбитали, имеющие одинаковое значение «n» и «l» и разные значения «m», должны иметь одинаковую энергию. Эти орбитали называются вырожденными орбиталями.
В присутствии внешнего магнитного поля вырожденные орбитали имеют немного другую энергию.
Правило максимальной множественности Хунда (Правило заполнения электронами на вырожденных орбиталях)
Когда доступно более одной орбитали с равной энергией (вырожденная орбиталь), электроны заполняются на этих орбиталях отдельно с параллельным спином. Спаривание электронов начнется только после того, как эти орбитали будут заняты однократно. Это правило называется правилом максимальной множественности Хунда.
Например: 8 O = 1 с 2 2 с 2 2p 4
Структура атома, Studymaterial: CBSE Class 11-science ХИМИЯ, Химия Часть I
Структура атома
Субатомные частицы: открытие и характеристики
Макроскопические объекты имеют характер частиц, поэтому их движение может быть описано в терминах классической механики, основанной на законах движения Ньютона.
Микроскопические объекты, такие как электроны, обладают как волнообразным, так и корпускулярным поведением, поэтому их нельзя описать с помощью классической механики. Для этого была разработана новая отрасль науки, называемая квантовой механикой.
Квантовая механика была разработана независимо Вернером Гейзенбергом и Эрвином Шредингером в 1926 году.
Квантовая механика учитывает двойственную природу материи (частицы и волны).
На основе квантовой механики была разработана новая модель, известная как квантово-механическая модель.
В квантово-механической модели поведение микроскопических частиц (электронов) в системе (атоме) описывается уравнением, известным как уравнение Шредингера, которое приведено ниже:
Где,
= Математический оператор, известный как оператор Гамильтона
ψ = Волновая функция (амплитуда электронной волны)
E = Полная энергия системы (включая все субатомные частицы, такие как электроны, ядра)
Решения уравнения Шредингера называются волновыми функциями.
Атом водорода и уравнение Шредингера
После решения уравнения Шредингера для атома водорода получаются допустимые решения.
Каждое разрешенное решение соответствует определенному энергетическому состоянию, и каждое определенное энергетическое состояние называется орбиталью. В случае атома это называется атомной орбиталью, а в случае молекулы — молекулярной орбиталью.
Каждая орбиталь характеризуется набором следующих трех квантовых чисел:
Главное квантовое число (n)
Азимутальное квантовое число (l)
Магнитное квантовое число (мл)
Для многоэлектронного атома уравнение Шредингера не может быть решено точно.
Важные особенности квантово-механической модели атома
Энергия электронов в атоме квантована (т.е. электроны могут иметь только определенные значения энергии).
Существование квантованных электронных энергетических состояний является прямым результатом волнообразных свойств электронов.
Точное положение и точная скорость электрона в атоме не могут быть определены одновременно (принцип неопределенности Гейзенберга).
Атомная орбиталь представлена волновой функцией ψ для электрона в атоме и связана с определенным количеством энергии.
В атоме может быть много орбиталей, но орбиталь не может содержать более двух электронов.
Орбитальная волновая функция ψ дает всю информацию об электроне.
| ψ | 2 известна как плотность вероятности, и по ее значению в разных точках внутри атома можно предсказать вероятную область нахождения электрона вокруг ядра.
Орбитали и квантовые числа
Чем меньше размер орбитали, тем выше шанс найти электрон около ядра.
Каждая орбиталь характеризуется набором следующих трех квантовых чисел:
Главное квантовое число (n)
Положительные целые числа (n = 1, 2, 3, ………) Определяет размер и энергию орбитального Определяет оболочку n = 1, 2, 3, 4, …… ..Корпус = K, L, M, N, …… ..
С увеличением значения n увеличивается количество разрешенных орбиталей (n2), размер орбитали и энергия орбитали.
Азимутальное квантовое число (l)
Также известен как орбитальный угловой момент или дополнительное квантовое число. Определяет трехмерную форму орбиты Для данного значения n, l может иметь n значений в диапазоне от 0 до n — 1.Для n = 1, l = 0
Для n = 2, l = 0, 1
Для n = 3, l = 0, 1, 2
Для n = 4, l = 0, 1, 2, 3, ……… и т. Д.
Каждая оболочка состоит из одной или нескольких подоболочек или подуровней. Количество подоболочек равно n, и каждая подоболочка соответствует разным значениям l.
Для n = 1 есть только одна подоболочка (l = 0)
Для n = 2 есть две подоболочки (l = 0, 1)
Для n = 3 есть три подоболочки (l = 0, 1, 2) …… .. и так далее
Значение для л
0
1
2
3
4
5 ……
Обозначение для суб-оболочки
с
п.
д
ф
г
ч ……
Обозначения подоболочек, соответствующие данным главным квантовым числам и азимутальным квантовым числам, перечислены в данной таблице.
Главное квантовое число (n)
Азимутальное квантовое число (l)
Обозначения суб-оболочки
1
0
1 с
2
0
2с
2
1
2п
3
0
3с
3
1
3 пол.
3
2
3д
4
0
4с
4
1
4п
4
2
4д
4
3
4f
Магнитное орбитальное квантовое число (мл):
Предоставляет информацию о пространственной ориентации орбитали относительно стандартного набора координатных осей. Для данного значения l (т.е.е., для данной подоболочки) возможно 2l + 1 значение ml.мл = −l, — (l — 1), — (l — 2),… 0, 1,…. (L — 2), (l — 1), l
Пример:
Для l = 0, ml = 0 (одна s-орбиталь)
Для l = 1, ml = −1, 0 + 1 (три p-орбитали)
Для l = 2, ml = −2, −1, 0, +1, +2 (пять d-орбиталей)
Для l = 3, ml = −3, −2, −1, 0, + 1, +2, + 3 (семь f-орбиталей)
Соотношение между подоболочкой и количеством орбиталей показано в следующей таблице:
Обозначение суб-оболочки
Количество орбиталей
с
1
п.
3
д
5
ф
7
г
9
ч
11
Существует четвертое квантовое число, известное как квантовое число спина электрона (мс).
Он обозначает ориентацию спина электрона. Есть две ориентации электрона, известные как два спиновых состояния электрона: + и -или ↑ (спин вверх) и ↓ (спин вниз). Орбиталь не может содержать более двух электронов.Макроскопические объекты имеют характер частиц, поэтому их движение может быть описано в терминах классической механики, основанной на законах движения Ньютона.
Микроскопические объекты, такие как электроны, обладают как волнообразным, так и корпускулярным поведением, поэтому их нельзя описать с помощью классической механики.Для этого была разработана новая отрасль науки, называемая квантовой механикой.
Квантовая механика была разработана независимо Вернером Гейзенбергом и Эрвином Шредингером в 1926 году.
Квантовая механика учитывает двойственную природу материи (частицы и волны).
На основе квантовой механики была разработана новая модель, известная как квантово-механическая модель.
В квантово-механической модели поведение микроскопических частиц (электронов) в системе (атоме) описывается уравнением, известным как уравнение Шредингера, которое приведено ниже:
Где,
= Математический оператор, известный как оператор Гамильтона
ψ = Волновая функция (амплитуда электронной волны)
E = Полная энергия системы (включая все субатомные частицы, такие как электроны, ядра)
Решения уравнения Шредингера называются волновыми функциями.
Атом водорода и уравнение Шредингера
После решения уравнения Шредингера для водорода при
Чтобы просмотреть всю тему, пожалуйста,
CBSE Class 11 Chemistry Notes Notes Set B Concepts for Chemistry Revision notes
CBSE Class 11 Chemistry Notes — Structure of Atom. Изучение важных понятий очень важно для каждого студента, чтобы получить более высокие оценки на экзаменах. Понятия должны быть ясными, что поможет ускорить обучение.Прилагаемые концепции, составленные в соответствии с шаблоном NCERT и CBSE, помогут студенту понять главу и получить более высокие оценки на экзаменах.
Очков для запоминания
Класс: XI
Глава 2: Структура атома
Основные концепции
1. Атомная теория материи была предложена Джоном Далтоном
2. Электроны были открыл Майкл Фарадей.
3. Электроны были обнаружены в эксперименте с электронно-лучевой разрядной трубкой.
4. Эксперимент с трубкой электронно-лучевого разряда. Берут трубку электронно-лучевого разряда из стекла с двумя электродами. При очень низком давлении и высоком напряжении ток начинает течь через поток частиц, движущихся в трубке от катода к аноду. Эти лучи были названы катодными лучами. Когда был взят перфорированный анод, катодные лучи попали на другой конец стеклянной трубки на флуоресцентное покрытие, и на покрытии появилось яркое пятно
Результаты:
a.Катодные лучи состоят из отрицательно заряженных электронов.
г. Сами катодные лучи не видны, но их поведение можно наблюдать с помощью флуоресцентных или фосфоресцентных материалов.
г. В отсутствие электрического или магнитного поля катодные лучи проходят по прямым линиям
d. В присутствии электрического или магнитного поля поведение катодного разряда аналогично тому, которое демонстрируют электроны
e. Характеристики катодных лучей не зависят от материала электродов и природы газа, присутствующего в электронно-лучевой трубке.
5. Отношение заряда к массе электрона было определено Томсоном. Отношение заряда к массе электрона равно 1,758820 x 10 11 C кг -1
6. Заряд электрона был определен Р. А. Милликеном с использованием эксперимента с каплей масла. Величина заряда электрона составляет -1,6 x 10 -19 C.
7. Масса электрона была определена путем объединения результатов эксперимента Томсона и эксперимента Милликена с каплей масла. Масса электрона была определена равной 9.1094 x 10 -31 кг.
8. Открытие протонов и лучей каналов: был проведен эксперимент с модифицированной электронно-лучевой трубкой, который привел к открытию протонов.
9. Канальные лучи — это положительно заряженные частицы, называемые протонами
10. Характеристики положительно заряженных частиц:
a. Отношение заряда к массе частиц зависит от газа, из которого они происходят
b. Положительно заряженные частицы зависят от природы газа, присутствующего в электронно-лучевой разрядной трубке
c.Некоторые из положительно заряженных частиц несут электрический заряд, кратный основному.
г. Поведение положительно заряженных частиц в электрическом или магнитном поле противоположно тому, которое наблюдается для катодных лучей.
11. Нейтроны были обнаружены Джеймсом Чедвиком при бомбардировке тонкого листа бериллия-частицами. Это электрически нейтральные частицы, масса которых немного больше массы протонов.
12. Модель атома Томсона: В этой модели предложено, что атом рассматривается как однородная положительно заряженная сфера, в которую встроены электроны.
13. Важной особенностью модели атома Томсона было то, что масса атома считается равномерно распределенной по атому.
14. Модель атома Томсона также называется сливовым пудингом, пудингом с изюмом или арбузной моделью
15. Модель атома Томсона была отброшена, поскольку она не могла объяснить некоторые экспериментальные результаты, такие как рассеяние α-частиц тонкой металлической фольгой
16. Наблюдения из эксперимента Резерфорда по рассеянию α-частиц:
a.Большая часть α — частиц (почти 99%) прошла через золотую фольгу без отклонений
b. Небольшая часть α — частиц отклонялась на малые углы
c. Очень немногие α-частицы не проходят через фольгу, но претерпевают большое отклонение почти 180 o
17. Наблюдения Резерфорд сделал из эксперимента по рассеянию α-частиц:
a. Поскольку большая часть α-частиц прошла через фольгу без отклонения, это означает, что большая часть пространства в атоме пуста
b.Поскольку некоторые из α-частиц отклоняются на определенные углы, это означает, что в атоме
c присутствует положительная масса. Поскольку только некоторые из α-частиц претерпевают большие отклонения, положительно заряженная масса должна занимать очень маленькое пространство.
г. Сильные отклонения или даже отскок α-частиц от металлической фольги были вызваны прямым столкновением с положительно заряженной массой в атоме.
18. Модель атома Резерфорда: Эта модель объясняет, что атом состоит из ядра, которое сосредоточено в очень небольшом объеме.Ядро состоит из протонов и нейтронов. Электроны вращаются вокруг ядра по фиксированным орбитам. Электроны и ядра удерживаются вместе за счет электростатических сил притяжения.
Щелкните ссылку ниже, чтобы загрузить файл pdf для заметок по химии класса 11 CBSE — Структура атома.
Урок 1 Структура атома
Презентация на тему: «Урок 1 Строение атома» — стенограмма презентации:
1 Урок 1 Структура атома
Глава 18 Урок 1 Структура атома
2 Научная стенография Ученые разработали собственную стенографию для работы с длинными и сложными именами.Химические символы состоят из одной заглавной буквы или заглавной буквы и одной или двух меньших букв.
3 Химические символы Заглавные буквы имеют значение!
Символы элементов содержат ОДНУ заглавную букву, за которой следует строчная буква, если необходимо. Ученые используют две буквы для обозначения некоторых элементов, потому что их больше, чем букв. Металлы, образующие ярко-синий Co по сравнению с CO, ядовитый газ, твердые соединения
4 Атомные компоненты Элемент — это материя, состоящая из одного типа атома, который представляет собой наименьший кусок материи, который все еще сохраняет свойства элемента.Атомы состоят из частиц, называемых протонами, нейтронами и электронами.
5 Атомные компоненты Протоны и нейтроны находятся в небольшом положительно заряженном центре атома, называемом ядром, которое окружено облаком, содержащим электроны. Протоны — это частицы с электрическим зарядом 1+.
6 Атомные компоненты Электроны — это частицы с электрическим зарядом 1–.Это частица, которая движется вокруг ядра. Нейтроны — это нейтральные частицы, не имеющие электрического заряда. Ядро в центральном ядре атома.
7 Субатомные частицы в нейтральном атоме Большая часть массы атома.
ЯДЕРНЫЕ ЭЛЕКТРОНЫ в нейтральном атоме ПРОТОНЫ НЕЙТРОНЫ ОТРИЦАТЕЛЬНЫЙ ЗАРЯД ПОЛОЖИТЕЛЬНЫЙ ЗАРЯД НЕЙТРАЛЬНЫЙ ЗАРЯД Большая часть массы атома. Атомный номер равен количеству …
8 Кварки — даже более мелкие частицы
Протоны и нейтроны состоят из более мелких частиц, называемых кварками.На данный момент ученые подтвердили существование шести уникально разных кварков.
9 Кварки. Ученые предполагают, что расположение трех кварков, удерживаемых вместе с помощью сильного ядерного взаимодействия, производит протон. Другое расположение трех кварков дает нейтрон Не
10 Поиск кварков Для изучения кварков ученые разгоняют заряженные частицы до огромных скоростей, а затем заставляют их сталкиваться с протонами или врезаться в них.Это столкновение заставляет протон распадаться. Частицы, образующиеся в результате столкновения, могут быть обнаружены различными устройствами сбора.
11 Шестой кварк Ученые обнаружили пять кварков и выдвинули гипотезу о существовании шестого кварка. Однако команде из почти 450 ученых со всего мира потребовалось несколько лет, чтобы найти шестой кварк. Следы шестого кварка было трудно обнаружить, потому что только около одной миллиардной процента выполненных столкновений протонов показывает присутствие шестого кварка.
Банк вопросов для 11-го класса Химическая структура атома 11-й CBSE Химическая структура атома
Переключить навигацию 00
- РЖД
- UPSC
- Банковское дело
- SSC
- CLAT
- JEE Main & Advanced
- NEET
- NTSE
- KVPY
- Обучение
- Государственный экзамен депутата
- Государственные экзамены UP
- 12-й класс
- 11-й класс
- 10-й класс
- 9-й класс
- 8-й класс
- 7-й класс
- 6-й класс
- 5-й класс
- 4-й класс
- 3-й класс
- 2-й класс
- 1-й класс
- Другой экзамен
- Дошкольное образование
- Ролики
- Учебные пакеты
- Серия испытаний
- Решения Ncert
- Образцы статей
- Банк вопросов
- Примечания
- Решенные статьи
- Текущие дела
Поиск…..
Идти!- Все
- Ролики
- Учебные пакеты
- Решения NCERT
- Вопросы
- Образцы статей
- Примечания
- РЖД
- UPSC
CBSE NCERT Notes Класс 11 Химическая структура атома
ОТКРЫТИЕ ЭЛЕКТРОНА:
Электрон был открыт Дж.Дж. Томсон, проводя эксперимент с электронно-лучевой трубкой.
Для эксперимента он использовал трубку Крука, которая представляла собой стеклянную трубку длиной 60 см, к которой была прикреплена небольшая трубка. К этой маленькой трубке был прикреплен вакуумный насос, у него также были две металлические пластины, которые были подключены к батарее проводами.
Трубка содержала газ при атмосферном давлении. при пропускании тока высокого напряжения (10000 вольт) были сделаны следующие наблюдения:
- Когда через газ пропускали ток при давлении 1 атм и очень высоком напряжении, ничего не происходило.То есть видимого эффекта внутри трубки не наблюдалось.
- Затем давление газа было снижено путем откачки воздуха с помощью вакуумного насоса. Давление снизили до 10 -2 атм, после чего при прохождении тока было видно, что вся трубка начала светиться зеленым.
- Затем давление было уменьшено до 10 -4 Было видно, что все свечение исчезло, но было видно, что на конце трубки (сторона анода) наблюдалось слабое зеленое свечение.
Для подтверждения слабого свечения анод был перфорирован, а за ним был помещен экран из сульфида цинка (флуоресцентный материал).
Когда ток пропускался в тех же условиях, он также начинал светиться зеленым. Это подтвердило, что в этих условиях некоторые лучи выходили через катод и направлялись к аноду. Эти лучи были названы катодными лучами, и было обнаружено, что они состоят из отрицательно заряженных частиц, называемых электронами.
Свойства катодных лучей
- Они движутся по прямой.Это свойство было завершено выполнением действия, когда объект был помещен на их путь. Когда они ударяют по нему, они отбрасывают тень объекта, как показано ниже:
- Катодные лучи состоят из материальных частиц. Это свойство было завершено выполнением действия, когда на их пути на ось была установлена весло, и когда они ударяли по нему, они вращали весло.
- Они заряжены отрицательно.Это свойство было заключено при выполнении действия, при котором было приложено электрическое и магнитное поле, они отклонялись к положительной пластине, а в присутствии магнитного поля они отклонялись к северному полюсу.
- Ударяя по металлической поверхности, они нагревали ее. Таким образом, был сделан вывод, что они также могут производить тепловой эффект.
- Они вызывают ионизацию газа, через который они прошли.
- Они излучают рентгеновские лучи при ударе о твердый металл, например, вольфрам и т. Д.
- Они могут вызывать свечение люминесцентного материала при ударе о люминесцентный материал.
- Они влияют на фотопластинку.
- Обладают проникающим действием.
Из приведенных выше свойств и экспериментов был сделан вывод, что катодных лучей состоят из отрицательно заряженных частиц, называемых электронами.
Дальнейшие эксперименты были проведены для того, чтобы узнать заряд и массу электрона.

 (2 балла). Только ковалентная связь наблюдается в соединении с формулой:
(2 балла). Только ковалентная связь наблюдается в соединении с формулой: (4 балла). Установите соответствие между составом атома и положением элемента в Периодической системе.
(4 балла). Установите соответствие между составом атома и положением элемента в Периодической системе. В) твердое вещество /
В) твердое вещество /