Контрольная работа по теме Строение атома. Химическая связь
Муниципальное общеобразовательное бюджетное учреждение
«Гимназия № 5» г. Оренбург
Контрольная работа
по теме
«Строение атома.
Химическая связь»
8 класс
подготовила учитель химии
Сидоренко Светлана Викторовна
г. Оренбург
2017 г.
8 класс Контрольная работа № 1 по теме «Строение атома. Химическая связь»
вариант 1
№ 1
Определите число электронов, протонов и нейтронов в изотопах брома с массовыми числами 79 и 81.
№ 2
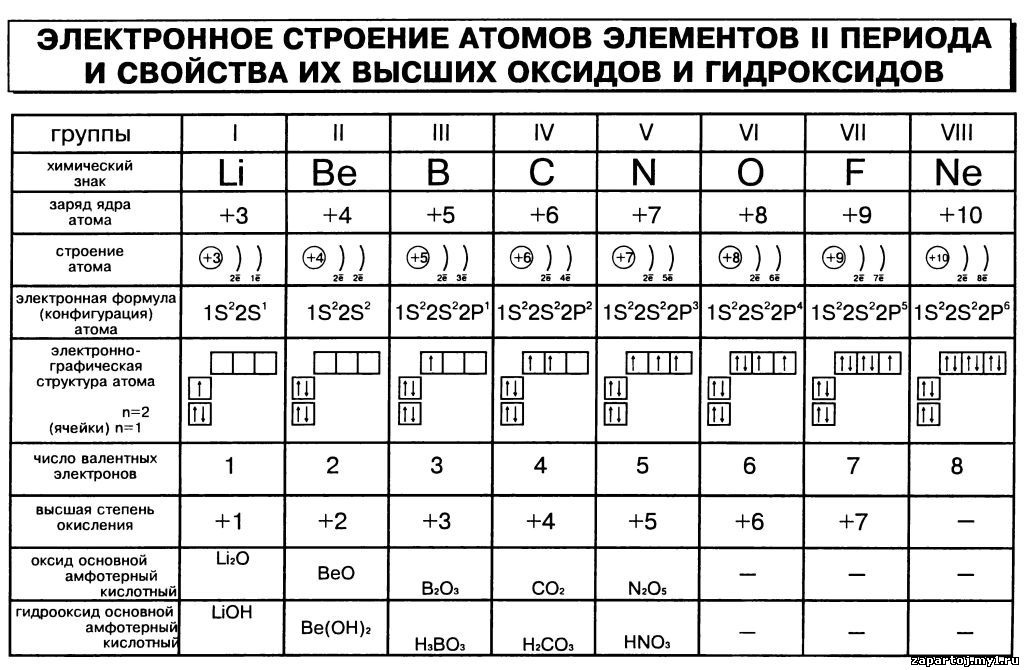
Запишите схемы строения атомов элементов с порядковыми номерами 10, 13, 16. Определите их принадлежность к металлам, неметаллам, благородным газам.
№ 3
Заполните таблицу
молекулярная формула(формульная единица) | вид связи | электронная формула, С. | структурная формула, С.О.(для КПС, КНС) |
F2 | |||
Na3P | |||
H2O |
№ 4
Составьте формулы бинарных веществ:
оксид кальция, хлорид натрия, оксид серы (VI), гидрид калия, сульфид железа (III), нитрид кальция, бромид бария.
№ 5
Определите степени окисления элементов, дайте названия веществам:
СaCl2—
Na2S-
MgО —
H3N-
N2О3—
№6
Вычислите количество вещества, объём, число молекул в порции азота N2 массой 56 г.
№7
Установите формулу вещества, применяемого для рентгеноскопии желудка. В его составе 58,8 % бария; 13,73 % серы; кислород.
______________________________________________________________________________________________
8 класс Контрольная работа № 1 по теме «Строение атома. Химическая связь»
Химическая связь»
вариант 2
№ 1
Определите число электронов, протонов и нейтронов в изотопах кальция с массовыми числами 40 и 42.
№ 2
Запишите схемы строения атомов элементов с порядковыми номерами 7, 18, 19. Определите их принадлежность к металлам, неметаллам, благородным газам.
№ 3
Заполните таблицу
молекулярная формула(формульная единица) | вид связи | электронная формула, С.О.(для ИС) | структурная формула, С.О.(для КПС, КНС) |
S2 | |||
CaCl2 | |||
HCl |
№ 4
Составьте формулы бинарных веществ:
оксид калия, хлорид кальция, оксид азота (V), гидрид лития, сульфид кремния (IV), нитрид кальция, бромид натрия.
№ 5
Определите степени окисления элементов, дайте названия веществам:
ВaCl2—
К2S-
Nа2О —
H2S —
NО2—
№6
Вычислите количество вещества, объём, число молекул в порции азота N2 массой 84 г.
№7
Установите формулу вещества, применяемого для лечения кожных заболеваний. В его составе 63,53 % серебра; 8,24 % азота; кислород.
Список использованной литературы
Габриелян О.С., Яшукова А.В. Химия. 8 класс. Учебник — М.: Дрофа, 2013.
Габриелян О.С., Яшукова А.В. Химия. 8 класс. Рабочая тетрадь к учебнику О.С.Габриеляна «Химия. 8» — М.: Дрофа, 2013.
Габриелян О.С., Яшукова А.В. Химия. 8 — 9 классы. Методическое пособие — М.: Дрофа, 2004.
Контрольная работа по химии «Строение атомов химических элементов»
Контрольная работа по учебнику О.С. Габриеляна. Представлена в 2 вариантах.
Просмотр содержимого документа
«Контрольная работа по химии «Строение атомов химических элементов»»
Контрольная работа № 1 «Строение атомов химических элементов»
Вариант 1
1. Расположите химические элементы
Расположите химические элементы
А) в порядке возрастания неметаллических свойств P, Cl, Mg.
Б) в порядке возрастания неметаллических свойств Tl, Al, Ga.
2. Дайте характеристику химических элементов B, C, Si
по плану:
химический символ и название элемента.
порядковый номер.
номер периода, группы, главная или побочная подгруппа.
заряд ядра атома.
число протонов и нейтронов в ядре.
общее число электронов.
число энергетических уровней.
число электронов на внешнем энергетическом уровне.
схема строения атома.
свойства химического элемента (металлические или неметаллические).

3. Укажите тип химической связи в соединениях: O2, Na, HBr, NaF. Запишите схему образования одного вида связи (по выбору).
Контрольная работа № 1 «Строение атомов химических элементов»
Вариант 2
1. Расположите химические элементы
А) в порядке возрастания неметаллических свойств C, Be, N.
Б) в порядке возрастания неметаллических свойств Ba, Mg, Sr.
2. Дайте характеристику химических элементов O, S, Cl
по плану:
химический символ и название элемента.
номер периода, группы, главная или побочная подгруппа.
заряд ядра атома.
число протонов и нейтронов в ядре.
общее число электронов.

число энергетических уровней.
число электронов на внешнем энергетическом уровне.
схема строения атома.
свойства химического элемента (металлические или неметаллические).
3. Укажите тип химической связи в соединениях: H2O, F2, K, KCl. Запишите схему образования одного вида связи (по выбору).
Контрольная работа №1. Строение атома. Химические формулы
. Контрольная работа №1.
Строение атома. Химические формулы. Вариант № 1.
Часть 1. При выполнении
заданий этой части запишите номер
задания и номер выбранного вами ответа. |
А 1. Главной неизменной характеристикой атома является
1) заряд ядра 2) число электронов 3) число нейтронов 4) масса атома
А 2. Распределению электронов по слоям 2, 8, 8 соответствует атому
1) неон 2) железо 3) кальций 4) аргон
А 3. Число нейтронов а атоме 30Si равно
1) 14 2) 28 3) 16 4) 30
А 4. У элементов 4-А группы четыре 1) энергетических уровня
2) электрона вокруг ядра 3) электрона на внешнем уровне 4) протона
А 5. Наиболее сильно выраженные неметаллические свойства проявляет
1) селен 2) сера 3) кислород 4) теллур
А
6. Одинаковое
число энергетических уровней у
Одинаковое
число энергетических уровней у
1) S и O 2) Si и Ti 3) C и N 4) Na и K
1) K3N2 2) N2O3 3) Ca2N3 4) Ca3N2
А 8. Верны ли следующие суждения?
А. Сложное вещество состоит из атомов одного элемента.
Б. Формула показывает только качественный состав вещества.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба неверны
Часть 2. |
В1. Установите соответствие между формулой
вещества и его относительной молекулярной
массой.
Установите соответствие между формулой
вещества и его относительной молекулярной
массой.
ФОРМУЛЫ ВЕЩЕСТВ МОЛЕКУЛЯРНАЯ МАССА
А) PH3 1) 30
Б) O3 2) 34
В) NO 3) 48
Г) Li2О 4) 32
В2. В ряду элементов Na → Mg → Al → Si → P → S → Cl увеличиваются
радиусы атомов
неметаллические свойства
число электронных слоев
заряд ядра атомов
С
1. Какова
массовая доля меди в соединении, формула
которого Cu2O?
Какова
массовая доля меди в соединении, формула
которого Cu2O?
Контрольная работа №1.
Строение атома. Химические формулы. Вариант № 2.
Часть 1. При выполнении заданий этой части запишите номер задания и номер выбранного вами ответа. |
А 1. Главной неизменной характеристикой атома является
1) число электронов 2) заряд ядра 3) число нейтронов 4) масса атома
А 2. Распределению электронов по слоям 2, 8, 8, 2 соответствует атому
1) неон 2) железо 3) кальций 4) аргон
А 3. Число нейтронов а атоме 64Zn
равно
Число нейтронов а атоме 64Zn
равно
1) 65 2) 35 3) 34 4) 30
А 4. У элементов 4 периода четыре 1) электрона вокруг ядра
2) энергетических уровня 3) электрона на внешнем уровне 4) протона
А 5. Наиболее сильно выраженные металлические свойства проявляет
1) литий 2) натрий 3) магний 4) алюминий
А 6. Одинаковое число электронов на внешнем уровне у
1) S и O 2) Si и Ti 3) C и N 4) Na и Са
А 7. Формула молекулы, состоящей из 3 атомов калия и 1 атома фосфора – это
1) K3F 2) CaF3 3) Ca 3Р 4) К3Р
А
8. Верны ли
следующие суждения?
Верны ли
следующие суждения?
А. Сложное вещество состоит из атомов разных элементов.
Б. Формула показывает только количественный состав вещества.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба неверны
Часть 2. Номера выбранных вами ответов запишите в виде таблицы в В1 и ряда чисел в В2. |
В1. Установите соответствие между формулой вещества и его относительной молекулярной массой.
ФОРМУЛЫ ВЕЩЕСТВ МОЛЕКУЛЯРНАЯ МАССА
А) NH3 1) 30
Б) O2 2) 28
В) CO 3) 17
Г) C2H4 4) 32
В2. В ряду элементов N
→ P
→ As
→ Sb
→ Bi
увеличиваются
радиусы атомов
неметаллические свойства
число электронных слоев
число валентных электронов
заряд ядра атомов
С 1. Какова массовая доля цинка в соединении, формула которого ZnCl2?
контрольная работа «Строение атома. Периодический закон Д.И.Менделеева. Строение вещества.» | Методическая разработка по химии (8 класс):
По теме: методические разработки, презентации и конспекты
ЕГЭ тест по теме «Периодический закон Д.И.Менделеева и строение атома»; Тема «Электроотрицательность», «Строение вещества»Тесты по основным темам ЕГЭ…
Контрольная работа №1 по темам «Строение атома. Периодический закон Д.И.Менделеева»Контрольная работа №1по темам «Строение атома. Периодический закон Д. И.Менделеева».11 класс, базовый уровень…
И.Менделеева».11 класс, базовый уровень…
Предлагаемый тест может быть использован восьмиклассниками для самопроверки знаний и самоконтроля при завершении изучения данной темы….
Подготовка к контрольной работе 11 класс по теме: Строение атома. периодический закон Д.И.Менделеева, учебник О.С.ГабриелянВариант контрольной работы для подготовки учащихся к контролю знаний по теме: Строение атома.Периодический закон Д.И.Менделеева…
Строение атома. Периодический закон Д.И. МенделееваВ соответствии с программой О.С. Габриеляна на тему «Атомы химических элементов» отводится 11 часов.Учащиеся должны:Знать Определение понятия «химический элемент», формулировку Периодического закона.У…
Кроссворды по темам «Периодический закон Д.И.Менделеева. Строение атома.» и «Химическая связь. Строение вещества.»Предлагаемые кроссворды могут быть использованы при проведении предметной недели, при обобщении темы или в качестве индивидуального задания ученику. Кроссворды составлены в трех вариантах (на одном ма…
Кроссворды составлены в трех вариантах (на одном ма…
В соответствии с программой О.С. Габриеляна на тему «Атомы химических элементов» отводится 11 часов.Учащиеся должны:Знать Определение понятия «химический элемент», формулировку…
Контрольная работа «ПСХЭ и строение атома» 11 класс Вариант 2
Пояснительная записка
Пояснительная записка Рабочая тетрадь рекомендована для студентов очной формы обучения, реализующих образовательную программу среднего (полного) общего образования технического профиля. Данная рабочая
Данная рабочая
ID_589 1/6 neznaika.pro
Вариант 1 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 Четыре электрона находятся во внешнем электронном слое атомов каждого из химических
ПодробнееТЕМА 1. Щелочные металлы и их соединения
ТЕМА 1. Щелочные металлы Тренировочные задания 1. Верны ли следующие суждения? А. Семейство щелочных металлов расположено в IА группе Периодической системы химических элементов Д.И. Менделеева. Б. Максимальная
Подробнее1) 19,2 % 2) 36,4 % 3) 43,7 % 4) 100 % 2)
Контрольная работа 1 Вариант I 1. В левом столбце под номерами 1 4 записаны известные вам понятия, в правом столбце буквами А Г обозначены их характеристики. Выпишите номер, которым обозначено понятие,
Выпишите номер, которым обозначено понятие,
ID_591 1/6 neznaika.pro
Вариант 3 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 На приведенном рисунке 1 изображен модель атома 1) кремния 2) серы 3) кислорода
ПодробнееID_590 1/7 neznaika.pro
Вариант 2 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 Химический элемент, в атомах которого распределение электронов по слоям: 2,
ПодробнееУЧИСЬ САМОСТОЯТЕЛЬНОСТИ
1 Ю.И. Юнг, В.Ю. Юнг УЧИСЬ САМОСТОЯТЕЛЬНОСТИ ХИМИЯ ПОСОБИЕ ПО ХИМИИ ДЛЯ УЧАЩИХСЯ ОСНОВНОЙ ШКОЛЫ (7-8 классы) Часть 1 Ангарск 2 ХИМИЧЕСКИЕ УРАВНЕНИЯ. Необходимо знать: — химические уравнения; Вам необходимо
ПодробнееВариант Оксиды это.
 ..
..1. Оксиды это… Вариант 1 г) сложные вещества, в состав которых входит атом металла и кислотный остаток.. Как классифицируют оксиды? Привести примеры. NaPO 4, МgО, A1( OH ), HS, Li O, CaCl, КОН, НI, ВаS,
ПодробнееID_737 1/8 neznaika.pro
Вариант 18 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 У атома алюминия число электронов на внешнем энергетическом уровне и заряд
Подробнее1) IV 2) V 3) VI 4) VII
2 1. В ряду: Na Mg Al Si 1) увеличивается число энергетических уровней в атомах 2) усиливаются металлические свойства элементов 3) уменьшается высшая степень окисления элементов 4) ослабевают металлические
ПодробнееЛабораторная работа 1
Общая химия Студент: Группа: Дата выполнения работы: 1 Цель работы: Лабораторная работа 1 ВАЖНЕЙШИЕ КЛАССЫ ХИМИЧЕСКИХ СОЕДИНЕНИЙ Основные понятия: Классы неорганических веществ: 1. оксиды осно вные (Na
оксиды осно вные (Na
ID_831 1/8 neznaika.pro
Вариант 24 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 Число электронов в атоме равно 1 1) числу протонов 2) числу нейтронов 3) сумме
ПодробнееID_595 1/7 neznaika.pro
Вариант 7 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 Во 2-м периоде VIA группе Периодической системы находится химический элемент,
ПодробнееID_593 1/8 neznaika.pro
Вариант 5 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 Химическому элементу, в атоме которого распределение электронов по слоям 2е,
Подробнеес.
 Веселая Лопань, 2015 год
Веселая Лопань, 2015 годМуниципальное общеобразовательное учреждение «Веселолопанская средняя общеобразовательная школа Белгородского района Белгородской области» Контрольное тестирование по химии 9 класс (промежуточный контроль)
ПодробнееЧасть 3 С3. Часть 3 С4
ШИФР Часть 1 Часть 2 С1 С2 С3 С4 С5 С6 Итоговый балл (из 100 баллов) Вступительная работа для поступающих в 10 ФХ и ХБ классы Часть 1 Обведите номер одного правильного ответа кружком. При правильном ответе
ПодробнееКонтрольные работы по химии 8 класс
Итоговая контрольная работа по химии 8 класс Вариант подготовила Субханова Г. Р. Вариант 1 В задания 1-12 выберите только один правильный ответ. 1. Только простые вещества содержатся в наборе: 1) C, O
ПодробнееКЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ Простые вещества. Молекулы состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ. Сложные
Молекулы состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ. Сложные
Контрольная работа по теме: `Строение атома и строение вещества`11 класс
Контрольная работа №1
«Строение атома и строение вещества» 11 класс
Вариант -1
Дать характеристику химического элемента №16 по его положению в Периодической системе.
Решить ОВР: MnO2 + HCl → MnCl2 + Cl2 + h3O
Атом какого элемента имеет на три электрона меньше, чем ион магния? Назовите элемент, составьте электронную формулу его атома.
Определите вид химической связи в соединениях, дайте им названия: FeSO4, CO2, CuCl2, N2, HNO3, Fe.
К 200г 8%-ного раствора нитрата калия добавили 5г этой же соли и 5г воды. Определите массовую долю соли в конечном растворе.
Контрольная работа №1
«Строение атома и строение вещества» 11 класс
Вариант -2
Дать характеристику химического элемента №18 по его положению в Периодической системе.

Решить ОВР: h3S + Cl2 → S + HClАтом какого элемента имеет на два электрона меньше, чем ион калия? Назовите элемент, составьте электронную формулу его атома.
Определите вид химической связи в соединениях, дайте им названия: KNO3, CO, FeBr3, O3, NaOH, Al.
Сколько граммов гидроксида калия надо прибавить к 40г 10%-ного раствора, чтобы получить 40%-ный раствор?
Контрольная работа №1
«Строение атома и строение вещества» 11 класс
Вариант -3
Дать характеристику химического элемента №15 по его положению в Периодической системе.
Решить ОВР: Na2SO3 + Cl2 + h3O → Na2SO4 + HClАтом какого элемента имеет на пять электронов больше, чем ион натрия? Назовите элемент, составьте электронную формулу его атома.
Определите вид химической связи в соединениях, дайте им названия: Li2SO4, P2O5, MgI2, P4, KOH, Cu.
Cколько граммов твердого нитрата аммония надо добавить к 210г воды, чтобы получить 16%-ный раствор соли?
Контрольная работа №1
«Строение атома и строение вещества» 11 класс
Вариант -4
Дать характеристику химического элемента №20 по его положению в Периодической системе.

Решить ОВР: HNO2 → HNO3 + NO + h3O
Атом какого элемента имеет на два электрона меньше, чем ион калия? Назовите элемент, составьте электронную формулу его атома.
Определите вид химической связи в соединениях, дайте им названия: Cu(NO3)2, Sih5, MnCl2, S8, h4PO4, Mg.
Какую массу бромида натрия необходимо прибавить к 140г 5%-ного раствора, чтобы получить 10%-ный раствор.
Контрольная работа №1
«Строение атома и строение вещества» 11 класс
Вариант -5
Дать характеристику химического элемента №19 по его положению в Периодической системе.
Решить ОВР: HI + h3SO4 → I2 + h3S + h3O
Атом какого элемента имеет на пять электронов больше, чем ион натрия? Назовите элемент, составьте электронную формулу его атома.
Определите вид химической связи в соединениях, дайте им названия: Al2(SO4)3, Nh4, ZnS, Br2, h3CO3, Ca.
Какую массу воды нужно добавить к 200г 20%-ного раствора бромида натрия, чтобы получить 5%-ный раствор.
Контрольная работа по химии.
 Тема «Строение атома»
Тема «Строение атома» Контрольная работа № 2
«Строение атома»
Проверяемые знания и умения: У2, У4, У6, З2,З3,И7.
Инструкция.
Время на выполнение работы – 45 мин. При выполнении заданий части А на листе ответов напишите
определения понятий. Часть В проверяет знания Периодической системы химических элементов: в
задании 6 – напишите знак химического элемента (Например, а) Н), в 7 задании напишите знаки искомых
химических элементов, в 8 задании дайте полную характеристику искомого элемента по периодической
системе. Ответы на задания на соответствие дайте в виде последовательности цифр, соответствующим
буквам по алфавиту. Цифры в ответе могут повторяться. В тестовых заданиях выберите 1 правильный
ответ.
Часть А. Дайте определения:
1. Современная формулировка Периодического закона –
2. Периодическая система химических элементов Д.И. Менделеева –
3. Электронная формула атома –
4. Электрон –
5. Атом
Часть В. Используя периодическую систему химических элементов, выполни задания. 6. Найдите в каждом ряду один химический элемент, который отличается от остальных по
положению в периодической системе:
а) H, He, Ne, Ar; б) H, Li, Be, B;
в) Fe, Co, Ni, Ar; c) F, Cl, Mn, Br.
7. Порядковые номера химических элементов А,В, С соответственно n, n+2, n+4.
А) Если химический элемент А – самый легкий галоген, то каким химическим элементом будет В?
Б) Если химический элемент С – благородный газ, а В – металл, то каким химическим элементом
является А?
С) Если химические элементы А,В входят в одну группу, то каким химическим элементом является
С?
8. Дайте характеристику химического элемента с зарядом ядра +23.
Часть С. Установите соответствие:
9.
Положение элемента
Валентные электроны
А) 3 период, 4А группа
Б) 4 период, 3И группа
В) 4 период, 3А группа
Г) 3 период, 5А группа
1. 4s24p2
2. 3d34s2
3. 3s23p3
4. 3d14s2
5. 3s23p2
6. 4s24p1 10.
1. Se
2. C
3. Ti
4. Ca
5.Ar
6.
6. Найдите в каждом ряду один химический элемент, который отличается от остальных по
положению в периодической системе:
а) H, He, Ne, Ar; б) H, Li, Be, B;
в) Fe, Co, Ni, Ar; c) F, Cl, Mn, Br.
7. Порядковые номера химических элементов А,В, С соответственно n, n+2, n+4.
А) Если химический элемент А – самый легкий галоген, то каким химическим элементом будет В?
Б) Если химический элемент С – благородный газ, а В – металл, то каким химическим элементом
является А?
С) Если химические элементы А,В входят в одну группу, то каким химическим элементом является
С?
8. Дайте характеристику химического элемента с зарядом ядра +23.
Часть С. Установите соответствие:
9.
Положение элемента
Валентные электроны
А) 3 период, 4А группа
Б) 4 период, 3И группа
В) 4 период, 3А группа
Г) 3 период, 5А группа
1. 4s24p2
2. 3d34s2
3. 3s23p3
4. 3d14s2
5. 3s23p2
6. 4s24p1 10.
1. Se
2. C
3. Ti
4. Ca
5.Ar
6. Kr
Атом
Электронная формула
А. 1s2 2s22p63s23p63d24s2
Б. 1s2 2s22p63s23p64s2
В. 1s2 2s22p2
Г. 1s2 2s22p63s23p63d104s2 4p4
Часть Д. Найдите один правильный ответ:
11. Число электронных уровней у атома железа равно
а) 4 б) 8 в) 5 г) 3
12. Число электронов на внешнем уровне атома стронция равно
а) 5 б) 4 в) 3 г) 2
13. Число электронов у атома хрома равно
а) 28 б) 52 в) 24 г) 76
14. Максимальное число электронов на третьем уровне равно
а) 12 б) 18 в) 24 г) 9
15. Максимальное число электронов на d подуровне равно
а) 10 б) 8 в) 6 г) 14
16. Гантелеобразная форма характерна для
а) s орбиталей б) p орбиталей в) d орбиталей г) f орбиталей
17. Сферическую форму имеет
а) f орбиталь б) d орбиталь в) s орбиталь г) p орбиталь
18.
Kr
Атом
Электронная формула
А. 1s2 2s22p63s23p63d24s2
Б. 1s2 2s22p63s23p64s2
В. 1s2 2s22p2
Г. 1s2 2s22p63s23p63d104s2 4p4
Часть Д. Найдите один правильный ответ:
11. Число электронных уровней у атома железа равно
а) 4 б) 8 в) 5 г) 3
12. Число электронов на внешнем уровне атома стронция равно
а) 5 б) 4 в) 3 г) 2
13. Число электронов у атома хрома равно
а) 28 б) 52 в) 24 г) 76
14. Максимальное число электронов на третьем уровне равно
а) 12 б) 18 в) 24 г) 9
15. Максимальное число электронов на d подуровне равно
а) 10 б) 8 в) 6 г) 14
16. Гантелеобразная форма характерна для
а) s орбиталей б) p орбиталей в) d орбиталей г) f орбиталей
17. Сферическую форму имеет
а) f орбиталь б) d орбиталь в) s орбиталь г) p орбиталь
18. Электронная формула внешнего уровня 2s22p1 соответствует атому
а) алюминия б) d фосфора в) азота г) бора
19. Электронная конфигурация внешней оболочки атома алюминия
а) 4s2 4p1 б) 3s2 3p3 в) 3s2 3p1 г) 3s2 3d1 Эталон ответов:
Контрольная работа № 2
«Строение атома»
Проверяемые знания и умения: У2, У4, У6, З2,З3,И7.
1. Свойства химических элементов и образуемых ими простых и сложных веществ находятся в
периодической зависимости от заряда ядра атомов этих элементов.
2. Графическое выражение Периодического закона;
3. Электронная формула атома – размещение электронов по орбиталям;
4. Электрон – отрицательно заряженная частица;
5. Атомы мельчайшие химически неделимые частицы, из которых состоят молекулы.
6. а) Н, б) Н, в) Ar г) Mn
7. а) A F, B – Na; б) C Rn, B –Po, APb; c) AH, B –Li, CB.
8. Натрий.
9. 5463
10. 3426
11. а
12. г
13. в
14. б
15. а
16.
Электронная формула внешнего уровня 2s22p1 соответствует атому
а) алюминия б) d фосфора в) азота г) бора
19. Электронная конфигурация внешней оболочки атома алюминия
а) 4s2 4p1 б) 3s2 3p3 в) 3s2 3p1 г) 3s2 3d1 Эталон ответов:
Контрольная работа № 2
«Строение атома»
Проверяемые знания и умения: У2, У4, У6, З2,З3,И7.
1. Свойства химических элементов и образуемых ими простых и сложных веществ находятся в
периодической зависимости от заряда ядра атомов этих элементов.
2. Графическое выражение Периодического закона;
3. Электронная формула атома – размещение электронов по орбиталям;
4. Электрон – отрицательно заряженная частица;
5. Атомы мельчайшие химически неделимые частицы, из которых состоят молекулы.
6. а) Н, б) Н, в) Ar г) Mn
7. а) A F, B – Na; б) C Rn, B –Po, APb; c) AH, B –Li, CB.
8. Натрий.
9. 5463
10. 3426
11. а
12. г
13. в
14. б
15. а
16. б
17. в
18. г
19. в
б
17. в
18. г
19. в
Тест по химии атомной структуры
1. Атом бериллия имеет 4 протона, 5 нейтронов и 4 электрона. Какое массовое число у этого атома?
Правильный Неправильный
Массовое число — это количество протонов и нейтронов в ядре. Для этого вопроса вы добавляете 4 протона и 5 нейтронов, чтобы получить ответ 9.
2. Наименьшее главное квантовое число для электрона:
Правильный Неправильный
Главное квантовое число указывает размер электронной орбитали.Он имеет положительное целочисленное значение, но никогда не может быть 0. Итак, наименьшее число — 1.
3. Символ электронной точки для элемента показывает символ этого элемента и расположение точек, которое указывает:
Правильный Неправильный
Структура Льюиса или структура электронных точек показывает несвязанные электронные пары. Несвязанные электроны — это валентные электроны или электроны во внешней электронной оболочке.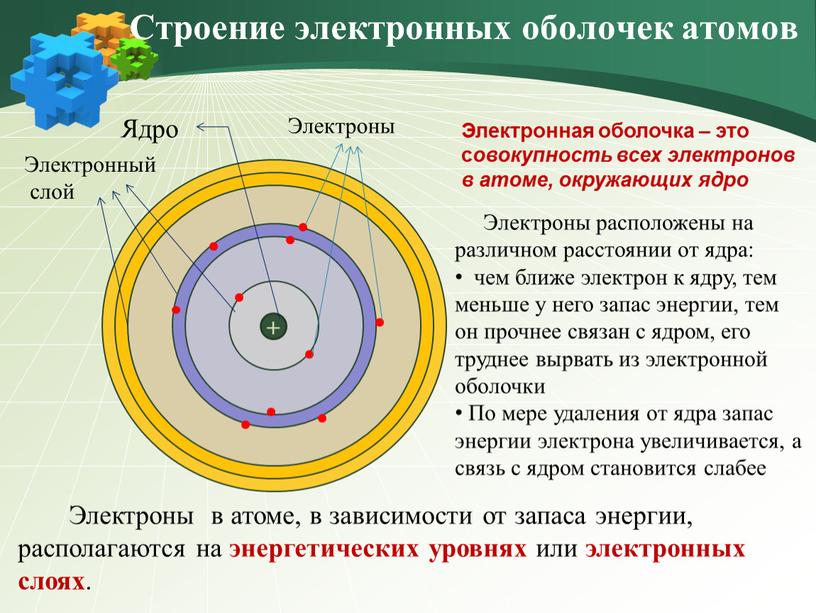
4. Наиболее распространенная степень окисления кремния в соединении:
.Правильный Неправильный
Существует набор правил, используемых для определения степени окисления.Степень окисления свободного элемента всегда равна нулю, но поскольку этот вопрос касается кремния в соединении, вы смотрите на количество электронов, необходимое для заполнения его валентной оболочки. Вы можете понять это по электронной конфигурации. Позиция в таблице Менделеева тоже обычно дает ответ. Кремний находится в той же группе, что и углерод. Кремний обычно показывает степень окисления +4.
5. На каком подуровне может находиться максимум 10 электронов?
Правильный Неправильный
Есть удобная диаграмма, которую вы можете нарисовать, чтобы выяснить конфигурации электронов, поэтому вам не нужно их запоминать.На подуровне s 2 электрона, на подуровне p — 6, на подуровне d — 10 и на подуровне f — 14.
6. Две основные части атома:
Правильный Неправильный
Две части атома — это его ядро, которое состоит из протонов и нейтронов, и электроны, вращающиеся вокруг ядра.
7. Какой элемент с наибольшей вероятностью образует ковалентное соединение?
Правильный Неправильный
Двумя основными типами химических связей являются ионные связи и ковалентные связи.Металлы имеют тенденцию к образованию ионных связей. Неметаллы более склонны к образованию ковалентных связей. Вы можете предсказать, будут ли два атома образовывать ионные или ковалентные связи, сравнив разницу между их значениями электроотрицательности. Углерод — единственный неметалл, упомянутый в вопросе.
8. Электронная точечная диаграмма хлора представляет собой Cl, окруженный семью точками. Атом с идентичным расположением имеет атомный номер:
.Правильный Неправильный
Электронно-точечная структура зависит от количества валентных электронов.Чтобы ответить на вопрос, вам нужно знать электронную конфигурацию атомов, чтобы увидеть, какой из них имеет 7 несвязанных электронов, например хлор. Фтор, элемент номер 9, имеет 2 электрона на s-подуровне (K-оболочка).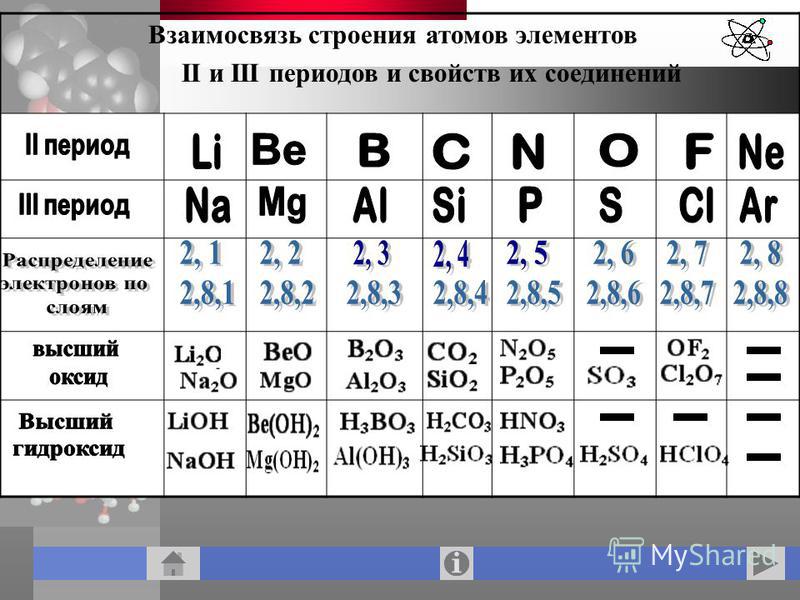 L-оболочка заполнена не полностью, 7 электронов.
L-оболочка заполнена не полностью, 7 электронов.
9. Орбитали не заняты:
Правильный Неправильный
Если у вас возникли проблемы с этим вопросом, вы можете рассмотреть квантовые числа и электронные орбитали. Орбитали никогда не содержат 3 электрона.
10. Число орбиталей на втором основном энергетическом уровне атома (n = 2) равно:
Правильный Неправильный
Это еще один вопрос, связанный с квантовыми числами. Если n = 2, то может быть 4 орбитали (1 с орбитальные и 3 p орбитали).
Тест по химии атомной структуры
Вы получили:% Верно. Атомная бомба
Вы провалили викторину по атомной структуре. Это как атомная бомба, только разное .. FPG / Getty ImagesВы провалили викторину, но она не для оценки, так что не волнуйтесь! Кроме того, вы многому научились, просто пройдя тест.
Если вы серьезно относитесь к изучению атомов, начните с изучения основ. Вы также можете пройти викторину по основам атома, чтобы убедиться, что вы знаете основы строительных блоков материи.
Поделитесь своими результатами
Тест по химии атомной структуры
Вы получили:% Верно. Ноу-хау по средней атомной структуре
Вы приобретаете знания об атомной структуре .. Креатив из бумажного кораблика / Getty ImagesХотя вам удобны некоторые аспекты атомной структуры, вы еще не определились с деталями.Отсюда вы можете просмотреть общие темы по химии или переключить передачи и пройти тест, чтобы узнать, насколько хорошо вы знаете общие научные мелочи.
Поделитесь своими результатами
Тест по химии атомной структуры
Вы получили:% Верно. Плюс в атомной теории
Вы много знаете об атомной структуре .. АЛЬФРЕД ПАСЬЕКА / Getty ImagesОтличная работа! Вы хорошо справились с викториной по атомной структуре. Готовы к еще одной викторине? Посмотрите, насколько хорошо вы справитесь с 20 вопросами химического теста. Готовы к чему-то другому? Узнайте интересные факты о науке.
Поделитесь своими результатами
Структура атома
Обзор атомной структуры
Атомы состоят из частиц протонов, нейтронов и электронов, которые отвечают за массу и заряд атомов.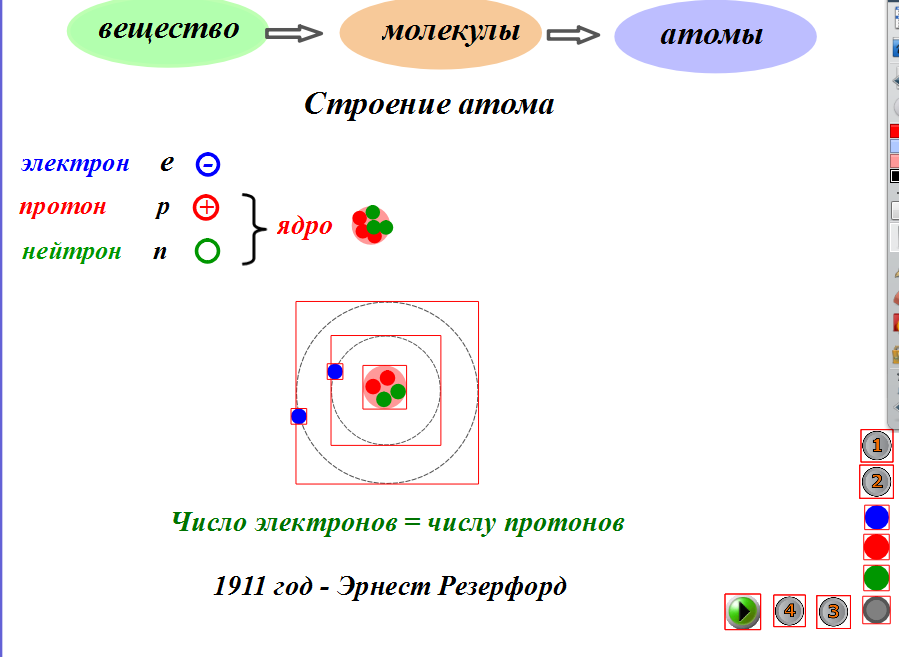
Цели обучения
Обсудить электронные и структурные свойства атома
Основные выводы
Ключевые моменты
- Атом состоит из двух областей: ядра, которое находится в центре атома и содержит протоны и нейтроны, и внешней области атома, которая удерживает свои электроны на орбите вокруг ядра.
- Протоны и нейтроны имеют примерно одинаковую массу, около 1,67 × 10-24 грамма, которую ученые определяют как одну атомную единицу массы (а.е.м.) или один дальтон.
- Каждый электрон имеет отрицательный заряд (-1), равный положительному заряду протона (+1).
- Нейтроны — это незаряженные частицы, находящиеся внутри ядра.
Ключевые термины
- атом : Наименьшее возможное количество вещества, которое все еще сохраняет свою идентичность как химический элемент, состоящее из ядра, окруженного электронами.
- протон : положительно заряженная субатомная частица, составляющая часть ядра атома и определяющая атомный номер элемента.
 Он весит 1 а.е.м.
Он весит 1 а.е.м. - нейтрон : субатомная частица, составляющая часть ядра атома. Это бесплатно. По массе он равен протону или весит 1 а.е.м.
Атом — это наименьшая единица вещества, которая сохраняет все химические свойства элемента. Атомы объединяются, образуя молекулы, которые затем взаимодействуют с образованием твердых тел, газов или жидкостей.Например, вода состоит из атомов водорода и кислорода, которые объединились в молекулы воды. Многие биологические процессы посвящены расщеплению молекул на составляющие их атомы, чтобы из них можно было собрать более полезную молекулу.
Атомные частицы
Атомы состоят из трех основных частиц: протонов, электронов и нейтронов. Ядро (центр) атома содержит протоны (положительно заряженные) и нейтроны (без заряда). Внешние области атома называются электронными оболочками и содержат электроны (отрицательно заряженные).Атомы имеют разные свойства в зависимости от расположения и количества их основных частиц.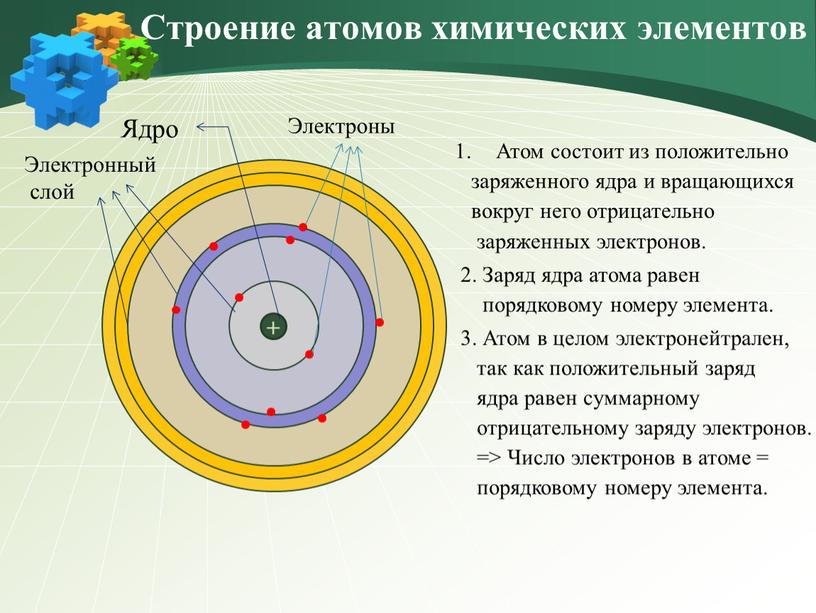
Атом водорода (H) содержит только один протон, один электрон и не содержит нейтронов. Это может быть определено с использованием атомного номера и массового числа элемента (см. Понятие атомных номеров и массовых чисел).
Структура атома : Изображенные здесь элементы, такие как гелий, состоят из атомов. Атомы состоят из протонов и нейтронов, расположенных внутри ядра, а электроны находятся на орбиталях, окружающих ядро.
Атомная масса
Протоны и нейтроны имеют примерно одинаковую массу, примерно 1,67 × 10 -24 грамма. Ученые определяют это количество массы как одну атомную единицу массы (а.е.м.) или один Дальтон. Протоны схожи по массе, но заряжены положительно, а нейтроны не имеют заряда. Следовательно, количество нейтронов в атоме существенно влияет на его массу, но не на его заряд.
Электроны намного меньше по массе, чем протоны, всего 9.11 × 10 -28 грамма, или примерно 1/1800 атомной единицы массы. Следовательно, они не вносят большой вклад в общую атомную массу элемента. При рассмотрении атомной массы принято игнорировать массу любых электронов и рассчитывать массу атома, исходя только из числа протонов и нейтронов.
Следовательно, они не вносят большой вклад в общую атомную массу элемента. При рассмотрении атомной массы принято игнорировать массу любых электронов и рассчитывать массу атома, исходя только из числа протонов и нейтронов.
Электроны вносят большой вклад в заряд атома, поскольку каждый электрон имеет отрицательный заряд, равный положительному заряду протона. Ученые определяют эти обвинения как «+1» и «-1».В незаряженном нейтральном атоме количество электронов, вращающихся вокруг ядра, равно количеству протонов внутри ядра. В этих атомах положительный и отрицательный заряды нейтрализуют друг друга, в результате чего получается атом без чистого заряда.
Протоны, нейтроны и электроны : Протоны и нейтроны имеют массу 1 а.е.м. и находятся в ядре. Однако протоны имеют заряд +1, а нейтроны не заряжены. Электроны имеют массу примерно 0 а.е.м., вращаются вокруг ядра и имеют заряд -1.
Исследование свойств электрона : Сравните поведение электронов с поведением других заряженных частиц, чтобы обнаружить такие свойства электронов, как заряд и масса.
Объем атомов
С учетом размеров протонов, нейтронов и электронов большая часть объема атома — более 99 процентов — фактически представляет собой пустое пространство. Несмотря на все это пустое пространство, твердые объекты не проходят сквозь друг друга. Электроны, которые окружают все атомы, заряжены отрицательно и заставляют атомы отталкиваться друг от друга, не позволяя атомам занимать одно и то же пространство.Эти межмолекулярные силы не позволяют вам провалиться сквозь такой объект, как стул.
Interactive: создайте атом : создайте атом из протонов, нейтронов и электронов и посмотрите, как изменяются элемент, заряд и масса. Тогда сыграйте в игру, чтобы проверить свои идеи!
Атомный номер и массовое число
Атомный номер — это количество протонов в элементе, а массовое число — это количество протонов плюс количество нейтронов.
Цели обучения
Определите взаимосвязь между массовым числом атома, его атомным номером, его атомной массой и количеством субатомных частиц.
Основные выводы
Ключевые моменты
- Нейтральные атомы каждого элемента содержат равное количество протонов и электронов.
- Число протонов определяет атомный номер элемента и используется, чтобы отличить один элемент от другого.
- Количество нейтронов варьируется, в результате чего образуются изотопы, которые представляют собой разные формы одного и того же атома, которые различаются только количеством нейтронов, которыми они обладают.
- Вместе количество протонов и количество нейтронов определяют массовое число элемента.
- Поскольку изотопы элемента имеют несколько разные массовые числа, атомная масса рассчитывается путем получения среднего массового числа его изотопов.
Ключевые термины
- массовое число : сумма количества протонов и количества нейтронов в атоме.
- атомный номер : число протонов в атоме.
- атомная масса : Средняя масса атома с учетом всех его естественных изотопов.

Атомный номер
Нейтральные атомы элемента содержат равное количество протонов и электронов. Число протонов определяет атомный номер элемента (Z) и отличает один элемент от другого. Например, атомный номер углерода (Z) равен 6, потому что у него 6 протонов. Количество нейтронов может изменяться для получения изотопов, которые представляют собой атомы одного и того же элемента, имеющие разное количество нейтронов.Число электронов также может быть различным в атомах одного и того же элемента, в результате чего образуются ионы (заряженные атомы). Например, железо Fe может существовать в нейтральном состоянии или в ионных состояниях +2 и +3.
Массовое число
Массовое число элемента (A) — это сумма количества протонов и количества нейтронов. Небольшой вклад массы электронов не принимается во внимание при вычислении массового числа. Это приближение массы можно использовать, чтобы легко вычислить, сколько нейтронов имеет элемент, просто вычтя количество протонов из массового числа. Протоны и нейтроны весят около одной атомной единицы массы или а.е.м. Изотопы одного и того же элемента будут иметь одинаковый атомный номер, но разные массовые числа.
Протоны и нейтроны весят около одной атомной единицы массы или а.е.м. Изотопы одного и того же элемента будут иметь одинаковый атомный номер, но разные массовые числа.
Атомный номер, химический символ и массовое число : Углерод имеет атомный номер шесть и два стабильных изотопа с массовыми числами двенадцать и тринадцать соответственно. Его средняя атомная масса 12,11.
Ученые определяют атомную массу, вычисляя среднее значение массовых чисел изотопов природного происхождения.Часто полученное число содержит десятичную дробь. Например, атомная масса хлора (Cl) составляет 35,45 а.е.м., потому что хлор состоит из нескольких изотопов, некоторые (большинство) с атомной массой 35 а.е.м. (17 протонов и 18 нейтронов), а некоторые с атомной массой 37 а.е.м. (17 протонов и 20 нейтронов).
Зная атомный номер (Z) и массовое число (A), вы можете найти количество протонов, нейтронов и электронов в нейтральном атоме. Например, атом лития (Z = 3, A = 7 а. е.м.) содержит три протона (находится из Z), три электрона (поскольку количество протонов равно количеству электронов в атоме) и четыре нейтрона (7 — 3 = 4).
е.м.) содержит три протона (находится из Z), три электрона (поскольку количество протонов равно количеству электронов в атоме) и четыре нейтрона (7 — 3 = 4).
Изотопы
Изотопы — это различные формы элементов, которые имеют одинаковое количество протонов, но разное количество нейтронов.
Цели обучения
Обсудить свойства изотопов и их использование в радиометрическом датировании
Основные выводы
Ключевые моменты
- Изотопы — это атомы одного и того же элемента, которые содержат одинаковое количество протонов, но разное количество нейтронов.
- Несмотря на разное количество нейтронов, изотопы одного и того же элемента имеют очень похожие физические свойства.
- Некоторые изотопы нестабильны и при радиоактивном распаде превращаются в другие элементы.
- Предсказуемый период полураспада различных распадающихся изотопов позволяет ученым датировать материал на основе его изотопного состава, например, с помощью датировки углерода-14.

Ключевые термины
- изотоп : Любая из двух или более форм элемента, в которых атомы имеют одинаковое количество протонов, но разное количество нейтронов в их ядрах.
- период полураспада : время, за которое половина исходной концентрации изотопа распадается обратно в более стабильную форму.
- радиоактивные изотопы : атом с нестабильным ядром, характеризующийся избыточной доступной энергией, который подвергается радиоактивному распаду и чаще всего создает гамма-лучи, альфа- или бета-частицы.
- радиоуглеродное датирование : Определение возраста объекта путем сравнения отношения обнаруженной в нем концентрации 14C к количеству 14C в атмосфере.
Что такое изотоп?
Изотопы — это различные формы элементов, которые имеют одинаковое количество протонов, но разное количество нейтронов. Некоторые элементы, такие как углерод, калий и уран, содержат несколько изотопов природного происхождения.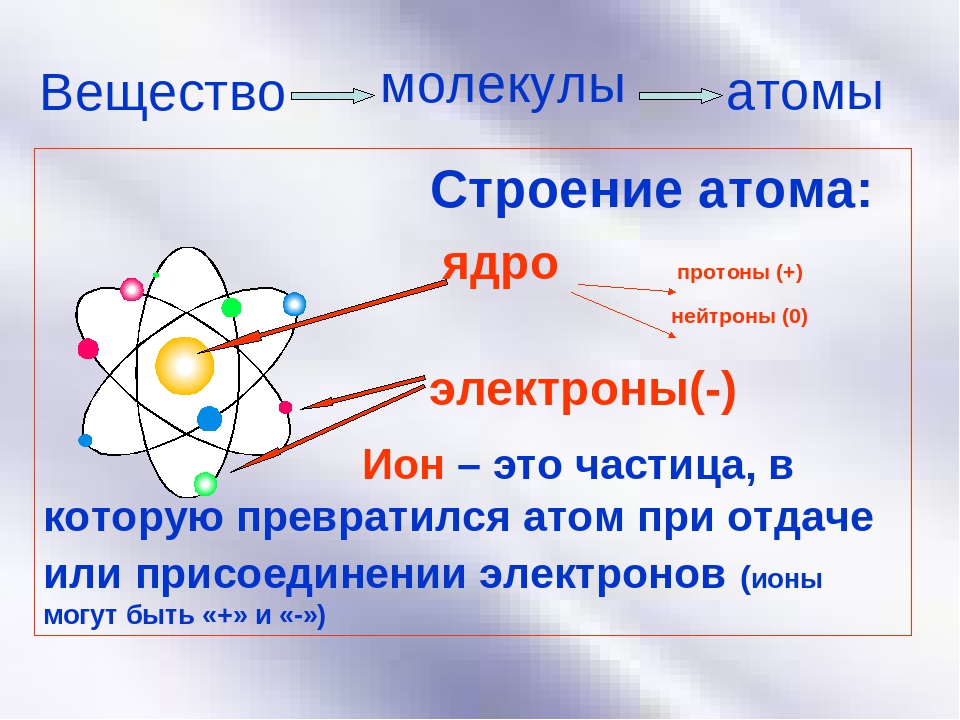 Изотопы определяются сначала их элементом, а затем суммой присутствующих протонов и нейтронов.
Изотопы определяются сначала их элементом, а затем суммой присутствующих протонов и нейтронов.
- Углерод-12 (или 12 C) содержит шесть протонов, шесть нейтронов и шесть электронов; следовательно, он имеет массовое число 12 а.е.м. (шесть протонов и шесть нейтронов).
- Углерод-14 (или 14 C) содержит шесть протонов, восемь нейтронов и шесть электронов; его атомная масса 14 а.е.м. (шесть протонов и восемь нейтронов).
Хотя масса отдельных изотопов различна, их физические и химические свойства в основном не меняются.
Изотопы действительно различаются по стабильности. Углерод-12 ( 12 C) — самый распространенный изотоп углерода, составляющий 98,89% углерода на Земле. Углерод-14 ( 14 C) нестабилен и встречается только в следовых количествах.Нестабильные изотопы чаще всего испускают альфа-частицы (He 2+ ) и электроны. Также могут испускаться нейтроны, протоны и позитроны, а электроны могут быть захвачены для достижения более стабильной атомной конфигурации (более низкого уровня потенциальной энергии) посредством процесса, называемого радиоактивным распадом. Созданные новые атомы могут находиться в состоянии высокой энергии и испускать гамма-лучи, которые понижают энергию, но сами по себе не превращают атом в другой изотоп. Эти атомы называются радиоактивными изотопами или радиоизотопами.
Созданные новые атомы могут находиться в состоянии высокой энергии и испускать гамма-лучи, которые понижают энергию, но сами по себе не превращают атом в другой изотоп. Эти атомы называются радиоактивными изотопами или радиоизотопами.
Радиоуглеродное датирование
Углерод обычно присутствует в атмосфере в виде газообразных соединений, таких как диоксид углерода и метан. Углерод-14 ( 14 C) представляет собой радиоизотоп природного происхождения, который создается из атмосферного 14 N (азота) за счет добавления нейтрона и потери протона, вызванной космическими лучами. Это непрерывный процесс, поэтому в атмосфере всегда образуется больше 14 C. После производства 14 C часто соединяется с кислородом атмосферы с образованием диоксида углерода.Образовавшийся таким образом углекислый газ диффундирует в атмосфере, растворяется в океане и попадает в организм растений посредством фотосинтеза. Животные поедают растения, и в конечном итоге радиоуглерод распространяется по биосфере.
В живых организмах относительное количество 14 C в их теле примерно равно концентрации 14 C в атмосфере. Когда организм умирает, он больше не потребляет 14 C, поэтому соотношение между 14 C и 12 C будет снижаться, поскольку 14 C постепенно возвращается к 14 N.Этот медленный процесс, который называется бета-распадом, высвобождает энергию за счет испускания электронов из ядра или позитронов.
Примерно через 5730 лет половина исходной концентрации 14 C будет преобразована обратно в 14 N. Это называется периодом полураспада или временем, которое требуется для получения половины исходной концентрации изотоп распадается до более стабильной формы. Поскольку период полураспада 14 C большой, он используется для датирования ранее живых объектов, таких как старые кости или дерево.Сравнивая отношение концентрации 14 C, обнаруженной в объекте, к количеству 14 C в атмосфере, можно определить количество изотопа, который еще не распался. На основе этого количества можно точно рассчитать возраст материала, если предполагается, что возраст материала составляет менее 50 000 лет. Этот метод называется радиоуглеродным датированием, или сокращенно углеродным датированием.
На основе этого количества можно точно рассчитать возраст материала, если предполагается, что возраст материала составляет менее 50 000 лет. Этот метод называется радиоуглеродным датированием, или сокращенно углеродным датированием.
Применение углеродного датирования : Возраст углеродсодержащих останков менее 50 000 лет, таких как этот карликовый мамонт, можно определить с помощью углеродного датирования.
Другие элементы имеют изотопы с различным периодом полураспада. Например, 40 K (калий-40) имеет период полураспада 1,25 миллиарда лет, а 235 U (уран-235) имеет период полураспада около 700 миллионов лет. Ученые часто используют эти другие радиоактивные элементы для датирования объектов, возраст которых превышает 50 000 лет (предел углеродного датирования). Используя радиометрическое датирование, ученые могут изучать возраст окаменелостей или других останков вымерших организмов.
Chem4Kids.com: Атомы: Структура
Атомы — основа химии.
 Они являются основой всего во Вселенной. Как известно, материя состоит из атомов. Твердые тела состоят из плотно упакованных атомов, а газы — из рассредоточенных атомов. Мы собираемся охватить такие основы, как атомная структура и связь между атомами. По мере того, как вы узнаете больше, вы можете перейти к страницам реакций и биохимии и увидеть, как атомы образуют соединения, которые помогают выжить биологическому миру.
Они являются основой всего во Вселенной. Как известно, материя состоит из атомов. Твердые тела состоят из плотно упакованных атомов, а газы — из рассредоточенных атомов. Мы собираемся охватить такие основы, как атомная структура и связь между атомами. По мере того, как вы узнаете больше, вы можете перейти к страницам реакций и биохимии и увидеть, как атомы образуют соединения, которые помогают выжить биологическому миру.Есть ли куски материи меньше атомов? Конечно, есть. Внутри кусков атомов можно найти сверхмалые частицы. Эти субатомные частицы включают нуклонов и кварков . Ядерные химики и физики работают вместе на ускорителях частиц , чтобы обнаружить присутствие этих крошечных, крошечных, крошечных кусочков материи. Однако наука основана на атоме, потому что это мельчайшая отдельная единица материи.
Несмотря на то, что существует множество сверхмалых атомных частиц, вам нужно помнить только о трех основных частях атома: электронах, протонах и нейтронах. Что такое электроны, протоны и нейтроны? Электроны — самые маленькие из трех частиц, составляющих атомы. Электроны находятся в оболочках или орбиталях, окружающих ядро атома. Протоны и нейтроны находятся в ядре . Они группируются вместе в центре атома. Это все, что вам нужно запомнить. Три легких штуки!
Что такое электроны, протоны и нейтроны? Электроны — самые маленькие из трех частиц, составляющих атомы. Электроны находятся в оболочках или орбиталях, окружающих ядро атома. Протоны и нейтроны находятся в ядре . Они группируются вместе в центре атома. Это все, что вам нужно запомнить. Три легких штуки!В периодической таблице около 120 известных элементов. (117, пока мы пишем это) Химики и физики каждый день пытаются создавать новые в своих лабораториях.Атомы разных элементов имеют разное количество электронов, протонов и нейтронов. Каждый элемент уникален и имеет атомный номер. Это число говорит вам количество протонов в каждом атоме элемента. Атомный номер также называют числом протона.
Вы можете видеть, что каждая часть атома помечена знаком «+», «-» или «0». Эти символы относятся к заряду частицы. Вы когда-нибудь слышали о поражении электрическим током от розетки, статическом электричестве или молнии? Все это связано с электрическими зарядами.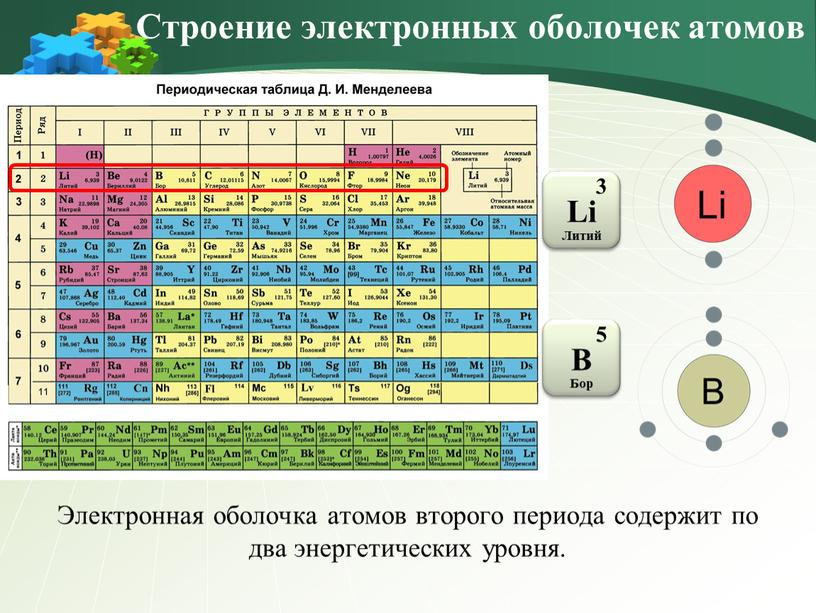 Заряды также находятся в крошечных частицах вещества.
Заряды также находятся в крошечных частицах вещества.Электрон всегда имеет «-» или отрицательный заряд. Протон всегда имеет «+» или положительный заряд. Если заряд всего атома равен «0» или нейтрален, имеется равное количество положительных и отрицательных зарядов. Нейтральные атомы имеют равное количество электронов и протонов. Третья частица — нейтрон. Он имеет нейтральный заряд, также известный как нулевой заряд.
Поскольку количество протонов в атоме не меняется, меньшее количество или больше электронов может создать особый атом, называемый ионом. Катионы имеют меньше электронов и положительный заряд. Анионы имеют лишние электроны, которые создают отрицательный заряд.
Самая маленькая письменность в мире (видео Стэнфордского университета)
Атомная теория — Введение в химию — 1-е канадское издание
- Изложите современную атомную теорию.
- Узнайте, как устроены атомы.

Наименьший кусок элемента, который поддерживает идентичность этого элемента, называется атомом.Отдельные атомы чрезвычайно малы. Чтобы построить линию длиной 1 см, потребуется около пятидесяти миллионов атомов подряд. Точка в конце печатного предложения состоит из нескольких миллионов атомов. Атомы настолько малы, что трудно поверить, что вся материя состоит из атомов, но это так.
Представление о том, что атомы играют фундаментальную роль в химии, формализовано современной атомной теорией, впервые изложенной английским ученым Джоном Далтоном в 1808 году. Она состоит из трех частей:
- Вся материя состоит из атомов.
- Атомы одного и того же элемента одинаковы; атомы разных элементов разные.
- Атомы объединяются в целочисленных отношениях с образованием соединений.
Эти концепции составляют основу химии.
Хотя слово атом происходит от греческого слова, которое означает «неделимый», теперь мы понимаем, что сами атомы состоят из более мелких частей, называемых субатомными частицами . Первым был обнаружен электрон, крошечная субатомная частица с отрицательным зарядом.Его часто обозначают как e — , где правый верхний индекс показывает отрицательный заряд. Позже были обнаружены две более крупные частицы. Протон — более массивная (но все же крошечная) субатомная частица с положительным зарядом, представленная как p + . Нейтрон — это субатомная частица с массой примерно такой же, как у протона, но без заряда. Он представлен как n или n 0 . Теперь мы знаем, что все атомы всех элементов состоят из электронов, протонов и (за одним исключением) нейтронов.Таблица 3.1 «Свойства трех субатомных частиц» суммирует свойства этих трех субатомных частиц.
Первым был обнаружен электрон, крошечная субатомная частица с отрицательным зарядом.Его часто обозначают как e — , где правый верхний индекс показывает отрицательный заряд. Позже были обнаружены две более крупные частицы. Протон — более массивная (но все же крошечная) субатомная частица с положительным зарядом, представленная как p + . Нейтрон — это субатомная частица с массой примерно такой же, как у протона, но без заряда. Он представлен как n или n 0 . Теперь мы знаем, что все атомы всех элементов состоят из электронов, протонов и (за одним исключением) нейтронов.Таблица 3.1 «Свойства трех субатомных частиц» суммирует свойства этих трех субатомных частиц.
Таблица 3.1 Свойства трех субатомных частиц
| Имя | Символ | Масса (прибл .; кг) | Заряд |
|---|---|---|---|
| Протон | п. + | 1,6 × 10 −27 | 1+ |
| нейтрон | п, н 0 | 1. 6 × 10 −27 6 × 10 −27 | нет |
| Электрон | e — | 9,1 × 10 −31 | 1− |
Как эти частицы расположены в атомах? Они расположены не случайно. Эксперименты Эрнеста Резерфорда в Англии в 1910-х годах указали на ядерную модель атома. Относительно массивные протоны и нейтроны собираются в центре атома, в области, называемой ядром атома (множество ядер , ).Электроны находятся вне ядра и проводят время, вращаясь в космосе вокруг ядра. (См. Рисунок 3.1 «Структура атома».)
Рисунок 3.1 Структура атома
В центре атома есть протоны и нейтроны, образующие ядро, а электроны вращаются вокруг ядра.
Современная атомная теория утверждает, что атомы одного элемента одинаковы, а атомы разных элементов различны. Что отличает атомы разных элементов? Фундаментальной характеристикой, которой обладают все атомы одного и того же элемента, является число протонов . Все атомы водорода имеют в ядре один и только один протон; все атомы железа имеют в ядре 26 протонов. Это количество протонов настолько важно для идентичности атома, что его называют атомным номером элемента. Таким образом, атомный номер водорода равен 1, а атомный номер железа — 26. Каждый элемент имеет свой собственный характерный атомный номер.
Все атомы водорода имеют в ядре один и только один протон; все атомы железа имеют в ядре 26 протонов. Это количество протонов настолько важно для идентичности атома, что его называют атомным номером элемента. Таким образом, атомный номер водорода равен 1, а атомный номер железа — 26. Каждый элемент имеет свой собственный характерный атомный номер.
Однако атомы одного и того же элемента могут иметь разное количество нейтронов. Атомы одного и того же элемента (т.е.атомы с одинаковым числом протонов) с разным числом нейтронов называются изотопами.Большинство природных элементов существуют в виде изотопов. Например, большинство атомов водорода имеют в своем ядре единственный протон. Однако небольшое количество (примерно один из миллиона) атомов водорода имеет в своих ядрах протон и нейтрон. Этот конкретный изотоп водорода называется дейтерий. Очень редкая форма водорода имеет в ядре один протон и два нейтрона; этот изотоп водорода называется тритием. Сумма количества протонов и нейтронов в ядре называется массовым числом изотопа.
Нейтральные атомы имеют такое же количество электронов, что и протоны, поэтому их общий заряд равен нулю. Однако, как мы увидим позже, так будет не всегда.
Пример 1
- Наиболее распространенные атомы углерода содержат шесть протонов и шесть нейтронов в своих ядрах. Каковы атомный номер и массовое число этих атомов углерода?
- Изотоп урана имеет атомный номер 92 и массовое число 235. Какое количество протонов и нейтронов в ядре этого атома?
Решение
- Если в ядре атома углерода шесть протонов, его атомный номер равен 6.Если у него также есть шесть нейтронов в ядре, то массовое число равно 6 + 6, или 12.
- Если атомный номер урана 92, то это количество протонов в ядре. Поскольку массовое число равно 235, то количество нейтронов в ядре равно 235 — 92, или 143.
Проверьте себя
Число протонов в ядре атома олова — 50, а число нейтронов в ядре — 68. Каковы атомный номер и массовое число этого изотопа?
Ответ
Атомный номер = 50, массовое число = 118
Обращаясь к атому, мы просто используем название элемента: термин натрий относится как к элементу, так и к атому натрия. Но постоянно использовать имя элемента может быть неудобно. Вместо этого химия определяет символ для каждого элемента. Атомарный символ — это одно- или двухбуквенное сокращение имени элемента. По соглашению первая буква символа элемента всегда заглавная, а вторая буква (если есть) — строчная. Таким образом, символ водорода — H, символ натрия — Na, а символ никеля — Ni. Большинство символов происходит от английского названия элемента, хотя некоторые символы происходят от латинского названия элемента.(Символ натрия Na происходит от его латинского названия natrium ). В таблице 3.2 «Названия и символы общих элементов» перечислены некоторые общие элементы и их символы. Вам следует запомнить символы в таблице 3.2 «Названия и символы общих элементов», так как именно так мы будем представлять элементы в химии.
Но постоянно использовать имя элемента может быть неудобно. Вместо этого химия определяет символ для каждого элемента. Атомарный символ — это одно- или двухбуквенное сокращение имени элемента. По соглашению первая буква символа элемента всегда заглавная, а вторая буква (если есть) — строчная. Таким образом, символ водорода — H, символ натрия — Na, а символ никеля — Ni. Большинство символов происходит от английского названия элемента, хотя некоторые символы происходят от латинского названия элемента.(Символ натрия Na происходит от его латинского названия natrium ). В таблице 3.2 «Названия и символы общих элементов» перечислены некоторые общие элементы и их символы. Вам следует запомнить символы в таблице 3.2 «Названия и символы общих элементов», так как именно так мы будем представлять элементы в химии.
Таблица 3.2 Названия и символы общих элементов
Имя элемента Символ
| Имя элемента | Символ | |||
|---|---|---|---|---|
| Алюминий | Al | Меркурий | Hg | |
| Аргон | Ar | молибден | Пн | |
| Мышьяк | Как | Неон | Ne | |
| Барий | Ba | Никель | Ni | |
| Бериллий | Be | Азот | N | |
| Висмут | Bi | Кислород | O | |
| Бор | B | Палладий | Pd | |
| Бром | Br | фосфор | п. | |
| Кальций | Ca | Платина | Pt | |
| Углерод | С | Калий | К | |
| Хлор | Класс | Радий | Ra | |
| Хром | Cr | Радон | Rn | |
| Кобальт | Co | Рубидий | руб. | |
| Медь | Cu | Скандий | сбн | |
| Фтор | Ф | Селен | SE | |
| Галлий | Ga | Кремний | Si | |
| Германий | Ge | Серебро | Ag | |
| Золото | Au | Натрий | Na | |
| Гелий | He | Стронций | Sr | |
| Водород | H | сера | S | |
| Йод | Я | Тантал | Ta | |
| Иридий | Ir | Олово | Sn | |
| Утюг | Fe | Титан | Ti | |
| Криптон | Кр | Вольфрам | Вт | |
| Свинец | Пб | Уран | U | |
| Литий | Ли | Ксенон | Xe | |
| Магний | мг | цинк | Zn | |
| Марганец | Mn | Цирконий | Zr |
Элементы сгруппированы вместе в специальной таблице, называемой периодической таблицей. Простая периодическая таблица показана на Рисунке 3.2 «Простая периодическая таблица», а более обширная представлена в главе 17 «Приложение: Периодическая таблица элементов». Элементы в периодической таблице перечислены в порядке возрастания атомного номера. Периодическая таблица имеет особую форму, которая станет для нас важной, когда мы рассмотрим организацию электронов в атомах (см. Главу 8 «Электронная структура»). Одно немедленное использование таблицы Менделеева помогает нам идентифицировать металлы и неметаллы.Неметаллы находятся в правом верхнем углу таблицы Менделеева, на одной стороне жирной линии, разделяющей правую часть таблицы. Все остальные элементы — металлы.
Простая периодическая таблица показана на Рисунке 3.2 «Простая периодическая таблица», а более обширная представлена в главе 17 «Приложение: Периодическая таблица элементов». Элементы в периодической таблице перечислены в порядке возрастания атомного номера. Периодическая таблица имеет особую форму, которая станет для нас важной, когда мы рассмотрим организацию электронов в атомах (см. Главу 8 «Электронная структура»). Одно немедленное использование таблицы Менделеева помогает нам идентифицировать металлы и неметаллы.Неметаллы находятся в правом верхнем углу таблицы Менделеева, на одной стороне жирной линии, разделяющей правую часть таблицы. Все остальные элементы — металлы.
Рисунок 3.2 Простая периодическая таблица
Есть простой способ представить изотопы с помощью атомных символов. Используем конструкцию
, где X — символ элемента, A — массовое число, а Z — атомный номер. Таким образом, для изотопа углерода, который имеет 6 протонов и 6 нейтронов, символ
.
, где C — символ элемента, 6 — атомный номер, а 12 — массовое число.
Пример 2
- Какой символ у изотопа урана с атомным номером 92 и массовым числом 235?
- Сколько протонов и нейтронов в 26 Fe?
Решение
- Обозначение этого изотопа — .
- В этом атоме железа 26 протонов и 56 — 26 = 30 нейтронов.
Проверьте себя
Сколько протонов в 11 N?
Ответ
11 протонов
Также принято указывать массовое число после названия элемента, чтобы указать на конкретный изотоп. Углерод-12 представляет собой изотоп углерода с 6 протонами и 6 нейтронами, а уран-238 представляет собой изотоп урана, содержащий 146 нейтронов.
Основные выводы
- Химия основана на современной атомной теории, которая утверждает, что вся материя состоит из атомов.
- Сами атомы состоят из протонов, нейтронов и электронов.

- Каждый элемент имеет свой атомный номер, равный количеству протонов в его ядре.
- Изотопы элемента содержат разное количество нейтронов.
- Элементы представлены атомным символом.
- Периодическая таблица — это таблица, в которой упорядочены все элементы.
Упражнения
Перечислите три утверждения, из которых состоит современная атомная теория.
Объясните, как устроены атомы.
Что больше, протон или электрон?
Что больше, нейтрон или электрон?
Каковы заряды каждой из трех субатомных частиц?
Где находится большая часть массы атома?
Нарисуйте схему атома бора, в ядре которого находятся пять протонов и шесть нейтронов.
Нарисуйте схему атома гелия, в ядре которого есть два протона и два нейтрона.
Определите атомный номер . Какой порядковый номер у атома бора?
Какой атомный номер у гелия?
Определите изотоп и приведите пример.
В чем разница между дейтерием и тритием?
Какая пара представляет собой изотопы?
а)
b) 26 F и 25 M
c) 14 S и 15 P
14.Какая пара представляет собой изотопы?
a) 20 C и 19 K
b) 26 F и 26 F
c) 92 U и 92 U
15. Дайте полные обозначения каждого атома, включая атомный номер и массовое число.
а) атом кислорода с 8 протонами и 8 нейтронами
б) атом калия с 19 протонами и 20 нейтронами
в) атом лития с 3 протонами и 4 нейтронами
16.Укажите полные обозначения каждого атома, включая атомный номер и массовое число.
а) атом магния с 12 протонами и 12 нейтронами
б) атом магния с 12 протонами и 13 нейтронами
в) атом ксенона с 54 протонами и 77 нейтронами
17. Америций-241 — изотоп, используемый в детекторах дыма. Каков полный символ этого изотопа?
Каков полный символ этого изотопа?
18. Углерод-14 — изотоп, используемый для проведения радиоактивных тестов датирования ранее живого материала.Каков полный символ этого изотопа?
19. Приведите атомарные символы для каждого элемента.
а) натрий
б) аргон
в) азот
г) радон
20. Приведите атомарные символы для каждого элемента.
а) серебро
б) золото
в) ртуть
г) йод
21. Дайте название элементу.
а) Si
б) Мн
в) Fe
г) Cr
22.Дайте название элементу.
а) Ф
б) Класс
в)
рублейг) Я
ответы
1.
Вся материя состоит из атомов; атомы одного и того же элемента одинаковы, а атомы разных элементов различны; атомы соединяются в целочисленных отношениях с образованием соединений.
3.
Протон больше электрона.
5.
протон: 1+; электрон: 1-; нейтрон: 0
7.
9.
Атомный номер — это количество протонов в ядре. У бора атомный номер пять.
11.
Изотопы — это атомы одного и того же элемента, но с разным числом нейтронов. являются примерами.
13.
а) изотопы
б) неизотопы
в) не изотопы
15.
а)
б) 19 К
в)
17.
95 А
19.
а) Na
б) Ар
в) №
г) Рн
21.
а) кремний
б) марганец
в) железо
г) хром
атом | Определение, структура, история, примеры, диаграммы и факты
Атом , наименьшая единица, на которую можно разделить материю без высвобождения электрически заряженных частиц. Это также мельчайшая единица вещества, обладающая характерными свойствами химического элемента.Таким образом, атом является основным строительным блоком химии.
Оболочечная модель атома В оболочечной модели атома электроны занимают разные энергетические уровни или оболочки.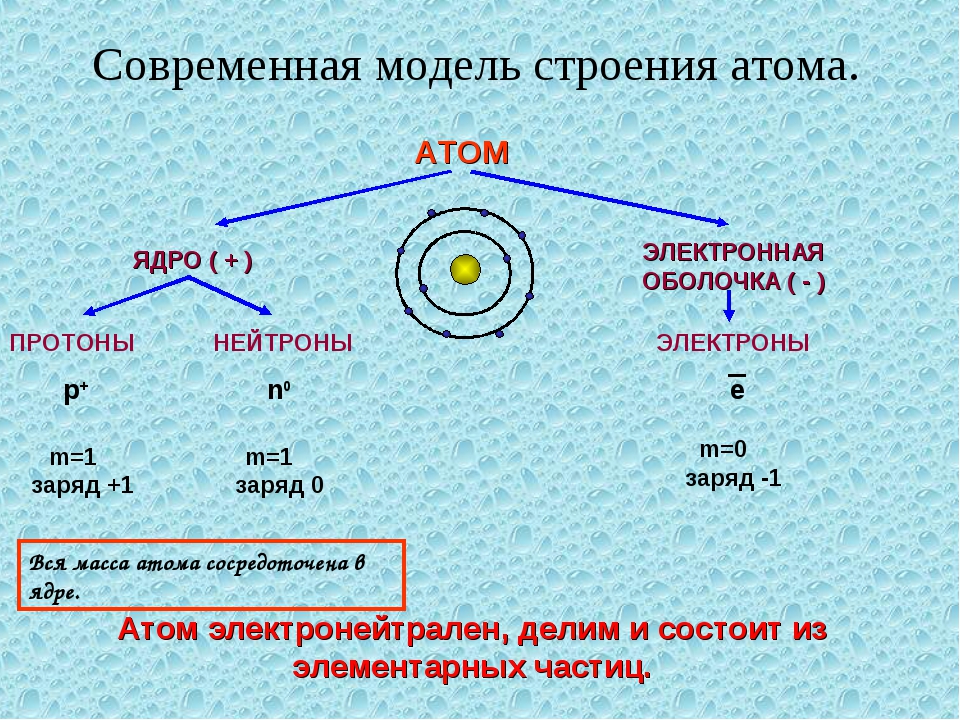 Оболочки K и L показаны для атома неона.
Оболочки K и L показаны для атома неона.
Большая часть атома — это пустое пространство. Остальное состоит из положительно заряженного ядра протонов и нейтронов, окруженного облаком отрицательно заряженных электронов. Ядро маленькое и плотное по сравнению с электронами, которые являются самыми легкими заряженными частицами в природе.Электроны притягиваются к любому положительному заряду своей электрической силой; в атоме электрические силы связывают электроны с ядром.
Из-за природы квантовой механики ни одно изображение не было полностью удовлетворительным для визуализации различных характеристик атома, что, таким образом, вынуждает физиков использовать дополнительные изображения атома для объяснения различных свойств. В некоторых отношениях электроны в атоме ведут себя как частицы, вращающиеся вокруг ядра. В других случаях электроны ведут себя как волны, застывшие вокруг ядра.Такие волновые структуры, называемые орбиталями, описывают распределение отдельных электронов. Эти орбитальные свойства сильно влияют на поведение атома, а его химические свойства определяются орбитальными группировками, известными как оболочки.
Эти орбитальные свойства сильно влияют на поведение атома, а его химические свойства определяются орбитальными группировками, известными как оболочки.
Эта статья открывается широким обзором фундаментальных свойств атома и составляющих его частиц и сил. После этого обзора следует исторический обзор наиболее влиятельных концепций об атоме, сформулированных на протяжении веков.Для дополнительной информации, относящейся к структуре ядра и элементарным частицам, см. субатомных частиц.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишись сейчас Большая часть вещества состоит из скоплений молекул, которые можно относительно легко разделить. Молекулы, в свою очередь, состоят из атомов, соединенных химическими связями, которые труднее разорвать. Каждый отдельный атом состоит из более мелких частиц, а именно из электронов и ядер.Эти частицы электрически заряжены, и электрические силы, действующие на заряд, несут ответственность за удержание атома вместе. Попытки разделить эти более мелкие составляющие частицы требуют все большего количества энергии и приводят к созданию новых субатомных частиц, многие из которых заряжены.
Попытки разделить эти более мелкие составляющие частицы требуют все большего количества энергии и приводят к созданию новых субатомных частиц, многие из которых заряжены.
Как отмечалось во введении к этой статье, атом в основном состоит из пустого пространства. Ядро является положительно заряженным центром атома и содержит большую часть его массы. Он состоит из протонов, которые имеют положительный заряд, и нейтронов, которые не имеют заряда.Протоны, нейтроны и окружающие их электроны — долгоживущие частицы, присутствующие во всех обычных, встречающихся в природе атомах. Другие субатомные частицы могут быть обнаружены в ассоциации с этими тремя типами частиц. Однако они могут быть созданы только с добавлением огромного количества энергии и очень недолговечны.
Все атомы примерно одинакового размера, независимо от того, имеют ли они 3 или 90 электронов. Примерно 50 миллионов атомов твердого вещества, выстроенных в ряд, будут иметь размер 1 см (0.4 дюйма). Удобной единицей длины для измерения размеров атомов является ангстрем (Å), определяемый как 10 −10 метра. Радиус атома составляет 1-2 Å. По сравнению с общим размером атома, ядро еще более миниатюрное. Он находится в той же пропорции к атому, что и мрамор на футбольном поле. По объему ядро занимает всего 10 −14 метра пространства в атоме, то есть 1 часть на 100 000. Удобной единицей длины для измерения размеров ядер является фемтометр (фм), который равен 10 −15 метра.Диаметр ядра зависит от количества содержащихся в нем частиц и колеблется от 4 фм для легкого ядра, такого как углерод, до 15 фм для тяжелого ядра, такого как свинец. Несмотря на малые размеры ядра, практически вся масса атома сосредоточена в нем. Протоны — массивные положительно заряженные частицы, тогда как нейтроны не имеют заряда и немного массивнее протонов. Тот факт, что ядра могут иметь от 1 до почти 300 протонов и нейтронов, объясняет их широкую вариацию массы.Самое легкое ядро, ядро водорода, в 1836 раз массивнее электрона, а тяжелые ядра почти в 500 000 раз массивнее.
Радиус атома составляет 1-2 Å. По сравнению с общим размером атома, ядро еще более миниатюрное. Он находится в той же пропорции к атому, что и мрамор на футбольном поле. По объему ядро занимает всего 10 −14 метра пространства в атоме, то есть 1 часть на 100 000. Удобной единицей длины для измерения размеров ядер является фемтометр (фм), который равен 10 −15 метра.Диаметр ядра зависит от количества содержащихся в нем частиц и колеблется от 4 фм для легкого ядра, такого как углерод, до 15 фм для тяжелого ядра, такого как свинец. Несмотря на малые размеры ядра, практически вся масса атома сосредоточена в нем. Протоны — массивные положительно заряженные частицы, тогда как нейтроны не имеют заряда и немного массивнее протонов. Тот факт, что ядра могут иметь от 1 до почти 300 протонов и нейтронов, объясняет их широкую вариацию массы.Самое легкое ядро, ядро водорода, в 1836 раз массивнее электрона, а тяжелые ядра почти в 500 000 раз массивнее.
Основные свойства
Самой важной характеристикой атома является его атомный номер (обычно обозначаемый буквой Z ), который определяется как количество единиц положительного заряда (протонов) в ядре. Например, если у атома Z из 6, это углерод, а Z из 92 соответствует урану.Нейтральный атом имеет равное количество протонов и электронов, так что положительный и отрицательный заряды точно уравновешиваются. Поскольку именно электроны определяют, как один атом взаимодействует с другим, в конечном итоге именно количество протонов в ядре определяет химические свойства атома.
Например, если у атома Z из 6, это углерод, а Z из 92 соответствует урану.Нейтральный атом имеет равное количество протонов и электронов, так что положительный и отрицательный заряды точно уравновешиваются. Поскольку именно электроны определяют, как один атом взаимодействует с другим, в конечном итоге именно количество протонов в ядре определяет химические свойства атома.
AP Chemistry: Atomic Structure — Practice Test Questions & Chapter Exam
Стр. 1
Вопрос 1 1.Как данные из PES поддерживают модель оболочек и подоболочки?
Ответы:вопрос 2 2. Что измеряет энергия связи?
Ответы:Вопрос 3 3. Что из следующего является примером поглощения энергии электроном?
Ответы:Вопрос 4 4.
 Чем должна заканчиваться электронная конфигурация неона (Ne)? Будет ли это стабильный атом или реактивный атом? Ответы:
Чем должна заканчиваться электронная конфигурация неона (Ne)? Будет ли это стабильный атом или реактивный атом? Ответы:Вопрос 5 5. Какое главное квантовое число у последнего электрона, добавленного к калию?
Ответы:Стр. 2
Вопрос 6 6.Какая буква орбитали соответствует l = 2?
Ответы:Вопрос 7 7. Модель атома Бора:
Ответы:Вопрос 8 8. Каковы возможные координаты оси X на графиках, построенных на основе данных PES?
Ответы:Вопрос 9 9.Что представляет собой атомный номер?
Ответы:Вопрос 10 10.
 Какой принцип гласит, что электроны заполняют орбитали с более низкой энергией, прежде чем перейти на орбитали с более высокой энергией? Ответы:
Какой принцип гласит, что электроны заполняют орбитали с более низкой энергией, прежде чем перейти на орбитали с более высокой энергией? Ответы:Стр. 3
Вопрос 11 11.Какое правило гласит, что электроны переходят на пустые орбитали с той же энергией, прежде чем войти на орбиталь с присутствующим электроном?
Ответы:Вопрос 12 12. Как называется константа в уравнении принципа неопределенности Гейзенберга?
Ответы:Вопрос 13 13.Сколько нейтронов имеет самый распространенный изотоп водорода?
Ответы:Вопрос 14 14. Что из следующего верно о парамагнитных атомах?
Ответы:Вопрос 15 15.
 Какое квантовое число указывает положение орбитали? Ответы:
Какое квантовое число указывает положение орбитали? Ответы:Стр. 4
Вопрос 16 16. Почему Демокрит не соглашался с Аристотелем?
Ответы:Вопрос 17 17.Если в атоме №1 19 протонов и 22 нейтрона, а в атоме №2 20 протонов и 22 нейтрона, являются ли эти изотопы одним и тем же элементом?
Ответы:Вопрос 18 18. Когда электрон переходит из возбужденного состояния в основное состояние, он будет _____.
Ответы:Вопрос 19 19.ВСЕ атомы одного и того же элемента имеют:
Ответы:Вопрос 20 20.
 Что говорится в первой части правила Хунда? Ответы:
Что говорится в первой части правила Хунда? Ответы:Стр.5
Вопрос 21 21.X и Y — элементы, которые являются изотопами друг друга. Что из следующего верно относительно X и Y?
Ответы:Вопрос 22 22. При записи электронных конфигураций электроны представлены в их самом низком возможном энергетическом состоянии, называемом их _____.
Ответы:Вопрос 23 23.Если только один тип атома составляет вещество, как вы можете назвать это вещество?
Ответы:Вопрос 24 24. Какой ученый использовал эксперимент с каплей масла для измерения заряда отдельных электронов?
Ответы:Вопрос 25 25.
 Какой элемент имеет массовое число 12 и содержит 6 нейтронов? Ответы:
Какой элемент имеет массовое число 12 и содержит 6 нейтронов? Ответы:Стр.6
Вопрос 26 26. Как лучше всего понять поведение материи на наноскопическом уровне?
Ответы:Вопрос 27 27.
Кусок алюминиевой фольги имеет массу 27 грамм. Примерно сколько атомов в нем?
(Алюминий имеет молекулярную массу 27 г / моль)
Ответы:Вопрос 28 28. Магний имеет три общих изотопа. Какой из них наиболее распространен, исходя из его средней атомной массы?
Ответы:Вопрос 29 29.Сколько пенсов в одной десятой мола пенсов?
Ответы:Вопрос 30 30.
 Какое максимальное количество электронов можно найти в кластере 5p (или орбитали) одного атома? Ответы:
Какое максимальное количество электронов можно найти в кластере 5p (или орбитали) одного атома? Ответы:AP Chemistry: Глава атомной структуры инструкции к экзамену
Выберите ответы на вопросы и нажмите «Далее», чтобы просмотреть следующий набор вопросов.Если хотите, можете пропустить вопросы и прийти назад к ним позже с помощью кнопки «Перейти к первому пропущенному вопросу». Когда вы сдали пробный экзамен, появится зеленая кнопка отправки. появляться. Щелкните его, чтобы увидеть свои результаты. Удачи!
Строение атома | Атом
В результате работы, проделанной предыдущими учеными над атомными моделями, ученые теперь имеют хорошее представление о том, как выглядит атом.Эти знания важны, потому что они помогают нам понять, почему материалы имеют разные свойства и почему одни материалы связываются с другими. Давайте теперь ближе познакомимся с микроскопической структурой атома (как атом выглядит внутри).
До сих пор мы обсуждали, что атомы состоят из положительно заряженного ядра , окруженного одним или несколькими отрицательно заряженными электронами . Эти электроны вращаются вокруг ядра.
Прежде чем мы рассмотрим некоторые полезные концепции, нам сначала нужно понять, что такое электроны, протоны и нейтроны.{- \ text {19}} \) \ (\ text {C} \)).
Ядро (ESABB)
В отличие от электрона, ядро можно разбить на более мелкие строительные блоки, называемые протонами и нейтронами . Вместе протоны и нейтроны называются нуклонами .
Ученые считают, что электрон можно рассматривать как точечную частицу или элементарную частицу , что означает, что он не может быть разбит на что-либо меньшее.
Протон
Электрон несет одну единицу отрицательного электрического заряда (т.е.{- \ text {19}} \)
Таблица 4. 2: Сводка частиц внутри атома.
2: Сводка частиц внутри атома.
Атомный номер и атомное массовое число (ESABC)
Химические свойства элемента определяются зарядом его ядра, т.е. числом протонов . Это число называется атомным номером и обозначается буквой Z .
- Атомный номер (Z)
Число протонов в атоме.
Вы можете найти атомный номер в периодической таблице Менделеева (см. Периодическую таблицу в начале книги). Атомный номер является целым числом от 1 до 118.
Масса атома зависит от того, сколько нуклонов содержит его ядро. Число нуклонов, то есть общее число протонов плюс нейтронов, называется атомным массовым числом и обозначается буквой A .
В настоящее время элемент 118 — это наивысший атомный номер элемента.Элементы с большими атомными номерами (примерно от 93 до 118) не существуют долго, поскольку они распадаются в течение нескольких секунд после образования. Ученые считают, что после элемента 118 может быть «остров стабильности», на котором встречаются элементы с более высоким атомным номером, которые не распадаются за секунды.
Ученые считают, что после элемента 118 может быть «остров стабильности», на котором встречаются элементы с более высоким атомным номером, которые не распадаются за секунды.
Нуклид — это особый вид атома или ядра, характеризующийся количеством протонов и нейтронов в атоме. Чтобы быть абсолютно правильным, когда мы представляем атомы, как здесь, мы должны называть их нуклидами.{56} \ text {Fe} \), где атомный номер \ (Z = 26 \), а массовое число \ (A = 56 \). Количество нейтронов — это просто разница \ (N = A — Z = 30 \).
Не путайте обозначения, которые мы использовали здесь, с тем, как эта информация отображается в периодической таблице. В периодической таблице атомный номер обычно появляется в верхнем левом углу блока или непосредственно над символом элемента. Число под символом элемента — это его относительная атомная масса . Это не совсем то же самое, что атомное массовое число.Это будет объяснено в разделе «Изотопы». Пример железа показан ниже.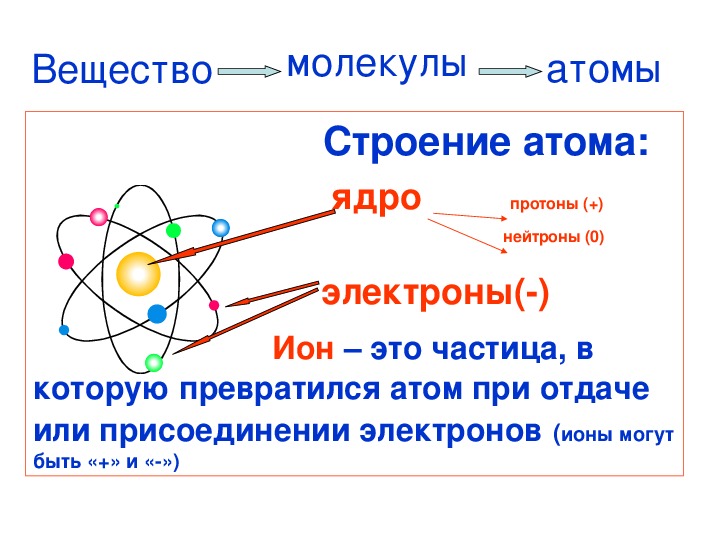

 О.(для ИС)
О.(для ИС)