Контрольная работа по химии на тему «Окислительно-восстановительные реакции» (9 класс)
КОНТРОЛЬНАЯ РАБОТА №1
по теме «Окислительно-восстановительные реакции»
ВАРИАНТ 1.
1. Расставьте степени окисления всех элементов в формулах веществ, участвующих в следующих химических реакциях.Укажите тип реакции. Подберите коэффициенты методом электронного баланса в уравнениях реакций, укажите окислитель и восстановитель.
а) Hg + S = HgS
б) NaNO3 = NaNO2 + O2
в) CuSO4 + NaOH = Na2SO4 + Cu(OH)2.
г) K2MnO4 + H2O = KMnO4 +MnO2 +KOH
д) CaH2+ H2O = Ca(OH)2 + H2
е) As + Cl2 + H2O = H3AsO4 + HCl
ж) FeCl2 + KClO3 + HCl = FeCl3 + KCl + H2O
2. Задача.
Задача.
Сколько грамм сульфата цинка получится, если цинк массой 6 г. положить в раствор серной кислоты массой 5 г?
КОНТРОЛЬНАЯ РАБОТА №1
по теме «Окислительно-восстановительные реакции»
ВАРИАНТ 2.
1.Расставьте степени окисления всех элементов в формулах веществ, участвующих в следующих химических реакциях.Укажите тип реакции. Подберите коэффициенты методом электронного баланса в уравнениях реакций, укажите окислитель и восстановитель.
а) Al(OH)3 = AL2O3 + H2O
б) H2O + P2O5 = H3PO4
в) Fe + HCL = FeCL2 + H2.
г) Cr(NO3)3 = Cr2O3 + NO2 + O2
д) KMnO4 + NaNO2 + H2O = MnO2 + NaNO3 + KOH
е) K2Cr2O7 + HBr = Br2 + CrBr3 + KBr + H2O
ж) Mg + HNO3 = Mg(NO3)2 + N2 + H2O
з) CuO + NH
2. Задача
Задача
Какова масса гидроксида железа (II), полученного при реакции 16 г. гидроксида натрия и 16 г. сульфата железа (II)?
КОНТРОЛЬНАЯ РАБОТА №1
по теме «Окислительно-восстановительные реакции»
ВАРИАНТ 3.
1.Расставьте степени окисления всех элементов в формулах веществ, участвующих в следующих химических реакциях. Укажите тип реакции. Подберите коэффициенты методом электронного баланса в уравнениях реакций, укажите окислитель и восстановитель.
а) CuSO4 + Zn = ZnSO4 + Cu,
б) CaCO3 + CO2 + H2O = Ca(HCO3)2,
в) SO3 + H2O = H2SO4,
г) K2Cr2O7 +H2S + H2SO4 = Cr2(SO4)3 + S + K2SO4 + H2O
д) Br2 + SO2 + H2O = HBr + H2SO4
е) K2S + KMnO4 + H2O MnO2 + S + KOH
ж) KMnO4 + H2S + H2SO4 = MnSO4
з) CH4 + Cl2 = CCl4 + HCl
2. Задача
Задача
Определите массу гидроксида алюминия полученного при взаимодействии 21,3 г. нитрата алюминия и 50 г. 40 %-ного раствора гидроксида натрия?
КОНТРОЛЬНАЯ РАБОТА №1
по теме «Окислительно-восстановительные реакции»
ВАРИАНТ 4.
1. Расставьте степени окисления всех элементов в формулах веществ, участвующих в следующих химических реакциях.Укажите тип реакции. Подберите коэффициенты методом электронного баланса в уравнениях реакций, укажите окислитель и восстановитель.
а) FeCl3 + NaOH = Fe(OH)3 + NaCl,
б) NaHCO3 + NaOH = Na2CO3 + H2O.
в) MgCO3 + HCl MgCl2 + CO2 + H2O,
г) NaBrO3 +NaBr + H2SO4 = Br2 + Na2SO4 + H2O
д) Na2SO3 = Na2S + Na2SO4
е) Cr2O3 + Na2CO3 + O2 = Na2CrO4 + CO2
ж) CuI +H
з) P + N2O = N2 + P2O5
2. Задача
Задача
При взаимодействии 168 г. гидроксида калия и раствора сульфата меди (II) массой 200 г., в котором 0,08 массовых долей соли, выпадает осадок. Определите массу осадка гидроксида меди (II)?
КОНТРОЛЬНАЯ РАБОТА №1
по теме «Окислительно-восстановительные реакции»
ВАРИАНТ 5.
1. Расставьте степени окисления всех элементов в формулах веществ, участвующих в следующих химических реакциях.Укажите тип реакции. Подберите коэффициенты методом электронного баланса в уравнениях реакций, укажите окислитель и восстановитель.
а) H2 + S = H2S
б) HNO3 + Zn= Zn (NO3)2 + H2
в) FeSO3 + HCl =FeCl2 + H2O + SO2
г) As + Cl2 + H2O = H3AsO4 + HCl
д) NaBr + NaBrO3 + H2SO4 = Na2SO4 + Br2 + H2O
е) PH3 + Cl2 = PCl3 + HCl
ж) KMnO4 + H3PO3 + H2SO4 = MnSO4 + H3PO4 + K2SO4 + H2O
з)HClO + H2O2 = HCl + O2 + H2O
2. Задача
Задача
14 г. оксида кальция обработали раствором, содержащим 35 г. азотной кислоты. Определите массу образовавшейся соли.
КОНТРОЛЬНАЯ РАБОТА №1
по теме «Окислительно-восстановительные реакции»
ВАРИАНТ 6.
1.Расставьте степени окисления всех элементов в формулах веществ, участвующих в следующих химических реакциях. Укажите тип реакции. Подберите коэффициенты методом электронного баланса в уравнениях реакций, укажите окислитель и восстановитель.
а) CO2 + Na2O = Na2CO3,
б) CuOHCl + HCl = CuCl2 + H2O,
в) Pb(NO3)2 + Na2SO4 = PbSO4 + 2NaNO3.
г) KClO3
д) KMnO4 + SO2 MnSO4 + K2SO4 + SO3.
е) PbS + H2O2 = PbSO4 + H2O
ж) KMnO4 + FeSO4 + H2SO4 MnSO4 + Fe2(SO4)3 + K2SO4 + H2O.
з) KCrO2 + Br2 + KOH K2CrO4 + KBr + H2O.
2. Задача
К раствору, содержащему 14,2 г. сульфата натрия добавили раствор, содержащий 30 г. хлорида бария. Сколько образовалось сульфата бария?
КОНТРОЛЬНАЯ РАБОТА №1
по теме «Окислительно-восстановительные реакции»
ВАРИАНТ 7.
1.Расставьте степени окисления всех элементов в формулах веществ, участвующих в следующих химических реакциях. Укажите тип реакции. Подберите коэффициенты методом электронного баланса в уравнениях реакций, укажите окислитель и восстановитель.
а) NH3 + O2 = NO + H2O
б) NH4NO3 = N2O + H2O
в) CuSO4 + NaOH →Cu(OH)2 + Na2SO4,
г) SO
д) KMnO4 + H2S + H2SO4 = MnSO4 + K2SO4 + S + H2O
е) K2Cr2O7 + SO2 + H2SO4 = Cr2(SO4)3 + K2SO4 + H2O
ж) HI + H2SO4 → I2 + H2S + H2O,
з) MnO2 + PbO2 + HNO3 HMnO4 + Pb(NO3)2 + H2O.
2. Задача
К 30 г. раствора, содержащего 10 % хлорида железа (III) добавили 30 г. раствора, который содержит 12 % гидроксида натрия. Вычислите массу образовавшегося осадка.
КОНТРОЛЬНАЯ РАБОТА №1
по теме «Окислительно-восстановительные реакции»
ВАРИАНТ 8.
1.Расставьте степени окисления всех элементов в формулах веществ, участвующих в следующих химических реакциях. Укажите тип реакции. Подберите коэффициенты методом электронного баланса в уравнениях реакций, укажите окислитель и восстановитель.
а) FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl,
б) H2S + H2SO3 = S + 3H2O,
в) KClO3 = KCl + KClO4,
г) I2 + H2O2 = HIO3 + H2O
д) K2MnO4 + H2O = MnO2 + KMnO4 + KOH
е) NaBr + H2SO4 + NaBrO3 = Br2 + Na2SO4 + H2O
ж) (NH4)2Cr2O7 = Cr2O3 + N2↑ + H2O
з) KI + H2O2 = I2 + KOH
2. Задача
Задача
Сколько соли может образоваться, если в качестве исходных веществ взять 20 г. 2 %-го раствора гидроксида натрия и раствор, в котором содержится 100 г. серной кислоты?
КОНТРОЛЬНАЯ РАБОТА №1
по теме «Окислительно-восстановительные реакции»
ВАРИАНТ 9.
1.Расставьте степени окисления всех элементов в формулах веществ, участвующих в следующих химических реакциях. Укажите тип реакции. Подберите коэффициенты методом электронного баланса в уравнениях реакций, укажите окислитель и восстановитель.
а) Fe2O3 + KNO3 + KOH = K2FeO4 + KNO2 +H2O
б) Cr2O3 + NaNO3 + NaOH = Na2CrO4 + NaNO2 + H2O
в )H2S + H2SO3 = S + H2O
г) CuOHCl + HCl = CuCl2 + H2O,
д) Pb(NO3)2 + Na2SO4 = PbSO4 + 2NaNO3.
е) Al + H2O = Al(OH)3 + H2
ж) F2 + H2O = HF + O2.
з) KMnO4 + HCl = Cl2↑ + MnCl2 + KCl + H2O
2. Задача
В раствор, содержащий 60 г. сульфата меди (II), поместили 20 г. железных опилок. Какие вещества образовались в результате реакции и какова их масса?
КОНТРОЛЬНАЯ РАБОТА №1
по теме «Окислительно-восстановительные реакции»
ВАРИАНТ 10.
1. Расставьте степени окисления всех элементов в формулах веществ, участвующих в следующих химических реакциях.Укажите тип реакции. Подберите коэффициенты методом электронного баланса в уравнениях реакций, укажите окислитель и восстановитель.
а) KMnO4 + SO2 MnSO4 + K2SO4 + SO3.
б) K2S + KMnO4 + H2O MnO2 + S + KOH.
в) KMnO4 + NaI + H2SO4 I2 + K2SO4 + MnSO4 + Na2SO4 + H2O.
г) MnO2 + HCl = MnCl2 + Cl2 + 2H2О,
д) Al 2O3 + HNO3 = Al (NO3)3 + H2O,
е) Zn + 2HCl = ZnCl2 + H2,
ж) AgNO3 + HCl = AgCl + HNO3.
з) Cr2O3 + NaNO3 + NaOH = Na2CrO4 + NaNO2 + H2O
2. Задача
К раствору, содержащему 21,3 г. нитрата алюминия, прилили раствор, содержащий 17,49 г. карбоната натрия. Вычислите массу образовавшегося осадка.
Контрольная работа по теме «Окислительно-восстановительные реакции. Периодический закон. Водород»
Муниципальное общеобразовательное бюджетное учреждение
«Гимназия № 5» г. Оренбурга
Оренбурга
Контрольная работа
по теме
«ОВР. Периодический закон.
Водород»
9 класс
подготовила учитель химии
Сидоренко Светлана Викторовна
с. Оренбург
2017 г.
9 класс Контрольная работа № 2 по теме «ОВР. ПЗ. Водород».
Вариант 1
№ 1
Вычислите степени окисления брома в веществах и определите, чем он будет являться в ОВР:
Br2O7, Br2, HBr, HBrO4, Br2O5.
№ 2
Водород реагирует с каждым из пары веществ, формулы которых:
а)Cl2 и MgO
б)H2O и PbO
в)H3PO4 и Fe
г)PbO и F2.
Напишите уравнения возможных реакций, составьте схемы электронного баланса, укажите окислитель и восстановитель, процессы окисления и восстановления, расставьте коэффициенты.
№ 3
Запишите уравнения возможных реакций. Определите их тип по признаку «число и состав исходных веществ и продуктов реакции».
а) Са + Н2О →
б) Сu + Н2О →
в) Li2O + Н2О →
г) FeO + Н2О →
д)N2O5+ Н2О →
е) SiО2+ Н2О →
№ 4
Вычислите массу гидроксида калия, полученного при взаимодействии 7,8 г калия с водой.
№ 5
Рассчитайте объём водорода, образующийся при взаимодействии 32, 5 г цинка с соляной кислотой.
__________________________________________________
9 класс Контрольная работа № 2 по теме «ОВР. ПЗ. Водород».
Вариант 2
№ 1
Вычислите степени окисления фосфора в веществах и определите, чем он будет являться в ОВР: P2O3,H3P,H3PO4,P,P2O5.
№ 2
Водород реагирует с каждым из пары веществ, формулы которых:
а)Cl2 и CaO
б)H2SO4 и Zn
в)CuO и O2
г)H2O и CuO.
Напишите уравнения возможных реакций, составьте схемы электронного баланса, укажите окислитель и восстановитель, процессы окисления и восстановления, расставьте коэффициенты.
№ 3
Запишите уравнения возможных реакций. Определите их тип по признаку «число и состав исходных веществ и продуктов реакции».
а) Bа + Н2О →
б) Ag + Н2О →
в) K2O + Н2О →
г) SnO + Н2О →
д)N2O3+ Н2О →
е) SiО+ Н2О →
№ 4
Вычислите массу гидроксида натрия, полученного при взаимодействии 4,6 г натрия с водой.
№ 5
Рассчитайте объём водорода, образующийся при взаимодействии 12 г магния с соляной кислотой.
Список использованной литературы
Габриелян О.С., Яшукова А.В. Химия. 9 класс. Учебник — М.: Дрофа, 2013.
Габриелян О.С., Яшукова А.В. Химия. 9 класс. Рабочая тетрадь к учебнику О.С.Габриеляна «Химия. 9» — М.: Дрофа, 2013.
9» — М.: Дрофа, 2013.
Габриелян О.С., Яшукова А.В. Химия. 8 — 9 классы. Методическое пособие — М.: Дрофа, 2004.
Габриелян О.С. Химия. 9 класс. Контрольные и проверочные работы к учебнику О.С.Габриеляна «Химия. 9.» — М.: Дрофа, 2005.
Адрес публикации: https://www.prodlenka.org/metodicheskie-razrabotki/275782-kontrolnaja-rabota-po-teme-okislitelno-vossta
Контроль знаний по теме Окислительно-восстановительные реакции 9 класс | Тест по химии (9 класс) на тему:
Тест по теме: «ОВР»
Вариант 1.
1. Какая из реакций, схемы которых приведены ниже, является окислительно-восстановительной:
1) 2Na + 2h3O = 2 NaOH + h3;
2) Na2O + 2HCl = 2 NaCl + h3O;
3) ZnSO4 + Na2CO3 = ZnCO3 + Na2SO4;
4) CaO + 2HNO3 = Ca(NO3)2 + h3O.
2.Уравнение реакции Изменение степени окисления окислителя
A) 2Nh4 + 2Na = 2NaNh3 + Н2 1) -1 → 0
Б) h3S + 2Na = Na2S + h3 2) 0 → — 1
B) 4Nh4 + 6NO = 5N2 + 6Н20 3) +2→ 0
Г) 2h3S + 302 = 2S02 + 2Н20 4) + 1 → 0
5) +4 → +2
6) 0→ -2
3. Установите соответствие между уравнением реакции и вещества, являющегося восстановителем в данной реакции
Установите соответствие между уравнением реакции и вещества, являющегося восстановителем в данной реакции
Уравнение реакции Восстановитель
A) NO + N02 + h30 = 2HN02 1) N02
Б) SO2 + 2h3S = 3S + 2h30 2) h3S
B) Br2 + S02 + 2h30 = 2HBr + h3SO4 3) Br2
Г) 2КI + Вr2 = 2КВг + I2 4) S02
5) NO
6) KI
4.Расставьте коэффициенты методом электронного баланса:
S02 + Н20 + NаIO3 → Н2S04 + NаI
Коэффициент перед формулой восстановителя равен:
1) 3;
2) 4;
3) 2;
4) 5
5.Вещество проявляет окислительно — восстановительные свойства, если атом, входящий в его состав, может:
1) только отдавать электроны;
2) только присоединять электроны;
3) проявлять промежуточную степень окисления;
4) иметь только постоянную степень окисления.
6.В реакции 2NO2 + h3O = HNO2 + HNO3
изменение степени окисления восстановителя соответствует схеме
1)-2 → 0 2)+4 → +5 3)+2 → +3 4)+4 → +3
7.В реакции, схема которой h3S + HClO → S + HCl + h3O,
восстановителем является 1)H+1 2)O-2 3)S-2 4)Cl+1
8.Элемент углерод является восстановителем в реакции
1)CO2 + CaO = CaCO3 2)2CO + O2 = 2CO2
3)2C + Ca = CaC2 4)CO2 + Na2O = Na2CO3
Тест по теме: «ОВР»
Вариант 2.
1. Какая из реакций, схемы которых приведены ниже, является окислительно-восстановительной:
1) ZnCl2 + h3S = ZnS + 2HCl
2) СаО + СО2 = СаСО3
3) 4HCl + MnO2 = Cl2 + MnCl2 + 2h3O
4) К2O + 2HCl = 2 КCl + h3O
2.Уравнение реакции Изменение степени окисления окислителя
A) 2Nh4 + 2Na = 2NaNh3 + Н2 1) -1 → 0
Б) h3S + 2Na = Na2S + h3 2) 0 → — 1
B) 4Nh4 + 6NO = 5N2 + 6Н20 3) +2→ 0
Г) 2h3S + 302 = 2S02 + 2Н20 4) + 1 → 0
5) +4 → +2
6) 0→ -2
3. Установите соответствие между уравнением реакции и вещества, являющегося восстановителем в данной реакции
Установите соответствие между уравнением реакции и вещества, являющегося восстановителем в данной реакции
Уравнение реакции Восстановитель
A) NO + N02 + h30 = 2HN02 1) N02
Б) SO2 + 2h3S = 3S + 2h30 2) h3S
B) Br2 + S02 + 2h30 = 2HBr + h3SO4 3) Br2
Г) 2КI + Вr2 = 2КВг + I2 4) S02
5) NO
6) KI
4. Расставьте коэффициенты методом электронного баланса:
S + НNО3 → Н2SО4 + NO2 + h3O
Коэффициент перед формулой восстановителя равен:
1) 6; 2) 3; 3) 1; 4) 5.
5. Вещество проявляет только восстановительные свойства, если атом, входящий в его состав, может:
1) только отдавать электроны
2) только присоединять электроны
3) проявлять промежуточную степень окисления
4) иметь только постоянную степень окисления.
6.В реакции Cl2 + 2NaOH = NaClO + NaCl + h3O
изменение степени окисления окислителя соответствует схеме
1) 0 → -1 2)-2 → -1 3) 0 → +1 4)+1 → -1
7.В реакции, схема которой KNO3 + Nh5Cl → KCl + N2O + h3O,
окислителем является 1)К+1 2)N+5 3)H+1 4)N-3
8.Элемент азот является окислителем в реакции
1)2NO + C = N2 + CO2 2)2Nh4 + 3h3O2 = N2 + 6h3O
3)2Nh4 + h3S = (Nh5)2S 4)2HNO3 + СaO = Сa(NO3)2 + h3O
Контрольная работа ««Электролитическая диссоциация», «Окислительно-восстановительные реакции»» 9 класс
Контрольная работа №1 в 9 классе по темам «Электролитическая
диссоциация», «Окислительно-восстановительные реакции»
2 вариант
Часть А
А1. Лампочка прибора для проверки электропроводности не будет загораться в
растворе 1 – серной кислоты 2 – глюкозы 3 – гидроксида калия
4 – поваренной соли
А2. Если степень диссоциации α равна 0%, то в растворе вещество существует
Если степень диссоциации α равна 0%, то в растворе вещество существует
1 – только в виде молекул 2 – в виде ионов 3 – в виде ионов и молекул
4 – в основном в виде молекул
А3. К сильным электролитам относится каждое из двух веществ:
1 – NaOH и MgSiO
3
2 – Al(OH)
3
и H
2
SO
4
3 –
Ba(OH)
2
и AlCl
3
4 – Cu(OH)
2
и CaCO
3
А4. Вещество, при диссоциации которого образуются катионы металла и
гидроксид-анионы, это
1 – соль 2 – кислота 3 – вода 4 – основание
А5. Одинаковое число молей катионов и анионов образуется в растворе при
полной диссоциации 1 моль
1 – Al
2
(SO4)
3
2 – CaBr
2
3 – CuSO
4
4 – Na
2
SO
4
А6. К выпадению осадка приводит взаимодействие пары ионов
1 – H
+
и CO
3
2-
2 – Fe
3+
и OH
—
3 – Fe
2+
и Cl
—
4 – H
+
и OH
—
А7. Сокращенному ионно-молекулярному уравнению Cu
Сокращенному ионно-молекулярному уравнению Cu
2+
+ S
2-
= CuS
соответствует уравнение реакции, левая часть которой
1 – CuO + H
2
S → 2 – Cu(OH)
2
+ H
2
SO
4
→ 3 – Cu + S →
4 – CuSO
4
+ Na
2
S →
А8. Оцените правильность двух суждений об окислительно-восстановительных
реакциях:
А. Все реакции замещения являются окислительно-восстановительными.
Б. Атом или ион, отдающий электроны, является окислителем.
1 – верно только А 2 – верно только Б
3 – оба суждения верны 4 – оба суждения неверны
А9. Схема превращений C
0
→ C
+4
соответствует химическому уравнению:
1 – CO
2
+ СаО = CаСО
3
2 – 2C + O
2
= 2CO
3 – C + 2CuO = 2Cu + CO
2
4 – CO
2
+ Н
2
О = Н
2
СО
3
А10. Cера является восстановителем в реакции
Cера является восстановителем в реакции
1 – S + H
2
= H
2
S 2 – S + O
2
= SO
2
3 – Fe + S = FeS 4 – 2S + C = CS
2
Часть В
В1. Вставьте в текст нужные слова из приведенного списка:
Контрольная работа 9 класс по теме :»Электролитическая диссоциация. Гидролиз».
Просмотр содержимого документа
«Контрольная работа 9 класс по теме :»Электролитическая диссоциация. Гидролиз».»
Контрольная работа по теме: «ОВР, Электролитическая диссоциация. Гидролиз»
Вариант № 1
Задание № 1
С какими из перечисленных веществ взаимодействует раствор серной кислоты: медь, раствор гидроксида бария, магний, оксид железа (II), раствор сульфата натрия, раствор нитрата бария? Запишите возможные уравнения реакций в молекулярном, полном ионном и сокращенном ионном виде.
Задание № 2
Закончите возможные уравнения реакций, запишите в ионном виде:
FeO + HNO3
Ca(OH)2+HCl
NaCl+KNO3
Al(OH)3+HNO3
CO2+KOH
Задание № 3
Уравнять окислительно-восстановительные реакции методом электронного баланса, укажите окислитель и восстановитель
NaClO+PNaCl+P2O5
Cu+H2SO4CuSO4+SO2+H2O
Mg+HClMgCl2+H2
Задание № 4
Определите реакцию среды, запишите уравнение гидролиза солей: FeCl2 , Li2CO3, KF, AlCl3
Задание № 5
По сокращенному ионному уравнению запишите полное ионное и молекулярное:
Ba+2+SO4-2BaSO4
CO3-2+2H+H2O+CO2
H++OH—H2O
Контрольная работа по теме: «ОВР, Электролитическая диссоциация. Гидролиз»
Гидролиз»
Вариант № 2
Задание № 1
С какими из перечисленных веществ взаимодействует раствор хлорида меди (II): медь, соляной кислоты, гидроксид натрия, раствор нитрата серебра, железо, оксид магния. вода? Запишите возможные уравнения реакций в молекулярном, полном ионном и сокращенном ионном виде.
Задание № 2
Закончите возможные уравнения реакций, запишите в ионном виде:
Cu + HCl
Fe(OH)2+H2SO4
ZnCl2+NaOH
HCl+Na2CO3
Zn+H2SO4
Задание № 3
Уравнять окислительно-восстановительные реакции методом электронного баланса, укажите окислитель и восстановитель
H2S+O2H2O+SO2
Cu+HNO3Cu(NO3)+NO2+H2O
Cl2+NaBrNaCl+Br2
Задание № 4
Определите реакцию среды, запишите уравнение гидролиза солей: Cu(NO3)2, Na2S, KNO3, NiCl2
Задание № 5
По сокращенному ионному уравнению запишите полное ионное и молекулярное:
CuO+2H+Cu+2+H2O
Ag++Cl—AgCl
Al+3+3OH—Al(OH)3
Химия 9 класс – СУНЦ МГУ
Курс состоит из следующих блоков:
1. Периодическая таблица. Металлы и неметаллы.
Периодическая таблица. Металлы и неметаллы.
1) Периодическая таблица. 2) Металлы и неметаллы. 3) Инертные газы. Химическая связь. Валентность. Структурная формула. 4) Вещество и элемент. Аллотропия. 5) Атомное и молекулярное строение. Атомные, металлические и молекулярные кристаллы. Диполь-дипольное и дисперсионное взаимодействие. 6) Химические свойства металлов. Электрохимический ряд напряжений. 7) Химические свойства неметаллов.
2. Газы. Ковалентная неполярная связь.
1) Воздух. 2) Кислород. Горение и дыхание. Озон. 3) Азот. Изоэлектронность. Угарный газ. 4) Углекислый газ. 5) Водород. Окисление и восстановление. 6) Ковалентная неполярная связь. Электроотрицательность. Моль. 7) Галогены. Диспропорционирование. 8) Газовые законы.
3. Бинарные соединения. Ковалентная полярная связь.
1) Оксиды. 2) Ковалентная полярная связь. 3) Степень окисления. 4) Оксиды неметаллов. 5) Кислотно-основные свойства оксидов неметаллов. Видео: взаимодействие SO2 с водой. 6) Окислительно-восстановительные свойства оксидов неметаллов. 7) Водородные соединения неметаллов. 8) Физические свойства водородных соединений неметаллов. 9) Водородная связь. 10) Химические свойства водородных соединений неметаллов.
6) Окислительно-восстановительные свойства оксидов неметаллов. 7) Водородные соединения неметаллов. 8) Физические свойства водородных соединений неметаллов. 9) Водородная связь. 10) Химические свойства водородных соединений неметаллов.
4. Бинарные соединения. Ионная связь. Расчеты по уравнениям.
1) Ионная связь. Ионные кристаллы. 2) Гидриды металлов. 3) Оксиды металлов. 4) Окислительно-восстановительные свойства оксидов металлов. 5) Кислотно-основные свойства оксидов металлов. 6) Другие бинарные соединения. 7) Закон сохранения массы в химических процессах. Расчеты по уравнениям реакций. Избыток/недостаток реагентов. Выход продукта. 8) Закон сохранения энергии в химических процессах. Экзотермические и эндотермические реакции. Термохимическое уравнение.
5. Гидроксиды. Кислотно-основное взаимодействие. Определение формулы вещества.
1) Гидроксиды. 2) Кислоты. 3) Сила кислот. 4) Химические свойства кислот. 5) Получение кислот. 6) Основания. 7) Сила оснований. 8) Химические свойства оснований. 9) Получение оснований. 10) Амфотерные гидроксиды. 11) Определение формулы вещества по массовым долям элементов.
9) Получение оснований. 10) Амфотерные гидроксиды. 11) Определение формулы вещества по массовым долям элементов.
6. Растворы. Соли.
1) Вещества, смеси, растворы. Растворитель. Как происходит образование раствора. Кристаллогидраты. 2) Концентрации растворов. Концентрированные и разбавленные растворы. 3) Растворимость. Насыщенные и ненасыщенные растворы. 4) Электролитическая диссоциация. 5) Реакции в растворах. Полные и сокращенные ионные уравнения. Реакции ионного обмена. 6) Соли. 7) Химические свойства солей. 8) Способы получения солей. 9) Смеси двух компонентов (расчетные задачи).
7. Степень окисления. Окислительно-восстановительные реакции. Марганец, хром. Электролиз
1) Степень окисления. 2) Окислительно-восстановительные реакции. 3) Окисление и восстановление. 4) Типичные окислители. 5) Типичные восстановители. 6) Электронный баланс. 7) Гальванический элемент. 8) Электролиз.
Контрольная работа №1 по теме «Электролитическая диссоциация. Окислительно-восстановительные реакции»
Контрольная работа №1
ФИ _____________________________________
1. Выберите правильный ответ
Выберите правильный ответ
а) Кислота 1) НСl 2) NaOH 3) Ch5 4) HNO3
б) Соль 1) ВaCl2 2) NaCl 3) BaO 4) ZnSO4
2. Дать определение понятию «электролит»_____________________________
__________________________________________________________________
__________________________________________________________________
3. Привести по 2 примера электролита___________________________________
неэлектролита_______________________________________________________
4. В водном растворе кислоты диссоциируют на __________________________
__________________________________________________________________
привести пример_____________________________________________________
5. Написать уравнение реакции в молекулярном, ионном и сокращенном ионном уравнении, расставить коэффициенты
NaCl+Pb(NO3)2=___________________________________________________
__________________________________________________________________
____________________________________________________________________
____________________________________________________________________
6. Написать уравнение реакции в молекулярном, ионном и сокращенном ионном уравнении, расставить коэффициенты
Написать уравнение реакции в молекулярном, ионном и сокращенном ионном уравнении, расставить коэффициенты
К2СO3+HNO3=____________________________________________________
______________________________________________________________________
______________________________________________________________________
7. Написать уравнение реакции в молекулярном, ионном и сокращенном ионном уравнении, расставить коэффициенты
хлорид натрия + нитрат серебра (Ι)_____________________________________
___________________________________________________________________
_____________________________________________________________________
_____________________________________________________________________
8. Расставить коэффициенты методом электронного баланса, определить окислитель
а) __С+__h3SO4= __CO2+__SO2+__h3
______________________________________________________________________
_____________________________________________________________________
б) __HNO3=__NO2+__O2__+________
_______________________________________________________________________
_______________________________________________________________________
в) __K2SO3+__h3SO4+__KMnO4=__K2SO4+__MnSO4+__h3O
_________________________________________________________________________
_________________________________________________________________________
STAAR / Средняя школа
STAAR 2021 EOC (окончание курса) оценки для 9–12 классов
Тесты STAAR EOC (End-of-Course) проверяют уровень владения учащимися средней школы базовыми знаниями и навыками Техаса (TEKS) для данного курса и определяют их готовность к колледжу и карьере. Если учащийся 8-го класса или ниже изучает курс, для которого предусмотрен тест STAAR EOC, этот учащийся должен будет пройти этот конкретный тест STAAR EOC. Эти оценки EOC предназначены для всех студентов, окончивших школу после 2014 года.Для получения дополнительной информации о требованиях к выпускным, см. Страницу Требования к выпускным экзаменам штата .
Если учащийся 8-го класса или ниже изучает курс, для которого предусмотрен тест STAAR EOC, этот учащийся должен будет пройти этот конкретный тест STAAR EOC. Эти оценки EOC предназначены для всех студентов, окончивших школу после 2014 года.Для получения дополнительной информации о требованиях к выпускным, см. Страницу Требования к выпускным экзаменам штата .
Обязательные экзамены по STAAR EOC (в конце курса) в средней школе:
- Алгебра I
- Биология
- Английский язык I (комбинированное чтение / письмо)
- Английский II (комбинированное чтение / письмо)
- История США
2021 График тестирования 9–12 классов
| Математика | Английский | Наука | Общественные науки |
| Алгебра I | Английский I | Биология | U. С. История С. История |
| Английский II | |||
| Тест по английскому языку I 2021 года будет сдан 6 апреля 2021 года. Тест по английскому языку 2021 года будет сдан 8 апреля 2021 года. Тест по алгебре 2021 года будет проводиться в период с 4 по 7 мая. 2021. Тест по биологии 2021 года будет проводиться в период с 4 по 7 мая 2021 года. Тест по истории США в 2021 году будет проводиться в период с 4 по 7 мая 2021 года. | |||
Существует четырехчасовой лимит на все тесты, кроме английского I и английского II, которые имеют пятичасовой лимит.
Дополнительные изменения, касающиеся недавнего законодательства (HB 5)
- Успеваемость ученика в STAAR EOC не может использоваться для определения рейтинга ученика в классе.
- Заключительная оценка по курсу не будет выставлена, если не будут выполнены требования к посещаемости (см.
 Руководство HISD School Guidelines).
Руководство HISD School Guidelines). - Экзамены I и II STAAR EOC по английскому языку будут комбинированными экзаменами по чтению и письму и проводиться в один день.
Дополнительная информация об оценках STAAR
Алгебра I
Вопросы теста STAAR Algebra I включают основные процессы и математические инструменты, описанные в этом курсе. К ним относятся числовые и алгебраические выражения, описание, построение графиков, запись и решение линейных функций, уравнений и неравенств.Дополнительные вопросы включают квадратные и экспоненциальные функции и уравнения.
Биология
STAAR EOC сосредоточит внимание на вопросах, касающихся структуры и функций клеток, механизмов генетики, биологической эволюции и классификации, биологических процессов и систем, а также взаимозависимости внутри экологических систем.
Английский язык I и II
STAAR EOC включает чтение и запись. Письменные оценки требуют, чтобы студенты написали одно пояснительное эссе. Студентам также предлагаются вопросы с несколькими вариантами ответов, которые сосредоточены на проверке и редактировании. Редактирование документа потребует от студентов более глубоких знаний
Студентам также предлагаются вопросы с несколькими вариантами ответов, которые сосредоточены на проверке и редактировании. Редактирование документа потребует от студентов более глубоких знаний
структуры, шаблонов и использования предложений. Содержание для чтения включает понимание разных жанров, а также понимание и анализ художественных и информационных текстов.
Примеры вопросов STAAR EOC (.pdf)
% PDF-1.7
%
278 0 объект
>
эндобдж
xref
278 74
0000000016 00000 н.
0000002403 00000 н.
0000002618 00000 н.
0000002662 00000 н.
0000005652 00000 н.
0000005766 00000 н.
0000005803 00000 н.
0000013351 00000 п.
0000020159 00000 н.
0000020789 00000 п.
0000021172 00000 п.
0000021735 00000 п.
0000022190 00000 п.
0000022602 00000 п.
0000023116 00000 п.
0000023548 00000 п.
0000023637 00000 п.
0000024185 00000 п.
0000024327 00000 п.
0000024439 00000 п.
0000032249 00000 н.
0000032381 00000 п.
0000032514 00000 п.
0000032907 00000 н. 0000033208 00000 п.
0000033235 00000 п.
0000039488 00000 п.
0000043767 00000 п.
0000047779 00000 п.
0000047960 00000 п.
0000053505 00000 п.
0000060421 00000 п.
0000060584 00000 п.
0000064524 00000 п.
0000064787 00000 п.
0000075418 00000 п.
0000075502 00000 п.
0000080956 00000 п.
0000083605 00000 п.
0000083675 00000 п.
0000083745 00000 п.
0000083829 00000 п.
0000087251 00000 п.
0000087524 00000 п.
0000087696 00000 п.
0000087723 00000 п.
0000088029 00000 п.
0000088099 00000 п.
0000088183 00000 п.
0000091949 00000 п.
0000092211 00000 п.
0000092375 00000 п.
0000092402 00000 п.
0000092702 00000 п.
0000094361 00000 п.
0000094682 00000 п.
0000095053 00000 п.
0000096801 00000 п.
0000097136 00000 п.
0000097513 00000 п.
0000097768 00000 п.
0000098020 00000 п.
0000106980 00000 п.
0000107230 00000 н.
0000107603 00000 н.
0000115853 00000 н.
0000115892 00000 н.
0000152757 00000 н.
0000152796 00000 н.
0000160401 00000 п.
0000160440 00000 н.
0000164546 00000 н.
0000033208 00000 п.
0000033235 00000 п.
0000039488 00000 п.
0000043767 00000 п.
0000047779 00000 п.
0000047960 00000 п.
0000053505 00000 п.
0000060421 00000 п.
0000060584 00000 п.
0000064524 00000 п.
0000064787 00000 п.
0000075418 00000 п.
0000075502 00000 п.
0000080956 00000 п.
0000083605 00000 п.
0000083675 00000 п.
0000083745 00000 п.
0000083829 00000 п.
0000087251 00000 п.
0000087524 00000 п.
0000087696 00000 п.
0000087723 00000 п.
0000088029 00000 п.
0000088099 00000 п.
0000088183 00000 п.
0000091949 00000 п.
0000092211 00000 п.
0000092375 00000 п.
0000092402 00000 п.
0000092702 00000 п.
0000094361 00000 п.
0000094682 00000 п.
0000095053 00000 п.
0000096801 00000 п.
0000097136 00000 п.
0000097513 00000 п.
0000097768 00000 п.
0000098020 00000 п.
0000106980 00000 п.
0000107230 00000 н.
0000107603 00000 н.
0000115853 00000 н.
0000115892 00000 н.
0000152757 00000 н.
0000152796 00000 н.
0000160401 00000 п.
0000160440 00000 н.
0000164546 00000 н. 0000002222 00000 н.
0000001776 00000 н.
трейлер
] / Назад 185387 / XRefStm 2222 >>
startxref
0
%% EOF
351 0 объект
> поток
hb«`a`X Ā
0000002222 00000 н.
0000001776 00000 н.
трейлер
] / Назад 185387 / XRefStm 2222 >>
startxref
0
%% EOF
351 0 объект
> поток
hb«`a`X Ā
Мнение: Почему тайваньские родители предпочитают частную школу государственной | Синтия Лин — 9 класс,
Родители любят своих детей, поэтому они всегда хотят дать своим детям самое большое преимущество, особенно когда дело касается школы.На Тайване многие родители предпочитают частную школу государственной, потому что частные школы, как правило, лучше подходят для будущих перспектив их детей.
Учащиеся частных школ получили более высокие баллы по GSAT
На Тайване все учащиеся, желающие поступить в колледж, должны пройти общий тест на школьные способности, независимо от того, в какую среднюю школу учится учащийся. GSAT похож на SAT в Америке; большинство колледжей будут использовать результат теста как важный показатель способностей.
В этом году 11 учениц средней школы Тайбэя Вего получили отличные оценки, в то время как только восемь учеников Первой средней школы для девочек в Тайбэе, лучшей государственной средней школы для женщин на Тайване, получили отличные оценки. Это показывает, что ученики частных школ часто успевают лучше. С хорошими оценками студенты попадают в лучшие колледжи. Таким образом, студенты частных школ с большей вероятностью поступят в лучшие университеты, чем студенты государственных школ.
Это показывает, что ученики частных школ часто успевают лучше. С хорошими оценками студенты попадают в лучшие колледжи. Таким образом, студенты частных школ с большей вероятностью поступят в лучшие университеты, чем студенты государственных школ.
Учащиеся частной школы могут сразу пойти в среднюю школу
Поскольку частные школы хотят удерживать талантливых учеников, у них есть системы, в которых ученики с хорошими оценками автоматически поступают в среднюю школу без сдачи каких-либо оценочных экзаменов.
В этом отличие от государственных школ на Тайване, где учащиеся обязаны сдавать вступительные испытания.Этот тест называется программой комплексной оценки, и все учащиеся 9-х классов, желающие посещать государственные средние школы, должны пройти его, чтобы выяснить, в какие школы они имеют право.
Программа комплексной оценки, однако, является кошмаром для учеников девятого класса. Дети на этом уровне должны учиться, зубрить и готовиться, потому что тест охватывает все знания, которые учащиеся получают в средней школе. Чтобы избежать стресса, который испытывают учащиеся, родители предпочитают отправлять своих детей в частные школы.
Чтобы избежать стресса, который испытывают учащиеся, родители предпочитают отправлять своих детей в частные школы.
В традиционных частных школах разрыв в способностях между учениками меньше
Перед тем, как поступить в традиционную частную среднюю школу, учащиеся должны пройти вступительный тест, который проводится школой, а не государством. Эти вступительные тесты часто проверяют основные предметы, такие как китайский, математика и английский.
Тестируя эти предметы, школы могут оценить способности ученика. Если у ученика слишком низкий балл, этот человек не сможет поступить в школу. Этот процесс помогает школе выбрать студентов, которых они хотят.Государственная школа, с другой стороны, не может выбирать учеников, которых они хотят, поскольку государственные школы открыты для всех.
–
В заключение, родителям следует отправлять своих детей в частную школу, потому что ученики частных школ, как правило, поступают в лучшие колледжи и наверняка попадут в программы частной средней школы после окончания средней школы. Поэтому, если вы хотите, чтобы у ваших детей было лучшее предложение или лучшее будущее, вы должны без колебаний отдать своих детей в частную школу, потому что это того стоит.
Поэтому, если вы хотите, чтобы у ваших детей было лучшее предложение или лучшее будущее, вы должны без колебаний отдать своих детей в частную школу, потому что это того стоит.
ISEE — это один тест для нескольких классов — Piqosity
Хотя существуют разные варианты каждого теста ISEE, вполне возможно, что ученик, поступающий в 9-й класс, может сдавать тот же тест с теми же вопросами, что и ученик, поступающий в 12 класс; однако ниже мы объясним, как эта возможность незначительно влияет на общую сложность теста.
ISEE или независимый вступительный экзамен в школу предлагается на нескольких уровнях, включая верхний, средний, нижний и начальный.Однако только «Начальные уровни» относятся к конкретным классам вплоть до той, на которую подает заявление ваш ребенок. Для учащихся, проходящих верхний, средний или нижний уровень ISEE, они будут проходить тест, предназначенный для измерения подготовленности учащихся к нескольким уровням обучения:
- ISEE Upper Level = для учеников 9, 10, 11 и 12 классов
- ISEE средний уровень = поступление в 7 и 8 классы
- ISEE нижний уровень = поступление в 5 и 6 классы
Однако, в отличие от экзамена CTP-4, который проводится во многих частных школах и который обычно называют «ERB» после того, как его разработало Бюро образовательной документации, ISEE не является строго тестом на успеваемость на уровне класса.
Подобно SAT и ACT, это также тест на рассуждение, призванный побудить учащихся мыслить дальше того, что они узнали в классе. В этой связи ERB не ожидает, что учащиеся разных классов будут набирать очень разные баллы.
Чтобы лучше понять баллы по классам, давайте посмотрим на «квартили по шкале баллов», предоставленные ERB для верхнего уровня ISEE для нормальных групп 2015–2016 годов.
Сравнительная оценка словесного мышления
Глядя на столбец 50-го процентиля учащихся (или средних учащихся), вы должны заметить, что разница в шкалах баллов для учащихся, поступающих в 12-й класс, и учащихся, поступающих в 9-й класс, составляет всего 6 баллов (887 — 881).Для этой группы норм эти 6 баллов по шкале означают получение всего 2 дополнительных вопросов (из 40) правильных ответов или улучшение на 5% за три года.
Количественное мышление Сравнительные баллы
Глядя на столбец для 50-го процентиля учащихся, вы должны заметить, что разница в баллах по шкале для учащихся, поступающих в 12-й класс, и учащихся, поступающих в 9-й класс, составляет всего 8 баллов (888–880). Для этой группы норм эти 8 баллов по шкале означают, что вы получили всего 2 дополнительных вопроса (из 37) правильно или чуть более чем на 5% улучшение за три года.
Для этой группы норм эти 8 баллов по шкале означают, что вы получили всего 2 дополнительных вопроса (из 37) правильно или чуть более чем на 5% улучшение за три года.
Сравнительные оценки понимания прочитанного
Глядя на столбец для 50-го процентиля учащихся, вы должны заметить, что разница в баллах по шкале для учащихся, поступающих в 12-й класс, и учащихся, поступающих в 9-й класс, составляет всего 7 баллов (891-884). Для этой группы норм эти 7 баллов по шкале означают, что вы получили всего 2 дополнительных вопроса (из 36) правильных ответов или улучшение чуть более 5% за три года.
Картина становится еще интереснее, если вы посмотрите на столбец для 25-го процентиля (или студентов ниже среднего).Обратите внимание, что максимальный балл для учеников, поступающих в 11-й класс, составляет 873, а на самом деле снижаются с до 869 для учеников, поступающих в 12-й класс.
Сравнительные результаты по математике
Глядя на столбец для 50-го процентиля учащихся, вы должны заметить, что разница в шкалах баллов для учащихся, поступающих в 12-й класс, и учащихся, поступающих в 9-й класс, составляет всего 9 баллов (892–883). Для этой нормативной группы эти 9 баллов по шкале означают, что вы получили всего 3 дополнительных вопроса (из 47) правильных ответов или улучшение чуть более 6% за три года.
Заключение
Структура ISEE в сочетании с нормированием сверстников означает, что учащиеся не должны чувствовать, что ISEE противопоставляется им, даже если они относятся к младшему классу.
* Квартили сравнительных данных представляют собой выдержки из «Чего ожидать от ISEE», доступного онлайн бесплатно на ERBLearn.org. ISEE® является зарегистрированным товарным знаком Бюро образовательной документации. Piqosity не является аффилированным лицом и не одобрено Бюро образовательной документации.
Обзор программы тестирования штата Нью-Джерси
Нью-Джерси придерживается стандартов оценки на протяжении более сорока лет. В 1975 году Законодательное собрание штата Нью-Джерси приняло Закон о государственном школьном образовании (PSEA) «, чтобы предоставить всем детям Нью-Джерси, независимо от социально-экономического статуса или географического положения, возможность получения образования, которая подготовит их к политической, экономической и социальной деятельности. в демократическом обществе ». Годом позже в PSEA были внесены поправки, чтобы установить единые стандарты минимальных достижений в основных коммуникативных и вычислительных навыках.Эта поправка также включала правовое основание для использования теста в качестве требования для получения диплома. С 1978 по 1982 год учащиеся третьего, шестого и девятого классов участвовали в программе тестирования по чтению и математике по программе «Минимальные базовые навыки (MBS) ».
в демократическом обществе ». Годом позже в PSEA были внесены поправки, чтобы установить единые стандарты минимальных достижений в основных коммуникативных и вычислительных навыках.Эта поправка также включала правовое основание для использования теста в качестве требования для получения диплома. С 1978 по 1982 год учащиеся третьего, шестого и девятого классов участвовали в программе тестирования по чтению и математике по программе «Минимальные базовые навыки (MBS) ».
Начиная с 1981–1982 годов, ученики девятых классов должны были сдать тест на минимальные базовые навыки как одно из требований для получения аттестата об окончании средней школы. Учащимся, не сдавшим экзамен MBS по чтению или математике, было предоставлено несколько возможностей повторного тестирования до одиннадцатого класса для прохождения обоих разделов.
Год спустя, в 1983 году, в штате был введен тест на знание 9-го класса средней школы (HSPT9) — более сложный экзамен для измерения минимальных навыков чтения, письма и математики. Первое своевременное администрирование HSPT9 произошло в 1983–1984 годах. Первым учебным годом, когда тест проводился в качестве выпускного, был 1985-1986 годы.
Первое своевременное администрирование HSPT9 произошло в 1983–1984 годах. Первым учебным годом, когда тест проводился в качестве выпускного, был 1985-1986 годы.
В 1988 году законодательное собрание штата Нью-Джерси приняло закон, согласно которому тест High School Proficiency Test (HSTP11) был перемещен с девятого на одиннадцатый класс и добавлен 8-й класс Early Warning Test (EWT) в качестве ранней контрольной оценки.В то время как HSPT11 и EWT представляли собой строгую оценку основных навыков чтения, письма и математики, EWT был предназначен для использования только для размещения студентов и планирования программ. В отличие от этого, экзамен на знание средней школы 11 класса (HSPT11) служил обязательным требованием для выпускников всех учащихся государственных школ, которые поступили в девятый класс 1 сентября 1991 года или позже. С 1991 по 1993 год было проведено трехлетнее тестирование с обязательным уведомлением. дайте школьным округам время на согласование своей учебной программы и обучения и на подготовку учащихся восьмых и одиннадцатых классов к новым, более сложным экзаменам.
В мае 1996 года Совет по образованию штата Нью-Джерси принял Стандарты содержания основной учебной программы (CCCS), в которых перечислено, что все учащиеся Нью-Джерси должны знать и уметь делать к концу четвертого и восьмого классов и по завершении Образование в государственной школе Нью-Джерси. CCCS, которые пересматриваются каждые пять лет, также определяют требования к окончанию средней школы штата Нью-Джерси и являются основой для оценки академической успеваемости учащихся 3–12 классов.CCCS проинформировал о разработке трех последующих оценок по всему штату: оценки уровня знаний в начальной школе (ESPA), которая проводилась с 1997 по 2002 год; оценка квалификации восьмого класса (GEPA), которая заменила EWT в 1998 году и проводилась в течение 2007-2008 годов; и экзамен по оценке уровня владения средней школой (HSPA), который заменил HSPT11 в качестве выпускного экзамена штата для всех учащихся, поступивших в одиннадцатый класс осенью 2001 года.
С принятием Закона № «Ни один ребенок не останется без внимания» от 200 1 ( NCLB ) система оценивания штата Нью-Джерси претерпела дальнейшие изменения. Это федеральное законодательство требовало, чтобы каждый штат проводил ежегодное оценивание на основе стандартов для учащихся 3–8 классов и, по крайней мере, один раз в средней школе. Федеральные ожидания заключались в том, что каждый штат будет предоставлять тесты, основанные на строгих стандартах содержания и оценивающие достижения учащихся в языковой грамотности, математике и, на трех контрольных уровнях обучения, в естественных науках.
Это федеральное законодательство требовало, чтобы каждый штат проводил ежегодное оценивание на основе стандартов для учащихся 3–8 классов и, по крайней мере, один раз в средней школе. Федеральные ожидания заключались в том, что каждый штат будет предоставлять тесты, основанные на строгих стандартах содержания и оценивающие достижения учащихся в языковой грамотности, математике и, на трех контрольных уровнях обучения, в естественных науках.
В ответ на требования NCLB и собственные ожидания Нью-Джерси о том, что учащиеся будут читать на уровне своего класса к концу третьего класса, Нью-Джерси пересмотрел свою элементарную оценку, включив в нее программу оценки для третьего класса.Тест New Jersey Assessment of Skills of Skills and Knowledge ( NJ ASK ) прошел полевые испытания в мае 2003 г. и полностью вступил в силу в следующем году. С внедрением NJ ASK 3 в 2003 году ESPA превратилась в NJ ASK4. Аттестация по элементарным наукам штата впервые была проведена для четвероклассников Нью-Джерси весной 2004 года, а в следующем году она стала применяться. В 2006 году программа NJ ASK была расширена и теперь включает в себя классы с 5 по 7. Затем система оценивания штата Нью-Джерси включала NJ ASK 3-8, HSPA, альтернативную оценку квалификации (APA) для учащихся с тяжелыми когнитивными нарушениями и среднюю школу в конце курса. оценки компетенций по биологии и алгебре.
В 2006 году программа NJ ASK была расширена и теперь включает в себя классы с 5 по 7. Затем система оценивания штата Нью-Джерси включала NJ ASK 3-8, HSPA, альтернативную оценку квалификации (APA) для учащихся с тяжелыми когнитивными нарушениями и среднюю школу в конце курса. оценки компетенций по биологии и алгебре.
В июне 2010 года Совет по образованию штата Нью-Джерси принял Общие основные государственные стандарты (CCSS) по математике и английскому языку искусств / грамотности. В 2011 году Министерство образования штата Нью-Джерси подало в Департамент образования США заявление об освобождении от определенных положений закона No Child Left Behind (NCLB). Комплексный отказ от прав позволил Департаменту разработать новую систему подотчетности для замены положений NCLB , сосредоточенных на оказании поддержки и вмешательстве школам штата с самой низкой успеваемостью и школам с наибольшим разрывом между подгруппами учащихся.
В рамках подготовки к новой системе подотчетности штат присоединился к консорциуму Партнерства по оценке готовности к колледжу и карьере (PARCC) весной 2010 года. Нью-Джерси стал управляющим штатом весной 2011 года и активно помогал формировать предложение PARCC по общая система оценивания нового поколения.
Нью-Джерси стал управляющим штатом весной 2011 года и активно помогал формировать предложение PARCC по общая система оценивания нового поколения.
Партнерство по оценке готовности к колледжу и карьере (PARCC) — это консорциум штатов, которые совместно разработали общий набор оценок для измерения достижений учащихся по Общим основным государственным стандартам и готовности к колледжу и карьере.В 2014–2015 годах электронные экзамены PARCC заменили существующие в масштабе штата — NJASK в 3-8 классах и HSPA в старших классах. В Нью-Джерси в течение более трех лет осуществлялся переход NJ ASK для измерения навыков более высокого уровня, чтобы предоставить местным округам и школам время, необходимое для смены практики и подготовки студентов и преподавателей к PARCC.
В 2015 году основные стандарты были пересмотрены и пересмотрены, чтобы обеспечить неизменно высокие ожидания студентов Нью-Джерси.В мае 2016 года Совет штата Нью-Джерси по образованию принял пересмотренные стандарты по математике и английскому языку, а также изменил названия всех девяти разделов стандартов Нью-Джерси на Стандарты обучения студентов штата Нью-Джерси.
Оценки PARCC соответствуют высокоуровневым навыкам мышления и были созданы для измерения способности учащихся применять свои знания о концепциях, а не повторять заученные факты. Оценки PARCC требуют от учащихся решать задачи, используя математические рассуждения и уметь моделировать математические принципы.При изучении искусств на английском языке (ELA) учащиеся должны внимательно читать несколько отрывков и писать ответы на эссе в области литературного анализа, исследовательских и повествовательных задач. Оценки также предоставляют учителям и родителям информацию об успеваемости учащихся для информирования инструкторов и оказания целевой поддержки учащимся.
(пересмотрено в июле 2016 г.)
Школьный округ Мид :: Информация о тестировании
NWEA Карта роста
Meade 46-1 использует MAP Growth в 1-10 классах по английскому языку и математике, а также в 6-10 классах по естествознанию.MAP Growth — это компьютерно-адаптивный тест. Если ученик правильно отвечает на вопрос, следующий вопрос будет более сложным. Если они ответят неправильно, следующий будет легче. Этот тип оценивания бросает вызов лучшим успевающим, не подавляя учащихся, чьи навыки ниже уровня их класса. MAP Growth использует шкалу RIT для точного измерения того, что знают учащиеся, независимо от их уровня обучения. Он также измеряет рост с течением времени, позволяя отслеживать успеваемость учащихся в течение учебного года и за несколько лет.MAP Growth предоставляется три раза в учебный год.
Тесты для оценки навыков в детском саду, которые измеряют знание стандартов детского сада по математике и английскому языку.
1–8 классы
Начало года: 16 сентября — 7 октября 2020 г.
Середина года: 1 — 16 февраля 2021 г.
Конец года: 26 апреля — 10 мая 2021 г.
9 и 10 классы средней школы
Начало года: 16 сентября — 7 октября 2020 г.
Середина года: 14 декабря — 18 декабря 2020 г.
Конец года: 19 апреля — 21 апреля 2021 г.
Национальная оценка образовательного прогресса (NAEP)
Национальная оценка прогресса в образовании (NAEP), часто называемая «Табель успеваемости нации», является единственной репрезентативной и продолжающейся на национальном уровне оценкой того, что американские студенты знают и могут делать по различным предметам.Его две основные цели — измерить успеваемость учащихся и сообщить об изменениях в успеваемости учащихся с течением времени. В 2019 году NAEP по математике и чтению будет проводиться среди многих студентов из Южной Дакоты. NAEP предоставляется выборке студентов по всей стране. Результаты NAEP даны как для всей страны, так и для отдельных штатов. Результаты также приводятся для конкретных групп студентов, например пол, расовые и этнические группы, а также право на участие в Национальной программе школьных обедов. Результаты недоступны для школ или отдельных учащихся.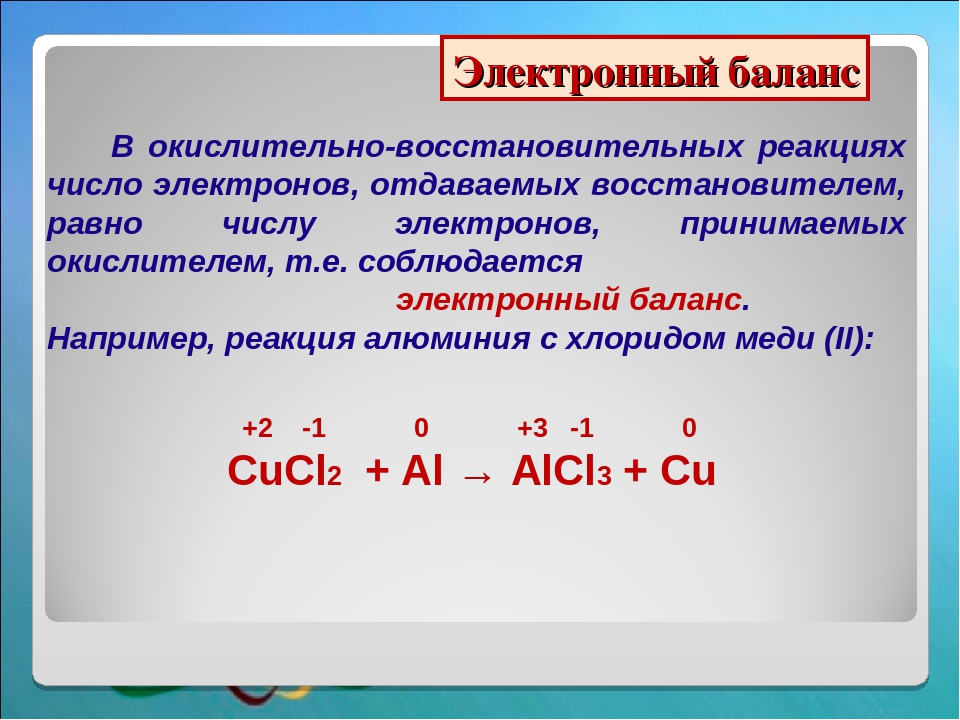
NAEP выдается многим ученикам Южной Дакоты по чтению и математике в 4, 8 и 12 классах каждые два года. Общенациональные и государственные результаты сообщаются общественности. Несколько других предметов проходят тестирование в разные годы, и результаты только на национальном уровне сообщаются.
Даты: подлежат уточнению
ДОСТУП для ELL
ACCESS for ELLs 2.0 — это безопасная крупномасштабная оценка уровня владения английским языком, проводимая учащимися детского сада для учащихся 12-х классов, которые были определены как изучающие английский язык (ELLs).Он проводится ежегодно для наблюдения за успеваемостью студентов в овладении академическим английским языком. ACCESS for ELLs 2.0 соответствует Стандартам развития английского языка WIDA и оценивает каждую из четырех языковых областей: аудирование, устная речь, чтение и письмо. Экзамен доступен как в бумажном, так и в онлайн-формате для 1–12 классов, в то время как Kindergarten и Alternate ACCESS for ELLs представляют собой бумажные тесты.
ACCESS 2.0: 25 января — 26 февраля 2021 г.
ACCESS Alt: 27 января — 28 февраля 2020 г.
Южная Дакота экзамен по английскому языку и математике
Оценка по английскому языку и математике оценивает успеваемость учащихся в соответствии с нашими государственными стандартами в области изучения английского языка и математики.Онлайн-тест использует технологии адаптивного тестирования в максимально возможной степени, чтобы обеспечить значимую обратную связь и действенные данные, которые учителя и другие преподаватели могут использовать, чтобы помочь учащимся добиться успеха. Помимо общих оценок по этим двум предметам, отчеты об оценках будут содержать информацию об успеваемости учащихся по следующим направлениям:
- Английский язык: чтение, письмо, аудирование и исследования
- Математика: концепции и процедуры; решение проблем и моделирование / анализ данных; и сообщая рассуждения
3–8 и 11 классы: 8 марта — 7 мая 2021 г.
Оценка науки Южной Дакоты
Тесты по естествознанию в Южной Дакоте оценивают уровень успеваемости учащихся в 5, 8 и 11 классах по Государственным академическим стандартам Южной Дакоты, принятым в мае 2015 года.Этот тест будет охватывать учащихся 3-5, 6-8 классов и старшую школу. Вопросы будут в равной степени поступать из естественных, физических и земных наук на всех трех тестируемых уровнях. Эта оценка будет полностью онлайн.
8 марта — 7 мая 2021 г.
Южная Дакота Альтернативная оценка науки
Оценка науки Южной Дакоты измеряет успеваемость учащихся в соответствии с нашими новыми государственными стандартами, принятыми в мае 2015 года. Оценка проводится на компьютере, и результаты будут доступны осенью следующего учебного года.
8 марта — 7 мая 2021 г.
Южная Дакота Альтернативный экзамен по английскому языку и математике
SD ELA & Math Alternative Assessment в области английского языка, искусства и математики — это экзамен, разработанный для учащихся с наиболее серьезными когнитивными нарушениями. Оценка основана на альтернативных стандартах успеваемости, которые были взяты из государственных стандартов успеваемости и связаны с ними. Общая цель оценки состоит в том, чтобы убедиться, что все учащиеся достигают все более высоких академических результатов и заканчивают среднюю школу, готовыми к таким вариантам после окончания средней школы, как колледж, карьера и участие в сообществе.
Оценка основана на альтернативных стандартах успеваемости, которые были взяты из государственных стандартов успеваемости и связаны с ними. Общая цель оценки состоит в том, чтобы убедиться, что все учащиеся достигают все более высоких академических результатов и заканчивают среднюю школу, готовыми к таким вариантам после окончания средней школы, как колледж, карьера и участие в сообществе.
3–8 и 11 классы: 15 марта — 30 апреля 2021 г.
Национальный сертификат готовности к карьере ACT® (NCRC)
Департамент образования Южной Дакоты (DOE) и Департамент труда и регулирования штата Южная Дакота (DLR) предлагают юниорам и пожилым людям возможность участвовать в программе ACT® National Career Readiness Certificate (NCRC).
NCRC — это признанный в отрасли портативный сертификат, подтверждающий основные навыки, необходимые для успеха на рабочем месте.Для получения сертификата учащиеся должны достичь как минимум самого низкого уровня сертификации по трем экзаменам ACT® WorkKeys: прикладная математика, чтение для информации и поиск информации. Эта жизненно важная инициатива является частью цели Министерства образования по обеспечению того, чтобы «все студенты заканчивали колледж, были готовы к карьере и жизни».
ПерсоналDLR будет оказывать помощь в оценке учащихся на месте в местных школах, а стоимость одного теста для каждого учащегося покрывается государством. Школьному персоналу необходимо предоставить место и по одному компьютеру на каждого ученика, так как это компьютерный тест.Каждому студенту дается 55 минут на три экзамена.
Количество оцениваемых студентов определяется местным законодательством, а первоначальная стоимость оплачивается государством. Оценки — отличный способ поддержать существующие учебные планы класса, и школы могут включать эту оценку в определенные классы. Школы также могут предлагать тесты для учащихся младших и старших классов, чтобы проверить их реальные навыки работы.
NCRC также включен в показатель готовности к колледжу и карьере (CCR) для индекса успеваемости (SPI).Дополнительную информацию, описывающую индикатор CCR и баллы SPI, можно найти в Государственном плане ESSA по адресу http://doe.sd.gov/ESSA/.
Эта инициатива может помочь учащимся продемонстрировать, что они готовы к работе, когда они начнут работать сразу после окончания учебы или продолжат образование после окончания средней школы.
Оценка национального сертификата готовности к карьере: 24 марта 2021 г.
Тестирование в домашней школе (Государственный экзамен SAT 10 ab)
22 марта — 16 апреля 2021 г.
Календарь аттестации школы
Начальная школа долины Пьемонта:
ГРАФИК ИСПЫТАНИЙ НА 2021 ГОД
Начальная школа Стерджиса:
ГРАФИК ИСПЫТАНИЙ НА 2021 ГОД
Whitewood Elementary:
Классы 3–5 Математика / английский язык 22 марта — апрель 1
5 класс, естественные науки 7–8 апреля
Аталл:
3–7 классы
23, 24, 30, 31 марта
7-8 апреля (и позже) будет использоваться для тестирования макияжа при необходимости
Вт., 23 марта — 4, 5, 6 ELA CAT
Ср., 24 марта — 4, 5, 6-е ELA PT Часть 1
Чт, 25 марта — 4, 5, 6-е ELA PT Часть 2
Вт, 30 марта — 4, 5, 6 математика CAT
PM — 5-я наука
, среда, 31 марта — 4, 5, 6 математические операции, PT
Elm Springs:
Вт, 23 марта — 4, 5, 6 ELA CAT
ср., 24 марта — 4, 5, 6-е ELA PT Часть 1
Чт, 25 марта — 4, 5, 6-е ELA PT Часть 2
Вт, 30 марта — 4, 5, 6 математика CAT
PM — 5-я наука
, среда, 31 марта — 4, 5, 6 математические операции, PT
Херефорд:
Вт, 23 марта — 4, 5, 6 ELA CAT
Ср., 24 марта — 4, 5, 6-е ELA PT Часть 1
Чт, 25 марта — 4, 5, 6-е ELA PT Часть 2
Вт., 30 марта — 4, 5, 6 математика CAT
PM — 5-я наука
, среда, 31 марта — 4, 5, 6 математические операции, PT
Опал:
Центральная школа округа Мид:
Тестирование 23 марта — 8 апреля
10: 40-12: 20
1: 00–2: 00
Вторник ИЛИ Среда
Вторник и среда
Среда и четверг (при необходимости)
Sturgis Intermediate:
Учащиеся 5-х классов SIS будут сдавать государственные экзамены в течение недели с 22 по 26 марта
Средняя школа Стерджиса Уильямса:
SWMS Ученики 7 и 8 классов будут сдавать государственные экзамены в течение недели с 15 по 17 марта
Шестиклассники SWMS будут сдавать государственные экзамены в течение недели с 22 по 26 марта
Средняя школа Stagebarn:
22, 23, 24, 25 марта = экзамен для 7 и 8 классов по математике и английскому языку
6, 7, 8, 9 апреля = 5 и 6 классы Тест по математике и английскому языку
13 апреля = тест для 5 и 8 классов Естественные науки
Средняя школа Стерджиса Брауна:
Государственное тестирование по английскому языку, математике и естественным наукам 19 апреля и 21 апреля
Конец EOG и EOC?
Целевая группа Совета по образованию штата Северная Каролина по итоговому оцениванию провела заседание 13 марта 2015 года.
На этой встрече целевая группа представила проект системы оценки, который включал две модели.
Первая модель для классов с третьего по восьмой исключает тесты NC End-of-Grade. Он заменяет их системой периодических оценок, которая «служит цели руководства методикой преподавания учителей и содействия обучению учащихся на этом пути».
Если у вас есть образование, вы знаете это как формирующее оценивание. Формирующие оценки являются более диагностическими, предоставляя учителям информацию в режиме реального времени, чтобы улучшить обучение и улучшить обучение учащихся.
Они отличаются от итоговых оценок (например, выпускных тестов). Итоговые оценки происходят в конце — единицы или года. Они скорее оценочные, чем диагностические. Иногда их сравнивают с вскрытием, потому что период обучения закончился. Эти оценки помогают учителю увидеть, что происходило в течение года, модуля или конкретного класса.
Здесь есть некоторая ирония. Целевая группа по суммативному оцениванию рекомендует перейти к преимущественно формативному оцениванию.
Вторая модель для классов с девятого по двенадцатый исключает тесты NC End-of-Course. Эти тесты заменены на «модель до / после тестирования с оценкой на уровне класса, проводимой в 9, 10 и 11 классах». 9-й и 10-й классы будут служить предварительными тестами для последнего теста, проводимого в 11-м классе. Тест 11-го класса будет измерять «соответствие академическим стандартам Северной Каролины».
В настоящее время набор тестов ACT требуется по закону штата Северная Каролина для измерения готовности к колледжу и карьере, а также для предоставления информации о подотчетности школы.Закон NC также требует, чтобы оценки были общенациональными по своему охвату. Если для принятия рекомендован другой набор национальных оценок, необходимо будет изменить закон штата.
Целевая группа собирается участвовать в обсуждениях с суперинтендантами, и предложенные модели будут представлены руководителям отделов содержания NC DPI в конце этого месяца. Кроме того, будут выпущены запросы на информацию (RFI) для определения доступности и стоимости систем оценки.
