Контрольная работа «Металлы и их соединения» по химии 9 класс
Контрольная работа по химии «Металлы и их соединения»
1 вариант
Часть А.
Электронная формула атома магния:1)1s22s2 2) 1s22s2 2p63s2 3) 1s22s2 2p63s1 4) 1s22s2 2p63s23p2
А2
В каком ряду химические элементы расположены в порядке усиления металлических свойств?
1) Na, Mg, Al 2) Al, Mg, Na 3) Ca, Mg, Be 4) Mg, Be, Ca
А3
Металл, обладающий самой высокой электропроводностью, — это
1) железо 2) медь 3) серебро 4) алюминий
А4
Наиболее энергично взаимодействует с водой:
1) калий 2) натрий 3) кальций 4) магний
А5
Гидроксид цинка взаимодействует с каждым из двух веществ:
1) HCl и CO2 2) NaOH и H2SO4 3) SiO2 и KOH 4) NaNO3 и H2SO4
А6
Методы переработки руд, основанные на восстановлении металлов из оксидов при высоких температурах, называются: 1) гидрометаллургия 2) пирометаллургия 3) электрометаллургия 4) гальваностегия
Часть В.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) СаO + CO2 1) Ca(OH)
Б) Ca(OH)2+ SO2 2) CaCO3+ H2O
В) Ca + H2O 3) CaSO4+ H2O
Г) Ca (HCO3)2 + Ca(OH)2 4) Ca(OH)2 + H25) CaSO3 + H2O
6) CaCO3
Часть С.
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: FeFeCl3Fe(OH)3Fe2O3FeFeCl2.
Контрольная работа по химии «Металлы и их соединения»
2 вариант
Часть А.
1)1s22s22р1 2) 1s22s2 2p63s2 3) 1s22s2 2p63s23р1 4) 1s22s2 2p63s23p3
В каком ряду химические элементы расположены в порядке увеличения их атомного радиуса?
1) Na, Mg, Al 2) Al, Mg, Na 3) K, Na, Li 4) Mg, Be, Ca
А3
Металл, обладающий самой высокой пластичностью, — это: 1) золото 2) медь 3) серебро 4) алюминий
А4
Не взаимодействует с раствором серной кислоты
1) цинк 2) серебро 3) никель 4) железо
А5
Оксид алюминия взаимодействует с каждым из двух веществ:
1) HCl и O2 2) КOH и H2О 3) HCl и KOH 4) NaNO3 и H2SO4
А6
В качестве восстановителя при выплавке чугуна в доменных печах используют
1) водород 2) алюминий 3) кокс 4) магний
Часть В.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) Fe + Cl2 1) Fe2(SO4)3 + H2O
Б) Fe + HCl 2) FeSO4 + H2O
В) Fe2O3 + H2SO4 3) FeCl3
Г) Fe + CuSO4 4) FeCl2 + H2
5) FeSO4 + Cu6) Fe2(SO4)3 + Cu
Часть С.
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: CaCa(OH)2CaCO3Ca(HCO3)2 CaCl2Ca(NO3)2.
Контрольная работа по химии «Металлы и их соединения»
3 вариант
Часть А.
Электронная формула атома железа:А2
В каком ряду химические элементы расположены в порядке ослабления металлических свойств?
1) Li, K, Rb 2) Al, Mg, K 3) Ca, Mg, Li 4) K, Ca, Be
А3
Самый легкоплавкий металл – это: 1) цезий 2) ртуть 3) алюминий 4) железо
А4
Вытеснит свинец из раствора нитрата свинца (II): 1) медь 2) цинк 3) калий 4) серебро
А5
Гидроксид железа (III) взаимодействует с каждым из двух веществ
1) HCl и CO2 2) NaOH и H2SO4 3) SiO2 и KOH 4) KCl и H2SO4
А6
Нельзя получить водородотермией
1) вольфрам 2) медь 3) натрий 4) хром
Часть В.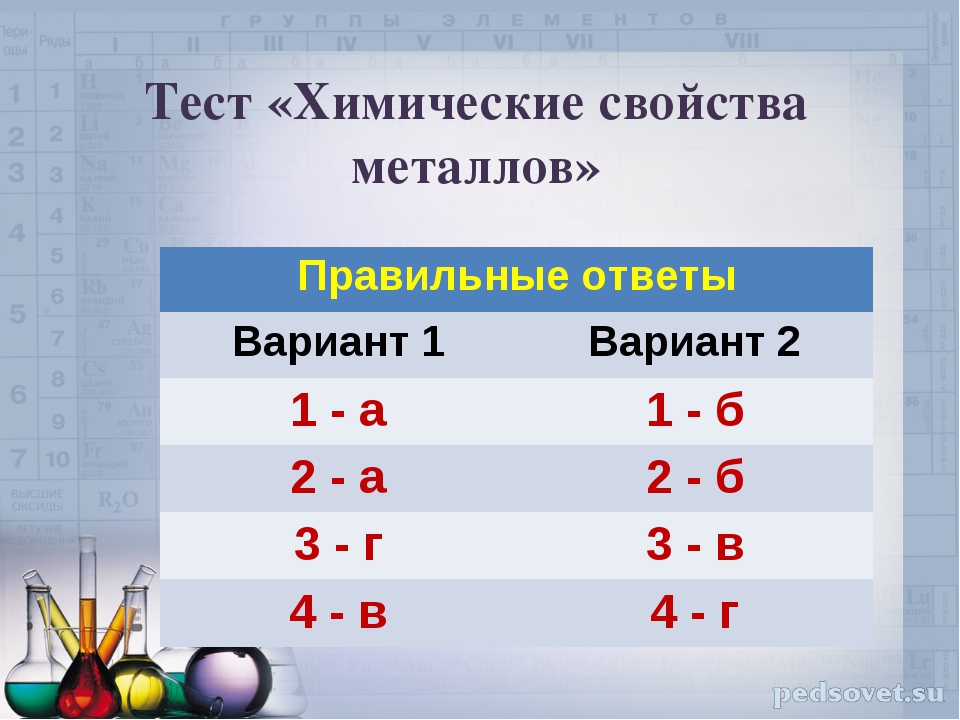
А) Na + H2O 1) Fe(OH)2+ NaCl
Б) Na2O + H2O 2) NaOH + H2
В) NaOH+ SO3 3) NaOH
Г) NaOH + FeCl2 4) Fe(OH)3+ NaCl
5) Na2SO3 + H2O6) Na2SO4 + H2O
Часть С.
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: AlAlCl3Al(OH)3Al
Контрольная работа по химии «Металлы и их соединения»
4 вариант
Часть А.
1) 1s22s2 2p63s1 2) 1s22s2 2p63s2 3р64s2 3) 1s22s
А2
В каком ряду химические элементы расположены в порядке уменьшения их атомного радиуса?
1) Li, K, Rb 2) Al, Mg, K 3) Ca, Mg, Li 4) Be, Ca, K
А3
Самый тугоплавкий металл – это: 1) хром 2) медь 3) вольфрам 4) железо
А4
Не вытеснит медь из раствора сульфата меди(II): 1) железо 2) цинк 3) натрий 4) марганец
А5
Оксид калия взаимодействует с каждым из двух веществ:
1) HCl и CO2 2) NaOH и H
А6
Щелочные металлы получают: 1) электролизом растворов солей 2) электролизом расплавов солей
3) восстановлением коксом из оксидов 4) восстановлением водородом из оксидов
Часть В.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) Al + NaOH + H2O 1) Al(NO3)3 + H2
Б) Al2O3 + NaOH
В) Al+ HNO3 3) NaAlO2
Г) Al2(SO4)3 + KOH 4) NaAlO2 + H2
5) NaAlO2 + H2O6) Al(OH)3 + K2SO4
Часть С.
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: FeFeCl2Fe(OH)2 Fe(OH)3Fe2O3Fe(NO3)3
Критерии оценивания
П
8
С2
Уметь анализировать условие задачи и решать её по известному алгоритму. Уметь рассчитывать массу и количество чистого вещества, если известна массовая доля примесей. Уметь рассчитывать массовую (или объемную долю) выхода продукта в % от теоретически возможного.
Уметь рассчитывать массу и количество чистого вещества, если известна массовая доля примесей. Уметь рассчитывать массовую (или объемную долю) выхода продукта в % от теоретически возможного.
В
8
Итоговая оценка
0- 8 баллов:
«2»
9-16 баллов:
«3»
17 -21 баллов: «4»
22 -26 баллов: «5»
Всего
26 баллов
КЛЮЧ
Часть А Часть В
Часть С.
С1. Элементы ответа:2Fe +3Cl2=2FeCl3 1б.
Fe3+ + 3OH— = Fe(OH)3 2б.
2Fe(OH)3 = Fe2O3 + 3H2O 1б.
Fe2O3 + 3СО = 2Fe + 3СО2, баланс 2б.
Fe0 + 2H+ = Fe2+ + H20 2б.

С1. Элементы ответа:
Са + 2Н2О = Са(ОН)2 + Н2, баланс 2б.
Са(ОН)2 + СО2 = СаСО3 + Н2О, 1б.
СаСО3 + СО2 + Н2О = Са(НСО3)2, 1б.
Са(НСО3)2 + 2НCl = CaCl2 + 2СО2 +2Н2О, ионное, 2б.
CaCl2 + 2AgNO3= Ca(NO3)2 + 2AgCl, ионное, 2б.
3 вариант
4 вариант
С1. Элементы ответа:
1) 2Al +3Cl2=2AlCl3, баланс, 2б.
2) AlCl3+ 3NaOH= Al(OH)3 + 3NaCl, ионное, 2б.
3) 2 Al(OH)3= Al2O3 + 3H2O, 1б.
4) Al2O3 + 2КОН = 2КAlO2+ H2O, 1б.
5) КAlO2+ 4HNO3 = Al(NO3)3+ KNO3 +2H2O, ионное, 2б.
С1. Элементы ответа:
Fe0 + 2HCl = FeCl2 + H20 , 1б.
Fe2+ + 2OH— = Fe(OH)2 , 2б.
4Fe(OH)2+ О2+ 2H2O =4Fe(OH)3, баланс, 2б.
2Fe(OH)3 = Fe2O3 + 3Н2О, 1б.
5) Fe2O3+ 6 HNO3 =2Fe(NO3)3 + 3Н2О, ионное,2б.
Контрольная работа по химии на тему: «Металлы» (9 класс)
Контрольная работа №1. «Периодический закон и строение вещества».
Назначение контрольной работы: оценить уровень освоения каждым обучающимся класса содержания учебного материала по темам: Строение атома, строение электронных оболочек атомов первых20 элементов Периодической системы Д.И. Менделеева. Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов Д. И. Менделеева, Атомы и молекулы. Химический элемент. Простые и сложные вещества. Химическая реакция. Условия и признаки протекания химических реакций, химические свойства веществ.
И. Менделеева, Атомы и молекулы. Химический элемент. Простые и сложные вещества. Химическая реакция. Условия и признаки протекания химических реакций, химические свойства веществ.
Спецификация КИМ для проведения контрольной работы
Каждый вариант контрольной работы содержит 11 заданий. Задания 1-8 оцениваются 1 баллом. Задания 9-10 оцениваются максимально 2 баллами. Задание 13 – максимальный балл 3.На выполнение контрольной работы отводится 45 минут.
Распределение заданий по уровням сложности, проверяемым элементам, уровню подготовки, типам заданий и времени выполнения представлено в таблице.
1 вариант
1. Шесть электронов находятся во внешнем электронном слое атома
1) бора 2) углерода 3) фосфора 4) серы
2. В каком ряду химических элементов усиливаются металлические свойства соответствующих им простых веществ?
1) калий → натрий → литий
2) сурьма → мышьяк → фосфор
3) углерод → кремний → германий
4) алюминий → кремний → углерод
3. Какой вид химической связи в оксиде натрия?
Какой вид химической связи в оксиде натрия?
1) ковалентная неполярная
2) металлическая
3) ковалентная полярная
4) ионная
4. Низшие степени окисления азота и серы соответственно равны
1) −З и −2 2) +1 и +2
3) +3 и + 2 4) −1 и −2
5. Названия только простых веществ записаны в ряду:
1) оксид магния, оксид серы(IV)
2) углекислый газ, угарный газ
3) железо, аммиак
4) цинк, графит
6. Как определяется место химического элемента в периодической системе Д.И. Менделеева?
1) количеством электронов на внешнем уровне
2) количеством нейтронов в ядре
3) зарядом ядра атома
4) атомной массой
7. Чем отличаются атомы изотопов одного элемента?
Чем отличаются атомы изотопов одного элемента?
1) числом протонов
2) числом нейтронов
3) числом электронов
4) зарядом ядра
8.Какой элемент возглавляет главную подгруппу пятой группы?
1) ванадий 2) азот 3) фосфор 4) мышьяк
9. При выполнении задания из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны.
В ряду химических элементов алюминий-магний натрий происходит уменьшение (ослабление)
1) числа электронов на внешнем энергетическом уровне
2) числа электронных слоев в атомах
3) металлических свойств
4) степени окисления в высших оксидах
5) основного характера свойств высших гидроксидов
10. При выполнении задания из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны.
Среди химических элементов C,N,O
1) наименьший радиус имеет атом углерода
2) наибольшую электроотрицательность имеет кислород
3) только у углерода высшая степень окисления равна номеру группы
4) отрицательную степень окисления может иметь только кислород
5) углерод и азот образуют высшие оксиды с кислотными свойствами
11. Установите соответствие между названием вещества и типом химической связи.
Название вещества Тип химической связи
А) хлорид натрия 1) ионная
Б) кислород 2) ковалентная полярная
В) алюминий 3) ковалентная неполярная
4) металлическая
Ответы:
1)4
2)2
3)2
4)1
5)4
6)3
7)2
8)2
9) 14
10) 25
11) 134
Перевод баллов к 5-бальной отметке представлен в таблице
БаллыОтметка
14-15 баллов
«5»
11-13 баллов
«4»
8-12 баллов
«3»
0 – 7 баллов
«2»
Контрольная работа №2. «Металлы».
«Металлы».
Предмет: химия
Класс: 9
Вид контроля: текущий
Назначение контрольной работы: оценить уровень освоения каждым обучающимся класса содержания учебного материала по темам: Положение металлов в Периодической системе Д.И.Менделеева и строение их атомов. Физические свойства металлов. Сплавы. Химические свойства металлов. Получение металлов. Щелочные металлы. Бериллий, магний и щелочноземельные металлы. Алюминий. Железо.
Спецификация КИМ для проведения контрольной работы
Каждый вариант контрольной работы состоит из 3 частей (А,B,C). Часть А содержит 6 тестовых заданий, которые оцениваются 1 баллами. Часть B имеет одно задание на соответвие, которое оценивается 2 баллами. Часть С содержит 2 задания (цепочка, задача) и оценивается 5 и 3 баллами соответственно. На выполнение контрольной работы отводится 45 минут.
Распределение заданий по уровням сложности, проверяемым элементам, уровню подготовки, типам заданий и времени выполнения представлено в таблице.
1
Базовый
1
3 мин
2
Базовый
1
3 мин
3
Базовый
1
3 мин
4
Базовый
1
3 мин
5
Базовый
1
3 мин
6
Базовый
1
3 мин
Часть В
1
Базовый
2
5 мин
Часть С
1
Повышенный
5
11 мин
2
Повышенный
3
11 мин
1 вариант
Часть А.
1)1s22s2 2) 1s22s2 2p63s2 3) 1s22s2 2p63s1 4) 1s22s2 2p63s23p2
А2
В каком ряду химические элементы расположены в порядке ослабления металлических свойств?
1) Li, K, Rb 2) Al, Mg, K
3) Ca, Mg, Li 4) K, Ca, Be
А3
Металл, обладающий самой высокой электропроводностью, — это
1) железо 2) медь 3) серебро 4) алюминий
А4
Не взаимодействует с раствором серной кислоты
1) цинк 2) серебро
3) никель 4) железо
А5
Гидроксид цинка взаимодействует с каждым из двух веществ:
1) HCl и CO2 2) NaOH и H2SO4 3) SiO2 и KOH 4) NaNO3 и H2SO4
А6
Методы переработки руд, основанные на восстановлении металлов из оксидов при высоких температурах, называются: 1) гидрометаллургия 2) пирометаллургия 3) электрометаллургия 4) гальваностегия
Часть В.
цифры выбранных вами ответов.
В1.
Установите соответствие между веществами, вступающими в реакцию
и продуктами их взаимодействия
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) СаO + CO2 1) Ca(OH)2
Б) Ca(OH)2+ SO2 2) CaCO3+ H2O
В) Ca + H2O 3) CaSO4+ H2O
Г) Ca (HCO3)2 + Ca(OH)2 4) Ca(OH)2 + H2
5) CaSO3 + H2O
6) CaCO3
Часть С.
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
FeFeCl3Fe(OH)3Fe2O3FeFeCl2.
C2. При взаимодействии 12 г технического магния, содержащего 5% примесей, с избытком соляной кислоты, выделилось 10 л водорода (н.у.). Вычислите объемную долю выхода продукта реакции.
Ответы:
Часть А
1)4
2) 4
3) 3
4) 2
5) 2
6) 2
Часть В
6542
Часть С
1)Элементы ответа:
2Fe + 3Cl2 → 2FeCl3
FeCl3 + 3КОН → Fe(OH)3 + 3КCl
2Fe(OH)3 →Fe2O3 + 3Н2О
Fe2O3 + 3Н2 →2Fe + 3Н2О
Fe + 2НCl = FeCl2 + Н2
2. Mg +2HCl = MgCl2 + H2
Mg +2HCl = MgCl2 + H2
m(Mg)= 12г * 0,95 = 11,4г
(Н2) = (Mg) = 11,4 /24 = 0,475моль
V(H2)= 0,475 моль*22,4 л/моль = 10,64л теория
w (выхода) = 10л/10,64л = 0,94 или 94%
Перевод баллов к 5-бальной отметке представлен в таблице
Итоговая контрольная работа по теме «Металлы»
Двухвариантная контрольная работа по теме «Металлы» носит обобщающий характер: строение вещества, физические и химические свойства металлов, способы их получения.
Просмотр содержимого документа
«Итоговая контрольная работа по теме «Металлы»»
КОНТРОЛЬНАЯ РАБОТА ПО ТЕМЕ «МЕТАЛЛЫ»
Вариант 1
Охарактеризуйте алюминий, исходя из его положения в ПСХЭ Д. И. Менделеева
И. Менделеева
Сравните металлические свойства элементов с порядковыми номерами 19 и 20. Укажите причины.
Предложите 3 способа получения хлорида железа (II)
Допишите химические реакции:
Любое уравнение реакции разберите как ОВР
Na + O2 →
Fe + Cl2 →
Ba + HOH →
Mg + серная кислота →
Осуществите цепочку превращений:
Mg → MgCl2 → Mg(OH)2 → MgO → MgSO4
AgCl → Ag
КОНТРОЛЬНАЯ РАБОТА ПО ТЕМЕ «МЕТАЛЛЫ»
Вариант 2
Охарактеризуйте магний, исходя из его положения в ПСХЭ Д.И. Менделеева
Сравните металлические свойства элементов с порядковыми номерами 11 и 19. Укажите причины.
Предложите 3 способа получения хлорида железа (III)
Допишите химические реакции:
Любое уравнение реакции разберите как ОВР
Na + HOH →
Ca + азотная кислота →
Fe + HCl →
Fe + O2 →
Осуществите цепочку превращений:
Na → Na2O2 → Na2O → Na2SO4→ BaSO4
NaOH + Al(OH)3 →
КОНТРОЛЬНАЯ РАБОТА ПО ТЕМЕ «МЕТАЛЛЫ»
Вариант 1
Охарактеризуйте алюминий, исходя из его положения в ПСХЭ Д. И. Менделеева
И. Менделеева
Сравните металлические свойства элементов с порядковыми номерами 19 и 20. Укажите причины.
Предложите 3 способа получения хлорида железа (II)
Допишите химические реакции:
Любое уравнение реакции разберите как ОВР
Na + O2 →
Fe + Cl2 →
Ba + HOH →
Mg + серная кислота →
Осуществите цепочку превращений:
Mg → MgCl2 → Mg(OH)2 → MgO → MgSO4
AgCl → Ag
КОНТРОЛЬНАЯ РАБОТА ПО ТЕМЕ «МЕТАЛЛЫ»
Вариант 2
Охарактеризуйте магний, исходя из его положения в ПСХЭ Д.И. Менделеева
Сравните металлические свойства элементов с порядковыми номерами 11 и 19. Укажите причины.
Предложите 3 способа получения хлорида железа (III)
Допишите химические реакции:
Любое уравнение реакции разберите как ОВР
Na + HOH →
Ca + азотная кислота →
Fe + HCl →
Fe + O2 →
Осуществите цепочку превращений:
Na → Na2O2 → Na2O → Na2SO4→ BaSO4
NaOH + Al(OH)3 →
Контрольная работа по химии для 9 класса по теме «Металлы»
Всероссийский дистанционный конкурс для учителей естественнонаучного цикла «Контрольная работа в формате теста»Контрольная работа по теме «Металлы»
химия 9 класс
Автор: учитель биологии и химии МОУ «Кушалинская СОШ» Тверская обл.
Артемьева Елена Юрьевна
Цель работы: оценить уровень усвоения учебного материала по химии по теме «Металлы» в 9 классе
Структура и содержание контрольной работы
Работа состоит из 2 частей, различающихся по форме и уровню сложности.
Часть 1 содержит 12 закрытых тестовых заданий базового и повышенного уровня сложности.
Часть 2 содержит 2 задания высокого уровня сложности (открытого типа). Для заданий открытого типа необходимо дать развернутый ответ.
К контрольной работе прилагаются:
бланк ответов для учащихся
инструкция
ответы
критерии оценивания
шкала перевода баллов в оценки.
Инструкция по выполнению работы.
На выполнение контрольной работы отводится 45 минут. Работа состоит из двух частей, включающих в себя 14 заданий.
Часть 1 содержит 12 заданий с кратким ответом.
При выполнении заданий 1-10 выберите номер одного правильного ответа из четырех предложенных и внесите его в бланк ответов. Максимальное количество баллов – 10 (по 1 баллу за задание)
При выполнении заданий 11-12 вам необходимо установить соответствие. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. Цифры занесите в бланк ответов. Максимальное количество баллов за каждое задание -2.
Часть 2 содержит 2 задания с развёрнутым ответом.
Для заданий 13-14 запишите развёрнутый ответ. Вам необходимо составить УХР, произвести расчеты. Максимальное количество баллов за каждое задание — 3.
Ответы заносите в бланк, записывайте чётко и разборчиво.
При выполнении работы вы можете пользоваться ПСХЭ Д.И. Менделеева, таблицей растворимости, электрохимическим рядом напряжений металлов и непрограммируемым калькулятором.
Ответы на задания необходимо вносить в бланк ответов.
Контрольная работа по теме «Металлы». 9 класс
1 часть
При выполнении заданий 1-10 выберите номер одного правильного ответа и внесите его в бланк ответов.
1. Наиболее ярко металлические свойства проявляет:
2. Ряд, в котором элементы расположены в порядке возрастания их атомного радиуса:
1) Al→Mg→Na
2) Ca→Ba→Be
3) K→Na→Li
4) K→Ca→Al
3. Электронная конфигурация внешнего электронного слоя….3s23p1 соответствует атому
1) скандия
2) бора
3) алюминия
4) калия
4. Реактивом на ион является ион:
1) СО32-
2) Na+
3) OH-
4) Cl-
5. Наиболее активно с водой при комнатной температуре будут взаимодействовать оба металла из пары:
1) Na и Cu
2) Na и K
3) K и Zn
4) Cu и Hg
6. С растворами кислот будут взаимодействовать оба металла
С растворами кислот будут взаимодействовать оба металла
1) Na и Cu
2) K и Hg
3) Al и Zn
4) Cu и Hg
7. При взаимодействии цинка с водой при нагревании образуется
1) соль и вода
2) основание и водород
3) оксид металла и водород
4) реакция не протекает
8. С водой с образованием основания и водорода будет взаимодействовать
9.Амфотерный оксид образуется при взаимодействии кислорода и
1) натрия
2) магния
3) бария
4) алюминия
10. Для вытеснения меди из раствора её соли можно использовать
1) кальций
2) цинк
3) литий
4) серебро
При выполнении заданий 11-12 вам необходимо установить соответствие. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. Цифры занесите в бланк ответов.
К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. Цифры занесите в бланк ответов.
11. Установите соответствие между исходными веществами и продуктами реакций
Исходные вещества | Продукты реакции |
А) NaCl+AgNO3→ Б) CuSO4+BaCl2→ В) Fe+CuCl2→ Г) NaOH+CuCl2→ | 1) CuOH↓+NaCl 2) Cu↓+FeCl2 3) Cu(OH)2+NaCl 4) NaNO3+AgCl 5) CuCl2+BaSO4↓ 6) Cu↓+FeCl3 |
12. Установите соответствие между веществами, вступающими в химическое взаимодействие и признаками данной реакции.
Взаимодействующие вещества | Признаки реакции |
А) цинк и соляная кислота Б) железо и раствор хлорида меди(II) В) раствор сульфата меди и раствор гидроксида калия Г) медь и конц. | 1) выделение бесцветного газа с резким запахом 2) выделение газа без цвета и запаха 3) выпадение красного осадка 4) выпадение голубого осадка |
2 часть
Для заданий 13-14 запишите развёрнутый ответ. Ответы заносите в бланк, записывайте чётко и разборчиво.
13. Мысленный эксперимент. Требуется получить гидроксид железа(II) в результате проведения двух последовательных реакций. Выберите необходимые для этого реактивы из числа тех, которые Вам предложены. Fe, НCl, NaOH, Н2О, Cl2
Запишите уравнения двух реакций. Для реакции обмена составьте сокращённое ионное уравнение.
14. Какая масса меди образуется при взаимодействии 2 моль железа с раствором, содержащим 16г сульфата меди(II)?
БЛАНК ОТВЕТОВ
Ф. И.______________________________ класс ____________________
И.______________________________ класс ____________________
1 часть
11.
12.
2 часть
13. Мысленный эксперимент
______________________________________________________________________
14. Задача
_________________________________________________________________________
Ответы и критерии оценивания
1 часть. Задания 1-10. Верное выполнение каждого из заданий оценивается 1 баллом. Неправильный ответ или его отсутствие – 0 баллов.
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
1 | 1 | 3 | 4 | 2 | 3 | 3 | 1 | 4 | 2 |
Задание 11, 12. Полный правильный ответ на каждое задание оценивается 2 баллами. Если допущена одна ошибка, то ответ оценивается в 1,5 балла, если две ошибки — 1 балл, 3 ошибки – 0,5 балла, 4 ошибки или отсутствие ответа — 0 баллов.
Полный правильный ответ на каждое задание оценивается 2 баллами. Если допущена одна ошибка, то ответ оценивается в 1,5 балла, если две ошибки — 1 балл, 3 ошибки – 0,5 балла, 4 ошибки или отсутствие ответа — 0 баллов.
11.
12.
2 часть. Критерии оценивания заданий с развёрнутым ответом
Часть 2
Критерии оценивания заданий с развёрнутым ответом
13. Мысленный эксперимент. Требуется получить гидроксид железа(II) в результате проведения двух последовательных реакций. Выберите необходимые для этого реактивы из числа тех, которые Вам предложены. Fe, НCl, NaOH, Н2О, Cl2
Запишите уравнения двух реакций. Для реакции обмена составьте сокращённое ионное уравнение.
Содержание верного ответа | Баллы |
Элементы ответа: Fe + 2HCl = FeCl2+ h3↑ FeCl2 + 2NaOH = 2NaCl + Fe(ОН)2↓ Fe2+ +2OH- = Fe(ОН)2 | 1 1 1 |
Максимальный балл | 3 |
14. Какая масса меди образуется при взаимодействии 2 моль железа с раствором, содержащим 16г сульфата меди(II)?
Какая масса меди образуется при взаимодействии 2 моль железа с раствором, содержащим 16г сульфата меди(II)?
Содержание верного ответа | Баллы |
Элементы ответа: Составлено уравнение реакции: CuSO4+ Fe → FeSO4+Cu Найдено количество вещества CuSO4 = 16г/160г/моль = 0,1 моль Определен избыток Fe; n(Fe) > n(CuSO4) Определено количество меди: n(Cu) = n(CuSO4) = 0,1 моль Рассчитана масса меди m(Cu) = 0,1моль × 64г/моль= 6,4 г. | 1 0,5 0,5 0,5 0,5 |
Максимальный балл | 3 |
Максимальный балл за работу – 20.
Перевод баллов в оценку
Кол-во баллов | Менее 6 | 6-12 | 12,5-17 | 17,5-20 |
оценка | 2 | 3 | 4 | 5 |
Контрольная работа «Металлы» (9 класс)
Контрольная работа № 1 по теме «Металлы»
Химия 9 класс
Вариант – 1
Часть 1.
1. Электронная формула атома магния:
1)1s22s2 2) 1s22s2 2p63s2 3) 1s22s2 2p63s1 4) 1s22s2 2p63s23p2
2. Число электронов на внешнем электронном слое у атомов щелочных металлов:
Число электронов на внешнем электронном слое у атомов щелочных металлов:
1) один 2) три 3) два 4) четыре
3. Тип химической связи в простом веществе литии:
1) ионная 2) ковалентная полярная3) ковалентная неполярная4)металлическая
4.Реакция взаимодействия цинка с соляной кислотой относится к реакциям
А)окислительно-восстановительным, обмена
Б)обратимым, замещения
В) окислительно-восстановительным, замещения
Г)необратимым, обмена
5.Металлические свойства ярче выражены у
1) калия 2) бериллия 3) бария 4) кальция
6. Гидроксид цинка взаимодействует с каждым из двух веществ:
1) HCl и CO2 2) NaOH и H2SO4 3) SiO2 и KOH 4) NaNO3 и H2SO4
7. Ионы серебра Аg+ можно обнаружить в растворе с помощью
1) нитрата серебра 2) соляной кислоты 3) гидроксида натрия 4) лакмуса
Часть 2.
8. Осуществить цепочку превращений
Fe = FeCl2 = Fe(OH)2
9.Расставить коэффициенты методом электронного баланса
Сu+HNO3(разб)=Cu(NO3)2+NO+h3O
10.Вычислите массу оксида цинка, который образуется при взаимодействии 13 г. цинка с кислородом (запишите в ответе число с точностью до целых).
Контрольная работа № 1 по теме «Металлы»
Химия 9 класс
Вариант – 2
Часть 1.
1. Электронная формула атома алюминия:
1)1s22s22р1 2) 1s22s2 2p63s2 3) 1s22s2 2p63s23р1 4) 1s22s2 2p63s23p3
2. Число электронов на внешнем электронном слое у атомов щелочноземельных металлов:
Число электронов на внешнем электронном слое у атомов щелочноземельных металлов:
1)Один 2) три 3) два 4) четыре
3.Тип химической связи в простом веществе натрий:
1) ионная 2) ковалентная полярная3) ковалентная неполярная4)металлическая
4. В каком ряду химические элементы расположены в порядке увеличения их атомного радиуса?
1) Na, Mg, Al 2) Al, Mg, Na 3) K, Na, Li 4) Mg, Be, Ca
5.К окислительно-восстановительным не относится реакция, уравнение которой
А)CuCl2 + Fe = FeCl2 + Cu
Б)CuO + H2SO4 = CuSO4 + H2O
В)2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
Г)2Na + 2H2O = 2NaOH + H2↑
6. Оксид алюминия взаимодействует с каждым из двух веществ:
1) HCl и O2 2) КOH и H2О 3) HCl и KOH 4) NaNO3 и H2SO4
7. Реактивом на катион Ва2+ является раствор
Реактивом на катион Ва2+ является раствор
1) гидроксида натрия 2) соляной кислоты 3) нитрата серебра 4) серной кислоты
Часть 2.
8. Осуществить цепочку превращений
Fe = FeCl2 = Fe(OH)2
9.Расставить коэффициенты методом электронного баланса
H2S + HNO3 H2SO4 + NO2 + H2O
10.Вычислите массу оксида цинка, который образуется при взаимодействии 13 г. цинка с кислородом (запишите в ответе число с точностью до целых).
Контрольная работа по теме «Металлы». 9 класс. на Сёзнайке.ру
Часть 1.
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А 1. Электронная формула атома магния:
Электронная формула атома магния:
1) 1s2 2s2 3) 1s2 2s3
2) 1s2 2s2 2p1 4) 1s2 2s2 2p6 3 s2
А 2. Электронная формула внешнего энергетического уровня атомов элементов главной подгруппы II группы ПС:
1) n s1 2) n s2 3) n s2 n p1 4) n s2 n p2
А 3. Простое вещество с наиболее ярко выраженными металлическими свойствами:
1) бериллий 3) магний
2) кальций 4) стронций
А 4. Наиболее энергично взаимодействует с водой:
1) калий 3) кальций
2) скандий 4) магний
А 5. С разбавленной серной кислотой не взаимодействует:
1) железо 3) платина
2) никель 4) цинк
А 6. Верны ли следующие суждения о щелочных металлах?
Верны ли следующие суждения о щелочных металлах?
А. Во всех соединениях они имеют степень окисления + 1.
Б. С неметаллами они образуют соединения с ионной связью.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
Часть 2.
В задании В1 на установление соответствия запишите последовательность цифр без пробелов и других символов.
В1. Установите соответствие между элементом и формулой его высшего оксида.
ЭЛЕМЕНТ ВЫСШИЙ ОКСИД
А) Cs 1) ЭО3
Б) Al 2) Э2О5
В) Ca 3) Э2О
Г) K 4) Э2О3
5) ЭО
6) Э2О7
Ответом к заданию В 2 является последовательность цифр в порядке возрастания.
В 2. Вещества, которые взаимодействуют с цинком:
1 HCl 4) CaO
2) NaOH 5) O2
3) H2SO4 6) CO2
Часть 3
Запишите номер задания и дайте полный ответ.
С 1. По схеме превращений составьте уравнения реакций в молекулярном виде. Для превращения № 3 запишите полное и сокращенное ионные уравнения. Назовите все вещества.
Cu(OH)2? CuO ? CuSO4? Cu(OH)2? Cu(NO3)2
▶▷▶ контрольная работа по теме металлы. 9 класс. ответы
▶▷▶ контрольная работа по теме металлы. 9 класс. ответы| Интерфейс | Русский/Английский |
| Тип лицензия | Free |
| Кол-во просмотров | 257 |
| Кол-во загрузок | 132 раз |
| Обновление: | 30-11-2018 |
контрольная работа по теме металлы 9 класс ответы — Yahoo Search Results Yahoo Web Search Sign in Mail Go to Mail» data-nosubject=»[No Subject]» data-timestamp=’short’ Help Account Info Yahoo Home Settings Home News Mail Finance Tumblr Weather Sports Messenger Settings Want more to discover? Make Yahoo Your Home Page See breaking news more every time you open your browser Add it now No Thanks Yahoo Search query Web Images Video News Local Answers Shopping Recipes Sports Finance Dictionary More Anytime Past day Past week Past month Anytime Get beautiful photos on every new browser window Download Контрольная работа по теме » Металлы » 9 класс videourokinet/razrabotki/kontrol-naia-rabota-po Cached 9класс Контрольная работа №2 по теме « Металлы » Вариант 1 Часть А При выполнении заданий выберите номер одного правильного ответа Контрольная работа на тему « Металлы » ( 9 класс Габриелян — 1 superhimikru/ 9 -klass/tema-metally-1-varianthtml Cached Контрольная работа на тему « Металлы » ( 9 класс Габриелян — 1 вариант) ЧАСТЬ А Тестовые задания с выбором ответа контрольная работа по химии по теме » Металлы » 9 класс nsportalru/shkola/khimiya/library/2015/02/13/ Cached Ответы на часто задаваемые вопросы контрольная работа по химии по теме » Металлы » 9 класс Контрольная Работа По Теме Металлы 9 Класс Ответы — Image Results More Контрольная Работа По Теме Металлы 9 Класс Ответы images Контрольная работа по Химии « Металлы » 9 класс globuss24ru/doc/kontrolynaya-rabota-po-himii Cached 9 класс Контрольная работа № 1 по теме : « Металлы » Вариант i ЧАСТЬ А Тестовые задания с выбором ответа Контрольная работа « Металлы » 9 класс globuss24ru/doc/kontrolynaya-rabota-metalli- 9 -klass Cached Контрольная работа №1 по теме : « Металлы » Вариант 1 ЧАСТЬ A Тестовые задания c выбором ответа 1 (3 балла) Распределение электронов по энергетическим уровням в атоме магния: A 2е, 2е Контрольная работа № 2 по теме : « Металлы » 9 класс infourokru/materialhtml?mid=37872 Cached Контрольная работа № 2 по теме : « Металлы » Вариант 1 9 класс 1 Составьте электронную схему атома, электронную и графическую формулу для химического элемента с порядковым номером 19, с помощью которой дайте ответы на Химия 9 класс Контрольные и проверочные работы Габриелян ОС allengorg/d/chem/chem56htm Cached Настоящее Пособие состоит из текстов контрольных и проверочных работ, соответствующих программе по Химии для 9 класса О С Габриеляна Контрольная работа по химии в 9 классе по теме : » Металлы kopilkaurokovru/himiya/testi/kontrol-naia Cached Контрольная работа по химии в 9 классе за 1 полугодие по теме « МЕТАЛЛЫ » Цель: проверка уровня усвоения учебного материала учащихся по теме « Металлы » Контрольная работа по теме » Металлы » 9 класс librepetitorseu/himiya/61-2009-12-09-07-30-21/1256—qq- 9 — Cached Контрольная работа по теме » Металлы » 9 класс Часть 1 При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует Контрольная работа № 1 по теме « Металлы » 9 класс | Контент pandiaru/text/77/481/8695php 211112 Контрольная работа № 1 по теме « Металлы » 9 класс Вариант 1 1Составьте уравнения реакций, характеризующих химические свойства металлического Promotional Results For You Free Download | Mozilla Firefox ® Web Browser wwwmozillaorg Download Firefox — the faster, smarter, easier way to browse the web and all of Yahoo 1 2 3 4 5 Next 57,300 results Settings Help Suggestions Privacy (Updated) Terms (Updated) Advertise About ads About this page Powered by Bing™
- 18
- 18
- которые самостоятельно готовятся к сдаче экзаменов ОГЭ или ЕГЭ по химии Читать ещё Тест « Металлы » ( 9 класс ) с ответами поможет подготовиться к итоговой или тематической контрольной работе ; он будет полезен и тем ребятам
ответы Характеристика заданий
химия 9 класс Контрольная работа содержит 4 варианта+критерии оценки+ ответы Контрольная _ работа Металлы 9 класс docx Скачать Посмотреть Комментарии (0) Добавить комментарий Отправить Наталья Горшкова Все материалы автора Скрыть Ответы на контрольную работу по теме « Металлы » 9classru › 16-metally-9-klass-gabrielyanhtml Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте ЧАСТЬ А Тестовые задания с выбором ответа 1 Распределение электронов по энергетическим уровням в атоме магния: Г 2е
- easier way to browse the web and all of Yahoo 1 2 3 4 5 Next 57
- с помощью которой дайте ответы на Химия 9 класс Контрольные и проверочные работы Габриелян ОС allengorg/d/chem/chem56htm Cached Настоящее Пособие состоит из текстов контрольных и проверочных работ
- smarter
контрольная работа по теме металлы 9 класс ответы — Все результаты Тест по химии (9 класс) на тему: Контрольная работа по химии по 28 февр 2016 г — Контрольная работа (в форме теста) по теме » Металлы » , два варианта, спецификация, ответы , работа на 45 минут Контрольная работа по теме Металлы (9 класс) — Инфоурок › Химия Похожие библиотека материалов 9 класс Контрольная работа № 1 по теме : « Металлы » Вариант I Ответ подтвердите уравнениями реакций 12 (6 баллов) Контрольная работа по теме «Металлы (9 класс) — Инфоурок › Химия 5 сент 2018 г — Cкачать: Контрольная работа по теме » Металлы 9 класс За каждый правильный ответ в задании В1 дается по 2 балла (1 балл за Контрольная работа по химии в 9 классе к УМК ОСГабриеляна › Химия Похожие 14 дек 2015 г — Контрольная работа по химии в 9 классе к УМК ОСГабриеляна по класса содержания учебного материала по теме « Металлы » по предмету химия При выполнении заданий этой части в бланке ответов под Ответы на контрольную работу по теме «Металлы» (Габриелян) 9classru/16-metally-9-klass-gabrielyanhtml Похожие Ответы на контрольную работу по теме « Металлы » (Габриелян) Вариант 1 8 С разбавленной серной кислотой не взаимодействует: В Платина 9 Контрольная работа по теме «Металлы» (9 класс, химия) — Знанио Контрольная работа по теме » Металлы » ( 9 класс , химия) — в разделе Рабочие тетради, по направлениям Химия, Методические и учебные материалы Контрольная работа по теме «Металлы»,9класс Все для учителя 14 нояб 2012 г — Без рубрики УМК ОСГабриелян,химия 9 класс Контрольная работа содержит 4 варианта+критерии оценки+ ответы document Контрольная работа по химии в 9 классе по теме :»Металлы Похожие 10 апр 2016 г — Контрольная работа по химии в 9 классе по теме :» Металлы » Нажмите 2) соляная кислота, кислород 5)оксид углерода(2), азот Ответ : Ответы@MailRu: Контрольная работа по химии по теме «Металлы» 9 › Домашние задания › Другие предметы Похожие 2 ответа 27 нояб 2017 г — первое не знаю) 2)Са + Н2О= Са (ОН) 2 СаSO4 + Ba(OH)2= Ca(OH)2 + BaSO4 4CaO + 2h3= 2Ca(OH)2 Контрольная работа по теме «Металлы» 9 Класс — Doc4webru Похожие Скачать к уроку химии Контрольная работа по теме « Металлы » 9 Класс На 2 , 5, 18, 19 и 20 задание необходимо дать самостоятельный ответ Контрольная работа по теме «Металлы» (Химия 9 класс) 9 февр 2018 г — Контрольная работа по теме » Металлы » (Химия 9 класс ) разработана на 2 варианта Цель: контроль за усвоением знаний по разделу Контрольная работа по теме «Металлы» 9 класс — Мультиурок Похожие 9 янв 2015 г — Контрольная работа в 9 классе завершает тему « Металлы », она Ответ подтвердите примерами конкретных физических и Контрольная работа по теме «Металлы» 9 класс — Видеоуроки 11 апр 2017 г — Контрольная работа по теме » Металлы » составлена в виде теста, состоящего из двух частей: 1 часть с выбором ответа, 2 часть Контрольная работа по химии для учащихся 9 класса по теме КОНТРОЛЬНАЯ РАБОТА по химии для учащихся 9 класса по теме : ” Металлы ” Вариант №1 ЧАСТЬ А Тестовые задания с выбором ответа (2 балла) Контрольная работа для 9 класса по теме «Металлы» по учебнику wwwobrazbaseru//1076-kontrolnaya-rabota-dlya-9-klassa-po-teme-metally-po-uch Похожие Рейтинг: 2 — 1 голос 6 мар 2015 г — Конспекты уроков, рабочие программы, планирование и методические материалы по химии Контрольная работа по теме Металлы 9 класс | Образовательный 20 февр 2017 г — Контрольная работа №2 « Металлы » 9 класс Автор Обливанова СВ « Сусанинская средняя школа» п Сусанино 2016 год Кодификатор Шаповалова ИА Контрольная работа по химии для 9 класса по viouchiminfo/Vio_124/cd_site/articles/art_3_1htm Похожие Контрольная работа по химии для 9 класса по теме : « Металлы » Часть А: Включает тестовые задания, требующие найти один верный ответ (1- балл) Контрольная работа по теме «Металлы» 9 класс на Сёзнайкеру wwwseznaikaru › Химия/ › Контрольные/ Контрольная работа по теме » Металлы » 9 класс Часть 1 При выполнении заданий Запишите номер задания и дайте полный ответ С 1 По схеме Металлы 9 Класс Проверочная Работа o96463lgbegettech/металлы%209%20класс%20проверочная%20работа Вопросы и ответы «металлы 9 класс проверочная работа»: Вопрос: Контрольная Работа По Химии Номер 1 По Теме Металлы 9 Класс Осуществить Контрольная работа для 9 класса за I четверть к учебнику «Химия для 9 класса за I четверть к учебнику «Химия 9 класс » по теме : Металлы 1 2 Контрольная работа для 9 класса за II четверть к учебнику «Химия 9 Часть А К каждому заданию части А даны несколько ответов , из которых Контрольная работа по теме «Металлы» (9 класс, коррекция pedsovetsu › Файлы для скачивания › Материалы для коррекц классов › Химия Похожие 27 мар 2012 г — Контрольная работа в 9 классе завершает тему « Металлы », она рассчитана на академический час и позволяет проверить качество тест по теме металлы 9 класс 1 вариант срочно!!!пж часть B и C › 5 — 9 классы › Химия Рейтинг: 1,5 — 2 голоса 15 дек 2016 г — Найди ответ на свой вопрос: тест по теме металлы 9 класс 1 вариант срочно !!!пж часть B и C ▷ контрольная работа металлы и их соединения 9 класс 1 вариант wwwzstelceu//kontrolnaia-rabota-metally-i-ikh-soedineniia-9-klass-1-variantxml 4 нояб 2018 г — контрольная работа металлы и их соединения 9 класс 1 вариант украина 9 класс Ответы @MailRu: Контрольная работа по теме : Проверочная работа по теме: «Металлы главных подгрупп» для 9 «metalli_glavnih_podgru_19462 Похожие 23 нояб 2015 г — Контрольная / проверочная работа для учителя-предметника для 9 класса Учебно-дидактические материалы по Химии для 9 класса главных подгрупп» для 9 классов I часть: выберите правильный ответ [DOC] 14 Контрольная работа по теме: Металлы 9 класс Курлаева ЕВ school80rdru//Контрольная%20работа%20по%20темеМеталлы%209%20класс Учебник: Габриелян ОС Химия 9 класс Тема : Металлы Контрольная работа состоит из 9 заданий: 7 заданий базового уровня, 2 — повышенного При выполнении заданий этой части в бланке ответов под номером Контрольная работа по теме «Металлы» Похожие 18 нояб 2014 г — Скачать: контрольная работа по теме металлы Определите, к какому классу относится вещество, имеющее ( Ответ : 1435, 9 кг ) Контрольная работа по теме Металлы (9 класс) — БОТАН › Учителю › Химия 23 авг 2015 г — 9 класс Контрольная работа № 1 по теме : « Металлы » Вариант I ЧАСТЬ А Тестовые Ответ подтвердите уравнениями реакций ЗАВУЧинфо — Методическая библиотека | Химия | Контрольные wwwzavuchru/methodlib/134/?pg=2 Похожие Тестовая контрольная работа по теме : » Металлы » ( 9 класс ) Работа содержит тестовые задания с вариантами ответов , а также расчетные задачи Урок №56 Контрольная работа №3 по теме «Металлы» — ХиМуЛя Похожие Звонок на урок > 9 класс — второй год обучения > Урок №56 Контрольная работа №3 по теме « Металлы » Версия №1 Обязательная часть 1 Картинки по запросу контрольная работа по теме металлы 9 класс ответы «id»:»kYE5jazFGXAcuM:»,»ml»:»600″:»bh»:90,»bw»:120,»oh»:720,»ou»:» «,»ow»:960,»pt»:»ds04infourokru/uploads/ex/1290/00068eb7-80049e71″,»rh»:»infourokru»,»rid»:»DSxBYXada5BQQM»,»rt»:0,»ru»:» «,»sc»:1,»st»:»Инфоурок»,»th»:90,»tu»:» \u003dtbn:ANd9GcTab6fz90P-yeKh4-77f9jqTwmDTw3pU30q0DnFK_UKXKCw2N-5nC67Wg»,»tw»:120 «cb»:12,»cl»:12,»cr»:6,»ct»:6,»id»:»uZKseX3TPKRVnM:»,»ml»:»600″:»bh»:90,»bw»:53,»oh»:708,»ou»:» «,»ow»:500,»pt»:»znanioru/static/files/cache/2d/43/2d43ea7e3c9761d»,»rh»:»znanioru»,»rid»:»iucGSigGZ3rC0M»,»rt»:0,»ru»:» «,»sc»:1,»st»:»Знанио»,»th»:99,»tu»:» \u003dtbn:ANd9GcRIW6c5i5Twm04IZWJf2Vn2TRU-EsZr21dTW5JWD8Ghx4lByVkmQB8n4Ko»,»tw»:70 «cb»:6,»cl»:12,»cr»:6,»ct»:12,»id»:»_AIBF-uRgS-WqM:»,»ml»:»600″:»bh»:90,»bw»:53,»oh»:708,»ou»:» «,»ow»:500,»pt»:»znanioru/static/files/cache/88/33/88336b2bc5bac4f»,»rh»:»znanioru»,»rid»:»iucGSigGZ3rC0M»,»rt»:0,»ru»:» «,»sc»:1,»st»:»Знанио»,»th»:99,»tu»:» \u003dtbn:ANd9GcSjsumrI-0mAh_zYQIr2w1x32HsF-SoBbVC_3eqTEISLVsPTCq-hl_6W6o»,»tw»:70 «cb»:21,»cl»:12,»cr»:3,»ct»:6,»id»:»ke11IPMlB80RJM:»,»ml»:»600″:»bh»:90,»bw»:55,»oh»:708,»ou»:» «,»ow»:500,»pt»:»znanioru/static/files/cache/44/91/44915e1dce69821″,»rh»:»znanioru»,»rid»:»iucGSigGZ3rC0M»,»rt»:0,»ru»:» «,»sc»:1,»st»:»Знанио»,»th»:99,»tu»:» \u003dtbn:ANd9GcQwHhePWMgPL1yY75f_ei6rCDtGHNBjDXHu-B1XAzK6vBO3cLjzyPtw9zw»,»tw»:70 «cb»:9,»cl»:6,»cr»:6,»ct»:6,»id»:»Y71slxG5C1YUxM:»,»ml»:»600″:»bh»:90,»bw»:57,»oh»:230,»ou»:» «,»ow»:163,»pt»:»znanioru/static/files/cache/0f/cc/0fccc9cd48cde7c»,»rh»:»znanioru»,»rid»:»UK-IPFqzN6C0gM»,»rt»:0,»ru»:» «,»sc»:1,»st»:»Знанио»,»th»:99,»tu»:» \u003dtbn:ANd9GcSAT7d4K9gRthGVGbjpWbDaqaOljnTec70o0Ow4etf9-HKznPHUM1HEhw»,»tw»:70 «id»:»fla7Ro1qE9VarM:»,»ml»:»600″:»bh»:90,»bw»:120,»oh»:720,»ou»:» «,»ow»:960,»pt»:»ds04infourokru/uploads/ex/1290/00068eb7-80049e71″,»rh»:»infourokru»,»rid»:»DSxBYXada5BQQM»,»rt»:0,»ru»:» «,»sc»:1,»st»:»Инфоурок»,»th»:90,»tu»:» \u003dtbn:ANd9GcRr9s9KEP8wwE1b0HeYehGAExct-oI1RDwbk3C7MHnWvN_mi4tdY0yDZxc»,»tw»:120 «id»:»CO-O2swuoojpkM:»,»ml»:»600″:»bh»:90,»bw»:118,»oh»:720,»ou»:» «,»ow»:960,»pt»:»ds04infourokru/uploads/ex/1290/00068eb7-80049e71″,»rh»:»infourokru»,»rid»:»DSxBYXada5BQQM»,»rt»:0,»ru»:» «,»sc»:1,»st»:»Инфоурок»,»th»:90,»tu»:» \u003dtbn:ANd9GcSFUivaKb2NPPFHMT1u_-v-TTLcazByHqJWqMenmVgMBqvU1sabnYf5bQ»,»tw»:120 Другие картинки по запросу «контрольная работа по теме металлы 9 класс ответы» Жалоба отправлена Пожаловаться на картинки Благодарим за замечания Пожаловаться на другую картинку Пожаловаться на содержание картинки Отмена Пожаловаться Все результаты Контрольная работа по теме «Металлы» 9 класс | Ответы по химии mendeleiru/kontrolnye-raboty/item/10121/ Похожие Задание 1 Напишите уравнения реакций, характеризующих химические свойства натрия Два уравнения взаимодействия с простыми веществами, два Контрольная работа + презентация по теме «Металлы», Химия, 9 journal-biptinfo › Предметы › Химия › Дидактические материалы Контрольная работа + презентация по теме « Металлы », Химия, 9 класс Контрольная До 33%- ниже 9 правильных ответов оценка«2», 34-46% «3» Тест по химии на тему «Металлы» (8-9 класс) Похожие Тест по химии на тему » Металлы » (8- 9 класс ) В науке химии очень много сложных формул, правил и законов Однако от этого она не перестает быть Контрольная работа металлы и их соединения | ВКонтакте Похожие контрольная работа по теме металлы и их соединения 9 класс ответы Бериллий, магний и щелочноземельные металлы , их соединения ▷ контрольная работа металлы и их соединение 1 вариант training-accesscom/upload/kontrolnaia-rabota-metally-i-ikh-soedinenie-1-variantxml 5 дней назад — Download Контрольная работа в 9 классе по теме » Металлы » Решебник по химии за 9 класс к дидактическому материалу АМ Контрольные и проверочные работы к учебнику ОС Габриеляна superhimikru/9-klass/kontrolnye-i-proverochnye-raboty-k-uchebniku-o-s-gabrielyan Похожие Контрольные и проверочные работы к учебнику ОС Габриеляна (Химия 9 класс ) Металлы himiya9kontrgabr 1 вариант · 2 вариант · 3 вариант Итоговая контрольная работа по теме «Неметаллы» Вариант 1 · Вариант 2 Контрольная работа №1 «Металлы» — Химическая провинция myhimsiteru/kontrolnaya-rabota-1-metally Похожие Контрольная работа по теме : Металлы и их соединения 9 Как называется соединение кальция, которое в обязательном порядке входит в состав эмали и его тривиальным названием, ответ дайте в виде последовательности цифр, Сравнительная характеристика металлов и неметаллов 9 класс Контрольная работа по химии по теме металлы 9 класс ответы — Автор mamagadanru/converge_local/talk/?viewforum=3&viewtopic=528 24 февр 2012 г — Тема форума Контрольная работа по химии по теме металлы 9 класс ответы — общение для школьников, абитуриентов и студентов Контрольные и проверочные работы к учебнику В В Еремина, Н Е Андрей Дроздов , Вадим Ерёмин — 2018 — Psychology 88 Проверочная работа 91 КОНТРОЛЬНАЯ РАБОТА 3 94 МЕТАЛЛЫ Общие свойства элементов- металлов 126 ОТВЕТЫ К ТЕСТАМ Еремин Вадим Владимирович Дроздов Андрей Анатольевич ХИМИЯ 9 159 Решение цепочек превращений по химии — YouTube Похожие ▶ 9:32 12 мар 2015 г — Добавлено пользователем День знаний Разбор принципов решения цепочек превращения по химии на примерах Ссылки на плейлисты с цепочками превращений: 1) Цепочки «Мечта и реальность»: аргументы для итогового сочинения 2018 › › Направление «Мечта и реальность» 2 сент 2018 г — Сборник аргументов из литературы по направлению «Мечта и реальность» для итогового сочинения в 11 классе в 2019/2019 учебном «Доброта и жестокость»: аргументы из литературы для итогового › › Направление «Доброта и жестокость» 2 сент 2018 г — Аргументы на темы «Доброта и жестокость» В ответ Савельевич также проявляет доброту и в свое время уговаривает палачей не контрольный тест в 9 классе по теме » Металлы» | Открытый класс wwwopenclassru › Сообщества › «Балаковочка» Похожие 20 дек 2010 г — контрольный тест по теме металлы docx, 321 KB Контрольная работа по теме » Металлы » в это году прошла, поэтому решила использовать на На: контрольный тест в 9 классе по теме » Металлы » Размещено Решебник (ГДЗ) по химии за 10 класс › ГДЗ › 10 класс › Химия Похожие теоретический материал, а также готовиться контрольным и самостоятельным ГДЗ по химии для 10 класса позволит облегчить процесс выполнения Все для студента Дипломная работа : методика подготовки и защиты874 Диссертационная Публицистика43 Работа и бизнес3 и образование256 Разные темы 4 Пояснения к фильтрации результатов Мы скрыли некоторые результаты, которые очень похожи на уже представленные выше (50) Показать скрытые результаты Вместе с контрольная работа по теме металлы 9 класс ответы часто ищут контрольная работа по химии 9 класс металлы 4 варианта контрольная работа по химии 9 класс металлы 4 варианта ответы тест по теме металлы 9 класс ответы 3 вариант тест по теме металлы 9 класс 1 вариант контрольная работа по теме металлы 11 класс ответы контрольная работа по химии 9 класс металлы 2 варианта контрольная работа номер 1 по химии 9 класс металлы контрольная работа по теме металлы 9 класс габриелян Ссылки в нижнем колонтитуле Россия — Подробнее… Справка Отправить отзыв Конфиденциальность Условия Аккаунт Поиск Карты YouTube Play Новости Почта Контакты Диск Календарь Google+ Переводчик Фото Ещё Документы Blogger Hangouts Google Keep Подборки Другие сервисы Google
Яндекс Яндекс Найти Поиск Поиск Картинки Видео Карты Маркет Новости ТВ онлайн Знатоки Коллекции Музыка Переводчик Диск Почта Все Ещё Дополнительная информация о запросе Показаны результаты для Нижнего Новгорода Москва 1 Тест по химии ( 9 класс ) на тему : Контрольная работа по nsportalru › …kontrolnaya-rabota-po…teme-metally…9 Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Сайт – выбор пользователей Подробнее о сайте Контрольная работа (в форме теста ) по теме » Металлы » , два варианта, спецификация, ответы Характеристика заданий , используемых в контрольной работе контрольной работы по теме : « Металлы » для 9 класса по химии В работу включены задания , ориентированные на проверку усвоения Читать ещё Контрольная работа (в форме теста ) по теме » Металлы » , два варианта, спецификация, ответы , работа на 45 минут Характеристика заданий , используемых в контрольной работе контрольной работы по теме : « Металлы » для 9 класса по химии В работу включены задания , ориентированные на проверку усвоения элементов содержания четырех блоков учебного материала: «Вещество», «Химическая реакция», «Элементарные основы неорганической химии», «Познание и применение веществ и химических реакций» Скрыть 2 Контрольная работа по теме » Металлы » 9 класс videourokinet › razrabotki…rabota-po…9-klasshtml Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте работа по теме » Металлы » составлена в виде теста , состоящего из двух частей: 1 часть с выбором ответа , 2 часть содержит задания с полным 5Наиболее активно с водой при комнатной температуре будут взаимодействовать оба металла из пары а) Na и Cu б) Li и Na в) K и Mg г) Cu и Hg 6С растворами кислот Читать ещё Контрольная работа по теме » Металлы » составлена в виде теста , состоящего из двух частей: 1 часть с выбором ответа , 2 часть содержит задания с полным, развернутым ответом 5Наиболее активно с водой при комнатной температуре будут взаимодействовать оба металла из пары а) Na и Cu б) Li и Na в) K и Mg г) Cu и Hg 6С растворами кислот будут взаимодействовать оба металла а) Li и Ag б) Na и Hg в) K и Mg г) Cu и Hg 7 При взаимодействии железа с водой при нагревании образуется а) соль и вода в) оксид металла и водород б) основание и водород г) реакция не протекает 8 С водой с образованием основания и водорода будет взаимодействовать а) Са б) Сu в) Zn г) Ag Скрыть 3 Контрольная работа по химии » Металлы » 9 класс скачать uchitelyacom › …kontrolnaya…po…metally-9-klasshtml Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Контрольная работа по химии для 9 класса Тема « Металлы » подготовила Обработка результатов контрольной работы Работа оценивается в 25 баллов Тестовые ответы части «А» оцениваются Читать ещё Контрольная работа по химии для 9 класса Тема « Металлы » подготовила учитель химии Обработка результатов контрольной работы Работа оценивается в 25 баллов Тестовые ответы части «А» оцениваются одним баллом каждое В части «Б» количество баллов определяется уровнем Скрыть 4 Контрольная работа по теме « Металлы » 9 Класс doc4webru › …kontrolnaya…po-teme-metalli-klasshtml Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Аургазинский район Республика Башкортостан Контрольная работа 1 по теме « Металлы » Работа состоит из 20 заданий К заданию приводится 4 варианта ответа , один из которых верный На 2 , 5, 18, 19 и 20 задание необходимо дать Читать ещё Аургазинский район Республика Башкортостан Контрольная работа 1 по теме « Металлы » Инструкция по выполнению работы На выполнения контрольной работы по химии дается 40 минут Работа состоит из 20 заданий К заданию приводится 4 варианта ответа , один из которых верный На 2 , 5, 18, 19 и 20 задание необходимо дать самостоятельный ответ Для определения легких и тяжелых металлов необходимо использовать справочник Выполняйте задания в том порядке, в котором они даны Если какое-то задание вызывает у вас затруднения, пропустите его и постарайтесь выполнить те, в ответах на которые вы уверены К Скрыть 5 Контрольная работа по теме » Металлы » 9 класс infourokru › kontrolnaya-rabota…teme-metalli-klass… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Сайт – выбор пользователей Подробнее о сайте Инфоурок › Химия › Тесты › Контрольная работа по теме » Металлы » 9 класс 5радиус атомов элементов 2го периода с увеличением заряда ядра от щелочного металла к галогену Ответ подтвердите уравнения реакции Читать ещё Инфоурок › Химия › Тесты › Контрольная работа по теме » Металлы » 9 класс Контрольная работа по теме » Металлы » 9 класс библиотека материалов Контрольная работа по теме « Металлы » 9 класс , ФИ_ Вариант 1 5радиус атомов элементов 2го периода с увеличением заряда ядра от щелочного металла к галогену: А) изменяется периодически Б) не изменяется Ответ подтвердите уравнения реакции _12 Напишите уравнения реакций согласно схеме: Fe(OH)3 – X – Y – Z — Fe 2 O3 Контрольная работа по теме « Металлы » 9 класс , ФИ_ Вариант 2 Скрыть 6 Тест по теме Металлы ( 9 класс ) с ответами obrazovakaru › test/po-teme-metally-9-klass-s… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Тест « Металлы » ( 9 класс ) с ответами поможет подготовиться к итоговой или тематической контрольной работе ; он будет полезен и тем ребятам, которые самостоятельно готовятся к сдаче экзаменов ОГЭ или ЕГЭ по химии Читать ещё Тест « Металлы » ( 9 класс ) с ответами поможет подготовиться к итоговой или тематической контрольной работе ; он будет полезен и тем ребятам, которые самостоятельно готовятся к сдаче экзаменов ОГЭ или ЕГЭ по химии Рейтинг теста А какую оценку получите вы? Чтобы узнать — пройдите тест Скрыть 7 Контрольная работа по теме Металлы ( 9 класс ) infourokru › kontrolnaya-rabota…teme-metalli-klass… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Сайт – выбор пользователей Подробнее о сайте по теме : « Металлы » Вариант I ЧАСТЬ А Тестовые задания с выбором ответа 1 (2 балла) Рассчитайте массу металла , который можно получить из 144 г оксида железа (II) 9 класс Контрольная работа № 1 Читать ещё по теме : « Металлы » Вариант I ЧАСТЬ А Тестовые задания с выбором ответа 1 (2 балла) Электронная формула атома магния Рассчитайте массу металла , который можно получить из 144 г оксида железа (II) 9 класс Контрольная работа № 1 по теме : « Металлы » Вариант II ЧАСТЬ А Тестовые задания с выбором ответа 1 (2 балла) Электронная формула атома лития Скрыть 8 КОНТРОЛЬНАЯ РАБОТА по теме металлы 9 Класс Ответы — смотрите картинки ЯндексКартинки › контрольная работа по теме металлы 9 класс Пожаловаться Информация о сайте Ещё картинки 9 Контрольная работа по теме » Металлы «, химия, 9 класс multiurokru › files/kontrol-naia-rabota-po…9-khtml Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Контрольная работа по химии для 9 класса по теме » Металлы » (Рудзитис Г Е), 4 варианта При выполнении заданий выберите номер одного правильного ответа 1Наиболее сильные восстановительные свойства проявляет Читать ещё Контрольная работа по химии для 9 класса по теме » Металлы » (Рудзитис Г Е), 4 варианта При выполнении заданий выберите номер одного правильного ответа 1Наиболее сильные восстановительные свойства проявляет а) K б) Mg в) Li г) Na 2Ряд, в котором элементы расположены в порядке возрастания их атомного радиуса: а) B→Be→Li в) K→Na→Li б) Mg→Ca→Be г) Na→Mg→Al 3Электронная конфигурация внешнего электронного слоя…2s22p1 соответствует атому Скрыть 10 Контрольная работа по теме » Металлы «, 9 класс kopilkaurokovru › himiya/uroki…rabota-po…9-klass Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте На выполнение контрольной работы по теме Металлы отводится 45 минут Работа состоит из 3 частей и включает 10 За каждый правильный ответ в задании В1 дается по 2 балла (1 балл за формулу вещества и 1 балл за его химическое название) Максимальный балл за задание В1 – 8 баллов За каждый Читать ещё На выполнение контрольной работы по теме Металлы отводится 45 минут Работа состоит из 3 частей и включает 10 заданий Часть А включает 6 заданий базового уровн За каждый правильный ответ в задании В1 дается по 2 балла (1 балл за формулу вещества и 1 балл за его химическое название) Максимальный балл за задание В1 – 8 баллов За каждый правильный ответ в задании В2 дается по 1 баллу Максимальный балл за задание В2 – 4 балла Часть С содержит два наиболее сложных, объемных заданий Задание С1 требует полного ответа , а именно записи уравнений химических реакций согласно генетическому ряду соединений металлов За каждое правильно составленное уравнение реакции можно получить по 1 баллу Скрыть Контрольная работа по теме » Металлы «, 9 класс pedsovetorg › …kontrolnaya…po-teme-metally9klass Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте УМК ОСГабриелян,химия 9 класс Контрольная работа содержит 4 варианта+критерии оценки+ ответы Контрольная _ работа Металлы 9 класс docx Скачать Посмотреть Комментарии (0) Добавить комментарий Читать ещё УМК ОСГабриелян,химия 9 класс Контрольная работа содержит 4 варианта+критерии оценки+ ответы Контрольная _ работа Металлы 9 класс docx Скачать Посмотреть Комментарии (0) Добавить комментарий Отправить Наталья Горшкова Все материалы автора Скрыть Ответы на контрольную работу по теме « Металлы » 9classru › 16-metally-9-klass-gabrielyanhtml Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте ЧАСТЬ А Тестовые задания с выбором ответа 1 Распределение электронов по энергетическим уровням в атоме магния: Г 2е, 8е, 2е 2 Число электронов на внешнем электронном слое у атомов щелочных металлов : А1 Читать ещё ЧАСТЬ А Тестовые задания с выбором ответа 1 Распределение электронов по энергетическим уровням в атоме магния: Г 2е, 8е, 2е 2 Число электронов на внешнем электронном слое у атомов щелочных металлов : А1 3 Тип химической связи в простом веществе литии: Г Металлическая 4 Простое вещество с наиболее ярко выраженными металлическими свойствами: Г Стронций 5 Радиус атомов элементов 3-го периода с увеличением заряда ядра от щелочного металла к галогену: Г Уменьшается 6 Атом алюминия отличается от иона алюминия: Б Радиусом частицы 7 Наиболее энергично реагирует с водой: А Калий 8 Скрыть Тест № 13 Тематический контроль по теме « Металлы » gdzgoru › 9-klass/himiya…test-13…po-teme-metally Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте ГДЗ по Химии за 9 класс от Стрельникова: Тест № 13 Тематический контроль по теме « Металлы » из Контрольно -измерительных материалов Производство: ВАКО Ответ на Тест № 13 Тематический контроль по теме « Металлы » Читать ещё ГДЗ по Химии за 9 класс от Стрельникова: Тест № 13 Тематический контроль по теме « Металлы » из Контрольно -измерительных материалов Авторы: Е Н Стрельникова Производство: ВАКО Ответ на Тест № 13 Тематический контроль по теме « Металлы » Содержание Предыдущее Следующее №12 Обобщение и систематизация знаний по теме « Металлы » №14 Неметаллы: атомы и простые вещества Скрыть Контрольная работа для 9 класса по теме » Металлы » uchportalru › load/61-1-0-52074 Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Контрольная работа была составлена на основе обязательного минимума содержания курса химии для 9 класса по теме : « Металлы » Тест в двух вариантах по 20 вопросов в каждом Тестовые задания содержат теоретические вопросы и задачи, решение которых позволит школьникам более глубоко усвоить знания Читать ещё Контрольная работа была составлена на основе обязательного минимума содержания курса химии для 9 класса по теме : « Металлы » Тест в двух вариантах по 20 вопросов в каждом Тестовые задания содержат теоретические вопросы и задачи, решение которых позволит школьникам более глубоко усвоить знания по химии Целевая аудитория: для 9 класса Автор: Габитов ФанзильРамилович Место работы : МБОУ СОШ дКебячево Добавил: gabitus Скачать с портала (527 Kb) 5037411897009052014 Скрыть Контрольная работа « Металлы » 9 класс скачать alllessonsru › …kontrolnaya…metally-9-klasshtml Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Контрольная работа « Металлы » 9 класс документ в формате doc и xls для вас и ваших детей бесплатно только на Alllessonsru Контрольная работа № 1 по теме : « Металлы » Вариант 1 ЧАСТЬ A Тестовые задания c выбором ответа 1 (3 балла) Распределение электронов по энергетическим уровням Читать ещё Контрольная работа « Металлы » 9 класс документ в формате doc и xls для вас и ваших детей бесплатно только на Alllessonsru Контрольная работа № 1 по теме : « Металлы » Вариант 1 ЧАСТЬ A Тестовые задания c выбором ответа 1 (3 балла) Распределение электронов по энергетическим уровням в атоме магния: A 2е, 2е Б 2е, 4е B2е, 3е Г 2е, 8е, 2е 2 (3 балла) Число элeктронов на внешнем электронном слое y атомов щелочных металлов : А1 б2 в3 г4 3 (3 балла) Скрыть Проверочная работа по теме : « Металлы главных» урокрф › …rabota_po_teme_«metalli…194624html Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Контрольная / проверочная работа для учителя-предметника для 9 класса Учебно-дидактические материалы по Химии I часть: выберите правильный ответ Все элементы главной подгруппы II группы периодической системы относятся к 1) типичным окислителям 2) переходным элементам 3) ѕ Читать ещё Контрольная / проверочная работа для учителя-предметника для 9 класса Учебно-дидактические материалы по Химии для 9 класса I часть: выберите правильный ответ Все элементы главной подгруппы II группы периодической системы относятся к 1) типичным окислителям 2) переходным элементам 3) ѕ – элементам 2 Укажите общее в строении атомов Be и Al А) 2 электрона на последнем электронном слое Скрыть Вместе с « контрольная работа по теме металлы 9 класс ответы » ищут: контрольная работа контрольная работа по математике 6 класс мерзляк контрольная работа по алгебре 7 класс мерзляк контрольная работа по математике 3 класс 2 четверть школа россии фгос контрольная работа по химии 9 класс металлы контрольная работа по химии 9 класс металлы с ответами габриелян контрольная работа по геометрии 9 класс метод координат контрольная работа по математике 4 класс контрольная работа по математике 2 класс 2 четверть школа россии фгос контрольная работа по математике 4 класс 2 четверть школа россии фгос 1 2 3 4 5 дальше Браузер Для безопасных прогулок в сети 0+ Установить
Свойства металлов Урок
Для большинства людей металл — это другое слово, обозначающее железо, сталь или подобное твердое блестящее вещество.
Но соответствует ли это определение истинным свойствам металлов?
Да… и нет.
Прежде чем мы объясним, вы должны знать, что большинство элементов в периодической таблице — металлы.
Металлы находятся в центре и в левой части таблицы Менделеева. Их можно дополнительно классифицировать как щелочные металлы, щелочноземельные металлы, переходные металлы и основные металлы.
Урок «Металловедение»
Свойства металлов
Элемент — это вещество, состоящее из одного вида атомов; его нельзя разделить на более простые части. Например, элемент гелий (вспомните воздушные шары) состоит исключительно из атомов гелия.
Элементы обычно классифицируются как металлы, или неметаллы, (хотя некоторые элементы имеют характеристики обоих; они называются металлоидами ).
Три свойства металлов:
- Блеск: Металлы блестят при резке, царапинах или полировке.

- Ковкость: Металлы прочные, но податливые, а это значит, что их можно легко сгибать или придавать форму. На протяжении веков кузнецы могли формировать металлические предметы, нагревая металл и ударяя по нему молотком. Если бы они попробовали это с неметаллами, материал бы лопнул! Большинство металлов также пластичны, , что означает, что их можно вытягивать для изготовления проволоки.
- Электропроводность: Металлы отлично проводят электричество и тепло. Поскольку они также пластичны, они идеально подходят для электропроводки. (Вы можете проверить это, используя некоторые предметы домашнего обихода. Продолжайте читать, чтобы узнать, как это сделать!)
Дополнительные свойства металлов
Высокая температура плавления : Большинство металлов имеют высокие температуры плавления, и все, кроме ртути, являются твердыми при комнатной температуре.
Звонкий : Металлы часто издают звенящий звук при ударе.
Реакционная способность : Некоторые металлы подвергаются химическому изменению (реакции) сами по себе или с другими элементами с выделением энергии. Эти металлы никогда не встречаются в чистом виде, и их трудно отделить от минералов, в которых они содержатся. Калий и натрий являются наиболее химически активными металлами. Они бурно реагируют с воздухом и водой; калий воспламеняется при контакте с водой!
Другие металлы вообще не вступают в реакцию с другими металлами. Это означает, что их можно найти в чистом виде (например, золото и платина).Поскольку медь относительно недорога и имеет низкую реакционную способность, ее можно использовать для изготовления труб и электропроводки.
Пять групп металлов:
Благородные металлы обнаруживаются как чистые металлы, потому что они не вступают в реакцию и не соединяются с другими элементами с образованием соединений. Поскольку они не реагируют, они не подвержены коррозии. Это делает их идеальными для украшений и монет. Благородные металлы включают медь, палладий, серебро, платину и золото.
Щелочные металлы очень реактивны.Они имеют низкую температуру плавления и достаточно мягкие, чтобы их можно было разрезать ножом. Калий и натрий — два щелочных металла.
Щелочноземельные металлы находятся в соединениях с множеством различных минералов. Они менее химически активны, чем щелочные металлы, а также тверже и имеют более высокие температуры плавления. В эту группу входят кальций, магний и барий.
Переходные металлы — это то, о чем мы обычно думаем, когда думаем о металлах. Они твердые и блестящие, прочные и легко поддаются форме.Они используются во многих промышленных целях. В эту группу входят железо, золото, серебро, хром, никель и медь, некоторые из которых также являются благородными металлами.
Poor Metals довольно мягкие, и большинство из них мало используются сами по себе. Однако они становятся очень полезными при добавлении к другим веществам. Бедные металлы включают алюминий, галлий, олово, таллий, сурьму и висмут.
Сплавы: сильные комбинации
Свойства этих разных металлов можно комбинировать, смешивая два или более из них вместе.Полученное вещество называется сплавом . Некоторые из наших самых полезных строительных материалов на самом деле являются сплавами. Сталь, например, представляет собой смесь железа и небольшого количества углерода и других элементов; комбинация, которая одновременно сильна и проста в использовании. (Добавьте хром, и вы получите нержавеющую сталь. Проверьте свои кухонные кастрюли и сковороды, чтобы узнать, сколько из них сделано из нержавеющей стали!)
Другие сплавы, такие как латунь (медь и цинк) и бронза (медь и олово), легко формуются и красивы.Бронза также часто используется в судостроении, поскольку она устойчива к коррозии в морской воде.
Титан намного легче и менее плотный, чем сталь, но такой же прочный; и хотя он тяжелее алюминия, он вдвое прочнее. Кроме того, он очень устойчив к коррозии. Все эти факторы делают его отличным сплавом. Титановые сплавы используются в самолетах, кораблях и космических кораблях, а также в красках, велосипедах и даже портативных компьютерах!
Золото, как чистый металл, настолько мягкое, что при изготовлении ювелирных изделий оно всегда смешивается с другим металлом (обычно серебром, медью или цинком).Чистота золота измеряется в карат . Самое чистое, что вы можете получить в ювелирных изделиях, — это 24 карата, что составляет около 99,7% чистого золота. Золото также можно смешивать с другими металлами, чтобы изменить его цвет; белое золото, которое популярно для ювелирных украшений, представляет собой сплав золота и платины или палладия.
Металл из руды
Руды — это горные породы или минералы, из которых можно извлечь ценное вещество — обычно металл. Некоторые распространенные руды включают галенит (свинцовая руда), борнит и малахит (медь), киноварь (ртуть) и боксит (алюминий).Наиболее распространенными железными рудами являются магнетит и гематит (минерал ржавого цвета, образованный железом и кислородом), которые содержат около 70% железа.
Существует несколько процессов переработки железа из руды. Более старый процесс заключается в сжигании железной руды с использованием древесного угля (углерода) и кислорода с помощью сильфонов. Углерод и кислород, включая кислород в руде, соединяются и покидают железо. Однако железо не нагревается до полного расплавления и содержит силикаты, оставшиеся от руды.Его можно нагреть и выковать из кованого железа .
В более современном процессе используется доменная печь для нагрева железной руды, известняка и кокса (угольный продукт, а не безалкогольный напиток). В результате реакции происходит отделение железа от кислорода в руде. Этот «чугун» необходимо дополнительно перемешать, чтобы получить кованое железо. Его также можно использовать для другой важной цели: при нагревании углеродом и другими элементами он становится более прочным металлом, называемым сталью .
Принимая во внимание этот процесс, неудивительно, что железо не использовалось примерно до 1500 г. до н.э. Но некоторые чистые металлы — золото, серебро и медь — использовались и раньше, а легированная бронза, как полагают, была открыта шумерами около 3500 г. до н.э. Но алюминий, один из важнейших металлов в современном мире, не был открыт до 1825 года нашей эры и не использовался широко до 20 века!
Коррозия: процесс и предотвращение
Вы когда-нибудь видели кусок серебра, который потерял свой блеск, или железо с красноватой ржавчиной на нем или даже с дырами в результате коррозии? Это происходит, когда кислород (обычно из воздуха) вступает в реакцию с металлом.Металлы с более высокой реакционной способностью (такие как магний, алюминий, железо, цинк и олово) гораздо более склонны к такому виду химического разрушения, или коррозии .
Когда кислород вступает в реакцию с металлом, он образует оксид на поверхности металла. Для некоторых металлов, например алюминия, это хорошо. Оксид образует защитный слой, предохраняющий металл от дальнейшей коррозии.
С другой стороны, у чугуна и стали возникнут серьезные проблемы, если их не обработать для предотвращения коррозии.Красноватый оксидный слой, который образуется на железе или стали при реакции с кислородом, называется ржавчиной . Слой ржавчины постоянно отслаивается, подвергая большую часть металла коррозии, пока металл в конечном итоге не проедает.
Один из распространенных способов защиты железа — это покрытие его специальной краской, которая препятствует взаимодействию кислорода с металлом под краской. Другой метод — цинкование : в этом процессе сталь покрывается цинком. Кислород, молекулы воды и углекислый газ в воздухе вступают в реакцию с цинком, образуя слой карбоната цинка, который защищает от коррозии.Посмотрите вокруг своего дома, двора и гаража, чтобы найти примеры коррозии, а также гальванизации и других средств защиты металла от ржавчины.
Технологии: фейерверки и химия
Если вы посмотрите фейерверк Четвертого июля, то увидите прекрасные сочетания цветов и искр.
Как работает этот удивительный пиротехнический дисплей? Короткий ответ — химия. Более длинный включает в себя обзор свойств металлов.
Один из основных ингредиентов петард, наземных и воздушных фейерверков (взрывающихся в небе) — это черный порошок , изобретенный китайцами около 1000 лет назад.Это смесь нитрата калия (селитры), древесного угля и серы в соотношении 75:15:10. Черный порох используется для запуска антенн, а также вызывает взрывы, необходимые для создания специальных эффектов, таких как шум или цветной свет.
В бенгальских огнях черный порошок смешивают с металлическими порошками и другими химическими соединениями в форме, которая будет гореть медленно, сверху вниз. В простых ракетах-фейерверках черный порох заключен в трубку вокруг взрывателя. При зажигании порошок создает силу, которая приводит к равной и противоположной реакции, отталкивая фейерверк от земли, а затем заставляя соединения внутри него взорваться в воздухе.
Более сложные снаряды для фейерверков запускаются из миномета, трубы с черным порохом, которая при зажигании вызывает реакцию взрыва. Затем воспламенитель фейерверк-снаряда загорается, когда он поднимается в воздух, и в нужный момент взрыв внутри снаряда заставляет его заряды со специальными эффектами взорваться.
Яркая, красочная часть фейерверка вызвана «возбужденными» электронами в атомах различных соединений металлов и солей. Эти соединения находятся в маленьких шариках, называемых звезд и , сделанных из того же соединения, что и бенгальский огонь.
Металлы как красители
Различные металлы горят разными цветами; например, если горит соединение меди, его пламя будет сине-зеленого цвета. Кальций горит красным цветом, а калий горит пурпурным. В фейерверках металлы комбинируются для создания разных цветов.
Когда звездные соединения внутри фейерверка нагреваются, возбужденные атомы выделяют световую энергию. Этот свет делится на две категории: лампы накаливания и люминесценции. Накаливание — это свет, возникающий при нагревании: в фейерверках химически активные металлы, такие как алюминий и магний, при нагревании вызывают вспышку очень яркого света — иногда при температуре выше 5000 ° F!
Менее реактивные соединения не нагреваются до такой степени, что искры становятся менее яркими. Люминесценция , с другой стороны, возникает из других источников и может возникать даже при низких температурах. Электроны в соединении поглощают энергию, делая их «возбужденными». Однако электроны не могут поддерживать этот высокий уровень, поэтому они возвращаются на более низкий уровень, высвобождая при этом световую энергию (фотоны).
Хлорид бария — химическое соединение, придающее фейерверкам светящийся зеленый цвет, а хлорид меди — синий. Для любого типа света важно использовать чистые ингредиенты, поскольку следы других соединений будут затемнять цвет.
Дополнительная литература по металлам:
открытых учебников | Сиявула
Математика
Наука
- Читать онлайн
Учебники
Английский
Класс 7A
Марка 7Б
7 класс (A и B вместе)
Африкаанс
Граад 7А
Граад 7Б
Граад 7 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 8A
Сорт 8Б
8 класс (A и B вместе)
Африкаанс
Граад 8А
Граад 8Б
Граад 8 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 9А
Марка 9Б
9 класс (A и B вместе)
Африкаанс
Граад 9А
Граад 9Б
Граад 9 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Класс 4A
Класс 4Б
Класс 4 (вместе A и B)
Африкаанс
Граад 4А
Граад 4Б
Граад 4 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 5A
Марка 5Б
Оценка 5 (вместе A и B)
Африкаанс
Граад 5А
Граад 5Б
Граад 5 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 6А
Марка 6Б
6 класс (A и B вместе)
Африкаанс
Граад 6А
Граад 6Б
Граад 6 (A en B saam)
Пособия для учителя
Наша книга лицензионная
Эти книги не просто бесплатные, они также имеют открытую лицензию! Один и тот же контент, но разные версии (брендированные или нет) имеют разные лицензии, как объяснено:
CC-BY-ND (фирменные версии)
Вам разрешается и поощряется свободное копирование этих версий.Вы можете делать ксерокопии, распечатывать и распространять их сколько угодно раз. Вы можете скачать их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственным ограничением является то, что вы не можете адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, спонсорские логотипы и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Узнайте больше о спонсорстве и партнерстве с другими, которые сделали возможным выпуск каждого из открытых учебников.
CC-BY (безымянные версии)
Эти небрендовые версии одного и того же контента доступны для вас, чтобы вы могли делиться ими, адаптировать, преобразовывать, модифицировать или дополнять их любым способом, с единственным требованием — дать соответствующую оценку Siyavula. Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
Какие бывают марки стали
Сталь представляет собой комбинацию железа и углерода, но знаете ли вы, что существует более 3500 различных марок стали? Марка стали определяется количеством углерода, другими сплавами, которые она содержит, и способом ее обработки.
Четыре типа стали
Стальклассифицируется как способ классификации и часто подразделяется на четыре группы: углерод, сплав, нержавеющая сталь и инструмент.
- Углеродистые стали , помимо углерода и железа, содержат только следовые количества элементов. Эта группа является наиболее распространенной, на ее долю приходится 90% производства стали. Углеродистая сталь делится на три подгруппы в зависимости от количества углерода в металле: низкоуглеродистые стали / мягкие стали (до 0,3% углерода), среднеуглеродистые стали (0.3–0,6% углерода) и высокоуглеродистых сталей (более 0,6% углерода).
- Легированные стали содержат легирующие элементы, такие как никель, медь, хром и / или алюминий. Эти дополнительные элементы используются для влияния на прочность, пластичность, коррозионную стойкость и обрабатываемость металла.
- Нержавеющая сталь содержит 10–20% хрома в качестве легирующего элемента и ценится за высокую коррозионную стойкость. Эти стали обычно используются в медицинском оборудовании, трубопроводах, режущих инструментах и оборудовании для пищевой промышленности.
- Инструментальная сталь является отличным оборудованием для резки и сверления, так как она содержит вольфрам, молибден, кобальт и ванадий для повышения термостойкости и долговечности.
Какие марки стали бывают?
Системы классификации сталипозволяют классифицировать сталь на основе всех различных факторов, которые могут влиять на ее свойства и использование.
Например, скорость охлаждения стали может влиять на то, как ее молекулы соединяются вместе, а также на количество времени, в течение которого сталь выдерживается при нескольких критических температурных точках во время процесса охлаждения.На основе этого процесса термообработки две стали с одинаковым содержанием сплава могут иметь разные марки.
- Система классификации ASTM присваивает каждому металлу буквенный префикс на основе его общей категории («A» — это обозначение для материалов из чугуна и стали), а также последовательно присваиваемый номер, который соответствует конкретным свойствам этого металла.
- Система оценок SAE использует четырехзначное число для классификации. Первые две цифры обозначают тип стали и концентрацию легирующих элементов, а последние две цифры указывают концентрацию углерода в металле.
широко используются учеными, инженерами, архитекторами и государственными учреждениями для обеспечения качества и стабильности материалов. Эти стандарты обеспечивают общий язык для описания свойств стали с большой определенностью и направляют производителей продукции в отношении надлежащих процедур обработки и нанесения.
Как предотвратить образование ржавчины: 9 способов для любой ситуации
Ржавчина может быстро стать большой проблемой.Это нарушает функциональность и стабильность важного оборудования и может стоить вашему бизнесу тысячи. Знание того, как эффективно предотвратить ржавчину, может сэкономить ваши деньги и предотвратить серьезные проблемы. Как и во многих других случаях, некоторые небольшие профилактические меры заранее могут сэкономить вам много денег, времени и разочарований в будущем. Мы собрали лучшие способы предотвращения ржавчины, поэтому вы можете найти стратегию, которая лучше всего подходит для вашего оборудования или деталей.Как предотвратить ржавчину в любой ситуации
Короче говоря, лучший способ предотвратить ржавчину — это предотвратить попадание влаги на металл или использовать материал, который корродирует медленнее.Ниже приведены лучшие способы предотвращения ржавчины. Мы обсудим, как предотвратить ржавчину, используя каждую стратегию, более подробно позже в этом посте.
- Используйте сплав: Использование сплавов, таких как нержавеющая сталь, является одним из наиболее распространенных способов предотвращения или замедления образования ржавчины. Нержавеющая сталь подходит не для всех областей применения и не экономична, но для многих она подойдет.
- Нанесите масло: Покрытие из масла поможет предотвратить образование ржавчины или замедлить ее образование, так как препятствует проникновению влаги в металл к железу.Однако маслянистая поверхность может создавать проблемы для некоторых инструментов или машин, а также создавать проблемы для окружающей среды и здоровья человека.
- Нанесите сухое покрытие: Специальные антикоррозийные средства высыхают без остатка и образуют защитный барьер над металлическими частями и оборудованием. Они эффективны для продуктов, которые используются, при транспортировке, хранении и т. Д.
- Покраска металла: Краска хорошего качества замедлит ржавление, не допуская попадания влаги на металл.
- Правильное хранение: Храните металлические детали или изделия в местах с низкой влажностью или в среде с контролируемой температурой и влажностью, чтобы значительно замедлить образование ржавчины.Также полезно использовать в этом хранилище адсорбционные осушители.
- Оцинковка: Оцинковка покрывает железо или сталь цинком для защиты от ржавчины. Цинк коррозирует гораздо медленнее, чем железо или сталь, поэтому он очень эффективен для замедления образования ржавчины.
- Посинение: Этот процесс создает слой магнетита поверх металла для предотвращения ржавчины. Металл необходимо регулярно смазывать маслом, чтобы поддерживать устойчивость к ржавчине, при этом он станет синим или черным.
- Порошковое покрытие: Слой акрила, винила, эпоксидной смолы или других веществ предотвращает попадание влаги на металл, тем самым предотвращая ржавчину.
- VCI Упаковка: Ингибиторы паровой коррозии (VCI) представляют собой тип химического соединения, которое при введении в различные упаковочные материалы защищает металлы, выделяя пары, устраняющие ржавчину, в замкнутое воздушное пространство для предотвращения коррозии металлической поверхности.
9 способов предотвратить ржавчину
1. Используйте сплав
Многие наружные конструкции, такие как этот мост, сделаны из кортеновской стали, чтобы уменьшить влияние ржавчины.Хотя все металлы подвержены коррозии, каждый из них подвергается коррозии с разной скоростью.Вот почему сплавы, состоящие из двух или более разных металлов, устойчивы к ржавчине. Технически все виды стали уже являются сплавами, так как они сделаны из железа и углерода. Однако добавление других металлов, таких как хром, никель, марганец и другие, приведет к созданию различных типов стальных сплавов.
Некоторые из них, например нержавеющая сталь, сделаны для полного предотвращения ржавчины. Хотя они, конечно, не полностью устойчивы к коррозии, они будут ржаветь гораздо медленнее. Другие сплавы, такие как сталь COR-TEN, накапливают слой ржавчины, но затем перестают ржаветь при правильных условиях.
Изменение состава стали также изменяет ее ударную вязкость, проводимость, внешний вид и многие другие свойства. Важно подумать о том, как предотвратить ржавчину, но также убедиться, что стальной сплав подходит для применения. Кроме того, примите во внимание используемые методы сварки и окружающую среду, так как все они будут влиять на скорость коррозии.
2. Нанесите масло
Большинство владельцев оружия знают, как важно держать огнестрельное оружие хорошо смазанным, даже если оно не используется.Масло не только смазывает металлические детали и позволяет им двигаться с меньшим трением, но и создает защитный барьер от ржавчины. Принцип здесь довольно прост; с покрытием из масла влага не может вступить в реакцию с железом в металле и вызвать ржавчину.
Хотя покрытие маслом может быть простым и эффективным способом предотвращения ржавчины, оно, безусловно, не идеально. Масло также затрудняет захват объекта и может привести к скольжению или разбалансировке деталей. Он также может быть грязным и неприятным в работе.Наконец, смазку нужно проводить неоднократно, что требует времени и энергии.
Нанесение сухого покрытия с подобным продуктом может быть полезным и универсальным способом предотвращения ржавчины.3. Нанесите сухое покрытие.
Некоторые продукты специально созданы для предотвращения ржавчины. Эти продукты работают по тому же принципу, что и масло, создавая защитный барьер от ржавчины, но не оставляют следов. Для металлических деталей или компонентов, которые должны оставаться чистыми или обеспечивать надежный захват, идеально подходит антикоррозионное сухое покрытие.
Сухие средства защиты от ржавчины, такие как ARMOR’s Dry Coat Rust Preventative, можно наносить распылением, окунанием или мытьем. Как только они высохнут, защитный барьер установлен. Металл не будет выглядеть и ощущаться по-другому, поэтому его применение останется прежним. Сухие покрытия также можно использовать в сочетании с другими способами предотвращения ржавчины. Например, вы можете нанести сухое покрытие на окрашенный или порошковый объект, чтобы повысить уровень защиты.
4. Покраска металла
Краски также создают защитный слой на металлических объектах и предотвращают попадание на них влаги.Конечно, никакие барьеры не могут полностью остановить проникновение влаги, но покраска может быть простым и легким способом замедлить образование ржавчины. Если вы уже хотите покрасить объект в другой цвет или получить другую отделку, это идеальное решение.
Важно использовать правильную краску для предотвращения ржавчины. Краска должна прилипать к металлу, поэтому помните, какой тип краски вы используете, а также какие виды отделки уже нанесены на металл. Вам также понадобится краска на масляной основе, а не водорастворимая, если вы ожидаете, что на детали будет слишком много влаги или загрязнений.Наконец, будьте осторожны со сварными соединениями или болтами. Если в окрашенном слое есть слабые места или незаполненные щели, эти участки начнут ржаветь.
Начните устранение промышленной ржавчины прямо сейчас
Наш интерактивный инструмент ASK JERRY готов определить и диагностировать причину возникновения ржавчины
ПОЛУЧИТЕ СВОЙ ОТВЕТ НА РЖАВУ
5. Правильное хранение
Лучший способ предотвратить ржавчину может также быть наиболее очевидным — держите объект подальше от влаги. Вода вступает в реакцию с железом с образованием ржавчины, поэтому в окружающей среде без влаги ржавчина не образуется.Однако имейте в виду, что даже обычный воздух содержит некоторую влагу в виде влажности. Чтобы полностью предотвратить ржавчину, вам понадобится воздухо- и водонепроницаемое уплотнение. Это, конечно, затрудняет использование объекта, поэтому имеет смысл предотвратить ржавчину во время хранения или транспортировки.
6. Оцинковка
При цинковании на железо или сталь наносится защитное покрытие из цинка. Поскольку цинк корродирует примерно в 30 раз медленнее, чем железо, цинкование может быть дешевым и эффективным способом предотвращения ржавчины.
Как и все способы предотвращения ржавчины, цинкование имеет ограничения. Покрытие из цинка не противостоит суровым воздействиям окружающей среды, таким как кислотный дождь или соль. Цинкование также изменяет внешний вид металла, а дополнительный слой может покрывать части детали, например резьбу на винте.
7. Воронение
Процесс воронения стали фактически создает новый слой, похожий на ржавчину, но гораздо менее разрушительный. Посинение создает слой магнетита, также называемого черным оксидом железа, и придает металлам черный или одноименный синий цвет.
Посинение обычно достигается воздействием высоких температур и солевого раствора. Этот процесс обычно используется для экономичной защиты огнестрельного оружия от ржавчины. Воронение работает лучше всего, когда сталь также регулярно смазывается маслом.
8. Порошковое покрытие
Порошковое покрытие часто используется для быстрой «окраски» объекта на сборочной линии. Во-первых, статическое электричество связывает порошкообразное вещество из акрила, полиэстера, эпоксидной смолы, полиуретана или чего-то еще с металлическим предметом. Затем порошок плавится в печи в однородный твердый слой.Поскольку жидкость не используется, порошковое покрытие идеально подходит для некоторых отделок или деталей.
Порошковое покрытие, как и окраска, покрывает металлический компонент защитным слоем. Этот слой предотвратит попадание влаги на металл и, следовательно, предотвратит появление ржавчины. Чтобы порошковое покрытие эффективно предотвращало ржавчину, покрытие должно быть целым. Любые слабые места обнажат металл и создадут вход для ржавчины.
9. VCI Packaging
VCI Packaging — это простой в использовании, чистый и сухой вариант упаковки для предотвращения ржавчины на металлических и металлических деталях.Ингибиторы паровой коррозии (VCI) представляют собой тип химического соединения, используемого для защиты черных и цветных металлов от ржавчины и коррозии, которые вводятся в упаковочные материалы, включая полимерные пленки, бумагу, эмиттеры, древесно-стружечные плиты, влагопоглотители и многие другие компоненты.
При правильном хранении металлических деталей с продуктами VCI Packaging, VCI активируются и заполняют паровое пространство внутри упаковки. Ионы VCI образуют защитный экран на поверхности металла, который вытесняет влагу и уничтожает ржавчину.VCI Packaging надежно предотвращает коррозию защищенных металлов без использования грязной смазки, масел, защитных покрытий или других трудоемких методов.
1 Коррозия — ее влияние и контроль | Возможности исследований в области науки и техники коррозии
Ядерные реакторные системыКоммерческие и военные ядерные реакторы испытали широкий спектр проблем с коррозией за последние 55 лет, и, начиная с 1960-х годов, исследования коррозии нашли хорошее применение для смягчения и решения этих проблем.Все действующие предприятия в Соединенных Штатах используют обычную легкую воду с небольшим количеством примесей, но, тем не менее, они на удивление подвержены коррозии.
В системах реакторов с кипящей водой преобладающей проблемой было межкристаллитное коррозионное растрескивание под напряжением (SCC) в аустенитной нержавеющей стали 304, сенсибилизированной сваркой, что приводило к серьезным простоям оборудования. Эта ситуация была изменена осознанием того, что растрескивание можно контролировать, изменяя химический состав воды и состояние увлажненных поверхностей установки.
Во-первых, было снижено содержание примесей в воде; затем вводили водород в нежелательно высоких концентрациях, чтобы снизить коррозионный потенциал стали. Затем, в классическом применении науки о коррозии, было показано, что влажное осаждение благородных металлов на поверхности растений может обеспечить аналогичный уровень защиты с гораздо более низким содержанием водорода. Все эти практические меры по смягчению последствий были поддержаны обширными научными исследованиями в области коррозии, включая разработку датчиков на месте для мониторинга содержания водорода, электродного потенциала и скорости роста трещин.
В реакторах с водой под давлением проблемы коррозии были связаны в основном с парогенераторами, где сплав 600 на основе никеля первоначально использовался для труб, отделяющих воду теплоносителя первого контура от воды, которая кипятится для привода турбин. Это оказалось плохим выбором, потому что материал был подвержен SCC с обеих сторон. Однако меры по исправлению положения — включая термическую обработку материала труб, замену трубок новым сплавом и уменьшение отложений шлама, возникающего из-за примесей в питательной воде, — продлили срок службы парогенераторов.
В процессе этого смягчения последствий были проведены превосходные исследования в поддержку критических вопросов в области металлургии, химического машиностроения, науки о коррозии и даже геохимии. Теперь отрасль находится в таком положении, что она может — с достаточной уверенностью — прогнозировать чрезвычайно долгий срок службы своих новых заводов, а также превышать целевые показатели по продлению срока службы отремонтированных заводов.
Оба типа ядерных установок испытали проблемы SCC из-за нейтронно-облученного материала в активной зоне, и некоторые из самых амбициозных исследований коррозии за последние два десятилетия имели дело с полученным сочетанием изменения свойств материала, микроструктуры и поведения SCC с использованием достижений в моделировании и характеристике.В результате экспериментов и фундаментальных исследований срок службы материала можно предсказать более точно, и существуют рекомендации для новых сплавов с повышенной устойчивостью к этой специализированной форме SCC. Конечная цель — количественное прогнозирование срока службы после полного понимания механизмов коррозии и деградации.
Ржавление как окислительно-восстановительная реакция
Ржавчина (коррозия) как окислительно-восстановительная реакция Что такое коррозия металла? Коррозия металла:
- Когда металлы подвергаются воздействию окружающей среды, они подвергаются коррозии.Например, через некоторое время блестящий алюминиевый горшок потеряет свой блеск, столовое серебро потускнеет, а железная конструкция заржавеет.
- Коррозия металла — это окислительно-восстановительная реакция, при которой металл естественным образом окисляется до своих ионов, что приводит к частичному или полному разрушению металла.
- Во время коррозии атомы металла теряют электроны, образуя положительные ионы.
M → M n + + ne — - Некоторые металлы подвержены коррозии легче, чем другие.Скорость коррозии металла зависит от двух факторов:
(a) Электропозитивность металлов
(b) Природа продукта коррозии - Электроположительность металлов
- Природа продукта коррозии
Когда металл подвергается коррозии, он обычно образует оксидное покрытие.
(a) Оксидное покрытие алюминия, например, плотно упаковано, непористо и прочно прикреплено к металлу. Он не пропускает воду и воздух, защищая находящийся под ним алюминий от дальнейшей коррозии.Это объясняет, почему алюминий достаточно устойчив к коррозии, хотя он очень электроположителен. Другие металлы с аналогичным защитным оксидным покрытием включают никель, хром, олово, свинец и цинк.
(b) Оксидное покрытие железа, с другой стороны, неплотно, пористое, непрочное и легко отслаивается. Таким образом, вода и воздух могут проникать через покрытие, чтобы еще больше разъедать металлическое железо под ним. - В таблице сравнивается устойчивость к коррозии некоторых распространенных металлов.
Люди тоже спрашивают
Ржавление как окислительно-восстановительная реакция Металлы прочие и ржавчина железа- Когда два металла соприкасаются друг с другом, сначала коррозирует более электроположительный металл. Это просто потому, что более электроположительный металл может легче терять свои электроны, чем менее электроположительный металл.
- Итак, когда железо контактирует с более чем на электроположительным металлом, ржавчина железа предотвращается, или подавляется.
- Например, магний более электроположителен, чем железо. Итак, когда железо контактирует с магнием, магний корродирует или окисляется вместо железа.
- С другой стороны, когда железо находится в контакте с менее электроположительным на металлом, ржавчина железа на ускоряется.
- Например, медь менее электроположительна, чем железо. Поэтому при контакте железа с медью железо быстрее ржавеет.
- Чем дальше друг от друга находятся металлы в электрохимическом ряду, тем быстрее коррозирует электроположительный металл.Например, железо ржавеет быстрее при контакте с медью, чем при контакте с оловом.
Контроль ржавчины:
Как правило, существует три основных способа борьбы с ржавчиной.
1. Использование защитного покрытия
Защитное покрытие предотвращает попадание воды и воздуха на поверхность железа. В качестве защитного покрытия могут использоваться различные материалы, в зависимости от стоимости и использования изделий из железа.
- Масло и смазка используются для подвижных частей двигателя.
- Краски используются для предметов, которые трудно поцарапать, таких как автомобили, корабли, мосты, перила и ворота. Например, большинство современных автомобилей имеют несколько слоев антикоррозионного покрытия и красок. Некоторые горшки и тарелки покрыты эмалевой краской.
- Пластмасса используется для изготовления легких предметов, таких как вешалки для одежды и проволочные заборы.
- Цинкование (цинкование) включает покрытие железного или стального листа тонким слоем цинка . Это делается путем погружения чугуна в расплавленный цинк.
- Гальванизация используется на объектах, которые подвергаются воздействию атмосферы, таких как железная крыша, резервуары для воды и железные мусорные баки.
- Оцинкованное железо защищено от ржавчины двумя способами. Во-первых, цинковый слой обеспечивает защитное оксидное покрытие.
- Во-вторых, когда оцинкованное железо поцарапано, сначала коррозирует цинк, а не железо, потому что цинк более электроположителен, чем железо.
- При лужении , лист железа или стали покрыт очень тонким слоем олова.Это делается путем погружения железа в расплавленное олово или путем нанесения гальванического покрытия на железный лист с использованием хлорида олова (IV) в качестве электролита.
- Лужение обычно используется для изготовления жестяных банок, поскольку олово очень дорогое. После лужения внутренняя часть банки покрывается тонким слоем пластика.
- Олово обеспечивает защитное оксидное покрытие банок. Банки не ржавеют, пока не повреждено оловянное покрытие.
- Однако, как только банка поцарапана, быстро образуется ржавчина.Это потому, что железо более электроположительно, чем олово. Таким образом, пищу в помятых или поцарапанных жестяных банках нельзя употреблять.
2. Легирование
Нержавеющая сталь — это коррозионно-стойкий сплав железа.
- Он содержит углерод и различное количество хрома , и никеля . Стандартная нержавеющая сталь содержит около 18% хрома и 8% никеля.
- Таким образом, нержавеющая сталь стоит дорого и в основном используется для изготовления небольших предметов, таких как столовые приборы и декоративные предметы.
- Хром и никель образуют защитное оксидное покрытие, которое прочно связывается с железом и с трудом удаляется. Кроме того, оксидное покрытие блестящее, что придает нержавеющей стали привлекательный зеркальный вид.
3. Жертвенная защита
- В этом методе железо прикрепляется к более электроположительному металлу , который действует как жертвенный металл.
- Используется для объектов, которые находятся в условиях, ускоряющих ржавление, таких как вода и морская вода.Например, опоры мостов и корпуса судов обычно крепятся к цинковым блокам, а подземные трубопроводы привязаны к мешкам с магнием.
- Будучи более электроположительным, жертвенный металл мог бы действовать как анод, в результате чего он окислялся, защищая железо от ржавчины. Таким образом, жертвенный металл также известен как жертвенный анод .
- Жертвенный металл необходимо время от времени обновлять.
Цель: Исследовать влияние других металлов на ржавление.
Статус проблемы: Как различные типы металлов, контактирующие с железом, влияют на ржавление?
Гипотеза: Когда более электроположительный металл находится в контакте с железом, металл замедляет ржавление. Когда менее электроположительный металл контактирует с железом, металл ускоряет ржавление.
Переменные:
(a) Управляемая переменная: различные металлы, контактирующие с железом
(b) Реагирующая переменная: наличие синего цвета
(c) Контролируемые переменные: чистые железные гвозди, среда, в которой хранятся железные гвозди, температура
Эксплуатационное определение:
Синий цвет указывает на ржавление железа.
Материалы: Железные гвозди, магниевая лента, медная полоска, цинковая полоска, оловянная полоска, раствор горячего гелеобразного вещества, содержащий небольшое количество раствора гексацианоферрата (III)
калия и фенолфталеиновый индикатор, наждачная бумага.
Аппаратура: Пробирки, штатив для пробирок.
Мера безопасности:
Раствор гексацианоферрата (III) калия ядовит. Таким образом, с раствором горячего студня следует обращаться осторожно.
Процедура:
- Все пять железных гвоздей, магниевая лента, полоски меди, цинка и олова зачищены наждачной бумагой.
- Четыре железных гвоздя туго свернуты в спираль с магниевой лентой, каждый с лентами из меди, цинка и олова.
- Все пять железных гвоздей помещены в пять отдельных пробирок, как показано на рисунке.
- Такое же количество раствора горячего желе, содержащего раствор гексацианоферрата (III) калия и фенолфталеиновый индикатор, наливают в пробирки, чтобы полностью покрыть все ногти.
- Пробирки хранят в штативе для пробирок и оставляют на сутки. Никаких изменений не наблюдается.
Результаты:
| Пробирка | Пара металлов | Интенсивность синего цвета | Розовый цвет | Заключение относительно ржавчины |
| I | Только Fe | Низкий | Настоящее время | Железный гвоздь немного ржавеет. |
| II | Fe + Mg | Нет | Настоящее время | Железный гвоздь не ржавеет. |
| III | Fe + Cu | Очень высокий | Настоящее время | Железный гвоздь очень быстро ржавеет. |
| IV | Fe + Zn | Нет | Настоящее время | Железный гвоздь не ржавеет. |
| В | Fe + Sn | Высокая | Настоящее время | Железный гвоздь быстро ржавеет. |
Обсуждение:
- При коррозии образуются ионы железа (II).Эти ионы образуют темно-синюю окраску с гексацианоферратом (III) калия. Чем больше образуется ионов железа (II), тем выше интенсивность темно-синей окраски.
- При коррозии металла при восстановлении кислорода образуются ионы гидроксида, что приводит к возникновению основного состояния. Ионы гидроксида придают фенолфталеину розовую окраску.
- Желе используется для того, чтобы мы могли ясно видеть синий и розовый цвета, поскольку диффузия в твердом состоянии происходит медленно. В противном случае голубой и розовый цвета смешиваются и их трудно различить.
- Поскольку все пробирки окрашены в розовый цвет, предполагается, что в каждой пробирке произошла коррозия металла. Металлом, который подвергается коррозии, должен быть либо железный гвоздь, либо металл, с которым он контактирует.
- Иногда розовая окраска нечеткая, так как образующиеся ионы гидроксида немедленно соединяются с ионами металлов. Таким образом, в желе не так много свободных гидроксид-ионов.
- Пробирка I действует как контроль. Железный гвоздь немного ржавеет.
- Пробирка II
(a) Магний более электроположителен, чем железо. Это означает, что магний может терять электроны легче, чем железо. Следовательно, магний окисляется. Магний действует как анод.
(b) Электроны текут к железу, которое действует как катод. На катоде электроны приобретает
кислорода. Таким образом, кислород подвергается восстановлению, образуя ионы гидроксида, которые с фенолфаталеином придают розовую окраску.
(c) Железный гвоздь не подвержен коррозии.Это объясняет отсутствие синей окраски в этой пробирке. - Пробирка III
(a) Железо более электроположительно, чем медь. Это означает, что железо может терять электроны легче, чем медь. Поэтому железо ржавеет или окисляется. Железо действует как анод.
(b) Поскольку железо и медь имеют большую разницу в электроположительности, ржавление железа происходит очень быстро, образуя большое количество ионов железа (II). Этим объясняется высокая интенсивность синего окрашивания в этой пробирке.
(c) Электроны текут к меди, которая действует как катод. На катоде электроны захватываются кислородом, тем самым восстанавливая кислород до гидроксид-ионов. На присутствие гидроксид-ионов указывает розовый цвет. - Пробирка IV
Подобно пробирке II, железный гвоздь в этой пробирке не подвергается коррозии, поэтому темно-синего цвета не обнаруживается.
Цинк действует как анод и окисляется, поскольку цинк является более электроположительным, чем железо. - Пробирка V
Подобно пробирке III, железный гвоздь действует как анод и ржавеет.Это потому, что железо более электроположительно, чем олово.
Однако скорость ржавления в пробирке V ниже, чем в пробирке III, поскольку разница в электроположительности
между железом и оловом меньше, чем разница в электроположительности между железом и медью.
Выводы:
- Ржавчина подавляется, когда железо контактирует с более электроположительным металлом.
- Ржавление ускоряется, когда железо контактирует с менее электроположительным металлом.
9 способов предотвратить ржавление металлов
Что такое ржавчина?
Ржавчина — это форма оксида железа. Это происходит, когда железо соединяется с кислородом воздуха, вызывая его коррозию. Ржавчина — это оранжево-коричневый цвет металла на поверхности. Ржавчина может повлиять на железо и его сплавы, включая сталь. Когда у вас есть железо, вода и кислород, вы получаете ржавчину. Основным катализатором появления ржавчины является вода. Хотя железные и стальные конструкции кажутся прочными, молекулы воды способны проникать через микроскопические щели в металле.Это запускает процесс коррозии. Если присутствует соль, например, в морской воде, коррозия будет более быстрой. Воздействие двуокиси серы и двуокиси углерода также ускорит коррозионный процесс.
Ржавчина вызывает расширение металла, что может оказывать большое давление на конструкцию в целом. При этом металл ослабнет, станет хрупким и шелушащимся. Ржавчина проницаема для воздуха и воды, поэтому металл под слоем ржавчины будет продолжать разъедать.
9 способов предотвратить образование ржавчины
Ржавчина может снизить прочность ваших металлов, делая их хрупкими и сокращая срок их службы.Когда дело доходит до того, чтобы ваши металлы выглядели наилучшим образом, а также сохраняли долговечность, ключевым моментом является предотвращение ржавчины. Воздействие внешних условий увеличивает риск образования ржавчины, особенно в дождливом или влажном климате.
К лучшим способам предотвращения ржавчины относятся:
1. ЦинкованиеЦинкование — это метод предотвращения ржавчины. Это достигается путем горячего цинкования или гальваники. Изделие из железа или стали покрыто тонким слоем цинка.Это предотвращает попадание кислорода и воды на металл под ними, но цинк также действует как жертвенный металл. Цинк более реакционноспособен, чем железо, поэтому он окисляется, а не железо.
2. Кортен или атмосферостойкая стальИспользуйте атмосферостойкую сталь , также известную как сталь «COR-TEN», которая содержит до 21% легирующих элементов, таких как хром, медь, никель и фосфор. Сплавы образуют защитную ржавчину, которая со временем снижает скорость коррозии.Сталь COR-TEN обычно дешевле нержавеющей стали.
3. Нержавеющая стальНержавеющие сплавы. Нержавеющая сталь — это сплав, а содержит минимум 11% хрома. Это позволяет образовывать защитную пленку из оксида хрома, которая защищает от ржавчины. В случае повреждения защитная пленка восстановится. Коррозионную стойкость можно дополнительно повысить за счет добавления никеля.
4. Правильный предварительный дизайн
Конструкция должна позволять воздуху свободно циркулировать вокруг металла.Правильное планирование на этапе проектирования может минимизировать проникновение воды и снизить риск образования ржавчины. Следует избегать щелей и впадин. Металлические стыки должны быть сварными, а не болтовыми. В случае необходимости следует рассмотреть возможность создания дренажных отверстий для воды. Для больших конструкций должен быть обеспечен соответствующий доступ для регулярного обслуживания.
5. ВоронениеВоронение — это погружение стальных деталей в раствор нитрата калия, воды и гидроксида натрия. Это полезный метод, обеспечивающий ограниченную защиту небольших стальных изделий от ржавчины.Причина, по которой это называется «воронением», заключается в сине-черном цвете покрытия при использовании этой техники. Он часто используется при производстве огнестрельного оружия для обеспечения определенной степени устойчивости к коррозии. Он также используется в точных часах и других металлических изделиях.
6. Регулярное обслуживание
Регулярное обслуживание встраивания поможет остановить образование ржавчины и остановить развитие любой образовавшейся ржавчины. Очень важно удалить всю образовавшуюся ржавчину. Лезвие бритвы можно использовать для небольших участков.С помощью теплой воды и мыла удалите грязь с поверхности. Затем на поверхность следует нанести антикоррозийное покрытие.
7. FOZZ
FOZZ представляет собой сбалансированную смесь фосфорной кислоты и других химикатов, смачивающих веществ и наполнителей, которые растворяют ржавчину и предотвращают дальнейшее ржавление. Правильно обработанные поверхности готовы к окраске после высыхания. FOZZ — это не краска, а грунтовка, которая кондиционирует металл, чтобы краска держалась.
8. Порошковое покрытие
Порошковое покрытие — это когда сухой порошок равномерно наносится на чистую поверхность.Затем объект нагревают, превращая порошок в тонкую пленку. Доступны акриловые, полиэфирные, нейлоновые, виниловые, эпоксидные и уретановые порошки. Порошки наносятся методом электростатического распыления. На электропроводящий объект распыляется заряженный непроводящий порошок.

 серная кислота
серная кислота