Методическая разработка по теме: Контрольная работа на тему «Углеводороды»
Пояснительная записка.
Кузнецова Ирина Вячеславовна
Преподаватель химии
ОГБОУ НПО ПУ-36
Тема: «Углеводороды».
Цель: проконтролировать уровень усвоения обучающимися знаний и умений
по теме: «Углеводороды».
Курс 2
Программа Г.Е.Рудзитис
Количество часов в неделю: 2
Форма контроля: письменная, тестовая
Вид контроля: итоговый
Уровень А — тесты выборки
Уровень В – тесты сличения
Уровень С – тесты напоминания
Контрольная работа была составлена на основе обязательного минимума содержания курса химии, Химия: конкурсные задания и ответы В. Н. Ушкалова, Н.В. Иоанидис. М. Просвещение, 2000г,учебно- тренировочные материалы для подготовки учащихся . ЕГЭ 2008. А.А. Каверина, А.С. Корощенко, Ю.Н. Медведев, А.В. Яшукова./ ФИПИ- М.: Интеллект- Центр, 2008, сборника контрольных измерительных материалов ЕГЭ М. Просвещение 2008,2009, 2010.
Задания составлены согласно требованиям Е Г Э и состоят из 3-х частей А, В, С.
Часть А. Тестовые задания с выбором ответа. За задание 1 балл,
Часть Б. Задания со свободным ответом,
Часть С. Задача.
Критерии оценок за работу: Максимальное количество баллов-23.
«5» — 17 – 23 баллов (76 — 100%),
«4» — 11 – 22 баллов (47 – 75%),
«3» — 8 – 10 баллов (34 – 46%),
«2» менее 8 баллов
В контрольную работу были включены вопросы и задания по теме: «Углеводороды»:
1.Общая формула классов углеводородов.
2.Номенклатура.
3.Гомологи и изомеры.
4.Химические реакции данных классов.
5.Генетическая связь между классами.
6.Основные области применения.
7.Задача на нахождение формулы.
Контрольная работа по теме «Углеводороды»
Вариант 1
Часть А. Тестовые задания с выбором ответа. За задание 1 балл
- Укажите общую формулу аренов
1) Cnh3n +2 2) Cnh3n 3) Cnh3n—2 4) Cnh3n -6
- Укажите к какому классу относится УВ с формулой СН3 – СН3
1) алканов 2) алкенов 3) алкинов 4) аренов
- Укажите название изомера для вещества, формула которого СН2 = СН – СН2 – СН3
1) 2 метилбутен 2 2) бутен 2 3) бутан 4) бутин 1
- Укажите название гомолога для пентадиена 1,3
1) бутадиен 1,2 2) бутадиен 1,3 3) пропадиен 1,2 4) пентадиен 1,2
- Укажите название вещества, для которого характерна реакция замещения
1) бутан 2) бутен 1 3) бутин 4) бутадиен 1,3
- Укажите название вещества, для которого характерна реакция гидрирования
1) пропен 2) пропан 3) этан 4) бутан
t Ni, +H
- Укажите формулу вещества X в цепочке превращений СН4 → X → С2Н6
1) CO2 2) C2h3 3) C3H8 4) C2H6
- Укажите, какую реакцию применяют для получения УВ с более длинной цепью
1) Вюрца 2) Кучерова 3) Зайцева 4) Марковникова
- Укажите формулы веществ, которые вступают в реакцию друг с другом
1) С2Н4 и СН4 2) С3Н8 и Н2 3) С6Н6 и Н2О 4) С2Н4 и Н2
- Определите, сколько молей углекислого газа образуется при полном сгорании метана
1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
- Сколько литров углекислого газа образуется при сжигании 4,2 г пропена
1) 3,36 л 2) 6,36 л 3) 6,72 л 4) 3,42 л
Часть Б. Задания со свободным ответом
Задания со свободным ответом
- Перечислите области применения алкенов. 2 балла
- Напишите уравнения химических реакций для следующих превращений: 6 баллов
Ch5 → Ch4Cl → C2H6 → C2H5NO2
Дайте названия продуктам реакции
Часть С. Задача
14. Выведите молекулярную формулу УВ, массовая доля углерода в котором составляет 83,3%. Относительная плотность паров этого вещества по водороду составляет 29. 4 балла
Контрольная работа по теме «Углеводороды»
Вариант 2
Часть А. Тестовые задания с выбором ответа. За задание 1 балл
1. Укажите общую формулу алкенов
1) Cnh3n +2 2) Cnh3n 3) Cnh3n—2 4) Cnh3n -6
- Укажите к какому классу относится УВ с формулой СН3 – С = СН2
|
СН3
1) алканов 2) алкенов 3) алкинов 4) аренов
3. Укажите название изомера для вещества, формула которого СН3 — С = С – СН3
Укажите название изомера для вещества, формула которого СН3 — С = С – СН3
1) пентин 2 2) бутан 3) бутен 2 4) бутин 1
4. Укажите название гомолога для бутана
1) бутен 2) бутин 3) пропан 4) пропен
5. Укажите название вещества, для которого характерна реакция замещения
1) гексан 2) гексен 1 3) гексин 1 4) гексадиен 1,3
6. Укажите название вещества, для которого характерна реакция гидрирования
1) метан 2) пропан 3) пропен 4) этан
t, Pt +HСl
- Укажите формулу вещества X в цепочке превращений С3Н8 → СН2 = СН – СН3 → X
1) Ch3Cl – CHCl – Ch4 2) Ch4 – CCl2 – Ch4 3) Ch4 – CHCl – Ch4 4) Ch3Cl – Ch3 – Ch4
- Укажите, согласно какому правилу осуществляется присоединение галогеноводородов к несимметричным алкенам
1) Вюрца 2) Кучерова 3) Зайцева 4) Марковникова
- Укажите формулы веществ, которые вступают в реакцию друг с другом
1) С3Н8 и О2 2) С2Н4 и СН4 3) С4Н10 и НCl 4) С2Н6 и Н2О
- Определите, сколько молей углекислого газа образуется при полном сгорании этана
1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
11. Сколько в граммах паров воды образуется при сжигании 5,8 г бутана
Сколько в граммах паров воды образуется при сжигании 5,8 г бутана
1) 9 г 2) 15 г 3) 12 г 4) 18 г
Часть Б. Задания со свободным ответом
12. Перечислите области применения алканов. 2 балла
13. Напишите уравнения химических реакций для следующих превращений: 6 баллов
CаС2 → C2Н2 → C6H6 → C6H5NO2
Дайте названия продуктам реакции
Часть С. Задача
14. Выведите молекулярную формулу УВ, массовая доля углерода и водорода в котором составляют 81,82% и 18,18% . Относительная плотность паров этого вещества по водороду составляет 2. 4 балла
Контрольная работа по теме «Углеводороды»
Вариант 3
Часть А. Тестовые задания с выбором ответа. За задание 1 балл
1. Укажите общую формулу алкинов
1) Cnh3n +2 2) Cnh3n 3) Cnh3n—2 4) Cnh3n -6
2. Укажите к какому классу относится УВ с формулой С6Н5 – СН3
Укажите к какому классу относится УВ с формулой С6Н5 – СН3
1) алканов 2) алкенов 3) алкинов 4) аренов
- Укажите название изомера для вещества, формула которого СН3 – СН — СН2 – СН3
|
СН3
1) бутан 2) 2 метилпропан 3) 3 метилпентан 4) пентан
4. Укажите название гомолога для бутина 1
1) бутин 2 2) пентин 2 3) пентин 1 4) гексин 2
5. Укажите название вещества, для которого характерна реакция замещения
1) гексан 2) гексен 1 3) гексин 1 4) гексадиен 1,3
6. Укажите название вещества, для которого характерна реакция полимеризации
1) бутадиен 1,3 2) бутан 3) бензол 4) циклогексан
+ HSO +HСl
7. Укажите формулу вещества X в цепочке превращений С2Н5ОН → X → СН3 – СН2 Cl
Укажите формулу вещества X в цепочке превращений С2Н5ОН → X → СН3 – СН2 Cl
1) C2h3 2) C2h5 3) C2H6 4) C3H6
8. Укажите название реакции присоединения к ацетилену воды
1) Вюрца 2) Кучерова 3) Зайцева 4) Марковникова
9. Укажите формулы веществ, которые вступают в реакцию друг с другом
1) С2Н6 и HCl 2) С2Н4 и Сl2 3) С2Н16 и Н2O 4) С6Н6 и Н2О
10. Определите, сколько молей углекислого газа образуется при полном сгорании этена
1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
11. Сколько литров углекислого газа образуется, при сжигании 6,8 г пентина
1) 3,36 л 2) 11,2 л 3) 6,72 л 4) 3,42 л
Часть Б. Задания со свободным ответом
12. Перечислите области применения алкинов. 2 балла
13. Напишите уравнения химических реакций для следующих превращений: 6 баллов
СН4 → C2Н2 → C6H6 → C6H5Cl
Дайте названия продуктам реакции
Часть С. Задача
Задача
14. Выведите молекулярную формулу УВ, массовая доля углерода и водорода в котором составляют 92,31% и 7,69% . Относительная плотность паров этого вещества по водороду составляет 13. 4 балла
Контрольная работа по теме «Углеводороды»
Вариант 4
Часть А. Тестовые задания с выбором ответа. За задание 1 балл
1. Укажите общую формулу алканов
1) Cnh3n +2 2) Cnh3n 3) Cnh3n—2 4) Cnh3n -6
- Укажите к какому классу относится УВ с формулой СН = С – СН3
1) алканов 2) алкенов 3) алкинов 4) аренов
3. Укажите название изомера для вещества, формула которого СН2 = СН — СН = СН2
1) 2 метилбутадиен 1,3 2) бутин 1 3) бутен 1 4) бутан
4. Укажите название гомолога для 2 метилпропана
1) 2 метилбутан 2) 2 метилбутен 1 3) пропан 4) пропен
5. Укажите название вещества, для которого характерна реакция гидратации
Укажите название вещества, для которого характерна реакция гидратации
1) ацетилен 2) бутан 3) полиэтилен 4) циклобутан
6. Укажите название вещества, для которого характерна реакция присоединения
1) метан 2) пропан 3) пропен 4) этан
t, С актив.
7. Укажите формулу вещества X в цепочке превращений СН4 → С2Н2 → X
1) С6Н6 2) C5Н14 3) С6Н5 – СН3 4) C6Н12
8. Укажите, согласно какому правилу осуществляется отщепление галогеноводорода
1) Вюрца 2) Кучерова 3) Зайцева 4) Марковникова
9. Укажите формулы веществ, которые вступают в реакцию друг с другом
1) СН4 и Н2 2) С6Н6 и Н2О 3) С2Н2 и Н2О 4) С2Н6 и Н2О
10. Определите, сколько молей углекислого газа образуется при полном сгорании этина
1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
11.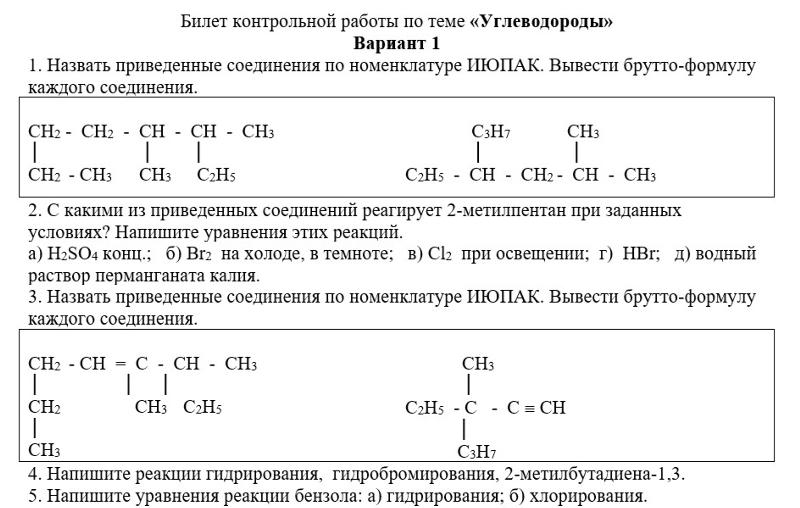 Сколько литров кислорода потребуется для сжигания 8,4 г гексена
Сколько литров кислорода потребуется для сжигания 8,4 г гексена
1) 20,16 л 2) 10,12 л 3) 21,16 л 4) 11,12 л
Часть Б. Задания со свободным ответом
12. Перечислите области применения аренов. 2 балла
13. Напишите уравнения химических реакций для следующих превращений: 6 баллов
С2Н5ОН → C2Н4 → C2H5Cl → C4h20
Дайте названия продуктам реакции
Часть С. Задача
14. Выведите молекулярную формулу УВ, массовая доля углерода и водорода в котором составляют 85,7% и 14,3% . Относительная плотность паров этого вещества по водороду составляет 28. 4 балла
Эталоны ответов
№ п/п | 1 вариант | 2 вариант | 3 вариант | 4 вариант |
1 | 4 | 2 | 3 | 1 |
2 | 1 | 2 | 4 | 3 |
3 | 2 | 4 | 4 | 2 |
4 | 2 | 3 | 3 | 1 |
5 | 1 | 1 | 1 | 1 |
6 | 1 | 3 | 1 | 3 |
7 | 2 | 3 | 2 | 1 |
8 | 1 | 4 | 2 | 3 |
9 | 4 | 1 | 2 | 3 |
10 | 2 | 4 | 2 | 4 |
11 | 3 | 1 | 2 | 3 |
12 | Производство полимеров, растворителей, уксусной кислоты, этанола, созревания плодов | Производство сажи, резины, типографской краски, органических соединений, фреонов, метанола, ацетилена | Производство растворителей, ацетона, уксусной кислоты, этанола, клея, резки и сварки металлов | Производство растворителей, анилина, фенола, пестицидов, лекарственных препаратов, феноформальдегидных смол |
13 | 1) Ch5 + Cl2 → Ch4Cl + HCl хлорметан р. 2)2 Ch4Cl + 2Na → C2H6 + 2NaCl этан р. Вюрца 3) C2H6+HNO3 →C2H5NO2 +h3O нитроэтан р. замещения (нитрование) | 1) СаC2 + 2Н2О → C2Н2 + Са(ОН)2 ацетилен р. получения ацетилена 2) 3C2Н2 → C6H6 бензол р. тримеризации 3) C6H6+HNO3 →C6H5NO2 +h3O нитробензол р. замещения (нитрование) | 1) 2Ch5 → C2Н2 + 3h3 ацетилен р. разложения 2) 3C2Н2 → C6H6 бензол р. тримеризации 3) C6H6+ Cl2 →C6H5Cl +HCl хлорбензол р. замещения (галогенирование) | 1) C2H5ОН → C2h5 + h3О этилен р. 2) C2h5 + HCl → C2H5Cl хлорэтан р. присоединения (гидрогалогенирование) 3) 2C2H5Cl+2Nа →C4h20 +2NaCl р. Вюрца бутан |
14 | 1) М(СхНу)=29 ·2=58г/моль 2) υ(C)=(0,833·58)/12=4моль 3) υ(Н)= 0,167·58/1 = 8моль Ответ: С4Н8 | 1) М(СхНу)=2 · 2= 4г/моль 2) υ(C)=(0,8182· 4) /12 =2моль 3) υ(Н)=(0,1818 · 4)/1 =6моль Ответ: С2Н6 | 1) МСхНу)=13 · 2 =26г/моль 2) υ(C)=(0,9213 · 26) /12 =2моль 3) υ(Н)=(0,0769 · 26)/1 = 2моль Ответ: С2Н2 | 1) МСхНу)=28 · 2 =56г/моль 2) υ(C)=(0,857 · 56) /12 =4моль 3) υ(Н)=(0,143 · 56)/1 = 8моль Ответ: С4Н8 |
Критерии оценок
«5» — 17 – 23 баллов (76 — 100%)
«4» — 11 – 22 баллов (47 – 75%)
«3» — 8 – 10 баллов (34 – 46%)
«2» менее 8 баллов
Контрольная работа по теме «Углеводороды» 10 класс (базовый уровень) УМК О. С.Габриеляна | Тест по химии (10 класс) на тему:
С.Габриеляна | Тест по химии (10 класс) на тему:
Контрольная работа по теме «Углеводороды»
Вариант 1
Часть А. Тестовые задания с выбором ответа
(За задание 1 балл)
- Укажите общую формулу алканов
1) Cnh3n 2) Cnh3n +2 3) Cnh3n—2 4) Cnh3n -6
- Укажите к какому классу относится углеводород с формулой СН3 – СН3
1) алканов 2) алкенов 3) алкинов 4) аренов
- Укажите название изомера для вещества, формула которого СН2 = СН – СН2 – СН3
1) 2-метилбутен-2 2) бутен-2 3) бутан 4) бутин-1
- Укажите название гомолога для пентадиена-1,3
1) бутадиен-1,2 2) бутадиен-1,3 3) пропадиен-1,2 4) пентадиен-1,2
- Укажите название вещества, для которого характерна реакция замещения
1) бутан 2) бутен-1 3) бутин-2 4) бутадиен-1,3
- Укажите название вещества, для которого характерна реакция гидрирования
1) пропен 2) пропан 3) этан 4) бутан
15000c Ni, +h3
- Укажите формулу вещества X в цепочке превращений СН4 → X → С2Н6
1) CO2 2) C2h3 3) C3H8 4) C2H6
- Укажите формулы веществ, которые вступают в реакцию друг с другом
1) С2Н4 и СН4 2) С3Н8 и Н2 3) С6Н6 и Н2О 4) С2Н4 и Н2
- Определите, сколько молей углекислого газа образуется при полном сгорании метана
1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
Часть Б. Задания со свободным ответом
Задания со свободным ответом
- Сколько литров углекислого газа образуется при сжигании 4,2 г пропена? (3 балла)
- Напишите структурную формулу 3-метилбутена-1. Составьте структурные формулы одного
изомера и одного гомолога, назовите эти вещества. (5 баллов)
- Напишите уравнения химических реакций для следующих превращений:
СН4 → C2Н2 → C6H6 → C6H5Cl
Дайте названия продуктам реакции. (6 баллов)
Контрольная работа по теме «Углеводороды»
Вариант 2
Часть А. Тестовые задания с выбором ответа. За задание 1 балл
1. Укажите общую формулу алкенов
1) Cnh3n +2 2) Cnh3n 3) Cnh3n—2 4) Cnh3n -6
- Укажите к какому классу относится углеводород с формулой СН3 – С = СН2
|
СН3
1) алканов 2) алкенов 3) алкинов 4) аренов
3. Укажите название изомера для вещества, формула которого СН3 — СН = СН – СН3
Укажите название изомера для вещества, формула которого СН3 — СН = СН – СН3
1) пентин-2 2) бутан 3) бутен-2 4) бутен-1
4. Укажите название гомолога для бутана
1) бутен 2) бутин 3) пропан 4) пропен
5. Укажите название вещества, для которого характерна реакция замещения
1) гексан 2) гексен-1 3) гексин-3 4) гексадиен-1,3
6. Укажите название вещества, для которого характерна реакция гидрирования
1) метан 2) пропан 3) пропен 4) этан
t, Ni +HСl
- Укажите формулу вещества X в цепочке превращений С3Н8 → СН2 = СН – СН3 → X
1) Ch3Cl – CHCl – Ch4 2) Ch4 – CCl2 – Ch4 3) Ch4 – CHCl – Ch4 4) Ch3Cl – Ch3 – Ch4
- Укажите формулы веществ, которые вступают в реакцию друг с другом
1) С3Н8 и О2 2) С2Н4 и СН4 3) С4Н10 и НCl 4) С2Н6 и Н2О
- Определите, сколько молей углекислого газа образуется при полном сгорании этана
1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
Часть Б. Задания со свободным ответом
Задания со свободным ответом
10. Сколько в граммах паров воды образуется при сжигании 5,8 г бутана? (3 балла)
- Напишите структурную формулу 3-метилпентина-1. Составьте структурные формулы одного
изомера и одного гомолога, назовите эти вещества. (5 баллов)
- Напишите уравнения химических реакций для следующих превращений:
CаС2 → C2Н2 → C6H6 → C6H5NO2
Дайте названия продуктам реакции. (6 баллов)
Контрольная работа по теме «Углеводороды»
Контрольная работа №1по теме «Углеводороды».10 класс.
Вариант №1
1.Для углеводорода СН≡С-СН2- СН2-СН3 записать структурные формулы 3 изомеров разного вида и 1 гомолога. Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
СН4 → СН3Сl → С2Н6 → С2Н4 → С2Н2
3.Определить молекулярную формулу вещества, если массовая доля углерода– 92,31% , остальное — водород. Относительная плотность паров вещества по водороду — 39 .
Относительная плотность паров вещества по водороду — 39 .
Вариант №2
1.Для углеводорода СН2=СН-СН2- СН2- СН= СН2 записать структурные формулы 3 изомеров разного вида и 1 гомолога. Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
CaC2 → С2Н2 → С2Н4 → С2Н5Br → С2Н4 Br2
3.Определить молекулярную формулу вещества, если массовая доля водорода 11,11%, остальное — углерод. Относительная плотность паров вещества по воздуху – 1,863 .
Вариант №3
1.Для углеводорода СН3- СН2- СН= СН СН2-СН3 записать структурные формулы 3 изомеров разного вида и 1 гомолога. Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
СН4→ С2Н2 →C6H6 → C6H5Сl → C6h5Сl2
3.Определить молекулярную формулу вещества, если массовая доля углерода 90% , остальное — водород. Относительная плотность паров вещества по водороду — 20.
Вариант №4 СН3
׀
1. Для углеводорода СН3- СН- СН= СН- СН2-СН3 записать структурные формулы 3 изомеров разного вида и 1 гомолога. Назвать все вещества.
Для углеводорода СН3- СН- СН= СН- СН2-СН3 записать структурные формулы 3 изомеров разного вида и 1 гомолога. Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
С2Н5Br →С2Н4 → С2Н2 → СН3-COH
↓
C6H6
3.Определить молекулярную формулу вещества, если массовая доля углерода 92,3%, остальное — водороду. Относительная плотность паров вещества по водороду — 13 .
Вариант №5 СН3
׀
1.Для углеводорода СН3- СН- СН= СН- СН2-СН3 записать структурные формулы
׀
СН3
3 изомеров разного вида и 1 гомолога. Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
С2Н6 → С2Н5Br → С3Н8 → С3Н7 Сl → С3Н6
3.Определить молекулярную формулу вещества, если массовая доля углерода 85,7%, остальное — водород. Относительная плотность паров вещества по углекислому газу 1,593.
Относительная плотность паров вещества по углекислому газу 1,593.
Вариант №6 СН3
׀
1.Для углеводорода СН2 =С -СН2- СН2- СН= СН2 записать структурные формулы 3 изомеров разного вида и 1 гомолога. Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
CaCO3→ CaO →CaC2 → С2Н2 → C6H6
3.Определить молекулярную формулу вещества, если массовая доля водорода 14.3%, остальное — углерод. Относительная плотность паров вещества по углекислому газу 1,593.
Вариант №7
1.Для углеводорода СН3 -С≡С-СН2- СН2-СН3 записать структурные формулы 3 изомеров разного вида и 1 гомолога. Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
С3Н8 → С3Н6 → С3Н4 → СН3-С -СН3
↓ ‖
С3Н7OH O
3.Определить молекулярную формулу вещества, если массовая доля углерода 85,7%, остальное — водород. Относительная плотность паров вещества по водороду -21.
Относительная плотность паров вещества по водороду -21.
Вариант №8 СН3
׀
1.Для углеводорода СН≡С-СН- СН2-СН3 записать структурные формулы 3 изомеров разного вида и 1 гомолога. Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
С3Н6→ С3Н8→ С3Н7 Сl → C6h24 → C6H6
3.Определить молекулярную формулу вещества, если массовая доля водорода 20%, остальное — углерод. Относительная плотность паров вещества по воздуху – 1,035.
Вариант №9
1.Для углеводорода 1,3-диметилбензола записать его структурную формулу, структурные формулы 3 изомеров и 1 гомолога. Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
С2Н3Сl→ С2Н2 → C6H6 → C6H6Сl6
↓
C6H5NO2
3.Определить молекулярную формулу вещества, если массовая доля углерода 85,7%, остальное — водород. Относительная плотность паров вещества по азоту — 2 .
Относительная плотность паров вещества по азоту — 2 .
׀
Вариант №10
1.Для углеводорода 1,3-диэтилциклобутана записать его структурную формулу, структурные формулы 3 изомеров и 1 гомолога. Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
C6h24 → С3Н6 → С3Н7Сl → С3Н6 → С3Н8
3.Определить молекулярную формулу вещества, если массовая доля углерода 75%, остальное – водород. Относительная плотность паров вещества по азоту -0,572.
Вариант №11
1.Для углеводорода 2,4-диметил-3-этилпентена-1 записать его структурную формулу, структурные формулы 3 изомеров разного вида и 1 гомолога. Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
бутан→ хлорбутан→ бутен→ хлорбутан→ октан
3.Определить молекулярную формулу вещества, если массовая доля водорода 25%, остальное — углерод. Относительная плотность паров вещества по кислороду – 0,5.
Вариант №12 СН3 СН3
׀ ׀
1.Для углеводорода СН2 =С -СН2- СН2- СН-СН3 структурные формулы 3 изомеров разного вида и 1 гомолога. Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
СН4 → СН3Сl → С2Н6 → С2Н4 → СО2
3.Определить молекулярную формулу вещества, если массовая доля углерода 80%, остальное — водород. Относительная плотность паров вещества по водороду — 15 .
Вариант №13 СН3 СН3
׀ ׀
1.Для углеводорода СН2 =С –СН =СН — СН-СН3 записать структурные формулы 3 изомеров разного вида и 1 гомолога. Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
С2Н4 → С2Н2 → C6H6 → C6H5Сl
↓
C6H5NO2
3.Определить молекулярную формулу вещества, если массовая доля углерода 85,71, остальное – водород. Относительная плотность паров вещества по воздуху – 1,931 .
Относительная плотность паров вещества по воздуху – 1,931 .
Вариант №14 СН3 СН3
׀ ׀
1.Для углеводорода СН3 — СН –С ≡ С — СН-СН3 записать структурные формулы 3 изомеров разного вида и 1 гомолога. Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
С2Н4 → С2Н5 OH → С2Н4 → С2Н2 → C6H6
3.Определить молекулярную формулу вещества, если массовая доля углерода 81,8%, остальное — водород. Относительная плотность паров вещества по азоту – 1,57.
Вариант №15
1.Для углеводорода 1,3,5-триметилбензола записать его структурную формулу, структурные формулы 3 изомеров и 1 гомолога. Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
С2Н4 → С2Н5 Сl → С3Н8 → С3Н6 → С3Н7 OH
3.Определить молекулярную формулу вещества, если массовая доля водорода 15,79%, остальное — углерод. Относительная плотность паров вещества по воздуху – 3,93.
Относительная плотность паров вещества по воздуху – 3,93.
Вариант №16
1.Для углеводорода пропилциклопропана записать его структурную формулу, структурные формулы 3 изомеров и 1 гомолога. Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
С2Н6 → С2Н5Br → С2Н4 → С2Н2 → уксусный альдегид
3.Определить молекулярную формулу вещества, если массовая доля углерода 51,89%, массовая доля водорода 9,73%, остальное — хлор. Относительная плотность паров вещества по воздуху 3,19.
Вариант №17
1.Для углеводорода 2,4,6-триметил-3,5диэтилоктана записать его структурную формулу, структурные формулы 3 изомеров и 1 гомолога. Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
СН4 → СН3Сl → С3Н8 → С3Н6→ СО2
3.Определить молекулярную формулу вещества, если массовая доля углерода 83,3%, остальное — водород. Относительная плотность паров вещества по водороду — 36 .
Вариант №18
1. Для углеводорода 1-метил-3- этилбензола записать его структурную формулу, структурные формулы 3 изомеров и 1 гомолога. Назвать все вещества.
Для углеводорода 1-метил-3- этилбензола записать его структурную формулу, структурные формулы 3 изомеров и 1 гомолога. Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
С3Н8→С3Н7Br →С3Н6→ С3Н6Сl2
↓
С3Н7OH
3.Определить молекулярную формулу вещества, если массовая доля углерода 52,18%, массовая доля водорода 13,04%, остальное — кислород. Относительная плотность паров вещества по водороду – 23.
Вариант №19 СН3
׀
1.Для углеводорода СН≡С-СН — СН2- СН2-СН3 записать структурные формулы 3 изомеров разного вида и 1 гомолога. Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
СН4 → СН3Сl → С2Н6 → С2Н5OH → СО2
3.Определить молекулярную формулу вещества, если массовая доля углерода 54,55%, массовая доля водорода 9.09%, остальное – кислород; простейшая формула является истинной.
Вариант №20
1.Для углеводорода СН3 -СН2- СН2-С≡С-СН2- СН2-СН3 записать структурные формулы 3 изомеров разного вида и 1 гомолога. Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
С2Н4 → С2Н4 Сl2 → С2Н4 → С2Н2 → C6H6
3.Определить молекулярную формулу вещества, если массовая доля углерода 54.4%, массовая доля водорода 9,2%, остальное — кислород. Относительная плотность паров вещества по водороду -44.
Вариант №21 СН3 СН3
׀ ׀
1.Для углеводорода СН3- СН — С = СН – СН -СН3 записать структурные формулы 3 изомеров
׀
СН3
разного вида и 1 гомолога. Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
C6h24 → С3Н8 → С3Н7Сl → С3Н6 → С3Н7OH
3.Определить молекулярную формулу вещества, если массовая доля углерода38,7%, массовая доля водорода 16. 15%, остальное — азот. Относительная плотность паров вещества по водороду – 15,5.
15%, остальное — азот. Относительная плотность паров вещества по водороду – 15,5.
Вариант №22 СН3 СН3 СН3
׀ ׀ ׀
1.Для углеводорода СН3- СН- СН= С — СН -СН3 записать структурные формулы 3 изомеров
разного вида и 1 гомолога. Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
СН4 → СН3Сl → С2Н6 → С2Н4 → С2Н2
3.Определить молекулярную формулу вещества, если массовая доля углерода 61%, массовая доля водорода 15,3%, остальное — азот. Относительная плотность паров вещества по кислороду – 1,844 .
Вариант №23 СН3 С2Н5
׀ ׀
1.Для углеводорода СН3- СН — С≡С-СН- СН2-СН3 записать структурные формулы 3 изомеров разного вида и 1 гомолога. Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
С3Н6 → С3Н7 Сl→ C6h24 → C6H6 → C6H5NO2
3. Определить молекулярную формулу вещества, если массовая доля углерода 84, 375%, стальное — водород. Относительная плотность паров вещества по воздуху – 4,414.
Определить молекулярную формулу вещества, если массовая доля углерода 84, 375%, стальное — водород. Относительная плотность паров вещества по воздуху – 4,414.
Вариант №24 С2Н5
׀
1.Для углеводорода СН3- СН2 — С≡С — СН- СН2-СН3 записать структурные формулы 3 изомеров разного вида и 1 гомолога. Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
Метан →ацетилен →бензол →хлорбензол
↓
ацетальдегид
3.Определить молекулярную формулу вещества, если массовая доля водорода 14,28%, остальное — углерод. Относительная плотность паров вещества по водороду – 42.
Вариант №25 СН3 СН3
׀ ׀
1.Для углеводорода СН3- СН — С = СН – СН -СН3 записать структурные формулы 3 изомеров
׀
С2Н5
разного вида и 1 гомолога. Назвать все вещества.
Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
С3Н8 → С3Н6 → С3Н4 → СН3-С -СН3
↓ ‖
С3Н7OH O
3.Определить молекулярную формулу вещества, если массовая доля углерода 37,5%, остальное — кальций. Простейшая формула является истинной.
Вариант №26
1.Для углеводорода 1,2,4-триметилбензол записать его структурную формулу, структурные формулы 3 изомеров и 1 гомолога. Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
С2Н6 → С2Н5 Сl→ С2Н4 → С2Н2 → C6H6
3.Определить молекулярную формулу вещества, если массовая доля углерода 90,56%, остальное — водород. Относительная плотность паров вещества по водороду — 53.
Вариант №27 С2Н5
׀
1.Для углеводорода СН≡С-СН — СН2- СН2-СН3 записать структурные формулы 3 изомеров разного вида и 1 гомолога. Назвать все вещества.
Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
C6h24 → С3Н6 → С3Н7Сl → С3Н6 → С3Н7OH
3.Определить молекулярную формулу вещества, если массовая доля водорода 7,7%, остальное — углерод. Относительная плотность паров вещества по кислороду – 2,4375.
Вариант №28
1.Для углеводорода 2-этилтолуола записать его структурную формулу, структурные формулы 3 изомеров и 1 гомолога. Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
СН4 → СН3Сl → С2Н6 → С2Н4 → С2Н2
3.Определить молекулярную формулу вещества, если массовая доля углерода 80%, массовая доля водорода 20% . Относительная плотность паров вещества по водороду -15.
Вариант №29 СН3 СН3
׀ ׀
1.Для углеводорода СН2 =С –СН = С – СН2 -СН3 записать структурные формулы 3 изомеров разного вида и 1 гомолога. Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
CaC2→ С2Н2 → С2Н4 → С2Н5Br →бутан
3.Определить молекулярную формулу вещества, если массовая доля углерода 90%, массовая доля водорода 10%. Относительная плотность паров вещества по водороду — 20 .
Вариант №30
1.Для углеводорода СН3 С2Н5
׀ ׀
1.Для углеводорода СН2 =С –СН = С – СН2 -СН3 записать структурные формулы 3 изомеров разного вида и 1 гомолога. Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
СН4→ С2Н2 →C6H6 → C6H5Сl → C6h5Сl2
3.Определить молекулярную формулу вещества, если массовая доля углерода 84,85%, остальное — водород. Плотность паров вещества при нормальных условиях 8,84 г/л.
Вариант №31
1.Для углеводорода СН3- СН — С = СН – СН -СН3 записать структурные формулы 3 изомеров
׀
С3Н7
разного вида и 1 гомолога. Назвать все вещества.
Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
С3Н8 → С3Н6 → С3Н4 → СН3-С -СН3
↓ ‖
С3Н7OH O
3.Определить молекулярную формулу вещества, если массовая доля углерода 85,71%, массовая доля водорода 14,29%. Относительная плотность паров вещества по воздуху 4,35.
Вариант №32 С3Н7
׀
1.Для углеводорода СН≡С — СН — СН2- СН2-СН3 записать структурные формулы 3 изомеров разного вида и 1 гомолога. Назвать все вещества.
2.Осуществить превращения. Указать условия проведения реакций.
C6h24 → С3Н6 → С3Н7Сl → С3Н6 → С3Н8
3.Определить молекулярную формулу вещества, если массовая доля углерода 81,82%, остальное — водород. Масса 1л углеводорода при (н.у.) составляет 1,964г.
Контрольная работа по химии «Углеводороды» (10 класс)
Контрольная работа по теме «Углеводороды»
10 класс (базовый уровень)
Автор: Бурмасова С. М. учитель химии МБОУ СОШ №24
М. учитель химии МБОУ СОШ №24
Контрольная работа по теме «Углеводороды»
Вариант 1
Часть А. Тестовые задания с выбором ответа. За задание 1 балл
1. Укажите общую формулу алкенов
1) CnH2n +2 2) CnH2n 3) CnH2n—2 4) CnH2n -6
Укажите к какому классу относится углеводород с формулой СН3 – С = СН2
|
СН3
1) алканов 2) алкенов 3) алкинов 4) аренов
3. Укажите название изомера для вещества, формула которого СН3 — С ≡ С – СН3
1) пентин-2 2) бутан 3) бутен-2 4) бутин-1
4. Укажите название гомолога для бутана
1) бутен 2) бутин 3) пропан 4) пропен
5. Укажите название вещества, для которого характерна реакция замещения
1) гексан 2) гексен-1 3) гексин-1 4) гексадиен-1,3
6. Укажите название вещества, для которого характерна реакция гидрирования
Укажите название вещества, для которого характерна реакция гидрирования
1) метан 2) пропан 3) пропен 4) этан
t, Pt +HСl
7.Укажите формулу вещества X в цепочке превращений С
1) CH2Cl – CHCl – CH3 2) CH3 – CCl2 – CH3 3) CH3 – CHCl – CH3
4) CH2Cl – CH2 – CH3
8.Укажите, согласно какому правилу осуществляется присоединение галогеноводородов к несимметричным алкенам
1) Вюрца 2) Кучерова 3) Зайцева 4) Марковникова
9.Укажите формулы веществ, которые вступают в реакцию друг с другом
1) С3Н8 и О2 2) С2Н4 и СН4 3) С4Н10 и НCl 4) С
10. Определите, сколько молей углекислого газа образуется при полном сгорании 1 моль этана
Определите, сколько молей углекислого газа образуется при полном сгорании 1 моль этана
1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
11. Сколько в граммах паров воды образуется при сжигании 5,8 г бутана
1) 9 г 2) 15 г 3) 12 г 4) 18 г
Часть Б. Задания со свободным ответом
12. Перечислите области применения алканов. (2 балла)
13. Напишите уравнения химических реакций для следующих превращений: (6 баллов)
CаС2 → C2Н2
Дайте названия продуктам реакции
Часть С. Задача
14. Какой объем воздуха потребуется для полного сгорания 12л дивинила? (Объемная доля кислорода в воздухе составляет 21%) 4 балла
Контрольная работа по теме «Углеводороды»
Вариант 2
Часть А. Тестовые задания с выбором ответа. За задание 1 балл
За задание 1 балл
1. Укажите общую формулу алканов
1) CnH2n +2 2) Cn
2. Укажите к какому классу относится углеводород с формулой С6Н5 – СН3
1) алканов 2) алкенов 3) алкинов 4) аренов
Укажите название изомера для вещества, формула которого СН3 – СН — СН2 – СН3
|
СН3
1) бутан 2) 2-метилпропан 3) 3-метилпентан 4) пентан
4. Укажите название гомолога для бутина-1
1) бутин-2 2) пентин-2 3) пентин-1 4) гексин-2
5. Укажите название вещества, для которого характерна реакция замещения
1) гексан 2) гексен-1 3) гексин-1 4) гексадиен-1,3
6. Укажите название вещества, для которого характерна реакция полимеризации
1) бутадиен-1,3 2) бутан 3) бензол 4) циклогексан
t, H2SO4 +HСl
7. Укажите формулу вещества X в цепочке превращений С2Н5ОН → X →
Укажите формулу вещества X в цепочке превращений С2Н5ОН → X →
→ СН3 – СН2Cl
1) C2H2 2) C2H4 3) C2H6 4) C3H6
8. Укажите название реакции присоединения к ацетилену воды
1) Вюрца 2) Кучерова 3) Зайцева 4) Марковникова
9. Укажите формулы веществ, которые вступают в реакцию друг с другом
1) С2Н6 и HCl 2) С2Н4 и Сl2 3) С2Н16 и Н2O 4) С6Н6 и Н2О
10. Определите, сколько молей углекислого газа образуется при полном сгорании 1 моль этена
1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
11. Сколько литров углекислого газа образуется, при сжигании 6,8 г пентина
1) 3,36 л 2) 11,2 л 3) 6,72 л 4) 3,42 л
Часть Б. Задания со свободным ответом
12.
13. Напишите уравнения химических реакций для следующих превращений:(6 баллов)
СН4 → C2Н2 → C6H6 → C6H5Cl
Дайте названия продуктам реакции
Часть С. Задача
14. Какой объем воздуха потребуется для полного сгорания 44,8 л этилена?
(Объемная доля кислорода в воздухе составляет 21%) 4 балла
Контрольная работа по теме «Углеводороды»
Вариант 3
Часть А. Тестовые задания с выбором ответа. За задание 1 балл
1. Укажите общую формулу алкинов
1) CnH2n +2 2) CnH2n 3) CnH2n—2 4) CnH2n -6
Укажите к какому классу относится углеводород с формулой СН ≡ С – СН3
1) алканов 2) алкенов 3) алкинов 4) аренов
3. Укажите название изомера для вещества, формула которого СН2 = СН — СН = СН2
Укажите название изомера для вещества, формула которого СН2 = СН — СН = СН2
1) 2 метилбутадиен-1,3 2) бутин-1 3) бутен-1 4) бутан
4. Укажите название гомолога для 2-метилпропана
1) 2-метилбутан 2) 2 метилбутен-1 3) пропан 4) пропен
5. Укажите название вещества, для которого характерна реакция гидратации
1) ацетилен 2) бутан 3) полиэтилен 4) циклобутан
6. Укажите название вещества, для которого характерна реакция присоединения
1) метан 2) пропан 3) пропен 4) этан
t, С актив.
7. Укажите формулу вещества X в цепочке превращений СН4 → С2Н2 → X
1) С6Н6 2) C5Н14 3) С6Н5 – СН3 4) C6Н12
8. Укажите, согласно какому правилу осуществляется присоединение воды к алкенам.
1) Вюрца 2) Кучерова 3) Зайцева 4) Марковникова
9. Укажите формулы веществ, которые вступают в реакцию друг с другом
Укажите формулы веществ, которые вступают в реакцию друг с другом
1) СН4 и Н2 2) С6Н6 и Н2О 3) С2Н2 и Н2О 4) С2Н6 и Н2О
10. Определите, сколько молей углекислого газа образуется при полном сгорании 1 моль этина:
1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
11. Сколько литров кислорода потребуется для сжигания 8,4 г гексена
1) 20,16 л 2) 10,12 л 3) 21,16 л 4) 11,12 л
Часть Б. Задания со свободным ответом
12. Перечислите области применения аренов. (2 балла).
13. Напишите уравнения химических реакций для следующих превращений (6 баллов)
С2Н5ОН → C2Н4 → C2H6 → C2H5Cl
Дайте названия продуктам реакции
Часть С. Задача
Какой объем воздуха потребуется для полного сгорания 25,6 л ацетилена? (Объемная доля кислорода в воздухе составляет 21%) 4 балла
Контрольная работа по теме «Углеводороды»
Вариант 4
 Тестовые задания с выбором ответа. За задание 1 балл
Тестовые задания с выбором ответа. За задание 1 балл1. Укажите общую формулу алкадиенов
1) CnH2n +2 2) CnH2n 3) CnH2n—2 4) CnH2n -6
Укажите к какому классу относится углеводород с формулой СН3 – СH– СН3
|
СН3
1) алканов 2) алкенов 3) алкинов 4) аренов
3. Укажите название изомера для вещества, формула которого СН3 – СH = СH – СН3
1) пентен-2 2) бутан 3) бутен-1 4) бутин-1
4. Укажите название гомолога для пропина
1) бутен 2) бутин 3) бутан 4) пропен
5. Укажите название вещества, для которого не характерна реакция замещения
1) гексан 2) этан 3) этен 4) 2-метилбутан
6. Укажите название вещества, для которого характерна реакция гидрирования
1) пропен 2) пропан 3) бутан 4) 2-метилпропан
t, Pt +HСl
7. Укажите формулу вещества X в цепочке превращений С2Н6 → СН2 = СН2 → X
Укажите формулу вещества X в цепочке превращений С2Н6 → СН2 = СН2 → X
1) CH2Cl – CH2Cl 2) CH3 – CH2Cl 3) CH3 –CH3
4) CH2Cl – CH2 – CH3
8.Укажите, согласно какому правилу осуществляется присоединение галогеноводородов к несимметричным алкенам
1) Вюрца 2) Кучерова 3) Марковникова 4) Зайцева
9.Укажите формулы веществ, которые вступают в реакцию друг с другом
1) С5Н12 и О2 2) С2Н4 и СO2 3) С4Н10 и НCl 4) С2Н6 и НCl
10.Определите, сколько молей кислорода потребуется для полного сгорания 1 моль пропина
1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
11. Сколько в граммах паров воды образуется при сжигании 5,8 г бутана
1) 9 г 2) 15 г 3) 12 г 4) 18 г
Часть Б. Задания со свободным ответом
Задания со свободным ответом
12. Перечислите области применения алканов. (2 балла)
13. Напишите уравнения химических реакций для следующих превращений: (6 баллов)
CаС2 → C2Н2 → C2H4 → C2H5OH
Дайте названия продуктам реакции
Часть С. Задача
14. Какой объем воздуха потребуется для полного сгорания 12 л метана? (Объемная доля кислорода в воздухе составляет 21%) (4 балла)
Контрольная работа по теме «Углеводороды»
Вариант 5
Часть А. Тестовые задания с выбором ответа. За задание 1 балл
1. Укажите общую формулу алкинов
1) CnH2n +2 2) CnH2n 3) CnH2n—2 4) CnH2n -6
2. Укажите к какому классу относится углеводород с формулой С6Н6
Укажите к какому классу относится углеводород с формулой С6Н6
1) алканов 2)аренов 3) алкинов 4) алкенов
Укажите название изомера для вещества, формула которого СН3 — СН – СН3
|
СН3
1) бутан 2) пропан 3) 2-метилпентан 4) пентан
4. Укажите название гомолога для 2-метилбутана
1) бутен-2 2) пентан 3) 2-метилпентан 4) 2-метилбутен-2
5. Укажите название вещества, для которого характерна реакция замещения
1) пентен-1 2) гексен-1 3) гексан 4) ацетилен
6. Укажите название вещества, для которого характерна реакция полимеризации
1) дивинил 2) бутан 3) бензол 4) 3-метилпентан
t, H2SO4 +Cl2
7. Укажите формулу вещества X в цепочке превращений С2Н5ОН → C2H4 → X
1) CH≡CCl 2) CH2Cl- CH2Cl 3) CH3-CH3 4) CH3-CH2Cl
8. Укажите название реакции присоединения к ацетилену воды
Укажите название реакции присоединения к ацетилену воды
1) Вюрца 2) Кучерова 3) Зайцева 4) Марковникова
9. Укажите формулы веществ, которые вступают в реакцию друг с другом
1) С2Н6 и Cl2 2) С2Н4 и СO2 3) С2Н6 и Н2O 4) С6Н6 и Н2О
10. Определите, сколько молей кислорода затрачивается при полном сгорании 1 моль этена
1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
11. Сколько литров углекислого газа образуется, при сжигании 6,8 г пентина
1) 3,36 л 2) 11,2 л 3) 6,72 л 4) 3,42 л
Часть Б. Задания со свободным ответом
12. Перечислите области применения алканов (2 балла)
13. Напишите уравнения химических реакций для следующих превращений:(6 баллов)
CaС2→ C2Н2 → C6H6 → C6H5NO2
Дайте названия продуктам реакции
Часть С. Задача
Задача
14 Какой объем воздуха потребуется для полного сгорания 44,8 л ацетилена? (Объемная доля кислорода в воздухе составляет 21%) 4 балла
Контрольная работа по теме «Углеводороды»
Вариант 6
Часть А. Тестовые задания с выбором ответа. За задание 1 балл
1. Укажите общую формулу алкинов
1) CnH2n +2 2) CnH2n 3) CnH2n—2 4) CnH2n -6
Укажите к какому классу относится углеводород с формулой СН2 =СH – СН=CH2
1) алкадиенов 2) алкенов 3) алкинов 4) аренов
3. Укажите название изомера для вещества, формула которого СН3 – СН2 — СН = СН2
1) 2 метилбутадиен-1,3 2) бутин-1 3) бутен-2 4) бутан
4. Укажите название гомолога для 2-метилпентана
1) 2-метилбутан 2) 2 метилбутен-1 3) пропан 4) пентан
5. Укажите название вещества, для которого не характерна реакция гидратации
Укажите название вещества, для которого не характерна реакция гидратации
1) ацетилен 2) бутин 3) этилен 4) циклобутан
6. Укажите название вещества, для которого характерна реакция присоединения
1) метан 2) пропан 3) пропен 4) этан
t, + H2O
7. Укажите формулу вещества X в цепочке превращений СН4 → С2Н2 → X
1) С6Н6 2) C2Н5OH 3) С2Н4O 4) C6Н12
8. Укажите, согласно какому правилу осуществляется присоединение воды к алкенам.
1) Вюрца 2) Кучерова 3) Зайцева 4) Марковникова
9. Укажите формулы веществ, которые вступают в реакцию друг с другом
1) СН4 и Н2 2) С6Н6 и Cl2 3) С2Н2 и CH4 4) С2Н6 и Н2О
10. Определите, сколько молей кислорода расходуется при полном сгорании 1 моль пропина:
1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
11. Сколько литров кислорода потребуется для сжигания 8,4 г гексена
Сколько литров кислорода потребуется для сжигания 8,4 г гексена
1) 20,16 л 2) 10,12 л 3) 21,16 л 4) 11,12 л
Часть Б. Задания со свободным ответом
12. Перечислите области применения аренов. (2 балла).
13. Напишите уравнения химических реакций для следующих превращений (6 баллов)
С2Н5ОН → C2Н4 → C2H6 → CO2
Дайте названия продуктам реакции
Часть С. Задача
Какой объем воздуха потребуется для полного сгорания 25,6 л пропилена? (Объемная доля кислорода в воздухе составляет 21%) (4 балла)
Критерии оценивания
Максимальное количество баллов-23.
«5» — 20 – 23 балла
«4» — 16 – 19 баллов
«3» — 9 – 15 баллов
«2» менее 9 баллов
Контрольная работа по теме «Углеводороды»
Контрольная работа по теме «Углеводороды»
10 класс (базовый уровень)
Автор: Черная Ольга Владимировна
Учитель химии МАОУ «Гимназия №80»
Контрольная работа по теме «Углеводороды»
Вариант 1
Часть А. Тестовые задания с выбором ответа. За задание 1 балл
Тестовые задания с выбором ответа. За задание 1 балл
1. Укажите общую формулу алкенов
1) CnH2n +2 2) CnH2n 3) CnH2n—2 4) CnH2n -6
Укажите к какому классу относится углеводород с формулой СН3 – С = СН2
|
СН3
1) алканов 2) алкенов 3) алкинов 4) аренов
3. Укажите название изомера для вещества, формула которого СН3 — С ≡ С – СН3
1) пентин-2 2) бутан 3) бутен-2 4) бутин-1
4. Укажите название гомолога для бутана
1) бутен 2) бутин 3) пропан 4) пропен
5. Укажите название вещества, для которого характерна реакция замещения
1) гексан 2) гексен-1 3) гексин-1 4) гексадиен-1,3
6. Укажите название вещества, для которого характерна реакция гидрирования
1) метан 2) пропан 3) пропен 4) этан
t, Pt +HСl
7. Укажите формулу вещества X в цепочке превращений С3Н8 → СН2 = СН – СН3 → X
Укажите формулу вещества X в цепочке превращений С3Н8 → СН2 = СН – СН3 → X
1) CH2Cl – CHCl – CH3 2) CH3 – CCl2 – CH3 3) CH3 – CHCl – CH3
4) CH2Cl – CH2 – CH3
8.Укажите, согласно какому правилу осуществляется присоединение галогеноводородов к несимметричным алкенам
1) Вюрца 2) Кучерова 3) Зайцева 4) Марковникова
9.Укажите формулы веществ, которые вступают в реакцию друг с другом
1) С3Н8 и О2 2) С2Н4 и СН4 3) С4Н10 и НCl 4) С2Н6 и Н2О
10.Определите, сколько молей углекислого газа образуется при полном сгорании 1 моль этана
1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
11. Сколько в граммах паров воды образуется при сжигании 5,8 г бутана
1) 9 г 2) 15 г 3) 12 г 4) 18 г
Часть Б. Задания со свободным ответом
Задания со свободным ответом
12. Перечислите области применения алканов. (2 балла)
13. Напишите уравнения химических реакций для следующих превращений: (6 баллов)
CаС2 → C2Н2 → C6H6 → C6H5NO2
Дайте названия продуктам реакции
Часть С. Задача
14. Какой объем воздуха потребуется для полного сгорания 12 л дивинила? (Объемная доля кислорода в воздухе составляет 21%) (4 балла)
Контрольная работа по теме «Углеводороды»
Вариант 2
Часть А. Тестовые задания с выбором ответа. За задание 1 балл
1. Укажите общую формулу алканов
1) CnH2n +2 2) CnH2n 3) CnH2n—2 4) CnH2n -6
2. Укажите к какому классу относится углеводород с формулой С6Н5 – СН3
Укажите к какому классу относится углеводород с формулой С6Н5 – СН3
1) алканов 2) алкенов 3) алкинов 4) аренов
Укажите название изомера для вещества, формула которого СН3 – СН — СН2 – СН3
|
СН3
1) бутан 2) 2-метилпропан 3) 3-метилпентан 4) пентан
4. Укажите название гомолога для бутина-1
1) бутин-2 2) пентин-2 3) пентин-1 4) гексин-2
5. Укажите название вещества, для которого характерна реакция замещения
1) гексан 2) гексен-1 3) гексин-1 4) гексадиен-1,3
6. Укажите название вещества, для которого характерна реакция полимеризации
1) бутадиен-1,3 2) бутан 3) бензол 4) циклогексан
t, H2SO4 +HСl
7. Укажите формулу вещества X в цепочке превращений С2Н5ОН → X →
→ СН3 – СН2Cl
1) C2H2 2) C2H4 3) C2H6 4) C3H6
8. Укажите название реакции присоединения к ацетилену воды
Укажите название реакции присоединения к ацетилену воды
1) Вюрца 2) Кучерова 3) Зайцева 4) Марковникова
9. Укажите формулы веществ, которые вступают в реакцию друг с другом
1) С2Н6 и HCl 2) С2Н4 и Сl2 3) С2Н16 и Н2O 4) С6Н6 и Н2О
10. Определите, сколько молей углекислого газа образуется при полном сгорании 1 моль этена
1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
11. Сколько литров углекислого газа образуется, при сжигании 6,8 г пентина
1) 3,36 л 2) 11,2 л 3) 6,72 л 4) 3,42 л
Часть Б. Задания со свободным ответом
12. Перечислите области применения алкинов (2 балла)
13. Напишите уравнения химических реакций для следующих превращений:(6 баллов)
СН4 → C2Н2 → C6H6 → C6H5Cl
Дайте названия продуктам реакции
Часть С. Задача
Задача
14 Какой объем воздуха потребуется для полного сгорания 44,8 л этилена? (Объемная доля кислорода в воздухе составляет 21%)
(4 балла)
Контрольная работа по теме «Углеводороды»
Вариант 3
Часть А. Тестовые задания с выбором ответа. За задание 1 балл
1. Укажите общую формулу алкинов
1) CnH2n +2 2) CnH2n 3) CnH2n—2 4) CnH2n -6
Укажите к какому классу относится углеводород с формулой СН ≡ С – СН3
1) алканов 2) алкенов 3) алкинов 4) аренов
3. Укажите название изомера для вещества, формула которого СН2 = СН — СН = СН2
1) 2 метилбутадиен-1,3 2) бутин-1 3) бутен-1 4) бутан
4. Укажите название гомолога для 2-метилпропана
1) 2-метилбутан 2) 2 метилбутен-1 3) пропан 4) пропен
5. Укажите название вещества, для которого характерна реакция гидратации
Укажите название вещества, для которого характерна реакция гидратации
1) ацетилен 2) бутан 3) полиэтилен 4) циклобутан
6. Укажите название вещества, для которого характерна реакция присоединения
1) метан 2) пропан 3) пропен 4) этан
t, С актив.
7. Укажите формулу вещества X в цепочке превращений СН4 → С2Н2 → X
1) С6Н6 2) C5Н14 3) С6Н5 – СН3 4) C6Н12
8. Укажите, согласно какому правилу осуществляется присоединение воды к алкенам.
1) Вюрца 2) Кучерова 3) Зайцева 4) Марковникова
9. Укажите формулы веществ, которые вступают в реакцию друг с другом
1) СН4 и Н2 2) С6Н6 и Н2О 3) С2Н2 и Н2О 4) С2Н6 и Н2О
10. Определите, сколько молей углекислого газа образуется при полном сгорании 1 моль этина:
1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
11. Сколько литров кислорода потребуется для сжигания 8,4 г гексена
1) 20,16 л 2) 10,12 л 3) 21,16 л 4) 11,12 л
Часть Б. Задания со свободным ответом
12. Перечислите области применения аренов. (2 балла).
13. Напишите уравнения химических реакций для следующих превращений (6 баллов)
С2Н5ОН → C2Н4 → C2H6 → C2H5Cl
Дайте названия продуктам реакции
Часть С. Задача
Какой объем воздуха потребуется для полного сгорания 25,6 л ацетилена? (Объемная доля кислорода в воздухе составляет 21%)
(4 балла)
Контрольная работа по теме «Углеводороды»
Вариант 4
Часть А. Тестовые задания с выбором ответа. За задание 1 балл
1. Укажите общую формулу алкадиенов
1) CnH2n +2 2) CnH2n 3) CnH2n—2 4) CnH2n -6
Укажите к какому классу относится углеводород с формулой СН3 – СH– СН3
|
СН3
1) алканов 2) алкенов 3) алкинов 4) аренов
3. Укажите название изомера для вещества, формула которого СН3 – СH = СH – СН3
1) пентен-2 2) бутан 3) бутен-1 4) бутин-1
4. Укажите название гомолога для пропина
1) бутен 2) бутин 3) бутан 4) пропен
5. Укажите название вещества, для которого не характерна реакция замещения
1) гексан 2) этан 3) этен 4) 2-метилбутан
6. Укажите название вещества, для которого характерна реакция гидрирования
1) пропен 2) пропан 3) бутан 4) 2-метилпропан
t, Pt +HСl
7.Укажите формулу вещества X в цепочке превращений С2Н6 → СН2 = СН2 → X
1) CH2Cl – CH2Cl 2) CH3 – CH2Cl 3) CH3 –CH3
4) CH2Cl – CH2 – CH3
8.Укажите, согласно какому правилу осуществляется присоединение галогеноводородов к несимметричным алкенам
1) Вюрца 2) Кучерова 3) Марковникова 4) Зайцева
9.Укажите формулы веществ, которые вступают в реакцию друг с другом
1) С5Н12 и О2 2) С2Н4 и СO2 3) С4Н10 и НCl 4) С2Н6 и НCl
10.Определите, сколько молей кислорода потребуется для полного сгорания 1 моль пропина
1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
11. Сколько в граммах паров воды образуется при сжигании 5,8 г бутана
1) 9 г 2) 15 г 3) 12 г 4) 18 г
Часть Б. Задания со свободным ответом
12. Перечислите области применения алканов. (2 балла)
13. Напишите уравнения химических реакций для следующих превращений: (6 баллов)
CаС2 → C2Н2 → C2H4 → C2H5OH
Дайте названия продуктам реакции
Часть С. Задача
14. Какой объем воздуха потребуется для полного сгорания 12 л метана? (Объемная доля кислорода в воздухе составляет 21%) (4 балла)
Контрольная работа по теме «Углеводороды»
Вариант 5
Часть А. Тестовые задания с выбором ответа. За задание 1 балл
1. Укажите общую формулу алкинов
1) CnH2n +2 2) CnH2n 3) CnH2n—2 4) CnH2n -6
2. Укажите к какому классу относится углеводород с формулой С6Н6
1) алканов 2)аренов 3) алкинов 4) алкенов
Укажите название изомера для вещества, формула которого СН3 — СН – СН3
|
СН3
1) бутан 2) пропан 3) 2-метилпентан 4) пентан
4. Укажите название гомолога для 2-метилбутана
1) бутен-2 2) пентан 3) 2-метилпентан 4) 2-метилбутен-2
5. Укажите название вещества, для которого характерна реакция замещения
1) пентен-1 2) гексен-1 3) гексан 4) ацетилен
6. Укажите название вещества, для которого характерна реакция полимеризации
1) дивинил 2) бутан 3) бензол 4) 3-метилпентан
t, H2SO4 +Cl2
7. Укажите формулу вещества X в цепочке превращений С2Н5ОН → C2H4 → X
1) CH≡CCl 2) CH2Cl- CH2Cl 3) CH3-CH3 4) CH3-CH2Cl
8. Укажите название реакции присоединения к ацетилену воды
1) Вюрца 2) Кучерова 3) Зайцева 4) Марковникова
9. Укажите формулы веществ, которые вступают в реакцию друг с другом
1) С2Н6 и Cl2 2) С2Н4 и СO2 3) С2Н6 и Н2O 4) С6Н6 и Н2О
10. Определите, сколько молей кислорода затрачивается при полном сгорании 1 моль этена
1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
11. Сколько литров углекислого газа образуется, при сжигании 6,8 г пентина
1) 3,36 л 2) 11,2 л 3) 6,72 л 4) 3,42 л
Часть Б. Задания со свободным ответом
12. Перечислите области применения алканов (2 балла)
13. Напишите уравнения химических реакций для следующих превращений:(6 баллов)
CaС2→ C2Н2 → C6H6 → C6H5NO2
Дайте названия продуктам реакции
Часть С. Задача
14 Какой объем воздуха потребуется для полного сгорания 44,8 л ацетилена? (Объемная доля кислорода в воздухе составляет 21%)
(4 балла)
Контрольная работа по теме «Углеводороды»
Вариант 6
Часть А. Тестовые задания с выбором ответа. За задание 1 балл
1. Укажите общую формулу алкинов
1) CnH2n +2 2) CnH2n 3) CnH2n—2 4) CnH2n -6
Укажите к какому классу относится углеводород с формулой СН2 =СH – СН=CH2
1) алкадиенов 2) алкенов 3) алкинов 4) аренов
3. Укажите название изомера для вещества, формула которого СН3 – СН2 — СН = СН2
1) 2 метилбутадиен-1,3 2) бутин-1 3) бутен-2 4) бутан
4. Укажите название гомолога для 2-метилпентана
1) 2-метилбутан 2) 2 метилбутен-1 3) пропан 4) пентан
5. Укажите название вещества, для которого не характерна реакция гидратации
1) ацетилен 2) бутин 3) этилен 4) циклобутан
6. Укажите название вещества, для которого характерна реакция присоединения
1) метан 2) пропан 3) пропен 4) этан
t, + H2O
7. Укажите формулу вещества X в цепочке превращений СН4 → С2Н2 → X
1) С6Н6 2) C2Н5OH 3) С2Н4O 4) C6Н12
8. Укажите, согласно какому правилу осуществляется присоединение воды к алкенам.
1) Вюрца 2) Кучерова 3) Зайцева 4) Марковникова
9. Укажите формулы веществ, которые вступают в реакцию друг с другом
1) СН4 и Н2 2) С6Н6 и Cl2 3) С2Н2 и CH4 4) С2Н6 и Н2О
10. Определите, сколько молей кислорода расходуется при полном сгорании 1 моль пропина:
1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
11. Сколько литров кислорода потребуется для сжигания 8,4 г гексена
1) 20,16 л 2) 10,12 л 3) 21,16 л 4) 11,12 л
Часть Б. Задания со свободным ответом
12. Перечислите области применения аренов. (2 балла).
13. Напишите уравнения химических реакций для следующих превращений (6 баллов)
С2Н5ОН → C2Н4 → C2H6 → CO2
Дайте названия продуктам реакции
Часть С. Задача
Какой объем воздуха потребуется для полного сгорания 25,6 л пропилена? (Объемная доля кислорода в воздухе составляет 21%)
(4 балла)
Критерии оценивания
Максимальное количество баллов-23.
«5» — 20 – 23 балла
«4» — 16 – 19 баллов
«3» — 9 – 15 баллов
«2» менее 9 баллов
Контрольная работа в 10 классе по теме УГЛЕВОДОРОДЫ
Контрольная работа по теме «Углеводороды»
Вариант 1
Часть А. Тестовые задания с выбором ответа. За задание 1 балл
- Укажите общую формулу аренов
1) Cnh3n +2 2) Cnh3n 3) Cnh3n—2 4) Cnh3n -6
- Укажите к какому классу относится УВ с формулой СН3 – СН3
1) алканов 2) алкенов 3) алкинов 4) аренов
- Укажите название изомера для вещества, формула которого СН2 = СН – СН2 – СН3
1) 2 метилбутен 2 2) бутен 2 3) бутан 4) бутин 1
- Укажите название гомолога для пентадиена 1,3
1) бутадиен 1,2 2) бутадиен 1,3 3) пропадиен 1,2 4) пентадиен 1,2
- Укажите название вещества, для которого характерна реакция замещения
1) бутан 2) бутен 1 3) бутин 4) бутадиен 1,3
- Укажите название вещества, для которого характерна реакция гидрирования
1) пропен 2) пропан 3) этан 4) бутан
t Ni, +H
- Укажите формулу вещества X в цепочке превращений СН4 → X → С2Н6
1) CO2 2) C2h3 3) C3H8 4) C2H6
- Укажите, какую реакцию применяют для получения УВ с более длинной цепью
1) Вюрца 2) Кучерова 3) Зайцева 4) Марковникова
- Укажите формулы веществ, которые вступают в реакцию друг с другом
1) С2Н4 и СН4 2) С3Н8 и Н2 3) С6Н6 и Н2О 4) С2Н4 и Н2
- Определите, сколько молей углекислого газа образуется при полном сгорании метана
1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
- Сколько литров углекислого газа образуется при сжигании 4,2 г пропена
1) 3,36 л 2) 6,36 л 3) 6,72 л 4) 3,42 л
Часть Б. Задания со свободным ответом
- Перечислите области применения алкенов. 2 балла
- Напишите уравнения химических реакций для следующих превращений: 6 баллов
Ch5 → Ch4Cl → C2H6 → C2H5NO2
Дайте названия продуктам реакции
Часть С. Задача
14. Выведите молекулярную формулу УВ, массовая доля углерода в котором составляет 83,3%. Относительная плотность паров этого вещества по водороду составляет 29. 4 балла
Контрольная работа по теме «Углеводороды»
Вариант 2
Часть А. Тестовые задания с выбором ответа. За задание 1 балл
1. Укажите общую формулу алкенов
1) Cnh3n +2 2) Cnh3n 3) Cnh3n—2 4) Cnh3n -6
- Укажите к какому классу относится УВ с формулой СН3 – С = СН2
|
СН3
1) алканов 2) алкенов 3) алкинов 4) аренов
3. Укажите название изомера для вещества, формула которого СН3 — С = С – СН3
1) пентин 2 2) бутан 3) бутен 2 4) бутин 1
4. Укажите название гомолога для бутана
1) бутен 2) бутин 3) пропан 4) пропен
5. Укажите название вещества, для которого характерна реакция замещения
1) гексан 2) гексен 1 3) гексин 1 4) гексадиен 1,3
6. Укажите название вещества, для которого характерна реакция гидрирования
1) метан 2) пропан 3) пропен 4) этан
t,Pt +HСl
- Укажите формулу вещества X в цепочке превращений С3Н8 → СН2 = СН – СН3 → X
1) Ch3Cl – CHCl – Ch4 2) Ch4 – CCl2 – Ch4 3) Ch4 – CHCl – Ch4 4) Ch3Cl – Ch3 – Ch4
- Укажите, согласно какому правилу осуществляется присоединение галогеноводородов к несимметричным алкенам
1) Вюрца 2) Кучерова 3) Зайцева 4) Марковникова
- Укажите формулы веществ, которые вступают в реакцию друг с другом
1) С3Н8 и О2 2) С2Н4 и СН4 3) С4Н10 и НCl 4) С2Н6 и Н2О
- Определите, сколько молей углекислого газа образуется при полном сгорании этана
1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
11. Сколько в граммах паров воды образуется при сжигании 5,8 г бутана
1) 9 г 2) 15 г 3) 12 г 4) 18 г
Часть Б. Задания со свободным ответом
12. Перечислите области применения алканов. 2 балла
13. Напишите уравнения химических реакций для следующих превращений: 6 баллов
CаС2 → C2Н2 → C6H6 → C6H5NO2
Дайте названия продуктам реакции
Часть С. Задача
14. Выведите молекулярную формулу УВ, массовая доля углерода и водорода в котором составляют 81,82% и 18,18% . Относительная плотность паров этого вещества по водороду составляет 2. 4 балла
Контрольная работа по теме «Углеводороды»
Вариант 3
Часть А. Тестовые задания с выбором ответа. За задание 1 балл
1. Укажите общую формулу алкинов
1) Cnh3n +2 2) Cnh3n 3) Cnh3n—2 4) Cnh3n -6
2. Укажите к какому классу относится УВ с формулой С6Н5 – СН3
1) алканов 2) алкенов 3) алкинов 4) аренов
- Укажите название изомера для вещества, формула которого СН3 – СН — СН2 – СН3
|
СН3
1) бутан 2) 2 метилпропан 3) 3 метилпентан 4) пентан
4. Укажите название гомолога для бутина 1
1) бутин 2 2) пентин 2 3) пентин 1 4) гексин 2
5. Укажите название вещества, для которого характерна реакция замещения
1) гексан 2) гексен 1 3) гексин 1 4) гексадиен 1,3
6. Укажите название вещества, для которого характерна реакция полимеризации
1) бутадиен 1,3 2) бутан 3) бензол 4) циклогексан
+ HSO +HСl
7. Укажите формулу вещества X в цепочке превращений С2Н5ОН → X → СН3 – СН2 Cl
1) C2h3 2) C2h5 3) C2H6 4) C3H6
8. Укажите название реакции присоединения к ацетилену воды
1) Вюрца 2) Кучерова 3) Зайцева 4) Марковникова
9. Укажите формулы веществ, которые вступают в реакцию друг с другом
1) С2Н6 и HCl 2) С2Н4 и Сl2 3) С2Н16 и Н2O 4) С6Н6 и Н2О
10. Определите, сколько молей углекислого газа образуется при полном сгорании этена
1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
11. Сколько литров углекислого газа образуется, при сжигании 6,8 г пентина
1) 3,36 л 2) 11,2 л 3) 6,72 л 4) 3,42 л
Часть Б. Задания со свободным ответом
12. Перечислите области применения алкинов. 2 балла
13. Напишите уравнения химических реакций для следующих превращений: 6 баллов
СН4 → C2Н2 → C6H6 → C6H5Cl
Дайте названия продуктам реакции
Часть С. Задача
14. Выведите молекулярную формулу УВ, массовая доля углерода и водорода в котором составляют 92,31% и 7,69% . Относительная плотность паров этого вещества по водороду составляет 13. 4 балла
Контрольная работа по теме «Углеводороды»
Вариант 4
Часть А. Тестовые задания с выбором ответа. За задание 1 балл
1. Укажите общую формулу алканов
1) Cnh3n +2 2) Cnh3n 3) Cnh3n—2 4) Cnh3n -6
- Укажите к какому классу относится УВ с формулой СН = С – СН3
1) алканов 2) алкенов 3) алкинов 4) аренов
3. Укажите название изомера для вещества, формула которого СН2 = СН — СН = СН2
1) 2 метилбутадиен 1,3 2) бутин 1 3) бутен 1 4) бутан
4. Укажите название гомолога для 2 метилпропана
1) 2 метилбутан 2) 2 метилбутен 1 3) пропан 4) пропен
5. Укажите название вещества, для которого характерна реакция гидратации
1) ацетилен 2) бутан 3) полиэтилен 4) циклобутан
6. Укажите название вещества, для которого характерна реакция присоединения
1) метан 2) пропан 3) пропен 4) этан
t, С актив.
7. Укажите формулу вещества X в цепочке превращений СН4 → С2Н2 → X
1) С6Н6 2) C5Н14 3) С6Н5 – СН3 4) C6Н12
8. Укажите, согласно какому правилу осуществляется отщепление галогеноводорода
1) Вюрца 2) Кучерова 3) Зайцева 4) Марковникова
9. Укажите формулы веществ, которые вступают в реакцию друг с другом
1) СН4 и Н2 2) С6Н6 и Н2О 3) С2Н2 и Н2О 4) С2Н6 и Н2О
10. Определите, сколько молей углекислого газа образуется при полном сгорании этина
1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
11. Сколько литров кислорода потребуется для сжигания 8,4 г гексена
1) 20,16 л 2) 10,12 л 3) 21,16 л 4) 11,12 л
Часть Б. Задания со свободным ответом
12. Перечислите области применения аренов. 2 балла
13. Напишите уравнения химических реакций для следующих превращений: 6 баллов
С2Н5ОН → C2Н4 → C2H5Cl → C4h20
Дайте названия продуктам реакции
Часть С. Задача
14. Выведите молекулярную формулу УВ, массовая доля углерода и водорода в котором составляют 85,7% и 14,3% . Относительная плотность паров этого вещества по водороду составляет 28. 4 балла
Что такое углеводороды? (с иллюстрациями)
Углеводороды — это органические химические соединения, которые полностью состоят из углерода и водорода и варьируются от простых молекул, таких как метан, до полимеров, таких как полистирол, который состоит из тысяч атомов. Способность атомов углерода прочно связываться друг с другом позволяет им образовывать практически неограниченное количество цепочек, колец и других структур, которые образуют основы органических молекул. Поскольку каждый атом может образовывать четыре связи, эти основные цепи включают другие элементы, такие как водород.Эти соединения легко воспламеняются, поскольку два содержащихся в них элемента легко соединяются с кислородом воздуха, выделяя энергию. Ископаемые виды топлива, такие как нефть и природный газ, представляют собой смеси углеводородов природного происхождения; уголь также содержит некоторое количество, хотя в основном это просто углерод.
Гидравлический насос поднимает нефть на поверхность.Структура и правила наименования
При присвоении названий углеводородам используются определенные соглашения, хотя во многих случаях соединения могут быть лучше известны под старыми названиями. В современной системе первая часть имени представляет собой количество атомов углерода в молекуле: в возрастающей последовательности первые восемь имеют префикс meth-, eth-, prop-, but-, pent-, hex-, hept. — и окт — .Соединения, в которых все атомы углерода связаны одинарными связями, вместе известны как алканов и имеют названия, оканчивающиеся на –ан. Следовательно, первые восемь алканов — это метан, этан, пропан, бутан, пентан, гексан, гептан и октан.
Сырая нефть — это природная смесь углеводородов.Атомы углерода могут также образовывать двойные или тройные связи друг с другом. Молекулы с двойными связями известны как алкены и имеют названия, оканчивающиеся на –ene , а молекулы с тройными связями называются алкинами и имеют названия, оканчивающиеся на -yne . Молекулы, которые имеют только одинарные связи, содержат максимально возможное количество атомов водорода и поэтому описываются как насыщенные. Там, где есть двойные или тройные связи, меньше мест для водорода, поэтому эти соединения описываются как ненасыщенные.
Сырая нефть разделяется на такие продукты, как бензин и керосин, в крекинг-башнях на нефтеперерабатывающих заводах.В качестве простого примера, этан имеет два атома углерода, соединенных простой связью, каждый из которых может связываться с тремя атомами водорода, поэтому его химическая формула C 2 H 6 , и это алкан.В этене есть двойная связь углерод-углерод, поэтому он может иметь только четыре атома водорода, что делает его алкеном с формулой C 2 H 4 . Этин имеет тройную связь, что дает ему формулу C 2 H 2 , что делает его алкином. Это соединение более известно как ацетилен.
Углеводороды используются как пропелленты для аэрозолей.Атомы углерода могут также образовывать кольца. Алканы с кольцами имеют названия, начинающиеся с цикло- . Следовательно, циклогексан представляет собой алкан с шестью атомами углерода, соединенными одинарными связями таким образом, чтобы образовать кольцо. Также возможно кольцо с чередующимися одинарными и двойными связями, известное как бензольное кольцо. Углеводороды, содержащие бензольное кольцо, известны как ароматические, потому что многие из них имеют приятный запах.
У некоторых молекул углеводородов есть разветвленные цепи.Бутан, который обычно состоит из одной цепи, может существовать в форме, в которой один атом углерода связан с двумя другими, образуя ответвление. Эти альтернативные формы молекулы известны как изомеры. Разветвленный изомер бутана известен как изобутан.
Производство
Большая часть углеводородов производится из ископаемых видов топлива: угля, нефти и природного газа, которые добываются из земли в количествах миллионов тонн в день.Сырая нефть в основном представляет собой смесь множества различных алканов и циклоалканов с некоторыми ароматическими соединениями. Они могут быть отделены друг от друга на нефтеперерабатывающих заводах путем перегонки из-за разной температуры кипения. Другой используемый процесс известен как «крекинг»: катализаторы используются для разрушения некоторых из более крупных молекул на более мелкие, которые более полезны в качестве топлива.
Недвижимость
Вообще говоря, чем сложнее углеводород, тем выше его температуры плавления и кипения.Например, более простые типы, такие как метан, этан и пропан, с одним, двумя и тремя атомами углерода, соответственно, являются газами. Многие формы являются жидкостями: примерами являются гексан и октан. Твердые формы включают парафиновый воск — смесь молекул, содержащих от 20 до 40 атомов углерода, и различные полимеры, состоящие из цепочек из тысяч атомов, такие как полиэтилен.
Наиболее заметными химическими свойствами углеводородов являются их воспламеняемость и способность образовывать полимеры.Те, что являются газами или жидкостями, будут реагировать с кислородом в воздухе, производя углекислый газ (CO 2 ) и воду и выделяя энергию в виде света и тепла. Чтобы начать реакцию, необходимо подать некоторую энергию, но если она начнется, она будет самоподдерживающейся: эти соединения будут гореть, как показано на примере зажигания газовой плиты спичкой или искрой. Твердые формы также будут гореть, но не так легко. В некоторых случаях не весь углерод образует CO 2 ; Некоторые виды сажи и дыма могут образовываться при горении на воздухе, а при недостаточном поступлении кислорода любой углеводород может выделять токсичный газ без запаха — окись углерода (CO).
использует
Воспламеняемость углеводородов делает их очень полезными в качестве топлива, и они являются основным источником энергии для современной цивилизации.Во всем мире большая часть электроэнергии вырабатывается при сжигании этих соединений, и они используются для приведения в движение практически всех мобильных машин: автомобилей, грузовиков, поездов, самолетов и кораблей. Они также используются при производстве многих других химикатов и материалов. Например, большинство пластиков представляют собой углеводородные полимеры. Другие применения включают растворители, смазочные материалы и пропелленты для аэрозольных баллончиков.
Проблемы с ископаемым топливом
Углеводороды были очень успешным источником топлива в течение последних двухсот лет или около того, но все чаще звучат призывы сократить их использование.При их сгорании образуется дым и сажа, вызывая серьезные проблемы с загрязнением в некоторых районах. Он также производит большое количество CO 2 . Среди ученых широко распространено мнение о том, что повышение уровня этого газа в атмосфере помогает удерживать тепло, повышая глобальную температуру и изменяя климат Земли.
Кроме того, ископаемое топливо не вечно.При нынешних темпах сжигания топлива нефть может закончиться менее чем за столетие, а уголь — через несколько столетий. Все это привело к призывам к развитию возобновляемых источников энергии, таких как солнечная и ветровая энергия, и к строительству большего числа атомных электростанций, которые производят нулевые выбросы CO 2 . В 2007 году Нобелевская премия мира была присуждена бывшему вице-президенту США Элу Гору и Межправительственной группе экспертов ООН по изменению климата за их работу по подтверждению и распространению идеи о том, что сгорание углеводородов в значительной степени отвечает за глобальное потепление.
Углеводороды состоят из атомов водорода и углерода.Углеводородов
16.1 Углеводороды
Цели обучения
- Укажите алканы, алкены, алкины и ароматические соединения.
- Перечислить некоторые свойства углеводородов.
Простейшие органические соединения состоят всего из двух элементов: углерода и водорода. Эти соединения называются углеводородами. Органическое соединение, состоящее из углерода и водорода. Сами углеводороды делятся на два типа: алифатические углеводороды и ароматические углеводороды. Алифатические углеводороды Углеводород на основе цепочек атомов C. представляют собой углеводороды на основе цепочек атомов C. Есть три типа алифатических углеводородов.Алканы — алифатический углеводород с одинарными ковалентными связями. представляют собой алифатические углеводороды только с одинарными ковалентными связями. Алкены — алифатический углеводород, содержащий двойную связь C – C. представляют собой углеводороды, содержащие по крайней мере одну двойную связь C – C, и алкины — алифатический углеводород, содержащий тройную связь C – C. представляют собой углеводороды, содержащие тройную связь C – C. Иногда мы находим алифатический углеводород с кольцом из атомов углерода; эти углеводороды называются циклоалканов (или циклоалкенов или циклоалкинов ).
Ароматические углеводороды Углеводород, содержащий бензольное кольцо. имеют специальное шестиуглеродное кольцо, называемое бензольным кольцом . Электроны в бензольном кольце обладают особыми энергетическими свойствами, которые придают бензолу физические и химические свойства, которые заметно отличаются от алканов. Первоначально термин ароматический использовался для описания этого класса соединений, поскольку они были особенно ароматными. Однако в современной химии термин ароматический означает наличие шестичленного кольца, которое придает молекуле различные уникальные свойства.
У простейших алканов атомы C связаны в прямую цепь; они называются нормальными алканами. Они названы в соответствии с количеством атомов углерода в цепи. Наименьший алкан — метан:
Чтобы образовать четыре ковалентные связи, атом C соединяется с четырьмя атомами H, образуя молекулярную формулу метана CH 4 . Однако диаграмма для метана вводит в заблуждение; четыре ковалентные связи, образующиеся атомом C, ориентированы в трех измерениях по направлению к углам тетраэдра.Лучшее представление молекулы метана показано на рисунке 16.1 «Трехмерное представление метана».
Следующий по величине алкан имеет два атома углерода, ковалентно связанные друг с другом. Чтобы каждый атом C образовал четыре ковалентные связи, каждый атом C должен быть связан с тремя атомами H. Полученная молекула, формула которой C 2 H 6 , представляет собой этан:
Пропан имеет основу из трех атомов C, окруженных атомами H. Вы должны убедиться, что молекулярная формула пропана: C 3 H 8 :
Диаграммы, представляющие алканы, называются структурными формулами. Диаграмма, которая показывает, как атомы в молекуле связаны.потому что они показывают структуру молекулы. По мере увеличения размеров молекул структурные формулы становятся все более сложными. Один из способов обойти это — использовать сжатую структурную формулу — список атомов, связанных с каждым атомом C в цепи., В котором перечисляется формула каждого атома C в основной цепи молекулы. Например, сконденсированная структурная формула для этана: CH 3 CH 3 , а для пропана — CH 3 CH 2 CH 3 . Таблица 16.1 «Первые 10 алканов» дает молекулярные формулы, сжатые структурные формулы и названия первых 10 алканов.
Таблица 16.1 Первые 10 алканов
| Молекулярная формула | Концентрированная структурная формула | Имя |
|---|---|---|
| Канал 4 | CH 4 | метан |
| C 2 H 6 | канал 3 канал 3 | этан |
| C 3 H 8 | Канал 3 Канал 2 Канал 3 | пропан |
| С 4 В 10 | Канал 3 Канал 2 Канал 2 Канал 3 | бутан |
| С 5 В 12 | Канал 3 Канал 2 Канал 2 Канал 2 Канал 3 | пентан |
| С 6 В 14 | канал 3 (канал 2 ) 4 канал 3 | гексан |
| С 7 В 16 | канал 3 (канал 2 ) 5 канал 3 | гептан |
| С 8 В 18 | канал 3 (канал 2 ) 6 канал 3 | октановое число |
| С 9 В 20 | канал 3 (канал 2 ) 7 канал 3 | нонан |
| С 10 В 22 | канал 3 (канал 2 ) 8 канал 3 | декан |
Поскольку алканы имеют максимальное количество атомов H, возможное в соответствии с правилами ковалентных связей, алканы также называют насыщенными углеводородами — углеродным соединением с максимально возможным числом атомов H в своей формуле..
Алкены имеют двойную связь C – C. Поскольку они имеют меньше максимально возможного количества атомов H, их называют ненасыщенными углеводородами. Углеродное соединение с меньшим, чем максимально возможное количество атомов H в его формуле. Наименьший алкен — этен — имеет два атома углерода и также известен его общее название этилен:
Следующий по величине алкен — пропен — имеет три атома углерода с двойной связью C – C между двумя атомами углерода. Он также известен как пропилен:
.Что вы заметили в названиях алканов и алкенов? Названия алкенов такие же, как и соответствующие им алканы, за исключением того, что окончание — ene , а не — ane .Как мы увидим, использование стержня для обозначения количества атомов C в молекуле и окончания для обозначения типа органического соединения является обычным явлением в органической химии.
С появлением следующего алкена, бутена, мы начинаем видеть главную проблему с органическими молекулами: выбор. С четырьмя атомами C двойная связь C – C может проходить между первым и вторым атомами C или между вторым и третьим атомами C:
(Двойная связь между третьим и четвертым атомами углерода такая же, как между первым и вторым атомами углерода, только перевернутая.) Правила наименования в органической химии требуют, чтобы эти два вещества имели разные названия. Первая молекула называется 1-бутен , а вторая молекула — 2-бутен . Число в начале названия указывает на происхождение двойной связи. Наименьшее возможное число используется для нумерации функции в молекуле; следовательно, называть вторую молекулу 3-бутеном было бы неправильно. Числа — общие части названий органических химических веществ, потому что они указывают, какой атом углерода в цепи содержит отличительную особенность.
Соединения 1-бутен и 2-бутен имеют разные физические и химические свойства, даже если они имеют одинаковую молекулярную формулу — C 4 H 8 . Различные молекулы с одинаковой молекулярной формулой называются изомерами. Молекула с той же молекулярной формулой, что и другая молекула, но с другой структурой. Изомеры распространены в органической химии и способствуют ее сложности.
Пример 1
На основании названий молекул бутена предложите название для этой молекулы.
Решение
С пятью атомами C мы будем использовать стержень pent -, а с двойной связью C – C это алкен, поэтому эта молекула является пентеном. При нумерации атомов C мы используем число 2 , потому что это нижняя возможная метка. Эта молекула называется 2-пентеном.
Проверьте себя
На основании названий молекул бутена предложите название для этой молекулы.
Ответ
3-гексен
Алкины с тройной связью C – C названы так же, как алкены, за исключением того, что их названия заканчиваются на — yne . Самый мелкий алкин — этин, также известный как ацетилен:
Пропин имеет структуру
С бутином нам нужно начать нумерацию позиции тройной связи, как мы это делали с алкенами:
Ароматические соединения содержат бензольное звено.Сам бензол состоит из шести атомов углерода в кольце с чередующимися одинарными и двойными связями C – C:
Чередующиеся одинарные и двойные связи C – C придают бензольному кольцу особую стабильность, и оно не реагирует как алкен, как можно было бы предположить. Бензол имеет молекулярную формулу C 6 H 6 ; в более крупных ароматических соединениях другой атом заменяет один или несколько атомов H.
Какими бы фундаментальными ни были углеводороды для органической химии, их свойства и химические реакции довольно банальны.Большинство углеводородов неполярны из-за близкой электроотрицательности атомов C и H. Как таковые, они плохо растворяются в H 2 O и других полярных растворителях. Небольшие углеводороды, такие как метан и этан, являются газами при комнатной температуре, тогда как более крупные углеводороды, такие как гексан и октан, являются жидкостями. Даже более крупные углеводороды являются твердыми веществами при комнатной температуре и имеют мягкую воскообразную консистенцию.
Углеводороды довольно инертны, но они участвуют в некоторых классических химических реакциях.Одна из распространенных реакций — замещение атомом галогена путем объединения углеводорода с элементарным.
Сжигание углеводородов Учебник по химии
Пожалуйста, не блокируйте рекламу на этом веб-сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Полное сгорание углеводородов
Любой углеводород сгорает в избытке кислорода с образованием газообразного диоксида углерода и водяного пара.
Для полного сгорания углеводорода:
⚛ газообразный кислород — избыток реагента
⚛ углеводород — ограничивающий реагент
Мы можем написать общее словесное уравнение для полного сгорания любого углеводорода, как показано ниже:
углеводород + избыточный газообразный кислород → газообразный диоксид углерода + водяной пар
Углеводороды включают алканы, алкены и алкины, поэтому мы можем сказать, что:
⚛ любой алкан сгорает в избытке кислорода с образованием газообразного диоксида углерода и водяного пара
алкан + избыток газообразного кислорода → газообразный диоксид углерода + водяной пар
⚛ любой алкен сгорает в избытке кислорода с образованием газообразного диоксида углерода и водяного пара
алкен + избыток газообразного кислорода → газообразный диоксид углерода + водяной пар
⚛ любой алкин сгорает в избытке кислорода с образованием газообразного диоксида углерода и водяного пара
алкин + избыток газообразного кислорода → газообразный диоксид углерода + водяной пар
Пример: полное сгорание метана
Метан, CH 4 (г) , является углеводородом.Это соединение, состоящее только из элементов углерода (C) и водорода (H).
Метан — это газ при комнатной температуре и давлении. Это обычный компонент природного газа, который используется в качестве топлива.
Метан сгорает в избытке кислорода с образованием газообразного диоксида углерода (CO 2 (г) ) и водяного пара (H 2 O (г) ).
Сгорание с избытком кислорода называется полным сгоранием.
Мы можем написать сбалансированное химическое уравнение для представления полного сгорания метана, как показано ниже:
- Напишите словесное уравнение для полного сгорания метана:
общее уравнение: реактивы → товаров уравнение слова: метан + кислород газ → углекислый газ + водяной пар - Запишите молекулярную формулу для каждого реагента и продукта в словесном уравнении:
Реагенты Продукты метан: газообразный кислород:
CH 4 (г) O 2 (г)
углекислый газ: водяной пар:
CO 2 (г) H 2 O (г)
- Напишите несбалансированное химическое уравнение, подставив молекулярную формулу для названия каждого реагента и продукта в словесное уравнение:
общее уравнение: реактивы → товаров уравнение слова: метан + кислород газ → углекислый газ + водяной пар несбалансированное химическое уравнение: CH 4 (г) + O 2 (г) → CO 2 (г) + H 2 O (г) - Сбалансируйте химическое уравнение:
несбалансированное химическое уравнение: CH 4 (г) + O 2 (г) → CO 2 (г) + H 2 O (г) №Атомы C: 1 = 1 баланс атомов углерода Кол-во атомов H: 4 ≠ 2 Атомы Н НЕ сбалансированы Необходимо умножить количество молекул воды на 2 , чтобы уравновесить атомы водорода.Затем проверьте баланс этого нового химического уравнения, как показано ниже. CH 4 (г) + O 2 (г) → CO 2 (г) + 2 H 2 O (г) Кол-во атомов C: 1 = 1 баланс атомов углерода №Атомы H: 4 = 4 баланс атомов H Кол-во атомов O: 2 ≠ 2 + 2 Атомы О НЕ сбалансированы Необходимо умножить количество молекул кислорода на 2 , чтобы уравновесить атомы кислорода.Затем проверьте баланс этого нового химического уравнения, как показано ниже: CH 4 (г) + 2 O 2 (г) → CO 2 (г) + 2H 2 O (г) Кол-во атомов C: 1 = 1 баланс атомов углерода №Атомы H: 4 = 4 баланс атомов H Кол-во атомов O: 4 = 2 + 2 баланс атомов O - Сбалансированное химическое уравнение полного сгорания газообразного метана:
CH 4 (г) + 2O 2 (г) → CO 2 (г) + 2H 2 O (г)
Неполное сгорание углеводородов
Если присутствует недостаточно газообразного кислорода для сгорания углеводорода, чтобы произвести наиболее окисленную форму углерода, которой является газообразный диоксид углерода, мы называем реакцию неполным сгоранием углеводорода.
Для неполного сгорания углеводорода:
⚛ газообразный кислород — ограничивающий реагент
⚛ углеводород — избыток реагента
Неполное сгорание углеводорода обычно приводит к возникновению «сажистого» пламени из-за присутствия углерода (C) или сажи как продукта реакции неполного сгорания.
Водород в углеводороде будет окислен до воды, H 2 O, но углерод в углеводороде может или не может быть окислен до газообразного монооксида углерода (CO (г) ).
Пример: неполное сгорание метана
В конкретном эксперименте избыточный газообразный метан (CH (g) ) сжигался в ограниченном количестве газообразного кислорода с образованием сажи (твердого углерода) и водяного пара.
Мы можем написать сбалансированное химическое уравнение, чтобы представить это неполное сгорание метана в этом эксперименте, как показано ниже:
- Напишите словесное уравнение неполного сгорания метана:
общее уравнение: реактивы → товаров уравнение слова: метан + кислород газ → твердый углерод + водяной пар - Запишите молекулярную формулу для каждого реагента и продукта в словесном уравнении:
Реагенты Продукты метан: газообразный кислород:
CH 4 (г) O 2 (г)
твердый углерод: водяной пар:
C (с) H 2 O (г)
- Напишите несбалансированное химическое уравнение, подставив формулу названия каждого реагента и продукта в словесное уравнение:
общее уравнение: реактивы → товаров уравнение слова: метан + кислород газ → твердый углерод + водяной пар несбалансированное химическое уравнение: CH 4 (г) + O 2 (г) → C (т) + H 2 O (г) - Сбалансируйте химическое уравнение:
несбалансированное химическое уравнение: CH 4 (г) + O 2 (г) → C (т) + H 2 O (г) №Атомы C: 1 = 1 баланс атомов углерода Кол-во атомов H: 4 ≠ 2 Атомы Н НЕ сбалансированы Необходимо умножить количество молекул воды на 2 , чтобы уравновесить атомы водорода.Затем проверьте баланс нового уравнения: CH 4 (г) + O 2 (г) → C (т) + 2 H 2 O (г) Кол-во атомов C: 1 = 1 баланс атомов углерода №Атомы H: 4 = 4 баланс атомов H Кол-во атомов O: 2 = 2 баланс атомов O - Сбалансированное химическое уравнение неполного сгорания газообразного метана в этом эксперименте:
CH 4 (г) + O 2 (г) → C (с) + 2H 2 O (г)
Исследование характеристик топливных элементов с прямым углеводородом (пропаном) с использованием математического моделирования
Улучшенная математическая модель была использована для расширения поляризационных кривых для топливных элементов с прямым пропаном (DPFC) до более высоких плотностей тока, чем можно было получить с помощью любой из предыдущих моделей.Затем эффективность DPFC оценивалась с использованием одиннадцати различных переменных. Переменные, связанные с явлениями переноса, мало влияли на поляризационные кривые DPFC. Все переменные, которые имели наибольшее влияние на кривые поляризации DPFC, были связаны с явлением скорости реакции. Явления скорости реакции доминировали на всей кривой поляризации DPFC вплоть до 100 мА / см 2 , что является значением, которое приближается к предельным плотностям тока DPFC. Ранее было известно, что DPFC сильно отличаются от топливных элементов с водородной протонообменной мембраной (PEMFC).Это первая работа, показывающая причину такой разницы. Явления скорости реакции преобладают в DPFC вплоть до предельной плотности тока. Напротив, преобладающее явление в водородных PEMFC изменяется от явлений скорости реакции до миграции протонов через электролит и диффузии газа на катоде, когда плотность тока увеличивается до предельной плотности тока.
1. Введение
Характеристики углеводородных топливных элементов (DHFC) отличаются от характеристик водородных топливных элементов (h3FCs).h3FC имеют плотности тока (скорости реакции), которые обычно на два порядка больше, чем DHFC. Следовательно, по h3FC было проведено гораздо больше исследований, чем по DHFC. Это исследование привело к множеству улучшений со времени первого эксперимента с h3FC, проведенного Гроувом [1] в 1839 году. В настоящее время доступны коммерчески жизнеспособные продукты с h3FC, такие как погрузочно-разгрузочное оборудование (вилочные погрузчики) и системы топливных элементов, которые генерируют резервную электроэнергию. Кроме того, автомобили, работающие на топливных элементах, теперь можно купить в нескольких странах.Перри и Фуллер [2] и Эйслер [3] задокументировали часть истории разработки h3FC.
Несмотря на успех h3FC, есть несколько факторов, которые отдают предпочтение DHFC над h3FC. (а) Существующая инфраструктура делает углеводородное топливо (природный газ, сжиженный нефтяной газ [СНГ] или пропан, бензин, дизельное топливо) доступным почти повсеместно. В отличие от этого инфраструктуры для поставки водородного топлива в большинстве мест нет. Стоимость производства водорода зависит от источника энергии, используемого для его производства.Самый дешевый водород получают из углеводородов (например, природного газа) с использованием сложных процессов, включающих реакцию парового риформинга, реакции конверсии водяного газа при высоких и низких температурах и очистку водорода. Более дорогой водород можно производить из возобновляемых источников энергии (солнечные или ветряные технологии) с последующим электролизом воды. (b) Многие углеводороды могут храниться в жидком виде. Варианты хранения водорода — это газ под высоким давлением, криогенная жидкость (-252 ° C) или гидрид металла. Все варианты хранения водорода дороже, чем хранение жидкости.(c) Плотность энергии углеводородов намного больше, чем у водорода. (d) Электрохимические реакции углеводородов имеют относительную теоретическую энергетическую эффективность 0,92–0,96 [4]. Напротив, для водорода он составляет 0,63 (сочетание 0,83 [4] для электрохимической энергоэффективности и 0,75 для энергоэффективности реакции эндотермического парового риформинга углеводородов). Каждый атом углерода, используемый в DHFC или в комбинации процесса получения водорода из углеводородов и h3FC, будет производить одну молекулу диоксида углерода.Вышеуказанная разница в их теоретической энергоэффективности указывает на то, что количество углекислого газа, выбрасываемого в атмосферу на единицу произведенной энергии, может быть меньше для DHFC, чем для h3FC.
Grove провел первый эксперимент DHFC [5] в 1845 году. Ранние исследования DHFC Беккерелем, Яблочкофом, Жаком, Борхерсом, Либеновом и Стрессером, Хабером и Хофманном были задокументированы Кетелааром [6], который пришел к выводу, что «топливный элемент развитие достигло относительно низкого уровня в течение первых 100 лет исследований ».В 1960-х годах в США были профинансированы концентрированные исследования DHFC. Результаты этой программы представлены в трех обзорах [4, 7, 8]. С тех пор проводились спорадические исследования DHFC. В нашей лаборатории топливный элемент на основе фосфорной кислоты использовался для экспериментов, в которых использовалось коммерческое дизельное топливо с низким содержанием серы при 200 ° C [9]. Хотя плотности тока были чрезвычайно малы, результаты были обнадеживающими: работа в установившемся режиме была продемонстрирована в течение 15 часов с каждым из четырех различных видов дизельного топлива.
Недавно было проведено еще несколько обнадеживающих исследований DHFC с использованием высокотемпературных прямых углеводородных топливных элементов с твердым оксидным электролитом (SOFCs). В этих исследованиях внутренний слой катализатора риформинга был добавлен к слою анодного катализатора. Его цель состояла в том, чтобы преобразовать углеводород в водород до того, как он достигнет соседнего слоя анодного катализатора. Ли и соавторы [10] добавили слой катализатора риформинга Ni-Fe к анодному слою, состоящему из NiO – YSZ (оксид циркония, стабилизированный оксидом иттрия), в экспериментах с метаном при 750 ° C.Позже [10] они сообщили о 1000-часовой непрерывной работе топливного элемента с использованием катализатора риформинга Ni с покрытием из церия в экспериментах с метаном при 610 ° C. Лю и соавторы [11] добавили слой катализатора риформинга, содержащий Ni, YSZ и BaZr (1-X) Y X O (3- δ ) в экспериментах с изооктаном при 750 ° C. Zhang et al. [12] показали, что твердооксидные топливные элементы прямого действия на пропане, имеющие электроды, состоящие из смеси оксида церия, легированного серебром и гадолинием, сохраняют стабильную работу в течение 160 часов в рабочем режиме.Однако эксперименты с оксидом церия, легированным никелем и гадолинием, серьезно дезактивировались после 40 часов работы. Во всех вышеупомянутых отчетах по ТОТЭ плотности тока были немного меньше, но того же порядка величины, что и в h3FC.
Пропан был выбран в качестве топлива для этой работы по двум причинам. Пропан используется для отопления помещений в сельской местности. Таким образом, инфраструктура для топливных элементов с прямым пропаном (DPFCs) в сельской местности уже существует. Во-вторых, затраты на электроэнергию для электросетей в сельской местности намного выше, чем в городских, даже несмотря на то, что цена на электроэнергию в сельских и городских районах одинакова.Следовательно, электроэнергия от системы топливных элементов в сельской местности может быть конкурентоспособной по стоимости с затратами на электроэнергию в сельской местности, даже если она слишком дорога для городских районов.
Результаты с низкотемпературными топливными элементами с протонообменной мембраной (PEMFC), работающими на пропане, были менее обнадеживающими. Некоторые из наиболее многообещающих результатов с пропаном в 1960-х годах были получены с электролитом на основе фосфорной кислоты, Grubb и Michalske [13], и с электролитом на основе плавиковой кислоты, Cairns [14].Однако в последние годы по DPFC было проведено лишь ограниченное количество работ. Примерами являются работа с пропаном с использованием нафиона и полибензимидазольных электролитных мембран Савадого и Варела [15] и с использованием полибензимидазольной мембраны Cheng et al. [16].
Наша долгосрочная цель — найти характеристики DPFC (условия обработки, материалы и конфигурации оборудования), при которых характеристики низкотемпературных DPFC могут стать конкурентоспособными с h3FC. Для достижения этой цели необходимы два шага: (а) выявление ограничивающих явлений, которые ответственны за малые плотности тока в DPFC, и (b) определение характеристик DPFC, которые снимут эти ограничения.
Чтобы внести свой вклад в первый шаг, в этой работе мы использовали математическое моделирование, чтобы изучить влияние нескольких переменных, которые влияют на производительность DPFC. Эксперименты всегда более точны, чем модели. Однако есть некоторые переменные, которые чрезвычайно трудно измерить экспериментально. Примером может служить градиент давления в слое электролита. Напротив, иногда их можно точно вычислить с помощью моделей. Изучая большие изменения каждой из переменных, можно будет определить те переменные, которые имеют наибольший потенциал для улучшения характеристик топливных элементов.
Математические модели топливных элементов используются для описания широкого спектра физических, химических, электрохимических явлений и явлений массопереноса. Было несколько ранних моделей. Вербрюгге и Хилл [17] использовали теорию разбавленного раствора для описания миграции протонов в топливном элементе, имеющем перфторсульфонатную иономерную мембрану. Springer et al. [18] разработали одну из первых моделей водородного топливного элемента. Он предсказал отношение потока воды к потоку протонов в мембране Nafion 117, которое соответствовало экспериментальному значению.Бернарди и Вербрюгге [19] смоделировали механизмы переноса нескольких видов в пределах PEMFC и обнаружили, что диффузия растворенных газов к катализатору ограничивает характеристики топливного элемента. С тех пор модели различной сложности были разработаны на основе простых (аналитических моделей), Kim et al. [20], к более сложным (механистическим моделям), Amphlett et al. [21] и численные модели Вебера и Ньюмана [22]. В настоящее время существует чрезвычайно большой объем литературы, описывающей модели топливных элементов. Некоторые недавние обзоры — это обзоры Жарауты и Рыжакова [23], Саломова и др.[24], а также Чжан и Цзяо [25].
Первая математическая модель пропанового топливного элемента прямого действия (DPFC) была разработана Псофогианнакисом и др. 2006 [26]. Это была одномерная модель вычислительной гидродинамики (CFD). Он использовал электролит фосфорной кислоты и анодный катализатор Pt. Было обнаружено, что перенапряжение контролирует работу топливных элементов. Впоследствии Khakdaman et al. В [27, 28] разработана двумерная математическая модель на основе протонообменной мембраны и Pt-анодного катализатора. Он правильно описал перенос заряженных видов.Электроны (отрицательно заряженные) мигрировали от анода к катоду в ответ на разность электрических потенциалов. Протоны (положительно заряженные) диффундировали от анода к катоду в ответ на разницу концентраций протонов. Недавно Данилов и др. [29] описали модель реактора с последовательно расположенными баками для описания пропанового топливного элемента прямого действия.
В этой работе описана двумерная модель прямого пропанового топливного элемента, которая является улучшением по сравнению с моделями Khakdaman et al.[28]. Для улучшения сходимости использовался метод прогрессивного шага по времени, чтобы можно было прогнозировать поляризационные кривые в более широком диапазоне плотностей тока. Модель использовалась для исследования массива переменных. Переменные были разделены на две группы. Одна группа переменных влияла на процессы массового транспорта. Другая группа переменных была связана с явлениями, происходящими на поверхности электрохимического катализатора, и поэтому влияла на скорость реакции.
Обзор этой работы можно резюмировать в двух заявлениях.Основной целью описанной здесь работы было выявление ограничивающих явлений, которые могут быть ответственны за небольшие плотности тока, наблюдаемые в DPFC. Новизна представленных результатов заключается в том, что все вычисления согласуются с одним явлением, ограничивающим производительность DPFC.
2. Описание модели
Модель основана на следующих желательных реакциях, происходящих в топливном элементе. Реакция между пропаном и водой на аноде и реакция между кислородом воздуха с протонами и электронами на катоде могут быть объединены, чтобы произвести следующую общую реакцию топливного элемента.Электродные потенциалы при 25 ° C для анода, и катода, вместе с разностью потенциалов топливных элементов,, [30], также показаны выше с их соответствующими стехиометрическими реакциями.
Нежелательная реакция, образование углерода, термодинамически возможна через общую реакцию топливного элемента, в которой C, а не CO 2 является продуктом реагентов в (3) (= 0,071 В [30]). Однако об образовании углерода в литературе по топливным элементам для пропана обычно не сообщается [13–18].В частности, Грабб и Михалске сообщили об образовании диоксида углерода 99,3% в 44 экспериментах с использованием водного электролита на основе фосфорной кислоты [13]. Кэрнс сообщил о 100% двуокиси углерода при использовании гидрофторидного водного электролита [14]. Савадого и Родригес [15] сообщили о 100% CO 2 с использованием полимерных электролитов нафион и полибензимидазол. Cheng et al. [16] сообщили, что CO и CO 2 были единственными продуктами, образованными с использованием полибензимидазольного полимерного электролита. Тем не менее, об образовании углерода сообщалось в экспериментах с топливными элементами с молекулами углеводородов с более длинной цепью, н-октаном [7] и дизельным топливом [9].Напротив, об образовании углерода никогда не сообщалось ни в одном низкотемпературном топливном элементе с прямым углеводородом, когда топливом был метан. Эти экспериментальные результаты показывают, что длина углеводородной цепи молекулы топлива определяет, образуется ли углерод в топливном элементе с прямым углеводородом. Поскольку об образовании углерода не сообщалось в экспериментах с топливными элементами с пропаном, его образование не было включено в эту модель.
Область моделирования DPFC состояла из слоя анодного катализатора (ACL), слоя электролита (мембраны) (ML) и слоя катодного катализатора (CCL).Фосфат циркония (Zr (HPO 4 ) 2 • H 2 O или ZrP) был протонопроводящим материалом или электролитом, используемым в модели. Слой мембраны состоял из твердого ZrP, заполняющего поры пористого политетрафторэтилена (ПТФЭ) [31]. Слой катализатора состоял из платинового (Pt) катализатора на углеродном носителе и электролита из ZrP. Встречно-штыревые поля потока (IDFF) использовались как для анода, так и для катода. Один из каналов потока в поле потока использовался для реагентов, а другой — для продуктов.Слой катализатора состоит из трех фаз: газовой фазы, фазы твердого электролита и фазы твердого катализатора.
Математическое описание Хакдамана [28] топливного элемента послужило отправной точкой для модели, используемой здесь. В модели использовались четыре уравнения сохранения: сохранение импульса, полной массы, полного заряда и отдельных компонентов, включая член реакции. Основные уравнения модели включали (а) сохранение массы в газовой фазе, (б) уравнение Эргуна, (в) уравнение Батлера-Фольмера (используемое для расчета скорости реакции на аноде и катоде) и ( г) уравнения сохранения воды и протонов в фазе электролита и в двух слоях катализатора.
Основные уравнения показаны ниже:
(a) Сохранение массы в газовой фазе Сохранение массы в газовой фазе описывается формулой (4).

 замещения (галогенирование)
замещения (галогенирование) разложения (дегидратация)
разложения (дегидратация)