Контрольная работа №1 по теме Классификация химических реакций» и «Электролитическая диссоциация»(9 класс)
Контрольная работа № 1 по темам «Классификация химических реакций» и «Электролитическая диссоциация». Вариант 1 | Баллы |
В реакцию разложения, сопровождающуюся изменением степени окисления, вступает
1) 2) 3) 4) | 1 |
Электрический ток не проводит 1) расплав хлорида натрия 2) расплав оксида кремния 3) раствор азотной кислоты 4) раствор хлорида цинка | 1 |
Вода образуется в реакции ионного обмена при взаимодействии 1) и 2) и 3) и 4) и | 1 |
Взаимодействию растворов карбоната калия и серной кислоты соответствует сокращённое ионное уравнение 1) 2) 3) 4) | 1 |
Сера является окислителем в реакции 1) 2) 3) 4) | 1 |
Правая часть уравнения электролитической диссоциации хлорида железа(III): 1) 2) 3) 4) | 1 |
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
Определите окислитель и восстановитель. | 3 |
Термохимическое уравнение сгорания железа в кислороде:
В результате реакции выделилось 2057,5 кДж. Вычислите массу образовавшегося оксида железа(III). Ответ дайте в граммах с точностью до целых. | 3 |
«5» — 12 БАЛЛОВ
«4» — 10 – 11 БАЛЛОВ
«3» — 7 – 9 БАЛЛОВ
УДАЧИ!
Контрольная работа № 1 по темам «Классификация химических реакций» и «Электролитическая диссоциация».
является восстановителем в реакции1)
2)
3)
4)
1
Электролитом не является
1)
2)
3)
4)
1
Пример реакции обмена:
1)
2)
3)
4)
1
Взаимодействию нитрата серебра и хлорида натрия отвечает краткое ионное уравнение
1)
2)
4)
1
Установите соответствие между схемой окислительно-восстановительной реакции и изменением степени окисления восстановителя в ней.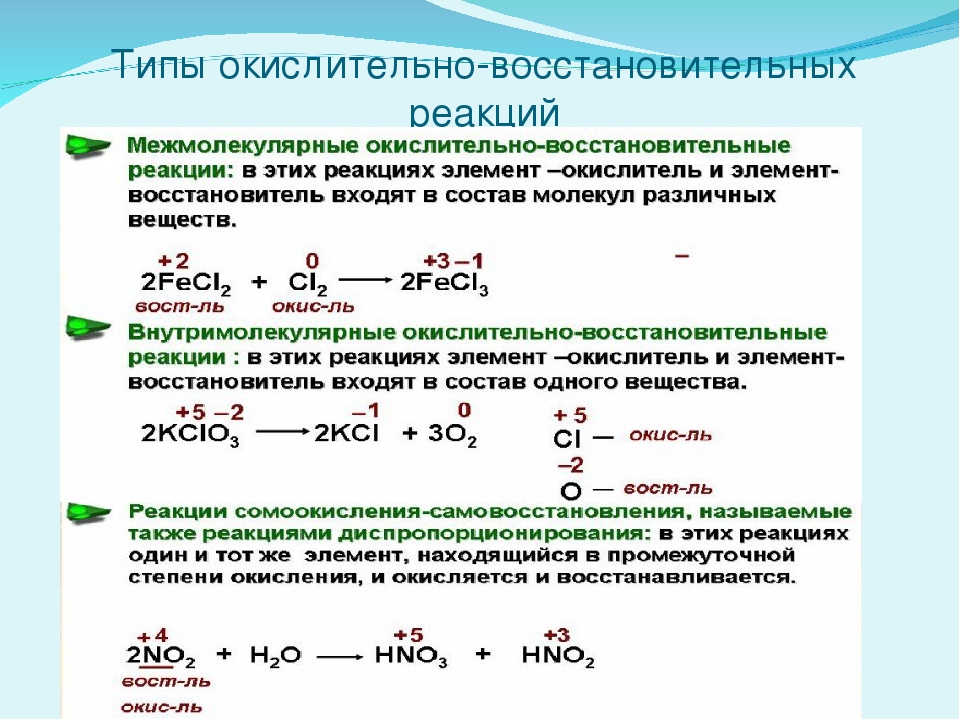
СХЕМА РЕАКЦИИ
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ
A)
1) +4 → +6
Б)
2) +6 → +3
B)
3) +6 → +4
4) 0 → +4
5) 0 → +6
1
Электролитической диссоциации ортофосфорной кислоты по третьей ступени отвечает уравнение
1)
2)
3)
4)
1
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
Определите окислитель и восстановитель
3
В результате реакции, термохимическое уравнение которой
выделилось 264 кДж теплоты. Вычислите массу образовавшейся при этом серной кислоты. Ответ укажите в граммах с точностью до целых.
Ответ укажите в граммах с точностью до целых.
3
«5» — 12 БАЛЛОВ
«4» — 10 – 11 БАЛЛОВ
«3» — 7 – 9 БАЛЛОВ
УДАЧИ!
Контрольная работа «Классификация химических реакций. Электролитическая диссоциация» 9 класс
Контрольная работа №1
Тема. Классификация химических реакций. Электролитическая диссоциация.
Цель: определить уровень знаний учащихся по теме: «Химические реакции и
«Электролитическая диссоциация», выявить затруднения в усвоении
учебного материала и определить пути их преодоления.
Базовые термины и понятия: химические реакции: окислительно-
восстановительные, экзо- и эндотермические, термохимические, реакции
ионного обмена, обратимые и необратимые; окислитель, восстановитель,
химическое равновесие, катализаторы, ионы, катод и анод.
Методы обучения: методы контроля.
Тип урока: контроль знаний.
Вариант 1
1. Дайте определение окислительно – восстановительные реакции и степень
окисления. (0,5 балла)
2. Будут ли подвергаться гидролизу соли АlCl
3
,BaSO
4
? Ответ обосновать.
Какова реакция среды в растворах этих солей? (0,5 балла)
3. Составьте две реакции ионного обмена, соответствующие данному
ионному уравнению: Al
3+
+ 3ОН
—
= Al(ОН)
3
Привести молекулярные и полные ионные уравнения. (1 балл)
4.Подберите коэффициент методом электронного баланса. Укажите
окислитель и восстановитель.
А. FeCl
3
+ Кl= FeCl
2
+l
2
+КСl (1,5 балла)
Б. Mg + N
2
= Mg
3
N
2
5. Определите возможные химические реакции для следующих пар веществ:
А. азотная кислота и хлорид бария;
Б. хлорид железа (ll) и гидроксид натрия;
хлорид железа (ll) и гидроксид натрия;
В. Сульфат алюминия и хлорид кальция.
Составьте для них молекулярные, полные и сокращенные ионные уравнения
реакций.
Контрольная работа №1
Классификация химических реакций. Электролитическая диссоциация.
Вариант 2
1. Дайте определение солей, оснований с точки зрения теории
электролитической диссоциации. (0,5 балла)
Контрольная работа для 9 класса по темам «Классификация химических реакций» и «Электролитическая диссоциация».
Просмотр содержимого документа
«Контрольная работа для 9 класса по темам «Классификация химических реакций» и «Электролитическая диссоциация».»
Контрольная работа по темам
«Классификация химических реакций» и
«Электролитическая диссоциация»
Вариант I
1. Допишите уравнения практически осуществимых химических реакций и рассмотрите их в свете представлений об окислительно-восстановительных процессах и электролитической диссоциации.
Допишите уравнения практически осуществимых химических реакций и рассмотрите их в свете представлений об окислительно-восстановительных процессах и электролитической диссоциации.
А. Са + H2SO4
Б. Cu + HCl
В. Na2SO4 + BaCl2
2. Даны вещества: хлорид железа(III), бромид натрия, бромоводородная кислота, карбонат кальция, оксид серы(VI). К каждому из них добавили гидроксид натрия. В каких случаях произойдут химические реакции? Каковы их признаки? Запишите уравнения этих химических реакций в полной и сокращённой ионной форме.
3. Для сокращённых ионных уравнений составьте молекулярные уравнения реакций:
А. Mg2+ + 2OH– = Mg(OH)2
Б. CO32– + 2H+ = H2O + CO2
4. Задача. Используя термохимическое уравнение
CuO + 2HCl = CuCl2 + H2О + 63,6 кДж
рассчитайте, сколько теплоты выделится при взаимодействии 160 г оксида меди(II) с соляной кислотой.
Дополнительные задания:
5. Объясните на основе знаний об электролитической диссоциации, почему растворы кислот имеют общие свойства.
6. Приведите два примера реакций соединения, одна из которых относится к окислительно-восстановительным реакциям, а другая не относится.
Контрольная работа по темам
«Классификация химических реакций» и
«Электролитическая диссоциация»
В а р и а н т II
1. Допишите уравнения практически осуществимых химических реакций и рассмотрите их в свете представлений об окислительно-восстановительных процессах и электролитической диссоциации.
А. K2CO3 + HNO3
Б. Mg + FeSO4
В. Na2CO3 + Cu
2. Даны вещества: сульфат натрия, оксид цинка, карбонат калия, гидроксид калия. К каждому из них добавили разбавленную серную кислоту. В каких случаях произойдут химические реакции? Каковы их признаки? Запишите уравнения этих химических реакций в полной и сокращённой ионной форме.
В каких случаях произойдут химические реакции? Каковы их признаки? Запишите уравнения этих химических реакций в полной и сокращённой ионной форме.
3. Для сокращённых ионных уравнений составьте молекулярные уравнения реакций:
А. Al3+ + 3OH– = Al(OH)3
Б. SiO3
4. Задача. Используя термохимическое уравнение
2Na + Cl2 = 2NaCl + 819 кДж
рассчитайте, какая масса натрия вступила в реакцию с хлором, если при этом выделилось 40,95 кДж?
Дополнительные задания:
5.Объясните на основе знаний об электролитической диссоциации, почему растворы щелочей имеют общие свойства.
6. Приведите два примера реакций разложения, одна из которых относится к окислительно-восстановительным реакциям, а другая не относится.
Контрольная работа по химии.
 8 класс. Классификация химических реакций. Вариант 1
8 класс. Классификация химических реакций. Вариант 1{module Адаптивный блок Адсенс в начале статьи}
КОНТРОЛЬНАЯ РАБОТА ПО ХИМИИ
8 КЛАСС
КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
ВАРИАНТ 1
1. Определите степени окисления элементов в соединениях: Cr2O3, CrSO4, Na2Cr2O7, Cr, CrO3, Cr(NO3)3. Какие из этих соединений являются за счет хрома:
а) только окислителями
б) только восстановителями
в) проявляют двойственность окислительно-восстановительных свойств?
2. Составьте уравнения реакций:
а) CuS + O2 → CuO + SO2
б) Mg + H2SO4 → MgSO4 + S + H2O
в) NaHCO3 + NaOH → Na2CO3 + H2O
г) PCl3 + Cl2 → PCl5
д) Na2O + Cl2O7 → NaClO4
Какие из реакций являются окислительно-восстановительными? Составьте где необходимо, электронный баланс.
3. Для хлорида меди (II) приведите по две реакции, протекающие
а) с изменением степеней окисления
б) без изменения степеней окисления.
Приведите для указанных вами реакций, где это необходимо, электронный баланс и ионные уравнения реакций.
4. В трех пробирках находятся растворы NaCl, Na2SO4, Na2CO3. Какие реактивы потребуются, чтобы определить, в какой пробирке какой раствор находится? Какие признаки химических реакций наблюдаются? Приведите уравнения реакций.
5. Серу массой 12,8 г окислили достаточным количеством кислорода. Продукт окисления пропустили через избыток гидроксида калия. К полученному раствору прилили раствор хлорида кальция. Определите массу осадка.
Решения и ответы:
ДРУГИЕ ВАРИАНТЫ КОНТРОЛЬНЫХ РАБОТ
{module Адаптивный блок Адсенс в конце статьи}
«Классификация химических реакций.
 Окислительно-восстановительные реакции». Вариант 2
Окислительно-восстановительные реакции». Вариант 2
КОНТРОЛЬНАЯ РАБОТА ПО ХИМИИ
8 КЛАСС
ТЕМА: КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
ВАРИАНТ 2
Контрольные работы являются одним из основных способов текущего и итогового контроля по теме. Обычно контрольные работы по химии для 8 класса включают в себя 5-6 заданий и рассчитаны на выполнение в течение одного урока (40-45 минут). В случае, если какое-либо задание вызывает затруднения, рекомендуется пропустить его и перейти к выполнению следующего, чтобы не терять время. К пропущенному заданию можно вернуться после выполнения всей контрольной работы, если позволит время.
1. Определите степени окисления элементов в соединениях:
As2O5, CrSO4, Na3AsO4, AsH3, AsBr3, As, H3AsO3 ?
Какие из этих соединений являются за счет мышьяка:
а) только окислителями;
б) только восстановителями;
в) проявляют двойственность окислительно-восстановительных свойств?
2. Составьте уравнения реакций, соответствующих схемам:
Составьте уравнения реакций, соответствующих схемам:
а) Fe(OH)2 + O2 + H2O → Fe(OH)3
б) ZnO + HNO3 → Zn(NO3)2 + H2O
в) Na2SO3 + Cl2 + H2O → Na2SO4 + HCl
г) Na3N + H2O → NaOH + NH3
д) KClO3 → KCl + KClO4
Какие из этих реакций являются окислительно-восстановительными? Для каждой окислительно-восстановительной реакции составьте электронный баланс.
3. Для серной кислоты приведите по две реакции, протекающие:
а) с изменением степеней окисления;
б) без изменения степеней окисления.
Приведите для указанных вами реакций, где это необходимо, электронный баланс и ионные уравнения реакций.
4. Предложите план распознавания следующих веществ: нитрата натрия, нитрата кальция, нитрата серебра. Приведите уравнения всех реакций, укажите их признаки.
5. Магний растворили в 150 г 7,3%-ного раствора соляной кислоты. Определите массу оксида никеля (II), которую можно восстановить полученным водородом.
Химия / 8 класс / Контрольные работы / Классификация химических реакций. Окислительно-восстановительные реакции.
Преподавателю: Данная контрольная работа по химии проводится с учащимися 8 класса общеобразовательной школы. По структуре и сложности задания контрольной работы соответствуют обязательному минимуму содержания по химии в полной средней школе, а также соответствуют тематическому поурочному планированию к учебнику О. С. Габриеляна для 2-х часовой программы. Данная контрольная работа может быть использована для контроля знаний учащихся по химии учителями, работающими по любым другим учебникам.
С. Габриеляна для 2-х часовой программы. Данная контрольная работа может быть использована для контроля знаний учащихся по химии учителями, работающими по любым другим учебникам.
Целью данной контрольной работы является контроль усвоения учащимися темы «Классификация химических реакций. Окислительно-восстановительные реакции».
| < Предыдущая | Следующая > |
|---|
Самостоятельная работа по темам «Классификация химических реакций, протекающих с изменением состава веществ», «Скорость химической реакции»
Самостоятельная работа по темам
«Классификация химических реакций,
протекающих с изменением состава веществ»,
«Скорость химической реакции»
Вариант 1
1. Определите тип химической реакции по числу и составу реагентов. Используя метод электронного баланса, найдите коэффициенты в уравнениях следующих реакций:
Определите тип химической реакции по числу и составу реагентов. Используя метод электронного баланса, найдите коэффициенты в уравнениях следующих реакций:
а) NO2 + O2 + h3O —-> HNO3
б) Mg + СО2 —-> MgО + С
в) Cu(NО3)2 —-> CuО + NО2 + О2
2. Определите скорость химической реакции А + В = АВ, если начальная концентрация вещества (А) С1 в определенный момент времени (t1) была равна 12 моль/л, а через 10 с концентрация этого вещества (С2) стала 1,2 моль/л.
3. Определите, как изменится скорость химической реакции 2СО(г) + О2(г) = 2СО2(г) при увеличении концентрации исходных веществ в 3 раза.
4. Во сколько раз увеличится скорость химической реакции при повышении температуры от 10 до 60о С, если температурный коэффициент равен 2.
Самостоятельная работа по темам
«Классификация химических реакций,
протекающих с изменением состава веществ»,
«Скорость химической реакции»
Вариант 2
1. Определите тип химической реакции по числу и составу реагентов. Используя метод электронного баланса, найдите коэффициенты в уравнениях следующих реакций:
а) Si + НF —-> SiF4 + Н2
б) Fе(ОН)2 + О2 + Н2О —-> Fе(ОН)3
в) АgNО3 —-> Аg + NО2 + О2
2. Определите скорость химической реакции А + В = АВ, если начальная концентрация вещества (А) С1 в определенный момент времени (t1) была равна 14 моль/л, а через 14 с концентрация этого вещества (С2) стала 2,6 моль/л.
3. Определите, как изменится скорость химической реакции 2NО(г) + О2(г) = 2NО2(г) при увеличении концентрации исходных веществ в 4 раза.
4. Во сколько раз увеличится скорость химической реакции при повышении температуры от 20 до 70о С, если температурный коэффициент равен 2.
5.3: Типы химических реакций
Результаты обучения
- Классифицируют реакцию как комбинацию, разложение, однократное замещение, двойное замещение или горение.
- Предсказать продукты и уравновесить реакцию горения.
Многие химические реакции можно разделить на пять основных типов. Полное понимание этих типов реакций будет полезно для предсказания продуктов неизвестной реакции. Пять основных типов химических реакций — это комбинация, разложение, однократное замещение, двойное замещение и горение.Анализ реагентов и продуктов данной реакции позволит вам отнести ее к одной из этих категорий. Некоторые реакции можно отнести к нескольким категориям.
Некоторые реакции можно отнести к нескольким категориям.
Комбинированные реакции
Реакция объединения , также известная как реакция синтеза , представляет собой реакцию, в которой два или более вещества объединяются с образованием единого нового вещества. Комбинированные реакции могут также называться реакциями синтеза. Общая форма комбинированной реакции:
\ [\ ce {A} + \ ce {B} \ rightarrow \ ce {AB} \]
Одна комбинационная реакция — это соединение двух элементов с образованием соединения.Твердый металлический натрий реагирует с газообразным хлором с образованием твердого хлорида натрия.
\ [2 \ ce {Na} \ left (s \ right) + \ ce {Cl_2} \ left (g \ right) \ rightarrow 2 \ ce {NaCl} \ left (s \ right) \]
Обратите внимание, что для того, чтобы правильно написать и сбалансировать уравнение, важно помнить о семи элементах, которые существуют в природе в виде двухатомных молекул (\ (\ ce {H_2} \), \ (\ ce {N_2} \), \ (\ ce {O_2} \), \ (\ ce {F_2} \), \ (\ ce {Cl_2} \), \ (\ ce {Br_2} \) и \ (\ ce {I_2} \)) .
Одним из часто встречающихся видов комбинационной реакции является реакция элемента с кислородом с образованием оксида.И металлы, и неметаллы легко реагируют с кислородом в большинстве условий. Магний быстро и резко реагирует при воспламенении, соединяясь с кислородом воздуха с образованием тонкого порошка оксида магния.
\ [2 \ ce {Mg} \ left (s \ right) + \ ce {O_2} \ left (g \ right) \ rightarrow 2 \ ce {MgO} \ left (s \ right) \]
Реакция разложения
Реакция разложения — это реакция, в которой соединение распадается на два или более простых вещества. Общая форма реакции разложения:
\ [\ ce {AB} \ rightarrow \ ce {A} + \ ce {B} \]
Большинство реакций разложения требуют ввода энергии в виде тепла, света или электричества.
Бинарные соединения — это соединения, состоящие всего из двух элементов. Самый простой вид реакции разложения — это когда бинарное соединение разлагается на элементы. Оксид ртути (II), красное твердое вещество, разлагается при нагревании с образованием ртути и газообразного кислорода.
Оксид ртути (II), красное твердое вещество, разлагается при нагревании с образованием ртути и газообразного кислорода.
\ [2 \ ce {HgO} \ left (s \ right) \ rightarrow 2 \ ce {Hg} \ left (l \ right) + \ ce {O_2} \ left (g \ right) \]
Реакция также считается реакцией разложения, даже если один или несколько продуктов все еще являются соединением.Карбонат металла разлагается на оксид металла и газообразный диоксид углерода. Например, карбонат кальция разлагается на оксид кальция и диоксид углерода.
\ [\ ce {CaCO_3} \ left (s \ right) \ rightarrow \ ce {CaO} \ left (s \ right) + \ ce {CO_2} \ left (g \ right) \]
Гидроксиды металлов разлагаются при нагревании с образованием оксидов металлов и воды. Гидроксид натрия разлагается с образованием оксида натрия и воды.
\ [2 \ ce {NaOH} \ left (s \ right) \ rightarrow \ ce {Na_2O} \ left (s \ right) + \ ce {H_2O} \ left (g \ right) \]
Реакции при однократной замене
Реакция однократного замещения — это реакция, в которой один элемент заменяет аналогичный элемент в соединении . Общая форма реакции однократного замещения (также называемой однократным вытеснением):
Общая форма реакции однократного замещения (также называемой однократным вытеснением):
\ [\ ce {A} + \ ce {BC} \ rightarrow \ ce {AC} + \ ce {B} \]
В этой общей реакции элемент \ (\ ce {A} \) является металлом и заменяет элемент \ (\ ce {B} \), также металл, в соединении. Когда элемент, выполняющий замену, является неметаллом, он должен заменить другой неметалл в соединении, и общее уравнение принимает следующий вид:
\ [\ ce {Y} + \ ce {XZ} \ rightarrow \ ce {XY} + \ ce {Z} \]
\ (\ ce {Y} \) является неметаллом и заменяет неметалл \ (\ ce {Z} \) в соединении на \ (\ ce {X} \).
Магний является более химически активным металлом, чем медь. Когда полоса металлического магния помещается в водный раствор нитрата меди (II), она заменяет медь. Продуктами реакции являются водный раствор нитрата магния и твердая металлическая медь.
\ [\ ce {Mg} \ left (s \ right) + \ ce {Cu (NO_3) _2} \ left (aq \ right) \ rightarrow \ ce {Mg (NO_3) _2} \ left (aq \ right) + \ ce {Cu} \ left (s \ right) \]
Многие металлы легко вступают в реакцию с кислотами, и, когда они это делают, одним из продуктов реакции является газообразный водород. Цинк реагирует с соляной кислотой с образованием водного хлорида цинка и водорода (см. Рисунок ниже).
Цинк реагирует с соляной кислотой с образованием водного хлорида цинка и водорода (см. Рисунок ниже).
\ [\ ce {Zn} \ left (s \ right) + 2 \ ce {HCl} \ left (aq \ right) \ rightarrow \ ce {ZnCl_2} \ left (aq \ right) + \ ce {H_2} \ влево (г \ вправо) \]
Рисунок 10.6.1: Металлический цинк реагирует с соляной кислотой с выделением газообразного водорода в реакции однократного замещения.
Рисунок 10.6.2: На этом изображении показано примерно 3 фунта металлического натрия, реагирующего с водой.Металлический натрий бурно реагирует при попадании в емкость с водой с выделением газообразного водорода. Большой кусок натрия часто выделяет столько тепла, что водород воспламеняется.
Реакция двойной замены
Реакция двойной замены — это реакция, в которой положительные и отрицательные ионы двух ионных соединений обмениваются местами с образованием двух новых соединений . Общая форма реакции двойного замещения (также называемой двойным вытеснением):
Общая форма реакции двойного замещения (также называемой двойным вытеснением):
\ [\ ce {AB} + \ ce {CD} \ rightarrow \ ce {AD} + \ ce {CB} \]
В этой реакции \ (\ ce {A} \) и \ (\ ce {C} \) являются положительно заряженными катионами, а \ (\ ce {B} \) и \ (\ ce {D} \) являются отрицательно заряженными анионами.Реакции двойного замещения обычно происходят между веществами в водном растворе. Для протекания реакции одним из продуктов обычно является твердый осадок, газ или молекулярное соединение, такое как вода.
Осадок образуется в реакции двойного замещения, когда катионы одного из реагентов соединяются с анионами другого реагента с образованием нерастворимого ионного соединения. При смешивании водных растворов йодида калия и нитрата свинца (II) происходит следующая реакция.
\ [2 \ ce {KI} \ left (aq \ right) + \ ce {Pb (NO_3) _2} \ left (aq \ right) \ rightarrow 2 \ ce {KNO_3} \ left (aq \ right) + \ ce {PbI_2} \ left (s \ right) \]
Рисунок 10. 6.3: Когда несколько капель нитрата свинца (II) добавляются к раствору иодида калия, сразу же образуется желтый осадок иодида свинца (II) в реакции двойного замещения.
6.3: Когда несколько капель нитрата свинца (II) добавляются к раствору иодида калия, сразу же образуется желтый осадок иодида свинца (II) в реакции двойного замещения.
Реакция горения
Реакция горения — это реакция, при которой вещество реагирует с газообразным кислородом, выделяя энергию в виде света и тепла. Реакции горения должны включать \ (\ ce {O_2} \) в качестве одного реагента. При сгорании газообразного водорода образуется водяной пар (см. Рисунок ниже).
\ [2 \ ce {H_2} \ left (g \ right) + \ ce {O_2} \ left (g \ right) + 2 \ ce {H_2O} \ left (g \ right) \]
Обратите внимание, что эта реакция также квалифицируется как реакция комбинации.
Рисунок 10.6.4: Hindenburg был дирижаблем, наполненным водородом, который потерпел аварию при попытке приземления в Нью-Джерси в 1937 году.Водород сразу же загорелся огромным огненным шаром, уничтожив дирижабль и убив 36 человек. Химическая реакция была простой: водород соединяется с кислородом с образованием воды.
Химическая реакция была простой: водород соединяется с кислородом с образованием воды.
Многие реакции горения происходят с углеводородом, соединением, состоящим исключительно из углерода и водорода. Продуктами сгорания углеводородов всегда являются углекислый газ и вода. Многие углеводороды используются в качестве топлива, поскольку при их сгорании выделяется очень большое количество тепловой энергии.Пропан \ (\ left (\ ce {C_3H_8} \ right) \) — газообразный углеводород, который обычно используется в качестве источника топлива в газовых грилях.
\ [\ ce {C_3H_8} \ left (g \ right) + 5 \ ce {O_2} \ left (g \ right) \ rightarrow 3 \ ce {CO_2} \ left (g \ right) + 4 \ ce {H_2O } \ left (g \ right) \]
Пример 10.6.1
Этанол можно использовать в качестве источника топлива в спиртовой лампе. Формула для этанола \ (\ ce {C_2H_5OH} \). Напишите сбалансированное уравнение горения этанола.
Решение:
Шаг 1. Спланируйте проблему.
Спланируйте проблему.
Реагентами являются этанол и кислород. Как и в случае с углеводородами, продуктами сгорания спирта являются углекислый газ и вода.
Шаг 2: Решить.
Запишите скелетные уравнения: \ (\ ce {C_2H_5OH} \ left (l \ right) + \ ce {O_2} \ left (g \ right) \ rightarrow \ ce {CO_2} \ left (g \ right) + \ ce {H_2O} \ left (g \ right) \)
Сбалансируйте уравнение.
\ [\ ce {C_2H_5OH} \ left (l \ right) + 3 \ ce {O_2} \ left (g \ right) \ rightarrow 2 \ ce {CO_2} \ left (g \ right) + 3 \ ce {H_2O } \ left (g \ right) \]
Шаг 3. Подумайте о своем результате.
Реакции горения должны включать кислород в качестве реагента. Обратите внимание, что получаемая вода находится в газообразном, а не в жидком состоянии из-за высоких температур, сопровождающих реакцию горения.
Авторы
Фонд CK-12 Шэрон Бьюик, Ричард Парсонс, Тереза Форсайт, Шонна Робинсон и Жан Дюпон.
Эллисон Султ, Ph.D. (Кафедра химии, Университет Кентукки)
7.10. Классификация химических реакций — Chemistry LibreTexts
Цели обучения
- Классифицируют химическую реакцию как синтез, разложение, однократное замещение, двойное замещение или реакцию горения.
- Предскажите продукты простых реакций.
Химические реакции, которые мы описали, представляют собой лишь небольшую часть бесконечного числа возможных химических реакций. Как химики справляются с таким огромным разнообразием? Как они предсказывают, какие соединения будут реагировать друг с другом и какие продукты будут образовываться? Ключ к успеху — найти полезные способы категоризации реакций.Знакомство с несколькими основными типами реакций поможет вам предсказать продукты, которые образуются при контакте определенных видов соединений или элементов.
Большинство химических реакций можно разделить на один или несколько из пяти основных типов: кислотно-основные реакции, реакции обмена, реакции конденсации (и обратные реакции расщепления) и реакции окисления и восстановления. Общие формы этих пяти типов реакций приведены в Таблице \ (\ PageIndex {1} \) вместе с примерами каждого из них.Однако важно отметить, что многие реакции могут быть отнесены к более чем одной классификации, как вы увидите в нашем обсуждении.
| Название реакции | Общая форма | Примеры |
|---|---|---|
| Окисление – восстановление (редокс) | окислитель + восстановитель → восстановленный окислитель + окисленный восстановитель | C 7 H 16 (л) + 11O 2 (г) → 7CO 2 (г) + 8H 2 O (г) |
| Кислотно-щелочная | кислота + основание → соль | NaOH (водн.) + HNO 3 (водн.) → NaNO 3 (водн.) + H 2 O (л) |
Обмен: однократная замена | AB + C → AC + B | ZnCl 2 (водн.) + Mg (s) → MgCl 2 (водн.) + Zn (s) |
| Обмен: Двойная замена | AB + CD → AD + CB | BaCl 2 (водн.) + Na 2 SO 4 (водн.) → BaSO 4 (т.) + 2NaCl (водн.) |
| Комбинация (синтез) | А + В → АВ | CO 2 (г) + H 2 O (л) → H 2 CO 3 (водн.) N 2 (г) + 2O 2 (г) → 2NO 2 (г) |
| Разложение | AB → A + B | CaCO 3 (т) → CaO (т) + CO 2 (г) |
Схема классификации приведена только для удобства; одну и ту же реакцию можно классифицировать по-разному, в зависимости от того, какая из ее характеристик наиболее важна.В этом разделе обсуждаются реакции окисления-восстановления, в которых происходит чистый перенос электронов от одного атома к другому, и реакции конденсации. Кислотно-основные реакции — это один из видов реакции обмена — образование нерастворимой соли, такой как сульфат бария, когда растворы двух растворимых солей смешиваются вместе.
Комбинированные реакции
Реакция объединения — это реакция, в которой два или более веществ объединяются с образованием одного нового вещества.Комбинированные реакции также можно назвать реакциями синтеза. Общая форма комбинированной реакции:
\ [\ ce {A} + \ ce {B} \ rightarrow \ ce {AB} \]
Одна комбинационная реакция — это соединение двух элементов с образованием соединения. Твердый металлический натрий реагирует с газообразным хлором с образованием твердого хлорида натрия.
\ [2 \ ce {Na} \ left (s \ right) + \ ce {Cl_2} \ left (g \ right) \ rightarrow 2 \ ce {NaCl} \ left (s \ right) \ nonumber \]
Обратите внимание, что для того, чтобы правильно написать и сбалансировать уравнение, важно помнить о семи элементах, которые существуют в природе в виде двухатомных молекул (\ (\ ce {H_2} \), \ (\ ce {N_2} \), \ (\ ce {O_2} \), \ (\ ce {F_2} \), \ (\ ce {Cl_2} \), \ (\ ce {Br_2} \) и \ (\ ce {I_2} \)) .
Одним из часто встречающихся типов комбинационной реакции является реакция элемента с кислородом с образованием оксида. И металлы, и неметаллы легко реагируют с кислородом в большинстве условий. Магний быстро и резко реагирует при воспламенении, соединяясь с кислородом воздуха с образованием тонкого порошка оксида магния:
\ [2 \ ce {Mg} \ left (s \ right) + \ ce {O_2} \ left (g \ right) \ rightarrow 2 \ ce {MgO} \ left (s \ right) \ nonumber \]
Сера реагирует с кислородом с образованием диоксида серы:
\ [\ ce {S} \ left (s \ right) + \ ce {O_2} \ left (g \ right) \ rightarrow \ ce {SO_2} \ left (g \ right) \ nonumber \]
При взаимодействии неметаллов друг с другом продукт представляет собой молекулярное соединение.Часто неметаллические реагенты могут сочетаться в разных соотношениях и давать разные продукты. Сера также может соединяться с кислородом с образованием триоксида серы:
\ [2 \ ce {S} \ left (s \ right) + 3 \ ce {O_2} \ left (g \ right) \ rightarrow 2 \ ce {SO_3} \ left (g \ right) \ nonumber \]
Переходные металлы способны принимать несколько положительных зарядов в своих ионных соединениях. Следовательно, большинство переходных металлов способны образовывать различные продукты в реакции сочетания. Железо реагирует с кислородом с образованием как оксида железа (II), так и оксида железа (III):
\ [2 \ ce {Fe} \ left (s \ right) + \ ce {O_2} \ left (g \ right) \ rightarrow 2 \ ce {FeO} \ left (s \ right) \ nonumber \]
\ [4 \ ce {Fe} \ left (s \ right) + 3 \ ce {O_2} \ left (g \ right) \ rightarrow 2 \ ce {Fe_2O_3} \ left (s \ right) \ nonumber \]
Пример \ (\ PageIndex {1} \): сжигание твердого калия
Калий — это очень реактивный щелочной металл, который необходимо хранить под маслом, чтобы предотвратить его реакцию с воздухом.Напишите сбалансированное химическое уравнение реакции взаимодействия калия и кислорода.
Решение
| Ступени | Пример решения |
|---|---|
Спланируйте проблему. | Убедитесь, что формулы всех реагентов и продуктов верны. перед балансировкой уравнения. Газообразный кислород — это двухатомная молекула.{2 -}} \). |
| Решить. | Каркас (неуравновешенное) уравнение: \ [\ ce {K} \ left (s \ right) + \ ce {O_2} \ left (g \ right) \ rightarrow \ ce {K_2O} \ left (s \ right) \ nonumber \] Уравнение затем легко уравновешивается с помощью коэффициентов. \ [4 \ ce {K} \ left (s \ right) + \ ce {O_2} \ left (g \ right) \ rightarrow 2 \ ce {K_2O} \ left (s \ right) \ nonumber \] |
| Подумайте о своем результате. | Формулы верны, и результирующая реакция комбинации сбалансирована. |
Комбинированные реакции также могут иметь место, когда элемент реагирует с соединением с образованием нового соединения, состоящего из большего числа атомов. Окись углерода реагирует с кислородом с образованием двуокиси углерода в соответствии с уравнением:
\ [2 \ ce {CO} \ left (g \ right) + \ ce {O_2} \ left (g \ right) \ rightarrow 2 \ ce {CO_2} \ left (g \ right) \]
Два соединения также могут реагировать с образованием более сложного соединения.Очень распространенный пример — реакции оксидов с водой. Оксид кальция легко реагирует с водой с образованием водного раствора гидроксида кальция:
\ [\ ce {CaO} \ left (s \ right) + \ ce {H_2O} \ left (l \ right) \ rightarrow \ ce {Ca (OH) _2} \ left (aq \ right) \]
Газообразный триоксид серы реагирует с водой с образованием серной кислоты. К сожалению, это обычная реакция, которая происходит в атмосфере в некоторых местах, где оксиды серы присутствуют в качестве загрязнителей. Кислота, образовавшаяся в результате реакции, падает на землю в виде кислотного дождя.
\ [\ ce {SO_3} \ left (g \ right) + \ ce {H_2O} \ left (l \ right) \ rightarrow \ ce {H_2SO_4} \ left (aq \ right) \]
Рисунок \ (\ PageIndex {1} \): Кислотный дождь имеет серьезные последствия как для природных, так и для искусственных объектов. Кислотный дождь разрушает мраморные статуи, подобные изображению слева (A). Деревья в лесу справа (B) погибли из-за кислотного дождя.Упражнение \ (\ PageIndex {1} \)
- Напишите химическое уравнение синтеза бромида серебра \ (\ ce {AgBr} \).
- Предскажите продукты для следующей реакции: \ (\ ce {CO_2} \ left (g \ right) + \ ce {H_2O} \ left (l \ right) \)
- Ответ:
- \ (2 \ ce {Ag} + \ ce {Br_2} \ rightarrow 2 \ ce {AgBr} \)
- Ответ b:
- \ (\ ce {CO_2} \ left (g \ right) + \ ce {H_2O} \ left (l \ right) \ rightarrow \ ce {H_2CO_3} \)
Реакция разложения
Реакция разложения — это реакция, в которой соединение распадается на два или более простых вещества.Общая форма реакции разложения:
\ [\ ce {AB} \ rightarrow \ ce {A} + \ ce {B} \]
Большинство реакций разложения требуют ввода энергии в виде тепла, света или электричества.
Бинарные соединения — это соединения, состоящие всего из двух элементов. Самый простой вид реакции разложения — это когда бинарное соединение разлагается на элементы. Оксид ртути (II), красное твердое вещество, разлагается при нагревании с образованием ртути и газообразного кислорода:
\ [2 \ ce {HgO} \ left (s \ right) \ rightarrow 2 \ ce {Hg} \ left (l \ right) + \ ce {O_2} \ left (g \ right) \]
Видео \ (\ PageIndex {2} \): Оксид ртути (II) представляет собой твердое вещество красного цвета.При нагревании он разлагается на металлическую ртуть и газообразный кислород.
Реакция также считается реакцией разложения, даже если один или несколько продуктов все еще являются соединениями. Карбонат металла разлагается на оксид металла и газообразный диоксид углерода. Например, карбонат кальция разлагается на оксид кальция и диоксид углерода:
\ [\ ce {CaCO_3} \ left (s \ right) \ rightarrow \ ce {CaO} \ left (s \ right) + \ ce {CO_2} \ left (g \ right) \]
Гидроксиды металлов разлагаются при нагревании с образованием оксидов металлов и воды.Гидроксид натрия разлагается с образованием оксида натрия и воды:
\ [2 \ ce {NaOH} \ left (s \ right) \ rightarrow \ ce {Na_2O} \ left (s \ right) + \ ce {H_2O} \ left (g \ right) \]
Некоторые нестабильные кислоты разлагаются с образованием оксидов неметаллов и воды. Углекислота легко разлагается при комнатной температуре на диоксид углерода и воду:
\ [\ ce {H_2CO_3} \ left (aq \ right) \ rightarrow \ ce {CO_2} \ left (g \ right) + \ ce {H_2O} \ left (l \ right) \]
Пример \ (\ PageIndex {2} \): Электролиз воды
Когда электрический ток проходит через чистую воду, она разлагается на элементы.Напишите сбалансированное уравнение разложения воды.
Решение
| Ступени | Пример решения |
|---|---|
| Спланируйте проблему. | Вода — это бинарное соединение, состоящее из водорода и кислорода. Газообразные водород и кислород, образующиеся в реакции, представляют собой двухатомные молекулы. |
Решить. | Каркас (неуравновешенное) уравнение: \ [\ ce {H_2O} \ left (l \ right) \ overset {\ text {elec}} {\ rightarrow} \ ce {H_2} \ left (g \ right) + \ ce {O_2} \ left (g \ right) \ nonumber \] Обратите внимание на аббревиатуру «\ (\ text {elec} \)» над стрелкой, чтобы указать прохождение электрического тока для инициирования реакции. Сбалансируйте уравнение. \ [2 \ ce {H_2O} \ left (l \ right) \ overset {\ text {elec}} {\ rightarrow} 2 \ ce {H_2} \ left (g \ right) + \ ce {O_2} \ left (г \ право) \ nonumber \] |
| Подумайте о своем результате. | Продукты являются стихиями, и уравнение сбалансировано. |
Упражнение \ (\ PageIndex {2} \)
Напишите химическое уравнение разложения:
- \ (\ ce {Al_2O_3} \)
- \ (\ ce {Ag_2S} \)
- Ответьте на
- \ (2 \ ce {Al_2O_3} \ rightarrow 4 \ ce {Al} + 3 \ ce {O_2} \)
- Ответ б
- \ (\ ce {Ag_2S} \ rightarrow 2 \ ce {Ag} + \ ce {S} \)
Реакции однократной замены
Третий тип реакции — реакция одиночного замещения, в которой один элемент заменяет аналогичный элемент в соединении.Общая форма реакции однократного замещения (также называемой однократным вытеснением):
\ [\ ce {A} + \ ce {BC} \ rightarrow \ ce {AC} + \ ce {B} \]
В этой общей реакции элемент \ (\ ce {A} \) является металлом и заменяет элемент \ (\ ce {B} \), также металл, в соединении. Когда элемент, выполняющий замену, является неметаллом, он должен заменить другой неметалл в соединении, и общее уравнение принимает следующий вид:
\ [\ ce {Y} + \ ce {XZ} \ rightarrow \ ce {XY} + \ ce {Z} \]
, где \ (\ ce {Y} \) — неметалл и заменяет неметалл \ (\ ce {Z} \) в соединении на \ (\ ce {X} \).
Замена металла
Магний является более химически активным металлом, чем медь. Когда полоса металлического магния помещается в водный раствор нитрата меди (II), она заменяет медь. Продуктами реакции являются водный раствор нитрата магния и твердая металлическая медь.
\ [\ ce {Mg} \ left (s \ right) + \ ce {Cu (NO_3) _2} \ left (aq \ right) \ rightarrow \ ce {Mg (NO_3) _2} \ left (aq \ right) + \ ce {Cu} \ left (s \ right) \]
Эта подкатегория реакций однократного замещения называется реакцией замещения металла, потому что это металл, который заменяется (медь).
Замена водорода
Многие металлы легко вступают в реакцию с кислотами, и когда они это делают, одним из продуктов реакции является газообразный водород. Цинк реагирует с соляной кислотой с образованием водного хлорида цинка и водорода (рисунок ниже).
\ [\ ce {Zn} \ left (s \ right) + 2 \ ce {HCl} \ left (aq \ right) \ rightarrow \ ce {ZnCl_2} \ left (aq \ right) + \ ce {H_2} \ влево (г \ вправо) \]
В реакции замещения водорода водород в кислоте заменяется активным металлом.Некоторые металлы настолько реактивны, что способны заменять водород в воде. Продуктами такой реакции являются гидроксид металла и газообразный водород. Все металлы группы 1 подвергаются этому типу реакции. Натрий бурно реагирует с водой с образованием водного гидроксида натрия и водорода (см. Рисунок ниже).
\ [2 \ ce {Na} \ left (s \ right) + 2 \ ce {H_2O} \ left (l \ right) \ rightarrow 2 \ ce {NaOH} \ left (aq \ right) + \ ce {H_2 } \ left (g \ right) \]
Рисунок \ (\ PageIndex {2} \): (Первое изображение) Металлический цинк реагирует с соляной кислотой с выделением газообразного водорода в реакции одинарного вытеснения.(Второе изображение) Металлический натрий бурно реагирует с водой с выделением газообразного водорода. Большой кусок натрия часто выделяет столько тепла, что водород воспламеняется.Замена галогена
Элемент хлор реагирует с водным раствором бромида натрия с образованием водного хлорида натрия и элементарного брома:
\ [\ ce {Cl_2} \ left (g \ right) + 2 \ ce {NaBr} \ left (aq \ right) \ rightarrow 2 \ ce {NaCl} \ left (aq \ right) + \ ce {Br_2} \ влево (л \ вправо) \]
Реакционная способность галогенной группы (группа 17) уменьшается сверху вниз внутри группы.Фтор является наиболее реактивным галогеном, а йод — наименее активным. Поскольку хлор выше брома, он более активен, чем бром, и может замещать его в реакции замещения галогена.
Пример \ (\ PageIndex {3} \)
Каковы продукты реакции между твердым алюминием (\ (\ ce {Al} \)) и оксидом железа (III) (\ (\ ce {Fe_2O_3} \))?
Решение
| Ступени | Пример решения |
|---|---|
| Спланируйте проблему. | Чтобы предсказать продукты, нам нужно знать, что алюминий заменит железо и образует оксид алюминия (металл заменит ион металла в соединении). Алюминий имеет заряд \ (+ 3 \), а кислород имеет заряд \ (- 2 \). Следовательно, соединение, образованное между алюминием и кислородом, будет \ (\ ce {Al_2O_3} \). Поскольку железо заменяется алюминием, железо теперь будет единственным элементом в продуктах. |
Решить. | Несбалансированное уравнение будет: \ [\ ce {Al} + \ ce {Fe_2O_3} \ rightarrow \ ce {Al_2O_3} + \ ce {Fe} \ nonumber \] и вычисленное уравнение будет: \ [2 \ ce {Al} + \ ce {Fe_2O_3} \ rightarrow \ ce {Al_2O_3} + 2 \ ce {Fe} \ nonumber \] |
| Подумайте о своем результате. | Это однократная реакция замещения, и при уравновешивании коэффициенты точно отражают, что железо и алюминий имеют одинаковый заряд в этой реакции. |
Упражнение \ (\ PageIndex {3} \)
- Напишите химическое уравнение для реакции единственного замещения между твердым цинком и раствором нитрата свинца (II) с образованием раствора нитрата цинка и твердого свинца. (Обратите внимание, что цинк образует ионы с зарядом \ (+ 2 \).)
- Предскажите продукты следующей реакции: \ (\ ce {Fe} + \ ce {CuSO_4} \). (Предположим, что в этой реакции железо образует ионы с зарядом \ (+ 2 \).)
- Ответьте на
- \ (\ ce {Zn} + \ ce {Pb (NO_3) _2} \ rightarrow \ ce {Pb} + \ ce {Zn (NO_3) _2} \)
- Ответ б
- \ (\ ce {Fe} + \ ce {CuSO_4} \ rightarrow \ ce {Cu} + \ ce {FeSO_4} \)
Реакция двойной замены
Реакция двойной замены — это реакция, в которой положительные и отрицательные ионы двух ионных соединений обмениваются местами с образованием двух новых соединений.Общая форма реакции двойного замещения (также называемой двойным вытеснением):
\ [\ ce {AB} + \ ce {CD} \ rightarrow \ ce {AD} + \ ce {BC} \]
В этой реакции \ (\ ce {A} \) и \ (\ ce {C} \) являются положительно заряженными катионами, а \ (\ ce {B} \) и \ (\ ce {D} \) являются отрицательно заряженными анионами. -} \) возникают очень сильные силы притяжения, в результате чего образуется ярко-желтый осадок (рис. \ (\ PageIndex {3} \)).Другой продукт реакции, нитрат калия, остается растворимым.
Рисунок \ (\ PageIndex {3} \): Иодид свинца (II) осаждается, когда йодид калия смешивают с нитратом свинца (II) (уравнение \ ref {eq10}). (CC BY-SA 3.0; PRHaney).Образование газа
В некоторых реакциях двойного замещения образуется газообразный продукт, который затем пузырится из раствора и уходит в воздух. При смешивании растворов сульфида натрия и соляной кислоты продуктами реакции являются водный раствор хлорида натрия и газообразный сероводород:
\ [\ ce {Na_2S} \ left (aq \ right) + 2 \ ce {HCl} \ left (aq \ right) \ rightarrow 2 \ ce {NaCl} \ left (aq \ right) + \ ce {H_2S} \ влево (г \ вправо) \]
Образование молекулярного соединения
Другой вид реакции двойного замещения — это реакция, при которой в качестве одного из продуктов образуется молекулярное соединение.Многие примеры в этой категории — это реакции с образованием воды. При взаимодействии водной соляной кислоты с водным гидроксидом натрия продуктами являются водный раствор хлорида натрия и вода:
\ [\ ce {HCl} \ left (aq \ right) + \ ce {NaOH} \ left (aq \ right) \ rightarrow \ ce {NaCl} \ left (aq \ right) + \ ce {H_2O} \ left (л \ вправо) \]
Пример \ (\ PageIndex {4} \)
Напишите полное и сбалансированное химическое уравнение реакции двойного замещения \ (\ ce {NaCN} \ left (aq \ right) + \ ce {HBr} \ left (aq \ right) \ rightarrow \) (газообразный цианистый водород сформирован).
Решение
| Ступени | Пример решения |
|---|---|
| Спланируйте проблему. | Производство газа запускает реакцию. |
Решить. | Катионы обоих реагентов — это \ (+ 1 \) заряженные ионы, а анионы — \ (- 1 \) заряженные ионы.После обмена партнерами сбалансированное уравнение будет: \ [\ ce {NaCN} \ left (aq \ right) + \ ce {HBr} \ left (aq \ right) \ rightarrow \ ce {NaBr} \ left (aq \ right) + \ ce {HCN} \ left (г \ вправо) \] |
| Подумайте о своем результате. | Это реакция двойной замены. Все формулы верны, и уравнение сбалансировано. |
Упражнение \ (\ PageIndex {4} \)
Напишите полное и сбалансированное химическое уравнение реакции двойной замены \ (\ ce {(NH_4) _2SO_4} \ left (aq \ right) + \ ce {Ba (NO_3) _2} \ left (aq \ right) \ rightarrow \) (образуется осадок сульфата бария).
- Ответ:
- \ [\ ce {(NH_4) _2SO_4} \ left (aq \ right) + \ ce {Ba (NO_3) _2} \ left (aq \ right) \ rightarrow 2 \ ce {NH_4NO_3} \ left (aq \ right) + \ ce {BaSO_4} \ left (s \ right) \]
Иногда в результате реакции образуются как газ, так и молекулярное соединение. Реакция раствора карбоната натрия с соляной кислотой дает водный раствор хлорида натрия, газообразный диоксид углерода и воду:
\ [\ ce {Na_2CO_3} \ left (aq \ right) + 2 \ ce {HCl} \ left (aq \ right) \ rightarrow 2 \ ce {NaCl} \ left (aq \ right) + \ ce {CO_2 } \ left (g \ right) + \ ce {H_2O} \ left (l \ right) \ nonumber \]
Материалы и авторство
Эта страница была создана на основе содержимого следующими участниками и отредактирована (тематически или широко) командой разработчиков LibreTexts в соответствии со стилем, представлением и качеством платформы:
Как определить 6 типов химических реакций
Обновлено 26 марта 2020 г.
Лан Луо
Рецензент: Лана Бандойм, Б.S.
Химические реакции являются неотъемлемой частью технологии, они вносят свой вклад в различные виды человеческой деятельности, которые являются частью нашей повседневной жизни. Примеры химических реакций, с которыми мы сталкиваемся каждый день, включают сжигание топлива и изготовление вина и пива. Химические реакции также широко распространены в природе, от химического выветривания горных пород, фотосинтеза в растениях и процесса дыхания у животных.
В более широком аспекте существует трех типов реакций : физическая, химическая и ядерная.Химические реакции можно разделить на множество категорий. Шесть общих типов химических реакций : синтез, разложение, одинарное вытеснение, двойное вытеснение, горение и кислотно-основные реакции. Ученые классифицируют их на основе того, что происходит при переходе от реагентов к продуктам. Это помогает прогнозировать реакционную способность реагентов и продуктов, образующихся в результате реакций.
Типы реакций
Химическая реакция — это процесс, в котором одно или несколько веществ, реагентов, подвергаются химическому превращению с образованием одного или нескольких различных веществ, продуктов.Это процесс, который включает перегруппировку составляющих атомов реагентов с образованием продуктов без изменения ядер атомов.
Например, в процессе производства соды и сельтерской воды диоксид углерода барботируется в воду под давлением и образует новое соединение, известное как угольная кислота (H 2 CO 3 ). По этому уравнению вы знаете, что произошла химическая реакция.
CO 2 (г) + H 2 O (l) -> H 2 CO 3 (водн.)
Физическая реакция отличается от химической реакции.Физические изменения включают только изменение состояния, например, замерзание воды до льда и сублимацию сухого льда до диоксида углерода. В обоих сценариях химическая идентичность реагентов, H 2 O и CO 2 , не изменилась. Продукты по-прежнему состоят из тех же соединений, что и реагенты.
Ядерная реакция также отличается от химической реакции. Он включает столкновение двух ядер с образованием одного или нескольких нуклидов, отличных от родительских ядер.Например, Эрнест Резерфорд выполнил первую искусственную трансмутацию, подвергнув газообразный азот воздействию альфа-частиц, образуя изотоп 17 O и выбрасывая протон в этом процессе. Элемент в реагенте изменился, таким образом, произошла реакция.
Типы химических реакций
Наиболее распространенными типами химических реакций являются синтез, разложение, одинарное вытеснение, двойное вытеснение, горение и кислотно-основные реакции. Однако такая категоризация не является исключительной.Например, кислотно-основная реакция также может быть классифицирована как реакция двойного замещения.
Реакция синтеза
Реакция синтеза — это реакция, в которой два или более вещества объединяются с образованием более сложного. Химическое уравнение для общей формы реакции синтеза выглядит следующим образом:
Одним из примеров реакции синтеза является комбинация железа (Fe) и серы (S) с образованием сульфида железа.
Другим примером является объединение газообразного натрия и хлора с образованием более сложной молекулы — хлорида натрия.
2Na (s) + Cl 2 (g) -> 2NaCl (s)
Реакция разложения
Реакция разложения работает прямо противоположно реакции синтеза. Это реакция, при которой более сложное вещество распадается на на более простые. Общая форма реакции разложения может быть записана как:
Примером реакции разложения является электролиз воды с образованием водорода и газообразного кислорода.
H 2 O (l) -> H 2 (g) + O 2 (g)
Разложение также может быть термическим, например, превращение угольной кислоты в воду и диоксид углерода в условиях нагревания .Обычно встречается в газированных напитках.
H 2 CO 3 (водн.) -> H 2 O (л) + CO 2 (г)
Реакция одиночного вытеснения
Также известна как реакция одиночного замещения, реакция одиночного вытеснения это когда чистый элемент меняется местами с другим элементом в соединении. Он имеет общую форму:
Многие металлы могут реагировать с сильной кислотой. Например, магний реагирует с соляной кислотой с образованием газообразного водорода и хлорида магния.В этой реакции магний меняется местами с водородом в соляной кислоте.
Mg (s) + 2HCl (водный) -> H 2 (g) + MgCl 2 (водный)
Магний также может реагировать с водой с образованием гидроксида магния и газообразного водорода.
Mg (s) + 2H 2 O (l) -> H 2 (g) + Mg (OH) 2 (вод.)
Двойное вытеснение
Другой тип химических реакций — двойное вытеснение, в котором катионы двух реагентов меняются местами, образуя два совершенно разных продукта.Общая форма этой реакции:
Одним из примеров реакции двойного замещения является реакция хлорида бария с сульфатом магния с образованием сульфата бария и хлорида магния. В этой реакции катионы бария и магния в реагентах меняются местами на новые соединения бария и магния.
BaCl 2 + MgSO 4 -> BaSO 4 + MgCl 2
Другой пример — реакция нитрата свинца с иодидом калия с образованием иодида свинца и нитрата калия.
Pb (NO 3 ) 2 + 2KI -> PbI 2 + 2KNO 3
В обоих случаях реакция дает осадок (BaSO 4 и PbI 2 ) из двух растворимые реагенты, поэтому они также группируются по реакциям осаждения.
Реакция горения
Реакция горения — это экзотермическая окислительно-восстановительная химическая реакция , при которой топливо реагирует с кислородом с образованием газообразных продуктов. Хотя обычно это инициируется какой-либо формой энергии, такой как использование зажженной спички для зажигания огня, выделяемое тепло обеспечивает энергию для поддержания реакции.
Полная реакция сгорания происходит при наличии избытка кислорода и дает в основном обычные оксиды, такие как диоксид углерода и диоксид серы. Для обеспечения полного сгорания содержание кислорода должно быть в два или три раза больше теоретического количества, рассчитанного по стехиометрии. Полное сгорание углеводорода можно выразить в виде:
4C x H y + (4x + y) O 2 -> 4xCO 2 + 2yH 2 O + heat
Горение метана, который является насыщенным углеводородом, выделяет значительное количество тепла (891 кДж / моль), и его можно суммировать следующим уравнением:
CH 4 + 2O 2 -> CO 2 + 2H 2 O + heat
Нафталин — еще один пример углеводорода, при его полном сгорании также выделяется углекислый газ, вода и тепло.
C 10 H 8 + 12O 2 -> 10CO 2 + 4H 2 O + тепло
Спирты также могут служить источником топлива для горения, например, метанол.
CH 3 OH + O 2 -> CO 2 + 2H 2 O + heat
Неполное сгорание происходит, когда недостаточно кислорода для полной реакции с топливом с образованием диоксида углерода и воды. Таким примером является сжигание метана при ограниченном количестве кислорода для получения комбинации монооксида углерода, диоксида углерода, углеродной золы и воды.Это может быть выражено приведенными ниже уравнениями в зависимости от количества присутствующего кислорода.
2CH 4 + 3O 2 -> 2CO + 4H 2 O
Больше, но недостаточно кислорода:
4CH 4 + 7O 2 -> 2CO + 2CO 2 + 8H 2 O
Слишком много оксида углерода может привести к отравлению воздуха, поскольку он соединяется с гемоглобином с образованием карбоксигемоглобина и снижает его способность доставлять кислород.Поэтому важно обеспечить полное сгорание топлива для бытовых и промышленных нужд.
Кислотно-основная реакция
Кислотно-основная реакция — это реакция между кислотой и основанием, одним из продуктов которой является вода. Это особый тип реакции двойного вытеснения (местами переключения A и B), и эти примеры химических реакций записываются как:
Простой пример кислотно-основной реакции — это когда антацид (гидроксид кальция) нейтрализует желудочную кислоту (соляная кислота). ).
Ca (OH) 2 + 2HCl -> CaCl 2 + 2H 2 O
Другой пример — реакция уксуса (уксусной кислоты) с пищевой содой (бикарбонатом натрия). В этом процессе образуются вода и углекислый газ, но не выделяется тепло, поэтому это не реакция горения.
CH 3 COOH + NaHCO 3 -> CH 3 COONa + H 2 O + CO 2
Химические реакции | Химия | Visionlearning
(Это обновленная версия модуля Химические реакции.Для предыдущей версии см. Эту страницу.)
Химические реакции происходят абсолютно везде. Хотя мы иногда связываем химические реакции со стерильной средой пробирки и лаборатории, ничто не может быть дальше от истины. На самом деле колоссальное количество преобразований приводит к головокружительному, почти непостижимому множеству новых веществ и энергетических изменений, которые происходят в нашем мире каждую секунду каждого дня.
В природе химические реакции можно гораздо хуже контролировать, чем в лаборатории, иногда гораздо сложнее, и они обычно происходят независимо от того, хотите вы этого или нет! Будь то пожар, бушующий в лесу (рис.1), медленный процесс ржавления железа в присутствии кислорода и воды в течение многих лет или нежный способ созревания фруктов на дереве, процесс преобразования одного набор химических веществ (реагентов) к другому набору веществ (продуктов) известен как химическая реакция.
Рисунок 1 : Контролируемый пожар в Альберте, Канада, установлен, чтобы создать барьер для будущих лесных пожаров. Image © Кэмерон Страндберг, Rocky Mountain HouseХотя химические реакции происходят на Земле с незапамятных времен, только 18 век, когда первые химики начали понимать их. Такие процессы, как ферментация, при которой сахар химически превращается в спирт, были известны на протяжении веков; однако химическая основа реакции не была понята.Что это были за трансформации и как ими управляли? На эти вопросы можно было ответить только тогда, когда произошел переход от алхимии к химии как количественной и экспериментальной науке.
Исторический контекст
Начиная с раннего средневековья европейские и персидские философы были очарованы тем, как одни субстанции, казалось, «трансмутировались» (или трансформировались) в другие.Простые камни, например, содержащие серу, казалось, волшебным образом горят; и иначе не впечатляющие минералы были преобразованы, как руда киновари, превращающаяся при нагревании в очаровательную серебристую жидкую металлическую ртуть. Алхимики основывали свой подход на идеях Аристотеля о том, что все в мире состоит из четырех основных веществ — воздуха, земли, огня и воды (рис. 2).
Рисунок 2 : Аристотель считал, что все в мире состоит из четырех основных веществ — воздуха, земли, огня и воды.Таким образом, они предложили и потратили поколения на то, чтобы доказать, что менее дорогие металлы, такие как медь и ртуть, можно превратить в золото. Несмотря на свой ошибочный подход, многие ранние алхимики проводили фундаментальные химические эксперименты, превращая одно вещество в другое, поэтому трудно указать на конкретную дату или событие как на рождение идеи упорядоченной, поддающейся количественной оценке химической реакции. Однако в истории есть несколько важных моментов, которые помогли разобраться в этом.
Лавуазье: Закон сохранения массы
Антуан Лавуазье был французским дворянином в 1700-х годах, который начал экспериментировать с различными химическими реакциями. В то время химию еще нельзя было назвать настоящей количественной наукой. Большинство теорий, которые существовали для объяснения того, как изменяются вещества, основывались на греческой философии, и было очень мало экспериментальных деталей, связанных с работой алхимика.
Однако во второй половине 18-го века Лавуазье провел множество количественных экспериментов и заметил, что, хотя вещества меняют форму во время химической реакции, масса системы — или мера общего количества присутствующего «вещества» — остается неизменной. не изменить. При этом Лавуазье отстаивал идею сохранения массы во время преобразований (рис. 3). Другими словами, в отличие от алхимиков до него, которые думали, что они создают материю из ничего, Лавуазье предположил, что вещества не создаются и не разрушаются, а скорее меняют форму в ходе реакций.Идеи Лавуазье были опубликованы в основополагающей работе Traité élémentaire de Chimie в 1789 году (Lavoisier, 1789), которая широко провозглашается рождением современной химии как количественной науки.
Рисунок 3 : Закон сохранения массы Лавуазье, который гласит, что вещества не создаются и не разрушаются, а меняют форму во время реакций. В этом примере реагенты (цинк и две молекулы хлористого водорода) превращаются в разные продукты (хлорид цинка и дигидроген), но масса не теряется и не создается.Пруст: Закон постоянной композиции
Жозеф Пруст был французским актером, который пошел по стопам Лавуазье. Пруст провел десятки химических реакций, начиная с разного количества различных материалов. Со временем он заметил, что независимо от того, как он запускал определенную химическую реакцию, соотношение, в котором расходуются реагенты, всегда было постоянным. Например, он много работал с карбонатом меди, и независимо от того, как он менял соотношение исходных реагентов, медь, углерод и кислород все вместе реагировали в постоянном соотношении (Proust, 1804).В результате в последние несколько лет 18 века Пруст сформулировал закон постоянного состава (также называемый законом определенных пропорций, рис. 4).
Он понял, что любое данное химическое вещество (которое мы теперь определяем как соединение) всегда состояло из одного и того же массового отношения его элементарных частей, независимо от метода приготовления. Это был огромный шаг вперед в современной химии, поскольку ранее считалось, что вещества, образующиеся в ходе химических реакций, были случайными и неупорядоченными.
Рис. 4 : Пример закона постоянного состава Пруста, который гласит, что любое соединение всегда состоит из одного и того же массового соотношения его элементарных частей, независимо от метода приготовления.Дальтон: Закон множественных пропорций
Английский химик Джон Дальтон помог разобраться в законах сохранения массы и определенных пропорций в 1803 году, предположив, что материя состоит из атомов уникальных веществ, которые не могут быть созданы или разрушены (см. модуль «Ранние идеи о материи» для получения дополнительной информации).
Дальтон расширил идеи Пруста, признав, что два элемента могут образовывать более одного соединения, но каким бы ни было соединение, оно всегда будет содержать элементы, объединенные в целочисленных отношениях (Dalton, 1808). Это наблюдение известно как закон множественных пропорций (рис. 5), и его атомная теория помогла закрепить наблюдения Лавуазье.
Рисунок 5 : Закон множественных пропорций Далтона, который гласит, что два элемента могут образовывать более одного соединения, но каким бы ни было соединение, оно всегда будет содержать элементы, объединенные в целочисленных отношениях.Эти достижения, взятые вместе, заложили основу для наше современное понимание химических реакций, химических уравнений и химической стехиометрии, или процесса выражения относительных количеств реагентов и продуктов в химической реакции.
Контрольная точка понимания
____ впервые предположил, что, хотя вещества меняют форму во время химической реакции, масса системы не меняется.
Типы химических реакций
Существует огромное количество химических реакций. Химические реакции постоянно происходят в наших телах, внутри растений и животных, в воздухе, который циркулирует вокруг нас, в озерах и океанах, в которых мы плаваем, и даже в почве, где мы выращиваем урожай и строим дома.На самом деле, происходит так много химических реакций, что было бы трудно, а то и невозможно понять их все. Однако один метод, который помогает нам понять их, — это разделить химические реакции на несколько общих типов. Хотя это и не идеальная система, объединение реакций в соответствии с их сходством помогает нам идентифицировать закономерности, что, в свою очередь, позволяет делать прогнозы относительно еще не изученных реакций. В этом модуле мы рассмотрим и предоставим некоторый контекст для нескольких категорий реакций, а именно: синтеза, разложения, одиночного замещения, двойного замещения, РЕДОКС (включая горение) и кислотно-основных реакций.
Независимо от типа реакции, одна универсальная истина применима ко всем химическим реакциям. Чтобы процесс был классифицирован как химическая реакция, то есть процесс, в котором происходит химическое изменение, должно быть произведено новое вещество. Образование нового вещества почти всегда сопровождается изменением энергии, а часто и каким-либо физическим или наблюдаемым изменением. Физические изменения могут быть разных типов, например образование пузырьков газа, твердого осадка или изменение цвета.Эти изменения являются ключом к разгадке химической реакции и являются важными триггерами для дальнейших исследований химиков.
Реакции синтеза
До работы Лавуазье было плохо известно, что существуют разные газы, состоящие из разных элементов. Вместо этого различные газы обычно неверно характеризовали как типы «воздуха» или отсутствующих частей воздуха — например, обычно использовались термины «легковоспламеняющийся воздух» или «дефлогистированный воздух».«Лавуазье думал иначе и был убежден, что это разные вещества. Он провел эксперименты, в которых он смешал горючий воздух с дефлогистированным воздухом и искрой, и обнаружил, что эти вещества образуют воду. В ответ он переименовал горючий воздух в« водород »из греческое hydro означает «вода» и гены — «создатель». При этом Лавуазье определил реакцию синтеза. В общем, реакция синтеза — это реакция, в которой более простые вещества объединяются, чтобы образовать другое, более сложное.Водород и кислород (который Лавуазье также переименовал в дефлогистированный воздух) объединяются в присутствии искры, чтобы образовать воду, что резюмируется химическим уравнением, показанным ниже (для получения дополнительной информации о химических уравнениях см. Раздел под названием Анатомия химического уравнения ), он представляет собой простая реакция синтеза.
Уравнение 1
2H 2 (g) + O 2 (g) → 2H 2 O (l)
Реакции разложения
В 1774 году ученый Джозеф Пристли обратил свое любопытство в минерал под названием киноварь — минерал кирпично-красного цвета.Когда он поместил минерал под солнечный свет, усиленный мощным увеличительным стеклом, он обнаружил, что образовался газ, который он описал как имеющий «возвышенную природу», потому что свеча ярко горела в газе (Priestley, 1775). Не осознавая этого, Пристли открыл кислород в результате реакции разложения. Реакции разложения часто считаются противоположностью реакций синтеза, поскольку они включают разложение соединения на более простые соединения или даже элементы. В случае с кислородом Пристли он разложил оксид ртути (II) (киноварь) с помощью тепла на отдельные элементы.Реакцию можно описать следующим уравнением.
Уравнение 2 2HgO (s) → 2Hg (l) + O 2 (g)
Реакции однократного замещения
Британский химик и метеоролог Джон Даниэлл изобрел одну из самых первых практичных батарей в 1836 году (Рисунок 6) .В своей камере Даниэлл использовал очень обычную реакцию одиночного замещения. Его ранние камеры были сложными, с неуклюжими деталями и сложными конструкциями, но, напротив, химия, лежащая в основе них, была действительно довольно простой.
Рисунок 6 : Батареи Daniell.В некоторых химических реакциях один компонент может заменять другой, уже включенный в химическое соединение. Ячейка Даниэля работает, потому что цинк может заменять медь в растворе сульфата меди и, таким образом, обменивать электроны, которые используются в элементе батареи.Реакцию можно резюмировать следующим образом:
Уравнение 3 Zn (s) + CuSO 4 (водн.) → ZnSO 4 (вод. многие типы батарей основаны на реакциях замещения металлов. Однако существует несколько других типов реакций одиночного замещения, например, когда металл может заменять водород из кислоты или воды, или галоген может заменять другой галоген в некоторых солевых соединениях.
Реакции возгорания
Контролируемое использование огня было решающим событием для ранней цивилизации. Хотя трудно определить точное время, когда люди впервые приручили реакции горения, приводящие к возникновению огня, недавние исследования показывают, что это могло произойти, по крайней мере, миллион лет назад в пещере в Южной Африке (Berna et al. 2012).
С химической точки зрения горение — это не что иное, как реакция топлива (древесины, масла, бензина и т. Д.).) с кислородом. Для того, чтобы произошло горение, должно быть топливо и газообразный кислород. Однако для этих реакций часто требуется энергия активации (более подробно описанная в модуле «Химическая связь: природа химической связи»), которая может быть получена с помощью «искры» или источника энергии для воспламенения. Топливо, кислород и энергия — это три составляющих так называемого огненного треугольника (рис. 7), и отсутствие любого из них означает, что горение не произойдет.
Рис. 7 : Огненный треугольник состоит из трех компонентов — топлива, кислорода и энергии.image © GustavbВ современном мире многие виды топлива, которые обычно сжигаются для получения энергии, представляют собой углеводороды — вещества, содержащие как водород, так и углерод (как более подробно обсуждается в нашем модуле химии углерода). Растения производят углеводороды во время роста и, таким образом, являются отличным источником топлива, а другие углеводороды производятся, когда растения или животные со временем разлагаются (например, природный газ, нефть и другие вещества). Когда это топливо сгорает, водород и углерод в нем соединяются с кислородом, образуя два очень знакомых соединения: воду и углекислый газ.Один простой пример — сжигание природного газа или метана, CH 4 :
Уравнение 4 CH 4 (г) + 2O 2 (г) → CO 2 (г) + 2H 2 O (л)
Как и при сгорании всех видов топлива, тепло и свет являются продуктами, тоже, и именно эти продукты используются для приготовления пищи или обогрева наших домов.
Реакции восстановления-окисления
Каждый из четырех вышеуказанных типов реакций является подкатегорией одного типа химической реакции, известной как окислительно-восстановительные реакции. Окислительно-восстановительная реакция — это реакция, при которой восстановление и окисление протекают вместе, отсюда и название. Отдельные процессы окисления и восстановления могут быть определены более чем одним способом, но независимо от определения, эти два процесса являются симбиотическими, т.е.е., они должны проходить вместе.
В одном из определений окисление описывается как процесс, в котором какое-либо вещество теряет электроны, а восстановление — это процесс, при котором вид приобретает электроны. Таким образом, мы можем увидеть, как пара должна иметь место вместе. Если химическое вещество должно терять электроны (и, следовательно, окисляться), тогда у него должно быть другое взаимозависимое химическое вещество, которому оно может отдать эти электроны. Говорят, что при этом второе вещество (то, которое получает электроны) восстанавливается.Без такого акцептора электронов исходные частицы никогда не могут потерять электроны, и не может произойти окисление. Когда присутствует акцептор электронов, он восстанавливается, и процесс окислительно-восстановительной комбинации завершается. Окислительно-восстановительные реакции этого типа можно резюмировать с помощью пары уравнений: одно показывает потерю электронов (окисление), а другое — прирост электронов (восстановление). Используя приведенный выше пример ячейки Даниэля,
Уравнение 5 Окисление: Zn → Zn 2+ + 2e — Восстановление: Cu 2+ + 2e — → Cu
Электроны, потерянные цинком в первой реакции, являются теми же электронами, которые принимаются ионами меди во второй.Вместе реакции могут быть объединены для нейтрализации электронов по обе стороны от реакции в общую окислительно-восстановительную реакцию:
Уравнение 6 Zn + Cu 2+ → Zn 2+ + Cu
Существуют и другие определения окисления и восстановления, но в каждом случае две половины окислительно-восстановительной реакции остаются симбиотическими — одна проигрывает, а другая выигрывает.Убыток от одного вида не может произойти без прироста другого вида.
Реакции двойного вытеснения
Когда мыло не образует пену в воде, вода считается «жесткой». Жесткая вода вызывает множество проблем, которые выходят за рамки простого образования пены. Накопление соединений в водопроводных трубах (известное как «накипь») может блокировать поток воды и вызывать проблемы в промышленных процессах.Текстильная промышленность и производство напитков в значительной степени зависят от воды. В таких ситуациях качество воды может иметь значение для конечного продукта, поэтому контроль состава воды имеет решающее значение.
Жесткая вода содержит ионы магния или кальция в виде растворенных солей, таких как хлорид магния или хлорид кальция. Когда мыло (стеарат натрия) вступает в контакт с любой из этих солей, оно вступает в реакцию двойного замещения, в результате которой образуется нерастворимый осадок, известный как «мыльная пена».
Реакция двойного замещения (также известная как реакция двойного замещения) происходит, когда два ионных вещества объединяются и оба вещества обмениваются партнерами. Общий:
Уравнение 7 AB + CD → AD + CB
Где A и C — катионы (положительно заряженные ионы), а B и D — анионы (отрицательно заряженные).
В случае реакции мыла с хлоридом кальция реакция:
Уравнение 8 CaCl 2 (водн.) + 2NA (C 17 H 35 COO) (водн.) → 2NaCl (водн.) + Ca (C 17 H 35 COO) 2 (с)
Твердый стеарат кальция — это то, что мы называем мыльной пеной, которая образуется в результате реакции растворимой соли стеарата натрия (мыла) в реакции двойного замещения с хлоридом кальция.
Кислотно-основные реакции
Кислотно-основные реакции происходят постоянно вокруг и даже внутри нас. От классического вулкана пищевой соды в начальной школе до процесса пищеварения мы ежедневно сталкиваемся с кислотами и основаниями.
Когда атом водорода теряет свой единственный электрон, он образует положительный ион H + .Этот ион водорода является важным компонентом всех кислот, и действительно, одно определение кислоты — это донор иона водорода. Такие соединения, как лимонная кислота в лимонном соке, этановая кислота в уксусе или типичная лабораторная кислота, такая как соляная кислота, все отдают свои ионы водорода в химических реакциях, известных как кислотно-основные реакции. Химические противоположности кислот известны как основания, а основания можно определить как акцепторы ионов водорода. Когда кислота отдает ион водорода основанию, происходит кислотно-основная реакция, например, когда соляная кислота отдает ион водорода основанию, такому как гидроксид натрия:
Уравнение 9a HCl (водн.) + NaOH (водн.) → H 2 O (l) + NaCl (водн.)
Более пристальный взгляд на эту реакцию показывает, что в воде HCl выделяет H + , как показано ниже:
Уравнение 9b HCl (водн.) + H 2 O (л) → H 3 O + (водн.) + Cl — (водн.)
Полученные частицы, H 3 O + (ион гидроксония), может, в свою очередь, действовать как кислота, когда вступает в контакт с любыми веществами, которые могут принимать ион водорода, такими как ионы гидроксида из гидроксида натрия:
Уравнение 9c H 3 O + (водн.) + NaOH (водн.) → 2H 2 O (l) + Na + (водн.)
Объединение уравнений # 9a и # 9b дает нам уравнение № 9c.
Уравнение № 9c можно переписать, чтобы показать отдельные ионы, находящиеся в растворе, таким образом:
Уравнение 9d H + (водн.) + Cl — (водн.) + Na + (водн.) + OH — (водн.) → H 2 O (л) + Na + (водн.) + Cl — (водн.)
Удалив ионы-наблюдатели из приведенного выше уравнения, мы получим чистое ионное уравнение:
Уравнение 9e H + (водн.) + OH — (водн.) → H 2 O (l)
Любая химическая реакция, в результате которой образуется вода в результате реакции между кислотой и основанием, как в уравнении # 9e известна как реакция нейтрализации.
Контрольная точка понимания
Тип химической реакции, при которой один компонент может заменять другой, уже связанный в химическое соединение:
Анатомия химического уравнения
Химические уравнения всегда связаны с химическими реакциями, поскольку они являются сокращением, с помощью которого описываются химические реакции.Один этот факт делает уравнения невероятно важными, но уравнения также играют решающую роль в описании количественного аспекта химии, то, что мы формально называем стехиометрией.
Все химические реакции протекают в одном и том же основном формате. Исходные вещества или реагенты перечислены с использованием их химической формулы в левой части стрелки, причем несколько реагентов разделены знаком плюс. В случае реакции углерода с кислородом:
Уравнение 10a C + O 2 →
Справа от стрелки находятся химические формулы нового вещества или веществ (известных как продукты), которые образуются в результате химической реакции.В этом случае, поскольку углекислый газ является результатом сжигания углерода в присутствии кислорода:
Уравнение 10b [Реагенты] C + O 2 → CO 2 [Продукты]
Поскольку реакции могут приводить как к физическим, так и к химическим изменениям, каждому веществу дается символ состояния, записанный в виде нижнего индекса справа от формулы, это описывает физическую форму реагентов и продуктов.Общепринятые аббревиатуры состояний: (s) для твердых веществ, (l) для жидкостей, (g) для газов и (aq) для любых водных веществ, то есть растворенных в воде.
Уравнение 10c C (s) + O 2 (g) → CO 2 (g)
Наконец, чтобы гарантировать, что это представление подчиняется закону сохранения массы, уравнение может потребоваться уравновесить сложение чисел перед каждым видом, что создает равное количество атомов каждого элемента с каждой стороны уравнения.В случае образования диоксида углерода из углерода и кислорода нет необходимости добавлять такие числа (называемые стехиометрическими коэффициентами), поскольку 1 атом углерода и 2 атома кислорода появляются на каждой стороне уравнения.
Изменения энергии
В природе химические реакции часто происходят за счет обмена энергией. В этом отношении реакции обычно делятся на две категории — те, которые высвобождают энергию, и те, которые поглощают энергию.
Экзотермические реакции — это реакции, которые выделяют энергию в окружающую среду (рис. 8, справа). Реакции горения являются очевидным примером, потому что энергия, выделяемая в результате реакции, преобразуется в свет и тепло, видимые в непосредственной близости.
Напротив, эндотермические реакции — это те, которые поглощают энергию из окружающей среды (рис. 8, слева).В этой ситуации, возможно, придется нагреть реакцию или добавить в систему какую-либо другую форму энергии, прежде чем реакция протекает.
Рис. 8 : Слева показана эндотермическая реакция, при которой энергия поглощается из окружающей среды. Напротив, справа — экзотермическая реакция, которая выделяет энергию в окружающую среду.В обоих случаях важно отметить, что энергия не создается и не разрушается, а передается от одного типа энергии к другому, например, от химической энергии к теплу или свету.Энергия, которая идет на образование химических связей, обменивается на другие виды энергии с окружающей средой вокруг этой реакции. Классическим примером является реакция фотосинтеза, при которой растения поглощают световую энергию солнца, чтобы создать связи между атомами, составляющими сахара, которые сохраняются в виде химической энергии для дальнейшего использования растениями. Процесс дыхания по сути противоположен фотосинтезу, когда связи в молекулах сахара разрываются, и высвобождаемая энергия затем используется растением.
Контрольная точка понимания
_____ реакции — это реакции, которые поглощают энергию из окружающей среды.
Контекст химических реакций
Химические реакции происходят вокруг нас каждый день. Будь то однократная реакция замены в батарее нашего фонарика, реакция синтеза, которая происходит, когда железо ржавеет в присутствии воды и кислорода, или кислотно-щелочная реакция, которая происходит, когда мы едим — мы испытываем химические реакции практически во всем, что мы делать.Понимание этих реакций не является абстрактным понятием для химика, работающего в далекой лаборатории, скорее, оно имеет решающее значение для понимания жизни и окружающего нас мира. Чтобы по-настоящему справиться с химическими реакциями, нам необходимо понимать количественный аспект этих реакций, называемый стехиометрией, и концепцию, которую мы обсудим в другом модуле.
Сводка
В этом модуле исследуется множество химических реакций, сгруппированных по общим типам.Мы рассмотрим синтез, разложение, однократное замещение, двойное замещение, РЕДОКС (включая горение) и кислотно-основные реакции с примерами каждого из них.
Ключевые понятия
- Шаги от качественной науки к количественной имели решающее значение для более полного понимания химии и химических реакций.
- Когда вещество или вещества (реагенты) претерпевают изменение, которое приводит к образованию нового вещества или веществ (продуктов), считается, что произошла химическая реакция.
- В химических реакциях сохраняются масса и энергия. Материя не создается и не разрушается, она скорее сохраняется, а перестраивается для создания новых веществ. Энергия не создается и не разрушается, она сохраняется, но часто преобразуется в другую форму.
- Химические реакции можно разделить на разные типы в зависимости от их природы. Каждый тип имеет свои собственные определяющие характеристики с точки зрения реагентов и продуктов.
- Химические реакции часто сопровождаются наблюдаемыми изменениями, такими как изменение энергии, изменение цвета, выделение газа или образование твердого вещества.
- Энергия играет решающую роль в химических реакциях. Когда энергия выделяется в окружающую среду, реакция называется экзотермической; когда энергия поглощается из окружающей среды, реакция считается эндотермической
NGSS
- HS-C5.4, HS-PS1.A2, HS-PS1.A3, HS-PS1.B3
Ссылки
Берна, Ф., Голдберг, П., Хорвиц, Л. К., Бринк, Дж., Холт, С., Бэмфорд, М., и Чазан, М. (2012). Микростратиграфическое свидетельство возгорания на месте в ашельских пластах пещеры Вандерверк, провинция Северный Кейп, Южная Африка. Proceedings of the National Academy of Sciences, 109 (20), E1215-E1220.
- Далтон, Джон (1808). Новая система химической философии .
- Лавуазье, Антуан (1789). Traité Élémentaire de Chimie, présenté dans un ordre nouveau, et d’après des découvertes modernes .
- Пристли, Джозеф (1775). «Отчет о дальнейших открытиях в воздухе». Философские труды. 65 : 384–94.
- Пруст Жозеф Луи (1804). «Sur les Oxydations Métalliques». J. Phys. 59 : 321-343.
Энтони Карпи, доктор философии, Адриан Дингл, бакалавр наук «Химические реакции» Visionlearning Vol. ЧЭ-1 (6), 2003.
Химические реакции — анатомия и физиология
Цели обучения
К концу этого раздела вы сможете:
- Различать кинетическую и потенциальную энергию, а также экзергонические и эндергонические химические реакции
- Определите четыре формы энергии, важные для функционирования человека
- Опишите три основных типа химических реакций
- Определите несколько факторов, влияющих на скорость химических реакций
Одной из характеристик живого организма является метаболизм, который представляет собой совокупность всех химических реакций, протекающих для поддержания здоровья и жизни этого организма.Процессы связывания, которые вы изучили до сих пор, представляют собой анаболические химические реакции; то есть они образуют более крупные молекулы из более мелких молекул или атомов. Но помните, что метаболизм может протекать и в другом направлении: в катаболических химических реакциях связи между компонентами более крупных молекул разрываются, высвобождая более мелкие молекулы или атомы. Оба типа реакции включают обмен не только веществом, но и энергией.
Роль энергии в химических реакциях
Химические реакции требуют достаточного количества энергии, чтобы заставить вещество столкнуться с такой силой и точностью, что старые химические связи могут быть разорваны и образованы новые.В общем, кинетическая энергия — это форма энергии, приводящая в движение любой тип материи. Представьте, что вы строите кирпичную стену. Энергия, необходимая для поднятия и установки одного кирпича на другой, называется кинетической энергией — энергией, которой обладает материя из-за своего движения. Как только стена установлена, она накапливает потенциальную энергию. Потенциальная энергия — это энергия положения или энергии, которой обладает материя из-за расположения или структуры ее компонентов. Если кирпичная стена рушится, сохраненная потенциальная энергия высвобождается в виде кинетической энергии при падении кирпичей.
В человеческом теле потенциальная энергия хранится в связях между атомами и молекулами. Химическая энергия — это форма потенциальной энергии, в которой энергия хранится в химических связях. Когда эти связи образуются, вкладывается химическая энергия, а когда они разрываются, выделяется химическая энергия. Обратите внимание, что химическая энергия, как и вся энергия, не создается и не разрушается; скорее, он преобразуется из одной формы в другую. Когда вы съедаете энергетический батончик перед тем, как отправиться в поход, мед, орехи и другие продукты, содержащиеся в батончике, расщепляются и превращаются вашим телом в молекулы, которые ваши мышечные клетки преобразуют в кинетическую энергию.
Химические реакции, при которых выделяется больше энергии, чем поглощается, называются экзергоническими. Катаболизм продуктов в вашем энергетическом батончике является примером. Часть химической энергии, хранящейся в стержне, поглощается молекулами, которые ваше тело использует в качестве топлива, но часть ее выделяется, например, в виде тепла. Напротив, химические реакции, которые поглощают больше энергии, чем выделяют, носят эндергонический характер. Эти реакции требуют ввода энергии, и получающаяся в результате молекула хранит не только химическую энергию в исходных компонентах, но и энергию, которая питала реакцию.Поскольку энергия не создается и не разрушается, откуда берется энергия, необходимая для эндергонических реакций? Во многих случаях это происходит из-за экзергонических реакций.
Формы энергии, важные для функционирования человека
Вы уже узнали, что химическая энергия поглощается, накапливается и высвобождается химическими связями. Помимо химической энергии, в жизнедеятельности человека важны механическая, лучистая и электрическая энергия.
- Механическая энергия, которая хранится в физических системах, таких как машины, двигатели или человеческое тело, напрямую приводит в движение материю.Когда вы поднимаете кирпич на стену, ваши мышцы обеспечивают механическую энергию, которая перемещает кирпич.
- Лучистая энергия — это энергия, излучаемая и передаваемая в виде волн, а не материи. Эти волны различаются по длине от длинных радиоволн и микроволн до коротких гамма-волн, излучаемых распадающимися атомными ядрами. Полный спектр лучистой энергии называется электромагнитным спектром. Организм использует ультрафиолетовую энергию солнечного света для преобразования соединения в клетках кожи в витамин D, который необходим для функционирования человека.Человеческий глаз эволюционировал, чтобы видеть длины волн, составляющие цвета радуги, от красного до фиолетового, поэтому этот диапазон в спектре называется «видимым светом».
- Электрическая энергия, поставляемая электролитами в клетках и жидкостях организма, способствует изменениям напряжения, которые помогают передавать импульсы в нервных и мышечных клетках.
Характеристики химических реакций
Все химические реакции начинаются с реагента — общего термина для одного или нескольких веществ, вступающих в реакцию.Например, ионы натрия и хлора являются реагентами при производстве поваренной соли. Одно или несколько веществ, образующихся в результате химической реакции, называются продуктом.
В химических реакциях компоненты реагентов — участвующие элементы и количество атомов каждого — все присутствуют в продукте (ах). Точно так же в продуктах нет ничего, что не присутствует в реагентах. Это потому, что химические реакции регулируются законом сохранения массы, который гласит, что материя не может быть создана или разрушена в химической реакции.
Так же, как вы можете выразить математические вычисления в уравнениях типа 2 + 7 = 9, вы можете использовать химические уравнения, чтобы показать, как реагенты превращаются в продукты. Как и в математике, химические уравнения действуют слева направо, но вместо знака равенства в них используется стрелка или стрелки, указывающие направление, в котором протекает химическая реакция. Например, химическая реакция, в которой один атом азота и три атома водорода производят аммиак, будет записана как [латекс] \ text {N + 3H} \ to {\ text {NH}} _ {\ text {3}} [/латекс].Соответственно, разделение аммиака на его компоненты будет записано как [латекс] {\ text {NH}} _ {\ text {3}} \ to \ text {N + 3H.} [/ Latex]
Обратите внимание, что в первом примере атом азота (N) и три атома водорода (H) связаны с образованием соединения. Эта анаболическая реакция требует энергии, которая затем накапливается в связях соединения. Такие реакции называются реакциями синтеза. Реакция синтеза — это химическая реакция, которая приводит к синтезу (соединению) компонентов, которые ранее были разделены ((Рисунок) a ).Опять же, азот и водород являются реагентами в реакции синтеза, которая дает аммиак в качестве продукта. Общее уравнение реакции синтеза: [латекс] \ text {A + B} \ to \ text {AB.} [/ Latex]
Три фундаментальных химических реакции
Атомы и молекулы, участвующие в трех фундаментальных химических реакциях, можно представить в виде слов.
Во втором примере аммиак катаболизируется на более мелкие компоненты, и потенциальная энергия, которая была сохранена в его связях, высвобождается.Такие реакции называются реакциями разложения. Реакция разложения — это химическая реакция, которая разрушает или «разлагает» что-то более крупное на составные части (см. (Рисунок) b ). Общее уравнение реакции разложения: [латекс] \ text {AB} \ to \ text {A} + \ text {B} [/ latex].
Обменная реакция — это химическая реакция, в которой происходят как синтез, так и разложение, химические связи образуются и разрываются, а химическая энергия поглощается, накапливается и высвобождается (см. (Рисунок) c ).Простейшей формой реакции обмена может быть: [latex] \ text {A} + \ text {BC} \ to \ text {AB} + \ text {C} [/ latex]. Обратите внимание, что для получения этих продуктов B и C должны были распасться в реакции разложения, тогда как A и B должны были соединиться в реакции синтеза. Более сложная реакция обмена может быть такой: [latex] \ text {AB} + \ text {CD} \ to \ text {AC} + \ text {BD} [/ latex]. Другой пример: [латекс] \ text {AB} + \ text {CD} \ to \ text {AD} + \ text {BC} [/ latex].
Теоретически любая химическая реакция может протекать в любом направлении при определенных условиях.Реагенты могут синтезироваться в продукт, который позже разлагается. Обратимость — это тоже качество обменных реакций. Например, [латекс] \ text {A} + \ text {BC} \ to \ text {AB} + \ text {C} [/ latex] может затем преобразоваться в [латекс] \ text {AB} + \ text { C} \ to \ text {A} + \ text {BC} [/ latex]. Эта обратимость химической реакции обозначена двойной стрелкой: [латекс] \ text {A} + \ text {BC} ⇄ \ text {AB} + \ text {C} [/ latex]. Тем не менее, в человеческом теле многие химические реакции действительно протекают в предсказуемом направлении, так или иначе.Вы можете думать об этом более предсказуемом пути как о пути наименьшего сопротивления, потому что обычно альтернативное направление требует больше энергии.
Факторы, влияющие на скорость химических реакций
Если вы добавите уксус в пищевую соду, реакция будет мгновенной; смесь будет пузыриться и шипеть. Но многие химические реакции требуют времени. На скорость химических реакций влияет множество факторов. В этом разделе, однако, будут рассмотрены только самые важные аспекты функционирования человека.
Свойства реагентов
Если химические реакции должны протекать быстро, атомы в реагентах должны иметь легкий доступ друг к другу. Таким образом, чем больше площадь поверхности реагентов, тем легче они будут взаимодействовать. Когда вы кладете в рот кубик сыра, вы его пережевываете, прежде чем проглотить. Помимо прочего, жевание увеличивает площадь поверхности пищи, так что пищеварительные химические вещества могут легче проникать в нее. Как правило, газы реагируют быстрее, чем жидкости или твердые тела, опять же потому, что для разделения частиц вещества требуется энергия, а газы по определению уже имеют пространство между своими частицами.Точно так же, чем больше молекула, тем больше общее количество связей, поэтому можно ожидать, что реакции с участием более мелких молекул с меньшим количеством общих связей будут протекать быстрее.
Кроме того, помните, что некоторые элементы более реактивны, чем другие. Реакции, в которых участвуют высокореактивные элементы, такие как водород, протекают быстрее, чем реакции, в которых участвуют менее реактивные элементы. Реакции с участием стабильных элементов, таких как гелий, вряд ли вообще произойдут.
Температура
Почти все химические реакции протекают быстрее при более высоких температурах.Напомним, что кинетическая энергия — это энергия движущегося вещества. Кинетическая энергия субатомных частиц увеличивается в ответ на увеличение тепловой энергии. Чем выше температура, тем быстрее движутся частицы и тем выше вероятность их соприкосновения и реакции.
Концентрация и давление
Если в клубе танцуют всего несколько человек, они вряд ли наступят друг другу на пятки. Но по мере того, как все больше и больше людей встают танцевать — особенно если музыка быстрая, — вероятны столкновения.То же самое и с химическими реакциями: чем больше частиц присутствует в данном пространстве, тем больше вероятность столкновения этих частиц друг с другом. Это означает, что химики могут ускорить химические реакции не только за счет увеличения концентрации частиц — количества частиц в пространстве — но также за счет уменьшения объема пространства, что, соответственно, приведет к увеличению давления. Если бы в клубе было 100 танцоров, и менеджер внезапно переместил группу в комнату вдвое меньшего размера, концентрация танцоров в новом пространстве увеличилась бы вдвое, и соответственно увеличилась бы вероятность столкновений.
Ферменты и другие катализаторы
Чтобы два химических вещества в природе вступили в реакцию друг с другом, они сначала должны вступить в контакт, и это происходит в результате случайных столкновений. Поскольку тепло помогает увеличить кинетическую энергию атомов, ионов и молекул, оно способствует их столкновению. Но очень высокая температура тела — например, очень высокая температура — может повредить клетки тела и быть опасной для жизни. С другой стороны, нормальная температура тела недостаточно высока для протекания химических реакций, поддерживающих жизнь.Вот тут-то и пригодятся катализаторы.
В химии катализатор — это вещество, которое увеличивает скорость химической реакции без каких-либо изменений. Вы можете думать о катализаторе как о химическом изменении. Они помогают увеличить скорость и силу столкновения атомов, ионов и молекул, тем самым увеличивая вероятность взаимодействия электронов их валентных оболочек.
Важнейшими катализаторами в организме человека являются ферменты. Фермент — это катализатор, состоящий из белка или рибонуклеиновой кислоты (РНК), оба из которых будут рассмотрены позже в этой главе.Как и все катализаторы, ферменты работают за счет снижения уровня энергии, которую необходимо вложить в химическую реакцию. Энергия активации химической реакции — это «пороговый» уровень энергии, необходимый для разрыва связей в реагентах. Как только эти связи будут разорваны, могут сформироваться новые договоренности. Без фермента, действующего в качестве катализатора, требуется гораздо больше энергии, чтобы зажечь химическую реакцию ((Рисунок)).
Ферменты
Ферменты уменьшают энергию активации, необходимую для протекания данной химической реакции.(а) Без фермента потребляемая энергия для начала реакции высока. (б) С помощью фермента требуется меньше энергии для начала реакции.
Ферменты имеют решающее значение для здорового функционирования организма. Они помогают, например, расщеплять пищу и превращать ее в энергию. Фактически, большинство химических реакций в организме осуществляется ферментами.
Обзор главы
Химические реакции, в которых разрываются и образуются химические связи, требуют первоначальных затрат энергии.Кинетическая энергия, энергия движущегося вещества, подпитывает столкновения атомов, ионов и молекул, которые необходимы для разрыва их старых связей и образования новых. Все молекулы хранят потенциальную энергию, которая высвобождается при разрыве их связей.
Четыре формы энергии, необходимые для функционирования человека: химическая энергия, которая накапливается и высвобождается при образовании и разрыве химических связей; механическая энергия, которая напрямую поддерживает физическую активность; лучистая энергия, излучаемая волнами, например, в солнечном свете; и электрическая энергия, сила движущихся электронов.
Химические реакции начинаются с реагентов и заканчиваются продуктами. Реакции синтеза связывают реагенты вместе, процесс, который требует энергии, тогда как реакции разложения разрывают связи внутри реагента и, таким образом, высвобождают энергию. В обменных реакциях связи как разрываются, так и образуются, и происходит обмен энергией.
Скорость, с которой происходят химические реакции, зависит от нескольких свойств реагентов: температуры, концентрации и давления, а также от наличия или отсутствия катализатора.Фермент — это каталитический белок, который ускоряет химические реакции в организме человека.
Обзорные вопросы
Энергия, запасенная в футе снега на крутой крыше, составляет ________.
- потенциальная энергия
- кинетическая энергия
- лучистая энергия
- энергия активации
Соединение кальция, фосфора и других элементов дает минеральные кристаллы, которые находятся в кости. Это пример реакции (n) ________.
- катаболический
- синтез
- разложение
- обмен
[латекс] \ text {AB} \ to \ text {A} + \ text {B} [/ latex] — общее обозначение для (n) ________ реакции.
- анаболический
- эндергоник
- разложение
- обмен
________ реакций выделяют энергию.
- Катаболический
- Экзергонический
- Разложение
- Катаболические, экзергонические и декомпозиционные
Какая из следующих комбинаций атомов , , с наибольшей вероятностью вызовет химическую реакцию?
- водород и водород
- водород и гелий
- гелий и гелий
- неон и гелий
Пережевывание хлеба приводит к смешиванию его со слюной и способствует ее химическому расщеплению.Это , скорее всего, из-за того, что ________.
- внутренняя часть рта поддерживает очень высокую температуру
- при жевании накапливает потенциальную энергию
- жевание способствует реакциям синтеза
- слюна содержит ферменты
Вопросы критического мышления
[латекс] \ text {AB} + \ text {CD} \ to \ text {AD} + \ text {BE} [/ latex] Это законный пример реакции обмена? Почему или почему нет?
Это не так.Реакция обмена может быть такой: [латекс] \ text {AB} + \ text {CD} \ to \ text {AC} + \ text {BD} [/ latex] или [latex] \ text {AB} + \ text {CD } \ to \ text {AD} + \ text {BC} [/ latex]. Во всех химических реакциях, включая реакции обмена, компоненты реагентов идентичны компонентам продуктов. Компонент, присутствующий в реагентах, не может исчезнуть, а компонент, отсутствующий в реагентах, не может внезапно появиться в продуктах.
Когда вы загружаете белье, почему вы просто не бросаете кусок мыла в стиральную машину? Другими словами, почему стиральный порошок продается в жидком или порошковом виде?
Напомним, что чем больше площадь поверхности реагентов, тем быстрее и легче они будут взаимодействовать.Для разделения частиц вещества требуется энергия. Порошковые и жидкие моющие средства для стирки с относительно большей площадью поверхности на единицу, могут быстро растворяться в своих реактивных компонентах при добавлении в воду.
Глоссарий
- энергия активации
- количество энергии, превышающее количество энергии, содержащейся в реагентах, которое необходимо преодолеть, чтобы реакция продолжилась
- катализатор
- Вещество, которое увеличивает скорость химической реакции без изменения самого себя в процессе
- химическая энергия
- форма энергии, которая поглощается в виде химических связей, сохраняется при их поддержании и высвобождается при их разрыве
- концентрация
- количество частиц в заданном пространстве
- реакция разложения
- тип катаболической реакции, при которой одна или несколько связей внутри более крупной молекулы разрываются, что приводит к высвобождению более мелких молекул или атомов
- фермент
- белок или РНК, катализирующая химические реакции
- обменная реакция
- тип химической реакции, в которой как образуются, так и разрываются связи, в результате чего происходит перенос компонентов
- кинетическая энергия
- энергия, которой обладает материя благодаря своему движению
- потенциальная энергия
- запасенная энергия, которой обладает материя из-за расположения или структуры ее компонентов
- товар
- Одно или несколько веществ, образующихся в результате химической реакции
- реагент
- одно или несколько веществ, вступающих в реакцию
- реакция синтеза
- тип анаболической реакции, в которой два или более атома или молекулы связываются, что приводит к образованию более крупной молекулы
2.3 Химические реакции — Анатомия и физиология
Цели обучения
К концу этого раздела вы сможете:
- Различать кинетическую и потенциальную энергию, а также экзергонические и эндергонические химические реакции
- Определите четыре формы энергии, важные для функционирования человека
- Опишите три основных типа химических реакций
- Определите несколько факторов, влияющих на скорость химических реакций
Одной из характеристик живого организма является метаболизм, который представляет собой совокупность всех химических реакций, протекающих для поддержания здоровья и жизни этого организма.Процессы связывания, которые вы изучили до сих пор, представляют собой анаболические химические реакции; то есть они образуют более крупные молекулы из более мелких молекул или атомов. Но помните, что метаболизм может протекать и в другом направлении: в катаболических химических реакциях связи между компонентами более крупных молекул разрываются, высвобождая более мелкие молекулы или атомы. Оба типа реакции включают обмен не только веществом, но и энергией.
Роль энергии в химических реакциях
Химические реакции требуют достаточного количества энергии, чтобы заставить вещество столкнуться с такой силой и точностью, что старые химические связи могут быть разорваны и образованы новые.В общем, кинетическая энергия — это форма энергии, приводящая в движение любой тип материи. Представьте, что вы строите кирпичную стену. Энергия, необходимая для поднятия и установки одного кирпича на другой, называется кинетической энергией — энергией, которой обладает материя из-за своего движения. Как только стена установлена, она накапливает потенциальную энергию. Потенциальная энергия — это энергия положения или энергии, которой обладает материя из-за расположения или структуры ее компонентов. Если кирпичная стена рушится, сохраненная потенциальная энергия высвобождается в виде кинетической энергии при падении кирпичей.
В человеческом теле потенциальная энергия хранится в связях между атомами и молекулами. Химическая энергия — это форма потенциальной энергии, в которой энергия хранится в химических связях. Когда эти связи образуются, вкладывается химическая энергия, а когда они разрываются, выделяется химическая энергия. Обратите внимание, что химическая энергия, как и вся энергия, не создается и не разрушается; скорее, он преобразуется из одной формы в другую. Когда вы съедаете энергетический батончик перед тем, как отправиться в поход, мед, орехи и другие продукты, содержащиеся в батончике, расщепляются и превращаются вашим телом в молекулы, которые ваши мышечные клетки преобразуют в кинетическую энергию.
Химические реакции, при которых выделяется больше энергии, чем поглощается, называются экзергоническими. Катаболизм продуктов в вашем энергетическом батончике является примером. Часть химической энергии, хранящейся в стержне, поглощается молекулами, которые ваше тело использует в качестве топлива, но часть ее выделяется, например, в виде тепла. Напротив, химические реакции, которые поглощают больше энергии, чем выделяют, носят эндергонический характер. Эти реакции требуют ввода энергии, и получающаяся в результате молекула хранит не только химическую энергию в исходных компонентах, но и энергию, которая питала реакцию.Поскольку энергия не создается и не разрушается, откуда берется энергия, необходимая для эндергонических реакций? Во многих случаях это происходит из-за экзергонических реакций.
Формы энергии, важные для функционирования человека
Вы уже узнали, что химическая энергия поглощается, накапливается и высвобождается химическими связями. Помимо химической энергии, в жизнедеятельности человека важны механическая, лучистая и электрическая энергия.
- Механическая энергия, которая хранится в физических системах, таких как машины, двигатели или человеческое тело, напрямую приводит в движение материю.Когда вы поднимаете кирпич на стену, ваши мышцы обеспечивают механическую энергию, которая перемещает кирпич.
- Лучистая энергия — это энергия, излучаемая и передаваемая в виде волн, а не материи. Эти волны различаются по длине от длинных радиоволн и микроволн до коротких гамма-волн, излучаемых распадающимися атомными ядрами. Полный спектр лучистой энергии называется электромагнитным спектром. Организм использует ультрафиолетовую энергию солнечного света для преобразования соединения в клетках кожи в витамин D, который необходим для функционирования человека.Человеческий глаз эволюционировал, чтобы видеть длины волн, составляющие цвета радуги, от красного до фиолетового, поэтому этот диапазон в спектре называется «видимым светом».
- Электрическая энергия, поставляемая электролитами в клетках и жидкостях организма, способствует изменениям напряжения, которые помогают передавать импульсы в нервных и мышечных клетках.
Характеристики химических реакций
Все химические реакции начинаются с реагента — общего термина для одного или нескольких веществ, вступающих в реакцию.Например, ионы натрия и хлора являются реагентами при производстве поваренной соли. Одно или несколько веществ, образующихся в результате химической реакции, называются продуктом.
В химических реакциях компоненты реагентов — участвующие элементы и количество атомов каждого — все присутствуют в продукте (ах). Точно так же в продуктах нет ничего, что не присутствует в реагентах. Это потому, что химические реакции регулируются законом сохранения массы, который гласит, что материя не может быть создана или разрушена в химической реакции.
Так же, как вы можете выразить математические вычисления в уравнениях типа 2 + 7 = 9, вы можете использовать химические уравнения, чтобы показать, как реагенты превращаются в продукты. Как и в математике, химические уравнения действуют слева направо, но вместо знака равенства в них используется стрелка или стрелки, указывающие направление, в котором протекает химическая реакция. Так, например, химическая реакция, в которой один атом азота и три атома водород производит аммиак бы быть записан в виде N + 3H → Nh4N + 3H → Nh4MathType @ СПР @ 5 @ 5 + = feaagyart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq = Jc9vqaqpepm0xbba9pwe9Q8fs0 = yqaqpepae9pg0FirpepeKkFr0xfr = XFR = xb9adbaqaaeGaciGaaiaabeqaamaabaabaaGcbaGaaeOtaiaabccacaqGRaGaaeiiaiaabodacaqGibGaeyOKh5QaaeOtaiaabIeadaWgaaWcbaGaae4maaqabaaaaa @ 3EA4 @.Соответственно, распад аммиака на составляющие записывается как Nh4 → N + 3H.Nh4 → N + 3H.
Обратите внимание, что в первом примере атом азота (N) и три атома водорода (H) связаны с образованием соединения. Эта анаболическая реакция требует энергии, которая затем накапливается в связях соединения. Такие реакции называются реакциями синтеза. Реакция синтеза — это химическая реакция, которая приводит к синтезу (соединению) компонентов, которые ранее были разделены (Рисунок 2.12 а ). Опять же, азот и водород являются реагентами в реакции синтеза, которая дает аммиак в качестве продукта. Общее уравнение для реакции синтеза А + В → AB.A + B → AB.MathType @ СПР @ 5 @ 5 + = feaagyart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq = Jc9vqaqpepm0xbba9pwe9Q8fs0 = yqaqpepae9pg0FirpepeKkFr0xfr = XFR = xb9adbaqaaeGaciGaaiaabeqaamaabaabaaqcaauaaiaabgeacaqGGaGaae4kaiaabccacaqGcbGaeyOKh5Qaaeyqaiaabkeaaaa @ 3D25 @
Рисунок 2.12 Три основных химических реакции Атомы и молекулы, участвующие в трех основных химических реакциях, можно представить в виде слов.
Во втором примере аммиак катаболизируется на более мелкие компоненты, и потенциальная энергия, которая была сохранена в его связях, высвобождается. Такие реакции называются реакциями разложения. Реакция разложения — это химическая реакция, которая разрушает или «разлагает» что-то более крупное на составные части (см. Рисунок 2.12 б ). Общее уравнение для реакции разложения составляет: АВ → А + ВАВ → А + BMathType @ СПР @ 5 @ 5 + = feaagyart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq = Jc9vqaqpepm0xbba9pwe9Q8fs0 = yqaqpepae9pg0FirpepeKkFr0xfr = XFR = xb9adbaqaaeGaciGaaiaabeqaamaabaabaaqcaauaaiaabgeacaqGcbGaeyOKh5QaaeyqaiabgUcaRiaabkeaaaa @ 3C13 @.
Обменная реакция — это химическая реакция, в которой происходят как синтез, так и разложение, химические связи образуются и разрываются, а химическая энергия поглощается, накапливается и высвобождается (см. Рисунок 2.12 c ). Простая форма реакции обмена может быть: А + ВС → АВ + СА + ВС → АВ + CMathType @ СПР @ 5 @ 5 + = feaagyart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq = Jc9vqaqpepm0xbba9pwe9Q8fs0 = yqaqpepae9pg0FirpepeKkFr0xfr = XFR = xb9adbaqaaeGaciGaaiaabeqaamaabaabaaqcaauaaiaabgeacqGHRaWkcaqGcbGaae4qaiabgkziUkaabgeacaqGcbGaey4kaSIaae4qaaaa @ 3E81 @. Обратите внимание, что для получения этих продуктов B и C должны были распасться в реакции разложения, тогда как A и B должны были соединиться в реакции синтеза.Более сложная реакция обмена может быть: AB + CD → AC + BDAB + CD → AC + BDMathType @ СПР @ 5 @ 5 @ + = feaagyart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq = Jc9vqaqpepm0xbba9pwe9Q8fs0 = yqaqpepae9pg0FirpepeKkFr0xfr = XFR = xb9adbaqaaeGaciGaaiaabeqaamaabaabaaqcaauaaiaabgeacaqGcbGaey4kaSIaae4qaiaabseacqGHsgIRcaqGbbGaae4qaiabgUcaRiaabkeacaqGebaaaa @ 400F @. Другим примером может быть: AB + CD → AD + BCAB + CD → AD + BCMathType @ СПР @ 5 @ 5 @ + = feaagyart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq = Jc9vqaqpepm0xbba9pwe9Q8fs0 = yqaqpepae9pg0FirpepeKkFr0xfr = XFR = xb9adbaqaaeGaciGaaiaabeqaamaabaabaaqcaauaaiaabgeacaqGcbGaey4kaSIaae4qaiaabseacqGHsgIRcaqGbbGaaeiraiabgUcaRiaabkeacaqGdbaaaa @ 400F @.
Теоретически любая химическая реакция может протекать в любом направлении при определенных условиях. Реагенты могут синтезироваться в продукт, который позже разлагается. Обратимость — это тоже качество обменных реакций. Так, например, А + ВС → АВ + СА + ВС → АВ + CMathType @ СПР @ 5 @ 5 + = feaagyart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq = Jc9vqaqpepm0xbba9pwe9Q8fs0 = yqaqpepae9pg0FirpepeKkFr0xfr = XFR = xb9adbaqaaeGaciGaaiaabeqaamaabaabaaqcaauaaiaabgeacqGHRaWkcaqGcbGaae4qaiabgkziUkaabgeacaqGcbGaey4kaSIaae4qaaaa @ 3E81 @ может затем обратный к АВ + С → А + BCAB + C, → А + BCMathType @ СПР @ 5 @ 5 + = feaagyart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq = Jc9vqaqpepm0xbba9pwe9Q8fs0 = yqaqpepae9pg0FirpepeKkFr0xfr = XFR = xb9adbaqaaeGaciGaaiaabeqaamaabaabaaqcaauaaiaabgeacaqGcbGaey4kaSIaae4qaiabgkziUkaabgeacqGHRaWkcaqGcbGaae4qaaaa @ 3E81 @.Эта обратимость химической реакции обозначено двойной стрелкой: А + BC⇄AB + СА + BC⇄AB + CMathType @ СПР @ 5 @ 5 + = feaagyart1ev2aaatCvAUfeBSjuyZL2yd9gzLbvyNv2CaerbuLwBLnhiov2DGi1BTfMBaeXatLxBI9gBaerbd9wDYLwzYbItLDharqqtubsr4rNCHbGeaGqiVu0Je9sqqrpepC0xbbL8F4rqqrFfpeea0xe9Lq = Jc9vqaqpepm0xbba9pwe9Q8fs0 = yqaqpepae9pg0FirpepeKkFr0xfr = XFR = xb9adbaqaaeGaciGaaiaabeqaamaabaabaaqcaauaaiaabgeacqGHRaWkcaqGcbGaae4qaiablsCiakaabgeacaqGcbGaey4kaSIaae4qaaaa @ 3E8A @. Тем не менее, в человеческом теле многие химические реакции действительно протекают в предсказуемом направлении, так или иначе.Вы можете думать об этом более предсказуемом пути как о пути наименьшего сопротивления, потому что обычно альтернативное направление требует больше энергии.
Факторы, влияющие на скорость химических реакций
Если вы добавите уксус в пищевую соду, реакция будет мгновенной; смесь будет пузыриться и шипеть. Но многие химические реакции требуют времени. На скорость химических реакций влияет множество факторов. В этом разделе, однако, будут рассмотрены только самые важные аспекты функционирования человека.
Свойства реагентов
Если химические реакции должны протекать быстро, атомы в реагентах должны иметь легкий доступ друг к другу. Таким образом, чем больше площадь поверхности реагентов, тем легче они будут взаимодействовать. Когда вы кладете в рот кубик сыра, вы его пережевываете, прежде чем проглотить. Помимо прочего, жевание увеличивает площадь поверхности пищи, так что пищеварительные химические вещества могут легче проникать в нее. Как правило, газы реагируют быстрее, чем жидкости или твердые тела, опять же потому, что для разделения частиц вещества требуется энергия, а газы по определению уже имеют пространство между своими частицами.Точно так же, чем больше молекула, тем больше общее количество связей, поэтому можно ожидать, что реакции с участием более мелких молекул с меньшим количеством общих связей будут протекать быстрее.
Кроме того, помните, что некоторые элементы более реактивны, чем другие. Реакции, в которых участвуют высокореактивные элементы, такие как водород, протекают быстрее, чем реакции, в которых участвуют менее реактивные элементы. Реакции с участием стабильных элементов, таких как гелий, вряд ли вообще произойдут.
Температура
Почти все химические реакции протекают быстрее при более высоких температурах.Напомним, что кинетическая энергия — это энергия движущегося вещества. Кинетическая энергия субатомных частиц увеличивается в ответ на увеличение тепловой энергии. Чем выше температура, тем быстрее движутся частицы и тем выше вероятность их соприкосновения и реакции.
Концентрация и давление
Если в клубе танцуют всего несколько человек, они вряд ли наступят друг другу на пятки. Но по мере того, как все больше и больше людей встают танцевать — особенно если музыка быстрая, — вероятны столкновения.То же самое и с химическими реакциями: чем больше частиц присутствует в данном пространстве, тем больше вероятность столкновения этих частиц друг с другом. Это означает, что химики могут ускорить химические реакции не только за счет увеличения концентрации частиц — количества частиц в пространстве — но также за счет уменьшения объема пространства, что, соответственно, приведет к увеличению давления. Если бы в клубе было 100 танцоров, и менеджер внезапно переместил группу в комнату вдвое меньшего размера, концентрация танцоров в новом пространстве увеличилась бы вдвое, и соответственно увеличилась бы вероятность столкновений.
Ферменты и другие катализаторы
Чтобы два химических вещества в природе вступили в реакцию друг с другом, они сначала должны вступить в контакт, и это происходит в результате случайных столкновений. Поскольку тепло помогает увеличить кинетическую энергию атомов, ионов и молекул, оно способствует их столкновению. Но очень высокая температура тела — например, очень высокая температура — может повредить клетки тела и быть опасной для жизни. С другой стороны, нормальная температура тела недостаточно высока для протекания химических реакций, поддерживающих жизнь.Вот тут-то и пригодятся катализаторы.
В химии катализатор — это вещество, которое увеличивает скорость химической реакции без каких-либо изменений. Вы можете думать о катализаторе как о химическом изменении. Они помогают увеличить скорость и силу столкновения атомов, ионов и молекул, тем самым увеличивая вероятность взаимодействия электронов их валентных оболочек.
Важнейшими катализаторами в организме человека являются ферменты. Фермент — это катализатор, состоящий из белка или рибонуклеиновой кислоты (РНК), оба из которых будут рассмотрены позже в этой главе.Как и все катализаторы, ферменты работают за счет снижения уровня энергии, которую необходимо вложить в химическую реакцию. Энергия активации химической реакции — это «пороговый» уровень энергии, необходимый для разрыва связей в реагентах. Как только эти связи будут разорваны, могут сформироваться новые договоренности. Без фермента, действующего в качестве катализатора, требуется гораздо больше энергии, чтобы зажечь химическую реакцию (рис. 2.13).
Рис. 2.13 Ферменты Ферменты уменьшают энергию активации, необходимую для протекания данной химической реакции.(а) Без фермента потребляемая энергия для начала реакции высока. (б) С помощью фермента требуется меньше энергии для начала реакции.
Ферменты имеют решающее значение для здорового функционирования организма. Они помогают, например, расщеплять пищу и превращать ее в энергию. Фактически, большинство химических реакций в организме осуществляется ферментами.
Химические реакции
Основные идеи толкания и тяги исследуются в
.Противопоставление взглядов студентов и ученых
Ежедневный опыт студентов
Дети испытали множество примеров химических изменений, даже не осознавая этого.Они знакомы с процессами горения, приготовления пищи, ржавчины и химических процессов, связанных с растворением. Однако на этом уровне ученики не видят, что новые материалы производятся в результате химических изменений, скорее они видят, что существующие материалы просто каким-то образом были изменены. Например, они видят дым как часть дерева, который каким-то образом выделяется при горении дерева. Поскольку учащиеся редко понимают понятие «вещество», они не видят изменения веществ. Тем не менее, понимание химических изменений является фундаментальным для понимания роли химии в их жизни, и на этом уровне студенты могут начать это понимать.
Студенты часто считают, что для того, чтобы получить что-то новое, нужно просто смешать все вместе. Когда химическая реакция действительно имеет место, они считают, что тот или иной реагент просто модифицируется; на самом деле это не изменилось. Например, учащиеся считают, что ржавчина — это все еще железо / сталь; он только что стал коричневым. Точно так же обычно не замечают отслаивания ржавчины — считается, что утюг просто исчезает. Пузырьки газа, которые часто образуются при растворении таблетки в воде, часто не воспринимаются студентами как новое вещество.Такие процессы, как смешивание с водой, использование красителей в пище, замораживание и кипячение, считаются аналогичными химическим изменениям, которые происходят при приготовлении яиц.
Исследование: Johnson (2002)
Дети часто верят, что при сгорании такие материалы, как дерево или бумага, просто исчезают — в конце концов, от продукта остается немного. По их мнению, воздух имеет мало общего с горением. Студенты считают, что при сжигании углеродных материалов, таких как дерево, древесный уголь (углерод) появляется из горит , а не материал .
Исследование: Государственный университет штата Аризона (2001)
Поскольку многие дети знают о таких вещах, как приготовление пищи и сжигание, они предполагают, что тепло всегда необходимо для возникновения реакций.
В обиходе слово «химический» часто используется как ярлык для нежелательных вещей, которых не должно быть в продуктах питания или косметике. Следовательно, учащиеся могут рассматривать химические вещества как группу веществ, обнаруженных в лабораториях, а не рассматривать все вещества в продуктах питания (например) как химические вещества.
Научная точка зрения
Все материалы сделаны из химических веществ. Химические реакции включают взаимодействие между химическими веществами, так что все реагенты превращаются в новые материалы. Свойства новых материалов отличаются от свойств реагентов. Это отличается от других изменений, таких как испарение, плавление, кипение, замораживание и перемешивание, при которых изменения не связаны с новыми веществами. Хотя для начала реакций часто требуется тепло, это не обязательно.
Химические реакции включают разрыв химических связей между молекулами реагента (частицами) и образование новых связей между атомами в частицах продукта (молекулах).Число атомов до и после химического изменения одинаково, но число молекул изменится.
Хотя многие химические реакции протекают быстро, небольшие, медленные изменения, такие как ржавление или биологические процессы, могут происходить в течение гораздо более длительных периодов времени.
Химические реакции обратимы (факт, который часто опускается во многих научных текстах), но на практике они больше всего отличаются от других наблюдаемых детьми изменений, таких как плавление, тем, что их очень трудно обратить вспять.
Люди используют химические реакции для производства широкого спектра полезных материалов; разложение отходов также включает химические реакции, которые происходят естественным образом в окружающей среде.Для некоторых антропогенных отходов таких реакций нет, и в результате они вызывают проблемы.
Критические идеи преподавания
При обучении химическим реакциям на этом уровне акцент должен делаться на улучшении понимания учащимися важности химических реакций в нашей жизни в производстве многих вещей, которые мы считаем само собой разумеющимися, а также на улучшении их понимания и понимания что вовлечено в химическое изменение. На данном этапе нет необходимости говорить о таких частицах, как атомы или молекулы, или о химических связях.
- Химические реакции включают образование новых материалов, которые сильно отличаются от реагирующих веществ. Любые новые материалы происходят из реагирующих веществ.
- Изменения, которые могут сопровождать химическую реакцию, включают цвет, внешний вид и образование новых материалов, например, газа.
- Само по себе смешивание не может вызвать химическую реакцию.
- Хотя для инициирования химической реакции часто требуется тепло, это не всегда необходимо.
- Для производства большей части нашей энергии используются химические реакции.
- Химические реакции широко используются для тестирования, идентификации и анализа широкого спектра материалов (например, наборы для тестирования в бассейне и судебно-медицинские тесты из телешоу, таких как « CSI» ).
- Кислород в воздухе является очень реактивным химическим веществом и играет важную роль во многих химических реакциях, таких как горение, ржавление и реакции, посредством которых мы получаем энергию из пищи, которую едим.
Изучите взаимосвязь между идеями о химических реакциях в Карты развития концепции — (атомы и молекулы, химические реакции, сохранение материи, состояния материи)
При изучении химических реакций учащимся нужно будет описывать различные вещества, которые на этом уровне будут материалами, с которыми они знакомы (кухня и изменения, связанные с приготовлением пищи, являются очень хорошей отправной точкой).Им нужно будет уметь идентифицировать изменения в этих веществах с целью в конечном итоге распознать, когда были произведены новые химические вещества, то есть произошло химическое изменение. Как упоминалось выше, это может быть сложно, поскольку студенты часто не видят разницы между яичным белком, переходящим из жидкого в твердое состояние в процессе приготовления, и такими изменениями, как таяние шоколада или кипячение воды, которые не связаны с химическими изменениями. Обучение должно быть сосредоточено на том, что происходит, когда образуются новые вещества.
Эти идеи также рассматриваются в идее фокуса Проблемы с классификацией.
Также можно учитывать воздействие химических реакций на окружающую среду, например, как мы утилизируем некоторые химические вещества после их производства в таких формах, как пластиковые пакеты.
Начать обсуждение через общий опыт
Первоначальная педагогическая деятельность должна быть направлена на выявление существующих идей учащихся. На этом этапе важно, чтобы учащихся поощряли высказывать свои идеи и обсуждать их в небольших группах.Все альтернативы следует рассматривать без разрешения на данном этапе.
Начальным действием может быть наблюдение за горением свечи и обсуждение происходящих изменений. Здесь можно различить плавление воска и появление новых материалов. Можно задать следующие вопросы:
- что происходит с воском?
- что горит?
- как вы думаете, куда идет воск?
- не могли бы вы собрать его снова?
- Это тот же процесс, что и испарение воды?
- горела бы свеча, если бы вокруг не было воздуха?
- воздух или часть воздуха израсходованы при горении свечи?
Содействовать осмыслению и разъяснению существующих идей
Действия, которые ставят проблемы для изучения и оспаривают существующие идеи, полезны для поощрения студентов к поиску новых объяснений наблюдаемых ими вещей.Студенты должны изучить ряд изменений и задать вопросы, аналогичные приведенным выше. Во всех этих случаях студентов следует поощрять наблюдать за происходящими изменениями и определять, какие продукты образуются. Обсуждение также может быть сосредоточено на том, чем они отличаются от исходных материалов. Вот несколько примеров:
- Пищевая сода и уксус в стеклянной бутылке с пробкой — почему пробка отлетает?
- Добавьте бикарбонат соды в стакан с уксусом и шестью смородинами.Почему смородина движется вверх и вниз? Какие пузыри? Откуда берутся пузыри?
- Приготовление щербета — смешайте четыре части сахарной пудры, две части лимонной кислоты и одну часть пищевой соды (все они доступны в супермаркетах). Студенты кладут небольшое количество смеси на язык. Что вызывает шипение? Выделяет ли какой-либо порошок сам по себе шипение?
- Наполните банку стальной мочалкой (без мыла) наполовину и добавьте уксуса, чтобы покрыть стальную мочалку. Оставьте на пять дней.Вылейте одну столовую ложку полученной жидкости во вторую банку. Добавьте одну чайную ложку бытового нашатыря и перемешайте. Сформируется темно-зеленая клейкая ткань. Опять же, студентов следует попросить подумать о том, что происходит, с упором на развитие понимания того, что создаются новые материалы.
- Изготовление карамели — студентам предлагается изучить сахар. Нагрейте концентрированный сахарный раствор, наблюдая за изменениями по пути — растворение сахара, затем потемнение. Карамелизация включает в себя ряд химических изменений.(Существует множество рецептов карамели — для улучшения вкуса, внешнего вида и текстуры можно добавить масло, пищевую соду и соль). Студентов следует поощрять искать доказательства химических изменений, а не плавления.
Практикуйтесь в использовании и укрепляйте воспринимаемую полезность научной модели или идеи
Другие виды деятельности могут включать изготовление шоколада. Учащимся можно предложить поискать различия между приготовлением шоколада, где шоколад тает, и производством карамели / ириса, когда сахар превращается во что-то другое.
Есть много других подобных химических изменений, которые можно исследовать — дальнейшие действия по приготовлению пищи могут включать: приготовление шоколадного торта, плавление и подрумянивание сыра, изготовление сот, выпечка хлеба, приготовление яиц-пашот и приготовление тостов. Другие изменения могут включать настройку двухкомпонентных клеев, таких как Araldite и смешивание стальной ваты и раствора медного купороса (можно приобрести в питомниках растений). Кислород является очень важным реагентом во многих химических реакциях, и студенты могут исследовать изменения, связанные с этим компонентом воздуха.
Прояснить и объединить идеи для / путем общения с другими
На этом этапе важно уточнить и закрепить то, что наблюдали студенты, и сосредоточиться на том, что происходит в химической реакции, которая отличается от плавления, кипения и замораживания. Для достижения этой цели студентов можно попросить в группах сделать мини-плакаты, которые показывают изменения, происходящие в одной или нескольких реакциях, которые они наблюдали, в частности сравнивая продукты с исходными материалами и демонстрируя, чем они отличаются.Этому можно способствовать, используя новые названия продуктов, такие как «сажа» или «углекислый газ». Затем студенты представляют свои плакаты классу.
Итоговое обсуждение в классе должно выявить идеи учащихся, изучить альтернативы и перейти к более общепринятым научным взглядам на химические реакции.
Должны быть выполнены задания, которые проверят полезность модели химических реакций и дополнительно укрепят представления учащихся о том, что представляет собой химическая реакция. Студентов можно также побудить сравнить продукты с исходными материалами.Например, студенты могут исследовать ржавление стального гвоздя в различных условиях (например, в воздухе / воде / соленой воде).
Для дальнейшего развития понимания учащимися роли химических изменений в их жизни они могли бы исследовать производство металлов из руд (таких как алюминий и сталь) или производство пластмасс и синтетических волокон. Акцент в этом исследовании делается на важности химических изменений в производстве материалов, которые мы используем каждый день.
Дополнительные ресурсы
Интерактивные обучающие объекты, связанные с наукой, можно найти на Страница ресурсов для учителей FUSE.
Чтобы получить доступ к интерактивному объекту обучения ниже, учителя должны войти в FUSE и выполнить поиск по идентификатору учебного ресурса:
- Mystery Substances: ваш первый случай — студенты раскрывают полицейские дела, определяя чистые вещества и компоненты смесей. Они проводят химические испытания загадочного вещества, такого как соль, пищевая сода или сахар, а также наблюдают и записывают, как каждое вещество реагирует с рядом жидкостей и при нагревании. Затем они обращаются к своей таблице данных о химических свойствах и используют ее для сопоставления загадочного вещества или веществ, обнаруженных на месте преступления.Этот учебный объект является одним из пяти объектов.
Идентификатор учебного ресурса: K6ZRNX
- Загадка сокровищ — ученики должны открыть металлическую дверь в сокровищницу, растворив ее кислотами. Они проверяют повседневные вещества, чтобы определить, какие из них являются кислотами: лимонный сок, соленая вода, алкоголь, уксус, вода и газированные безалкогольные напитки.

