Контрольно-измерительные материалы по химии (8 класс)
Государственное казенное общеобразовательное учреждение «Школа-интернат Костромской области для обучающихся с ограниченными возможностями здоровья по слуху»
КОНТРОЛЬНО-ИЗМЕРИТЕЛЬНЫЕ МАТЕРИАЛЫ ПО химии
8 КЛАСС
- контрольная работа за I полугодие
- итоговая контрольная работа
Кодификатор
элементов содержания и требований к уровню подготовки обучающихся для проведения контрольной работы по химии по теме «Первоначальные химические понятия» в 8 классе
Предмет: «химия» 8 класс
Учебник для общеобразовательных учреждений под редакцией О.
Вид контроля: тематический
Тема: «Первоначальные химические понятия»
- Перечень элементов предметного содержания, проверяемых на контрольной работе
|
Код |
Описание элементов предметного содержания |
|
|
Названия химических элементов |
|
1.2 |
Произношение химических элементов |
|
1.3 |
Расположение химических элементов в периодической системе |
|
1. |
Формулы веществ |
|
1.5 |
Относительная молекулярная масса. Расчёт |
|
1.6 |
Валентность |
|
1.7 |
Массовые доли элементов. Расчёт |
2.Перечень элементов метапредметного содержания, проверяемых на контрольной работе
|
код |
Описание элементов метапредметного содержания |
|
2. |
Умение соотносить данные (познавательное УУД) |
|
2.2 |
Умение структурировать знания (познавательное УУД) |
|
2.3 |
Умение работать со знаково-символическими средствами (познавательное УУД) |
|
2.4 |
Умение использовать общий приём решения задач (логическое УУД) |
|
2.5 |
Умение производить вычислительные действия (логическое УУД) |
|
2. |
Умение оценивать правильность выполнения учебной задачи (регулятивное УУД) |
3.Перечень требований к уровню подготовки обучающихся, освоивших тему «Первоначальные химические понятия» по предмету «химия» в 8 классе
|
код |
Описание требований к уровню подготовки обучающихся |
|
3.1 |
Владеть понятийным аппаратом и символическим языком химии (базовый уровень) |
|
3.2 |
Изображать состав простейших веществ с помощью химических формул (базовый уровень) |
|
3. |
Вычислять относительную молекулярную массу веществ, а также массовую долю химического элемента в соединениях для оценки их практической значимости (базовый уровень) |
|
3.4. |
Определять правильность записанных неравенств (повышенный уровень) |
|
3.5. |
Определять валентность элементов в веществах, составлять формулы неорганических соединений по валентностям (базовый уровень) |
Спецификация КИМ
для проведения контрольной работы по теме «Первоначальные химические понятия»
Предмет: «химия» 8 класс
Учебник для общеобразовательных учреждений под редакцией О.
Вид контроля: тематический
Тема: «Первоначальные химические понятия»
Назначение контрольной работы: оценить уровень освоения каждым учащимся 8 класса содержания темы «Первоначальные химические понятия» по предмету «химия»
Содержание контрольных измерительных заданий определяется содержанием рабочей программы по теме «Первоначальные химические понятия» учебного предмета «химия», а также содержанием темы «Первоначальные химические понятия» учебника для общеобразовательных учреждений под редакцией О.С. Габриеляна.
Контрольная работа состоит из 9 заданий базового уровня, 1 повышенного.
Распределение заданий по уровням сложности, проверяемым элементам предметного, метапредметного содержания, уровню подготовки, типам заданий и времени выполнения представлено в таблице 1
Таблица 1
|
№ задания |
уровень |
Что проверяется |
Тип задания |
Примерное время выполнения задания |
|
1 |
Базовый |
1. |
Тест с выбором ответа |
2 мин. |
|
2 |
Базовый |
1.2; 2.1, 2.3, 3.1 |
Тест с выбором ответа |
3 мин |
|
3 |
Базовый
|
1.3,2.2, 2.3, 3.1 |
Тест с выбором ответа |
5 мин |
|
4 |
Базовый |
1. |
Написание формул веществ |
3 мин. |
|
5 |
Базовый
|
1.5; 2.5; 3.3 |
Определение правильной записи |
2 мин |
|
6 |
Базовый
|
1.5; 2.5; 3.3 |
Расчёт относительной молекулярной массы. |
6 мин |
|
7 |
Повышенный |
1.5; 2.5; 3.3, 3.4 |
Расчёт относительной молекулярной массы. Выбор правильных неравенств |
7 мин |
|
8 |
Базовый
|
1.6, 2.3, 2.4,3.5 |
Определение валентности по формулам веществ |
4 мин |
|
9 |
Базовый
|
1. |
Задача |
8 мин |
|
Оценка правильности выполнения задания |
Базовый |
Выполнение теста на знание информации и применения репродуктивных способов деятельности |
Сверка с эталоном |
Выполняется на следующем уроке, после проверки работы учителем |
|
Повышенный |
2.6 |
Сверка с выполненной учебной задачей по критериям |
На выполнение 9 заданий отводится 40 минут. Контрольная работа составляется в 2-х вариантах. Каждому учащемуся предоставляется распечатка заданий.
Контрольная работа составляется в 2-х вариантах. Каждому учащемуся предоставляется распечатка заданий.
Задания в контрольной работе оцениваются в зависимости от сложности задания разным количеством баллов, указанных в таблице 2.
Таблица 2
|
№ задания |
Количество баллов |
|
1 |
1 балл – правильный ответ 0 баллов – неправильный ответ |
|
2 |
1 балл – правильный ответ 0 баллов – неправильный ответ |
|
3 |
Максимальное количество баллов — 2 1 балл – одна ошибка 0 баллов – неправильный ответ |
|
4 |
Максимальное количество баллов — 2 1 балл – одна ошибка (неправильный символ) 0 баллов – неправильный ответ |
|
5 |
1 балл – правильный ответ 0 баллов – неправильный ответ |
|
6 |
Максимальное количество баллов — 2 1 балл – одна ошибка в расчётах 0 баллов – неправильный ответ |
|
7 |
Максимальное количество баллов – 3 2 балла — одна ошибка в расчётах 1 балл – одна ошибка в расчётах + 1 ошибка в определении правильного неравенства 0 баллов – неправильный ответ |
|
8 |
Максимальное количество баллов — 2 1 балл – одна ошибка в определении валентности 0 баллов – неправильный ответ |
|
9 |
Максимальное количество баллов -3 2 балла – правильный алгоритм, но ошибки в вычислениях 1 балл – определена массовая доля 1 элемента 0 баллов – неправильный ответ |
|
Оценка правильности выполнения задания |
Оценка правильности выполнения задания (регулятивное УУД): после проверки работы учителем попросить проверить учащихся свои работы, сверяя их с эталоном ответов (умение оценивать правильность выполнения учебной задачи). Данное задание оценивается, но в баллы и отметку не переводится. |
|
Итого |
17 баллов |
Перевод баллов к 5-балльной отметке представлен в таблице 3.
Таблица 3.
|
Баллы |
Отметка |
|
14-17 |
Отметка «5» |
|
9-13 |
Отметка «4» |
|
6-8 |
Отметка «3» |
|
0-5 |
Отметка «2» |
Показатели уровня освоения каждым обучающимся 8 класса содержания темы «Первоначальные химические понятия» по предмету «химия» определены в таблице 4.
Таблица 4.
|
Код требования к уровню подготовки |
№ задания контрольной работы |
Предметный результат не сформирован |
Предметный результат сформирован на базовом уровне |
Предметный результат сформирован на повышенном уровне |
|
3.1 |
1,2,3 |
Учащимся выполнено частично 1-2 задания |
Учащимися выполнены все три задания, допускаются небольшие неточности |
|
|
3. |
4 |
Задание не выполнено или выполнено частично |
Задание выполнено с одной неточностью |
|
|
3.3. |
5, 6,7,9 |
Задания не выполнены или выполнено меньше половины заданий |
Задания выполнены, допускаются 2 ошибки в вычислениях |
Задания выполнены полностью, допускаются небольшие неточности |
|
3. |
7 |
Задание не выполнено или неверно найдены две массовые доли элементов |
Найдены все массовые доли элементов, но допущены ошибки в вычислениях |
Задание выполнено полностью, допускаются небольшие неточности |
|
3.5 |
8 |
Задание не выполнено или выполнено частично |
Задание выполнено с одной неточностью |
|
Показатели сформированности у обучающихся 8 класса метапредметных умений определены в таблице 5.
Таблица 5.
|
Код метапредметного результата |
№ задания контрольной работы |
Продемонстрировал сформированность |
Не продемонстрировал сформированность |
|
2.1 |
1, 2 |
Сделано два задания |
Сделано менее двух заданий |
|
2.2 |
3 |
Выполнено задание |
Не выполнено |
|
2. |
1, 2, 3,4, 8, 9 |
Сделано более пяти заданий |
Сделано менее четырёх заданий |
|
2.4 |
8,9 |
Сделано два задания |
Сделано одно задание частично |
|
2.5 |
5, 6, 7, 9 |
Сделано 3-4 задания |
Сделано менее трёх заданий |
|
2. |
Оценка правильности выполнения задания |
Результаты обучения учащимися комментируются и аргументируются |
Результаты в большинстве случаев учащимися не комментируются |
Типовые контрольные задания
Контрольная работа по теме: «Первоначальные химические понятия»
Вариант 1
- Соотнесите
названия химических элементов: символы:
- Азот а) H д) C
- Алюминий б) Ca е) K
- Калий в) N ж) Aq
- Водород г) Cu з) Al
- Соотнесите
произношение химических элементов: химические знаки:
- Эн а) S д) Na
- Цэ б) C е) N
- Магний в) Cl ж) Fe
- эс г) Cu з) Mq
- Соотнесите
места химических элементов в периодической системе: химические знаки:
- 3 период, VII группа а) Hе д) Cu
- 1 период, VIII группа б) Aq е) S
- 4 период, VII группа в) Cl ж) Ne
побочная подгруппа г) Mn
- 5 период, I группа
побочная подгруппа
- Напишите формулы веществ по их произношению:
а) Феррум-два-о-три в) два-эн-аш-три
б) Аш-два-эс-о-четыре г) пять-натрий-хлор
-
Выберите правильную запись расчёта относительной молекулярной массы фосфорной кислоты H3PO4.

а) 1+31+16 в) 14*3+31+16*4
б) 1*3+31+16*4 г) 1*3+31+16
- Соотнесите:
формулы веществ: Mr веществ:
- C2H4O2 а) 232 д) 80
- Na2O б) 62 е) 60
- CaO в) 72 ж) 142
- CuO г) 56
- Выберите правильные записи:
а) Mr (KHCO3) < Mr (CaCO3) в) Mr (Fe2O3) = 2Mr (SO3)
б) Mr (Cl2) > Mr (N2) г) Mr (H2S) > Mr (SO2)
- Определите валентность по формулам веществ:
N2O5, NO, NO2, CuO, FeCl3
-
Вычислите массовые доли элементов в гидроксиде натрия NaOH.

Контрольная работа по теме: «Первоначальные химические понятия»
Вариант 2
1.Соотнесите
названия химических элементов: символы:
- Кальций а) H д) C
- Серебро б) Ca е) K
- Калий в) O ж) Aq
- Сера г) S з) Al
2.Соотнесите
произношение химических элементов: химические знаки:
- Хлор а) S д) Na
- Купрум б) C е) N
- Магний в) Cl ж) Fe
- эн г) Cu з) Mq
3. Соотнесите
Соотнесите
места химических элементов в периодической системе: химические знаки:
- 3 период, VIII группа а) Hе д) Cu
- 2 период, III группа б) Ar е) S
- 4 период, I группа в) Cl ж) B
побочная подгруппа г) Rb
- 5 период, I группа
главная подгруппа
4. Напишите формулы веществ по их произношению:
Напишите формулы веществ по их произношению:
а) пэ-два-о пять в) два-цэ-аш-четыре
б) Купрум-эс-о-четыре г) три-калий-эн-о-три
- Выберите правильную запись расчёта относительной молекулярной массы серной кислоты H2SO4.
а) 1+32+16 в) 1*2+32+16*4
б) 1+32+16*4 г) 1*2+32+16
6.Соотнесите:
формулы веществ: Mr веществ:
- C2H4O2 а) 232 д) 29
- Na2CO3 б) 71 е) 72
- MqO в) 72 ж) 106
- FeO г) 40
7. Выберите правильные записи:
Выберите правильные записи:
а) Mr (KHCO3) < Mr (CaCO3) в) Mr (Fe2O3) < 2Mr (SO3)
б) Mr (Cl2) > Mr (N2) г) Mr (H2S) < Mr (SO2)
8. Определите валентность по формулам веществ:
Na2O, N2O5, CaO, SO3, , FeCl3
9. Вычислите массовые доли элементов в кремниевой кислоте H2SiO3.
Кодификатор
элементов содержания и требований к уровню подготовки обучающихся для проведения итоговой контрольной работы по химии в 8 классе
Предмет: «химия» 8 класс
Учебник для общеобразовательных учреждений под редакцией О. С. Габриеляна
С. Габриеляна
Вид контроля: итоговый
Тема: «Итоговая контрольная работа»
- Перечень элементов предметного содержания, проверяемых на контрольной работе
|
Код |
Описание элементов предметного содержания |
|
1.1 |
Названия химических элементов |
|
1.2 |
Относительная молекулярная масса. Расчёт |
|
1.3 |
Валентность |
|
1. |
Расчет количества вещества |
|
1.5 |
Составление уравнений реакций и определение их типа |
|
1.6 |
Расчеты по уравнениям реакций |
- Перечень элементов метапредметного содержания, проверяемых на контрольной работе
|
код |
Описание элементов метапредметного содержания |
|
2. |
Умение соотносить данные (познавательное УУД) |
|
2.2 |
Умение структурировать знания (познавательное УУД) |
|
2.3 |
Умение работать со знаково-символическими средствами (познавательное УУД) |
|
2.4 |
Умение классифицировать (логическое УУД) |
|
2.5 |
Умение использовать общий приём решения задач (логическое УУД) |
|
2. |
Умение производить вычислительные действия (логическое УУД) |
|
2.7 |
Умение оценивать правильность выполнения учебной задачи (регулятивное УУД) |
- Перечень требований к уровню подготовки обучающихся 8 класса
|
код |
Описание требований к уровню подготовки обучающихся |
|
3.1 |
Владеть понятийным аппаратом и символическим языком химии (базовый уровень) |
|
3. |
Вычислять относительную молекулярную массу веществ (базовый уровень) |
|
3.3. |
Определять валентность элементов по формулам веществ (базовый уровень) |
|
3.4. |
Определять количество вещества по формуле (базовый уровень) |
|
3.5. |
Составлять уравнения реакций по схемам и определять их тип (базовый уровень) |
|
3.6. |
Вести расчеты по уравнениям реакций (повышенный уровень) |
Спецификация КИМ
для проведения итоговой контрольной работы в 8 классе
Предмет: «химия» 8 класс
Итоговая контрольная работа по химии; 8 класс — Оценка знаний учащихся — Химия
Итоговая контрольная работа за курс химии 8 класса.

Пояснительная записка.
Итоговая контрольная работа за курс химии 8 класса составлена на основе Программы курса химии для 8-11 классов общеобразовательных учреждений. Автор: Габриелян О. С. – М.:Дрофа,2010 .Данная программа рассчитана на 2 учебных часа в неделю, 68 учебных часов в году.
Итоговая контрольная работа проводится в конце учебного года.
Цель:
• Определить уровень освоения учащимися программы по химии для 8 класса
• Определить соответствие уровня знаний, умения и навыков требованиям к уровню подготовки учеников 8 класса.
Итоговая контрольная работа за курс химии 8 класса
1 вариант
А1. Символ химического элемента кальция
1. K
2. Ca
3. Сs
4. Сd
А2. Физическим природным явлением является
1. образование глюкозы в зеленом растении
2. лесной пожар
3. высыхание дождевых луж
4. процесс дыхания растений
А3. Из приведенных понятий выберите только те, которые обозначают вещество.
1. железо, нож, сахар
железо, нож, сахар
2. стекло, дерево, железо
3. парта, дерево, стекло
4. стекло, окно, гвоздь
А4. Из приведенного перечня выберите ряд, в котором указаны только сложные вещества.
1. кислород, ртуть, оксид азота
2. оксид натрия, вода, серная кислота
3. барий, оксид бария, гидроксид бария
4. кислород, водород, барий
А5. Число, показывающее число атомов в молекуле называется…
1. индекс
2. коэффициент
3. валентность
4. электроотрицательность
А6. Как определяется число электронов атома химического элемента?
1. по порядковому номеру
2. по номеру периода
3. по номеру группы
4. по разнице между атомной массой и порядковым номером.
А7. Какое из веществ имеет ковалентный неполярный вид связи?
1. O2
2. h3O
3. CaCl2
4. Ba
А8. Из приведенного перечня выберите ряд, в котором указаны только двухвалентные элементы.
1. H, Na, K
2. O, Mg, Zn
3. Na, Mg, Ca
4. Al, P, Cl
Al, P, Cl
А9. Выберите ряд, где указаны только основания
1. h3SO4 N2O5 Cu(NO3)2 Na2O
2. Ca(OH)2 Cu(OH)2 NaOH
3. CaO h3O Na2O N2O5
4. CaO NaOH Na2O N2O5
А10. Сумма коэффициентов в уравнении реакции, схема которой
SO2+ O2 → SO3
1. 4
2. 5
3. 6
4. 7
В1. Процесс диссоциации хлорида кальция можно выразить уравнением
1. CaCl2 ↔ Ca2+ + Cl —
2. CaCl2 ↔ Ca2+ + 2Cl —
3. CaCl2 ↔ Ca2+ + 2Cl -2
4. CaCl2 ↔ Ca+ + 2Cl —
В2. Установите соответствие между уравнением реакции и типом реакции
1. 2Al + 3S → 2Al2S3 А. реакция обмена
2. 2Fe(OH)3 → Fe2O3 + 3h3O Б. реакция замещения
3. Zn + 2HCl → ZnCl2 + h3 В. реакция разложения
4. ZnO + 2HNO3 → Zn (NO3) 2 + h3O Г. реакция соединения
С1. Для приготовления 400 г 2% раствора соли необходимо взять соль массой
1. 8 г
2. 4 г
3. 2 г
4. 10 г
С2. Объем углекислого газа, образовавшегося при сжигании 11,2 л (н.у.) метана СН4
СН4 + 2О2 → СО2 + Н2О равен
1. 11,2 л
11,2 л
2. 22,4 л
3. 44,8 л
4. 5,6 л
На странице приведен фрагмент.
Спасибо за Вашу оценку. Если хотите, чтобы Ваше имя
стало известно автору, войдите на сайт как пользователь
и нажмите Спасибо еще раз. Ваше имя появится на этой стрнице.
Есть мнение?
Оставьте комментарий
Итоговая контрольная работа по химии 8 класс
На выполнение работы отводится 2 часа (120 минут). Работа состоит из 3 частей, содержащих задания.
Часть 1 содержит 12 заданий. К каждому заданию дается 4 варианта ответа, из которых только один правильный.
Часть 2 состоит из 3 заданий, на которые нужно дать краткий ответ в виде набора цифр.
Часть 3 включает 3 задания, выполнение которых предполагает написание полного, развернутого ответа, включающего необходимые уравнения реакций и расчеты.
При выполнении работы можно использовать периодическую систему химических элементов Д.И. Менделеева, таблицей растворимости кислот, оснований, солей, электрохимическим рядом напряжения металлов и непрограммируемым калькулятором.
Часть 1
К каждому из заданий даны 4 варианта ответа, из которых только один правильный.
А1. Одинаковое число электронов во внешнем электронном слое имеют атомы
- Углерод и кремний 2) хлор и сера 3)азот и кислород 4) кислород и хлор
А2. В каком ряду химические элементы располагаются в порядке усиления металлических свойств?
- As → P → S 3) I → Br → Cl
- O → S → Se 4) Be → B → C
А3. Для какого вещества характерна ковалентная полярная связь?
- MgO 2) Br2 3) NO 4) Al
А4. Наименьшее значение степени окисления азот имеет в соединении
- Nh5OH 2) NaNO2 3) N2O3 4) HNO3
А5. Кислотному оксиду и кислоте соответствуют формулы
Кислотному оксиду и кислоте соответствуют формулы
- CaO , HNO3 2) CO2, Ch5 3) BeO, Be(OH)2 4) SO2, h3S
А6. Раствор соляной кислоты реагирует с металлом
- Медь 2) железо 3) золото 4) платина
А7. Химическая реакция возможна между
- Оксидом углерода (IV) и серебром
- Оксидом алюминия и водой
- Оксидом кальция и гидроксидом натрия
- Оксидом углнрода (IV) и гидроксидом калия
А8. Раствор гидроксида калия взаимодействует
- Водой
- Азотной кислотой
- Оксидом кальция
- Магнием
А9. Для растворения гидроксида алюминия можно использовать раствор
- Воду
- Серной кислоты
- Нитрата цинка
- Хлорида алюминия
А10. Верны ли следующие суждения о способах разделения смесей?
А. Очистить воду от нерастворимых твердых примесей можно с помощью фильтрования.
Б. Смесь растительного масла и воды разделяют с помощью делительной воронки.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
А 11. Массовая доля кислорода в карбонате кальция равна
- 13% 2) 20% 3) 48% 4) 40%
А12. Доказать наличие водорода в сосуде можно с помощью
- Тлеющей лучинки
- Влажной лакмусовой бумажки
- Горящей лучинки
- Известковой воды
Часть 2.
При выполнении заданий из предложенного перечня ответов выберите два правильных. Цифры выбранных ответов запишите в указанном месте без дополнительных символов.
В1. Для ряда химических элементов бор – углерод – азот – кислород характерны следующие закономерности:
- Уменьшается электроотрицательность
- Увеличивается число электронов во внешнем электронном слое
- Увеличивается радиус атома
- Ослабевают неметаллические свойства
- Усиливаются неметаллические свойства
Ответ:
При выполнении заданий к каждому элементу первого столбца подберите соответствующий элемент из второго столбца. Выбранные цифры запишите под соответствующими буквами таблицы. Цифры в ответе могут повторяться.
Выбранные цифры запишите под соответствующими буквами таблицы. Цифры в ответе могут повторяться.
В2. Установите соответствие между схемой реакции и изменением степени окисления фосфора.
|
Схема реакции |
Изменение степени окисления фосфора |
|
А) Ph4 + HCl → Ph5Cl |
|
|
Б) P2O5 + C → P + CO |
|
|
В) PCl3 + Cl2→ PCl5 |
|
|
|
|
Ответ
ВЗ. Установите соответствие между исходными веществами и продуктами реакции.
|
Исходные вещества |
Продукты реакции |
|
|
|
Б) K2O + h3SO4 |
|
|
|
|
|
|
Ответ
Часть 3.
Для ответов на задания используйте отдельный лист. Запишите сначала номер задания (С1, С2, С3), а затем развернутый ответ к нему.
С1. Дана схема преврашений:
Сu → CuCl2→Cu(OH)2 → CuO→Cu
Напишите уравнения реакций, с помощью которых можно осуществить указанные превращения.
С2. Сколько грамм серной кислоты потребуется для нейтрализации 5.6 г гидроксида калия?
С3. Учащимся для исследования был выдан оксид – порошок черного цвета. При его взаимодействии с раствором серной кислоты образуется раствор голубого цвета, а при пропускании над нагретым выданным порошком газообразного вещества, которое в 14,5 раз легче воздуха, образуется простое вещество – металл красного цвета. Запишите химическую формулу и название неизвестного вещества. Составьте два уравнения реакций, которые были проведены в процессе исследования его свойств.
Химия 8 класс: ИТОГОВЫЙ ТЕСТ за год
Химия 8 класс: ИТОГОВЫЙ ТЕСТ за год
Рекомендуется вначале прочитать конспекты уроков Химии по всем темам 8 класса. В настоящем тесте 26 вопросов. Нет ограничения по времени. Вначале вопросы с выбором одного ответа из 4-х вариантов. В конце — вопросы повышенной сложности (множественный выбор, сопоставление понятий, заполнить пропуски). В случае явно плохих результатов (меньше 15% правильных ответов) тестирование по теме «Химия 8 класс: ИТОГОВЫЙ ТЕСТ за год» заканчивается досрочно! Неудовлетворительная оценка выставляется, если правильных ответов меньше 50% ! Вернуться на страницу «Химия 8 класс».
В настоящем тесте 26 вопросов. Нет ограничения по времени. Вначале вопросы с выбором одного ответа из 4-х вариантов. В конце — вопросы повышенной сложности (множественный выбор, сопоставление понятий, заполнить пропуски). В случае явно плохих результатов (меньше 15% правильных ответов) тестирование по теме «Химия 8 класс: ИТОГОВЫЙ ТЕСТ за год» заканчивается досрочно! Неудовлетворительная оценка выставляется, если правильных ответов меньше 50% ! Вернуться на страницу «Химия 8 класс».
 ..
Loading…
Loading…
Loading…
Loading…
Loading…
Loading…
Loading…
Loading…
Loading…
..
Loading…
Loading…
Loading…
Loading…
Loading…
Loading…
Loading…
Loading…
Loading…23.
Среди реакций:
1) 2H2O = 2H2 + О2;
2) H2 + FeO = Fe + H2O;
3) H2 + S = H2S;
4) 6НCl + Fe2О3 = 2FeCl3 4- 3H2O
реакции соединения, замещения, разложения и обмена соответственно
3, 2, 1, 4
2, 3, 1, 4
3, 1, 2, 4
3, 4, 2, 1
Loading… Loading…25. Распределите на группы — (А) взаимодействуют с водой при комнатной температуре, (Б) — взаимодействуют с водой при нагревании, (В) — не взаимодействуют с водой — вещества, названия которых приведены ниже. Напротив вещества напишите соответствующую букву: А, Б или В.
Напротив вещества напишите соответствующую букву: А, Б или В.
1) никель — , 2) барий — , 3) оксид кремния — , 4) оксид стронция — , 5) кокс (углерод) — , 6) оксид фосфора(V) — , 7) оксид бериллия — , 8) цинк — .
Loading… Loading… Loading…
Контрольные работы по химии 8 класс Итоговая контрольная работа
Контрольные работы по химии 8 класс
Итоговая контрольная работа по химии 8 класс
Вариант подготовила Субханова Г. Р.
Вариант 1
В задания 1-12 выберите только один правильный ответ.
- Только простые вещества содержатся в наборе:
1) C, O2, CO
2) N2, NO, Br2
3) CO2, NO2, SO2
4) S2, N2, Al
Решение:
Простые вещества – состоят из атомов только одного вида, соответственно правильный ответ S2, N2, Al
Ответ: 4
- Химическое явление – это:
1) растворение соли
2) горение свечи
3) плавление железа
4) намагничивание железа
Решение:
Химические явления – это явления, в результате которых образуются новые соединения. Растворение соли, плавление железа и намагничивание железа – это физические явления. Горение свечи – химическое явление.
Растворение соли, плавление железа и намагничивание железа – это физические явления. Горение свечи – химическое явление.
Ответ: 2
- Смесь мела и воды можно разделить:
1) фильтрованием
2) выпариванием
3) перегонкой
4) перекристаллизацией
Решение:
Если вещество нерастворимо в воде, например крупы (рис, гречка, манка и др.), речной песок, мел, глина, то можно воспользоваться методом фильтрования.
Ответ: 1
- Массовая доля азота в оксиде азота(II) равна:
1) 46,7%
2) 25,9%
3) 14,9%
4) 7, 04%
Ответ: 1
- В 120 г 10%-ного раствора соли растворили 30 г этой же соли. Массовая доля соли в новом растворе равна:
1) 35%
2) 20%
3) 28%
4) 25%
Решение:
Найдем массу соли в первом растворе
m(соли) = 120*0,1 = 12 г
После добавления соли масса соли в конечном растворе составила
m(соли) = 12 + 30 = 42 г
m(конечного раствора) = m(первоначального раствора) + m(соли) = 120 + 30 =150г
Ответ: 3
6. Число нейтронов в ядре атома 23Na равно:
Число нейтронов в ядре атома 23Na равно:
1) 12
2) 11
3) 23
4) 34
Решение:
Атомная масса (А) = количество протонов + количество нейтронов
Количество протонов определяется порядковым номером элемента
Натрий имеет порядковый номер 11, значит, содержит 11 протонов
23 = 11 + количество нейтронов
Количество нейтронов = 12
Ответ: 1
- Элемент, у которого распределение электронов в атоме по энергетическим уровням 2, 5- это:
1) азот
2) фтор
3) фосфор
4) бор
Решение:
Чтобы определить элемент необходимо сосчитать общее количество электронов. В данном случае это 7 электронов. Известно, что атом – это электронейтральная частица, которая содержит одинаковое количество протонов и электронов. Значит, данный элемент имеет порядковый номер 7. Это азот N
Ответ: 1
- Металлические свойства наиболее выражены у элемента:
1) Cl
2) Al
3) P
4) Mg
Решение:
Металлические свойства изменяются периодически, в группах сверху вниз с увеличением порядкового номера усиливаются. Так как увеличивается количество энергетических уровней и валентный электрон дальше располагается от ядра. В периодах слева направо, т.е. от первой группы к восьмой ослабляются. Предложенные элементы являются элементами одного периода, наиболее выражены металлические свойства у магния.
Так как увеличивается количество энергетических уровней и валентный электрон дальше располагается от ядра. В периодах слева направо, т.е. от первой группы к восьмой ослабляются. Предложенные элементы являются элементами одного периода, наиболее выражены металлические свойства у магния.
Ответ: 4
- Вещества, в которых присутствует только ионная связь,-это:
1) NaCl и HCl
2) Na2O и KCl
3) O2 и HCl
4) Na и Cl2
Решение:
Ионная связь образуется между атомами металлов (или гидроксид ионом) и атомами неметаллов.
NaCl – ионная связь, HCl – ковалентная полярная связь
Na2O и KCl ионная связь
O2 ковалентная неполярная связь и HCl ковалентная полярная связь
Na металлическая связь Cl2 ковалентная неполярная связь
Ответ: 2
- Валентность серы в веществе, формула которого SO2, равна:
1) ΙΙ 2) VI 3) IV 4) I
Решение:
Определим степень окисления серы, так как степень окисления кислорода -2, на два атома приходится -4, сера имеет степень окисления +4. Валентность серы равна IV.
Валентность серы равна IV.
Ответ: 3
- Среди веществ, формулы которых:
А) KNO3 Б) H2S В) H2SO4 Г) CuSO4 Д) H3PO4 Е) NaCl – к кислотам относятся:
1) АГЕ 2) АВД 3) БВД 4) БВЕ
Решение:
Кислота – это сложное вещество, которое при диссоциации образует ионы водорода и кислотный остаток. Среди перечисленных соединений Б) H2S В) H2SO4 Д) H3PO4 являются кислотами, остальные соединения – соли.
Ответ: 3
- Больше всего ионов образуется в результате диссоциации 1 моль:
1) хлорида натрия
2) сульфата натрия
3) хлорида алюминия
4) сульфата алюминия
Решение:
Необходимо расписать уравнения диссоциации данных веществ
NaCl ↔ Na+ + Cl–
1моль 1 моль 1моль (образуется 2моль ионов)
Na2SO4 ↔ 2Na+ + SO42-
1моль 2 моль 1моль (образуется 3моль ионов)
AlCl3 ↔ Al3+ + 3Cl–
1моль 1 моль 3моль (образуется 4моль ионов)
Al2(SO4)3 ↔ 2Al3+ +3SO42-
1моль 2 моль 3моль (образуется 5моль ионов)
Ответ: 4
При выполнении заданий 13-15 к каждому элементу первого столбца подберите соответствующий элемент из второго столбца. Выбранные буквы запишите под соответствующими цифрами. Буквы в ответах могут повторяться.
Выбранные буквы запишите под соответствующими цифрами. Буквы в ответах могут повторяться.
- Установите соответствие между уравнением реакции и типом этой реакции:
УРАВНЕНИЕ РЕАКЦИИ ТИП РЕАКЦИИ
А. 2Na+2H2O=2NaOH+H2 1) обмена
Б. CuO+2HCl=CuCl2+H2O 2) замещения
В. N2+O2=2NO 3) соединение
Решение:
2Na+2H2O=2NaOH+H2 реакция замещения
CuO+2HCl=CuCl2+H2O реакция обмена
N2+O2=2NO реакция соединения
- Установите соответствие между молекулярным и сокращенным ионным уравнением химической реакции:
МОЛЕКУЛЯРНОЕ УРАВНЕНИЕ СОКРАЩЕННОЕ ИОННОЕ УРАВНЕНИЕ
А) CaCO3+2HCl=CaCl2+CO2+H2O 1) OH–+H+=H2O
Б) 2LiOH+h3SO4=Li2SO4+2H2O 2) Zn2++2OH–=Zn(OH)2
В) ZnSO4+2KOH=Zn(OH)2+K2SO4 3) CaCO3+2H+=Ca2++H2O+CO2
Решение:
При написании ионного уравнения необходимо посмотреть таблицу растворимости. Если вещество растворяется в воде, значит, в водном растворе находится в виде ионов, если вещество нерастворимо в воде либо имеет молекулярное строение, то в ионном уравнении записывается в виде молекулы.
Если вещество растворяется в воде, значит, в водном растворе находится в виде ионов, если вещество нерастворимо в воде либо имеет молекулярное строение, то в ионном уравнении записывается в виде молекулы.
CaCO3+2HCl=CaCl2+CO2+H2O
CaCO3 нерастворим в воде, в ионном уравнении записываем в виде молекулы
CaCO3+2H+ +2 Cl–= Ca2+ + 2 Cl– +CO2+H2O
CaCO3+2H+=Ca2++H2O+CO2
2LiOH+H2SO4=Li2SO4+2H2O
2Li+ + 2OH– + 2H+ + SO42- = 2 Li+ + SO42- +2H2O
OH–+H+=H2O
ZnSO4+2KOH=Zn(OH)2+K2SO4
Zn2++ SO42- +2K+ + 2 OH– =Zn(OH)2 + 2K+ + SO42-
Zn2++2OH–=Zn(OH)2
- Установите соответствие между уравнением реакции и схемой, иллюстрирующей изменение степени окисления восстановителя.
| УРАВНЕНИЕ РЕАКЦИИ | СХЕМА, ИЛЛЮСТРИРУЮЩАЯ ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ |
| А) 2SO2+O2=2SO3 | 1) Cl–→Cl0 |
| Б) CuSO4+Fe=FeSO4+Cu | 2) Fe0→Fe+2 |
| В) 4HCl+MnO2=MnCl2+Cl2+2H2O | 3) S+4→S+2 |
Решение:
Восстановитель – это атом либо группа атомов, которые отдают электроны, т.е. степень окисления элемента при этом увеличивается
При выполнении задания 16 из предложенного перечня вариантов ответа выберите три правильных и запишите буквы в алфавитном порядке.
- Определите, с какими из перечисленных веществ будет взаимодействовать гидроксид натрия: А) HNO3 Б) Fe(OH)2 В) SO3 Г) K2CO3 Д) CO2
Гидроксид натрия – это щелочь, взаимодействует с кислотами (HNO3), кислотными оксидами (SO3 и CO2)
NaOH + HNO3 → NaNO3 + H2O
2NaOH + SO3 → Na2SO4 + H2O
2NaOH + CO2 → Na2CO3 + H2O
Ответ: АВД
При выполнении заданий 17-19 приведите развернутый ответ.
- Даны вещества: NaNO3; BaCl2; Zn; CuSO4; AgNO3. Приведите молекулярные уравнения трех возможных реакций между данными веществами. Укажите тип каждой реакции. Для реакций ионного обмена приведите полные и сокращенные ионные уравнения.
Решение:
BaCl2+CuSO4=BaSO4+CuCl2; (реакция обмена)
Cu2+ + SO42- + Ba2+ + 2Cl– = BaSO4 ↓+ Cu2+ + 2Cl–
SO42- + Ba2+ = BaSO4 ↓
BaCl2+AgNO3=2AgCl+Ba(NO3)2; (реакция обмена)
2Ag+ + 2NO3– + Ba2+ + 2Cl– = 2AgCl↓ + Ba2+ + 2NO3–
2Ag+ + 2Cl– = 2AgCl↓
Ag+ + Cl– = AgCl↓
Zn+CuSO4=ZnSO4+Cu (реакция замещения)
Zn+2AgNO3=Zn(NO3)2+2Ag; (реакция замещения)
- Приведите уравнения реакций, с помощью которых можно осуществить превращения:
Zn→ZnO→Zn(NO3)2
Решение:
2Zn+O2=2ZnO
ZnO+2HNO3=Zn(NO3)2+H2O
- Определите объем водорода(н.у.), который выделится при действии цинка на 200г 36,6%-ного раствора соляной кислоты.
Решение:
- Напишем уравнение реакции
Zn + 2HCl = ZnCl2 + H2
- Рассчитаем массу соляной кислоты
m(HCl) = 200*0,366 = 73,2 г
Найдем количество вещества HC
По уравнению химической реакции n(H2) = n(HCl)/2 = 1 моль
- V(H2) = n(H2)*Vm = 1 моль* 22.4л/моль = 22.4 л
Ответ: 22.4 л
Вариант 2
В задания 1-12 выберите только один правильный ответ.
- Только сложные вещества содержатся в наборе:
1) Si, O2, CO
2) N2, NO, Br2
3) CO2, NO2, SO2
4) O2, N2, Al
Решение:
Сложные вещества – состоят из атомов двух и более видов, соответственно правильный ответ CO2, NO2, SO2
Ответ: 3
- Химическое явление – это:
1) таяние льда
2) ржавление железа
3) испарение воды
4) замерзание воды
Решение:
Если твердое вещество растворимо в воде (поваренная соль, сахар, лимонная кислота), то для разделения смеси можно применить метод выпаривания.
Выпаривание- выделение растворенных в жидкости твердых веществ способом ее превращения в пар.
Ответ: 2
- Массовая доля азота в азотной кислоте равна:
1) 18%
2) 25 %
3) 20 %
4) 22 %
Ответ: 4
- В 200 г 10%-ного раствора соли добавили 20 г воды. Массовая доля соли в новом растворе равна:
1) 9.1%
2) 20%
3) 19.1%
4) 8.1%
Решение:
Найдем массу соли в первом растворе
m(соли) = 200*0,1 = 20 г
m(конечного раствора) = m(первоначального раствора) + m(воды) = 200 + 20 =220г
Ответ: 1
6.Число нейтронов в ядре атома 40Ar равно:
1) 40
2) 18
3) 22
4) 58
Решение:
Неметаллические свойства изменяются периодически, в группах сверху вниз с увеличением порядкового номера усиливаются. Так как увеличивается количество энергетических уровней и валентный электрон дальше располагается от ядра. В периодах слева направо, т.е. от первой группы к восьмой ослабляются. Предложенные элементы являются элементами одного периода, наиболее выражены металлические свойства у магния.
Ответ: 4
- Вещества, в которых присутствует только ковалентная полярная связь, -это:
1) NaOH и HCl
2) MgO и KCl
3) H2O и HCl
4) Cu и O2
Решение:
Определим степень окисления серы, так как степень окисления кислорода -2, на четыре атома приходится -8, степень окисления водорода +1, на два атома приходится +2
2(+1) + х +4 (-2) = 0, х = +6
Сера имеет степень окисления +6. Валентность серы равна VI.
Ответ: 2
- Среди веществ, формулы которых:
А)KNO3 Б) H2S В) H2SO4 Г) CuSO4 Д) H3PO4 Е) NaCl – к солям относятся:
1) АГЕ 2) АВД 3) БВД 4) БВЕ
Решение:
2Al+6HCl =2AlCl3 +3 H2 реакция замещения
Cu(OH)2 +2HCl= CuCl2+ 2H2O реакция обмена
H2+I2=2HI реакция соединения
- Установите соответствие между молекулярным и сокращенным ионным уравнением химической реакции:
МОЛЕКУЛЯРНОЕ УРАВНЕНИЕ СОКРАЩЕННОЕ ИОННОЕ УРАВНЕНИЕ
А) CaSO3 + 2HCl=CaCl2+SO2+H2O 1) OH–+H+=H2O
Б) NaOH + HCl =HCl +H2O 2) Cu2++2OH–=Cu(OH)2
В) CuSO4+2KOH=Cu(OH)2+K2SO4 3) CaSO3+2H+=Ca2++H2O+SO2
Решение:
При написании ионного уравнения необходимо посмотреть таблицу растворимости. Если вещество растворяется в воде, значит, в водном растворе находится в виде ионов, если вещество нерастворимо в воде либо имеет молекулярное строение, то в ионном уравнении записывается в виде молекулы.
CaSO3 + 2HCl = CaCl2 + SO2 + H2O
CaSO3 нерастворим в воде, в ионном уравнении записываем в виде молекулы
CaSO3+2H+ +2 Cl–= Ca2+ + 2 Cl– +SO2+H2O
CaSO3+2H+=Ca2++H2O+SO2
NaOH + HCl =HCl +H2O
Na+ + OH– + H+ + Cl– = Li+ + Cl– +2H2O
OH–+H+=H2O
CuS4 + 2KOH = Cu(OH)2 + K2SO4
Cu2++ SO42- +2K+ + 2 OH– = Cu(OH)2 + 2K+ + SO42-
Cu2++2OH–= Cu(OH)2
- Установите соответствие между уравнением реакции и схемой, иллюстрирующей изменение степени окисления окислителя.
| УРАВНЕНИЕ РЕАКЦИИ | СХЕМА, ИЛЛЮСТРИРУЮЩАЯ ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ |
| А) 2SO2+O2=2SO3 | 1) Сu+2 → Cu0 |
| Б) CuSO4+Fe=FeSO4+Cu | 2) Mn+4→ Mn+2 |
| В) 4HCl+MnO2=MnCl2+Cl2+2H2O | 3) O0→ O-2 |
Решение:
Окислитель – это атом либо группа атомов, которые присоединяют электроны, т.е. степень окисления элемента при этом уменьшается
При выполнении задания 16 из предложенного перечня вариантов ответа выберите три правильных и запишите буквы в алфавитном порядке.
- Определите, с какими из перечисленных веществ будет взаимодействовать соляная кислота: А) HNO3 Б) Cu(OH)2 В) SO3 Г) Na2CO3 Д) MgO
Решение:
Соляная кислота HCl взаимодействует с основаниями, основными оксидами и солями
2HCl + Cu(OH)2 → CuCl2 + 2H2O
2HCl + Na2CO3 → 2NaCl + H2O + CO2
2HCl + MgO → MgCl2 + H2O
Ответ: БГД
При выполнении заданий 17-19 приведите развернутый ответ.
- Даны вещества: Na2SO4; BaCl2; Mg; CuSO4; NaOH Приведите молекулярные уравнения трех возможных реакций между данными веществами. Укажите тип каждой реакции. Для реакций ионного обмена приведите полные и сокращенные ионные уравнения.
Решение:
BaCl2+CuSO4=BaSO4+CuCl2; (реакция обмена)
Cu2+ + SO42- + Ba2+ + 2Cl– = BaSO4 ↓+ Cu2+ + 2Cl–
SO42- + Ba2+ = BaSO4 ↓
CuSO4 +2NaOH = Cu(OH)2 + Na2SO4
(реакция обмена)
Cu2+ + SO42- + 2Na+ + 2OH– = Cu(OH)2 + SO42- + 2Na+
Cu2+ +2OH– = Cu(OH)2
Mg + CuSO4 = MgSO4 + Cu
(реакция замещения)
- Приведите уравнения реакций, с помощью которых можно осуществить превращения:
Cu → CuO → CuCl2
Решение:
2Cu + O2 = 2CuO
CuO + 2HCl = CuCl2 + H2O
- Определите объем углекислого газа (н.у.), который выделится при действии 73 г 10%-ного раствора соляной кислоты на карбонат кальция
Решение:
- Напишем уравнение реакции
CaCO3 + 2HCl = CaCl2 + H2O + CO2
- Рассчитаем массу соляной кислоты
m(HCl) = 73*0,1 = 7,3 г
Найдем количество вещества HCl
По уравнению химической реакции n(CO2) = n(HCl)/2 = 0.1 моль
- V(CO2) = n(CO2)*Vm = 0.1 моль* 22.4л/моль = 2.24 л
Ответ: 2.24 л
Решебник контрольные и проверочные работы по Химии для 8 класса Габриелян О.С.
Авторы: Габриелян О.С., Березкин П.Н., Ушакова А.А..
Онлайн решебник контрольные и проверочные работы по Химии для 8 класса Габриелян О.С., Березкин П.Н., Ушакова А.А., гдз и ответы к домашнему заданию.
ГДЗ к учебнику по химии за 8 класс Габриелян О.С. можно скачать здесь.
ГДЗ к рабочей тетради по химии за 8 класс Габриелян О.С. можно скачать здесь.
ГДЗ к тетради для оценки качества знаний по химии за 8 класс Габриелян О.С. можно скачать здесь.
ГДЗ к контрольным и самостоятельным работам по химии за 8 класс Павлова Н.С. можно скачать здесь.
ГДЗ к тетради для лабораторных опытов и практических работ по химии за 8 класс Габриелян О.С. можно скачать здесь.
ГДЗ к контрольным работам по химии за 8 класс Габриелян О.С. можно скачать здесь.
вопросов по химии с несколькими вариантами ответов — тест по химии для 10 класса
Темы по химии для 10-го класса для MCQ
Темы ответов на вопросы по химии 10-го класса:
- Алкены
- Закон действия масс и вывод экспрессии
- РНК
- Решенные упражнения 10-го класса по химии
- Витамин и функции
- Самоионизация воды Шкала pH
- Классификация органических соединений
- Свойства воды
- Экзамен по химии 10-го класса Практический тест
- Углеводы
- Химия: органические соединения
- Алканы
- Константа и единицы равновесия
- Витамины и добавки
- Концепции кислот и равновесий 9000 Реакций и равновесий 000 Динамические загрязнители воздуха000000
- Липиды
- Измерения pH
- Моносахарид
- Загрязнение воды
- Типы жесткости воды
- Использование органических соединений
- Функциональные группы
- Глюкоза
- Белки Химия
- Алкины
- Рабочие листы
- Тропосфера
- Важность витамина
- Тест по химии с ответами
- Источники органических соединений
- Витамины и их характеристики
- Рабочие листы по химии 10 класса
- Основные металлургические операции Витамин Витамин
- Нуклеиновые кислоты
- Климатология
- Загрязнение окружающей среды
- Важность константы равновесия
- Тест по химии в старших классах
- Метеорология
- Органические соединения и химия
- 00080007 Химические вещества, переносимые водой,
- 000
- 0008
- слоев атмосферы
- Факты о витаминах
- MCQ по химии для класса 10
- Химия: шкала pH
- Структура ДНК
- Состав атмосферы
- Проблемы окружающей среды
- Вода и раствор nt
- Концепция кислот и оснований Бренстеда
- Проверьте свои знания о витаминах
- Витамины
- Разрушение озонового слоя
- Алкановые и алкильные радикалы
- Мочевина и их состав
- Кислоты и основания 9000 Наука о атмосфере 9000
- Металлургические операции
- Глобальное потепление
- Основы константы равновесия
- Процесс Сольвея
- Химическая викторина Оценка 10
- Соли: химия для всех
- Методы стратосферы
- 9000 7000 Твердость
- Мальтоза 9000 9000 Твердость
- Жесткая вода
- Химический тест, степень 10
- Недостатки жесткой воды
- Ионосфера
1-й периодический тест, степень 8 (S.Ю. 2019-2020)
перейти к содержанию- Дом
- Новости и обновления
- Департамент общин
- Обновления COVID-19
- Обновление погоды
- Май Пасок Ба?
- Walang Pasok
- Май Пасок
- DepEd News
- Обновления DepEd
- Пресс-релиз
- Официальное заявление
- Объявления
- Напоминания
- LIS и EBEIS
- Новости КНР
- Результаты экзамена
- LET Результат
- Результат основного экзамена
- Экзамен по государственной службе
- Результат экзамена CPA Board
- Результаты экзамена
- DLL
- DLP
- ТГ
- LM
- Загрузки
- Презентации PowerPoint
- Учебные материалы
- Материалы для чтения
- Суммативные тесты
- Периодические испытания
- Диагностические тесты
- Учебные программы
- Задания
- Рабочие тетради
- Руководство для учащихся
- Бюджет работ
- Чтение изображений
- Формы
- Школьные формы
- Файлы RPMS
- Старшая школа
- ресурсов
- О нас
- Рекламируйте с нами
- Внести вклад
- Обратная связь
- Статус сайта
- Видео
- Электронное обучение
- Бухай Гуро
- Бригада Эсквела
- Buhay Estudyante
- выпусков
- Приказ департамента
- Деп. Меморандум
- Выпускные материалы
- Ленты
- Сертификаты
- Дизайн классных комнат
- Руководства
- Руководство SSS
- MS Office
- О нас
- Дом
- Новости и обновления
- Департамент общин
- Обновления COVID-19
- Обновление погоды
- Май Пасок Ба?
- Walang Pasok
- Май Пасок
- DepEd News
- Обновления DepEd
- Пресс-релиз
- Официальное заявление
- Объявления
- Напоминания
- LIS и EBEIS
- Новости КНР
- Результаты экзамена
- LET Результат
- Результат основного экзамена
- Экзамен по государственной службе
- Результат экзамена CPA Board
- Результаты экзамена
- DLL
- DLP
- ТГ
- LM
- Загрузки
- Презентации PowerPoint
- Учебные материалы
- Материалы для чтения
- Суммативные тесты
Обзор финального экзамена по химии — Скачать PDF бесплатно
ХИМИЯ II ЗАКЛЮЧИТЕЛЬНЫЙ ЭКЗАМЕН
Имя Период ХИМИЯ II ЗАКЛЮЧИТЕЛЬНЫЙ ЭКЗАМЕН Заключительный экзамен: примерно 75 вопросов с несколькими вариантами ответов. Раздел 12: Стехиометрия. Разделы 5 и 6: Электронные конфигурации и периодические свойства. Разделы 7 и 8: Связь. Раздел 14: Газ
. Дополнительная информацияIB Химия.Обзор химии DP
DP Chemistry Review Тема 1: Количественная химия 1.1 Концепция молей и константа Авогадро Заявление об оценке Примените концепцию молей к веществам. Определите количество частиц и количество
Дополнительная информацияХимия: химические уравнения
Химия: химические уравнения Напишите сбалансированное химическое уравнение для каждого словесного уравнения.Включите в уравнение фазу каждого вещества. Классифицировать реакцию как синтез, разложение, однократное замещение,
Дополнительная информациянейтроны присутствуют?
Рабочий лист №1 для летних заданий AP Chem. Структура атома 1. a) Для иона 39 K + укажите, сколько электронов, сколько протонов и сколько 19 нейтронов присутствует? б) Какая из этих частиц имеет наименьшее
Дополнительная информацияПРИЛОЖЕНИЕ B: УПРАЖНЕНИЯ
ПРИЛОЖЕНИЕ B: УПРАЖНЕНИЯ Молекулярная масса, моль и массовый процент Относительная атомная и молекулярная масса Относительная атомная масса (A r) — это константа, которая выражает соотношение
Дополнительная информацияW1 МАСТЕРСКАЯ ПО СТОХИОМЕТРИИ
ВВЕДЕНИЕ W1 СЕМИНАР ПО СТОХИОМЕТРИИ Эти заметки и упражнения разработаны, чтобы познакомить вас с основными концепциями, необходимыми для понимания химической формулы или уравнения.Относительные атомные массы
Дополнительная информацияРАСЧЕТ МОЛЕЙ И МОЛЕЙ
35 МОЛЕЙ И МОЛЕЙ КУКУЛЯЦИИ ВВЕДЕНИЕ Цель этого раздела — представить некоторые методы расчета количества каждого реагента, используемого в химической реакции, и количества каждого продукта
Дополнительная информацияБлок 10A Примечания по стехиометрии
Блок 10А. Примечания к стехиометрии. Стехиометрия — это громкое слово для процесса, который химики используют для расчета количеств в реакциях.Он использует соотношение коэффициентов, установленное уравнениями сбалансированной реакции
Дополнительная информацияХимические уравнения и стехиометрия
Химические уравнения и стехиометрия Глава Цели Уравнения баланса для простых химических реакций. Выполните расчеты стехиометрии, используя сбалансированные химические уравнения. Разберитесь в значении термина
Дополнительная информация6 Реакции в водных растворах
6 Реакции в водных растворах. Вода — самая распространенная среда, в которой естественным образом протекают химические реакции.В этом нетрудно убедиться: 70% массы нашего тела составляет вода, а около 70% поверхности —
. Дополнительная информацияСостав ядра. Приоритетный словарь: электрон, протон, нейтрон, ядро, изотопы, атомный номер, атомная масса, элемент, электронная оболочка,
Лейк Каунти, Лейквью, 9 класс, Физические науки, Стандарт Брента Старра: h2P1 Объясните, как атомная структура связана со свойствами элементов и их положением в Периодической таблице.Объясните, как
Дополнительная информацияУчебное пособие к главе 7
Имя: Класс: Дата: ID: Учебное пособие по главе 7 «Множественный выбор». Определите вариант, который лучше всего завершает утверждение или отвечает на вопрос. 1. Число атомов в моль любого чистого вещества
Дополнительная информацияВопросы о летних каникулах
Летние каникулы Вопросы Глава 1 1) Гидроксид бария реагирует с соляной кислотой.Начальная концентрация 1-го раствора — 0,1 М, объем — 100 мл. Начальная концентрация
Дополнительная информацияПроблемы практики склеивания
НАЗВАНИЕ 1. По сравнению с H 2 S, H 2 O имеет более высокое значение 8. Учитывая электронно-точечную диаграмму Льюиса: точка кипения, поскольку H 2 O содержит более сильные металлические связи, ковалентные связи, ионные связи, водородные связи 2. Которая
Дополнительная информацияВыпускной экзамен по химии 151
Химия 151 Название финального экзамена: SSN: Правила и рекомендации для экзаменов Покажите свою работу.Ответ не будет засчитан, если ваша работа не будет показана. Обозначьте свой ответ квадратом или кружком. Все документы должны быть
Дополнительная информацияРаздел 2: Количества в химии
Масса, моль и молярная масса Относительные количества изотопов в природном элементе (%) Например, Углерод имеет 2 изотопа С-12 и С-13. Из двух изотопов углерода содержится 98,9% С-12 и 11,1% С-13. Найдите
Дополнительная информацияAP Глава 1, 2 и 3: Атомы, молекулы и массовые отношения Имя
AP Глава 1, 2 и 3: Атомы, молекулы и массовые отношения Разминка имени (Покажите свою работу для подтверждения) Дата 1.Дата 2. Дата 3. Дата 4. Дата 5. Дата 6. Дата 7. Дата 8. AP Глава 1, 2 и 3: Атомы и молекулы,
Дополнительная информацияПериодическая таблица вопросов
Вопросы о таблице Менделеева 1. Элементы, характеризуемые как неметаллы, расположены в таблице Менделеева в (1) крайнем левом углу; (2) низ; (3) центр; (4) вверху справа. 2. Элемент, который является жидкостью на STP, составляет
Дополнительная информацияГлава 3: Стехиометрия
Глава 3: Стехиометрия Ключевые навыки: Уравновешивание химических уравнений Предсказание продуктов простого сочетания, реакций разложения и горения.Расчет веса формулы Преобразование граммов в моль и
Дополнительная информацияАТОМЫ. Вопросы с множественным выбором
Глава 3 АТОМЫ И МОЛЕКУЛЫ Вопросы с множественным выбором 1. Что из следующего правильно соответствует 360 г воды? (i) 2 моля H 2 0 (ii) 20 моль воды (iii) 6,022 10 23 молекулы воды (iv)
Дополнительная информацияПрактикуйте вопросы с множественным выбором:
Практикуйте вопросы с множественным выбором: 1) Что из перечисленного НЕ является правилом лабораторной безопасности? а) Никогда не смешивайте кислоты с основаниями. б) Собирайте длинные волосы назад. в) Никогда не добавляйте воду
Дополнительная информацияГлава 6 Примечания Наука 10 Название:
6.1 Типы химических реакций a) Синтез (A + B AB) Реакции синтеза также известны как реакции. Когда это происходит, два или более реагента (обычно элементы) соединяются, образуя a. A + B AB, где A и
Дополнительная информацияГЛАВА 6 Химическая связь
ГЛАВА 6 Химическая связь РАЗДЕЛ 1 Введение в химическую связь ЦЕЛИ 1.


 1
1
 6
6
 3.
3.
 1; 2.1,2.3, 3.1
1; 2.1,2.3, 3.1
 1; 1.2; 1.3, 1.4, 2.3, 3.2
1; 1.2; 1.3, 1.4, 2.3, 3.2

 7, 2.3,2.4,2.5, 3.3
7, 2.3,2.4,2.5, 3.3
 Соотнести с отметкой учителя, прокомментировать результат выполнения задания.
Соотнести с отметкой учителя, прокомментировать результат выполнения задания.
 2
2
 4.
4.
 3
3
 6
6
 4
4
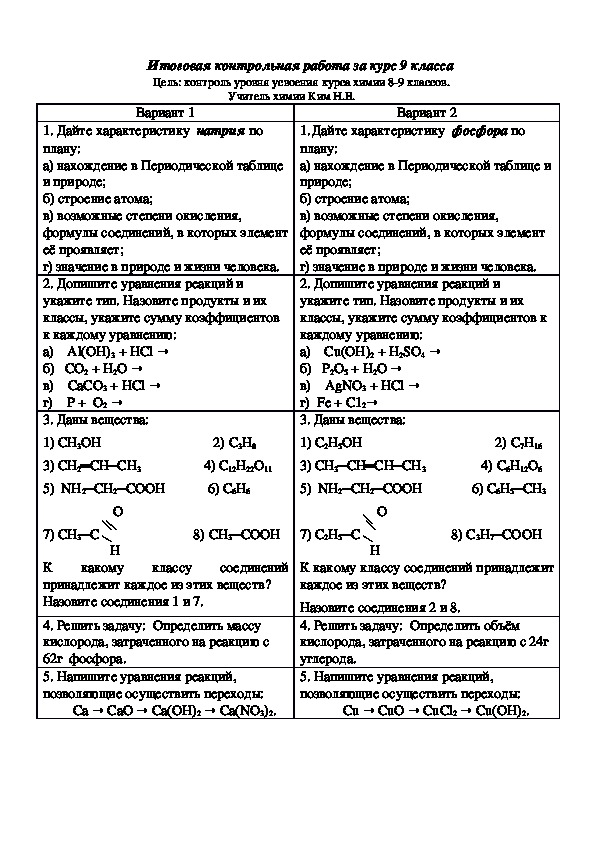 1
1
 6
6
 2
2