Контрольные работы к учебнику О. С. Габриеляна «Химия – 8»
Контрольные работы
ХИМИЯ
К учебнику О. С. Габриеляна «Химия – 8»
8 класс
2014
Контрольные работы
ХИМИЯ
К учебнику О. С. Габриеляна «Химия – 8»
8 класс
2014
Галиева О.В.
Химия. 8* класс: Контрольные работы к учебнику О. С. Габриеляна «Химия – 8»
Пособие состоит из текстов контрольных работ в тестовой форме в параметрах ЕГЭ, соответствующих программе химии для 8 класса О. С. Габриеляна. Оно предназначено для проведения на уроках тематического и итогового контроля по основным темам курса.
Содержание
Контрольная работа № 1 Атомы химических элементов………………….………………………. 5
Вариант 1…………………………………………………………………………………………………5
Вариант 2…………………………………………………………………………………………………7
Вариант 3 …………………………………………………….……………………..……………………9
Вариант 4………………………………………………………………………………..………………11
Контрольная работа № 2 Простые вещества. Количественные соотношения………………..13
Вариант 1……………………………………………………………..…………………………………13
Вариант 2………………………………………………………………………………………………..15
Вариант 3 ……………………………………………………………………………………………….17
Вариант 4………………………………………………………………………………………..………19
Контрольная работа № 3 Соединения химических элементов……………………..……………21
Вариант 1………………………………………………………………………………………………..21
Вариант 2…………………………………………………………………………………..……………23
Вариант 3 ……………………………………………………………………………………………….25
Вариант 4………………………………………………………………………………………………..27
Контрольная работа № 4 Изменения, происходящие с веществами…………………….……..29
Вариант 1……………………………………………………….…………………………………….…29
Вариант 2………………………………………………………………………………………………..31
Вариант 3 ……………………………………………………………………………………………….33
Вариант 4………………………………………………………………………….…………………….35
Контрольная работа № 5 Классы неорганических соединений…………………………………37
Вариант 1…………………………………………………………………….……….…………………37
Вариант 2………………………………………………………………………………………………..39
Вариант 3 ……………………………………………………………………………………………….41
Вариант 4………………………………………………………………………………………………..43
Контрольная работа № 6 Итоговая контрольная работа за курс 8 класса……………………45
Вариант 1…………………………………………………………………………………………..……45
Вариант 2………………………………………………………………………………………………..47
Вариант 3 ……………………………………………………………………………………………….49
Вариант 4…………………………………………………………………………………………….….51
Приложения…………………………………………………………………………………………….53
Ответы…………………………………………………………………………………………………..55
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 45 минут. Работа состоит из 2 частей и включает 10 заданий.
Часть 1 включает 9 заданий с кратким ответом. К заданиям 1 – 6 дается 4 варианта ответа, из которых только один правильный. За каждый правильный ответ дается 1 балл. Максимальный балл — 6.
Задания 7 — 9 повышенного уровня, на которые надо дать краткий ответ в виде числа или последовательности цифр. За каждый правильный ответ ты получишь 2 балла. Максимальный балл – 6.
Часть 2 содержит 1 наиболее сложное, объемное задание, которое требует полного ответа. За правильное выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Постарайся набрать наибольшее количество баллов. Максимальный первичный балл – 15 баллов.
Система оценивания работы.
0 – 6 баллов – «2» 7 – 10 баллов – «3» 11 – 13 баллов – «4» 14 – 15 баллов – «5»
Контрольная работа № 1
Атомы химических элементов
ВАРИАНТ-1
Часть 1
Ответом к заданиям 1- 6 является одна цифра. Запиши ответ в БЛАНК ОТВЕТОВ справа от номера соответствующего задания, начиная с первой клеточки.
1. Элемент третьего периода главной подгруппы III группы ПСХЭ — это:
1) алюминий
3) магний
2) бериллий
4) бор
2. Обозначение изотопа, в ядре которого содержится 8 протонов и 10 нейтронов:
1) 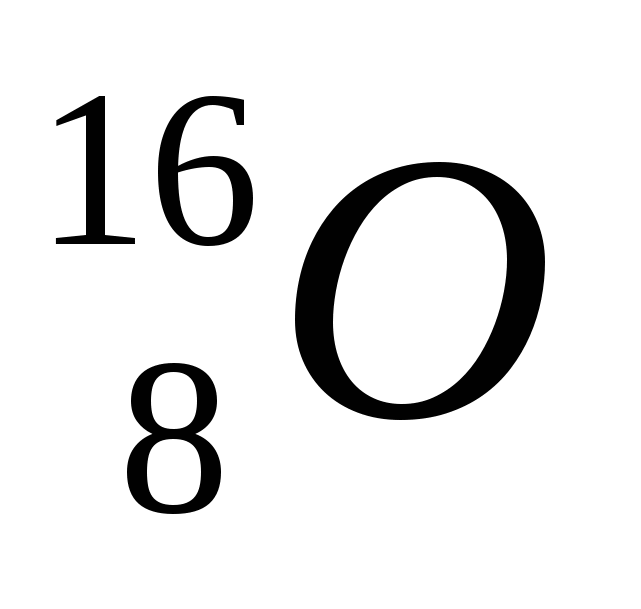
3) 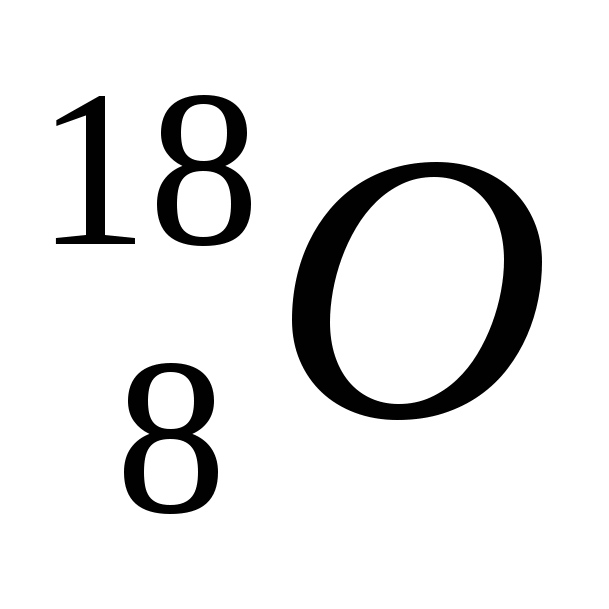
2) 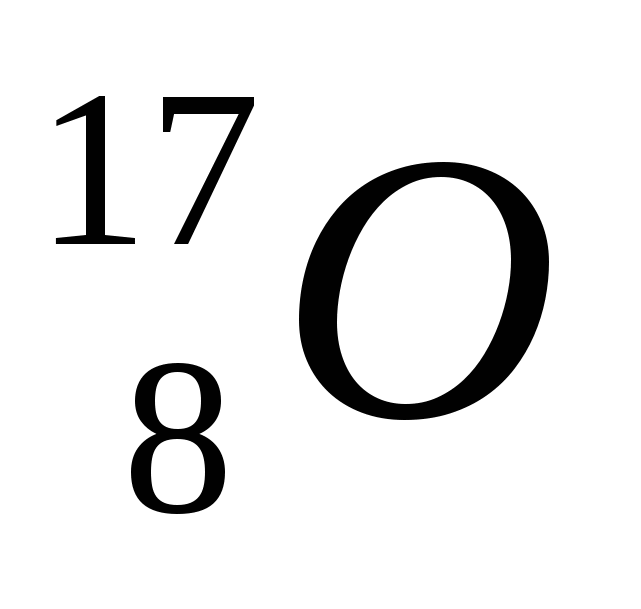
4) 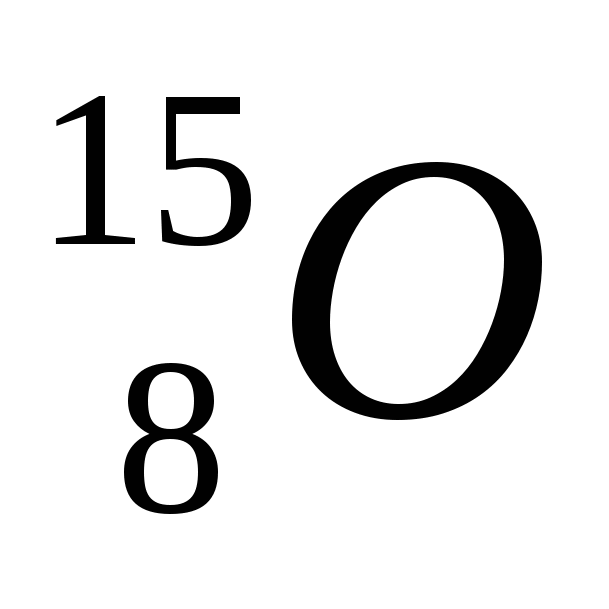
3. Атом химического элемента, электронная оболочка которого содержит 17 электронов:
1) кислород
3) хлор
2) сера
4) фтор
4. Два электронных слоя (энергетических уровня) имеет атом:
1) азота
3) калия
2) магния
4) гелия
5. Пара химических элементов, имеющих на внешнем электронном уровне по 5 электронов:
1) P и С
3) Si и Са
2) С и Si
4) N и P
6. Верны ли следующие высказывания?
А. В периоде металлические свойства атомов элементов с увеличением порядкового номера усиливаются.
Б. В периоде металлические свойства атомов элементов с увеличением порядкового номера ослабевают.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
В задании 7 к каждому элементу первого столбца подберите соответствующий элемент второго столбца и запишите в таблицу на черновике выбранные цифры под соответствующими буквами. Получившуюся последовательность цифр перенесите в БЛАНК ОТВЕТОВ без пробелов, запятых и других дополнительных символов. Цифры в ответе могут повторяться
Частица:
Распределение электронов:
А) Ca
1) 2е, 8е, 8е, 2е
Б) Al3+
2) 2е, 8е, 2е
В) N3-
3) 2е, 5е
Г) N
4) 2е, 8е, 3е
5) 2е, 8е,18е,4е
6) 2е, 8е
А
Б
В
Г
Ответом к заданию 8 является последовательность трёх цифр, которые соответствуют номерам правильных ответов. Запишите эти цифры в порядке возрастания
8. Соединениями с ионной связью являются:
1) NH3
3) BaCl2
5) ZnS
2) CO2
4) Al I3
6) O2
Ответом к заданию 9 является число. Запишите это число в БЛАНК ОТВЕТОВ без указания единиц измерения с точностью до целых
9. Относительная молекулярная масса хлорида бария BaCl2 равна __________.
Часть 2
Запишите номер задания и полное решение
10. Дайте характеристику элемента c Z = 11 (Приложение 1, пункты I (1-5), II (1-3, 6, 7), V(1,2)). Запишите схему строения его иона Na+.
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 45 минут. Работа состоит из 2 частей и включает 10 заданий.
Часть 1 включает 9 заданий с кратким ответом. К заданиям 1 – 6 дается 4 варианта ответа, из которых только один правильный. За каждый правильный ответ дается 1 балл. Максимальный балл — 6.
Задания 7 — 9 повышенного уровня, на которые надо дать краткий ответ в виде числа или последовательности цифр. За каждый правильный ответ ты получишь 2 балла. Максимальный балл – 6.
Часть 2 содержит 1 наиболее сложное, объемное задание, которое требует полного ответа. За правильное выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Постарайся набрать наибольшее количество баллов. Максимальный первичный балл – 15 баллов.
Система оценивания работы.
0 – 6 баллов – «2» 7 – 10 баллов – «3» 11 – 13 баллов – «4» 14 – 15 баллов – «5»
Контрольная работа № 1
Атомы химических элементов
ВАРИАНТ-2
Часть 1
Ответом к заданиям 1- 6 является одна цифра. Запиши ответ в БЛАНК ОТВЕТОВ справа от номера соответствующего задания, начиная с первой клеточки.
1. Элемент второго периода главной подгруппы III группы ПСХЭ — это:
1) литий
3) кальций
2) бор
4) магний
2. Обозначение изотопа, в ядре которого содержится 26 протонов и 30 нейтронов:
1) 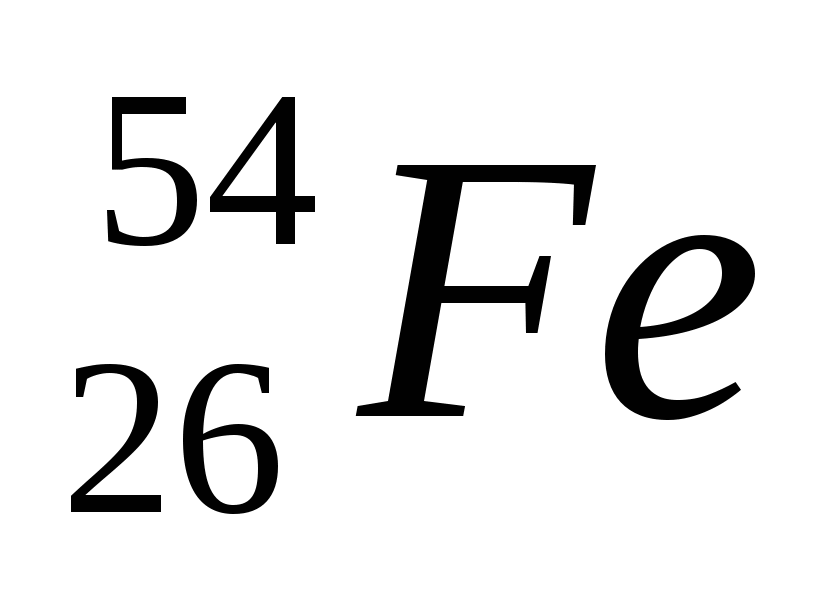
3)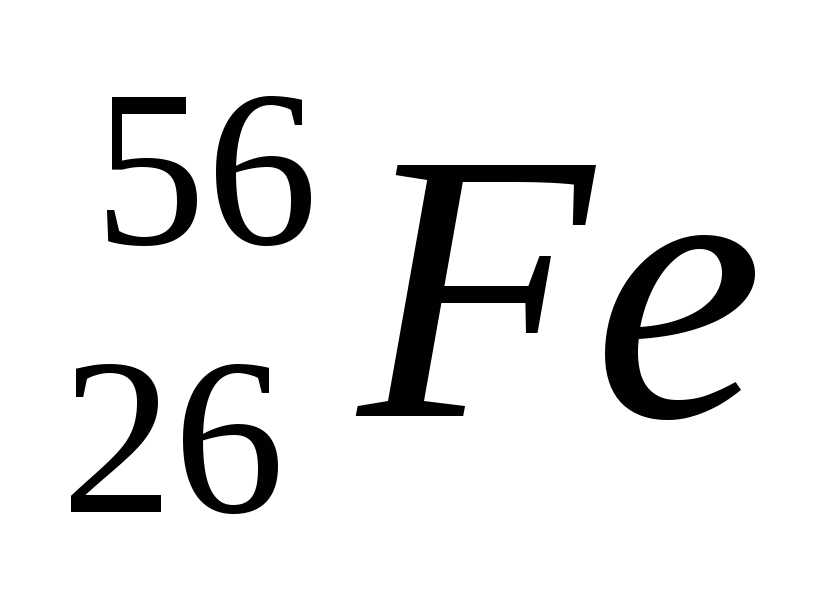
2)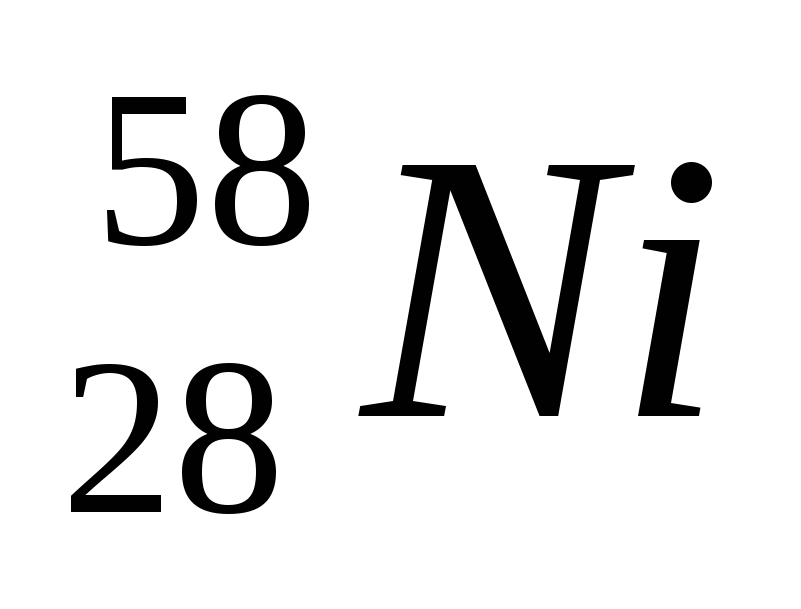
4)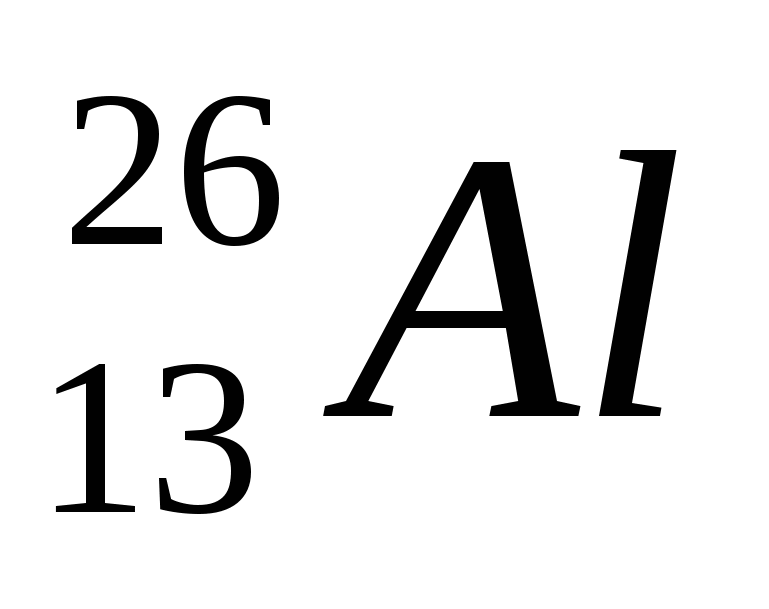
3. Атом химического элемента, ядро которого содержит 14 протонов — это:
1) азот
3) калий
2) кремний
4) цинк
4. Три электронных слоя (энергетических уровня) имеет атом:
1) бора
3) фтора
2) кальция
4) серы
5. Пара химических элементов, имеющих на внешнем электронном уровне по 3 электрона:
1) Mg и Al
3) N и S
2) O и S
4) B и Al
6. Верны ли следующие высказывания?
А. В главной подгруппе неметаллические свойства атомов элементов с увеличением порядкового номера усиливаются.
Б. В главной подгруппе неметаллические свойства атомов элементов с увеличением порядкового номера ослабевают.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
В задании 7 к каждому элементу первого столбца подберите соответствующий элемент второго столбца и запишите в таблицу на черновике выбранные цифры под соответствующими буквами. Получившуюся последовательность цифр перенесите в БЛАНК ОТВЕТОВ без пробелов, запятых и других дополнительных символов. Цифры в ответе могут повторяться
7. Установите соответствие между частицей и распределением электронов по энергетическим уровням:
Частица:
Распределение электронов:
А) Mg
1) 2е, 8е, 7е
Б) K
2) 2е, 8е, 2е
В) Na+
3) 2е, 7е
Г) Cl —
4) 2е, 8е, 8е
5) 2е, 8е
6) 2е, 8е, 8е,1е
А
Б
В
Г
Ответом к заданию 8 является последовательность трёх цифр, которые соответствуют номерам правильных ответов. Запишите эти цифры в порядке возрастания в БЛАНК ОТВЕТОВ справа от номера соответствующего задания, начиная с первой клеточки, без пробелов, запятых и других дополнительных символов.
8. Соединениями с ковалентной полярной связью являются:
1) NH3
3) BaCl2
5) O2
2) CO2
4) H2S
6) ZnS
Ответом к заданию 9 является число. Запишите это число в БЛАНК ОТВЕТОВ без указания единиц измерения с точностью до целых
9. Относительная молекулярная масса оксида алюминия Al2O3 равна _______.
Часть 2
Запишите номер задания и полное решение
10. Дайте характеристику элемента c Z = 16 (Приложение 1, пункты I (1-5), II (1-3, 6, 7), V(1,2)). Запишите схему строения его иона S2-.
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 45 минут. Работа состоит из 2 частей и включает 10 заданий.
Часть 1 включает 9 заданий с кратким ответом. К заданиям 1 – 6 дается 4 варианта ответа, из которых только один правильный. За каждый правильный ответ дается 1 балл. Максимальный балл — 6.
Задания 7 — 9 повышенного уровня, на которые надо дать краткий ответ в виде числа или последовательности цифр. За каждый правильный ответ ты получишь 2 балла. Максимальный балл – 6.
Часть 2 содержит 1 наиболее сложное, объемное задание, которое требует полного ответа. За правильное выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Постарайся набрать наибольшее количество баллов. Максимальный первичный балл – 15 баллов.
Система оценивания работы.
0 – 6 баллов – «2» 7 – 10 баллов – «3» 11 – 13 баллов – «4» 14 – 15 баллов – «5»
Контрольная работа № 1
Атомы химических элементов
ВАРИАНТ-3
Часть 1
Ответом к заданиям 1- 6 является одна цифра. Запиши ответ в БЛАНК ОТВЕТОВ справа от номера соответствующего задания, начиная с первой клеточки.
1. Элемент третьего периода главной подгруппы V группы ПСХЭ — это:
1) азот
3) фосфор
2) алюминий
4) углерод
2. Атом химического элемента, имеющий в своем составе 9 протонов, 10 нейтронов, 9 электронов:
1) бор
3) фтор
2) бериллий
4) калий
3. Атом химического элемента, электронная оболочка которого содержит 10 электронов:
1) кальций
3) неон
2) фтор
4) бор
4. Четыре электронных слоя (энергетических уровня) имеет атом:
1) железа
3) углерода
2) бария
4) аргона
5. Пара химических элементов, имеющих на внешнем электронном уровне по 4 электрона:
1) углерод и кремний
3) азот и углерод
2) азот и фосфор
4) калий и кальций
6. Верны ли следующие высказывания?
А. В периоде неметаллические свойства атомов элементов с увеличением порядкового номера не изменяются.
Б. В периоде неметаллические свойства атомов элементов с увеличением порядкового номера ослабевают.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
В задании 7 к каждому элементу первого столбца подберите соответствующий элемент второго столбца и запишите в таблицу на черновике выбранные цифры под соответствующими буквами. Получившуюся последовательность цифр перенесите в БЛАНК ОТВЕТОВ без пробелов, запятых и других дополнительных символов. Цифры в ответе могут повторяться
7. Установите соответствие между частицей и распределением электронов по энергетическим уровням:
Частица:
Распределение электронов:
А) C4+
1) 2е, 6е
Б) Li
2) 2е, 1е
В) O
3) 2е, 8е, 3е
Г) S2-
4) 2е, 8е, 8е,1е
5) 2е, 8е, 8е
6) 2е
А
Б
В
Г
Ответом к заданию 8 является последовательность трёх цифр, которые соответствуют номерам правильных ответов. Запишите эти цифры в порядке возрастания в БЛАНК ОТВЕТОВ справа от номера соответствующего задания, начиная с первой клеточки, без пробелов, запятых и других дополнительных символов.
8. Соединениями с ионной связью являются:
1) NaCl
3) K
5) CuO
2) H2
4) ZnI2
6) HCl
Ответом к заданию 9 является число. Запишите это число в БЛАНК ОТВЕТОВ без указания единиц измерения с точностью до десятых.
9. Относительная молекулярная масса нитрата калия KNO3 равна __________.
Часть 2
Запишите номер задания и полное решение
10. Дайте характеристику элемента c Z = 14 (Приложение 1, пункты I (1-5), II (1-3, 6, 7), V(1,2)). Запишите схему строения его иона Si 4+.
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 45 минут. Работа состоит из 2 частей и включает 10 заданий.
Часть 1 включает 9 заданий с кратким ответом. К заданиям 1 – 6 дается 4 варианта ответа, из которых только один правильный. За каждый правильный ответ дается 1 балл. Максимальный балл — 6.
Задания 7 — 9 повышенного уровня, на которые надо дать краткий ответ в виде числа или последовательности цифр. За каждый правильный ответ ты получишь 2 балла. Максимальный балл – 6.
Часть 2 содержит 1 наиболее сложное, объемное задание, которое требует полного ответа. За правильное выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Постарайся набрать наибольшее количество баллов. Максимальный первичный балл – 15 баллов.
Система оценивания работы.
0 – 6 баллов – «2» 7 – 10 баллов – «3» 11 – 13 баллов – «4» 14 – 15 баллов – «5»
Контрольная работа № 1
Атомы химических элементов
ВАРИАНТ-4
Часть 1
Ответом к заданиям 1- 6 является одна цифра. Запиши ответ в БЛАНК ОТВЕТОВ справа от номера соответствующего задания, начиная с первой клеточки.
1. Элемент четвертого периода главной подгруппы II группы ПСХЭ — это:
1) натрий
3) калий
2) кальций
4) углерод
2. Атом химического элемента, имеющий в своем составе 15 протонов, 16 нейтронов, 15 электронов:
1) кислород
3) фтор
2) цинк
4) фосфор
3. Атом химического элемента, ядро которого содержит 24 протона — это:
1) хром
3) медь
2) магний
4) криптон
4. Пять электронных слоев (энергетических уровней) имеет атом:
1) брома
3) мышьяка
2) йода
4) бора
5. Пара химических элементов, имеющих на внешнем электронном уровне по 7 электронов:
1) кремний и фосфор
3) хлор и йод
2) азот и фосфор
4) серебро и кадмий
6. Верны ли следующие высказывания?
А. В главной подгруппе радиус атомов элементов с увеличением порядкового номера увеличивается.
Б. В главной подгруппе радиус атомов элементов с увеличением порядкового номера уменьшается.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
В задании 7 к каждому элементу первого столбца подберите соответствующий элемент второго столбца и запишите в таблицу на черновике выбранные цифры под соответствующими буквами. Получившуюся последовательность цифр перенесите в БЛАНК ОТВЕТОВ без пробелов, запятых и других дополнительных символов. Цифры в ответе могут повторяться
7. Установите соответствие между частицей и распределением электронов по энергетическим уровням:
Частица:
Распределение электронов:
А) S
1) 2е, 8е, 7е
Б) Ca2+
2) 2е, 8е, 4е
В) О2-
3) 2е, 8е
Г) Si
4) 2е, 8е, 6е
5) 2е
6) 2е, 8е, 8е
А
Б
В
Г
Ответом к заданию 8 является последовательность трёх цифр, которые соответствуют номерам правильных ответов. Запишите эти цифры в порядке возрастания в БЛАНК ОТВЕТОВ справа от номера соответствующего задания, начиная с первой клеточки, без пробелов, запятых и других дополнительных символов.
8. Соединениями с ковалентной неполярной связью являются:
1) H2
3) Cl2
5) KCl
2) SO2
4) Na
6) C
Ответом к заданию 9 является число. Запишите это число в БЛАНК ОТВЕТОВ без указания единиц измерения с точностью до десятых.
9. Относительная молекулярная масса сульфата натрия Na2SO4 равна _________.
Часть 2
Запишите номер задания и полное решение
10. Дайте характеристику элемента c Z = 20 (Приложение 1, пункты I (1-5), II (1-3, 6, 7), V(1,2)). Запишите схему строения его иона Ca 2+.
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 45 минут. Работа состоит из 2 частей и включает 10 заданий.
Часть 1 включает 9 заданий с кратким ответом. К заданиям 1 – 6 дается 4 варианта ответа, из которых только один правильный. За каждый правильный ответ дается 1 балл. Максимальный балл — 6.
Задания 7 — 9 повышенного уровня, на которые надо дать краткий ответ в виде числа или последовательности цифр. За каждый правильный ответ ты получишь 2 балла. Максимальный балл – 6.
Часть 2 содержит 1 наиболее сложное, объемное задание, которое требует полного ответа. За правильное выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Постарайся набрать наибольшее количество баллов. Максимальный первичный балл – 15 баллов.
Система оценивания работы.
0 – 6 баллов – «2» 7 – 10 баллов – «3» 11 – 13 баллов – «4» 14 – 15 баллов – «5»
Контрольная работа № 2
Простые вещества. Количественные соотношения
ВАРИАНТ-1
Часть 1
Ответом к заданиям 1- 6 является одна цифра. Запиши ответ в БЛАНК ОТВЕТОВ справа от номера соответствующего задания, начиная с первой клеточки.
1. Больше металлических свойств проявляет:
1) магний
3) алюминий
2) натрий
4) железо
2. Аллотропная модификация кислорода:
1) графит
3) озон
2) белый фосфор
4) алмаз
3. Атому элемента, образующему простое вещество — металл, соответствует электронная схема:
1) +18Э)2)8)8
3) +3Э)2)1
2) +15Э)2)8)5
4) +8Э)2)6
4. Запись 3О2 означает:
1) 2 молекулы кислорода
3) 5 атомов кислорода
2) 3 молекулы кислорода
4) 6 атомов кислорода
5. Химическая связь является ковалентной неполярной в веществе:
1) железо
3) вода
2) хлор
4) соляная кислота
6. Верны ли следующие высказывания?
А. При нормальных условиях ртуть жидкая.
Б. При нормальных условиях ртуть твердая.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Ответом к заданиям 7- 9 является число. Запишите это число в БЛАНК ОТВЕТОВ без указания единиц измерения с точностью до десятых.
7. Масса 3 моль сероводорода Н2S равна ________г.
8. Количество вещества углекислого газа СO2, в котором содержится 36•1023 молекул, равно_____ моль.
9. Объем, который занимает 2 моль газообразного вещества с формулой SO2 (н.у.) равен ____л.
Часть 2
Запишите номер задания и полное решение
10. Рассчитайте объем для 160 г кислорода O2.
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 45 минут. Работа состоит из 2 частей и включает 10 заданий.
Часть 1 включает 9 заданий с кратким ответом. К заданиям 1 – 6 дается 4 варианта ответа, из которых только один правильный. За каждый правильный ответ дается 1 балл. Максимальный балл — 6.
Задания 7 — 9 повышенного уровня, на которые надо дать краткий ответ в виде числа или последовательности цифр. За каждый правильный ответ ты получишь 2 балла. Максимальный балл – 6.
Часть 2 содержит 1 наиболее сложное, объемное задание, которое требует полного ответа. За правильное выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Постарайся набрать наибольшее количество баллов. Максимальный первичный балл – 15 баллов.
Система оценивания работы.
0 – 6 баллов – «2» 7 – 10 баллов – «3» 11 – 13 баллов – «4» 14 – 15 баллов – «5»
Контрольная работа № 2
Простые вещества. Количественные соотношения
ВАРИАНТ-2
Часть 1
Ответом к заданиям 1- 6 является одна цифра. Запиши ответ в БЛАНК ОТВЕТОВ справа от номера соответствующего задания, начиная с первой клеточки.
1. Больше неметаллических свойств проявляет:
1) углерод
3) фтор
2) азот
4) кислород
2. Аллотропная модификация углерода:
1) озон
3) красный фосфор
2) сера кристаллическая
4) алмаз
3. Атому элемента, образующему простое вещество — неметалл, соответствует электронная схема:
1) +11Э)2)8)1
3) +12Э)2)8)2
2) +8Э)2)6
4) +4Э)2)2
4. Запись 5N2 означает:
1) 2 молекулы азота
3) 7 атомов азота
2) 5 молекул азота
4) 10 атомов азота
5. Химическая связь является металлической в веществе:
1) кислород
3) сульфид железа
2) алюминий
4) оксид калия
6. Верны ли следующие высказывания?
А. При нормальных условиях озон жидкий.
Б. При нормальных условиях озон твердый.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Ответом к заданиям 7- 9 является число. Запишите это число в БЛАНК ОТВЕТОВ без указания единиц измерения с точностью до десятых.
7. Масса 2 ммоль углекислого газа СО2 равна __________ мг:
8. Количество вещества воды, в котором содержится 12•1023 молекул, равно_____ моль.
9. 3 моль кислорода О2 (н.у.) занимают объем ____л.
Часть 2
Запишите номер задания и полное решение
10. Сколько молекул содержат 140 г азота N2?
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 45 минут. Работа состоит из 2 частей и включает 10 заданий.
Часть 1 включает 9 заданий с кратким ответом. К заданиям 1 – 6 дается 4 варианта ответа, из которых только один правильный. За каждый правильный ответ дается 1 балл. Максимальный балл — 6.
Задания 7 — 9 повышенного уровня, на которые надо дать краткий ответ в виде числа или последовательности цифр. За каждый правильный ответ ты получишь 2 балла. Максимальный балл – 6.
Часть 2 содержит 1 наиболее сложное, объемное задание, которое требует полного ответа. За правильное выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Постарайся набрать наибольшее количество баллов. Максимальный первичный балл – 15 баллов.
Система оценивания работы.
0 – 6 баллов – «2» 7 – 10 баллов – «3» 11 – 13 баллов – «4» 14 – 15 баллов – «5»
Контрольная работа № 2
Простые вещества. Количественные соотношения
ВАРИАНТ-3
Часть 1
Ответом к заданиям 1- 6 является одна цифра. Запиши ответ в БЛАНК ОТВЕТОВ справа от номера соответствующего задания, начиная с первой клеточки.
1. Больше металлических свойств проявляет:
1) литий
3) калий
2) рубидий
4) натрий
2. Аллотропная модификация фосфора:
1) кислород
3) красный фосфор
2) алмаз
4) карбин
3. Атому элемента, образующему простое вещество — металл, соответствует электронная схема:
1) +16Э)2)8)6
3) +12Э)2)8)2
2) +14Э)2)8)4
4) +10Э)2)8
4. Запись 4N означает:
1) 4 молекулы азота
3) 4 атома азота
2) 2 молекулы азота
4) 4 атома натрия
5. Химическая связь является ковалентной неполярной в веществе:
1) вода
3) цинк
2) кислород
4) поваренная соль
6. Верны ли следующие высказывания?
А. При нормальных условиях сера твердая.
Б. При нормальных условиях сера газообразная.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Ответом к заданиям 7- 9 является число. Запишите это число в БЛАНК ОТВЕТОВ без указания единиц измерения с точностью до десятых.
7. Масса 3 кмоль воды равна _______________кг.
8. Количество вещества алюминия, в котором содержится 24•1023 атомов, равно_____ моль.
9. 4 кмоль хлора C12 (н.у.) занимают объем _____м3. (Запишите число с точностью до десятых).
Часть 2
Запишите номер задания и полное решение
10. Рассчитайте объем для 20 г водорода (н. у.).
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 45 минут. Работа состоит из 2 частей и включает 10 заданий.
Часть 1 включает 9 заданий с кратким ответом. К заданиям 1 – 6 дается 4 варианта ответа, из которых только один правильный. За каждый правильный ответ дается 1 балл. Максимальный балл — 6.
Задания 7 — 9 повышенного уровня, на которые надо дать краткий ответ в виде числа или последовательности цифр. За каждый правильный ответ ты получишь 2 балла. Максимальный балл – 6.
Часть 2 содержит 1 наиболее сложное, объемное задание, которое требует полного ответа. За правильное выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Постарайся набрать наибольшее количество баллов. Максимальный первичный балл – 15 баллов.
Система оценивания работы.
0 – 6 баллов – «2» 7 – 10 баллов – «3» 11 – 13 баллов – «4» 14 – 15 баллов – «5»
Контрольная работа № 2
Простые вещества. Количественные соотношения
ВАРИАНТ-4
Часть 1
Ответом к заданиям 1- 6 является одна цифра. Запиши ответ в БЛАНК ОТВЕТОВ справа от номера соответствующего задания, начиная с первой клеточки.
1. Больше неметаллических свойств проявляет:
1) азот
3) мышьяк
2) фосфор
4) кремний
2. Аллотропная модификация олова:
1) графит
3) озон
2) алмаз
4) серое олово
3. Атому элемента, образующему простое вещество — неметалл, соответствует электронная схема:
1) +13Э)2)8)3
3) +9Э)2)7
2) +12Э)2)8)2
4) +3Э)2)1
4. Запись 6Н означает:
1) 6 молекул водорода
3) 6 атомов водорода
2) 3 молекулы водорода
4) 6 атомов гелия
5. Химическая связь является металлической в веществе:
1) озон
3) железо
2) графит
4) оксид натрия
6. Верны ли следующие высказывания?
А. При нормальных условиях азот твердый.
Б. При нормальных условиях азот газообразный.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Ответом к заданиям 7- 9 является число. Запишите это число в БЛАНК ОТВЕТОВ без указания единиц измерения с точностью до десятых.
7. Масса 5 моль аммиака NН3 равна __________ г:
8. Количество вещества сернистого газа SO2, в котором содержится 3•1023 молекул, равно _____моль.
9. 2 кмоль газа метана СН4 занимают объем (н.у.)____м3.
Часть 2
Запишите номер задания и полное решение
10. Сколько молекул содержит 44,8 л сероводорода H2S (н.у.)?
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 45 минут. Работа состоит из 2 частей и включает 10 заданий.
Часть 1 включает 9 заданий с кратким ответом. К заданиям 1 – 6 дается 4 варианта ответа, из которых только один правильный. За каждый правильный ответ дается 1 балл. Максимальный балл — 6.
Задания 7 — 9 повышенного уровня, на которые надо дать краткий ответ в виде числа или последовательности цифр. За каждый правильный ответ ты получишь 2 балла. Максимальный балл – 6.
Часть 2 содержит 1 наиболее сложное, объемное задание, которое требует полного ответа. За правильное выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Постарайся набрать наибольшее количество баллов. Максимальный первичный балл – 15 баллов.
Система оценивания работы.
0 – 6 баллов – «2» 7 – 10 баллов – «3»
11 – 13 баллов – «4» 14 – 15 баллов – «5»
Контрольная работа № 3
Соединения химических элементов
ВАРИАНТ -1
Часть 1
Ответом к заданиям 1- 6 является одна цифра. Запиши ответ в БЛАНК ОТВЕТОВ справа от номера соответствующего задания, начиная с первой клеточки.
1. Смесью веществ в отличие от чистого вещества является:
1) алюминий 3) магний.
2) водопроводная вода 4) углекислый газ
2. Ряд формул, в котором все вещества – оксиды:
1) SO3, MgO, CuO 3) ZnO, ZnCl2, H2O.
2) KOH, K2O, MgO 4) H2SO4, Al2O3, HCl
3. Азот проявляет наибольшую степень окисления в соединении с формулой:
1) NO2 3) NH3
2) NO 4) N2O5
4. Формула сульфата железа (III):
1) FeS 3) Fe2 (SO4)3
2) FeSO4 4) Fe2(SO3)3
5. В 80г воды растворили 20г соли. Массовая доля соли в полученном растворе равна:
1) 40% 2) 25% 3) 50% 4) 20%
6. Верны ли следующие высказывания?
А. В состав оснований входит ион металла.
Б. В состав оснований входит кислотный остаток.
1) верно только А 3) верно только Б
2) верны оба суждения 4) оба суждения не верны
В задании 7 к каждому элементу первого столбца подберите соответствующий элемент второго столбца и запишите в таблицу на черновике выбранные цифры под соответствующими буквами. Получившуюся последовательность цифр перенесите в БЛАНК ОТВЕТОВ без пробелов, запятых и других дополнительных символов. Цифры в ответе могут повторяться
7. Установите соответствие между названием вещества и формулой соединения:
Название вещества: Формула соединения:
А) Оксид алюминия
Б) Серная кислота
В) Гидроксид алюминия
Г) Сульфат алюминия
1) Al(OH)3
2) Al2 (SO4)3
3) AlО
4) Al2O3
5) H2SO4
6) H2SO3
А
Б
В
Г
Ответом к заданию 8 является последовательность трёх цифр, которые соответствуют номерам правильных ответов. Запишите эти цифры в порядке возрастания в БЛАНК ОТВЕТОВ справа от номера соответствующего задания, начиная с первой клеточки, без пробелов, запятых и других дополнительных символов.
8. К кислотам относятся:
1) H2CO3
2) Fe(OH)2
3) H2SiO3
4) Hg(NO3)2
5) HCl
6) SO2
Ответом к заданию 9 является число. Запишите это число в БЛАНК ОТВЕТОВ без указания единиц измерения с точностью до десятых.
9. Массовая доля кислорода в серной кислоте равна ________(%)
Часть 2
Запишите номер задания и полное решение
10. Рассчитайте объем кислорода, полученного из 200л воздуха, если известно, что объемная доля кислорода в воздухе составляет 21%?
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 45 минут. Работа состоит из 2 частей и включает 10 заданий.
Часть 1 включает 9 заданий с кратким ответом. К заданиям 1 – 6 дается 4 варианта ответа, из которых только один правильный. За каждый правильный ответ дается 1 балл. Максимальный балл — 6.
Задания 7 — 9 повышенного уровня, на которые надо дать краткий ответ в виде числа или последовательности цифр. За каждый правильный ответ ты получишь 2 балла. Максимальный балл – 6.
Часть 2 содержит 1 наиболее сложное, объемное задание, которое требует полного ответа. За правильное выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Постарайся набрать наибольшее количество баллов. Максимальный первичный балл – 15 баллов.
Система оценивания работы.
0 – 6 баллов – «2» 7 – 10 баллов – «3»
11 – 13 баллов – «4» 14 – 15 баллов – «5»
Контрольная работа № 3
Соединения химических элементов
ВАРИАНТ -2
Часть 1
Ответом к заданиям 1- 6 является одна цифра. Запиши ответ в БЛАНК ОТВЕТОВ справа от номера соответствующего задания, начиная с первой клеточки.
1. Чистое вещество в отличие от смеси — это:
1) морская вода 3) кислород
2) воздух 4) молоко
2. Ряд формул, в котором все вещества – основания:
1) СuOH, CuCl2, NaOH. 3) Ca(OH)2, Mg(OH)2, MgOHCl.
2) K2O, HCl, Ca(OH)2 4) KOH, Ba(OH)2, Cu(OH)2
3.Углерод проявляет наименьшую степень окисления в соединении с формулой:
1) СаСО3 2) СH4 3) СO2 4) СO
4.Формула хлорида меди (II):
1) CuCl 2) Cu(NO3)2 3) CuCl2 4) CuSO4
5. В 180г воды растворили 20г хлорида натрия. Массовая доля соли в полученном растворе равна:
1) 15% 2) 20% 3) 30% 4) 10%
6. Верны ли следующие высказывания?
А. В состав кислот входит ион водорода.
Б. В состав кислот входит кислотный остаток.
1) верно только А 3) верно только Б
2) верны оба суждения 4) оба суждения не верны
В задании 7 к каждому элементу первого столбца подберите соответствующий элемент второго столбца и запишите в таблицу на черновике выбранные цифры под соответствующими буквами. Получившуюся последовательность цифр перенесите в БЛАНК ОТВЕТОВ без пробелов, запятых и других дополнительных символов. Цифры в ответе могут повторяться
7. Установите соответствие между названием вещества и формулой соединения:
Название вещества: Формула соединения:
А) Оксид магния 1) MnCl2
Б) Соляная кислота 2) Mg(OH)2
В) Гидроксид магния 3) HF
Г) Хлорид магния 4) HCl
5) MgCl2
6) MgO
А
Б
В
Г
Ответом к заданию 8 является последовательность трёх цифр, которые соответствуют номерам правильных ответов. Запишите эти цифры в порядке возрастания в БЛАНК ОТВЕТОВ справа от номера соответствующего задания, начиная с первой клеточки, без пробелов, запятых и других дополнительных символов.
8. К солям относятся:
1) H2CO3
2) KNO3
3) Ba(OH)2
4) SO2
5) Na2S
6) CaCO3
Ответом к заданию 9 является число. Запишите это число в БЛАНК ОТВЕТОВ без указания единиц измерения с точностью до десятых.
9. Массовая доля кислорода в оксиде алюминия равна ________(%)
Часть 2
Запишите номер задания и полное решение
10. Рассчитайте объём воздуха, необходимого для получения 39л азота, если известно, что объёмная доля азота в воздухе составляет 78%?
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 45 минут. Работа состоит из 2 частей и включает 10 заданий.
Часть 1 включает 9 заданий с кратким ответом. К заданиям 1 – 6 дается 4 варианта ответа, из которых только один правильный. За каждый правильный ответ дается 1 балл. Максимальный балл — 6.
Задания 7 — 9 повышенного уровня, на которые надо дать краткий ответ в виде числа или последовательности цифр. За каждый правильный ответ ты получишь 2 балла. Максимальный балл – 6.
Часть 2 содержит 1 наиболее сложное, объемное задание, которое требует полного ответа. За правильное выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Постарайся набрать наибольшее количество баллов. Максимальный первичный балл – 15 баллов.
Система оценивания работы.
0 – 6 баллов – «2» 7 – 10 баллов – «3»
11 – 13 баллов – «4» 14 – 15 баллов – «5»
Контрольная работа № 3
Соединения химических элементов
ВАРИАНТ -3
Часть 1
Ответом к заданиям 1- 6 является одна цифра. Запиши ответ в БЛАНК ОТВЕТОВ справа от номера соответствующего задания, начиная с первой клеточки.
1. Смесью веществ не является:
1) речная вода 3) воздух
2) дистиллированная вода 4) почва
2. Ряд формул, в котором все вещества – кислоты:
1) HCl, CaCl2, H2SO4 3) HNO3, H2SO3, H3PO4.
2) NaOH, H2CO3, H2S 4) CaO, Na2CO3, H2S
3. Cера проявляет наибольшую степень окисления в соединении с формулой:
1) H2 S 2) SO2 3) Na 2S 4) SO3
4. Формула сульфита хрома (Ш):
1) Cr2S3 3) CrSO4
2) Cr2(SO4)3 4) Cr2(SO3)3
5. В 120г воды растворили 30г соли. Массовая доля соли в полученном растворе равна:
1) 20% 2) 25% 3) 30% 4) 10%
6. Верны ли следующие высказывания?
А. В состав солей входит ион металла.
Б. В состав солей входит кислотный остаток.
1) верно только А 3) верно только Б
2) верны оба суждения 4) оба суждения не верны
В задании 7 к каждому элементу первого столбца подберите соответствующий элемент второго столбца и запишите в таблицу на черновике выбранные цифры под соответствующими буквами. Получившуюся последовательность цифр перенесите в БЛАНК ОТВЕТОВ без пробелов, запятых и других дополнительных символов. Цифры в ответе могут повторяться
7. Установите соответствие между названием вещества и формулой соединения:
Название вещества: Формула соединения:
А) Оксид меди (II) 1) Cu2O
Б) Нитрат меди (II) 2) HNO3
В) Азотная кислота 3) Cu(OH)2
Г) Гидроксид меди (II) 4) Cu(NO3)2
5) H3PO4
6) CuO
А
Б
В
Г
Ответом к заданию 8 является последовательность трёх цифр, которые соответствуют номерам правильных ответов. Запишите эти цифры в порядке возрастания в БЛАНК ОТВЕТОВ справа от номера соответствующего задания, начиная с первой клеточки, без пробелов, запятых и других дополнительных символов.
8. К оксидам относятся:
1) NaOH 4) K2O
2) MgO 5) SO2
3) BaSO4 6) OF2
Ответом к заданию 9 является число. Запишите это число в БЛАНК ОТВЕТОВ без указания единиц измерения с точностью до десятых.
9. Массовая доля кислорода в азотной кислоте равна__________(%)
Часть 2
Запишите номер задания и полное решение
10. Рассчитайте объём газа метана СН4, полученного из 500л природного газа, если известно, что объёмная доля метана в природном газе составляет 95%?
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 45 минут. Работа состоит из 2 частей и включает 10 заданий.
Часть 1 включает 9 заданий с кратким ответом. К заданиям 1 – 6 дается 4 варианта ответа, из которых только один правильный. За каждый правильный ответ дается 1 балл. Максимальный балл — 6.
Задания 7 — 9 повышенного уровня, на которые надо дать краткий ответ в виде числа или последовательности цифр. За каждый правильный ответ ты получишь 2 балла. Максимальный балл – 6.
Часть 2 содержит 1 наиболее сложное, объемное задание, которое требует полного ответа. За правильное выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Постарайся набрать наибольшее количество баллов. Максимальный первичный балл – 15 баллов.
Система оценивания работы.
0 – 6 баллов – «2» 7 – 10 баллов – «3»
11 – 13 баллов – «4» 14 – 15 баллов – «5»
Контрольная работа № 3
Соединения химических элементов
ВАРИАНТ -4
Часть 1
Ответом к заданиям 1- 6 является одна цифра. Запиши ответ в БЛАНК ОТВЕТОВ справа от номера соответствующего задания, начиная с первой клеточки.
1. Смесью веществ, в отличие от чистого вещества, является:
1) алюминий 3) азот
2) воздух 4) золото
2. Ряд формул, в котором все вещества – соли:
1) NaCl, BaSO4, KNO3 3) MgSO3, CaO, AlCl3
2) CaSO4 , Na2CO3 , H2CO3 4) ZnS, CaI2, Al2O3
3. Фосфор проявляет наименьшую степень окисления в соединении с формулой:
1) Р2O5 3) РН3
2) Р2O3 4) Н3РО4
4. Формула нитрата железа (II):
1) Fe(NO3)2 3) Fe(NO3)3
2) Fe3N2 4) Fe(NO2)2
5. В 450г воды растворили 50г соли. Массовая доля соли в полученном растворе равна:
1) 9% 2)10% 3) 14% 4) 11%
6. Верны ли следующие высказывания?
А. Оксиды состоят из двух элементов.
Б. Степень окисления кислорода в оксидах +2
1) верно только А 3) верно только Б
2) верны оба суждения 4) оба суждения не верны
В задании 7 к каждому элементу первого столбца подберите соответствующий элемент второго столбца и запишите в таблицу на черновике выбранные цифры под соответствующими буквами. Получившуюся последовательность цифр перенесите в БЛАНК ОТВЕТОВ без пробелов, запятых и других дополнительных символов. Цифры в ответе могут повторяться
7. Установите соответствие между названием вещества и формулой соединения:
Название вещества: Формула соединения:
А) Сернистая кислота 1) H2SO4
Б) Гидроксид бария 2) BaSO3
В) Сульфат бария 3) BaO
Г) Оксид бария 4) BaSO4
5) Ва(OH)2
6) H2 SO3
А
Б
В
Г
Ответом к заданию 8 является последовательность трёх цифр, которые соответствуют номерам правильных ответов. Запишите эти цифры в порядке возрастания в БЛАНК ОТВЕТОВ справа от номера соответствующего задания, начиная с первой клеточки, без пробелов, запятых и других дополнительных символов.
8. К основаниям относятся:
1) H2SO3 4) Fe(OH)2
2) NaOH 5) K2S
3) MgO 6) Ba(OH)2
Ответом к заданию 9 является число. Запишите это число в БЛАНК ОТВЕТОВ без указания единиц измерения с точностью до десятых.
9. Массовая доля углерода в карбонате кальция равна ________(%).
Часть 2
Запишите номер задания и полное решение
10. Рассчитайте объём воздуха, необходимого для получения 50л кислорода, если известно, что объёмная доля кислорода в воздухе составляет 21%?
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 45 минут. Работа состоит из 2 частей и включает 10 заданий.
Часть 1 включает 8 заданий с кратким ответом. К заданиям 1 – 6 дается 4 варианта ответа, из которых только один правильный. За каждый правильный ответ дается 1 балл. Максимальный балл — 6.
Задания 7 — 8 повышенного уровня, на которые надо дать краткий ответ в виде числа или последовательности цифр. За каждый правильный ответ ты получишь 2 балла. Максимальный балл – 4.
Часть 2 содержит 1 наиболее сложное, объемное задание, которое требует полного ответа. За правильное выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Постарайся набрать наибольшее количество баллов. Максимальный первичный балл – 13 баллов.
Система оценивания работы.
0 – 6 баллов – «2» 7 – 9 баллов – «3»
10 – 11 баллов – «4» 12 – 13 баллов – «5»
Контрольная работа № 4
Изменения, происходящие с веществами.
ВАРИАНТ -1
Часть 1
Ответом к заданиям 1- 6 является одна цифра. Запиши ответ в БЛАНК ОТВЕТОВ справа от номера соответствующего задания, начиная с первой клеточки.
1. Физическое явление — это:
1) ржавление железа 3) скисание молока
2) горение древесины 4) плавление свинца
2. Сумма вех коэффициентов в уравнении реакции, схема которой Al + Cl2 AlCl3, равна:
1) 4 2) 5 3) 8 4) 7
3. Схема, являющаяся уравнением химической реакции:
1) H2 + Cl2 HCl 3) Zn +HCl ZnCl2+H2
2) 2Ca + O2 2CaO 4) H2 + О2 H2О
4. Вещество «Х» в схеме: Х + 2HCl = FeCl2 + H2.
1) железо 3) хлор
2) оксид железа 4) гидроксид железа
5. Объём водорода, который полностью прореагирует по уравнению реакции
2H2 + O2 = 2H2O с 1 моль кислорода, равен:
1) 8,96л 3) 44,8л
2) 22, 4л4) 67,2л
6. Верны ли следующие высказывания?
А. Из нескольких простых или сложных веществ образуется одно более сложное вещество в реакции соединения.
Б. Из нескольких простых или сложных веществ образуется одно более сложное вещество в реакции разложения.
1) верно только А 3) верно только Б
2) верны оба суждения 4) оба суждения не верны
В задании 7 к каждому элементу первого столбца подберите соответствующий элемент второго столбца и запишите в таблицу на черновике выбранные цифры под соответствующими буквами. Получившуюся последовательность цифр перенесите в БЛАНК ОТВЕТОВ без пробелов, запятых и других дополнительных символов. Цифры в ответе могут повторяться
7. Установите соответствие между левой и правой частями уравнений:
Левая часть: Правая часть:
А) CuO + H2SO4= 1) CuSO4 + H2O
Б) CuCl2 + 2NaOH =. 2) CuSO4 + 2H2O
В) Cu(OН)2 +2HCl = 3) CuCl2 + H2O
Г) Cu(OН)2 + H2SO4= 4) Cu(OH)2 + NaCl
5) CuCl2 + 2H2O
6) Cu(OH)2 + 2NaCl
А
Б
В
Г
Ответом к заданию 8 является последовательность трех цифр, которые соответствуют номерам правильных ответов. Запишите эти цифры в порядке возрастания в БЛАНК ОТВЕТОВ справа от номера соответствующего задания, начиная с первой клеточки, без пробелов, запятых и других дополнительных символов.
8. Уравнения реакции обмена:
1) CaO + 2HCl= CaСl2 + H2O
2) FeS + 2HCl = FeCl2 + H2S
3) 2KClO3 = 2KCl + 3O2
4) Fe2O3 + 2Al = Al2O3 + 2Fe.
5) LiСl + AgNO3 = LiNO3 + AgCl.
6) 2Ca + O2 = 2CaO.
Часть 2
Запишите номер задания и полное решение
9. По уравнению реакции Cu (OH)2 = CuO + H2O найдите массу оксида меди (II), образовавшегося при разложении 39,2г гидроксида меди (II).
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 45 минут. Работа состоит из 2 частей и включает 10 заданий.
Часть 1 включает 8 заданий с кратким ответом. К заданиям 1 – 6 дается 4 варианта ответа, из которых только один правильный. За каждый правильный ответ дается 1 балл. Максимальный балл — 6.
Задания 7 — 8 повышенного уровня, на которые надо дать краткий ответ в виде числа или последовательности цифр. За каждый правильный ответ ты получишь 2 балла. Максимальный балл – 4.
Часть 2 содержит 1 наиболее сложное, объемное задание, которое требует полного ответа. За правильное выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Постарайся набрать наибольшее количество баллов. Максимальный первичный балл – 13 баллов.
Система оценивания работы.
0 – 6 баллов – «2» 7 – 9 баллов – «3»
10 – 11 баллов – «4» 12 – 13 баллов – «5»
Контрольная работа № 4
Изменения, происходящие с веществами.
ВАРИАНТ -2
Часть 1
Ответом к заданиям 1- 6 является одна цифра. Запиши ответ в БЛАНК ОТВЕТОВ справа от номера соответствующего задания, начиная с первой клеточки.
1. Химическое явление — это:
1) горение свечи 3) испарение бензина
2) плавление льда 4) образование льда
2. Сумма вех коэффициентов в уравнении реакции, схема которой
Ca + HCl CaCl2 + H2, равна:
1) 6 2) 5 3) 3 4) 4
3. Схема, являющаяся уравнением химической реакции:
1) CaCO3 CaO + CO2 3) Ca + O2 CaO.
2) Mg + HCl MgCl2 + H2. 4) CO + O2 CO2
4. Вещество «Х» в схеме: Fe2O3 + 3H2 2Х + 3H2O
1) железо 3) водород
2) оксид железа 4) гидроксид железа
5. Объём водорода, который полностью прореагирует по уравнению реакции
H2 + Cl2 = 2HCl с 0,2 моль хлора (н.у.), равен:
1) 4,48л 3) 44,8л
2) 22, 4л4) 67,2л
6. Верны ли следующие высказывания?
А. Из одного сложного вещества образуются два или более новых веществ в реакции
соединения
Б. Из одного сложного вещества образуются два или более новых веществ в реакции
замещения
1) верно только А 3) верно только Б
2) верны оба суждения 4) оба суждения не верны
В задании 7 к каждому элементу первого столбца подберите соответствующий элемент второго столбца и запишите в таблицу на черновике выбранные цифры под соответствующими буквами. Получившуюся последовательность цифр перенесите в БЛАНК ОТВЕТОВ без пробелов, запятых и других дополнительных символов. Цифры в ответе могут повторяться
7. Установите соответствие между левой и правой частями уравнений
Левая часть: Правая часть:
А) Na2O + H2SO4= 1) Fe(OH)2 + KCl
Б) FeCl2 + 2KOH = 2) Fe(NO3)2 + 2H2O
В) Fe(OН)2 +2HNO3 = 3) FeNO3 + 2H2O
Г) 2NaOН + H2SO4= 4) Fe(OH)2 + 2KCl
5) Na2SO4 + 2H2O
6) Na2SO4 + H2O
А
Б
В
Г
Ответом к заданию 8 является последовательность трех цифр, которые соответствуют номерам правильных ответов. Запишите эти цифры в порядке возрастания в БЛАНК ОТВЕТОВ справа от номера соответствующего задания, начиная с первой клеточки, без пробелов, запятых и других дополнительных символов.
8. Уравнения реакции разложения:
1) CaSiO3 = CaO + SiO2
2) FeS + 2HCl = FeCl2 + H2S
3) 2KNO3 = 2KNO2 + O2
4) Fe2O3 + 2Al = Al2O3 + 2Fe.
5) NaСl + AgNO3 = NaNO3 + AgCl.
6) 2Al(OH)3 = Al2O3 + 3H2O
Часть 2
Запишите номер задания и полное решение
9. По уравнению реакции Zn(OH)2 = Zn O + H2O определите массу оксида цинка, который образуется при разложении 198г исходного вещества.
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 45 минут. Работа состоит из 2 частей и включает 10 заданий.
Часть 1 включает 8 заданий с кратким ответом. К заданиям 1 – 6 дается 4 варианта ответа, из которых только один правильный. За каждый правильный ответ дается 1 балл. Максимальный балл — 6.
Задания 7 – 8 повышенного уровня, на которые надо дать краткий ответ в виде числа или последовательности цифр. За каждый правильный ответ ты получишь 2 балла. Максимальный балл – 4.
Часть 2 содержит 1 наиболее сложное, объемное задание, которое требует полного ответа. За правильное выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Постарайся набрать наибольшее количество баллов. Максимальный первичный балл – 13 баллов.
Система оценивания работы.
0 – 6 баллов – «2» 7 – 9 баллов – «3»
10 – 11 баллов – «4» 12 – 13 баллов – «5»
Контрольная работа № 4
Изменения, происходящие с веществами.
ВАРИАНТ -3
Часть 1
Ответом к заданиям 1- 6 является одна цифра. Запиши ответ в БЛАНК ОТВЕТОВ справа от номера соответствующего задания, начиная с первой клеточки.
1. Физическое явление — это:
1) испарение воды 3) горение керосина
2) скисание молока 4) появление ржавчины
2. Сумма вех коэффициентов в уравнении реакции, схема которой
Al + O2 Al2O3 равна:
1) 6 2) 3 3) 9 4) 4
3. Схема, являющаяся уравнением химической реакции:
1) Cu + O2 CuO 3) 2HgO 2Hg + O2.
2) KClO3 KCl + O2. 4) HCl + Zn H2 + ZnCl2
4. Вещество «Х» в схеме: Х +H2SO4 = ZnSO4 + H2
1) цинк 3) оксид цинка
2) гидроксид цинка 4) вода
5 Объём водорода, который полностью прореагирует по уравнению реакции
H2 + Cl2 = 2HCl с 0,5 моль хлора (н.у.), равен:
1) 5,6л 3) 44,8л
2) 11,2л4) 22,4л
6. Верны ли следующие высказывания?
А. Атомы простого вещества замещают атомы одного из химических элементов в составе сложного вещества в реакции обмена.
Б. Атомы простого вещества замещают атомы одного из химических элементов в составе сложного вещества в реакции замещения.
1) верно только А 3) верно только Б
2) верны оба суждения 4) оба суждения не верны
В задании 7 к каждому элементу первого столбца подберите соответствующий элемент второго столбца и запишите в таблицу на черновике выбранные цифры под соответствующими буквами. Получившуюся последовательность цифр перенесите в БЛАНК ОТВЕТОВ без пробелов, запятых и других дополнительных символов. Цифры в ответе могут повторяться
7. Установите соответствие между левой и правой частями уравнений:
Левая часть: Правая часть:
А) ZnO + 2HCl = 1) ZnCl2 + 2H2O
Б) Zn(OH)2 + 2HCl = 2) ZnCl2 + H2O
В) Zn + 2HCl = 3) Zn(OH)2 + 2KCl
Г) ZnCl2 + 2KOH = 4) ZnCl2 + H2
5) ZnOH + 2KCl
6) ZnCl2 + 2H2
А
Б
В
Г
Ответом к заданию 8 является последовательность трех цифр, которые соответствуют номерам правильных ответов. Запишите эти цифры в порядке возрастания в БЛАНК ОТВЕТОВ справа от номера соответствующего задания, начиная с первой клеточки, без пробелов, запятых и других дополнительных символов.
8. Уравнения реакции замещения:
1) BaO + H2O = Ba(OH)2.
2) CuO + H2 = Cu + H2O.
3) 3KOH + H3PO4 = K3PO4 + 3H2O.
4) CaI2 + Cl2 = CaCl2+I2.
5) 2NH3 = N2 + 3H2.
6) Mg + 2HCl = MgCl2 + H2
Часть 2
Запишите номер задания и полное решение
9. По уравнению реакции Fe(OH)2 = FeO + H2O определите массу оксида железа (II), образовавшегося при разложении 45г исходного вещества.
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 45 минут. Работа состоит из 2 частей и включает 10 заданий.
Часть 1 включает 8 заданий с кратким ответом. К заданиям 1 – 6 дается 4 варианта ответа, из которых только один правильный. За каждый правильный ответ дается 1 балл. Максимальный балл — 6.
Задания 7 — 8 повышенного уровня, на которые надо дать краткий ответ в виде числа или последовательности цифр. За каждый правильный ответ ты получишь 2 балла. Максимальный балл – 4.
Часть 2 содержит 1 наиболее сложное, объемное задание, которое требует полного ответа. За правильное выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Постарайся набрать наибольшее количество баллов. Максимальный первичный балл – 13 баллов
Система оценивания работы.
0 – 6 баллов – «2» 7 – 9 баллов – «3»
10 – 11 баллов – «4» 12 – 13 баллов – «5»
Контрольная работа № 4
Изменения, происходящие с веществами.
ВАРИАНТ -4
Часть 1
Ответом к заданиям 1- 6 является одна цифра. Запиши ответ в БЛАНК ОТВЕТОВ справа от номера соответствующего задания, начиная с первой клеточки.
1. Химическое явление — это:
1) плавление олова 3) горения магния
2) замерзания воды 4) образование тумана
2. Сумма вех коэффициентов в уравнении реакции, схема которой
N2 + H2 NH3 равна:
1) 6 2) 3 3) 4 4) 5
3. Схема, являющаяся уравнением химической реакции:
1) 3Fe + 2O2 Fe3O4 3) HgO Hg + O2.
2) 2Al + O2 Al2O3. 4) Ca + HCl CaCl2 + H2.
4. Формула вещества «Х» в схеме: 2Na + Х 2NаCl.
1) Cl 3) Cl2
2) HCl 4) Cl2O7
5 Объём водорода (н.у.), который полностью прореагирует по уравнению реакции
N2 + 3H2 2NH3c 1 моль азота, равен:
1) 67,2л 3) 44,8л
2) 11,2л4) 22,4л
6. Верны ли следующие высказывания?
А. Из двух сложных веществ образуется два новых сложных вещества в реакции обмена.
Б. Из двух сложных веществ образуется два новых сложных вещества в реакции соединения.
1) верно только А 3) верно только Б
2) верны оба суждения 4) оба суждения не верны
В задании 7 к каждому элементу первого столбца подберите соответствующий элемент второго столбца и запишите в таблицу на черновике выбранные цифры под соответствующими буквами. Получившуюся последовательность цифр перенесите в БЛАНК ОТВЕТОВ без пробелов, запятых и других дополнительных символов. Цифры в ответе могут повторяться
7. Установите соответствие между левой и правой частями уравнений
Левая часть: Правая часть:
А) Mg(NO3)2 + 2KOH = 1) Mg(NO3)2 + 2H2O
Б) Mg(OH)2 + 2HNO3 = 2) MgNO3 + 2H2O
В) Mg + 2HCl = 3) Mg(OH)2 + 2KNO3
Г) MgO + 2HCl = 4) MgCl2+ H2
5) MgCl2+ H2O
6) Mg(OH)2 + KNO3
А
Б
В
Г
Ответом к заданию 8 является последовательность трех цифр, которые соответствуют номерам правильных ответов. Запишите эти цифры в порядке возрастания в БЛАНК ОТВЕТОВ справа от номера соответствующего задания, начиная с первой клеточки, без пробелов, запятых и других дополнительных символов.
8. Уравнения реакции соединения:
1) BaO + H2O = Ba(OH)2.
2) CuO + H2 = Cu + H2O.
3) N2 + O2 = 2NO
4) Ca(OH)2 + 2HCl = CaCl2+2H2O.
5) N2 + 3H2 = 2NH3
6) Mg + 2HCl = MgCl2 + H2
Часть 2
Запишите номер задания и полное решение
9. По уравнению реакции CaО + H2O Ca (OH)2 определите массу гидроксида кальция, образовавшегося при взаимодействии 112г оксида кальция с водой.
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 45 минут. Работа состоит из 2 частей и включает 10 заданий.
Часть 1 включает 9 заданий с кратким ответом. К заданиям 1 – 6 дается 4 варианта ответа, из которых только один правильный. За каждый правильный ответ дается 1 балл. Максимальный балл — 6.
Задания 7 — 9 повышенного уровня, на которые надо дать краткий ответ в виде числа или последовательности цифр. За каждый правильный ответ ты получишь 2 балла. Максимальный балл – 6.
Часть 2 содержит 1 наиболее сложное, объемное задание, которое требует полного ответа. За правильное выполнение задания ты можешь получить 4 балла.
Баллы, полученные за выполненные задания, суммируются. Постарайся набрать наибольшее количество баллов. Максимальный первичный балл – 16 баллов
Система оценивания работы.
0 – 6 баллов – «2» 7 – 10 баллов – «3»
11 – 14 баллов – «4» 15 – 16 баллов – «5»
Контрольная работа № 5
Классы неорганических соединений
ВАРИАНТ -1
Часть 1
Ответом к заданиям 1- 6 является одна цифра. Запиши ответ в БЛАНК ОТВЕТОВ справа от номера соответствующего задания, начиная с первой клеточки.
1. Группа формул веществ, включающая формулы основания, кислоты, соли и кислотного оксида.
1) CuO, Zn(OH)2, AlCl3, K2S 3) SO2, H2SO4, NaCl, CuO
2) Cu(OH)2, HCl, NaNO3, SO3 4) Zn(OH)2 ,HCl, K2S, Na2O
2. Формула сульфата натрия:
1) Na2SO4 3) Na2S
2) Na2SO3 4) Na2SiO3
3. Изменение свойств оксидов от кислотных к основным происходит в ряду веществ с формулами:
1) Li2O — BeO — B2O3 3) NO2 — CO2 — SO2
2) P2O5 — SiO2 — Al2O3 4) P2O5 — CаO — SO3
4. Пара формул веществ, реагирующих с оксидом серы (IV):
1) Ca(OH)2, H2O 3) H2O, NaCl
2) Na2O, Na4) SO3, H2SO4
5. Металл, реагирующий с водным раствором хлорида меди (II):
1) Золото 2) Железо 3) Ртуть 4) Серебро
6. Верны ли следующие высказывания?
А. В уравнении реакции: Х + HCl = NaCl + H2O веществом Х является
вещество с формулой Na.
Б. В уравнении реакции: Х + HCl = NaCl + H2O веществом Х является
вещество с формулой NaOH.
1) верно только А 3) верно только Б
2) верны оба суждения 4) оба суждения не верны
В задании 7 к каждому элементу первого столбца подберите соответствующий элемент второго столбца и запишите в таблицу на черновике выбранные цифры под соответствующими буквами. Получившуюся последовательность цифр перенесите в БЛАНК ОТВЕТОВ без пробелов, запятых и других дополнительных символов. Цифры в ответе могут повторяться
7. Установите соответствие между формулой оксида и соответствующего ему гидроксида.
Формула оксида Формула гидроксида
А) Cu2O 1) H2SO4
Б) CO2 2) Al (OH)3
В) Al2O3 3) Cu (OH)2
Г) SO3 4) H2CO3
5) CuOH
6) H2SO3
А
Б
В
Г
Ответом к заданиям 8, 9 является последовательность трёх цифр, которые соответствуют номерам правильных ответов. Запишите эти цифры в порядке возрастания в БЛАНК ОТВЕТОВ справа от номера соответствующего задания, начиная с первой клеточки, без пробелов, запятых и других дополнительных символов.
8. Металлы, реагирующие с раствором соляной кислоты:
1) Ca 4) Cu
2) Mg 5) Ag
3) Zn 6) С
9. Вещества, реагирующие с раствором гидроксида натрия:
1) Соляная кислота 4) Хлорид натрия
2) Нитрат меди 5) Углекислый газ
3) Вода 6) Оксид калия
Химия 8 класс. Тематические и итоговые контрольные работы. | Контрольные работы по Химии
Химия 8 класс. Тематические и итоговые контрольные работы.
03.11.2014 48610 0Контрольная работа №1.
Первоначальные химические понятия
Вариант №1
Задание №1
Определите, из какого числа атомов состоят молекулы, сколько молекул веществ, формулы которых приведены ниже:
5O3, N2, 2h3O, Al, P2O5, 3h3SO4.
Задание №2
Согласно следующим схемам расставьте коэффициенты и определите тип каждой химической реакции.
А) Р + О2 = Р2О5
Б) WO3 + h3 = W + h3O
В) Cu(OH)2 = CuO + h3O
Г) AlCl3 + KOH = Al(OH)3 + KCl
Задание №3
Вычислите массовые доли кислорода в данных оксидах. Какой из них богаче кислородам?
Mn2O3, Mn2O7 , MnO.
Задание №4
Выпишите, какая масса железа входит в состав оксида железа (III) массой 60 грамм.
Вариант №2
Задание №1
Определите, из какого числа атомов состоят молекулы, сколько молекул веществ, формулы которых приведены ниже:
SiO2, 3h4PO4, Mg, h3, 4SO3, 2Br2
Задание №2
Согласно следующим схемам расставьте коэффициенты и определите тип каждой химической реакции.
А) Ch5 = C + h3
Б) Al + Cl2 = AlCl3
В) Na + h3SO4 = Na2SO4 + h3
Г) Fe2O3 + h3SO4 = Fe2(SO4)3 + h3O
Задание №3
Вычислите массовые доли кислорода в данных оксидах. Какой из них богаче кислородам?
SO, SO2, SO3.
Задание №4
В какой массе оксида алюминия Al2O3 содержится 27кг. алюминия.
Вариант №3
Задание №1
Определите, из какого числа атомов состоят молекулы, сколько молекул веществ, формулы которых приведены ниже:
2Al2O3, Cu, 2h3CO3, Cl2, Ch4COOH, 5NaCl.
Задание №2
Согласно следующим схемам расставьте коэффициенты и определите тип каждой химической реакции.
А) Fe + CuSO4 = FeSO4 + Cu
Б) CaCO3 = CaO + CO2
В) Na2SO4 + BaCl2 = NaCl + BaSO4
Г) Li + O2 = Li2O
Задание №3
Вычислите массовые доли кислорода в данных оксидах. Какой из них богаче кислородам?
Fe2O3, FeO, Fe3O4.
Задание №4
Сколько граммов натрия содержит в 400г чистой поваренной соли?
Вариант №4
Задание №1
Из приведённых ниже формул веществ распределите отдельно простые и сложные вещества.
Озон – О3, вода – Н2О, сероводород – Н2S, азот – N2, алмаз – С, метан – СН4, медный купорос – CuSO4, сера – S8, этиловый спирт – C2H5OH, углекислый газ – CO2, медь – Cu, аммиак – Nh4.
Задание №2
Согласно следующим схемам расставьте коэффициенты и определите тип каждой химической реакции.
А) Al + O2 = Al2O3
Б) Fe(OH)3 = Fe2O3 + h3O
В) CuO + h3 = Cu + h3O
Г) CuCl2 + NaOH = Cu(OH)2 + NaCl
Задание №3
Вычислите массовые доли кислорода в данных оксидах. Какой из них богаче кислородам?
CrO3, Cr2O3, CrO.
Задание №4
Вычислите массу углерода, содержащегося в 176г. углекислого газа (CO2)
Вариант №5
Задание №1
Поваренная соль- NaCl, кислород –O2, железо- Fe, уксусная кислота- Ch4COOH, графит- С, золото- Au, марганцовка-KMnO4, кремнезём – SiO2, пирит – FeS, вода – h3O, фосфор – Р, угарный газ – СО.
Задание №2
Согласно следующим схемам расставьте коэффициенты и определите тип каждой химической реакции.
А)KClO3 = KCl + O2
Б) Na + O2 = Na2O
В) Al2O3 + h3SO4 = Al2(SO4)3 + h3O
Г) Fe + HCl = FeCl3 + h3
Задание №3
Вычислите массовые доли кислорода в данных оксидах. Какой из них богаче кислородам?
N2O, NO, N2O3.
Задание №4
Выпишите массу железа в 66г. сульфата железа (II) FeS.
Вариант №6
Задание №1
Приведите три примера простых веществ, молекулы которых состоят из двух атомов и два примера сложных веществ, молекулы которых состоят из двух атомов.
Задание №2
Согласно следующим схемам расставьте коэффициенты и определите тип каждой химической реакции.
А) (Cu OH)2CO3 = CuO + CO2 + h3O
Б) Ca + h4PO4 = Ca3(PO4)2 + h3
В) K2O + P2O5 = K3 PO4
Г) CaCO3 + Na3PO4 = Na2CO3 + Ca3(PO4)2
Задание №3
Определите массовую долю хлорида калия в сильвините (KCl * NaCl), если в нём имеется 10% примесей.
Задание №4
В какой массе медного купороса CuSO4 * 5h3O содержится 90г. воды?
Контрольная работа №2
«Кислород. Оксиды. Горение»
Вариант №1
Задание №1
Составьте уравнения следующих химических реакций. Назовите получение оксиды.
А) Al + …= Al2O3
Б) Ca + O2 = …
Задание №2
Закончите реакцию горения сложного вещества, расставьте коэффициенты
Ch5 + O2 =
Задание №3
Даны следующие вещества: h3O и h3O2 рассчитайте, в каком случае при разложении одинаковых молей исходных веществ выделится больше кислорода.
Задание №4
Из предложенных веществ выпишите формулы оксидов, назовите выписанные оксиды: h3O, MgCl2, h3SO4, SO3, h3S, P2O5, Na2SiO3, Al2O3, KOH, Mn2O7.
Вариант №2
Задание №1
Составьте уравнения следующих химических реакций. Назовите получение оксиды.
А) С + … = СО2
Б) К + О2 = …
Задание №2
Закончите реакцию горения сложного вещества, расставьте коэффициенты
С2Н6 + О2 =
Задание №3
Даны следующие вещества: h3O и KMnO4 рассчитайте, в каком случае при разложении одинаковых молей исходных веществ выделится больше кислорода.
Задание №4
Из предложенных веществ выпишите формулы оксидов, назовите выписанные оксиды: h3CO3, SO2, Al(OH)3, Cr2O7, h4PO4, Mn2O3, BaO, NaNO3, CuO.
Вариант №3
Задание №1
Составьте уравнения следующих химических реакций. Назовите получение оксиды.
А) Fe + … = Fe2O3
Б) … + О2 = MgO
Задание №2
Закончите реакцию горения сложного вещества, расставьте коэффициенты
С3Н8 + О2 =
Задание №3
Даны следующие вещества: KClO3 и h3O рассчитайте, в каком случае при разложении одинаковых молей исходных веществ выделится больше кислорода.
Задание №4
Из предложенных веществ выпишите формулы оксидов, назовите выписанные оксиды
Cu2O, K2SO4, WO3, HCl, h3O2, HNO3, N2O5, BaCl2, FeO, Zn(OH)2.
Вариант №4
Задание №1
Составьте уравнения следующих химических реакций. Назовите получение оксиды.
А) Cu +… = CuO
Б) N2…+ O2=
Задание №2
Закончите реакцию горения сложного вещества, расставьте коэффициенты
C2h5 + O2 =
Задание №3
Даны следующие вещества: KClO3 и h3O2 рассчитайте, в каком случае при разложении одинаковых молей исходных веществ выделится больше кислорода.
Задание №4
Из предложенных веществ выпишите формулы оксидов, назовите выписанные оксиды
MgO, CaCO3, Fe3O4, CuCl2, SO2, Nh4, N2O5, h3SO3, NaOH, K2O.
Вариант №5
Задание №1
Составьте уравнения следующих химических реакций. Назовите получение оксиды.
А) Hg + … =HgO
Б) … + O2 = SO3
Задание №2
Закончите реакцию горения сложного вещества, расставьте коэффициенты
C2h3 + O2 =
Задание №3
Даны следующие вещества: KClO3 и KMnO4 рассчитайте, в каком случае при разложении одинаковых молей исходных веществ выделится больше кислорода.
Задание №4
Из предложенных веществ выпишите формулы оксидов, назовите выписанные оксиды: Ag2O, Ca(OH)2, BaO, h3SO4, N2O3, CuCl2, h3O, Al2(SO4)3, CO2.
Вариант №6
Задание №1
Составьте уравнения следующих химических реакций. Назовите получение оксиды.
А) SO2 + … = SO3
Б) h3S + …= h3O + SO2
Задание №2
Закончите реакцию горения сложного вещества, расставьте коэффициенты
C4h20 + O2 =
Задание №3
Известно, что в организме человека большую часть составляет кислород ( массовая доля кислорода составляет приблизительно 65%). Рассчитайте массу кислорода в организме человека массой 50кг. Найдите массу кислорода в вашем организме.
Задание №4
Выпишите из приведённых ниже формул формулы:
а) оксидов металлов, б) оксидов неметаллов, дайте названия:
SiO2, Nh4, h3CO3, CaO, KOH, Ch5, Cr2O3, BaS, PbO2, HClO3, HF, V2O5, NO.
Контрольная работа №3
Водород. Кислоты. Соли.
Вариант №1
Задание №1
Составьте уравнения реакций взаимодействия водорода с а) кислородам, б) оксидом ртути (II), в) натрием.
Задание №2
С какими из данных веществ реагирует серная кислота Са, О2, СuO, CO2, K2O, напишите уравнение реакций, расставьте коэффициенты, назовите получение соли.
Задание №3
Из данного списка веществ выпишите формулы кислот и солей, дайте им названия, подчеркните кислотный остаток и определите его валентность. h3O, Mg(NO3)2, HCl, SO3, CaCO3, h4PO4, NaOH, BaSO4, HNO3, Cl2.
Задание №4
Вычислите количество вещества и массу цинка, который может полностью прореагировать с 980 грамм серной кислоты.
Вариант №2
Задание №1
Составьте уравнения реакций взаимодействия водорода с а) бромом, б) оксидом свинца, в) магнием.
Задание №2
С какими из данных веществ реагирует фосфорная кислота Na, О2, MgO, CO2, ZnO, напишите уравнение реакций, расставьте коэффициенты, назовите получение соли.
Задание №3
Из данного списка веществ выпишите формулы кислот и солей, дайте им названия, подчеркните кислотный остаток и определите его валентность.
BaCl2, Al(OH)3, HNO3, Nh4, CuSO4, h3SiO3, Br2, Na2S, HCl.
Задание №4
Вычислите количество вещества и массу оксида меди (II) вступившего в реакцию с водородом, если в результате было получено 192 грамма меди.
Вариант №3
Задание №1
Составьте уравнения реакций взаимодействия водорода с а) хлором, б) оксидом вольфрама, в) калием.
Задание №2
С какими из данных веществ реагирует соляная кислота Mg, Cu, P2O5, Al2O3, CaO напишите уравнение реакций, расставьте коэффициенты, назовите получение соли.
Задание №3
Из данного списка веществ выпишите формулы кислот и солей, дайте им названия, подчеркните кислотный остаток и определите его валентность.
CO2, MgCl2, h3CO3, KOH, h3S, h3O2, Na2, SO3, P, Ca3(PO4)2, h3SO4.
Задание №4
Вычислите количество вещества и массу оксида меди (II), который полностью прореагировал с серной кислотой, если известно, что сульфаты меди получено в этой реакции 48 грамм.
Вариант №4
Задание №1
Составьте уравнения реакций взаимодействия водорода с
а) оксидом железа (III), б) серой, в) азотом.
Задание №2
С какими из данных веществ реагирует азотная кислота Ba, Ag, SO2, K2O, Al2O3. напишите уравнение реакций, расставьте коэффициенты, назовите получение соли.
Задание №3
Из данного списка веществ выпишите формулы кислот и солей, дайте им названия, подчеркните кислотный остаток и определите его валентность. NaNO3, P2O5, h3SO4, S, HBr, K2SiO3, FeCl3, h4PO4.
Задание №4
Вычислите количество вещества и массу водорода, который образуется при взаимодействии 8 моль Al с соляной кислотой.
Вариант №5
Задание №1
Запишите реакции получения водорода в результате взаимодействия цинка с кислотами а) соляной; б) серной; в) фосфорной.
Задание №2
В приведённых схемах вставьте формулы неизвестных веществ, напишите уравнения реакций, дайте названия реагирующих веществ и продуктов реакций:
а) X+h3SO4 →ZnSO4+Y
б) MgO+X→Y+h3O
в) X+Y→Ca3(PO4)2+h3O
Задание №3
Какие оксиды соответствуют следующим кислотам, запишите их формулы: h3SO4, h4PO4, h4PO3, h4BO3, h3SiO3.
Задание №4
Вычислите, в каком из приведенных случаев водорода образуется больше в реакциях соляной кислоты HCl с:
а) 3,2г алюминия
б) 3,2г цинка
Вариант №6
Задание №1
Приведите примеры реакций: а) разложения; б) замещения, в которых водород выделяется в качестве продукта реакции.
Задание №2
Напишите уравнения реакций, с помощью которых можно осуществить превращения:
Al2O3→Al→ Al2O3→ Al2(SO4)3
Задание №3
В приведенных формулах солей Na2S, Na3PO4, AlCl3, Fe2(SO4)3, Na2CrO4, CaI2 выделите кислотные остатки, определите их валентность, приведите формулы соответствующих кислот.
Задание №4
Сожгли 6 молей фосфора. Полученный оксид растворили в воде. Определите массу оксида фосфора, образовавшегося при сжигании.
О – срез знаний по химии 9 класс
Задание №1
Запишите реакции получения водорода в результате взаимодействия цинка с кислотами а) соляной; б) серной; в) фосфорной.
Задание №2
В приведённых схемах вставьте формулы неизвестных веществ, напишите уравнения реакций, дайте названия реагирующих веществ и продуктов реакций:
а) X+h3SO4 →ZnSO4+Y
б) MgO+X→Y+h3O
в) X+Y→Ca3(PO4)2+h3O
Задание №3
Какие оксиды соответствуют следующим кислотам, запишите их формулы: h3SO4, h4PO4, h4PO3, h4BO3, h3SiO3.
Задание №4
Вычислите, в каком из приведенных случаев водорода образуется больше в реакциях соляной кислоты HCl с:
а) 3,2г алюминия
б) 3,2г цинка
Задание №5
Приведите примеры реакций: а) разложения; б) замещения, в которых водород выделяется в качестве продукта реакции.
Задание №6
Напишите уравнения реакций, с помощью которых можно осуществить превращения:
Al2O3→Al→ Al2O3→ Al2(SO4)3
Задание №7
В приведенных формулах солей Na2S, Na3PO4, AlCl3, Fe2(SO4)3, Na2CrO4, CaI2 выделите кислотные остатки, определите их валентность, приведите формулы соответствующих кислот.
Задание №8
Сожгли 6 молей фосфора. Полученный оксид растворили в воде. Определите массу оксида фосфора, образовавшегося при сжигании.
Химия — 8 класс. Химия. Итоговая контрольная работа за курс 8-ого класса
 Курсотека
Курсотека - Каталог
- Школьникам
- Алгебра
140 - Английский язык
481 - Астрономия
2 - Биология
426 - Всеобщая история
285 - География
230 - Геометрия
172 - ИЗО
24 - Информатика
66 - История России
338 - Еще 17 категорий
- Студентам
- Адвокатура
7 - Административное право
2 - Английский язык
63 - Архитектура и строительство
10 - АФХД
11 - Банковское дело
20 - БЖД
38 - Биология и химия
46 - Бухгалтерский учет и аудит
41 - Еще 57 категорий
- Самообразование
- Без категории
9 - Бизнес
10 - Бухгалтерия и 1C
11
Контрольная работа по химии 8 класс 1 четверть — 6 Апреля 2015
I вариантРабота состоит из 13 заданий и состоит из трех частей. Часть А включает в себя 10 тестовых заданий с выбором одного правильного ответа, В части В содержатся задания с полным развернутым ответом. Максимальное количество балов за контрольную работу равно 40.
Часть А Каждое задание оценивается в 2 балла.
О простом веществе, а не о химическом элементе кислород идет речь в выражении:
Кислород входит в состав воды;
Кислород содержится в земной коре;
Кислород входит в состав атмосферы;
Кислород входит в состав оксидов;
Для очистки воды от нерастворимых в ней примесей используется метод:
Фильтрование;
Дистилляция;
Выпаривание;
Хроматография;
Химическое явление – это:
Горение свечи;
Испарение бензина;
Плавление льда;
Замерзание воды;
Смесью веществ не является:
Дистиллированная вода
Воздух;
Почва;
Железная руда;
Сложное вещество – это:
Вода;
Сера;
Кислород;
Медь;
Относительная молекулярная масса наибольшая у вещества с формулой:
h3S;
SO2;
K2S;
SO3;
Запись 3О2 означает:
2 молекулы кислорода;
3 молекулы кислорода;
5 атомов кислорода;
6 атомов кислорода;
Азот проявляет наибольшую валентность в соединении с формулой:
Nh4;
NO2;
N2;
N2O5;
Массовая доля серы в серной кислоте h3SO4 равна:
2,04%
65,31%
32,65%
47,55%
Масса 5 моль оксида фосфора (V) равна:
710г;
305г;
1420г;
250г;
Часть В
В1 (7 баллов). Рассчитайте массу кислорода, который может быть получен из перманганата калия массой 7,9г.
В2. (7 баллов) Термохимическое уравнение реакции горения угля имеет вид:
C + O2 = CO2 + 394 кДж
Рассчитайте? какое количество теплоты выделится, если сгорело 60г угля.
В3. Расставьте коэффициенты в уравнениях реакций, укажите тип реакции:
N2 + h3 = Nh4 (2 балла)
MnO2 + h3 = Mn + h3O ( 2 балла)
KOH + h3SO4 = K2SO4 + h3O (2 балла)
Итоговая контрольная работа по химии
за первое полугодие
II вариант
Работа состоит из 13 заданий и состоит из трех частей. Часть А включает в себя 10 тестовых заданий с выбором одного правильного ответа, В части В содержатся задания с полным развернутым ответом. Максимальное количество балов за контрольную работу равно 40.
Часть А Каждое задание оценивается в 2 балла.
О химическом элементе, а не о простом веществе азот идет речь в выражении:
азот является составной частью воздуха;
взрывчатое вещество тротил содержит азот;
азот имеет меньшую плотность, чем кислород;
жидкий азот иногда используется для замораживания продуктов;
Смесь бензина с водой можно разделить методом
Фильтрование;
Дистилляция;
Выпаривание;
Отстаивания;
Физическое явление – это:
Испарение воды;
Горение керосина;
Скисание молока;
Ржавление железа;
Чистое вещество в отличие от смеси – это:
Морская вода
Молоко;
Кислород;
Воздух;
Простое вещество – это:
Спирт;
Сера;
Вода;
Сахар;
Относительная молекулярная масса наименьшая у вещества с формулой:
СО2;
СН4;
СО;
СS2;
Запись 6Н означает:
3 молекулы водорода;
6 молекул водорода;
6 атомов гелия;
6 атомов водорода;
Сера проявляет наименьшую валентность в соединении с формулой:
h3S;
SO2;
S2;
SO3;
Массовая доля алюминия в оксиде алюминия Al2O3 равна:
52,94%
0,36%
73,00%
32,65%
Масса 3моль оксида азота (III) равна:
144г;
288г;
188г;
96г;
Часть В
В1 (7 баллов). Рассчитайте массу кислорода, необходимого реакции горения серы, массой 64г.
В2. (7 баллов) Термохимическое уравнение взаимодействия алюминия с серой имеет вид:
2Al + 3S = Al2S3 + 509 кДж
Рассчитайте, какое количество теплоты выделится, если для реакции взяли 81г алюминия.
В3. Расставьте коэффициенты в уравнениях реакций, укажите тип реакции:
h3S + O2 = S + h3O (2 балла)
MnO2 + Al = Mn + Al2O3 ( 2 балла)
KOH + HCl = KClO + KCl + h3O (2 балла)
Решения NCERT для химии класса 12 (обновлено на 2020-21 годы)
Химия NCERT класс 12 включает ряд тем, которые предлагают студентам углубленные знания различных аспектов химии. Чтобы различать уравнения и химические формулы, может пригодиться решение PDF-файла 12 класса химии NCERT. Решение, предлагаемое Vedantu, доступно в легко загружаемом формате PDF.
Вы можете обратиться к решениям класса 12 по химии, чтобы найти лучшие решения и получить хорошие оценки на экзаменах совета директоров, а также подготовиться к конкурсным экзаменам.
Химический класс 12 Разделы решений NCERT
Это решение химического класса 12 состоит из шестнадцати глав, которые содержат диаграммы, иллюстрации, теоретические вопросы и вопросы, связанные с химическими уравнениями.
Давайте посмотрим
Chemistry Class 12 Глава 1 Твердое тело
Первая глава посвящена твердому телу, его природе связывания и форме. Существуют теоретические вопросы относительно классификации твердых тел на такие категории, как металлические, ионные, ковалентные и аморфные твердые тела.Студенты также должны различать тетраэдрическую пустоту, кристаллическую решетку и т. Д.
[Изображение будет загружено в ближайшее время]
В числовых вопросах химии 12 класса, атомная масса серебра и эффективность упаковки в простой кубической гранецентрированной кубический металлический кристалл и объемно-центрированный кубический. Помимо вопросов intext, есть еще 24 дополнительных вопроса.
Chemistry Class 12 Глава 2 Решения
Решения этой второй главы включают 12 интерактивных вопросов, которые являются как числовыми, так и теоретическими, касающимися образования и свойств решений и связанных с ними законов.Есть вопросы, требующие оценки массы бензола, четыреххлористого углерода и молярности растворов, которые также необходимо рассчитать.
| 4а. Метод расчета% процентное содержание элементов в соединении по массе% по массе состав соединения по количеству составляющих элементов рассчитан в три простых шага Химические расчеты 4. Как рассчитать процент (%) по массе элемент в сложной формуле? Как рассчитать процент (%) по массе вода или ион в формуле соединения? (i) Вычислить формулу или молекулярную массу соединения
(ii) Рассчитайте массу указанного элемента (для своего%) в соединении с учетом количества атомов элемента в формуле соединения (iii) Рассчитайте (ii) как процент от (i)
Тесты для самооценки: введите ответ Викторина или большой выбор ВИКТОРИНА НАЧАЛО СТРАНИЦЫ 4б. Другие расчет процентного массового состава, включая% любого компонента в соединение или смесь Используемые атомные массы для 4b.вопросы: C = 12 , Cl = 35,5 , Fe = 56 , H = 1 , Mg = 24 , N = 14 , Na = 23 , O = 16 , S = 32 , К настоящему моменту я предполагаю, что вы можете вычислить формулу массы и читать формулы без каких-либо проблем, поэтому ВСЕ детали таких расчетов НЕ показано, только самое необходимое! Пример 4b.1
Пример 4б.2
Пример 4б.3
Пример 4б.4
Пример 4b.5
Пример 4b.6
Пример 4b.7
Пример 4b.8 ПОЖАЛУЙСТА, ОБРАТИТЕ ВНИМАНИЕ:
НАЧАЛО СТРАНИЦЫ ДРУГИЕ РАСЧЕТНЫЕ СТРАНИЦЫ
как сделать процент по массе Расчеты Редакция KS4 Наука пересмотр как делать проценты по массе расчеты Дополнительные Тройная награда в области науки Курсы по отдельным наукам помогают научиться набирать процент путем пересмотра учебника массовых расчетов Уровень GCSE / IGCSE / O Химия, как рассчитать процент по массе Информационные заметки для изучения для пересмотра для AQA GCSE Наука, как рассчитать процент по массе, Edexcel GCSE Science / IGCSE Chemistry как делать проценты массовыми вычислениями и OCR 21st Century Science, OCR Gateway Наука как рассчитать процент по массе WJEC gcse science chemistry как делать массовые вычисления процентов CEA / CEA gcse science chemistry O Уровень химии (пересмотреть курсы, равные 8 классу США, 9 класс 10 классу как делать процентов по массовым расчетам) Уровень Примечания к пересмотру для продвинутого вспомогательного уровня GCE как делать массовые проценты Расчеты AS Продвинутый Уровень A2 IB Пересмотр того, как делать процент по массе расчеты AQA GCE Chemistry OCR GCE Chemistry как рассчитать процент по массе Edexcel GCE Chemistry Salters Chemistry как делать проценты по массовым вычислениям CIE Химия как рассчитать процент по массе, WJEC GCE AS A2 Chemistry как для вычисления процентов по массе, CCEA / CEA GCE AS A2 Chemistry revision как делать курсы массового расчета процентов для доуниверситетских (соответствует 11-му и 12-му классам в США и уровню AP Honors / Honors как сделать процент Руководство по пересмотру массовых вычислений, как сделать процент по массовым вычислениям, пересмотр химии gcse бесплатные подробные заметки о том, как рассчитать% состав соединение, помогающее пересмотреть химию IGCSE Заметки о пересмотре химии igcse о том, как рассчитать% состав соединения уровня O химия бесплатные подробные примечания о том, как рассчитать% состав соединения, чтобы помочь пересмотреть gcse бесплатные подробные заметки о том, как рассчитать% состав соединения, помогающего пересмотреть уровень O бесплатный веб-сайт по химии, чтобы помочь пересмотреть, как рассчитать% состав соединения для gcse бесплатный веб-сайт по химии, чтобы помочь пересмотреть, как рассчитать% состав соединения для Бесплатный онлайн-сайт igcse Chemistry, который поможет пересмотреть уровень O как рассчитать% состав химического соединения как добиться успеха в вопросах по как рассчитать% состава соединения для ГКСЭ химия как добиться успеха в igcse химия как добиться успеха по химии уровня O хороший сайт для бесплатных вопросов по как рассчитать% состава соединения, чтобы помочь сдать вопросы по химии gcse как рассчитать% состав компаунда сайт бесплатно помогите пройти igcse химия с доработкой примечания о том, как рассчитать% состава соединения хороший веб-сайт для бесплатной помощи для прохождения уровня O химия gcse химия пересмотр бесплатные подробные заметки о том, как рассчитать процент по массе элементов в соединении, чтобы помочь пересмотреть химию igcse Заметки о пересмотре химии igcse о том, как рассчитать процентное содержание по массе элементов в химическом составе соединения на уровне O бесплатные подробные заметки о том, как рассчитать процент по массе элементов в соединении, чтобы помочь пересмотреть gcse бесплатные подробные заметки по химии о том, как рассчитать процент по массе элементов в соединении, чтобы помочь пересмотреть уровень O бесплатный веб-сайт по химии, чтобы помочь пересмотреть, как рассчитать процентное содержание элементов в соединении по массе для gcse бесплатный веб-сайт по химии, чтобы помочь пересмотреть, как рассчитать процентное содержание элементов в соединении по массе для Бесплатный онлайн-сайт igcse Chemistry, который поможет пересмотреть уровень O как рассчитать процентное соотношение по массе элементов в составная химия как добиться успеха в вопросах о том, как вычислить процент по масса элементов в соединении для gcse химия как добиться успеха в igcse химия как добиться успеха по химии уровня O хороший сайт для бесплатных вопросов по как рассчитать процентное соотношение по массе элементов в соединение, помогающее сдать вопросы по химии gcse о том, как рассчитать процент по массе элементов в соединении хорошее сайт бесплатно помогите пройти igcse химия с доработкой примечания о том, как рассчитать процентное соотношение по массе элементов в соединение хороший сайт для бесплатной помощи для сдачи O level химия НАЧАЛО СТРАНИЦЫ |
| 0807.9.1 | Атомы — Определите атомы как элементарные частицы, из которых состоит материя |
| 0807.9.2 | Состояния материи — проиллюстрируйте расположение частиц и тип движения, связанные с различными состояниями материи. |
| 0807.9.3 | Мера — Измерение или вычисление массы, объема и температуры данного вещества |
| 0807.9,4 | Density — Рассчитайте плотность различных объектов |
| 0807.9.5 | Элемент или соединение — Различение элементов и соединений по их символам и формулам |
| 0807.9.6 | Физические или химические — Различия физических и химических изменений |
| 0807.9.7 | Составные части — Опишите, чем характеристики компаунда отличаются от характеристик его составных частей. |
| 0807.9,8 | Взаимодействия — Определите типы взаимодействий между веществами, которые приводят к химическим изменениям |
| 0807.9.9 | Смесь газов — Объясните, как химический состав атмосферы иллюстрирует смесь газов |
| 0807.9.10 | Периодическая таблица— Определите атомный номер, атомную массу, количество протонов, нейтронов и электронов в атоме элемента, используя периодическую таблицу |
| 0807.9,11 | Сохранение массы — Используйте исследования химических и физических изменений для описания закона сохранения массы. |
| 0807.9.12 | Химическая реакция — различие между реагентами и продуктами химического уравнения |
| 0807.9.13 | Кислота или основание — Определите, является ли вещество кислотой или основанием, по его реакции на индикатор |
| 0807.12,1 | Электричество и магнетизм — Создайте диаграмму, чтобы объяснить взаимосвязь между электричеством и магнетизмом |
| 0807.12.2 | Электромагнит — изготовить электромагнит с помощью стержневого магнита и проволочной катушки. |
| 0807.12.3 | Сила электромагнита — Экспериментируйте с электромагнитом, чтобы определить, как изменить его силу |
| 0807.12.4 | Магнитные поля — Создайте диаграмму, чтобы различать магнитное поле Земли и поля, окружающие магнит и электромагнит. |
| 0807.12,5 | Масса и вес — Объясните разницу между массой и весом |
| 0807.12.6 | Гравитационная сила — Определите факторы, которые влияют на количество гравитационной силы между объектами |
| 0807.12.7 | Движение объектов — Объясните, как гравитация влияет на движение объектов в Солнечной системе. |
Показатели государственной деятельности | |
| SPI 0807.9.1 | Материя — Признайте, что вся материя состоит из атомов |
| SPI 0807.9.2 | Химическое изменение — Определите общий результат всех химических изменений |
| SPI 0807.9.3 | Классификация веществ — Классифицируйте обычные вещества как элементы или соединения на основе их символов или формул |
| SPI 0807.9,4 | Смесь или соединение — различие между смесью и соединением |
| SPI 0807.9.5 | Атмосфера — Опишите химический состав атмосферы. | .
| SPI 0807.9.6 | Движение частиц — Сравните расположение частиц и тип движения частиц, связанных с различными состояниями материи |
| SPI 0807.9.7 | Уравнение плотности — примените уравнение для определения плотности объекта на основе его массы и объема |
| SPI 0807.9,8 | Интерпретировать результаты — Интерпретировать результаты расследования, чтобы определить, произошло ли физическое или химическое изменение. |
| SPI 0807.9.9 | Свойства элемента — Используйте периодическую таблицу для определения свойств элемента |
| SPI 0807.9.10 | Реагенты и продукты — Определение реагентов и продуктов химической реакции |
| SPI 0807.9,11 | Закон сохранения — Признать, что в химической реакции масса реагентов равна массе продуктов (Закон сохранения массы) |
| SPI 0807.9.12 | Свойства кислот или оснований — Определение основных свойств кислот и оснований |
| SPI 0807.12.1 | Производство электроэнергии — Признать, что электричество можно производить с помощью магнита и катушки из проволоки |
| SPI 0807.12,2 | Принципы электромагнита — Опишите основные принципы электромагнита |
| SPI 0807.12.3 | Магнитное поле Земли — Различайте магнитное поле Земли, магнит и поля, которые окружают магнит и электромагнит |
| SPI 0807.12.4 | Измерение массы и веса — Различия между массой и весом с помощью соответствующих измерительных приборов и единиц |
| SPI 0807.12,5 | Гравитационное притяжение — Определите взаимосвязь между массой объектов, расстоянием между этими объектами и силой гравитационного притяжения. |
| SPI 0807.12.6 | Движение в космосе — проиллюстрируйте, как гравитация контролирует движение объектов в солнечной системе. |
 | Balance Chemical Equation — Онлайн-балансир
© 2020 webqc.org Все права защищены |
HSC Chemistry — Outotec
Меню
Переключить навигацию
- Продукция и Услуги
- Технологии
- Услуги
- Товары
- Информационные бюллетени
- Анализаторы и автоматика
- Переработка бокситов и глинозема
- Алюминиевые решения
- Решения для обогатительной фабрики
- Цифровые решения
- Прямое восстановление и плавление
- Сортировка
- Производство энергии
- Фильтрация
- Флотация
- Шлифовальный
- Гидрометаллургия
- Промышленная водоподготовка
- Хвостохранилище
- Физическое разделение
- Обжарка
- Спекание и гранулирование
- Плавка и переработка
- Производство серной кислоты
- Утолщение и осветление
Ионная сила (формула ионной силы)
Определение: Ионная сила — это мера концентрации ионов в растворе.Он был определен Льюисом и Рэндаллом в 1921 году и основан на диссоциации, которая проявляется солями, кислотой и основаниями, когда они находятся в водном растворе. Он выражается в единицах концентрации, например в молярной концентрации (моль / л).
Общая формула: Формула ионной силы рассчитывается как сумма молярной концентрации каждого иона, умноженная на квадрат валентности.
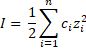
, где член 1/2 связан с тем, что рассматриваются оба иона (катион и анион), c — концентрация в молярных единицах (моль / л), а z — заряд каждого иона.Например, если ионы представляют собой сульфат (SO 4 2-) z = 2. Как видно, многовалентный ион имеет больший вклад.
Использование: Используется в теоретической химии для расчета диссоциации солей в гетерогенных системах, таких как коллоиды. Он также используется в биохимии и молекулярной биологии для определения силы буферных растворов, которые должны иметь концентрации, аналогичные обнаруженным в природе.
Пример: Для раствора хлорида калия 3 M рассчитать ионную силу.
Сначала необходимо провести диссоциацию: KCl → K + + Cl —
Итак, концентрация каждого иона такая же, как концентрация соли, 3 моль / л.
Тогда можно применить уравнение:
I = 1/2 [(3 моль / л) (+ 1) 2 + (3 моль / л) (- 1) 2 ] = 3 M
Для раствора хлорида калия 1 M и сульфата магния 0,2 M рассчитайте ионную силу.
Сначала необходимо провести диссоциацию: KCl → K + + Cl — и MgSO 4 → Mg 2+ + SO 4 2-
Тогда можно применить уравнение:
I = 1/2 [(1 моль / л) (+ 1) 2 + (1 моль / л) (- 1) 2 + (0.2 моль / л) (+ 2) 2 + (0,2 моль / л) (- 2) 2 ] = 3,6 M
Соображения: для неидеальных растворов (растворов, которые не соответствуют идеальному поведению, например, растворов, в которых следует учитывать силы взаимодействия), вместо молярности используется единица моляльности (моль / кг H 2 O). .
.