Входной контроль по химии 10 класс
Входной контроль по химии для 10 класса.
Пояснительная записка.
Входная контрольная работа представлена в виде теста в двух вариантах.
Цель проведения: определить уровень знаний, умений и навыков учащихся на начало учебного года.
На выполнение работы отводится 30 минут.
Структура работы:
Работа состоит из двух частей, включающих в себя 8 заданий.
Часть 1 содержит 6 заданий с кратким ответом базового уровня сложности с ответом в виде одной цифры, соответствующей номеру правильного ответа; 7- задание повышенного уровня сложности, на установление соответствия элементов двух информационных рядов и записью ответа в виде последовательности цифр. Часть 2 содержит 1 задание с развёрнутым ответом.
Спецификация теста:
Распределение заданий по основным содержательным разделам курса
 Химические свойства кислот
Химические свойства кислот4
Химические свойства солей. Реакции ионного обмена.
5
Техника безопасности при работе с химическими веществами в лаборатории и быту
6
Химические свойства простых и сложных веществ.
7
Взаимосвязь между основными классами неорганических веществ.
8
Распределение заданий по проверяемым умениям и способам действий
На выполнение работы отводится 30 минут. Работа состоит из 2 частей, содержащих 8 заданий.
Часть 1 содержит 7 заданий. К каждому заданию (1–6) дается 4 варианта ответа, из которых только один правильный. На 7 задание нужно дать краткий ответ в виде набора цифр.
Часть 2 включает 1 задания, выполнение которых предполагает написание полного, развернутого ответа, включающего необходимые уравнения реакций.
Полученные вами баллы за выполнение всех заданий суммируются. Итоговая оценка определяется по 5-балльной шкале: 0-6 баллов – «2», 7-8 баллов «3»; 9-10 баллов «4»; 11-12 балла «5».
При выполнении работы вы можете пользоваться периодической системой химических элементов Д.И. Менделеева, таблицей растворимости солей, кислот и оснований в воде, электрохимическим рядом напряжений металлов и непрограммируемым калькулятором.
Советуем выполнять задания в том порядке, в котором они даны. Для экономии времени пропускайте задание, которое не удается выполнить сразу, и переходите к следующему. Если после выполнения всей работы у вас останется время, вы сможете вернуться к пропущенным заданиям. Постарайтесь выполнить как можно больше заданий и набрать максимально возможное количество баллов.
Желаем успеха!
2.Текст работы
Входной контроль
Химия, 10 класс
1 вариант
Часть 1
1. Химическому элементу 2-го периода VIA-группы соответствует схема распределения электронов
Химическому элементу 2-го периода VIA-группы соответствует схема распределения электронов
2. В каком ряду химических элементов усиливаются металлические свойства соответствующих им простых веществ?
калий → натрий → литий
сурьма → мышьяк → фосфор
углерод → кремний → германий
алюминий → кремний → углерод
3. Электролитом не является
SO3
NaOH
HCl
K2SO4
4. Раствор серной кислоты взаимодействует
только с основными оксидами
только с кислотными оксидами
с основными и кислотными оксидами
с основными и амфотерными оксидами
5.
 Между какими веществами возможно взаимодействие?
Между какими веществами возможно взаимодействие?
CaCl2 и H2O
AgCl и HNO3
BaCl2 и CuSO4
AlCl3 и Na2SO4
6.Верны ли следующие суждения о правилах безопасной работы в лаборатории?
А. При получении кислорода из раствора пероксида водорода необходимо использовать резиновые перчатки.
Б. При растворении соды в воде необходимо надеть защитные очки.
верно только А
верно только Б
верны оба суждения
оба суждения неверны
7.Установите соответствие между исходными веществами и продуктами реакции.
Часть 2
8.

Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.
Входной
Химия, 10 класс
2 вариант
Часть 1
1.Во 2-м периоде VIA группе Периодической системы находится химический элемент, схема строения атома которого
2.
 Неметаллические свойства фосфора выражены сильнее, чем неметаллические свойства
Неметаллические свойства фосфора выражены сильнее, чем неметаллические свойстваазота
кислорода
кремния
3. Электролитом не является
H2SO4
KOH
NaCl
CaO
4. Гидроксид кальция реагирует с
углекислым газом
кислородом
водородом
поваренной солью
5.Между какими веществами возможно взаимодействие?
MgCl2 и H
AgCl и HNO3
BaCl2 и CuSO4
NaCl и K2SO4
6.
 Верны ли суждения о правилах применения и хранения препаратов бытовой химии?
Верны ли суждения о правилах применения и хранения препаратов бытовой химии?А. Аэрозоли, использующиеся в качестве средств для борьбы с бытовыми насекомыми, безопасны для детей и животных.
Б. Растворители и моющие средства допускается хранить в доступных для детей местах.
верно только А
верно только Б
верны оба суждения
оба суждения неверны
7.Установите соответствие между исходными веществами и продуктами реакции.
Часть 2
8. Дана схема превращений: S → X → H2SO3 → Na2SO3
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.

3.Критерии оценивания
Каждое задание теста оценивается соответствующим баллом, определенным сложностью задания. Максимальное количество баллов-16
Верное выполнение каждого задания Части 1 (1–6) оценивается1 баллом. За выполнение задания с выбором ответа выставляется 1 балл при условии, что указан только один номер правильного ответа. Если отмечены два и более ответов, в том числе правильный, то ответ не засчитывается.
Задание с кратким ответом считается выполненным верно, если в заданиях 7 правильно указана последовательность цифр. За полный правильный ответ на задание ставится 2 балла, если допущена одна ошибка, то ответ оценивается в 1 балл.
 Если допущены две и более ошибки или ответа нет, то выставляется 0 баллов
Если допущены две и более ошибки или ответа нет, то выставляется 0 балловОтветы
Часть 2
1 вариант
Задание 8
Дана схема превращений: Мg → X → MgCl2→Mg(OH)2
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.
- Элементы ответа
(допускаются иные формулировки ответа, не искажающие его смысл)
Написаны уравнения реакций, соответствующие схеме превращений:
1) 2Мg + O2 = 2 МgO
2) МgO + 2HCl = МgCl2 + H2O
3) МgCl2 + 2NaOH = Mg(OH)2 + 2NaCl
Критерии оценивания
Баллы
Ответ правильный и полный, включает все названные элементы.

3
Правильно записаны 3 уравнения реакций.
3
Правильно записаны 2 уравнения реакций.
2
Правильно записано 1 уравнение реакции.
1
Все элементы ответа записаны неверно.
0
Максимальный балл
3
2 вариант
Задание 8. Дана схема превращений: S → X → H2SO3 → Na2SO3
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.

- Элементы ответа
(допускаются иные формулировки ответа, не искажающие его смысл)
Написаны уравнения реакций, соответствующие схеме превращений:
1) S + O2 = SO2
2) SO2 + H2O = H2SO3
3) H2SO3 + 2NaOH = Na2SO3+ 2 H2O
Критерии оценивания
Баллы
Ответ правильный и полный, включает все названные элементы.
3
Правильно записаны 3 уравнения реакций.
3
Правильно записаны 2 уравнения реакций.
2
Правильно записано 1 уравнение реакции.

1
Все элементы ответа записаны неверно.
0
Максимальный балл
3
Ученик справился с работой, если он выполнил не менее 50% заданий. Оценка “5” – если выполнено 90–100% заданий, оценка “4” – выполнено 70–89% заданий, оценка “3” – выполнено 50–69% заданий
Перевод баллов в оценку:
оценка5
4
3
2
баллы
11-12
9-10
7-8
0-6
4.
 Правильные ответы:
Правильные ответы:Часть 1
Часть 2
1 вариант
Задание 8
Дана схема превращений: Мg → X → MgCl2→Mg(OH)2
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.
- Элементы ответа
(допускаются иные формулировки ответа, не искажающие его смысл)
Написаны уравнения реакций, соответствующие схеме превращений:
1) 2Мg + O2 = 2 МgO
2) МgO + 2HCl = МgCl2 + H2O
3) МgCl2 + 2NaOH = Mg(OH)2 + 2NaCl
2 вариант
Задание 8. Дана схема превращений: S → X → H2SO3 → Na2SO3
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.

- Элементы ответа
(допускаются иные формулировки ответа, не искажающие его смысл)
Написаны уравнения реакций, соответствующие схеме превращений:
1) S + O2 = SO2
2) SO2 + H2O = H2SO3
3) H2SO3 + 2NaOH = Na2SO3+ 2 H2O
Ссылки на источники:
ФИПИ открытый банк заданий ОГЭ по химии http://www.fipi.ru/content/otkrytyy-bank-zadaniy-oge
2. ГИА 9 http://gia.edu.ru/ru/
3. Решу ОГЭ https://chem-oge.sdamgia.ru/
Входная контрольная работа по химии (10 класс)
Входная контрольная работа 10 класс
Вариант 1.
А 1. Химический элемент, имеет следующее распределение электронов по энергетическим уровням в атоме: 2е, 8е, 4е. Какое положение занимает в Периодической системе
1) 4-й период, главная подгруппа III группа 3) 3-й период, главная подгруппа IV группа 2) 2-й период, главная подгруппа IV группа 4) 3-й период, главная подгруппа II группа
А 2. Элемент с наиболее ярко выраженными неметаллическими свойствами: 1) кремний 2) магний 3) сера 4) фосфор
А 3. Схеме превращения N+2 → N+4 соответствует химическое уравнение: 1) N2 + 3Mg = Мg3N2 3) N2 + О2 = 2NO 2) N2 + 3Н2 = 2NН3 4) 2NO + О2 = 2NО2
А 4. Количество водорода, выделившегося при взаимодействии 2 моль серной кислоты с цинком, равно …(моль). 1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
А 5. Углекислый газ проявляет свойства кислотного оксида, реагируя с … 1)Mg 2) Ca(OH)2 3) С 4) HCl
А 6. Ион SO42- можно обнаружить с помощью раствора, содержащего катион: 1) бария 2) водорода 3) калия 4) меди
Ион SO42- можно обнаружить с помощью раствора, содержащего катион: 1) бария 2) водорода 3) калия 4) меди
А 7. Коэффициент перед окислителем в уравнении реакции Ca + N2 Ca3N2 равен: 1) 1 2) 2 3) 3 4) 6
А 8. Азот имеет степень окисления +3 в ряду веществ: 1) N2О3, HNО3, KNО2 3) NaNО2, N2О3, HNO2 2) NН3, N2О3, НNO3 4) KNО3, HNО2, NH3
А 9. Кристаллическое вещество тёмно-фиолетового цвета, плохо растворяется в воде, но хорошо в спирте, при нагревании из твердого состояния переходит в газообразное, минуя жидкое, соединяется с водородом при нагревании, в его растворе крахмал синеет. 1)S 2) I2 3) CuO 4) KMnО4
А 10. Сокращенное ионное уравнение Fe2++2OH—=Fe(OH)2 соответствует взаимодействию 1) гидроксида калия и фосфата железа (II) 3) нитрата железа (III) и гидроксида натрия 2) нитрата железа (II) и гидроксида меди (II) 4) хлорида железа (II) и гидроксида бария
Часть В.
Ответом к заданию В 1 является последовательность цифр в порядке возрастания.
В 1. С раствором гидроксида натрия реагируют:
1) CuSO4 2) CuO 3) KOH 4) HNO3 5) Zn(OH)2 6) CO2
В2.Установите соответствие между правой и левой частями уравнений
1122
33
44
Часть С.
Запишите номер задания и полное решение
C1. Какой объем водорода (н.у.) образуется при взаимодействии 60г кальция с водой, если объёмная доля выхода продукта составляет 90%?
C2. По схеме превращений составьте уравнения реакций в молекулярном виде. Превращение № 1 рассмотрите с точки зрения ОВР.
Ca CaO Ca(OH)2 CaCO3
Мониторинг качества знаний по химии 9 класс.
Вариант 2.
А 1. Химический элемент, имеет следующее распределение электронов по энергетическим уровням в атоме: 2е, 8е, 6е. Какое положение занимает в Периодической системе
1) 2-й период, главная подгруппа VII группа 3) 3-й период, главная подгруппа VI группа 2) 2-й период, главная подгруппа VI группа 4) 2-й период, главная подгруппа II группа
А 2. Элемент с наиболее ярко выраженными металлическими свойствами: 1) калий 2) литий 3) натрий 4) рубидий
А 3. Схеме превращения S -2 → S+4 соответствует химическое уравнение: 1) SO2 + Н2О = Н2SO3 3) 2SO2 + O2 = 2SO3 2) Н2 + S = Н2S 4) 2Н2S + 3O2 = 2SO2 + 2Н2О
А 4. Количество водорода, выделившегося при взаимодействии 3 моль серной кислоты с магнием, равно …(моль). 1) 1 моль 2) 2 моль 3) 3 моль 4) 6 моль
А 5. Оксид серы (IV) проявляет свойства кислотного оксида, реагируя с … 1)NaOH 2) Ca 3) P2O5 4) HCl
Оксид серы (IV) проявляет свойства кислотного оксида, реагируя с … 1)NaOH 2) Ca 3) P2O5 4) HCl
А 6. Ион Cl— можно обнаружить с помощью раствора, содержащего катион: 1) бария 2) серебра 3) калия 4) меди
А 7. Коэффициент перед восстановителем в уравнении реакции Na + N2 Na3N равен: 1) 1 2) 2 3) 3 4) 6
А 8. Низшие отрицательные степени окисления азота, серы и хлора соответственно равны 1) -5; -6; -7 3) -2; -3; -4 2) -4; -3; -2 4) -3; -2; -1
А 9. Порошок красного цвета, не ядовит, не растворяется в воде, при нагревании быстро загорается с образованием «белого дыма», который жадно поглощает воду, образуя кислоту, называется
1) оксид фосфора (V) 3) фосфорная кислота
2) фосфор 4) фосфат натрия
А 10. Сокращенное ионное уравнение 2H++CO32- = H2O + CO2 соответствует взаимодействию 1) серной кислоты с оксидом углерода (IV) 3) азотной кислоты с гидроксидом кальция 2) углекислого газа с гидроксидом кальция 4) карбоната натрия с соляной кислотой
Часть В.
Ответом к заданию В 1 является последовательность цифр в порядке возрастания.
В1. С соляной кислотой реагируют:
1) Zn 2) Mg(OH)2 3) Na2O 4) Na2CO3 5) BaCl2 6) SO2
В2.Установите соответствие между правой и левой частями уравнений
- 11
22
33
44
Д)CuCl2+BaSO4↓
Часть С.
Запишите номер задания и полное решение
C1. Какой объем оксида углерода (IV) образуется при взаимодействии 60г карбоната кальция, содержащего 10% примесей, с соляной кислотой?
С2. По схеме превращений составьте уравнения реакций в молекулярном виде. Для превращения № 3 запишите полное и сокращенное ионные уравнения.
Fe(OH)3 Fe2O3 FeCl3 Fe(OH)3
Инструкция по проверке заданий
Минимальное число баллов за тест — 22, из них за задания части А – 10 (по 1 баллу за задание), части В – 4 (по 2 балла за задание), части С – 8 (по 4 балла за задание)
ЧастьА
Часть В.
Вариант 1.
В1. 1, 4, 5, 6
В2.
Вариант 2.
В1. 1, 2, 3, 4
В2.
Часть С.
С1
Вариант 1.
1.Составлено уравнение реакции: Ca + 2H2O = Ca(OH)2 + H2
2. Рассчитано количество вещества Ca: n(Ca) = 60:40 =1,5 моль
3.Найдено количество вещества водорода и объём водорода по уравнению реакции (теоретический V): n(H2) = n(Ca) = 1,5 моль, V(H2) = 1,5 * 22,4 = 33,6 л
4. Рассчитан V(H2) практический: V(H2)= 33,6 * 0,9=30,24 л.
За каждый элемент задачи по 1 баллу, всего за задание 4 балла.
(Возможно решение другим способом)
Вариант 2.
1.Составлено уравнение реакции: CaCO3 + 2HCl = CaCl2 + H2O + CO2
2. Рассчитана масса чистого вещества карбоната кальция: n(CaCO3) = 60*0,9 =54 г. 3.Найдено количество вещества карбоната кальция: n(CaCO3) = 54:100=0,54 моль.
3.Найдено количество вещества карбоната кальция: n(CaCO3) = 54:100=0,54 моль.
4. Рассчитано количество вещества и объём углекислого газа по уравнению реакции n(CO2) = n(CaCO3) = 0,54 моль, V(CO2) = 0,54 * 22,4 = 12,096 л
За каждый элемент задачи по 1 баллу, всего за задание 4 балла.
(Возможно решение другим способом)
С2. Вариант 1.
Ca CaO Ca(OH)2 CaCO3
2Ca + O2 = 2 CaO (1б)
CaO + H2O = Ca(OH)2 (1б)
Ca(OH)2 + CO2 = CaCO3 + H2O (1б)
Записан электронный баланс для 1 реакции. (1б)
С2. Вариант 1.
Fe(OH)3 Fe2O3 FeCl3 Fe(OH)3
2Fe(OH)3= Fe2O3 + 3H2O (1б)
Fe2O3 + 6HCl = 2FeCl3 + 3H2O (1б)
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl (1б)
Записано ионное и сокращённое ионное уравнение для 3 реакции.
 (1б)
(1б)
Шкала перевода баллов в отметку:
8 — 14 «3»
15 – 18 «4»
19 – 22 «5»
Контрольная работа по химии «Входной контроль» (10 профильный класс)
Входной контроль по химии в 10 профильном классе
Вариант 1
Часть 1. С одним вариантом ответа ( оценивается по 1 баллу)
1. Укажите заряд ядра атома и число неспаренных электронов у атома фосфора в основном состоянии
1) +5 и 15 2) +15 и 3 3) +15 и 5 4) +15 и 1
2. Какой вид химической связи в молекуле аммиака:
1) ковалентная неполярная 3) ковалентная полярная
2) металлическая 4) ионная
3. К кислотным оксидам относится каждое из двух веществ:
1) СО2, СаО 3) SO2, CO
2) SO2, P2O5 4) P2O5, Al2O3
4.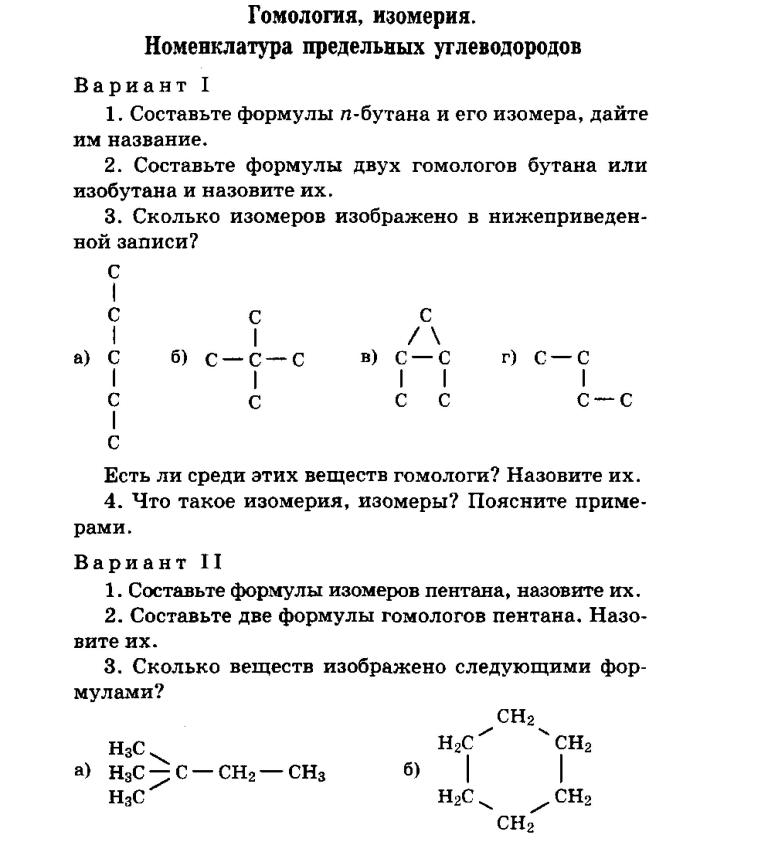 Верны ли следующие суждения об использовании лабораторного оборудования и правила хранения препаратов бытовой химии?
Верны ли следующие суждения об использовании лабораторного оборудования и правила хранения препаратов бытовой химии?
А) Для отбора определенного объема жидкости используют мерный цилиндр
Б) Средства бытовой химии следует хранить отдельно от продуктов питания.
1) верно только А 3) верны оба суждения
2) верно только В 4) оба суждения неверны
5. В каких соединениях атомы азота и фосфора имеют одинаковое значение степени окисления?
NH3 и PCl5 3) N2O3 и PH3
NH3 и Ca3P2 4) NaNO2 и P2O5
6. К электролитам относится
1) С2Н5ОН 2) С12Н24 3) Са(ОН)2 4) СО
7. Хлорид-ионы образуются при электролитической диссоциации:
1) KClO4 2) KClO3 3) CH3Cl 4) KCl
8. Взаимодействие соляной кислоты и едкого натра отвечает краткое ионное уравнение:
Взаимодействие соляной кислоты и едкого натра отвечает краткое ионное уравнение:
1) HCl + OH— = H2O + Cl— 3) H+ + NaOH = H2O + Na+
2) H+ + OH— = H2O 4) H+ + Cl— + OH— = H2O + Cl—
9. Различить растворы соляной и серной кислот можно, если добавить к ним раствор
1) лакмуса 3) фенолфталеина
2) нитрата бария 4) гидроксида калия
10. Массовая доля азота в нитрате алюминия равна
1) 14,0% 2) 19,7% 3) 6,6% 4) 21,3%
Часть 2. При выполнении заданий выберите один или несколько правильных ответов и запишите их в порядке возрастания цифр (за правильный ответ по 2 балла)
11. В ряду химических элементов Li – Be – B
1) увеличивается заряд ядра атома
2) возрастают кислотные свойства образуемых гидроксидов
3) увеличивается число электронных уровней
4) уменьшается электроотрицательность
5) возрастает атомный радиус
12.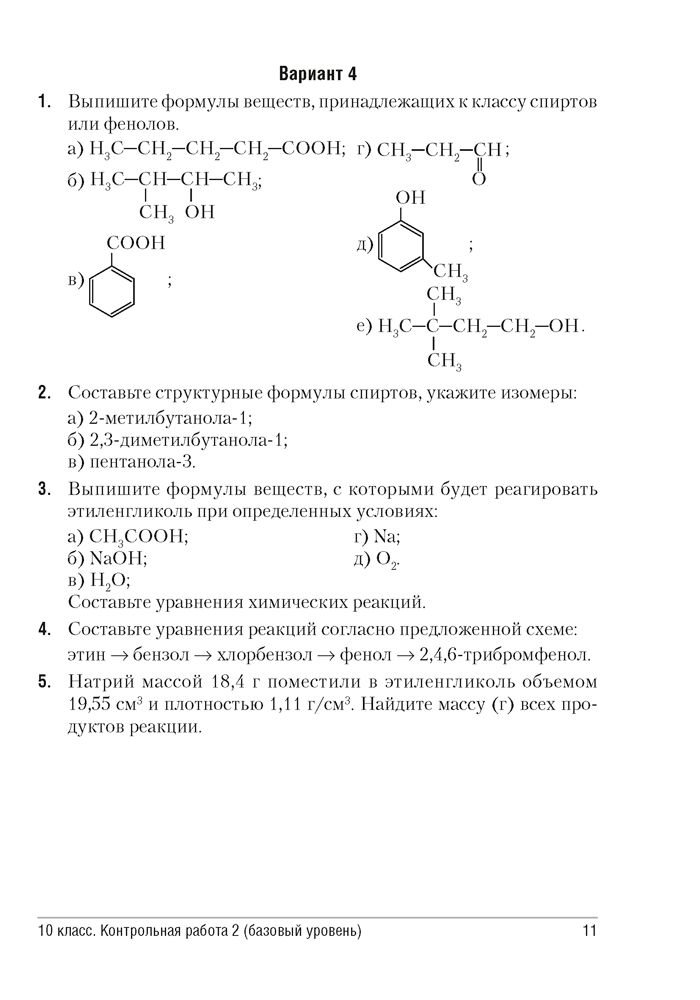 Установите соответствие между схемой химической реакции и веществом-восстановителем в ней.
Установите соответствие между схемой химической реакции и веществом-восстановителем в ней.
СХЕМА РЕАКЦИИ ВОССТАНОВИТЕЛЬ
А) HCl + KMnO4 → MnCl2 + KCl + Cl2 + H2O 1) KMnO4
Б) H2S + HClO3 → HCl + S + H2O 2) HCl
В) HCl + Mg → MgCl2 + H2 3) HClO3
4) H2S
5) Mg
13. Установите соответствие между веществом и реагентами, с которыми оно может вступать в реакцию.
ВЕЩЕСТВО РЕАГЕНТЫ
А) железо 1) Na2O, Mg
Б) оксид углерода (IV) 2) K2SO4, HNO3
В) гидроксид калия 3) HCl, O2
4) CuSO4, Al(OH)3
Часть 3. Для выполнения задания части 3 необходимо записать полное решение и ответ к нему.
14. Дана схема превращений:
CuSO4 → X → Cu(NO3)2 → Cu
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращенное ионное уравнение реакции. (4 балла)
Для второго превращения составьте сокращенное ионное уравнение реакции. (4 балла)
15. Рассчитайте массу осадка, который выпадает при взаимодействии избытка карбоната калия с 17,4 г раствора нитрата бария с массовой долей 15%. (4 балла)
16. К раствору соли добавили гидроксид натрия при этом выпал осадок голубого цвета, а при добавлении к этому же раствору соли нитрат серебра выпадает осадок белого цвета. Определить исходное вещество. Написать уравнения всех реакций. (4 балла)
Входной контроль по химии в 10 профильном классе
Вариант 2
Часть 1. С одним вариантом ответа ( оценивается по 1 баллу)
1. Укажите заряд ядра атома и число неспаренных электронов у атома серы в основном состоянии.
+6 и 16 2) +16 и 6 3) +16 и 4 4) +16 и 2
2. Ковалентная полярная связь образуется между атомами
натрия и брома 3) водорода
серы и кислорода 4) калия и хлора
3. Только к основным оксидам относится каждое из двух веществ:
Только к основным оксидам относится каждое из двух веществ:
1) СО2, СаО
2) SO2, P2O5
3) СаО, Al2O3
4) BaO, Na2O
4. Верны ли следующие суждения о правилах обращения с веществами?
А. Химические вещества нельзя определять по запаху.
Б. Сыпучие вещества следует брать химической ложечкой.
1) верно только А 3) верны оба суждения
2) верно только Б 4) оба суждения неверны
5. Такую же степень окисления, как и в SO2, сера имеет в соединении
K2SO4 3) H2SO3
(NH4)2S 4) SO3
6. Не является электролитом
1) NaOH 2) CH3OH 3) Са(ОН)2 4) HCl
7. Хлорид-ионы образуются при электролитической диссоциации:
1) NaClO4 2) NaCl 3) CH3Cl 4) NaClO3
8. Взаимодействие азотной кислоты и едкого калия отвечает краткое ионное уравнение:
Взаимодействие азотной кислоты и едкого калия отвечает краткое ионное уравнение:
1) HNO3 + OH— = H2O + NO3— 3) H+ + KOH = H2O + K+
2) H+ + OH— = H2O 4) H+ + NO3— + OH— = H2O + NO3—
9. С помощью соляной кислоты можно распознать:
1) карбонат натрия 3) хлорид натрия
2) сульфат бария 4) нитрат магния
10. Массовая доля кислорода в нитрате алюминия равна
1) 7,5% 2) 22,5% 3) 42,4% 4) 67,6%
Часть 2. При выполнении заданий выберите один или несколько правильных ответов и запишите их в порядке возрастания цифр (за правильный ответ по 2 балла)
11. В ряду химических элементов Be – Mg – Ca
1) уменьшается число электронов на внешнем уровне
2) возрастает высшая степень окисления
3) увеличиваются основные свойства образуемых гидроксидов
4) увеличивается электроотрицательность
5) возрастает атомный радиус
12. Установите соответствие между схемой химической реакции и веществом-восстановителем в ней.
Установите соответствие между схемой химической реакции и веществом-восстановителем в ней.
СХЕМА РЕАКЦИИ ВОССТАНОВИТЕЛЬ
А) H2S + O2 → SO2 + H2O 1) SO2
Б) H2SO4 + Na → Na2SO4 +H2S + H2O 2) H2S
В) SO2 + Br2 + H2O → H2SO4 + HBr 3) Na
4) H2O
5) Br2
13. Установите соответствие между веществом и реагентами, с которыми оно может вступать в реакцию.
ВЕЩЕСТВО РЕАГЕНТЫ
А) оксид цинка 1) K2O, Fe
Б) углекислый газ 2) SO2, H2O
В) серная кислота (разб.) 3) HCl, Ca(OH)2
4) H2O, C
Часть 3. Для выполнения задания части 3 необходимо записать полное решение и ответ к нему.
14. Дана схема превращений:
CuСl2 → X → Cu(NO3)2 → Cu
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращенное ионное уравнение реакции. (4 балла)
Для первого превращения составьте сокращенное ионное уравнение реакции. (4 балла)
15. В соляной кислоте растворили 1,506 г известняка, содержащего 77% карбоната кальция. Определите объем углекислого газа, выделившегося при этом. (4 балла)
16. К раствору соли добавили гидроксид натрия при этом выпал осадок голубого цвета, а при добавлении к этому же раствору соли хлорида бария выпадает осадок белого цвета. Определить исходное вещество. Написать уравнения всех реакций. (4 балла)
Входной контроль по органической химии для 10 класса
Вариант 1
1. Как называются вещества, имеющие одинаковый состав, но разное строение: 1) полимеры 2) изомеры 3) гомологи 4) алканы.
2. Какой из рядов содержит вещества, не имеющие изомеров?
1) пропадиен, этилен, ацетилен 2) метан, ацетилен, пропан
3) пропан, пропаналь, бутан 4) этан, бензол, циклопропен
3.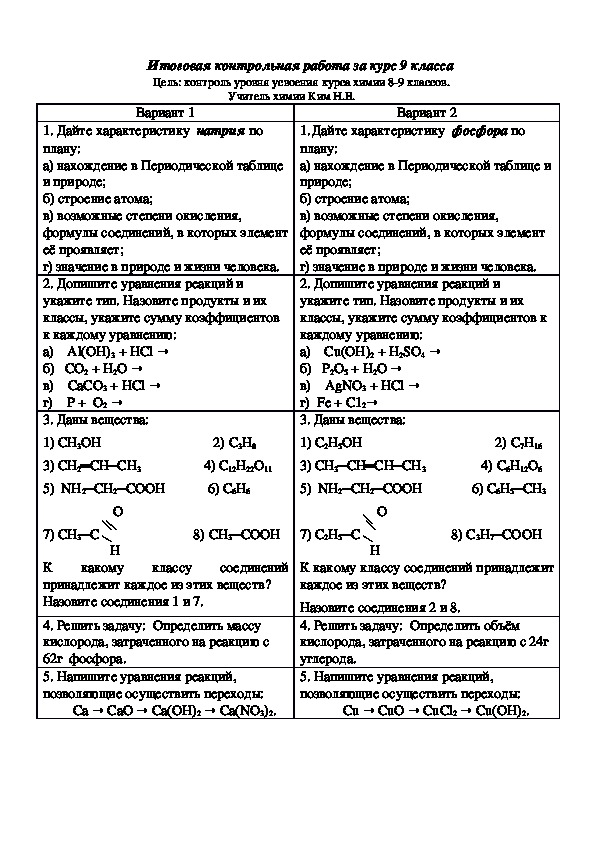 Четвертичный атом углерода соединен с четырьмя …
Четвертичный атом углерода соединен с четырьмя …
1) атомами углерода 2) атомами водорода
3) углеродными скелетами 4) функциональными группами
4. B молекуле этилена имеются:
1) одна σ- и одна π –связь 3) пять σ- и две π -связи
2) две σ- и три π –связи 4) пять σ- и одна π -связь
5. В молекуле какого вещества все атомы углерода находятся в состоянии sp2-гибридизации?
1) гексана 2) гексена 3) этана 4) этена
6. В виде цис-транс-изомеров может существовать:
1) этилен 2) пентен-1 3) пентен-2 4) 2-метилпентен-2
7. Для метана характерна реакция с:
1) водородом 2) хлороводородом 3) хлором 4) медью
8. Основным продуктом взаимодействия пропана с бромом является:
1) 1-бромпропан 3) 2-бромпропан
2) 1,2- дибромпропан 4) 1,1-дибромпропан
9. Из какого галогеналкана можно с помощью реакции Вюрца получить
4,5-диметилоктан:
1) 2-бромпентан 3) 2-бромбутан
2) 1-бромбутан 4)1-хлор-1-метилбутан
10. При взаимодействии бутена-1 с водой образуется преимущественно:
При взаимодействии бутена-1 с водой образуется преимущественно:
1) бутен-1-ол-2 2) бутанол-2 3) бутанол-1 4) бутен-1-ол-1
11. Составьте уравнение ОВР окисления пропена перманганатом калия в сернокислой среде.
12. Относительная плотность паров углеводорода по азоту равна 3. Массовая доля углерода в нём равна 85,71%. Выведите его молекулярную формулу.
Вариант 2
1. Найдите верное утверждение:
1) два гомолога могут являться изомерами;
2) два изомера могут являться гомологами;
3) два вещества, являющиеся изомерами, не могут относиться к различным гомологическим рядам;
4) два вещества, состав молекул которых отличается на одну или несколько групп -СН2-, являются гомологами.
2. Изомерами являются:
1) пентан и пентадиен 3) бутан и циклобутан
2) этан и ацетилен 4) бутен и циклобутан
3. Число сигма-связей в молекуле изобутана: 1) 3 2) 4 3) 13 4) 12
4. В каком из углеводородов величина валентного угла между атомами углерода максимальна:
В каком из углеводородов величина валентного угла между атомами углерода максимальна:
1) пропан 2) пропен 3) пропин 4) циклопропан.
5. В молекуле 2-метилбутена-2 гибридизация орбиталей углеродных атомов:
1) только sp3 2) только sp2 3) sp3 и sp2 4) sp3 и sp
6. При пиролизе метана не образуется:
1) водород 2) этан 3) ацетилен 4) сажа
7. Какой из алканов не способен к реакции ароматизации:
1) 2-метилгексан 2) н-октан 3) 3,4- диметилгептан 4) 3-метилпентан
8. Метан можно получить в реакции:
1) карбида алюминия с водой 2) гидрирования ацетилена
3) дегидратации метанола 4) гидратации карбида кальция
9. При комнатной температуре этилен вступает в реакции:
1) гидрохлорирования и гидрирования 2) бромирования и окисления
3) гидратации и полимеризации 4) дегидрирования и горения
10. В результате реакции присоединения воды к 2-метилпропену преимущественно образуется:
1) бутанол-2 3) 2-метилпропанол-1
2) 2-метилпропанол-2 4) 2-метилпропандиол-1,2
11. Составьте уравнение ОВР окисления пентена-2 перманганатом калия в водной среде.
Составьте уравнение ОВР окисления пентена-2 перманганатом калия в водной среде.
12. При сжигании 8,4г органического вещества получено 26,4г углекислого газа и 10,8г воды. Плотность паров по воздуху равна 2,9. Определите молекулярную формулу вещества.
Вариант 3
1. Какой простейший алкан имеет изомеры?
1) этан 2) метан 3) бутан 4) пропан
2. Изомерами являются:
1) циклопропан и циклогексан 3) метан и пропан
2) бутен-1 и бутен-2 4) гексен-1 и гептен-2
3. Название углеводорода, в молекуле которого содержатся 13 σ-связей:
1) бутан 2) 2-метилбутан 3) 2-метилбутен-1 4) бутин-1
4. Вещество, в молекуле которого имеются только два атома углерода в sp2-гибридном состоянии и один атом углерода в sp3-гибридном состоянии:
1) пропин 2) бутен 3) пропан 4) пропен
5. Верны ли следующие суждения о свойствах алканов?
А. Для алканов не характерна реакция присоединения.
Б. Галогенирование алканов протекает по цепному радикальному механизму.
1) верно только А 3) оба суждения верны
2) верно только Б 4) оба суждения не верны
6. Превращение бутана в бутен относится к реакции:
1) полимеризации 3) дегидратации
2) дегидрирования 4) изомеризации
7. 2-метилбутан не вступает в реакцию полимеризации, т.к.
1) является углеводородом
2) его молекула не симметрична
3) в его молекуле нет пи-связей
4) в его молекуле есть тетраэдрические структуры
8. Бутан нельзя получить в одну стадию из:
1) хлорэтана 2) бутена 3) бутановой кислоты 4) пентаноата калия
9. Этанол можно получить из этилена в результате реакции:
1) гидратации 3) галогенирования
2) гидрирования 4) гидрогалогенирования
10. При взаимодействии бутена-1 с бромоводородом образуется преимущественно:
1) 2-бромбутан 3) 1-бромбутан
2) 2-бромбутен-1 4) 1-бромбутен-1
11. Составьте уравнение ОВР окисления 2-метилбутена-2 перманганатом калия в сернокислой среде.
Составьте уравнение ОВР окисления 2-метилбутена-2 перманганатом калия в сернокислой среде.
12. Определите молекулярную формулу алкена, если 11,2г его взаимодействуют с бромоводородом с образованием 27,4г бромпроизводного.
Вариант 4
1. К ряду алканов относится:
1) C7h22 2) C7h26 3) C7H6 4) C7H8
2. Число изомеров, имеющих формулу C5h22, равно:
1) 5 2) 2 3) 3 4) 4
3. Гомологи различаются:
1) физическими свойствами 3) значением молярных масс
2) химическим строением 4) качественным и количественным составом
4. Какой тип реакции характерен для алкенов:
1) замещения 3) обмена
2) соединения 4) разложения
5. Какую геометрическую форму имеет молекула метана:
1) тетраэдрическую 3) объёмную
2) линейную 4) плоскую
6. Каким углеводородам по составу изомерны алкены:
1) алканам 2) циклоалканам 3) алкинам 4) алкадиенам
7. С каким веществом может вступать в реакцию пропан:
С каким веществом может вступать в реакцию пропан:
1) хлороводородом 3) гидроксидом натрия
2) хлором 4) перманганатом калия
8. Пропен не вступает в реакцию с веществом:
1) бромная вода 3) металлический натрий
2) раствор перманганата калия 4) вода
9. Какое вещество образуется в результате реакции 2-метилбутена -2 с
хлороводородом?
1) 1-хлор-3-метилбутан 3) 2-хлор-3-метилбутан
2) 2-хлор-3-метилбутен-2 4) 2-хлор-2-метилбутан
10. Определите, какая из схем соответствует получению этилена в
лаборатории?
1) C2H6 → C2h5 + h3
2) C2H5OH → C2h5 + h3O
3) 2C + 2h3 → C2h5
4) C2h3 + h3 → C2h5
11. Составьте уравнение ОВР окисления бутена-2 перманганатом калия в водном растворе.
12. Установите молекулярную формулу углеводорода, массовая доля углерода в котором равна 82%, а плотность этого газа при н.у. равна 1,97 г/л.
Вариант 5
1. Укажите, какие данные правильно отражают строение алканов:
Укажите, какие данные правильно отражают строение алканов:
1) sp2-гибридизация, форма молекулы плоская, 1200 , длина С – С связи 0,134 нм;
2) sp2-гибридизация, форма молекулы плоская, 1200 , длина С – С связи 0,134 нм, сопряженная система π-связей;
3) sp-гибридизация, форма молекулы линейная, 1800 , длина С – С связи 0,120 нм;
4) sp3-гибридизация, форма молекулы тетраэдрическая, 109,50 , длина С – С связи 0,154 нм.
2. Определите ряд, в котором все вещества между собой являются гомологами:
1) Ch5, C2h3, C4H6 3) C3H8, C5h22, C8h28
2) C2h3, C2h5, C2H6 4) C2H6, C2h5, C2h3
3.В виде цис-транс-изомеров может существовать:
1) этилен 2) пентен-1 3) бутен-2 4) 2-метилпентен-2
4. Алкены не взаимодействуют с:
1) водородом 2) азотом 3) хлором 4) бромом
5. Непредельные углеводороды получаются при:
1) ректификации 2) гидрогенизации 3) крекинге 4) полимеризации
6. Отметьте реакцию с участием алканов, в результате которой происходит рост цепи углеродных атомов:
1) крекинг 2) реакция Вюрца 3) реакция Зайцева 4) галогенирование
7. Как пропан, так и пропен взаимодействуют с:
Как пропан, так и пропен взаимодействуют с:
1) бромом 2) водой 3) водородом 4) перманганатом калия
8. Верны ли следующие суждения о свойствах углеводородов?
А. Алканы вступают в реакции полимеризации.
Б. Этилен обесцвечивает раствор перманганата калия.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
9. В схеме превращений C2H5OK → X → C2h5 веществом «Х» является:
1) C2H6 2) C2H5COOH 3) C2H5OH 4) C2H5Cl
10. И бутан и бутилен реагируют с:
1) бромной водой 2) раствором KMnO4 3) водородом 4) кислородом
11. Составьте уравнение ОВР окисления пентена-1 перманганатом калия в сернокислой среде.
12. Определите молекулярную формулу алкена, если известно, что его плотность по воздуху составляет 1,931.
Вариант 6
1. Какова общая формула гомологического ряда алканов:
1) Cnh3n-6 2) Cnh3n 3) Cnh3n-2 4) Cnh3n+2
2. Укажите, какие данные правильно отражают строение алкенов:
Укажите, какие данные правильно отражают строение алкенов:
1) sp2-гибридизация, форма молекулы плоская, 1200 , длина С – С связи 0,134 нм;
2) sp2-гибридизация, форма молекулы плоская, 1200 , длина С – С связи 0,134 нм, сопряженная система π-связей;
3) sp-гибридизация, форма молекулы линейная, 1800 , длина С – С связи 0,120 нм;
4) sp3-гибридизация, форма молекулы тетраэдрическая, 109,50 , длина С – С связи 0,154 нм.
3. Всем алканам присущи свойства:
1) вступать в реакции радикального замещения;
2) окисляться при обычных условиях;
3) реагировать с активными металлами;
4) вступать в реакции электрофильного присоединения.
4. Отметьте реакцию с участием алканов, в результате которой происходит уменьшение числа углеродных атомов:
1) крекинг 2) реакция Вюрца 3) реакция Зайцева 4) галогенирование
5. Изопентан получают при:
1) нагревании пентана;
2) крекинге декана;
3) нагревании пентана в присутствии хлорида алюминия;
4) дегидрирования пентана.
6. Бромную воду не обесцвечивает:
1) бутен 2) пропин 3) 2-метилпропан 4) 2-метилпропен
7. Этан вступает в реакции:
1) разложения и замещения 2) гидрирования и гидролиза
3) дегидратации и замещения 4) горения и гидрирования
8. Укажите неверное утверждение: «Реакция хлорирования метана — это реакция:
1) замещения 3) каталитическая
2) цепная свободнорадикальная 4) гомогенная
9. Этанол можно получить из этилена в результате реакции:
1) гидратации 2) гидрирования
3) галогенирования 4) гидрогалогенирования.
10. Полипропилен получают из вещества, формула которого:
1) Ch3=Ch3 2) Ch4-Ch3-Ch4 3) Ch3=CH-Ch4 4) Ch3=C=Ch3
11. Составьте уравнение ОВР окисления пропена перманганатом калия в водном растворе.
12. Найдите молекулярную формулу органического вещества, если при сгорании 1,2г паров образовалось 1,344г оксида углерода (IV) и 1,44г воды, если его плотность составила 2,8 г/л.
Входной контроль Химия, 10 класс
Входной контроль
Химия, 10 класс
Задания с выбором ответа
Вариант 1.
№ 1. К физическим явлениям относится:
1) | разложение воды электрическим током |
2) | испарение воды |
3) | горение свечи |
4) | скисание молока |
№ 2. Сокращенное ионное уравнение реакции Mg2+ + 2OH– = Mg(OH) 2 соответствует взаимодействию:
1) | магния с гидроксидом натрия |
2) | оксида магния с водой |
3) | хлорида магния с гидроксидом калия |
4) | нитрата магния с гидроксидом алюминия |
№ 3. Укажите название основного оксида.
Укажите название основного оксида.
1) | оксид углерода (IV) |
2) | оксид кремния |
3) | оксид магния |
4) | оксид серы (VI) |
№ 4. Водород образуется в результате взаимодействия:
1) | H3PO4 и CaO |
2) | H2SO4 и Ca(OH)2 |
3) | HCl и Ca |
4) | HNO3 и CaCO3 |
№ 5. Формула вещества, обозначенного «X» в схеме превращений
Формула вещества, обозначенного «X» в схеме превращений
P X H3PO4,
1) | PH3 | 2) | P2O3 | 3) | P4O6 | 4) | P2O5 |
Задания с кратким ответом
№ 6. При взаимодействии хлорида алюминия с гидроксидом калия образовалось 39 г осадка. Масса гидроксида калия равна _______г.
№ 7. Объём углекислого газа, образовавшегося при сжигании 22,4 л (н.у.) метана CH4 в соответствии с уравнением реакции CH4 + 2O2 = CO2 + 2H2O, равен ______ л.
№ 8.Массовая доля растворенного вещества в растворе, полученном при растворении
20 г сахара в 140 г воды, равна ________ %.
Входной контроль
Химия, 10 класс
Задания с выбором ответа
Вариант 2.
№ 1. При сжигании жёлтой серы образуется газ с резким запахом. Это явление:
1) | физическое, т. к. нового вещества не образуется |
2) | физическое, т. к. меняется агрегатное состояние |
3) | химическое, т. к. наблюдаются признаки реакции изменение цвета и появление запаха |
4) | химическое, т. |
№ 2. В соответствии с сокращенным ионным уравнением Cu2+ + 2ОН— = Сu(ОН)2 взаимодействуют:
1) | CuS04 и Fe(OH)2 |
2) | CuCl2 и Са(ОН)2 |
3) | Cu2S03 и NaOH |
4) | КОН и Cu2S |
№ 3. Основный оксид, кислота, нерастворимое основание, соль расположены в ряду:
1) | CaO, HCl, NaOH, NaCl |
2) | CaO, HCl, Cu(OH)2, NaCl |
3) | CaO, HCl, Cu(OH)2, CuO |
4) | CO2, NaH, Cu(OH)2, NaCl |
№ 4. Оксид серы (VI) SO3 вступает в реакцию со всеми веществами ряда
Оксид серы (VI) SO3 вступает в реакцию со всеми веществами ряда
1) | Ca(OH)2, H2SO4, Zn |
2) | K2O, NaOH, SO2 |
3) | K2O, NaOH, H2O |
4) | H2O, Na2O, SO3 |
№ 5.Формула вещества, обозначенного «X» в схеме превращений Mg → Х → MgSO4
1) | MgH2 | 2) | MgO | 3) | Mg3P2 | 4) | MgCl2 |
Задания с кратким ответом
№ 6. Вычислить массу углекислого газа, образовавшегося при сжигании 32г метана CH4, CH4 + 2O2 = CO2 +2H2O. Масса углекислого газа равна _______г.
№ 7. Объём углекислого газа, образовавшегося при сжигании 44,8 л (н.у.) метана CH4 в соответствии с уравнением реакции CH4 + 2O2 = CO2 + 2H2O, равен ______ л.
№ 8. В 180 г воды растворили 20 г хлорида калия KCl. Определите массовую долю хлорида калия в растворе ________ ( %)
Входной контроль
Химия, 10 класс
Задания с выбором ответа
Вариант 3.
№ 1. К химическому явлению относится процесс:
1) | замерзание воды |
2) | прокисание молока |
3) | ковка металла |
4) | размягчение стекла при нагревании |
№ 2. Сущность реакции обмена между растворами нитрата серебра и соляной кислотой можно выразить сокращенным ионным уравнением:
1) | Ag+ + Сl— = AgCl↓ |
2) | Н+ + CI— = НСl |
3) | Ag+ + NO3— = AgNO3 |
4) | Н++ NO3— = HNO3 |
№ 3. Формула кислотного оксида, основания, соли, соответственно:
1) | SO3, Cu(OH)2, FeCl2 |
2) | SO2, BaO, H2S |
3) | CuO, Fe(OH)2, Na2CO3 |
4) | H2O, CuO, NaOH |
№ 4. Хлороводородная кислота HCl вступает в реакции со всеми веществами, записанными в ряду
1) | Na2O, SO3, CaCl2 |
2) | NaOH, K2O, CuO |
3) | P2O5, H2SO3, Ca(OH) 2 |
4) | ) CuO, HCl, NaOH |
№ 5.Формула вещества, обозначенного «X» в схеме превращений
MgO → Х →Mg(OH)2
1) | MgH2 | 2) | Mg | 3) | MgSO4 | 4) | Mg3P2 |
Задания с кратким ответом
№ 6. Масса цинка, расходуемого для получения 12 г водорода, при взаимодействии с соляной кислотой (Zn + 2HCl = ZnCl2 +H2 ) составляет _______г.
№ 7. Объём углекислого газа, образовавшегося при сжигании 11,2 л (н.у.) метана CH4 в соответствии с уравнением реакции CH4 + 2O2 = CO2 + 2H2O, равен ______ л.
№ 8. Для приготовления 400 г 2%-го раствора соли, необходимо взять соль массой___ г.
Входной контроль
Химия, 10 класс
Задания с выбором ответа
Вариант 4.
№ 1. Плавление парафина и подгорание пищи на сковородке представляют соответственно явления:
1) | оба химические |
2) | оба физические |
3) | химическое и физическое |
4) | физическое и химическое |
№ 2. Сущность реакции обмена между растворами сульфата натрия и хлорида бария можно выразить сокращенным ионным уравнением:
1) | Na+ + CI— = NaСl |
2) | Ва 2+ + SO4 2- = BaSO4↓ |
3) | Na+ + SO4 2- = Na2 SO4 2- |
4) | Ва 2+ + CI— = BaСl2 |
№ 3. Соль, кислота, основание записаны соответственно в строке:
1) | Fe3O4, Ba(OH)2, BaCl2 |
2) | Li2O, H2S, Cu(OH)2 |
3) | KClO3, HNO3, RbOH |
4) | SO4, Na2SO3, H2SO4 |
№ 4. Оксид меди (II) CuO взаимодействует со всеми веществами ряда:
1) | SO3, HCl, H N O 3 |
2) | SO 2, СаO, H 2 SO4 |
3) | H2O, Ca O, H 2 SO 4 |
4) | H 2O, Fe O , P 2O 5 |
№ 5.Формула вещества, обозначенного «X» в схеме превращений Fe → Х → FeSO4
1) | Fe(OH)2 | 2) | FeO | 3) | Fe(OH)3 | 4) | Fe2O3 |
Задания с кратким ответом
№ 6. Масса серы, прореагировавшей с 5,4 г алюминия, равна _______ г. Уравнение химической реакции имеет вид 2Al + 3S= Al2S3
№ 7. Объём углекислого газа, образовавшегося при сжигании 67,2 л (н.у.) метана CH4 в соответствии с уравнением реакции CH4 + 2O2 = CO2 + 2H2O, равен ______ л.
№ 8. Для приготовления 200 г 5%-го раствора соли, необходимо взять соль массой___ г.
http://www.mcko.ru/md/2007/start/chi10_start07.rar
Стартовая контролная работа по химии 10 класс
Стартовая контрольная работа по химии 10 класс
Вариант 1
1. Из предложенных рядов, выберите генетический ряд металла:
1) Li – Li2O – LiOH – LiCl2) P- P2O5 – h4PO4 – Na3PO4
3) Al – Al2O3 – Al (OH)3 – Al (NO3)3
4) N2 – N2O5 – HNO3 – Ba (NO3)2
2. В каком ряду представлены простые вещества-металлы:
1) хлор, никель, серебро 3) железо, барий, натрий
2) алмаз, сера, кальций 4) кислород, озон, азот
3. В каком ряду представлены простые вещества-неметаллы:
1) хлор, никель, серебро 3) железо, фосфор, ртуть
2) алмаз, сера, кальций 4) кислород, углерод, азот
4. Какую формулу имеет сульфат-ион:
1) S0 2) SO32- 3) SO42- 4) S2-
5. Сумма коэффициентов в уравнении взаимодействия брома с водородом:
1) 3 2)4 3) 2 4) 5
6. Тип химической связи в простом веществе литии:
1) ионная 2)ковалентная полярная
3)ковалентная неполярная 4) металлическая
7. Установите соответствие между названием вещества и формулой соединения:
Название вещества: Формула соединения:
А) сульфат бария 1) Сa (OH)2
Б) сероводородная кислота 2) BaSO4
В) гидроксид лития 3) Li2O
Г) оксид углерода (II) 4)CO
5) h3S
6)LiOH8. Составьте окислительно-восстановительную реакцию
Al + h3SO4 = Al2(SO4)3 + h3
9. Составьте уравнение ионного обмена
MgCl2+ Н3PO4 =
10. Какой объём водорода образуется в результате реакции соляной кислоты с цинком массой 15г?
Стартовая контрольная работа по химии 10 класс
Вариант 2
1. Из предложенных рядов, выберите генетический ряд амфотерного металла:
1) Li – Li2O – LiOH – LiCl2) P- P2O5 – h4PO4 – Na3PO4
3) Al – Al2O3 – Al (OH)3 – Al (NO3)3
4) N2 – N2O5 – HNO3 – Ba (NO3)2
2 . В каком ряду представлены простые вещества-металлы:
Пройдите онлайн-тест с несколькими вариантами ответов для математической части 2 по химии
Химия — важный предмет науки, изучающий, из чего состоят различные материалы, их функции, структуры и реакции. Это сложный предмет, требующий дополнительных усилий. Обычно его преподают в более старших классах, обычно после 9 класса. В 10-м классе ученики имеют право выбирать этот курс, и они могут продолжить его для дальнейшего обучения, если захотят.Мы предлагаем 10-й классный онлайн-тест MCQ по химии , который студенты могут пройти, чтобы укрепить свои знания по предмету.
Онлайн-тест по химии для учеников 10-х классов:
С нашей командой профессионалов, имеющих большой опыт в этой области, мы разработали онлайн-тестов для учеников 10-х классов химии и других классов. . Это бесплатно, и его можно легко попробовать, не выходя из дома.Многие студенты считают изучение книги скучным и недостаточным для достаточной подготовки. Здесь, по адресу campus.pk , мы помогаем студентам подготовиться к выпускным экзаменам по химии в 10 классе с помощью различных материалов, доступных на нашем веб-сайте. У нас есть доступ к материалам для студентов: прошлые работы, тесты MCQ, советы по курсу и многое другое. Чтобы получить доступ к контенту, просто посетите наш веб-сайт campus.pk и выберите нужный вариант в раскрывающемся списке на главной странице.
Практический тест MCQ для 10-го класса химии:
Мы рекомендуем установить строгий график занятий и установить конкретное время для изучения каждого предмета. Убедитесь, что вы просматриваете соответствующий материал и эффективно используете свое время. Наши системы онлайн-теста очень эффективны в этом вопросе, так как они разработаны в соответствии с последовательностью глав в книгах. Результаты быстро доступны после попытки пройти тесты, и студенты могут легко оценить свой уровень подготовки.
MCQ по химии 10 класса с ответами Скачать PDF
Вышеупомянутые MCQ NCERT CBSE и KVS для класса 10 по химии помогут вам повысить свои оценки, поскольку на экзаменах появляются вопросы с несколькими вариантами ответов. Эти экзамены CBSE NCERT по химии для класса 10 были разработаны опытными преподавателями сайта StudiesToday.com для учащихся 10 класса.
Преимущества MCQ CBSE NCERT для химии 10 класса
a) MCQ NCERT CBSE KVS 10 класса помогут детям укрепить свои представления и улучшить оценки на тестах и экзаменах.
b) Эти вопросы с несколькими вариантами ответов для 10-го класса химии помогут улучшить навыки анализа и решения сложных задач.
c) Ежедневная практика различных MCQ по различным предметам поможет развить глубокое понимание каждой темы, которую вы будете помнить до даты экзаменов
d) Вы также сможете правильно пересмотреть все главы по химии и сэкономить время во время классные тесты и экзамены.
Бесплатная распечатка MCQ в формате PDF для CBSE Class 10 Chemistry разработана школьными учителями в StudiesToday.com. Мы предоставляем самые эксклюзивные бесплатные печатные MCQ из базы данных в соответствии со стандартами CBSE NCERT и KVS. Все MCQ были тщательно разработаны для всех типов студентов. Вы можете загрузить в формате PDF CBSE Class 10 Chemistry Chapter мудрые вопросы MCQ с ответами и использовать их для дальнейшего изучения. Вам также следует внимательно ознакомиться с учебной программой по химии 10 класса и загрузить MCQ по каждой изучаемой вами теме. Это очень поможет в выявлении всех ошибок в вашем понимании темы.Ежедневно выполняйте MCQ по химии CBSE для 10-го класса, чтобы получить более высокие баллы на экзамене.
Щелкните по ссылкам ниже для NCERT Class 10 Chemistry , чтобы загрузить последние решенные образцы документов CBSE (NCERT), вопросы за прошлый год (последние десять лет) с решениями, распечатанные рабочие листы в формате pdf для Class 10 Chemistry NCERT Books и NCERT решения для Химия класса 10 NCERT на основе учебной программы и руководящих принципов, выпущенных CBSE и NCERT. Учебный материал для NCERT для 10 класса химии был подготовлен опытными учителями ведущих школ Индии и доступен для бесплатной загрузки
ВВОДНАЯ ХИМИЯ
«3» кредита Всего кредитов
«5» недель Продолжительность курса
добавить в корзину
Купить одним курсом
Этот курс доступен как часть программы получения степени или сертификата.
Посмотреть все программыУровень курса: «Низший дивизион»
«Этот курс исследует основные принципы химии концептуально и конкретно. В курсе будут применяться химические концепции для решения соответствующих вопросов, начиная от атомной структуры и химических реакций до органической и биологической химии.Темы курса включают материю и энергию, химическую связь, межмолекулярные силы, химическое равновесие, а также ядерную, органическую и биологическую химию. Студенты будут применять эти концепции, используя практические примеры, дискуссии и эксперименты, проводимые в виртуальной лаборатории ».
«За подробностями обращайтесь по телефону (844) 937-8679, чтобы поговорить с научным консультантом»
Обратите внимание: посещение и участие являются обязательными на всех курсах университета, и конкретные требования могут отличаться в зависимости от курса.Если требования к посещаемости не соблюдены, студент может быть исключен с курса. Пожалуйста, ознакомьтесь с Политикой посещаемости курсов в Каталоге для получения дополнительной информации.
University of Phoenix оставляет за собой право изменять курсы. Несмотря на широкую доступность, не все курсы доступны во всех местах или в формате онлайн и на территории кампуса. Пожалуйста, свяжитесь с представителем по регистрации.
Что ты узнаешь
Что вы узнаете
Расширить все
Основы химии Атомы, молекулы и химические реакции Электронные конфигурации, химическая связь, межмолекулярные силы и фазы вещества Растворы, химическое равновесие и перенос электронов Ядерная химия, органическая химия и биохимия
Экзамен № 1 CH 100, Вводная химия, осень, 2003 г. Название
ГЛАВА 3: ВОПРОС.Вопросы для активного обучения: 1–6, 9, 13–14; Вопросы в конце главы: 1-18, 20, 24-32, 38-42, 44, 49-52, 55-56, 61-64
ГЛАВА 3: ВОПРОСЫ Активного обучения Вопросы: 1-6, 9, 13-14; Вопросы в конце главы: 1-18, 20, 24-32, 38-42, 44, 49-52, 55-56, 61-64 3.1 ВЕЩЕСТВО Материя: все, что имеет массу и занимает объем Мы изучаем
ПодробнееЧто в кроте? Молярная масса
УРОК 10 Что есть в кроте? Молярная масса ОБЗОР Ключевые идеи Тип урока Лаборатория: Группы из 4 химиков сравнивают моль веществ, а не массы, потому что моль — это способ подсчета атомов.При рассмотрении
ПодробнееГлава 3 Чтение учащихся
Глава 3 Чтение учащихся Если вы держите в руке кусок твердого свинца или железа, он кажется тяжелым для своего размера. Если вы держите кусок бальзового дерева или пластика такого же размера, он кажется легким для своего размера.
ПодробнееГлава 4 Практическая викторина
Глава 4 Практический тест 1.Пометьте каждую коробку соответствующим состоянием вещества. A) I: газ II: жидкость III: твердое тело B) I: жидкость II: твердое вещество III: газ C) I: твердое вещество II: жидкость III: газ D) I: газ II: твердое вещество III:
ПодробнееИмя: Учитель: Pd. Дата:
Имя: Учитель: Pd. Дата: Учебное пособие STAAR: Энергия и материя: элементы, соединения и химические уравнения: 6.5C Различия между элементами и соединениями на самом базовом уровне. 8.5F Распознать, соответствует ли
Подробнее10 г 5 г? 10 г 5 г. 10 г 5 г. масштаб
Международная система единиц, или единицы СИ против. Honors Chem 1 ДЛИНА В системе СИ основной единицей длины является метр. Префиксы определяют дополнительные единицы длины на основе метра. Меньше
ПодробнееРаздел 2: Количества в химии
Масса, моль и молярная масса Относительные количества изотопов в природном элементе (%) E.грамм. Углерод имеет 2 изотопа С-12 и С-13. Из двух изотопов углерода содержится 98,9% C-12 и 11,1% C-13. Найдите
ПодробнееБЛОК (1) ИЗМЕРЕНИЯ В ХИМИИ
БЛОК (1) ИЗМЕРЕНИЯ В ХИМИИ Измерения являются частью нашей повседневной жизни. Мы измеряем свой вес, пройденное расстояние и галлоны бензина. Как медицинский работник вы можете измерять артериальное давление,
ПодробнееIB Химия.Обзор химии DP
DP Chemistry Review Тема 1: Количественная химия 1.1 Концепция молей и константа Авогадро Заявление об оценке Примените концепцию молей к веществам. Определите количество частиц и количество
ПодробнееСИМВОЛЫ, ФОРМУЛЫ И МОЛЯРНЫЕ МАССЫ
СИМВОЛЫ, ФОРМУЛЫ И МОЛЯРНЫЕ МАССЫ ЦЕЛИ 1. Правильно написать и интерпретировать химические формулы 2.Для расчета молекулярной массы по химическим формулам 3. Для расчета молей из граммов с помощью химического вещества
ПодробнееАТОМЫ. Вопросы с множественным выбором
Глава 3 АТОМЫ И МОЛЕКУЛЫ Вопросы с множественным выбором 1. Что из следующего правильно соответствует 360 г воды? (i) 2 моля H 2 0 (ii) 20 моль воды (iii) 6,022 10 23 молекулы воды (iv)
ПодробнееСмеси и чистые вещества
Блок 2 Смеси и чистые вещества. Вещества можно разделить на две группы: смеси и чистые вещества.Смеси являются наиболее распространенной формой веществ и состоят из смесей чистых веществ. Они
ПодробнееХИМИЯ ПЕРВОГО СОРТА
ПЕРВЫЙ КЛАСС ХИМИИ ПЛАНЫ УРОКОВ И МЕРОПРИЯТИЯ НА 1 НЕДЕЛЮ ОБЗОР РОК-ЦИКЛА НЕДЕЛИ ХИМИИ ПЕРВОГО КЛАССА 1. ПРЕДВАРИТЕЛЬНАЯ ИНФОРМАЦИЯ: Сравнение твердых тел, газов, жидкостей и плазмы. ЛАБОРАТОРИЯ: Изучение того, как состояния материи могут
ПодробнееОбзор стехиометрии
Обзор стехиометрии В этом обзоре 20 задач.Ответы, включая постановку задачи, можно найти во второй половине этого документа. 1. N 2 (г) + 3H 2 (г) ———> 2NH 3 (г) а. азот
ПодробнееРабочий лист химии: вопрос №1
Рабочий лист по химии: Вопрос № 1 1. Смесь (является / не является) химическим соединением веществ. 2. В соединении (атомы / молекулы) (химически / физически) объединены так, что элементы, составляющие
ПодробнееПрактические занятия Лабораторное руководство SM-1
ЭКСПЕРИМЕНТ 4: Разделение смеси твердых тел. Прочтите весь эксперимент и определите время, материалы и рабочее пространство перед началом.Не забывайте просматривать разделы по технике безопасности и при необходимости надевать защитные очки.
ПодробнееПериодическая таблица, валентность и формула
Периодическая таблица, валентность и формула Происхождение периодической таблицы Мендельев в 1869 году предположил, что существует связь между химическими свойствами элементов и их атомными массами. Он заметил
ПодробнееРабочий лист химии после зачисления
Название: Рабочий лист химии после зачисления Цель этого рабочего листа — помочь вам обобщить некоторые фундаментальные концепции, которые вы изучали на GCSE, и представить некоторые концепции, которые будут частью
. ПодробнееОписание концепции крота:
Описание концепции крота: Предположим, вас отправили в магазин купить 36 яиц.Когда вы их подберете, вы получите 3 коробки, в каждой по 12 яиц. Вы только что использовали математический аппарат под названием
. ПодробнееРАБОЧАЯ ТАБЛИЦА ЗАКОНА ХИМИИ
Закон Бойля Закон Чарльза Закона Гая-Лассака Комбинированный газовый закон Для данной массы газа при постоянной температуре объем газа изменяется обратно пропорционально давлению PV = k Объем фиксированной массы газа равен
Подробнее2 Строение атомов
ГЛАВА 4 2 СТРУКТУРА АТОМОВ РАЗДЕЛ АТОМЫ КЛЮЧЕВЫЕ ИДЕИ Читая этот раздел, имейте в виду следующие вопросы: Что общего у атомов одного и того же элемента? Что такое изотопы? Как устроен элемент
ПодробнееХимия: химические уравнения
Химия: химические уравнения Напишите сбалансированное химическое уравнение для каждого словесного уравнения.Включите в уравнение фазу каждого вещества. Классифицировать реакцию как синтез, разложение, однократное замещение,
Подробнее20.2 Химические уравнения
Все химические изменения, которые вы наблюдали в последнем расследовании, были результатом химических реакций. Химическая реакция включает перегруппировку атомов в одном или нескольких реагентах с образованием одного или нескольких
ПодробнееAP Глава 1, 2 и 3: Атомы, молекулы и массовые отношения Имя
AP Глава 1, 2 и 3: Атомы, молекулы и массовые отношения Разминка имени (Покажите свою работу для подтверждения) Дата 1.Дата 2. Дата 3. Дата 4. Дата 5. Дата 6. Дата 7. Дата 8. AP Глава 1, 2 и 3: Атомы и молекулы,
ПодробнееИзмерение и калибровка
Адаптировано из: Модульная лабораторная программа Х. А. Нейдига и Дж. Н. Спенсера по химии Thompson Learning;, Лабораторное руководство 0110 Химического университета Питтсбурга, 1998. Цель Достичь понимания
ПодробнееВыпускной экзамен по химии 151
Химия 151 Название финального экзамена: SSN: Правила и рекомендации для экзаменов Покажите свою работу.Ответ не будет засчитан, если ваша работа не будет показана. Обозначьте свой ответ квадратом или кружком. Все документы должны быть
ПодробнееЭмпирическая формула соединения
Эмпирическая формула лаборатории соединений № 5 Введение Взгляд на массовые отношения в химии обнаруживает мало порядка или смысла. Отношение масс элементов в соединении, пока постоянное,
ПодробнееРАСЧЕТ МОЛЕКУЛЯРНОГО ВЕСА
РАСЧЕТ МОЛЕКУЛЯРНОГО ВЕСА Расчет веса по формуле; Значимые числа Page 2 Процентный состав соединения 18 Экспоненциальная запись; Число Авогадро; Моль 28 Расчет эмпирических формул
ПодробнееChem 211 — Тесты на альдегиды и кетоны
Тесты на альдегиды и кетоны
2,4-ДНП Тест на альдегиды и кетоны
Тест Толлена на альдегиды
Jones (хромовая кислота) Окисление Тест на альдегиды
Йодоформный тест на метилкетоны
2,4-DNP Тест на альдегиды и кетоны
Альдегид или кетон
Стандарты
Циклогексанон, бензофенон и бензальдегид
Процедура
Добавьте раствор из 1 или 2 капель или 30 мг неизвестного вещества в 2 мл
95% этанола на 3 мл реагента 2,4-динитрофенилгидразина.Энергично встряхивать,
и, если сразу не образуется осадок, дать раствору отстояться
в течение 15 минут.
Реагент 2,4-динитрофенилгидразин уже готов для вас.
Положительный результат
Образование осадка — положительный результат.
Осложнения
- Некоторые кетоны дают масла, которые не затвердевают.
- Некоторые аллиловые спирты окисляются реагентом до альдегидов и дать положительный тест.
- Некоторые спирты, если они не очищены, могут содержать примеси альдегидов или кетонов.
Толлена Тест на альдегиды
Альдегид
Стандарты
Циклогексанон и бензальдегид
Процедура
Добавьте одну каплю или несколько кристаллов неизвестного происхождения в 1 мл свежеприготовленного Tollens.
реагент. Если сразу не наблюдается реакции, можно использовать осторожное нагревание.
Реагент Толленса: В пробирку, очищенную
3M гидроксид натрия, налейте 2 мл 0,2 M раствора нитрата серебра и добавьте
капля 3М гидроксида натрия. Добавить 2,8% раствор аммиака по каплям,
при постоянном встряхивании, пока почти не выпадет осадок оксида серебра
растворяется. Не используйте более 3 мл аммиака. Затем разведите весь
раствора до конечного объема 10 мл водой.
Положительный тест
Образование серебряного зеркала или черного осадка является положительным результатом.
Осложнения
- Пробирка должна быть чистой и обезжиренной, если требуется серебряное зеркало. наблюдаться.
- Легко окисляющиеся соединения дают положительный результат. Например: ароматный амин и некоторые фенолы.
Очистка
Поместите все растворы, использованные в этом эксперименте, в соответствующий контейнер для отходов.
Джонс (хромированный Кислота) Испытание на окисление альдегидов
Альдегидов
Стандарты
Циклогексанон и бензальдегид
Процедура
Растворите 10 мг или 2 капли неизвестного вещества в 1 мл чистого ацетона в ходе теста.
пробирку и добавьте в раствор 1 маленькую каплю реактива Джонса (хроническая кислота
в серной кислоте).Положительный тест отмечается образованием зеленого
цвет в течение 5 секунд после добавления оранжево-желтого реагента к первичному
или вторичный спирт. Альдегиды также дают положительный результат, но третичные спирты
не делайте.
Реагент Джонса уже приготовлен для вас.
Положительный тест
Положительный тест на альдегиды и первичные или вторичные спирты состоит из
производство непрозрачной суспензии от зеленого до синего цвета. Третичный
спирты не дают видимой реакции в течение 2 секунд, раствор остается
оранжевого цвета.Не обращайте внимания на любые изменения через 15 секунд.
Осложнения
- Альдегиды лучше охарактеризовать другими способами. Цвет обычно развивается за 5-15 секунд.
Очистка
Поместите тестовый раствор в соответствующий контейнер для отходов.
Йодоформный тест для метилкетонов
Кетон
Стандартный
Ацетон
Процедура
Если испытуемое вещество растворимо в воде, растворите 4 капли жидкости.
или примерно 50 мг твердого вещества в 2 мл воды в большой пробирке.Добавьте 2 мл 3 М гидроксида натрия, а затем медленно добавьте 3 мл йода.
решение. Закройте пробирку и энергично встряхните. Положительный тест будет
приводит к исчезновению коричневого цвета реагента и желтого йодоформа
твердое осаждение из раствора. Если исследуемое вещество нерастворимо
в воде растворите его в 2 мл 1,2-диметоксиэтана, действуйте, как указано выше,
и в конце разбавить 10 мл воды.
Положительный тест
Образование твердого йодоформа (желтый) — положительный результат.(Йодоформ может
быть узнаваемым по запаху и желтому цвету и, что более безопасно, от
точка плавления 119 o -123 o C).
Осложнения
Тест не будет положительным, если группа R представляет собой диорто-замещенную арильную группу
Очистка
Поместите растворы в соответствующий контейнер для отходов.
Вводная глава: Вторичные метаболиты
1. Введение
Метаболизм можно определить как сумму всех биохимических реакций, проводимых организмом.Метаболиты являются промежуточными продуктами и продуктами метаболизма и обычно ограничиваются небольшими молекулами. Термин «вторичный», введенный А. Косселем в 1891 году, означает, что, хотя первичные метаболиты присутствуют в каждой живой клетке, способной к делению, вторичные метаболиты присутствуют лишь случайно и не имеют первостепенного значения для жизни организма. Хотя вторичные метаболиты происходят из первичного метаболизма, они не составляют основной молекулярный скелет организма. Его отсутствие не сразу урезает жизнь организма, что противоречит первичному метаболиту, но выживаемость организма ухудшается в большей степени.Его наличие и синтез наблюдаются у экологически неблагополучных видов филогенетической группы [1].
Разница между первичным и вторичным метаболитами неоднозначна, поскольку многие промежуточные соединения первичного метаболизма перекрываются с промежуточными продуктами вторичных метаболитов [2]. Аминокислоты, хотя и считаются продуктом первичного метаболита, определенно являются вторичным метаболитом. Вопреки наблюдению, что стерины являются вторичными метаболитами, которые являются неотъемлемой частью многих структурных структур клетки.Мозаичный характер промежуточного соединения указывает на общий биохимический путь, разделяемый первичным и вторичным метаболизмом [3]. Вторичные метаболиты служат буферной зоной, в которую можно переместить избыток C и N, чтобы сформировать неактивную часть первичного метаболизма. Сохраненные C и N могут вернуться обратно в первичный метаболит за счет метаболического распада вторичного метаболита, когда это необходимо. Существует динамизм и тонкий баланс между активностями первичного и вторичного метаболизма (рис. 1), на которые влияют рост, дифференциация тканей и развитие клетки или тела, а также внешнее давление [4].
Рисунок 1.
Схематическая диаграмма, представляющая интеграцию первичного и вторичного метаболизма.
Следовательно, вторичные метаболиты или натуральные продукты могут быть определены как гетерогенная группа природных продуктов метаболизма, которые не являются необходимыми для вегетативного роста продуцирующих организмов, но считаются соединениями дифференциации, выполняющими адаптивные функции, например, действуя как защитные соединения или сигнальные молекулы в экологических взаимодействиях, симбиозе, переносе металлов, конкуренции и так далее [5].Множество секреции вторичных метаболитов собираются людьми для улучшения своего здоровья (антибиотики, ингибиторы ферментов, иммуномодуляторы, противоопухолевые средства и стимуляторы роста животных и растений), расширения пирамиды здорового питания (пигменты и нутрицевтики), повышения продуктивности сельского хозяйства (пестициды, инсектициды, факторы экологической конкуренции и симбиоза и феромоны) и, следовательно, оказывают определенное положительное влияние на экономику нашего общества. Они являются источником антибиотиков.
2. Классификация вторичных метаболитов
Известно более 2 140 000 вторичных метаболитов, которые обычно классифицируются в соответствии с их огромным разнообразием по структуре, функциям и биосинтезу. Существует пять основных классов вторичных метаболитов, таких как терпеноиды и стероиды, вещества и поликетиды, производные жирных кислот, алкалоиды, нерибосомные полипептиды и кофакторы ферментов [6].
2.1. Терпеноиды и стероиды
Это основная группа веществ, биосинтетически полученных из изопентенилдифосфата.В настоящее время идентифицировано более 35 000 известных терпеноидных и стероидных соединений. Терпеноиды имеют различное разнообразие неродственных структур, в то время как стероиды имеют общий тетрациклический углеродный скелет и представляют собой модифицированные терпеноиды, которые биосинтезируются из тритерпенового ланостерина.
2.2. Алкалоиды
Известно более 12 000 соединений алкалоидов, и их основные структуры состоят из основной аминогруппы и биосинтетически получены из аминокислот.
2.3. Вещества и поликетиды на основе жирных кислот
Идентифицировано около 10 000 соединений, которые биосинтезируются из простых предшественников ацила, таких как пропионил-КоА, ацетил-КоА и метилмалонил-КоА.
2.4. Нерибосомные полипептиды
Эти соединения, производные от аминокислот, синтезируются биологическим путем с помощью многофункционального ферментного комплекса без прямой транскрипции РНК.
2.5. Кофакторы ферментов
Кофакторы ферментов — небелковые низкомолекулярные компоненты ферментов [6].
3. Функции вторичных метаболитов
Основными функциями вторичных метаболитов, включая антибиотики, являются:
конкурентное оружие против других видов жизни, таких как животные, растения, насекомые и микроорганизмы
агентов транспортировки металлов
агентов для симбиотических отношений с другими организмами
репродуктивного агента и
эффекторов дифференциации
агентов связи между организмами
Другие функции включают вмешательство в образование спор (не обязательно) и прорастание [5 ].Преимущественно вторичные метаболиты используются для различных видов биологической активности, таких как противомикробные и противопаразитарные средства, ингибиторы ферментов и противоопухолевые средства, иммунодепрессанты и т. Д. [7].
4. Источники вторичных метаболитов
Основными источниками вторичных метаболитов являются растения (80% вторичного метаболита), бактерии, грибы и многие морские организмы (губки, оболочники, кораллы и улитки) (Таблица 1) [8 ].
4.1. Вторичные метаболиты растений
Вторичные метаболиты растений представляют собой высоко экономически ценные продукты.Они используются в качестве ценных химикатов, таких как лекарства, ароматизаторы, ароматизаторы, инсектициды, красители и т. Д. Растения богаты широким спектром вторичных метаболитов, таких как дубильные вещества, терпеноиды, алкалоиды и флавоноиды, которые, как было обнаружено, содержат in vitro антимикробные свойства. Растения обладают практически безграничной способностью синтезировать ароматические вещества, большинство из которых представляют собой фенолы или их кислородзамещенные производные [9]. Около 25000 терпеноидов известны как вторичные соединения и являются производными пятиуглеродного предшественника изопентенилдифосфата (IPP).Всего идентифицировано около 12000 известных алкалоидов, которые содержат один или несколько атомов азота, которые биосинтезируются из аминокислот. 8000 известных фенольных соединений синтезируются либо через путь шикимовой кислоты, либо через путь малонат / ацетат [10].
Многие алкалоиды используются в медицине, обычно в виде солей. Некоторые примеры включают винбластин, обладающий противоопухолевыми свойствами [11]; хинин, обладающий жаропонижающими и противомалярийными свойствами [12]; и резерпин, который можно использовать для лечения высокого кровяного давления.Алкалоиды рассматриваются как резервные материалы для синтеза белка, как защитные вещества, препятствующие нападениям животных или насекомых, как стимуляторы или регуляторы растений или просто как продукты детоксикации. Алкалоиды, которые в настоящее время используются в клинической практике, включают анальгетики морфин и кодеин, противоопухолевый агент винбластин, подавляющий подагру колхицин, миорелаксант тубокурарин, антиаритмический аджмалицин, антибиотик сангвинарин и седативный скополамин.
Исследования in vitro показали, что природные фенолы обладают антимикробным [13], противовирусным [14], противовоспалительным [15] и сосудорасширяющим действием [16].Он защищает растение от неблагоприятных факторов, которые угрожают его выживанию в неблагоприятной окружающей среде, таких как засуха, физический ущерб или инфекции. Устойчивость растений к УФ-излучению обусловлена фенольными соединениями, особенно фенилпропаноидами, присутствующими в них [17]. Фенольные соединения действуют как антиоксиданты, защищая клетки от окислительного стресса, улавливая свободные радикалы за счет донорства атомов водорода. Действие фенольных соединений как нейропротекторных [18], фунгицидных [19], бактерицидных [20] и их противоатеросклерозное [21], а также противораковое [22] действие хорошо задокументировано.
Терпеноиды являются коммерчески важными отдушками и ароматизаторами [23]. Пренол и α-бисаболол используются в ароматизаторах из-за фруктового запаха и сладкого цветочного аромата соответственно. Моно- и сескви-терпены являются основой натуральных духов, а также пряностей и ароматизаторов в пищевой промышленности. Роль терпеноидов как фармацевтических агентов с антибактериальной и противоопухолевой активностью все еще исследуется. Существуют примеры дитерпенов, которые проявляли in vitro, цитотоксическую, противоопухолевую и антимикробную активность.Терпены жизненно важны для жизни большинства организмов, осуществляющих метаболический контроль и опосредующих межвидовые и внутривидовые взаимодействия, например, производят соединения в ответ на травоядные или стрессовые факторы, а также было показано, что цветы могут выделять терпеноиды, чтобы привлекать опыляющих насекомых и даже привлекать полезные клещи, питающиеся травоядными насекомыми. Cheng et al. [24] сообщили, что терпены могут действовать как химические посредники, влияющие на экспрессию генов, участвующих в защитных функциях растений, или на экспрессию генов соседних растений.Другие вторичные метаболиты растительного происхождения и их функции приведены в таблице 2 [25].
| Источник | Все известные соединения | Биоактивные вещества | Антибиотики | ||||
|---|---|---|---|---|---|---|---|
| Натуральные продукты | Более миллиона | 905–250 000 | 905 | 600 000–700 000 | 150 000–200 000 | ~ 25 000 | |
| Микробы | Более 50 000 | 22 000–23 000 | ~ 17 000 | ||||
| Водоросли 1500–165 | ~ 1000 | ||||||
| Высшие растения | 500 000–600 000 | ~ 100 000 | 10 000–12 000 | ||||
| Животный мир | 300 000–400 000 | 50 000–100 000 | 905 15 905 905 15 50 000–100 000 905 Несколько сотен100–200 | ~ 50 | |||
| I беспозвоночные | ~ 100,000 | NA | ~ 500 | ||||
| Морские животные | 20,000–25,000 | 7000–8000 | 3000–4000 | ||||
| Насекомые / черви / | 8000–10 000 | 800–1000 | 150–200 | ||||
| Позвоночные (млекопитающие, рыбы, земноводные, и т. Д. ) | 200 000–250 000 | 50 0001615–70 000 | 50 0001615–70 000 |
Таблица 1.
Приблизительное количество известных природных метаболитов.
NA — Данных нет.
Источник: Bérdy [8].
| S. No. | Вторичные метаболиты | Биологическая активность | ||
|---|---|---|---|---|
| 1. | Пиретрины | Инсектицидные | ||
| 2. | Никотин | Инсектицидные | ||
| 3. | Ротиноиды | Инсектицидные | 905 905 905 905 905 905 905 905 905 Фитоэкдизоны | Инсектицидное средство |
| 6. | Бакарин | Противоопухолевое средство | ||
| 7. | Брюссантин | Противоопухолевое средство | ||
| Gsaline | Противоопухолевое средство | |||
| 9. | 3-Доксиколхицин | Противоопухолевое средство | ||
| 10. | Эллиптицин 902 | 905 905 11905 905 11 905 11 905 12. | Fagaronive | Противоопухолевое средство |
| 13. | Тларринговинл | Противоопухолевое средство | ||
| 14. | Jandicine N-оксид | Противоопухолевое средство | ||
| 15. | Майтансив | Противоопухолевое средство | ||
| 16. | Подофиллотоксин 9015 905 905 905 905 905 905 905 905 905 | Таликарпин | Противоопухолевое средство | |
| 19. | Трипдиолид | Противоопухолевое средство | ||
| 20. | Винбластин | Противоопухолевое средство | ||
| 21. | Хинин | Противомалярийное средство | ||
| 22. | Дигоксин | Кардиотоник | Морфин | Анальгетик |
| 25. | Тебаин | Источник кодеина | ||
| 26. | Суолполанин | Антигипертензия | . | Алропин | Миорелаксант |
| 28. | Кодеин | Анальгетик | ||
| 29. | Шиконин | Краситель фармацевтический | Краситель, фармацевтический | 3016.ua31. | Розамариновая кислота | Специи, антиоксиданты, духи |
| 32. | Jasmini | Sweetner | ||
| 33. | Стевиозид | Шафран | ||
| 34. | Краун | Чили | ||
| 35. | Капсацин | Ваниль | 905 905 905 Ваниль 905 905 905 905 905 Ваниль | 905 Ваниль 905 ГутлаперчаЭфирные масла |
| 38. | Терпендиды | Спазмолитические | ||
| 39. | Папаверив | Гипертензивные | ||
| 40. | Ajmalicive | Стимулятор | ||
| 41. | Кофеин | Антиспазматическое средство | ||
| 42. | Бирберин | NA | Birberine | NA |
NA — Не оценивался.
Источник: Рамават и Мериллон [25].
4.2. Производство вторичных метаболитов растениями
4.2.1. Обычный
Традиционный метод производства вторичных метаболитов основан на экстракции метаболита, а не на его производстве, из тканей растения с помощью различных фитохимических процедур, таких как экстракция растворителем, паром и сверхкритическая экстракция.Последние разработки в области биотехнологических методов, таких как культура тканей растений, ферментативная технология и технология ферментации, облегчили синтез in vitro и производство вторичных метаболитов растений . К основным процессам относятся:
4.2.2. Иммобилизация
Клетки или биокатализаторы заключены в матрицу за счет захвата, адсорбции или ковалентного связывания. При добавлении подходящего субстрата и обеспечении оптимальных физико-химических параметров синтезируются желаемые вторичные метаболиты.Иммобилизация с помощью подходящей биореакторной системы обеспечивает несколько преимуществ, таких как непрерывный процесс, но для развития процесса культивирования иммобилизованных растительных клеток необходима естественная или искусственно индуцированная секреция накопленного продукта в окружающую среду.
4.2.3. In vitro культура тканей, органов и клеток
Культуры растительных клеток и тканей могут быть получены обычным образом в стерильных условиях из эксплантов, таких как листья, стебли, корни, меристемы растений и т. Д., как для размножения, так и для извлечения вторичных метаболитов. Побеги, корни, каллус, клеточная суспензия и культура волосистых корней используются для синтеза представляющего интерес метаболита. Метаболиты, локализованные во многих тканях, могут быть синтезированы с помощью неорганизованных каллусов или суспензионных культур. Но когда интересующий метаболит ограничен специализированной частью или железами растения-хозяина, предпочтительным методом является дифференцированное микропроцессорное растение или культура органов. Сапонины из женьшеня производятся в его корнях, и поэтому корневая культура in vitro предпочтительна для синтеза сапонинов.Точно так же антидепрессанты гиперицин и гиперфорин локализуются в листовых железах Hypericum perforatum , которые не были синтезированы из недифференцированных клеток [26].
Количество вторичных метаболитов в клеточных культурах может быть увеличено путем обработки растительных клеток биотическими и / или абиотическими элиситорами. Метилжасмонат, грибковые углеводы и дрожжевой экстракт являются обычно используемыми элиситорами. Метилжасмонат является признанным и эффективным элиситором, используемым в производстве таксола из Taxus chinensis [27] и гинсенозида из Panax ginseng [28, 29, 30, 31, 32].Последние разработки и разработки метаболической инженерии могут быть использованы для повышения производительности.
Производство метаболитов через волосистую корневую систему на основе инокуляции Agrobacterium rhizogenes в последнее время привлекает большое внимание. Качество и количество вторичного метаболита в волосистой корневой системе такое же или даже лучше, чем у интактного корня растения-хозяина [33]. Кроме того, стабильный генетический состав, мгновенный рост в питательных средах для культивирования тканей растений и фитогормонов предоставляет дополнительные возможности для биохимических исследований.Кончики корней, инфицированные A. rhizogenes , выращивают на средах для культивирования тканей [среды B5 или SH Гамборга Мурашиге и Скуга], не содержащей фитогормонов. Шривастава и Шривастава [34] недавно обобщили попытки адаптировать конструкцию биореактора к культурам волосистых корней; бак с мешалкой, эрлифт, барботажные колонны, соединительный поток, лопатка турбины, вращающийся барабан, а также различные газофазные реакторы были успешно использованы. Испытываются генетические манипуляции в культуре волосистых корней для производства вторичных метаболитов.Укрепившиеся корни проверяются на предмет более быстрого роста и производства метаболитов. Трансгенные волосатые корни, полученные с помощью Agrobacterium rhizogenes , проложили путь не только для образования проростков, но и для синтеза желаемого продукта через культуры трансгенных волосистых корней.
4.3. Вторичные метаболиты микроорганизмов
Вторичные метаболиты микробов представляют собой низкомолекулярные продукты с необычной структурой. Структурно разнообразные метаболиты проявляют разнообразную биологическую активность, такую как противомикробные средства, ингибиторы ферментов и противоопухолевые средства, иммуносупрессивные и противопаразитарные средства [7], стимуляторы роста растений, гербициды, инсектициды, антигельминтики и т. Д.Они производятся на поздней стадии роста микроорганизмов. Производство вторичных метаболитов контролируется особыми регуляторными механизмами в микроорганизмах, поскольку их производство обычно подавляется в логарифмической фазе и подавляется в стационарных фазах роста. Вторичные метаболиты микробов имеют характерный молекулярный скелет, которого нет в химических библиотеках, и около 40% микробных метаболитов не могут быть синтезированы химическим путем [35].
4.3.1. Характеристики микробных вторичных метаболитов
Принцип и процесс синтеза продуктов естественной ферментации могут быть успешно расширены и использованы для максимального использования в медицине, сельском хозяйстве, пищевой промышленности и окружающей среде.
Метаболит может служить в качестве исходного материала для получения интересующего продукта, расширяемого путем химической или биологической трансформации.
Новый аналог или шаблоны, в которых вторичный метаболит служит в качестве основных соединений, приведет к открытию и разработке новых лекарств.
4.4. Применение микробных вторичных метаболитов
4.4.1. Антибиотики
Открытие пенициллина дало толчок исследователям к использованию микроорганизмов для производства вторичных метаболитов, что произвело революцию в области микробиологии [5].С появлением новых методов скрининга и выделения были идентифицированы различные молекулы, содержащие β-лактам [36] и другие типы антибиотиков. Описано около 6000 антибиотиков, 4000 из актинобактерий (таблица 3). В группе прокариот одноклеточные бактерии Bacillus (таблица 3) и Pseudomonas (таблица 3) являются наиболее повторяющимися продуцентами антибиотиков. Точно так же у эукариот грибы являются основными продуцентами антибиотиков после растений (таблица 3).В последние годы виды миксобактерий и цианобактерий присоединились к этим выдающимся организмам в качестве продуктивных видов.
| Название вторичных метаболитов | Источник вторичных метаболитов | Биологическая активность | Ссылки |
|---|---|---|---|
| Вторичные метаболиты актинобактерий0 | Ингибитор протеазы ВИЧ-1 | Shiono et al.[39] | |
| Гималомицины А и В | Streptomyces sp. B6921 | Противомикробное средство | Maskey et al. [40] |
| Бонактин | Streptomyces sp. BD21–2 | Антибактериальный | Schumacher et al. [41] |
| Триоксакарцины | S. ochraceus и S. botropensis | Противоопухолевое и противомалярийное средство | Maskey et al. [42] |
| Хиникомицины А и В | Streptomyces sp. | Противоопухолевое и противовирусное средство | Li et al. [43] |
| Daryamides | Streptomyces sp. CNQ-085 | Цитотоксические поликетиды | Asolkar et al. [44] |
| Резистофлавин | S. chibaensis | Антибактериальный | Gorajana et al. [45] |
| Халкомицин А и терпены | Streptomyces sp. M491 | Антибактериальный | Wu et al.[46] |
| Напирадиомицин (С-16 стереоизомеры) | S. antimycoticus | Антибактериальный | Motohashi et al. [47] |
| Оксогексаен и цефалаксин | Streptomyces sp. RM17 ; Streptomyces sp. RM42 | Антибактериальные | Ремья и Виджаякумар [48] |
| Цитреамицин θ A, цитреамицин θ B и цитреагликон A | S. caelestis | Антибактериальный Liu et al. | [49]|
| Спирамицин | Streptomyces sp. RMS6 | Антибактериальный | Виджаякумар и Малати [50] |
| N-изопентилтридеканамид | Streptomyces labedae ECR 77 | Антибактериальный | и др. Thirumurugan. [51] |
| Стауроспорин | Streptomyces champavatii KV2 | Противомикробное средство | Cholarajan and Vijayakumar [52] |
| Вторичные метаболиты Bacillus. | |||
| Коагулин | B.coagulans | Бактерицидное, бактериолитическое | Le Marrec et al. [53] |
| Бактуруцин f4 | B. thuringenesis sp. | Fungicidal sub sp., kurstaki BUPM4 | Kamoun et al. [54] |
| Cerein | B. cereus | Бактерицидное, бактериолитическое | Bizani et al. [55] |
| Мегацин | B.megaterium | , | Lisboa et al. [56] |
| Турицин S | B. thuringenesis | , | Chehimi et al. [57] |
| Турицин CD 19 | B. thuringenesis DPC6431 B. anthracis | , | Rea et al. [58] |
| Галобациллин 5b | B. licheniformis | Гемолитический, цитотоксический | Калиновская и др.[59] |
| Бацилломицин | B. амилоликефацины FZB42, B. subtilis | Противогрибковое гемолитическое средство | Ramarathnam et al. [60] |
| Бацилизоцин | B. subtilis | Фунгицидное антибактериальное действие | Tamehiro et al. [61] |
| Бацилизин 1 | B. subtilis 168 , B. pumilus B. amyloliquefaciens GSB272 | Противогрибковое, антибактериальное средство | Steinborn.[62] |
| Вторичные метаболиты Pseudomonas spp. | |||
| Псевдомонин | P. stutzeri KC | Конкурентное ингибирование фитопатогенов | Lewis et al. [63] |
| Цианистый водород | P. pseudoalcaligenes P4 | Противогрибковое | Ayyadurai et al. [64] |
| Вторичные метаболиты грибов | |||
| Ловастатин | Monascus ruber; Aspergillus terreus | Ингибитор ферментов | Дьюик [65] |
| Лимонен и гвайол | Trichoderma viride | Противомикробное средство | Awad et al.[66]|
| Tuberculariols | Tubercularia sp. TF5 | Противораковое средство | Xu et al. [67] |
| Оксалин | Penicillium raistricki | Анти-клеточная пролиферация | Sumarah et al. [68] |
| Benzomalvin C | Penicillium raistrickii , Penicillium sp. SC67 | Противомалярийное средство | Stierle et al. [69] |
| Рокефортин C | P.рокфорти; P. crustosum | Нейротоксин | Kim et al. [70]; Xu et al. [67] |
| Правастатин | Penicillium citrinum | Антихолестеринемические средства | Gonzalez et al. [71] |
Таблица 3.
Вторичные метаболиты, продуцируемые микроорганизмами.
Фармацевтический продукт, особенно противоинфекционные производные, содержит 62% антибактериальных препаратов, 13% сывороток, иммуноглобулинов и вакцин, 12% противовирусных препаратов против ВИЧ, 7% противогрибковых средств и 6% противовирусных препаратов, не являющихся вирусами ВИЧ.Существует более 160 антибиотиков. Streptomyces hygroscopicus с более чем 200 антибиотиками, Streptomyces griseus с 40 антибиотиками и Bacillus subtilis с более чем 60 соединениями являются основными участниками рынка антибиотиков [7].
4.4.2. Противоопухолевые средства
Натуральный продукт и его производные составляют более 60% противоопухолевых препаратов. В настоящее время используются противоопухолевые молекулы, происходящие от актинобактерий, — это актиномицин D, антрациклины (даунорубицин, доксорубицин, эпирубицин, пирарубицин и валрубицин), блеомицин, митозаны (митомицин C), антраценоны (митозан, стрептогестицин) и энтрациклины (пенто-гестицин) и и эпотилоны [37].
Таксол представляет собой неактинобактериальную молекулу, полученную из растения Taxus brevifolia и эндофитных грибов Taxomyces andreanae и Nodulisporium sylviforme. Он препятствует распаду микротрубочек, важному событию, ведущему к делению клеток, тем самым подавляя быстро делящиеся раковые клетки. Он эффективен против груди и на поздних стадиях саркомы Капоши. Также обнаружено, что он проявляет противогрибковую активность против Pythium , Phytophthora, и Aphanomyces .
4.4.3. Фармакологические и нутрицевтические агенты
Огромным успехом стало открытие грибковых статинов, включая компактин, ловастатин, правастатин и другие, которые действуют как агенты, снижающие уровень холестерина. Ловастатин производится A. terreus. Большое значение в медицине имеют иммунодепрессанты, такие как циклоспорин А, сиролимус (рапамицин), такролимус и микофенолят мофетил. Они используются для трансплантации сердца, печени и почек и были ответственны за создание области трансплантации органов.Циклоспорин А производится грибком Tolypocladium niveum . Микофенолятмофетил — это полусинтетический продукт самого старого известного антибиотика, микофеноловой кислоты, который также вырабатывается грибком. Сиролимус и такролимус — продукты стрептомицетов [7]. Метаболиты пробиотических бактерий рассматриваются как средство для контроля набора веса, предотвращения ожирения, увеличения сытости, продления насыщения, уменьшения потребления пищи, уменьшения отложения жира, улучшения энергетического обмена, лечения и повышения чувствительности к инсулину и лечения ожирения. Firmicutes и Bacteroidetes являются доминирующими полезными бактериями, присутствующими в нормальном желудочно-кишечном тракте человека, и о последних в меньшем количестве сообщалось у пациентов с синдромом раздраженного кишечника с преобладанием запора [38]. Каротиноиды микробного происхождения используются в качестве пищевого красителя, кормов для рыб, нутрицевтиков, косметики и антиоксидантов. Широко используемым пищевым красителем является каротин, полученный из Blakeslea trispora, Dunaliella salina и ликопин из B.trispora и Streptomyces chrestomyceticus, subsp . rubescens. Астаксантин, полученный из Xanthophyllomyces dendrorhous , является одобренным кормом для рыб. Астаксантин, лютеин, β-каротин, зеаксантин и кантаксантин используются в качестве нутрицевтиков из-за их превосходных антиоксидантных свойств. Докозагексаеновая кислота (DHA), используемая в детских смесях в качестве пищевых добавок, получена из микроводорослей Schizochytrium spp. [7].
4.4.4. Ферменты и ингибиторы ферментов
Ферменты, произведенные из микроорганизмов, ежегодно продаются в размере 2 долларов США.3 миллиарда ферментов, которые находят применение в моющих средствах (34%), пищевых продуктах (27%), сельском хозяйстве и кормах (16%), текстиле (10%) и коже, химикатах и целлюлозно-бумажной промышленности (10%). Ежегодная продажа протеазы субтилизина, используемой в моющих средствах, составляет 200 миллионов долларов. Другие основные ферменты включают глюкозоизомеразу (100 000 тонн) и пенициллин амидазу (60 000 тонн). Стоимость производства нитрилазы (30 000 тонн) и фитазы составляет 135 миллионов долларов. Глюкозоизомераза Streptomyces используется для изомеризации D-глюкозы в D-фруктозу для производства 15 миллионов тонн кукурузного сиропа с высоким содержанием фруктозы в год, стоимостью 1 миллиард долларов [7].
Наиболее важными ингибиторами ферментов являются клавулановая кислота, синтезируемая Streptomyces clavuligerus , ингибитором β-лактамаз. Некоторые из общих мишеней для других ингибиторов — это глюкозидазы, амилазы, липазы, протеазы и ксантиноксидаза. Ингибиторы амилазы предотвращают всасывание диетического крахмала в организм и, следовательно, могут использоваться для похудания [38].
4.4.5. Продукты для сельского хозяйства и здоровья животных
Вторичные метаболиты находят широкое применение в области сельского хозяйства и здоровья животных: касугамицин и полиоксины используются в качестве биопестицидов; Bacillus thuringiensis кристаллы, никкомицин и спинозины используются в качестве биоинсектицидов; биогербициды (биалафос) находят применение в качестве биогербицидов; ивермектин и дорамектин в качестве антигельминтных средств и эндектоцидов против глистов, вшей, клещей и клещей; стимуляторы роста жвачных животных в виде кокцидиостатов; гормоны растений, такие как гиббереллины, в качестве регуляторов роста являются наиболее распространенным применением [7].
4.5. Производство вторичных метаболитов из микроорганизмов
Вторичные метаболиты ответвляются от путей первичного метаболизма. Коммерчески важные вторичные и первичные метаболические пути приведены в таблице 4.
| S. No. | Промежуточные продукты первичного метаболического пути | Вторичные метаболиты, полученные из вторичных метаболитов | ||
|---|---|---|---|---|
| 1. | Шикимовая кислота | Алкалоиды спорыньи, антибиотики: кандицидин и хлорамфеникол | ||
| 2. | Аминокислоты | Антибиотики: пенициллин, цефалоспорины и цефамицины, а также грамицидин, иммунодепрессивный циклоспорин | ||
| 3. | Ацетил-КоА и другие промежуточные звенья антипаразита 905, антипаразитоксин 905, антипаразитарный цикл Кребба 905 | 4. | Сахара | Антибиотики: стрептомицин и канамицин. |
Таблица 4.
Промежуточный продукт первичного метаболизма и производные их вторичных метаболитов.
4.5.1. Жидкая ферментация
Периодическая или периодическая культура с подпиткой при глубокой ферментации используется для производства вторичных метаболитов. Инокулят создается после тщательной доработки штамма организма-продуцента. Сначала используют культуру во встряхиваемых колбах, и культуру, находящуюся в активной фазе роста, переносят в небольшой ферментер, а затем в более крупный ферментер с производственной средой. Контролируются некоторые параметры, такие как состав среды, pH, температура, скорость перемешивания и аэрации.Индуктор, такой как метионин, добавляется к ферментации цефалоспорина, фосфат ограничивается при ферментации хлортетрациклина, а глюкоза избегается при ферментации пенициллина или эритромицина.
4.5.2. Твердотельная ферментация
Твердотельная ферментация, определяемая как микробная культура, развивающаяся на поверхности и внутри твердого матрикса и в отсутствие свободной воды, обладает важным потенциалом для производства вторичных метаболитов. В зависимости от природы используемой твердой фазы можно выделить два типа SSF [7]: (а) твердая культура одной твердой фазы фазы подложка-подложка и (b) твердая культура твердой фазы двух фаз подложка-подложка.Преимущества твердофазной ферментации по сравнению с погруженной ферментацией включают: энергетические потребности процесса относительно низкие, поскольку кислород передается непосредственно микроорганизмам. Вторичные метаболиты часто производятся с гораздо более высокими выходами, часто в более короткие сроки, и часто стерильные условия не требуются [7].
Здесь важно отметить наш собственный опыт получения вторичного метаболита актинобактерий. Актинобактерии из наземных и морских местообитаний были проверены на их антимикробную активность.Биоактивные метаболиты экстрагировали и очищали с помощью тонкослойной и колоночной хроматографии, а структура метаболита была выяснена с помощью УФ-спектрометрии, FT-IR, масс-спектрального анализа и ЯМР. Производные метаболиты стауроспорин, окта-валиномицин, метил-4,8-диметилундеканат и N-изопентилтридеканамид известны своей биологической активностью (рис. 2).
Рисунок 2.
Химическая структура вторичных метаболитов актинобактерий. (а) стауроспорин, (б) окта-валиномицин, (в) метил-4,8-диметилундеканат и (г) N-изопентилтридеканамид из актинобактерий.Источник: Чолараджан и Виджаякумар [52]; Чолараджан [72]; Thirumurugan et al. [73].
5. Заключение
В этом обзоре подчеркивается важность вторичных метаболитов из различных источников, таких как растения, микроорганизмы, включая бактерии, актинобактерии и грибы, а также их классификация, производство и применение в различных областях. Поскольку существует постоянная и критическая потребность в новых фармацевтических средствах для борьбы с раком, сердечными заболеваниями, вредителями, цитотоксическими средствами, комарами, инфекционными заболеваниями и аутоиммунными заболеваниями как животных, так и растений, изменения климата создают условия, благоприятные для повторных вспышек этих явлений.Борьба с любой болезнью — это яркая симметрия между достижениями в химиотерапии и естественным отбором в отношении инфекционных или инвазивных агентов.

 к. образуется ядовитый газ
к. образуется ядовитый газ