 2Fe2 O3 + 8SO2 + Q
2Fe2 O3 + 8SO2 + QРеферат по химии
<img src="/cache/referats/21821/image001.gif" v:shapes="_x0000_i1025">
ученицы 9 «В» класса
гимназии № 44
Богдановой Инги
Сернаякислота
Свойства.
Сернаякислота представляет собой бесцветную вязкую жидкость, плотность 1,83 г/мл(20º). Температура плавления серной кислоты составляет 10,3ºС,температура кипения 269,2ºС.
Химические свойства серной кислоты во многом зависят от ее концентрации. В лабораториях ипромышленности применяют разбавленную и концентрированную серную кислоту, хотяэто деление условно (четкую границу между ними провести нельзя).
1. Взаимодействие с металлами.
Разбавленная серная кислота взаимодействует с некоторыми металлами,например с железом, цинком, магнием, с выделением водорода:
Fe+h3SO4=FeSO4+h3
Некоторые малоактивные металлы, такиекак медь, серебро, золото, с разбавленной серной кислотой не реагируют.
Концентрированная серная кислотаявляется сильным окислителем. Она окисляет многие металлы. Продуктами восстановлениякислоты обычно являются оксиды серы (IV), сероводород и сера (Н2S и Sобразуются в реакциях кислоты сактивными металлами – магнием, кальцием, натрием, калием и др.). Примерыреакций:
Cu+2h3SO4=CuSO4+SO2+2h3O
Mg+2h3SO4=MgSO4+SO2+2h3O или
4Mg+5h3SO4=4MgSO4+h3S+4h3O
Серная кислота высокой концентрации(практически безводная) не взаимодействует с железом в результате пассивации металла. Явление пассивациисвязано с образованием на поверхности металла прочной сплошной пленки,состоящей из оксидов или других соединений, которые препятствуют контактуметалла с кислотой. Благодоря пассивации можно хранить и перевозитьконцентрированную серную кислоту в стальной таре. Концентрированная сернаякислота пассивирует также аллюминий, никель, хром, титан.
2. Взаимодействие с неметаллами.
Концентрированная серная кислотаможет окислять неметаллы, например:
S+2h3SO4=3SO2+2h3O
Окислительные свойства концентрированной серной кислоты могутпроявляться в реакциях с некоторыми сложными веществами – востановителями,например:
2KBr+2h3SO4=Br2+SO2+K2SO4+2h3O
3. Взаимодействия сосновными оксидами и основаниями.
Серная кислота проявляет все типичныесвойства кислот. Так, она реагирует с основными амфотерными оксидами игидроксидами с образованием солей. Как двухосновная кислота h3SO4образует два типа солей: средниесоли – сульфаты и кислые соли – гидросульфаты. Примеры реакций:
Al2O3+3h3SO4=Al2(SO4)3+3Н2О
сульфат алюминия
2КОН+Н2SO4=K2SO4+2h3O
сульфат калия
КОН+Н2SO+=KHSO4+h3O
гидросульфат калия
Гидросульфаты образуются, когдакислота берется в избытке.
Многие соли серной кислоты выделяютсяиз растворов в виде кристаллогидратов, например
Al2(SO4)3 18Н2О Na2SО4 10Н2О
4. Взаимодействие с солями.
С некоторыми солями серная кислотавступает в реакции обмена, например:
СаСО3+Н2SO4=CaSO4+СО2↑+Н2О
ВаСl2+h3SO4=BaSO4↓+2HCl
Последняя реакция являетсякачественной на серную кислоту и ее соли: об их присутствии в растворе судят пообразованию белого осадка ВаSO4, которыйпрактически не растворяется в концентрированой азотной кислоте.
5. Взаимодействие с водой.
При растворении в воде сернаякислота активно взаимодействует с ней, образуя гидраты:
nh3O+h3SO4=h3SO4·nh3O
Благодоря способности связывать воду,серная кислота является хорошим осушителем.
Многие органические вещества,содержащие водород и кислород (бумага, древесина, ткани, сахара), при дествиисерной кислоты обугливаются в результате связывания кислотой воды. Например: процессобугливания сахара С12Н22О11можно описать следующим уравнением:
nC12h32O11+h3SO4=12nC
6. Диссоциация кислоты.
В водных растворах серная кислотадиссоциирует на ионы
В водном растворе серная кислота является оченьсильной- она диссоциирована практически полностью по юбоим ступеням. Безводнаясерная кислота диссоциирует в незначительной степени, т.е. является слабой.
Производство серной кислоты.
Весь процесс можно разбить на три последовательные стадии:получение диоксида серы, окисление его до триоксида и поглощение триоксидасеры.
1.<span Times New Roman"">
Получение диоксида серы.Наиболее распространенным сырьемдля получения SO2 является пирит FeS2, который подвергается обжигу:
4FeS2+11O2=2FeO2+8SO2
Обжиг производят в специальнойпечи.В печь снизу под давлением подается воздух с такой скоростью, чтобы слойраздробленного пирита разрыхлялся, но частицы твердого вещества не уносилисьпотоком воздуха и обжиговых газов. Такой способ обжига называется обжигом в кипящем слое, так как слойтвердого вещества похож на кипящую жидкость.
В результате обжига пиритаполучается обжиговый газ, который, кроме диоксида серы, содержит кислород, азот,пары воды и другие примеси. Некотрые из этих примесей вредны для последующихпроцессов производства серной кислоты, поэтому обжиговый газ подвергается тщательной очистке от твердыхчастиц (пыли) и влаги. Осушение газа проводится концентрированной сернойкислотой.
Иногда в качестве сырья дляполучения серной кислоты используют диоксид серы, содержащийся в отходящихгазах других производств или полученный сжиганием серы.
2.Получение триоксида серы.
Вторая стадия производства сернойкислоты – окисление диоксида серы кислородом воздуха до триоксида. В настоящеевремя этот процесс осуществляется контактныи способом: окисление производитсяпри температуре 400- 600°С в присутствии катализаторов (платина, оксид ванадия(V)V2O5илиоксид железа(III) Fe2O3).Этот процесс экзотермический. Выделяющаяся теплота используется для подогреваобжигового газа.
3.Прглощение триоксида серы.
Полученный оксид серы (VI) поступает впоглотительную башню, стенки которой орошаются концентрированной сернойкислотой(массовая доля h3SO498%).Поглощение триоксида серы водой неэффективно: образуется «туман» из мелкихкапелек серной кислоты, который долго концентрируется.
Конечный продукт производства –раствор SO3в серной кислоте, называемый олеумом. Он может быть разбавлен водой до серной кислоты нужной концентрации.
Применение.
Серная кислота – важнейший продуктхимической промышленности. Она находит примерение в производстве минеральныхудобрений, волокон, пластмасс, красителей, взрывчатых веществ, в металлургиипри получении меди, никеля, урана и других металлов. Используется ка осушител ьгазов.
Большое практическоеприменение из солей серной кислоты имеют различные сульфаты. Медный и железныйкупоросы CuSO4·5h3O и FeSO4 ·7h3O используются всельском хозяйстве для борьбы с вредителями растений, в производстве красок,для пропитки древесины в качествеантисептического средства. Купоросами называюткристаллогидраты сульфатов некоторых металлов (меди, железа, цинка, никеля).
Гипс CaSO4·2h3O и сульфаткальция СаSO4 используют в строительстве, медицинеи других облостях. Из гипса при прокаливании получают алебастр СаSO4·0,5h3O:
CaSО4·2h3O=CaSO4·0,5h3O+1,5h3O
Алебастр, смешааный с водой, быстрозатвердевает, превращаясь в гипс:
СаSO4·0,5h3O+1,5h3O=CaSO4·2h3O
Сульфат натрия N2SO4 используется в производстве стекла.Сульфат натрия входит в состав природного минерала Na2SO4·10h3O – глауберовой соли, или мирабилита. Сульфаты калия или аммонияприменяют как удобрения. Алюмокалиевыкквасцы КАI(SO4)2·11h3O проявляют дубящие своцства, и их используют в производствекожи, а также как протраву при крашении тканей. Сульфат бария ВаSО4применяется в производстве бумаги, резины и белыхминеральных красок.
www.ronl.ru
Серная кислота
Химическое производство представляет собой сложную химико-технологическую систему (ХТС), сложность которой определяется как наличием большого количества связей, элементов и подсистем, так и разнообразием решаемых задач. Основной целью химического производства является получение химического (целевого) продукта заданного качества при минимальных затратах и возможно меньшим количестве отходов. Для анализа ХТС и возможности их оптимизации необходима модель процесса, отражающая, в первую очередь, связи между элементами и их взаимное влияние друг на друга. Основой такой модели служит баланс масс в системе.
Расчет материального баланса является основным этапом в проектной работе инженеров химиков-технологов. На основе материальных балансов определяется целый ряд важнейших техно-экономических показателей и характеристик основных аппаратов. Из данных материальных балансов определяют: расход сырья и вспомогательных материалов для обеспечения заданной производительности; тепловой баланс и, соответственно, расход энергии и теплообменную аппаратуру; экономический баланс производства, себестоимость продукции и, следовательно, рентабельность производства. Материальный баланс позволяет оценить степень совершенства производства (комплексность использования сырья, номенклатуру и количество отходов), а также проанализировать причины потерь. При расчете баланса задаются величиной механических потерь, которая, как правило, не должна превышать 5%. Эти потери определяются не столько несовершенством технологии или дефектами оборудования, сколько культурой производства в целом.
Технология серной кислоты.
Среди минеральных кислот, производимых химической промышленностью, серная кислота по объему производства и потребления занимает первое место. Объясняется это и тем, что она самая дешевая из всех кислот, а также ее свойствами. Серная кислота не дымит, в концентрированном виде не разрушает черные металлы, в то же время является одной из самых сильных кислот, в широком диапазоне температур (от –40…-20 до 260-336,5 ºС) находится в жидком состоянии.
Области применения серной кислоты чрезвычайно обширны. Существенная ее часть используется как полупродукт в различных отраслях химической промышленности, прежде всего для получения минеральных удобрений, а также солей, кислот, взрывчатых веществ. Серная кислота применяется и при производстве красителей, химических волокон, в металлургической, текстильной, пищевой промышленности и т. д.
Серная кислота может существовать как самостоятельное химическое соединение h3SO4, а также в виде соединений с водой
h3SO4*2h3O, h3SO4*h3O, h3SO4 *4h3O и с триоксидом серы h3SO4 *SO3 , h3SO4*2SO3.
В технике серной кислотой называют и безводную h3SO4 и ее водные растворы (по сути дела, это смесь h3O, h3SO4 и соединений h3SO4*nh3O), и растворы триоксида серы в безводной h3SO4 – олеум (смесь h3SO4 и соединений h3SO4*nSO3)
Безводная серная кислота – тяжелая маслянистая бесцветная жидкость, смешивающаяся с водой и триоксидом серы в любом соотношении. Физические свойства серной кислоты, такие, как плотность, температура кристаллизации, температура кипения, зависят от ее состава.
Безводная 100%-ная серная кислота имеет сравнительно высокую температуру кристаллизации 10,7ºC. Чтобы уменьшить возможность замерзания товарного продукта при перевозке и хранении, концентрацию технической серной кислоты выбирают такой, чтобы она имела достаточно низкую температуру кристаллизации. Промышленность выпускает три вида товарной серной кислоты (башенная кислота, контактная кислота и олеум).
Рассмотренные свойства серной кислоты необходимо учитывать как при выборе технологического режима процесса, так и при проектировании отдельных аппаратов, трубопроводов и т. д. Например, при размещении цеха на открытой площадке необходимо предусмотреть теплоизоляцию трубопроводов, по которым циркулируют растворы серной кислоты, имеющие достаточно высокие температуры кристаллизации. Учет диаграммы фазового равновесия паров и жидкости позволяет правильно выбрать условия проведения стадии абсорбции триоксида серы, обеспечивающие высокую степень абсорбции и предупреждающие побочные явления, такие, например, как образование сернокислотного тумана.
Сырье для серной кислоты и методы ее получения.
Исходными реагентами для получения серной кислоты могут быть элементная сера и серосодержащие соединения, из которых можно получить либо серу, либо диоксид серы
Традиционно основными источниками сырья являются сера и железный (серный) колчедан. Около половины серной кислоты получают из серы, треть – из колчедана. Значительное место в сырьевом балансе занимают отходящие газы цветной металлургии, содержащие диоксид серы.
В то же время отходящие газы – наиболее дешевое сырье, низки оптовые цены и на колчедан, наиболее же дорогостоящим сырьем является серы. Следовательно, для того чтобы производство серной кислоты из серы было экономически целесообразно, должна быть разработана схема, в которой стоимость ее переработки будет существенно ниже стоимости переработки колчедана или отходящих газов.
Получение серной кислоты включает несколько этапов. Первым этапом является получение диоксида серы окислением (обжигом) серосодержащего сырья (необходимость в этой стадии отпадает при использовании в качестве сырья отходящих газов, так как в этом случае обжиг сульфидов является одной из стадий других технологических процессов). Следующий этап – превращение оксида серы (IV) в оксид серы (VI). Этот окислительный процесс характеризуется очень высоким значением энергии активации, для понижения которой необходимо, как правило применение катализаторов. В зависимости от того, как осуществляется процесс окисления SO2 в SO3, различают два основных метода получения серной кислоты.
В контактном методе получения серной кислоты процесс окисления SO2 в SO3 проводят на твердых катализаторах.
Триоксид серы переводят в серную кислоту на последней стадии процесса – абсорбции триоксида серы, которую упрощенно можно представить уравнением реакции:
SO3 + h3Oà h3SO4
При проведение процесса по нитрозному (башенному) методу в качестве переносчика кислорода используют оксиды азота.
Окисление диоксида серы осуществляется в жидкой фазе и конечным продуктом является серная кислота:
SO2 + N2O3 + h3O à h3SO4 + 2NO
В настоящее время в промышленности в основном применяют контактный метод получения серной кислоты, позволяющий использовать аппараты с большей интенсивностью.
При подготовке данной работы были использованы материалы с сайта http://www.studentu.ru
Дата добавления: 27.11.2002
www.km.ru
Физические свойства.
Чистая 100 %-ная серная кислота (моногидрат) представляет собой бесцветную маслянистую жидкость, застывающую в кристаллическую массу при +10 °С. Реактивная серная кислота имеет обычно плотность 1,84 г/см3 и содержит около 95 % h3SO4. Затвердевает она лишь ниже -20 °С.
Температура плавления моногидрата равна 10,37 °С при теплоте плавления 10,5 кДж/моль. В обычных условиях он представляет собой очень вязкую жидкость с весьма высоким значением диэлектрической проницаемости (e = 100 при 25 °С). Незначительная собственная электролитическая диссоциация моногидрата протекает параллельно по двум направлениям: [Н3SO4+]·[НSO4-] = 2·10-4 и [Н3О+]·[НS2О7-] = 4·10-5. Его молекулярно-ионный состав может быть приближенно охарактеризован следующими данными (в %):
h3SO4 HSO4- h4SO4+ h4O+ HS2O7- h3S2O7
99,5 0,18 0,14 0,09 0,05 0,04
При добавлении даже малых количеств воды преобладающей становится диссоциация по схеме:Н2О + Н2SО4 Н3О+ + НSO4-
h3SO4 - сильная двухосновная кислота.
h3SO4 H+ + HSO4- 2H+ + SO42-
Первая ступень (для средних концентраций) приводит к 100%-ой диссоциации:
K2 = ([H+] · [SO42-]) / [HSO4-] = 1,2 · 10-2
1) Взаимодействие с металлами:
a) разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода:
Zn0 + h3+1SO4(разб) --> Zn+2SO4 + h3O
b) концентрированная h3+6SO4 - сильный окислитель; при взаимодействии с металлами (кроме Au, Pt) может восстанавливаться до S+4O2, S0 или h3S-2 (без нагревания не реагируют также Fe, Al, Cr - пассивируются):
2Ag0 + 2h3+6SO4 --> Ag2+1SO4 + S+4O2 + 2h3O
8Na0 + 5h3+6SO4 --> 4Na2+1SO4 + h3S-2 + 4h3O
2) концентрированная h3S+6O4 реагирует при нагревании с некоторыми неметаллами за счет своих сильных окислительных свойств, превращаясь в соединения серы более низкой степени окисления, (например, S+4O2):
С0 + 2h3S+6O4(конц) --> C+4O2 + 2S+4O2 + 2h3O
S0 + 2h3S+6O4(конц) --> 3S+4O2 + 2h3O
2P0 + 5h3S+6O4(конц) --> 5S+4O2 + 2h4P+5O4 + 2h3O
3) с основными оксидами:
CuO + h3SO4 --> CuSO4 + h3O
CuO + 2H+ --> Cu2+ + h3O
4) с гидроксидами:
h3SO4 + 2NaOH --> Na2SO4 + 2h3O
H+ + OH- --> h3O
h3SO4 + Cu(OH)2 --> CuSO4 + 2h3O
2H+ + Cu(OH)2 --> Cu2+ + 2h3O
5) обменные реакции с солями:
BaCl2 + h3SO4 --> BaSO4 + 2HCl
Ba2+ + SO42- --> BaSO4
Образование белого осадка BaSO4 (нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов.
MgCO3 + h3SO4 --> MgSO4 + h3O + CO2 h3CO3
Моногидрат (чистая, 100%-ая серная кислота) является ионизирующим растворителем, имеющим кислотный характер. В нём хорошо растворяются сульфаты многих металлов (переходя при этом в бисульфаты), тогда как соли других кислот растворяются, как правило, лишь при возможности их сольволиза (с переводом в бисульфаты). Азотная кислота ведет себя в моногидрате как слабое основаниеHNO3 + 2 h3SO4 h4O+ + NO2+ + 2 HSO4-хлорная - как очень слабая кислотаh3SO4 + HClO4 = h4SO4+ + ClO4- Фторсульфоновая и хлорсульфоновая оказываются кислотами несколько более сильными (HSO3F > HSO3Cl > HClO4). Моногидрат хорошо растворяет многие органические вещества, имеющие в своём составе атомы с неподелёнными электронными парами (способными к присоединению протона). Некоторые из них могут быть затем выделены обратно в неизменённом состоянии путем простого разбавления раствора водой. Моногидрат обладает высоким значением криоскопической константы (6,12°) и им иногда пользуются как средой для определения молекулярных весов.
Концентрированная h3SO4 является довольно сильным окислителем, особенно при нагревании (восстанавливается обычно до SO2). Например, она окисляет HI и частично HВr (но не HСl) до свободных галогенов. Окисляются ею и многие металлы - Cu, Hg и др. (тогда как золото и платина по отношению к h3SO4 устойчивы). Так взаимодействие с медью идёт по уравнению:
Cu + 2 h3SO4 = CuSO4 + SO2 + h3O
Действуя в качестве окислителя, серная кислота обычно восстанавливается до SO2. Однако наиболее сильными восстановителями она может быть восстановлена до S и даже h3S. С сероводородом концентрированная серная кислота реагирует по уравнению:
h3SO4 + h3S = 2h3O + SO2 + S
Следует отметить, что она частично восстанавливается также газообразным водородом и поэтому не может применяться для его осушки.
Рис. 13. Электропроводность растворов серной кислоты.
Растворение концентрированной серной кислоты в воде сопровождается значительным выделением тепла (и некоторым уменьшением общего объёма системы). Моногидрат почти не проводит электрического тока. Напротив, водные растворы серной кислоты являются хорошими проводниками. Как видно на рис. 13, максимальной электропроводностью обладает приблизительно 30 %-ная кислота. Минимум кривой соответствует гидрату состава h3SO4·h3O.
Выделение тепла при растворении моногидрата в воде составляет (в зависимости от конечной концентрации раствора) до 84 кДж/моль h3SO4. Напротив, смешиванием 66 %-ной серной кислоты, предварительно охлажденной до 0 °С, со снегом (1:1 по массе) может быть достигнуто понижение температуры, до -37 °С.
Изменение плотности водных растворов h3SO4 с её концентрацией (вес. %) дано ниже:
| 5 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 15 °С | 1,033 | 1,068 | 1,142 | 1,222 | 1,307 | 1,399 | 1,502 |
| 25 °С | 1,030 | 1,064 | 1,137 | 1,215 | 1,299 | 1,391 | 1,494 |
| 70 | 80 | 90 | 95 | 97 | 100 | ||
| 15 °С | 1,615 | 1,732 | 1,820 | 1,839 | 1,841 | 1,836 | |
| 25 °С | 1,606 | 1,722 | 1,809 | 1,829 | 1,831 | 1,827 |
Как видно из этих данных, определение по плотности концентрации серной кислоты выше 90 вес. % становится весьма неточным. Давление водяного пара над растворами h3SO4 различной концентрации при разных температурах показано на рис. 15. В качестве осушителя серная кислота может действовать лишь до тех пор, пока давление водяного пара над её раствором меньше, чем его парциальное давление в осушаемом газе.
Рис. 15. Давление водяного пара.
Рис. 16. Температуры кипения над растворами h3SO4. растворов h3SO4.
При кипячении разбавленного раствора серной кислоты из него отгоняется вода, причём температура кипения повышается вплоть до 337 °С, когда начинает перегоняться 98,3 % h3SO4(рис. 16). Напротив, из более концентрированных растворов улетучивается избыток серного ангидрида. Пар кипящей при 337 °С серной кислоты частично диссоциирован на h3O и SO3, которые вновь соединяются при охлаждении. Высокая температура кипения серной кислоты позволяет использовать её для выделения при нагревании легколетучих кислот из их солей (например, HCl из NaCl).
Моногидрат может быть получен кристаллизацией концентрированной серной кислоты при -10 °С.
Производство серной кислоты.
1-я стадия. Печь для обжига колчедана.
4FeS2 + 11O2 --> 2Fe2O3 + 8SO2 + Q
Процесс гетерогенный:
1) измельчение железного колчедана (пирита)
2) метод "кипящего слоя"
3) 800°С; отвод лишнего тепла
4) увеличение концентрации кислорода в воздухе
2-я стадия. После очистки, осушки и теплообмена сернистый газ поступает в контактный аппарат, где окисляется в серный ангидрид (450°С - 500°С; катализатор V2O5):
2SO2 + O2 2SO3
3-я стадия. Поглотительная башня:
nSO3 + h3SO4(конц) --> (h3SO4 · nSO3)(олеум)
Воду использовать нельзя из-за образования тумана. Применяют керамические насадки и принцип противотока.
Применение.
Помните! Серную кислоту нужно вливать малыми порциями в воду, а не на оборот. Иначе может произойти бурная химическая реакция, в результате которой человек может получить сильные ожоги.
Серная кислота — один из основных продуктов химической промышленности. Идет на производство минеральных удобрений (суперфосфат, сульфат аммония), различных кислот и солей, лекарственных и моющих средств, красителей, искусственных волокон, взрывчатых веществ. Применяется в металлургии (разложение руд, напр. урановых), для очистки нефтепродуктов, как осушитель и др.
Практически важно то обстоятельство, что очень крепкая (выше 75 %) серная кислота не действует на железо. Это позволяет хранить и перевозить её в стальных цистернах. Напротив, разбавленная h3SO4 легко растворяет железо с выделением водорода. Окислительные свойства для неё вовсе не характерны.
Крепкая серная кислота энергично поглощает влагу и поэтому часто применяется для осушки газов. От многих органических веществ, содержащих в своём составе водород и кислород, она отнимает воду, что нередко используется в технике. С этим же (а также с окислительными свойствами крепкой h3SO4) связано её разрушающее действие на растительные и животные ткани. Случайно попавшую при работе на кожу или платье серную кислоту следует тотчас же смыть большим количеством воды, затем смочить пострадавшее место разбавленным раствором аммиака и вновь промыть водой.
Молекулы чистой серной кислоты.
Рис.1. Схема водородных связей в кристалле h3SO4.
Молекулы, образующие кристалл моногидрата, (НО)2SO2 соединены друг с другом довольно сильными (25 кДж/моль) водородными связями, как это схематически показано на рис. 1. Сама молекула (НО)2SO2 имеет структуру искаженного тетраэдра с атомом серы около центра и характеризуется следующими параметрами: (d(S-ОН) = 154 пм, РНО-S-ОН = 104°, d(S=O) = 143 пм, РOSO = 119°. В ионе HOSO3-, d(S-ОН) = 161 и d(SO) = 145 пм, а при переходе к иону SO42- тетраэдр приобретает правильную форму и параметры выравниваются [d(SO) = 148 пм].Кристаллогидраты серной кислоты.
Для серной кислоты известно несколько кристаллогидратов, состав которых показан на рис. 14. Из них наиболее бедный водой представляет собой соль оксония: h4O+HSO4-. Так как рассматриваемая система очень склонна к переохлаждению, фактически наблюдаемые в ней температуры замерзания лежат гораздо ниже температур плавления.
Рис. 14. Температуры плавления в системе h3O·h3SO4.
bukvasha.ru
.
Серную кислоту производят в больших количествах на сернокислотных заводах.
I. Сырьё, используемое для производства серной кислоты:
| 1. | Самородная сера S |
| 2. | Пирит (серный колчедан) FeS2 |
| 3. | Сероводород h3 S |
| 4. | Сульфиды цветных металлов ZnS, Cu2 S |
II. Подготовка сырья.
Разберём производство серной кислоты из пирита FeS2 .
1) Измельчение пирита.
Перед использованием большие куски пирита измельчают в дробильных машинах. Вы знаете, что при измельчении вещества скорость реакции увеличивается, т.к. увеличивается площадь поверхности соприкосновения реагирующих веществ.
2) Очистка пирита.
После измельчения пирита, его очищают от примесей (пустой породы и земли) методом флотации. Для этого измельчённый пирит опускают в огромные чаны с водой, перемешивают, пустая порода всплывает наверх, затем пустую породу удаляют.
III. Химизм производства.
Производство серной кислоты из пирита состоит из трёх стадий.
ПЕРВАЯ СТАДИЯ — обжиг пирита в печи для обжига в «кипящем слое».
Уравнение реакции первой стадии
t = 800°C
4FeS2 + 11O2 2Fe2 O3 + 8SO2 + Q
2Fe2 O3 + 8SO2 + Q

Измельчённый очищенный влажный (после флотации) пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу (принцип противотока) пропускают воздух, обогащённый кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800°С. Пирит раскаляется до красна и находится в «подвешенном состоянии» из-за продуваемого снизу воздуха. Похоже это всё на кипящую жидкость раскалённо-красного цвета.
За счёт выделяющейся теплоты в результате реакции поддерживается температура в печи. Избыточное количество теплоты отводят: по периметру печи проходят трубы с водой, которая нагревается. Горячую воду используют дальше для центрального отопления рядом стоящих помещений.
Образовавшийся оксид железа Fe2 O3 (огарок) в производстве серной кислоты не используют. Но его собирают и отправляют на металлургический комбинат, на котором из оксида железа получают металл железо и его сплавы с углеродом — сталь (2% углерода С в сплаве) и чугун (4% углерода С в сплаве).
Таким образом выполняется принцип химического производства — безотходность производства.

Из печи выходит печной газ, состав которого: SO2, O2, пары воды (пирит был влажный!) и мельчайшие частицы огарка (оксида железа). Такой печной газ необходимо очистить от примесей твёрдых частиц огарка и паров воды.
Очистка печного газа от твёрдых частичек огарка проводят в два этапа — в циклоне (используется центробежная сила, твёрдые частички огарка ударяются о стенки циклона и ссыпаются вниз) и в электрофильтрах (используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра, при достаточном накоплении под собственной тяжестью они ссыпаются вниз), для удаления паров воды в печном газе (осушка печного газа) используют серную концентрированную кислоту, которая является очень хорошим осушителем, поскольку поглощает воду.
 |
Осушку печного газа проводят в сушильной башне — снизу вверх поднимается печной газ, а сверху вниз льётся концентрированная серная кислота. На выходе из сушильной башни печной газ уже не содержит ни частичек огарка, ни паров воды. Печной газ теперь представляет собой смесь оксида серы SO2 и кислорода О2 .
ВТОРАЯ СТАДИЯ — окисление SO2 в SO3 кислородом.
Протекает в контактном аппарате.
Уравнение реакции этой стадии: 2SO2 + O2 2SO3 + Q
2SO3 + Q
Сложность второй стадии заключается в том, что процесс окисления одного оксида в другой является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3 ).
 |
а) температура:
Прямая реакция является экзотермической +Q, согласно правилам по смещению химического равновесия, для того, чтобы сместить равновесие реакции в сторону экзотермической реакции, температуру в системе необходимо понижать. Но, с другой стороны, при низких температурах, скорость реакции существенно падает. Экспериментальным путём химики-технологи установили, что оптимальной температурой для протекания прямой реакции с максимальным образованием SO3 является температура 400-500°С. Это достаточно низкая температура в химических производствах. Для того, чтобы увеличить скорость реакции при столь низкой температуре в реакцию вводят катализатор. Экспериментальным путём установили, что наилучшим катализатором для этого процесса является оксид ванадия V2 O5 .
б) давление:
Прямая реакция протекает с уменьшением объёмов газов: слева 3V газов (2V SO2 и 1V O2 ), а справа — 2V SO3. Раз прямая реакция протекает с уменьшением объёмов газов, то, согласно правилам смещения химического равновесия давление в системе нужно повышать. Поэтому этот процесс проводят при повышенном давлении.
Прежде чем смесь SO2 и O2 попадёт в контактный аппарат, её необходимо нагреть до температуры 400-500°С. Нагрев смеси начинается в теплообменнике, который установлен перед контактным аппаратом. Смесь проходит между трубками теплообменника и нагревается от этих трубок. Внутри трубок проходит горячий SO3 из контактного аппарата. Попадая в контактный аппарат смесь SO2 и О2 продолжает нагреваться до нужной температуры, проходя между трубками в контактном аппарате.
Температура 400-500°С в контактном аппарате поддерживается за счёт выделения теплоты в реакции превращения SO2 в SO3. Как только смесь оксида серы и кислорода достигнет слоёв катализатора, начинается процесс окисления SO2 в SO3 .
Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню.
ТРЕТЬЯ СТАДИЯ — поглощение SO3 серной кислотой.
Протекает в поглотительной башне.

А почему оксид серы SO3 не поглощают водой? Ведь можно было бы оксид серы растворить в воде: SO3 + h3 O  h3 SO4. Но дело в том, что если для поглощения оксида серы использовать воду, образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты (оксид серы растворяется в воде с выделением большого количества теплоты, серная кислота настолько разогревается, что закипает и превращается в пар). Для того, чтобы не образовывалось сернокислотного тумана, используют 98%-ную концентрированную серную кислоту. Два процента воды — это так мало, что нагревание жидкости будет слабым и неопасным. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: h3 SO4 ·nSO3 .
h3 SO4. Но дело в том, что если для поглощения оксида серы использовать воду, образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты (оксид серы растворяется в воде с выделением большого количества теплоты, серная кислота настолько разогревается, что закипает и превращается в пар). Для того, чтобы не образовывалось сернокислотного тумана, используют 98%-ную концентрированную серную кислоту. Два процента воды — это так мало, что нагревание жидкости будет слабым и неопасным. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: h3 SO4 ·nSO3 .
Уравнение реакции этого процесса nSO3 + h3 SO4 h3 SO4 ·nSO3
h3 SO4 ·nSO3
Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю.
Охрана окружающей среды,
связанная с производством серной кислоты.
Основным сырьем для производства серной кислоты, является сера. Она относится к числу наиболее распространенных числу химических элементов на нашей планете.
Производство серной кислоты происходит в три стадии на первой стадии получают SO2, путем обжига FeS2, затем SO3, после чего на третьей стадии получают серную кислоту.
Научно-техническая революция и связанный с ней интенсивный рост химического производства, вызывает существенные негативные изменения в окружающей среде. Например отравление пресных вод, загрязнение земной атмосферы, истребление животных и птиц. В результате мир оказался в тисках экологического кризиса. Вредные выбросы сернокислых заводов следует оценивать не только по действию содержащегося в них оксида серы на расположенные вблизи предприятия зоны, но и учитывать другие факторы — увеличение количества случаев респираторных заболеваний человека и животных, гибель растительности и подавление ее роста, разрушение конструкций из известняка и мрамора, повышение коррозионного износа металлов. По вине “кислых” дождей повреждены памятники архитектуры (Тадж-Макал).
В зоне до 300 км от источника загрязнения (SO2 ) опасность представляет серная кислота, в зоне до 600 км. — сульфаты. Серная кислота и сульфаты замедляют рост с/х культур. Закисление водоемов (весной при таянии снега, вызывает гибель икр и молоди рыб. Помимо экологического ущерба налицо экономический ущерб — громадные суммы каждый год теряются при раскисление почв.
Рассмотрим химические метода отчистки от наиболее распространенных газообразных загрязняющих воздух веществ. Известно более 60 методов. Наиболее перспективны методы, основанные на поглощение оксида серы известняком, раствором сульфита — гидросульфита аммония и щелочным раствором алюмината натрия. Интерес также представляют каталитические методы окисления оксида серы в присутствии оксида ванадия.
Особое значение имеет очистка газов от фторсодержащих примесей, которые даже в незначительной концентрации вредно влияют на растительность. Если в газах содержится фтороводород и фтор, то их пропускают через колоны с насадкой противотоком по отношению к 5-10% раствору гидроксида натрия. В течении одной минуты протекают следующие реакции:
F2 +2NaOH-> O2 +h3 O+2NaF
HF+NaOH->NaF+h3 O;
Образующийся фторид натрия обрабатывают для регенерации гидроксида натрия:
2NaF+CaO+h3 O->CaF2 +2NaOH
www.ronl.ru
Серная кислота
Химическое производство представляет собой сложную химико-технологическую систему (ХТС), сложность которой определяется как наличием большого количества связей, элементов и подсистем, так и разнообразием решаемых задач. Основной целью химического производства является получение химического (целевого) продукта заданного качества при минимальных затратах и возможно меньшим количестве отходов. Для анализа ХТС и возможности их оптимизации необходима модель процесса, отражающая, в первую очередь, связи между элементами и их взаимное влияние друг на друга. Основой такой модели служит баланс масс в системе.
Расчет материального баланса является основным этапом в проектной работе инженеров химиков-технологов. На основе материальных балансов определяется целый ряд важнейших техно-экономических показателей и характеристик основных аппаратов. Из данных материальных балансов определяют: расход сырья и вспомогательных материалов для обеспечения заданной производительности; тепловой баланс и, соответственно, расход энергии и теплообменную аппаратуру; экономический баланс производства, себестоимость продукции и, следовательно, рентабельность производства. Материальный баланс позволяет оценить степень совершенства производства (комплексность использования сырья, номенклатуру и количество отходов), а также проанализировать причины потерь. При расчете баланса задаются величиной механических потерь, которая, как правило, не должна превышать 5%. Эти потери определяются не столько несовершенством технологии или дефектами оборудования, сколько культурой производства в целом.
Технология серной кислоты.
Среди минеральных кислот, производимых химической промышленностью, серная кислота по объему производства и потребления занимает первое место. Объясняется это и тем, что она самая дешевая из всех кислот, а также ее свойствами. Серная кислота не дымит, в концентрированном виде не разрушает черные металлы, в то же время является одной из самых сильных кислот, в широком диапазоне температур (от –40…-20 до 260-336,5 ºС) находится в жидком состоянии.
Области применения серной кислоты чрезвычайно обширны. Существенная ее часть используется как полупродукт в различных отраслях химической промышленности, прежде всего для получения минеральных удобрений, а также солей, кислот, взрывчатых веществ. Серная кислота применяется и при производстве красителей, химических волокон, в металлургической, текстильной, пищевой промышленности и т. д.
Серная кислота может существовать как самостоятельное химическое соединение h3SO4, а также в виде соединений с водой
h3SO4*2h3O, h3SO4*h3O, h3SO4 *4h3O и с триоксидом серы h3SO4 *SO3 , h3SO4*2SO3.
В технике серной кислотой называют и безводную h3SO4 и ее водные растворы (по сути дела, это смесь h3O, h3SO4 и соединений h3SO4*nh3O), и растворы триоксида серы в безводной h3SO4 – олеум (смесь h3SO4 и соединений h3SO4*nSO3)
Безводная серная кислота – тяжелая маслянистая бесцветная жидкость, смешивающаяся с водой и триоксидом серы в любом соотношении. Физические свойства серной кислоты, такие, как плотность, температура кристаллизации, температура кипения, зависят от ее состава.
Безводная 100%-ная серная кислота имеет сравнительно высокую температуру кристаллизации 10,7ºC. Чтобы уменьшить возможность замерзания товарного продукта при перевозке и хранении, концентрацию технической серной кислоты выбирают такой, чтобы она имела достаточно низкую температуру кристаллизации. Промышленность выпускает три вида товарной серной кислоты (башенная кислота, контактная кислота и олеум).
Рассмотренные свойства серной кислоты необходимо учитывать как при выборе технологического режима процесса, так и при проектировании отдельных аппаратов, трубопроводов и т. д. Например, при размещении цеха на открытой площадке необходимо предусмотреть теплоизоляцию трубопроводов, по которым циркулируют растворы серной кислоты, имеющие достаточно высокие температуры кристаллизации. Учет диаграммы фазового равновесия паров и жидкости позволяет правильно выбрать условия проведения стадии абсорбции триоксида серы, обеспечивающие высокую степень абсорбции и предупреждающие побочные явления, такие, например, как образование сернокислотного тумана.
Сырье для серной кислоты и методы ее получения.
Исходными реагентами для получения серной кислоты могут быть элементная сера и серосодержащие соединения, из которых можно получить либо серу, либо диоксид серы
Традиционно основными источниками сырья являются сера и железный (серный) колчедан. Около половины серной кислоты получают из серы, треть – из колчедана. Значительное место в сырьевом балансе занимают отходящие газы цветной металлургии, содержащие диоксид серы.
В то же время отходящие газы – наиболее дешевое сырье, низки оптовые цены и на колчедан, наиболее же дорогостоящим сырьем является серы. Следовательно, для того чтобы производство серной кислоты из серы было экономически целесообразно, должна быть разработана схема, в которой стоимость ее переработки будет существенно ниже стоимости переработки колчедана или отходящих газов.
Получение серной кислоты включает несколько этапов. Первым этапом является получение диоксида серы окислением (обжигом) серосодержащего сырья (необходимость в этой стадии отпадает при использовании в качестве сырья отходящих газов, так как в этом случае обжиг сульфидов является одной из стадий других технологических процессов). Следующий этап – превращение оксида серы (IV) в оксид серы (VI). Этот окислительный процесс характеризуется очень высоким значением энергии активации, для понижения которой необходимо, как правило применение катализаторов. В зависимости от того, как осуществляется процесс окисления SO2 в SO3, различают два основных метода получения серной кислоты.
В контактном методе получения серной кислоты процесс окисления SO2 в SO3 проводят на твердых катализаторах.
Триоксид серы переводят в серную кислоту на последней стадии процесса – абсорбции триоксида серы, которую упрощенно можно представить уравнением реакции:
SO3 + h3Oà h3SO4
При проведение процесса по нитрозному (башенному) методу в качестве переносчика кислорода используют оксиды азота.
Окисление диоксида серы осуществляется в жидкой фазе и конечным продуктом является серная кислота:
SO2 + N2O3 + h3O à h3SO4 + 2NO
В настоящее время в промышленности в основном применяют контактный метод получения серной кислоты, позволяющий использовать аппараты с большей интенсивностью.
При подготовке данной работы были использованы материалы с сайта http://www.studentu.ru
www.neuch.ru
Департамент образования
Администрация Кировской области
Оричевское районное управление образование
Оричевская средняя общеобразовательная школа №2
Проект
«Хлеб химической промышленности»
Выполнили:
Бехтерев Константин
и Сандаков Александр
ученики 9 класса
Консультант проекта
Володина Т. В.
Учитель химии
первая категория
Оричи 2009
Оглавление.
№ п/п | Содержание | Страницы |
1 | Цель проекта. | 3 |
2 | Задачи проекта. | 3 |
3 | Срок реализации проекта. | 3 |
4 | Этапы реализации проекта. | 3 |
5 | Обоснование актуальности. | 4 |
6 | Подготовительный этап. | 5 |
7 | Информационные ресурсы. | 20 |
8 | Приложение №1 | 21 |
9 | Приложение №2. | 22 |
Цель проекта: изучить и исследовать свойства серной кислоты, узнать её значение в химической промышленности и жизни человека.
Задачи проекта:
-найти и проанализировать информационные ресурсы по теме: «Серная кислота».
-изучить строение, свойства и способы получение серной кислоты
-собрать информацию о её применении в химической промышленности
-составить презентацию.
Срок реализации проекта: сентябрь-март 2008-2009 учебного года.
Этап | Сроки | Результат |
Подготовительный | Сентябрь-декабрь2008года | Анализ информационныхресурсов |
Практический | Январь-апрель2009года | Исследование по теме,Написание проектаСоздание презентации. |
Контрольно-оценочный | Апрель-июнь2009года | Оценка проекта. |
Обоснование актуальности проекта.
Как известно издавна серную кислоту считали «матерью» всех кислот.
Серная кислота известна с древности. Первое упоминание о кислых газах, получаемых при прокаливании квасцов или железного купороса "зеленого камня", встречается в сочинениях, приписываемых арабскому алхимику Джабир ибн Хайяну.
Позже, в 9 веке персидский алхимик Ар-Рази, прокаливая смесь железного и медного купороса (FeSO4•7h3O и CuSO4•5h3O), также получил раствор серной кислоты. Этот способ усовершенствовал европейский алхимик Альберт Магнус, живший в 13 веке.
В 15 веке алхимики обнаружили, что серную кислоту можно получить, сжигая смесь серы и селитры, или из пирита - серного колчедана, более дешевого и распространенного сырья, чем сера. Таким способом получали серную кислоту на протяжении 300 лет, небольшими количествами в стеклянных ретортах. И только в середине 18 столетия, когда было установлено, что свинец не растворяется в серной кислоте, от стеклянных лабораторий перешли к большим свинцовым камерам.
В настоящее время серная кислота является «хлебом химической промышленности».
На уроках химии мы изучили тему: «Сера и её соединения», и решили узнать больше информации о производстве серной кислоты, её свойствах и применении.
Продуктом нашего проекта является компьютерная презентация созданная с учётом требований к презентациям, которые мы изучили в ходе работе над проектом.
На подготовительном этапе мы проанализировали информационные ресурсы по теме: «Серная кислота».
Серная кислота́ h3SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом.
Физические свойства:
Кислота серная - прозрачная, тяжелая, маслянистая жидкость с резким запахом. На воздухе медленно испаряется. Чистая серная кислота бесцветна, наличие примесей придает технической серной кислоте желтовато-бурый оттенок. Концентрацию серной кислоты определяют по содержанию в кислоте моногидрата или по плотности. С водой смешивается во всех отношениях, очень гигроскопична. Смешение серной кислоты с водой сопровождается высоким тепловым эффектом, выделением паров и газов.
Правила разбавления
Растворение серной кислоты в воде – физико-химическое явление, которое сопровождается выделением большого количества энергии (экзотермическая реакция. Каждому нужно знать правило:
Кислоту льём в воду, а не наоборот!!!
Иначе не избежать ожогов.
Правила обращения с кислотами
- Наливать кислоту осторожно, держа пробирку над ящиком.
- В случае попадания кислоты на кожу или слизистые оболочки, тщательно промыть под краном пораженное место.
- Нейтрализовать раствором соды.
Разрушающе действует на органические вещества, вызывает сильное раздражение глаз, вплоть до слепоты, разъедает кожу, вызывает ее изъязвление, ожоги, оказывает коррозионное действие на многие металлы. Серная кислота - негорючая пожароопасная жидкость. Разбавленная серная кислота растворяет металлы с выделением водорода, концентрированная вызывает самовоспламенение горючих веществ.
Химические свойства:
Серная кислота — довольно сильный окислитель.
I. Серная кислота в растворе обладает общими для класса кислот химическими свойствами.
1. Серная кислота ступенчато диссоциирует в растворе с образованием иона водорода.
h3SO4 = H++HSO4-
HSO4- = H++SO42-
серная кислота изменяет окраску индикаторов:
Лакмус - краснеет
Метиловый оранжевый - розовеет
2.Окислительно-востановительные реакции характерны для взаимодействия растворов серной кислоты с металлами.
Zn+h3SO4=ZnSO4+h3O
Zn+2H+=Zn2++h3
3.Реакции обмена разбавленной серной кислоты с основными и амфотерными оксидами:
MgO+h3SO4=MgSO4+h3OMgO+2H+=Mg2++h3O
4.Реакции с основаниями
h3SO4+2KOH=K2SO4+2h3O
2H++2OH=2h3O
5.Реакции с растворами солей:
h3SO4+Na2CO3=Na2SO4+CO2+ h3O
2H++ CO3-2= CO2+ h3O
Качественная реакция на серную кислоту и ее соли, с помощью которой можно распознать их среди других веществ, реакция с растворимыми солями бария:
h3SO4+BaCl2=BaSO4+2h3Cl
K2SO4+Ba(NO3)2= BaSO4+2KNO3
Суть процесса: выпадает белый осадок сульфата бария, не растворимый ни в воде, ни в кислотах:
Ba2++SO42+= BaSO4
Катион бария является реагентом на сульфат-ион.
II. Химические свойства концентрированной серной кислоты.
h3SO4+n h3O= h3SO4* n h3O+Q
C+2h3SO4=CO2+ 3SO2+2h3O
S+2h3SO4=3SO2+2h3O
h3SO4+2h3Br= Br2+SO2+2h3O
8 Na+5 h3SO4= 4Na2 SO4+ h3S+4h3O
Концентрированная серная кислота реагирует и с металлами, стоящими в ряду активности после водорода, с такими, как медь, серебро, ртуть. Реакции идут при нагревании.
Cu+2h3SO4= Cu SO4+SO2+2h3O
Производство серной кислоты
Исходное сырье
Традиционно основными источниками сырья являются сера и железный (серный) колчедан. Около половины серной кислоты в СССР получали из серы, треть – из колчедана. Значительное место в сырьевом балансе занимают отходящие газы цветной металлургии, содержащие диоксид серы.
В целях защиты окружающей среды во всем мире принимаются меры по использованию отходов промышленности, содержащих серу. В атмосферу с отходящими газами тепловых электростанций и металлургических заводов выбрасывается диоксида серы значительно больше, чем употребляется для производства серной кислоты. Из-за низкой концентрации SO2 в таких отходящих газах их переработка пока еще не всегда осуществима.
В то же время отходящие газы – наиболее дешевое сырье, низки оптовые цены и на колчедан, наиболее же дорогостоящим сырьем является сера. Следовательно, для того чтобы производство серной кислоты из серы было экономически целесообразно, должна быть разработана схема, в которой стоимость ее переработки будет существенно ниже стоимости переработки колчедана или отходящих газов.
В кратере вулкана Иджен на острове Ява, расположено большое горячее озеро серной кислоты, по берегам которого местные жители в нечеловеческих условиях добывают серу. В чаше из базальтовых серых стен расположено яблочно-зеленое озеро, над поверхностью которого тянутся сернистые шлейфы. Озеро находится на высоте 2 386 метров над уровнем моря. Глубина его не велика - 212 метров. По берегам вокруг черных отверстий, напоминающих раскрытые зевы чудовищ, отливают золотом валики серы. Такие же отверстия существуют в дне озера, поэтому его температура на поверхности составляет 60 градусов, а в глубине - свыше 200 градусов по Цельсию. Озеро хранит в своей чаше 40 миллионов тонн смеси концентрированных соляной и серной кислот. Но, самое удивительное, - в каждом литре этой смеси содержится ещё и 5 граммов растворенного алюминия. Ученые подсчитали, что всего в озере растворено свыше 200 тысяч тонн этого металла. "Дуновение" газов с высоким содержанием сероводорода, сернистого ангидрида и соляной кислоты не позволяет подолгу находиться в этом месте. Пары вызывают острые приступы кашля, если не одевать на лицо маску. Тем не менее, в кратере вулкана вручную добывается сера для промышленных нужд. Носильщики серы набивают по 70 - 80 кг сырья в специальные корзины, неся их в одну ходку. Дневная зарплата работника - около 5 долларов. Средняя продолжительность жизни индонезийского добытчика серы составляет 30 лет
В настоящее время серная кислота производится двумя способами: нитрозным, существующим более 200 лет, и контактным, освоенным в промышленности в конце ХIХ и начале ХХ века. Контактный способ вытесняет нитрозный (башенный). Первой стадией сернокислотного производства по любому методу является получение диоксида серы при сжигании сернистого сырья. После очистки диоксида серы (особенно в контактном методе) ее окисляют до триоксида серы, который соединяют с водой с получением серной кислоты. Окисление SO2 в SO3 в обычных условиях протекает крайне медленно. Для ускорения процесса применяют катализаторы.
В настоящее время контактным методом получают концентрированную серную кислоту, олеум и 100% серный ангидрид.
Одновременно с увеличением объема производства серной кислоты расширяется ассортимент продукции сернокислотных заводов, организуется выпуск особо чистой кислоты, 100% SO2, высококачественного олеума и кислоты, а также увеличивается производство новых продуктов на основе SO2. Кроме олеума, концентрированной серной кислоты и аккумуляторной кислоты, отечественные заводы выпускают также более чистую контактную кислоту улучшенного качества (для производства искусственного волокна, титановых белил и др.), чистый олеум, химически чистую и реактивную серную кислоту.
referat911.ru
Серную кислоту не случайно называют "хлебом" химической промышленности. Она используется в производстве других кислот, химических волокон, цветных металлов, при мойке шерсти. В основном кислоту применяют в выпуске фосфорных удобрений. Многоплановое ее применение обусловлено сильной химической активностью, дешевизной производства, удобствами использования - не дымит, не выделяет запаха, а в концентрированном виде не разрушает черные металлы.
Сырьем для производства серной кислоты могут быть различные серосодержащие вещества, но наибольшее практическое значение имеют колчедан, элементарная сера, сернистые газы цветной металлургии, сжигания угля, очистки нефти. Колчедан получают в основном как побочный продукт флотационного обогащения. Он имеет низкую себестоимость, хорошую транспортабельность, что делает его основным сырьем в сернокислотном производстве. Основу флотационного колчедана составляет пирит (FeS2), содержащий до 45% железа и серу. В нем имеются также сульфиды мышьяка, селена и др., которые образуют газообразные соединения, попадают в сернистые газы и ухудшают их качество. Поэтому сернистые газы требуют дополнительной очистки, что усложняет технологическую схему производства. Достаточно распространенное сырье - элементарная сера. Она наиболее концентрированный серосодержащий ресурс. В результате более эффективны дальние перевозки, снижается расход сырья на выпуск единицы продукции более чем в 2 раза по сравнению с колчеданом. Процесс производства кислоты проще, требует меньших удельных капвложений, экологичнее. Чистая сера имеет достаточную тепловую способность (10000 кдж/кг), что позволяет при получении сернистого газа использовать ее не только как сырье для кислоты, но и как источник энергии в теплоэнергоблоках для собственных производственных целей и поставки другим потребителям (рис.1).Однако запасы элементарной серы в природе ограничены, а

Сжигание серы
абсорбция SO3 и образование серной кислоты



Серная кислота
себестоимость ее добычи высокая. Это обусловливает повышенную стоимость конечного продукта по сравнению с кислотой, полученной из колчедана. Наиболее эффективное сырье для выпуска кислоты - сернистые газы цветной металлургии, очистки нефти, сероводород природного газа. Себестоимость тонны кислоты из них в 2,5 - 6 раз меньше, чем из элементарной серы и колчедана, сам процесс достаточно экологичен, а в окружающую среду в результате утилизации серы не попадают вредные соединения. Техногенные выбросы серы в атмосферу вдвое превышают ее мировую добычу в качестве сырья для промышленности.
Значительные запасы серы в сульфатах - гипсе, ангидриде. Однако эти виды сырья менее эффективны из-за больших энергетических затрат в производстве.
Исходным этапом производства серной кислоты является получение сернистого ангидрида (SO2). Для этого колчедан дробят, обжигают в многоподовых печаx, в кипящем слое, как и в металлургическом процессе. При этом газы составляют основной продукт, а оксиды железа - побочный. Образуется так называемый огарок - твердые отходы, содержащие окислы железа, как и в богатых железных рудах, а также незначительную часть невыгоревшей серы (до 2%) и минеральные примеси. Каждый кубический метр сернистых газов содержит до 300 г пыли, а также мышьяк, селен, теллур, фтор и другие вещества, которые загрязняют кислоту, снижают активность катализатора. Поэтому газы обжига колчедана очищают (рис. 2). При использовании высококачественного сырья с практическим отсутствием примесей - элементарной серы, сероводорода - сжигание проводится через форсунки в более простых печах. В этом случае не образуется огарок, а сернистые газы без предварительной очистки применяются в выпуске кислоты, что упрощает технологический процесс, повышает его экологичность (рис.1,3). В производстве кислоты из газов цветной металлургии отсутствует стадия обжига, а сернистые газы в производстве используются после предварительной очистки. Это уменьшает удельные капитальные вложения при создании сернокислотных предприятий.
Основная сложность сернокислотного производства - получение из сернистого ангидрида серного (S03), так как взаимодействие сернистых газов с кислородом в обычных условиях осуществляется медленно и для промышленных процессов не приемлемо. В зависимости от метода ускорения отмеченной химической реакции существуют способы получения кислоты: контактный и нитрозный. При нитрозном способе в качестве ускорителя реакции применяют двуокись азота, которая отдает кислород сернистым газам и превращается в окись азота. Последняя вновь окисляется кислородом воздуха до двуокиси и взаимодействует с сернистыми газами. Серный ангидрид соединяется с водой и образует 75% кислоту, которую упаривают до товарного продукта, содержащего 98,5% кислоты. Этот процесс проводят в специальных металлических
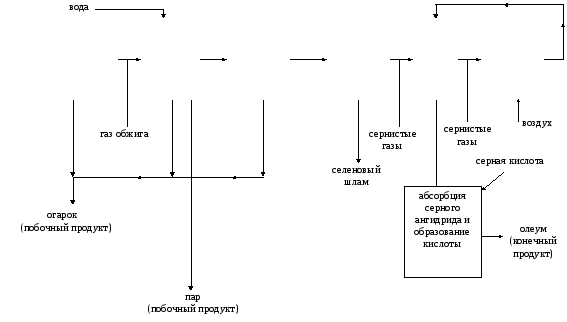
Обжиг колчедана
Охлаждение газа
Очистка газа от пыли
Промывка и сушка газа
подогрев газа
Окисление сернистого ангидрида в серный на катализаторе


колчедан
воздух
сернистый ангидрид
РИС. 2. Принципиальная схема производства серной кислоты
башнях, футерованных кислотоустойчивым кирпичом. Поэтому нитрозный способ называют еще башенным.
Контактный способ основан на окислении сернистых газов воздухом, кислородом в присутствии ванадиевого катализатора в контактных аппаратах. Серный ангидрид направляют в абсорбционные башни, куда подается концентрированная серная кислота. Она поглощает серные газы и образуется 100% серная кислота, в которой избыточно растворим ангидрид (Н2S04 • nSО3). Этот продукт называют олеумом. Рассмотренный способ прогрессивнее по сравнению с нитрозным. При контактном получении кислоты - скорость окисления выше, особенно при использовании кислорода, что повышает единичную производительность оборудования, лучше качество конечного продукта, а производство - экологичнее (меньше выбросов окислов азота). В технологическом процессе практически не расходуют топливо. Поэтому подавляющую часть серной кислоты вырабатывают контактным методом.
Размещение сернистого производства обусловлено особенностями сырьевых ресурсов и имеет в зависимости от этого ориентацию на сырье или центры потребления. При использовании сернистых газов промышленности предприятия ориентированы на центры переработки нефти, цветной металлургии как комбинированные производства на основе утилизации отходов и имеют сырьевую ориентацию (Новополоцк). Здесь могут создаваться также предприятия-потребители серной кислоты, выпускающие фосфорные удобрения (Ревда - Россия, Алаверди - Армения и др.). Получение кислоты из колчедана, элементарной серы имеет территориальную ориентацию на пункты потребления как нематериалоемкое производство (Гомель). На 1 т 100% серной кислоты расходуют около 800 кг колчедана или 350 кг элементарной серы, 0,1 кг контактной массы, 100 кВт•ч электрической энергии и 50 куб.м воды. Такое влияние потребителя на размещение предприятий усиливается также худшей транспортабельностью готовой продукции по сравнению с сырьем. Перевозка кислоты требует специальных транспортных средств, упаковки, соблюдения более сложных условий безопасности.
studfiles.net