|
to кип. (oС)
444,674Степ.окис.
-2 +4 +632,066
to плав.(oС)
119,3Плотность
2070(a) 1960(b)
3s23p4
ОЭО
2,60в зем. коре
0,052 %
Сера — одно из немногих веществ, которыми уженесколько тысяч дет назад оперировали первые «химики». Она стала служитьчеловечеству задолго до того, как заняла в таблице Менделеева клетку под №16.
Об одном из самых древних (хотя игипотетических!) применении серы рассказывают многие старинные книги. Какисточник тепла при термообработке грешников серу живописуют и Новый и Ветхийзаветы. И если книги такого рода не дают достаточных основании дляархеологических раскопок в поисках остатков райских кущ или геенны огненной, тоих свидетельство о том, что древние были знакомы с серой и некоторыми ее свойствами,можно принять на веру.
Одна из причин этой известности —распространенность самородной серы в странах древнейших цивилизаций,Месторождения этого желтого горючего вещества разрабатывались греками иримлянами, особенно в Сицилии, которая вплоть до конца прошлого века славиласьв основном серой.
С древнейших времен серу использовали длярелигиозно-мистических целей, ее зажигали при различных церемониях и ритуалах.Но так же давно элемент № 16 приобрел и вполне мирские назначения: серойчернили оружие, ее употребляли при изготовлении- косметических и лекарственныхмазей, ее жгли для отбелки тканей и для борьбы с насекомыми. Добыча серызначительно увеличилась после того, как был изобретён черный порох. Ведь сера(вместе с углем и селитрой)—непременный его компонент.
И сейчас пороховое производство потребляет частьдобываемой серы, правда весьма незначительную. В наше время сера — один изважнейших видов сырья для многих химических производств. И в этом причинанепрерывного роста мирового производства серы.
Происхождение серы
Большие скопления самородной серы встречаются нетак уж часто. Чаще она присутствует в некоторых рудах. Руда самородной серы —это порода с вкраплениями чистой серы.
Когда образовались эти вкрапления — одновременнос сопутствующими породами или позже? От ответа на этот вопрос зависитнаправление поисковых и разведочных работ. Но, несмотря на тысячелетия общенияс серой, человечество до сих пор не имеет однозначного ответа. Существуетнесколько теорий, авторы которых придерживаются противоположных взглядов.
Теория сингенеза (т. е. одновременногообразования серы и вмещающих пород) предполагает, что образование самороднойсеры происходило в мелководных бассейнах. Особые бактерии восстанавливалисульфаты, растворенные в воде, до сероводорода, который поднимался вверх,попадал в окислительную зону и здесь химическим путем или при участии другихбактерий окислялся до элементарной серы. Сера осаждалась на дно, и впоследствиисодержащий серу ил образовал руду.
Теория эпигенеза (вкрапления серы образовалисьпозднее, чем основные породы) имеет несколько вариантов. Самый распространенныйиз них предполагает, что подземные воды, проникая сквозь толщи пород,обогащаются сульфатами. Если такие воды соприкасаются с месторождениями нефтиили природного газа, то ионы сульфатов восстанавливаются углеводородами досероводорода. Сероводород поднимается к поверхности и, окисляясь, выделяетчистую серу в пустотах и трещинах пород.
В последние десятилетия находит все новыеподтверждения одна из разновидностей теории эпигенеза — теория метасоматоза (впереводе с греческого «метасоматоз» означает замещение). Согласно ей в недрахпостоянно происходит превращение гипса CaSO4-h3O и ангидрита CaSО4 в серу икальцит СаСО3. Эта теория создана в 1935 году советскими учеными Л. М.Миропольским и Б. П. Кротовым. В ее пользу говорит, в частности, такой факт.
В 1961 году в Ираке было открыто месторождениеМишрак. Сера здесь заключена в карбонатных породах, которые образуют свод,поддерживаемый уходящими вглубь опорами (в геологии их называют крыльями).Крылья эти состоят в основном из ангидрита и гипса. Такая же картинанаблюдалась на отечественном месторождении Шор-Су.
Геологическое своеобразие этих месторожденийможно объяснить только с позиций теории метасоматоза: первичные гипсы иангидриты превратились во вторичные карбонатные руды с вкраплениями самороднойсеры. Важно не только соседство минералов — среднее содержание серы в руде этихместорождений равно содержанию химически связанной серы в ангидрите. Аисследования изотопного состава серы и углерода в руде этих месторождений далисторонникам теории метасоматоза дополнительные аргументы.
Но есть одно «но»: химизм процесса превращениягипса в серу и кальцит пока не ясен, и потому нет оснований считать теориюметасоматоза единственно правильной. На земле и сейчас существуют озера (вчастности, Серное озеро близ Серноводска), где происходит сингенетическоеотложение серы и сероносный ил не содержит пи гипса, ни ангидрита.
Все это означает, что разнообразие теорий игипотез о происхождении самородной серы — результат не только и не стольконеполноты наших знаний, сколько сложности явлений, происходящих в недрах. Ещеиз элементарной школьной математики все мы знаем, что к одному результату могутпривести разные пути. Этот закон распространяется и на геохимию.
Добыча серы
Серные руды добывают разными способами—взависимости от условий залегания. Но в любом случае приходится уделять многовнимания технике безопасности. Залежам серы почти всегда сопутствуют скопленияядовитых газов — соединений серы. К тому же нельзя забывать о возможности еесамовозгорания.
Добыча руды открытым способом происходит так.Шагающие экскаваторы снимают пласты пород, под которыми залегает руда. Взрывамирудный пласт дробят, после чего глыбы руды отправляют на обогатительнуюфабрику, а оттуда—на сероплавильный завод, где из концентрата извлекают серу.Методы извлечения—различны. О некоторых из них будет рассказано ниже. А здесьуместно кратко описать скважинный метод добычи серы из-под земли, позволивший СоединеннымШтатам Америки и Мексике стать крупнейшими поставщиками серы.
В конце прошлого века на юге Соединенных Штатовбыли открыты богатейшие месторождения серной руды. Но подступиться к пластамбыло непросто: в шахты (а именно шахтным способом предполагалось разрабатыватьместорождение) просачивался сероводород и преграждал доступ к сере. Кроме того,пробиться к сероносным пластам мешали песчаные плывуны. Выход нашел химикГерман Фраш, предложивший плавить серу под" землей и через скважины,подобные нефтяным, выкачивать ее на поверхность. Сравнительно невысокая (меньше120° С) температура плавления серы подтверждала реальность идеи Фраша. В 1890году начались испытания, приведшие к успеху.
В принципе установка Фраша очень несложна: трубав трубе. В пространство между трубами подается перегретая вода и по нему идет впласт. А по внутренней, обогреваемой со всех сторон, трубе поднимаетсярасплавленная сера. Современный вариант установки Фраша дополнен третьей —самой узкой трубой. Через нее в скважину подается сжатый воздух, которыйпомогает поднять расплавленную серу на поверхность. Одно из основных достоинствметода Фраша — в том, что он позволяет уже на первой стадии добычи получитьсравнительно чистую серу. При разработке богатых руд этот метод весьма эффективен.
Раньше считалось, что метод подземной выплавкисеры применим только в специфических условиях «соляных куполов» тихоокеанскогопобережья США и Мексики. Однако опыты, проведенные в Польше и СССР, опроверглиэто мнение. В народной Польше этим методом уже добывают большое количествосеры; в 1968. году пущены первые серные скважины и в СССР.
А руду, полученную в карьерах и шахтах,приходится перерабатывать (часто с предварительным обогащением), используя дляэтого различные технологические приемы.
Известно несколько методов получения серы изсерных руд: пароводяные, фильтрационные, термические, центрифугальные иэкстракционные.
Термические методы извлечения серы — самыестарью. Еще в XVIII веке в Неаполитанском королевстве выплавляли серу в кучах—«сольфатарах». До сих пор в Италии выплавляют серу в примитивных печах —«калькаронах». Тепло, необходимое для выплавления серы из руды, получают,сжигая часть добытой серы. Процесс этот малоэффективен, потери достигают 45%.
Италия стала родиной и пароводяных методовизвлечения серы из руд. В 1859 году Джузеппе Джилль получил патент на свойаппарат — предшественник нынешних автоклавов. Автоклавный метод (значительноусовершенствованный, конечно) используется и сейчас во многих странах.
В автоклавном процессе обогащенный концентратсерной руды, содержающий до 80% серы, в виде жидкой пульпы с реагентамиподается насосами в автоклав. Туда же под давлением подается водяной пар.Пульпа нагревается до 130° С. Сера, содержащаяся в концентрате, плавится иотделяется от породы. После недолгого отстоя выплавленная сера сливается. Затемиз автоклава выпускаются «хвосты»—взвесь пустой породы в воде? Хвосты содержатдовольно много серы и вновь поступают на обогатительную фабрику.
В России автоклавный способ был впервые примененинженером К. Г. Паткановым в 1896 году.
Современные автоклавы — это огромные аппаратывысотой с четырехэтажный дом. Такие автоклавы установлены, в частности, насероплавильном заводе Роздольского горнохимического комбината в Прикарпатье.
На некоторых производствах, например на крупномсерном комбинате в Тарнобжеге (Польша), пустую породу отделяют от расплавленнойсеры на специальных фильтрах. Метод разделения на специальных центрифугахразработан недавно в нашей стране. Словом, «руду золотую (точнее — золотистую)отделять от породы пустой» можно по-разному.
По-разному и удовлетворяют свои потребности всере разные страны. Мексика и США используют в основном метод Фраша. Италия,занимающая по добыче серы третье место среди капиталистических государств, продолжаетдобывать и перерабатывать (разными методами) серные руды сицилийскихместорождений и провинции Марко. У Японии есть значительные запасы серывулканического происхождения. Франция и Канада, не имеющие самородной серы,развили крупное производство, ее из газов. Нет собственных серных месторожденийи в Англии и Германии. Свои потребности в серной кислоте они покрывают за счётпереработки серусодержащего сырья (преимущественно пирита), а элементарную серуимпортируют.
Россия полностью удовлетворяют свои потребностиблагодаря собственным источникам сырья. После открытия и освоения богатыхПрикарпатских месторождений СССР и Польша значительно увеличили производствосеры. Эта отрасль промышленности продолжает развиваться. Были построены новыекрупные предприятия на Украине, реконструированы старые комбинаты на Волге и вТуркмении, расширено производство серы из природного газа и отходящих газов.
Кристаллы в макромолекулы
В том, что сера—самостоятельный химическийэлемент, а не соединение, первым убедился великий французский химик АнтуанЛоран Лавуазье в XVIII веке.
С тех пор представления о сере как элементеизменились не очень сильно но значительно углубились и дополнились.
Сейчас известно, что элемент № 16 состоит изсмеси четырех устойчивых изотопов с массовыми числами 32, 33, 34 и 36. Этотипичный неметалл.
Лимонно-желтые кристаллы чистой серыполупрозрачны. Форма кристаллов не всегда одинакова. Чаще всего встречаетсяромбическая сера (наиболее устойчивая модификация) — кристаллы имеют видоктаэдров со срезанными углами. В эту модификацию при комнатной (или близкой ккомнатной) температуре превращаются все прочие модификации. Известно, например,что при кристаллизации из раплава (температура плавления серы 119,5° С) сначалаполучаются игольчатые кристаллы (моноклинная форма). Но эта модификациянеустойчива, и при температуре ниже 95,6° С она переходит в ромбическую.Подобный процесс происходит и с другими модификациями серы.
Напомним известный опыт — получение пластическойсеры.
Если расплавленную серу вылить в холодную воду,образуется эластичная, во многом похожая на резину масса. Ее можно получить и ввиде нитей. Но проходит несколько дней, и масса перекристаллизуется, становитсяжесткой и ломкой.
Молекулы кристаллов серы всегда состоят из восьмиатомов (S8), а различие в свойствах модификаций серы объясняется полиморфизмом— неодинаковым строением кристаллов. Атомы в молекуле серы построены взамкнутый цикл
S-S-S
/ \
S S
\ /
S-S-S
При плавлении связи в цикле рвутся, и циклическиемолекулы превращаются в линейные.
Необычному поведению серь при плавлении даютсяразличные толкования. Одно из них — такое. При температуре от 155 до 187°,по-видимому, происходит значительный рост молекулярного веса, этоподтверждается многократным увеличением вязкости. При 187° С вязкость расплавадостигает чуть ли ни тысячи пуаз, получается почти твердое вещество. Дальнейшийрост температуры приводит к уменьшению вязкости (молекулярный вес падает). При300° С сера вновь переходит в текучее состояние, а при 444,6° С закипает.
У паров серы с повышением температуры числоатомов в молекуле постепенно уменьшается:
S8 —> S6—> S4 —><sup/>S2. При1700°С пары серы одноатомны.
Коротко о соединениях серы
По распространенности элемент, № 16 занимает-15-е место. Содержание серы в земной коре составляет 0,05% по весу. Этонемало.
К тому же сера химически активна и вступает' вреакции с большинством элементов. Поэтому в природе сера встречается не тольков свободном состоянии, но и в виде разнообразных неорганических соединений.Особенно распространены сульфаты, (главным образом щелочных и щелочноземельных,металлов) и сульфиды (железа, меди, цинка, свинца). Сера есть и в углях,сланцах, нефти, природных газах, в организмах животных и растений.
При взаимодействии серы с металлами, как правило,выделяется довольно много тепла. В реакциях с кислородом сера дает несколькоокислов, из них самые важные SО2 и SО3 — ангидриды сернистой Н2SО3 и сернойН2SО4 кислот. Соединение серы с водородом — сероводород Н2S — очень ядовитый,зловонный газ, всегда присутствующий в местах гниения органических остатков.Земная
кора в местах, расположенных близ месторожденийсеры, часто содержит довольно значительные количества сероводорода. В водномрастворе этот газ обладает кислотными свойствами. Хранить его растворы навоздухе нельзя, он окисляется с выделением серы:
2h3S + О2=2Н2О + 2S.
Сероводород — сильный восстановитель. Этим егосвойством пользуются во многих химических производствах.
Для чего нужна сера
Среди вещей, окружающих нас, мало таких, дляизготовления которых не нужны были бы сера и ее соединения. Бумага и резина,эбонит и спички, ткани и лекарства, косметика и пластмассы, взрывчатка икраска, удобрения и ядохимикаты — вот далеко не полный перечень вещей ивеществ, для производства которых нужен элемент № 16. Для того чтобыизготовить, например, автомобиль, нужно израсходовать около 14 кг серы. Можнобез преувеличения сказать, что промышленный потенциал страны довольно точноопределяется потреблением серы.
Значительную часть мировой добычи серы поглощаетбумажная промышленность (соединения серы помогают выделить целлюлозу). Для тогочтобы произвести одну тонну целлюлозы, нужно затратить более 100 кг серы. Многоэлементарной серы потребляет и резиновая промышленность — для вулканизациикаучуков.
В сельском хозяйстве сера применяется как вэлементарном виде, так и в различных соединениях. Она входит в составминеральных удобрений и препаратов для борьбы с вредителями. Наряду с фосфором,калием и другими элементами сера необходима растениям. Впрочем, большая частьвносимой в почву серы не усваивается ими, но помогает усваивать фосфор. Серувводят в почву вместе с фосфоритной мукой. Имеющиеся в почве бактерии окисляютее, образующиеся серная и сернистая кислоты реагируют с фосфоритами, и врезультате получаются фосфорные соединения, хорошо усваиваемые растениями.
Однако основной потребитель серы — химическаяпромышленность. Примерно половина добываемой в мире серы идет на производствосерной кислоты. Чтобы получить одну тонну h3SО4, нужно сжечь около 300 кг серы.А роль серной кислоты: в химической промышленности сравнима с ролью хлеба внашем питании.
Значительное количество серы (и серной кислоты)расходуется при производстве взрывчатых веществ и спичек. Чистая» освобожденнаяот примесей сера нужна для производства красителей и светящихся составов.
Соединения серы находят применение внефтехимической промышленности. В частности, они необходимы при. -производствеантидетонаторов, смазочных веществ для аппаратуры сверхвысоких давлений; вохлаждающих маслах, ускоряющих обработку.металла, содержится иногда до 18%серы.
Перечисление примеров, подтверждающихпервостепенную важность элемента № 16, можно было бы продолжить, но «нельзяобъять необъятное». Поэтому вскользь упомянем, что сера необходима и такимотраслям промышленности, как горнодобывающая, пищевая, текстильная, и —поставим точку.
* * *
Наш век считается веком «экзотических» материалов— трансурановых элементов, титана, полупроводников, и так далее. Но внешненепритязательный, давно известный элемент № 16 продолжает оставаться абсолютнонеобходимым. Подсчитано, что в производстве 88 из 150 важнейших химическихпродуктов используют либо саму серу, либо ее соединения.
Реферат по химии
Тема: «Сера»
Ученицы 9 «ч» класса
Средней школы № 27
Зима Анны
Бишкек 2001г.
www.ronl.ru
1. Историческая справка.
2. Физические свойства.
3. Химические свойства.
4. Добыча серных руд и получение серы.
5. Применение серы.
Сера S – химический элемент VI группы переодической системы Мендеева, атомный номер 16, атомная масса 32,064. Твёрдое хрупкое вещество жёлтого цвета.
Историческая справка.
Сера в самородном состоянии, а также в виде соединений, например сульфидов, известна с древнейших времен. Жрецы использовали ее в составе «священных курений» при некоторых религиозных обрядах. Разные горючие смеси для военных целей также содержали серу. Еще у Гомера упоминаются «сернистые испарения» и смертельное действие продуктов горения серы. Она входила в состав «греческого огня», наводившего ужас на противников.
В 941 г. под стенами Царьграда был уничтожен флот киевского князя Игоря. В летописном своде событий «Повесть временных лет», составленном в Киеве, так описан поход Игоря: «Словно молнию... которая на небе, греки имеют у себя и пускали ее, сжигая нас, поэтому мы и не одолели их». Дружинники князя защищались от «греческого огня» щитами, воловьими шкурами, но потерпели поражение. Греки выбрасывали горящую смесь через медные трубы, установленные на бортах византийских кораблей. Состав этой смеси был неизвестен. Греки держали его в секрете. Предполагают, что в нее входили нефть, различные горючие масла, смола, селитра, клен, сера и вещества, которые окрашивали пламя.
Горючесть серы, легкость, с которой она соединяется с металлами, объясняют причину, почему ее считали «принципом горючести» и обязательной составной частью металлических руд. Наивное верование алхимиков о сере выражено в небольшом стихотворении Н. А. Михайловым:
Семь металлов создал свет. Медь, железо, серебро,
По числу семи планет: Злато, олово, свинец...
Дал нам Космос на добро Сын мой! сера им отец!..
В VIII—IX вв. в сочинениях арабских алхимиков рассматривается ртутно-серная теория состава металлов, согласно которой происхождение всех металлов объяснялось сочетанием серы и ртути. Эти воззрения сохранялись в Европе вплоть до XVIII в. Рождение металлов в средние века, конечно, мыслилось при благословении католической церкви, как это и изображено в иллюстрации к книге «Семь ключей мудрости», приписываемой алхимику Базилю Валентину.
Элементарную природу серы установил француз Антуан Лоран Лавуазье (по образованию юрист, а по призванию химик) в своих опытах по сжиганию.
Древнерусское название «сера» употребляется очень давно. По-видимому, оно происходит от санскритского слова «сира», что означает светло-желтый. Но есть и другое древнерусское название серы — «жупел» (сера горючая).
Сера—это порошок желтого цвета. Для нее характерно несколько модификаций, отличающихся друг от друга строением молекул и некоторыми свойствами. Так, ромбическая и моноклиническая сера всегда состоит из восьмиатомных кольцевидных молекул S8.
|
|
Третья модификация серы пластическая. Она состоит из нерегулярно расположенных зигзагообразных цепочек Sn, где п достигает нескольких тысяч. Другие модификации серы построены из молекул S2 (пурпурная) и S6 (оранжево-желтая).
Сколько бы аллотропных видоизменений ни образовывал химический элемент, при определенных заданных условиях абсолютно устойчивым из них, как правило, оказывается лишь какое-то одно. Для серы самой устойчивой аллотропной модификацией при обычных условиях при нормальном давлении и температуре не выше 95,6°С является ромбическая сера. В нее при комнатной температуре (или близкой к комнатной) превращаются все другие формы. Например, при кристаллизации из расплава серы сначала получаются игольчатые кристаллы моноклинической формы, которые при температуре ниже 95,6°С переходят в ромбические. При температуре выше 95,6°С устойчива моноклиническая сера.
Подобные превращения происходят и с другими модификациями серы. Так, если расплавленную серу вылить в холодную воду, образуется эластичная, во многом похожая на резину коричневая масса. Переход из одной аллотропной формы в другую сопровождается поглощением теплоты:
S D S — Q кдж
кристал- пласти-
лическая ческая
Такую пластическую серу можно получить в условиях школьной лаборатории. Она неустойчива и через некоторое время станет хрупкой, приобретет желтый цвет, т. е. постепенно будет превращаться в ромбическую.
Физические свойства.
Плавление серы происходит в интервале температур 112—119,3°С (в зависимости от чистоты образца). При этом с увеличением температуры до 155°С вязкость расплава уменьшается и возрастает в тысячи раз в интервале температур 155—187°С. Затем снова наступает спад. На рисунке 10 показано, как изменяется вязкость расплава серы при нагревании. Имеется несколько объяснений этого явления. Одно из них таково, С возрастанием температуры от 155 до 187°С, вероятно, происходит значительный рост молекулярной массы. Кольцевые молекулы Ss разрушаются и образуются другие — в виде длинных цепей из нескольких тысяч атомов. Вязкость расплава увеличивается. При 187°С она достигает величины свыше 90 н • сек/м2, т. е. почти как у твердого вещества. Дальнейшее повышение температуры ведет к разрыву цепей, и жидкость снова становится подвижной, вязкость
расплава уменьшается. При 300°С сера переходит в текучее состояние, а при 444,6°С закипает. В зависимости от температуры в ее парах обнаруживают молекулы S8, S6, S4, S2. При 1760°С пары серы одноатомны. Таким образом, с увеличением температуры число атомов в молекуле постепенно уменьшается:
S8 " S6 " S4 " S2 " S
Изменение состава молекул вызывает изменение окраски паров серы от оранжево-желтого до соломенно-желтого.
Сера в обычных условиях имеют различный цвет (см. выше). Окраска этих веществ обусловлена способностью поглощать какую-то часть спектра белого света. В результате этого они окрашены в какой-нибудь дополнительный (к цвету поглощения лучей) цвет. Дополнительными, или взаимокомпенсирующими, до белого цвета являются следующие пары цветовых сочетаний: красный — голубой, желтый — синий, зеленый — пурпурный и т. д. «Вычитание» какого-либо цвета из белого дает дополнительную окраску вещества. Так, ромбическая сера поглощает синий цвет, поэтому она окрашена в желтый, кристаллический моноклинный селен красного цвета, так как поглощает голубой.
Сера совершенно не проводит тока и при трении заряжается отрицательным электричеством, поэтому из нее делают круги электрических машин, в которых электрический заряд возбуждается посредством трения. Очень плохо проводит сера и тепло. Если в ней содержится менее 0,1% примесей, то при согревании куска серы в руке слышится своеобразный треск, и случается, что кусок распадается на части. Это происходит из-за напряжений, возникающих в куске вследствие его неравномерного расширения в связи с малой теплопроводностью серы.
Химические свойства.
Сера в обычных условиях с водородом не соединяется. Лишь при нагревании происходит обратимая реакция:
Н2 + S D h3S + 20,92 кдж/моль
Равновесие ее при 350°С смещено вправо, а при более высокой температуре - влево.
Все элементы VI группы взаимодействуют с галогенами. Известны галогениды серы, селена и теллура и других элементов группы. Например, хлорид или бромид серы получают при нагревании серы с галогенами в запаянной трубке:
2S + Br2 = 83 Br2
2S+Cl2 = S2Cl2
Хлорид серы S2Cl2 является хорошим растворителем многих химических соединений серы. В частности, в химической промышленности его используют в качестве растворителя серы при вулканизации каучука.
Сера с водой и разбавленными кислотами не взаимодействуют, в то время как теллур окисляется водой при температуре 100—160°С:
Те + 2Н2О==ТеO2 + 2Н2 #
Со щелочами сера взаимодействуют с образованием сульфидов и сульфитов (реакция обратимая):
3S + 6КОН D 2К2S + К2SО4 + Зh3O
Сера, так же как и кислород, взаимодействует со всеми металлами, кроме золота, платины, иридия, с образованием сульфидов. Эти реакции идут обычно при нагревании, но с некоторыми металлами и без нагревания. Так, со ртутью сера вступает в реакцию в обычных условиях при простом соприкосновении веществ. Если в лаборатории разлили ртуть (возникла опасность отравления парами ртути), ее сначала собирают, а те участки, где ртутные капли нельзя извлечь, засыпают порошкообразной серой. Происходит реакция с образованием безвредного сульфида ртути (II), или киновари:
Hg+S=HgS
В школьных условиях можно легко получить сульфиды некоторых металлов, например CuzS. Для этого в пробирку, закрепленную в штативе, вносят немного серы и нагревают ее до кипения. Затем щипцами вводят в пары серы предварительно подогретую полоску медной фольги. Медь энергично взаимодействует с серой: 2 Сu + S = Cu2S
|
|
В древности и в средние века серу добывали примитивным способом. В землю вкапывали большой глиняный горшок, на который ставили другой, но с отверстием в дне. Последний заполняли породой, содержа
щей серу, и затем нагревали. Сера плавилась и стекала в нижний горшок.
В настоящее время руды добывают разными способами, в зависимости от условий их залегания. Но в любом случае большое внимание уделяется технике безопасности. Ведь часто залежам серных руд сопутствуют скопления ядовитого газа — сероводорода. Да и сама сера может самовозгораться. При открытом способе добычи серы шагающий экскаватор снимает пласты пород, под которыми залегает руда. Рудные пласты дробят взрывами и далее глыбы руды отправляют на
сероплавильиый завод, где из них извлекают серу. Если сера залегает глубоко и в значительном количестве, то ее получают по методу Фраша. В этом случае серу расплавляют под землей и через скважину, подобно нефти, выкачивают на поверхность, т. е. этот способ основан на легкоплавкости серы и ее сравнительно небольшой плотности.
Установка Фраша доволь проста: труба в трубе. В пространство между трубами подается перегретая вода и по нему идет в пласт, а по внутренней трубе, обогреваемой со всех сторон, поднимается
|
|
Руда, полученная из шахт, карьеров, обычно перерабатывается с предварительным обогащением. Известно несколько методов извлечения серы из руд: пароводяные, фильтрационные, термические, центрифугальные и экстракционные.
Термические методы извлечения серы из руд наиболее старые. Еще в XVIII в. в Неаполитанском королевстве серу выплавляли в кучах—«сольфаторах». До сих пор в Итални выплавляют серу в примитивных печах-калькаронах. Калькарона—одна из самых старых сероплавильных печей. Это открытая сверху камера цилиндрической формы. Обычно калькароны располагали на уступах скал или углубляли в землю. Куски руды в такие печи укладывали определенным образом:
внизу—большие, сверху—маленькие. При этом обязательно оставляли вертикальные ходы для тяги. Этот процесс малоэффективен: 45% потерь, так как часть серы сжигают для получения теплоты, необходимой при выплавке серы из руды.
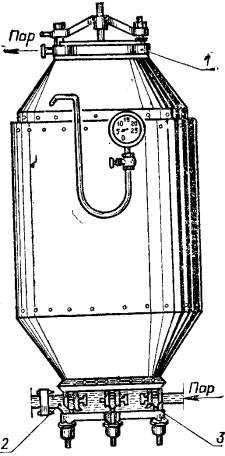
Италия стала родиной и второго метода извлечения серы из руд—пароводяного, предшественника автоклавного. В этом процессе серная руда, содержащая до 80% серы, поступает в автоклав. Туда же под давлением подают водяной пар. Пульпу нагревают до 130°С. Сера, содержащаяся в концентрате, плавится и отделяется от породы. После недолгого отстоя серу сливают и только потом из автоклава выпускают взвесь пустой породы в воде — «хвосты». Последние содержат довольно много серы и вновь поступают на обогатительную фабрику. Современные автоклавы—это огромные аппараты высотой с четырехэтажный дом. Такие автоклавы установлены у нас в Прикарпатье, в частности на сероплавильном заводе Раздольского горнохимического комбината.
Иногда пустую породу отделяют от расплавленной серы на специальных фильтрах. В нашей стране используют метод разделения на центрифугах.
Однако сера, полученная выплавкой из руды (комовая сера), обычно содержит еще много примесей. Дальнейшую очистку ее производят перегонкой в рафинированных печах, где сера нагревается до кипения. Пары серы поступают в выложенную кирпичом камеру. Вначале, пока камера холодная, сера переходит в твердое состояние и осаждается на стенках в виде светло-желтого порошка (серный цвет). Когда камера нагреется выше 120°С, пары конденсируются в жидкость, которую выпускают из камеры в формы, где она и застывает в виде палочек. Полученная таким образом сера называется черенковой.
Способы получения серы в разных странах неодинаковы. Так, в США и Мексике применяют в основном метод Фраша. В Италии (она занимает третье место по добыче серы среди капиталистических государств) используют разные методы переработки серных сицилийских руд и руд из Марокко. Япония имеет значительные запасы серы вулканического происхождения. Франция и Канада, не имеющие самородной серы, развили ее крупное производство из газов. В Англии и ФРГ перерабатывают сырье, содержащее серу (FeS2), а элементарную серу покупают, так как в этих странах нет собственных серных месторождений.
|
Обычно в сере, которую получают из руд, остается после ее очистки 0,6% примесей, а в сере, полученной из газов,— только 0,2%. При этом газовая сера значительно дешевле.
В настояще время в Узбекистане пущена первая очередь Мубарекского газоперерабатываюшего завода— одного из крупнейших предприятий отечественной газовой химической промышленности. Около поселка Мубарек Кашкадарьинской области было обнаружено мощное месторождение природного газа, содержащего 6% сероводорода. Серу стали получать из сероводорода при нагревании его в присутствии катализаторов. Ежедневно новое предприятие будет перерабатывать 4,7 млрд. м3 природного газа и выпускать 220 тыс. т чистой серы. Получая серу этим способом, попутно очищают большие количества природного газа от примесей.
ПРИМЕНЕНИЕ СЕРЫОсновным потребителем серы является химическая промышленность. Примерно половина добываемой в мире серы идет на производство серной кислоты, роль которой в химической промышленности велика. Чтобы получить 1 т серной кислоты, нужно сжечь 300 кг серы.
Большое количество серы расходуется на производство черного пороха, сероуглерода, различных красителей, светящихся составов и бенгальских огней.
| |
В резиновой промышленности сера применяется для превращения каучука в резину. Свои ценные свойства (упругость, эластичность и др.) каучук приобретает после смешивания его с серой и нагревания до определенной температуры. Такой процесс носит название вулканизации. Последняя может быть горячей и холодной. В первом случае
каучук нагревают с серой до 130—160°С. Этот способ был предложен в 1839 г. Ч. Гудиром. Во втором случае процесс ведут без нагревания, обрабатывая каучук хлоридом серы S2C12. Холодная вулканизация была предложена в 1J846 г. А. Парксом. Сущность вулканизации заключается в образовании новых связей между полимерными группами. При этом мостики могут содержать 1, 2, 3 и т. д. атомов серы:
Состав, распределение и энергия связей —С—Sn—С—
определяют многие важнейшие физико-механические свойства вулканизированных материалов. Если к каучуку присоединяется 0,5—5% серы, то образуется мягкая резина (автомобильные покрышки, камеры, мячи, трубки и т. д.). Присоединение к каучуку 30—50% серы приводит к образованию жесткого неэластичного материала—эбонита. Он представляет собой твердое вещество и является хорошим электрическим изолятором.
В сельском хозяйстве сера применяется как в элементарном виде, так и в виде соединений. Установлено, что потребность растений в этом элементе немногим меньше фосфора. Серные удобрения влияют не только на количество, но и качество урожая. Опытами доказано, что серные удобрения влияют на морозостойкость злаков. Они способствуют образованию органических веществ, содержащих сульфогидрильные группы-S-Н. Это приводит к изменению внутренней структуры белков, их гидрофильности, что повышает морозостойкость растений в целом. Применяют серу в сельском хозяйстве и для борьбы с болезнями растений, главным образом винограда и хлопчатника.
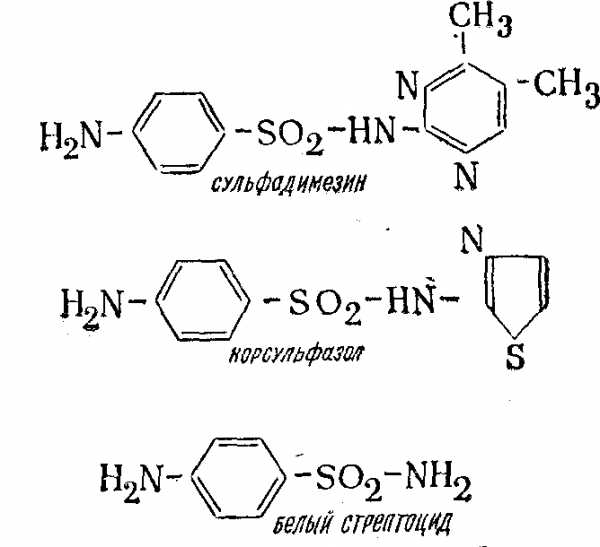
В медицине используется как элементарная сера, так и ее соединения. Например, мелкодисперсная сера—основа мазей, необходимых для лечения различных грибковых заболеваний кожи. Все сульфамидные препараты, (сульфидин, сульфазол, норсульфазол, сульфодимезин, стрептоцид и др.) —это органические соединения серы, например:
Растет количество серы, добываемой из недр земли, из промышленных газов, при очистке топлива. В мире сейчас уже производится на 10% серы больше, чем используется. Ей ищут новые области применения, предполагают использовать в строительной индустрии. В Канаде уже изготовлен серный пенопласт, который будет применен в строительстве шоссейных дорог и при прокладке трубопроводов в условиях вечной мерзлоты. В Монреале построен одноэтажный дом, состоящий из необычных блоков: 70% песка и 30% серы. Приготовляются блоки в металлических формах при температуре спекания 120°С. По прочности и стойкости они не уступают цементным. Защита их от окисления достигается покраской любым синтетическим лаком. Можно сооружать гаражи, магазины, склады и дачи. Появились сведения и о других строительных материалах, содержащих серу. Оказалось, что с помощью серы можно получать отличные асфальтовые покрытия, способные при сооружении автострад заменять трехкратное количество гравия. Такова, к примеру, смесь 13,5% серы, 6% асфальта и 80,5% песка.
alive-inter.net
| S | 16 | Сера | ||
| to кип. (o С) | 444,674 | Степ.окис. | -2 +4 +6 | |
| 32,066 | to плав.(o С) | 119,3 | Плотность | 2070(a) 1960(b) |
| 3s2 3p4 | ОЭО | 2,60 | в зем. коре | 0,052 % |
Сера — одно из немногих веществ, которыми уже несколько тысяч дет назад оперировали первые «химики». Она стала служить человечеству задолго до того, как заняла в таблице Менделеева клетку под № 16.
Об одном из самых древних (хотя и гипотетических!) применении серы рассказывают многие старинные книги. Как источник тепла при термообработке грешников серу живописуют и Новый и Ветхий заветы. И если книги такого рода не дают достаточных основании для археологических раскопок в поисках остатков райских кущ или геенны огненной, то их свидетельство о том, что древние были знакомы с серой и некоторыми ее свойствами, можно принять на веру.
Одна из причин этой известности — распространенность самородной серы в странах древнейших цивилизаций, Месторождения этого желтого горючего вещества разрабатывались греками и римлянами, особенно в Сицилии, которая вплоть до конца прошлого века славилась в основном серой.
С древнейших времен серу использовали для религиозно-мистических целей, ее зажигали при различных церемониях и ритуалах. Но так же давно элемент № 16 приобрел и вполне мирские назначения: серой чернили оружие, ее употребляли при изготовлении- косметических и лекарственных мазей, ее жгли для отбелки тканей и для борьбы с насекомыми. Добыча серы значительно увеличилась после того, как был изобретён черный порох. Ведь сера (вместе с углем и селитрой)—непременный его компонент.
И сейчас пороховое производство потребляет часть добываемой серы, правда весьма незначительную. В наше время сера — один из важнейших видов сырья для многих химических производств. И в этом причина непрерывного роста мирового производства серы.
Происхождение серы
Большие скопления самородной серы встречаются не так уж часто. Чаще она присутствует в некоторых рудах. Руда самородной серы — это порода с вкраплениями чистой серы.
Когда образовались эти вкрапления — одновременно с сопутствующими породами или позже? От ответа на этот вопрос зависит направление поисковых и разведочных работ. Но, несмотря на тысячелетия общения с серой, человечество до сих пор не имеет однозначного ответа. Существует несколько теорий, авторы которых придерживаются противоположных взглядов.
Теория сингенеза (т. е. одновременного образования серы и вмещающих пород) предполагает, что образование самородной серы происходило в мелководных бассейнах. Особые бактерии восстанавливали сульфаты, растворенные в воде, до сероводорода, который поднимался вверх, попадал в окислительную зону и здесь химическим путем или при участии других бактерий окислялся до элементарной серы. Сера осаждалась на дно, и впоследствии содержащий серу ил образовал руду.
Теория эпигенеза (вкрапления серы образовались позднее, чем основные породы) имеет несколько вариантов. Самый распространенный из них предполагает, что подземные воды, проникая сквозь толщи пород, обогащаются сульфатами. Если такие воды соприкасаются с месторождениями нефти или природного газа, то ионы сульфатов восстанавливаются углеводородами до сероводорода. Сероводород поднимается к поверхности и, окисляясь, выделяет чистую серу в пустотах и трещинах пород.
В последние десятилетия находит все новые подтверждения одна из разновидностей теории эпигенеза — теория метасоматоза (в переводе с греческого «метасоматоз» означает замещение). Согласно ей в недрах постоянно происходит превращение гипса CaSO4-h3O и ангидрита CaSО4 в серу и кальцит СаСО3. Эта теория создана в 1935 году советскими учеными Л. М. Миропольским и Б. П. Кротовым. В ее пользу говорит, в частности, такой факт.
В 1961 году в Ираке было открыто месторождение Мишрак. Сера здесь заключена в карбонатных породах, которые образуют свод, поддерживаемый уходящими вглубь опорами (в геологии их называют крыльями). Крылья эти состоят в основном из ангидрита и гипса. Такая же картина наблюдалась на отечественном месторождении Шор-Су.
Геологическое своеобразие этих месторождений можно объяснить только с позиций теории метасоматоза: первичные гипсы и ангидриты превратились во вторичные карбонатные руды с вкраплениями самородной серы. Важно не только соседство минералов — среднее содержание серы в руде этих месторождений равно содержанию химически связанной серы в ангидрите. А исследования изотопного состава серы и углерода в руде этих месторождений дали сторонникам теории метасоматоза дополнительные аргументы.
Но есть одно «но»: химизм процесса превращения гипса в серу и кальцит пока не ясен, и потому нет оснований считать теорию метасоматоза единственно правильной. На земле и сейчас существуют озера (в частности, Серное озеро близ Серноводска), где происходит сингенетическое отложение серы и сероносный ил не содержит пи гипса, ни ангидрита.
Все это означает, что разнообразие теорий и гипотез о происхождении самородной серы — результат не только и не столько неполноты наших знаний, сколько сложности явлений, происходящих в недрах. Еще из элементарной школьной математики все мы знаем, что к одному результату могут привести разные пути. Этот закон распространяется и на геохимию.
Добыча серы
Серные руды добывают разными способами—в зависимости от условий залегания. Но в любом случае приходится уделять много внимания технике безопасности. Залежам серы почти всегда сопутствуют скопления ядовитых газов — соединений серы. К тому же нельзя забывать о возможности ее самовозгорания.
Добыча руды открытым способом происходит так. Шагающие экскаваторы снимают пласты пород, под которыми залегает руда. Взрывами рудный пласт дробят, после чего глыбы руды отправляют на обогатительную фабрику, а оттуда—на сероплавильный завод, где из концентрата извлекают серу. Методы извлечения—различны. О некоторых из них будет рассказано ниже. А здесь уместно кратко описать скважинный метод добычи серы из-под земли, позволивший Соединенным Штатам Америки и Мексике стать крупнейшими поставщиками серы.
В конце прошлого века на юге Соединенных Штатов были открыты богатейшие месторождения серной руды. Но подступиться к пластам было непросто: в шахты (а именно шахтным способом предполагалось разрабатывать месторождение) просачивался сероводород и преграждал доступ к сере. Кроме того, пробиться к сероносным пластам мешали песчаные плывуны. Выход нашел химик Герман Фраш, предложивший плавить серу под" землей и через скважины, подобные нефтяным, выкачивать ее на поверхность. Сравнительно невысокая (меньше 120° С) температура плавления серы подтверждала реальность идеи Фраша. В 1890 году начались испытания, приведшие к успеху.
В принципе установка Фраша очень несложна: труба в трубе. В пространство между трубами подается перегретая вода и по нему идет в пласт. А по внутренней, обогреваемой со всех сторон, трубе поднимается расплавленная сера. Современный вариант установки Фраша дополнен третьей — самой узкой трубой. Через нее в скважину подается сжатый воздух, который помогает поднять расплавленную серу на поверхность. Одно из основных достоинств метода Фраша — в том, что он позволяет уже на первой стадии добычи получить сравнительно чистую серу. При разработке богатых руд этот метод весьма эффективен.
Раньше считалось, что метод подземной выплавки серы применим только в специфических условиях «соляных куполов» тихоокеанского побережья США и Мексики. Однако опыты, проведенные в Польше и СССР, опровергли это мнение. В народной Польше этим методом уже добывают большое количество серы; в 1968. году пущены первые серные скважины и в СССР.
А руду, полученную в карьерах и шахтах, приходится перерабатывать (часто с предварительным обогащением), используя для этого различные технологические приемы.
Известно несколько методов получения серы из серных руд: пароводяные, фильтрационные, термические, центрифугальные и экстракционные.
Термические методы извлечения серы — самые старью. Еще в XVIII веке в Неаполитанском королевстве выплавляли серу в кучах —«сольфатарах». До сих пор в Италии выплавляют серу в примитивных печах — «калькаронах». Тепло, необходимое для выплавления серы из руды, получают, сжигая часть добытой серы. Процесс этот малоэффективен, потери достигают 45%.
Италия стала родиной и пароводяных методов извлечения серы из руд. В 1859 году Джузеппе Джилль получил патент на свой аппарат — предшественник нынешних автоклавов. Автоклавный метод (значительно усовершенствованный, конечно) используется и сейчас во многих странах.
В автоклавном процессе обогащенный концентрат серной руды, содержающий до 80% серы, в виде жидкой пульпы с реагентами подается насосами в автоклав. Туда же под давлением подается водяной пар. Пульпа нагревается до 130° С. Сера, содержащаяся в концентрате, плавится и отделяется от породы. После недолгого отстоя выплавленная сера сливается. Затем из автоклава выпускаются «хвосты»—взвесь пустой породы в воде? Хвосты содержат довольно много серы и вновь поступают на обогатительную фабрику.
В России автоклавный способ был впервые применен инженером К. Г. Паткановым в 1896 году.
Современные автоклавы — это огромные аппараты высотой с четырехэтажный дом. Такие автоклавы установлены, в частности, на сероплавильном заводе Роздольского горнохимического комбината в Прикарпатье.
На некоторых производствах, например на крупном серном комбинате в Тарнобжеге (Польша), пустую породу отделяют от расплавленной серы на специальных фильтрах. Метод разделения на специальных центрифугах разработан недавно в нашей стране. Словом, «руду золотую (точнее — золотистую) отделять от породы пустой» можно по-разному.
По-разному и удовлетворяют свои потребности в сере разные страны. Мексика и США используют в основном метод Фраша. Италия, занимающая по добыче серы третье место среди капиталистических государств, продолжает добывать и перерабатывать (разными методами) серные руды сицилийских месторождений и провинции Марко. У Японии есть значительные запасы серы вулканического происхождения. Франция и Канада, не имеющие самородной серы, развили крупное производство, ее из газов. Нет собственных серных месторождений и в Англии и Германии. Свои потребности в серной кислоте они покрывают за счёт переработки серусодержащего сырья (преимущественно пирита), а элементарную серу импортируют.
Россия полностью удовлетворяют свои потребности благодаря собственным источникам сырья. После открытия и освоения богатых Прикарпатских месторождений СССР и Польша значительно увеличили производство серы. Эта отрасль промышленности продолжает развиваться. Были построены новые крупные предприятия на Украине, реконструированы старые комбинаты на Волге и в Туркмении, расширено производство серы из природного газа и отходящих газов.
Кристаллы в макромолекулы
В том, что сера—самостоятельный химический элемент, а не соединение, первым убедился великий французский химик Антуан Лоран Лавуазье в XVIII веке.
С тех пор представления о сере как элементе изменились не очень сильно но значительно углубились и дополнились.
Сейчас известно, что элемент № 16 состоит из смеси четырех устойчивых изотопов с массовыми числами 32, 33, 34 и 36. Это типичный неметалл.
Лимонно-желтые кристаллы чистой серы полупрозрачны. Форма кристаллов не всегда одинакова. Чаще всего встречается ромбическая сера (наиболее устойчивая модификация) — кристаллы имеют вид октаэдров со срезанными углами. В эту модификацию при комнатной (или близкой к комнатной) температуре превращаются все прочие модификации. Известно, например, что при кристаллизации из раплава (температура плавления серы 119,5° С) сначала получаются игольчатые кристаллы (моноклинная форма). Но эта модификация неустойчива, и при температуре ниже 95,6° С она переходит в ромбическую. Подобный процесс происходит и с другими модификациями серы.
Напомним известный опыт — получение пластической серы.
Если расплавленную серу вылить в холодную воду, образуется эластичная, во многом похожая на резину масса. Ее можно получить и в виде нитей. Но проходит несколько дней, и масса перекристаллизуется, становится жесткой и ломкой.
Молекулы кристаллов серы всегда состоят из восьми атомов (S8), а различие в свойствах модификаций серы объясняется полиморфизмом — неодинаковым строением кристаллов. Атомы в молекуле серы построены в замкнутый цикл
S-S-S
/ \
S S
\ /
S-S-S
При плавлении связи в цикле рвутся, и циклические молекулы превращаются в линейные.
Необычному поведению серь при плавлении даются различные толкования. Одно из них — такое. При температуре от 155 до 187°, по-видимому, происходит значительный рост молекулярного веса, это подтверждается многократным увеличением вязкости. При 187° С вязкость расплава достигает чуть ли ни тысячи пуаз, получается почти твердое вещество. Дальнейший рост температуры приводит к уменьшению вязкости (молекулярный вес падает). При 300° С сера вновь переходит в текучее состояние, а при 444,6° С закипает.
У паров серы с повышением температуры число атомов в молекуле постепенно уменьшается:
S8 —> S6—> S4 —>S2. При 1700°С пары серы одноатомны.
Коротко о соединениях серы
По распространенности элемент, № 16 занимает -15-е место. Содержание серы в земной коре составляет 0,05% по весу. Это немало.
К тому же сера химически активна и вступает' в реакции с большинством элементов. Поэтому в природе сера встречается не только в свободном состоянии, но и в виде разнообразных неорганических соединений. Особенно распространены сульфаты, (главным образом щелочных и щелочноземельных, металлов) и сульфиды (железа, меди, цинка, свинца). Сера есть и в углях, сланцах, нефти, природных газах, в организмах животных и растений.
При взаимодействии серы с металлами, как правило, выделяется довольно много тепла. В реакциях с кислородом сера дает несколько окислов, из них самые важные SО2 и SО3 — ангидриды сернистой Н2SО3 и серной Н2SО4 кислот. Соединение серы с водородом — сероводород Н2S — очень ядовитый, зловонный газ, всегда присутствующий в местах гниения органических остатков. Земная
кора в местах, расположенных близ месторождений серы, часто содержит довольно значительные количества сероводорода. В водном растворе этот газ обладает кислотными свойствами. Хранить его растворы на воздухе нельзя, он окисляется с выделением серы:
2h3S + О2=2Н2О + 2S.
Сероводород — сильный восстановитель. Этим его свойством пользуются во многих химических производствах.
Для чего нужна сера
Среди вещей, окружающих нас, мало таких, для изготовления которых не нужны были бы сера и ее соединения. Бумага и резина, эбонит и спички, ткани и лекарства, косметика и пластмассы, взрывчатка и краска, удобрения и ядохимикаты — вот далеко не полный перечень вещей и веществ, для производства которых нужен элемент № 16. Для того чтобы изготовить, например, автомобиль, нужно израсходовать около 14 кг серы. Можно без преувеличения сказать, что промышленный потенциал страны довольно точно определяется потреблением серы.
Значительную часть мировой добычи серы поглощает бумажная промышленность (соединения серы помогают выделить целлюлозу). Для того чтобы произвести одну тонну целлюлозы, нужно затратить более 100 кг серы. Много элементарной серы потребляет и резиновая промышленность — для вулканизации каучуков.
В сельском хозяйстве сера применяется как в элементарном виде, так и в различных соединениях. Она входит в состав минеральных удобрений и препаратов для борьбы с вредителями. Наряду с фосфором, калием и другими элементами сера необходима растениям. Впрочем, большая часть вносимой в почву серы не усваивается ими, но помогает усваивать фосфор. Серу вводят в почву вместе с фосфоритной мукой. Имеющиеся в почве бактерии окисляют ее, образующиеся серная и сернистая кислоты реагируют с фосфоритами, и в результате получаются фосфорные соединения, хорошо усваиваемые растениями.
Однако основной потребитель серы — химическая промышленность. Примерно половина добываемой в мире серы идет на производство серной кислоты. Чтобы получить одну тонну h3SО4, нужно сжечь около 300 кг серы. А роль серной кислоты: в химической промышленности сравнима с ролью хлеба в нашем питании.
Значительное количество серы (и серной кислоты) расходуется при производстве взрывчатых веществ и спичек. Чистая» освобожденная от примесей сера нужна для производства красителей и светящихся составов.
Соединения серы находят применение в нефтехимической промышленности. В частности, они необходимы при. -производстве антидетонаторов, смазочных веществ для аппаратуры сверхвысоких давлений; в охлаждающих маслах, ускоряющих обработку.металла, содержится иногда до 18% серы.
Перечисление примеров, подтверждающих первостепенную важность элемента № 16, можно было бы продолжить, но «нельзя объять необъятное». Поэтому вскользь упомянем, что сера необходима и таким отраслям промышленности, как горнодобывающая, пищевая, текстильная, и — поставим точку.
* * *
Наш век считается веком «экзотических» материалов — трансурановых элементов, титана, полупроводников, и так далее. Но внешне непритязательный, давно известный элемент № 16 продолжает оставаться абсолютно необходимым. Подсчитано, что в производстве 88 из 150 важнейших химических продуктов используют либо саму серу, либо ее соединения.
Реферат по химии
Тема: «Сера»
Ученицы 9 «ч» класса
Средней школы № 27
Зима Анны
Бишкек 2001г.
www.ronl.ru
Сера
План
1. Историческая справка.
2. Физические свойства.
3. Химические свойства.
4. Добыча серных руд и получение серы.
5. Применение серы.
Сера S – химический элемент VI группы переодической системы Мендеева, атомный номер 16, атомная масса 32,064. Твёрдое хрупкое вещество жёлтого цвета.
Историческая справка.
Сера в самородном состоянии, а также в виде соединений, например сульфидов, известна с древнейших времен. Жрецы использовали ее в составе “священных курений” при некоторых религиозных обрядах. Разные горючие смеси для военных целей также содержали серу. Еще у Гомера упоминаются “сернистые испарения” и смертельное действие продуктов горения серы. Она входила в состав “греческого огня”, наводившего ужас на противников.
В 941 г. под стенами Царьграда был уничтожен флот киевского князя Игоря. В летописном своде событий “Повесть временных лет”, составленном в Киеве, так описан поход Игоря: “Словно молнию... которая на небе, греки имеют у себя и пускали ее, сжигая нас, поэтому мы и не одолели их”. Дружинники князя защищались от “греческого огня” щитами, воловьими шкурами, но потерпели поражение. Греки выбрасывали горящую смесь через медные трубы, установленные на бортах византийских кораблей. Состав этой смеси был неизвестен. Греки держали его в секрете. Предполагают, что в нее входили нефть, различные горючие масла, смола, селитра, клен, сера и вещества, которые окрашивали пламя.
Горючесть серы, легкость, с которой она соединяется с металлами, объясняют причину, почему ее считали “принципом горючести” и обязательной составной частью металлических руд. Наивное верование алхимиков о сере выражено в небольшом стихотворении Н. А. Михайловым:
Семь металлов создал свет. Медь, железо, серебро,
По числу семи планет: Злато, олово, свинец...
Дал нам Космос на добро Сын мой! сера им отец!..
В VIII—IX вв. в сочинениях арабских алхимиков рассматривается ртутно-серная теория состава металлов, согласно которой происхождение всех металлов объяснялось сочетанием серы и ртути. Эти воззрения сохранялись в Европе вплоть до XVIII в. Рождение металлов в средние века, конечно, мыслилось при благословении католической церкви, как это и изображено в иллюстрации к книге “Семь ключей мудрости”, приписываемой алхимику Базилю Валентину.
Элементарную природу серы установил француз Антуан Лоран Лавуазье (по образованию юрист, а по призванию химик) в своих опытах по сжиганию.
Древнерусское название “сера” употребляется очень давно. По-видимому, оно происходит от санскритского слова “сира”, что означает светло-желтый. Но есть и другое древнерусское название серы — “жупел” (сера горючая).
Сера —это порошок желтого цвета. Для нее характерно несколько модификаций, отличающихся друг от друга строением молекул и некоторыми свойствами. Так, ромбическая и моноклиническая сера всегда состоит из восьмиатомных кольцевидных молекул S 8 .
Различие в свойствах кристаллических модификаций серы обусловлено не числом атомов в молекуле, как например в молекулах кислорода и озона, а неодинаковой структурой кристаллов. На рисунке 5 показан внешний вид кристаллов ромбической и моноклинической серы. Ромбическая сера обычно желтого, а моноклиническая бледно-желтого цвета.
Третья модификация серы пластическая. Она состоит из нерегулярно расположенных зигзагообразных цепочек Sn, где п достигает нескольких тысяч. Другие модификации серы построены из молекул S 2 (пурпурная) и S 6 (оранжево-желтая).
Сколько бы аллотропных видоизменений ни образовывал химический элемент, при определенных заданных условиях абсолютно устойчивым из них, как правило, оказывается лишь какое-то одно. Для серы самой устойчивой аллотропной модификацией при обычных условиях при нормальном давлении и температуре не выше 95,6°С является ромбическая сера. В нее при комнатной температуре (или близкой к комнатной) превращаются все другие формы. Например, при кристаллизации из расплава серы сначала получаются игольчатые кристаллы моноклинической формы, которые при температуре ниже 95,6°С переходят в ромбические. При температуре выше 95,6°С устойчива моноклиническая сера.
Подобные превращения происходят и с другими модификациями серы. Так, если расплавленную серу вылить в холодную воду, образуется эластичная, во многом похожая на резину коричневая масса. Переход из одной аллотропной формы в другую сопровождается поглощением теплоты:
S D S — Q кдж
кристал- пласти-
лическая ческая
Такую пластическую серу можно получить в условиях школьной лаборатории. Она неустойчива и через некоторое время станет хрупкой, приобретет желтый цвет, т. е. постепенно будет превращаться в ромбическую.
Физические свойства.
Плавление серы происходит в интервале температур 112—119,3°С (в зависимости от чистоты образца). При этом с увеличением температуры до 155°С вязкость расплава уменьшается и возрастает в тысячи раз в интервале температур 155—187°С. Затем снова наступает спад. На рисунке 10 показано, как изменяется вязкость расплава серы при нагревании. Имеется несколько объяснений этого явления. Одно из них таково, С возрастанием температуры от 155 до 187°С, вероятно, происходит значительный рост молекулярной массы. Кольцевые молекулы Ss разрушаются и образуются другие — в виде длинных цепей из нескольких тысяч атомов. Вязкость расплава увеличивается. При 187°С она достигает величины свыше 90 н • сек/м 2 , т. е. почти как у твердого вещества. Дальнейшее повышение температуры ведет к разрыву цепей, и жидкость снова становится подвижной, вязкость
расплава уменьшается. При 300°С сера переходит в текучее состояние, а при 444,6°С закипает. В зависимости от температуры в ее парах обнаруживают молекулы S 8 , S 6 , S 4 , S 2 . При 1760°С пары серы одноатомны. Таким образом, с увеличением температуры число атомов в молекуле постепенно уменьшается:
S 8 " S 6 " S 4 " S 2 " S
Изменение состава молекул вызывает изменение окраски паров серы от оранжево-желтого до соломенно-желтого.
Сера в обычных условиях имеют различный цвет (см. выше). Окраска этих веществ обусловлена способностью поглощать какую-то часть спектра белого света. В результате этого они окрашены в какой-нибудь дополнительный (к цвету поглощения лучей) цвет. Дополнительными, или взаимокомпенсирующими, до белого цвета являются следующие пары цветовых сочетаний: красный — голубой, желтый — синий, зеленый — пурпурный и т. д. “Вычитание” какого-либо цвета из белого дает дополнительную окраску вещества. Так, ромбическая сера поглощает синий цвет, поэтому она окрашена в желтый, кристаллический моноклинный селен красного цвета, так как поглощает голубой.
Сера совершенно не проводит тока и при трении заряжается отрицательным электричеством, поэтому из нее делают круги электрических машин, в которых электрический заряд возбуждается посредством трения. Очень плохо проводит сера и тепло. Если в ней содержится менее 0,1% примесей, то при согревании куска серы в руке слышится своеобразный треск, и случается, что кусок распадается на части. Это происходит из-за напряжений, возникающих в куске вследствие его неравномерного расширения в связи с малой теплопроводностью серы.
Химические свойства.
Сера в обычных условиях с водородом не соединяется. Лишь при нагревании происходит обратимая реакция:
Н 2 + S D H 2 S + 20,92 кдж/моль
Равновесие ее при 350°С смещено вправо, а при более высокой температуре - влево.
Все элементы VI группы взаимодействуют с галогенами. Известны галогениды серы, селена и теллура и других элементов группы. Например, хлорид или бромид серы получают при нагревании серы с галогенами в запаянной трубке:
2S + Br 2 = 83 Br 2
2S+Cl 2 = S 2 Cl 2
Хлорид серы S 2 Cl 2 является хорошим растворителем многих химических соединений серы. В частности, в химической промышленности его используют в качестве растворителя серы при вулканизации каучука.
Сера с водой и разбавленными кислотами не взаимодействуют, в то время как теллур окисляется водой при температуре 100—160°С:
Те + 2Н 2 О==ТеO 2 + 2Н 2 #
Со щелочами сера взаимодействуют с образованием сульфидов и сульфитов (реакция обратимая):
3S + 6КОН D 2К 2 S + К 2 SО 4 + ЗH 2 O
Сера, так же как и кислород, взаимодействует со всеми металлами, кроме золота, платины, иридия, с образованием сульфидов. Эти реакции идут обычно при нагревании, но с некоторыми металлами и без нагревания. Так, со ртутью сера вступает в реакцию в обычных условиях при простом соприкосновении веществ. Если в лаборатории разлили ртуть (возникла опасность отравления парами ртути), ее сначала собирают, а те участки, где ртутные капли нельзя извлечь, засыпают порошкообразной серой. Происходит реакция с образованием безвредного сульфида ртути (II), или киновари:
Hg+S=HgS
В школьных условиях можно легко получить сульфиды некоторых металлов, например CuzS. Для этого в пробирку, закрепленную в штативе, вносят немного серы и нагревают ее до кипения. Затем щипцами вводят в пары серы предварительно подогретую полоску медной фольги. Медь энергично взаимодействует с серой: 2 Сu + S = Cu 2 S
ДОБЫЧА СЕРНЫХ РУД И ПОЛУЧЕНИЕ СЕРЫ
В древности и в средние века серу добывали примитивным способом. В землю вкапывали большой глиняный горшок, на который ставили другой, но с отверстием в дне. Последний заполняли породой, содержа
щей серу, и затем нагревали. Сера плавилась и стекала в нижний горшок.
В настоящее время руды добывают разными способами, в зависимости от условий их залегания. Но в любом случае большое внимание уделяется технике безопасности. Ведь часто залежам серных руд сопутствуют скопления ядовитого газа — сероводорода. Да и сама сера может самовозгораться. При открытом способе добычи серы шагающий экскаватор снимает пласты пород, под которыми залегает руда. Рудные пласты дробят взрывами и далее глыбы руды отправляют на
сероплавильиый завод, где из них извлекают серу. Если сера залегает глубоко и в значительном количестве, то ее получают по методу Фраша. В этом случае серу расплавляют под землей и через скважину, подобно нефти, выкачивают на поверхность, т. е. этот способ основан на легкоплавкости серы и ее сравнительно небольшой плотности.
Установка Фраша доволь проста: труба в трубе. В пространство между трубами подается перегретая вода и по нему идет в пласт, а по внутренней трубе, обогреваемой со всех сторон, поднимается
расплавленная сера. В современном варианте установка Фраша дополнена третьей, более узкой, трубой. Через нее в скваж,иту подается сжатый воздух, который поднимает на поверхность расплавленную серу.
Руда, полученная из шахт, карьеров, обычно перерабатывается с предварительным обогащением. Известно несколько методов извлечения серы из руд: пароводяные, фильтрационные, термические, центрифугальные и экстракционные.
Термические методы извлечения серы из руд наиболее старые. Еще в XVIII в. в Неаполитанском королевстве серу выплавляли в кучах—“сольфаторах”. До сих пор в Итални выплавляют серу в примитивных печах-калькаронах. Калькарона—одна из самых старых сероплавильных печей. Это открытая сверху камера цилиндрической формы. Обычно калькароны располагали на уступах скал или углубляли в землю. Куски руды в такие печи укладывали определенным образом:
внизу—большие, сверху—маленькие. При этом обязательно оставляли вертикальные ходы для тяги. Этот процесс малоэффективен: 45% потерь, так как часть серы сжигают для получения теплоты, необходимой при выплавке серы из руды.
Италия стала родиной и второго метода извлечения серы из руд—пароводяного, предшественника автоклавного. В этом процессе серная руда, содержащая до 80% серы, поступает в автоклав. Туда же под давлением подают водяной пар. Пульпу нагревают до 130°С. Сера, содержащаяся в концентрате, плавится и отделяется от породы. После недолгого отстоя серу сливают и только потом из автоклава выпускают взвесь пустой породы в воде — “хвосты”. Последние содержат довольно много серы и вновь поступают на обогатительную фабрику. Современные автоклавы—это огромные аппараты высотой с четырехэтажный дом. Такие автоклавы установлены у нас в Прикарпатье, в частности на сероплавильном заводе Раздольского горнохимического комбината.
Иногда пустую породу отделяют от расплавленной серы на специальных фильтрах. В нашей стране используют метод разделения на центрифугах.
Однако сера, полученная выплавкой из руды (комовая сера), обычно содержит еще много примесей. Дальнейшую очистку ее производят перегонкой в рафинированных печах, где сера нагревается до кипения. Пары серы поступают в выложенную кирпичом камеру. Вначале, пока камера холодная, сера переходит в твердое состояние и осаждается на стенках в виде светло-желтого порошка (серный цвет). Когда камера нагреется выше 120°С, пары конденсируются в жидкость, которую выпускают из камеры в формы, где она и застывает в виде палочек. Полученная таким образом сера называется черенковой.
Способы получения серы в разных странах неодинаковы. Так, в США и Мексике применяют в основном метод Фраша. В Италии (она занимает третье место по добыче серы среди капиталистических государств) используют разные методы переработки серных сицилийских руд и руд из Марокко. Япония имеет значительные запасы серы вулканического происхождения. Франция и Канада, не имеющие самородной серы, развили ее крупное производство из газов. В Англии и ФРГ перерабатывают сырье, содержащее серу (FeS 2 ), а элементарную серу покупают, так как в этих странах нет собственных серных месторождений.
СССР и социалистические страны благодаря собственным источникам сырья применяют разнообразные методы добычи серы. За последние годы возросла производство серы из природных и отходящих газов цветной металлургии.
Обычно в сере, которую получают из руд, остается после ее очистки 0,6% примесей, а в сере, полученной из газов,— только 0,2%. При этом газовая сера значительно дешевле.
В настояще время в Узбекистане пущена первая очередь Мубарекского газоперерабатываюшего завода— одного из крупнейших предприятий отечественной газовой химической промышленности. Около поселка Мубарек Кашкадарьинской области было обнаружено мощное месторождение природного газа, содержащего 6% сероводорода. Серу стали получать из сероводорода при нагревании его в присутствии катализаторов. Ежедневно новое предприятие будет перерабатывать 4,7 млрд. м 3 природного газа и выпускать 220 тыс. т чистой серы. Получая серу этим способом, попутно очищают большие количества природного газа от примесей.
ПРИМЕНЕНИЕ СЕРЫ
Основным потребителем серы является химическая промышленность. Примерно половина добываемой в мире серы идет на производство серной кислоты, роль которой в химической промышленности велика. Чтобы получить 1 т серной кислоты, нужно сжечь 300 кг серы.
Большое количество серы расходуется на производство черного пороха, сероуглерода, различных красителей, светящихся составов и бенгальских огней.
Значительную часть мировой добычи серы поглощает бумажная промышленность. Для того чтобы произвести 1 7 целлюлозы, нужно затратить более 100 кг серы.
В резиновой промышленности сера применяется для превращения каучука в резину. Свои ценные свойства (упругость, эластичность и др.) каучук приобретает после смешивания его с серой и нагревания до определенной температуры. Такой процесс носит название вулканизации. Последняя может быть горячей и холодной. В первом случае
каучук нагревают с серой до 130—160°С. Этот способ был предложен в 1839 г. Ч. Гудиром. Во втором случае процесс ведут без нагревания, обрабатывая каучук хлоридом серы S2C12. Холодная вулканизация была предложена в 1J846 г. А. Парксом. Сущность вулканизации заключается в образовании новых связей между полимерными группами. При этом мостики могут содержать 1, 2, 3 и т. д. атомов серы:
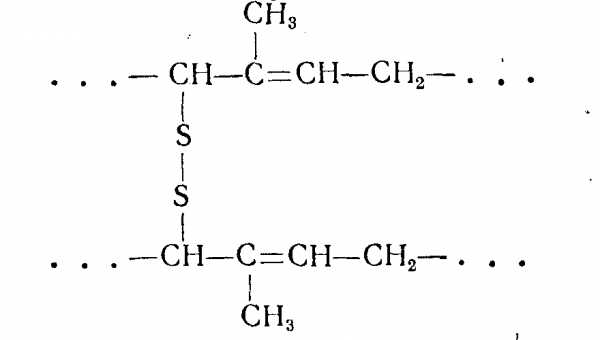
Состав, распределение и энергия связей —С—Sn—С—
определяют многие важнейшие физико-механические свойства вулканизированных материалов. Если к каучуку присоединяется 0,5—5% серы, то образуется мягкая резина (автомобильные покрышки, камеры, мячи, трубки и т. д.). Присоединение к каучуку 30—50% серы приводит к образованию жесткого неэластичного материала—эбонита. Он представляет собой твердое вещество и является хорошим электрическим изолятором.
В сельском хозяйстве сера применяется как в элементарном виде, так и в виде соединений. Установлено, что потребность растений в этом элементе немногим меньше фосфора. Серные удобрения влияют не только на количество, но и качество урожая. Опытами доказано, что серные удобрения влияют на морозостойкость злаков. Они способствуют образованию органических веществ, содержащих сульфогидрильные группы-S-Н. Это приводит к изменению внутренней структуры белков, их гидрофильности, что повышает морозостойкость растений в целом. Применяют серу в сельском хозяйстве и для борьбы с болезнями растений, главным образом винограда и хлопчатника.
В медицине используется как элементарная сера, так и ее соединения. Например, мелкодисперсная сера—основа мазей, необходимых для лечения различных грибковых заболеваний кожи. Все сульфамидные препараты, (сульфидин, сульфазол, норсульфазол, сульфодимезин, стрептоцид и др.) —это органические соединения серы, например:
Растет количество серы, добываемой из недр земли, из промышленных газов, при очистке топлива. В мире сейчас уже производится на 10% серы больше, чем используется. Ей ищут новые области применения, предполагают использовать в строительной индустрии. В Канаде уже изготовлен серный пенопласт, который будет применен в строительстве шоссейных дорог и при прокладке трубопроводов в условиях вечной мерзлоты. В Монреале построен одноэтажный дом, состоящий из необычных блоков: 70% песка и 30% серы. Приготовляются блоки в металлических формах при температуре спекания 120°С. По прочности и стойкости они не уступают цементным. Защита их от окисления достигается покраской любым синтетическим лаком. Можно сооружать гаражи, магазины, склады и дачи. Появились сведения и о других строительных материалах, содержащих серу. Оказалось, что с помощью серы можно получать отличные асфальтовые покрытия, способные при сооружении автострад заменять трехкратное количество гравия. Такова, к примеру, смесь 13,5% серы, 6% асфальта и 80,5% песка.
ref.repetiruem.ru
По-разному и удовлетворяют свои потребности в сере разные страны. Мексика и США используют в основном метод Фраша. Италия, занимающая по добыче серы третье место среди капиталистических государств, продолжает добывать и перерабатывать (разными методами) серные руды сицилийских месторождений и провинции Марко. У Японии есть значительные запасы серы вулканического происхождения. Франция и Канада, не имеющие самородной серы, развили крупное производство, ее из газов. Нет собственных серных месторождений и в Англии и Германии. Свои потребности в серной кислоте они покрывают за счёт переработки серусодержащего сырья (преимущественно пирита), а элементарную серу импортируют. Россия полностью удовлетворяют свои потребности благодаря собственным источникам сырья. После открытия и освоения богатых Прикарпатских месторождений СССР и Польша значительно увеличили производство серы. Эта отрасль промышленности продолжает развиваться. Были построены новые крупные предприятия на Украине, реконструированы старые комбинаты на Волге и в Туркмении, расширено производство серы из природного газа и отходящих газов. Кристаллы в макромолекулы В том, что сера—самостоятельный химический элемент, а не соединение, первым убедился великий французский химик Антуан Лоран Лавуазье в XVIII веке. С тех пор представления о сере как элементе изменились не очень сильно но значительно углубились и дополнились. Сейчас известно, что элемент № 16 состоит из смеси четырех устойчивых изотопов с массовыми числами 32, 33, 34 и 36. Это типичный неметалл. Лимонно-желтые кристаллы чистой серы полупрозрачны. Форма кристаллов не всегда одинакова. Чаще всего встречается ромбическая сера (наиболее устойчивая модификация) — кристаллы имеют вид октаэдров со срезанными углами. В эту модификацию при комнатной (или близкой к комнатной) температуре превращаются все прочие модификации. Известно, например, что при кристаллизации из раплава (температура плавления серы 119,5° С) сначала получаются игольчатые кристаллы (моноклинная форма). Но эта модификация неустойчива, и при температуре ниже 95,6° С она переходит в ромбическую. Подобный процесс происходит и с другими модификациями серы. Напомним известный опыт — получение пластической серы. Если расплавленную серу вылить в холодную воду, образуется эластичная, во многом похожая на резину масса. Ее можно получить и в виде нитей. Но проходит несколько дней, и масса перекристаллизуется, становится жесткой и ломкой. Молекулы кристаллов серы всегда состоят из восьми атомов (S8), а различие в свойствах модификаций серы объясняется полиморфизмом — неодинаковым строением кристаллов. Атомы в молекуле серы построены в замкнутый цикл S-S-S / \ S S \ / S-S-S
При плавлении связи в цикле рвутся, и циклические молекулы превращаются в линейные. Необычному поведению серь при плавлении даются различные толкования. Одно из них — такое. При температуре от 155 до 187°, по-видимому, происходит значительный рост молекулярного веса, это подтверждается многократным увеличением вязкости. При 187° С вязкость расплава достигает чуть ли ни тысячи пуаз, получается почти твердое вещество. Дальнейший рост температуры приводит к уменьшению вязкости (молекулярный вес падает). При 300° С сера вновь переходит в текучее состояние, а при 444,6° С закипает. У паров серы с повышением температуры число атомов в молекуле постепенно уменьшается: S8 —> S6—> S4 —> S2. При 1700°С пары серы одноатомны.
Коротко о соединениях серы По распространенности элемент, № 16 занимает -15-е место. Содержание серы в земной коре составляет 0,05% по весу. Это немало. К тому же сера химически активна и вступает' в реакции с большинством элементов. Поэтому в природе сера встречается не только в свободном состоянии, но и в виде разнообразных неорганических соединений. Особенно распространены сульфаты, (главным образом щелочных и щелочноземельных, металлов) и сульфиды (железа, меди, цинка, свинца). Сера есть и в углях, сланцах, нефти, природных газах, в организмах животных и растений. При взаимодействии серы с металлами, как правило, выделяется довольно много тепла. В реакциях с кислородом сера дает несколько окислов, из них самые важные SО2 и SО3 — ангидриды сернистой Н2SО3 и серной Н2SО4 кислот. Соединение серы с водородом - сероводород Н2S — очень ядовитый, зловонный газ, всегда присутствующий в местах гниения органических остатков. Земная кора в местах, расположенных близ месторождений серы, часто содержит довольно значительные количества сероводорода. В водном растворе этот газ обладает кислотными свойствами. Хранить его растворы на воздухе нельзя, он окисляется с выделением серы: 2h3S + О2=2Н2О + 2S.
Сероводород — сильный восстановитель. Этим его свойством пользуются во многих химических производствах. Для чего нужна сера Среди вещей, окружающих нас, мало таких, для изготовления которых не нужны были бы сера и ее соединения. Бумага и резина, эбонит и спички, ткани и лекарства, косметика и пластмассы, взрывчатка и краска, удобрения и ядохимикаты — вот далеко не полный перечень вещей и веществ, для производства которых нужен элемент № 16. Для того чтобы изготовить, например, автомобиль, нужно израсходовать около 14 кг серы. Можно без преувеличения сказать, что промышленный потенциал страны довольно точно определяется потреблением серы. Значительную часть мировой добычи серы поглощает бумажная промышленность (соединения серы помогают выделить целлюлозу). Для того чтобы произвести одну тонну целлюлозы, нужно затратить более 100 кг серы. Много элементарной серы потребляет и резиновая промышленность — для вулканизации каучуков. В сельском хозяйстве сера применяется как в элементарном виде, так и в различных соединениях. Она входит в состав минеральных удобрений и препаратов для борьбы с вредителями. Наряду с фосфором, калием и другими элементами сера необходима растениям. Впрочем, большая часть вносимой в почву серы не усваивается ими, но помогает усваивать фосфор. Серу вводят в почву вместе с фосфоритной мукой. Имеющиеся в почве бактерии окисляют ее, образующиеся серная и сернистая кислоты реагируют с фосфоритами, и в результате получаются фосфорные соединения, хорошо усваиваемые растениями. Однако основной потребитель серы — химическая промышленность. Примерно половина добываемой в мире серы идет на производство серной кислоты. Чтобы получить одну тонну h3SО4, нужно сжечь около 300 кг серы. А роль серной кислоты: в химической промышленности сравнима с ролью хлеба в нашем питании. Значительное количество серы (и серной кислоты) расходуется при производстве взрывчатых веществ и спичек. Чистая» освобожденная от примесей сера нужна для производства красителей и светящихся составов. Соединения серы находят применение в нефтехимической промышленности. В частности, они необходимы при. -производстве антидетонаторов, смазочных веществ для аппаратуры сверхвысоких давлений; в охлаждающих маслах, ускоряющих обработку.металла, содержится иногда до 18% серы. Перечисление примеров, подтверждающих первостепенную важность элемента № 16, можно было бы продолжить, но «нельзя объять необъятное». Поэтому вскользь упомянем, что сера необходима и таким отраслям промышленности, как горнодобывающая, пищевая, текстильная, и — поставим точку. * * * Наш век считается веком «экзотических» материалов — трансурановых элементов, титана, полупроводников, и так далее. Но внешне непритязательный, давно известный элемент № 16 продолжает оставаться абсолютно необходимым. Подсчитано, что в производстве 88 из 150 важнейших химических продуктов используют либо саму серу, либо ее соединения.
Реферат по химии Тема: «Сера»
Ученицы 9 «ч» класса Средней школы № 27 Зима Анны
Бишкек 2001г.
www.ronl.ru
to кип. (oС)
444,674Степ.окис.
-2 +4 +632,066
to плав.(oС)
119,3Плотность
2070(a) 1960(b)
3s23p4
ОЭО
2,60в зем. коре
0,052 %
Сера — одно из немногих веществ, которыми уженесколько тысяч дет назад оперировали первые «химики». Она стала служитьчеловечеству задолго до того, как заняла в таблице Менделеева клетку под №16.
Об одном из самых древних (хотя игипотетических!) применении серы рассказывают многие старинные книги. Какисточник тепла при термообработке грешников серу живописуют и Новый и Ветхийзаветы. И если книги такого рода не дают достаточных основании дляархеологических раскопок в поисках остатков райских кущ или геенны огненной, тоих свидетельство о том, что древние были знакомы с серой и некоторыми ее свойствами,можно принять на веру.
Одна из причин этой известности —распространенность самородной серы в странах древнейших цивилизаций,Месторождения этого желтого горючего вещества разрабатывались греками иримлянами, особенно в Сицилии, которая вплоть до конца прошлого века славиласьв основном серой.
С древнейших времен серу использовали длярелигиозно-мистических целей, ее зажигали при различных церемониях и ритуалах.Но так же давно элемент № 16 приобрел и вполне мирские назначения: серойчернили оружие, ее употребляли при изготовлении- косметических и лекарственныхмазей, ее жгли для отбелки тканей и для борьбы с насекомыми. Добыча серызначительно увеличилась после того, как был изобретён черный порох. Ведь сера(вместе с углем и селитрой)—непременный его компонент.
И сейчас пороховое производство потребляет частьдобываемой серы, правда весьма незначительную. В наше время сера — один изважнейших видов сырья для многих химических производств. И в этом причинанепрерывного роста мирового производства серы.
Происхождение серы
Большие скопления самородной серы встречаются нетак уж часто. Чаще она присутствует в некоторых рудах. Руда самородной серы —это порода с вкраплениями чистой серы.
Когда образовались эти вкрапления — одновременнос сопутствующими породами или позже? От ответа на этот вопрос зависитнаправление поисковых и разведочных работ. Но, несмотря на тысячелетия общенияс серой, человечество до сих пор не имеет однозначного ответа. Существуетнесколько теорий, авторы которых придерживаются противоположных взглядов.
Теория сингенеза (т. е. одновременногообразования серы и вмещающих пород) предполагает, что образование самороднойсеры происходило в мелководных бассейнах. Особые бактерии восстанавливалисульфаты, растворенные в воде, до сероводорода, который поднимался вверх,попадал в окислительную зону и здесь химическим путем или при участии другихбактерий окислялся до элементарной серы. Сера осаждалась на дно, и впоследствиисодержащий серу ил образовал руду.
Теория эпигенеза (вкрапления серы образовалисьпозднее, чем основные породы) имеет несколько вариантов. Самый распространенныйиз них предполагает, что подземные воды, проникая сквозь толщи пород,обогащаются сульфатами. Если такие воды соприкасаются с месторождениями нефтиили природного газа, то ионы сульфатов восстанавливаются углеводородами досероводорода. Сероводород поднимается к поверхности и, окисляясь, выделяетчистую серу в пустотах и трещинах пород.
В последние десятилетия находит все новыеподтверждения одна из разновидностей теории эпигенеза — теория метасоматоза (впереводе с греческого «метасоматоз» означает замещение). Согласно ей в недрахпостоянно происходит превращение гипса CaSO4-h3O и ангидрита CaSО4 в серу икальцит СаСО3. Эта теория создана в 1935 году советскими учеными Л. М.Миропольским и Б. П. Кротовым. В ее пользу говорит, в частности, такой факт.
В 1961 году в Ираке было открыто месторождениеМишрак. Сера здесь заключена в карбонатных породах, которые образуют свод,поддерживаемый уходящими вглубь опорами (в геологии их называют крыльями).Крылья эти состоят в основном из ангидрита и гипса. Такая же картинанаблюдалась на отечественном месторождении Шор-Су.
Геологическое своеобразие этих месторожденийможно объяснить только с позиций теории метасоматоза: первичные гипсы иангидриты превратились во вторичные карбонатные руды с вкраплениями самороднойсеры. Важно не только соседство минералов — среднее содержание серы в руде этихместорождений равно содержанию химически связанной серы в ангидрите. Аисследования изотопного состава серы и углерода в руде этих месторождений далисторонникам теории метасоматоза дополнительные аргументы.
Но есть одно «но»: химизм процесса превращениягипса в серу и кальцит пока не ясен, и потому нет оснований считать теориюметасоматоза единственно правильной. На земле и сейчас существуют озера (вчастности, Серное озеро близ Серноводска), где происходит сингенетическоеотложение серы и сероносный ил не содержит пи гипса, ни ангидрита.
Все это означает, что разнообразие теорий игипотез о происхождении самородной серы — результат не только и не стольконеполноты наших знаний, сколько сложности явлений, происходящих в недрах. Ещеиз элементарной школьной математики все мы знаем, что к одному результату могутпривести разные пути. Этот закон распространяется и на геохимию.
Добыча серы
Серные руды добывают разными способами—взависимости от условий залегания. Но в любом случае приходится уделять многовнимания технике безопасности. Залежам серы почти всегда сопутствуют скопленияядовитых газов — соединений серы. К тому же нельзя забывать о возможности еесамовозгорания.
Добыча руды открытым способом происходит так.Шагающие экскаваторы снимают пласты пород, под которыми залегает руда. Взрывамирудный пласт дробят, после чего глыбы руды отправляют на обогатительнуюфабрику, а оттуда—на сероплавильный завод, где из концентрата извлекают серу.Методы извлечения—различны. О некоторых из них будет рассказано ниже. А здесьуместно кратко описать скважинный метод добычи серы из-под земли, позволивший СоединеннымШтатам Америки и Мексике стать крупнейшими поставщиками серы.
В конце прошлого века на юге Соединенных Штатовбыли открыты богатейшие месторождения серной руды. Но подступиться к пластамбыло непросто: в шахты (а именно шахтным способом предполагалось разрабатыватьместорождение) просачивался сероводород и преграждал доступ к сере. Кроме того,пробиться к сероносным пластам мешали песчаные плывуны. Выход нашел химикГерман Фраш, предложивший плавить серу под" землей и через скважины,подобные нефтяным, выкачивать ее на поверхность. Сравнительно невысокая (меньше120° С) температура плавления серы подтверждала реальность идеи Фраша. В 1890году начались испытания, приведшие к успеху.
В принципе установка Фраша очень несложна: трубав трубе. В пространство между трубами подается перегретая вода и по нему идет впласт. А по внутренней, обогреваемой со всех сторон, трубе поднимаетсярасплавленная сера. Современный вариант установки Фраша дополнен третьей —самой узкой трубой. Через нее в скважину подается сжатый воздух, которыйпомогает поднять расплавленную серу на поверхность. Одно из основных достоинствметода Фраша — в том, что он позволяет уже на первой стадии добычи получитьсравнительно чистую серу. При разработке богатых руд этот метод весьма эффективен.
Раньше считалось, что метод подземной выплавкисеры применим только в специфических условиях «соляных куполов» тихоокеанскогопобережья США и Мексики. Однако опыты, проведенные в Польше и СССР, опроверглиэто мнение. В народной Польше этим методом уже добывают большое количествосеры; в 1968. году пущены первые серные скважины и в СССР.
А руду, полученную в карьерах и шахтах,приходится перерабатывать (часто с предварительным обогащением), используя дляэтого различные технологические приемы.
Известно несколько методов получения серы изсерных руд: пароводяные, фильтрационные, термические, центрифугальные иэкстракционные.
Термические методы извлечения серы — самыестарью. Еще в XVIII веке в Неаполитанском королевстве выплавляли серу в кучах—«сольфатарах». До сих пор в Италии выплавляют серу в примитивных печах —«калькаронах». Тепло, необходимое для выплавления серы из руды, получают,сжигая часть добытой серы. Процесс этот малоэффективен, потери достигают 45%.
Италия стала родиной и пароводяных методовизвлечения серы из руд. В 1859 году Джузеппе Джилль получил патент на свойаппарат — предшественник нынешних автоклавов. Автоклавный метод (значительноусовершенствованный, конечно) используется и сейчас во многих странах.
В автоклавном процессе обогащенный концентратсерной руды, содержающий до 80% серы, в виде жидкой пульпы с реагентамиподается насосами в автоклав. Туда же под давлением подается водяной пар.Пульпа нагревается до 130° С. Сера, содержащаяся в концентрате, плавится иотделяется от породы. После недолгого отстоя выплавленная сера сливается. Затемиз автоклава выпускаются «хвосты»—взвесь пустой породы в воде? Хвосты содержатдовольно много серы и вновь поступают на обогатительную фабрику.
В России автоклавный способ был впервые примененинженером К. Г. Паткановым в 1896 году.
Современные автоклавы — это огромные аппаратывысотой с четырехэтажный дом. Такие автоклавы установлены, в частности, насероплавильном заводе Роздольского горнохимического комбината в Прикарпатье.
На некоторых производствах, например на крупномсерном комбинате в Тарнобжеге (Польша), пустую породу отделяют от расплавленнойсеры на специальных фильтрах. Метод разделения на специальных центрифугахразработан недавно в нашей стране. Словом, «руду золотую (точнее — золотистую)отделять от породы пустой» можно по-разному.
По-разному и удовлетворяют свои потребности всере разные страны. Мексика и США используют в основном метод Фраша. Италия,занимающая по добыче серы третье место среди капиталистических государств, продолжаетдобывать и перерабатывать (разными методами) серные руды сицилийскихместорождений и провинции Марко. У Японии есть значительные запасы серывулканического происхождения. Франция и Канада, не имеющие самородной серы,развили крупное производство, ее из газов. Нет собственных серных месторожденийи в Англии и Германии. Свои потребности в серной кислоте они покрывают за счётпереработки серусодержащего сырья (преимущественно пирита), а элементарную серуимпортируют.
Россия полностью удовлетворяют свои потребностиблагодаря собственным источникам сырья. После открытия и освоения богатыхПрикарпатских месторождений СССР и Польша значительно увеличили производствосеры. Эта отрасль промышленности продолжает развиваться. Были построены новыекрупные предприятия на Украине, реконструированы старые комбинаты на Волге и вТуркмении, расширено производство серы из природного газа и отходящих газов.
Кристаллы в макромолекулы
В том, что сера—самостоятельный химическийэлемент, а не соединение, первым убедился великий французский химик АнтуанЛоран Лавуазье в XVIII веке.
С тех пор представления о сере как элементеизменились не очень сильно но значительно углубились и дополнились.
Сейчас известно, что элемент № 16 состоит изсмеси четырех устойчивых изотопов с массовыми числами 32, 33, 34 и 36. Этотипичный неметалл.
Лимонно-желтые кристаллы чистой серыполупрозрачны. Форма кристаллов не всегда одинакова. Чаще всего встречаетсяромбическая сера (наиболее устойчивая модификация) — кристаллы имеют видоктаэдров со срезанными углами. В эту модификацию при комнатной (или близкой ккомнатной) температуре превращаются все прочие модификации. Известно, например,что при кристаллизации из раплава (температура плавления серы 119,5° С) сначалаполучаются игольчатые кристаллы (моноклинная форма). Но эта модификациянеустойчива, и при температуре ниже 95,6° С она переходит в ромбическую.Подобный процесс происходит и с другими модификациями серы.
Напомним известный опыт — получение пластическойсеры.
Если расплавленную серу вылить в холодную воду,образуется эластичная, во многом похожая на резину масса. Ее можно получить и ввиде нитей. Но проходит несколько дней, и масса перекристаллизуется, становитсяжесткой и ломкой.
Молекулы кристаллов серы всегда состоят из восьмиатомов (S8), а различие в свойствах модификаций серы объясняется полиморфизмом— неодинаковым строением кристаллов. Атомы в молекуле серы построены взамкнутый цикл
S-S-S
/ \
S S
\ /
S-S-S
При плавлении связи в цикле рвутся, и циклическиемолекулы превращаются в линейные.
Необычному поведению серь при плавлении даютсяразличные толкования. Одно из них — такое. При температуре от 155 до 187°,по-видимому, происходит значительный рост молекулярного веса, этоподтверждается многократным увеличением вязкости. При 187° С вязкость расплавадостигает чуть ли ни тысячи пуаз, получается почти твердое вещество. Дальнейшийрост температуры приводит к уменьшению вязкости (молекулярный вес падает). При300° С сера вновь переходит в текучее состояние, а при 444,6° С закипает.
У паров серы с повышением температуры числоатомов в молекуле постепенно уменьшается:
S8 —> S6—> S4 —><sup/>S2. При1700°С пары серы одноатомны.
Коротко о соединениях серы
По распространенности элемент, № 16 занимает-15-е место. Содержание серы в земной коре составляет 0,05% по весу. Этонемало.
К тому же сера химически активна и вступает' вреакции с большинством элементов. Поэтому в природе сера встречается не тольков свободном состоянии, но и в виде разнообразных неорганических соединений.Особенно распространены сульфаты, (главным образом щелочных и щелочноземельных,металлов) и сульфиды (железа, меди, цинка, свинца). Сера есть и в углях,сланцах, нефти, природных газах, в организмах животных и растений.
При взаимодействии серы с металлами, как правило,выделяется довольно много тепла. В реакциях с кислородом сера дает несколькоокислов, из них самые важные SО2 и SО3 — ангидриды сернистой Н2SО3 и сернойН2SО4 кислот. Соединение серы с водородом — сероводород Н2S — очень ядовитый,зловонный газ, всегда присутствующий в местах гниения органических остатков.Земная
кора в местах, расположенных близ месторожденийсеры, часто содержит довольно значительные количества сероводорода. В водномрастворе этот газ обладает кислотными свойствами. Хранить его растворы навоздухе нельзя, он окисляется с выделением серы:
2h3S + О2=2Н2О + 2S.
Сероводород — сильный восстановитель. Этим егосвойством пользуются во многих химических производствах.
Для чего нужна сера
Среди вещей, окружающих нас, мало таких, дляизготовления которых не нужны были бы сера и ее соединения. Бумага и резина,эбонит и спички, ткани и лекарства, косметика и пластмассы, взрывчатка икраска, удобрения и ядохимикаты — вот далеко не полный перечень вещей ивеществ, для производства которых нужен элемент № 16. Для того чтобыизготовить, например, автомобиль, нужно израсходовать около 14 кг серы. Можнобез преувеличения сказать, что промышленный потенциал страны довольно точноопределяется потреблением серы.
Значительную часть мировой добычи серы поглощаетбумажная промышленность (соединения серы помогают выделить целлюлозу). Для тогочтобы произвести одну тонну целлюлозы, нужно затратить более 100 кг серы. Многоэлементарной серы потребляет и резиновая промышленность — для вулканизациикаучуков.
В сельском хозяйстве сера применяется как вэлементарном виде, так и в различных соединениях. Она входит в составминеральных удобрений и препаратов для борьбы с вредителями. Наряду с фосфором,калием и другими элементами сера необходима растениям. Впрочем, большая частьвносимой в почву серы не усваивается ими, но помогает усваивать фосфор. Серувводят в почву вместе с фосфоритной мукой. Имеющиеся в почве бактерии окисляютее, образующиеся серная и сернистая кислоты реагируют с фосфоритами, и врезультате получаются фосфорные соединения, хорошо усваиваемые растениями.
Однако основной потребитель серы — химическаяпромышленность. Примерно половина добываемой в мире серы идет на производствосерной кислоты. Чтобы получить одну тонну h3SО4, нужно сжечь около 300 кг серы.А роль серной кислоты: в химической промышленности сравнима с ролью хлеба внашем питании.
Значительное количество серы (и серной кислоты)расходуется при производстве взрывчатых веществ и спичек. Чистая» освобожденнаяот примесей сера нужна для производства красителей и светящихся составов.
Соединения серы находят применение внефтехимической промышленности. В частности, они необходимы при. -производствеантидетонаторов, смазочных веществ для аппаратуры сверхвысоких давлений; вохлаждающих маслах, ускоряющих обработку.металла, содержится иногда до 18%серы.
Перечисление примеров, подтверждающихпервостепенную важность элемента № 16, можно было бы продолжить, но «нельзяобъять необъятное». Поэтому вскользь упомянем, что сера необходима и такимотраслям промышленности, как горнодобывающая, пищевая, текстильная, и —поставим точку.
* * *
Наш век считается веком «экзотических» материалов— трансурановых элементов, титана, полупроводников, и так далее. Но внешненепритязательный, давно известный элемент № 16 продолжает оставаться абсолютнонеобходимым. Подсчитано, что в производстве 88 из 150 важнейших химическихпродуктов используют либо саму серу, либо ее соединения.
Реферат по химии
Тема: «Сера»
Ученицы 9 «ч» класса
Средней школы № 27
Зима Анны
Бишкек 2001г.
www.ronl.ru
| S | 16 | Сера | |||
| toкип. (oС) | 444,674 | Степ.окис. | -2 +4 +6 | ||
| 32,066 | toплав.(oС) | 119,3 | Плотность | 2070(a) 1960(b) | |
| 3s23p4 | ОЭО | 2,60 | в зем. коре | 0,052 % | |
Сера — одно из немногих веществ, которыми уже несколько тысяч дет назад оперировали первые «химики». Она стала служить человечеству задолго до того, как заняла в таблице Менделеева клетку под№16.
Об одном из самых древних (хотя и гипотетических!) применении серы рассказывают многие старинные книги. Как источник тепла при термообработке грешников серу живописуют и Новый и Ветхий заветы. И если книги такого рода не дают достаточных основании для археологических раскопок в поисках остатков райских кущ или геенны огненной, то их свидетельство о том, что древние были знакомы с серой и некоторыми ее свойствами, можно принять на веру.
Одна из причин этой известности — распространенность самородной серы в странах древнейших цивилизаций, Месторождения этого желтого горючего вещества разрабатывались греками и римлянами, особенно в Сицилии, которая вплоть до конца прошлого века славилась в основном серой.
С древнейших времен серу использовали для религиозно-мистических целей, ее зажигали при различных церемониях и ритуалах. Но так же давно элемент № 16 приобрел и вполне мирские назначения: серой чернили оружие, ее употребляли при изготовлении- косметических и лекарственных мазей, ее жгли для отбелки тканей и для борьбы с насекомыми. Добыча серы значительно увеличилась после того, как был изобретён черный порох. Ведь сера (вместе с углем и селитрой)—непременный его компонент.
И сейчас пороховое производство потребляет часть добываемой серы, правда весьма незначительную. В наше время сера — один из важнейших видов сырья для многих химических производств. И в этом причина непрерывного роста мирового производства серы.
Происхождение серы
Большие скопления самородной серы встречаются не так уж часто. Чаще она присутствует в некоторых рудах. Руда самородной серы — это порода с вкраплениями чистой серы.
Когда образовались эти вкрапления — одновременно с сопутствующими породами или позже? От ответа на этот вопрос зависит направление поисковых и разведочных работ. Но, несмотря на тысячелетия общения с серой, человечество до сих пор не имеет однозначного ответа. Существует несколько теорий, авторы которых придерживаются противоположных взглядов.
Теория сингенеза (т. е. одновременного образования серы и вмещающих пород) предполагает, что образование самородной серы происходило в мелководных бассейнах. Особые бактерии восстанавливали сульфаты, растворенные в воде, до сероводорода, который поднимался вверх, попадал в окислительную зону и здесь химическим путем или при участии других бактерий окислялся до элементарной серы. Сера осаждалась на дно, и впоследствии содержащий серу ил образовал руду.
Теория эпигенеза (вкрапления серы образовались позднее, чем основные породы) имеет несколько вариантов. Самый распространенный из них предполагает, что подземные воды, проникая сквозь толщи пород, обогащаются сульфатами. Если такие воды соприкасаются с месторождениями нефти или природного газа, то ионы сульфатов восстанавливаются углеводородами до сероводорода. Сероводород поднимается к поверхности и, окисляясь, выделяет чистую серу в пустотах и трещинах пород.
В последние десятилетия находит все новые подтверждения одна из разновидностей теории эпигенеза — теория метасоматоза (в переводе с греческого «метасоматоз» означает замещение). Согласно ей в недрах постоянно происходит превращение гипса CaSO4-h3O и ангидрита CaSО4 в серу и кальцит СаСО3. Эта теория создана в 1935 году советскими учеными Л. М. Миропольским и Б. П. Кротовым. В ее пользу говорит, в частности, такой факт.
В 1961 году в Ираке было открыто месторождение Мишрак. Сера здесь заключена в карбонатных породах, которые образуют свод, поддерживаемый уходящими вглубь опорами (в геологии их называют крыльями). Крылья эти состоят в основном из ангидрита и гипса. Такая же картина наблюдалась на отечественном месторождении Шор-Су.
Геологическое своеобразие этих месторождений можно объяснить только с позиций теории метасоматоза: первичные гипсы и ангидриты превратились во вторичные карбонатные руды с вкраплениями самородной серы. Важно не только соседство минералов — среднее содержание серы в руде этих месторождений равно содержанию химически связанной серы в ангидрите. А исследования изотопного состава серы и углерода в руде этих месторождений дали сторонникам теории метасоматоза дополнительные аргументы.
Но есть одно «но»: химизм процесса превращения гипса в серу и кальцит пока не ясен, и потому нет оснований считать теорию метасоматоза единственно правильной. На земле и сейчас существуют озера (в частности, Серное озеро близ Серноводска), где происходит сингенетическое отложение серы и сероносный ил не содержит пи гипса, ни ангидрита.
Все это означает, что разнообразие теорий и гипотез о происхождении самородной серы — результат не только и не столько неполноты наших знаний, сколько сложности явлений, происходящих в недрах. Еще из элементарной школьной математики все мы знаем, что к одному результату могут привести разные пути. Этот закон распространяется и на геохимию.
Добыча серы
Серные руды добывают разными способами—в зависимости от условий залегания. Но в любом случае приходится уделять много внимания технике безопасности. Залежам серы почти всегда сопутствуют скопления ядовитых газов — соединений серы. К тому же нельзя забывать о возможности ее самовозгорания.
Добыча руды открытым способом происходит так. Шагающие экскаваторы снимают пласты пород, под которыми залегает руда. Взрывами рудный пласт дробят, после чего глыбы руды отправляют на обогатительную фабрику, а оттуда—на сероплавильный завод, где из концентрата извлекают серу. Методы извлечения—различны. О некоторых из них будет рассказано ниже. А здесь уместно кратко описать скважинный метод добычи серы из-под земли, позволивший Соединенным Штатам Америки и Мексике стать крупнейшими поставщиками серы.
В конце прошлого века на юге Соединенных Штатов были открыты богатейшие месторождения серной руды. Но подступиться к пластам было непросто: в шахты (а именно шахтным способом предполагалось разрабатывать месторождение) просачивался сероводород и преграждал доступ к сере. Кроме того, пробиться к сероносным пластам мешали песчаные плывуны. Выход нашел химик Герман Фраш, предложивший плавить серу под" землей и через скважины, подобные нефтяным, выкачивать ее на поверхность. Сравнительно невысокая (меньше 120° С) температура плавления серы подтверждала реальность идеи Фраша. В 1890 году начались испытания, приведшие к успеху.
В принципе установка Фраша очень несложна: труба в трубе. В пространство между трубами подается перегретая вода и по нему идет в пласт. А по внутренней, обогреваемой со всех сторон, трубе поднимается расплавленная сера. Современный вариант установки Фраша дополнен третьей — самой узкой трубой. Через нее в скважину подается сжатый воздух, который помогает поднять расплавленную серу на поверхность. Одно из основных достоинств метода Фраша — в том, что он позволяет уже на первой стадии добычи получить сравнительно чистую серу. При разработке богатых руд этот метод весьма эффективен.
Раньше считалось, что метод подземной выплавки серы применим только в специфических условиях «соляных куполов» тихоокеанского побережья США и Мексики. Однако опыты, проведенные в Польше и СССР, опровергли это мнение. В народной Польше этим методом уже добывают большое количество серы; в 1968. году пущены первые серные скважины и в СССР.
А руду, полученную в карьерах и шахтах, приходится перерабатывать (часто с предварительным обогащением), используя для этого различные технологические приемы.
Известно несколько методов получения серы из серных руд: пароводяные, фильтрационные, термические, центрифугальные и экстракционные.
Термические методы извлечения серы — самые старью. Еще в XVIII веке в Неаполитанском королевстве выплавляли серу в кучах —«сольфатарах». До сих пор в Италии выплавляют серу в примитивных печах — «калькаронах». Тепло, необходимое для выплавления серы из руды, получают, сжигая часть добытой серы. Процесс этот малоэффективен, потери достигают 45%.
Италия стала родиной и пароводяных методов извлечения серы из руд. В 1859 году Джузеппе Джилль получил патент на свой аппарат — предшественник нынешних автоклавов. Автоклавный метод (значительно усовершенствованный, конечно) используется и сейчас во многих странах.
В автоклавном процессе обогащенный концентрат серной руды, содержающий до 80% серы, в виде жидкой пульпы с реагентами подается насосами в автоклав. Туда же под давлением подается водяной пар. Пульпа нагревается до 130° С. Сера, содержащаяся в концентрате, плавится и отделяется от породы. После недолгого отстоя выплавленная сера сливается. Затем из автоклава выпускаются «хвосты»—взвесь пустой породы в воде? Хвосты содержат довольно много серы и вновь поступают на обогатительную фабрику.
В России автоклавный способ был впервые применен инженером К. Г. Паткановым в 1896 году.
Современные автоклавы — это огромные аппараты высотой с четырехэтажный дом. Такие автоклавы установлены, в частности, на сероплавильном заводе Роздольского горнохимического комбината в Прикарпатье.
На некоторых производствах, например на крупном серном комбинате в Тарнобжеге (Польша), пустую породу отделяют от расплавленной серы на специальных фильтрах. Метод разделения на специальных центрифугах разработан недавно в нашей стране. Словом, «руду золотую (точнее — золотистую) отделять от породы пустой» можно по-разному.
По-разному и удовлетворяют свои потребности в сере разные страны. Мексика и США используют в основном метод Фраша. Италия, занимающая по добыче серы третье место среди капиталистических государств, продолжает добывать и перерабатывать (разными методами) серные руды сицилийских месторождений и провинции Марко. У Японии есть значительные запасы серы вулканического происхождения. Франция и Канада, не имеющие самородной серы, развили крупное производство, ее из газов. Нет собственных серных месторождений и в Англии и Германии. Свои потребности в серной кислоте они покрывают за счёт переработки серусодержащего сырья (преимущественно пирита), а элементарную серу импортируют.
Россия полностью удовлетворяют свои потребности благодаря собственным источникам сырья. После открытия и освоения богатых Прикарпатских месторождений СССР и Польша значительно увеличили производство серы. Эта отрасль промышленности продолжает развиваться. Были построены новые крупные предприятия на Украине, реконструированы старые комбинаты на Волге и в Туркмении, расширено производство серы из природного газа и отходящих газов.
Кристаллы в макромолекулы
В том, что сера—самостоятельный химический элемент, а не соединение, первым убедился великий французский химик Антуан Лоран Лавуазье в XVIII веке.
С тех пор представления о сере как элементе изменились не очень сильно но значительно углубились и дополнились.
Сейчас известно, что элемент № 16 состоит из смеси четырех устойчивых изотопов с массовыми числами 32, 33, 34 и 36. Это типичный неметалл.
Лимонно-желтые кристаллы чистой серы полупрозрачны. Форма кристаллов не всегда одинакова. Чаще всего встречается ромбическая сера (наиболее устойчивая модификация) — кристаллы имеют вид октаэдров со срезанными углами. В эту модификацию при комнатной (или близкой к комнатной) температуре превращаются все прочие модификации. Известно, например, что при кристаллизации из раплава (температура плавления серы 119,5° С) сначала получаются игольчатые кристаллы (моноклинная форма). Но эта модификация неустойчива, и при температуре ниже 95,6° С она переходит в ромбическую. Подобный процесс происходит и с другими модификациями серы.
Напомним известный опыт — получение пластической серы.
Если расплавленную серу вылить в холодную воду, образуется эластичная, во многом похожая на резину масса. Ее можно получить и в виде нитей. Но проходит несколько дней, и масса перекристаллизуется, становится жесткой и ломкой.
Молекулы кристаллов серы всегда состоят из восьми атомов (S8), а различие в свойствах модификаций серы объясняется полиморфизмом — неодинаковым строением кристаллов. Атомы в молекуле серы построены в замкнутый цикл
S-S-S
/ \
S S
\ /
S-S-S
При плавлении связи в цикле рвутся, и циклические молекулы превращаются в линейные.
Необычному поведению серь при плавлении даются различные толкования. Одно из них — такое. При температуре от 155 до 187°, по-видимому, происходит значительный рост молекулярного веса, это подтверждается многократным увеличением вязкости. При 187° С вязкость расплава достигает чуть ли ни тысячи пуаз, получается почти твердое вещество. Дальнейший рост температуры приводит к уменьшению вязкости (молекулярный вес падает). При 300° С сера вновь переходит в текучее состояние, а при 444,6° С закипает.
У паров серы с повышением температуры число атомов в молекуле постепенно уменьшается:
S8 —> S6—> S4 —>S2. При 1700°С пары серы одноатомны.
Коротко о соединениях серы
По распространенности элемент, № 16 занимает -15-е место. Содержание серы в земной коре составляет 0,05% по весу. Это немало.
К тому же сера химически активна и вступает' в реакции с большинством элементов. Поэтому в природе сера встречается не только в свободном состоянии, но и в виде разнообразных неорганических соединений. Особенно распространены сульфаты, (главным образом щелочных и щелочноземельных, металлов) и сульфиды (железа, меди, цинка, свинца). Сера есть и в углях, сланцах, нефти, природных газах, в организмах животных и растений.
При взаимодействии серы с металлами, как правило, выделяется довольно много тепла. В реакциях с кислородом сера дает несколько окислов, из них самые важные SО2 и SО3 — ангидриды сернистой Н2SО3 и серной Н2SО4 кислот. Соединение серы с водородом - сероводород Н2S — очень ядовитый, зловонный газ, всегда присутствующий в местах гниения органических остатков. Земная
кора в местах, расположенных близ месторождений серы, часто содержит довольно значительные количества сероводорода. В водном растворе этот газ обладает кислотными свойствами. Хранить его растворы на воздухе нельзя, он окисляется с выделением серы:
2h3S + О2=2Н2О + 2S.
Сероводород — сильный восстановитель. Этим его свойством пользуются во многих химических производствах.
Для чего нужна сера
Среди вещей, окружающих нас, мало таких, для изготовления которых не нужны были бы сера и ее соединения. Бумага и резина, эбонит и спички, ткани и лекарства, косметика и пластмассы, взрывчатка и краска, удобрения и ядохимикаты — вот далеко не полный перечень вещей и веществ, для производства которых нужен элемент № 16. Для того чтобы изготовить, например, автомобиль, нужно израсходовать около 14 кг серы. Можно без преувеличения сказать, что промышленный потенциал страны довольно точно определяется потреблением серы.
Значительную часть мировой добычи серы поглощает бумажная промышленность (соединения серы помогают выделить целлюлозу). Для того чтобы произвести одну тонну целлюлозы, нужно затратить более 100 кг серы. Много элементарной серы потребляет и резиновая промышленность — для вулканизации каучуков.
В сельском хозяйстве сера применяется как в элементарном виде, так и в различных соединениях. Она входит в состав минеральных удобрений и препаратов для борьбы с вредителями. Наряду с фосфором, калием и другими элементами сера необходима растениям. Впрочем, большая часть вносимой в почву серы не усваивается ими, но помогает усваивать фосфор. Серу вводят в почву вместе с фосфоритной мукой. Имеющиеся в почве бактерии окисляют ее, образующиеся серная и сернистая кислоты реагируют с фосфоритами, и в результате получаются фосфорные соединения, хорошо усваиваемые растениями.
Однако основной потребитель серы — химическая промышленность. Примерно половина добываемой в мире серы идет на производство серной кислоты. Чтобы получить одну тонну h3SО4, нужно сжечь около 300 кг серы. А роль серной кислоты: в химической промышленности сравнима с ролью хлеба в нашем питании.
Значительное количество серы (и серной кислоты) расходуется при производстве взрывчатых веществ и спичек. Чистая» освобожденная от примесей сера нужна для производства красителей и светящихся составов.
Соединения серы находят применение в нефтехимической промышленности. В частности, они необходимы при. -производстве антидетонаторов, смазочных веществ для аппаратуры сверхвысоких давлений; в охлаждающих маслах, ускоряющих обработку .металла, содержится иногда до 18% серы.
Перечисление примеров, подтверждающих первостепенную важность элемента № 16, можно было бы продолжить, но «нельзя объять необъятное». Поэтому вскользь упомянем, что сера необходима и таким отраслям промышленности, как горнодобывающая, пищевая, текстильная, и — поставим точку.
* * *
Наш век считается веком «экзотических» материалов — трансурановых элементов, титана, полупроводников , и так далее. Но внешне непритязательный, давно известный элемент № 16 продолжает оставаться абсолютно необходимым. Подсчитано, что в производстве 88 из 150 важнейших химических продуктов используют либо саму серу, либо ее соединения.
Реферат по химии
Тема: «Сера»
Ученицы 9 «ч» класса
Средней школы № 27
Зима Анны
Бишкек 2001г.
superbotanik.net