
Казанский межвузовский инженерный центр
"НОВЫЕ ТЕХНОЛОГИИ"
ГОУ ВПО КГТУ
Контрольная работа.
Теория горения и взрыва
На тему:
"Классификация взрывов по плотности вещества, по типам химических реакций. "
Казань 2011 г.
Оглавление
Введение
Взрывы
Классификация взрывов по плотности вещества два основных типа
Классификация по типам химических реакций
Список используемой литературы
ВведениеГорение - с детства и навсегда поражающий наше воображение феномен природы - несомненно один из важнейших для природы и человеческой практики физико-химических процессов. Греческий миф о Прометее, похитившем огонь у богов и отдавшем его людям, культ огня в других древних мифологиях - своеобразная" поэтическая дань роли огня в возникновении цивилизации.
Научное исследование горения началось в XVIII в, имеете со стремительный распитием химии. Па первоначальном этапе горение определялось как соединение с кислородом горючих веществ (п первую очередь содержащих водород и углерод). Обобщая эту точку зрения, химики формулируют в то время широко известное высказывание: "Жизнь - это медленное горение"; это высказывание остается первым и поныне, поскольку именно соединение с кислородом накопленного растениями горючего служит источником энергии человека и вообще живых существ.
Выяснение химической сущности горения на этом раннем этапе развития пауки подготовило базу для развитии энергетики и термодинамики, поскольку горение - сонорной поставщик газов высокой температуры и энергии, В конце XIX в. интенсивно занимаются важные исследовании химико-термодинамических равновесий и системе Н3-НаО--СО-СО,-С-О,, определяющих в первом приближении температуру, достигаемую при горении углеводородных топлен, и состав продуктов горения газон, твердых и жидких, веществ.
Этап изучения горения и взрывов, начавшийся в конце XIX в. и продолжающийся до настоящего времени, был связан с появлением двигателей внутреннего сгорания, развитием внутренней баллистики артиллерийских орудии и взрывного дела, а в последние десятилетия - с широким внедрением в технику реактивных двигателей. Это во многом стимулировало быстрое развитие науки о горении.
На современном этапе исследований процесса горения н центре внимании стоит вопрос о скорости химического превращения. Сегодня горением и взрывом мы называем быстрое протекание реакции в веществе, которое в исходном состоянии инертно. При этом решающим оказывается выделение тепла и/или активных центров при самой реакции. В современном поминании с понятиями горении, взрыва, пламени, детонации и т, д. связывается характер протекания реакции, а не ел химическое содержание: мы говорим, например, о пламени разложения озонэ 203 - * 30й, хотя в этой реакции выделяется, а не потребляется кислород. Разумеется > полностью научить характер проникания реакции молкни, лишь зная ее элементарные акты, механизм и кинетику химического превращения. Развитие теории горения оказалось, таким образом, тесно связанным - и логически и исторически - с трудами академика Н.Н. Семенова и его школы. Основанный Н. Н, Семеновым Институт химической, физики АН СССР сохраняет ведущее положение и сегодня, когда увеличилось число и расширилась география учреждений, работающих в области горения и взрывов. Отметим имена ушедших из жизни замечательных ученых. На стыке химической кинетики и науки о горении плодотворно работали В.В. Воеводский, А.В. Загулин, А.А. Ковальский, В. Н, Кондратьев.
Рядом с советской школой химической кинетики возникла и советская школа современной науки о горении,
Развитие теории горения привело к формированию некоторых специфических, асимптотических по своей природе понятий и математических методов. Дело в том, что для теории горения типична весьма сильная зависимость скорости химической реакции от температуры. Если подходить к делу с точки зрения численного решения получающихся уравнений, это вызывает затруднения. Но это же обстоятельство обусловливает плодотворность асимптотических подходов. Само основополагающее понятие в теории горения - понятие пламени, распространяющегося с постоянной скоростью, не зависящей от условий поджигания и определяемой только свойствами и состоянием горючей смеси, - представляет собой продукт асимптотического подхода.
Сильная зависимость скорости химической реакции от температуры обусловливает также специфическое для теории горения резкое различие режимов протекания реакции: существование воспламенения, разнообразных критических условий смены режимов, для которых характерна сильная, в пределе скачкообразная зависимость режима от параметров задачи.
Именно эти асимптотические понятия и подходы имеют значение, далеко выходящее за пределы теории горения. Свидетельством этому являются, например, проблемы механики полимеров, разрушения материалов, распространения импульсов по нервным тканям; в этих и во многих других проблемах с большим эффектом использовались методы теории горения.
Интересные постановки задач возникают при диффузионном горении, когда реагирующие вещества первоначально пространственно разделены. В этом случае можно считать в первом приближении, что скорость химической реакции бесконечна, однако для количества сгорающего вещества и для количества тепла, выделяющегося в единицу времени, получаются конечные выражения. При уменьшении скорости реакции толщина зоны растет, но лишь до определенного предела, за которым следует срыв, погасание пламени - один из типичных примеров критических условий в теории горения.
В качестве примера парадоксальной ситуации, с которой часто приходится сталкиваться в теории горения, упомянем вопрос о гидродинамической неустойчивости плоского фронта пламени. Прямой анализ показывает, что тонкий плоский фронт пламени абсолютно неустойчив к пространственным искривлениям, какой бы длины волны они небыли. Этот выдающийся результат принадлежит замечательному советскому физику-теоретику Л.Д. Ландау (независимо и практически одновременно он получен также французским ученым Дарье (С. Вагпеив)). И тем интереснее было выяснение физико-химических и гидродинамических факторов, обеспечивающих устойчивость пламени, которая наблюдается в экспериментах.
Теория горения, как часть математической физики, включает и использует достижения многих родственных наук - теории тепло - и массообмена, газодинамики реагирующих потоков, химической кинетики, турбулентного движения газа и др. Отбирая материал для книги, предлагаемой вниманию читателя, авторы стремились включить в нее вопросы, наиболее полно характеризующие специфику теории горения как с позиции новых любопытных физико-химических и гидродинамических эффектов, так в с точки зрения разработанных в теории новых математических методов, которые могут быть полезны читателю при решении разнообразных задач, даже весьма далеких от теории горения. Именно на эти методы мы хотели обратить внимание читателя, и название книги подчеркивает эту ее особенность: к "теории горения" добавлено определение "математическая". Подчеркнем еще раз, что основной математический факт теории горения заключен в следующем: исходные дифференциальные уравнения молекулярных и макроскопических процессов и химической кинетики имеют непрерывные решения, непрерывным образом зависящие от параметров, начальных и граничных условий. Но при выделении асимптотик возникает скачкообразность решений, их критичность к малому изменению параметров, т.е. характер решения резко изменяется.
ВзрывыВзрывы чаще всего происходят на пожаро- и взрывоопасных объектах, где могут возникнуть условия для образования газо-паровоздушных смесей, пылевоздушных смесей, где в больших количествах применяются углеводородные газы (метан, этан, пропан). Возможны взрывы котлов в котельных, газовой аппаратуры, продукции и полуфабрикатов химических заводов, паров бензина и других компонентов, муки на мельницах, пыли на элеваторах, сахарной пудры на сахарных заводах, древесной пыли на деревообрабатывающих предприятиях.
Могут быть взрывы в жилых помещениях, когда люди забывают выключить газ. Взрывы происходят на газопроводах при плохом контроле за их состоянием и несоблюдении требований техники безопасности при их эксплуатации. К тяжелым последствиям приводят взрывы рудничного газа в шахтах.
Классификация взрывов по плотности вещества два основных типа
Существуют два основных типа взрыва:
1) взрыв конденсированного ВВ
2) объемный взрыв.
1) ВЗРЫВЫ КОНДЕНСИРОВАННЫХ ВВ
Взрывы этого типа вызываются всеми твердыми ВВ и относительно незначительным числом жидких ВВ, включая нитроглицерин. Такие ВВ обычно имеют плотность, лежащую в диапазоне 1,5 - 1,80 г/см3 (т.е.1500 - 1800 кг/м). Однако первичные ВВ, содержащие свинец или ртуть, имеют намного большие плотности.
К физическим взрывам следует отнести также явление так называемой физической (или термической) детонации. Это явление возникает при смешении горячей и холодной жидкостей, когда температура одной из них значительно превышает температуру кипения другой (например, при выливании расплавленного металла в воду). В образовавшейся парожидкостной смеси испарение может протекать взрывным образом вследствие развивающихся процессов тонкой фрагментации капель расплава, быстрого теплоотвода от них и перегрева холодной жидкости. Физическая детонация сопровождается возникновением ударной волны с избыточным давлением в жидкой фазе, достигающим в некоторых случаях тысяч атмосфер. Указанное явление может стать причиной крупных аварий в ядерных реакторах и на промышленных предприятиях металлургической, химической и бумажной промышленности.
2) ОБЪЕМНЫЕ ВЗРЫВЫ
Объемный взрыв в разреженной среде возникает от смесей воздуха и некоторых окисляющихся веществ в виде пыли, аэрозоли или пара. Такие смеси имеют плотность, едва отличимую от плотности воздуха. Объемные взрывы в разреженной среде можно разделить на два класса: ограниченные и неограниченные.
Все взрывы, кроме одного - пылевого, подробно описанного ниже, были ограниченными. В книге [Bartnecht, 1979] приводится фотография неограниченного взрыва 4 кг пигмента, рассеянного в воздухе, но в ней не обсуждаются неограниченные пылевые взрывы. Можно предположить из-за отсутствия противоположных данных, что такие взрывы не имеют широкого распространения.
Известно мало данных (за одним важным исключением) о серьезных взрывах, связанных с аэрозолями, хотя сравнительно небольшие аэрозольные взрывы случаются не так уж редко в системах сжатого воздуха, где аэрозоль представляет собой туман из масляных капелек. Упомянутое исключение - это авария 20 января 1968 г. в Пернисе (Нидерланды), где, согласно [Pernis, 1968], сильный взрыв при очистке масла произошел после зажигания облака пара, содержащего около 50 т углеводородов.
взрыв реакция химическая плотность
Газовые или паровые взрывы могут быть как ограниченными (их большинство), так и неограниченными, когда количество газа/пара достигает по крайней мере 3 т.
Классификация по типам химических реакций
1) РЕАКЦИИ РАЗЛОЖЕНИЯ
Самый простой случай взрыва - это процесс разложения, который дает газообразные продукты. Один из примеров - пероксид водорода, который разлагается со значительной теплотой реакции, давая водяной пар и кислород:
2Н2О2 Н2О + О2 - 23,44 ккал/моль
Как бытовой продукт пироксид водорода продается в виде 3% -ного водного раствора и представляет незначительную опасность. Иначе дело обстоит с пироксидом водорода "высокой пробы", концентрация которого составляет 90% или более. Разложение Н2О2 высокой пробы ускоряется рядом веществ, что используется в качестве реактивного топлива или в газовой турбине для накачки топлива к главным двигателям. Второй пример - это азид свинца, который легко разлагается при трении или ударе:
PbN6 Pb + 3N2 - 115,5 ккал/моль
Азид свинца - это первичное ВВ, или детонатор. Подавляющее большинство ВВ после детонации дает различные продукты. Например, ТНТ высокой плотности (1,59 г/см3) при детонации дает, согласно [Cook. 1966], продукты реакции разложения, указанные в табл.10.2. Надо отметить, что ТНТ является веществом
ТАБЛИЦА 10.2. Продукты разложения ТНТ
| Продукт | CO | CO2 | h3O | N2 | Nh4 | Ch4OH | HCN | C |
| Количество моль/кг | 0,6 | 10,0 | 0,8 | 6,0 | 0,4 | 4,7 | 1 | 14,9 |
С "дефицитом кислорода", и поэтому одним из основных продуктов его распада является углерод. При взрывах ТНТ образуется, таким образом, очень много дыма. Большинство бризантных ВВ (за исключением нитроглицерина) - вещества с дефицитом кислорода, т.е. в их молекулах недостаточно атомов кислорода, чтобы образовался 1 моль СО2 на каждый атом углерода, присутствующий в молекуле, и 1 моль Н2О на каждые два атома водорода. Ряд промышленно важных веществ, не классифицируемых как ВВ, ведет себя сходным образом. Они перечислены в [ECD. 1982]; во многих случаях они являются органическими пероксидами.
На основе законов термохимии можно выявить, будет или нет данное соединение способным к взрыву. Согласно [Stull. 1977], если в данной реакции сумма теплот образования продуктов имеет более низкое значение, чем теплота образования исходного соединения, то тогда это вещество потенциально взрывоопасно.
Таким образом, для реакции
А В + С + D
Должно быть

Где δf - теплота образования. * δf имеет положительное значение для соединений, которые поглощают тепло в процессе образования (эндотермическая реакция), и наоборот, отрицательное значение для соединений, которые выделяют тепло в процессе образования (экзотермическая реакция). Например:

Для составных частей в их обычном молекулярном состоянии, например О2, N2, Н2 (но не О3), δf считается равной нулю.
Следует иметь в виду, что применение термохимии может лишь указать на возможность взрывного процесса, тогда как скорость реакции определяет мощность, т.е. силу эффекта. Реакция между воском свечи и кислородом - это реакция высокоэкзотермическая, но обычно не приводит к взрыву.
2) ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Окислительно-восстановительные реакции, в которых воздух или кислород реагирует с восстановителем, весьма обычны и составляют основу всех реакций горения. В тех случаях, когда восстановитель является недиспергированным твердым веществом или жидкостью, реакции горения протекают недостаточно быстро, чтобы стать взрывными. Если, однако, твердое вещество мелко раздроблено или жидкость находится в виде капелек, то возможен быстрый рост давления. Это, вообще говоря, может привести в условиях замкнутого объема к росту избыточного давления вплоть до 8 бар.
3) РЕАКЦИИ ПОЛИМЕРИЗАЦИИ, ИЗОМЕРИЗАЦИИ И КОНДЕНСАЦИИ
Некоторые вещества могут полимеризоваться более или менее самопроизвольно, и обычные реакции полимеризации будут экзотермическими. Если мономер - летучий, как это часто бывает, достигается стадия, при которой может произойти опасное повышение давления. Иногда полимеризация может протекать только при повышенных температурах, но для некоторых веществ, таких, как этиленоксид, полимеризация может начаться при комнатной температуре, особенно когда исходные соединения загрязняются веществами, ускоряющими полимеризацию. Этиленоксид может также изомеризоваться в ацетальдегид экзотермическим путем:

Эта реакция, а также реакция разложения ацетальдегида с образованием двух молей постоянных газов обсуждаются в работе:

Реакции конденсации весьма распространены. Они особенно широко применяются в производстве красок, лаков и смол, где служат основой процессов в реакторах непрерывного действия со змеевиками для нагрева или охлаждения. Зарегистрировано много примеров неконтролируемых реакций, обусловленных тем, что скорость переноса тепла в таких сосудах является линейной функцией разности температур между реакционной массой и охладителем, тогда как скорость реакции - это экспоненциальная функция температуры реагента. Однако благодаря тому, что скорость выделения тепла, будучи функцией концентрации реагентов, во время протекания реакции уменьшается, нежелательный эффект до некоторой степени компенсируется.
4) РЕАКЦИИ СМЕСЕЙ
Наиболее наглядный пример смеси, которая реагирует со взрывом, - это смесь, известная первоначально под названием "черный порох", а позднее - "дымный порох".
Типичный состав ружейного пороха таков:
| Компонент | Содержание, в % |
|
Нитрат калия (селитра) Древесный уголь Сера |
75 15 10 |
В этой смеси богатая кислородом селитра окисляет углерод и серу.
Аналогичные эффекты характерны для детонации смесей органических соединений с другими окислителями, такими, как перхлораты или хлораты. Некоторые органические вещества, если намочить их в жидком кислороде и подходящим образом инициировать, взрываются. Древесина, намоченная в жидком кислороде, используется для взрывов в минном деле.
Интересно отметить, что высокоэкзотермичная реакция

Не будет сама по себе приводить к взрыву, так как не образуется газообразных продуктов.
Список используемой литературы1. Зельдовичь Я.В. "Математическая теория горения и взрывов"
3. По ссылке: http://www.genon.ru/GetAnswer. aspx? qid=b28d75bd-5415-4dff-8317-55879b42e86e
4. По ссылке: http://www.agps-mipb.ru/index. php/2010-12-23-08-05-07/148-10-3-taksonomiya-vzryvov.
5. По ссылке: http://ru. wikipedia.org/wiki/%C2%E7%F0%FB%E2
www.neuch.ru
Горение - это хим-я реакция окисления, сопров-ся выделением значительного кол-ва тепла и свечением. Для возникновения горения требуется наличие трех факторов: горючего вещества, окислителя (обычно кислород воздуха) и источника загорания (импульса). Окислителем может быть не только кислород, но и хлор, фтор, бром, йод, окислы азота и т.д. В зависимости от свойств горючей смеси горение бывает гомогенным и гетерогенным. Также сущ-ет горение взрывчатых в-в и порохов. При гомогенном горении исходные вещества имеют одинаковое агрегатное состояние (например, горение газов). Горение твердых и жидких горючих веществ является гетерогенным. Горение дифференцируется также по скорости распространения пламени и в зависимости от этого параметра может быть дефлаграционным (порядка десятка метров в секунду), взрывным (порядка сотни метров в секунду) и детонационным (распространяющееся со сверхзвуковыми скоростями, порядка тысячи метров в секунду). Пожарам свойственно дефлаграционное горение (протекающее дозвуковыми скоростями). Вспышка - быстрое сгорание горючей смеси, не сопровождающееся образованием сжатых газов. Воспламенение - возгорание, сопровождающееся появлением пламени. Самовозгорание - явление резкого увеличения скорости экзотермических реакций, приводящее к возникновению горения вещества (материала, смеси) при отсутствии источника зажигания. Виды самовозгорания: тепловое, химическое, микробиологическое. Взрыв - чрезвычайно быстрое химическое (взрывчатое) превращение, сопровождающееся выделением энергии и образованием сжатых газов, способных производить механическую работу. Следует отметить, что на возникновение и развитие процесса горения оказывают влияние ряд физических факторов. Н-р, температура. Скорость большинства реакций (и горения в том числе) с повышением температуры возрастает. Поэтому в помещении с более высокой температурой скорость распространения пожара будет выше, чем в помещении с более низкой температурой. Воздухообмен. С точки зрения физикохимии воздухообмен способствует отводу из зоны горения продуктов реакции и подвода в зону горения свежих реагентов (в частности, кислорода). При этом, естественно, скорость реакции увеличивается. Поверхность реакции. Очевидно, что чем на большей поверхности развивается реакция (горение), тем суммарная скорость реакции в системе выше. Теперь рассмотрим факторы угроз, которые могут вызывать собственно угрозу возникновения пожара.
Горение - это хим-я реакция окисления, сопров-ся выделением значительного кол-ва тепла и свечением.
Цепными наз.реакции, идущие ч/з ряд стадий(промежуточных реакций), в к/х образуются промежуточные соед-я со свободными валентностями, т.наз-е активные центры, являющиеся зародышами последующих быстропротекающих стадий процесса. При освещении смеси водорода с хлором молекула хлора, поглощая квант световой энергии, распадается на атомы: Cl2 + hν = Cl + Cl. Цепные р-и м.б разветвляющиеся и неразветвляющиеся – каждый активный центр вызывает появление только одного нового активного центра, поэтому р-я может продолжаться, но не ускоряться. В разветв-ся цепной р-и каждый активный центр зарождает 2 или более активных центров. Цепные р-и лежат в основе многих хим.процессов, в т.ч окисления и горения.
Р-и окисления горючих в-в при определенных условиях может самопроизвольно ускоряться и переходить в р-ю горения. При тепловом самовоспламенении причиной ускорения р-и окисления и возникновения горения является превышение скорости выделения тепла над скоростью теплоотвода. При низкой температуре смеси р-я м/у горючим газом и кислородом воздуха практически не протекает. Для того чтобы она началась, нужно смесь нагреть до более высокой температуры. Если сосуд и смесь в нем нагреть до температуры окисления начнется хим.р-я окисления с выделением тепла. Как только температура смеси превысит температуру внешней среды, начнется теплоотвод ч/з стенки сосуда в ОС.
Если для процесса зажигания решающими факторами является темп-ра ист-ка зажигания и величина первонач-го нагретого объема, то для процесса самовоспламенения основное знач-е имеют усл-я концентрации тепла. При горении химически неоднородных горючих систем, т.е систем, в к/х гор.в-во и воздух не перемешены и имеют повер-ти раздела(тв.материал и жидкость, струи паров и газов, поступающие в воздух). Время диффузии кислорода к горючему в-ву несоизмеримо больше времени необходимого для протекания хим.р-и. Такое горение наз-ся диффузионным. Все пожары предст-ют собой диффуз-е горение.
studfiles.net
Эссе «Реакции горения»
Горение – это первая химическая реакция, с которой познакомился человек. Огонь… Можно ли представить наше существование без огня? Он вошел в нашу жизнь, стал неотделим от нее. Без огня человек не сварит пищу, сталь, без него невозможно движение транспорта. Огонь стал нашим другом и союзником, символом славных дел, добрых свершений, памятью о минувшем. Пламя, огонь, как одно из проявлений реакции горения, имеет и свое монументальное отражение. Яркий пример – мемориал славы в г. Сыктывкаре. Раз в четыре года в мире происходит событие, сопровождающееся переносом «живого» огня. В знак уважения к основателям олимпиад огонь доставляют из Греции. По традиции один из выдающихся спортсменов доставляет этот
факел на главную арену олимпиады. Об огне сложены
сказки, легенды. В старину люди думали,
что в огне живут маленькие ящерицы – духи огня. А были и такие, которые считали огонь божеством и строили в его честь храмы. Сотни лет горели в этих храмах, не угасая, светильники, посвященные богу огня. Поклонение огню было следствием незнания людьми процесса горения. В наши дни тема реакций горения очень популярна, поскольку в нашей повседневной жизни мы можем встретить много примеров горения, которые естественным образом влекут за собой реакции на этот процесс. Например, когда мы жарим шашлыки на открытом огне или это могут быть пожары. Так всем нам известные торфяные пожары или пожары на производствах. В своем эссе я хочу подробней рассмотреть горение и узнать, приносит ли нам оно пользу или же вред.
Горение — процесс превращения компонентов горючей смеси в продукты сгорания с выделением теплового излучения, света и лучистой энергии. Описать горение можно как бурно идущее окисление, поэтому и реакции горения представляют собой реакции окисления. А вообще горением называется реакция окисления, протекающая с высокой скоростью, которая сопровождается выделением тепла в большом количестве и, как правило, ярким свечением, которое мы называем пламенем. Причина многообразия реакций горения в том, что есть много разнообразных
горючих смесей, а также способов и мест горения. Влияние реакций горения на природу в большинстве случаев отрицательное, как и их влияние на экономику, и здоровье людей. Например, если реакция горения происходит при недостатке кислорода, то образуется угарный газ, который загрязняет природу, также им могут отравиться люди и животные. Также экономика сильно страдает из-за того что приходится выделять отдельную сумму денег для устранения последствия пожаров.
В наши дни реакции горения изучаются в специальных лабораториях. Топливом интересуются такие организации как «Газпром» и «ЛУКОЙЛ» а экологией интересуются такие
организации как «Гринпис». Исследования реакций
горения сложно финансируются, поскольку они могут
быть очень опасными. Как из-за пожаров, так и из-за
того что некоторые не изученные так и изученные продукты
горения могут быть опасны для здоровья и вообще для жизни
рабочих.
Можно определенно точно сказать, что работа с взрывчатыми веществами крайне опасна и сложна. Ведь как уже было сказано выше, продукты горения могут быть опасны для здоровья и вообще для жизни рабочих. Ну а использование моделей невозможно по простой причине того что настолько совершенные материалы еще не были разработаны человечеством.
Для того чтобы решить проблемы связанные с реакциями горения каждый должен начать с себя. Самое простое, что лично я могу сделать – аккуратно обращаться с электроприборами и спичками. Также не следует сжигать легковоспламеняющийся мусор или выкидывать мусор, содержащий радиоактивные или просто вредные и также легковоспламеняющиеся вещества.
Вывод
В ходе ответов на вопросы своего эссе я смогла больше узнать о реакциях горения, например, то, что реакции горения представляют собой реакции окисления, а также что они сопровождаются как правило, ярким свечением то есть пламенем. После проделанной исследовательской работы я могу ответить на поставленный мною вопрос. Реакции горения имеют свои плюсы и минусы. Например, благодаря ним мы можем вырабатывать энергию, но благодаря ним мы можем, и отравится (вдыхая через дыхательные пути). Но без реакций горения мы не можем жить. Реакции горения используются и в других сферах, например, сгорание топлива используется в технике и промышленности. Основной задачей при этом является
достижение максимальной полноты сгорания за заданный промежуток. Используется горение, например, в горном деле - методы разработки различных полезных ископаемых основаны на использовании горючего процесса. Но в определенных природных и геологических условиях явление горения может стать фактором, несущим серьезную опасность. Реальную опасность, например, представляет процесс самовозгорания торфа, приводящий к возникновению эндогенных пожаров.
Источники информации:
http://ru.wikipedia.org/wiki/%D0%93%D0%BE%D1%80%D0%B5%D0%BD%D0%B8%D0%B5
http://www.ngpedia.ru/id386421p1.html
http://fb.ru/article/49517/kak-protekaet-reaktsiya-goreniya
https://sites.google.com/site/himulacom/zvonok-na-urok/8-klass/urok-no23-gorenie-i-medlennoe-okislenie-teplovoj-effekt-himiceskih-reakcij
http://ru.wikipedia.org/wiki/Файл:Streichholz.jpg
stud24.ru
Казанский межвузовский инженерный центр
«НОВЫЕ ТЕХНОЛОГИИ»
ГОУ ВПО КГТУ
Контрольная работа.
Теория горения и взрыва
На тему:
«Классификация взрывов по плотности вещества, по типам химических реакций. „
Казань 2011 г.
Оглавление
Введение
Взрывы
Классификация взрывов по плотности вещества два основных типа
Классификация по типам химических реакций
Список используемой литературы
Горение — с детства и навсегда поражающий наше воображение феномен природы — несомненно один из важнейших для природы и человеческой практики физико-химических процессов. Греческий миф о Прометее, похитившем огонь у богов и отдавшем его людям, культ огня в других древних мифологиях — своеобразная“ поэтическая дань роли огня в возникновении цивилизации.
Научное исследование горения началось в XVIIIв, имеете со стремительный распитием химии. Па первоначальном этапе горение определялось как соединение с кислородом горючих веществ (п первую очередь содержащих водород и углерод). Обобщая эту точку зрения, химики формулируют в то время широко известное высказывание: „Жизнь — это медленное горение“; это высказывание остается первым и поныне, поскольку именно соединение с кислородом накопленного растениями горючего служит источником энергии человека и вообще живых существ.
Выяснение химической сущности горения на этом раннем этапе развития пауки подготовило базу для развитии энергетики и термодинамики, поскольку горение — сонорной поставщик газов высокой температуры и энергии, В конце XIXв. интенсивно занимаются важные исследовании химико-термодинамических равновесий и системе Н3 -На О--СО-СО,-С-О,, определяющих в первом приближении температуру, достигаемую при горении углеводородных топлен, и состав продуктов горения газон, твердых и жидких, веществ.
Этап изучения горения и взрывов, начавшийся в конце XIXв. и продолжающийся до настоящего времени, был связан с появлением двигателей внутреннего сгорания, развитием внутренней баллистики артиллерийских орудии и взрывного дела, а в последние десятилетия — с широким внедрением в технику реактивных двигателей. Это во многом стимулировало быстрое развитие науки о горении.
На современном этапе исследований процесса горения н центре внимании стоит вопрос о скорости химического превращения. Сегодня горением и взрывом мы называем быстрое протекание реакции в веществе, которое в исходном состоянии инертно. При этом решающим оказывается выделение тепла и/или активных центров при самой реакции. В современном поминании с понятиями горении, взрыва, пламени, детонации и т, д. связывается характер протекания реакции, а не ел химическое содержание: мы говорим, например, о пламени разложения озонэ 203 — * 30й, хотя в этой реакции выделяется, а не потребляется кислород. Разумеется > полностью научить характер проникания реакции молкни, лишь зная ее элементарные акты, механизм и кинетику химического превращения. Развитие теории горения оказалось, таким образом, тесно связанным — и логически и исторически — с трудами академика Н.Н. Семенова и его школы. Основанный Н. Н, Семеновым Институт химической, физики АН СССР сохраняет ведущее положение и сегодня, когда увеличилось число и расширилась география учреждений, работающих в области горения и взрывов. Отметим имена ушедших из жизни замечательных ученых. На стыке химической кинетики и науки о горении плодотворно работали В.В. Воеводский, А.В. Загулин, А.А. Ковальский, В. Н, Кондратьев.
Рядом с советской школой химической кинетики возникла и советская школа современной науки о горении,
Развитие теории горения привело к формированию некоторых специфических, асимптотических по своей природе понятий и математических методов. Дело в том, что для теории горения типична весьма сильная зависимость скорости химической реакции от температуры. Если подходить к делу с точки зрения численного решения получающихся уравнений, это вызывает затруднения. Но это же обстоятельство обусловливает плодотворность асимптотических подходов. Само основополагающее понятие в теории горения — понятие пламени, распространяющегося с постоянной скоростью, не зависящей от условий поджигания и определяемой только свойствами и состоянием горючей смеси, — представляет собой продукт асимптотического подхода.
Сильная зависимость скорости химической реакции от температуры обусловливает также специфическое для теории горения резкое различие режимов протекания реакции: существование воспламенения, разнообразных критических условий смены режимов, для которых характерна сильная, в пределе скачкообразная зависимость режима от параметров задачи.
Именно эти асимптотические понятия и подходы имеют значение, далеко выходящее за пределы теории горения. Свидетельством этому являются, например, проблемы механики полимеров, разрушения материалов, распространения импульсов по нервным тканям; в этих и во многих других проблемах с большим эффектом использовались методы теории горения.
Интересные постановки задач возникают при диффузионном горении, когда реагирующие вещества первоначально пространственно разделены. В этом случае можно считать в первом приближении, что скорость химической реакции бесконечна, однако для количества сгорающего вещества и для количества тепла, выделяющегося в единицу времени, получаются конечные выражения. При уменьшении скорости реакции толщина зоны растет, но лишь до определенного предела, за которым следует срыв, погасание пламени — один из типичных примеров критических условий в теории горения.
В качестве примера парадоксальной ситуации, с которой часто приходится сталкиваться в теории горения, упомянем вопрос о гидродинамической неустойчивости плоского фронта пламени. Прямой анализ показывает, что тонкий плоский фронт пламени абсолютно неустойчив к пространственным искривлениям, какой бы длины волны они небыли. Этот выдающийся результат принадлежит замечательному советскому физику-теоретику Л.Д. Ландау (независимо и практически одновременно он получен также французским ученым Дарье (С. Вагпеив)). И тем интереснее было выяснение физико-химических и гидродинамических факторов, обеспечивающих устойчивость пламени, которая наблюдается в экспериментах.
Теория горения, как часть математической физики, включает и использует достижения многих родственных наук — теории тепло — и массообмена, газодинамики реагирующих потоков, химической кинетики, турбулентного движения газа и др. Отбирая материал для книги, предлагаемой вниманию читателя, авторы стремились включить в нее вопросы, наиболее полно характеризующие специфику теории горения как с позиции новых любопытных физико-химических и гидродинамических эффектов, так в с точки зрения разработанных в теории новых математических методов, которые могут быть полезны читателю при решении разнообразных задач, даже весьма далеких от теории горения. Именно на эти методы мы хотели обратить внимание читателя, и название книги подчеркивает эту ее особенность: к „теории горения“ добавлено определение „математическая“. Подчеркнем еще раз, что основной математический факт теории горения заключен в следующем: исходные дифференциальные уравнения молекулярных и макроскопических процессов и химической кинетики имеют непрерывные решения, непрерывным образом зависящие от параметров, начальных и граничных условий. Но при выделении асимптотик возникает скачкообразность решений, их критичность к малому изменению параметров, т.е. характер решения резко изменяется.
Взрывы чаще всего происходят на пожаро- и взрывоопасных объектах, где могут возникнуть условия для образования газо-паровоздушных смесей, пылевоздушных смесей, где в больших количествах применяются углеводородные газы (метан, этан, пропан). Возможны взрывы котлов в котельных, газовой аппаратуры, продукции и полуфабрикатов химических заводов, паров бензина и других компонентов, муки на мельницах, пыли на элеваторах, сахарной пудры на сахарных заводах, древесной пыли на деревообрабатывающих предприятиях.
Могут быть взрывы в жилых помещениях, когда люди забывают выключить газ. Взрывы происходят на газопроводах при плохом контроле за их состоянием и несоблюдении требований техники безопасности при их эксплуатации. К тяжелым последствиям приводят взрывы рудничного газа в шахтах.
Существуют два основных типа взрыва:
1) взрыв конденсированного ВВ
2) объемный взрыв.
1) ВЗРЫВЫ КОНДЕНСИРОВАННЫХ ВВ
Взрывы этого типа вызываются всеми твердыми ВВ и относительно незначительным числом жидких ВВ, включая нитроглицерин. Такие ВВ обычно имеют плотность, лежащую в диапазоне 1,5 — 1,80 г/см3 (т.е.1500 — 1800 кг/м). Однако первичные ВВ, содержащие свинец или ртуть, имеют намного большие плотности.
К физическим взрывам следует отнести также явление так называемой физической (или термической) детонации. Это явление возникает при смешении горячей и холодной жидкостей, когда температура одной из них значительно превышает температуру кипения другой (например, при выливании расплавленного металла в воду). В образовавшейся парожидкостной смеси испарение может протекать взрывным образом вследствие развивающихся процессов тонкой фрагментации капель расплава, быстрого теплоотвода от них и перегрева холодной жидкости. Физическая детонация сопровождается возникновением ударной волны с избыточным давлением в жидкой фазе, достигающим в некоторых случаях тысяч атмосфер. Указанное явление может стать причиной крупных аварий в ядерных реакторах и на промышленных предприятиях металлургической, химической и бумажной промышленности.
2) ОБЪЕМНЫЕ ВЗРЫВЫ
Объемный взрыв в разреженной среде возникает от смесей воздуха и некоторых окисляющихся веществ в виде пыли, аэрозоли или пара. Такие смеси имеют плотность, едва отличимую от плотности воздуха. Объемные взрывы в разреженной среде можно разделить на два класса: ограниченные и неограниченные.
Все взрывы, кроме одного — пылевого, подробно описанного ниже, были ограниченными. В книге [Bartnecht, 1979] приводится фотография неограниченного взрыва 4 кг пигмента, рассеянного в воздухе, но в ней не обсуждаются неограниченные пылевые взрывы. Можно предположить из-за отсутствия противоположных данных, что такие взрывы не имеют широкого распространения.
Известно мало данных (за одним важным исключением) о серьезных взрывах, связанных с аэрозолями, хотя сравнительно небольшие аэрозольные взрывы случаются не так уж редко в системах сжатого воздуха, где аэрозоль представляет собой туман из масляных капелек. Упомянутое исключение — это авария 20 января 1968 г. в Пернисе (Нидерланды), где, согласно [Pernis, 1968], сильный взрыв при очистке масла произошел после зажигания облака пара, содержащего около 50 т углеводородов.
взрыв реакция химическая плотность
Газовые или паровые взрывы могут быть как ограниченными (их большинство), так и неограниченными, когда количество газа/пара достигает по крайней мере 3 т.
1) РЕАКЦИИ РАЗЛОЖЕНИЯ
Самый простой случай взрыва — это процесс разложения, который дает газообразные продукты. Один из примеров — пероксид водорода, который разлагается со значительной теплотой реакции, давая водяной пар и кислород:
2Н2О2 Н2О + О2 — 23,44 ккал/моль
Как бытовой продукт пироксид водорода продается в виде 3% -ного водного раствора и представляет незначительную опасность. Иначе дело обстоит с пироксидом водорода „высокой пробы“, концентрация которого составляет 90% или более. Разложение Н2О2 высокой пробы ускоряется рядом веществ, что используется в качестве реактивного топлива или в газовой турбине для накачки топлива к главным двигателям. Второй пример — это азид свинца, который легко разлагается при трении или ударе:
PbN6 Pb + 3N2 — 115,5 ккал/моль
Азид свинца — это первичное ВВ, или детонатор. Подавляющее большинство ВВ после детонации дает различные продукты. Например, ТНТ высокой плотности (1,59 г/см3) при детонации дает, согласно [Cook. 1966], продукты реакции разложения, указанные в табл.10.2. Надо отметить, что ТНТ является веществом
ТАБЛИЦА 10.2. Продукты разложения ТНТ
| Продукт | CO | CO2 | h3O | N2 | Nh4 | Ch4OH | HCN | C |
| Количество моль/кг | 0,6 | 10,0 | 0,8 | 6,0 | 0,4 | 4,7 | 1 | 14,9 |
С „дефицитом кислорода“, и поэтому одним из основных продуктов его распада является углерод. При взрывах ТНТ образуется, таким образом, очень много дыма. Большинство бризантных ВВ (за исключением нитроглицерина) — вещества с дефицитом кислорода, т.е. в их молекулах недостаточно атомов кислорода, чтобы образовался 1 моль СО2 на каждый атом углерода, присутствующий в молекуле, и 1 моль Н2О на каждые два атома водорода. Ряд промышленно важных веществ, не классифицируемых как ВВ, ведет себя сходным образом. Они перечислены в [ECD. 1982]; во многих случаях они являются органическими пероксидами.
На основе законов термохимии можно выявить, будет или нет данное соединение способным к взрыву. Согласно [Stull. 1977], если в данной реакции сумма теплот образования продуктов имеет более низкое значение, чем теплота образования исходного соединения, то тогда это вещество потенциально взрывоопасно.
Таким образом, для реакции
А В + С + D
Должно быть
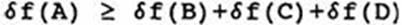
Где δf — теплота образования. * δf имеет положительное значение для соединений, которые поглощают тепло в процессе образования (эндотермическая реакция), и наоборот, отрицательное значение для соединений, которые выделяют тепло в процессе образования (экзотермическая реакция). Например:
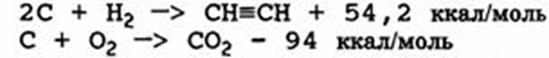
Для составных частей в их обычном молекулярном состоянии, например О2, N2, Н2 (но не О3), δf считается равной нулю.
Следует иметь в виду, что применение термохимии может лишь указать на возможность взрывного процесса, тогда как скорость реакции определяет мощность, т.е. силу эффекта. Реакция между воском свечи и кислородом — это реакция высокоэкзотермическая, но обычно не приводит к взрыву.
2) ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Окислительно-восстановительные реакции, в которых воздух или кислород реагирует с восстановителем, весьма обычны и составляют основу всех реакций горения. В тех случаях, когда восстановитель является недиспергированным твердым веществом или жидкостью, реакции горения протекают недостаточно быстро, чтобы стать взрывными. Если, однако, твердое вещество мелко раздроблено или жидкость находится в виде капелек, то возможен быстрый рост давления. Это, вообще говоря, может привести в условиях замкнутого объема к росту избыточного давления вплоть до 8 бар.
3) РЕАКЦИИ ПОЛИМЕРИЗАЦИИ, ИЗОМЕРИЗАЦИИ И КОНДЕНСАЦИИ
Некоторые вещества могут полимеризоваться более или менее самопроизвольно, и обычные реакции полимеризации будут экзотермическими. Если мономер — летучий, как это часто бывает, достигается стадия, при которой может произойти опасное повышение давления. Иногда полимеризация может протекать только при повышенных температурах, но для некоторых веществ, таких, как этиленоксид, полимеризация может начаться при комнатной температуре, особенно когда исходные соединения загрязняются веществами, ускоряющими полимеризацию. Этиленоксид может также изомеризоваться в ацетальдегид экзотермическим путем:
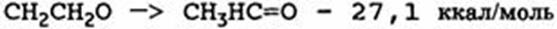
Эта реакция, а также реакция разложения ацетальдегида с образованием двух молей постоянных газов обсуждаются в работе:
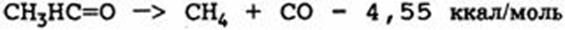
Реакции конденсации весьма распространены. Они особенно широко применяются в производстве красок, лаков и смол, где служат основой процессов в реакторах непрерывного действия со змеевиками для нагрева или охлаждения. Зарегистрировано много примеров неконтролируемых реакций, обусловленных тем, что скорость переноса тепла в таких сосудах является линейной функцией разности температур между реакционной массой и охладителем, тогда как скорость реакции — это экспоненциальная функция температуры реагента. Однако благодаря тому, что скорость выделения тепла, будучи функцией концентрации реагентов, во время протекания реакции уменьшается, нежелательный эффект до некоторой степени компенсируется.
4) РЕАКЦИИ СМЕСЕЙ
Наиболее наглядный пример смеси, которая реагирует со взрывом, — это смесь, известная первоначально под названием „черный порох“, а позднее — »дымный порох".
Типичный состав ружейного пороха таков:
| Компонент | Содержание, в % |
Нитрат калия (селитра) Древесный уголь Сера | 75 15 10 |
В этой смеси богатая кислородом селитра окисляет углерод и серу.
Аналогичные эффекты характерны для детонации смесей органических соединений с другими окислителями, такими, как перхлораты или хлораты. Некоторые органические вещества, если намочить их в жидком кислороде и подходящим образом инициировать, взрываются. Древесина, намоченная в жидком кислороде, используется для взрывов в минном деле.
Интересно отметить, что высокоэкзотермичная реакция
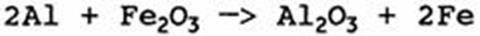
Не будет сама по себе приводить к взрыву, так как не образуется газообразных продуктов.
1. Зельдовичь Я.В. «Математическая теория горения и взрывов»
3. По ссылке: www.genon.ru/GetAnswer. aspx? qid=b28d75bd-5415-4dff-8317-55879b42e86e
4. По ссылке: www.agps-mipb.ru/index. php/2010-12-23-08-05-07/148-10-3-taksonomiya-vzryvov.
5. По ссылке: ru. wikipedia.org/wiki/%C2%E7%F0%FB%E2
www.ronl.ru
Казанский межвузовский инженерный центр
«НОВЫЕ ТЕХНОЛОГИИ»
ГОУ ВПО КГТУ
Контрольная работа.
Теория горения и взрыва
На тему:
«Классификация взрывов по плотности вещества, по типам химических реакций. „
Казань 2011 г.
Оглавление
Введение
Взрывы
Классификация взрывов по плотности вещества два основных типа
Классификация по типам химических реакций
Список используемой литературы
Горение — с детства и навсегда поражающий наше воображение феномен природы — несомненно один из важнейших для природы и человеческой практики физико-химических процессов. Греческий миф о Прометее, похитившем огонь у богов и отдавшем его людям, культ огня в других древних мифологиях — своеобразная“ поэтическая дань роли огня в возникновении цивилизации.
Научное исследование горения началось в XVIIIв, имеете со стремительный распитием химии. Па первоначальном этапе горение определялось как соединение с кислородом горючих веществ (п первую очередь содержащих водород и углерод). Обобщая эту точку зрения, химики формулируют в то время широко известное высказывание: „Жизнь — это медленное горение“; это высказывание остается первым и поныне, поскольку именно соединение с кислородом накопленного растениями горючего служит источником энергии человека и вообще живых существ.
Выяснение химической сущности горения на этом раннем этапе развития пауки подготовило базу для развитии энергетики и термодинамики, поскольку горение — сонорной поставщик газов высокой температуры и энергии, В конце XIXв. интенсивно занимаются важные исследовании химико-термодинамических равновесий и системе Н3 -На О--СО-СО,-С-О,, определяющих в первом приближении температуру, достигаемую при горении углеводородных топлен, и состав продуктов горения газон, твердых и жидких, веществ.
Этап изучения горения и взрывов, начавшийся в конце XIXв. и продолжающийся до настоящего времени, был связан с появлением двигателей внутреннего сгорания, развитием внутренней баллистики артиллерийских орудии и взрывного дела, а в последние десятилетия — с широким внедрением в технику реактивных двигателей. Это во многом стимулировало быстрое развитие науки о горении.
На современном этапе исследований процесса горения н центре внимании стоит вопрос о скорости химического превращения. Сегодня горением и взрывом мы называем быстрое протекание реакции в веществе, которое в исходном состоянии инертно. При этом решающим оказывается выделение тепла и/или активных центров при самой реакции. В современном поминании с понятиями горении, взрыва, пламени, детонации и т, д. связывается характер протекания реакции, а не ел химическое содержание: мы говорим, например, о пламени разложения озонэ 203 — * 30й, хотя в этой реакции выделяется, а не потребляется кислород. Разумеется > полностью научить характер проникания реакции молкни, лишь зная ее элементарные акты, механизм и кинетику химического превращения. Развитие теории горения оказалось, таким образом, тесно связанным — и логически и исторически — с трудами академика Н.Н. Семенова и его школы. Основанный Н. Н, Семеновым Институт химической, физики АН СССР сохраняет ведущее положение и сегодня, когда увеличилось число и расширилась география учреждений, работающих в области горения и взрывов. Отметим имена ушедших из жизни замечательных ученых. На стыке химической кинетики и науки о горении плодотворно работали В.В. Воеводский, А.В. Загулин, А.А. Ковальский, В. Н, Кондратьев.
Рядом с советской школой химической кинетики возникла и советская школа современной науки о горении,
Развитие теории горения привело к формированию некоторых специфических, асимптотических по своей природе понятий и математических методов. Дело в том, что для теории горения типична весьма сильная зависимость скорости химической реакции от температуры. Если подходить к делу с точки зрения численного решения получающихся уравнений, это вызывает затруднения. Но это же обстоятельство обусловливает плодотворность асимптотических подходов. Само основополагающее понятие в теории горения — понятие пламени, распространяющегося с постоянной скоростью, не зависящей от условий поджигания и определяемой только свойствами и состоянием горючей смеси, — представляет собой продукт асимптотического подхода.
Сильная зависимость скорости химической реакции от температуры обусловливает также специфическое для теории горения резкое различие режимов протекания реакции: существование воспламенения, разнообразных критических условий смены режимов, для которых характерна сильная, в пределе скачкообразная зависимость режима от параметров задачи.
Именно эти асимптотические понятия и подходы имеют значение, далеко выходящее за пределы теории горения. Свидетельством этому являются, например, проблемы механики полимеров, разрушения материалов, распространения импульсов по нервным тканям; в этих и во многих других проблемах с большим эффектом использовались методы теории горения.
Интересные постановки задач возникают при диффузионном горении, когда реагирующие вещества первоначально пространственно разделены. В этом случае можно считать в первом приближении, что скорость химической реакции бесконечна, однако для количества сгорающего вещества и для количества тепла, выделяющегося в единицу времени, получаются конечные выражения. При уменьшении скорости реакции толщина зоны растет, но лишь до определенного предела, за которым следует срыв, погасание пламени — один из типичных примеров критических условий в теории горения.
В качестве примера парадоксальной ситуации, с которой часто приходится сталкиваться в теории горения, упомянем вопрос о гидродинамической неустойчивости плоского фронта пламени. Прямой анализ показывает, что тонкий плоский фронт пламени абсолютно неустойчив к пространственным искривлениям, какой бы длины волны они небыли. Этот выдающийся результат принадлежит замечательному советскому физику-теоретику Л.Д. Ландау (независимо и практически одновременно он получен также французским ученым Дарье (С. Вагпеив)). И тем интереснее было выяснение физико-химических и гидродинамических факторов, обеспечивающих устойчивость пламени, которая наблюдается в экспериментах.
Теория горения, как часть математической физики, включает и использует достижения многих родственных наук — теории тепло — и массообмена, газодинамики реагирующих потоков, химической кинетики, турбулентного движения газа и др. Отбирая материал для книги, предлагаемой вниманию читателя, авторы стремились включить в нее вопросы, наиболее полно характеризующие специфику теории горения как с позиции новых любопытных физико-химических и гидродинамических эффектов, так в с точки зрения разработанных в теории новых математических методов, которые могут быть полезны читателю при решении разнообразных задач, даже весьма далеких от теории горения. Именно на эти методы мы хотели обратить внимание читателя, и название книги подчеркивает эту ее особенность: к „теории горения“ добавлено определение „математическая“. Подчеркнем еще раз, что основной математический факт теории горения заключен в следующем: исходные дифференциальные уравнения молекулярных и макроскопических процессов и химической кинетики имеют непрерывные решения, непрерывным образом зависящие от параметров, начальных и граничных условий. Но при выделении асимптотик возникает скачкообразность решений, их критичность к малому изменению параметров, т.е. характер решения резко изменяется.
Взрывы чаще всего происходят на пожаро- и взрывоопасных объектах, где могут возникнуть условия для образования газо-паровоздушных смесей, пылевоздушных смесей, где в больших количествах применяются углеводородные газы (метан, этан, пропан). Возможны взрывы котлов в котельных, газовой аппаратуры, продукции и полуфабрикатов химических заводов, паров бензина и других компонентов, муки на мельницах, пыли на элеваторах, сахарной пудры на сахарных заводах, древесной пыли на деревообрабатывающих предприятиях.
Могут быть взрывы в жилых помещениях, когда люди забывают выключить газ. Взрывы происходят на газопроводах при плохом контроле за их состоянием и несоблюдении требований техники безопасности при их эксплуатации. К тяжелым последствиям приводят взрывы рудничного газа в шахтах.
Существуют два основных типа взрыва:
1) взрыв конденсированного ВВ
2) объемный взрыв.
1) ВЗРЫВЫ КОНДЕНСИРОВАННЫХ ВВ
Взрывы этого типа вызываются всеми твердыми ВВ и относительно незначительным числом жидких ВВ, включая нитроглицерин. Такие ВВ обычно имеют плотность, лежащую в диапазоне 1,5 — 1,80 г/см3 (т.е.1500 — 1800 кг/м). Однако первичные ВВ, содержащие свинец или ртуть, имеют намного большие плотности.
К физическим взрывам следует отнести также явление так называемой физической (или термической) детонации. Это явление возникает при смешении горячей и холодной жидкостей, когда температура одной из них значительно превышает температуру кипения другой (например, при выливании расплавленного металла в воду). В образовавшейся парожидкостной смеси испарение может протекать взрывным образом вследствие развивающихся процессов тонкой фрагментации капель расплава, быстрого теплоотвода от них и перегрева холодной жидкости. Физическая детонация сопровождается возникновением ударной волны с избыточным давлением в жидкой фазе, достигающим в некоторых случаях тысяч атмосфер. Указанное явление может стать причиной крупных аварий в ядерных реакторах и на промышленных предприятиях металлургической, химической и бумажной промышленности.
2) ОБЪЕМНЫЕ ВЗРЫВЫ
Объемный взрыв в разреженной среде возникает от смесей воздуха и некоторых окисляющихся веществ в виде пыли, аэрозоли или пара. Такие смеси имеют плотность, едва отличимую от плотности воздуха. Объемные взрывы в разреженной среде можно разделить на два класса: ограниченные и неограниченные.
Все взрывы, кроме одного — пылевого, подробно описанного ниже, были ограниченными. В книге [Bartnecht, 1979] приводится фотография неограниченного взрыва 4 кг пигмента, рассеянного в воздухе, но в ней не обсуждаются неограниченные пылевые взрывы. Можно предположить из-за отсутствия противоположных данных, что такие взрывы не имеют широкого распространения.
Известно мало данных (за одним важным исключением) о серьезных взрывах, связанных с аэрозолями, хотя сравнительно небольшие аэрозольные взрывы случаются не так уж редко в системах сжатого воздуха, где аэрозоль представляет собой туман из масляных капелек. Упомянутое исключение — это авария 20 января 1968 г. в Пернисе (Нидерланды), где, согласно [Pernis, 1968], сильный взрыв при очистке масла произошел после зажигания облака пара, содержащего около 50 т углеводородов.
взрыв реакция химическая плотность
Газовые или паровые взрывы могут быть как ограниченными (их большинство), так и неограниченными, когда количество газа/пара достигает по крайней мере 3 т.
1) РЕАКЦИИ РАЗЛОЖЕНИЯ
Самый простой случай взрыва — это процесс разложения, который дает газообразные продукты. Один из примеров — пероксид водорода, который разлагается со значительной теплотой реакции, давая водяной пар и кислород:
2Н2О2 Н2О + О2 — 23,44 ккал/моль
Как бытовой продукт пироксид водорода продается в виде 3% -ного водного раствора и представляет незначительную опасность. Иначе дело обстоит с пироксидом водорода „высокой пробы“, концентрация которого составляет 90% или более. Разложение Н2О2 высокой пробы ускоряется рядом веществ, что используется в качестве реактивного топлива или в газовой турбине для накачки топлива к главным двигателям. Второй пример — это азид свинца, который легко разлагается при трении или ударе:
PbN6 Pb + 3N2 — 115,5 ккал/моль
Азид свинца — это первичное ВВ, или детонатор. Подавляющее большинство ВВ после детонации дает различные продукты. Например, ТНТ высокой плотности (1,59 г/см3) при детонации дает, согласно [Cook. 1966], продукты реакции разложения, указанные в табл.10.2. Надо отметить, что ТНТ является веществом
ТАБЛИЦА 10.2. Продукты разложения ТНТ
| Продукт | CO | CO2 | h3O | N2 | Nh4 | Ch4OH | HCN | C |
| Количество моль/кг | 0,6 | 10,0 | 0,8 | 6,0 | 0,4 | 4,7 | 1 | 14,9 |
С „дефицитом кислорода“, и поэтому одним из основных продуктов его распада является углерод. При взрывах ТНТ образуется, таким образом, очень много дыма. Большинство бризантных ВВ (за исключением нитроглицерина) — вещества с дефицитом кислорода, т.е. в их молекулах недостаточно атомов кислорода, чтобы образовался 1 моль СО2 на каждый атом углерода, присутствующий в молекуле, и 1 моль Н2О на каждые два атома водорода. Ряд промышленно важных веществ, не классифицируемых как ВВ, ведет себя сходным образом. Они перечислены в [ECD. 1982]; во многих случаях они являются органическими пероксидами.
На основе законов термохимии можно выявить, будет или нет данное соединение способным к взрыву. Согласно [Stull. 1977], если в данной реакции сумма теплот образования продуктов имеет более низкое значение, чем теплота образования исходного соединения, то тогда это вещество потенциально взрывоопасно.
Таким образом, для реакции
А В + С + D
Должно быть
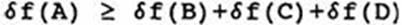
Где δf — теплота образования. * δf имеет положительное значение для соединений, которые поглощают тепло в процессе образования (эндотермическая реакция), и наоборот, отрицательное значение для соединений, которые выделяют тепло в процессе образования (экзотермическая реакция). Например:
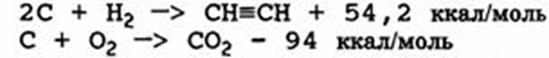
Для составных частей в их обычном молекулярном состоянии, например О2, N2, Н2 (но не О3), δf считается равной нулю.
Следует иметь в виду, что применение термохимии может лишь указать на возможность взрывного процесса, тогда как скорость реакции определяет мощность, т.е. силу эффекта. Реакция между воском свечи и кислородом — это реакция высокоэкзотермическая, но обычно не приводит к взрыву.
2) ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Окислительно-восстановительные реакции, в которых воздух или кислород реагирует с восстановителем, весьма обычны и составляют основу всех реакций горения. В тех случаях, когда восстановитель является недиспергированным твердым веществом или жидкостью, реакции горения протекают недостаточно быстро, чтобы стать взрывными. Если, однако, твердое вещество мелко раздроблено или жидкость находится в виде капелек, то возможен быстрый рост давления. Это, вообще говоря, может привести в условиях замкнутого объема к росту избыточного давления вплоть до 8 бар.
3) РЕАКЦИИ ПОЛИМЕРИЗАЦИИ, ИЗОМЕРИЗАЦИИ И КОНДЕНСАЦИИ
Некоторые вещества могут полимеризоваться более или менее самопроизвольно, и обычные реакции полимеризации будут экзотермическими. Если мономер — летучий, как это часто бывает, достигается стадия, при которой может произойти опасное повышение давления. Иногда полимеризация может протекать только при повышенных температурах, но для некоторых веществ, таких, как этиленоксид, полимеризация может начаться при комнатной температуре, особенно когда исходные соединения загрязняются веществами, ускоряющими полимеризацию. Этиленоксид может также изомеризоваться в ацетальдегид экзотермическим путем:
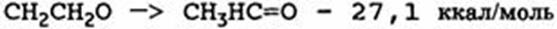
Эта реакция, а также реакция разложения ацетальдегида с образованием двух молей постоянных газов обсуждаются в работе:
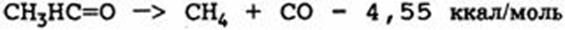
Реакции конденсации весьма распространены. Они особенно широко применяются в производстве красок, лаков и смол, где служат основой процессов в реакторах непрерывного действия со змеевиками для нагрева или охлаждения. Зарегистрировано много примеров неконтролируемых реакций, обусловленных тем, что скорость переноса тепла в таких сосудах является линейной функцией разности температур между реакционной массой и охладителем, тогда как скорость реакции — это экспоненциальная функция температуры реагента. Однако благодаря тому, что скорость выделения тепла, будучи функцией концентрации реагентов, во время протекания реакции уменьшается, нежелательный эффект до некоторой степени компенсируется.
4) РЕАКЦИИ СМЕСЕЙ
Наиболее наглядный пример смеси, которая реагирует со взрывом, — это смесь, известная первоначально под названием „черный порох“, а позднее — »дымный порох".
Типичный состав ружейного пороха таков:
| Компонент | Содержание, в % |
Нитрат калия (селитра) Древесный уголь Сера | 75 15 10 |
В этой смеси богатая кислородом селитра окисляет углерод и серу.
Аналогичные эффекты характерны для детонации смесей органических соединений с другими окислителями, такими, как перхлораты или хлораты. Некоторые органические вещества, если намочить их в жидком кислороде и подходящим образом инициировать, взрываются. Древесина, намоченная в жидком кислороде, используется для взрывов в минном деле.
Интересно отметить, что высокоэкзотермичная реакция
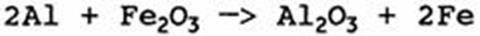
Не будет сама по себе приводить к взрыву, так как не образуется газообразных продуктов.
1. Зельдовичь Я.В. «Математическая теория горения и взрывов»
3. По ссылке: www.genon.ru/GetAnswer. aspx? qid=b28d75bd-5415-4dff-8317-55879b42e86e
4. По ссылке: www.agps-mipb.ru/index. php/2010-12-23-08-05-07/148-10-3-taksonomiya-vzryvov.
5. По ссылке: ru. wikipedia.org/wiki/%C2%E7%F0%FB%E2
www.ronl.ru
Условия возникновения и прекращения горения интересовали человека со времен его первого знакомства с огнем. Что же необходимо для возникновения горения?
Конечно, для этого в первую очередь нужны вещества, между которыми будет происходить реакция, то есть горючее вещество и кислород. Эти вещества должны тесно кон тактировать друг с другом. Однако этого мало. Дрова в печке не загораются сами, хотя и окружены со всех сторон воздухом, содержащим кислород. Их нужно зажечь, то есть довести температуру древесины до такой, при которой начинается ее взаимодействие с кислородом. Для этого совсем не обязательно, чтобы дерево непосредственно контактировало с огнем (рис. 19.3).
Температура воспламенения разных веществ неодинакова. Керосин загорается при 400 °С, сера — при 450 °С, древесная пыль — при 610 °С, белый фосфор — при 45-60 °С (в зависимости от степени его измельчения).
 |
| Рис. 19.3. Добывание огня трением |
Для продолжения начавшегося горения последующее нагревание уже не нужно. Вещество нагревается за счет тепла, которое выделяется при горении. При сжигании любого топлива в процессе горения освобождается скрытая в нем химическая энергия в виде тепла и света.
Чтобы лучина загорелась, мы вводим ее кончик в пламя горелки. В этом месте древесина нагревается до нужной температуры и загорается. Ближайший к огню участок лучины нагревается от тепла, которое выделяется при горении. Процесс распространяется все дальше и дальше, захватывает новые и новые участки. Иногда горючее вещество сильно измельчено, то есть представляет собой тонкий порошок (угольная, сахарная пыль) или находится в виде мелких капель (аэрозоль керосина, бензина). При поджигании таких смесей веществ с воздухом тепло быстро распространяется во все стороны. Вся смесь мгновенно нагревается до температуры воспламенения. Происходит быстрое сгорание — вспышка. Например, тонкая желтая пыльца спор плауна (ликоподий) применяется в фармации для пересыпания пилюль. Кучку этого вещества не всегда удается поджечь спичкой. Зато при распылении ликоподия в воздухе на пламя происходит мгновенная вспышка.
Следовательно, для возникновения горения нужен тесный контакт горючего вещества с воздухом и нагревание до температуры воспламенения. Если хотя бы одно из этих условий не будет выполнено, горение не возникнет. Понятно, что для предотвращения возникновения горения достаточно нарушить хотя бы одно из указанных условий. Материал с сайта http://worldofschool.ru
Чтобы прекратить горение топлива в топках печей или ослабить горение, сокращают приток кислорода, закрывая поддувало.
Условия прекращения горения учитывают и при тушении пожаров. При горении деревянного дома пытаются баграми удалить из огня горючие материалы. Огонь засыпают песком, накрывают плотной тканью, заливают водой, пеной. Вода, попадая на горящее вещество, снижает его температуру. А образовавшийся водяной пар препятствует доступу воздуха.
Наша жизнь невозможна без процессов горения. Поэтому каждому необходимо знать условия возникновения и прекращения горения и приемы безопасного обращения с горючими и огнеопасными веществами.
 На этой странице материал по темам:
На этой странице материал по темам: worldofschool.ru
Казанский межвузовский инженерный центр
«НОВЫЕ ТЕХНОЛОГИИ»
ГОУ ВПО КГТУ
Контрольная работа.
Теория горения и взрыва
На тему:
«Классификация взрывов по плотности вещества, по типам химических реакций. „
Казань 2011 г.
Оглавление
Введение
Взрывы
Классификация взрывов по плотности вещества два основных типа
Классификация по типам химических реакций
Список используемой литературы
Горение — с детства и навсегда поражающий наше воображение феномен природы — несомненно один из важнейших для природы и человеческой практики физико-химических процессов. Греческий миф о Прометее, похитившем огонь у богов и отдавшем его людям, культ огня в других древних мифологиях — своеобразная“ поэтическая дань роли огня в возникновении цивилизации.
Научное исследование горения началось в XVIIIв, имеете со стремительный распитием химии. Па первоначальном этапе горение определялось как соединение с кислородом горючих веществ (п первую очередь содержащих водород и углерод). Обобщая эту точку зрения, химики формулируют в то время широко известное высказывание: „Жизнь — это медленное горение“; это высказывание остается первым и поныне, поскольку именно соединение с кислородом накопленного растениями горючего служит источником энергии человека и вообще живых существ.
Выяснение химической сущности горения на этом раннем этапе развития пауки подготовило базу для развитии энергетики и термодинамики, поскольку горение — сонорной поставщик газов высокой температуры и энергии, В конце XIXв. интенсивно занимаются важные исследовании химико-термодинамических равновесий и системе Н3 -На О--СО-СО,-С-О,, определяющих в первом приближении температуру, достигаемую при горении углеводородных топлен, и состав продуктов горения газон, твердых и жидких, веществ.
Этап изучения горения и взрывов, начавшийся в конце XIXв. и продолжающийся до настоящего времени, был связан с появлением двигателей внутреннего сгорания, развитием внутренней баллистики артиллерийских орудии и взрывного дела, а в последние десятилетия — с широким внедрением в технику реактивных двигателей. Это во многом стимулировало быстрое развитие науки о горении.
На современном этапе исследований процесса горения н центре внимании стоит вопрос о скорости химического превращения. Сегодня горением и взрывом мы называем быстрое протекание реакции в веществе, которое в исходном состоянии инертно. При этом решающим оказывается выделение тепла и/или активных центров при самой реакции. В современном поминании с понятиями горении, взрыва, пламени, детонации и т, д. связывается характер протекания реакции, а не ел химическое содержание: мы говорим, например, о пламени разложения озонэ 203 — * 30й, хотя в этой реакции выделяется, а не потребляется кислород. Разумеется > полностью научить характер проникания реакции молкни, лишь зная ее элементарные акты, механизм и кинетику химического превращения. Развитие теории горения оказалось, таким образом, тесно связанным — и логически и исторически — с трудами академика Н.Н. Семенова и его школы. Основанный Н. Н, Семеновым Институт химической, физики АН СССР сохраняет ведущее положение и сегодня, когда увеличилось число и расширилась география учреждений, работающих в области горения и взрывов. Отметим имена ушедших из жизни замечательных ученых. На стыке химической кинетики и науки о горении плодотворно работали В.В. Воеводский, А.В. Загулин, А.А. Ковальский, В. Н, Кондратьев.
Рядом с советской школой химической кинетики возникла и советская школа современной науки о горении,
Развитие теории горения привело к формированию некоторых специфических, асимптотических по своей природе понятий и математических методов. Дело в том, что для теории горения типична весьма сильная зависимость скорости химической реакции от температуры. Если подходить к делу с точки зрения численного решения получающихся уравнений, это вызывает затруднения. Но это же обстоятельство обусловливает плодотворность асимптотических подходов. Само основополагающее понятие в теории горения — понятие пламени, распространяющегося с постоянной скоростью, не зависящей от условий поджигания и определяемой только свойствами и состоянием горючей смеси, — представляет собой продукт асимптотического подхода.
Сильная зависимость скорости химической реакции от температуры обусловливает также специфическое для теории горения резкое различие режимов протекания реакции: существование воспламенения, разнообразных критических условий смены режимов, для которых характерна сильная, в пределе скачкообразная зависимость режима от параметров задачи.
Именно эти асимптотические понятия и подходы имеют значение, далеко выходящее за пределы теории горения. Свидетельством этому являются, например, проблемы механики полимеров, разрушения материалов, распространения импульсов по нервным тканям; в этих и во многих других проблемах с большим эффектом использовались методы теории горения.
Интересные постановки задач возникают при диффузионном горении, когда реагирующие вещества первоначально пространственно разделены. В этом случае можно считать в первом приближении, что скорость химической реакции бесконечна, однако для количества сгорающего вещества и для количества тепла, выделяющегося в единицу времени, получаются конечные выражения. При уменьшении скорости реакции толщина зоны растет, но лишь до определенного предела, за которым следует срыв, погасание пламени — один из типичных примеров критических условий в теории горения.
В качестве примера парадоксальной ситуации, с которой часто приходится сталкиваться в теории горения, упомянем вопрос о гидродинамической неустойчивости плоского фронта пламени. Прямой анализ показывает, что тонкий плоский фронт пламени абсолютно неустойчив к пространственным искривлениям, какой бы длины волны они небыли. Этот выдающийся результат принадлежит замечательному советскому физику-теоретику Л.Д. Ландау (независимо и практически одновременно он получен также французским ученым Дарье (С. Вагпеив)). И тем интереснее было выяснение физико-химических и гидродинамических факторов, обеспечивающих устойчивость пламени, которая наблюдается в экспериментах.
Теория горения, как часть математической физики, включает и использует достижения многих родственных наук — теории тепло — и массообмена, газодинамики реагирующих потоков, химической кинетики, турбулентного движения газа и др. Отбирая материал для книги, предлагаемой вниманию читателя, авторы стремились включить в нее вопросы, наиболее полно характеризующие специфику теории горения как с позиции новых любопытных физико-химических и гидродинамических эффектов, так в с точки зрения разработанных в теории новых математических методов, которые могут быть полезны читателю при решении разнообразных задач, даже весьма далеких от теории горения. Именно на эти методы мы хотели обратить внимание читателя, и название книги подчеркивает эту ее особенность: к „теории горения“ добавлено определение „математическая“. Подчеркнем еще раз, что основной математический факт теории горения заключен в следующем: исходные дифференциальные уравнения молекулярных и макроскопических процессов и химической кинетики имеют непрерывные решения, непрерывным образом зависящие от параметров, начальных и граничных условий. Но при выделении асимптотик возникает скачкообразность решений, их критичность к малому изменению параметров, т.е. характер решения резко изменяется.
Взрывы чаще всего происходят на пожаро- и взрывоопасных объектах, где могут возникнуть условия для образования газо-паровоздушных смесей, пылевоздушных смесей, где в больших количествах применяются углеводородные газы (метан, этан, пропан). Возможны взрывы котлов в котельных, газовой аппаратуры, продукции и полуфабрикатов химических заводов, паров бензина и других компонентов, муки на мельницах, пыли на элеваторах, сахарной пудры на сахарных заводах, древесной пыли на деревообрабатывающих предприятиях.
Могут быть взрывы в жилых помещениях, когда люди забывают выключить газ. Взрывы происходят на газопроводах при плохом контроле за их состоянием и несоблюдении требований техники безопасности при их эксплуатации. К тяжелым последствиям приводят взрывы рудничного газа в шахтах.
Существуют два основных типа взрыва:
1) взрыв конденсированного ВВ
2) объемный взрыв.
1) ВЗРЫВЫ КОНДЕНСИРОВАННЫХ ВВ
Взрывы этого типа вызываются всеми твердыми ВВ и относительно незначительным числом жидких ВВ, включая нитроглицерин. Такие ВВ обычно имеют плотность, лежащую в диапазоне 1,5 — 1,80 г/см3 (т.е.1500 — 1800 кг/м). Однако первичные ВВ, содержащие свинец или ртуть, имеют намного большие плотности.
К физическим взрывам следует отнести также явление так называемой физической (или термической) детонации. Это явление возникает при смешении горячей и холодной жидкостей, когда температура одной из них значительно превышает температуру кипения другой (например, при выливании расплавленного металла в воду). В образовавшейся парожидкостной смеси испарение может протекать взрывным образом вследствие развивающихся процессов тонкой фрагментации капель расплава, быстрого теплоотвода от них и перегрева холодной жидкости. Физическая детонация сопровождается возникновением ударной волны с избыточным давлением в жидкой фазе, достигающим в некоторых случаях тысяч атмосфер. Указанное явление может стать причиной крупных аварий в ядерных реакторах и на промышленных предприятиях металлургической, химической и бумажной промышленности.
2) ОБЪЕМНЫЕ ВЗРЫВЫ
Объемный взрыв в разреженной среде возникает от смесей воздуха и некоторых окисляющихся веществ в виде пыли, аэрозоли или пара. Такие смеси имеют плотность, едва отличимую от плотности воздуха. Объемные взрывы в разреженной среде можно разделить на два класса: ограниченные и неограниченные.
Все взрывы, кроме одного — пылевого, подробно описанного ниже, были ограниченными. В книге [Bartnecht, 1979] приводится фотография неограниченного взрыва 4 кг пигмента, рассеянного в воздухе, но в ней не обсуждаются неограниченные пылевые взрывы. Можно предположить из-за отсутствия противоположных данных, что такие взрывы не имеют широкого распространения.
Известно мало данных (за одним важным исключением) о серьезных взрывах, связанных с аэрозолями, хотя сравнительно небольшие аэрозольные взрывы случаются не так уж редко в системах сжатого воздуха, где аэрозоль представляет собой туман из масляных капелек. Упомянутое исключение — это авария 20 января 1968 г. в Пернисе (Нидерланды), где, согласно [Pernis, 1968], сильный взрыв при очистке масла произошел после зажигания облака пара, содержащего около 50 т углеводородов.
взрыв реакция химическая плотность
Газовые или паровые взрывы могут быть как ограниченными (их большинство), так и неограниченными, когда количество газа/пара достигает по крайней мере 3 т.
1) РЕАКЦИИ РАЗЛОЖЕНИЯ
Самый простой случай взрыва — это процесс разложения, который дает газообразные продукты. Один из примеров — пероксид водорода, который разлагается со значительной теплотой реакции, давая водяной пар и кислород:
2Н2О2 Н2О + О2 — 23,44 ккал/моль
Как бытовой продукт пироксид водорода продается в виде 3% -ного водного раствора и представляет незначительную опасность. Иначе дело обстоит с пироксидом водорода „высокой пробы“, концентрация которого составляет 90% или более. Разложение Н2О2 высокой пробы ускоряется рядом веществ, что используется в качестве реактивного топлива или в газовой турбине для накачки топлива к главным двигателям. Второй пример — это азид свинца, который легко разлагается при трении или ударе:
PbN6 Pb + 3N2 — 115,5 ккал/моль
Азид свинца — это первичное ВВ, или детонатор. Подавляющее большинство ВВ после детонации дает различные продукты. Например, ТНТ высокой плотности (1,59 г/см3) при детонации дает, согласно [Cook. 1966], продукты реакции разложения, указанные в табл.10.2. Надо отметить, что ТНТ является веществом
ТАБЛИЦА 10.2. Продукты разложения ТНТ
| Продукт | CO | CO2 | h3O | N2 | Nh4 | Ch4OH | HCN | C |
| Количество моль/кг | 0,6 | 10,0 | 0,8 | 6,0 | 0,4 | 4,7 | 1 | 14,9 |
С „дефицитом кислорода“, и поэтому одним из основных продуктов его распада является углерод. При взрывах ТНТ образуется, таким образом, очень много дыма. Большинство бризантных ВВ (за исключением нитроглицерина) — вещества с дефицитом кислорода, т.е. в их молекулах недостаточно атомов кислорода, чтобы образовался 1 моль СО2 на каждый атом углерода, присутствующий в молекуле, и 1 моль Н2О на каждые два атома водорода. Ряд промышленно важных веществ, не классифицируемых как ВВ, ведет себя сходным образом. Они перечислены в [ECD. 1982]; во многих случаях они являются органическими пероксидами.
На основе законов термохимии можно выявить, будет или нет данное соединение способным к взрыву. Согласно [Stull. 1977], если в данной реакции сумма теплот образования продуктов имеет более низкое значение, чем теплота образования исходного соединения, то тогда это вещество потенциально взрывоопасно.
Таким образом, для реакции
А В + С + D
Должно быть
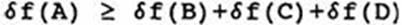
Где δf — теплота образования. * δf имеет положительное значение для соединений, которые поглощают тепло в процессе образования (эндотермическая реакция), и наоборот, отрицательное значение для соединений, которые выделяют тепло в процессе образования (экзотермическая реакция). Например:
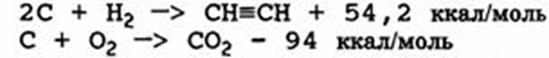
Для составных частей в их обычном молекулярном состоянии, например О2, N2, Н2 (но не О3), δf считается равной нулю.
Следует иметь в виду, что применение термохимии может лишь указать на возможность взрывного процесса, тогда как скорость реакции определяет мощность, т.е. силу эффекта. Реакция между воском свечи и кислородом — это реакция высокоэкзотермическая, но обычно не приводит к взрыву.
2) ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Окислительно-восстановительные реакции, в которых воздух или кислород реагирует с восстановителем, весьма обычны и составляют основу всех реакций горения. В тех случаях, когда восстановитель является недиспергированным твердым веществом или жидкостью, реакции горения протекают недостаточно быстро, чтобы стать взрывными. Если, однако, твердое вещество мелко раздроблено или жидкость находится в виде капелек, то возможен быстрый рост давления. Это, вообще говоря, может привести в условиях замкнутого объема к росту избыточного давления вплоть до 8 бар.
3) РЕАКЦИИ ПОЛИМЕРИЗАЦИИ, ИЗОМЕРИЗАЦИИ И КОНДЕНСАЦИИ
Некоторые вещества могут полимеризоваться более или менее самопроизвольно, и обычные реакции полимеризации будут экзотермическими. Если мономер — летучий, как это часто бывает, достигается стадия, при которой может произойти опасное повышение давления. Иногда полимеризация может протекать только при повышенных температурах, но для некоторых веществ, таких, как этиленоксид, полимеризация может начаться при комнатной температуре, особенно когда исходные соединения загрязняются веществами, ускоряющими полимеризацию. Этиленоксид может также изомеризоваться в ацетальдегид экзотермическим путем:
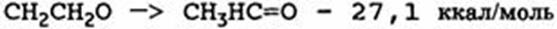
Эта реакция, а также реакция разложения ацетальдегида с образованием двух молей постоянных газов обсуждаются в работе:
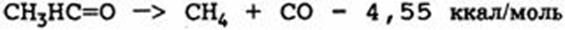
Реакции конденсации весьма распространены. Они особенно широко применяются в производстве красок, лаков и смол, где служат основой процессов в реакторах непрерывного действия со змеевиками для нагрева или охлаждения. Зарегистрировано много примеров неконтролируемых реакций, обусловленных тем, что скорость переноса тепла в таких сосудах является линейной функцией разности температур между реакционной массой и охладителем, тогда как скорость реакции — это экспоненциальная функция температуры реагента. Однако благодаря тому, что скорость выделения тепла, будучи функцией концентрации реагентов, во время протекания реакции уменьшается, нежелательный эффект до некоторой степени компенсируется.
4) РЕАКЦИИ СМЕСЕЙ
Наиболее наглядный пример смеси, которая реагирует со взрывом, — это смесь, известная первоначально под названием „черный порох“, а позднее — »дымный порох".
Типичный состав ружейного пороха таков:
| Компонент | Содержание, в % |
Нитрат калия (селитра) Древесный уголь Сера | 75 15 10 |
В этой смеси богатая кислородом селитра окисляет углерод и серу.
Аналогичные эффекты характерны для детонации смесей органических соединений с другими окислителями, такими, как перхлораты или хлораты. Некоторые органические вещества, если намочить их в жидком кислороде и подходящим образом инициировать, взрываются. Древесина, намоченная в жидком кислороде, используется для взрывов в минном деле.
Интересно отметить, что высокоэкзотермичная реакция
Не будет сама по себе приводить к взрыву, так как не образуется газообразных продуктов.
1. Зельдовичь Я.В. «Математическая теория горения и взрывов»
3. По ссылке: www.genon.ru/GetAnswer. aspx? qid=b28d75bd-5415-4dff-8317-55879b42e86e
4. По ссылке: www.agps-mipb.ru/index. php/2010-12-23-08-05-07/148-10-3-taksonomiya-vzryvov.
5. По ссылке: ru. wikipedia.org/wiki/%C2%E7%F0%FB%E2
www.ronl.ru