 Разработка урока химии в 8 классе по теме «Строение атомов» по программе О.С. Габриеляна.
Разработка урока химии в 8 классе по теме «Строение атомов» по программе О.С. Габриеляна.
Разделы: Химия, Конкурс «Презентация к уроку»
Загрузить презентацию (456,2 кБ)
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Цель урока: создать условия для формирования таких понятий, как атом, орбиталь, изотопы, протон, нейтрон, электрон. Продолжать формировать умение работать с Периодической системой, рассмотреть физический смысл порядкового номера элемента. Познакомить с историей открытия строения атома.
Тип урока: урок усвоения новых знаний.
1. Оргмомент
2. Изучение нового материала.
Ребята, сегодня тема нашего урока: «Строение атома».
1. Информирование
2. Практическая часть.
3. Контроль.
Впервые понятие «атом» ввел Демокрит, но он не вкладывал в него столь глубокий смысл.
Демокрит
В основе философии Демокрита лежит учение об атомах и пустоте как двух принципах, порождающих многообразие космоса. Атом есть мельчайшее «неделимое» тело, не подверженное никаким изменениям. Неделимость атома аналогична неделимости «бытия».
Модель Томсона
Гораздо позже в 1904 году Томсон представил свою новую модель атома. Она представляла собой также равномерно заряженную положительным электричеством сферу, внутри которой вращались отрицательно заряженные корпускулы, число и расположение которых зависело от природы атома. После открытия радиоактивности, эта модель не соответствовала действительности.
Опыт Резерфорда
Резерфорд исследовал особенности прохождения альфа-частиц через тонкие металлические пластинки.
На основании этих опытов ученый предложил планетарную модель атома: в центре атома - ядро, вокруг которого вращаются электроны.
Планетарная модель Резерфорда
Положительный заряд сконцентрирован в ядре атома, а отрицательно заряженные электроны находятся вокруг него
А сейчас ребята, обсудим некоторые термины, запишите их в словарик.
АТОМ - мельчайшая, химически неделимая, частица
ОРБИТАЛИ - место расположения электрона в атоме
Запись а.е.м. – означает атомную единицу массы
В ядре сосредоточена большая часть массы атома
Посмотрите на таблицу.
Строение атома
| частица | место нахождения | масса | заряд |
| Протон P+ | ядро | 1 а.е.м | +1 |
| Нейтрон n0 | ядро | 1а.е.м. | 0 |
| Электрон e- | орбиталь | 0 | -1 |
Порядковый номер элемента:
Число нейтронов N =A r -Z
ИЗОТОПЫ – это атомы одного химического элемента , имеющие одинаковое число протонов и электронов, но разное нейтронов и разные массовые числа.
Практическая часть
Закончи определения
Заполни таблицу
| Ca | Fe | Cu | Cl | |
| p+ | ||||
| e- | ||||
| n0 |
А сейчас ребята выполним небольшой тест
Тестовые задания
Поменяйтесь заданиями с соседом по парте, проверим ответы:
МОЛОДЦЫ! ЭТО ВАМ УДАЛОСЬ!!!
Установите соответствие, соединив стрелками (слайд 17)
МОЛОДЦЫ!!!
Вы справились. Желаю дальнейших успехов в изучении химии!
Домашние задание: параграф 6, 7, упр. 3 стр.24
Поделиться страницей:xn--i1abbnckbmcl9fb.xn--p1ai
 Разработка урока химии в 8 классе по теме «Строение атомов» по программе О.С. Габриеляна.
Разработка урока химии в 8 классе по теме «Строение атомов» по программе О.С. Габриеляна.
Содержание: Атомы как форма существования химических элементов. Основные сведения о строении атомов. Доказательства сложности строения атомов. Опыты Резерфорда. Планетарная модель строения атома. Состав атомных ядер: протоны, нейтроны. Относительная атомная масса. Взаимосвязь понятий «протон», «нейтрон», «относительная атомная масса».
Задачи урока: организовать деятельность учащихся по изучению и первичному закреплению состава и строения атомов химических элементов;
обеспечить понимание сложности вопроса строения атома;
создать условия для развития у школьников представлений об исторической эволюции понятий.
Оборудование: персональный компьютер, мультимедийный проектор, экран.
Лабораторная работа “Анализ содержимого “черного ящика”.
План урока:
1. Постановка цели и задач урока, составление плана работы.
2. Актуализация знаний учащихся:
а) что изучает химия?
б) что называют химической реакцией?
в) перечислите формы существования химического элемента.
г) дайте определение понятия «атом».
3. Изучение нового материала.
Выдающийся физик современности, лауреат Нобелевской премии Роберт Фейнман говорил: «Если бы в результате какой-то мировой катастрофы все накопленные знания вдруг оказались уничтоженными, и к грядущим поколениям живых существ перешла только одна фраза, то какое утверждение, составленное из наименьшего количества слов, принесло бы наибольшую информацию? Я считаю, что это атомная гипотеза: все тела состоят из атомов – маленьких телец, которые находятся в беспрерывном движении, притягиваются на небольшом расстоянии, но отталкиваются, если одно из них плотнее прижать к другому».
Почему утверждение об атомном строении веществ так высоко оценено? Попробуем ответить на этот вопрос.
Вспомним, что понятие «атом» впервые появилось в работах древнегреческих философов Демокрита и Левкипта. Под атомом они понимали мельчайшую частицу вещества (atomos – неделемый). К атомной гипотезе они пришли только на основании размышлений, т.к. в то время люди не владели современными физическими методами исследования.
Если считать атом неделимой частицей, тогда невозможно объяснить образование химических связей в веществах. В ходе химических реакций атомы элементов не изменяются. Сущность химической реакции заключается в разрыве связей в исходных веществах и образовании связей в продуктах реакции. Как атомы соединяются в молекулы? Ответить на этот вопрос можно только в том случае, если изучим строение атомов.
Лабораторная работа “Анализ содержимого “черного ящика”.
Группам учащихся выдаются закрытые “черные ящики”, содержащие некоторую геометрическое тело.
Задание: определить какое тело находится в ящике, его размеры, цвет.
Данная работа показывает сложность познания строения атома.
Предположение о сложном строении атома было высказано на основании результатов нескольких экспериментов. В первую очередь это открытие электрона – частицы, которая переносит электрический ток. Масса электрона оказалась в 1840 раз меньше массы самого легкого атома – атома водорода. Исследования показали, что электрон несет на себе электрический заряд (–1,6∙10–19 Кл), который принят за единицу (–1), т.к. является наименьшим отрицательным зарядом. Условное обозначение электрона .
Следующим шагом в познании атома стало открытие явления радиоактивности. Анри Беккерель обнаружил, что соли урана излучают невидимые лучи, которые вызывают засвечивание фотопластинки. Позднее были установлены три вида радиоактивных лучей. a–лучи представляют собой частицы, масса которых в 4 раза больше массы атома водорода и несущие положительный заряд (+2). b–лучи представляют собой поток электронов, а g–лучи –коротковолновое электромагнитное излучение.
В 1911 году английский физик Эрнест Резерфорд проводил опыты с a–лучами. Он направил поток a–частиц на очень тонкую золотую фольгу, за которой поместил экран. Было установлено, что большая часть a–частиц проходила через фольгу, не изменяя своего направления движения, т.е. не встречая на своем пути препятствий. Но небольшая доля a–частиц отклонялась от прямолинейного пути на различные углы. Самым интересным оказалось то, что приблизительно одна из 10000 a–частиц отскакивала от металлической фольги обратно почти под углом 180°.
Какие выводы сделал Резерфорд? Он предположил, что в атомах большая часть «пустая», а отлетающие обратно a–частицы встречают на своем пути «сгусток» положительно зараженной массы. Этот сгусток был назван ядром атома.
Проанализировав результаты проведенных экспериментов, Резерфорд сделал ряд выводов, которые составили основу планетарной модели строения атома. В центре атома находится положительно заряженное ядро, которое имеет достаточно малые размеры, но в нем заключена почти вся масса, приходящаяся на атом. Вокруг ядра по круговым орбитам двигаются отрицательно заряженные электроны, подобно планетам вокруг Солнца.
Ядро – внутренняя часть атома, имеет положительный заряд и весьма малый объем, но невероятно высокую плотность вещества: 1014–1015 г/см3 (в 1 см3 ~ 100 млн т). Электроны образуют электронную оболочку, которая определяет размеры атома, имеет отрицательный заряд.
Позднее было установлено, что ядро атома состоит из частиц двух видов – протонов ( или р+) и нейтронов ( или n°). Массы этих частиц почти одинаковы, но протон несет на себе единичный положительный заряд, а нейтрон не имеет заряда.
Протоны, нейтроны и электроны определяют важнейшие свойства атома: массу, заряд ядра и заряд электронной оболочки. Масса атома имеет очень маленькое значение. Например, масса атома водорода равна 1,674∙10–24 г, атома кислорода – 2,667∙10–23 г. Принято использовать не абсолютные, а относительные атомные массы, показывающие сколько единиц массы содержит данный атом. В качестве атомной единицы массы (а.е.м.) была выбрана 1/12 массы атома углерода, в ядре которого содержится 6 протонов и 6 нейтронов.
1 а.е.м. = 1,661∙10–24 г
Наряду с относительной атомной массой используют так называемое массовое число (А) – сумму протонов и нейтронов, входящих в состав ядра атома.
Заряд ядра (зарядовое число) обозначается Z. Величина заряда ядра равна числу протонов в атоме. Заряд электронной оболочки равен числу электронов.
Массовое и зарядовое числа используют при обозначении атома: . Например, обозначение говорит о том, что масса атома водорода равна 1, а ядро имеет заряд +1.
Как определить состав атома? Оказалось, что число протонов в ядре атома равно порядковому (атомному) номеру химического элемента в Периодической системе. Так как атом электронейтрален (не имеет заряда), то число протонов равно числу электронов. Число нейтронов равно разности между массой атома и порядковым номером химического элемента в Периодической системе. Например, определим состав и характеристики атома кислорода : 6р+, 6n0, 6е–; Z(ядра) = + 6, Z(эл.об.) = – 6.
Обобщим полученные сведения о частицах, входящих в состав атома:
| Название частиц | |||
| протоны | нейтроны | электроны | |
| обозначение | р+ | n0 | е– |
| масса | 1 | 1 | 0 |
| заряд | +1 | 0 | –1 |
| число протонов равно порядковому номеру элемента. | число нейтронов находят по формуле: N=A–Z | число электронов равно порядковому номеру элемента | |
4. Закрепление изученного на уроке. Коррекция знаний учащихся.
5. Итоги урока.
.pdf (1 130 КБ)
vaskino-sch.ru

Тема урока : "Строение атома".
Архангельская область, Устьянский район, пос.Октябрьский, МОУ "ОСОШ№1" , учитель химии Ржавитина Ольга Львовна.
8 класс

Атом – сложная частица.
Понятие "атом" пришло к нам из далекой античности
( в переводе с греческого "атом" означает " неделимый ").
Этимология названия "неделимый" отражает сущность
атома с точностью до наоборот.

I. Доказательства сложности строения атома.

II. Модели строения атома.
"Сливовый пудинг" Дж. Томсона.
+
Атом уподоблен сферической капле пудинга с положительным зарядом.
-
-
+
+
-
-
+
-
+
+
-
Внутрь сферы вкраплены отрицательно заряженные "сливины" – электроны.
-
-
-
+
+
+
-
-
+
Планетарная модель Резерфорда.
Ядро – "Солнце".
Электроны – "планеты".

Современная модель строения атома.
АТОМ
ЭЛЕКТРОННАЯ ОБОЛОЧКА ( - )
ЯДРО ( + )
НЕЙТРОНЫ
ПРОТОНЫ
ЭЛЕКТРОНЫ
e
n 0
р +
m= 0 заряд -1
m=1 заряд +1
m=1 заряд 0
Вся масса атома сосредоточена в ядре.
Атом электронейтрален, делим и состоит из элементарных частиц.

Н 1
1,00797
водород
порядковый номер
относительная атомная масса
Na 11
22 ,9 898
натрий
Заряд ядра, число протонов в ядре, число электронов в атоме равно порядковому номеру элемента в Периодической системе Д.И.Менделеева.
Число нейтронов определяется по формуле : n 0 = Ar – p +

p + 1
ē 1
n 0 0
p + 11
ē 11
n 0 12
H
Na
Определите число протонов, нейтронов и электронов для атомов:
p +
ē
n 0
8
8
8
О
p +
ē
n 0
p +
ē
n 0
13
13
14
35
35
46
Al
Br

?
Что произойдет, если изменить число протонов в ядре, т.е. заряд атомного ядра ?
Ответ : образуется новый химический элемент.
?
Что произойдет, если изменить число нейтронов в ядре ?
Ответ : это будет тот же химический элемент, но атомы его будут отличаться от исходных своей массой.
Образуются изотопы.
Относительная атомная масса
2
1
3
1
1
1
Н
Н
Н
Заряд ядра

Строение электронных оболочек атомов.
Каждый электрон в атоме обладает запасом энергии ( Е связи).
Электроны, имеющие близкие значения Е связи, образуют энергетические уровни.
Число энергетических уровней в атоме определяется по номеру периода.
энергетические уровни
+
Максимальное число электронов, находящихся на энергетическом уровне, определяется по формуле:
2 n 2 , где n – номер уровня .
2 ē
8 ē
18 ē
32 ē

H +1
He +2
2
1
C +6
O +8
Li +3
1
6
4
2
2
2
Ne +10
Число электронов на внешнем энергетическом уровне равно номеру группы.
8
2

H +1
He +2
2
1
Li +3
C +6
O +8
4
1
6
2
2
2
Если энергетический уровень содержит максимальное число электронов, то он называется завершенным .
Ne +10
8
2

∞
∞
∞
Пространство вокруг ядра атома, где наиболее вероятно нахождение данного электрона, называется орбиталью этого электрона .
Форма орбиталей
P – орбиталь
S – орбиталь
На любой орбитали может быть не более 2 ē .

Электронные формулы.
H +1
1 S 1
число ē на данной орбитали
форма орбитали
№ эн. уровня
1
He +2
1 S 2
2
O +8
1 S 2
2 S 2
2 p 4
6
2

Напишите распределение электронов по энергетическим уровням и электронные формулы для следующих атомов.
P +15
Mg +12
1s 2 2s 2 2p 6 3s 2 3p 3
1s 2 2s 2 2p 6 3s 2
8
2
2
8
2
5
Cl +17
Ar +18
1s 2 2s 2 2p 6 3s 2 3p 5
1s 2 2s 2 2p 6 3s 2 3p 6
8
8
8
2
7
2
Ca +20
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2
2
8
8
2

До новых
встреч !
multiurok.ru
Тип урока: урок изучения нового материала.
Вид урока: интегрированный урок (физика, химия) 8 класс.
Цель урока: изучить строение атома.
Задачи:
Образовательные:
Изучить планетарную модель атома.
Познакомить учащихся с гипотезой Томсона и фундаментальным опытом Резерфорда.
Развивающие:
Отработать навыки определения состава атома, состава ядра атома по периодической системе химических элементов.
Продолжить развитие навыков работы с опорным конспектом, таблицами и схемами.
Развивать интеллектуальные и творческие способности учащихся.
Воспитательные:
Развивать познавательный интерес к предметам.
Показать значение опытных фактов.
Оборудование: мультимедийные пособия по физике и химии; таблица периодической системы химических элементов Д.И.Менделеева; бланк опорного конспекта (у каждого учащегося, см. Приложение).
План урока:
Повторение материала.
Вступительное слово учителя химии, постановка целей урока.
Изложение нового материала.
Отработка изученного материала.
Подведение итогов. Домашнее задание.
1. Фронтальный опрос проводит учитель физики.
Можно ли разделить элементарный электрический заряд на 4?, 3?, 2?
Что можно сказать о величине заряда любого заряженного тела?
Можно ли передать телу заряд величиной 1,6 • 10 – 20 Кл?; 48 •10 – 20 Кл?
^ 2. Учитель химии. Всем известно, что на одну и туже проблему или какой-либо факт, можно взглянуть с различных точек зрения, что вы порой и делаете, даже не подозревая об этом, на уроках химии, физики, биология, географии. Сегодня мы решили объединить уроки химии и физики, чтобы раскрыть строение одной очень маленькой частички - атома. Слово “атом” придумал очень давно более 2500 лет назад древнегреческий философ Демокрит. С греческого “атом” переводится как “неделимый”. Так ли это?
^ 3. Учитель физики. В истории развития физики одна из самых интересных и увлекательных страниц – это история открытия сложного строения атома. В конце XIX- начале XX в. идеи о строении атома витали в воздухе, различные догадки ученых создавали духовную атмосферу, в которой, в конце концов, и рождалось открытие, ведь в то время ничего о внутреннем строении атома не было известно.
Учащийся. (Делает небольшое сообщение о модели атома, предложенной английским физиком Дж. Дж. Томсоном)
“Атом” в переводе с греческого - неделимый. Но после открытия в 1897 г. электрона, входящего в состав атома, был сделан вывод о сложном строении атома. Первая достаточно разработанная модель атома была предложена английским физиком Дж. Дж. Томсоном, открывшим электрон. Согласно этой модели вещество в атоме несет положительный заряд и равномерно заполняет весь объем атома. Электроны “вкраплены” в атом. Предполагалось, что их очень много. В целом атом электрически нейтрален. Для устойчивости атома необходимо, чтобы электроны располагались концентрическими слоями, в каждом слое определенное число электронов. Томсон с помощью данной модели объяснил ряд физических явлений. Например, хорошая проводимость металлов объяснялась тем, что атомы металлов легко теряют часть электронов.
Первая модель атома сыграла положительную роль: в дальнейшем была использована верная идея о слоях электронов в атоме, о потере электронов атомами. Однако скоро обнаружилось несоответствие модели реальной действительности. В частности, модель атома Томсона оказалась в противоречии с результатами опыта Резерфорда”.
^ Учитель физики. Чтобы проверить гипотезу Дж. Дж. Томсона необходимо провести эксперимент. (Просматривается фрагмент об опыте Э.Резерфорда).
Учащийся. (Делает пояснения о планетарной модели атома, вытекающей из опытов Э.Резерфорда по самостоятельно изготовленному плакату)
“В 1909 - 1911 гг. Резерфорд экспериментально доказал, что у атомов есть ядра. В мае 1911 г. на страницах лондонского “философского журнала” он изложил результаты экспериментальных и теоретических поисков в области строения атома. Ядро занимает в атоме ничтожную часть объема, оно положительно заряжено, и в нем сосредоточена почти вся масса атома, так как электроны по сравнению с атомом очень легкие частицы. Электроны движутся вокруг ядра.
Альфа-частицы от радиоактивного источника, пройдя через диафрагму, попадают на тонкую фольгу из золота. Она имеет толщину около микрона, т.е. состоит приблизительно из 3000 атомных слоев. Большая часть альфа-частиц легко проходит через фольгу, мало отклоняясь. Но некоторые, редкие альфа-частицы отклоняются на значительные углы и даже на углы, близкие к 180°, т.е. отбрасываются назад.
Результаты опыта можно объяснить следующим образом. Альфа-частицы, проходя через фольгу, проходят сквозь атомы золота. Это возможно потому, что легкие электроны почти не влияют на движение тяжелой альфа-частицы. Так как они в большинстве случаев отклоняются на малые углы, атомы в большей части своего объема заполнены электронами и лишь небольшую их часть занимает положительно заряженное вещество. Эта центральная часть атома получила название ядра. Из опытов следует, что ядро и отталкивает альфа-частицу, причем тем сильнее, чем ближе к ядру она проходит. По соотношению между общим числом частиц и числом отклонившихся на определенные углы частиц рассчитывается размер ядра и заряд ядра. Оказалось, что радиус ядра имеет порядок 10 - 12 см (10 - 14 м). Заряд же ядра положителен и определяется формулой q = Z•e, где Z - порядковый номер элемента в периодической системе, а е- модуль заряда электрона”.
^ Учитель химии. Таким образом, на сегодня известно точно, что... (учитель - на доске, ребята - в тетради составляют схему-таблицу строения атома).
^ Учитель химии. Строение всех атомов зашифровано в периодической системе химических элементов. Порядковый номер химического элемента показывает электрический заряд ядра атома Z , этот заряд численно равен сумме протонов в ядре атома; т.к. атом в целом электрически нейтральная частица, то суммарный положительный заряд атома равен суммарному отрицательному заряду, следовательно, равен числу электронов в оболочке атома. Чтобы вычислить число нейтронов в ядре из массового числа атома вычитаем заряд ядра:
^ 4. Отработка изученного материала проводится с помощью вопросов, предложенных в мультимедийном пособии, а также:
а) Опроверг ли своими опытами Э. Резерфорд модель атома Томсона?
Какая модель атома вытекает из опытов Э. Резерфорда?
Что принимается за размер атома в планетарной модели атома?
б) задача с выбором ответа:
Опыты Резерфорда по рассеянию альфа-частиц показали:
электрон вращается в атоме по круговой орбите;
альфа-частицы положительно заряжены;
атом не взаимодействует с альфа-частицами;
атом состоит из малого по объему и массивного ядра и легких электронов;
атом состоит из заряженных частей.
Выберете правильный и исчерпывающий ответ.
в) заполняем таблицу вместе с учащимися
г) фронтальный опрос:
Чем отличаются протоны и электроны?
Сходство и различие протонов и нейтронов?
Какой заряд имеет атом меди?
Из чего складывается масса атома?
Предлагаем вашему вниманию сочинение. Как вы думаете, о чём идёт речь в сочинении?:
^ 5. Выполнение тестовой работы на два варианта (задания на рабочем листе у каждого учащегося, работы сдаются для проверки)
6. Подведение итогов: (выставляем оценки, благодарим активных учащихся, ребят, подготовивших интересные сообщения.)
7. Домашнее задание:
по физике: §30;
по химии: §37
Предлагаем ребятам по желанию творческое задание (записано на доске):
1. Используя изученные на уроке термины: атом, ядро, оболочка, протон, нейтрон, электрон; фамилии ученых: Томсон, Резерфорд, составить кроссворд.
2. Нарисовать иллюстрации к прозвучавшему на уроке сочинению.
3. Сочинить историю в любом жанре (сказка, басня, детектив и т.д.): на что по-вашему похож атом?
8. Рефлексия: на рабочих листах ответить на вопрос: Если бы не было открыто строение атома, то……………
Приложение
Тема урока: "Строение атома"
Рабочий лист
1. Демокрит (др. греч.): 2. Модель Дж. Дж. Томсона: «атом» - « ». (дорисуй модель)
3. Планетарная модель атома:
1. - ;
2. - ;
4. Заполни схему: «Состав атома».
химические элементы
ядро
Электроны,
Протоны, p
Нейтроны, n
О
В
Na
Hg
Al
^ Заполни таблицу:
6. В учебнике физики найдите и прочитайте определения положительных и отрицательных ионов. Как образуются положительные и отрицательные ионы?
____________________________________________________________________________________________________________________________________________
Ответьте на вопрос: Что произойдёт с атомом, если изменить количество электронов?
1H0 - 1 → 1H+1 ? _____________________________
1H0 + 1 → 1H-1 ? ____________________________
Частицы, которые получились при отдаче (потере) и принятии (присоединении) и приобрели заряд, называются ___________________
7. Тест
Вариант 1
1. В состав ядра атома углерода входят 6 протонов. Выберите правильное утверждение.
А. В состав ядра атома углерода входят 6 нейтронов.
Б. В состав ядра атома углерода входят 6 электронов.
В. Если атом углерода потеряет один электрон, он превратится в атом другого химического элемента.
Г. Среди утверждений нет правильного.
2. Может ли атом водорода лишиться заряда равного 1,5 заряда электрона? Почему?______________________________________________________________
______________________________________________________________________
3. Атом хлора принял один электрон. Как называется полученная частица? Чему равен её заряд?________________________________________________________
______________________________________________________________________
4. В ядре атома цинка 65 частиц, из них 30 протонов. Сколько нейтронов в ядре и сколько электронов обращается вокруг ядра этого атома?
5. В каком из ниже приведённых случаев можно утверждать, что мы имеем дело с двумя атомами одного и того же химического элемента:
а) в ядрах атомов одинаковое число частиц;
б) в ядрах атомов одинаковое число протонов;
в) в ядрах атомов одинаковое число нейтронов.
8. Выводы:
Закончи предложение:
Если бы не было открыто строение атома, то _______________________
____________________________________________________________________________________________________________________________________
7. Тест
Вариант 2
1. В атоме кремния 14 электронов. Выберите правильное утверждение.
А. В ядре атома кремния 14 частиц.
Б. В ядре атома кремния 14 протонов.
В. Масса положительного иона кремния больше массы атома кремния.
Г. Среди утверждений нет правильного.
2. Существуют ли атомные ядра с зарядом меньшим, чем у одного протона? Почему?
3. Является ли нейтральным атом гелия, если вокруг его ядра обращается один электрон?
4. В ядре атом серебра 107 частиц. Вокруг ядра обращаются 47 электронов. Сколько в ядре этого атома нейтронов и протонов?
5. В результате трения стеклянной палочки о шёлк ей сообщён положительный заряд. Объясните, все ли атомы, из которых состоит заряженная палочка, нейтральны. Почему? Изменилась ли масса стеклянной палочки после сообщения ей положительного заряда? Как? Почему?
8. Выводы:
Закончи предложение:
Если бы не было открыто строение атома, то _______________________
____________________________________________________________________________________________________________________________________
www.ronl.ru
Скачать методическую разработку урока «Химическая связь. Строение атома» в формате doc
Скачать презентацию «Химическая связь. Строение атома» в формате ppt
 Ещё одна разработка урока химии предлагается вниманию посетителей сайта Школьный портал — «Химическая связь. Строение атома». Разработан данный материал и презентация к уроку на основе УМК Габриеляна О.С. План урока отражает нетрадиционную схему, напоминающую путешествие в страну под названием «Периодическая система химических элементов».
Ещё одна разработка урока химии предлагается вниманию посетителей сайта Школьный портал — «Химическая связь. Строение атома». Разработан данный материал и презентация к уроку на основе УМК Габриеляна О.С. План урока отражает нетрадиционную схему, напоминающую путешествие в страну под названием «Периодическая система химических элементов».
Урок проводится ещё в первом полугодии и имеет целью обобщить, а также систематизировать знания по указанной теме, продолжить развитие умения обращения с Периодической системой Менделеева Д.И. и повторить основные понятия. А чтобы темп на уроке был высоким, вносятся элементы, формирующие соревновательный дух, и воспитывающие коллективизм, чувства ответственности за общее дело, так как предполагается работа в группах.
 В ходе мотивации школьников к учебной деятельности учитель сообщает в организационной части занятия о том, что будут на уроке обобщены уже имеющиеся знания по теме "Химическая связь. Строение атома". Учащиеся зачитывают с экрана девиз урока, а затем приступаем к актуализации опорных знаний.
В ходе мотивации школьников к учебной деятельности учитель сообщает в организационной части занятия о том, что будут на уроке обобщены уже имеющиеся знания по теме "Химическая связь. Строение атома". Учащиеся зачитывают с экрана девиз урока, а затем приступаем к актуализации опорных знаний.
Своеобразное «разрешение на въезд» в страну, которая именуется «Периодическая система химических элементов», получат ребята после того, как правильно ответят на вопросы и закончат предложения:• Атом состоит из ...• Электроны заряжены ...• Нейтроны имеют заряд ...• Протоны заряжены ...• Число энергетических уровней равно ...• Заряд ядра равен ...• Количество электронов равно ...• Количество протонов равно ...• Число нейтронов равно ...• Ионы — это ...• Изотопы — это ...• Ковалентная связь — это ...• Ионная связь — это ...• Металлическая связь — это ...• Ковалентная связь бывает ...• Электроотрицательность — это ...
А следующей конкурсной частью урока станет интеллектуальное состязание «Узнай меня», где учащимся требуется записать символы и названия химических элементов, указать порядковый номер, название подгруппы (побочная или главная), номер группы и периода, когда известны количества нейтронов, протонов и электронов:• 6 электронов, 6 нейтронов и 6 протонов (углерод — С)• 13 электронов, 14 нейтронов и 13 протонов (алюминий — Al)• 22 электрона, 26 нейтронов и 22 протона (титан — Ti)• 56 электронов, 81 нейтрон и 56 протонов (барий — Ba)
На следующем этапе урока, автор методической разработки рекомендует дать учащимся 8 класса ещё одно задание «Расскажи обо мне», в котором, следуя плану характеристики, необходимо описать элементы с порядковыми номерами 17, 18 и 20.
Характеристика даётся по следующим критериям: относительная атомная масса элемента, номер группы, периода, количественный заряд ядра, число протонов, нейтронов и электронов, число энергетических уровней, а также число электронов на каждом из энергетических уровней, и сделать запись электронной конфигурации атома.
Физминутка проводится также тематическая в форме эстафеты. Каждая из трёх команд получает задание на доске, где участникам по очереди необходимо возле записи распределения электронов по энергетическим уровням вписать символ химического элемента, а также указать является ли элемент металлом или неметаллом. Эстафетной палочкой в такой физминутке служит мел, который и передают ученики сразу после своей записи.
Следующим конкурсом будет состязание капитанов каждой из команд. Им предстоит проанализировать состав атома и на основе причинно-следственной связи между числом электронов, протонов, общего заряда частиц и вида атома, дать название частицам, схемы электронного строения которых даны на слайде презентации «Строение атома: химия – 8 класс».
 Конкурс «Мои соседи» предлагает каждой команде выполнить задания, демонстрируемые на экране. Первая команда должна расположить химические элементы, предложенные ниже, в порядке усиления их металлических свойств: натрий, калий, литий, рубидий, цезий. Вторая команда школьников располагает элементы в порядке уменьшения их свойств неметаллических: бор, кислород, углерод, азот, фтор. А третья команда должна предложить расположение химических элементов, отражающее уменьшение металлических свойств: алюминий, натрий, магний, рубидий, калий.
Конкурс «Мои соседи» предлагает каждой команде выполнить задания, демонстрируемые на экране. Первая команда должна расположить химические элементы, предложенные ниже, в порядке усиления их металлических свойств: натрий, калий, литий, рубидий, цезий. Вторая команда школьников располагает элементы в порядке уменьшения их свойств неметаллических: бор, кислород, углерод, азот, фтор. А третья команда должна предложить расположение химических элементов, отражающее уменьшение металлических свойств: алюминий, натрий, магний, рубидий, калий.
В заключительной части на экране появляются части предложений, в которых пропущены слова. Их по смыслу и подбирают учащиеся класса, показывая учителю насколько им понятен материал урока обобщения. Подводим итоги и выставляем оценки за урок.
Подробную методическую разработку «Строение атома: химия – 8 класс» можно скачать в начале статьи вместе с презентацией к уроку.
Скачать презентацию «Строение атома: химия — 8 класс»
nashashcola.ru
С помощью данного урока вы узнаете, из чего состоит атом, а также познакомитесь с историей появления и развития представлений о сложном строении атома. На уроке рассматриваются результаты некоторых физических опытов, которые позволили установить состав и строение атома.
Тема: Первоначальные химические представления
Урок: Становление представлений о строении атома
Первые экспериментальные факты, доказывающие сложное строение атома, появились в процессе изучения электрического тока в вакууме. В вакууме, где нет других веществ, кроме материалов катода и анода, может протекать электрический ток, если катод нагреть (Рис. 1). Было установлено, что частицы, испускаемые веществом, из которого сделан катод, имеют отрицательный заряд и очень маленькую массу. Их назвали электронами.
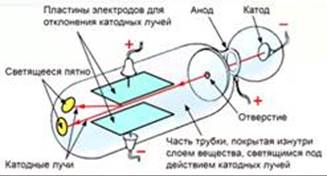
Рис. 1. Прибор Томсона для измерения отклонения катодных лучей под действием электрического тока
Так появилась одна из первых моделей строения атома, которую предложил английский физик Джозеф Томсон (Рис. 2). В соответствии с этой моделью, атом представляет собой шар, состоящий из положительно заряженного вещества с вкраплениями отрицательно заряженных электронов (наподобие изюма в бисквите).

Рис. 2. Модель строения атома, предложенная Дж. Томсоном
Особенность модели Томсона заключалась в предположении того, что положительный заряд «размыт» внутри атома и не «вылетает» из него, т. к. обладает значительно большей массой по сравнению с электронами.
Следующим удивительным экспериментальным фактом было открытие Беккерелем в 1896 г. явления радиоактивности. Было обнаружено, что атомы некоторых элементов самопроизвольно распадаются с образованием новых атомов, электронов и α-частиц. Также установили, что α-частицы имеют положительный заряд и относительно большую массу.
С помощью α-частиц Эрнест Резерфорд и его ученики провели эксперимент, результаты которого опровергли модель строения атома Дж. Томсона. Англичанин Эрнест Резерфорд и его ученики поставили следующий эксперимент: направляли быстрый поток α-частиц на тонкую золотую фольгу. Оказалось, что большинство α-частиц проходит через фольгу беспрепятственно, небольшая часть отклоняется на различные углы, а примерно 1 на 10 000 частиц отскакивает в обратном направлении (Рис. 3).
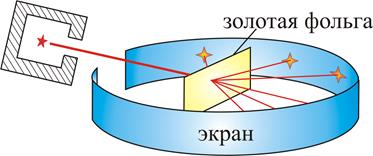
Рис. 3. Схема опыта Э. Резерфорда
Результаты опыта противоречили модели Томсона. Частица с большой массой и положительным зарядом может отскочить назад, если только встретит в качестве препятствия большой положительный заряд, сконцентрированный в одном месте.
Положительный заряд, сконцентрированный в центре атома, Резерфорд назвал ядром и предложил свою модель строения атома: в центре атома находится положительно заряженное ядро, вокруг которого вращаются отрицательно заряженные электроны (Рис.4). При этом основная масса атома сосредоточена в ядре, масса электронов очень мала.
Суммарный заряд ядра и электронов должен быть равен нулю, т. к. атом в целом электронейтрален.
Модель Резерфорда напоминает Солнечную систему, поэтому ее назвали «планетарной».
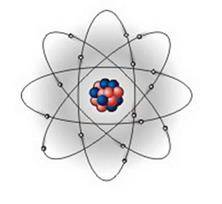
Рис. 4. Планетарная модель атома, предложенная Резерфордом
Порядковый номер элемента в Периодической системе численно равен заряду ядра атома химического элемента. Так как атом в целом заряда не имеет, то и число отрицательно заряженных частиц – электронов – в атоме должно быть тоже равным порядковому номеру.
Существуют атомы с одинаковым зарядом ядра, но разной массой. Такие атомы называются изотопами.
Ядро атома состоит из протонов нейтронов (Рис. 5).
Протон р – элементарная частица, имеющая заряд +1 и относительную массу, равную 1.
Нейтрон n – частица, не имеющая заряда, с относительной массой 1.
Масса атома в основном складывается из суммы масс всех протонов и нейтронов. Массой электронов при расчетах пренебрегают, т. к. она очень мала (масса 1 электрона в 1841 раз меньше массы 1 протона или нейтрона).
Заряд ядра атома определяет число находящихся в нем протонов.
Таким образом, изотопы одного химического элемента различаются между собой числом нейтронов в ядре.
Изотопы – атомы одного химического элемента, различающиеся массой, а значит, числом нейтронов в ядре.

Рис. 5. Состав атома
Список литературы
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
Домашнее задание
interneturok.ru
Урок по химии 8 класс
«Основные сведения о строении атома»
Запольская Елена Николаевна учитель химии и биологии
МБОУ «СОШ№3 г.Мамадыш»
Цель: сформировать представление об истории открытия сложного строения атома, знания об элементарных частицах, входящих в состав атома, атомного ядра, и их основных характеристиках; научить характеризовать строение атома химического элемента на основании его порядкового номера в ПСХЭ Д.И. Менделеева, химический элемент на основе его положения в ПСХЭ Д.И. Менделеева.
Задачи: Обучающая: сформировать у учащихся целостное представление о строении атома
Развивающая: способствовать развитию творческих способностей учащихся, анализировать и перерабатывать полученную информацию в соответствии с поставленными задачами, находить ответы на поставленные вопросы и излагать его.
Воспитывающая: развитие навыков коллективной работы; развитие навыков культуры общения; толерантного отношения друг к другу.
Основные понятия: радиоактивность, планетарная модель атома, протоны, нейроны, массовое число, электроны, электронейтральный атом.
Оборудование: ПСХЭ Д.И. Менделеева, таблица «Строение атома», справочные таблицы.
Ход урока
Организационный момент
Актуализация знаний
Учитель анализирует результаты выполнения учениками проверочной работы №1, акцентирует внимание учащихся на ошибках, допущенных в ней, и объясняет решение некоторых заданий. Предлагает сделать работу над ошибками.
Изучение нового материала
План
История открытия сложного строения атома.
Строение атома.
Планетарная модель атома Э. Резерфорда.
Основные характеристики элементарных частиц, входящих в состав атома, атомного ядра.
Порядковый номер химического элемента в ПСХЭ Д.И. Менделеева и его физический смысл.
Характеристика химического элемента на основе его положения в ПСХЭ Д.И. Менделеева.
- Какие формы существования химического элемента нам известны? (свободные атомы, молекулы простых и сложных веществ)
История открытия сложного строения атома.
Выступления учащихся.
Джозеф Джон Томсон 18.12.1856–30.08.1940
Английский физик, член Лондонского королевского общества. В 1897 году экспериментально доказал существование – электрона, мельчайшей частицы, которая в 2000 раз меньше атома, определил массу и заряд электрона. В 1903–1904 годах выдвинул гипотезу, что атом представляет собой положительно заряженную сферу, внутри которой находятся электроны. Ученые назвали эту модель “пудингом с изюмом”.
Эрнест Резерфорд 30.08.1871–19.11.1937
Английский физик, основоположник ядерной физики, член Лондонского королевского общества. В 1911 году экспериментально обосновал ядерную модель атома: в центре атома находится положительное ядро, а вокруг него вращаются электроны. В 1919 году осуществил опыт, в котором из ядра вылетали ядра водорода, получившие названия протонов, имеющие положительный заряд
Джеймс Чедвик 20.10.1891–24.07.1974
Английский физик – экспериментатор, член Лондонского королевского общества. В 1920 году подтвердил теорию атома Резерфорда и вывод о том, что заряд ядра равен порядковому номеру элемента. В 1932 году обнаружил частицы, которые отличаются от протонов электрическими свойствами, но очень близки к ним по массе и размеру. Он назвал эти частицы нейтронами. И доказал, что ядра атомов тоже делимые! Они состоят из протонов и нейтронов, которые связаны между собой мощным ядерным воздействием.
Приступим к изучению формы существования химического элемента – свободного атома.
Понятие атома означает неделимый. Долгое время считалось, что атом – неделимая, наименьшая частица вещества.
Учащиеся читают текст на с.38 – 39 и рассматривают рис.29. Все эти открытия говорят о сложности строения атома, его делимости.
Учащиеся читают текст на с.40 и рассматривают рис.30.
На основе вышеизложенных фактов можно сделать вывод: атом химического элемента – электронейтральная частица, имеющая следующее строение: в центре атома располагается ядра атома, имеющее положительный заряд, равный порядковому номеру химического элемента. В состав ядра входят частицы: протоны и нейроны. Сумма чисел протонов и нейтронов называют массовыми числами (А). Например, массовое число атома железа: А (Fe) = 56.
Протоны – положительно заряженные частицы, их количество соответствует порядковому номеру (Z) химического элемента. Масса протонов равна 1.
Нейроны – нейтральные частицы, их количество соответствует разности значений массового числа и числа протонов. Масса нейтронов равна 1. Например, число нейтронов в атоме железа: N(Fe) – Z(Fe) = 56 – 26 = 30.
Число электронов и протонов в атоме одинаково и равно порядковому номеру элемента, т.к. атом – электронейтраленая частица.
Учащиеся изучают табл.2 с.41.
Закрепление изученного материала
Учеики по руководством учителя выполняют задания №1, 2, 3 (золото), 4, 5 из учебника с.43.
Подведение итогов урока
Атом имеет сложное строение, напоминающее Солнечную систему и названное Э. Резерфордом планетарной моделью.
Атом – электронейтральная частица, имеющая положительно заряженное ядро и электроны, отрицательно заряженный частицы, вращающиеся с огромной скоростью в пространстве вокруг ядра атома.
Ядро атома состоит и протонов и нейтронов. Протоны – положительно заряженные частицы, масса протона равна 1. Нейрон – нейтральные частицы, масса нейрона равна 1.
Порядковый номер химического элемента в ПСХЭ Д.И. Менделеева имеет определенный физический смысл: соответствует заряду ядра атома, количеству протонов в ядре атома и количеству электронов в атоме; зная атомную массу химического элемента (массовое число А) и его порядковый номер (Z), можно вычислить количество нейронов (N) в ядре атома по формуле: N = A – Z.
План характеристики химического элемента на основе его положения в ПСХЭ Д.И. Менделеева
Номер периода, большой или малый период; номер группы, главная или побочная подгруппа.
Порядковый номер химического элемента.
Заряд ядра атома химического элемента.
Количество протонов и нейтронов в ядре атома химического элемента.
Количество электронов в атоме химического элемента.
Домашнее задание
Параграф 6, выполнить задания №3 (натрий, фосфор), 5 (хар-ка химического элемента №47 на основе его положения в ПСХЭ Д.И. Менделеева) с.43.
kopilkaurokov.ru