|
|
|
|
 Far Far |
 WinNavigator WinNavigator |
 Frigate Frigate |
 Norton
Commander Norton
Commander |
 WinNC WinNC |
 Dos
Navigator Dos
Navigator |
 Servant
Salamander Servant
Salamander |
 Turbo
Browser Turbo
Browser |
|
|
 Winamp,
Skins, Plugins Winamp,
Skins, Plugins |
 Необходимые
Утилиты Необходимые
Утилиты |
 Текстовые
редакторы Текстовые
редакторы |
 Юмор Юмор |
|
|
|
File managers and best utilites |
Гальванические элементы. Аккумуляторы. Реферат на тему гальванический элемент
Читать реферат по физике: "Гальванические элементы. Аккумуляторы"
 (Назад)
(Назад) (Cкачать работу)
(Cкачать работу)
Функция "чтения" служит для ознакомления с работой. Разметка, таблицы и картинки документа могут отображаться неверно или не в полном объёме!
г. Кызыл, ТГУ
РЕФЕРАТ
Тема: "Гальванические элементы. Аккумуляторы."
Составила: Спиридонова В.А.
I курс, IV гр., ФМФ
Проверила: Кендиван О.Д.
2001 г.
СОДЕРЖАНИЕ:
Введение
Гальванические источники тока
Типы гальванических элементов
Аккумуляторы
КислотныеЩелочныеГерметичные никель-кадмиевыеГерметичныеАккумуляторы технологии "DRYFIT"
I
ВВЕДЕНИЕ
Химические источники тока (ХИТ) в течении многих лет
прочно вошли в нашу жизнь. В быту потребитель редко обращает
внимание на отличия используемых ХИТ. Для него это батарейки и
аккумуляторы. Обычно они используются в устройствах таких, как
карманные фонари, игрушки, радиоприемники или автомобили.
В том случае, когда потребляемая мощность относительно
велика (10Ач), используются аккумуляторы, в основном кислотные,
а также никель-железные и никель-кадмиевые. Они применяются в
портативных ЭВМ (Laptop, Notebook, Palmtop), носимых средствах
связи, аварийном освещении и пр.
В последние годы такие аккумуляторы широко применяются в
резервныхисточникахпитанияЭВМи электромеханических
системах, накапливающих энергию для возможных пиковых нагрузок
и аварийного питания электроэнергией жизненно-важных систем.
II
ГАЛЬВАНИЧЕСКИЕ ИСТОЧНИКИ ТОКА
Гальваническиеисточникитокаодноразового действия
представляют собой унифицированныйконтейнер,вкотором
находятсяэлектролит,абсорбируемыйактивнымматериалом
сепаратора, и электроды (анод и катод), поэтому они называются
сухими элементами. Этот термин используется применительно ко
всем элементам, не содержащим жидкого электролита. К обычным
сухимэлементам относятся углеродно-цинковые элементы.
Сухие элементы применяются при малых токах и прерывистых
режимах работы. Поэтому такие элементы широко используются в
телефонных аппаратах, игрушках, системах сигнализации и др.
Действие любого гальванического элемента основано на протекании в нем окислительно-восстановительной реакции. В простейшем случае гальванический элемент состоит из двух пластин или стержней, изготовленных из различных металлов и погруженных в раствор электролита. Такая система делает возможным пространственное разделение окислительно-восстановительной реакции: окисление протекает на одном металле, а восстановление - на другом. Таким образом, электроны передаются от восстановителя к окислителю по внешней цепи.
Рассмотрим в качестве примера медно-цинковый гальванический элемент, работающий за счет энергии приведенной выше реакции между цинком и сульфатом меди. Этот элемент (элемент Якоби-Даниэля) состоит из медной пластины, погруженной в раствор сульфата меди (медный электрод), и цинковой пластины, погруженной в раствор сульфата цинка (цинковый электрод). Оба раствора соприкасаются друг с другом, но для предупреждения смешивания они разделены перегородкой, изготовленной из пористого материала.
При работе элемента, т.е. при замкнутой цепи, цинк окисляется: на поверхности его соприкосновения с раствором атомы цинка превращаются в ионы и, гидратируясь, переходят в раствор. Высвобождающиеся при этом электроны движутся по внешней цепи к медному электроду. Вся совокупность этих процессов схематически изображается уравнением полуреакции, или электрохимическим уравнением:Zn = Zn2+ + 2e-На медном электроде протекает восстановление ионов меди. Электроны, приходящие сюда от цинкового электрода, соединяются с выходящими из раствора дегидратирующимися ионами меди; образуются атомы меди, выделяющиеся в виде металла. Соответствующее электрохимическое уравнение имеет вид:Cu2+ + 2e- = CuСуммарное уравнение реакции, протекающей в элементе, получится при сложении уравнений обеих полуреакций. Таким образом, при работе гальванического элемента, электроны от восстановителя переходят к окислителю по внешней цепи, на электродах идут электрохимические процессы, в растворе наблюдается направленное движение ионов.
Электрод, на котором протекает окисление, называется анодом(цинк). Электрод, на котором протекает восстановление, называется катодом (медь).
В принципе электрическую энергию может дать любая окислительно-восстановительная реакция. Однако, число реакций,
практически используемых в химических источниках электрической энергии, невелико. Это связано с тем, что не всякая окислительно-восстановительная реакция позволяет создать гальванический элемент, обладающий технически ценными свойствами. Кроме того, многие окислительно-восстановительные реакции требуют расхода дорогостоящих веществ.
В отличие от медно-цинкового элемента, во всех современных гальванических элементах и аккумуляторах используют не два, а один электролит; такие источники тока значительно удобнее в эксплуатации.
ТИПЫ ГАЛЬВАНИЧЕСКИХ ЭЛЕМЕНТОВ
Угольно-цинковые элементы
Угольно-цинковые элементы (марганец-цинковые)являются
самыми распространенными сухими элементами. В угольно-цинковых
элементах используется пассивный (угольный) коллектор тока в
контакте с анодом из двуокиси марганца (MnO2), электролит из
хлорида аммония и катодом из цинка. Электролит находится в
пастообразном состоянии или пропитывает пористую диафрагму.
Такой электролит мало подвижен и не растекается, поэтому
элементы называются сухими.
Угольно-цинковые элементы "восстанавливаются" в течении
перерывавработе.Это явление обусловлено постепенным
выравниваниемлокальныхнеоднородностейвкомпозиции
электролита, возникающих в процессе разряда. В результате
периодического "отдыха" срок службы элемента продлевается.
Достоинством угольно-цинковыхэлементовявляетсяих
относительнонизкая стоимость. К существенным недостаткам
следует отнести значительное снижение напряжения при разряде,
невысокуюудельную мощность (5...10 Вт/кг) и малый срок
хранения.
Низкие температуры снижают эффективность использования
гальванических элементов, а внутренний разогрев батареи его
повышает. Повышение температуры вызывает химическую коррозию цинкового электрода водой, содержащейся в электролите, и высыхание электролита. Эти факторы удается несколько компенсировать выдержкой батареи приповышенной температуре и введением внутрь элемента, через предварительно проделанное отверстие, солевого раствора.
Щелочные элементы
Как и в угольно-цинковых, в щелочных элементах используется анод из MnO2 и цинковый катод с разделенным электролитом.
Отличие щелочных элементов от угольно-цинковых заключается
в применениищелочногоэлектролита,вследствиечего
газовыделение при разряде фактически отсутствует, и их можно
выполнять герметичными, что очень важно для целого ряда их
применений.
Ртутные элементы
Ртутные элементы очень похожи на щелочные элементы. В них
используется оксид ртути (HgO). Катод состоит из смеси порошка
цинка и ртути. Анод и катод разделены сепаратором и диафрагмой,
пропитанной 40% раствором щелочи.
Так как ртуть дефицитна и токсична, ртутные элементы не
следует выбрасывать после их полного использования. Они должны
поступать на вторичную переработку.Серебряные элементы
Они имеют "серебряные" катоды из Ag2O и AgO.
Литиевые элементы
В них применяются литиевые аноды, органический электролит
и катоды из различных материалов. Они обладают очень большими
сроками хранения, высокими плотностями энергии и работоспособны
в широком интервале температур, поскольку не содержат воды.
Так как литий обладает наивысшим отрицательным потенциалом
по отношениюковсемметаллам,литиевыеэлементы
характеризуютсянаибольшимноминальнымнапряжениемпри
минимальных габаритах.
referat.co
Гальванические элементы. Аккумуляторы - Реферат
г. Кызыл, ТГУ
РЕФЕРАТ
Тема: "Гальванические элементы. Аккумуляторы."
Составила: Спиридонова В.А.
I курс, IV гр., ФМФ
Проверила: Кендиван О.Д.
2001 г.
СОДЕРЖАНИЕ:
- Введение
- Гальванические источники тока
- Типы гальванических элементов
- Аккумуляторы
- Кислотные
- Щелочные
- Герметичные никель-кадмиевые
- Герметичные
- Аккумуляторы технологии "DRYFIT"
I
ВВЕДЕНИЕ
Химические источники тока (ХИТ) в течении многих лет
прочно вошли в нашу жизнь. В быту потребитель редко обращает
внимание на отличия используемых ХИТ. Для него это батарейки и
аккумуляторы. Обычно они используются в устройствах таких, как
карманные фонари, игрушки, радиоприемники или автомобили.
В том случае, когда потребляемая мощность относительно
велика (10Ач), используются аккумуляторы, в основном кислотные,
а также никель-железные и никель-кадмиевые. Они применяются в
портативных ЭВМ (Laptop, Notebook, Palmtop), носимых средствах
связи, аварийном освещении и пр.
В последние годы такие аккумуляторы широко применяются в
резервных источниках питания ЭВМ и электромеханических
системах, накапливающих энергию для возможных пиковых нагрузок
и аварийного питания электроэнергией жизненно-важных систем.
II
ГАЛЬВАНИЧЕСКИЕ ИСТОЧНИКИ ТОКА
Гальванические источники тока одноразового действия
представляют собой унифицированный контейнер, в котором
находятся электролит, абсорбируемый активным материалом
сепаратора, и электроды (анод и катод), поэтому они называются
сухими элементами. Этот термин используется применительно ко
всем элементам, не содержащим жидкого электролита. К обычным
сухим элементам относятся углеродно-цинковые элементы.
Сухие элементы применяются при малых токах и прерывистых
режимах работы. Поэтому такие элементы широко используются в
телефонных аппаратах, игрушках, системах сигнализации и др.
Действие любого гальванического элемента основано на протекании в нем окислительно-восстановительной реакции. В простейшем случае гальванический элемент состоит из двух пластин или стержней, изготовленных из различных металлов и погруженных в раствор электролита. Такая система делает возможным пространственное разделение окислительно-восстановительной реакции: окисление протекает на одном металле, а восстановление - на другом. Таким образом, электроны передаются от восстановителя к окислителю по внешней цепи.
Рассмотрим в качестве примера медно-цинковый гальванический элемент, работающий за счет энергии приведенной выше реакции между цинком и сульфатом меди. Этот элемент (элемент Якоби-Даниэля) состоит из медной пластины, погруженной в раствор сульфата меди (медный электрод), и цинковой пластины, погруженной в раствор сульфата цинка (цинковый электрод). Оба раствора соприкасаются друг с другом, но для предупреждения смешивания они разделены перегородкой, изготовленной из пористого материала.
При работе элемента, т.е. при замкнутой цепи, цинк окисляется: на поверхности его соприкосновения с раствором атомы цинка превращаются в ионы и, гидратируясь, переходят в раствор. Высвобождающиеся при этом электроны движутся по внешней цепи к медному электроду. Вся совокупность этих процессов схематически изображается уравнением полуреакции, или электрохимическим уравнением:
Zn = Zn2+ + 2e-
На медном электроде протекает восстановление ионов меди. Электроны, приходящие сюда от цинкового электрода, соединяются с выходящими из раствора дегидратирующимися ионами меди; образуются атомы меди, выделяющиеся в виде металла. Соответствующее электрохимическое уравнение имеет вид:
Cu2+ + 2e- = Cu
Суммарное уравнение реакции, протекающей в элементе, получится при сложении уравнений обеих полуреакций. Таким образом, при работе гальванического элемента, электроны от восстановителя переходят к окислителю по внешней цепи, на электродах идут электрохимические процессы, в растворе наблюдается направленное движение ионов.
Электрод, на котором протекает окисление, называется анодом(цинк). Электрод, на котором протекает восстановление, называется катодом (медь).
В принципе электрическую энергию может дать любая окислительно-восстановительная реакция. Однако, число реакций,
практически используемых в химических источниках электрической энергии, невелико. Это связано с тем, что не всякая окислительно-восстановительная реакция позволяет создать гальванический элемент, обладающий технически ценными свойствами. Кроме того, многие окислительно-восстановительные реакции требуют расхода дорогостоящих веществ.
В отличие от медно-цинкового элемента, во всех современных гальванических эл
www.studsell.com
Гальванический элемент: особенности и история открытия
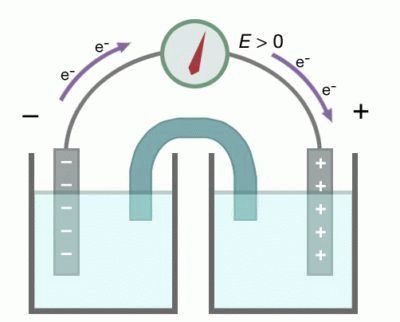
Гальванический элемент – это источник электрической энергии, принцип действия основан на химических реакциях. Большинство современных батареек и аккумуляторов подпадает под определение и относится к рассматриваемой категории. Физически гальванический элемент состоит из проводящих электродов, погруженных в одну или две жидкости (электролиты).
Общая информация
Гальванические элементы делятся на первичные и вторичные в соответствии со способностью вырабатывать электрический ток. Оба вида считаются источниками и служат для различных целей. Первые вырабатывают ток в ходе химической реакции, вторые функционируют исключительно после зарядки. Ниже обсудим обе разновидности. По количеству жидкостей различают две группы гальванических элементов:
- Ярким примером приборов с единственной жидкостью считаются вольтов столб (1800 год) и элемент Волластона, которым пользовался первоначально Георг Ом в собственных исследованиях. Он состоял из медных пластин, свёрнутых в полые цилиндрической форму поверхности: первая вставлена во вторую. Обе ограждены от соприкосновения при помощи деревянных распорок. Электролитом служит разбавленная серная кислота. В результате происходит удвоение рабочих поверхностей. В ходе реакции образуется сульфат меди с выделением водорода, а цинк окисляется. В батарейках один электрод обычно угольный.
Источник электрической энергии
- В элементах с двумя жидкостями используется электролит с избытком кислорода для погружения электрода, где образуется водород. В результате происходит химическая реакция образования воды, нестабильность тока компенсируется и сглаживается. Первым идею использования источников выдвинул в 1829 году Беккерель. Первоначально для разделения ёмкостей использовался сосуд из слабо обожжённой глины, обладавший хорошей пористостью. Для компенсации выделения водорода на медном электроде допустимо использовать синий купорос.
Непостоянство источников питания с единственной жидкостью заметил Ом, открыв неприемлемость гальванического элемента Волластона для экспериментов по исследованию электричества. Динамика процесса такова, что в начальный момент времени ток велик и вначале растёт, потом за несколько часов падает до среднего значения. Современные аккумуляторы капризны.
История открытия химического электричества
Мало известен факт, что в 1752 году гальваническое электричество упоминалось Иоганном Георгом. Издание Исследование происхождения приятных и неприятных ощущений, выпущенное Берлинской академией наук, даже придавало явлению вполне правильное толкование. Опыт: серебряную и свинцовую пластины соединяли с одного конца, а противоположные с разных сторон прикладывались к языку. На рецепторах наблюдается вкус железного купороса. Читатели уже догадались, описанный способ проверки батареек часто использовали в СССР.

Химическое электричество
Объяснение явления: видимо, имеются некие частицы металла, раздражающие рецепторы языка. Частицы испускаются одной пластиной при соприкосновении. Причём один металл при этом растворяется. Собственно, налицо принцип действия гальванического элемента, где цинковая пластина постепенно исчезает, отдавая энергию химических связей электрическому току. Объяснение сделано за полвека до официального доклада Королевскому обществу Лондона Алессандро Вольта об открытии первого источника питания. Но, как происходит часто с открытиями, к примеру, электромагнитным взаимодействием, опыт остался незамечен широкой научной общественностью и не исследован должным образом.
Добавим, это оказалось связано с недавней отменой преследования за колдовство: немногие решались после печального опыта «ведьм» на изучение непонятных явлений. Иначе обстояло дело с Луиджи Гальвани, с 1775 года работающим на кафедре анатомии в Болонье. Его специализаций считались раздражители нервной системы, но светило оставил значимый след не в области физиологии. Ученик Беккарии активно занимался электричеством. Во второй половине 1780 года, как следует из воспоминаний учёного (1791, De Viribus Electricitatis in Motu Muscylary: Commentarii Bononiensi, том 7, стр. 363), в очередной раз производилось препарирование лягушки (опыты и потом длились долгие годы).
Примечательно, что необычное явление подмечено ассистентом, в точности, как с отклонением стрелки компаса проводом с электрическим током: открытие сделали лишь косвенно связанные с научными исследованиями люди. Наблюдение касалось подергиваний нижних конечностей лягушки. В ходе опыта ассистент задел внутренний бедренный нерв препарируемого животного, ножки дёрнулись. Рядом, на столе стоял электростатический генератор, на приборе проскочила искра. Луиджи Гальвани немедленно загорелся идеей повторить опыт. Что удалось. И опять на машине проскочила искра.

Опыты Луиджи Гальвани
Образовалась параллель связи с электричеством, и Гальвани возжелал узнать, станет ли на лягушку действовать подобным образом гроза. Оказалось, что природные катаклизмы не оказывают заметного воздействия. Лягушки, прикреплённые медными крючками за спинной мозг к железной ограде, дёргались вне зависимости от погодных условий. Опыты не удавалось реализовать со 100-процентной повторяемостью, атмосфера воздействия не оказывала. В итоге Гальвани нашёл сонм пар, составленных из разных металлов, которые при соприкосновении между собой и нервом вызывали подёргивание лапок у лягушки. Сегодня явление объясняют различной степенью электроотрицательности материалов. К примеру, известно, что нельзя алюминиевые пластины клепать медью, металлы составляют гальваническую пару с ярко выраженными свойствами.
Гальвани справедливо заметил, что образуется замкнутая электрическая цепь, предположил, что лягушка содержит животное электричество, разряжаемое подобно лейденской банке. Алессандро Вольта не принял объяснения. Внимательно изучив описание экспериментов, Вольта выдвинул объяснение, что ток возникает при объединении двух металлов, непосредственно или через электролит тела биологического существа. Причина возникновения тока кроется в материалах, а лягушка служит простым индикатором явления. Цитата Вольты из письма, адресованного редактору научного журнала:
Проводники первого рода (твёрдые тела) и второго рода (жидкости) при соприкосновении в некоторой комбинации рождают импульс электричества, сегодня нельзя объяснить причины возникновения явления. Ток течёт по замкнутому контуру и исчезает, если целостность цепи нарушена.
Вольтов столб
Лепту в череду открытий внёс Джованни Фаброни, сообщивший, что при размещении двух пластинок гальванической пары в воду, одна начинает разрушаться. Следовательно, явление имеет отношение к химическим процессам. А Вольта тем временем изобрёл первый источник питания, долгое время служивший для исследования электричества. Учёный постоянно искал способы усиления действия гальванических пар, но не находил. В ходе опытов создана конструкция вольтова столба:
- Попарно брались цинковые и медные кружки в плотном соприкосновении друг с другом.
- Полученные пары разделялись мокрыми кружками картона и ставились друг над другом.
Легко догадаться, получилось последовательное соединение источников тока, которые суммируясь, усиливали эффект (разность потенциалов). Новый прибор вызывал при прикосновении ощутимый для руки человека удар. Подобно опытам Мушенбрука с лейденской банкой. Однако для повторения эффекта требовалось время. Стало очевидно, что источник энергии имеет химическое происхождение и постепенно возобновляется. Но привыкнуть к понятию нового электричества оказалось непросто. Вольтов столб вёл себя подобно заряженной лейденской банке, но…

Эксперимент Вольта
Вольта организует дополнительный эксперимент. Снабжает каждый из кружков изолирующей ручкой, приводит в соприкосновение на некоторое время, потом размыкает и проводит исследование электроскопом. К тому времени уже стал известен закон Кулона, выясняется, что цинк зарядился положительно, а медь – отрицательно. Первый материал отдал электроны второму. По указанной причине цинковая пластина вольтова столба постепенно разрушается. Для изучение работы назначили комиссию, которой представили доводы Алессандро. Уже тогда путём умозаключений исследователь установил, что напряжение отдельных пар складывается.
Вольта объяснил, что без мокрых кружков, прокладываемых между металлами, конструкция ведёт себя как две пластинки: медная и цинковая. Усиления не происходит. Вольта нашёл первый ряд электроотрицательности: цинк, свинец, олово, железо, медь, серебро. И если исключить промежуточные металлы между крайними, «движущая сила» не изменяется. Вольта установил, что электричество существует, пока соприкасаются пластины: сила не видна, но легко чувствуется, следовательно, она истинна. Учёный 20 марта 1800 года пишет президенту Королевского общества Лондона сэру Джозефу Бэнксу, к которому обращался впервые и Майкл Фарадей.
Английские исследователи быстро обнаружили: если на верхнюю пластину (медь) капнуть воды, в указанной точке в районе контакта выделяется газ. Они проделали опыт с обоих сторон: провода подходящей цепи заключили в колбы с водой. Газ исследовали. Оказалось, что газ горючий, выделяется лишь с единственной стороны. С противоположной заметно окислилась проволока. Установлено, что первое является водородом, а второе явление происходит вследствие избытка кислорода. Установлено (2 мая 1800 года), что наблюдаемый процесс — разложение воды под действием электрического тока.
Уильям Крукшенк немедленно показал, что аналогичное допустимо проделать с растворами солей металлов, а Волластон окончательно доказал идентичность вольтова столба статическому электричеству. Как выразился учёный: действие слабее, но обладает большей продолжительностью. Мартин Ван Марум и Христиан Генрих Пфафф зарядили от элемента лейденскую банку. А профессор Хампфри Дэви установил, что чистая вода не может служить в этом случае электролитом. Напротив, чем сильнее жидкость способна окислять цинк, тем лучше действует вольтов столб, что вполне согласовывалось с наблюдениями Фаброни.
Кислота намного улучшает работоспособность, ускоряя процесс выработки электричества. В конце концов Дэви создал стройную теорию вольтова столба. Он пояснил, что металлы изначально обладают неким зарядом, при замыкании контактов вызывающим действие элемента. Если электролит способен окислять поверхность донора электронов, слой истощённых атомов постепенно удаляется, открывая новые слои, способные давать электричество.
В 1803 году Риттер собрал столб из чередующихся кружков серебра и мокрого сукна, прообраз первого аккумулятора. Риттер зарядил его от вольтова столба и наблюдал процесс разрядки. Правильное толкование явлению дал Алессандро Вольта. И лишь в 1825 году Огюст де ла Рив доказал, что перенос электричества в растворе осуществляется ионами вещества, наблюдая образование оксида цинка в камере с чистой водой, отделённой от соседней мембраной. Заявление помогло Берцелиусу создать физическую модель, в которой атому электролита представлялись составленными из двух противоположно заряженных полюсов (ионов), способных диссоциировать. В результате получилась стройная картина переноса электричества на расстояние.
vashtehnik.ru
|
|
..:::Счетчики:::.. |
|
|
|
|
|
|
|
|


