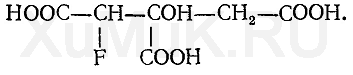
На распределение органических веществ влияют следующие факторы:
1. Индекс липорастворимости (коэффициент распределения Кр. = м/в). Чужеродные соединения, хорошо растворимые в липидах и имеющие высокий коэффициент распределения, характеризуются тенденцией локализоваться в жировых тканях с простым распределением неионизированных молекул между внутриклеточными липидами и жидкостями организма. Таким образом ведут себя тиопентал, гексенал, хлорорганические пестициды, бензол, дихлорэтан и ряд подобных им веществ. Большинство других чужеродных органических соединений не имеют специфической абсорбции и в состоянии статического равновесия распределяются между тканями и кровью в соответствии с коэффициентом распределения ткань/кровь.
2.Способность проникать через клеточные мембраны. Свободно диффундировать через клеточные мембраны могут только те соединения, которые не связаны с белками плазмы или связаны не очень прочно. Чем прочнее связь “белок-вещество”, тем более длительное время вещество циркулирует в крови. В этом случае объект представляет особый интерес для химика-эксперта.
3.Сродство к макромолекулярным структурам и белкам. Белком плазмы, наиболее часто вовлекаемым в связывание чужеродных соединений, является альбумин, имеющий в составе одной молекулы до трёх тысяч азотсодержащих групп, за счёт которых альбумин образует комплексы в основном с веществами кислотного и амфотерного характера. Связывание с белками зависит от рН среды ввиду необходимости ионизации как белка, так и чужеродного соединения. Например, органические кислоты (бензойная, салициловая), барбитураты, сульфаниламиды, кумарины и др. ионизированы при рН крови (~ 7,4) и способны вступать во взаимодействие с белками.
Кроме альбуминов, чужеродные соединения могут связываться с другими белками, например, глобулинами (морфин, кодеин), а также с нуклеиновыми кислотами (некоторые антибиотики и канцерогены).
Примеры: с белками сыворотки крови связываются диазепам (на 98%), фенобарбитал (на 50%), морфин (на 35%).
Значительное связывание с белками может привести к уменьшению скорости метаболизма и выведения чужеродных соединений из организма.
Распределение неорганических веществ в организме подчиняется иным закономерностям, связанным с физико-химическими взаимодействиями с биологическими структурами тканей. Наиболее характерная черта такого распределения – неравномерность (свинец накапливается в костях, мышьяк – в ногтях, волосах). В этом случае коэффициент распределения ткань/кровь, так удобно характеризующий распределение органических веществ, теряет смысл.
Большинство чужеродных соединений органической природы подвергается в организме животных и человека метаболизму ( от греческого слова metabole – превращение, переход из одного состояния в другое, перемена).
Метаболизм чужеродных соединений направлен на введение в их молекулы группировок, обуславливающих увеличение полярности (гидрофильности или водорастворимости молекул) для ускорения выведения веществ почками и уменьшения токсичности.
Эти превращения осуществляются состемой энзимов, главным образом, печени. Различают микросомальные реакции, в которых участвуют ферменты микросомальной фракции печени, и немикросомальные, которые катализируются ферментами, локализованными в других местах. Основываясь на химической природе этих реакций, их более детально можно классифицировать следующим образом:
Основные пути биотрансформации чужеродных соединений:
Окисление:
а) микросомальное – алифатическое и ароматическое гидроксилирование;
- эпоксидирование,
N-гидроксилирование,
N,S - окисление;
дезалкилирование,
дезаминирование,
десульфирование,
б) немикросомальное – окислительное дезаминирование;
-окисление спиртов, альдегидов,
-ароматизация алициклических соединений.
studfiles.net
Размещено на
Введение
Стремительные темпы развития промышленного производства, химизация народного хозяйства ведут к появлению во внешней среде большого количества разнообразных химических соединений, постоянно загрязняющих биосферу и пагубно влияющих на живую природу.
В силу различных причин многие химические вещества, поступающие в организм и ранее не встречающиеся в нем, получили название чужеродных или ксенобиотиков (от греческих слов xenos - чужой, biotos- жизнь). К таким веществам относятся синтетические и природные лекарственные препараты, пестициды, промышленные яды,отходы производств, пищевые добавки, косметические средства и прочие.
Актуальность проблем, рассматриваемых в ксенобиологии все возрастает. Это обусловлено тем, что ежегодно на Земле синтезируются десятки тысяч новых соединений. Ряд из них вовлекаются в круговорот веществ в природе. Чем шире масштабы производства химических соединений, тем больше влияние они оказывают на биологические процессы в почве, водоемах и на суше, тем сильнее проявляются побочные и отдаленные последствия их действия на живые системы.
Воздействие ксенобиотиков на живой мир, и на человека в частности происходит, в самых различных комбинациях этих соединений не только друг с другом, но и с фактором окружающей среды. Поэтому многие из ксенобиотиков, вошедших в сегодняшнюю практику могут являться носителями опасного биологического действия.
Биотрансформация органических ксенобиотиков
Многие ксенобиотики, попав в организм, подвергаются биотрансформации и выделяются в виде метаболитов. В основе биотрансформации по большей части лежат энзиматические преобразования молекул. Биологический смысл явления - превращение химического вещества в форму, удобную для выведения из организма, и тем самым, сокращение времени его действия.
Метаболизм ксенобиотиков проходит в две фазы (рисунок 1).
Рисунок 1. Фазы метаболизма чужеродных соединений
В ходе первой фазы окислительно-восстановительного или гидролитического превращения молекула вещества обогащается полярными функциональными группами, что делает ее реакционно-способной и более растворимой в воде. Во второй фазе проходят синтетические процессы конъюгации промежуточных продуктов метаболизма с эндогенными молекулами, в результате чего образуются полярные соединения, которые выводятся из организма с помощью специальных механизмов экскреции.
Разнообразие каталитических свойств энзимов биотрансформации и их низкая субстратная специфичность позволяет организму метаболизировать вещества самого разного строения. Вместе с тем, у животных разных видов и человека метаболизм ксенобиотиков проходит далеко не одинаково, поскольку энзимы, участвующие в превращениях чужеродных веществ, часто видоспецифичны.
Следствием химической модификации молекулы ксенобиотика могут стать:
1. Ослабление токсичности;
2. Усиление токсичности;
3. Изменение характера токсического действия;
4. Инициация токсического процесса.
Метаболизм многих ксенобиотиков сопровождается образованием продуктов существенно уступающих по токсичности исходным веществам. Так, роданиды, образующиеся в процессе биопревращения цианидов, в несколько сот раз менее токсичны, чем исходные ксенобиотики. Гидролитическое отщепление от молекул зарина, зомана, диизопропилфторфосфата иона фтора, приводит к утрате этими веществами способности угнетать активность ацетилхолинэстеразы и существенному понижению их токсичности. Процесс утраты токсикантом токсичности в результате биотрансформации обозначается как "метаболическая детоксикация". В процессе метаболизма других веществ образуются более токсичные соединения. Примером такого рода превращений является, в частности, образование в организме фторуксусной кислоты при интоксикации фторэтанолом.
В ряде случаев в ходе биотрансформации ксенобиотиков образуются вещества, способные совершенно иначе действовать на организм, чем исходные агенты. Так, некоторые спирты (этиленгликоль), действуя целой молекулой, вызывают седативно-гипнотический эффект (опьянение, наркоз). В ходе их биопревращения образуются соответствующие альдегиды и органические кислоты (щавелевая кислота), способные повреждать паренхиматозные органы и, в частности, почки. Многие низкомолекулярные вещества, являющиеся факультативными аллергенами, подвергаются в организме метаболическим превращениям с образованием реакционноспособных промежуточных продуктов. Так, соединения, содержащие в молекуле амино- или нитрогруппу в ходе метаболизма превращаются в гидроксиламины, активно взаимодействующие с протеинами крови и тканей, формируя полные антигены. При повторном поступлении таких веществ в организм помимо специфического действия развиваются аллергические реакции.
Порой сам процесс метаболизма ксенобиотика является пусковым звеном в развитии интоксикации. Например, в ходе биологического окисления ароматических углеводородов инициируются свободно-радикальные процессы в клетках, образуются ареноксиды, формирующие ковалентные связи с нуклеофильными структурами клеток (белками, сульфгидрильными группами, нуклеиновыми кислотами и т.д), активирующие перекисное окисление липидов биологических мембран (рисунок 2). В итоге инициируется мутагенное, канцерогенное, цитотоксическое действие токсикантов.
Аналогично ареноксидам на клетки действуют N-оксиды, нитрозамины, гидроксиламины, также являющиеся канцерогенами и мутагенами. В опытах на собаках установлена прямая зависимость между канцерогенной активностью (рак мочевого пузыря) и концентрацией в моче продуктов N-окисления веществ в ряду: 1-нафтиламин, 2-нафтиламин, 4-аминодифенил. По такому же механизму действуют на организм галогенированный бензол, нафтанол и многие другие ксенобиотики. Процесс образования токсичных продуктов метаболизма называется "токсификация", а продукты биотрансформации, обладающие высокой токсичностью - токсичными метаболитами. Во многих случаях токсичный метаболит является не стабильным продуктом, подвергающимся дальнейшим превращениям. В этом случае он также называется промежуточным или реактивным метаболитом. Реактивные метаболиты это как раз те вещества, которые часто и вызывают повреждение биосистем на молекулярном уровне. Общим свойством практически всех реактивных метаболитов является их электродефицитное состояние, т.е. высокая электрофильность. Эти вещества вступают во взаимодействие с богатыми электронами (нуклеофильными) молекулами, повреждая их. К числу последних относятся макромолекулы клеток, в структуру которых входят в большом количестве атомы кислорода, азота, серы. Это, прежде всего, белки и нуклеиновые кислоты. Реактивные метаболиты либо присоединяются к нуклеофильным молекулам, образуя с ними ковалентные связи, либо вызывают их окисление. В обоих случаях структура макромолекул нарушается, следовательно, нарушаются и их функции.
Биоактивация далеко не всегда сопровождается повреждением биосубстрата, поскольку одновременно в организме протекают процессы детоксикации и репарации. Интенсивность этих процессов может быть достаточной для компенсации ущерба, связанного с образованием реактивных метаболитов. Тем не менее при введении высоких доз токсиканта, повторном воздействии защитные механизмы могут оказаться несостоятельными, что и приведет к развитию токсического процесса.
Концепция l и ll фазы метаболизма ксенобиотиков
l фаза метаболизма в широком смысле может быть определена, как этап биотрансформации, в ходе которого к молекуле соединения либо присоединяются полярные функциональные группы, либо осуществляется экспрессия таких групп, находящихся в субстрате в скрытой форме. Это достигается либо путем окисления или (значительно реже) восстановления молекул с помощью оксидо-редуктаз, либо путем их гидролиза эстеразами и амидазами.
Фаза ll - этап биологической конъюгации промежуточных продуктов метаболизма с эндогенными молекулами, такими как глутатион, глюкуроновая кислота, сульфат и т.д. Специфические системы транспорта конъюгированных дериватов обеспечивают их выведение из организма. В ходе биопревращений липофильный и, следовательно, трудновыводимый ксенобиотик становиться гидрофильным продуктом, что обусловливает возможность его быстрой экскреции.
Классическим примером биотрансформации ксенобиотиков является метаболизм бензола в организме (рисунок 2)
Рисунок 2. Метаболизм бензола
В ходе l фазы метаболизма обеспечивается превращение жирорастворимого субстрата в полярный продукт путем включения в молекулу гидроксильной группы. В ходе ll фазы образовавшийся фенол взаимодействует с эндогенным сульфатом, в результате полярность образующегося продукта еще более возрастает. Фенилсульфат прекрасно растворяется в воде и легко выделяется из организма.
Локализация процессов биотрансформации
Основным органом метаболизма ксенобиотиков в организме человека и млекопитающих является печень, главным образом благодаря разнообразию и высокой активности здесь ферментов биотрансформации. Кроме того, портальная система обеспечивает прохождение всех веществ, поступивших в желудочно-кишечный тракт, именно через печень, до того, как они проникнут в общий кровоток. Это также определяет функциональное предназначение органа. Тончайшая сеть печеночных капилляров, огромная площадь контакта между кровью и поверхностью гепатоцитов, обеспечивающаяся микроворсинками базальной поверхности печеночных клеток, обусловливают высокую эффективность печеночной элиминации токсиканта на клеточном уровне.
Рисунок...
www.tnu.in.ua
Вещества, поступившие в организм с пищей, а также лекарственные и другие соединения под влиянием ферментов подвергаются различным превращениям. Процесс превращения поступивших в организм веществ называется метаболизмом, или биотрансформацией, а вещества, образующиеся при этих превращениях, называются метаболитами.
Белки, жиры, углеводы, гормоны, витамины и некоторые другие вещества, поступившие в организм, являются свойственными организму. Они служат источником энергии или являются структурными элементами для создания клеток, тканей и т. д. Свойственные организму вещества подвергаются метаболизму с помощью специфических ферментных систем, обеспечивающих жизнь тканей и деятельность организма, как говорилось выше.
Кроме свойственных организму веществ в него могут поступать лекарственные препараты, пищевые добавки, химические средства защиты растений, предметы бытовой химии и многие другие вещества, которые не свойственны организму. Они не обеспечивают энергией все нуждающиеся в ней формы жизнедеятельности и не превращаются в компоненты клеток и тканей. В определенных условиях эти вещества могут нарушать нормальные процессы метаболизма белков, жиров и других свойственных организму соединений, вызывать отравления и даже смерть. Такие вещества называются чужеродными, или ксенобиотиками. Ниже остановимся только на описании метаболизма чужеродных соединений.
Преобладающее число метаболитов является менее токсичным, чем чужеродные вещества, из которых они образовались. Метаболиты легко выводятся из организма. Поэтому метаболизм лекарственных веществ и особенно ядов является одним из путей детоксикации.- В связи с этим изучение метаболизма представляет большой интерес для фармакологов, токсикологов, клиницистов и специалистов ряда других отраслей науки.
Интерес химиков-токсикологов к изучению метаболизма ядовитых веществ объясняется рядом причин. Некоторые лекарственные вещества и яды быстро метаболизируются в организме и могут быть обнаружены только в виде метаболитов.
Физические и химические свойства большинства метаболитов отличаются от свойств чужеродных соединений, из которых они образовались. Поэтому методы выделения чужеродных соединений из биологического материала, применяемые в химико-токсикологическом анализе, во многих случаях не пригодны для выделения метаболитов. Не располагая соответствующими методами выделения метаболитов из биологического материала в ходе анализа объектов биологического происхождения на наличие ядов, химики-токсикологи частично или полностью могут потерять метаболиты.
Из-за частичной или полной потери метаболитов в ходе химико-токсикологического анализа заключение химиков-экспертов о наличии и количестве яда в соответствующих органах или биологических жидкостях не могут отражать истинного содержания искомого вещества, поступившего в исследуемые объекты.
Для более полного представления о количестве яда, вызвавшего отравление, при химико-токсикологическом анализе необходимо производить идентификацию и количественное определение не только ядовитого вещества, но и его метаболитов. Однако методы обнаружения и количественного определения многих метаболитов еще не разработаны или разработаны недостаточно.
До настоящего времени достигнуты определенные успехи в области изучения метаболизма ряда лекарственных веществ и ядов. Однако метаболизм этих веществ еще не изучен или изучен недостаточно. В литературе имеются противоречивые данные о метаболитах отдельных ядов. Большинство результатов экспериментальных исследований, посвященных изучению метаболизма чужеродных соединений, приведено в малодоступных источниках литературы. Имеется ограниченное число монографий на русском языке, посвященных метаболизму чужеродных соединений.
Методам анализа метаболитов посвящена книга Ж. Хирца, которая представляет большой интерес для химиков-аналитиков и судебных химиков, изучающих методы исследования ядов и их метаболитов. Однако эта книга не может быть руководством для специалистов указанных областей знаний. В ней приведена сводка методик анализа метаболитов без подробного описания основных этапов их исследования.
Учитывая большое значение методов анализа метаболитов для определения ядов, которые могут вызвать отравление, разработка указанных методов имеет теоретическое и практическое значение. Однако решение указанной задачи связано с некоторыми затруднениями.
Основное затруднение при исследовании метаболитов состоит в том, что они находятся в биологическом материале в малых количествах, для анализа которых требуются специальные методы. Поэтому из объектов биологического происхождения, содержащих различные по химическому составу и свойствам вещества (белки, продукты их разложения и др.), трудно выделить метаболиты количественно. Для выделения метаболитов из биологического материала необходимо применять методы, связанные с проведением ряда сложных, а иногда и трудоемких операций, при выполнении которых может теряться определенное количество этих веществ.
Количество метаболитов, выделяемых из биологического материала с помощью соответствующих методов, в ряде случаев является недостаточным для определения элементного состава, функциональных групп, химического строения, физических и химических свойств выделенных веществ.
Метаболиты, выделенные из биологического материала, необходимо подвергать исследованию с помощью соответствующих реакций и методов. Результаты этих исследований необходимо сравнивать с результатами исследований заведомо известных соединений. Такие соединения в большинстве случаев отсутствуют в химических лабораториях. Их нужно получать синтетическим путем. Синтез предполагаемых метаболитов, как правило, является довольно сложным. Поэтому вопросы исследования метаболитов иногда должны решаться совместно химиками-аналитиками и химиками-синтетиками.
Несмотря на затруднения, возникающие при изучении метаболизма, в этой области уже получены определенные результаты, позволяющие установить состав и строение многих метаболитов и вывести некоторые общие закономерности процессов биотрансформации.
Метаболизм чужеродных соединений (лекарственных препаратов, ядов и др.) в организме людей и животных происходит под влиянием ферментных систем. Большинство из ядов метабо-лизируется в печени, в которой продуцируется значительное число ферментов. Эти ферменты локализуются в митохондриях, микросомах, лизосомах клеток печени. Метаболиты, образующиеся в печени, поступают в желчь, затем в кишки и выводятся с калом или поступают в почки и выделяются с мочой. Метаболизм чужеродных соединений частично происходит в почках, легких, пищевом канале, коже и др.
Многие ферменты, под влиянием которых происходит метаболизм чужеродных соединений, присущи организму. Они катализируют превращение близких по химической природе веществ. Однако некоторые ферменты, необходимые для превращения чужеродных веществ, отсутствуют в организме, но образуются в'процессе метаболизма. В этих случаях чужеродные соединения индуцируют образование ферментов, которые катализируют их метаболизм, Такие ферменты называются индуцированными.
В процессе метаболизма под влиянием ферментов чужеродные соединения подвергаются ряду превращений, в результате которых образуются метаболиты. В молекулах метаболитов содержатся определенные функциональные группы, от наличия которых зависит полярность и растворимость этих веществ. Как правило, метаболиты являются более полярными, чем чужеродные вещества, из которых они образовались. С увеличением полярности метаболитов возрастает их растворимость в воде. Это обстоятельство приводит к увеличению возможности выделения метаболитов из организма через почки с мочой.
За небольшим исключением метаболиты являются менее токсичными, чем чужеродные соединения, из которых они образовались. Таким образом, метаболизм является одним из путей дезактивирования (дезинтоксикации) чужеродных соединений в организме.
Однако в ряде случаев метаболиты могут быть более токсичными, чем чужеродные соединения, из которых они образовались. Известно, что гексаметилентетрамин не обладает антибактериальной активностью, а его метаболит — формальдегид — проявляет указанную активность и является токсичным. Метиловый спирт имеет значительно меньшую токсичность, чем формальдегид, являющийся метаболитом этого спирта. При метаболизме кодеина может образовываться морфин, более токсичный, чем кодеин. Хлоралгидрат проявляет снотворное действие только после превращения его в более токсичный метаболит — трихлорэтанол. Метаболитом фенацетина является парацетамол, который имеет более выраженное фармакологическое действие на организм, чем фенацетин. Примеров образования метаболитов более токсичных, чем чужеродные соединения, можно привести еще много.
Более токсичными, чем исходные вещества, являются продукты летального синтеза. При летальном синтезе из более простых чужеродных соединений в организме образуются более сложные соединения, обладающие токсическим действием. Это можно показать на таком примере: нетоксичная фторуксусная кислота F—СН 2 —СООН в организме подвергается синтезу, в результате которого образуется фторлимонная кислота
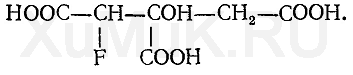
На метаболизм чужеродных соединений влияют различные факторы. Метаболизм одних и тех же чужеродных соединений в организме людей может протекать не так, как в организме некоторых животных. Изменения метаболизма чужеродных веществ могут зависеть от возраста, пола, питания, различных заболеваний, стрессовых состояний, наличия других чужеродных соединений в организме и некоторых других факторов.
Метаболизм ряда чужеродных соединений происходит в две фазы. В первой фазе под влиянием ферментных систем чужеродные соединения превращаются в их метаболиты. Во второй фазе метаболиты и некоторые чужеродные соединения с определенными веществами, находящимися в организме, образовывают конъюгаты.
В первой фазе метаболизма под влиянием ферментных систем чужеродные соединения могут подвергаться окислению, восстановлению, гидролизу, дезаминированию, дезалкилирова-нию, десульфированию и другим превращениям.
studfiles.net
 ЛЕКЦИЯ № 5. Биотрансформация чужеродных соединений в организме. Этапы и основные пути биотрансформации. Факторы, влияющие на метаболизм чужеродных соединений. Метаболиты и токсичность. Представление о вторичном метаболизме. Экскреция чужеродных соединений и их метаболитов. Биотрансформация — метаболическое превращение эндогенных и экзогенных химических веществ в более полярные (гидрофильные) соединения. Фазы биотрансформации Реакции 1 -й фазы -гидролиз, -восстановление, -окисление. Реакции 2 -й фазы (реакции синтеза) -глюкуронирование, -сульфатирование, -ацетилирование, -метилирование, -конъюгация (соединение) с: а) глутатионом (синтез меркаптуровой кислоты) б) аминокислотами (глицином, таурином и глутаминовой кислотой).
ЛЕКЦИЯ № 5. Биотрансформация чужеродных соединений в организме. Этапы и основные пути биотрансформации. Факторы, влияющие на метаболизм чужеродных соединений. Метаболиты и токсичность. Представление о вторичном метаболизме. Экскреция чужеродных соединений и их метаболитов. Биотрансформация — метаболическое превращение эндогенных и экзогенных химических веществ в более полярные (гидрофильные) соединения. Фазы биотрансформации Реакции 1 -й фазы -гидролиз, -восстановление, -окисление. Реакции 2 -й фазы (реакции синтеза) -глюкуронирование, -сульфатирование, -ацетилирование, -метилирование, -конъюгация (соединение) с: а) глутатионом (синтез меркаптуровой кислоты) б) аминокислотами (глицином, таурином и глутаминовой кислотой).
 Основные пути биотрансформации чужеродных соединений. 1. Окисление: а) микросомальное – алифатичекое или ароматическое гидроксилирование, – эпоксидирование, – N-гидроксилирование, – N, S-окисление, – дезалкилирование, – дезаминирование, – десульфирование; б) немикросомальное – окислительное дезаминирование, – окисление спиртов, альдегидов, – ароматизация алициклических соединений. 2. Восстановление: а) восстановление нитросоединений, азотсоединений микросомальными ферментами; б) микросомальное восстановительное галогенирование; в) немикросоальное восстановление. 3. Гидролиз с участием микросомальных и немикросомальных ферментов. 4. Синтез (реакции коньюгирования): а) образование коньюгатов с глюкуроновой кислотой; б) образование сложных эфиров с серной и фосфорной кислотами; в) метилирование; г) ацетилирование; д) пептидная коньюгация.
Основные пути биотрансформации чужеродных соединений. 1. Окисление: а) микросомальное – алифатичекое или ароматическое гидроксилирование, – эпоксидирование, – N-гидроксилирование, – N, S-окисление, – дезалкилирование, – дезаминирование, – десульфирование; б) немикросомальное – окислительное дезаминирование, – окисление спиртов, альдегидов, – ароматизация алициклических соединений. 2. Восстановление: а) восстановление нитросоединений, азотсоединений микросомальными ферментами; б) микросомальное восстановительное галогенирование; в) немикросоальное восстановление. 3. Гидролиз с участием микросомальных и немикросомальных ферментов. 4. Синтез (реакции коньюгирования): а) образование коньюгатов с глюкуроновой кислотой; б) образование сложных эфиров с серной и фосфорной кислотами; в) метилирование; г) ацетилирование; д) пептидная коньюгация.
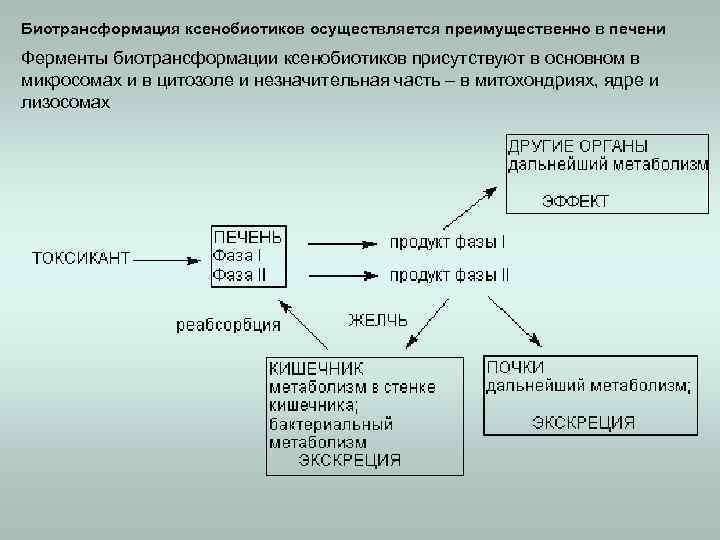 Биотрансформация ксенобиотиков осуществляется преимущественно в печени Ферменты биотрансформации ксенобиотиков присутствуют в основном в микросомах и в цитозоле и незначительная часть – в митохондриях, ядре и лизосомах
Биотрансформация ксенобиотиков осуществляется преимущественно в печени Ферменты биотрансформации ксенобиотиков присутствуют в основном в микросомах и в цитозоле и незначительная часть – в митохондриях, ядре и лизосомах
 Ферментативные реакции 1 -й фазы биотрансформации ксенобиотиков l фаза метаболизма - этап биотрансформации, в ходе которого к молекуле соединения либо присоединяются полярные функциональные группы, либо осуществляется экспрессия таких групп, находящихся в субстрате в скрытой форме 1. Гидролиз при биотрансформации X = OR‘, SR‘, Cl, NR‘ 2 карбоксилэстераза, ацетилхолинэстераза псевдохолинэстераза параоксаназа пептидазы эпоксидная гидролаза эфиры карбоновых кислот, амидов и тиоэфиров эфиры фосфорной кислоты амидная связь между аминокислотами в пептидах, рекомбинантных пептидных гормонах, факторах роста, цитокинах, растворимых рецепторов и моноклональных антител. присоединение воды к эпоксидам алкенов и оксидам аренов
Ферментативные реакции 1 -й фазы биотрансформации ксенобиотиков l фаза метаболизма - этап биотрансформации, в ходе которого к молекуле соединения либо присоединяются полярные функциональные группы, либо осуществляется экспрессия таких групп, находящихся в субстрате в скрытой форме 1. Гидролиз при биотрансформации X = OR‘, SR‘, Cl, NR‘ 2 карбоксилэстераза, ацетилхолинэстераза псевдохолинэстераза параоксаназа пептидазы эпоксидная гидролаза эфиры карбоновых кислот, амидов и тиоэфиров эфиры фосфорной кислоты амидная связь между аминокислотами в пептидах, рекомбинантных пептидных гормонах, факторах роста, цитокинах, растворимых рецепторов и моноклональных антител. присоединение воды к эпоксидам алкенов и оксидам аренов
 2. Восстановление при биотрансформации Некоторые металлы альдегиды, кетоны, дисульфиды, сульфоксиды, хиноны, алкены, азо- и нитросоединеня Коферменты — никотинамидадениндинуклеотид (НАД+/НАДН, НАДФ+/НАДФН) флавинадениндинуклеотид (ФАД/ФАДН 2). Восстановление азо- и нитросоединений - цитохром Р 450 НАДФН-хинон оксидоредуктазы реакция ингибируются кислородом
2. Восстановление при биотрансформации Некоторые металлы альдегиды, кетоны, дисульфиды, сульфоксиды, хиноны, алкены, азо- и нитросоединеня Коферменты — никотинамидадениндинуклеотид (НАД+/НАДН, НАДФ+/НАДФН) флавинадениндинуклеотид (ФАД/ФАДН 2). Восстановление азо- и нитросоединений - цитохром Р 450 НАДФН-хинон оксидоредуктазы реакция ингибируются кислородом
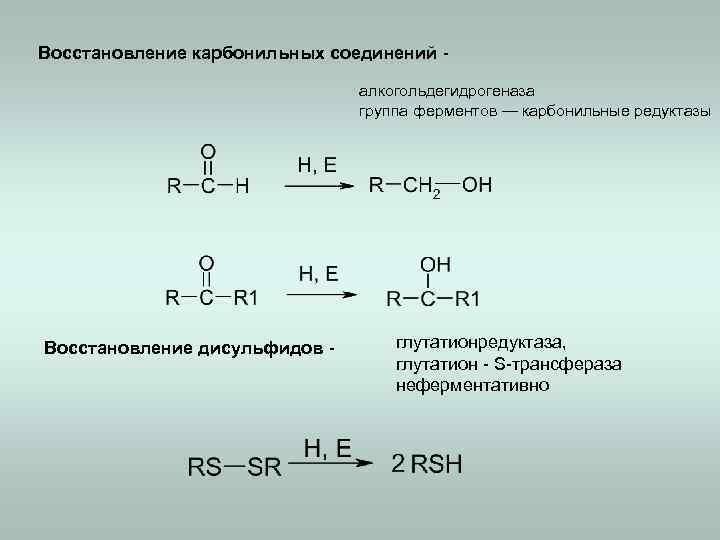 Восстановление карбонильных соединений алкогольдегидрогеназа группа ферментов — карбонильные редуктазы Восстановление дисульфидов - глутатионредуктаза, глутатион - S-трансфераза неферментативно
Восстановление карбонильных соединений алкогольдегидрогеназа группа ферментов — карбонильные редуктазы Восстановление дисульфидов - глутатионредуктаза, глутатион - S-трансфераза неферментативно
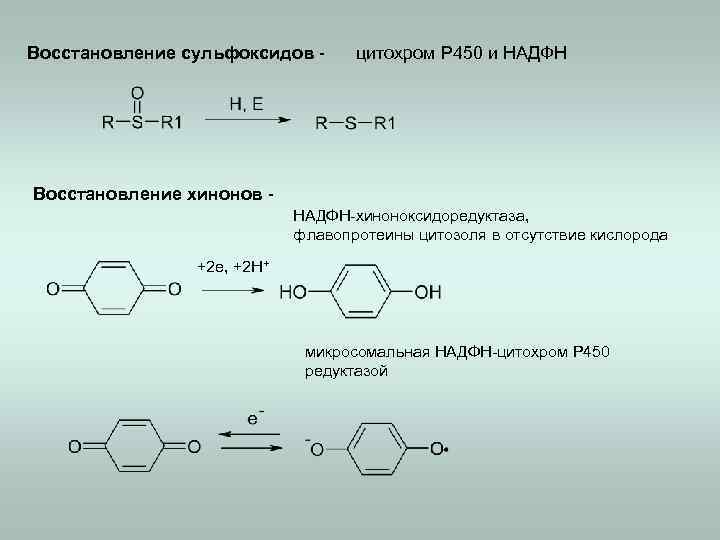 Восстановление сульфоксидов - цитохром Р 450 и НАДФН Восстановление хинонов НАДФН-хиноноксидоредуктаза, флавопротеины цитозоля в отсутствие кислорода +2 e, +2 H+ микросомальная НАДФН-цитохром Р 450 редуктазой
Восстановление сульфоксидов - цитохром Р 450 и НАДФН Восстановление хинонов НАДФН-хиноноксидоредуктаза, флавопротеины цитозоля в отсутствие кислорода +2 e, +2 H+ микросомальная НАДФН-цитохром Р 450 редуктазой
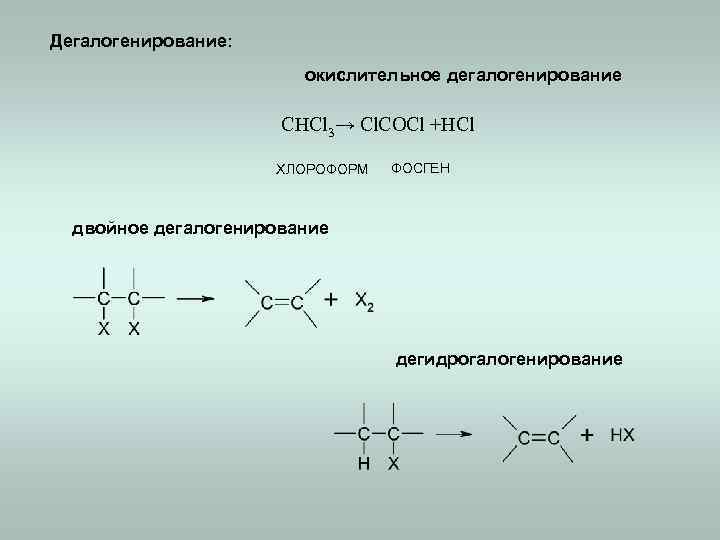 Дегалогенирование: окислительное дегалогенирование CHCl 3→ Cl. COCl +HCl ХЛОРОФОРМ ФОСГЕН двойное дегалогенирование дегидрогалогенирование
Дегалогенирование: окислительное дегалогенирование CHCl 3→ Cl. COCl +HCl ХЛОРОФОРМ ФОСГЕН двойное дегалогенирование дегидрогалогенирование
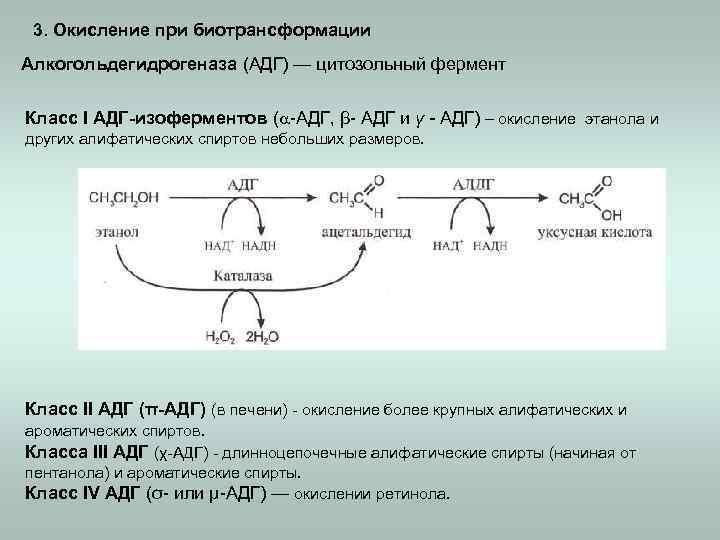 3. Окисление при биотрансформации Алкогольдегидрогеназа (АДГ) — цитозольный фермент Класс I АДГ-изоферментов ( -АДГ, β- АДГ и γ - АДГ) – окисление этанола и других алифатических спиртов небольших размеров. Класс II АДГ (π-АДГ) (в печени) - окисление более крупных алифатических и ароматических спиртов. Класса III АДГ (χ-АДГ) - длинноцепочечные алифатические спирты (начиная от пентанола) и ароматические спирты. Класс IV АДГ (σ- или μ-АДГ) — окислении ретинола.
3. Окисление при биотрансформации Алкогольдегидрогеназа (АДГ) — цитозольный фермент Класс I АДГ-изоферментов ( -АДГ, β- АДГ и γ - АДГ) – окисление этанола и других алифатических спиртов небольших размеров. Класс II АДГ (π-АДГ) (в печени) - окисление более крупных алифатических и ароматических спиртов. Класса III АДГ (χ-АДГ) - длинноцепочечные алифатические спирты (начиная от пентанола) и ароматические спирты. Класс IV АДГ (σ- или μ-АДГ) — окислении ретинола.
 Альдегид-дегидрогеназа (АЛДГ) - окислении альдегидов до карбоновых кислот (кофактор НАД+). Дигидродиолдегидрогеназа - окисление полициклических ароматических углеводородов. Молибденовые гидроксилазы – альдегидоксидаза и ксантиндегидрогеназа / ксантиноксидаза, сульфитоксидаза - окисляет токсичный сульфит до относительно безопасного сульфата. Ксантиндегидрогеназа (XD) и ксантиноксидаза (ХО) — участвуют в процессах связанных с оксидативным стрессом, пероксидном окислении липидов. Альдегидоксидаза - пероксидное окисление липидов, катаболизм биогенных аминов и катехоламинов.
Альдегид-дегидрогеназа (АЛДГ) - окислении альдегидов до карбоновых кислот (кофактор НАД+). Дигидродиолдегидрогеназа - окисление полициклических ароматических углеводородов. Молибденовые гидроксилазы – альдегидоксидаза и ксантиндегидрогеназа / ксантиноксидаза, сульфитоксидаза - окисляет токсичный сульфит до относительно безопасного сульфата. Ксантиндегидрогеназа (XD) и ксантиноксидаза (ХО) — участвуют в процессах связанных с оксидативным стрессом, пероксидном окислении липидов. Альдегидоксидаза - пероксидное окисление липидов, катаболизм биогенных аминов и катехоламинов.
 Моноаминоксидаза - окислительное дезаминировании первичных, вторичных и третичных аминов, включая серотонин. Пероксидаза-зависимое окисление превращение ксенобиотиков в токсичные метаболиты прямой перенос пероксидного кислорода к ксенобиотику Тох → Тох. О амины или фенолы окисляются пероксидом водорода в присутствии пероксидаз с образованием свободных радикалов Флавинмонооксигеназа - окисляет нуклеофильный азот, серу и фосфор в молекулах ксенобиотиков
Моноаминоксидаза - окислительное дезаминировании первичных, вторичных и третичных аминов, включая серотонин. Пероксидаза-зависимое окисление превращение ксенобиотиков в токсичные метаболиты прямой перенос пероксидного кислорода к ксенобиотику Тох → Тох. О амины или фенолы окисляются пероксидом водорода в присутствии пероксидаз с образованием свободных радикалов Флавинмонооксигеназа - окисляет нуклеофильный азот, серу и фосфор в молекулах ксенобиотиков
 Цитохром Р 450 катализирует реакции окисления: -гидроксилирование алифатических и ароматических углеводородов; -эпоксидирование двойной связи; -окисление гетероатомов (О-, S-, N-, Si-) -N-гидроксилирование; -деалкилирование гетероатомов (О-, S-, N-, Si-), -окислительный перенос группы; -разрыв сложноэфирной связи; -дегидрирование. НАДФН НАДФ
Цитохром Р 450 катализирует реакции окисления: -гидроксилирование алифатических и ароматических углеводородов; -эпоксидирование двойной связи; -окисление гетероатомов (О-, S-, N-, Si-) -N-гидроксилирование; -деалкилирование гетероатомов (О-, S-, N-, Si-), -окислительный перенос группы; -разрыв сложноэфирной связи; -дегидрирование. НАДФН НАДФ
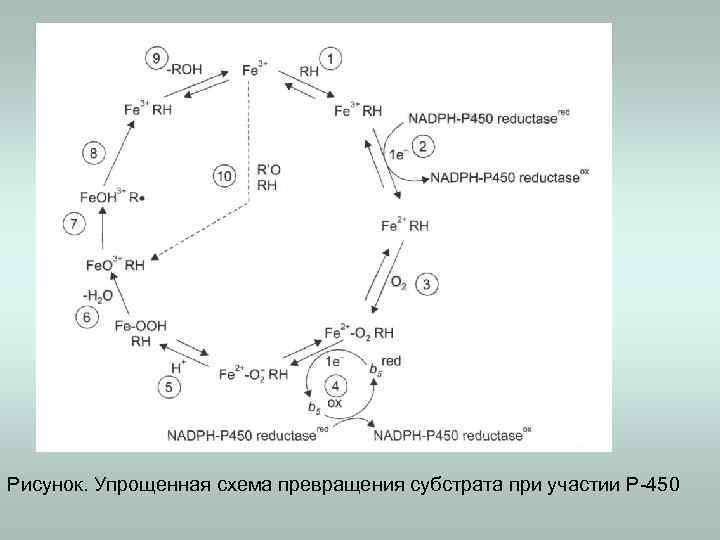 Рисунок. Упрощенная схема превращения субстрата при участии Р-450
Рисунок. Упрощенная схема превращения субстрата при участии Р-450
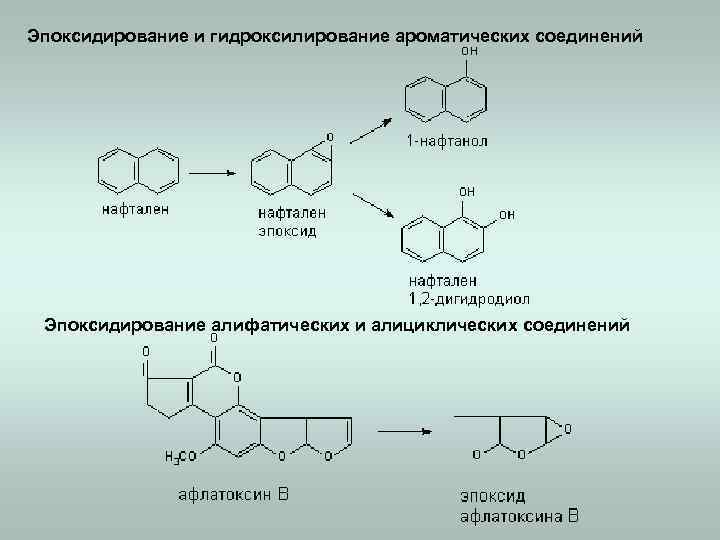 Эпоксидирование и гидроксилирование ароматических соединений Эпоксидирование алифатических и алициклических соединений
Эпоксидирование и гидроксилирование ароматических соединений Эпоксидирование алифатических и алициклических соединений
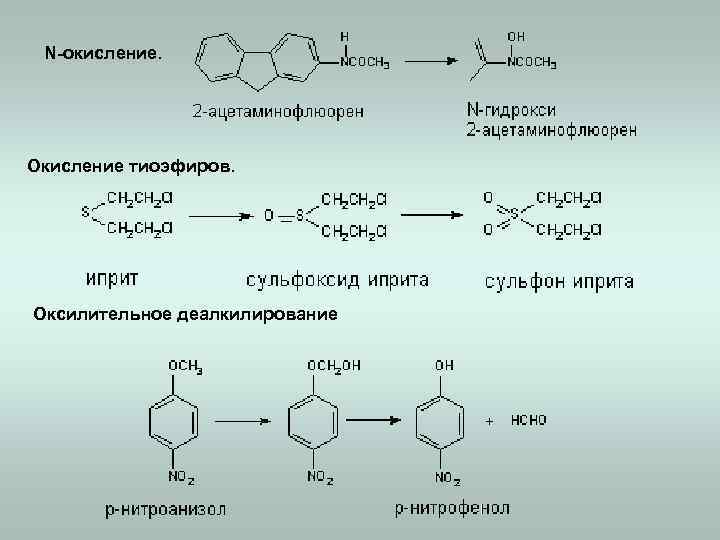 N-окисление. Окисление тиоэфиров. Оксилительное деалкилирование
N-окисление. Окисление тиоэфиров. Оксилительное деалкилирование
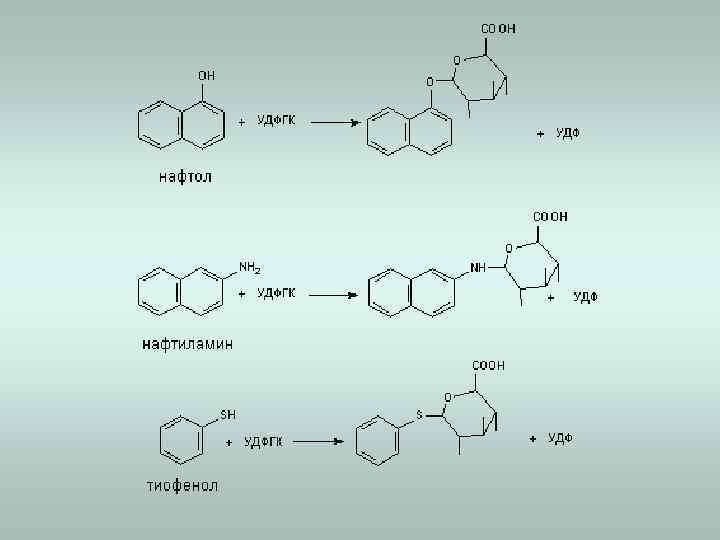
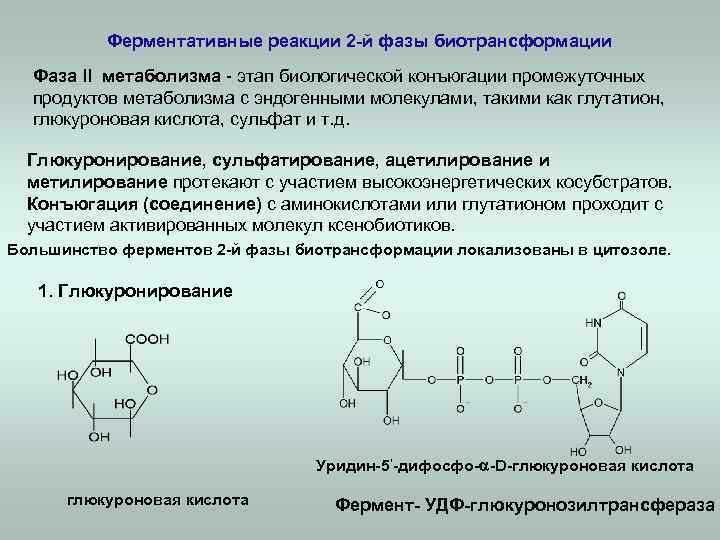 Ферментативные реакции 2 -й фазы биотрансформации Фаза ll метаболизма - этап биологической конъюгации промежуточных продуктов метаболизма с эндогенными молекулами, такими как глутатион, глюкуроновая кислота, сульфат и т. д. Глюкуронирование, сульфатирование, ацетилирование и метилирование протекают с участием высокоэнергетических косубстратов. Конъюгация (соединение) с аминокислотами или глутатионом проходит с участием активированных молекул ксенобиотиков. Большинство ферментов 2 -й фазы биотрансформации локализованы в цитозоле. 1. Глюкуронирование Уридин-5‘-дифосфо- -D-глюкуроновая кислота Фермент- УДФ-глюкуронозилтрансфераза
Ферментативные реакции 2 -й фазы биотрансформации Фаза ll метаболизма - этап биологической конъюгации промежуточных продуктов метаболизма с эндогенными молекулами, такими как глутатион, глюкуроновая кислота, сульфат и т. д. Глюкуронирование, сульфатирование, ацетилирование и метилирование протекают с участием высокоэнергетических косубстратов. Конъюгация (соединение) с аминокислотами или глутатионом проходит с участием активированных молекул ксенобиотиков. Большинство ферментов 2 -й фазы биотрансформации локализованы в цитозоле. 1. Глюкуронирование Уридин-5‘-дифосфо- -D-глюкуроновая кислота Фермент- УДФ-глюкуронозилтрансфераза
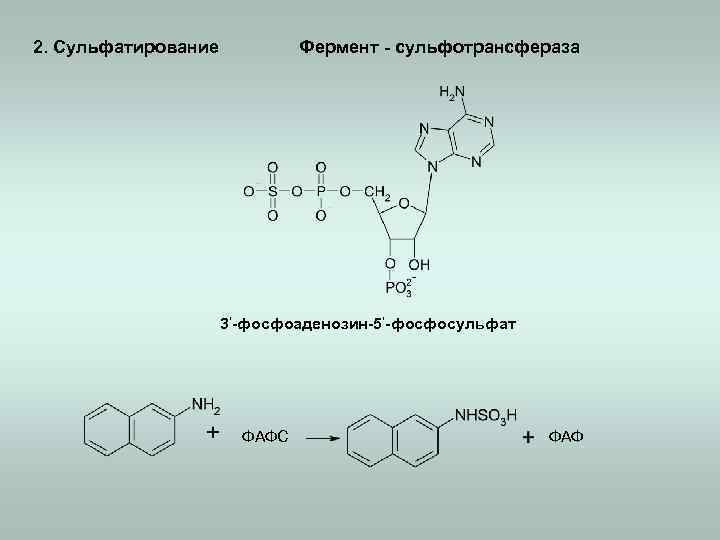 2. Сульфатирование Фермент - сульфотрансфераза 3‘-фосфоаденозин-5‘-фосфосульфат ФАФС ФАФ
2. Сульфатирование Фермент - сульфотрансфераза 3‘-фосфоаденозин-5‘-фосфосульфат ФАФС ФАФ
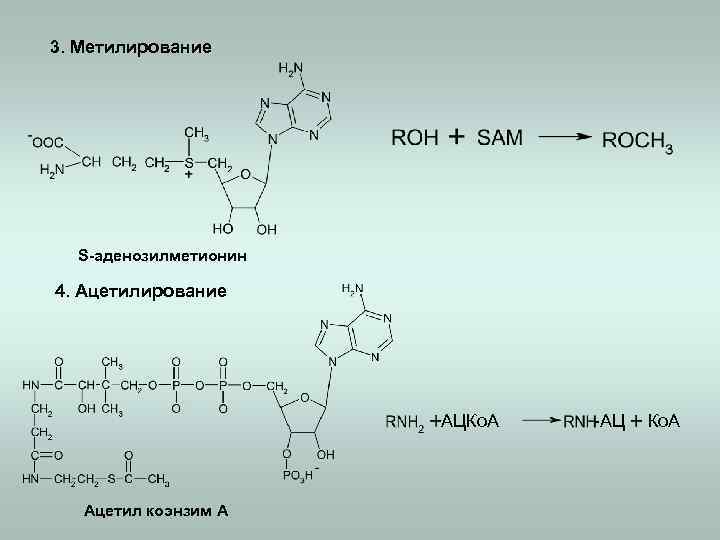 3. Метилирование S-аденозилметионин 4. Ацетилирование АЦКо. А Ацетил коэнзим А -АЦ Ко. А
3. Метилирование S-аденозилметионин 4. Ацетилирование АЦКо. А Ацетил коэнзим А -АЦ Ко. А
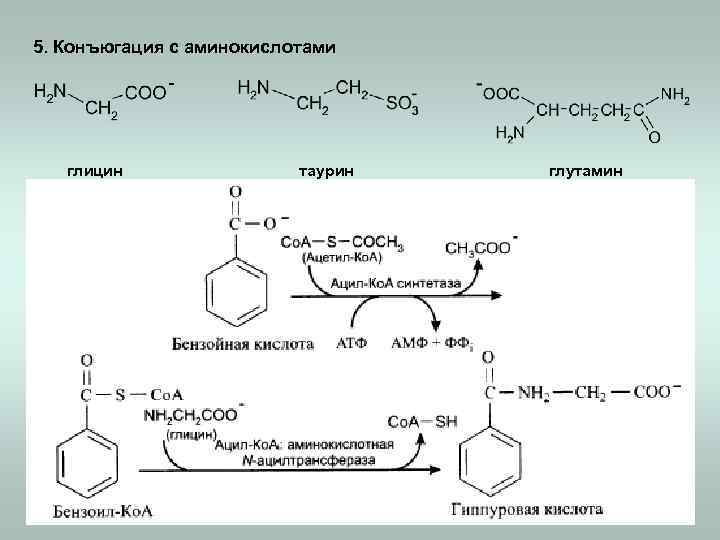 5. Конъюгация с аминокислотами глицин таурин глутамин
5. Конъюгация с аминокислотами глицин таурин глутамин
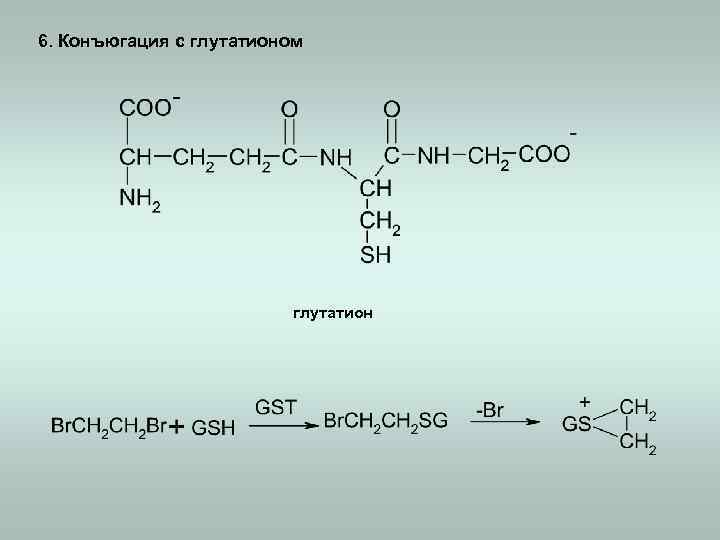 6. Конъюгация с глутатионом глутатион
6. Конъюгация с глутатионом глутатион
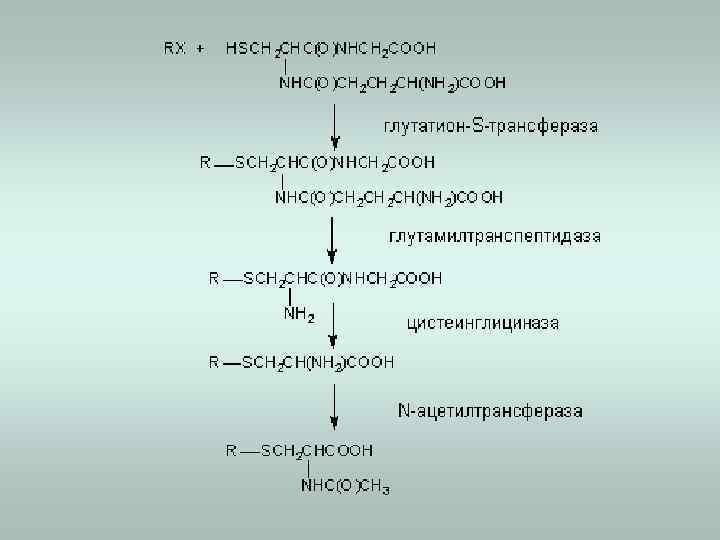
 Факторы, влияющие на метаболизм чужеродных соединений. 1. Генетические факторы и внутривидовые различия (возможны генетические дефекты ферментов, их изучением занимается фармакогенетика). 2. Физиологические: -возраст и развитие ферментных систем; -половые различия; -гормональный фон; -беременность; -питание; -патологические состояния, заболевания; -длительное применение лекарств. 3. Факторы окружающей среды: -стресс; -ионизирующая радиация; -стимулирование метаболизма чужеродными соединениями; -ингибирование метаболизма чужеродными соединениями. Вторичный метаболизм - посмертные метаболические процессы
Факторы, влияющие на метаболизм чужеродных соединений. 1. Генетические факторы и внутривидовые различия (возможны генетические дефекты ферментов, их изучением занимается фармакогенетика). 2. Физиологические: -возраст и развитие ферментных систем; -половые различия; -гормональный фон; -беременность; -питание; -патологические состояния, заболевания; -длительное применение лекарств. 3. Факторы окружающей среды: -стресс; -ионизирующая радиация; -стимулирование метаболизма чужеродными соединениями; -ингибирование метаболизма чужеродными соединениями. Вторичный метаболизм - посмертные метаболические процессы
present5.com
БИОТРАНСФОРМАЦИЯ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ В ОРГАНИЗМЕ.
ВВЕДЕНИЕ:
Печень – самая крупная железа пищеварительного тракта. Она выполняет в организме функцию биохимической лаборатории и играет важную роль в белковом, углеводном и липидном обменах.
Функции печени:
А). Участие в пищеварении: связано с образованием желчных кислот, способствующих эмульгации, расщеплению и всасыванию жиров и жирорастворимых веществ (например, витаминов А, D, E, K), а также активации липаз.
Б). Система гемостаза: печень поддерживает оптимальное состояние (содержание и/или активность) факторов системы гемостаза и агрегатного состояния крови (например, через образование компонентов свёртывающей системы, путём депонирования и выброса крови в сосудистое русло).
В). Участие в реакциях системы ИБН (иммунобиологического надзора): в связи с наличием в печени фагоцитирующих клеток фон Купффера, способных также к процессингу и презентации антигена лимфоцитам.
Г). Дезинтоксикация (барьерная функция): в печени проходит связывание токсичных веществ с глюкуроновой кислотой и сульфатами, инактивация аммиака, индола, скатолов, фенолов и др. соединений, поступающих из ЖКТ, а также попадающих в организм извне.
Вещества, поступающие в организм из окружающей среды и не используемые им для построения тканей организма или как источники энергии, называют чужеродными веществами, или ксенобиотиками. Эти вещества могут попадать в организм с пищей, через кожу, слизистые оболочки.
Чужеродные вещества, или ксенобиотики делят на две группы:
- продукты хозяйственной деятельности человека (промышленность, сельское хозяйство, транспорт).
- вещества бытовой химии (моющие средства, вещества для борьбы с насекомыми, парфюмерия и парафармация).
В зависимости от химического строения ксенобиотика, он претерпевает различные изменения в организме и в дальнейшем, при условии нормального гомеостаза выводится им (организмом). Гидрофильные ксенобиотики выводятся из организма в неизменном виде в мочой, в то время как гидрофобные задерживаются в тканях, связываясь с белками или образуя комплексы с липидами мембран, затем претерпевают ряд биохимических изменений и уже в изменённом состоянии выводятся из организма.
Как уже было упомянуто выше, большинство гидрофильных ксенобиотиков выводится из организма с мочой. Вещества, более гидрофобные или обладающие большей молекулярной массой (> 300 кД) выводятся с желчью в кишечник, а затем уже удаляются с фекалиями. Система обезвреживания включает множество разнообразных ферментов, под воздействием которых практически любой ксенобиотик может быть модифицирован.
Изменение химической структуры лекарственных веществ в организме называется их метаболизмом, а продукты метаболизма – метаболитами. В организме лекарственное вещество может подвергаться всем известным типам химических превращений. В результате метаболизма лекарственные вещества, как правило, теряют свою активность и приобретают более гидрофильные свойства.
Метаболизм лекарственных веществ может происходить во всех тканях и жидких средах организма, однако наиболее активно этот процесс происходит в полостях и слизистых оболочках желудка, а также печени.
МЕХАНИЗМ ВЫВЕДЕНИЯ КСЕНОБИОТИКОВ ИЗ ОРГАНИЗМА:

БИОТРАНСФОРМАЦИЯ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ:
Лекарства, поступившие в организм, проходят ряд следующих превращений:
- всасывание
- связывание с белками и транспорт кровью
- взаимодействие с рецепторами
- распределение в тканях
- метаболизм и выведение из организма
Механизм первого этапа (всасывание) определяется физико-химическими свойствами лекарства. Гидрофобные соединения легко проникают через мембраны простой диффузией, в то время как лекарственные вещества, не растворимые в липидах, проникают через мембраны путём трансмембранного переноса при участии различных типов транслоказ. Некоторые нерастворимые крупные частицы могут проникать в лимфатическую систему путём пиноцитоза. Следующие этапы метаболизма лекарственного вещества в организме тоже определяются его химическим строением – гидрофобные молекулы перемещаются по крови в комплексе с альбумином, кислым а1-гликопротеином или в составе липопротеинов. В зависимости от структуры лекарственное вещество может поступать из крови в клетку или, являясь аналогами эндогенных веществ, связываться с рецепторами клеточной мембраны.
Действие на организм большинства веществ прекращается через некоторое время после их приёма. Прекращение действия может быть вызвано тем, что лекарственное вещество выводится из организма либо в неизменном виде (гидрофильные соединения), либо подвергается биотрансформации.
ИЗМЕНЕНИЯ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ ПРИ БИОТРАНСФОРМАЦИИ:
Биохимические превращения лекарственных веществ в организме человека, обеспечивающие их инактивацию и детоксикацию, являются частичным проявлением биотрансформации ксенобиотиков. В результате биотрансформации лекарственных веществ может произойти:
- инактивация лекарственных веществ (снижение фармакологической активности)
- повышение активности лекарственных веществ
- образование токсических метаболитов
ИНАКТИВАЦИЯ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ:
Инактивация лекарственных веществ, как и всех ксенобиотиков, происходит в две фазы. Первая фаза – химическая модификация под действием ферментов монооксигеназной системы ЭР. Например, лекарственное вещество барбитурат в ходе биотрансформации превращается в гидроксибарбитурат, который далее участвует в реакции конъюгации с остатком глюкуроновой кислоты. Фермент глюкуронил-трансфераза катализирует образование барбитуратглюкуронида, в качестве источника глюкуроновой кислоты используется УДФ-глюкуронил.
Другой пример инактивации лекарственного вещества – процесс метаболизма толуола. Толуол ферментами ЭР окисляется в бензиловый спирт. Затем из него в цитоплазме путём окисления образуется бензойная кислота, которая в митохондриях конъюгирует с глицином и в виде бензоглицина элиминирует в кровь, а затем выводится с мочой.
Некоторые лекарственные вещества способны индуцировать синтез микросомальных ферментов в ЭР. При этом лекарственное вещество в первые дни после приёма циркулирует в крови в количестве, достаточном для развития фармакологического эффекта, а затем начинает быстро разрушаться индуцированным ферментом. Таким свойством обладает бутадион, барбитураты (особенно фенобарбитал). Индуцированные ферменты, вызвавшие разрушение лекарственных средств могут сохраняться до двух месяцев. Некоторые хлорированные инсектициды (гексахлоран) оказались активными индукторами ферментов, разрушающих лекарственные вещества и даже естественные стероидные гормоны.
Путём образования эфирно-серных и эфирно-глюкуроновых кислот обезвреживаются фенолсодержащие соединения (например, камфора), хлоралгидрат, ароматические кислоты.
Многие ароматические соединения, соли тяжёлых металлов, образуют ковалентную связь с сульфгидридными группами цистеина и в таком виде выводятся из организма.
ПОВЫШЕНИЕ АКТИВНОСТИ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ:
Очень редко в процессе метаболизма образуются более активные лекарственные вещества, например, из противосифилитического средства новарсенола образуется арсеноксид.
Ещё одним примером образования более активного вещества является образование дезметилимипрамина из имипрамина, который имеет способность ослаблять депрессивное состояние при психических расстройствах.
При таких превращениях возможно не только усиление основного фармакологического действия, но и его подмена на совершенно противоположный усиленный в сотни раз эффект. Особенно эти эффекты могут быть выражены при неправильном лечении комплексами различных антагонистичных препаратов.
ОБРАЗОВАНИЕ ТОКСИЧЕСКИХ ПРОДУКТОВ ИЗ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ:
В отдельных случаях химические превращения лекарственных веществ в организме могут приводить к появлению у них токсических свойств. Так, жаропонижающее, болеутоляющее, противовоспалительное средство фенацетин превращается в парафенацетин, вызывающий гипоксию за счёт образования метгемоглобина – неактивной формы Hb.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА АКТИВНОСТЬ ФЕРМЕНТОВ БИОТРАНСФОРМАЦИИ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ:
Скорость метаболизма лекарственных веществ зависит от состояния организма. У утомлённых и ослабленных людей обезвреживание происходит медленнее. Метаболизм некоторых ЛС снижается при недостатке кислорода. Например, этаминал-натрий (снотворное) разрушается быстрее в присутствии кислорода, поэтому увеличение парциального давления кислорода во вдыхаемом воздухе уменьшает длительность сна.
При заболеваниях печени инактивация ЛС замедляется, поэтому в организме при понижении скорости метаболизма уровень ЛС в крови повышается, а длительность нахождения их увеличивается. В таких случаях значительно снижают дозу.
Чувствительность к ЛС меняется в зависимости от возраста. Например, у новорождённых активность метаболизма в первый месяц жизни существенно отличается от взрослых. Это связано с недостаточностью многих ферментов, участвующих в биотрансформации ЛС, функции почек, повышенной проницаемости гематоэнцефалического барьера, недоразвитием ЦНС. В пожилом возрасте метаболизм ЛС протекает менее эффективно, чем у молодых. Снижается функциональная активность печени, нарушается скорость экскреции препаратов почками, В целом чувствительность в старческом возрасте к большинству препаратов понижена, в связи с чем их доза должна быть снижена.
В ряде случаев повышенная чувствительность к ЛС может быть обусловлена наследственной недостаточностью некоторых ферментов (энзимопатии), участвующих в их метаболизме. Например, при генетической недостаточности холинэстеразы плазмы крови длительность действия миелорелаксанта дитилина резко возрастает и может достигать 6-8 часов, вместо 5-7 минут. Известно, что скорость ацетилирования противотуберкулёзного средства изониазида варьирует довольно широко. Выделяют лиц с медленной и быстрой инактивацией. Считают, что у лиц с медленной инактивацией нарушена структура белков, регулирующих синтез фермента ацетилтрансферазы, обеспечивающего конъюгацию с ацетильным остатком.
Существенное влияние на метаболизм в организме оказывают также факторы окружающей среды, такие как ионизирующее облучение, температура, состав пищи и особенно различные химические вещества (ксенобиотики), в том числе и сами лекарственные вещества.
МОСКОВСКАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ ИМ. И.М. СЕЧЕНОВА
КАФЕДРА БИОХИМИИ
ДОКЛАД ПО БИОХИМИИ
МЕТАБОЛИЗМ И БИОТРАНСФОРМАЦИЯ ЛЕАРСТВЕННЫХ СРЕДСТВ
ВЫПОЛНИЛ: СТУДЕНТ КУРСА ГРУППЫ
ФАРМАЦЕВТИЧЕСКОГО ФАКУЛЬТЕТА
- 2003 г -
studfiles.net
 (Назад)
(Назад) (Cкачать работу)
(Cкачать работу)
Функция "чтения" служит для ознакомления с работой. Разметка, таблицы и картинки документа могут отображаться неверно или не в полном объёме!
Введение Стремительные темпы развития промышленного производства, химизация народного хозяйства ведут к появлению во внешней среде большого количества разнообразных химических соединений, постоянно загрязняющих биосферу и пагубно влияющих на живую природу.
В силу различных причин многие химические вещества, поступающие в организм и ранее не встречающиеся в нем, получили название чужеродных или ксенобиотиков (от греческих слов xenos - чужой, biotos- жизнь). К таким веществам относятся синтетические и природные лекарственные препараты, пестициды, промышленные яды,отходы производств, пищевые добавки, косметические средства и прочие.
Актуальность проблем, рассматриваемых в ксенобиологии все возрастает. Это обусловлено тем, что ежегодно на Земле синтезируются десятки тысяч новых соединений. Ряд из них вовлекаются в круговорот веществ в природе. Чем шире масштабы производства химических соединений, тем больше влияние они оказывают на биологические процессы в почве, водоемах и на суше, тем сильнее проявляются побочные и отдаленные последствия их действия на живые системы.
Воздействие ксенобиотиков на живой мир, и на человека в частности происходит, в самых различных комбинациях этих соединений не только друг с другом, но и с фактором окружающей среды. Поэтому многие из ксенобиотиков, вошедших в сегодняшнюю практику могут являться носителями опасного биологического действия.
Биотрансформация органических ксенобиотиков Многие ксенобиотики, попав в организм, подвергаются биотрансформации и выделяются в виде метаболитов. В основе биотрансформации по большей части лежат энзиматические преобразования молекул. Биологический смысл явления - превращение химического вещества в форму, удобную для выведения из организма, и тем самым, сокращение времени его действия.
Метаболизм ксенобиотиков проходит в две фазы (рисунок 1).
Рисунок 1. Фазы метаболизма чужеродных соединений В ходе первой фазы окислительно-восстановительного или гидролитического превращения молекула вещества обогащается полярными функциональными группами, что делает ее реакционно-способной и более растворимой в воде. Во второй фазе проходят синтетические процессы конъюгации промежуточных продуктов метаболизма с эндогенными молекулами, в результате чего образуются полярные соединения, которые выводятся из организма с помощью специальных механизмов экскреции.
Разнообразие каталитических свойств энзимов биотрансформации и их низкая субстратная специфичность позволяет организму метаболизировать вещества самого разного строения. Вместе с тем, у животных разных видов и человека метаболизм ксенобиотиков проходит далеко не одинаково, поскольку энзимы, участвующие в превращениях чужеродных веществ, часто видоспецифичны.
Следствием химической модификации молекулы ксенобиотика могут стать:
. Ослабление токсичности;
. Усиление токсичности;
. Изменение характера токсического действия;
. Инициация токсического процесса.
Метаболизм многих ксенобиотиков сопровождается образованием продуктов существенно уступающих по токсичности исходным веществам. Так, роданиды, образующиеся в процессе биопревращения цианидов, в несколько сот раз менее токсичны, чем исходные ксенобиотики. Гидролитическое отщепление от молекул зарина, зомана, диизопропилфторфосфата иона фтора, приводит к утрате этими веществами способности угнетать активность ацетилхолинэстеразы и существенному понижению их токсичности. Процесс утраты токсикантом токсичности в результате биотрансформации обозначается как "метаболическая детоксикация". В процессе метаболизма других веществ образуются более токсичные соединения. Примером такого рода превращений является, в частности, образование в организме фторуксусной кислоты при интоксикации фторэтанолом.
В ряде случаев в ходе биотрансформации ксенобиотиков образуются вещества, способные совершенно иначе действовать на организм, чем исходные агенты. Так, некоторые спирты (этиленгликоль), действуя целой молекулой, вызывают седативно-гипнотический эффект (опьянение, наркоз). В ходе их биопревращения образуются соответствующие альдегиды и органические кислоты (щавелевая кислота), способные повреждать паренхиматозные органы и, в частности, почки. Многие низкомолекулярные вещества, являющиеся факультативными аллергенами, подвергаются в организме метаболическим превращениям с образованием реакционноспособных промежуточных продуктов. Так, соединения, содержащие в молекуле амино- или нитрогруппу в ходе метаболизма превращаются в гидроксиламины, активно взаимодействующие с протеинами крови и тканей, формируя полные антигены. При повторном поступлении таких веществ в организм помимо специфического действия развиваются аллергические реакции.
Порой сам процесс метаболизма ксенобиотика является пусковым звеном в развитии интоксикации. Например, в ходе биологического окисления ароматических углеводородов инициируются свободно-радикальные процессы в клетках, образуются ареноксиды, формирующие ковалентные связи с нуклеофильными структурами клеток (белками, сульфгидрильными группами, нуклеиновыми кислотами и т.д), активирующие перекисное окисление липидов биологических мембран (рисунок 2). В итоге инициируется мутагенное, канцерогенное, цитотоксическое действие токсикантов. Аналогично ареноксидам на клетки действуют N-оксиды, нитрозамины, гидроксиламины, также являющиеся канцерогенами и мутагенами. В опытах на собаках установлена прямая зависимость между канцерогенной активностью (рак мочевого пузыря) и концентрацией в моче продуктов N-окисления веществ в ряду: 1-нафтиламин, 2-нафтиламин, 4-аминодифенил. По такому же механизму действуют на организм галогенированный бензол, нафтанол и многие другие ксенобиотики. Процесс образования токсичных продуктов метаболизма называется "токсификация", а продукты биотрансформации, обладающие высокой токсичностью - токсичными метаболитами. Во многих случаях токсичный метаболит является не стабильным продуктом, подвергающимся дальнейшим превращениям. В этом случае он также называется промежуточным или реактивным метаболитом. Реактивные метаболиты это как раз те вещества, которые часто и вызывают повреждение биосистем на молекулярном уровне. Общим свойством практически всех реактивных метаболитов является их электродефицитное состояние, т.е. высокая электрофильность. Эти вещества вступают во взаимодействие с богатыми электронами (нуклеофильными) молекулами, повреждая их. К числу последних относятся макромолекулы клеток, в структуру которых входят в большом количестве атомы кислорода, азота, серы. Это, прежде всего, белки и нуклеиновые кислоты. Реактивные метаболиты либо присоединяются к нуклеофильным молекулам, образуя с ними ковалентные связи, либо вызывают их окисление. В обоих случаях структура макромолекул нарушается, следовательно, нарушаются и их функции.
Биоактивация далеко не всегда сопровождается повреждением биосубстрата, поскольку одновременно в организме протекают процессы детоксикации и репарации. Интенсивность этих процессов может быть достаточной для компенсации ущерба, связанного с образованием реактивных метаболитов. Тем не менее при введении высоких доз токсиканта, повторном воздействии защитные механизмы могут оказаться несостоятельными, что и приведет к развитию токсического процесса. Концепция l и ll фазы метаболизма ксенобиотиков l фаза метаболизма в широком смысле может быть определена, как этап биотрансформации, в ходе которого к молекуле соединения либо присоединяются полярные функциональные группы, либо осуществляется экспрессия таких групп, находящихся в субстрате в скрытой форме. Это достигается либо путем окисления или (значительно реже) восстановления молекул с помощью оксидо-редуктаз, либо путем их гидролиза эстеразами и амидазами.
Фаза ll - этап биологической конъюгации промежуточных продуктов метаболизма с эндогенными молекулами, такими как глутатион, глюкуроновая кислота, сульфат и т.д. Специфические системы транспорта конъюгированных дериватов обеспечивают их выведение из организма. В ходе биопревращений липофильный и, следовательно, трудновыводимый ксенобиотик становиться
referat.co
Большинство чужеродных соединений органической природы подвергается в организме животных и человека метаболизму ( от греческого слова metabole – превращение, переход из одного состояния в другое, перемена).
Метаболизм чужеродных соединений направлен на введение в их молекулы группировок, обуславливающих увеличение полярности (гидрофильности или водорастворимости молекул) для ускорения выведения веществ почками и уменьшения токсичности.
Эти превращения осуществляются состемой энзимов, главным образом, печени. Различают микросомальные реакции, в которых участвуют ферменты микросомальной фракции печени, и немикросомальные, которые катализируются ферментами, локализованными в других местах. Основываясь на химической природе этих реакций, их более детально можно классифицировать следующим образом:
Основные пути биотрансформации чужеродных соединений:
1. Окисление:
а) микросомальное – алифатическое и ароматическое гидроксилирование;
- эпоксидирование,
- N-гидроксилирование,
- N,S - окисление;
- дезалкилирование,
- дезаминирование,
- десульфирование,
б) немикросомальное – окислительное дезаминирование;
-окисление спиртов, альдегидов,
-ароматизация алициклических соединений.
2 2. Восстановление:
а) восстановление нитросоединений, азосоединений микросо- мальными ферментами;
б) микросомальное восстановительное галогенирование;
в) немикросомальное восстановление.
3. Гидролизс участием микросомальных и немикросомальных ферментов.
4. Синтез(реакции конъюгирования):
а) образование конъюгатов с глюкуроновой кислотой,
б) образование сложных эфиров с серной и фосфорной кислотами;
в) метилирование;
г) ацетилирование;
д) пептидная конъюгация.
У большинства веществ метаболизм протекает в два этапа. На первом этапе идут несинтетические реакции (окисления, восстановления, гидролиза), на втором – реакции синтеза. Для того, чтобы вступить в реакции синтеза, вещество должно иметь в своей структуре соответствующие функциональные группы – Nh3, -OH, -COOH и др. Если таких групп нет, то соединение может их получить с помощью одной из несинтетических реакций.
Образующиеся в результате синтеза конъюгаты (парные соединения), как правило, не обладают токсичностью и легко выводятся из организма почками с мочой. Однако, конъюгаты с белковыми молекулами могут выступать в роли антигенов и приводить к выработке антител на исходное вещество. В результате при повторном приёме возникают аллергические реакции, вплоть до анафилактического шока.
Факторы, влияющие на метаболизм чужеродных соединений
1. Генетические факторы и внутривидовые различия (возможны генетические де
фекты ферментов, их изучением занимается фармакогенетика).
2. Физиологические:
а) возраст и развитие ферментных систем;
б) половые различия;
в) гормональный фон;
г) беременность;
д) питание;
е) патологические состояния, заболевания;
ж) длительное применение лекарств.
3. Факторы окружающей среды:
а) стресс;
б) ионизирующая радиация;
в) стимулирование метаболизма чужеродными соединениями,
г) ингибирование метаболизма чужеродными соединениями.
Выделение чужеродных соединений
Чужеродные соединения и их метаболиты выделяются, главным образом, с мочой и желчью. Однако они могут выводиться и с выдыхаемым воздухом, слюной, слезами, молоком, потом, секрецией в желудок и другие разделы желудочно-кишечного тракта.
Выделение почками состоит из трёх различных процессов, а именно: клубочковой фильтрации, активного и пассивного канальцевого транспорта.
1. Фильтрация через клубочковую мембрану нефрона. В результате образуется ультрафильтрат плазмы крови, который содержит чужеродные вещества и их метаболиты приблизительно в той же концентрации, как в крови. Белок плазмы и комплексы «белок –соединение» в этом случае не фильтруются и остаются в крови. Таким образом, соединения, прочно связанные с белками, практически не выделяются с мочой.
2. Активное выделение ионизированных молекул клетками проксимальных канальцев. Соединения, выделяемые путём активного транспорта, высокоионизированы и могут выводится в канальцевую мочу против высоких концентрационных градиентов (органические кислоты и основания). При выведении лекарственного вещества преимущественно канальцевой секрецией величина его связывания с белками не играет существенной роли, т.к. канальцы секретируют не только свободные, но и связанные с белками соединения.
Выделяемые по механизму активного транспорта вещества конкурируют друг с другом, и скорость выделения одного изменяется при появлении другого. Этот феномен используется в фармакологической практике для замедления выделения лекарств и поддержания их концентрации в крови на терапевтическом уровне.
3.Пассивный канальцевый транспорт. Подобно другим биологическим мембранам канальцевый эпителий, в частности, в дистальных канальцах, ведёт себя как липопротеиновый барьер, пропуская липидорастворимые, неионизированные молекулы. Поэтому липидорастворимые соединения подвергаются обратному всасыванию (реабсорбции) в кровь посредством простой диффузии в дистальных канальцах нефрона. Соединения, плохо растворимые в жирах, реабсорбируются лишь частично (например, веронал). Более того, соединения, которые в моче ионизированы в большей степени, чем в плазме крови, имеют тенденцию к диффундированию через канальцевый эпителий из крови в клубочковый фильтрат. Величина рН мочи колеблется в норме между 4,8 и 7,5 (в среднем значение рН 5,8).
Когда канальцевая моча более щелочная, чем плазма, в мочу легко проникают слабые кислоты с рКа = 3-7,5 (барбитураты, салицилаты, сульфаниламиды) и, наоборот, если канальцевая моча более кислая, в неё переходят слабые основания с рКа = 7-11. При рН мочи равной рН плазмы (7,4) экскреция не будет зависеть от величины рКа.
Выделение с выдыхаемым воздухом. Многие летучие соединения, индекс липорастворимости которых мал, выделяются неизменёнными с выдыхаемым воздухом путём процесса, аналогичного перегонке с водяным паром. Бензол, фторбензол, хлорбензол выделяются по этому пути интенсивно, а бромбензол, нитробензол, анилин – менее интенсивно.
Как правило, с воздухом выделяется нативное вещество и его ближайшие метаболиты (например, этанол и ацетальдегид). Очень редки случаи, когда в процессе метаболизма из нелетучих соединений образуются летучие. Тогда выделение также идёт через лёгкие.
Выделение через желудочно-кишечный трактиграет значительно меньшую роль. Практическое значение этот путь имеет только для солей тяжёлых металлов и некоторых лекарственных и наркотических веществ (каннабиноиды на 65% выделяются с желчью, производное фенотиазина – тиоридазин – на 9%).
Выделение чужеродных соединений в незначительной степени происходит также путём пассивного транспорта неионизированных молекул в секреты различных желёз.
Нередко чужеродные вещества и их метаболиты выделяются сразу несколькими путями, например, этиловый спирт на 90% метаболизирует, и лишь 10% его выделяется в неизмененном виде, причём с выдыхаемым воздухом – 7%, 3% выделяется с мочой и в небольших количествах со слюной, потом и др.
megaobuchalka.ru